|
1
ÉíÈÚÔáÇ
ÉíØÇÑÞãíÏáÇ
ÉíÑÆÇÒÌáÇ
ÉíÑæåãÌáÇ
íãáÚáÇ
ËÍÈáÇ æ
íáÇÚáÇ
ãíáÚÊáÇ
ÉÑÇÒæ

Département de Biologie
MEMOIRE DE MASTER
Domaine : Sciences de la Nature et de la Vie
Filière : Sciences biologiques
Spécialité : Biotechnologie
microbienne
Thème
Etude de la biodiversité microbienne dans un sol
pollué
par les hydrocarbures.
Présenté par : Soutenu le :
/06/2018
Melle BENNABI Amina Melle KHALDI Zineb
Devant le jury composé de :
Président Mr. BOUHADDA Y.
Examinateur1 Mme. DJAADOUNI F.
Examinateur2 Mme. DILMI F.
Encadreur Mr. AIT ABDELSLAM A.
Année Universitaire : 2017/2018
2
Remerciement :
Tout d'abord nous remercions le bon Dieu
tout
puissant de la bonne santé, la
Volonté et la patience qu'il nous a donnée
tout le
long de la période de nos études.
Nous exprimons nos profondes reconnaissances et
gratitude à toutes les
Personnes qui ont apportés leur aimable
contribution à ce travail par leurs
remarques,
Leurs conseils, leurs encouragements et leurs
compétences.
Enfin, un grand merci, à toute personne qui
a
contribué de prés
ou de loin à la réalisation de ce
travail.
3
Dédicace :
Je dédie ce mémoire :
A mes chers parents, pour tous leurs sacrifices,
leur amour, leur tendresse, leur soutien et leurs
prières tout au long de mes études,
A mes chères soeurs pour leurs
encouragements
permanents, et leur soutien moral,
A mes chers frères pour leur appui et leur
encouragement,
A toute ma famille pour leur soutien tout au long
de mon parcours universitaire,
Que ce travail soit l'accomplissement de vos voeux
tant allégués, et le fuit de votre soutien
infaillible,
Merci d'être toujours là pour moi.
AMINA.
4
Résumé
La pollution par les hydrocarbures constitue une menace pour
les sols algériens vu la longueur du réseau de canalisation
servant à transporter le pétrole. Les sols pollués sont
peuplés de microorganismes efficaces dans la dégradation
biologique du polluant.
Le pétrole représente l'un des polluants
récalcitrants qui perturbent la flore autochtone permettant ainsi
l'installation de bactéries qui s'adaptent et utilisent cette source de
carbone et ou l'un de ces dérivés. Les bactéries «
hydrocarbonoclastes» sont des microorganismes qui se nourrissent
typiquement d'hydrocarbures.
Dans le but d'isoler des bactéries capables de
dégrader les hydrocarbures, nous avons réalisé en
février 2018 des prélèvements de sol au niveau de 4
Wilaya.
La mise en culture sur gélose nutritive a permis
d'isoler 17 bactéries, dont cinq diffèrent par leurs
caractères macroscopiques et microscopiques. Des tests morphologiques et
biochimiques ont été utilisés pour la sélection et
l'identification de l'ensemble des bactéries cultivables (cinq
isolats).
Ces cinq isolats sont testés pour leur capacité
à dégrader 1% de pétrole brut sur un milieu minéral
de base supplémenté en pétrole comme seule source de
carbone et d'énergie.
Les résultats préliminaires obtenus montrent que
les bactéries dégradant les hydrocarbures appartiennent à
différents groupes de bactéries Gram - et Gram + respectivement
à des taux de 75 % et 25 %. Ce sont les bactéries de type
bacilles Gram - qui sont prédominantes (83 %).
Enfin le suivi de la cinétique de croissance en
présence du pétrole brut et du phénol a montré des
courbes de diauxie pour les cinq souches.
Mot clés : hydrocarbonoclaste,
bactérie, biodégradation
Abstract
Pollution by hydrocarbons constitues a serious treath on
algerian soils because of the transport of oil. Polluted soils are full of
microorganisms effective to biologic degradation of the pollutant.
Oil is one of the contrary pollutants that disturb the
autochthonous flora thereby enable the installation of bacteria, which adapt
themselves and use this source of carbon or one of its derivatives. These
hydrocarbonoclastic bacteria are microorganisms that typically feed on
hydrocarbons.
In order to isolate bacteria showing ability to degrade
hydrocarbons were taken soil samples in FEVRIER 2017 at 4 Wilaya.
The culturing on nutrient agar has allowed us to isolate 17
bacteria, 5 of which differentiate with their macroscopic and microscopic
characteristics.
5
These 5 isolates are tested for their capacity to degrade crude
petroleum on an enrichment cultures on basal mineral salt medium supplemented
with 1% as unique carbon and energy source.
preliminary results showed that the polycyclic aromatic
hydrocarbon degrading bacteria belong to various Gram - and Gram + groups (75%
and 25 % respectively). Gram - bacilli were prevalent (83 %).
Finally the monitoring of the kinetic development in presence of
crude oil has shown diauxic growth curves for the 5 bacterial strains.
Key words: hydrocarbonoclast, bacteria,
biodegradation, hydrocarbonoclastic, hydrocarbon.
ÕÎáã
ÉáãÚÊÓãáÇ
ÊÇæäÞáÇ
ÉßÈÔ áæØá
ÇÑÙä
ÉíÑÆÇÒÌáÇ
íÖÇÑáÇÇ
ÏÏåí ÑØÎ
ÊÇäæÈÑßæÑÏíåáÇÈ
辇懂
ÑÈÊÚí
|
ÚÖæãÊá
áÇÌãáÇ
ÉÍÓÇ ËæáãáÇ
ÑÕäÚáá
íÌæáæíÈáÇ
ááÍÊáÇ í
ÉíáÇÚÈ
ãåÇÓÊ
ÉíÑåÌã
ÊÇäÆÇßÈ ÌÚÊ
ÉËæáãáÇ
ÉÈÑÊáÇ äÇ
íå
)ÉíÊÓáÇßæäÈÑÇß
æÑÏíåáÇ(
ÇíÑíÊßÈáÇ
.åÊÇÞÊÔã ÏÍÇ
æÇ äæÈÑÇßáÇ
ÑÏÕã
áãÚÊÓÊæ
ãáÞÇÊÊ íÊáÇ
ÊÇíÑíÊßÈáÇ
|
|
ÊÇÞæÑÍãáÇ
ìáÚ ÇíÑÕÍ
ìÐÛÊÊ
ÊÇäÆÇß
|
|
|
|
|
|
4 ìæÊÓã ìáÚ
ÉÈÑÊáÇ äã
ÊÇäíÚ 2018
ÑíÇÑÈ
|
í
|
ÇäÐÎÇ
ÊÇäæÈÑßæÑÏíåáÇ
áíáÍÊ ìáÚ
ÉÑÏÇÞáÇ
|
ÇíÑíÊßÈáÇ
áÒÚ
|
áÌÇ äã
|
|
ÉíáßÔáÇ
悒͂뇂
ÑÈÚ ÇåíÑÚÊ
ãÊ íÊáÇæ
ÇíÑíÊßÈáÇ
|
äã
|
ÉáÊÎãáÇ
áÇÐÌáÇÇ äã 5
áÒÚ äã ÉíáæÇ
ÉíáãÚ
|
í ÇäáÕæÊ
ÏÞæ
|
.ÊÇíáÇæ
|
|
ÏíÍæ
ÑÏÕãß
íÆÇÐÛáÇ
ØÓæáÇ ìáÇ
ÉÇÖã ãÇÎáÇ
áæÑÊÈáÇ äã 1 %
áíáÍÊ ìáÚ
ÊáÇáÇÓáÇ
åÐå ÉÑÏÞ
ÑÇÈÊÎÇ
ÇäÏÑÇ
ìáÚ
ÉÑÏÇÞáÇ
ÇíÑíÊßÈáÇ
äÇ ÉíáæáÇÇ
ÌÆÇÊäáÇ
ÊÊÈËÇæ
ÉÞÇØáÇ æ
äæÈÑßáá 25% æ
75%íÊÈÓäÈ
íáÇæÊáÇ
|
.ÉíÆÇíãíßæíÈáÇæ
ìáÚ Gram-
|
|
,Gram+ ÉáÊÎã
ÊÇÚæãÌãá
|
íãÊäÊ
ÊÇäæÈÑßæÑÏíåáÇ
|
áÇãÚÊÓÇ
|
|
|
|
|
ÉáæÒÚãáÇ
áÇÐÌáÇÇ
|
äã ÏÏÚ
ÑÈßÇ
ÊÇíÕÚáÇ Úæä
äã
ÇíÑíÊßÈáÇ
ÉÚæãÌã
|
ãÖÊæ
|
|
|
|
æãäáÇ
íÁÇäË ìäÍäã
Çäá ÑåÙÇ
|
áæäíáÇ æ
ãÇÎáÇ ØäáÇ
|
äã 1% ÏæÌæÈ
íÆÇÐÛáÇ
ØÓæáÇ í
æãäáÇ
ÉíßÑÍ
|
ÉÈÞÇÑã
|
ÇãÇÊÎ
|
(
|
|
|
ÉíÍÇÊãáÇ
|
ÊÇãáßáÇ
|
|
|
|
|
íÌæáæíÈáÇ
ááÍÊáÇ
-ÇíÑíÊßÈáÇ
-ÉíÊÓáÇßæäÈÑÇß
|
æÑÏíåáÇ
|
|
|
6
Liste des abréviations
MSM Milieu de Sels Minéraux
HAPs Hydrocarbures Aromatiques
Polycycliques
|
ONPG NaCl
|
Orthonitrophénylgalactopyranoside Chlorure de
sodium
|
ADH Arginine Dihydrolase
LDC Lysine Décarboxylase
|
ODC UFC
|
Citrate de Simmons
Unités Formants Colonies
|
HC Hydrocarbure
BN Bouillon nutritif
DO Densité optique
GN Gélose nutritive
pH Potentiel d'Hydrogène
C Carbone
S Souche
G Gram
P. Pseudomonas
7
Liste des Tableaux
Tableau 1 : Exemples de durée de demi-
vie des HAPs dans le sol. 9
Tableau 2 : Caractéristiques de quatre
types de sols étudiés. 35
Tableau 3 : Résultat du potentiel
d'hydrogène des sols étudiés. 35
Tableau 4 : Résultat d'analyse
d'humidité des sols étudiés. 36
Tableau 5 : Résultat d'analyse de
conductivité des sols étudiés. 37
Tableau 6 : Dénombrement sur
gélose nutritive pour l'échantillon 3. 39
Tableau 7 : Dénombrement sur
gélose nutritive pour l'échantillon 4. 39
Tableau 8 : Dénombrement sur
gélose nutritive pour l'échantillon 1. 39
Tableau 9 : Caractères macroscopiques
des colonies isolées sur GN. 42
Tableau 10 : Etude microscopique des souches
isolées. 42
Tableau 11 : Présence des enzymes
respiratoire. 47
Tableau 12 : Résultats des tests
biochimiques. 48
8
Liste des figures
Figure 01: Structure chimique des hydrocarbures
pétroliers. 3
Figure 02: Représentation
schématique d'une pollution pétrolière du sol. 8
Figure 03: Dégradation du pyrène.
17
Figure 04: Dégradation du
naphtalène en salicylate par voie intradiol. 18
Figure 05: Site d'échantillonnage de
Mascara. 23
Figure 06: Site d'échantillonnage
d'Ouargla. 24
Figure 07: Site d'échantillonnage
d'Arzew. 24
Figure 08: Site d'échantillonnage de
Sfisef. 15
Figure 09: Schéma de l'isolement et de
dénombrement des bactéries. 27
Figure 10: Différents échantillons
des sols étudiés. 35
37
38
38
Figure 11 : Potentiel d'hydrogène des
quatre sols étudies. Figure 12 : Taux d'humidité
des quatre sols étudies. Figure 13 :
Conductivité électrique des quatre sols
étudies.
Figure 14: Dénombrement sur gélose
nutritive pour l'échantillon 3. 40
Figure 15: Dénombrement sur gélose
nutritive pour l'échantillon 1. 40
Figure 16: Différents aspects des
colonies bactériennes obtenus. 44
Figure 17: Différents aspects
microscopiques obtenus. 46
Figure 18: Test catalase. 47
Figure 19: Test oxydase. 47
Figure 20: Résultats des tests
biochimiques (métabolisme glucidique). 49
Figure 21 : Résultats des tests
biochimiques (métabolisme protéique). 50
Figure 22: Résultats des tests
biochimiques (King A et B). 50
Figure 23: Zones claires du test de
biodégradation. 55
56
57
57
58
58
Figure 24: Cinétique de croissance d'une
souche bactérienne (SI) durant la biodégradation du
pétrole et du phénol.
Figure 25: Cinétique de croissance
d'une souche bactérienne (SL) durant la biodégradation du
pétrole et du phénol.
Figure 26: Cinétique de croissance
d'une souche bactérienne (SH) durant la biodégradation du
pétrole et du phénol.
Figure 27: Cinétique de croissance
d'une souche bactérienne (SG) durant la biodégradation du
pétrole et du phénol.
Figure 28: Cinétique de croissance
d'une souche bactérienne (SJ) durant la biodégradation du
pétrole et du phénol.
9
Sommaire
Dédicace.
Remerciements.
Résumé. Abstract.
ÕÎáãáÇ
Liste des tableaux.
Liste des figures.
Liste des abréviations.
Introduction. 1
Partie I : Partie
bibliographique
I- Les hydrocarbures dans l'environnement. 2
I-1- Définition. 2
I-2- Nature et origine. 2
I-3- Composition et caractéristiques. 2
I-3-1- Les hydrocarbures aliphatiques. 2
I-3-2- Les hydrocarbures cycliques. 3
I-4- Les types de pétroles. 3
I-5- Les hydrocarbures en Algérie. 4
I-5-1- Historique. 4
I-5-2- Problématique liée aux hydrocarbures
pétroliers en Algérie. 4
I-6- Mobilité des hydrocarbures dans l'environnement.
6
I-6-1 Evaporation. 6
I-6-2- Solubilisation. 6
I-6-3- Emulsification. 6
I-6-4- Sédimentation. 7
I-6-5- Photo-oxydation 7
I-6-6- Biodégradation. 8
I-6-7- Pénétration dans la chaîne
alimentaire. 9
I-7-
9
10
Conséquences de la pollution de l'environnement par les
HAPs. I-7-1- Pollution du sol par les HAPs.
I-7-2- Origines de pollution. 10
I-7-3- Types de polluants. 10
I-7-4- Biodétection de la pollution du sol par les
hydrocarbures. 10
I-7-4-1- Quatre types de procédés. 11
I-7-5- Biorémediation. 11
11
12
I-7-5-1- Micro-organismes effectuant la bioremédiation.
I-7-5-2- Micro-organismes utilisées.
I-7-5-2-1- Bactéries. 12
I-7-5-2-2- Champignons. 12
I-7-5-2-3- Plantes. 13
I-7-6- Traitement des sols pollués par les HAPs. 13
II- Biodégradation des HAPs. 15
II-1- Types de biodégradation. 16
II-1-1- Biodégradation aérobie. 16
10
II-1-2- Biodégradation anaérobie. 18
II-2- Facteur affectant la biodégradation des HAPs.
18
II-3- Biodégradation du pétrole brut. 20
II-4- Biodégradation par type d'hydrocarbure. 20
II-4-1- Biodégradation des hydrocarbures
saturés. 20
II-4-1-1- Voies de dégradation des alcanes
linéaires. 20
II-5- Biodégradation oxydative des HAPs par les
bactéries. 20
II-6- Microbiologie classique.
|
21
|
Partie II : Matériels et méthodes
I- Objectif. 23
II- Milieux de culture. 23
III- Matériel biologique. 23
IV- Méthode. 25
IIII-1- Echantillonnage. 25
IIII-2- Analyses physico-chimiques. 25
IIII-2-1- Teneur en eau ou humidité. 25
IIII-2-2- Potentiel d'hydrogène (pH). 25
IIII-2-3- Conductivité électrique (CE). 25
IIII-3- Isolement des microorganismes. 25
IIII-3-1- Enrichissement. 26
IIII-3-1-1- Dilution décimale. 26
IIII-3-1-2- Isolement des bactéries sur milieu solide.
26
IIII-3-2- Dénombrement des bactéries. 26
IIII-3-3- Observation macroscopique. 27
IIII-3-4- Observation microscopique. 28
IIII-3-4-1-Coloration de Gram. 28
IIII-3-4-2-Coloration de spores. 29
IIII-4-Purification des isolats. 29
IIII-5- Conservation des isolats. 29
IIII-6- Identification des microorganismes. 30
IIII-6-1- Recherche des enzymes respiratoires. 30
IIII-6-1-1- Recherche de la catalase. 30
IIII-6-1-2- Recherche de l'oxydase. 30
IIII-6-2-Test ONPG. 30
IIII-6-3- Recherche de Citrate. 31
IIII-6-4- Clark et lubs. 31
IIII-6-5- Hydrolyse a l'amidon. 31
IIII-6-6- Mannitol mobilité. 32
IIII-6-7- Viande-foie. 32
IIII-6-8- Étude du métabolisme protéique.
32
IIII-6-8-1-Recherche des décarboxylases (ODC, LDC,
ADH). 32
IIII-6-9- Sélection des bactéries par
utilisation de milieux de culture
spécifiques. 32
IIII-6-9-1-Croissance sur milieu King (King A et King B).
32
IIII-6-10- Bouillon nitraté. 33
IIII-7- Isolement de bactéries qui dégradent le
pétrole. 33
IIII-8- Détection de l'activité de
biodégradation des bactéries. 34
11
Partie III : Résultats et discussions
I- Analyses physico-chimiques. 35
I-1- Caractéristique du sol étudié.
35
I-2- Mesure du potentiel d'hydrogène. 35
I-3- Teneur en eau ou humidité 36
I-4- Conductivité électrique (CE). 37
II- Analyses microbiologiques du sol. 39
II-1- Caractéristiques des isolats purifies. 41
III- Etude des caractères morphologiques. 41
IIII- Recherche des enzymes respiratoires. 47
IV- Tests biochimiques. 48
V- Identification des souches isolées. 51
VI- Test de biodégradation. 54
VII- Détection de l'activité de
biodégradation des bactéries. 56
Conclusion. 61
Références bibliographiques.
62
Annexes. 65
Introduction
La pollution par les hydrocarbures constitue une menace
très sérieuse pour l'environnement en Algérie. Les pertes
et les fuites ainsi que les déversements accidentels font craindre une
situation écologique irréversible.
L'Algérie est un pays producteur et exportateur de
pétrole. En effet, la production du pétrole brut est en hausse.
De nombreux puits ne cessent d'être découverts sur le territoire
national par la Sonatrach et/ou par les Associés (Sociétés
étrangères d'exploitation et de production), ceci constitue des
sources de contamination du sol de plus en plus importante, de l'exploration au
transport des hydrocarbures.
Cette pollution nécessite donc l`intervention de
différents facteurs pour l`élimination de ce dernier. Parmi ces
facteurs, la biodégradation par les microorganismes et en particulier
les bactéries est le processus naturel le plus important dans la
dépollution de l`environnement. (VANESSA S. CERQUEIRA et al.
2011).
La réussite de La biodégradation des
hydrocarbures dans le sol réside non seulement dans le choix de l'agent
biologique mais également dans la maitrise des conditions
physicochimiques du sol telles que l'humidité, le pH, la
disponibilité des nutriments, la concentration des contaminants, qui
permettent son développement (KUMAR et GOPAL, 2015).
Les microorganismes jouent un rôle primordiale dans la
biodégradation, ils sont très divers dans la nature (YADAV et
HASSANIZADEH, 2011). Un certain nombre d'espèces
bactériennes sont connues pour la dégradation des hydrocarbures
et la plupart d'entre elles sont isolées à partir des sols
contaminés. Plusieurs espèces microbiennes sont recensées
et qualifiées aptes à dégrader des hydrocarbures
(HARITASH et KAUSHIK, 2009).
Le présent travail est réalisé dans le
but d'étudier la capacité de dégradation des
bactéries du sol contaminé par les hydrocarbures
pétroliers présente dans notre échantillon qui se trouve
au niveau de champs d'Ouargla, au niveau de la zone industrielle SONATRACH d'
Arzew.
La réalisation de ce modeste mémoire est
structurée en trois parties : la première partie présente
une synthèse bibliographique, la deuxième décrit le
matériel et les méthodes utilisés, et une troisième
partie consacré aux résultats et discussion qui sera suivi d'une
conclusion.
12
Rappel bibliographique
13
I. Les hydrocarbures dans l'environnement
I.1. Définition
Les hydrocarbures sont des composés organiques
uniquement constitués d'atome de carbone et d'hydrogène
(FRENENNEC et al., 1988). Ils possèdent une formule brute de
type C n H m, où n et m sont 2 entiers naturels. Ils peuvent être
classés en fonction de la forme de leur structure (linéaires,
cycliques) et de leur degré de saturation (TARAYRE, 2012).
I.2. Nature et origine
Les hydrocarbures sont considérés comme
étant des polluants à la fois organiques et chimiques
(KOLLER, 2004) provenant des activités des secteurs
énergétique et industriel. Certains composés, les HAP, se
forment naturellement par les incendies de forêt (BARRIUSO et al.,
1996).
I.3. Composition et caractéristiques
Malgré le fait que les principaux composants
présents dans les hydrocarbures soient le carbone et l'hydrogène,
une proportion significative d'autres atomes peut être présente.
Celle-ci inclue l'oxygène, le soufre et l'azote (MORGAN et
WATKINSON, 1994) et des métaux tels que le calcium et le
magnésium (CHITOUR, 1983). Les hydrocarbures peuvent être
classés en groupes de structures différentes.
I.3.1. Les hydrocarbures aliphatiques
Ce sont des hydrocarbures à chaînes droites
saturés ou insaturés. Les hydrocarbures aliphatiques
saturés sont des alcanes de formule générale C n H 2n+2,
ce sont les plus représentés dans le pétrole et vont du
méthane aux chaînes contenant 40 atomes de carbone et plus
(CERNIGLIA, 1992).
Les insaturés comportent les alcènes de formule
générale C n H 2n. Ces molécules contiennent une double
liaison et les alcynes qui ont pour formule C n H 2n-2 et contenant une triple
liaison dans leur molécule. Ils sont rares dans les pétroles
bruts, plus communs dans les produits de raffinage (CERNIGLIA,
1992).
I.3.2. Les hydrocarbures cycliques
Ils peuvent être saturés : appelés
cyclanes qui sont des cycles saturés isomères des alcanes, ou
insaturés appelés cyclènes s'ils possèdent une
double liaison dans leurs cycles et cyclines s'ils ont une triple liaison. Ils
sont dits hétérocycliques si le cycle de leur molécule
contient des
14
atomes autres que le carbone tels que le soufre, l'azote et
l'oxygène. Les hydrocarbures aromatiques sont des composés
contenant au moins un noyau benzénique dans leurs molécules.
C'est un cycle insaturé à six atomes de carbone. Ils constituent
une proportion très importante du pétrole et s'étalent du
benzène aux HAP. Ce sont des composés hydrophobes, persistants
dans les écosystèmes à cause de leur faible
solubilité dans l'eau (Cerniglia, 1992), certains, tels que
l'anthracène, sont quasiment insolubles (solubilité de 0.7
mg/l) (SMITH, 1994).
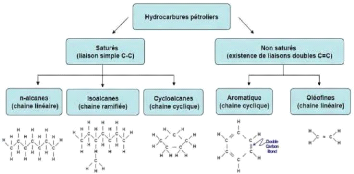
Figure 1 : Structure chimique des hydrocarbures
pétroliers (COLOMBANO et al., 2008).
I.4. Les type des pétroles
Le terme de pétrole recouvre un enssemle de produits
dont les compositions peuvent être très différentes. La
diversité de composition des bruts repose principalement sur leur
provenance. En effet , les conditions de formation d'un brut vont influencer
l'importance relative de chacune des familles de constituants citées
précédemment. Cependant, des bruts issus d'une région
donnée peuvent présenter des différences importantes
liées aux conditions de formation et d'évolution
différentes. Les bruts lourds contiennent des proportions importantes de
résines et d'alphaltènes par rapport aux hydrocarbures
saturés. Au contraire les bruts légers sont très riches en
hydrocarbures saturés et très pauvres en asphaltènes.
Cette diversité dans la composition des bruts est un aspect très
important dans l'industrie du raffinage (SYAKTI, 2004).
I.5. Les hydrocarbures en Algérie I.5.1.
Historique
Les hydrocarbures Algériens ont été
nationalises juste après l'indépendance (24 février 1971),
ils occupent une place importante par rapport l'économie nationale.
L'Algérie dispose de
15
potentialités importantes en pétrole et gaz
naturel lesquels ne sont pas exploités sous forme de matières
premières mais transformés en partie sur place, selon une
stratégie et une planification rigoureuses. Le transport, la
transformation et la commercialisation des hydrocarbures ont été
confiés à la société nationale SONATRACH dont les
principaux sièges se trouvent à: Hassi Messaoud, Alger, Arzew et
Skikda. Arzew, wilaya d'Oran représente un pôle important de
transformation et transport des hydrocarbures. Elle renferme un grand complexe
d'industrie pétrochimique en Afrique. Néanmoins, le
développement d'une telle industrie s'est fait au détriment de
l'environnement de cette belle ville qu'on voit se dégrader
d'année en année.
I.5.2. Problématique liée aux hydrocarbures
pétroliers en Algérie
Le littoral de l'Ouest d'Algérie recèle un
potentiel biologique important, une flore et une faune riches et variés,
des sites naturels exceptionnels, un tel littoral devrait faire l'objet d'un
soin minutieux. Les hydrocarbures représentent la plus importante source
de pollution. Cette pollution résulte de plusieurs activités
liées surtout à l'extraction du pétrole, à son
transport et en aval à l'utilisation des produits finis dans les
raffineries. En effet, de nombreuses études ont permis d'observer
l'apparition de problèmes de santé lors de la baignade ou de
pratique de sports aquatiques en eau contaminées. Les plus
fréquents sont des troubles digestifs et des infections cutanées.
Cette pollution à retenue l'attention de l'opinion mondiale et a
suscité de nombreuses conventions nationales et internationales. En mai
1974, l'Algérie porta ratification de la convention de Bruxelles, puis,
elle adopta le décret n°94-279 du 17 septembre 1994, portant
organisation de lutte contre les pollutions marines et institutions de plans
d'urgence. Enfin, le 05 février 2002 la loi algérienne
n°02-02 relative à la protection et à la valorisation du
littoral est promulguée. Théoriquement la législation
protège la baie algérienne, cependant la réalité
est toute autre. Les textes de la loi restent inappliqués, puisque sur
le terrain rien n'est respecté. Les rejets des déchets riches en
hydrocarbures émanant des zones industrielles se déversent
directement dans la grande bleue et sans parler de ceux émanant des
bateaux poubelles et les navires de ballastage qui traversent quotidiennement
la côte, comme ce fut le cas en 1989 par le pétrolier `Maas Luis'
et en 2003 par le navire italien `Valbruna' (SAKER, 2007). En
attendant l'application de ces textes et la concrétisation de ces
projets, seule l'état de la faune et la flore pourra témoigner de
la triste vérité. En effet, la pollution par les hydrocarbures en
Algérie a fait l'objet de plusieurs études, parmi lesquelles on
cite les travaux de TALBI (2009) et GHAOUAS en 2005 qui
touchent aux techniques physico-chimiques de traitement des effluents de la
raffinerie d'Arzew- Oran, ils montrent la composition des produits
pétroliers tels que Naphta léger et le Naphta lourd, le
kérosène et gasoil. Le gasoil est le produit le plus
chargé en alcane (62.36%), ces composés varient entre
16
(C1 à C30), et en aromatique (17.36%) et il regroupe le
benzène et des hydrocarbures aromatiques non identifiés.
YASSA (2005) cible la pollution atmosphérique, ces travaux
traitent la composition en particules organiques de la torche (combustion du
pétrole brut) émis par la raffinerie à Hassi-Messaoud et
la comparer avec la pollution présente en ville. La composition en
particules chimiques atmosphériques en n-alcanes est de 33% pour (C16 et
C34) tel Octadecane (0.012 ppm), et de 47% pour les n-alcanoique acides (A10
à A30) tel acide pamitique (0.061 ppm). En HAPs 20% tels
Phénanthrène (0.011 ppm) et pyrène (0.003 ppm). LADJI
(2010) étudie la composition organique du sable du Sahara
pollué par les hydrocarbures des différentes régions
d'Algérie, Hassi-Messaoud, Hassi-Bahbah, Laghouat, Tougguort et
Ghardaia, la plus grande pollution est détectée en n-alcanes
à HassiBahbah avec 66% entre (C16 à C35), le % de chaque
n-alcanes est défini dans le sable pollué et pour chaque ville.
En HAPs la ville la plus polluée est Laghouat avec 21.8% entre les
aromatiques légers tels phénanthrènes, anthracène
et les aromatiques lourds tels pyrènes et benzo[a]pyrène, le % de
chaque composé aromatique est défini dans le sable pollué
et pour chaque ville. BOUTENFNOUCHET en (2005) a permis
d'établir une cartographie de la pollution et à évaluer la
pollution industrielle par les hydrocarbures totaux au niveau de la plateforme
industrielle de Skikda. Cependant, il serait intéressant de
connaître l'identité de ces hydrocarbures directement dans
l'effluent industriel et même dans le pétrole brut avant et
après le traitement en raffinerie, qui est un élément
important pour définir le degré du danger qu'ils constituent.
I.6. Mobilité des hydrocarbures dans
l'environnement
Une fois déplacé, transformé ou
éliminé dans l'environnement, l'hydrocarbure est soumis à
différents processus qui vont entraîner des modifications de son
aspect général et de ses caractéristiques
physico-chimiques. Ces processus sont soumis au contrôle de facteurs
physiques, chimiques et biologiques. On citera les facteurs environnementaux
qui sont (R.E1, 2004) :
I.6.1. Evaporation
Qui, selon le type de pétrole, peut affecter la quasi
totalité ou une partie insignifiante du pétrole
déversé. Les fractions de faible poids moléculaires, les
plus volatiles des hydrocarbures déversés se perdent dans
l'atmosphère à un taux qui est déterminé par le
type d'hydrocarbure, la vitesse du vent et la température ambiante. La
plupart des pétroles bruts déversés perdent jusqu'à
40% de leur volume dans les première 48 heures alors que les fuels
17
moins ils lourds, qui contiennent peu de composés
volatils, s'évaporent très peu, même après plusieurs
jours (R.E1, 2004).
I.6.2. Solubilisation
Bien que les hydrocarbures soient des composés
insolubles dans l'eau, certains d'entre eux peuvent partiellement se dissoudre
(hydrocarbures aromatiques et hydrocarbures à faible nombre de carbone)
(BERTRAND et MILLE, 1989). Un hydrocarbure est d'autant plus soluble
que sa masse moléculaire est faible et que sa polarité est
élevée (SOLTANI, 2004). Il est important de noter que
ces hydrocarbures solubles sont parmi les plus dangereux pour l`environnement,
ils sont difficiles à éliminer et sont adsorbés par la
faune et la flore (SOLTANI, 2004).
I.6.3.Emulsification
C'est le mélange de deux fractions non miscibles :
l'eau et le pétrole. Deux types d'émulsions peuvent se former :
Les émulsions directes « huile dans l'eau »: si la surface de
l'eau est turbulente ; les hydrocarbures peuvent se fragmenter en gouttelettes
qui ensuite restent en suspension dans l'eau. Ces émulsions facilitent
l'élimination des hydrocarbures (R.E1, 2004). Et l'eau dans
huile appelée « mousse chocolat » Ce type d'émulsion ;
que l'on qualifie également d'émulation inverse ; peut se
produire en l'espace de quelques heures ; et contient jusqu'à 90% d'eau
.Le résultat est une augmentation de la densité et de la
viscosité, aussi que des volumes à traiter ou à enlever
(R.E1, 2004). Les émulsions eau dans huile sont
constituées par des hydrocarbures de haut poids moléculaires
(SOLTANI, 2004).
I.6.4. Sédimentation
Elle résulte de l'augmentation de la densité du
pétrole par rapport à celle de l'eau de mer. Divers processus
interviennent dans l'accroissement de cette densité, à savoir
l'évaporation, la dissolution des composés légers,
l'oxydation des paraffines, la formation d'agrégats et l'adsorption du
pétrole dispersé sur les particules en suspension. Les
hydrocarbures aromatiques et aliphatiques à haut poids
moléculaires, sont plus facilement adsorbés par les
matières organiques particulaires et colloïdales et donc
incorporés plus rapidement dans les sédiments (BERTRAND et
MILLE, 1989).
I.6.5. Photo-oxydation
Photo-oxydation est observée au niveau de la surface de
l'eau ou l'air (oxygène) et la lumière (radiation solaires) sont
présents pour la transformation des hydrocarbures. Etant donné la
réduction rapide de la diffusion de la lumière dans les couches
épaisses d'hydrocarbures ; la
18
photo-oxydation affecte essentiellement les couches minces ou
la surfaces des couches épaisses d'hydrocarbures (BERTRAND et MILLE,
1989). La photo-oxydation touche plus particulièrement les
composés aromatiques qui sont plus photo-sensibles que les
composés aliphatiques elle transforme les hydrocarbures en leurs
homologues oxygénés généralement beaucoup plus
solubles que les hydrocarbures de départ, mais parfois beaucoup plus
toxiques (BERTRAND et MILLE, 1989).
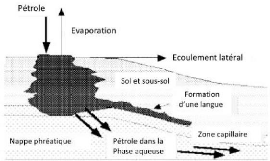
Figure 2 : Représentation schématique du
devenir d'une pollution pétrolière à la surface du sol
(MORGAN et WATKINSON, 1989).
I.6.6.Biodégradation
La biodégradation des hydrocarbures par les
bactéries et les champignons marins contribue de façon
significative à la transformation des hydrocarbures en produits
oxydés. La vitesse de dégradation dépend de la chaleur,
des éléments nutritifs et de la teneur en oxygène dissous
ainsi que du type d'hydrocarbure. Les composés les plus légers se
dégradent plus vite que ceux qui ont un poids moléculaire
élevé (SAUER et al., 1993). L'importance de la
biodégradation dans l'élimination du pétrole ; les voies
métaboliques d'oxydation des hydrocarbures par les bactéries et
les paramètres qui peuvent influencer la biodégradation.
(SOLTANI ,2004).
19
Tableau 1 : Exemples de durée de demi- vie des
HAPs dans le sol (LCPE, 1994)
HAPs Demi-vie
Fluorène 32 à 60 jours
Phénanthrène 2.5 à 210 jours
Anthracène 170 jours à 8 ans
Fluoranthène 268 jours à 377 jours
Pyrène 2010 jours à 5.5 ans
Benzo (a) pyrène 0.3 à 58 ans
I.6.7.Pénétration dans la chaîne
alimentaire
Suite à leur exposition à des composés
pétroliers variés, plusieurs organismes marins tels que les
organismes planctoniques, les invertébrés (bivalves) et les
poissons, peuvent accumuler les hydrocarbures sous forme de vésicules
intracytoplasmique (BERTRAND et MILLE, 1989). Les organismes
planctoniques qui sont solidaires des masses d'eau dans lesquelles ils sont en
suspension, sont incapables d'éviter les zones contaminées par
des déversements pétroliers et ils incorporent ainsi les
hydrocarbures directement dans leurs cellules ce qui constitue une voie de
pénétration de ces composés dans la chaîne
alimentaire. Par conséquent une altération affectant le plancton
se répercute forcement sur les niveaux trophiques les plus
élevés de la chaîne alimentaire (LACAZE, 1980).
I.7. Conséquences de la pollution de
l'environnement par les hydrocarbures
La notion de la pollution est toute relative .On peut
considérer qu'il y a pollution par les hydrocarbures lorsque l'action de
ceux-ci peut être considérée comme néfaste aux
conditions de vie de l'homme directement, ou indirectement si elle affecte les
populations animales et végétales qui lui sont utiles (BRIANT
et GATELIER ,1971).
20
L'étude de la pollution des hydrocarbures
nécessite des dosages très précis:200 ppb d'hydrocarbures
dans l'eau sont suffisantes pour altérer son odeur. On constateque10 ans
peuvent s'écouler entre un déversement dans le sol et son
arrivée dans une nappe aquifère (BRIANT et GATELIER,
1971).
I.7.1. Pollution du sol par les hydrocarbures
L'exploitation des hydrocarbures nécessite et engendre
des opération et activités importantes qui perturbent notre
environnement provoquant des effets néfastes pour la santé
humain. (ARBAOUI et AFFANE, 2005). Les hydrocarbures consistent les
éléments essentiels des pétroles; leurs molécules
ne contiennent que du carbone et de l'hydrogène, elles se devisent en
plusieurs familles chimiques selon leur structure (WAUQUIER, 1994).
Toutes ces structures sont basées sur le carbone (WAUQUIER,
1994). Les enchainements moléculaires carbones - carbone peuvent
être : soit réunis par une simple liaison -C-C- (suffixe ANE) soit
par liaisons multiples : Doubles C=C (suffixe ENE) ou triples C=C (suffixe YNE)
(WAUQUIER, 1994).
I.7.2. Origines de pollution
A. Pollutions accidentelles : ou une grande quantité
de polluant est déversée en fonction du temps (déversement
ou dépôt ponctuel de polluants).
B. Pollutions chroniques : dont les effets cumulés
peuvent être plus importants que ceux d'une pollution accidentelle
(JEANNOT et LEMIERE ,2001).
I.7.3. Types de polluants
Les groupes de composes pétroliers polluants pour
lesquelles la biodépollution est possible sont : A. Les hydrocarbures
pétroliers (gasoils, fuel, kérosène, huiles
minérales).
B. Les déchets d'exploitation du pétrole (boues
et résidus d'huiles goudrons) (BLIEFERT et PERRAVD, 2004).
I.7.4. Biodétection de la pollution du sol par les
hydrocarbures
Une méthode plus pratique pour épurer les
environnements contaminés par des produits dangereux est la
biorémediation ou la dépollution biologique (DAVID
,2005).
Il s'avère que le traitement des terres polluées
se fait majoritairement à l'aide de techniques biologiques qui
s'appliquent préférentiellement hors site, dans des installations
spécialisées recevant des terres de plusieurs origines. Suivent
les techniques de biodépollution des sols in situ puis la
biodégradation des polluants des terres mises en andain sur le site. Ces
techniques
21
se basent sur le fait que les micro-organismes qui se
développent dans un sol pollué y trouvent des conditions
favorables et se nourrissent notamment du polluant présent qui est alors
dégradé. En modulant des paramètres comme
l'oxygène, l'humidité, la température et les
éléments nutritifs, la croissance des micro- organismes
dépollueurs peut être optimisée. (DAVID .C ,2005).
L'ensemble des procédés d'élimination de polluants,
organiques ou minéraux, présents dans les milieux naturels par
l'action de microorganismes (DAVID ,2005).
I.7.4.1. Quatre types de
procédés
A. Biodégradation: Décomposition d'un substrat
organique, par action de microorganismes vivants.
B. Bioréduction: Réduction des composés
oxydés (nitrates, oxydes métalliques) par voie biologique.
C. Biolixiviation: Extraction des métaux contenus dans
une boue, un sol, un sédiment ou un minerai par solubilisation
provoquée par des microorganismes.
D. Biofixation/Biosorption:"Fixation" de polluants, la
plupart du temps, métalliques, présents dans un effluent liquide
sur des microorganismes.
I.7.5. Biorémediation
La bioremédiation est définie par l'utilisation
d'organismes vivants pour détruire les polluants environnementaux. Elle
a été appliquée au traitement de contaminations
inhabituelles (PERR ,2001) par l'activité des bactéries l'action
de leur condition de prolifération (KOLLER, 2004).
I.7.5.1. Micro-organismes effectuant la
bioremédiation
L'évolution a permis l'émergence d'une grande
variété de micro-organismes présentant des
capacités de biodégradation larges et flexibles. Ils peuvent
survivre et détruire ou détoxifier des composés chimiques
dans une grande variété de niche environnementales (chaleur,
froid, PH bas, avec ou sans oxygène, etc.).Les organismes les mieux
adaptés pour la bioremédiation sont souvent les espèces
indigènes d'un habitat pollué particulier. Les microorganismes
indigènes par définition survivre et se multiplie en
présence de substances toxiques (PERRY, 2001).
I.7.5.2. Micro-organismes utilisés
La dépollution de sols contaminés par
hydrocarbures en utilisant les microorganismes appelés
hydrocarbonoclastes a été mise en évidence des 1946 par
ZoBell (SOLTANI, 2OO4).
22
Les microorganismes impliqués dans cette
biodégradation peuvent être : des bactéries, des
archées, des algues ou encore des champignons. On dénombre
après un siècle d'études 200 genres de ces
microorganismes, représentant plus de 500 espèces et souches
décrites (TERRAT ,2001)
Depuis cette date le nombre d'espèces
bactériennes identifiées possédant cette
propriété n'a cessé d'augmentes. En se basant sur la
fréquence d'isolement, les genres bactériens prédominants
sont Pseudomonas, Acinetobacter, Alcaligénes, Vibro, Flavobacterium,
Achromobacter, Micrococcus, Corynebacteria, et Nocardia, Ces organismes
dégradant les hydrocarbures sont ubiquistes (SOLTANI ,2004).
I.7.5.2.1. Bactéries
Dans le sol, les bactéries sont les micro-organismes
les plus abondants et les plus actifs. En fonction des propriétés
physico-chimique du sol ; tous les types physiologiques bactériens sont
représentés dans la microflore tellurique : Autotrophes et
hétérotrophes, thermophiles et psychrophiles, aérobies,
anaérobies facultatifs et anaérobies très répandus,
les actinomycètes jouent un rôle important dans la
décomposition de la matière organique. Certaines espèces
d'actinomycètes du genre Streptomyces produisent la géosmine, un
composé volatil qui donne au sol son odeur terreuse
caractéristique (BOUSSEBOUA, 2005).
I.7.5.2.2. Champignons
Les champignons semblent plus résistants que les
bactéries dans les conditions de très faible humidité et
sont relativement plus abondants (SASSON, 1967).
I.7.5.2.3. Plantes
De nombreuses plantes sont capables de fixer dans leurs
cellules les métaux lourds, radionucléides, composés
organiques polluants et autres produits indésirables; certaines plantes
produisent des enzymes qui dégradent ces polluants en des produits moins
toxiques ou non-toxiques. Elles peuvent également être
accompagnées d'une mycorrhizosphére se chargeant du travail de
fixation et / ou de transformation, dont l'étude visant aux applications
à l'échelle industrielle est en plein essor. Ces
propriétés en ont fait des candidates d'avenir à la
dépollution des sols. Les plantes sont aussi sélectionnées
selon leur taille et aptitude à faire plonger leurs racines
profondément dans le sol, de manière à atteindre les
couches polluées profondes (quelques mètres), et selon le type de
polluant qu'elles sont capables d'emprisonner ainsi. (COLOMBANO et al
,2010).
23
En pratique on peut aussi excaver la terre et l'épandre
sur une membrane imperméable sous serre, de manière à
isoler la matière polluante et contrôler précisément
les paramètres influant sur la croissance des plantes
sélectionnées. Cela retire toutefois un des
bénéfices majeurs de la phytoremédiation, à savoir
son coût d'opération peu élevé (COLOMBANO et al
,2010).
L'un des avantages de la phytoremédiation est la
possible revalorisation des polluants recyclables, aussi appelé
phytominage. Ainsi, les plantes dites hyperaccumulatrices, qui stockent le
polluant dans leurs tiges et leurs feuilles peuvent être
récoltées puis incinérées en vue de
récupérer les métaux parmi les cendres et les
réutiliser en métallurgie (COLOMBANO et al ,2010).
I.7.6. Traitement des sols pollués par les
hydrocarbures
Les hydrocarbures en forte concentration dans l'environnement
ainsi que leur transfert ont un effet néfaste vis-à-vis la
santé de l'homme et les écosystèmes. Le choix d'une
méthode de dépollution doit être préalablement
étudié à fin d'éviter la diffusion du polluant des
sites contaminés. Les différents paramètres
étudiés généralement sont :
· Type de polluant
· Nature du sol et son accessibilité ainsi que sa
localisation
· Date de la pollution (récente ou ancienne)
· L'étendu de la surface contaminée
· les exigences économiques et administratives
Les opérations de traitements des sols polluées
peuvent se faire de plusieurs manières (physico-chimique et biologique).
Les procédés physico-chimiques englobent des traitements
physiques comme les lavages et l'extraction des polluants, des traitements
thermiques par incinération des produits organiques polluants
réduits en CO 2 et H 2 O et des traitements chimiques qui ont pour but
de détruire les polluants ou les rendre moins toxiques. Les
procédés biologiques qui sont plus écologiques sont aussi
employés, comme la phytoremédiation qui par certaines plantes
permet de transformer les polluants dans les sols par association
(racines-microflore). Le « Landfarming » qui repose sur le
déversement de terres contaminées sur des surfaces plus ou moins
préparées { l'avance. L'ajustement du pH et l'additionnement de
l'azote sont réalisés afin de stimuler s'emploie hors site ou sur
le site. Une autre technique biologique par aération du sol ou
bioventing, repose sur l'injection d'air
24
dans le sol pour fournir aux microorganismes l'oxygène
nécessaire (la biodégradation) (BOUDERHEM ,2011).
II. Biodégradation des hydrocarbures
La biodégradation des hydrocarbures pose un certain
nombre de défis aux micro-organismes. D'une part, le pétrole et
ses dérivés se présentent comme des mélanges
complexes. D'autre part, les hydrocarbures à faible poids
moléculaire montrent une toxicité due à leur effet solvant
sur les membranes. Enfin, la majorité des hydrocarbures présente
une solubilité limitée dans l'eau (MORGAN et al.,
1989).
Les microorganismes doivent donc s'adapter à ces
substrats et être capables de les utiliser comme source de carbone. Il
est actuellement établi que l'hydrocarbure, pour être
assimilé par la cellule, doit subir une transformation. Actuellement, on
peut dire que les micro-organismes sont capables de dégrader certains
constituants des pétroles, mais que les taux de décomposition
dans les écosystèmes naturels sont encore très mal connus.
Par ailleurs, la pollution par les hydrocarbures peut souvent être
qualifiée de multi-pollution car elle est associée aux
métaux lourds, en particulier le vanadium et le nickel naturellement
présents dans les pétroles. La concentration du vanadium peut
atteindre les 400 à 580 ppm (ENVIRONNEMENT CANADA, 2005).
L'utilisation d'une grande variété
d'hydrocarbures par les bactéries a été
démontrée. En effet, des souches bactériennes
dégradent les paraffines, les cycloparaffines, les HAM et les HAP
(MORGAN et WATKINSON, 1989 ; DOELLE, 1979 ;SCHNEIDER et al., 1996 ;
SANSEVERINO et al., 1993 ; MALAKUL et al., 1998 ; DEAN et al.,2001 ; GRIFOLLet
al., 1992 ; SCRIBAN, 1999 et BOLDRIN et al., 1993). Cette
dégradation fait intervenir l'équipement enzymatique des germes
caractérisé par une faible spécificité, ou par la
synthèse de nouvelles enzymes spécifiques aux polluants
présents. Cette voie peut s'opérer jusqu'à un stade
avancé qui peut aller jusqu'à la minéralisation
complète du substrat (PELMONT, 1993).
Certaines souches transforment les hydrocarbures en la
présence obligatoire d'un autre substrat. Le cométabolisme est
notamment la voie utilisée par Mycobacterium sp. pour transformer le
fluorène en présence de l'extrait de levure et de la peptone
(BOLDRIN et al., 1993). Par ailleurs, plusieurs espèces de
champignons ont l'aptitude de transformer les hydrocarbures aromatiques
polycycliques (BUMPUS, 1988 ; STAPLETON et al., 1998 ; BZALEL et al., 1996
et CERNIGLIA, 1992). Les champignons lignolytiques tels que Phanerochaete
chrysosporium dégradent les HAP au moyen des enzymes dégradant la
lignine (BUMPUS, 1988). Les champignons non lignolytiques utilisent
les monooxygénases du cytochrome P-450. Le plus étudié est
Cunninghamella elegans qui transforme les HAP en
produits moins mutagènes, aboutissant ainsi à
leurs détoxification (CERNIGLIA, 1992). L'attaque des HAP par
les champignons conduit à la détoxification alors que la voie
bactérienne conduit à la rupture des cycles avec assimilation du
carbone (CERNIGLIA, 1984 ; CERNIGLIA et al., 1992 ; SUTHERLAND, 1992
cité par CERNIGLIA, 1992).
Les algues vertes et les cyanobactéries transforment
les HAP sous conditions photoautotrophes. Selenatrum capricornutum
dégraderait le Benz[a]pyrène en faisant intervenir une
dioxygénase similaire à celle des bactéries
(CERNIGLIA, 1992).
Le taux de dégradation des HAP est en
général inversement proportionnel au nombre de cycle dans la
molécule. La biodégradation de ces composés aussi bien par
les procaryotes que par les eucaryotes nécessite la présence
d'oxygène pour effectuer la première attaque sur les noyaux
(GIBSON et SUBRAMANIAN, 1984 cités par CERNIGLIA, 1992).
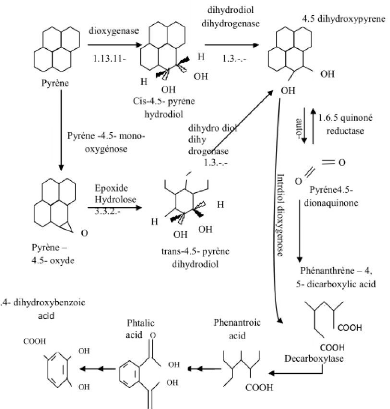
Figure 3 : Dégradation du pyrène
proposée par LIANG et al. (2006).
25
II.2. Types de biodégradation
26
II.2.1. Biodégradation aérobie
Selon ZHENPENG et al.,(2002), La biodégradation
aérobie d'une substance organique est le degré de modification
physique et chimique que subit cette matière organique par les
microorganismes. Celle-ci peut être affectée par la modification
de l'un des facteurs suivants :
· Vitesse de dégradation des composés
organiques.
· Quantité de l'oxygène consommée.
· Produits résultant de la dégradation.
· Activité microbienne.
Figure 4 : Dégradation du naphtalène en
salicylate par voie intradiol par des bactéries
aérobies du
genre Pseudomonas (VANDECASTEELE, 2005).
II.2.2. Biodégradation
anaérobie
La biodégradation anaérobie d'une substance
organique est le degré de modification physique et chimique que subit
cette matière organique par les microorganismes en conditions
d'anaérobiose. La figure 2 illustre les processus de
biodégradation que subit la matière organique en condition
anaérobie (HONGWIE et al., 2003).
II.3. Facteurs affectant la biodégradation des
hydrocarbures dans l'environnement
La biodégradation des hydrocarbures est l'un des
premiers mécanismes conduisant à la transformation de ces
polluants en produits moins toxiques. Les travaux de recherche sur l'oxydation
des hydrocarbures par les microorganismes ont montré que ce processus
dépend de la structure chimique des hydrocarbures et des conditions
environnementales (COSTES et DRUELLE, 1997). Les facteurs
physicochimiques influant sur la vitesse de biodégradation microbienne
sont :
A.
27
La structure du sol et leur nature (composition structure et
surtout diffusion d'oxygène).
B. La composition du polluant selon SOLTANI (2004)
(la vitesse de biodégradation est plus élevée pour
les hydrocarbures saturés, viennent en suite les aromatiques
légers, les aromatiques à haut poids moléculaire).
C. Température (entre 25°C à
37°C.)
D. Ressources en oxygène ; sous forme d'oxygène
pure, air atmosphérique ou le peroxyde d'hydrogène (H 2 O 2)
E. La pression et l'humidité
F. Les nutriments (azote et phosphore en particulier)
G. Le potentiel d'hydrogène (entre 6 et 8)
H. Effet de la salinité
II.4. Biodégradation du pétrole
brut
La spécificité des substrats à l'attaque
microbienne a été largement étudiée. ATLAS 1981
et LEAHY et COLWELL (1990), ont classé les composés du
pétrole en quatre familles. Ces composés différents par
leur susceptibilité à l'attaque microbienne. Ainsi la vitesse de
biodégradation est plus élevée pour les saturés,
viennent ensuite les aromatiques légers, les aromatiques à haut
poids moléculaire, les composés polaires ayant la vitesse de
dégradation la plus faible.
Les hydrocarbures saturés incluent les n-alcanes, les
alcanes ramifiés et les cycloalcanes. Les alcanes à chaines
linéaires sont les plus abondants des hydrocarbures totaux dans le cas
du pétrole léger et peuvent atteindre dans certains cas 60%, les
plus rapidement dégradable tels les n-alcanes à nombre de carbone
supérieur à 44 peuvent être métabolisés par
les microorganismes et ceux ayant de 10 à 24 atomes de carbone (C10-4)
sont généralement les plus facilement dégradables. Les
alcanes ramifiés sont plus récalcitrants à la
biodégradation que les n-alcanes et plus le nombre de ramification
augmente, moins ces composés sont susceptibles à la
biodégradation microbienne. Les hydrocarbures cycliques constituent une
fraction importante des hydrocarbures dans la plupart des bruts
pétroliers, ils sont difficilement dégradables que les deux
séries précédentes à cause de leur toxicité
suite à l'interaction avec la membrane cellulaire des microorganismes
(SIKKEMA et al., 1995).
28
Les expériences montrent de façon
équivoque que la biodégradation des cycloalcanes est très
limitée (ATLAS 1981). La non accumulation des hydrocarbures
cycliques dans l'environnement implique des phénomènes non
conventionnels de dégradation telle que l'intervention des
phénomènes de Co-oxydation impliquant plusieurs souches
microbiennes dont l'équipement enzymatique est complémentaire
(BERTRAND et al., 1989, ROTANI et al.,1992).
II.5. Biodégradation par type
d'hydrocarbure
En aérobiose, de nombreuses bactéries ont
développé des stratégies enzymatiques qui leur permettent
d'incorporer un ou deux atomes d'oxygène à la molécule
cible. Cette réaction d'oxydation rend l'hydrocarbure plus hydrophile et
par conséquent plus facilement dégradable par le
métabolisme bactérien. Les réactions impliquées
dans ces processus font le plus souvent appel à l'action
d'oxygénases (mono- ou dioxygénase). L'acquisition par les
organismes des gènes de dégradation des hydrocarbures se fait le
plus souvent par transfert horizontal via des plasmides, des transposons
(PHALE et al., 2007).
II.5.1. Biodégradation des hydrocarbures
saturés II.5.1.1. Voies de dégradation des alcanes
linéaires
La dégradation aérobie des alcanes est
amorcée par l'introduction d'un atome d'oxygène sur la
chaîne aliphatique via l'action d'une monooxygénase pour former un
alcool linéaire. Cette réaction peut être
réalisée par des cytochromes P450 (SARIASLANI et OMER, 1992),
des méthanes monooxygénases et des systèmes
d'hydroxylases à fer non hémique appelés « alcane
hydroxylase » qui semblent être les plus répandus dans la
dégradation des alcanes (VAN BEILEN et al., 2001).
II.6. Biodégradation oxydative des HAPs par les
bactéries
Une grande variété de bactéries à
Gram-positif et Gram-négatif ont été isolées et
caractérisées pour leur capacité à
métaboliser les HAPs. Si la dégradation bactérienne des
HAPs à faible poids moléculaire tels que le naphtalène, le
phénanthrène, ou encore l'anthracène est clairement mise
en évidence et présente des similarités importantes
(CERNIGLIA, 1992), les mécanismes intervenants dans celle des
HAPs à cinq cycles aromatiques ou plus tels que le Benzo Pyrène
restent encore à explorer. Les HAPs peuvent être
dégradés et minéralisés par un seul organisme ou
par cométabolisme. Les bactéries oxydent initialement les HAPs
par l'incorporation de deux atomes d'oxygène via l'action d'une
dioxygénase entraînant ainsi l'oxydation d'un cycle aromatique.
L'étape initiale d'attaque des HAPs peut être
réalisée via
29
une monooxygénase, une dioxygénase, ou par
oxydation du groupement substitué par l'action de monooxygénase
(GIBSON et PARALES, 2000 ; KHAN et al., 2001 ; WILLIAMS et SAYERS, 1994).
A l'issu de plusieurs réactions biochimiques, l'attaque par une
dioxygénase conduit à un cis-dihydrodiol caractéristique
de la dégradation bactérienne. Les produits sont par la suite
minéralisés ou incorporés en biomasse cellulaire
(dépendant du nombre de cycles et de substitutions). La
dégradation du naphtalène par clivage intradiol est la mieux
connue et constitue la référence pour la dégradation des
HAPs. L'étape initiale de la dégradation du naphtalène,
catalysée par la naphtalène dioxygénase (NahAc) implique
l'incorporation de deux atomes d'oxygène pour former le
cis-1,2-naphtalène dihydrodiol. Les étapes enzymatiques suivantes
aboutissent à la formation de salicylate et sont spécifiques des
composés polyaromatiques (EATON, 1994).
II.7. Microbiologie classique
La microbiologie, selon la technique utilisée, permet
de définir les trais morphologiques, physiologiques et/ou
métaboliques des microorganismes d'un écosystème
donné (HEITKAMP et al., 1988). La majeure partie des
connaissances concernant la biodégradation des hydrocarbures dans
l'environnement a été acquise à partir d'études
basées sur l'isolement de microorganismes hydrocarbonoclastes
(WATANBE et HAMAMURA, 2003).
L'isolement présente comme avantage essentiel de
pouvoir travailler sur des souches pures et ainsi d'étudier
précisément un microorganisme et certaines de ses fonctions. Il
est par exemple possible de caractériser in vitro les mécanismes
biochimiques et moléculaires impliqués dans la dégradation
d'un hydrocarbure. Cependant, les souches hydrocarbonoclastes isolées ne
sont pas forcément représentatives des capacités
métaboliques de la communauté naturellement présente
(THOMPSON et al., 2005).
En effet, seul 1% des bactéries d'une communauté
serait cultivable en condition de laboratoire (AMANN et al., 1995), le
principal biais de ces techniques étant une sous-estimation importante
de la diversité soit une sous-estimation des capacités
métaboliques de la communauté étudiée. Aussi, les
cinétiques de biodégradation d'un polluant in vitro sont
très différentes de celles observées dans l'environnement
(WATANBE et BAKER, 2000).
Toutes ces méthodes, à l'exception des comptages
directs, sont dépendantes de la culture des microorganismes. Afin de
s'affranchir de tels biais, des approches biochimiques et moléculaires
ont été développées au cours de ces vingt
dernières années. La simple utilisation de techniques de
microbiologie classique ne permet pas la caractérisation de
communautés complexes. Elles sont aujourd'hui généralement
utilisées en complément d'approches moléculaires afin
d'apporter des informations complémentaires sur la communauté
30
bactérienne étudiée. Au début du
XXème siècle, la classification des microorganismes reposait sur
des critères morphologiques observés par microscopie ou cultures
pures sur boites de Petri. A cette époque, les microbiologistes
étaient conscients que ces méthodes étaient restrictives
et insuffisantes pour distinguer les espèces les unes des autres
(JANSSEN, 2006).
Matériels et méthodes
I. Objectif
Notre travail a pour objectif d'essayer de réhabiliter un
sol agricole contaminé par les hydrocarbures pétroliers en
utilisant des souches bactériennes.
Ce chapitre a pour but de décrire les différents
protocoles et méthodes mis en oeuvre au cours de ce travail. Certains
protocoles sont détaillés en annexe.
II. Milieux de culture
Gélose nutritive : GN (la composition voir annexe) : un
milieu d'isolement et de purification Gélose au cétrimide (la
composition voir annexe) : un milieu sélectif, qui permet l'isolement
des Pseudomonas et notamment de P.aeruginosa. Ce milieu,
proche du milieu King A, favorise aussi la production de pigments par
P.aeruginosa.
BN (la composition voir annexe) : un milieu destiné
à obtenir une croissance rapide du microorganisme
étudié.
MSM (la composition voir annexe) : un milieu des sels
minéraux
III. Matériel biologique :
Pour la réalisation de nos expériences, nous
avons utilisé des échantillons de sols contaminés par les
hydrocarbures prélevés au niveau des champs de Mascara, Ouargla,
la raffinerie d'Arzew (Sonatrach, compagnie Algérienne de
pétrole). Un autre échantillon est prélevé d'un sol
n'ayant pas subit de rejets pétroliers, il s'agit de sfisef. Afin de
déterminer la répartition des bactéries telluriques en
fonction du degré de pollution du sol par les hydrocarbures.
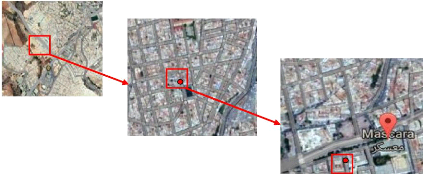
31
Figure 5 : Site d'échantillonnage de Mascara
(Google, 2018)

32
Figure 6 : Site d'échantillonnage d'Ouargla
(Google, 2018)

Figure 7 : Site d'échantillonnage d'Arzew (Google,
2018)

33
Figure 8 : Site d'échantillonnage de Sfisef
(Google, 2018)
IIII. Méthode
IIII.1.Echantillonnage
L'échantillonnage est effectué au centre de
chaque site. Les prélèvements ont été
réalisés à l'aide d'une spatule stérile à
une profondeur de 20 cm. Pour chaque échantillon, 1Kg de sol
prélevé est mis dans des flacons en verre stériles. Les
échantillons de sols obtenus sont ensuite tamisés à 5 mm
puis à 2 mm pour éliminer les éléments grossiers et
les débris organiques. Les échantillons de sols sont
conservés au frais (environ 4°C) (CHAUSSOD et al, 1992 ;
FARDOUX et al, 2000).
IIII.2. Analyses physico-chimiques IIII.2.1. Teneur en
eau ou humidité
Nous avons procédé à la
détermination de la teneur pondérale en eau du sol par la
méthode gravimétrique selon la norme NF ISO 1146. Elle s'exprime
en % c'est-à-dire en gramme d'eau pour 100 g de sol
déshydraté à 105°C. Le taux d'humidité
s'exprime en % selon la formule suivante : H% = P 1 - P 0 / P
0
P 0 : poids de la prise d'essai du sol (g).
P 1 : poids de la prise d'essai de sol
après séchage à 105°C (g).
IIII.2.2. Potentiel d'hydrogène (pH)
Le pH est déterminé selon la norme AFNOR X
31-103 (AFNOR, 1994) par la mesure du pH d'une suspension de sol dans l'eau
à 2/5 (rapport masse/volume) après 1 heure d'agitation puis
décantation à l'aide d'un pH mètre.
34
III.2.3. Conductivité électrique (CE)
La conductivité électrique est mesurée
sur l'extrait de sol dilué au 1/5. Elle doit être exprimée
en dicisiemens par mètre (ds/m) (BAIZE, 2000). Elle a
été déterminée par un conductimètre.
IIII.3.Isolement des microorganismes
Pour la dilution des échantillons, nous avons besoin d'eau
physiologique stérile, tubes Stériles, une micropipette et un
vortex, une balance.
Pour l'ensemencement et la purification, nous utilisons des
boites de Pétri contenant de la Gélose nutritive ordinaire (GN)
et de gélose au cétrimide.
IIII.3.1. Enrichissement IIII.3.1.1. Dilution
décimale
Afin de dénombrer la microflore bactérienne
existant dans l'échantillon, la solution mère du Sol est
préparé (10gr de sol dans 90mL de bouillon nutritif) suivie d'une
série de dilutions Décimales allant de 10 -1 (solution
mère) à 10-6en conditions d'asepsie.
IIII.3.1.2. Isolement des bactéries sur milieu
solide
On prélève 0,1 ml de chaque dilution
préparée qu'on ensemence par étalement sur les boites De
Pétri contenant de la GN et de cétrimide à l'aide d'un
râteau. L'incubation des boites se fait à 30°C pendant
24h.
IIII.3.2. Dénombrement des
bactéries
Le dénombrement après culture concerne,
évidement les cellules viables de l'échantillon Autrement dit,
les cellules capables de croitre. Il est basé sur l'aptitude de chaque
bactérie, fixée par la solidification du milieu
gélosé, à former une colonie visibles à l'oeil nu
(AUSTIN, 1988).
Après 24h d'incubation à 30°C, les colonies
développées sont dénombrées à l'aide d'un
Compteur de colonies en UFC (Unité Formant Colonie).
Le nombre de germes par gramme de sol est déterminé
en calculant la moyenne
Arithmétique des résultats obtenus et en tenant
compte des facteurs de dilution, selon la formule (MARCHAL et BOURDON
,1982)
N = n / d. v
35
Où :
N : Nombre des microorganismes en UFC/ ml.
n: Nombre des colonies
dénombrées.
v: Volume prélevé (0.1ml).
d: Dilution).
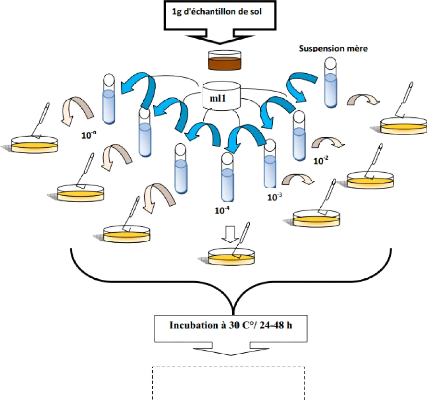
Dénombrement des colonies
Figure 9 : Schéma de l'isolement et de
dénombrement des bactéries IIII.3. Observation
macroscopique
L'observation macroscopique des colonies permet d'effectuer une
première caractérisation (aspect des colonies et de leur revers,
la taille et la couleur.
D'après JOFFIN et LEYRAL (2006), les
éléments d'identifications macroscopiques sont:
· La forme des colonies : rondes,
irrégulières,...etc.
· La taille des colonies par la mesure du diamètre:
ponctiformes ou non ponctiformes.
· La chromogénèse: couleur de la colonie.
· L'élévation: convexe, concave, plate.
·
36
L'opacité: opaque, translucide ou transparente.
· La surface: lisse, rugueuse, sèche,
dentelée,...etc. IIII.3.4. Observation microscopique
IIII.3.4.1.Coloration de Gram
C'est une double coloration qui nous permet de connaître
la forme, l'arrangement, la pureté ainsi que la nature biochimique de la
paroi des cellules purifiées. Cette coloration est réalisé
systématiquement sur les différentes colonies purifiés
pour préciser le caractère Gram+ ou Gram-. Avec cette coloration
double, les bactéries Gram positive apparaissent en violet foncé
tandis que les bactéries Gram négatives sont colorées en
rose ou en rouge (DELARRAS, 2008).
La technique est comme suit :
-A partir des boîtes de pétri faire
un frottis.
-Déposer une goutte d'eau physiologique sur la lame.
-Frotter la pointe dans la goutte d'eau physiologique. Laisser
sécher à l'air.
-Passer 3 fois la lame dans la petite flamme du bec Bunsen pour
fixer l'échantillon à la
chaleur.
-Déposer quelques gouttes de solution de violet de
gentiane (cristal violet) sur le frottis fixé.
-Laisser agir 1 minute. Jeter l'excès de colorant dans un
bécher.
-Rincer très brièvement
-Déposer quelques gouttes de lugol sur le frottis.
-Laisser agir 1 minute. Jeter la solution de Lugol dans un
bécher et rincer brièvement à l'H2O.
-Déposer quelques gouttes d'alcool sur le frottis et
laisser agir 30 secondes.
-Rincer à l'H2O.
-Déposer la solution de fishine pendant 1 minute.
-Rincer à l'H2O.
-Laisser sécher à l'air.
-Observer au microscope (grossissement 400x ou, avec une goutte
d'huile à immersion, au
grossissement 1000x).
37
IIII.3.4.2.Coloration de spores
La coloration au bleu de méthylène permet
l'observation de la morphologie cellulaire et la présence ou l'absence
de spore (DELARRAS, 2008).
La technique est comme suivante :
-Réaliser un frottis fixé sur la lame.
-Recouvrir la lame de vert de malachite.
-Chauffer jusqu'à émission de vapeurs sans faire
bouillir le colorant ni laisser sécher la
préparation. Le chauffage doit durer 10 min.
-Laisser refroidir et laver à l'eau.
- Recouvrir la lame de fishine durant 1min.
-Laver et sécher
-Observation à l'objectif 100 à immersion.
IIII.4.Purification des isolats
Après 24 h d'incubation, nous passons à
l'étape de purification des cultures. Celle-ci
Nous permet d'obtenir des cultures pures à partir des
différentes colonies isolées.
La sélection des colonies est basée sur l'aspect
macroscopique des colonies à savoir la couleur, la forme, le
diamètre, l'opacité. Un échantillon de chaque type de
colonie est prélevé et ensuite purifié par repiquages
successifs et alternés en milieu liquide, puis en milieu solide
jusqu'à l'obtention au sein d'une boite de Pétri de colonies
identiques par l'aspect et la couleur (Delarras, 2007).
IIII.5. Conservation des isolats
A partir d'une boite de pétri contient des colonies
bien purifie, prélever une colonie bien isolé. -ensemencer dans
un milieu BN, incuber a 30 °C /24 avec agitation.
-centrifuger a 6000 rpm pendant 10 min dans des tubes
Eppendorf (1ml de la suspension bactérienne)
-éliminer le surnageant et garder le culot.
-ajouter 0.8ml BN stérile et 0.2 solution glycérol
stérile a l'Eppendorf qui contient le culot. -vortexer et conserver a
-20 °C (congélation).
(HOHZOH K, 1982) (JYOTHI K, K SURENDRA BABU 2012)
38
IIII.6. Identification des microorganismes
Elle comporte une série de tests permettant de mettre
en évidence le type respiratoire des souches, leur métabolisme
énergétique et celle du sulfure d'hydrogène (H2S), la
réduction des nitrates. Des activités enzymatiques telles que
l'oxydase, la catalase, et les enzymes de transformation des acides
aminés (ADH et LDC) ont été également
recherchées. Les souches ont été testées aussi pour
l'utilisation des citrates, du glucose et de lactose.
IIII.6.1. Recherche des enzymes respiratoires
IIII.6.1.1. Recherche de la catalase
La catalase est une enzyme ayant la propriété de
décomposer le peroxyde d'hydrogène (H2O2 ) Avec dégagement
d'oxygène (Marchal et Bourdon, 1982).
Sur une lame et à l'aide d'une pipette Pasteur, on
dépose une colonie bactérienne à laquelle On ajoute de
l'eau oxygénée (à 10 volumes = 3%).
La présence d'une catalase est
révélée immédiatement par des bulles de gaz qui
Correspondent à l'oxygène
dégagé.
IIII.6.1.2. Recherche de l'oxydase
Ce test permet la détection de la
phénylène-diamine-oxydase ou le cytochrome oxydase Enzyme entrant
dans divers couples d'oxydoréduction (Singleton, 1999).
Pour réaliser ce test, un disque d'oxydase
préalablement imbibé d'une goutte d'eau distillée
Stérile est déposé sur une lame et mis en contact avec une
colonie bactérienne fraîchement cultivée.
L'apparition d'une coloration violette immédiatement
indique que le test est positif.
IIII.6.2.Test ONPG
- Faire une suspension dense en eau physiologique de la souche
à étudier, puis ajouter un disque ONPG
(MARCHAL et BOURDON, 1982).
IIII.6.3. Recherche de Citrate
(Utilisation du citrate comme seule source de carbone)
Pour réaliser ce test :
39
Ensemencer la pente selon une strie longitudinale
avec une pipette chargée de suspension (préparée
à partir d'une culture sur milieu gélosé, en
prenant soin de ne pas racler le milieu pour ne pas apporter
d'éléments nutritifs susceptibles de fausser les
résultats).
- incuber à 37°C/24, sans trop visser le
bouchon
(JOFFIN et LEYRAL, 2006).
IIII.6.4. Clark et Lubs (tests RM et VP)
-Ensemencer un milieu Clark et Lubs avec
quelques gouttes de suspension bactérienne.
- Incuber à 37°C pendant 24 à 48 h.
Après vérification de la culture
(trouble du milieu) :
Test RM (rouge de méthyle)
-Transférer a l'aide d'une pipette
Pasteur environ 0,5 ml de milieu Clark et Lubs dans un tube
à hémolyse.
- Ajouter 1 goutte de rouge de
méthyle.
Test VP (Vosges-Proskauer)
- Transférer dans un tube à hémolyse
à l'aide d'une pipette Pasteur, environ 0,5 ml de milieu
Clark et Lubs, y ajouter 1 goutte de
réactif.
- Attendre 10 min avant de conclure à un résultat
négatif
(JOFFIN et LEYRAL, 2006).
IIII.6.4. Hydrolyse a l'amidon
Ensemencer la gélose par une strie ou un spot de 3
à 5 mm de diamètre, à l'aide de l'anse de platine
chargée de culture (plusieurs souches possibles sur la même
boîte).
Incuber à 30 ou 37°C pendant 1 à 5
jours, en position retournée
(MARCHAL et BOURDON, 1982)
IIII.6.5. Mannitol mobilité
Ensemencer par piqûre centrale à l'aide du fil droit
chargé de suspension de la culture à étudier.
Incuber 24 heures à 37°C
(MARCHAL et BOURDON, 1982).
40
IIII.6.6.Viande-foie
-Régénérée la gélose VF par
ébullition au bain-marie bouillant pendant environ 30 minutes.
-Ensemencer lorsque le milieu est encore liquide, vers 45°C.
L'ensemencement se fait à la pipette Pasteur scellée (ou
boutonnée) et chargée. On introduit la pipette Pasteur au fond du
tube et on remonte en spirale.
-Ne pas visser le bouchon à fond.
-On place ensuite le tube à l'incubateur (à
37°C) pendant 24 heures (JOFFIN et LEYRAL, 2006).
IIII.6.7. Étude du métabolisme
protéique
IIII.6.7.1. Recherche des décarboxylases (ODC,
LDC, ADH)
- Ensemencer chaque milieu avec quelques gouttes de suspension de
la culture à étudier. - incuber à 37°C/24h
(MARCHAL et BOURDON. ,1982).
IIII.6.I. Sélection des bactéries par
utilisation de milieux de culture spécifiques IIII.6.I.1.Croissance sur
milieu King (King A et King B)
Les milieux de King (milieu King A et milieu King B permettent de
différencier entre elles les différences espèces du genre
Pseudomonas, par la mise en évidence de la production de pigments
spécifiques (MARCHAL et BOURDON, 1982).
La technique est comme suivante
- A partir d'une culture sur gélose (faire une
suspension), ensemencer le milieu en faisant une strie à la surface de
la gélose avec l'anse (ou en déposant une goutte de
suspension).
- L'incubation est réalisée en aérobiose.
IIII.6.J. Bouillon nitraté
Ensemencer un milieu nitraté avec quelques gouttes de
suspension bactérienne. Après incubation (culture visible),
ajouter:
-Du réactif de Griess (2 gouttes)
-Ou une goutte de réactifs :
o
41
réactif Nitrites 1 (acide sulfanilique),
o réactif Nitrites 2
(á-naphtylamine).
Le réactif de Greiss est un mélange des
réactifs nitrites 1 & 2 (MARCHAL et BOURDON, 1982).
IIII.7.isolement de bactéries qui
dégradent le pétrole :
-Ensemencer les souches dans un milieu minéral qui
contient MSM.
-Lancer une culture des souches isolées dans du
bouillon nutritif et incuber pendant 24heures. -Centrifuger la culture à
3000t/min pendant 10 minutes, récupérer le culot et effectuer un
lavage avec msm liquide 5 fois.
-Laver l'agar puis préparer MSM solide, le couler dans
des boites préalablement numérotées et les laisser
solidifier.
-Après solidification de la gélose (verser une
grande couche de la gélose), étaler 100 ul de pétrole
filtré sur la surface des boites puis laisser sécher devant le
bec benzène 3heures de temps.
- A partir des différents culots, prendre avec une ance
stérile une goute et déposer sous forme de spots le
concentré de culture dans les carreaux appropriés a chaque
souche.
-Laisser sécher devant le bec benzène puis
incuber a l'abri de la lumière à 30°C pendant 7 à
15jours et la lecture doit se faire quotidiennement
Remarque : l'incubation de certaines souches peut durer
jusqu'à 21jours.
-Faire la lecture des boites tous les jours pour voir s'il y
apparition de zones claire.
(HOHZOH K, 1982) (JYOTHI K, K SURENDRA BABU 2012)
IIII.8.Détection de l'activité de biodégradation
des bactéries
La croissance bactérienne a été suivie
par mesure de la DO par spectrométrie à une longueur d'onde de
595nm de 0heure jusqu'à 15 jours et a des intervalles réguliers
de 2 jours (avec MSM comme Blanc).
(HOHZOH K, 1982) (JYOTHI K, K SURENDRA BABU 2012)
42
Résultats et discussion
I. Analyses physico-chimiques
I.1. Caractéristiques du sol
étudié
Tableau 2 : Caractéristiques de quatre types de
sols étudiés.
|
Echantillon
|
Site de prélèvement
|
Description
|
|
1
|
Mascara
|
Couleur marron foncée.
|
|
2
|
Ouargla
|
Couleur orange, sableux,
sèche.
|
|
3
|
Raffinerie d'Arzew
|
Couleur noir avec des
particules marron
foncé, forte odeur de polluant
|
|
4
|
Sfisef
|
Couleur marron.
|
|
|
|
|
|
|
|
|
E4
|
|
E3 E1 E2
|
|
|
|
|
Figure 10 : Différents échantillons des
sols étudiés.
|
I.2. Mesure du potentiel d'hydrogène
Tableau 3 : Potentiel d'hydrogène des quatre sols
étudies.
|
Echantillon
|
pH
|
|
1
|
6.73
|
|
2
|
6.08
|
|
3
|
6.54
|
|
4
|
6.8
|
43
Les valeurs de pH obtenues pour les 4 sols
étudiés varient entre 6.08 et 6.73. Les échantillons de
sol appartenant à E1, E3, E4 sont des sols acidifiés mais
présente des valeurs proche de la neutralité alors que E2 est un
sol acidifié. On constate aussi une diminution de la valeur de pH pour
E2.
Le pH apparait ainsi comme un paramètre qui influence
de manière majeure la structure et la diversité des
communautés bactériennes dans les sols, et impose directement une
contrainte physiologique sur les bactéries du sol. (NICOLAS T.,
2013).
L'activité biologique d'un sol varie avec le pH, la
diversité, l'abondance et l'activité de la microflore
(bactéries) sont en effet influencées par le pH. Chaque
espèce possède une plage optimale de pH, par exemple, Un pH de 7
est optimal pour l'activité des bactéries responsables des
transformations de la matière organique, et par conséquent il
assure un bon déroulement de la biodégradation des
hydrocarbures.
I.3. Teneur en eau ou humidité
Tableau 4 : Taux d'humidité des quatre sols
étudies.
|
Echantillon
|
Humidité
|
|
1
|
4
|
|
2
|
0.95
|
|
3
|
4.3
|
|
4
|
4.4
|
Les échantillons de sols étudiés sont
aussi caractérisés par une humidité relative variant de
0.95 à 4.4%. Les valeurs les plus élevées sont celles de
l'échantillon d'E4 (4.4%), de l'échantillon d'E3 (4.3%) et d'E1
(4%), l'échantillon E2 présente la valeur d'humidité la
plus faible 0.95%.
Les faibles teneurs en eau des échantillons peuvent
d'une part être expliquées par les faibles humidités
relatives des sols sahariens (MONOD, 1999), il est à noter
qu'un faible taux d'humidité peut avoir un effet négatif sur
l'activité microbienne en limitant le contact microorganisme / polluant
et en inhibant le processus de dégradation enzymatique (LECOMTE,
1995).
ERIKSON et al. (2001) ont montré l'influence
de la structure du sol sur le transport de l'oxygène dans ce dernier.
Ces auteurs indiquent que plus un sol est dense, moins les nutriments et l'O 2
sont transportés vers la flore indigène du milieu, responsable de
la
biodégradation. De même, NAM et al. (2003)
ont observé que les agrégats de sols réduisaient la
biodégradation. Cependant, dans les zones arides où le sable est
la fraction dominante, les micro-organismes et leurs produits de
synthèse sont faiblement reliés aux particules du sol
(DOMMERGUES ET MANGENOT, 1970).
I.4. Conductivité électrique
(CE)
Tableau 5 : Conductivité électrique des
quatre sols étudies.
|
Echantillon
|
Conductivité
|
|
1
|
2.5
|
|
2
|
14.7
|
|
3
|
3.4
|
|
4
|
3
|
La valeur de la conductivité électrique de l
échantillon E2 est très élevée 14.7 dS/m, les trois
autres échantillons présentent des valeurs de conductivité
électrique similaires variables de 2.5 à 3 dS/m.
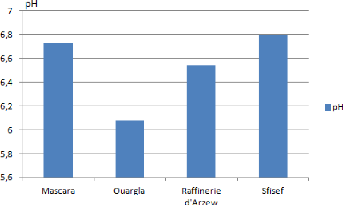
44
Figure 11 : Potentiel d'hydrogène des quatre
sols étudies.
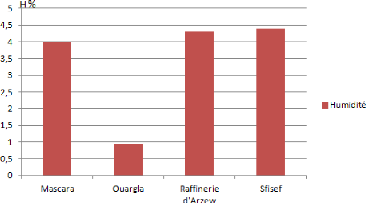
Figure 12 : Taux d'humidité des quatre sols
étudies.
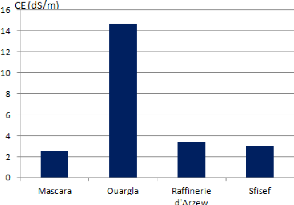
45
Figure 13 : Conductivité électrique des
quatre sols étudies.
II. Analyses microbiologiques du sol
Le résultat du dénombrement sur gélose
nutritive obtenus pour les différentes dilutions a permis d'avoir une
idée sur la charge bactérienne du site pollué ainsi que de
sa diversité. Les valeurs sont rapportées dans les tableaux
suivants.
Tableau 6 : Dénombrement sur gélose
nutritive pour l'échantillon 3.
|
Dilution
|
10-1
|
10-2
|
10-3
|
10-4
|
10-5
|
10-6
|
|
Dénombrement(boite1)
|
nappe
|
nappe
|
nappe
|
nappe
|
118
|
53
|
|
Dénombrement(boite2)
|
nappe
|
nappe
|
nappe
|
nappe
|
40
|
40
|
Tableau 7 : Dénombrement sur gélose
nutritive pour l'échantillon 4.
|
Dilution
|
-1
|
-2
|
-3
|
-4
|
-5
|
-6
|
|
Dénombrement(boite1)
|
nappe
|
nappe
|
nappe
|
346
|
nappe
|
280
|
|
Dénombrement(boite2)
|
nappe
|
nappe
|
nappe
|
18
|
nappe
|
10
|
Tableau 8 : Dénombrement sur gélose
nutritive pour l'échantillon 1.
|
Dilution
|
10-1
|
10-2
|
10-3
|
10-4
|
10-5
|
10-6
|
|
Dénombrement(boite1)
|
nappe
|
nappe
|
nappe
|
280
|
152
|
270
|
|
Dénombrement(boite2)
|
nappe
|
nappe
|
nappe
|
310
|
210
|
80
|
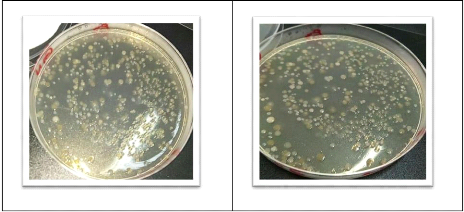
Figure 14 : Dénombrement sur gélose
nutritive pour l'échantillon 3.
46
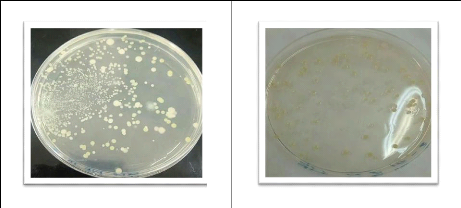
47
Figure 15 : Dénombrement sur gélose
nutritive pour l'échantillon 1.
Le dénombrement a montré une charge
bactérienne aux alentours de 11.4×106 UFC/g de sol pour
l'échantillon 3 et de 59.1×106 UFC/g de sol pour
l'échantillon 1, cela ne s'explique que par les conditions
éco-climatique du site et la présence des polluants.
En tenant compte uniquement des bactéries cultivables,
la variété des aspects, par contre n'est pas très
élevée, cela nous a permis de sélectionner à partir
de 17 isolats 5 seulement qui sont vraiment différentes sur le plan
macroscopique.
II.1. Caractéristiques des isolats
purifiés
Un sol qui contient des hydrocarbures va modifier
l'activité des microorganismes. Ceux-ci doivent donc adapter leur
activité enzymatique afin de pouvoir s'y attaquer. Les bactéries
vont ensuite subir une période de forte croissance au cours de laquelle
ils seront capables d'assimiler les produits de la dégradation des
hydrocarbures. Cette biodégradation peut prendre plusieurs mois. Une
fois qu'ils ont consommé les composés les plus facilement
dégradables, leur nombre diminue jusqu'à atteindre de nouveau la
taille d'une population normale. (Ce qui explique l'écart au niveau de
nombre des souches isolées entre les deux échantillons). Parfois,
seule une partie des polluants est dégradés car les hydrocarbures
se lient partiellement à la matière organique du sol et
deviennent alors moins accessibles aux microorganismes. Le niveau de
dégradation des pétroles (mélange de composés
facilement dégradables et de composés récalcitrants) est
donc totalement dépendant de la diversité métabolique des
bactéries hydrocarbonoclastes présentes dans l`environnement
pollué. La diversité des espèces bactériennes est
un facteur décisif dans la réponse des communautés
bactériennes à ce type de variation environnementale. (SAURET
C.,2011).
48
Les colonies sont généralement lisses et ont un
diamètre de plus de 1mm, de tous les microorganismes du sol, les
bactéries sont les plus nombreuses et les plus petites : la taille de
leurs colonies ne dépasse pas en général, 0.5 à 2
mm de diamètre. (ROGET et al,.2001) cité dans
(DJAOUD M.,2013).
III. Etude des caractères
morphologiques
Les caractères macroscopiques des souches
isolées sont regroupés dans le tableau 9. Tableau 9 :
Caractères macroscopiques des colonies isolées sur gélose
nutritive.
|
Souche
|
Taille
|
Forme
|
Aspect de
surface
|
Contour
|
Opacité
|
Consistance
|
Couleur
|
|
SC
|
Petite
|
Allure bombé
|
Lisse
|
Régulier
|
Translucide
|
Grasse
|
Banche
|
|
SG
|
Grande
|
Allure bombé
|
Lisse
|
Régulier
|
Translucide
|
Grasse
|
Verte
|
|
SH
|
Grande
|
Allure bombé
|
Lisse
|
Régulier
|
Translucide
|
Grasse
|
Verte
|
|
SI
|
Petite
|
Allure
Demi
bombé
|
Lisse
|
Régulier
|
Translucide
|
Crémeuse
|
Banche
|
|
SJ
|
Moyenne
|
Allure Demi bombé
|
Lisse
|
Régulier
|
Opaque
|
Grasse
|
Rouge
|
|
SL
|
Grande
|
|
Rigoureuse
|
Dentelé
|
Opaque
|
Sèche
|
Beige
|
L'observation macroscopique montre des colonies bien
séparées avec des caractères spécifiques qui
différencient les souches.
49
Tableau 10 : Etude microscopique des souches
isolées.
|
Critères
|
Coloration de Gram
|
Présence de spores
|
|
Gram
|
Forme des cellules
|
|
SC
|
+
|
Cocci
|
Spore -
|
|
SG
|
-
|
Bacille
|
Spore -
|
|
SH
|
-
|
Bacille
|
Spore -
|
|
SI
|
-
|
Coccobacille
|
Spore -
|
|
SL
|
+
|
Bacille
|
Spore +
|
|
SJ
|
-
|
Petit bacille
|
Spore -
|
D'après les observations, il ressort que les souches
isolées sont de forme et de Gram différents. La souche (SB) est
une Cocci à Gram positive. Les souches (SG) et (SH) sont des bacilles
à Gram négative, la souche (SI) Coccobacille à Gram
négative alors que la souche (SJ) appartient à des petits
bacilles à Gram négative, tandis que la souche (SL) est bacille
à Gram positive.
La coloration de spore a révélé la
présence de spore uniquement chez les bacilles, les coques et les
colibacilles en sont dépourvus.
Selon PELMONT, (1995), Les caractéristiques
des bactéries aptes à biodégrader les hydrocarbures sont
les suivantes :
· La majorité des souches bâtonnées
Gram négatives
· 32% des bactéries motiles ou mobiles
· 20% des bactéries à Gram positives,
filamenteux.
Les figures en dessous illustrent les différents
aspects macroscopiques et quelques aspects microscopiques.
50
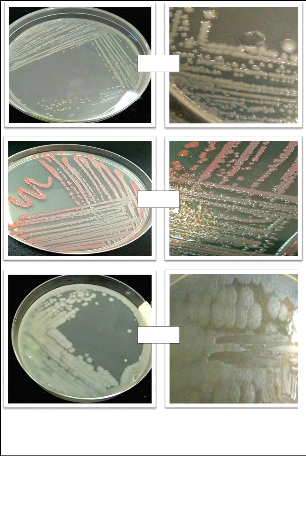
51
Souche C
Souche J
Souche L
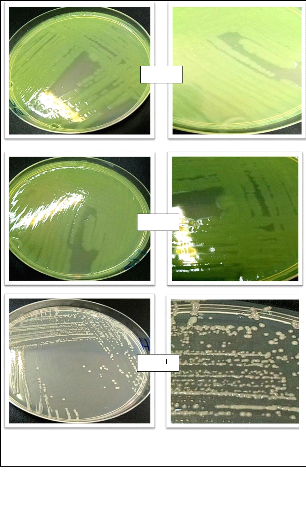
52
Figure 16 : Différents aspects des colonies
bactériennes obtenus.
Souche H
Souche
Souche G
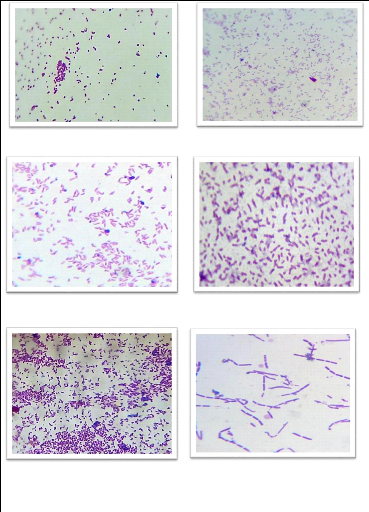
Figure 17 : Différents aspects microscopiques
obtenus.
53
IIII. Recherche des enzymes respiratoires
Le dégagement des bulles de gaz par les souches (SG),
(SI), (SJ), et (SL) révèle la présence de l'enzyme
catalase sauf pour les souches (SC), et (SH) qui ne possède pas
d'enzyme.
54
Pour le test de l'oxydase toutes les souches ont un
résultat négatif à part les deux souches (SG), et (SH).
Tableau 11 : Présence des enzymes
respiratoire.
|
Souche
|
Oxydase
|
Catalase
|
|
SC
|
-
|
-
|
|
SG
|
+
|
+
|
|
SH
|
+
|
-
|
|
SI
|
-
|
+
|
|
SJ
|
-
|
+
|
|
SL
|
-
|
+
|

Figure 19 : Test oxydase.
Figure 18 : Test catalase.
IV. Tests biochimiques
Le tableau 12 regroupe les résultats des tests que nous
avons effectués sur chacune des souches isolées.
55
Tableau 12 : Résultats des tests
biochimiques.
|
Souches /tests
|
SC
|
SG
|
SH
|
si
|
SJ
|
SL
|
|
Enzymes Respiratoires
|
Catalase
|
-
|
+
|
+
|
+
|
+
|
+
|
|
Oxydase
|
_
|
+
|
+
|
_
|
-
|
-
|
|
Viande foie
|
Ana
Fac
|
AS
|
AS
|
AAF
|
Ana
Fac
|
AAF
|
|
Nitrate
|
+
|
+
|
_
|
+
|
+
|
+
|
|
Métabolismes glucidique
|
Glucose
|
-
|
+
|
-
|
-
|
+
|
+
|
|
Diholoside
|
-
|
-
|
-
|
+
|
-
|
-
|
|
Gaz
|
+
|
-
|
-
|
+
|
+
|
+
|
|
H2s
|
-
|
-
|
-
|
+
|
-
|
-
|
|
ONPG
|
+
|
+
|
-
|
-
|
+
|
-
|
|
RM
|
+
|
+
|
+
|
+
|
-
|
-
|
|
VP-
|
|
-
|
-
|
-
|
-
|
-
|
|
Mannitol
|
+
|
+
|
+
|
+
|
+
|
+
|
|
Citrate perméase
|
-
|
+
|
+
|
-
|
+
|
+
|
|
Métabolisme protéique
|
ADH
|
_
|
+
|
+
|
_
|
_
|
_
|
|
LDC
|
+
|
+
|
+
|
+
|
+
|
_
|
|
ODC
|
_
|
+
|
+
|
_
|
+
|
_
|
|
King A
|
/
|
_
|
_
|
/
|
/
|
/
|
|
King B
|
/
|
+
|
+
|
/
|
/
|
/
|
56
|
|
|
|
|
|
|
|
|
|
|
|
Mannitol
|
TSI
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Citrate
|
|
Clark et Lubs
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ONPG
|
VF
|
|
Figure 20 : Résultats des tests biochimiques
obtenus (métabolisme glucidique).
|
57
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ADH
|
LDC
|
ODC
|
|
Figure 21 : Résultats des tests biochimiques
obtenus (métabolisme protéique).
|

Figure 22 : Résultats des tests biochimiques
obtenus (King A et B).
V. Identification des souches isolées
L'identification a pu être réalisée
à l'échelle du genre ou de la famille. En effet, parmi les cinq
bactéries isolées, nous avons pu affilier les souches comme
appartenant aux familles suivantes (BERGEY, 1984 ) :
58
Pseudomonaceae
D'après sa morphologie macroscopique, les souche SG et
SH ont été affiliées au genre Pseudomonas en
raison de la morphologie de ses petites colonies circulaires, lisses et
brillantes. Ces souches ont une forme bacillaire, isolées ou en amas
avec les caractéristiques suivantes : Gram négatif, oxydase
positive, catalase positive, non sporulées. Ceci nous a orientés
vers la culture de ces souches sur milieux King A et King B spécifiques
des Pseudomonas.
La révélation d'une couleur bleu verte sur King
A et un jaune verdâtre fluorescent sur King B confirme l'appartenance au
genre Pseudomonas (Figure 22). Ces bactéries ont un
caractère aérobie strict, ADH et citrate positif (BERGEY,
1984 ;LARPENT, 1992 ; PREVOT, 1961 et SINGLETON, 1999). Une identification
biochimique (tableau 12) a permis de différencier ces souches
bactériennes et de les identifier au tant que : Pseudomonas putida
(SH) et Pseudomonas fluorescens (SG).
L'incapacité de la souche SH à dégrader
le mannitol avec ONPG positive (tableau 12) nous permet de supposer qu'il
s'agit de Pseudomonas putida. (LEYRAL et JOFFIN, 1998).
Les colonies de la souche SG sont incolores dans le milieu
King A et elles sont de couleur jaune dans le milieu King B. A coté de
ce paramètre, les caractères biochimiques permettent de
déduire que cette souche correspondrait à P.fleoresens.
(LEYRAL et JOFFIN,1998).
Moraxellaceae
Ce sont de petits Coccobacille G- de 0,9 um sur 1,36 um,
immobiles. La souche (SI) répond positivement au catalase et de nitrate
réductase, ainsi que l'ONPG. Elle n'utilise pas le glucose. Elle produit
l'H2S, et peut utiliser les nitrates. Elle est LDC positive mais ADH et ODC
négative. D'après les résultats des tests biochimiques
(tableau 12) et par comparaison avec ceux établis par BERGEY (1984),
il est probable que la souche (SD) correspondrait à l'espèce
Acinetobacter sp.
Bacillaceae
En raison de la morphologie de leurs cellules en forme de
bacilles (figure 6), Gram positif, sporulés (tableau 10) catalase
positive, oxydase négative et un citrate perméase positif
(tableau 12). La souche (SL) a été affiliée au genre
Bacillus.
La souche (SL) a un ONPG, ADH, LDC et ODC négatives,
elle oxyde le glucose et le saccharose, ne produit pas H 2 S (tableau 12).
D'après ces caractéristiques, cette souche pourrait
être Bacillus sp. (BERGEY, 1984 ; LEYRAL et JOFFIN, 1998).
Enterococcaceae
59
La souche (SC) est apparentée au genre Enterococcus
en raison de sa forme de chaînettes. Les colonies blanches,
régulières et lisses (figure 22). Cette souche n'oxyde pas le
glucose, à mobilité, oxydase négative et résistante
(NACL= 6).
D'après les résultats des tests biochimiques et
par comparaison avec ceux établis par BERGEY (1984), il est
probable que la souche SC correspondrait à l'espèce
Entérococcus sp.
Enterobacteriaceae
La souches (SJ) a été rattachée à
la famille des Enterobacteriaceae et présente les
caractéristiques suivantes : une forme bacillaire (figure 22), à
Gram négatif, catalase positive et oxydase négative.
L'étude des caractères biochimiques, nous a permis de rattacher
la souche (SJ) au genre Serratia.
La souche bactérienne (SJ) est mobile, capable
d'utiliser le citrate de sodium comme unique source de carbone, elle est ONPG
positive, LDC, ADH, ODC, indole et VP négatives (tableau12). Compte tenu
de ces résultats, l'espèce serait probablement Serratia
marcescens (BERGEY, 1984, LEYRAL et JOFFIN, 1998).
La synthèse des résultats obtenus et leur
comparaison à ceux de nombreux auteurs (BERGEY, 1974 ; MARCHAL, 1987
; LARPENT et al., 1990 et LARPENT et al., 1998) nous conduisent aux
conclusions suivantes :
SG :
Famille : Pseudomonadaceae Genre :
Pseudomonas
Espèce : Pseudomonas fluorescens
SH :
Famille : Pseudomonadaceae Genre :
Pseudomanas
Espèce : Pseudomanas putida
60
SI :
Famille : Moraxellaceae Genre : Acinetobacter
Espèce : Acinetobacter sp
SL :
Famille : Bacillaceae Genre : Bacillus
Espèce : Bacillus sp
SJ :
Famille : Enterobacteriaceae Genre :
Serratia
Espèce : Serratia marcescens VI. Test de
biodégradation
Après une incubation de 5 jours à
l'obscurité, les colonies qui montrent une dégradation sont
entourées de zones claires sur la surface opaque de la gélose.
Cette technique s'appelle: (OIL SPREADING THECHNIQUE) (HOHZOH K et al.,
1982).
Après l'incubation des boites, la lecture se fait
quotidiennement pour voire s'il y a eu apparition de zones clair.
La biodégradation des hydrocarbures se manifeste par
l'apparition de zones claires sur le milieu de culture. Cette méthode
s'avère, simple et pratique pour l'isolement des bactéries qui
ont le potentiel de dégrader les hydrocarbures.
Ces bactéries isolées sont capables de
digérer le pétrole et cette méthode peut être
applicable pour la détection de souches qui dégradent d'autres
hydrocarbures non volatiles.
Cette méthode peut être utilisée aussi
pour l'étude de la dégradation du naphtalène,
phénanthrène, et l'anthracène en plus de la
détection des bactéries mutantes, auxotrophes
61
d'après HOHZOH K et al., 1982.
Dans quelques cas, il y a eu des colonies qui ont
montré une dégradation du pétrole vaporisé sur la
gélose, et qui ont donné des zones beaucoup plus importantes que
celles observées dans le travail de ce dernier. Le diamètre des
zones varie de 2 mm à 10 mm, et cela est important comme résultat
par rapport aux résultats cités dans la littérature.
(HOHZOH K et al., 1982).
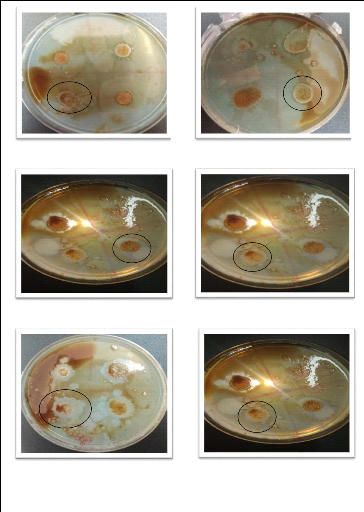
La souche C (avec un diamètre de 10 mm) La souche G (avec
un diamètre de 2mm)
La souche H (avec un diamètre de 4mm) La souche I (avec un
diamètre de 2mm)
La souche J (avec un diamètre de 4mm) La souche L (avec un
diamètre de 2mm)
Figure 23 : Les zones claires du test de
biodégradation.
62
VII. Détection de l'activité de
biodégradation des bactéries
La variation de biomasse au cours de temps (jour) des quatre
souches testé au cours de croissance dans le milieu de sels
minéraux (MSM) additionné de 1% de pétrole brute comme
seul source de carbone et de phénol a été suivi en
mesurant la concentration microbienne en fonction du temps ce qui nous a permis
de tracer les courbes représentées par les figure (24,
25, 26, 27 et 28). Les valeurs de Log UFC/ml en fonction du
temps sont données dans les tableaux (voir annexe).
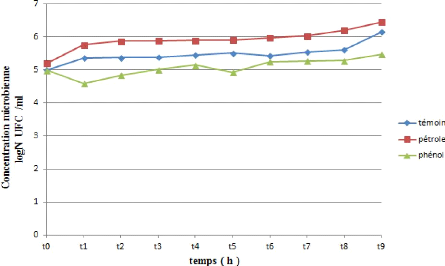
63
Figure 24 : Cinétique de croissance d'une souche
bactérienne (SI) durant la
biodégradation du pétrole et
du phénol.
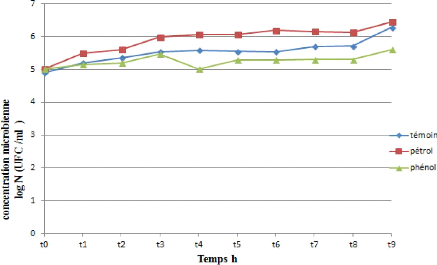
64
Figure 25 : Cinétique de croissance d'une souche
bactérienne (SL) durant la
biodégradation du pétrole et
du phénol.
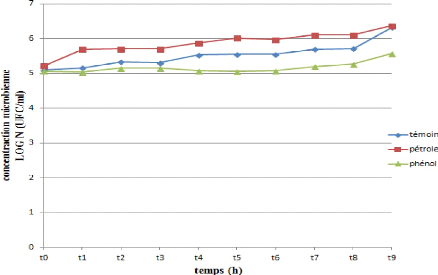
Figure 26 : Cinétique de croissance d'une souche
bactérienne (SH) durant la
biodégradation du pétrole et
du phénol.
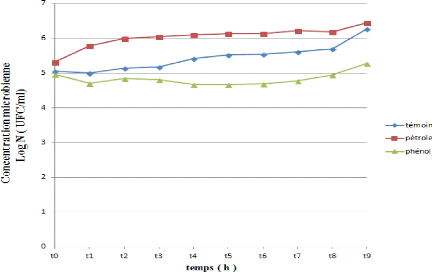
65
Figure 27 : Cinétique de croissance d'une souche
bactérienne (SG) durant la
biodégradation du pétrole et
du phénol.
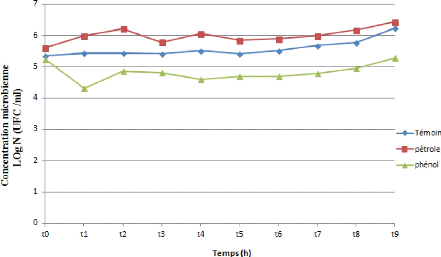
Figure 28 : Cinétique de croissance d'une souche
bactérienne (SJ) durant la
biodégradation du pétrole et
du phénol.
Cinétique de croissance des souches
bactériennes testées (dégradation du
pétrole)
D'après les figures (24, 25, 26, 27 et 28) on observe
une similarité de trajet de croissance pour les cinq souches
testés toutes presque présentent le même troc .La
croissance pour les cinq
66
souches commence par un DO= 5, puis on observe une
augmentation de la croissance de T0 jusqu'à 30 minutes puis une
augmentation exprimée par un phase de croissance exponentielle courte
.Cette augmentation ralentie correspond a la phase stationnaire pas
fixée dans même valeur mais presque stable, observée a
partir d'une heure a 24 heures pour les 5 souches et après la 5
éme heure il ya une recroissance de biomasse des souches jusqu`à
un valeur maximale (DO SI =6.456) (DO SL =6,453) (DO SH =6,369) (DO SG =6,447)
(DO SJ =6,429). Cette DO atteint son maximum à la fin de
l`incubation.
Les variations des densités optiques (DO)
constatées dans les milieux de culture des différentes souches
bactériennes étudiées (SI, SL, SH, SG, SJ) peuvent
être dues à la distribution différente de ces
bactéries entre les deux phases de notre culture, ou par leur vitesse
d`adaptation au substrat utilisé (AKMOUCI, 2009).
L`absence de phase latence démontre une adaptation plus
rapide des souches étudiées à la source de carbone
utilisée (hydrocarbure pétrole), ils ont dégradé
les fractions soluble des hydrocarbures pétrolières.
Par ailleurs, l`augmentation de la biomasse microbienne
correspondrait à la phase exponentielle, phase durant laquelle la
dissolution du substrat «hydrocarbure pétrole» suffit aux
besoins métaboliques des souches. Ainsi, La stabilisation de la
concentration microbienne au-delà d'une heure montre que le niveau des
exigences nutritionnelles surpassent la vitesse de dissolution du substrat, la
biodisponibilité deviendra alors limitant (ROCHA et al. 2007),
la diminution explique peut être par la migration de la cellule vers
le nutriment par augmentation de hydrophobicité pour facilité
l`accession de hydrocarbure. Puis on observe encore une 2 éme phase
exponentielle s'explique par la richesse du milieu par des composés
facile à dégrader qui s'exprime aussi par un indicateur
biologique de croissance élevé.
Cinétique de croissance des souches
bactériennes testées (dégradation du
phénol)
On observant l'évolution de la croissance pendant 24
heures dans des courbes des (24, 25, 26, 27 et 28). Au temps initial de la
croissance, la concentration microbienne diminue pour les souches (SI, SH, SG,
SJ) durant le premier temps (30 minutes) au même temps il y a une
augmentation notable de croissance de souche SL. Pour 1 heure on remarque une
perturbation des valeurs de la concentration microbienne pour toutes les
souches et après 3
67
heures il ya une recroissance de biomasse des souches
jusqu`à une valeur maximale (DO SI =5,481) (DO SL =5,610) (DO SH =5,574)
(DO SG =5,279) (DO SJ =5,279).
Ce résultat peut être expliqué par
l'adaptation des cellules au phénol comme seule source de carbone, la
cinétique de biodégradation est plus rapide, et le
phénomène de biodégradation se déclenche
immédiatement après la mise en culture des cellules
adaptées (SL), contrairement aux cellules non adaptées (SI, SH,
SG, SJ).
L'amélioration de la capacité des
microorganismes adaptés au phénol à le biodégrader
se manifeste par l'amélioration de la cinétique de croissance des
cellules bactériennes, ainsi que l'augmentation du taux de croissance
des bactéries libres Les cellules non adaptés prennent plus de
temps à croître et à consommer (biodégrader) le
phénol. Ces résultats sont conformes avec les travaux de
SHIMP et al .,(1987)
68
Conclusion
Le pétrole se présente comme un mélange
complexe d'hydrocarbures. Sa dégradation implique une microflore
diversifiée du fait de la spécificité des fonctions
déprédatives. Il est caractérisé par
l'hydrophobicité de ses molécules, ce qui réduit leur
biodisponibilité.
L'objectif principal de cette étude était
d'étudier la biodiversité microbienne dans un sol pollué
par les hydrocarbures et d'isoler des bactéries aptes à
dégrader des hydrocarbures.
Afin de mener à bien nos travaux, nous avons
réalisé une étude préliminaire concernant, d`une
part, la sélection des meilleures bactéries (cinq souches sont
testées dans notre étude) qui se cultivent en présence de
pétrole brut comme seule source de carbone, pour une bonne
compréhension des conditions optimales du processus de
biodégradation des hydrocarbures dans le milieu terrestre.
Les résultats d'isolement bactériens de sol
contaminés, nous ont permis d'isoler six souches bactériennes. En
se basant sur leurs caractères microscopiques (deux souches à
Gram+ et quatre souches à Gram-), macroscopique et biochimique.
Les sols contaminés par le pétrole brut
permettent aux différents microorganismes de dégrader les
hydrocarbures de vivre.
L'évolution de cinétique au cours du temps
révèle que les bactéries : SI, SL, SH, SG, SJ en mesurant
la concentration microbienne en fonction du temps ce qui nous a permis de
tracer les courbes représentées la croissance
élevés.
On peut donc conclure que les différents constituants
de pétrole sont intrinsèquement biodégradables, mais
à des degrés variables et appropriés aux
différentes espèces des bactéries hydrocarbonoclastes
utilisées.
69
Références
bibliographiques
Aouad Linda et Abbouni Bouziane. (2012).
Petroleum-oil biodegradation by Corynebacterium aquaticum and
Pseudomonas aeruginosa strains isolated from the industrial rejection of the
rafinery of ARZEW-Algeria. World Applied Sciences Journal. 18(8) : 11191123.
Arshad Rubina., Farooq
Shafqat. et
Shahid Ali Syed. (2012). Bacterial strain improvement by mutagenesis
isolation, characterization and improvement of bacterial strains for enhanced
production of penicillin acylase. LAP LAMBERT Academic Publishing, pages:
261.
Arzu C.C., Nilgun T., Birgul O. et Cumhur C. (2011).
The genetic diversity of genus Bacillus and the related genera
revealed by 16S rRNA gene sequences and ARDRA analyses isolated from geothermal
regions of Turkey. Brazilian Journal of Microbiology. 309-324.
Atagana H.I. (2008). Compost bioremediation
of hydrocarbon-contaminated soil inoculated with organic manure. African
Journal of Biotechnology. 7(10): 1516-1525.
Atlas R.M. (1981). Microbial-degradation of
petroleum-hydrocarbons-- an environmental perspective. Microbiol Rev.
45(1):180-209
Atlas R.M. et Bartha R. (1998). Microbial
ecology: fundamentals and applications. 4th edn. Addison Wesley Longman, New
York, pp 556-588
Atlas R.M. et Bartha R. (1973). Inhibition by
fatty acids of the biodegradation of petroleum. Antonie van Leeuwenhoek. 39(1):
257- 271.
Atlas R.M. (1977). Stimulated petroleum
biodegradation. CRC Crit. Rev. Microbiol. 5: 371- 386.
Atlas R.M., et Philp J. (2005).
Bioremediation: applied microbial solutions for real-world
environmental cleanup. American Society for Microbiology (ASM) Press,
Washington, DC, pp 78-105
Atlas R. M., (2005). Handbook of Media for
Environmental Microbiology (2 Ed.). Boca Raton: Taylor & Francis Group,
pages: 664.
AKMOUCI S. (2009). Contribution à
l`étude des boues de forage : Isolement et évaluation de la
capacité de quelques souches microbiennes à dégrader le
gasoil. Mémoire de Magister Biochimie et microbiologie appliquée.
Université M`hamad Bougara Boumerdès. 109p.
AL-ARAJI1L, ABD RAHMAN R. N. Z. R, BASRI, SALLEH M. A.
B. (2007). Minireview: Microbial Surfactant. (AsPac) J. Mol. Biol.
Biotechnol., Vol. 15 No.3, p. 99-105.
ALEKSANDRA WLODARCZYK. (2010). Recherche de
signaux moléculaires végétaux impliqués dans
l`induction de gènes chez la bactérie phytopathogène
Erwinia chrysanthemi (Dickeya dadantii). Docteur. Microbiologie
environnementale. Université Lyon. p85.
ASIA FADHILE ALMANSOORY, MUSHRIFAH IDRIS, SITI
ROZAIMAH SHEIKH ABDULLAH, NURINA ANUAR. (2014).Creening for potential
biosurfactant producing bacteria from hydrocarbon-degrading isolates. Adv.
Environ. Biol.8(3).639-647.
70
BOUCHESEICHE .C, CREMILLE. E, PELTE .T, P OJER .K.
(2002). Pollution toxique et ecotoxicologique : notions de base. Guide
technique N°7. Agence de l`Eau Rhone Mediterranee et Corse, Montpellier
(France).
BOUDERHEM A. (2011). Utilisation de souches
bactériennes telluriques autochtones dans la biodetection et la
bioremediation des sols polluent par les hudrocarbures. Thèse de
magister de l`université Kasdi Merbah Ouargla. Spécialité
Microbiologie Appliquée ; p91.
BOUKHERISSA .M. (2008). Etude de la
stabilité des asphaltènes dans le pétrole brut. Choix de
dispersants et le mécanisme. Thèse de doctorat de
l`Université Paul Verlaine -Metz.
Abouseoud M.; Maachi R.; Amrane A.; Bouderga S.; Nabi
A., 2008: Evaluation of different carbon and nitrogen sources in
production of biosurfactant by Pseudomonas fluorescens. Desalination. Vol. 223.
pp: 143-151.
Amellal N.; Portal J.; Vogel T.; Berthelin J., 2001
: .Distribution and location of polycyclic aromatic hydrocarbons
(PAHs) and PAH-degrading bacteria within polluted soil aggregates.
Biodegradation. Vol.12. N°1. pp : 49-57.
ANONYME (1994). Loi Canadienne sur la
Protection de l'Environnement (LCPE),Liste des substances
d'intérêt prioritaire - Rapport d'évaluation -
Hydrocarbures Aromatiques Polycycliques, 69p.
ABOUSEOUD M., MAACHI R., AMRANE A., BOUDERGUA S. et
NABI A., (2008) .Evaluation of different carbon and nitrogen sources
in production of biosurfactant by Pseudomonas fluorescens. Desalination, 223:
143-151.
Sauret C. 2011. Ecologies des
communautés bactériennes marines soumises a une pollution
pétrolière Influence des facteurs environnementaux, de la
prédation et de la récurrence des pollutions. Thèse de
doctorat de l'université pierre et marie curie, Spécialité
Microbiologie environnementale Ecole Doctorale Sciences de l'Environnement
d'Ile de France (ED129).
Singleton P., 1999, Bactériologie,
Edition Duonod 4 ème édition Paris, p.415.
Soltani M., 2004. Distribution lipidique et
voies métaboliques chez quatre bactéries Gram négatives
hydrocarbonoclastes. Variation en fonction de la source de carbone.
Thèse de doctorat de l'université Paris 6,
spécialité chimie analytique, p. 284.
Syakti A.D. 2004. Biotransformation des
hydrocarbures pétroliers et effets sur les acides gras phospholipidiques
de bactéries hydrocarbonoclastes marines. Thèse de doctorat,
Université de Droit, d'Economie et des Sciences (Aix Marseille III),
Marseille, France.
Duchaufour Ph., 2001 : Introduction à
la science du sol. Sol, végétation, environnement. 6 ème
edt Dunod, Paris. 395p.
Fan S. ; Scow K .M., 1993 : Biodegradation of
trichloroethylene and toluene by indigenous microbial populations in soil.
Applied and Environmental Microbiology. Vol. 59. N°6. pp : 1911-1918.
ZHANPENG.J, HONGWEI.Y, LI XIN .S, SHAOQI, S. (2002).
Integrated assessment for aerobic biodegradability o f organic
substances. Chemosphere 48 133-138.
71
CHURCHILL S. A., GRIFFIN R. A., JONES L. P. et
CHURCHILL P. F., (1995). Biodegradation rate enhancement of
hydrocarbons by an oleophilic fertilizer and arhamnolipidbiosurfactant. Journal
of EnvironmentalQuality, 24 : 19-28.
40. COLIN F., (2000). Pollution
localisée des sols et des sous-sols par les hydrocarbures et par les
solvants chlorés, Académie des sciences, rapport n° 44,
Editions Tec&Doc, 417 p.
Sites Web consultés
http://www.infoclimat.fr/climatologie/globale/in-salah/60630.html
http://dlecorgnechimie.fr/wp-content/uploads/2014/11/CCM.pdf
http://www.cooperation.ch/L_homme+peut_il+fabriquer+du+petrole_
http://wwwabi.snv.jussieu.fr/boccara/Public/LV342_distance/POLY_1_CNEDLV342.pdf
72
Annexes Annexe 1:
Matériels utilisés
Ø Equipements 1- Etuve.
1- Spectrophotomètre UV.
2- Autoclave.
3- pH mètre.
4- Agitateur -plaque chauffante.
5- Vortex.
6- Centrifugeuse.
7- Incubateur- agitateur.
8- Microscope photonique.
9- Loupe.
10- Balance.
11- Bec Bunsen.
12- Réfrigérateur.
Ø Verreries et matériels en
plastiques
1- Erlenmeyer de 100ml, 250ml, 500ml, 1000ml.
2- Becher de 100ml, 250ml, 500ml, 1000ml.
3- Boite de Pétri en plastique.
4- Pipettes Pasteur.
5- Anse de platine.
6- Tubes à essai.
7- Lames et lamelles.
8- Seringues.
9-
73
Parafilm.
10- Micropipettes.
11- Pinces (a bois et métallique).
12- Cuvettes de spectrophotomètre.
13- Sacs en plastique.
Annexe 2:
Milieu de dénombrement et de conservation Bouillon
nutritif : la composition chimique en g /L d eau distillée
|
Peptone
|
5
|
|
Extrait de viande
|
1
|
|
Extrait de levures
|
2
|
|
Chlorure de sodium
|
5
|
PH final 7.4 + /- 0 ,2 a 25 C
Stérilisation a l autoclave a 121 +/- pendants 15 minutes
Gélose nutritive : composition chimique en g /L d eau
distillée
|
Peptone
|
5
|
|
Extrait de viande
|
1
|
|
Extrait de levures
|
2
|
|
Chlorure de sodium
|
5
|
|
Agar
|
15
|
PH 7, 4 +/- 0,2 a 25 C
Stérilisation à l autoclave à 121 C pendant
15 minutes
Gélose cétrimide : la composition
chimique en g /L d eau distillée
|
Peptone de gélatine bovin ou porcin
|
.20
|
|
Chlorure de magnésium
|
1 ,4
|
|
Sulfate de potassium
|
.. ......10
|
|
Cétrimide
|
0 ,3
|
|
Glycérol
|
10 ml
|
74
Agar .13 ,6
PH 7 ,2
La gélose viande foie : la composition
chimique en g /L d'eau distillée
Base de viande de foie 30
Glucose 2
Agar .6
PH final 7,6 +/- 0 ,2 a 25 ?C
Stérilisation a l autoclave : 20 min a 121 +/- 1 C
La gélose au nitrate conventionnelle : la
composition chimique en g /L d eau distillée
Extrait de viande . . 3
Peptone .5
KNO3 1
Agar 12
PH final 7,2 +/- 0,2
Stérilisation à l autoclave à 121 C pendant
15 minutes
Citrate de simmons : la composition chimique en
g /L d'eau distillée
Sulfate de magnésium . 0.2g/l
Phosphate mono-ammoniaque 1g/l
Phosphate bipotassique .2g/l
Chlorure de sodium 5g/l
Bleu de bromothymol 0.08g/l
Agar 15g/l
Milieu Clark et Lubs : la composition chimique
en g /L d'eau distillée
Peptone trypsique ou polypeptone . 7g
Glucose 5g
K2HPO4 . 5g
pH= 7 ,5
La composition du milieu Mannitol : la
composition chimique en g /L d'eau distillée
75
Peptone trypsique de viande 20g/l
Agar .4g/l
Mannitol 2g/l
K NO3 1g/l
Rouge de phénol 4ml
Gélose king A : la formule
théorique de la gélose king A en en g /L d'eau
distillée
|
Peptone bactériologique A
|
20
|
|
Agar purifié
|
.12
|
|
Glycérol
|
10
|
|
K2SO4
|
10
|
|
MgCL2
|
1,4
|
|
PH 7,2 +/- 0 ,2 a25 C
Gélose king B : formule théorique
de la gélose king B en en g /L d'eau distillée
Peptone bactériologique B 20
|
|
Agar purifié
|
12
|
|
Glycérol
|
10 ml
|
|
K2HPO4
|
1 ,5
|
|
MgSO4 7H2O
|
1 ,5
|
|
PH 7,2 +/- 0 ,2 a25 C
Milieu MSM minéral Salt medium : la
composition chimique en g /L d'eau distillée
|
|
K2HPO4
|
1.8
|
|
NH4Cl
|
4
|
|
MgSO4.7H2O
|
..0.2
|
|
NaCl
|
0.1
|
|
Na2SO4.7H2O
|
0.01
|
Agar 2 0
Source de carbone . 1%
Eau physiologique
Chlorure de sodium ...9g
76
Eau distillée . 1000ml
Réactifs et additifs Alcool
Disque d'oxydases Eau distillée
Eau oxygénée
Fuchine
Huile de vaseline Huile à immersion Poudre de Zinc
Réactifs de Kovacs Solution de lugol Violet de gentiane
Annexe 3:
Mise en oeuvre pratique
Coloration de Gram :
· Selon la norme (NF EN ISO 7218, octobre 2007)
· Préparer un frottis d'un produit pathologique ou
d'une culture bactérienne pure
· Recouvrir le frottis de violet de cristal oxalaté
laisser agir 1 min rincer a l eau distillée
· Verser de lugol et le laisser agir pendant une minute 1
minute rincer a l eau distillée
· Décolorer à alcool à 95 entre 15 et
30 secondes rincer à l eau distillée
· Recolorer avec le safranine pendant 10 à 30
secondes rincer a l eau distillée
· Sécher au dessus de la flamme d u bec Bunsen
· Observer au microscope a l objectif 100 immersion
Avec cette coloration double les bactéries Gram +
apparaissent en violet foncé tandis que les bactéries Gram - sont
colorées en rose ou en rouge
Coloration des spores bactérienne :
· réaliser un frottis en routine puis :
· le recouvrir d une solution aqueuse vert de vert
malachite 0,5 % chauffer pendant quelques minutes sur une platine chauffante
jusqu' a émission de vapeurs Rajouter du colorant pendant le chauffage
si nécessaire sans jamais laisser évaporer complètement le
colorant
· laver a l eau distillée
· colorer avec de la safranine pendants 30 secondes
Les cellules végétatives apparaissent
colorée en rouge les spores en vert dans leur sporange rouges et les
spores libres colorées en vert
Annexe 4:
Contrôle de qualité du milieu
Gélose king B :
Souches bactériennes Couleur des colonies
après 24 h a 48 h d
incubation a 36 °C
Pseudomonas aeruginosa ATTC 10145 Jaune vert
fluorescente
équivalente a NCTC 10332
Pseudomonas fluorescens CIP 69.13 Jaune vert
faible
équivalente a ATCC 13525
Gélose king A :
Souches bactériennes Couleur des colonies
après 24 h a 48 h d
incubation a 30 °C

Pseudomonas aeruginosa ATTC 27853 Bleu vert
Pseudomonas aeruginosa ATTC 9027 Pseudomonas aeruginosa
ATTC 17934
77
78
Pseudomonas fluorescens CIP 69.13 T Incolore
DELARRAS C., 2014. Pratique en
microbiologie de laboratoire recherche de bactéries et de levures
moisissures, Paris : Edition Céline Poiteaux 570, 586, 115, 66, 88, 71,
66 p Hohzoh Kiyohara, 1982) (Jyothi K, K Surendra Babu 2012)
Annexe 5 :
Suivi de la cinétique de la croissance
microbienne
Tableau : Suivi de la cinétique de la croissance
microbienne d'une souche bactérienne (SI) durant la
biodégradation du pétrole et du phénol.
|
T0
|
T1
|
T2
|
T3
|
T4
|
T5
|
T6
|
T7
|
T8
|
T9
|
|
T
|
5,0028
|
5,3654
|
5,3741
|
5,3808
|
5,4502
|
5,5087
|
5,4308
|
5,5481
|
5,6095
|
6,1610
|
|
8569
|
8798
|
3709
|
1401
|
4911
|
541
|
2727
|
8461
|
9441
|
6839
|
|
P
|
5,00
|
5,7634
|
5,8750
|
5,8864
|
5,8976
|
5,9084
|
5,9777
|
6,0293
|
6,2041
|
6,4563
|
|
63025
|
2799
|
6126
|
9073
|
2709
|
8502
|
2361
|
8378
|
1998
|
6603
|
|
P
|
4,9867
|
4,5910
|
4,8450
|
5,0128
|
5,1522
|
4,9344
|
5,2552
|
5,2695
|
5,2810
|
5,4814
|
|
h
|
7173
|
6461
|
9804
|
3722
|
8834
|
9845
|
7251
|
1294
|
3337
|
4263
|
T : témoin P : pétrole Ph : Phénol
Tableau : Suivi de la cinétique de la
croissance microbienne de la souche (L) cultivée sur le milieu bouillon
nutritif, MSM additionné de 1% de pétrole brut et ou
phénol
|
t0
|
t1
|
t2
|
t3
|
t4
|
t5
|
t6
|
t7
|
t8
|
t9
|
|
T
|
4,8994
|
5,1977
|
5,3610
|
5,5428
|
5,5906
|
5,5498
|
5,5407
|
5,7047
|
5,7072
|
6,2776
|
|
557
|
9754
|
9797
|
2543
|
9326
|
2037
|
4646
|
2233
|
8623
|
0921
|
|
P
|
5,0211
|
5,4969
|
5,6053
|
5,9822
|
6,0644
|
6,0648
|
6,1875
|
6,1461
|
6,1271
|
6,4533
|
|
893
|
2965
|
0505
|
7123
|
5799
|
3222
|
2072
|
2804
|
048
|
1834
|
|
P
|
5,0128
|
5,1583
|
5,2013
|
5,4771
|
5,0086
|
5,2922
|
5,2944
|
5,2966
|
5,2988
|
5,6106
|
|
h
|
3722
|
6249
|
9712
|
2125
|
0017
|
5607
|
6623
|
6519
|
5308
|
6016
|
T : témoin P : pétrole Ph : Phénol
Tableau : Tableau : Suivi de la cinétique de la
croissance microbienne d'une souche bactérienne (SH) durant la
biodégradation du pétrole et du phénol.
|
t0
|
t1
|
t2
|
t3
|
t4
|
t5
|
t6
|
t7
|
t8
|
t9
|
|
T
|
5,0969
|
5,1603
|
5,3371
|
5,3046
|
5,5365
|
5,5567
|
5,5518
|
5,6901
|
5,7140
|
6,3279
|
|
1001
|
6847
|
2634
|
3412
|
5844
|
0444
|
5645
|
9608
|
502
|
7162
|
|
P
|
5,2227
|
5,6998
|
5,7024
|
5,7067
|
5,8750
|
6,0170
|
5,9684
|
6,1105
|
6,1034
|
6,3692
|
|
1647
|
3773
|
3054
|
1778
|
6126
|
3334
|
8295
|
8971
|
6162
|
1586
|
|
P
|
5,0718
|
5,0492
|
5,1613
|
5,1522
|
5,0827
|
5,0569
|
5,0791
|
5,2041
|
5,2787
|
5,5740
|
|
h
|
8201
|
1802
|
68
|
8834
|
8537
|
0485
|
8125
|
1998
|
536
|
3127
|
T : témoin P : pétrole Ph : Phénol
Tableau : Suivi de la cinétique de la croissance
microbienne d'une souche bactérienne (SG) durant la
biodégradation du pétrole et du phénol.
t0 t1 t2 t3 t4 t5 t6 t7 t8 t9
79
|
T
|
5,0517
|
4,9956
|
5,1388
|
5,1751
|
5,4199
|
5,5215
|
5,5369
|
5,6092
|
5,6975
|
6,2697
|
|
9545
|
3519
|
288
|
2509
|
5575
|
739
|
7907
|
3858
|
1994
|
4637
|
|
P
|
5,3222
|
5,7923
|
6
|
6,0413
|
6,0969
|
6,1351
|
6,1322
|
6,2240
|
6,1875
|
6,4471
|
|
1929
|
9169
|
|
9269
|
1001
|
3265
|
5969
|
1481
|
2072
|
5803
|
|
P
|
4,9590
|
4,6989
|
4,8450
|
4,8061
|
4,6627
|
4,6776
|
4,6901
|
4,7781
|
4,9542
|
5,2798
|
|
h
|
4139
|
7
|
9804
|
7997
|
5783
|
0695
|
9608
|
5125
|
4251
|
9498
|
T : témoin P : pétrole Ph : Phénol
Tableau : Suivi de la cinétique de la croissance
microbienne d'une souche bactérienne (SJ) durant la
biodégradation du pétrole et du phénol.
|
t0
|
t1
|
t2
|
t3
|
t4
|
t5
|
t6
|
t7
|
t8
|
t9
|
|
T
|
5,3528
|
5,4345
|
5,4497
|
5,4292
|
5,5087
|
5,4205
|
5,5158
|
5,6842
|
5,7631
|
6,2451
|
|
2544
|
689
|
3545
|
1379
|
541
|
0584
|
7384
|
4675
|
7833
|
0121
|
|
P
|
5,6020
|
5,9837
|
6,2139
|
5,7853
|
6,0632
|
5,8426
|
5,8893
|
5,9890
|
6,1683
|
6,4297
|
|
5999
|
7659
|
6024
|
2984
|
0822
|
0924
|
017
|
0462
|
0101
|
5228
|
|
p
|
5,2329
|
4,3010
|
4,8450
|
4,8061
|
4,6020
|
4,6776
|
4,6901
|
4,7781
|
4,9542
|
5,2798
|
|
h
|
9611
|
3
|
9804
|
7997
|
5999
|
0695
|
9608
|
5125
|
4251
|
9498
|
80
T : témoin P : pétrole Ph : Phénol
| 


