INTRODUCTION
Les navigateurs européens découvrirent le tabac
pour la première fois à la fin du XVième
siècle avec les premières expéditions aux Antilles
où les populations indiennes fumaient ses feuilles sèches dans un
tube grossier.
Jean Nicot fut le premier à introduire officiellement
le tabac sur le sol françaises. C'est au cours de
16ième siècle que la culture de tabac et son usage
comme plante médicinale se répand en Europe (1).
En 1623, Sir Francis Bacon (1) écrivit que "l'usage du
tabac s'étend beaucoup, il conquiert les hommes grâce à un
certain secret tel que ceux qui ont commencé peuvent difficilement se
restreindre". En 1828, Posselt et Ruman isolent l'élément actif
du tabac (nicotine) et au XXième siècle, la cigarette
conquiert le monde entier, et la consommation du tabac est reconnue comme une
toxicomanie.
En fait, le tabagisme peut être défini comme un
comportement renforcé par une dépendance pharmacologique dont la
nicotine est responsable (2,3). Celle-ci, en raison de sa fixation sur des
récepteurs nicotiniques cérébraux et ses effets psycho
actifs, induit une double dépendance : psychique et physique (4).
Le tabac représente le premier facteur de perte
d'années de vie, il est à l'origine de 4 millions de
décès par an dans le monde, ce qui représente un
décès toutes les 8 secondes (5,6). Si les tendances de la
consommation tabagique restent telles qu'elles le sont actuellement, ce chiffre
devrait passer à 8,4 millions en 2020, et à 10 millions en 2030
(7,8).
La mortalité varie en fonction du nombre de cigarettes
consommées (9). Chaque cigarette représente une réduction
de l'espérance de vie égale au temps passé à la
fumer ce qui correspond à deux heures par jour pour une consommation
quotidienne d'un paquet par jour.
A l'échelle mondiale, ce sont les adolescents qui
posent le principal problème en matière de tabagisme
(10).
Les grandes enquêtes prospectives font apparaître
que la consommation de tabac est à l'origine d'une surmortalité
liée notamment aux cancers broncho-pulmonaires, ceux de la sphère
O.R.L et d'autres organes, aux broncho-pneumopathies chroniques obstructives
(BPCO) et aux maladies cardio-vasculaires. Ces pathologies sont
aggravées par d'autres facteurs de risque tels que certains
comportements alimentaires, l'abus d'alcool et la contraception orale (5).
L'intoxication tabagique peut être évaluée
par la mesure des marqueurs dans les milieux biologiques. Ces marqueurs
différent par leur spécificité et leur sensibilité
dans la distinction fumeur /non fumeur. Il est important de distinguer les
marqueurs spécifiques du tabac (nicotine, cotinine) des marqueurs non
spécifiques pouvant avoir d'autres origines que la fumée de
cigarette (CO, cadmium, HbCO, thiocyanates, ....).
Ces marqueurs constituent des indicateurs
d'intérêt différent en fonction de leurs
caractéristiques pharmacocinétiques propres. Le cadmium est un
marqueur à long terme car il s'accumule graduellement au cours de la vie
du fumeur (11). Son dosage pourrait être utile dans les groupes
d'ex-fumeurs pour permettre l'appréciation a posteriori du
tabagisme.
Le dosage de la carboxyhémoglobine permet
d'apprécier de manière directe la pénétration du
monoxyde de carbone dans l'organisme.
Le dosage des thiocyanates, catabolites de l'acide
cyanhydrique présent dans la fumée, peut s'avérer utile
pour le suivi du sevrage des fumeurs (11). Les concentrations dans l'urine des
fumeurs sont variables. La demi-vie de ce marqueur qui s'élimine surtout
par voie rénale est d'environ deux semaines. Il n'est pas
spécifique du tabagisme puisque l'origine peut être alimentaire.
Le dosage de la cotinine libre urinaire est en relation
directe avec l'imprégnation nicotinique à moyen terme chez le
fumeur (11,12).
Dans ce travail, nous avons étudié dans un
premier les composants de la fumée du tabac, les diverses pathologies
liées à la consommation chronique et les marqueurs biologiques
dans un deuxième temps, nous nous sommes intéressé
à l'analyse des xénobiotiques (cotinine) dans les urines.
L'objectif de cette étude est de mettre en
évidence la relation entre la consommation du tabac et les
concentrations urinaires en cotinine afin d'estimer la valeur discriminative de
la cotininurie entre les fumeurs, les fumeurs passifs, ainsi que les non
fumeurs et de préciser l'intérêt du dosage urinaire de la
cotinine dans la prise en charge et le suivi du sevrage tabagique.
I. RAPPELS SUR LE
TABAGISME
1. Composition de la
fumée du tabac
La composition de la fumée est extrêmement
complexe, plus de 4000 composés, dont une cinquantaine sont
cancérigènes, ont pu être ainsi identifiées. Dans
les poumons, tous les constituants de la fumée sont rapidement
absorbés et chaque bouffé est un mélange de deux phases
(4,5):
Ø La phase volatile: représente à elle
seule environ 95% de la fumée de cigarette et contient environ 500
composés gazeux comme le dioxyde de carbone (12 à 15%), le
monoxyde de carbone (3 à 6%), d'acide cyanhydrique (0.1 à 0.2%)
et des composés organiques volatiles (1 à 3%) sous formes
d'aldéhydes, de cétones et de divers hydrocarbures.
Ø La phases particulaire : on dénombre plus de
3500 composés, le goudron renferme la majorité des
composés connu pou être cancérigènes comme:
ü Les hydrocarbures aromatiques dont le principal agent
est le benzopyréne; considérés comme des agents
initiateurs du cancer en altérant la structure des acides
nucléiques et en provoquant la mutation de la protéine P53
inhibitrice des tumeurs .Ces hydrocarbures ont aussi une action promotrice par
la mise en jeu d'un double mécanisme : inhibition des processus
enzymatiques en neutralisant l'action des métabolites toxiques d'une
part puis une action immunodépressive d'autre part.
ü Les dérivés nitrés
hétérocycliques.
ü Les composés phénoliques,
d'aldéhydes et de nitrosamines (4).
Parmi ces composés, nombreux sont ceux qui pourraient
contribuer à l'installation et au maintien de la dépendance
tabagique. La nicotine est certainement l'un des composés les plus
caractéristiques de la fumée du tabac, tant pour ses effets
pharmacologiques sur le système nerveux central des fumeurs, que pour
son rôle dans l'instauration du régime de dépendance
liée à la consommation de tabac.
2. La dépendance
tabagique
2.1 Définition
La dépendance est un état psychique
résultant de l'interaction de l'organisme vivant avec une substance
étrangère, suivie par des modifications comportementales et
d'autres réactions telles que l'augmentation de l'envie ou le besoin de
prendre le produit de manière à compenser le manque,
d'éviter le malaise de la frustration et en général de
retrouver les effets psychiques.
Ce profit peut être accompagné ou non d'une
tolérance accrue et, parfois, d'un syndrome de sevrage physique à
l'arrêt.
La tolérance est une adaptation de l'organisme à
un produit psycho actif avec diminution de ses effets et
nécessité d'augmenter la dose pour retrouver les mêmes
effets (4,13).
2.2 Mécanisme de la
dépendance tabagique
La dépendance tabagique représente un
phénomène complexe où interviennent à la fois des
éléments psychologiques et une participation pharmacologique.
La dépendance est en partie psychologique et
comportementale : fumer est entré dans les habitudes sociales ou
familiales avec une dépendance gestuelle.
La dépendance pharmacologique est due
principalement à la nicotine qui stimule les récepteurs
nicotiniques, en modifiant certaines fonctions essentielles responsables des
différents aspects de la dépendance tabagique et des troubles
apparaissant lors du sevrage. Ces modifications dépendent de l'apport de
nicotine :
Ø un apport aigu stimule les neurones dopaminergiques
et le système des monoamines, mais cette action est brève
(quelques millisecondes) et la nicotine se dissocie rapidement de son
récepteur qui est alors prêt à fonctionner de nouveau.
Ø alors que pour un apport chronique, l'amplitude de la
réponse diminue progressivement et le récepteur se
désensibilise en quelques minutes, il devient alors réfractaire
car la nicotine se fixe avec une très grande affinité et ne se
dissocie plus (1, 12,13).
3. Pathologies liées
au tabagisme
Le tabagisme est un facteur de risque depuis la vie in
utéro jusqu'à l'âge adulte. Il est à l'origine de
nombreuses maladies : les cancers des voies aérodigestives (pathologie
majeure), les insuffisances coronariennes, l'artérite, les accidents
vasculaires cérébraux, les bronchites chroniques et d'autres
maladies mineures.
3.1 Les cancers liées au
tabac
3.1.1 Cancers
pulmonaires
Le tabac est le principal facteur de risque du cancer du
poumon, les fumeurs de cigarette ayant un risque 10 à 15 fois plus
élevé que les non fumeurs. Les risques de cancer du poumon
augmentent avec la quantité de tabac fumé et avec la durée
du tabagisme. Dans la population masculine, la mortalité par cancer du
poumon a considérablement augmenté en France et ce cancer
représente à l'heure actuelle la première cause de
morbidité et de mortalité dans le monde (4, 14, 15,16). Le risque
du cancer pulmonaire varie en fonction du type de tabac fumé, de
l'inhalation, du nombre de cigarettes par jour et de la durée du
tabagisme. Le risque est d'autant plus élevé que :
Ø le sujet a commencé à fumer jeune,
Ø le sujet a fumé longtemps,
Ø le nombre de cigarettes fumées est
important,
Ø la teneur de la cigarette en goudrons est
élevée,
Ø le sujet inhale plus profondément la
fumée de cigarette.
Plus le cancer pulmonaire est diagnostiqué de
façon précoce, plus il a de chance d'être curable.
Toutefois, les symptômes sont multiples et peu expressifs ou surviennent
trop tard. Les principaux signes d'alerte sont :
Ø La survenue d'un crachat sanglant,
Ø La survenue d'infections respiratoires
récidivantes ou répondant mal au traitement,
Ø Une toux persistante différente de celle que
connaît bien le fumeur,
Ø Un essoufflement anormal,
Ø Une modification de la voix,
Ø Un amaigrissement inexpliqué,
Ø Une asthénie et une altération de
l'état général.
Le diagnostic s'effectue à l'aide de radiographies
pulmonaires, d'un scanner thoracique et d'une fibroscopie bronchique (1,17).
3.1.2 Cancers de la
cavité buccale, du pharynx, du larynx et de l'oesophage
Les cancers de la cavité buccale, du larynx et de
l'oesophage sont à la fois liés à la consommation de tabac
et à la consommation d'alcool, ces deux facteurs agissant de
façon synergique. Le risque de décès par cancers de la
bouche et du larynx liés à la consommation de cigarettes est
trois fois plus élevé que pour le cancer de l'oesophage. Ces
risques augmentent avec le nombre de cigarettes (4).
3.1.3 Cancers de la vessie et du
rein
La cigarette constitue un facteur de risque important du
cancer de la vessie et probablement de celui du rein. Le risque augmente avec
le nombre de cigarettes fumées par jour et avec la durée du
tabagisme (17).
3.1.4 Autres formes de
cancers
Les autres cancers attribuables ou liés au tabac sont
ceux de l'estomac, du pancréas, du foie et du col de l'utérus (4,
17,18).
3.2 Les maladies
cardiovasculaires liées au tabac
Le tabagisme chronique est associé à un risque
significativement accru de maladies cardiovasculaires (surtout infarctus du
myocarde et mort subite), d'artériopathies oblitérantes des
membres inférieurs et d'accidents vasculaires cérébraux,
chez les deux sexes et quel que soit l'âge (4).
3.2.1 Les maladies
coronaires
La survenue d'un infarctus du myocarde ou d'une mort subite
est associée à la consommation du tabac alors que l'angine de
poitrine ne l'est pas. Elle ne semble pas dépendre de façon
évidente de la quantité de tabac fumée. Le risque de mort
subite est dix fois plus important chez le fumeur par rapport au non fumeur. Il
faut souligner également l'effet synergique de l'association avec
d'autres facteurs de risque comme l'hypertension artérielle,
l'hypercholestérolémie ou le diabète.
3.2.2
L'athérosclérose des membres inférieurs
L'inhalation de la fumée de tabac augmente la
perméabilité des parois artérielles vis-à-vis des
lipides et favorise la prolifération des cellules musculaires lisses.
L'ensemble de ces effets favorise l'athérosclérose. Les fumeurs
développent 2 à 3 fois plus de symptômes d'artérite
des membres inférieurs que les non fumeurs (4,14).
3.3 Les accidents vasculaires
cérébraux liées au tabac
Le tabagisme peut être la cause de trois types
d'accidents vasculaires : des ischémies, des hémorragies
intracérébrales et des hémorragies
méningées.
Le risque d'accident vasculaire cérébral est 3,7
fois plus élevé chez les fumeurs, indépendamment du sexe
et de l'âge.
L'association tabac et contraception oestroprogestative est
particulièrement dangereuse. La consommation de tabac peut
également provoquer l'athérosclérose des troncs supra
aortiques.
Dans certaines études (4), l'arrêt du tabagisme a
entraîné une diminution rapide du risque de morbidité et de
mortalité par accident vasculaire cérébral. Le tabagisme
peut être un facteur de risque d'autres maladies cardiovasculaires
notamment de l'hypertension artérielle, en rapport avec l'effet
hypertenseur de la nicotine (4).
3.4 Les maladies respiratoires
chroniques
La fumée de cigarette a des effets nuisibles à
la fois sur la structure et la fonction pulmonaires. Le tabac
représente, à lui seul, le facteur de risque le plus important
pour le développement d'une broncho-pneumopathie chronique obstructive
(BPCO).
La bronchite chronique et l'emphysème sont les deux
principales BPCO et correspondent à des entités cliniques,
fonctionnelles et anatomopathologiques bien définies (4).
3.4.1 Bronchique
chronique
Elle est définie par une hypersécrétion
bronchique caractérisée par une toux avec expectoration pendant
plus de trois mois par an durant au moins deux années
consécutives.
3.4.2 Emphysème
Les lésions de l'emphysème sont également
responsables d'obstruction bronchique. Ces lésions sont liées
à une inflammation du parenchyme pulmonaire et à un
déséquilibre du système
protéase/anti-protéase. Ce déséquilibre peut
être dû à un déficit génétique en
á1-antitrypsine (18).
La fumée de cigarette augmente l'activité des
protéases par l'intermédiaire de l'élastase provenant des
macrophages et des neutrophiles et réduit l'activité des
anti-protéases (4,19).
Les BPCO sont une cause importante de morbidité et de
mortalité dans nombreux pays. La prévalence de la maladie
augmente avec l'âge, elle est plus élevée chez l'homme que
chez la femme (4).
3.4.3 Asthme
L'asthme est une maladie chronique inflammatoire des voies
aériennes dans laquelle les mastocytes, les éosinophiles, les
lymphocytes T et les Ig E sont impliqués. Il est
caractérisé par la survenue d'épisodes dyspnéiques
paroxystiques avec sibilances récidivantes, variables dans le temps,
volontiers nocturnes. La crise d'asthme associe trois composantes :
Ø Spasme de la musculature
lisse : contraction brutale des muscles commandant l'ouverture et
la fermeture des bronches,
Ø Inflammation : oedèmes
et infiltration cellulaire,
Ø Hyperréactivité
bronchique : hypersécrétion des muqueuses des voies
aériennes (20).
Le tabagisme aggrave encore plus la dégradation
fonctionnelle et augmente le risque de survenue d'un d'asthme (21).
3.5 Les maladies
thyroïdiennes
La consommation de tabac exerce des effets contrastés
sur la thyroïde. Les composés issus du tabac sont susceptibles
d'agir sur la thyroïde en inhibant la capture et l'organification des
iodures. Les concentrations des hormones thyroïdiennes restent
inchangées mais il existe une tendance à la diminution de la TSH
et à une augmentation du volume thyroïdien chez les fumeurs. Le
tabac peut être également la cause de rechute de la maladie de
Basedow traitée, il est aussi un facteur d'aggravation de
l'ophtalmopathie basedowienne. Le tabac constitue également un agent de
goitrogénèse qui agit en synergie avec d'autres facteurs et ce,
quel que soit le taux de TSH. Cet effet est majoré dans les zones de
carence iodée. Le tabagisme pourrait avoir aussi des effets
anti-thyroïdiens périphériques et exerce des effets
délétères sur la thyroïde foetale.
L'effet protecteur du tabac vis-à-vis du cancer de la
thyroïde n'est pas bien établi (18).
3.6 Risques pathologiques chez
la femme enceinte
Le tabagisme, aussi bien maternel que paternel, augmente le
délai nécessaire à la conception, avec un effet plus
marqué chez les femmes avec modification des fonctions hormonales et
placentaires et une augmentation du risque de grossesses
extra-utérines.
L'usage du tabac pendant la grossesse est associé
à une augmentation du risque d'accouchements hémorragiques et
d'hématomes rétro placentaires. Une étude faite sur des
placentas obtenus lors d'avortements thérapeutiques au cours du premier
trimestre de grossesse a montré chez les grandes fumeuses une
épaisseur accrue de la membrane villeuse et de la couche
trophoblastique. L'altération de la réserve ovarienne est plus
fréquente en cas de tabagisme, et la ménopause survient en
moyenne deux ans plus tôt chez les fumeuses (21, 18, 22,23). La
consommation de tabac durant la grossesse peut être également la
cause d'une hypoxie pour le nouveau-né (20).
3.7 Autres effets du tabac
Ø Le tabac altère les fibres élastiques
de la peau qui deviennent plus grosses, moins longues et moins nombreuses, pour
donner une peau précocement ridée (24).
Ø La prévalence de la dyskinésie tardive
est plus élevée chez les fumeurs que chez les non fumeurs
(25,26).
Ø La consommation chronique de tabac diminue
l'activité sexuelle chez l'homme et est la cause de cancers des
testicules (24).
Ø Le tabac augmente le risque de démence et de
maladie d'Alzheimer chez les patients non porteurs de l'allèle APO E4
(27).
Ø Le tabagisme altère la capacité
à percevoir l'odeur et le goût.
Ø L'association tabac/alcool peut entraîner des
troubles visuels en altérant le nerf optique.
Ø Le tabac augmente la sécrétion
salivaire, en particulier parotidienne. Il est à l'origine de stomatites
ou de stomatoses. Il modifie également l'aspect des dents (4, 28,16).
4. Tabagisme passif
Le tabagisme passif, encore appelé tabagisme involontaire
ou environnemental est défini comme étant l'exposition d'un non
fumeur à la fumée de tabac dégagée par son
entourage. La composition physico-chimique, notamment en produits toxiques et
carcinogènes, du courant secondaire dégagée entre les
bouffées est similaire à celle du courant primaire, directement
inhalé par le fumeur. Il peut être à l'origine de
diverses pathologies.
4.1 Risques pathologiques chez
les enfants
Ce sont les pédiatres qui, les premiers, se sont
intéressés aux conséquences du tabagisme des parents sur
la santé de leurs enfants, en tout premier lieu les nourrissons.
Il augmente le risque d'incidence des infections
respiratoires, des symptômes respiratoires chroniques et asthmatiques, et
des otites moyennes chroniques et aigues chez les enfants des parents fumeurs
(29).
Pendant la grossesse, il peut être à l'origine
d'un retard de croissance intra-utérine, d'une diminution du poids du
nouveau-né, d'une réduction de la taille des poumons et par
conséquent d'une diminution de la fonction respiratoire. De ce fait, il
est responsable de la survenue d'asthme. On remarque également une
baisse des marqueurs nutritionnels contre une augmentation des substances de
stress, une augmentation du risque de pneumothorax.
Les enfants de parents fumeurs sont hospitalisés plus
fréquemment pour bronchite ou pneumonie pendant la première
année de leur vie avec une prévalence de toux chronique de 30
à 80% plus élevée par rapport à celle
observée chez les enfants de parents non fumeurs (4,21).
4.2 Les maladies cardiaques
Le risque pour un non-fumeur exposé au tabagisme
environnemental de décéder d'une maladie cardiaque est de 30 %
supérieur à ce qu'il serait en l'absence d'exposition à la
fumée de cigarette. Il s'agit là d'une notion primordiale dans
l'épidémiologie des maladies cardiaques et vasculaires, puisqu'on
évalue à 1.7 le risque relatif de décès par
maladies cardiaque directement liées cette fois pour tabagisme actif.
Cela signifie qu'une fraction importante des décès par maladies
cardiaques peut être attribué au tabagisme environnemental (4).
4.3 Les maladies respiratoires
L'effet le plus répandu de l'exposition involontaire
aux fumées est l'irritation muqueuse au niveau du nez,
de la gorge et des voies aérienne supérieure. L'apparition et la
persistance de symptômes respiratoires chroniques (toux, expectoration,
dyspnée), uniquement dus au tabagisme passif semble possible mais est
beaucoup plus difficile à affirmer et revêt une signification
imprécise.
4.4 Les cancers bronchiques
Le tabagisme passif est un facteur de risque important pour la
survenue de cancer bronchique primitif chez les non-fumeurs exposés
(4).
Certaines études ont également invoqué la
responsabilité du tabagisme passif dans la survenue de plusieurs autres
tumeurs (sein, col de l'utérus...) (4).
5. Lutte contre le
tabagisme
La prévention du tabagisme comporte à la fois
des mesures collectives et individuelles. Ces mesures tendent vers un
même objectif qui est la diminution de l'incidence des maladies
causées par le tabac, et s'adressent à 3 populations : les
fumeurs, les fumeurs « potentiels » et les non
fumeurs.
Le tabagisme est si répandu, ses complications sont si
nombreuses et si dramatiques que l'aide pour l'arrêt du tabac doit
être la plus précoce possible, et le sevrage brutal et total. La
meilleure méthode pour arrêter de fumer est une décision
personnelle sous-tendue par une forte motivation c'est-à-dire qu'il faut
vraiment vouloir avant de pouvoir. Une forte motivation permet à la
majeure partie des individus d'arrêter seuls, sans aucun concours
extérieur. Certains, cependant, ont besoin d'une aide. Ils ont à
leur disposition différentes méthodes psychothérapiques ou
médicamenteuses.
La stratégie de prise en charge est totalement
différente d'un fumeur à l'autre suivant le degré de
motivation, la nature et l'intensité des dépendances, les
troubles psychopathologiques et les autres conduites addictives
associées (4,30).
5.1 L'aide
médicamenteuse au sevrage tabagique
5.1.1 Substitution
nicotinique
Pour être efficace, le traitement par les
substitutions nicotiniques doit s'inscrire dans une stratégie qui
comporte plusieurs étapes (30,31).
Ø Il faut d'abord évaluer la dépendance
à la nicotine, en utilisant le test de Fagerström (Annexe
n°1).
Ø Par la suite, l'aide à l'arrêt sera
basée sur l'adaptation de la posologie à l'intensité de la
dépendance, en prolongeant la durée du traitement tant qu'il y a
persistance du syndrome de sevrage et en tenant compte des états
anxiodépressifs présents chez les fumeurs les plus
dépendants.
Ø Enfin, il est nécessaire de prévenir
les rechutes.
Pendant toutes ces étapes, un accompagnement
psychologique est important pour augmenter les chances de réussite du
sevrage.
Le traitement à l'aide des substitutions nicotiniques
consiste à remplacer l'emploi habituel de la drogue par d'autres
produits analogues, mais moins dangereux pour la santé et qui
contribuent à atténuer le syndrome de privation (30,31). Il
existe plusieurs formes de substitution nicotique :
5.1.1.1 Formes orales
a- La gomme à mâcher
Les gommes aident à contrôler les envies de
fumer, elles contiennent la principale substance responsable de la
dépendance pharmacologique, la nicotine.
Celle-ci, fixée sur une résine échangeuse
d'ions, permet une libération progressive du principe actif quand la
gomme est mâchée. La présence d'un tampon facilite
l'absorption de la nicotine par la muqueuse buccale (1,12).
Deux formes sont disponibles :
Les gommes à 2 mg
La posologie est de 10 gommes/jour pour un moyennement
dépendant et de 20 gommes pour un sujet fortement dépendant. Elle
ne doit pas dépasser 30 gommes/jour. Le patient doit ensuite diminuer
progressivement le nombre de gommes jusqu'au jour du sevrage quand il arrive
à une ou deux gommes/jour. Il est recommandé de ne pas
dépasser 6 mois de traitement continu (1,4).
Les gommes à 4mg
La posologie moyenne est de 8 à 12 gommes/jour, elle ne
doit pas dépasser 15 gommes/jour. Le traitement ne doit pas
dépasser 6 mois continus (1,4).
Les conseils pour l'utilisation des
gommes :
Il est recommandé :
Ø d'arrêter complètement et brutalement la
consommation des cigarettes ;
Ø de mâcher la totalité des
gommes ;
Ø de répartir la prise de gommes au cours de la
journée ;
Ø de suivre une certaine technique de
mastication
ü en mâchant la gomme une seule fois/min ;
ü en suçant entre deux mastications ;
ü et en la gardant pendant une demi-heure, soit environ
une trentaine de mastications.
Ø de ne pas interrompre le traitement
précocement ni brutalement
Les effets indésirables des gommes
:
Ce sont essentiellement des effets locaux (traumatismes
dentaires), des effets mécaniques (douleurs des muscles masticateurs) et
des effets gastro-intestinaux (1).
b- Les comprimés sublinguaux :
Ils sont placés sous la langue où ils vont se
dissoudre lentement après 30 min. Le traitement ne doit pas
dépasser 6 mois.
5.1.1.2 Formes
transdermiques ou Patchs
Ce sont des préparations pharmaceutiques souples, de
dimensions variables (12), qui servent de support à un ou plusieurs
principes actifs. Ils sont formés de quatre couches :
Ø Une couche extérieure pour la protection et la
conservation du principe actif,
Ø Une couche contenant la nicotine,
Ø Une couche contrôlant la libération de
la nicotine à partir de son réservoir et une couche
adhésive assurant le contact avec la peau.
Lors de l'application de ces dispositifs, la surface de la
peau doit être propre. Il existe deux formes de patchs :
Ceux agissant pendant 24 heures, et ceux agissant pendant 16
heures avec respect de la fenêtre nocturne.
Les effets indésirables cutanés
spécifiques aux patchs sont nombreux : prurit au lieu
d'application, érythème localisé,...
Les patchs nicotiniques sont à utiliser avec prudence
en cas de troubles du rythme cardiaque, de diabète, d'augmentation
de la pression artérielle et d'ulcère gastro-duodénal.
Le traitement par les substitutions nicotiniques augmente le
métabolisme de certains médicaments et diminue alors leur taux
sanguin : caféine, imipramine, oestrogènes,
benzopyrène .... (4,32).
5.1.2. Substances non
nicotiniques : ZYBAN®
ZYBAN® est le premier
traitement par voie orale d'aide au sevrage tabagique, sans nicotine,
commercialisé depuis 2001. Il existe sous forme de comprimés
pelliculés à libération prolongée (ZYBAN
L.P®), et il a pour principe actif le
chlohydrate de bupropion, un dérivé de nature
amphétaminique (12, 30, 33,34).
5.1.2.1 Mécanisme
d'action
Le chlorhydrate de bupropion est rapidement absorbé par
le tractus digestif après administration orale. Il est ensuite
métabolisé par le foie et éliminé dans l'urine.
Il inhibe partiellement la recapture neuronale de la dopamine
et totalement celle de la noradrénaline, mais son action est minime sur
la recapture de la sérotonine. Il n'inhibe pas les monoaminooxydases.
L'action du bupropion dans l'aide à l'abstinence tabagique serait
médiée par des mécanismes dopaminergiques. Trois
métabolites pharmacologiques actifs ont été
identifiés dans le plasma :
Ø l'hydroxybupropion ;
Ø le thréohydro-bupropion ;
Ø et l'érythrohydro-bupropion.
Ces métabolites sont importants sur le plan des
interactions médicamenteuses car leurs concentrations plasmatiques sont
aussi élevées, voire plus, que celles du bupropion. Ils sont
ensuite métabolisés en métabolites inactifs et
éliminés avec les urines (33).
5.1.2.2 Effet
indésirables et contre-indications
Les effets indésirables sont généralement
modérés (fièvre, sécheresse de la bouche, troubles
digestifs, insomnies, dépressions, anxiété, prurit,
asthénie,...). Ce médicament est contre-indiqué chez les
patients ayant des antécédents d'hypersensibilité au
bupropion ou à l'un des excipients, chez les malades présentant
un trouble convulsif évolutif ou une tumeur du système nerveux
central, chez les sujets en cours de sevrage alcoolique ou de sevrage des
benzodiazépines et ceux souffrant d'insuffisance hépatique
sévère (33,34).
Le ZYBAN LP® est contre-indiqué avant
l'âge de 18 ans.
5.2 L'aide non
médicamenteuse au sevrage tabagique
5.2.1
Acupuncture
Elle consiste à placer des fines aiguilles dans la peau
pour exciter des points précis correspondant à certaines parties
du corps, organes ou nerfs, afin de rétablir l'équilibre
énergétique et faire disparaître la sensation de besoin en
provoquant un certain dégoût du tabac (1).
5.2.2
Auriculothérapie
Elle consiste à stimuler deux points précis au
niveau de l'oreille soit par un fil ou par une agrafe. La pose est indolore,
elle se fait sous anesthésie locale. Le fil ou l'agrafe sont
gardés pendant trois semaines puis retirées. L'action du fil ou
de l'agrafe modifie le goût de la cigarette et supprime l'envie de fumer
(1).
5.2.3 Les méthodes
psychothérapeutiques
5.2.3.1
Psychothérapie de groupe : Plan de 5 jours
Elle est basée sur une thérapie de groupe, 5
soirs de suite. Le but est, dans un premier temps, de se libérer du
désir de fumer puis de désintoxiquer son corps (1).
5.2.3.2
L'hypnose
Le praticien aide le patient à renforcer sa motivation
et favorise le changement d'habitude en l'aidant à prendre conscience de
son corps et de sa santé ou en provoquant le dégoût du
tabac. Le traitement du tabagisme par hypnose offre une méthode
alternative d'interruption, qui pourrait répondre aux besoins de
certains individus (1).
5.2.3.3 La
thérapeutique comportementale par aversion
Ces méthodes regroupent un certain nombre de
techniques : le fumer rapide, le fumer à saturation, la
sensibilisation indirecte ; et utilisent toujours comme composantes
aversives, des stimuli issus de la cigarette elle-même (1).
6. Les marqueurs
biologiques du tabagisme
Plusieurs marqueurs biologiques ont été
proposés comme outils permettant d'effectuer un travail de suivi et de
contrôle du tabagisme. Il est important de distinguer les marqueurs
spécifiques du tabac des marqueurs non spécifiques pouvant avoir
d'autres origines que la fumée de cigarette.
Ils doivent alors répondre à différents
critères :
Ø être présents dans la fumée des
différents produits du tabac (cigarettes, cigares)
Ø être résorbés dans l'organisme de
tous les fumeurs
Ø être métabolisés afin de
permettre un contrôle à court et moyen terme.
Ø pouvoir être détectés, même
à de faibles concentrations (35).
6.1 Marqueurs non
spécifiques
6.1.1 Le monoxyde de
carbone (CO)
Le taux de CO dans l'air expiré est un bon reflet de
l'intoxication tabagique récente. Il est le résultat de la
combustion incomplète au niveau du cône de combustion d'une
cigarette allumée. Il fait partie intégrante des 4000
composés chimiques de la fumée inhalée, dont l'importance
est corrélée à l'intensité avec laquelle le fumeur
«tire» sur sa cigarette, et donc à sa dépendance. Le CO
inhalé diffuse à travers la membrane alvéolo-capillaire
des alvéoles pulmonaires et se fixe, à la place de
l'oxygène sur les globules rouges (HbCO). La liaison HbCO n'est pas
stable dans le temps : la demi vie du CO est de 3 à 4 h. Ainsi, le
dosage du CO dans l'air expiré du fumeur qui a fumé dans les 2
heures précédentes, est un témoin direct de sa
façon de fumer: plus il est important, plus le fumeur aura fumé
intensément (plus il aura, par conséquent, inhalé de
nicotine). Une constatation : plus le taux de CO dans l'air expiré du
fumeur est important, plus la coloration marron de son filtre est foncée
et homogène.
Le
CO peut se mesurer facilement, en 10 secondes, grâce à un
CO-tester.
Le CO s'élimine rapidement, en 2 à 5 h, dans l'air
expiré. La mesure devra tenir compte du délai de la
dernière cigarette fumée.
Le seuil de positivité est habituellement fixé
à 8-10 ppm (partie par million).
Le dosage du CO dans l'air
expiré est systématiquement pratiqué dans toutes les
consultations de tabacologie, Il est utilisé essentiellement
pour discriminer fumeurs et non-fumeurs. Il met en
évidence la présence d'un produit toxique « dans le
corps » du fumeur, informe mieux ceux qui minimisent leur tabagisme
ainsi que les parents des enfants exposés à un tabagisme passif
(35,36).
6.1.2 La
carboxyhémoglobine
La carboxyhémoglobine (HbCO) est formée par la
fixation remarquablement stable du CO sur l'hème de
l'hémoglobine. Elle est couramment mesurée au cours des
explorations fonctionnelles respiratoires par une méthode
d'absorptiométrie.
Les résultats sont habituellement exprimés en
saturation fractionnelle: environ 1 % chez un citadin non fumeur mais
facilement 2 à 6 %, voire plus chez un grand fumeur. La technique est
simple et fiable, mais elle nécessite un matériel particulier et
surtout un prélèvement sanguin invasif. De ce fait, elle est
rarement utilisée au cours du sevrage tabagique.
Elle est par contre indispensable, avec les gaz du sang, dans
la surveillance des broncho-pneumopathies obstructives chroniques (en
particulier les formes dyspnéisantes) lorsqu'une prescription de
nicotine de substitution est envisagée dans un but de réduction
du risque (36).
L'HbCO permet de classer les non fumeurs (< 1,5%), les
fumeurs non inhalants (3 à 4%) et les fumeurs inhalants (6 à
8%).
6.1.3 Les thiocyanates
Ce sont des produits de détoxification des cyanures et
des composés cyanogènes. Ils sont produits à partir du
cyanure d'hydrogène et des nitriles formés lors de la combustion
de tabac. Ils sont métabolisés pour la plus grande partie par la
thiosulfate sulfure transférase ou rhodanèse, enzymes
localisées principalement dans les mitochondries hépatiques
(35).
Les thiocyanates se retrouvent dans le sang, la sueur, la
salive, où ils sont concentrés. Leur demi-vie est de 10 -15 jours
et permet de valider un arrêt persistant du tabac (35).
Les seuils de positivité correspondant à un
tabagisme actif sont :
Ø Thiocyanates plasmatiques (méthode
colorimétrique) : 75-100 mmol/L ;
Ø Thiocyanates salivaires : 230mg/L.
La
sensibilité du dosage des thiocyanates est moindre que celle du
CO.
Ce dosage n'est pas utilisé en pratique courante (35).
6.1.4 Le cadmium
Le cadmium représente un bon marqueur de la
consommation tabagique cumulée, du fait de son accumulation
hépatique et de sa longue demie vie. Le taux plasmatique du cadmium
augmente chez la femme enceinte, il est aussi augmenté par d'autres
facteurs tels que le tabagisme passif et la pollution.
Chez le foetus d'une mère fumeuse, le taux plasmatique
de cadmium est significativement élevé. Par ailleurs, les
réserves en zinc du foetus sont faibles du fait que le cadmium
empêche le transfert placentaire du zinc (le zinc entre dans la
composition de nombreuses enzymes). Il est également possible de doser
le cadmium dans le liquide amniotique (17, 37, 38).
6.1.5 Autres marqueurs
Les alcaloïdes mineurs du tabac comme l'anabasine et
l'anatabine ont également été proposés en tant que
marqueurs d'utilisation de tabac. Ces deux molécules ne sont pas
présentes dans les traitements de substitution tabagique et ne sont pas
des métabolites de nicotine; elles peuvent donc se révéler
utiles pour détecter la poursuite d'une consommation tabagique en
période de sevrage sous substitution nicotinique. L'anabasine et
l'anatabine sont dosables dans l'urine (35).
6.2 Marqueurs
spécifiques: nicotine, cotinine et autres métabolites de la
nicotine
La nicotine est un alcaloïde, liposoluble, présent
dans la feuille de tabac (10 à 20 mg de nicotine sèche par gramme
de tabac séché). Lors de la combustion, elle est retrouvée
dans la fumée de tabac, sous forme gazeuse dans le courant principal et
sous forme particulaire dans le courant secondaire. La majeure partie est
métabolisée dans le foie en plusieurs métabolites dont la
cotinine, la nicotine glucuronide et la nicotine N-oxyde. La cotinine est
métabolisée par la suite en cotinine-glucuronide,
trans-hydroxycotinine et trans-hydroxycotinine glucuronide.
Chez le fumeur, la nicotine et ses métabolites, se
retrouvent dans le plasma, la salive, la sueur, les urines, le lait maternel,
la liquide amniotique, le liquide séminal, et même dans les
cheveux.
La demi-vie de la nicotine est brève : 2 à 3 h
en moyenne. La demi-vie de la cotinine (son métabolite principal) est
plus longue, de 15 à 40 heures. Les taux de cotinine sont en moyenne 15
fois plus élevés que ceux de la nicotine pendant le tabagisme
régulier ou la substitution nicotinique.
Le dosage de la cotinine urinaire se pratique presque
exclusivement dans les consultations hospitalières de tabacologie (elles
sont faites dans le service de pharmacologie) (35).
II. NICOTINE ET SON
PRINCIPAL METABOLITES : LA COTININE
1. La nicotine
1.1 Structure
C'est le principal alcaloïde du tabac résulte de
la condensation de pyridine et de méthyle- pyrrolidine (Figure 1).
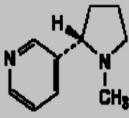
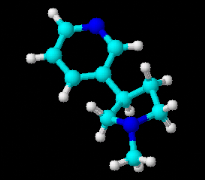
a- Configuration plane
b- Configuration spatiale
Figure 1 : Structure chimique de la
nicotine
1.2 Caractéristiques de
la nicotine
La nicotine à été
découverte à la fin du 18ème siècle
.Elle a été extraite pour la première fois en 1828 des
feuilles de tabac. C'est une amine tertiaire de faible poids moléculaire
(MM =162,23g/mol) formée d'un cycle pyridinique et d'un cycle
pyrrolydinique. Elle représente l'alcaloïde prédominant du
tabac, et un composé très toxique, la dose létale
étant de 60 mg. Elle se présente à l'état pur sous
forme d'un liquide huileux, âcre, d'odeur nauséabonde, instable et
dont l'entraînement est facilité par l'eau. Au contact de l'air,
elle donne une coloration jaune (39).
La majorité des cigarettes disponibles sur le
marché renferment entre 5 et 10 mg de nicotine. Pendant la combustion,
cette dernière est transportée en partie par la phase
particulaire, où elle se trouve adsorbée à la surface de
très fines particules de goudrons et par la phase gazeuse (40).
Aujourd'hui, l'utilisation de la nicotine ne se limite pas
à la fabrication de cigarettes et autres tabacs, mais elle est aussi de
plus en plus utilisée à des fins thérapeutiques. En effet,
des recherches sont actuellement en cours pour étudier son rôle
dans le traitement de la maladie d'Alzheimer, la maladie de parkinson, la
colite ulcéreuse, l'obésité, la dépression,
l'anxiété et le syndrome de Tourette (41). La nicotine a
été utilisée également dans la fabrication de
certains pesticides.
1.3 Pharmacocinétique
1.3.1 Absorption
L'absorption de la nicotine est intense et très rapide,
entraînant une élévation aiguë de la
nicotinémie. Elle varie selon le nombre de bouffées et le
degré de rétention pulmonaire (42).
1.3.1.1 Au niveau des voies
respiratoires et de la bouche
L'absorption de la nicotine par les muqueuses nasales et
buccales dépend du pH. En effet, en milieu acide, cette molécule
se trouve sous forme ionisée, ce qui rend son transfert à travers
les membranes buccales et nasales particulièrement difficile. En milieu
basique, cet alcaloïde, sous forme non ionisée, traverse assez
facilement les membranes cellulaires lipidiques, grâce à ses
propriétés amphiphiles.
La fumée ne permet qu'une légère
absorption buccale, même si elle est retenue plus longtemps dans la
bouche. Quand la fumée est inhalée, la nicotine atteint
rapidement les alvéoles pulmonaires où elle est tamponnée
au pH physiologique, et très rapidement absorbée au niveau du
tissu alvéolaire. Cette absorption porte sur 80 à 100 % de la
nicotine contenue dans la fumée (41). Elle est ainsi comparable à
une injection intraveineuse. La nicotinémie augmente rapidement lors de
la consommation d'une cigarette et atteint un pic plasmatique à la fin
de celle-ci. Dés que la cigarette est terminée, la
nicotinémie baisse car la nicotine est rapidement détruite.
1.3.1.2 Au niveau
digestif
En raison du pH acide de l'estomac, la nicotine n'est que
très faiblement résorbée au niveau gastrique. En revanche,
grâce au pH alcalin et à la grande surface de contact de
l'intestin grêle, la nicotine y est plus facilement absorbée.
1.3.1.3 Au niveau
cutané
Grâce à ses propriétés lipophiles,
la nicotine peut être absorbée par la peau. Cette
propriété est utilisée aujourd'hui pour le sevrage
tabagique par le système transdermique grâce aux patchs ou
timbres.
1. 3.2 Distribution
La distribution de la nicotine dans le corps se fait d'une
manière très rapide, notamment vers le système nerveux
central qu'elle atteint en à peine 10 secondes, soit deux fois plus
rapidement que suite à une injection intraveineuse (7). Ainsi, quasi
instantanément après l'inhalation de fumée, le cerveau
présente un pic de concentration 6 à 10 fois supérieur
à la concentration plasmatique.
Cette distribution très rapide produit une
réponse pharmacologique intense que la plupart des fumeurs cherchent,
très souvent de manière inconsciente, et qui explique bien la
dépendance tabagique (43).
Dans un deuxième temps, les taux
cérébraux de nicotine diminuent rapidement et la molécule
est redistribuée aux autres organes en 20 à 30 minutes (7).
1.3.3 Biotransformations
de la nicotine
Le foie représente la voie majeure de
métabolisation de la nicotine (80%-90%). Celle-ci est faiblement
métabolisée au niveau des poumons et des reins (40). Une faible
partie est éliminée sans métabolisation dans les urines,
mais la majeure partie est métabolisée dans le foie par le
cytochrome P 450 2A6 et par l'aldéhyde oxydase en divers
métabolites dont la cotinine, le nicotine glucuronide et le nicotine
N-oxyde. Le taux de la conversion de nicotine en cotinine est d'environ 72%,
cet important taux de conversion confère à la cotinine la
propriété très intéressante d'être un
excellent marqueur biologique du tabagisme pour étudier la
biotransformation de la nicotine chez l'homme. Mais ce taux présente de
grandes variations individuelles (55 à 92%) (44,21, 45).
La figure 2 illustre les principales voies
réactionnelles conduisant à la formation des différents
métabolites détectés dans les urines de
mammifères.

Figure 2 : Les différentes
voies du métabolisme de la nicotine
La nicotine et ses métabolites peuvent être
très dangereux pour l'organisme. En effet, la nicotine constitue un
puissant cancérigène. En fait, en plus des réactions
d'oxydation, la nicotine peut subir d'autres types de réactions
métaboliques comme des réactions d'ouverture du cycle pyrrolidine
qui correspond à la partie non aromatique de la molécule. Il ne
faut pas négliger la présence du groupement méthyle sur
l'azote de ce cycle qui, s'il est détaché de la
molécule, peut devenir un agent alkylant très puissant.
La fonction amine de la nicotine peut réagir avec du
monoxyde d'azote, ou de l'acide nitreux, pour former une molécule de
type « nitrosonium ». Ces derniers peuvent, comme la
nicotine, être métabolisés, c'est-à-dire
oxydés et ouverts. Cette ouverture peut se faire de deux façons,
et il se forme donc deux isomères, deux molécules de type
« nitrosamino » (R2N-N=O), où l'un des
groupements R est un méthyle (figure3).
En présence d'acide, l'oxygène du
« nitrosamino » est attaqué par un proton, ce qui
engendre le déplacement de la liaison double sur l'azote central,
celui-ci devenant chargé positivement. La molécule ainsi
formée se comporte comme une source de méthyle. Le groupement
« nitrosamino » peut donc être attaqué par une
autre amine, permettant à l'azote de se libérer de sa charge
positive. Si l'amine attaquant le nitrosamino fait partie de la structure d'une
base azotée de l'ADN, il se produit alors une alkylation
irréversible de l'ADN: (figure 4).
Cette alkylation est très nocive, et peut
s'avérer cancérigène puisqu'elle entrave le
développement normal de la cellule. Si cette altération advient
sur une partie de l'ADN impliquée dans la transcription d'un
oncogène, le développement d'une tumeur est assuré
(35).
Parmi tous ces métabolites, nous nous limiterons dans
le travail expérimental à l'étude de la cotinine,
composé le plus étudié dans le suivi du sevrage
tabagique.
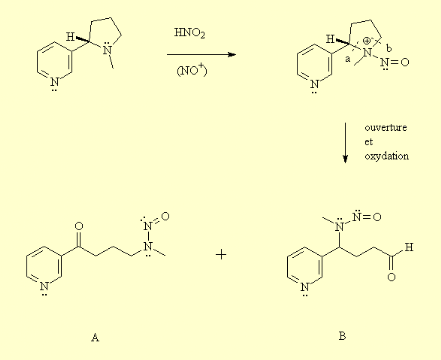
Figure 3 : Biotransformation de nicotine en
nitrosonium
A: 4
(N-méthyl-N-nitrosamino)-1-(3-pyridyl)-butan-1-one
B: 4
(N-méthyl-N-nitrosamino)-4-(3-pyridyl)-butanal
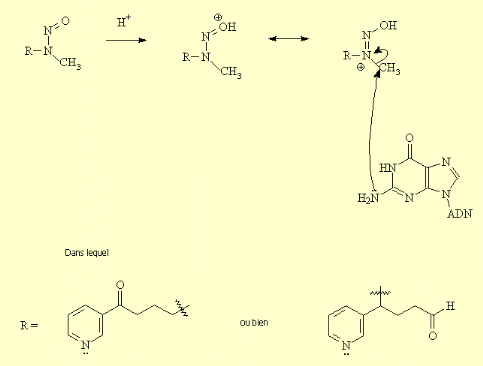
Figure 4 : Alkylation de nicotine
1.3.4 Elimination de la
nicotine
La nicotine étant une molécule basique, son
excrétion salivaire ou urinaire est fortement dépendante de
faibles variations du pH. Dans les urines, si le pH est supérieur
à 7, la nicotine est sous forme basique non ionisée, liposoluble
et est donc réabsorbée par le tubule rénal. A pH
inférieur à 7, elle est sous forme ionisée, non
liposoluble et son élimination urinaire est augmentée (46, 45).
Les fluctuations plasmatiques liées à la brièveté
de sa demi-vie et la variation de l'élimination urinaire en fonction du
pH, expliquent que la nicotine ne soit pas le marqueur de choix de
l'imprégnation tabagique.
1.3.5 Mode d'action de la
nicotine
La forme active de la nicotine est un cation dont la charge se
situe sur l'azote du cycle pyrrolidine. Cette forme active ressemble à
l'acétylcholine quant à l'espace séparant les charges
positives et négatives. L'acétylcholine est une molécule
flexible. Il existe deux types de récepteurs de l'acétylcholine:
les récepteurs nicotiniques sur lesquels la nicotine peut se fixer et
les récepteurs muscariniques qui peuvent être activés par
la muscarine. La nicotine et la muscarine sont donc des agonistes
spécifiques d'un seul type de récepteurs cholinergiques (un
agoniste est une molécule qui se fixe sur le récepteur et mime
l'effet du neurotransmetteur).
La nicotine a pour cible la neurotransmission
cholinergique. Elle se fixe à la place de l'acétylcholine sur les
récepteurs nicotiniques cholinergiques, des récepteurs canaux. La
liaison de l'agoniste sur le récepteur nicotinique provoque un
changement de conformation de l'architecture protéique du
récepteur, ce qui ouvre le canal ionique pendant quelques millisecondes.
Le canal est sélectif pour les cations (surtout le sodium), son
ouverture entraîne donc une brève dépolarisation. Puis le
canal se referme et le récepteur devient transitoirement
réfractaire aux agonistes : c'est l'état de
désensibilisation, qui est normalement suivi d'un retour à
l'état de repos, fermé et sensible aux agonistes. En cas
d'exposition continue à l'agoniste (même à faible dose),
cet état de désensibilisation est durable (inactivation à
long terme) (42,47). (Figure 5).
Conditions normales physiologiques: après ouverture
du canal sodique par liaison de l'acétylcholine, le récepteur
passe par un état désensibilisé avant de revenir au stade
de repos ou d'être renouvelé.
Conditions tabagiques: la nicotine remplace
l'acétylcholine et sur stimule le récepteur nicotinique. Puis le
récepteur est inactivé à long terme et son renouvellement
est saturé par la nicotine.
Figure 5 : Cycle de fonctionnement d'un
récepteur nicotinique:
1.3.5.1. Effets
centraux
La nicotine traverse facilement la barrière
hémato encéphalique et elle est absorbée par une simple
diffusion passive et un transport actif par le plexus chorode. Elle est alors
distribuée dans l'ensemble du cerveau avec des concentrations plus
élevées au niveau du thalamus, de l'hippocampe, de
l'hypothalamus, de l'aire tégumentaire ventrale, du cortex
préfrontal, du cortex du système visuel et du cervelet.
La fixation de la nicotine sur des récepteurs
nicotiniques s'accompagne d'une activation physiologique des diverses zones
cérébrales. La nicotine module la libération de nombreux
neurotransmetteurs et hormones tels que l'acétylcholine, la
vasopressine, l'ACTH et les monoamines (sérotonine, dopamine,
noradrénaline) qui interviennent dans les fonctions cognitives et dans
la régulation de l'humeur et des émotions. La plupart des effets
centraux de la nicotine sont les résultats d'une stimulation directe des
récepteurs nicotiniques cérébraux, stimulation qui
explique les propriétés psycho actives de la nicotine conduisant
au renforcement positif du comportement:
Ø activation des fonctions cognitives, de la
mémoire à court terme et de vigilance,
Ø sensation de plaisir et de bien-être,
Ø régulation de l'appétit : effet
anorexigène;
Ø régulation de l'humeur, de
l'anxiété et action antidépressive (42,47).
1.3.5.2 Effets
périphériques
La nicotine a également une action
ganglioplégique qui se manifeste par une action au niveau des
systèmes sympathique et parasympathique avec stimulation initiale des
récepteurs, suivie d'une inhibition (42). Les effets excito-
ganglionnaires sont responsables des manifestations d'intolérance
à la première cigarette (sueur, vomissements, brachycardie) et
diminuent rapidement par la consommation quotidienne du tabac. Par contre, les
effets exercés par la nicotine sur la glande
médullosurrénale persistent et se traduisent par diverses
modifications:
Ø une augmentation du taux des acides gras libres;
Ø une augmentation de l'agrégation plaquettaire
par augmentation de l'adhésion, c'est un facteur de risque de thrombose
artérielle.
A faible dose, la nicotine provoque une stimulation
transitoire de tous les ganglions et engendre la libération des
catécholamines ; à l'opposé, une quantité plus
importante inverse l'action pharmacologique de la nicotine et elle peut
être la cause d'une dépression.
Fumer peut également entraîner :
Ø Une baisse du HDL-cholestérol;
Ø Une augmentation de la peroxydation des LDL
dont le rôle athérogène est considéré
comme primordial ;
Ø Et une baisse des oestrogènes conduisant
à une ménopause précoce et à une ostéoporose
post-ménopausique plus intense (42).
2. La cotinine
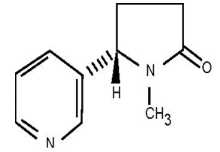
Figure 6: Configuration plane de la
cotinine
La cotinine ou 1-Méthyl-5-(3-pyridinyl)-2-pyrolidinone,
de formule brute C10H12N2O (figure 6), il est
caractérisée par une masse molaire MM =176,22g.mol, se
présente à l'état pur sous forme d'une solution
huileuse.
2.1 Métabolisme de la
cotinine
Tout comme la nicotine, la cotinine est à son tour
métabolisée par des réactions simultanées dans le
foie. Ceci est illustré sur la figure 2. La réaction la plus
importante est celle qui conduit à la formation de la trans 3' hydroxy-
cotinine, qui constitue de point de vue quantitatif le métabolite le
plus abondant dans les urines des fumeurs, mais la plupart des
métabolites issus de la cotinine peuvent être dosés dans
les urines.
Grâce à sa spécificité, sa
sensibilité, sa stabilité et sa longue demi-vie (24 heures, soit
10 fois plus longue que celle de la nicotine), la cotinine est le marqueur le
plus couramment utilisé et le suivi de sa concentration dans les
différentes matrices biologiques (urine, sang, cheveux,.....) peut
être d'une grande importance pour l'étude du tabagisme (passif ou
actif), ainsi que tous les aspects qui lui sont liés tels que: les
programmes de sevrage, les phénomènes de dépendance
tabagique, l'efficacité des traitements,....(48).
Nombreuses sont les études qui ont utilisé cette
molécule comme un bio marqueur du tabagisme (48, 49).
2.2. Elimination de la
cotinine
La cotinine est une base beaucoup plus faible que la nicotine,
les concentrations salivaires ou urinaires sont beaucoup moins
dépendantes du pH (9,45).
Le pH urinaire étant soumis à des fluctuations,
le fumeur excrète donc des proportions variables de cotinine dans la
journée.
2.3. Mode d'action de la
cotinine
Cette molécule est pharmacologiquement active et agit
à différents niveaux : Des expériences menées
sur les animaux montrent qu'elle diminue la résistance vasculaire et la
pression artérielle. Chez les fumeurs abstinents, la privation de
nicotine aurait des effets sur la diminution des performances cognitives.
Sur le système nerveux central, elle exerce une action
stimulatrice psychomotrice, une action antidépressive
(commercialisée aux Etats-Unis sous le nom de Scotine®),
une action stimulante sur la libération de la dopamine et de la
noradrénaline, et une action au niveau des récepteurs
sérotoninergiques centraux.
Sur le système cardiovasculaire, la cotinine
possède une activité artério relaxante, elle est
antagoniste des effets hypertensifs de la nicotine et de l'adrénaline de
manière non compétitive, avec une action bradychardisante
observée chez l'animal mais non vérifiée chez l'homme et
une action stimulante sur la biosynthèse de la prostacycline (PGI2).
Sur les systèmes enzymatiques, la cotinine est
inhibitrice de la 11-â-hydroxylase (biosynthèse du cortisol), de
l'aromatase (biosynthèse des oestrogènes) et de la
biosynthèse de l'aldostérone.
III. ANALYSE URINAIRE
1. Composition de l'urine
L'urine est composée à 95% d'eau et à 5%
de substances diverses. Les composés azotés sont l'urée,
l'acide urique et la créatinine. On trouve aussi des ions tels que:
sodium, potassium, phosphate, calcium, magnésium et bicarbonate.
L'urine émise est généralement claire, de
coloration jaune pâle à intense dépendant de la
concentration de l'urine. Son pH normal est d'environ 6.
2. Particularités
de l'analyse urinaire
Nous utilisons un échantillon urinaire en raison de
son recueil facile et non invasif et des variations du taux de cotinine
urinaire au cours du nycthémère. Cette matrice offre plusieurs
avantages, comme elle présente également certains
inconvénients, plusieurs peuvent influer sur la concentration de la
cotinine urinaire:
Ø Variabilité due au métabolisme:
Certaines études (50) ont montré que des
facteurs comme le sexe, le poids, l'âge, la consommation
simultanée d'autres substances actives (médicaments ou drogues),
le régime alimentaire et la pratique ou non de sport peuvent influer sur
les concentrations retrouvées. Ces facteurs interviennent notamment au
niveau du métabolisme hépatique, ce qui explique les
différences existant d'un individu à un autre concernant les taux
relatifs de la cotinine.
Ø Variabilité due à
l'échantillonnage:
Sous ce titre se cache un aspect fondamental pour toute
analyse chimique en général, et plus particulièrement
l'analyse de matrices biologiques. En effet, les paramètres tels que La
nature de l'échantillon étudié, les conditions du
prélèvement (heure, quantité, nombre,..........) sont
primordiaux.
Ø Variabilité due à l'analyse:
Cette variabilité est due en grande partie à
l'étape de préparation de l'échantillon à partir de
n'importe quelle matrice biologique. En effet, l'analyse de matrice aussi
complexe que les urines nécessite plusieurs étapes de
prétraitement, de purification, .....Toutes ces étapes
introduisent des variations plus au moins importantes que le chercheur doit
identifier, maîtriser et minimiser.
3. Les méthodes de
dosage
3.1 Méthode
colorimétrique
Cette technique est fondée sur une réaction
colorée, la réaction de König, liée à la
présence du noyau pyridinique intact, ce qui explique les
interférences avec d'autres composés pyridiniques
endogènes ou exogènes tels l'isoniazide.
Elle a été adaptée par Barlow et
collaborateurs pour le dosage des métabolites urinaires de la nicotine
en 1987. Il s'agit d'un dosage spectrophotométrique à une
longueur d'onde de 510 nm, après réaction avec le cyanure de
potassium et l'acide barbiturique. Cette méthode permet de doser
l'ensemble des métabolites urinaires de la nicotine, exprimés en
« équivalents cotinine», à l'exception du
nicotine-glucuronide et du cotinine-glucuronide. Cette technique est simple,
rapide, peu coûteuse et facilement automatisable.
Le principal inconvénient de cette méthode est
son seuil de sensibilité de 1250 ng/ml ne permettant son utilisation ni
pour l'évaluation du tabagisme occasionnel ou faible, ni pour la
détection d'un tabagisme passif (45,51).
La littérature montre une bonne corrélation
entre le dosage colorimétrique et le dosage spécifique de la
cotinine urinaire par HPLC, avec un facteur d'environ 13 entre les deux
résultats (51,52). Une variante de cette méthode utilisant
l'acide diéthylthiobarbiturique a également été
décrite (53).
3.2 Méthodes
immunologiques
3.2.1 Test RIA (Radio
Immuno Assay)
Cette technique utilise un principe de compétition,
vis-à-vis de leurs anticorps spécifiques, entre la nicotine ou la
cotinine présentes dans le sérum ou l'urine et une
quantité donnée de nicotine ou cotinine marquée par un
radio-isotope.
L'inconvénient principal est la
réactivité croisée des anticorps anti-nicotine et
anti-cotinine avec la trans- 3'-OH-cotinine et le cotinine-glucuronide
(45,54).
3.2.2 Test ELISA (Enzyme
Linked Immunosorbent Assay)
Le dosage se fait dans des plaques dont les puits sont
recouverts de cotinine. Un anticorps anti-cotinine est ajouté aux puits
ainsi que l'échantillon à tester. L'anticorps n'ayant pas
réagi avec la cotinine de l'échantillon se lie avec la cotinine
fixée dans le puits. Une technique analogue existe pour la nicotine.
Après lavage de la plaque, la quantité d'anticorps lié au
puits est révélée par l'ajout d'un second anticorps
lié à une peroxydase (lecture à 490 nm). La limite de
détection est de 5 ng/ml pour la nicotine et de 2 ng/ml pour la cotinine
dans la salive. Mais cette technique a également été
utilisée pour le dosage de la cotininurie, avec un seuil de
détection à 5 ng/ml.
Cette méthode est simple, rapide, sensible et
spécifique mais coûteuse en réactifs (45,55, 56).
3.3 Les méthodes
chromatographiques
3.3.1 Chromatographie sur
couche mince
Cette technique a été décrite par Tyrpien
et al, pour le dosage de la nicotine et de la cotinine (57). Après une
extraction solide/liquide et migration sur couche mince, la détection
est faite par densitométrie. C'est une technique très sensible
permettant de quantifier des expositions passives à la fumée de
tabac. Cependant les dosages en chromatographie couche mince sont peu souvent
réalisés par les laboratoires car ils sont longs à mettre
en oeuvre et nécessitent une prise d'essai importante.
3.3.2 Chromatographie
phase gazeuse
Cette méthode permet le dosage de la nicotine et de la
cotinine dans le sérum et dans l'urine. Deux types d'extraction ont
été décrits : extraction liquide/liquide avec une limite
de détection à 0,16 ng/ml et extraction liquide/solide
avec une limite de détection à 2 ng/ml. La
détection est le plus souvent couplée à la
spectrométrie de masse, pour un dosage sensible et spécifique.
C'est une méthode simple mais très coûteuse (45,58, 59,
60).
3.3.3 Chromatographie
liquide haute performance
C'est la technique de référence car elle est
très sensible et spécifique (61). Cependant, elle est
coûteuse en temps de personnel et nécessite un appareillage
spécialisé. Elle permet le dosage simultané et
spécifique dans le sérum ou l'urine de la nicotine, de la
cotinine et, selon les techniques, d'autres métabolites comme la
trans-3'-hydroxycotinine, le cotinine N-oxyde et la norcotinine (62).
La technique originale utilise une chromatographie en phase
inverse avec formation de paires d'ions et détection UV. Des
interférences analytiques existent notamment avec la caféine mais
celles-ci peuvent être éliminées en modifiant les
conditions de chromatographie. La limite de détection est de 10 ng/ml
pour la nicotine et la cotinine dans l'urine et peut descendre jusqu'à 5
ng/ml pour la cotinine sérique. Une méthode d'extraction en phase
solide a également été décrite pour le dosage de la
nicotine, de la cotinine et de la trans-3'- hydroxycotinine dans l'urine (45),
il s'agit d'une technique rapide et fiable qui peut s'appliquer à des
échantillons provenant aussi bien des fumeurs passifs que actifs
(63,64).
Avec ce type d'extraction, Oddose et al. obtiennent une limite
de quantification de 0.5 ng/ml pour la nicotine (65).
Enfin, Tuomi et al. ont utilisé une technique HPLC
couplée à la spectrométrie de masse pour évaluer
l'exposition à la fumée de tabac (63). La limite de
détection est de l'ordre de 1 ng/ml pour la nicotine et ces seuils sont
abaissés en augmentant le volume d'échantillon.
I. INTRODUCTION
La détection et la quantification des
xénobiotiques à l'état des traces à partir des
matrices biologiques constituent un défi auquel sont confrontés
de nombreux analystes. Les domaines d'application de ce type d'investigation
sont diverses, et vont des analyses toxicologiques aux tests antidopage en
passant par les expertises judiciaires, etc.
Plusieurs marqueurs biologiques ont été
proposés comme outils permettant d'effectuer un travail de suivi et de
contrôle du tabagisme.
De rares travaux ont utilisé des marqueurs qui
permettaient essentiellement de distinguer les fumeurs des non fumeurs, comme
le dosage des thiocyanates dans les urines, la mesure du monoxyde de carbone
dans l'air expiré (66), ou encore le dosage de la
carboxyhémoglobine dans le sang. Cependant, ces marqueurs
n'étaient pas réellement spécifiques à la
consommation de tabac, ce qui explique la faible validité des
résultats obtenus (45). Optant pour des marqueurs de plus grande
spécificité, la majorité des travaux ont axé leurs
recherche sur le dosage simultané de la nicotine ou de son
métabolite principal la cotinine (63,65) dans plusieurs matrices
biologiques, telles que l'urine (63,65,66), le sang (66,67), les cheveux ou la
salive (66).
Les enquêtes menées n'ont cependant pas permis
d'établir une relation quantitative de cause à effet en raison
des difficultés à mesurer de façon précise le
degré réel de l'absorption tabagique à partir des
renseignements obtenus par questionnaire. Aussi, pour tenter de valider
l'hypothèse selon laquelle les manifestations cliniques s'observent de
préférence chez les sujets les plus exposés, nous avons
cherché à savoir si le niveau d'exposition pouvait être
quantifié par dosage d'un marqueur biochimique spécifique du
tabac, la cotinine urinaire.
Les urines représentent, en effet, le milieu biologique
actuellement le plus utilisé dans la littérature (68), leur
recueil, modérément contraignant, étant bien
accepté.
Pour mener à bien cette étude, et en se basant
sur les résultats bibliographiques, nous nous sommes choisi de doser la
cotinine et non pas la nicotine parce que ce paramètre est davantage
représentatif d'une intoxication tabagique en raison de sa demi vie plus
longue (19 heures contre 2 heures pour la nicotine). Par ailleurs, son
excrétion est, contrairement à celle de la nicotine,
indépendante de la valeur du pH urinaire. Grâce à sa
spécificité et stabilité relatives, le suivi de la
concentration de la cotinine dans les différents supports biologiques
(urines, sang, salive, cheveux,....) peut être d'une grande
utilité pour mener à bien tout travail d'investigation concernant
l'étude du phénomène de tabagisme (passif ou actif), ainsi
que tous les problèmes qui lui sont liés tels que la
dépendance, les programmes de sevrage, l'étude de
l'efficacité des traitements de substitutions, etc. Nombreuses sont les
études qui ont utilisés ces molécules comme bio marqueurs
du tabagisme (66).
L'objectif principal de ce travail est de chercher si le
niveau d'exposition pourrait être quantifié par le dosage d'un
marqueur biochimique spécifique du tabac: la cotinine urinaire et de
mettre en évidence la relation entre la consommation du tabac et les
concentrations urinaires en cotinine afin d'estimer la valeur discriminative de
la cotininurie entre les fumeurs, les fumeurs passifs, ainsi que les non
fumeurs, et de corréler la cotinine urinaire à certains autres
paramètres notamment le nombre de cigarettes consommés/j et
l'ancienneté d'exposition. L'objectif secondaire est de décrire
les discordances (faux négatifs et faux positifs) entre le dosage de la
cotinine et les données de l'interrogatoire.
II. MATERIEL ET
METHODES
1. Matériel
1.1 Population d'étude
Notre population est formée auprès de sujets
fumeurs (F) [n = 47] âgés de 17 à 73 ans, de fumeurs
passifs (FP) [n = 50] âgés de 3 à 75 ans, et de non
fumeurs non exposés (NF) [n = 50] formant le groupe témoin
(Tableau I).
Afin de faciliter l'exploitation des données,
différentes catégories de comportement ont été
distinguées, c'est ainsi que dans la catégorie des fumeurs actifs
figurent les sujets fumant moins de 10 cigarettes/j, ceux fumant entre 10 - 20
cigarettes et ceux consomment plus de 20 cigarettes/j. Les fumeurs passifs ont
été classés en trois catégories en fonction du
degré d'exposition et répartis en quatre groupes en fonction de
l'ancienneté de l'exposition.
Tableau I: Population
étudiée
|
Fumeurs
(F)
|
Fumeurs passifs
(FP)
|
Non fumeurs
(NF)
|
Total
|
|
Hommes
|
45
|
13
|
21
|
79
|
|
Femmes
|
2
|
37
|
29
|
68
|
|
Age moyen
(années)
|
29,6 #177; 12,7
|
24,6 #177; 16,8
|
26, 9 #177; 19
|
147
|
1.2 Recueil des
échantillons urinaires
Pour chaque sujet de l'étude, 10 mL d'urines ont
été recueillis dans un flacon stérile sans conservateur.
Chaque prélèvement a fait l'objet d'un étiquetage avant
son acheminement au laboratoire.
Ces prélèvements ont été
rapportés rapidement au laboratoire pour éviter toute
détérioration et contamination extérieure et
conservés à + 4°C.
1.3 Réactifs
utilisés
Nous avons utilisé le kit de dosage de la cotinine
urinaire (Thermo Electron corporation. Réf : 981632). Les
réactifs sont prêts à l'emploi et ont été
adaptés sur automate multiparamétrique de transfert
KonelabTM de Thermo Electron. La limite de détection du kit
est de 33 ug/L.
Ø Réactif A : Réactif
anticorps / substrat
o Anticorps monoclonal anti-cotinine (de
souris)
o Glucose-6-phosphate
o NAD+
o Tampon Tris
o NaN3 < 0, 1%
Ø Réactif B : Réactif
conjugué enzymatique
o G6PDH marquée à la
cotinine
o Tampon Tris
o NaN3 < 0,1%
Ø Une trousse de Calibration set D,
code 981633 ; cette trousse contient : six flacons aux concentrations
respectives de D0 = 0 ug/L, D1 = 100 ug/L, D2
= 250 ug/L, D3 = 500 ug/L, D4 = 1000 ug/L et
D5 = 2000 ug/L.
1.4 Appareillage
Ø Automate multiparamétrique de transfert
KonelabTM 30 de Thermo Electron Lab systems, Finlande.
Ø Centrifugeuse.
Ø Balance électronique.
Ø Réfrigérateur.
Ø Etuve.
2. Méthodes
2.1. Recueil des
données
Les données ont été recueillies par le
biais d'un questionnaire (annexe n°2) comportant divers renseignements
à propos du sujet de l'étude:
Ø Statut sociodémographique: âge, sexe,
niveau d'instruction, origine.
Ø Tabagisme passif et actif: âge à la
première cigarette, quantité moyenne de tabac consommée,
mode de consommation (cigarette, pipe, tabac à priser ou à
chiquer ou narguilé), âge auquel les anciens fumeurs ont
cessé de fumer.
Ø Les pathologies liées à la consommation
du tabac.
Ø Les antécédents : alcoolisme,
pathologies respiratoires, pathologies cardio-vasculaires.
2.2. Analyse des données
Par fumeur régulier, on entend toute personne ayant
fumé au moins 20 paquets de cigarettes/an ou 360g du tabac ou au moins
une cigarette par jour ou un cigare par semaine pendant une année et
par gros fumeur toute personne ayant fumé quotidiennement 20 cigarettes
ou plus. Pour le tabagisme passif, il a été défini comme
l'exposition d'un sujet non fumeur à la fumée d'au moins trois
cigarettes par jour en atmosphère confinée.
2.3 Méthode de dosage
La cotinine est dosée par une technique
immunoenzymatique, fondée sur la compétition entre une enzyme,
la glucose-6-phosphate déshydrogénase (G6PDH) marquée par
la cotinine et la cotinine libre de l'échantillon d'urine pour une
quantité fixe de sites de liaisons spécifiques de l'anticorps. En
l'absence de cotinine libre dans l'échantillon, la G6PDH marquée
est fixée par l'anticorps spécifique et l'activité
enzymatique est inhibée. Ce phénomène crée une
relation directe entre la concentration de la cotinine dans l'urine et
l'activité enzymatique. L'activité enzymatique de la G6PDH est
déterminée par spectrophotométrie à 340 nm en
mesurant sa capacité à convertir la nicotinamide adénine
dinucléotide (NAD+) en NADH, H+.
2.4 Expression des
résultats
Le dosage simultané de la créatinine urinaire
par la méthode de Jaffé automatisée permet d'éviter
les erreurs dues aux variations de la diurèse. Les concentrations
urinaires de la cotinine sont donc exprimées en ug/ umol de
créatinine.
2.5 Analyse statistique
Les résultats sont exprimés en
moyenne (M) #177; écart type (ET). La saisie des
données a été effectuée à l'aide du logiciel
Epi Info version 6 et leurs analyses (calcul de fréquences et
pourcentages) au moyen du logiciel SPSS / PC version 10.00.
La comparaison entre les pourcentages a été
faite à l'aide du test chi², et celle des moyennes à l'aide
du test t de Student.
Les corrélations sont exprimées par le
coefficient r. Le seuil de signification retenu est de 5%.
III. RESULTATS
L'expression des résultats sous forme d'un rapport
cotinine sur créatinine (Cot/Créa en ug/umol) permet une
meilleure corrélation avec la nicotine théorique inhalée
et la valeur de la cotinine métabolisée, afin d'éviter les
interférences de l'osmolarité, de la clairance rénale, et
enfin de la diurèse.
1. Cotininurie et statut
tabagique
Le tableau II rapporte les valeurs moyennes du rapport
Cot/Créa en fonction du statut tabagique, et montre des
différences significatives entre les trois sous-groupes.
Tableau II : Comparaison de la cotininurie entre les
trois populations étudiées
|
Rapport Cot/créa
(Moyenne #177; Ecart type)
(ug/umol)
|
Test t de Student
|
|
Fumeurs
|
225,10 #177; 202,99
|
Entre (F et FP) p < 10-7
|
|
Fumeurs passifs
|
31,07 #177; 21,84
|
Entre (F et NF) p < 10-8
|
|
Non fumeurs
|
10,31 #177; 6,83
|
Entre (FP et NF) p < 10-7
|
La cotininurie est significativement plus élevée
chez les fumeurs que chez les fumeurs passifs et les non fumeurs (p <
0,05). Il existe également une différence significative entre les
fumeurs passifs et les non fumeurs (Figure 7).
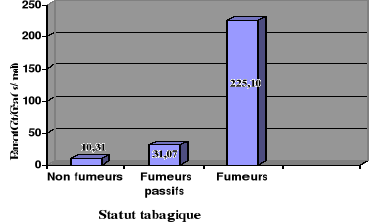
Figure 7 : Variation de la cotininurie selon le statut
tabagique
La cotininurie est significativement plus élevée
chez les fumeurs que chez les fumeurs passifs et les non fumeurs (p <
0,05). Il existe également une différence significative entre les
fumeurs passifs et les non fumeurs.
2. Cotininurie chez les
fumeurs passifs
2.1
Cotininurie selon l'âge
Le tableau III rapporte les moyennes du rapport Cot/Créa
selon les tranches d'âge.
Tableau III : Comparaison de la cotininurie chez
les fumeurs passifs selon l'âge
|
Tranche d'âge
(ans)
|
Nombre de sujets
|
Rapport Cot/créa
(Moyenne #177; Ecart type)
(ug/umol)
|
|
1-15 ( A )
|
19
|
27,49 #177; 21,26
|
|
16-25 ( B )
|
10
|
32,29 #177; 28,60
|
|
26-40 ( C )
|
12
|
33,26 #177; 18,77
|
|
> 40 ( D )
|
9
|
34,33 #177; 21,17
|
A Vs B p=
0,647; A Vs C p= 0,436;
A Vs D p= 0,437
B Vs C p= 0,927;
B Vs D p= 0,860;
C Vs D p= 0,905
Quelle que soit la tranche d'âge, le rapport
Cot/Créa ne présente pas de variation significative selon
l'âge, ne dépassant pas en moyenne la valeur de 40 ug/umol.
Le test t de Student ne montre pas des différences
significatives entre les quatre sous-groupes.
2.2 Cotininurie et sexe
Le tableau IV compare le rapport Cot/Créa entre les deux
sexes.
Nous constatons qu'il n'existe pas de variation significative de
la cotininurie entre les deux sexes.
Tableau IV : Comparaison de la cotininurie entre
les deux sexes
|
Sexe
|
Rapport Cot/créa
(Moyenne #177; Ecart type)
(ug/umol)
|
Test t de Student
|
|
Hommes
|
30,71 #177; 24,69
|
p= 0,949
|
|
Femmes
|
31,19 #177; 21,12
|
2.3
Cotininurie et niveau de scolarité
Le tableau V rapporte les résultats de la comparaison des
moyennes du rapport Cot/Créa selon le niveau de scolarité.
Tableau V : Variation de la
cotininurie en fonction du niveau de scolarité
|
Niveau de scolarité
|
Rapport
Cot/Créa
(Moyenne #177; Ecart
type)
(ug/umol)
|
|
Analphabète (A)
|
33,71#177; 22,43
|
|
Primaire (B)
|
27,78 #177; 20,93
|
|
Secondaire (C)
|
28,20 #177; 25,52
|
|
Supérieur (D)
|
38,96 #177; 19,34
|
A Vs B p=
0,531; A Vs C p =0,617;
A Vs D p = 0,608
B Vs C p= 0,961;
B Vs D p = 0,162;
C Vs D p = 0,274
Le rapport Cot/Créa est plus élevé chez
les fumeurs passifs qui ont un niveau de scolarité supérieur,
sans qu'il y ait de différence significative entre les quatre
sous-groupes.
2.4 Variation de la
cotininurie en fonction de la durée d'exposition
Le tableau VI résume le rapport Cot/Créa en
fonction de la durée d'exposition.
Tableau VI: Variation de la cotininurie en fonction de
la durée d'exposition
|
Rapport Cot/Créa
(Moyenne #177; Ecart type)
(ug/umol)
|
Durée d'exposition
(heures/j)
|
|
22,39 #177; 12,57
|
1 à 2 (A)
|
|
35,59 #177; 25,98
|
3 (B)
|
|
43,16 #177; 25,42
|
> 3 (C)
|
A Vs B p =
0,092; A Vs C p
=0,018; B Vs C
p = 0, 0461
Il montre une augmentation de la cotininurie en fonction
de la durée d'exposition avec une différence significative
entre les trois sous-groupes, traduisant une augmentation notable de la
cotininurie lorsque la durée d'exposition par jour dépasse les
trois heures.
Le test t de student montre une différence
significative entre les sujets exposés pendant 1 à 2 h / jour
et ceux exposés pendant plus de 3 heures (p<0.05).
La figure 8 illustre la variation de la cotininurie en
fonction de la durée d'exposition. Elle montre une augmentation
linéaire du rapport Cot/Créa en fonction de la durée
d'exposition par jour. Cette relation présente un coefficient de
corrélation r = 0,988 et une équation
Y= 10,405 X + 12,92.
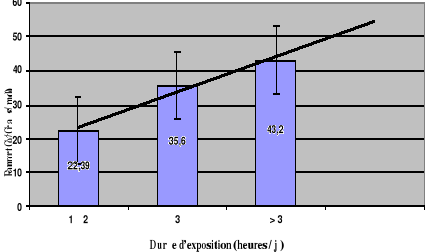
Figure 8: Evolution de la cotininurie en
fonction
de la durée d'exposition
2.5 Variation de la cotininurie en fonction de
l'ancienneté de l'exposition
Le tableau VII rapporte les résultats de la comparaison
des moyennes du rapport Cot/Créa selon l'ancienneté de
l'exposition.
Tableau VII : Variation de la cotininurie en fonction
de l' ancienneté de l'exposition
|
Ancienneté de l'exposition
(années)
|
Rapport Cot/Créa
(Moyenne #177; Ecart type)
(ug/umol)
|
|
1 à 5 (A)
|
28,60 #177;18, 82
|
|
6 à 10 (B)
|
41,51#177; 28, 83
|
|
> 10 (C)
|
45, 50 #177; 37,29
|
A Vs B p =
0,502; A Vs C p =0,371;
B Vs C p = 0,871
Le test t de Student ne montre pas de différence
significative entre les trois sous-groupes.
La figure 9 illustre la corrélation entre
l'ancienneté de l'exposition et la cotininurie. Elle montre une
augmentation linéaire du rapport Cot/Créa en fonction de
l'ancienneté d'exposition. Cette relation présente un coefficient
de corrélation r = 0,956 et une
équation Y=8,45X + 21,63.
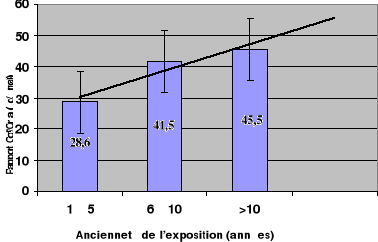
Figure 9: Evolution de la
cotininurie en fonction
de l'ancienneté
d'exposition
3. Etude de la cotininurie chez les fumeurs
3.1 Cotininurie selon
l'âge
Le tableau VIII rapporte les résultats de la comparaison
des moyennes du rapport Cot/Créa selon l'âge.
Tableau VIII: Variation de la cotininurie en fonction
de l'âge
|
Age (ans)
|
Nombre
|
Rapport Cot/Créa
(Moyenne #177; Ecart type)
(ug/umol)
|
|
15 à 19 (A)
|
5
|
151,72 #177; 58,82
|
|
20 à 40 (B)
|
35
|
221,79 #177; 218,78
|
|
> 40 (C)
|
7
|
294,05 #177; 179,59
|
A Vs B p=
0,135; A Vs C p=0,087;
B Vs C p= 0, 372.
Chez les fumeurs, l'âge du début de consommation
se situe aux alentours de 7 ans. Le tableau VIII montre une augmentation de la
cotininurie avec l'âge. Entre 20 à 40 ans, le rapport
Cot/Créa est de 221,79 ug/umol, alors qu'il atteint la valeur de 294,05
ug/umol dans la tranche d'âge suivante. Cependant le test t de Student ne
montre pas de différence significative entre les trois sous-groupes.
3. 2 Cotininurie et sexe
Le tableau IX rapporte les résultats de la comparaison des
moyennes du rapport Cot/Créa selon le sexe.
Tableau IX: Variation de la cotininurie en fonction du
sexe
|
Sexe
|
Rapport Cot/créa
(Moyenne #177;Ecart type)
(ug/umol)
|
Test t de Student
|
|
Hommes
(n =45)
|
211,98 #177; 83,83
|
P = 0,068
|
|
Femmes
(n =2)
|
520,20 #177;196,93
|
Le test de Student montre une différence non
significative entre ces deux sous- groupes malgré l'existence d'une
différence importante de la valeur de la cotininurie entre les hommes et
les femmes.
3.3. Cotininurie et niveau de
scolarité
Le tableau X rapporte les résultats de la comparaison des
moyennes du rapport Cot/Créa selon le niveau de scolarité.
Plus l'individu est instruit et plus le rapport Cot/Créa
est faible.
Tableau X: Variation de la cotininurie en fonction du
niveau de scolarité
|
Niveau de
scolarité
|
Rapport
Cot/Créa
(Moyenne #177; Ecart
type)
(ug/umol)
|
|
Analphabète (A)
|
321,89 #177;177,10
|
|
Primaire (B)
|
214,07 #177; 52,31
|
|
Secondaire (C)
|
223,00 #177; 230,77
|
|
Supérieur (D)
|
197,05 #177; 216,38
|
A Vs B p=
0,203; A Vs C p =0,297;
A Vs D p = 0,190
B Vs C p= 0,
879; B Vs D p = 0,766;
C Vs D p = 0,
733.
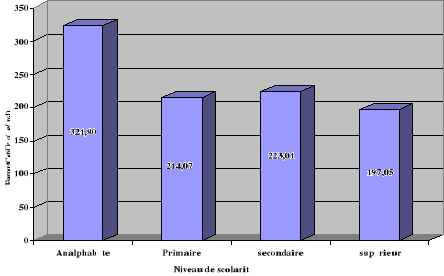
Figure 10: Cotininurie et niveau de scolarité
chez les fumeurs
3.4 Variation de la
cotininurie en fonction de l'ancienneté de l'exposition
Le tableau XI résume le rapport Cot/Créa en
fonction de l'ancienneté de l'exposition. Il montre une
augmentation de la cotininurie pour une exposition supérieure
à 4 ans.
Tableau XI: Variation de la cotininurie en fonction
de l'ancienneté de l'exposition.
|
Ancienneté de l'exposition
(ans)
|
Rapport
Cot/Créa
(Moyenne #177;Ecart type)
(ug/umol)
|
|
2 à 4 (A)
|
132,83 #177; 60,46
|
|
5 à 7 ( B)
|
218,53 #177; 241,18
|
|
8 à 15 ( C)
|
267,63 #177; 251,02
|
|
> 15 (D)
|
266,34 #177; 155,37
|
A Vs B p=
0,238; A Vs C p =0,072;
A Vs D p =
0,026
B Vs C p= 0, 608;
B Vs D p =0,570;
C Vs D p =0,
987.
Nous relevons une augmentation significative de la cotininurie
chez les fumeurs depuis plus de 15 ans par rapport à ceux dont le
tabagisme ne date pas de plus de 2 à 4 ans.
Le figure 11 montre une augmentation du rapport
Cot/Créa en fonction de l'ancienneté du tabagisme. Cette relation
présente un coefficient de corrélation r =
0,999 et une équation Y= -21,74 X2+ 153,71X+
0,18.
On remarque également que la relation entre
l'ancienneté de l'exposition et la cotininurie cesse d'être
linéaire pour tendre vers un plateau au-delà de 15 ans.
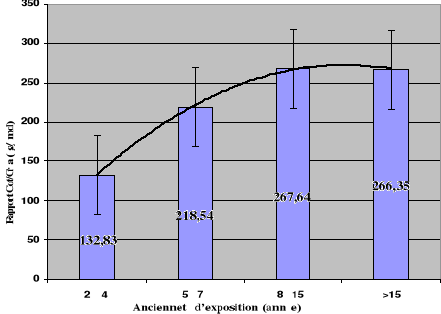 Figure 11: Variation de la cotininurie en fonction Figure 11: Variation de la cotininurie en fonction
de l'ancienneté de l'exposition.
3.5 Variation de la
cotininurie en fonction du nombre de cigarettes consommées par jour
Le tableau XII résume le rapport Cot/Créa en
fonction du nombre de cigarettes consommée par jour.
L'analyse des résultats chez les fumeurs montre
l'existence d'une relation significative entre le nombre de cigarettes
consommées et l'augmentation de la cotininurie.
Ce tableau montre une différence importante entre ces
sous-groupes, traduisant une augmentation notable de la cotininurie lorsque le
nombre de cigarettes fumées par jour atteint les 20.
Tableau XII : Variation de la cotininurie en fonction
de nombre de cigarettes consommées par jour
|
Nombre de cigarettes/j
|
Nombre de sujets (n)
|
Rapport
Cot/Créa
(Moyenne #177; Ecart
type)
(ug/umol)
|
|
1 à 10 ( A)
|
7
|
145,90 #177; 59,22
|
|
20 (B)
|
25
|
218,70 #177;193,74
|
|
30 (C)
|
10
|
256,35 #177; 256,35
|
|
40 (D)
|
5
|
305,46 #177; 101,55
|
A Vs B p=
0,114; A Vs C p =0,292;
A Vs D p =
0,020
B Vs C p= 0, 724;
B Vs D p =0,174;
C Vs D p =0,
654.
L'analyse statistique montre que plus le nombre de cigarettes
consommées est important, plus le taux de cotinine urinaire est
élevé, avec une différence statistiquement significative
de la valeur de la cotininurie entre les sujets fumant 1 à 10
cigarette/jours et ceux fumant 40 cigarettes/jours.
La figure 12 montre une augmentation linéaire du
rapport Cot/Créa en fonction du nombre de cigarettes consommées
par jour. Cette relation présente un coefficient de corrélation
r = 0,990 et une équation Y= 51,63 X +
102,53.
Nous relevons une augmentation significative de la cotininurie
chez les sujets fumant plus de 40 cigarettes par jour.
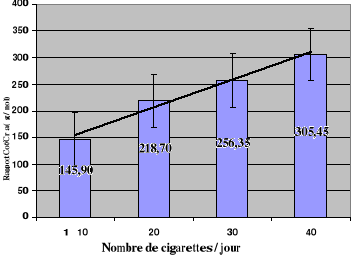
Figure 12: Evolution de la cotininurie en fonction
du nombre de cigarettes consommées/j
3.6 Cotininurie et
consommation d'alcool
Le tableau XIII rapporte les résultats de la comparaison
des moyennes du rapport Cot/Créa selon la consommation d'alcool ou
non.
Tableau XIII : Cotininurie et consommation d'alcool
|
Consommation
d'alcool
|
(n)
|
Nombre de
cigarettes / j
(Moyenne)
|
Rapport Cot/Créa
(Moyenne #177;Ecart type)
(ug/umol)
|
Test t de Student
|
|
Absence (A)
|
27
|
22,29
|
228,99 #177; 196,36
|
Entre (A) et (B)
p= 0,862
|
|
Consommation alcoolique (B)
|
16
|
23,75
|
241,27 #177; 237,75
|
Entre (A) et (C)
p= 0,047
|
|
Sevrage (C)
|
4
|
20
|
134,14 #177; 49,19
|
Entre (B) et
(C)
p= 0,113
|
L'analyse des résultats chez les fumeurs montre aussi
l'existence d'une relation entre l'alcoolisme et l'augmentation de la
cotininurie. On remarque également que cette augmentation significative
de la cotininurie est en relation avec le nombre de cigarettes
consommées par jour, cette augmentation est nette pour le
deuxième sous-groupe (fumant en moyenne 23,75 cigarettes/jour).
Le test t de Student montre une différence significative
entre le premier et le dernier sous-groupe, on note également une
légère différence entre les sujets alcooliques et les
sujets sevrés.
3.7. Cotininurie et
données cliniques
3.7.1 Traduction clinique
du tabagisme
La figure 13 illustre la répartition des fumeurs selon
l'existence ou pas des signes cliniques en rapport avec le tabagisme.

Figure 13: Répartition des fumeurs selon
l'expression clinique du tabagisme
Plus de 3/4 des fumeurs présentent au moins un signe
clinique en rapport avec le tabagisme.
3.7.2 Conséquences
cliniques du tabagisme.
La figure 14 illustre la répartition des fumeurs selon
les signes cliniques qu'ils présentent.
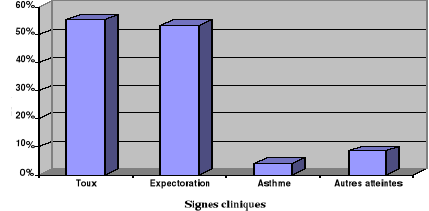
Figure 14: Répartition des fumeurs selon les
signes
cliniques du tabagisme
L'analyse des résultats chez les fumeurs montre que la
toux (55.32%) et les expectorations (53.32%) représentent les signes
cliniques les plus fréquents chez les fumeurs.
Le tableau XIV rapporte les résultats de la
corrélation entre cotininurie etexistence de signes cliniques.
Tableau XIV: Corrélation entre cotininurie et
présence de signes cliniques
|
Rapport Cot/Créa
(Moyenne #177;Ecart type)
(ug/umol)
|
Test t de Student
|
|
Présence des signes
|
244,03 #177; 222,68
|
p=0,045
|
|
Absence des signes
|
155,04 #177; 72,95
|
La cotininurie est significativement plus élevée
chez les fumeurs qui présentent des signes pathologiques que chez les
fumeurs qui ne présentent aucun signe (p < 0,05).
VI. DISCUSSION
Dans ce travail, nous avons dosé la cotinine urinaire
par une méthode immuno-enzymatique dont la limite de détection
est de l'ordre de 33 ug/ L selon le fournisseur du Kit de dosage, permettant la
détection de la cotinine même chez les fumeurs et chez les
fumeurs passifs. En pratique, nous avons retrouvé chez les
témoins non exposés des valeurs de cotininurie
inférieures à 33ug/L, faisant de cette méthode un outil
adapté au dépistage du tabagisme. Notre méthode se
caractérise par une limite de détection meilleure que celle de la
technique immuno-enzymatique utilisant le réactif
Microgénics® (45 ug/L), permettant de dépister de
façon satisfaisante les "fumeurs" mais pas les "petits fumeurs", mais
plus élevée que celle de la méthode "métabolites de
la nicotine" DPC® (10,8 ug/L), dont le principal avantage est
la précision satisfaisante pour de faibles concentrations de cotinine,
permettant le dépistage du "fumeur passif".
Le dosage de la cotinine urinaire est également
possible par une méthode colorimétrique utilisant comme
réactifs le chlorure de cyanogène et l'acide barbiturique, et
donnant un complexe coloré évalué à 500 nm. Mais
cette méthode manque de spécificité et de
sensibilité (69,70) et son principal inconvénient réside
dans le domaine de linéarité restreint qui impose d'effectuer
des dilutions des échantillons biologiques pour les fumeurs fortement
dépendants ou traités par de fortes doses de nicotine
(45,49).
Par ailleurs, concernant notre méthode, d'autres
métabolites de la nicotine et notamment la 3-Hydroxy-cotinine, dont la
forme libre représente 34% de l'ensemble des métabolites
urinaires de la cotinine,, peuvent majorer significativement les
concentrations de la cotininurie mesurée. Cette interférence se
répercutant sur toutes les mesures effectuées, elle demeure sans
incidence sur la comparaison de nos résultats
(45,49).
Cependant, la meilleure alternative préconisée
par certains auteurs est le recours à l'HPLC
précédée par une extraction en phase solide qui a
été également décrite pour le dosage de la
nicotine, de la cotinine et de la trans-3'-hydroxycotinine dans l'urine
(45,60,61). Il s'agit d'une technique rapide et fiable qui peut s'appliquer
à des échantillons provenant aussi bien de fumeurs actifs que
passifs (49,64). Avec ce type d'extraction, Oddoze et al (71) obtiennent une
limite de quantification de 0,5 ng/mL pour la cotinine et de 5 ng/mL pour la
nicotine. Tuomi et al (72) ont utilisé une technique HPLC couplée
à la spectrométrie de masse pour évaluer l'exposition
à la fumée de tabac. La limite de détection est de l'ordre
de 1ng/mL pour la cotinine et de 10 ng/mL pour la nicotine et ces seuils
peuvent être abaissés en augmentant le volume de
l'échantillon.
Avec l'adaptation de notre méthode sur automate, la
cotininurie s'avère un marqueur biologique pertinent du tabagisme avec
une valeur discriminative entre les trois sous-groupes (fumeurs, sujets non
exposés et sujets exposés), les valeurs supérieures
à 25,3 ug/umol de cotinine ayant toujours été
retrouvées chez les fumeurs passifs et supérieures à
105,18 ug/umol chez les fumeurs confirmés.
La surveillance biologique du tabagisme actif et du tabagisme
passif chez les personnes soumises à un environnement tabagique (in
utero, enfants, adultes), est une notion maintenant acquise. La cotinine libre
urinaire apparaît comme le meilleur marqueur, étant un parfait
témoin de l'imprégnation tabagique (45). Elle constitue le
marqueur le plus couramment utilisé. En effet, la cotinine est lentement
éliminée de l'organisme: sa demi-vie varie de 10 à 37
heures en fonction des sujets et son dosage reflète
l'imprégnation tabagique des deux ou trois jours
précédents. De plus, la cotinine étant une base beaucoup
plus faible que la nicotine, les concentrations urinaires sont beaucoup moins
dépendantes du pH (75, 73,74).
Selon Larramendy et al (76), la cotinine est un marqueur de
l'abstinence tabagique avec une sensibilité de 96-97 % et une
spécificité de 99-100 % pour la distinction fumeur / non-fumeur
(45,76).
Dans ce travail, nous retrouvons une différence
significative entre les valeurs moyennes de la cotinine urinaire chez les
fumeurs, les fumeurs passifs et les non fumeurs, permettant le
dépistage du tabagisme passif. Cependant, en tenant compte des vrais
intervalles des taux de cotinine urinaire, il semble difficile de faire la
différence entre les fumeurs passifs et les non fumeurs non
exposés. Les résultats obtenus concordent avec ceux de Berny et
al. (77,78) sur les marqueurs spécifiques du tabagisme.
Dans notre étude, les non fumeurs apparemment non
exposés éliminent en moyenne 10,31 ug/umol de cotinine, contre
31, 07 ug/umol chez les fumeurs passifs et 225,10 ug/umol chez les fumeurs
actifs.
Il faut cependant reconnaître qu'il s'agit là de
valeurs moyennes qui n'excluent pas la possibilité de rencontrer chez
certains individus des éliminations apparemment non proportionnelles au
degré d'intoxication supposé comme en témoignent quelques
valeurs relativement basses (33,42 ug/umol et 90,35 ug/umol) observées
chez 2 fumeurs sur 47 et à l'opposé, des valeurs
exceptionnellement élevées (100,63 ug/umol) chez un non fumeur
exposé sur 40. La cotininurie pourrait ainsi permettre de mieux exprimer
le degré d'absorption tabagique que les renseignements fournis par
questionnaire. Les valeurs précédentes doivent faire l'objet
d'une interprétation critique, car il existe toute une série de
facteurs devant être pris en compte.
Chez les fumeurs, l'âge du début de consommation
se situe aux alentours de 17 ans dans notre étude, alors que d'autres
études faites en Tunisie en 2002 situent l'âge moyen auquel une
personne commence à fumer entre 19 et 20 ans (79,80). Pour d'autres
auteurs, l'âge des premières expériences se situe autour de
14 ans (81). De plus, on remarque que le taux de cotinine urinaire est plus
élevé chez les fumeurs âgés de plus de 40 ans par
rapport aux groupes des 15 à 19 ans et des 20 à 40 ans. On
peut corréler cette différence à d'autres
paramètres tels que la prévalence du tabagisme dans chaque
groupe, l'intensité de consommation du tabac, les opinions de chaque
sujet fumeur et l'ancienneté d'exposition. Dans notre étude, nous
remarquons que la prévalence du tabagisme est plus
élevée dans la tranche d'âge > 40 ans, alors qu'elle
est plus importante dans la tranche d'âge 25-39 ans d'après Libbey
(78). De plus, nous avons noté qu'il existe à
la fois des similitudes et des différences entre le tabagisme des jeunes
(15-19 ans) et celui des adultes (20-40 ans).
Les jeunes, principalement au stade de
l'expérimentation, fument rarement quotidiennement ou de manière
régulière. Ils fument notamment pour les effets pharmacologiques
immédiats ressentis, parfois pour maîtriser leur poids et pour
répondre aux stimuli environnementaux. De plus, on peut corréler
l'augmentation de la cotininurie chez les fumeurs de plus de 40 ans à
la nature du tabac consommé. En effet, chez les jeunes, le tabagisme se
limite presque exclusivement à la consommation de cigarettes, les
personnes plus âgées préférant le tabac à
priser. De plus, chez le sujet prisant ou mâchant, la nicotine passe
facilement et plus rapidement à travers les muqueuses à
l'état de sels de base (82).
Il convient de révéler la constance de certains
comportements propres à la société tunisienne, tels que
l'usage de narguilé ou de substances traditionnelles comme le tabac
à priser, apanage des anciens, en particulier des femmes habitant les
zones rurales. De plus, nous avons relevé dans ce travail que la
majorité des sujets âgés de plus de 40 ans ont un niveau
d'instruction bas, méconnaissent la nocivité du tabac et fument
plus que les deux autres groupes (20 à 40 ans et 15 à 19 ans), ce
qui explique la valeur élevée de la cotinine urinaire chez ces
sujets. Dans la littérature, la population des fumeurs réguliers
et le nombre de cigarettes fumées augmentent rapidement avec l'âge
et sont maximales autour de 40 à 50 ans (79,80).
Ce travail montre aussi que le tabagisme passif touche toutes
les tranches d'âge avec des valeurs de la cotininurie qui ne
dépassent pas en moyenne 40 ug/ umol. Les travaux de Schulte-Hobein et
al (83) ont montré que pour une même exposition au tabagisme
passif, les taux de cotinine urinaire observés chez les enfants (1
à 15 ans) sont généralement plus élevés que
ceux observés chez les adultes, ce qui s'explique non pas par une
différence de métabolisme mais par une plus forte exposition due
à leur incapacité à s'extraire volontairement d'une
atmosphère enfumée (83).
De plus, il existe une corrélation fortement positive
entre le taux de cotinine urinaire mesuré chez les enfants et les
habitudes tabagiques de leurs parents (84).
Par ailleurs, notre étude révèle
l'absence d'une différence statistiquement significative de la valeur de
la cotininurie entre les femmes et les hommes, alors que la valeur de la
cotininurie est nettement plus élevée chez les femmes.
L'augmentation de la valeur de la cotininurie trouvée chez les femmes
peut s'expliquer par le fait que les deux femmes testées utilisent le
tabac sous formes traditionnelles (tabac à priser ou à chiquer),
ceci concorde avec les résultats trouvés par El Gharbi (82)
concernant le comportement propre à la société tunisienne,
tel que l'usage de substances traditionnelles comme le tabac à priser,
en particulier chez les femmes habitant les zones rurales. En accord avec nos
résultats, Tessier (85) rapporte une prévalence tabagique plus
élevée chez l'homme que chez la femme. D'autres auteurs estiment
que chez les femmes, la quantité de cigarettes fumées au cours
d'une vie est proche de celle des hommes, même si elles commencent
à fumer plus tard (79). Théoriquement, en présence d'un
taux de cotinine urinaire élevé, alors que la femme affirme
qu'elle ne fume pas, il peut s'agir :
Ø d'une femme fumeuse qui cache son tabagisme;
Ø d'un tabagisme passif (les taux de cotinine urinaire
sont alors faibles) (65);
Ø de l'absorption de cotinine d'origine non pas
tabagique mais alimentaire, certains aliments étant riches en
cotinine : tomate, thé, aubergine, café,... (86,78);
Ø d'un relargage de cotinine glucuroconjugée en
cotinine libre du fait de mauvaises conditions de stockage à
température trop élevée (87).
Nous avons également noté que le taux de
cotinine urinaire est plus élevé chez les femmes exposées
que chez les hommes exposés, cette augmentation peut s'expliquer par le
fait que la majorité des femmes enquêtées et admettant
fumer vit avec un mari fumeur et/ou bien des enfants fumeurs. Nos
résultats concordent avec ceux de Burguet (84).
Dans notre étude, la valeur de la cotinine urinaire est
plus importante chez les fumeurs analphabètes (321, 89 ug/umol) par
rapport aux autres sous-groupes, ainsi que pour les fumeurs passifs. Ceci peut
s'expliquer par le fait que ces derniers groupes sont inconscients des effets
nocifs du tabac, négligeant le fait que ce dernier puisse être un
facteur favorisant la survenue de nombreuses pathologies. Nos résultats
concordent avec ceux de l'ONFP (Office National de la Famille et de la
Population) (79,80). Selon cet organisme, le niveau de consommation de tabac
chez l'homme est inversement proportionnel à son niveau d'instruction:
une personne ayant une formation universitaire fume moins que celle dont le
niveau d'instruction est bas. Par ailleurs, les cadres supérieurs fument
moins que les manutentionnaires. Dans la plupart des pays à revenu
élevé, la prévalence du tabagisme entre les
différents groupes socioéconomiques varie sensiblement: les
individus dont le niveau socio-économique et le niveau d'instruction
sont faibles fument davantage que les individus instruits de niveau
socio-économique élevé (88). Cela est
particulièrement vrai chez les hommes.
Concernant la durée de l'exposition au tabac, notre
étude révèle une forte corrélation entre la valeur
de la cotinine urinaire et l'ancienneté de l'exposition ; cette
relation cesse d'être linéaire à partir de 15 ans. D'un
autre côté, nous retrouvons une forte corrélation entre la
concentration de la cotinine urinaire et le nombre de cigarettes fumées
par jour; la différence de concentration est significative entre le
groupe fumant 1 à 10 cigarettes par jour et ceux fumant 40 cigarettes
par jour (p<0.05). Par contre, Bruckert et al (89) retrouvent une
corrélation faible entre les concentrations de cotinine urinaire et le
nombre de cigarettes par jour même si d'autres auteurs montrent que la
relation entre le nombre de cigarettes fumées et la concentration de la
cotinine urinaire cesse d'être linéaire pour tendre vers un
plateau à partir de 25 cigarettes par jour (90). Phung et al (51) ont
montré que la corrélation entre le taux de la cotinine urinaire
et la quantité de nicotine consommée, évaluée par
le nombre de cigarettes indiqué par le fumeur, n'est pas très
étroite. Le degré réel de l'intoxication au tabac
dépend du rendement de cigarettes en nicotine, mais aussi et surtout du
mode de consommation du tabac (pipe, cigare ou cigarette), du fait d'inhaler ou
non et de la profondeur et la fréquence de cette inhalation (51,91).
En pratique, les droites de corrélation obtenues dans
notre étude permettent une estimation de la consommation tabagique chez
les sujets fumeurs. La consommation d'environ 1 à 10 cigarettes par jour
correspond à un taux de cotinine urinaire moyen de 145,90 ug/umol chez
le fumeur. La consommation d'environ 20 cigarettes par jour correspond en
moyenne à un taux de cotinine urinaire de 218, 7 ug/umol. La
consommation d'environ 30 cigarettes par jour correspond à un taux
urinaire de 256,35ug/umol et la consommation d'environ 40 cigarettes par jour
correspond à un taux de cotinine urinaire de 305,462 ug/umol.
Ce travail ne constitue pas une étude
pharmacocinétique cherchant à établir la concentration de
cotinine urinaire des fumeurs après la consommation
vérifiée d'une certaine quantité de cigarettes. Il s'agit
plutôt d'étudier la faisabilité et l'intérêt
du dosage, et les différents mécanismes expliquant les variations
du taux de cotinine urinaire. Dans ces conditions et au vu des données
pharmacodynamiques de la cotinine et des délais assez larges du recueil
des urines des fumeurs de notre étude, il est intéressant de
constater une corrélation aussi forte entre les valeurs de la
consommation tabagique et les valeurs de la cotinine urinaire.
Les autres paramètres pouvant expliquer la variation
des concentrations de la cotinine, mais qui n'ont pas été
analysés, sont l'importance de l'inhalation tabagique, le polymorphisme
génétique des cytochromes P 450, le délai entre la
dernière cigarette fumée et le prélèvement
urinaire. Il semble donc nécessaire de quantifier
précisément le nombre de cigarettes consommées par jour
car le risque lié à la consommation du tabac est proportionnel
à la fois à la durée du tabagisme et à la
quantité de tabac consommé (51, 84, 90,91).
Dans notre série, nous retrouvons aussi une
corrélation entre le taux de la cotinine urinaire et la durée
d'exposition (heures/jour). La différence est significative entre le
groupe exposé pendant 1 à 2 h/j et ceux exposés pendant
plus de 3h/j (p<0.05). Nos résultats concordent avec ceux de
Schneider et al (92) qui démontrent que lorsque le taux de cotinine
urinaire est significativement augmenté, cela peut traduire une
exposition passive plus importante. D'un autre côté, la forte
corrélation entre cotinine urinaire et ancienneté d'exposition
semble prévisible connaissant les propriétés cumulatives
de la cotinine. Des résultats similaires sont rapportés par
Roussel et al (91).
L'analyse de nos résultats chez les fumeurs montre
aussi que la valeur moyenne de la cotininurie est significativement plus
élevée chez les fumeurs consommateurs d'alcool par rapport aux
fumeurs non consommateurs d'alcool et ceux sevrés (p < 0.05). On peut
corréler ce phénomène au nombre de cigarettes
consommées car les fumeurs alcooliques consomment
généralement un nombre de cigarettes plus important par rapport
aux deux autres sous-groupes. Ces résultats concordent avec les
données de la littérature concernant les sujets
alcoolo-dépendants. Il existe une corrélation positive entre la
consommation d'alcool et de tabac (45). Chez les patients
alcoolo-dépendants, la prévalence du tabagisme dépasse 80%
et le degré de dépendance est particulièrement
élevé, avec des difficultés d'arrêt importantes. Par
ailleurs, l'augmentation du taux urinaire de la cotinine peut être en
rapport avec d'autres facteurs tels que l'âge. Ainsi, dans notre,
étude, la plupart des fumeurs alcooliques sont des adolescents. Sachant
que le tabagisme est souvent la première dépendance
observée chez les adolescents, il est associé significativement
avec l'augmentation du risque de dépendance à l'alcool au
début de l'âge adulte (45, 92,93).
Notre étude montre également que le tabac est un
facteur déclenchant de plusieurs signes pathologiques tels que toux,
expectoration et autres pathologies respiratoires, avec une corrélation
significative entre la présence d'une pathologie liée à la
consommation de tabac et l'augmentation de la cotininurie (p< 0.05).
Toutes les études épidémiologiques
s'accordent sur le fait que le tabac favorise à la fois les infections
des voies aériennes supérieures et inférieures(94,60).
D'après Larramendy et al (45), le risque est proportionnel à la
fois à la durée du tabagisme et à la quantité de
tabac consommée et par conséquent à la quantité de
cotinine.
Bien que les principales pathologies liées au tabagisme
apparaissent chez l'adulte, elles trouvent souvent leurs fondements dans le
développement de la dépendance au tabac au cours de la
période juvénile, particulièrement pendant
l'adolescence.
Il convient cependant de se souvenir que le dosage de la
cotinine ne traduit que l'intoxication tabagique récente. Pour
déduire que la constatation de valeurs élevées de cotinine
peut comporter ou non des risques pour la santé, il faut s'assurer que
la situation où a lieu l'observation se répète
régulièrement depuis plusieurs années et ne constitue pas
un phénomène accidentel qui n'aurait pas alors la même
signification.
La cotinine urinaire s'avère suffisamment sensible pour
l'évaluation du statut tabagique et pour distinguer clairement entre
fumeurs actifs (225,10 ug/umol) et sujets exposés (31,07 ug/umol). Notre
travail révèle également l'existence d'une
corrélation avec la durée d'exposition chez les fumeurs passifs.
Il montre une augmentation de la cotininurie en fonction de la
durée d'exposition traduisant une augmentation notable de la cotininurie
lorsque la durée d'exposition par jour dépasse les trois heures
(43,16 ug/umol). Une corrélation existe également avec le nombre
de cigarettes fumées, et avec l'ancienneté de l'exposition chez
les fumeurs confirmés. Nous retrouvons également une
corrélation significative entre la présence d'une pathologie
liée à la consommation de tabac et l'augmentation de la
cotininurie. La cotininurie est plus élevée chez les fumeurs qui
présentent des signes pathologiques (244,03ug/umol) que chez les fumeurs
qui ne présentent aucun signe (155,04ug/umol).
Le dosage de la cotinine urinaire permet donc de prouver et
de quantifier cette exposition, et aussi de dégager des
corrélations souvent instructives chez la femme enceinte, le
nouveau-né, le nourrisson, le jeune enfant et l'adolescent (92).
En résumé, l'intérêt de la
cotininurie est de permettre la quantification des apports réels en
nicotine chez le sujet fumeur, ou exposé au tabac, et de l'utiliser
comme marqueur du tabagisme dans le cadre d'études
épidémiologiques, en complément des questionnaires. Il y a
alors nécessité de s'appuyer sur un questionnaire fournissant
des renseignements complets sur l'intoxication tabagique et surtout sur la
connaissance des sujets de la nocivité du tabac. Le choix de la
méthode de dosage de ce marqueur est d'une grande importance dans la
mesure où il faut opter pour une technique permettant de traiter un
grand nombre d'échantillons dans un délai relativement court,
avec un coût raisonnable. L'échantillonnage constitue une
étape déterminante dans le sens oú les concentrations de
cotinine dépendent du moment du prélèvement et surtout du
délai qui sépare ce prélèvement de la
dernière consommation de cigarette (71). De plus, il convient
d'être vigilant et de se renseigner d'une part sur les prises
médicamenteuses qui peuvent induire des résultats faussement
positifs par suite d'une coélution avec la cotinine, et d'autre part,
sur le régime alimentaire puisque la cotinine peut être
présente dans certains légumes (tomate, aubergine ....) ou
breuvages (thé, café ...) (78,86).
L'application la plus évidente est l'évaluation
du statut tabagique. En effet, dans les études
épidémiologiques générales, il est important de
différencier fumeurs, non fumeurs et fumeurs passifs, et de
contrôler la fiabilité des données rapportées par
les sujets d'étude. Cependant, se pose alors le problème des
seuils à établir et de la référence à
choisir, car on ne peut pas se fonder sur la consommation
alléguée par les sujets puisque c'est cela même que l'on
veut vérifier.
Le dosage de la cotinine urinaire est utile à pratiquer
lors de la 1ère consultation d'un fumeur désireux
d'arrêter de fumer et au terme d'une semaine de traitement, mais n'est
pas indispensable. Il est plus utile a posteriori pour comprendre certaines
erreurs de dosage initial, sachant qu'un taux de substitution > 60 % semble
nécessaire pour supprimer le syndrome de sevrage (pulsion à
fumer, irritabilité,...).
En chirurgie vasculaire, le dosage de la cotinine urinaire a
un intérêt lors des consultations de suivi pour authentifier la
réalité d'un arrêt du tabac et le contrôle d'un
sevrage total avant des gestes d'endartériectomie ou de plastie
vasculaire.
En gynécologie obstétrique, le dosage de la
cotinine urinaire chez les femmes enceintes fumeuses a un double
intérêt : il peut constituer un argument favorisant la motivation
à l'arrêt du tabac et à l'arrêt d'un conjoint fumeur
d'une femme enceinte non-fumeuse, reflétant ainsi la
réalité d'un tabagisme passif certain.
En pédiatrie, le dosage de la cotinine urinaire chez
des enfants asthmatiques peut être un élément de motivation
des parents (2).
CONCLUSION
Le tabac reste un problème majeur de santé
publique en raison notamment des maladies qu'il entraîne à
l'âge adulte, mais également dans l'enfance car malgré les
nombreuses campagnes d'information, le tabagisme reste très
répandu. Les pédiatres doivent être particulièrement
vigilants non seulement sur l'intoxication tabagique de l'adolescent, mais
également sur l'information des parents quant au risque encouru par
leurs jeunes enfants.
Parmi les différents marqueurs biologiques du
tabagisme, nous avons étudié l'intérêt du dosage de
la cotinine urinaire réalisé par une méthode immuno-
enzymatique (Thermo Electron™) adaptée sur automate
multiparamétrique de transfert KonelabTM 30.
Au vu des avantages et inconvénients des
méthodes existantes, il apparaît clairement que les
méthodes colorimétriques doivent être abandonnées au
profit soit des méthodes chromatographiques pour leur
spécificité, soit des méthodes immunologiques pour leur
praticabilité. Les techniques séparatives (HPLC associée
à un détecteur à barettes de diodes ou CPG couplée
à la spectrométrie de masse) allient une grande
spécificité et la possibilité de quantifier les faibles
concentrations urinaires observées chez les fumeurs passifs.
Par comparaison de la cotinine urinaire chez 3 populations de
fumeurs (n = 47), de fumeurs passifs (n = 50) et de sujets non exposés
(n = 50), ce paramètre biologique, en relation directe avec
l'imprégnation nicotinique, s'avère suffisamment sensible pour
l'évaluation du statut tabagique et pour distinguer clairement entre
fumeurs actifs (225,10 ug/umol) et sujets exposés (31,07 ug/umol). Notre
travail révèle également l'existence d'une
corrélation avec la durée d'exposition chez les fumeurs passifs.
Il montre une augmentation de la cotininurie en fonction de la
durée d'exposition avec augmentation notable de ce paramètre
lorsque la durée d'exposition par jour dépasse les trois heures
(43,16 ug/umol). Chez les fumeurs actifs, la cotininurie est influencée
par le nombre de cigarettes fumées. Plus le nombre de cigarettes
consommées est important, plus le taux de cotinine urinaire est
élevé, avec une différence statistiquement significative
de la valeur de la cotininurie entre les sujets fumant 1 à 10
cigarette/jours (145,90ug/umol) et ceux fumant 40 cigarettes/jours
(305,46ug/umol). Nous retrouvons par ailleurs une relation avec
l'ancienneté de l'exposition chez les fumeurs confirmés, et une
corrélation significative entre la présence d'une pathologie
liée à la consommation de tabac et l'augmentation de la
cotininurie. La cotininurie est plus élevée chez les fumeurs qui
présentent des signes pathologiques (244,03ug/umol) que chez les fumeurs
qui ne présentent aucun signe (155,04ug/umol).
La mesure des marqueurs biologiques du tabagisme permet
d'évaluer de façon objective le degré de l'exposition, que
celle-ci soit volontaire comme dans le tabagisme actif ou non comme dans le
tabagisme passif. Le recours au laboratoire devient alors indispensable.
La cotinine libre
urinaire apparaît comme le meilleur marqueur, étant un bon
témoin de l'imprégnation tabagique. De plus, le
prélèvement urinaire est généralement bien
accepté par les fumeurs et sa facilité de recueil le rend
totalement compatible avec une recherche de tabagisme passif dans une
population d'enfants ou de nouveau -nés exposés à la
fumée.
La cotininurie mérite une place de choix dans
l'appréciation objective de l'imprégnation nicotinique et pour le
suivi du sevrage, son évaluation permet l'adaptation
personnalisée de la substitution nicotinique notamment après un
événement clinique ou chez la femme enceinte fumeuse.
La prise de conscience grandissante des dangers du tabagisme
et l'accroissement de l'intérêt des pouvoirs publics pour ce
problème permettent de prévoir, dans un futur proche, une
augmentation de l'utilisation de marqueurs du tabagisme dans toutes leurs
indications. Cela met en évidence l'intérêt d'associer
différents marqueurs tels que les thiocyanates et le monoxyde de carbone
ou la carboxyhémoglobine (HbCO) pour une mesure objective de
l'imprégnation tabagique, avec des études plus approfondies de la
nicotine et de ses métabolites, afin de disposer avec ces marqueurs
urinaires d'un outil fiable et accessible pour l'évaluation du statut
tabagique.
BIBLIOGRAPHIE
1- Gérald C. Le sevrage tabagique.
Actualités pharmaceutiques 1992; 295:35-47.
2- Lagrue G, Cormiers S, Mautrait C. L'aide à
l'arrêt du tabac. J Mal Vasc1999;
24 :263-265.
3- Clemente Jiménez ML, Rubio Aranda E, Pérez
Trullén A, Marron Tundidor R, Herrero Labarga I, Fernandez-Espinar YL.
Determination of nicotine dependence in school-aged smokers through a modified
Fagerström test. An Pediatr 2003 ;
58:538-544.
4- Hirsch A. Tabagisme. Rev Prat 1993;
43 :1195-1235.
5- Mecklenburg RE. Public health issues in treating tobacco
use. Am J Med Sci 2003; 326:255-261.
6- OMS. Tabac et santé. Aide-mémoire
1999; 221.
7- OMS. La lutte contre l'épidémie de tabagisme.
Rapport sur la santé dans le monde. 1999; 73-88.
8- Sobezak A. The effects of tobacco smoke on the homocysteine
level - a risk factor of atherosclerosis. Addiction biology
2003; 8:47-158.
9- Doll R, Hill AB. Mortality in relation to smoking : Ten
years observations of British doctor's. BMJ 2003;
189:118.
10- Turbiana M. Les adolescents et le tabac. La revue des
addictions 2002; 4:757-761.
11- Willers S, Attewell R, Bensryd I, Schutz
A, Skarping G, Vahter M. Exposure to environmental tobacco smoke in the
household and urinary cotinine excretion, heavy metals retention and lung
function. Arch Environ Health 1992 ; 47 :
357-63.
12- Severson HH, Hatsukami D. Smokeless tobacco cessation.
Prim Care 1999; 26:529-551. 13-
Buttross LS, Kastner JW. A brief review of adolescents and tobacco : what we
know and don't know. Am J Med Sci 2003;
326 :235-237.
14- Lisa SC, Nicole LA, Kenneth PT, Kathryn LT. Nicotine
dependence treatment for patients with cancer. American Cancer Society
2003;98:632-643.
15- Tamer SL. Trends and patterns of tobacco use in the United
States. Am J Med Sci 2003;326:248-254.
16- Gordon JS, Severson HH. Tobacco cessation through dental
office settings. Journal of Dental Education 2001;
65:354-362.
17- Jarvis MJ, Primatesta P, Erens
B,Feyerabend C, Bryant A. Measuring nicotine intake in population surveys :
Comparability of saliva cotinine and plasma cotinine estimate. Nicotine and
Tobacco Research 2003; 5:349-355.
18- Schlienger JL, Grunenberger F, Vinzio S, Goichot B.
Thyroïde et tabac : des relations complexes. Ann Endocrinol
2003; 64 :309-315.
19- Terry MD. Cigarette smoke-inducted airway inflammation as
sampled by the expired breath condensate. J Med Sci 2003;
326:174-178.
20- Reynaud M, Schwman R. Diagnostic des adolescents. Rev
Prat 2003; 53 :1304-14.
21- Raherison C, Taytard A, AnnesiMaesano I. Tabagisme, Asthme
et phénotypes associés, Approche épidémiologique.
Rev Mal Resp 2003; 20 :233-247.
22- Prescrire rédaction. Désinformation sur le
tabagisme passif. Prescrire 2001;
21:786-787.
23- Christen AG, Christen JA. The female smoker : From
addiction to recovery. Am J Med Sci 2003
;326:235-237.
24- Guillerm R. La fumée de tabac : composition et
effets. Rev Prat 1987; 28:1403-1406.
25-Chong SA, Tan EC, Tan CH. Smoking and tardive dyskinesia :
lack of involvement of the cyp1A2 gene J Psychiatry Neuro
Sci 2003; 28:185-189.
26-Dennis E, Mc Chargue, Bonnie S. History of depression and
smoking cessation outocome : A meta-Analysis. Journal of
consulting and clinical psychology
2003;71:657-663.
27-Ashley MJ, Cohen J, Ferrence R. Light and mild cigarettes:
who smokers them. Can J Pub Health
2001;92:407-411.
28-Taybos G. Oral Change Associated with Tobacco Use. Am J
Med Sci 2003; 326:179-182.
29-Clare B, Nick S, Sheila B, Christine C, Alan D, Rob M.
Effect of strategies to reduce exposure of infants to environnemental tobacco
smoke in the home : Cross sectional survey BMJ 2003;
327:1-5.
30- Severson HH. What Have We
Learned From 20 Years of Research on Smokeless Tobacco Cessation. Am J Med
Sci 2003; 326:206-211.
31-Conférence de consensus. Arrêt de la
consommation du tabac. J Mal Vasc 1999;
24:309-323.
32- Elbert DG, Penny NG, Thomas JP. Treating nicotine
dependence. Am J Med Sci 2003; 326:183-186.
33- Buxeraud J, Buxeraud B. Zyban® : une
nouvelle approche du sevrage tabagique. Actualités pharmaceutiques
2001; 402: 49-51.
34- Robyn R, Nicholas R. Bupropion for Smoking Cessation.
Drug and Alcohol Rev 2003; 22:203-220.
35- Deniz Yildiz.
Nicotine, its metabolism and an overview of its biological
effects.
Toxicon
2004; 43: 619 -632.
36- Gérard H, Jacob N.
Evaluation de l'imprégnation nicotinique par les marqueurs tabagiques.
Rev Prat - Médecine générale 2003;
17: 504- 506.
37- Dhar P. Measuring tobacco smoke exposure: Quantifying
nicotine/ cotinine concentration in biological sample by colorimetry,
chromatography and immunoassay methods. J of pharmaceutical and Biomed
Analysis 2004; 35: 155 - 168.
38- Meger M, Meger- Kossien I,
Schuler- Metz A, Janket D, Sherer G. Simultaneous detemination of nicotine and
eight nicotine métabolits in urine sof smokers using liquid
chromatography- tandem mass spectrometry. J of chromatogr B 2002;
778: 251-261.
39- Delaveau P. Plantes médicinales. Les
actualités pharmaceutiques 1989; 261:50.
40- Kintz, P. Gas chromatography analysis of nicotine and
cotinine in urine. J of chromatogr 1992, 580:
347-353.
41- James H, Tizabi Y, Taylor R. Rapid method for the
simultaneous measurement of nicotine and cotinine in urine and serum by gas
chromatography-mass spectrometry . J of chromatogr B 1998,
708: 87-93.
42- Gramboulam V. Particularités du tabagisme chez les
adolescents. Rev Mal Resp 1999; 16:19-20.
43-Moye T.P, Charlson J.R, Enger, R.J, Dane L.C, Ebbert J.O,
Schroeder D.R, Hurt R.D. Simultaneous Analysis of nicotine, nicotine
metabolites, and tobacco alkaloids in serum or urine by tandem mass
spectrometry, with clinically relevant metabolic profiles. Clin Chem
2002, 48: 1460-1471.
44- Franello S, Durand C, Bellanger JC, Morel L, Cardinal S,
Mouras Y. Les pharmaciens d'officine et la prévention du tabagisme.
Le concours Médical 1998;
120:2694-2699.
45- C. Larramendy, C.Diviné, S.Asnafi- Faraud,
G.Lagrue. Intèret des diffèrents marqueurs biologique dans
l'évaluation des tabagismes. Path Biol 2004,
52: 164-172.
46- Paris M, Hurabielle M. Abrégé de
matière médicale. Paris : Editions Masson ;
1981.
47-Emmons KM, Swift RM, Monti PM, Rohsenow DJ, Colby SM, Brown
RA et al. Depressive symptoms and readiness to quit smoking among cigarette
smokers in outpatient alcohol treatment. Psychology of addiction
behaviors 2002; 16: 264-268.
48- Stolker, A.L.A.M.; Niesing, W.; Hogendoorn, E.A.; Rambali.,;
Vleeming,W. Determination of nicotine and cotinine
-![]() in rat plasma by liquid chromatography-tandem mass spectrometry.
J of chromatogr A 2003, 1020:
35-43. in rat plasma by liquid chromatography-tandem mass spectrometry.
J of chromatogr A 2003, 1020:
35-43.
49-Gaillard,
Y.;Pepin, G.Testing hair for pharmaceuticals. J of chromatogr B 1999,
733: 231-246.
50-
Jacob N, Lamaire L, Bellini M. Measurement of urinary tobacco markers in a
smoking- Cessation program. Clin chem. 1991; 37:
1655-1656.
51- Phung- Fdskas T, Le moel G, Garelik D, Harault C,
Durand G. Intoxication tabagique: Dosage de la cotinine urinaire.
L'eurobiologiste 1999, 239: 23-27.
52- Parviainen MT, Punhakainen EV, Laatikainen R,
Savolainen K, Herranen J, Barlow LD. Nicotine metabolics in the urine of
smokers. J Chromatogr 1990, 525: 193-202.
53- Robert F S, Hugh M M, and
Gordon A. Assessment of simple colorimetric procedures to determine smoking
status of diabetic subjects. Clin Chem 1998; 44:275-280.
54-Hrtemann
T, Tecunescu D, Oryszczym MP, Hannhart B. Dosage radio immunologique de la
cotinine urinaire: variabilité des mesures, identification des sujets.
Path Biol 1993;42: 269-272.
55-
Kuo HW, Yang GS, Chiu MC. Determination of urinary and salivary cotinine using
gas and liquid chromatography and enzyme - linked immunosorbent assay. J of
chromatogr B 2002, 768: 297-303.
56-
Roche D, Callais F, Reungoat P and Momas I. Adaptation of an enzyme immunoassay
to assess urinary cotinine in non smokers exposed to tobacco smoke. Clin
Chem 2001; 47: 950-952.
57- Tyrpien K, Wielkoszynski T, Janoszska B, Dobosz C,
Bodzek D, Steplewski Z. Application of liquid separation techniques to the
determination of the main urinary nicotine metabolites. J chromatogr A
2000, 870: 29-38.
58-Hariharan M and Vannoord T. Liquid chromatographic
determination of nicotine and cotinine in urine from passive smokers:
comparison with gas chromatography with a nitrogen -Specific detector. Clin
Chem 1991;37: 1276- 1280.
59- Lafnoune N, Philippon C, Khouri K, Lagrue G.
Corrélations entre les différentes méthodes de dosage de
la cotinine. Sem Hop Paris1992; 68: 1310-1311.
60-
Barbier C, Houdret N, Vittrant C, Deschildre A et Turck D. Etude du tabagisme
passif par la mesure de la cotininurie en consultation de protection maternelle
et infantile dans le Nord- Pas - de - Calais. Arch Pediatr 2000;
7: 791-24.
61-
D'Aigremont G. Dosage de la cotinine urinaire par chromatographie liquide
haute performance. L'eurobiologiste 1992; 179: 13-
15.
62- Horstmann M. Simple high - performance liquid
chromatographic method for rapid determination of nicotine and cotinine in
urine. J Chromatogr 1985; 344:391-6.
63- Allena JI, Lawson GM, Anderson R, Dane LC, Croghan
IT and Hurt RD. A new gas chromatography - mass spectrometry method for
simultaneous determination of total and free tans - 3'- hydroxycotinine and
cotinine in the urine of subjjectes receiving transdermal nicotine. Clin
Chem 1999; 45: 85-91.
64-
Jacob N, Berny C, Boyer JC, Capolaghi B, de l'Homme G, Desch G, Garelik D,
Hayder R, Houdret N, Le Moel G, Moulsma M, Plantin-Carrenard E. Dosage de la
cotinine urinaire et des métabolites de la nicotine.
Ann
Biol Clin 2005; 63: 397-409.
65- James H, Tizabi Y, Taylor R.
Rapid method for the simultaneous measurement of nicotine and cotinine in urine
and serum by gas chromatography- mass spectrometry. J Chromatogr B Biomed
Sci Appl 1998; 708:87-93.
66- Torano, J.S, Van Kan H.J.M.
Simultaneous determination of the tobacco smoke uptake parameters nicotine,
cotinine and thiocyanate in urine, saliva and hair, using gaz chromatography
-spectrometry for characterisation of smoking status of recently exposed
subjects. The analyst 2003; 128: 838-843.
67- Feyerabend C, Russell MAH. A
rapid gas liquid chromatographic method for the determination of cotinine and
nicotine in biologicals fluids. J Pharm Pharmacol
1990;42: 450-452.
68- Curvall M, Vala E.K, Enzell
C.R, Wahren J, Simulation and evaluation of nicotine intake during passive
smoking: cotinine measurements in body fluids of non smokers given intravenous
infusions of nicotine. Clin Pharmacol Ther 1990; 47: 42-9.
69- Barlow RD, Stone RB, Wald NJ, Puhakainen EVJ. The direct
barbituric acid assay for nicotine metabolites in urine: a simple colorimetric
test for the routine assessment of smoking status and cigarette smoke intake.
Clin Chem Acta 1987; 165 : 45-52.
70-Parant F, Moulsma M, Lardet G, Flourié F and
Pénés MC. Métabolites urinaires de la nicotine:
évaluation des immunodosages EIA «cotinine » Microgenics et
Immulite 2000 « Métabolites de la nicotine » DPC en
comparaison à la colorimétrie. Immuno- analyse et Biologie
spécialisée 2003; 18: 218-224.
71- Oddoze C, Pauli AM, Pastor J, Rapid and sensitive high-
performance liquid chromatographic determination of nicotine and cotinine in
nonsmokers human and rat urines. J Chromatogr B Biomed Sci Appl 1998;
708: 95-101.
72- Tuomi T, Johnsson T, Reijula K. Analysis of nicotine, 3-
hydroxycotinine, cotinine and caffeine in urine of passive smokers by HPLC-
tandem mass spectrometry. Clin Chem1999; 45: 2164-
72.
73- Benowitz NL, Kuyt F, Jacob P, Jones RT, Osman A-L.
Cotinine disposition and effects. Clin Pharmacol Ther
1983;34:604-611.
74- Benowitz NL, Peyton J. Metabolism of nicotine to cotinine
studied by a dual stable isotope method. Clin Pharmacol Ther 1994;
56: 483-93.
75- Benowitz NL, Kuyt F, Jacob P.
Nicotine and cotinine elimination pharmacokinetics in smokers and non
smokers. Clin Pharmacol Ther 1993; 53: 316-23.
76- SRNT Subcommittee on biochemical verification. Biochemical
verification of tobacco use and cessation. NicotineTob Res 2002;
4: 149-59.
77-Caraballo RS, Giovino GA, Pechacek TF, Mowery PD, Richter
PA, Strauss WJ, et al. Racial and ethnic differences in serum cotinine levels
of cigarette smokers: third National Health and Nutrition Examination Survey.
JAMA 1998; 280: 135-9.
78- Berny C, Boyer JC, Capolaghi B, de l'Homme G, Desch G,
Garelik D, Hayder R, Houdret N, Jacob N, Koskas T, Lainé G, Le Moel G,
Moulsma M, Plantin-Carrenard E, Venembre Ph. Les marqueurs spécifiques
du tabagisme.
Ann
Biol Clin 2002; 60: 263-72.
79- Fakhfakh R, Hsairi, Maalej M, Achour N et Naceur T.
Tabagisme ne Tunisie: comportements et conaissances. Bulletin de
l'Organisation Mondial de la Santé 2002; 7:
60-66.
80-Office national de la famille et de la population. Les
jeunes célibataires au quotidien. Tunis: Office national de la
famille et de la population 1996; 60-66.
81- Lachronique JF. Tabagisme, épidémiologie et
pathologie liée au tabac. Rev Prat 1993; 44:
2781-3.
82- El Gharbi B. Tabac et appareil respiratoire. Ariana:
Institut National de Pneumo- Phtisiologie Abderahmen Mami1984.
83- Leong JW, Dore ND, Shelley K, Holt EJ, Laing IA, Palmer
LJ, et al. The elimination half- life of urinary cotinine in children in
tobacco - smoking mothers. Pulmonary Pharmacology and Theurapeutics 1992;
11: 287- 90.
84- Burguet A, Berad M, Woronoff A-S, Roth P, Menetrier M,
Vanlemmens P, Schaal JP, Menget A. Appréciation du tabagisme maternel et
néonatal par un dosage de la cotinine urinaire par chromatographie
liquide haute performance. J Gynecol Obstet Biol Reprod 2001;
30: 166- 173.
85- Tessier JF, Nejjari C, Bennani- Othmani M. Smoking i
Mediterranean countries: Europe, North Africa AND the Middle East: Results from
a cooperative study. International Journal of tuberculosis and lung
disease1999; 3: 927-37.
86- Davis RA, Stiles MF, De Bethizy JD, Reynolds JH, Dietary
nicotine: A source of urinary cotinine. Food Chem Toxicol 1991;
29: 821-7.
87-Hagan RL, Ramos JM, Jacob PM. Increasing urinary cotinine
concentration at elevated temperatures: the role of conjugated metabolites.
J Pharm Biomed Anal 1997; 16: 191-7.
88- Pierce JP. International comparison of trends in
cigarettes smoking prevalence. Am J of Pub Health 1989;
79: 152-7.
89- Bruckert E, Jacob N, Lamaire L, Truffert J, Percheron F,
de Gennes JL, Relationships between smoking status and serum lipids in a
hyperlipidemic population and analysis of possible confounding factors.
Clin Chem 1992; 38: 169 - 705.
90- Woodward M, Tunstall- Pedoe H, Smith WC, Tavendale R.
Smoking characteristics and inhalation biochemistry in the Scottish population.
J Clin Epidemiolo 1991; 44: 1405-10.
91-Roussel G, Le Quang NT, Miguéres ML, Roche D,
Mongin-Charpin D, Chrétien J, Ekindjian OG. Interprétation des
valeurs de la cotininurie chez les fumeurs non -fumeurs. Rev Mal Resp 1991;
8: 225-232.
92- Schneider JM, Capolaghi B, Briançon S, Covi G,
Merlin JP, Leveau PH. Le tabagisme passif de l'enfant : Son dépistage
par le dosage de la cotinine urinaire. Arch Fr Pediatr 1993;
50: 567- 71.
93- Thomas J. Gould, Allan C. Collins, Jeanne
M. Wehner. La nicotine augmente l'inhibition latente et améliore le
déficit d'inhibition latente induits par l'éthanol. Nicotine
& Tobacco Research 2001 ; 3 : 17-24.
94- Juchet A, Micheou P, Brémont F, Dihou G. Quelle
peut être la place de la pédiatre dans la lutte anti tabac. J
Pédiatrie Puériculture 2001; 14: 104-109.
Annexes n°1 :
Test de Fagerström.
-Dans quel délai après le réveil vous fumez
votre première cigarette ?
- Moins de 5 minutes 3
- 6 à 30 minutes 2
- 31 à 60 minutes 1
- Après 60 minutes 0
-Trouvez -vous difficile de ne pas fumer dans les endroits
interdits ?
- Oui 1
- Non 0
- Quelle cigarette trouvez-vous la plus indispensable
- La première 1
- Une autre 0
- Combien de cigarette fumez-vous par jour ?
- 10 ou moins 0
- 11 à 20 1
- 21 à 30 2
- 31 ou plus 3
- Fumez-vous de façons plus rapprochée dans le
première heure après le réveil que pendant le reste de la
journée ?
- Oui 1
- Non 0
- Fumez-vous si une maladie vous oblige à rester au lit ?
- Oui 1
- Non 0
- Score total
0-2 Pas de dépendance
3-4 Dépendance faible
5-6 Dépendance moyenne
7-8 Dépendance forte
Annexe n°2 : Fiche de renseignement
CHU Fattouma Bourguiba Monastir
Laboratoire de biochimie toxicologie
Protocole de tabagisme
Fiche de renseignement n°...............
-Age
..................Sexe.....................Poids...................Taille.............
-
Origine..............Profession.............................................................
- Niveau de scolarité : Pré- scolaire? Primaire ?
Secondaire ? Supérieur ?
Analphabète ? Autres ?
- Antécédents : · Alcoolisme ?: Consommation
régulière : Oui ? Non ?
Si Oui : Quantité/ jour....................
· Cardio- vasculaire ?
· Pathologie respiratoire ?
- Tabagisme : Oui ? Non ?
? Si Non : Tabagisme passif : Oui ? Non?
Si Oui :
Antécédents familiaux :..................
Lieu
d'exposition : Domicile? Travail ? Café? autres ?
Ancienneté d'exposition ..................
Duré
d'exposition / jour ...................
? Si Oui : Antécédents familiaux du
tabagisme : Père?, Mère?, Fratrie ?, Autres ?
Age au début de
consommation du tabac...........................
Rythme de consommation : nombre
de paquet /jour .............
Effets du tabagisme : Toux?,
Expectoration?, Maladies respiratoires?,
Asthme?, Problèmes cardiaques?, Autres?
Analyses biologiques :
|
Paramètres
|
Résultats
|
|
Cotinine
|
|
|
Créatinine
|
|
Echantillion urinaire prélevé sans
conservateur
Conservation : 4°C, 15 jours
TABLE DES MATIERES
INTRODUCTION
1
PARTIE THEORIQUE
I. RAPPELS SUR LE TABAGISME
4
1. Composition de la fumée du tabac
4
2. La dépendance tabagique
5
2.1 Définition
5
2.2 Mécanisme de la dépendance
tabagique
5
3. Pathologies liées au tabagisme
6
3.1 Les cancers liées au tabac
6
3.1.1 Cancers pulmonaires
6
3.1.2 Cancers de la cavité buccale, du
pharynx, du larynx et de l'oesophage
7
3.1.3 Cancers de la vessie et du rein
7
3.1.4 Autres formes de cancers
7
3.2 Les maladies cardiovasculaires liées au
tabac
7
3.2.1 Les maladies coronaires
7
3.2.2 L'athérosclérose des membres
inférieurs
8
3.3 Les accidents vasculaires
cérébraux liées au tabac
8
3.4 Les maladies respiratoires chroniques
8
3.4.1 Bronchique chronique
9
3.4.2 Emphysème
9
3.4.3 Asthme
9
3.5 Les maladies thyroïdiennes
10
3.6 Risques pathologiques chez la femme
enceinte
10
3.7 Autres effets du tabac
11
4. Tabagisme passif
11
4.1 Risques pathologiques chez les enfants
11
4.2 Les maladies cardiaques
12
4.3 Les maladies respiratoires
12
4.4 Les cancers bronchiques
12
5. Lutte contre le tabagisme
13
5.1 L'aide médicamenteuse au sevrage
tabagique
13
5.1.1 Substitution nicotinique
13
5.1.1.1 Formes orales
14
5.1.1.2 Formes transdermiques ou Patchs
15
5.1.2. Substances non nicotiniques :
ZYBAN®
16
5.1.2.1 Mécanisme d'action
16
5.1.2.2 Effet indésirables et
contre-indications
16
5.2 L'aide non médicamenteuse au sevrage
tabagique
17
5.2.1 Acupuncture
17
5.2.2 Auriculothérapie
17
5.2.3 Les méthodes
psychothérapeutiques
17
5.2.3.1 Psychothérapie de groupe : Plan
de 5 jours
17
5.2.3.2 L'hypnose
17
5.2.3.3 La thérapeutique comportementale
par aversion
17
6. Les marqueurs biologiques du tabagisme
17
6.1 Marqueurs non spécifiques
18
6.1.1 Le monoxyde de carbone (CO)
18
6.1.2 La carboxyhémoglobine
19
6.1.3 Les thiocyanates
19
6.1.4 Le cadmium
20
6.1.5 Autres marqueurs
20
6.2 Marqueurs spécifiques: nicotine,
cotinine et autres métabolites de la nicotine
20
II. NICOTINE ET SON PRINCIPAL METABOLITES : LA
COTININE
21
1. La nicotine
21
1.1 Structure
21
1.2 Caractéristiques de la nicotine
22
1.3 Pharmacocinétique
22
1.3.1 Absorption
22
1.3.1.1 Au niveau des voies respiratoires et de la
bouche
22
1.3.1.2 Au niveau digestif
23
1.3.1.3 Au niveau cutané
23
1. 3.2 Distribution
23
1.3.3 Biotransformations de la nicotine
24
1.3.4 Elimination de la nicotine
28
1.3.5 Mode d'action de la nicotine
28
1.3.5.1. Effets centraux
30
1.3.5.2 Effets périphériques
30
2. La cotinine
31
2.1 Métabolisme de la cotinine
31
2.2. Elimination de la cotinine
32
2.3. Mode d'action de la cotinine
32
III. ANALYSE URINAIRE
33
1. Composition de l'urine
33
2. Particularités de l'analyse urinaire
33
3. Les méthodes de dosage
34
3.1 Méthode colorimétrique
34
3.2 Méthodes immunologiques
35
3.2.1 Test RIA (Radio Immuno Assay)
35
3.2.2 Test ELISA (Enzyme Linked Immunosorbent
Assay)
35
3.3 Les méthodes chromatographiques
35
3.3.1 Chromatographie sur couche mince
35
3.3.2 Chromatographie phase gazeuse
36
3.3.3 Chromatographie liquide haute
performance
36
PARTIE PRATIQUE
I. INTRODUCTION
37
II. MATERIEL ET METHODES
38
1. Matériel
38
1.1 Population d'étude
38
1.2 Recueil des échantillons urinaires
39
1.3 Réactifs utilisés
39
1.4 Appareillage
40
2. Méthodes
40
2.1. Recueil des données
40
2.2. Analyse des données
40
2.3 Méthode de dosage
41
2.4 Expression des résultats
41
2.5 Analyse statistique
41
III. RESULTATS
42
1. Cotininurie et statut tabagique
42
2. Cotininurie chez les fumeurs passifs
43
2.1 Cotininurie selon l'âge
43
2.2 Cotininurie et sexe
44
2.3 Cotininurie et niveau de scolarité
44
2.4 Variation de la cotininurie en fonction de la
durée d'exposition
45
2.5 Variation de la cotininurie en fonction de
l'ancienneté de l'exposition
46
3. Etude de la cotininurie chez les fumeurs
47
3.1 Cotininurie selon l'âge
47
3. 2 Cotininurie et sexe
48
3.3. Cotininurie et niveau de scolarité
49
3.4 Variation de la cotininurie en fonction de
l'ancienneté de l'exposition
50
3.5 Variation de la cotininurie en fonction du
nombre de cigarettes consommées par jour
51
3.6 Cotininurie et consommation d'alcool
53
3.7. Cotininurie et données cliniques
54
3.7.1 Traduction clinique du tabagisme
54
3.7.2 Conséquences cliniques du
tabagisme.
54
VI. DISCUSSION
56
CONCLUSION
66
BIBLIOGRAPHIE
68
| 


