|
É?ÈÚÔáÇ
É?ØÇÑÞã?ÏáÇ
É?ÑÆÇÒÌáÇ
É?ÑæãÌáÇ
République Algérienne Démocratique et
Populaire
íãáÚáÇ
ËÍÈáÇ æ
íáÇÚáÇ
ã?áÚÊáÇ
ÉÑÇÒæ
Ministère de l'Enseignement Supérieur et de la
Recherche Scientifique
|
- ÉáÌáÇ -
ÑæÔÇÚ äÇ?Ò
|
?????
|
Université ZIANE ACHOUR - Djelfa -
'14áÇ æ
ÉÚ?ÈØáÇ
ãæáÚ ????
Faculté des sciences de la nature et de la
vie
Département d'Agrovétérinaire

MÉMOIRE
En vue de l'obtention du diplôme
d'Ingénieur d'Etat en Agropastoralisme
THÈME
Etude comparative entre les miels locaux et les
miels importés
Présenté par : Mr. GUERZOU Mohamed Nabil
et Mr. NADJI Noureddine
Devant le jury :
Mr. HAMIDI Mohamed Maître assistant U.Z.A Djelfa
Président
Mlle. MEKIOUS Scherazad Maître assistante U.Z.A
Djelfa Promotrice
Mr. ADLI Benziane Maître assistant U.Z.A Djelfa
Examinateur
Mme. NAAS Oumsaad Maître assistante U.Z.A Djelfa
Examinatrice
Promotion 2004-2009
?????? ?????? ?? ???
????? ?? ???????? -????? ????????
?????????? -??? ???????? ???? ??a????? ?????
?????? ???a?????
????
-6 6
?
?? ??? ? ?
)
68
(
?? ??????????????????????????????????????????????
?????????????????
|
??a?????
|
???íóÂ?? ?????? ???
|
???? ???????? ñÁÇ???? ?????
??????????? ?????????? ??????? ??????????
?
)
69
(
?????????????
. ????? ???? ?? 69 68
??????
«O Prophète, ton Seigneur a inspiré aux
abeilles leur mode de vie et leurs moyens de subsistance. Il leur a
inspiré de prendre les cavernes des montagnes, les cavités des
arbres et les treilles pour demeures. 68-Puis Allah - qu'Il
soit exalté- leur a inspiré de se nourrir de tous les fruits des
arbres et des plantes; Il leur a rendu disponibles, à cette fin, des
moyens que leur Seigneur leur avait préparés et rendus faciles.
De leurs entrailles sort un liquide de différentes couleurs, qui apporte
une guérison pour les hommes. Il y a dans cette chose merveilleuse des
preuves évidentes de l'existence d'un Créateur Tout-Puissant et
Sage, pour un peuple qui réfléchit pour en tirer profit et gagner
ainsi un bonheur permanent.69" (Sourate El Nahl verset 68 -
69)
Dédicaces
Je Dédie ce travail à mes très chers
parents, ma mère Arabia et
mon père Abderrahmane, pour leur
amour, leur patience et leur
encouragement avec toute ma gratitude et mon
amour. Ce travail
est dédié, à mes frères:
Ahmed, kadi, Hocin, Rabah et Mohamedet
mes soeurs: chahrazad, khadidja,
fatima, kaltoum et hadda. A mes
très chers neveux Iyad et
Meriouma.
A tous mes oncles : Hamid, Djamel, et rabeh, Ahmed et
tantes,
cousin et cousines. Et a l'âme de mon oncle Ahmed
A mon collègue Guerzou Mohamed Nabil
Aux tous mes amis surtout : Nadjib, Telli, Abdou,
Dahmane,
Ammar, Ali, Oussama, Hamid, chine, salim et hmida,
Et à toute la promotion cinquième année
agropastoralisme
2008/2009.
NADJI Noureddine
Je dédie ce travail à l'âme de mon grand
père Mohamed ben
Mganni. À mon très cher père
Tayab, ma chère mère Hadjira, qui
ont sacrifié leur vie
pour moi, et qui ont été mon repère, merci
pour leur
amour, affection et patience. À mon grand père Taleb
Ahmed.
À mon frère Abdou et mes soeurs Imène, Fatima, Loubna.
À mon collègue Nadji Noureddine.
À tous mes amis surtout : Nadjib, Telli, Dahmane,
Abdelbaki,
Ammar, Mohamed Chine, Salim, Maâmar D, et Faiza Hadjadj.
À toute la promotion cinquième année
agropastoralisme
2008/2009.
Remerciement
Avant tout, nous remercions ALLAH le tout puissant qui nous a
donné le courage ; la volonté et la patience pour faire ce
travail.
Au terme de ce travail, il m'est agréable de remercier
vivement tous ceux qui, grâce à leur aide précieuse, ont
permis la réalisation de ce travail.
Nous remercions particulièrement:
Mlle MEKIOUS Scherazad, pour avoir proposé et
dirigé ce travail et pour ses conseils et ses orientations tout au long
de ce travail. Et nous la remercie vivement pour sa gentillesse.
Mr HAMIDI Mohamed Maître assistant à
l'Université Ziane Achour de Djelfa et notre professeur durant la
graduation pour ces aides et ces conseils et d'avoir d'accepté
d'être le président de jury.
Nous exprimons nos gratitudes :
À Mr. ADLI Benziane d'avoir
accepté d'examiner ce modeste travail ainsi qu'à
MmeNAAS Oumsaad, pour l'honneur qu'elle a mis à notre
disposition les photos des grains de pollen qui nous aident dans l'analyse
pollinique, et ainsi d'avoir acceptée d'examiner notre travail.
Nos remerciements vont également à :
Les Apicultures Mr Najem Ahmed et Mr
Bouzaine d'avoir fourni aimablement les échantillons de miel de la
région de Messâad et de Aïn Oussara.
Tout le personnel de laboratoire de faculté de
S.N.V de l'université de Ziane Achour de Djelfa et tout le personnel de
laboratoire d'analyse de miel à L'I.T.E.L.V. à Baba Ali -
Alger.
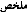
|
?? ?????
|
10
|
???? áÓÚáÇ ????? ??
|
?????
|
14 ??? ??????? ? ?????????? ? ??????????? ???????? ??? ???? ?
ÇäÜ????
|
??????
|
???????
ÉíÆÇÈÑåßáÇ
???????? ÉíÖæã?? ????????
:4?? ??????? ???? ??? ????? ??????? ????? ?? ????? ?
????? ?????
????? ???? ???? ?????? ???? ? ???? ? ???? ????? ?
áÇÑæÑæ ?????????????? ? ?????????
ÁÇ?? ???? ÉíÆæÖáÇ
|
?????? ? ????? ??? ?? ?
|
(??????)
|
. ?????? ????? ???? ? ??k? ?? ??????? ??? ?
????????
?????? ???????? ??????? ?????? ????? ????? ????? ???? ?? ???? ??
?????? ??? ??
|
?? ????'?? ?????????? ???? ??????? ????? ????? ??? ??? ??? ???
.?s??? ??? ?? ????????? ?????? '??
|
. ????????? ??????? ?? ????? 4???
|
?????? ??? ?? ??? ???? áÇÑæ???
?????????????? ?? ??????
|
????? ?? ???????
|
ÏÑæÊÓã ???
íáÍã ???
Ñ?ÛÊãáÇ ?????
íÚáØ ????? íÆÇ?ã?ß
????? íÆÇ?Ò? ????? ÉÏæÌ
áÓÚ
:É?ÍÇÊãáÇ
ÊÇãáßáÇ
.áÇÑæÑæ
á?Ë?ã?ÓßæÑÏ?
ÉÏæÌáá
É?ãáÇÚáÇ
Ñ??ÇÚãáÇ
Résumé
Notre travail consiste à faire des analyses
physicochimiques et polliniques sur 14 échantillons de miel, dont 10
sont des miels locaux et les 4 autres sont des miels importés
retrouvés dans le commerce. Durant notre expérimentation, nous
avons effectué les analyses suivantes: la densité, le pH, la
conductibilité électrique, l'absorbance, la teneur en eau, la
teneur en protéines, le taux de l'HMF, et le taux de
l'acidité. Nous avons aussi essayé d'identifier
la quantité et la nature des grains de pollens contenues dans ces
échantillons de miels.
A travers ces analyses, nous avons remarqué que tous
les miels locaux répondent aux normes requises du Codex
alimentarus (2001), ils sont naturels n'ayant subis aucun traitement
technologique qui pourra nuire à leurs qualités. Par contre,
certains miels introduits sont des miels ultrafiltres avec un taux d'HMF
très élevé, cela nous indique que ces miels sont vieux
ayant subis un traitement de la chaleur.
Mots clés : miel, qualité,
analyse physique, analyse chimique, analyse pollinique, analyse de la variance,
miel local, miel importé, normes internationales,
hydroxyméthylfurfural.
Sammury
Our work consists in making the physical, chemical and
pollinical analysis, on 14 samples of honey, of which 10 are local honeys, and
the 4 others are the imported honeys, recovered in the trade. During our
experimentation, we did the following analysis: the density, the pH, the
electric conductibility, the absorbance, the content in water, the content in
proteins, the rate of the HMF, and the rate of the acidity. We also tried to
identify the quantity and the nature of the grains of pollens contained in
these samples of honeys.
By this analysis, we noticed that all local honeys answer the
norms required of the Codex alimentarus (2001), they are natural not having
undergone no technological treatment that will be able to harm to their
qualities. On the other hand, some introduced honeys are ultra-filtred honeys
with a very elevated HMF rate, it indicates us that these honeys are old having
undergone a treatment of the heat.
Liste des igures
Figure 1: Origine du miel (J.PROST, 1987) 8
Figure 2: Composition moyenne du miel (LOUVEAUX, 1985)
11
Figure 3 : Extracteur centrifuge à moteur
électrique (PROST 1987) 22
Figure 4 : Miel semence en réserve, (Maurice MARY, 2008)
24
Figure 5: Processus de la formation de l'HMF
36
Figure 6 : Le protocole expérimental
49
Figure 7 : Préparation des Solutions du miel
50
Figure 8 : Le pH-mètre utilisé
50
Figure 9 : Le conductimètre électrique
utilisé 51
Figure 10 : Refractomètre spécial pour le miel
52
Figure 11 : Centrifugeuse de type SIGMA 55
Figure 12 : Les calibres de la Centrifugeuse
55
Figure 13 : Solution du miel après centrifugation (le
dépôt de pollens) 56
Figure 14 : Lames préparées et
séchées 56
Figure 15 : Microscope optique a appareil photo numérique
56
Figure 16 : Représentation graphique des valeurs de la
densité 58
Figure 17 : Représentation graphique des valeurs du pH
59
Figure 18 : Représentation graphique des valeurs de la
conductibilité électrique 61
Figure 19 : Représentation graphique des valeurs de
l'absorbance 62
Figure 20 : Représentation graphique des valeurs de la
teneur en eau 63
Figure 21 : Représentation graphique des valeurs de la
teneur en protéines 65
Figure 22 : Représentation graphique des valeurs de
l'acidité 66
Figure 23 : Représentation graphique des valeurs de la
teneur en HMF 68
Figure 24 : Vue microscopique des grains de pollen du miel
n°1 (g×100) 69
Figure 25 : Vue microscopique des grains de pollen du miel
n°1 (g×40) 69
Figure 26 : Vue microscopique des grains de pollen du miel
n°2 (g×100) 70
Figure 27 : Vue microscopique des grains de pollen du miel
n°2 (g×40) 70
Figure 28 : Vue microscopique des grains de pollen du miel
n°6 (g×100) 70
Figure 29 : Vue microscopique des grains de pollen du miel
n°6 (g×100) 70
Figure 30 : Vue microscopique des grains de pollen du miel
n°6 (g×40) 71
Figure 31 : Vue microscopique des grains de pollen du miel
n°4 (g×40) 71
Figure 32 : Vue microscopique des grains de pollen du miel
n°4 (g×100) 71
Figure 33 : Vue microscopique des grains de pollen du miel
n°5 (g×40) 72
Figure 34 : Vue microscopique des grains de pollen du miel
n°5 (g×40) 72
Figure 35 : Vue microscopique des grains de pollen du miel
n°7(g×40) 72
Figure 36 : Vue microscopique des grains de pollen du miel
n°7(g×40) 72
Figure 37 : Vue microscopique des grains de pollen du miel
n°12 (g×40) 73
Figure 38 : Vue microscopique des grains de pollen du miel
n°12 (g×40) 73
Figure 39 : Vue microscopique des grains de pollen du miel
n°12 (g×100) 73
Figure 40 : Vue microscopique des grains de pollen du miel
n°10 (g×100) 74
Figure 41 : Vue microscopique des grains de pollen du miel
n°10 (g×100) 74
Figure 42 : Vue microscopique des grains de pollen du miel
n°10 (g×100) 74
Figure 43 : Vue microscopique des grains de pollen du miel
n°3 (g×40) 75
Figure 44 : Vue microscopique des grains de pollen du miel
n°3 (g×40) 75
Figure 45 : Vue microscopique des grains de pollen du miel
n°11 (g×40) 75
Figure 46 : Vue microscopique des grains de pollen du miel
n°11 (g×100) 75
Figure 47 : Vue microscopique des grains de pollen du miel
n°13 (g×40) 76
Figure 48 : Vue microscopique des grains de pollen du miel
n°13 (g×40) 76
Figure 49 : Vue microscopique des grains de pollen du miel
n°14 (g×40) 76
Liste des tableaux
Tableau 1 : Les différents facteurs de la production
mellifère, (BELAID, 1997) 9
Tableau 2 : Propriétés et indications
thérapeutiques plus spécifiques attribuées aux
principaux miels unifloraux. (DONADIEU, 1984)
18
Tableau 3 : Principales caractéristiques de miel de nectar
de Lavande 29
Tableau 4 : Exemple d'un bulletin
d'analyse d'un miel
d'Algérie 30
Tableau 5 : Table de CHATAWAY (1935) 33
Tableau 6 : Constituants minéraux du miel
34
Tableau 7 : Les valeurs de l'acidité de
quelques miels 38
Tableau 8 : Norme concernant la qualité du miel (Codex
Alimentarius et l`UE) 44
Tableau 9 : Teneur en sucre et CE: Proposition
d`une nouvelle norme 45
Tableau 10: Présentation des échantillons du miel
étudiés 48
Tableau 11 : Les valeurs de la densité
58
Tableau 12 : Les valeurs du pH obtenus 59
Tableau 13 : Les valeurs de la conductibilité
électrique 61
Tableau 14 : Les valeurs de l'absorbance
62
Tableau 15 : Les valeurs de la teneur en eau des
échantillons 63
Tableau 16 : Les valeurs de la teneur en protéines
65
Tableau 17 : Les valeurs de l'acidité
libre 66
Tableau 18 : Les valeurs de l'HMF
61
Tableau 19 : Le spectre pollinique de 14 échantillons
61
Liste des Annexes
Annexe 1 : Résultats de
l'analyse statistique: ANOVA et test Newman-Keuls
87
Annexe 2 : Quelques photos de pollen de
référence 92
Annexe 3 : Méthode de BIURET de dosage
des protéines 96
Liste des abréviations
Abs : Absorbance Ac L :
Acidité libre
CE : Conductibilité électrique
°C : Degré Celsius E. Type :
Ecart type Ech : Echantillon
g : Gramme
h: Heure
HMF : Hydroxyméthylfurfural
Kg : Kilogramme Meq:
Milliéquivalents
mg: Milligramme ml:
Millilitre
N°: Numéro
pH : Potentiel
d'hydrogène
Prot : Protéines
SAB : Sérum d'albumine
bovin
T.eau : Teneur en eau Var :
Variance
Sommaire
1. Introduction 2
PARTIE BIBLIOGRAPHIQUE
Chapitre I.
Le miel : généralités, composition et
propriétés
1. Définition 6
2. Origine 6
2.1. Origine directe 6
2.2. Origine indirecte 7
3. Formation du miel 10
4. Composition et propriétés de miel
10
4.1. Les types des miels 10
Les miels monofloraux (unifloraux) 11
Les miels multifloraux (polyfloraux) 11
4.2. Composition chimique du miel 11
4.2.1. Les éléments majeurs 12
A) L'eau 12
B) Les Glucides 12
4.2.2. Les éléments mineurs 12
A) Les acides 12
B) Les protéines 13
C) Matières minérale 13
D) Les enzymes 13
E) Les vitamines 14
F) Les substances aromatiques 14
G) Matières pigmentaires 14
H) Les lipides 14
4.3. Les propriétés physiques du miel
14
4.3.1. La Densité 14
4.3.2. La Viscosité 15
4.3.3. La Chaleur spécifique 15
4.3.4. La Conductibilité thermique 15
4.3.5. La Conductibilité électrique
15
4.3.6. Indice de réfraction 16
4.3.7. Coloration 16
4.3.8. Le pH 16
4.3.9. Turbidité 16
4.3.10. Fluorescent 16
4.3.11. Pouvoir rotatoire 16
4.3.12. Solubilité 17
4.3.13. La Cristallisation 17
4.4. Les propriétés biologiques du miel
17
4.4.1. Valeur alimentaire et diététique
17
4.4.2. Valeur thérapeutique 17
4.5. Propriétés organoleptiques
19
4.5.1. Couleur 19
4.5.2. Odeurs 19
4.5.3. Goûts 19
Chapitre II. Technologie du miel
1. La récolte du miel 21
1.1. Enlèvement des cadres
21
1.2. L'extraction de miel 21
1.3. La maturation de miel 22
2. Le conditionnement de miel 23
3. Pasteurisation de miel 23
4. Le contrôle de la cristallisation
23
5. Emballage et étiquetage 24
6. Principales transformations physiques et chimiques du miel
25
6.1. La cristallisation 25
6.2. La fermentation 25
Chapitre III. Analyse du miel
1. Les tableaux de références
28
2. Les bulletins d'analyses
28
3. Description de principales données
d'analyse 31
3.1. Analyse physique 31
3.1.1. La Densité 31
3.1.2. La Conductibilité électrique
31
3.1.3. Le pH 32
3.2. Analyse chimique 32
3.2.1. La teneur en eau 32
3.2.2. La teneur en cendres 33
3.2.3. Le Dosage des sucres 34
3.2.4. Rapports Glucose/eau et Fructose/Glucose
35
3.2.5. L'hydroxyméthylfurfural (HMF)
35
3.2.6. Le Dosage des protéines 36
3.2.7. L'acidité 37
3.2.8. L'Activité diastasique (ou
enzymatique) 38
3.4. La melisso-palynologie 39
Les méthodes utilisées en mélissopalynologie
39
3.4.1. Méthode classique 40
3.4.2. Méthode d'acétolyse
41
3.3. L'analyse sensorielle 41
3.3.1. La Couleur 42
3.3.2. La Granulation 42
4. Qualité de miel et normes internationales
42
4.1. La qualité du miel 42
4.1.1. Facteurs essentiels de composition et de qualité
42
4.1.2. Les normes internationales relatives aux miels
43
- Projets du Codex Alimentarius et de l'UE relatifs aux normes
pour le miel 43
PARTIE EXPERIMENTALE
Chapitre IV. Matériels
et méthodes
1. Le choix des échantillons de miel
48
2. Le Protocole expérimental 49
3. L'Analyse physique 50
3.1. La densité 50
3.2. Le pH 50
3.3. La conductibilité électrique
51
3.4. L'absorbance 51
4. L'Analyse chimique 51
4.1. Teneur en eau 51
4.2. Degré brix 52
4.4. Dosage des protéines 52
4.5. La détermination de l'acidité
53
4.5. La détermination de teneur en HMF
53
5. L'Analyse pollinique 54
6. L'Analyse Statistique 56
Chapitre V. Résultats et discussions
1. L'Analyse physique 58
1.1. La densité 58
1.2. Le pH 59
1.3. La conductibilité électrique
60
1.4. L'absorbance 61
2. L'Analyse chimique 63
2.1. Teneur en eau 63
2.2. Dosage des protéines 64
2.3. L'acidité 66
2.4. La teneur en HMF 67
3. L'Analyse pollinique 69
Conclusion 79
Bibliographie 82
Annexes 87
Introduction
Introduction
La production des miels en Algérie reste très
inférieure par rapport aux potentialités mellifères
existantes. La douceur relative du climat, et la présence de ces
ressources naturelles très variées des zones rurales du littorale
ainsi des zones steppiques pourrait pourtant nous offrir la possibilité
de développer la production nationale des miels, et
d'éviter par ailleurs les importations massives en
cette matière surtout en absence des normes nationales de
qualité, ce qui favorise les fraudes et engendre une dévaluation
des miels de terroir face à ceux importés.
Il important de signaler que pour produire un kilogramme de
miel, une abeille peut butiner 500 000 fleurs dans un rayon de trois
kilomètres et donc rapporter de nombreuses substances dans la ruche. Les
enjeux actuels de telles recherches en amont sont bien sûr
d'ordre économique et environnemental, les apiculteurs
sont soucieux de préserver l'image d'un miel pur et naturel. Ils
souhaitent pouvoir garantir aux consommateurs la qualité de leur produit
et être en mesure de contrôler la composition de leurs miels. Ainsi
le vide juridique en matière d'importations du miel nous rend fragile
devant l'ouverture du marché internationale ainsi nous nous pouvant en
aucun cas être rigoureux en matière de contrôle de
qualité.
Notre modeste travail pourra s'inscrire comme une contribution
de l'étude des qualités des miels locaux et leurs
caractéristiques tout en les comparant avec quelques miels
importés trouvés dans le commerce. En absence de normes de
qualité des miels nationales nous nous sommes référer aux
normes du codex alimentarius, par ailleurs nous avons effectué des
analyses physico-chimiques et polliniques sur quelques échantillons de
miel provenant des différentes régions : de la Wilaya de Djelfa
(Messâad, Ain el bel...), de la région de Mitidja (Boufarik), et
pour les miels importés nous avons trouvé dans commerce des miels
de provenance d'Espagne, d'Arabie Saoudite, d'Inde et du Mali.
En plus de la valorisation de la qualité des miels locaux, notre travail
d'analyse permet aussi à la profession apicole d'améliorer les
techniques apicoles et agricoles et de préserver ainsi la pureté
de leurs produits.
Généralement, un apiculteur qui fait analyser un
miel de sa production (ce qui est très rare en Algérie) cherche
à connaitre son origine florale et ça qualité, tandis que
le consommateur voudra plutôt savoir si le miel qu'il a
acheté est pur ou falsifier, Le miel est
considéré comme un aliment essentiel pour ses
qualités nutritionnelles et thérapeutiques. Pour cela, il existe
certain nombre de critères sur lesquels repose la qualité des
miels à savoir la coloration, la teneur en eau, les sucres, le pH,
l'acidité, taux
d'hydroxyméthylefurfural, critère très
important pour juger la qualité d'un miel.
Un autre critère très important qui juge sur la
qualité d'un miel et peut transformer ce produit noble à la
consommation en un produit impropre et d'un danger énorme sur la
santé public, il s'agit de vérifier la présence
d'antibiotiques dans les miels d'importations et de déterminer la teneur
et la nature des composés chimiques contenus dans ces miels. Dans notre
étude nous n'avons pas pu aborder ce genre d'analyse par faute de
moyens. Nous souhaitant dans des prochaines travaux de recherche d'aborder tous
les types d'analyses qui se rapporte à la qualité de miel et de
pouvoir ainsi constituer une base de données pour améliorer la
qualité de nos miels et de pouvoir contrôler les miels qui rentre
dans notre pays.
Partie
Bibliographique
Premier
Chapitre
Le miel :
généralités,
composition,
et propriétés
Chapitre I. Le miel : généralités,
composition, et
propriétés
1. Définition:
Dans de nombreux pays, la loi fourni une définition
légale du miel. Cette dernière a pour objet la protection du
consommateur contre les différents types de fraudes susceptibles
d'être pratiqués (LOUVEAUX, 1968).
Le Codex alimentarius définit le miel comme suit
:
<< Le miel est la substance naturelle
sucrée produite par les abeilles "Apis
mellifera" à partir du nectar des plantes ou
à partir des sécrétions provenant de parties vivantes de
plantes ou à partir d'excrétions d'insectes butineurs
laissées sur les parties vivantes de plantes, que les abeilles butinent,
transforment en les combinant avec des substances spécifiques qu'elles
sécrètent elles-mêmes, déposent,
déshydratent, emmagasinent et laissent affiner et mûrir
dans les rayons de la ruche >> (Codex, 2001).
2. l'origine du miel :
Selon PROST (1987), le miel vient des plantes par
l'intermédiaire des abeilles. Et cela à partir
du nectar recueilli dans la fleur, ou du
miellat recueilli sur les plantes, selon
qu'il vient du nectar ou du miellat, il existe
l'origine directe et indirecte.
(figure n° 1)
2.1. L'origine directe:
Le nectar est un liquide sucré et mielleux, il se
produit à la surface des parties spéciales appelés
nectaires, qui sont en forme de turgescences, situés soit sur les
feuilles, appelés nectaires Extrafloraux, soit sur les
fleurs, (sépales, pétales, carpelles) appelés nectaires
Floraux, retrouvés par exemple chez la plante de Thym.
Pour recueillir un litre de nectar, on estime qu'il faut entre
20000 et 100000 voyage des abeilles (GONNET, 1982, DONADIEU, 1984, LOUVEAUX,
1968, ZIEGLER, 1968).
La composition du nectar
Le nectar est le résultat de plusieurs transformations
biochimiques complexes dues au métabolisme de la plante, ces
transformations sont à l'origine des différents
goûts retrouvés dans les miels.
Les principaux constituants du nectar sont
l'eau et les sucres (saccharose, glucose, fructose). Selon
ZIEGLER (1968), la teneur en eau est fortement variable de 20 à 95%, et
cela
selon les espèces et selon les facteurs de
l'environnement (météorologiques, situation
géographique,...), le nectar contient aussi des acides organiques, des
acides aminés des protéines, des enzymes des vitamines et des
substances aromatiques. Ces substances sont présentes en faible
quantité ne dépasse pas 1%, la composition en sucres est
relativement fixe pour une espèce ou même pour une famille
botanique donnée.
LOUVEAUX (1982), distingue trois grands groupes de plantes
suivant la nature des sucres :
- Groupe de saccharose dominant.
- Groupe de saccharose en quantité égale en glucose
et en fructose. - Groupe de glucose et fructose dominant.
Le rapport glucose/fructose est généralement
variable selon les espèces. Chez le colza (brassicaceae), la
teneur en glucose est supérieure au fructose, ce qui provoque la
cristallisation rapide du miel, chez thym (laminaceae), la teneur en
fructose est supérieure au glucose, ce qui rend le miel liquide.
Le nectar attire les abeilles qui le récoltent et le
ramènent à la ruche. C'est par cette
dernière pendant la collecte du nectar, que s'effectue
la pollinisation des fleurs (GONNET, 1982).
2.2. L'origine indirecte:
Le miellat est un produit plus complexe que le nectar faisant
intervenir un intermédiaire, généralement, des insectes de
la famille des Homoptères tel que les pucerons, leur pièces
buccales sont disposées pour piquer et absorber les aliments liquides
telle que la sève des végétaux et rejettent
l'excèdent des matières sucrées sous
forme des gouttelettes, que les abeilles récupèrent sur les
feuilles des plantes. Nous citons quelques exemples d'arbres
qui hébergent les pucerons, tels que, les sapins, les Epicéas,
les chênes, et aussi les plantes herbacées comme les
blés... (VACHE, GONNET, 1985).
Les miellats représentent une ressource alimentaire
importante pour les abeilles lorsqu'elles ne trouvent pas une
autre source alimentaire. Certain auteur distinguent deux types de miellat :
Le miellat de puceron, et le miellat végétal qui
se produit dans les journées chaudes à sécheresse
prolongée séparée par des nuits relativement froides et
humides, selon Gonnet, 1985, en conditions particulières et en absence
de tous pucerons par exsudation des feuilles à travers des orifices
stomatiques.
Ces miellats sont récoltés par les abeilles
qu'en absence des fleurs à leur disposition, et que
même certain auteur tel que BONNIER (1927), signalent que le miel qui en
résulte du miellat est de mauvaise qualité, par suite de la
présence des gommes et dextrines.
Composition du miellat
D'après KLOFT (1968), Le miellat des
pucerons est composé généralement des sucres le
mélizitose, le glucose, et dextrine et de gommes, de protéines et
d'acides aminés, de vitamines tel que la thymine et la
biotine, de minéraux et d'acides organiques (acides
nitriques et acides maliques).
MAURIZIO cité par ZIGLER (1968), indique que les
espèces suçant une même plante peuvent emmètre
chacune un miellat particulier et de composition chimique différente.
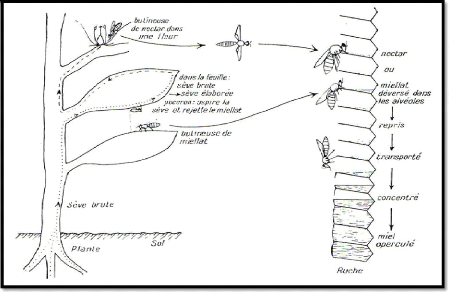
Figure 1: Origine du miel (J.PROST, 1987)
Tableau 1: Les différents facteurs de la
production mellifère, (BELAID, 1997).
|
Les différents facteurs
|
Observations
|
Auteurs
|
|
Moment de la journée
|
De nombreuses fleurs fournissent du nectar surtout le matin
(exemple Helianthus, Origanum, Salvia) et le soir (Tilia)
|
A.MAURIZIO (1979 a)
|
|
Humidité de l'air
|
- Si l'humidité de
l'air est élevée, le nectar est
généralement sécrété en grande
quantité mais contenant un peu du sucre. - En air sec, le nectar diminue
mais la concentration en sucre augmente. Ce phénomène est
dû à l'effet hygroscopique du sucre contenant
dans le nectar.
|
A.MAURIZIO (1979 a)
|
|
Température
|
La sécrétion nectarifère ne commence pas au
dessous de certaine température, le seuil critique varie selon les
espèces : Tilleul et sainfoin 15°C, Trifoluim
repens 23°C.
|
CRANE
(1979 b)
|
|
Nature du sol
|
Le volume du nectar varie avec la texture du sol, une même
plante peut être nectarifère sur un sol calcaire et
l'être beaucoup moins sur un sol siliceux ou
inversement.
Exemple: la moutarde blanche a donné plus de nectar sur
les terrains calcairo-sableux et calcaires que sur les terrains argileux.
|
GLAYENS et G.BONNIER (1927)
|
|
Humidité du sol
|
La quantité du nectar augmente avec la quantité
d'eau absorbée par les racines. Elle atteint 45
à 75 %.
|
A.MAURIZIO (1979 a)
|
|
Les fumures organiques
ou minérales
|
· Les engrais phosphatés ou potassiques favorisent
la floraison donc la sécrétion nectarifère alors que
l'azote nuit la floraison.
· L'addition du calcium et
magnésium a un effet positif sur Trifolium pratens, mais
n'a pas d'effet sur Brassica napus
var. oleifera et Phacelia.
|
E.RABIET (1984)
|
|
Le climat
|
La même plante peut être mellifère dans une
contrée et ne pas l'être dans une autre. Le
trèfle blanc est beaucoup plus mellifère en Angleterre
qu'en France. Il l'est
d'avantage dans le Nord que dans le Midi de la France.
|
J.PROST (1972)
|
|
Latitude et Altitude
|
La puissance mellifère d'une plante
augmente avec la latitude.
Une même plante produit beaucoup plus de nectar en altitude
que dans la plaine,
|
G. LAYENS, G.BONNIER (1927)
et R.SIGNORINI (1978).
|
|
Intensité du butinage
|
Si une fleur est visitée par les abeilles, elle aura
produit plus de nectar que si elle n'avait pas
été visitée.
|
G.LAYENS et G.BONNIER (1927).
|
3. Formation du miel:
Selon GONNET (1982), le miel est produit par les abeilles
selon le processus suivant : le nectar est prélevé par les
abeilles butineuses, qu'elles emmagasinent dans leur jabot
avec la salive, elles transforment le saccharose en sucre simple (fructose,
glucose) selon la réaction chimique suivante sous
l'action de Gluco-invertase :
h + ' +
C H O I H O ? C H O + C H O
Dans le même temps, les abeilles réduisent la
teneur en eau de la solution sucrée à un taux avoisinant 50%, de
retour à la ruche, les butineuses transfèrent leurs
récolte à des ouvrières
d'intérieur, ces dernières par
régurgitations successives complètent et terminent la
transformation commencée. Puis, vont dégorger ce liquide sur des
grandes surfaces dans des alvéoles disponibles sur les rayons de
cire.
La solution sucrée transformée, contenant
encore environ 50% d'eau, va subir une nouvelle concentration
par l'évaporation, qui s'effectue sous
le double influence d'une part, de la chaleur régnant
dans la ruche qui est de l'ordre de 36 à 37
°C, d'autre part, par la ventilation qui
est assurée par les abeilles ventileuses, en créant un puissant
courant d'air ascendant dans la ruche par un mouvement
très rapide des ailes. Au bout de quelques jours, cette solution
contiendra en moyen 18% d'eau, et 80% des sucres. Cette
solution représente le miel stocké dans les cellules. Ces
dernières, une fois remplies, sont cachetées par un mince
opercule de cire, permettant une excellente conservation (GONNET, 1982,
DONADIEU, 1984).
Selon EMMANUELLE (1996), la quantité emmagasinée
dans la ruche est largement supérieure aux besoins immédiats de
la colonie, l'abeille possède un fort instinct de stockage.
4. Composition et propriétés de miel :
4.1. Les types des miels:
Il existe nombreuses variétés de miel qui peuvent
être classées de façon diverses :
1. Le miel varie selon l'origine florale, il
existe donc deux grandes variétés de miel en fonction de
l'origine sécrétoire : miel de nectar et le miel
de miellat.
2. La détermination de l'origine
géographique du miel repose sur l'analyse pollinique.
(CHAUVIN, 1968), en général, on admet qu'un miel
provient principalement d'une certaine source de nectar
lorsque le pollen correspondant est au stade dominant. (LOUVEAUX, 1970). Selon
le même auteur, les pollens représentent une preuve des plus
sérieuses de l'origine botanique du miel.
3. DONADIEU (1984), signale que selon cette origine nous avons
les miels monofloraux et les miels multifloraux :
-Les miels monofloraux (unifloraux):
Un miel dit monofloral est issu d'un nectar, ou d'un miellat,
collecté par les abeilles sur un végétal unique et
particulièrement attractif pour ces insectes. Cette définition
stricte n'est vraiment avérée qu'en certains cas particuliers,
notamment sur les grandes cultures. (GONNET, 1982)
Les miels monofloraux possèdent des
caractéristiques palynologiques, physico-chimiques et organoleptiques
spécifiques. (BOGDANOV, 2003).
-Les miels multifloraux (polyfloraux):
Les miels multifloraux, ou miel toutes fleurs, souvent
classés suivant les lieux de récolte (miel de montagne, de
forêt, etc.), ou encore suivant les saisons (miel de printemps ou
d'été). (DONADIEU, 1984)
4.2. Composition chimique du miel :
La composition du miel varie en fonction de
l'origine florale. PROST, 1987, signale que plusieurs facteurs
peuvent influencer la composition chimique du miel tels que, la nature du sol,
la race d'abeille, l'état
physiologique da la colonie.
Les miels de miellats ont très souvent une couleur
foncée, ils cristallisent généralement peu, et contiennent
moins de glucose et de fructose, mais d'avantage des sucres
supérieurs (C11) que les miels de nectar.
La composition chimique varie d'un
échantillon à l'autre,
généralement, le miel contient des éléments majeurs
et des éléments mineurs.
Eau Fractose Glucose Maltose Saccharose Divers sucres Divers
1.5% 1.5% 3.5%
7.5%
31%
17%
38%
Figure 2: Composition moyenne du miel (LOUVEAUX,
1985)
4.2.1. Les éléments majeurs :
A) L'eau :
La teneur en eau est une caractéristique importante
des miels, elle conditionne la conservation du produit, son poids
spécifique, et dans une certaine mesure sa cristallisation, sa saveur ;
en un seul mot, sa qualité (LOUVAUX 1968).
Selon GONNET (1982), Lorsque les abeilles operculent les
contenants du miel au niveau des alvéoles, la teneur en eau de celui-ci
est de l'ordre de 17 % à 18 %.
LOUVAUX (1980), ajoute que la teneur en eau des miels varie
assez largement en fonction de leur origine florale, de la saison, de
l'intensité de miellée, de la force de colonies
d'abeilles, et de la technique de récolte.
B) Les Glucides :
Les glucides représentent 95 à 99 % de la
matière sèches du miel. C'est-à-dire que
l'eau et les sucres ensemble forment la quasi-totalité
du miel (LOUVEAUX, 1985).
On trouve des monosaccharides (glucose et fructose) qui
représentent 85% à 95% des sucres du miel mais
c'est le fructose (lévulose) qui est presque toujours
dominant, avec une teneur de 38% du poids du miel, tandis que la teneur en
glucose est de 31%. On y trouve également du saccharose (1.5%) et du
maltose (7.5%) ainsi que d'autres sucres présents à l'état
de traces : isomaltose, nigérose, turanose, maltulose, isomaltulose,
leucrose, kojibiose, néotréhalose, gentiobiose, laminaribiose,
mélézitose, erlose, 1-kertose, dextrantriose, raffinose,
isopanose, isomaltotétraose, 6-a-glucosylsaccharose,
arabogalactomannane, maltotriose, isomaltopentaose, panose, isomaltotriose,
3-a-isomaltosylglucose, centose (EMMANUELLE et al.1996).
4.2.2. Les éléments mineurs A) Les
acides:
Tous les miels on une réaction acide. Ils contiennent des
acides organiques, dont certains volatiles, et des lactones (LOUVEAUX,
1968).
Le plus important est l'acide gluconique dont l'origine serait
une bactérie, appelée gluconobacter, qui lors de la
maturation du miel, transforme le glucose en acide gluconique. On y trouve
également une vingtaine d'acides organiques comme l'acide
acétique, l'acide citrique, l'acide lactique, l'acide malique, l'acide
oxalique, l'acide butyrique, l'acide pyroglutamique et l'acide succinique. On y
trouve des traces d'acide formique (un des constituants du venin), d'acide
chlorhydrique et d'acide phosphorique. D'autres composés, les
lactones dont la présence est constante, ont
également une fonction acide. Le pH, qui peut varier de 3.2 à
4.5, est égal, en moyenne, à 3.9 (HUCHET et al.1996).
B) Les protéines :
Les miels convenablement récoltés sont pauvres ou
très pauvres en protéines (White et al. 1962, cité par
LOUVEAUX, 1968).
Les protides sont présents en faible quantité
(1.7 gramme par kilogramme de miel soit une teneur de 0.26%) et la teneur en
azote est négligeable (de l'ordre de 0.041%). Il s'agit essentiellement
de peptones, d'albumines, de globulines et de nucléo-protéines
qui proviennent soit de la plante, soit de l'abeille. On y trouve
également des acides aminés libres dont la proline, qui provient
des sécrétions salivaires de l'abeille (EMMANUELLE et al,
1996).
Selon GONNET (1982), Les recherches les plus récentes ont
permis de mettre en évidence dans différents miels la
présence de 19 acides aminés libres.
C) Les matières minérale :
La teneur en sels minéraux selon White et al. (1962), est
de l'ordre de 0.169 % en moyenne. Elle est donc faible ou
très faible et sujette à des variations très
importantes.
LOUVEAUX (1968), signale que, d'une
façon générale, les miels clairs sont nettement moins
riches en cendres que les miels foncés. Les études de White et
al. (1962), montent qu'il existe une relation entre la couleur
des miels et leur teneur en cendres.
GONNET, (1982), ajoute qu'on y trouve
également à l'état de traces une
trentaine d'éléments différents parmi
lesquels le fer, le cuivre, le cobalt, le chlore, le soufre, le phosphore, le
magnésium, le calcium, le sodium et le zinc...
D) Les enzymes :
Le miel contient plusieurs enzymes dont la présence est
liée à l'origine double du miel : animal ou
végétal, le nectar, contient dès sa récolte des
enzymes qui agissent sur les sucres ; les secrétions de
l'abeille viennent y ajouter les enzymes
secrétés par les glandes pharyngiennes (LOUVEAUX, 1968).
De nombreuses enzymes se retrouvent dans le miel :
l'invertase, l'a-amylase, la f3- amylase,
l'a-glucosidase et la glucose-oxydase capable de transformer
le glucose en acide gluconique. Le miel contient aussi une catalase et une
phosphatase. Ces diastases sont détruites par un chauffage
exagéré du miel, il y a donc lieu d'éviter ce chauffage de
miel si on veut bénéficier de leur action. Ainsi, leur dosage
permet de détecter les fraudes liées au chauffage du miel (HUCHET
et al.1996).
E) Les vitamines
Le miel est relativement pauvre en vitamines, si on le
compare à d'autres aliments. Les vitamines du miel ont
presque toujours leur origine dans les grains de pollen (LOUVEAUX, 1985).
DONADIEU (1984), ajoute qu'il y a un grand nombre de
vitamines, dont les quantités loin de pouvoir couvrir les besoins
journalières de l'homme. On trouve essentiellement :
les vitamines B1, B2, B3, B5, B6, et C, et accessoirement (en quantité
négligeable): les vitamines (A, B8, B9, D, K).
F) Les substances aromatiques
Les substances aromatiques ne sont pas importantes quant
à leur poids. On dénombre plus de cinquante substances
aromatiques qui peuvent permettre l'identification de l'origine des miels, car
elles proviennent presque exclusivement de la plante (HUCHET et al.1996).
DONADIEU (1984), ajoute que ces substances donnent
l'arôme et le goût spécifique
d'un miel déterminé, mais qui ont par ailleurs
des vertus thérapeutiques.
G) Matières pigmentaires :
Le miel contient des produits pigmentaires qui donnent la
couleur au miel et qui n'ont pas encore fait
l'objet d'études approfondies
(DONADIEU, 1984). LOUVEAUX (1985), ajoute qu'elles sont
probables qu'elles appartiennent aux groupes des
caroténoïdes et des flavonoïdes.
La coloration est une caractéristique physique
très importante des miels car elle est en relation avec
l'origine florale et la composition, elle va de
l'incolore au noir en passant par le blanc, le jaune, le brun
ambré et le brun vert, en général les miels
d'agrumes sont plus clairs que ceux des forêts.
(LOUVEAUX, 1985 ; WEISS, 1985 et PROST, 1987 in DJERD, 2008).
H) Les lipides :
Le miel est pauvre en lipides : ceux qu'on y trouve sont
probablement des microparticules de cire qui échappent à la
filtration (HUCHET et al.1996). LOUVEAUX (1985), identifie cependant, des
glycérides et des acides gras tels que l'acide
palmitique, les acides oléïques et linoléïques.
4.3. Les propriétés physiques du miel
4.3.1. La Densité
La densité d'un miel homogène
est le rapport, exprimé en nombre décimal, de la masse volumique
de ce miel à la masse volumique de l'eau pure à
4 °C. (La masse volumique
s'exprime en kg/dm3). La densité du miel
varie approximativement de 1,39 à 1,44 à 20
°C (GONNET, 1982). Le miel est donc un produit
relativement dense. Les variations de la
densité proviennent surtout des variations de la teneur en
eau. Plus un miel est riche en eau et moins il est dense.
On peut pratiquement se servir de la densité comme moyen
de connaitre la teneur en eau d'un miel (LOUVEAUX, 1985).
4.3.2. La Viscosité
La majorité des miels ont une viscosité normale,
c'est-à-dire qu'ils suivent les lois de Newton sur
l'écoulement des fluides (LOUVEAUX, 1985). Selon HUCHET
et al. (1996), La viscosité du miel dépend de trois facteurs qui
sont, sa teneur en eau, sa composition chimique et de sa température.
La viscosité est très élevée
à basse température. Elle décroit rapidement lorsque la
température augmente (GONNET, 1982). Pour 30 à
35°C, la viscosité est minimale, c'est d'ailleurs
la température de la ruche. C'est pourquoi les apiculteurs sont
contraints, au cours des opérations de centrifugation, d'extraction et
de mise en pots, d'opérer à température suffisamment
élevée (HUCHET et al.1996). HOOPER (1980), ajoute que cette
viscosité est également accrue par la quantité de la
matière colloïdale contenue dans le miel : les miels foncés
ont une viscosité plus élevée que les miels clairs.
4.3.3. La Chaleur spécifique
La chaleur spécifique d'un corps est la
quantité de chaleur nécessaire pour élever de
1oC la température d'une unité de
poids de ce corps.
Un miel a 17 % d'eau, la chaleur
spécifique est de 0.54 à
20°C. Cela veut dire qu'il faut
approximativement deux fois moins d'énergie (de joules)
pour réchauffer du miel que pour réchauffer la même masse
d'eau (LOUVEAUX, 1985 et PROST, 1987). LOUVEAUX (1968), ajoute
que la Chaleur spécifique varie très peu d'un
miel à l'autre.
4.3.4. La Conductibilité thermique
La conductivité thermique est une mesure du transfert de
chaleur. Elle est aussi désignée en tant qu'indice thermique. La
conductivité du miel est relativement faible. Pour un miel
-4
liquide, elle s'élève à 12 ·
10cal/cm/s/°C, pour un miel cristallisé, elle est
de 12.9 · 10-5 cal/cm/s/°C (BOGDANOV et
al. 2004).
Selon GONNET, (1985), le miel est mauvais conducteur de la
chaleur, donc bon isolant thermique.
4.3.5. La Conductibilité
électrique
La conductibilité électrique est la
propriété d'un corps de permettre le passage du
courant électrique. C'est donc
l'inverse de la résistivité (GONNET, 1982).
DONADIEU (1984), signale que le miel à une
conductivité électrique dans de fortes proportions suivant sa
teneur en eau et sa teneur en matières minérales.
4.3.6. L'indice de réfraction
L'indice de réfraction est une
propriété optique qui caractérise toute substance
transparente. Il est en fonction de la teneur en eau et de la
température. L'indice de réfraction de miel est
d'autant plus élevé que sa teneur en eau est
plus basse (GONNET, 1982).
L'indice de réfraction varie de
façon presque linéaire avec la teneur en eau, de telle sorte
qu'il est possible de connaitre très rapidement cette
teneur en mesurant l'indice de réfraction (LOUVEAUX,
1985).
4.3.7. La coloration
La coloration est une caractéristique physique importante
des miels car elle est en rapport avec leur origine florale et avec leur
composition (GONNET, 1982).
La coloration des miels est due à la présence
des substances encore mal identifiées, mais parmi lesquelles semble bien
figurer le carotène. La couleur d'un miel étant
un caractère très important sur le plan commercial (LOUVEAUX,
1985).
4.3.8. Le pH
Le pH d'un miel est en fonction de la
quantité d'acide ionisable qu'il
renferme (ions H+) ainsi que de sa composition minérale (ions OH-). Plus
le taux de la matière minérale est fort, et plus le pH de miel se
rapproche de la neutralité (GONNET, 1982). Selon DONADIEU (1984), le
miel est acide et son pH oscille en moyenne entre 3.5 et 6.
4.3.9. La turbidité :
A moins d'avoir été
filtrés d'une façon parfaite, les miels sont
toujours plus ou moins troubles, même lorsqu'ils ont
été très bien refondus. Cette turbidité est due aux
particules en suspension : grains de pollen, poussière, levures,
particules de cire et de propolis, colloïdes, protéines, etc....
(LOUVEAUX, 1985).
4.3.10. La fluorescence
Sous l'action des rayons
d'ultra-violet, beaucoup de miels présentent une
fluorescence dont les couleurs sont très variables selon la composition
de miel examiné (DONADIEU, 1984). Selon LOUVEAUX (1985),
L'origine de cette fluorescence est mal connue.
4.3.11. Le pouvoir rotatoire
Le Pouvoir rotatoire des miels concerne leur action sur la
lumière polarisée. (PROST, 1987). La majorité des miels
font tourner à gauche la lumière polarisée, mais il existe
des
miels dextrogyres, qui par conséquent font tourner le
plan de polarisation à droite. Le pouvoir rotatoire du miel est une
donné peu significative, car les divers sucres qu'il
contient ont tous un pouvoir rotatoire différent (LOUVEAUX, 1985).
4.3.12. La solubilité
Selon DONADIEU (1984), le miel est soluble dans
l'eau et l'alcool dilué, mais
insoluble dans l'alcool fort, l'éther,
le chloroforme et le benzène.
4.3.13. La Cristallisation :
La cristallisation des miels est un phénomène
très important car c'est de lui que dépend en partie la
qualité du miel (HUCHET et al.1996).
Le miel consiste en une solution sucrée
sursaturée. La cristallisation du miel est ainsi un processus naturel.
La vitesse de cristallisation dépend surtout de la teneur en glucose du
miel. Les miels dont la teneur en glucose est inferieure à 28 g/100 g ou
dont le rapport glucose/eau est inferieure à 1,7 restent plus longtemps
liquides. Les miels à cristallisation rapide se cristallisent le plus
souvent très finement, alors que les miels à cristallisation
lente ont tendance à avoir une cristallisation grossière. Une
cristallisation fine peut être obtenue par des procédés
spéciaux d'ensemencement (BOGDANOV et al 2004).
4.4. Les propriétés biologiques du miel
: 4.4.1. Valeur alimentaire et diététique :
Le miel est un aliment glucidique à haute valeur
énergétique (320 calories par 100 g ou 13400 joules / kg) il est
composé essentiellement d'un couple
d'hexoses :
-le glucose, qui est assimilé directement ;
-le fructose, qui assimilé après une
légère transformation.
Le miel présente sur le sucre ordinaire
l'avantage de contenir des sels minéraux ainsi que des
substances aromatique qui rendent sa consommation plus agréable. Le miel
est un aliment très favorable à la croissance des jeunes enfants
(GONNET, 1982).
4.4.2. Valeur thérapeutique
Le miel contient des substances
anti-bactériennes d'où le nom
d'inhibine. L'action
antibactérienne du miel est certainement à
l'origine de quelques unes des propriétés
médicinales qui lui sont attribuées.
Dans le domaine médicale elle a été
signalé l'action bénéfique du miel dans
certaine cas de maladies de l'estomac, de
l'intestin, des reins ou des voies respiratoires (GONNET,
1982).
Le miel à un pouvoir antiseptique utilisé dans
le traitement des plaies depuis l'antiquité (ATTIPOUK
et al. 1998). PROST (1987), ajoute signale que
l'élément essentiel de cette activité
antibiotique du miel, est une enzyme, la gluco-oxydase, qui provoque
un dégagement d'eau oxygénée.
Tableau 2: Propriétés et
indications thérapeutiques plus spécifiques attribuées aux
principaux
miels unifloraux (DONADIEU, 1984).
|
Origine botanique
|
Propriétés plus
spécifiques
|
Indicateurs plus particulières
|
|
Acacia
|
- Régulateur intestinal
|
- Paresse intestinal, notamment chez le jeune enfant
|
|
Bruyère
|
- Antiseptique des voies urinaires et diurétiques ;
-Antianémique ;
- Dynamogénique des voies respiratoires et des voies
urinaires.
|
- Affections de l'arbre urinaire dans son
ensemble et dans le régime diététique de
l'insuffisance rénale et chronique ;
- Certains anémies ;
- Etats de fatigue en général ;
- convalescences ;
Sénescences.
|
|
Eucalyptus
|
- Antiseptique des voies respiratoires et des voies
urinaires.
|
- Affection touchant à la sphère
respiratoire et à l'arbre urinaire dans
leur ensemble.
|
|
Oranger
|
- Antispasmodique ; - Sédatif nerveux.
|
- Etats spasmodiques d'origines diverses ; -
Nervosisme en général et troubles qui en découlent :
insomnies, palpitations.
|
|
Sapin
|
- Antianémique ;
- Antiseptique et anti- inflammatoire des voies respiratoires
;
- Diurétique.
|
- Certains anémies ;
- Affection touchant à la sphère
respiratoire dans tout son ensemble ;
- Affections de l'arbre urinaire dans son
ensemble et dans le régime diététique de
l'insuffisance rénale et chronique.
|
|
Lavande
|
- Antiseptique et anti- inflammatoire des voies respiratoires
;
- Antispasmodique ; - Sédatif nerveux.
|
- Affection touchant à la sphère respiratoire dans
tout son ensemble ;
- Rhumatismes chroniques (arthrose).
|
|
Thym
|
- Antiseptique général.
|
- Maladies infectieuses en général touchant aussi
bien les sphères respiratoires, digestives et urinaires.
|
|
Tilleul
|
- Antispasmodique ; - Sédatif nerveux.
|
- Etats spasmodiques d'origines diverses ; -
Nervosisme en général et troubles qui en découlent :
insomnies, palpitations.
|
|
Trèfle
|
- Dynamogénique.
|
- Etats de fatigue ;
- Convalescences ;
- Efforts physiques (chez les sportifs en particulier.
|
4.5. Propriétés organoleptiques :
4.5.1. La couleur :
Elle varie de blanc ou de nuance très claire à
brun sombre selon l'origine du produit. Les miels
français de robinier ou << acacia
>> - Robinia pseudoacacia -,
luzerne, romarin, rhododendron, lavande... sont clairs à
l'état liquide et blancs lorsqu'ils
sont cristallisés ; ceux de fenouil, de bourdaine, de bruyère, de
callune, d'eucalyptus, d'arbousier et de
miellats sont, au contraire, foncés avec des reflets variés
(verdâtres dans le miel de sapin) ; celui de sarrasin est presque noir.
Certains miels sont lumineux (miel de tournesol), d'autres, au
contraire, le sont peu (miel de colza). L'intensité de
la couleur est mesurée par l'échelle de
Pfund (Pfund color grader) ou par le comparateur
visuel de Lovibond. La limpidité, la fluidité,
l'homogénéité, la cristallisation et la
propreté sont également prises en considération (MOKEDDEM,
1997).
4.5.2. L'odeurs :
Dans les différents miels, les odeurs varient
considérablement mais s'évaporent très
rapidement. Elles sont végétales, florales ou fruitées,
puissantes ou non, fines, lourdes, vulgaires. Une odeur de fumée ou de
fermentation est un défaut (MOKEDDEM, 1997).
4.5.3. Les goûts :
Il s'agit des arômes, de la saveur
(acide, sucrée, salée, amère) et de la flaveur par voie
rétronasale. Ils sont végétaux, floraux, empyreumatiques,
fins, puissants ou persistants, exogènes.
L'arrière-goût peut être amer ou acide et
laisse en fin de bouche de tanin, de rance, de fumée... (MOKEDDEM,
1997).
Deuxième
Chapitre
Technologie du
miel
Chapitre II. Technologie du miel
Depuis quelques dizaines d'années, la
commercialisation du miel a cependant subi de profondes transformations. De
plus en plus, la production du miel est appelée à passer par des
circuits commerciaux complexes qui nécessitent la mise en oeuvre de
moyens modernes de conditionnement pour assurer une présentation
agréable et la fourniture en quantités importantes de produits
d'excellente qualité. L'obtention de
très grosses quantités d'un produit
homogène et irréprochable nécessite
l'application d'une véritable
technologie du miel, dont on peut situer la naissance vers 1929 avec les
travaux de Dyce sur la cristallisation contrôlée, et qui
constitue, à l'heure actuelle, un objet de recherches
et de mises au point continuelles.
Les problèmes de technologie commencent à se
poser dès la récolte du miel. Viennent ensuite la maturation,
l'ajustement de la teneur en eau, la refonte, la
pasteurisation, la cristallisation dirigée, le conditionnement et la
conservation (LOUVEAUX, 1968).
1. La récolte du miel :
D'après DONADIEU (1984), La
récolte de miel par l'apiculteur a lieu en
général après une miellée (qui correspond à
la période de production de nectar par la flore susceptible
d'en fournir) et lorsque les 3/4 des alvéoles des
rayons de cire sont operculés.
C'est ainsi que dans le midi de la France, le
miel est récolté entre les mois d'avril et de
novembre, en une ou plusieurs fois, La première récolte ne
débute habituellement qu'à la fin du mois de
mai.
1.1. Enlèvement des cadres :
L'apiculteur retire les cadres de miel, après avoir
chassé les abeilles par enfumage, il transporte les hausses dans la
miellerie et enlève les opercules à l'aide d'un couteau à
désoperculer (HUCHET et al, 1996).
1.2. L'extraction de miel a. La
désoperculation :
C'est l'enlèvement
des opercules. Avec ou sans passage à l'étuve,
la désoperculation se pratique dans une pièce tiède et
bien fermer (PROST, 1987). Selon DONADIEU (1984), il y a deux
procédés de désoperculation :
-soit à la main avec un couteau, un rabot ou une herse
à désoperculer,
-soit mécaniquement grâce à des machines
spéciales conçues pour cette opération.
b. L'extraction :
BIRI (1986), signale que l'extraction doit
être exécutée avec un extracteur, c'est à dire un
récipient en général cylindrique revêtu d'acier
inoxydable, qui permet d'extraire le miel des rayons par la force centrifuge
sans que ceux-ci soient endommagés. (figure
n°03)

Figure 03 : Extracteur centrifuge à moteur
électrique (PROST 1987).
c. La filtration
Le miel est recueilli sur un filtre, qui va retenir les
débris de cire entraînés lors de
l'extraction, et être reçu dans un bac avant
d'atteindre, après un deuxième filtrage le
maturateur qui est un simple récipient de décantation pour lequel
le terme d'épurateur serait
préférable.
Selon LOUVEAUX (1985), Les filtres couramment utilisés
en apiculture sont de simples tamis à maille de 0,1 mm. Leur
efficacité est suffisante pour éliminer du miel les
déchets de cire et les grosses impuretés.
L'installation des filtres ne se justifie que sur des circuits
de conditionnement industriels.
1.3. La maturation de miel
L'extraction centrifuge ne fournit pas
directement un miel prêt à la mise en pots. Pour obtenir un miel
commercialisable il est indispensable de l'épurer
(LOUVEAUX, 1985). Selon PROST (1987), la maturation signifie épuration,
quand il s'agit du miel.
Selon le même autour, la maturation est une simple
décantation dans un récipient où le miel abandonne ces
impuretés (débris de cire, amas de pollen), ainsi que les bulles
d'air incorporées pendant
l'extraction.
D'après LOUVEAUX (1985), la meilleure
façon d'épurer le miel est encore de le laisser
reposer pendant quelques jours dans un récipient appelé
maturateur, DONADIEU, (1984), signale que la maturation dure 2 a 8 jours.
2. Le conditionnement de miel
Du maturateur, le miel est coulé directement dans les
récipients de vente. Le miel doit être mis a l'
abri de l'air et de l'humidité ceci
afin d'éviter certaine dénaturation et surtout
des fermentations, d'où la nécessité de
récipients bien remplis et hermétiquement fermés.
(DONADIEAU, 1985).
D'après HUCHET (1996), le miel est
gardé dans des locaux frais où la température ne
dépasse pas 20°C. Si le miel a stocker
présente un risque de fermentation, il faudra impérativement le
pasteuriser ou le conserver a une température de 4 a
5°C.
3. Pasteurisation de miel
La pasteurisation consiste a porter le miel a
l'abri de l'air, a une température de
l'ordre de 78°C pendant 6 a 7 minutes,
puis le refroidir rapidement. L'appareillage comporte
principalement des plaques chauffante parallèles entres lesquelles le
miel va circuler en lames minces (PROST, 1987). Le miel pasteurisé est a
l'bri des fermentations puisque les levures ont
été détruites, et il se conservera a
l'état liquide pendant au moins six mois, le temps
nécessaire pour qu'il ait été
consommé (LOUVEAUX, 1985).
PROST (1987), mentionne que la pasteurisation peut augmenter
très sensiblement la couleur et le taux de l'HMF,
qu'il caractérise les miels chauffés et
vieux.
4. Le contrôle de la cristallisation
Pour éviter les défauts de cristallisation et
accroître la popularité d'un miel auprès
des consommateurs, on contrôle la cristallisation, en particulier celle
des miels de fleurs a cristallisation rapide (BOGDANOV, 1999).
Tous les miels n'ont pas la vocation pour rester
a l'état liquide. Trop riches en glucose, même
après pasteurisation, ils risqueraient de recristalliser de façon
irrégulière.
Pour obtenir une cristallisation fine et homogène, on
procède a un ensemencement du miel après pasteurisation et
refroidissement complet. On mélange intimement au moyen
d'appareils spéciaux un miel a cristallisation
très fine avec le miel a faire cristalliser. On utilise environ 10 % de
semence. Les cristaux ajoutés au miel servent d'amorce
et, en quelques jours, a la température de 14 °C,
la plus favorable a la croissance des cristaux, tout le miel est
cristallisé dans le système souhaité. Bien entendu,
c'est le mélange encore pâteux du miel et de la
semence qui est envoyé dans la machine a empoter (LOUVEAUX, 1985).

Figure 04 : Miel semence en réserve, (Maurice MARY,
2008)
5. Emballage et étiquetage :
Les récipients doivent être étanches
à l'eau et à l'air pour
éviter toute pénétration
d'humidité dans le miel. Les récipients et cuves
en fer blanc, en aluminium, en acier chromé et en plastique
(qualité alimentaire) conviennent parfaitement à cet usage.
Pour les emballages de consommation, les pots en verre, mais
aussi ceux en plastique (qualité alimentaire) et en fer blanc
conviennent. Quant aux boîtes en paraffine, elles ne sont étanches
ni à l'eau ni à l'air et sont
en conséquence inutilisables pour le stockage du miel. Selon la loi sur
les denrées alimentaires, elles sont même interdites (car la
paraffine contienne des substances toxiques qui peuvent migrer dans le miel) et
ne pourront plus être utilisées une fois la période de
transition est écoulée (BOGDANOV, 1999).
D'après PROST (1987), le verre est le
meilleure emballage pour le miel, mais son poids, sa fragilité et
transparence rend visible les traînées blanche, causées par
les bulles d'aire, dans le miel cristallisé lui font
préférer le carton ou la matière plastique.
Légalement, l'étiquette doit
fournir les indications suivantes: -Le nom et l'adresse de
l'apiculteur,
-L'appellation du miel ou une autre appellation
légale, -Le poids du miel contenu dans le récipient,
-Une date de garantie, à consommer de
préférence avant fin mois/année (exemple, à
consommer avant fin 04/2010), mais il ne s'agit pas
d'une date de péremption, tout miel peut être
consommé sans risque après cette date. Il est normal de
s'en tenir à une durée de conservation maximale
de 18 à 24 mois selon les miels, à condition de garantir au
consommateur que le miel aura au moins jusqu' à cette
date, conservé ses qualités et ses caractéristiques
sensorielles (GUERRIAT, 1996);
-En outre, l'apiculteur valorise
d'autant mieux son produit qu'il mentionne
aussi le résultat d'une analyse de laboratoire
(espèces butinées, consistance...) et une région de
production (BOGDANOV, l999 et SCHWEITZER, 2004).
6. Principales transformations physiques et chimiques du
miel : 6.1. La cristallisation
Selon HUCHET et al, (1996), La cristallisation des miels est
un phénomène très important car c'est de
lui que dépend en partie la qualité du miel. Il dépend des
facteurs suivants:
a. La teneur en sucres
Plus la teneur en glucose est élevée, plus
rapide sera la cristallisation du miel, les miels avec plus de 28% de glucose
se cristallisent très rapidement, mais aussi, plus la concentration en
fructose par rapport à celle du glucose (rapport fructose/glucose) est
élevée, plus la cristallisation est lente. En principe, le miel
reste liquide au-dessus d'un rapport fructose/glucose proche
de 1,3 (BOGDANOV, 1999).
b. La température
La température optimale pour la cristallisation du
miel se situe entre 10 et 18°C. Une température
constante de 14°C est idéale pour un miel à
teneur en eau moyenne. Les basses températures retardent la croissance
des cristaux. Les hautes températures entraînent la dissolution
des cristaux qui disparaissent totalement à 78°C
(HUCHET et al, 1996 et BOGDANOV, 1999b).
La température idéale pour une bonne
conservation du miel doit être comprise entre 12 et
16°C, elle est ralentie à plus basse comme
à plus haute température. Mais dans ce dernier cas, la
dégradation du miel se caractérise par un taux
d'HMF croissant dans le temps (CARTEL, 2003 in DJERD,
2008).
c. La teneur en eau
Les miels avec une teneur en eau de 15 à 18% ont une
bonne cristallisation. Ceux dont la teneur est inférieure ou
supérieure se cristallisent plus lentement, ceux au contenu hydrique
faible deviennent durs, alors que ceux avec plus de 18% d'eau
restent mous (BOGDANOV, 1999).
6.2. La fermentation
Tous les miels naturels contiennent des levures, champignons
microscopiques responsables de fermentations alcooliques. Ces derniers
proviennent du nectar, mais également de pollutions accidentelles dues
aux abeilles ou intervenant après la récolte (LOUVEAUX, 1985).
Selon GONNET (1982), la fermentation peut intervenir lorsque
plusieurs facteurs favorables sont réunis:
> Une teneur en eau du miel supérieure à 18%,
> La présence de levures vivantes en quantité
suffisante,
> Une température voisine de
16°C, et comprise de toute façon entre 10 et
25°C.
PROST (1987), ajoute que le miel qui fermente dégage des
bulles de gaz carbonique; sa surface se soulève, son goût change,
et il n'est plus commercialisable.
Troisième
Chapitre
Analyse du
miel
Chapitre. III. Analyse du miel
Les analyses de miel se pratiquent depuis fort longtemps et la
liste des auteurs ayant travaillé sur ce sujet est impressionnante, ils
sont alors arrivé peu à peu à définir un certain
nombre de critères se rapportant aux divers aspects physico-chimiques du
produit ainsi que sa composition.
1. Les tableaux de références
Ce sont des documents analytiques qui donnent les principaux
critères retenus pour tel type de miel, ces tableaux ont donc une valeur
de référence et donnent des valeurs extrêmes pour chaque
critère retenu, ces tableaux de références sont obtenus
grâce à l'analyse d'un nombre
important d'échantillons.
Les moyennes obtenues sont alors considérées comme
représentatives des mesures idéales pour le type de miel
défini (tableau 3) ;
Des renseignements complémentaires concernant
notamment la mélissopalynologie, sont apportés à ces
tableaux ils indiquent les types de pollens pour le type de miel. Ceux-ci sont
classés en pollens dominants, d'accompagnements et
isolés en fonction de leurs fréquences dans les
échantillons, des pollens rares peuvent également être
mentionnés (MOKEDDEM, 1997).
2. Les bulletins d'analyses
Le bulletin d'analyse se rapporte à un
échantillon donné. Cet échantillon doit être
représentatif du lot de miel pour lequel des renseignements analytiques
sont recherchés, ceci implique de s'entourer
d'un minimum de précaution lors de son
prélèvement (en évitant, par exemple, de le
prélever à la partie supérieure du récipient mais
plutôt en profondeur s'il s'agit
d'un miel liquide), les données portées sur le
bulletin d'analyse ne sont plus des moyennes mais des valeurs
correspondant à celles trouvées lors de
l'analyse.
Les résultats fournis peuvent être limités
ou complètes suivant la demande de
l'intéressé et en fonction du but
recherché. Si l'analyse est suffisamment
complète, il est alors possible d'en comparer les
résultats à un tableau de référence, on peut ainsi
déterminer si le miel analysé correspond ou non aux
critères établis (tableau 4) (MOKEDDEM, 1997).
Tableau 3 : Principales
caractéristiques de miel de nectar de
Lavande
D'après une proposition de normes
française, I.T.A.P.I.
Tableau de référence
|
Critères
|
Moyenne
|
Minimum
|
Maximum
|
|
Couleur (échelle de Pfund)
|
> 5,5
|
|
|
|
Humidité
|
> 17,5
|
|
|
|
pH initial
|
3,63
|
3,3
|
4,0
|
|
pH équivalent
|
6,34
|
6,0
|
6,7
|
|
Acidité totale (meq/kg)
|
34,2
|
26,0
|
40,6
|
|
Conduct. Electrique
|
2,5
|
|
|
|
Fructose (%)
|
41,91
|
39,2
|
45,4
|
|
Glucose (%)
|
38,72
|
36,9
|
42,2
|
|
Glucose + Fructose (%)
|
80,63
|
76,1
|
87,6
|
|
Saccharose (%)
|
7,22
|
2,0
|
11,6
|
|
Maltose (%)
|
5,53
|
4,2
|
7,1
|
|
Erlose (%)
|
2,12
|
1,2
|
4,3
|
|
Mélizitose (%)
|
0
|
0
|
0
|
|
Monosaccharides totaux
|
80,63
|
76,10
|
87,60
|
|
Disaccharides totaux
|
13,30
|
8,50
|
18,90
|
|
Trisaccharides totaux
|
2,12
|
1,20
|
4,30
|
|
Fructose/Glucose
|
1,08
|
1,04
|
1,14
|
|
Fructose/Glucose
|
2,0
|
1,80
|
2,20
|
Source: F. Jeanne (1993) in Mokeddem, 1997.
Tableau 4: Exemple d'un
bulletin d'analyse d'un miel
d'Algérie. Effectue par le 1aboratoire
officiel du
CNFVA.
Source: F. Jeanne (1993) in Moukaddem, 1997.
|
I. Analyse physico-chimique
|
|
|
pH initial
|
4.16
|
|
pH du point équivalent
|
6.88
|
|
Acidité libre
|
21.24 m éq./kg
|
|
Acidité combinée
|
11.19 rn éq./kg
|
|
Acidité totale
|
32.43 m éq./kg
|
|
H.M.F.
|
l2mgfkg
|
|
Acidité diastasique
|
37
|
|
Conductivité
|
micro siemens
|
|
Coloration S
|
-
|
|
Humidité
|
18.1%
|
|
Tréhalose
|
0,14%
|
|
Glucose (%)
|
31,00 %
|
|
Fructose (%)
|
40,29 %
|
|
Isomlatose
|
1.50 %
|
|
Saccharose(%)
|
0.1%
|
|
Turanose
|
1.44%
|
|
Mélizitose (%)
|
1.09 %
|
|
Raffinose
|
0.52%
|
|
Maltose(%)
|
2.57%
|
|
Erlose (%)
|
0.73 %
|
|
Sucres totaux
|
80.82 %
|
|
Fructose/Glucose
|
1.29
|
|
Glucose/eau
|
1.71
|
II. Caractères organoleptiques et
aspect
Miel semi-liquide ambré
Examen normal permettant de percevoir la présence
d'Eucalyptus.
III. Interprétation Beau miel naturel
conforme aux normes de qualité exigées d'un miel
de bouche.
|
3. Description de principales données d'analyse :
3.1. Analyse physique :
3.1.1. La Densité :
La densité appelée aussi le poids
spécifique. Selon LOUVEAUX (1968), Le poids spécifique du miel
est en fonction principalement de sa teneur en eau. La mesure du poids
spécifique au moyen d'un densimètre ou le
réfractomètre. Les valeurs trouvées par les
différents auteurs (Marvin, 1934 ; DEANS, 1953 ; White et al. 1962)
concordent de façon très satisfaisante. Selon PROST, 1987, la
densité de miel à 20 °c est comprise entre
1.39 et 1.44, il ajoute qu'un miel récolté trop
tôt ou extrait dans un endroit humide contient trop
d'eau.
White et al, ont trouvé une valeur moyenne de 1,4225
à 20 °C pour 490 échantillons de miel des
U.S.A.
3.1.2. La Conductibilité électrique
:
La conductibilité électrique
d'un miel est la conductibilité mesurée à
20°C d'un volume cubique de 1cm de
côté d'une solution à 20% de
matière sèche. C'est la mesure de la
capacité de cet échantillon de miel à transmettre un flux
électrique ou conductance. La mesure s'effectue
à l'aide d'un conductimètre.
Une cellule de conductance reliée à un potentiomètre
analyse la vitesse de passage du flux électrique entre deux
électrodes. Le résultat s'affiche en siemens
(S). Le siemens étant l'unité de mesure de la
vitesse de conductance. Conventionnellement, la conductibilité est
donnée en 10-4 S/cm, mais ce n'est pas
toujours le cas dans la réalité. En effet, les laboratoires
donnent de plus en plus souvent de mesure de conductivité
électrique en micro-siemens (uS = 10-6) mais on donne
également des résultats en millisiemens (mS = 10-3)
(Italie) ou en Ohm (f2) (grande Bretagne).
Elle est d'autant plus élevée
que le miel est riche en substances ionisables, telles les matières
minérales. Cette mesure, exprimée en 10-4 S/cm, se
fait dans une solution standard à 20 % de matière sèche
(cendres). Elle est d'autant plus élevée que le
miel est foncé par la présence de matières
minérales (miels de miellats). (LOBREAU-CALLEN et al, 2001)
Pour le miel cette conductivité varie selon un rapport
moyen (V) comprise entre 1 et 15, entre 1 et 5 on trouvé à peu
prés tous les miels de nectar: 1 à 2,5 mS pour celui de colza ;
2,5 mS environ pour le miel de lavande ou de romarin; entre 1,3 et 3 mS celui
d'acacia et 1,4 et 3 mS pour celui de
l'oranger. Certains miels cependant transgressent cette
règle. C'est le cas du miel de callune avec une
conductivité variant entre 7 et 9 mS ou celle du châtaignier qui
est généralement supérieur à 10 mS.
La conductibilité élecrique présente un
bon critère pour la détermination de l'origine
botanique du miel, et elle est désignée
aujourd'hui lors des contrôles de routine à la
place de la teneur en cendre, cette mesure dépend de la teneur en
minéraux et de l'acidité du miel, plus elles
sont élevées, plus le CE correspondante est
élevée.
3.1.3. Le pH
Le pH ou «potentiel
hydrogène», encore appelé indice de
«sorensen». C'est
la mesure du coefficient caractérisant l'acidité
ou la basicité d'un milieu, il représente la
concentration des ions H+ d'une solution.
Selon Gonnet, (1985), le coefficient 7 (eau distillée
à 22°C) correspond à la neutralité,
supérieur, il est basique, inférieur il est acide. Il se situe
entre 3,5 et 4,5 pour les miels de nectars et entre 4,5 et 5,5 pour les miels
de miellats.
Le pH d'un miel est mesuré en solution
dans l'eau à 10 % à l'aide
d'un pH- mètre. (LOUVEAUX, 1985).
3.2. Analyse chimique: 3.2.1. La teneur en
eau:
La mesure de la teneur en eau, se fait très simplement
au moyen d'un réfractomètre ;
l'indice de réfraction est fonction de sa teneur en
eau. Connaissant l'indice de réfraction, on en
déduit la teneur en eau. Les tables de CHATAWAY donnent directement la
correspondance. Le réfractomètre permet une mesure avec une
simple goutte de miel ; il ne peut toutefois donner un résultat que si
le miel est parfaitement liquide (LOUVEAUX, 1982).
Une goutte de miel est déposée sur la platine du
prisme d'un réfractomètre. La lecture est faite
à travers l'oculaire au niveau de la ligne horizontale
de partage entre une zone claire et une zone obscure. Cette ligne coupe une
échelle verticale graduée directement en pourcentage
d'humidité dans le miel. La température du
prisme est notée.
Si la mesure a été effectuée à une
température différente de 20°C, la lecture
doit être corrigée pour ramener l'indice de
réfraction. Le coefficient de correction est de 0,00023 par degré
Celsius. La correction est additive, si la mesure est faite au dessus de
20°C, soustractive dans le contraire.
La norme de Codex Alimentarius et de U.E prescrivent
actuellement une teneur en eau maximale est de 21%, le miel qui contient une
teneur en eau élevée fermente plus facilement, exemple les miels
de bruyère et de trèfle ont une teneur en eau de 23% (CODEX,
2001).
Les contrôles chimiques effectués
jusqu'à aujourd'hui pour les miels de
qualité ont montré que la teneur en eau de plus de 95% des miels
est inferieure à la valeur de 18.5%.
L'estimation de la teneur en eau peut se faire
par mesure de la densité, mais il s'agit
d'un moyen empirique et
l'interprétation du résultat est assez difficile
(GONNET, 1986).
Tableau 5 : Table de CHATAWAY (1935)
|
Indice de réfraction (20°c)
|
Teneur en eau (%)
|
Indice de réfraction (20°c)
|
Teneur en eau (%)
|
Indice de réfraction (20°c)
|
Teneur en eau (%)
|
|
1.5044
|
13.0
|
1.4935
|
17.2
|
1.4835
|
21.2
|
|
1.5038
|
13.2
|
1.4930
|
17.4
|
1.4830
|
21.4
|
|
1.5033
|
13.4
|
1.4925
|
17.6
|
1.4825
|
21.6
|
|
1.5028
|
13.6
|
1.4920
|
17.8
|
1.4820
|
21.8
|
|
1.5023
|
13.8
|
1.4915
|
18.0
|
1.4815
|
22.0
|
|
1.5018
|
14.0
|
1.4910
|
18.2
|
1.4810
|
22.2
|
|
1.5012
|
14.2
|
1.4905
|
18,4
|
1.4805
|
22.4
|
|
1.5007
|
14.4
|
1.4900
|
18.6
|
1.4800
|
22.6
|
|
1.5002
|
14.6
|
1.4895
|
18.8
|
1,4795
|
22.8
|
|
1.4997
|
14.8
|
1.4890
|
19.0
|
1.4790
|
23.0
|
|
1.4992
|
15.0
|
1.4885
|
19.2
|
1.4785
|
23.2
|
|
1.4987
|
15,2
|
1.4880
|
19.4
|
1.4780
|
23.4
|
|
1.4982
|
15.4
|
1.4875
|
19.6
|
1.4775
|
23.6
|
|
1.4976
|
15.6
|
1.4870
|
19.8
|
1.4770
|
23.8
|
|
1.4971
|
15.8
|
1.4865
|
20.0
|
1.4765
|
24.0
|
|
1.4966
|
16.0
|
1.4860
|
20.2
|
1.4760
|
24.2
|
|
1.4961
|
16.2
|
1.4855
|
20.4
|
1.4755
|
24.4
|
|
1.4956
|
16.4
|
1.4850
|
20.6
|
1.4750
|
24.6
|
|
1.4951
|
16.6
|
1.4845
|
20.8
|
1.4745
|
24.8
|
|
1.4946
|
16.8
|
1.4840
|
21.0
|
1.4740
|
25.0
|
|
1.4940
|
17.0
|
|
|
|
|
3.2.2. La teneur en cendres :
On appelle cendre l'ensemble des produits fixes
de l'incinération du miel conduite de façon
à obtenir la totalité des cations.
Les creusets vides sont mis dans le four à 650
°C pendant quelques minutes, puis dans un dessiccateur
jusqu'au refroidissement total.
Les creusets vides sont pesés, puis après avoir
taré la balance on pèse 5g de miel et on ajoute quelques gouttes
d'acide sulfurique; ce qui permet
d'accélérer la combustion de la matière
organique.
Les creusets contenant le miel sont d'abord
chauffés au bain-marie durant 30 minutes, ensuite ils sont introduits
dans un four à 650°C pendant 18 heures;
jusqu'à l'obtention de cendres
blanches.
Après refroidissement dans un dessiccateur, les creusets
sont pesés avec les cendres.
L'incinération du miel est donc le
procédé qui permet de connaître sa teneur en constituants
minéraux, cette teneur est très variable. Celle des miels clairs
est plus faible que les miels foncés. Elle est comprise entre 0.020 et
1.028 g/100g de miel (LOUVEAUX, 1968).
La teneur en cendres est un critère de qualité
dépend de l'origine botanique du miel. Le miel de
nectar à une teneur en cendres plus faible que le miel de miellat.
LOUVEAUX (1968), ajoute que la teneur en cendres des miels est comprise entre
0.020 et 1.028%.
La teneur maximale autorisée par les normes
internationales est de 0,6 g/100 g, et pour le miel de miellat ou
mélanges de miel de miellat et de nectar, miel de châtaignier est
de 1.20 g/100g (Codex, 1998).
Tableau 6 : Constituants minéraux du
miel (les résultats sont exprimes en mg/kg)
D'après
white (1963) et
d'après les travaux de SCHUETTE et al.
(D'après LOUVEAUX in
CHAUVIN, 1968)
|
Eléments
|
Miels clairs
|
Miels foncés
|
|
Nbre
|
Moy.
|
Mini.
|
Max.
|
Nbre
|
Moy.
|
Mini.
|
Max.
|
|
Potassium (K)
|
13
|
205
|
100
|
588
|
18
|
1676
|
115
|
4733
|
|
Chlore (CI)
|
10
|
52
|
23
|
75
|
13
|
113
|
48
|
201
|
|
Soufre(S)
|
10
|
58
|
36
|
108
|
3
|
100
|
56
|
126
|
|
Calcium(Ca)
|
14
|
49
|
23
|
68
|
21
|
51
|
5
|
266
|
|
Sodium (Na)
|
13
|
18
|
6
|
35
|
18
|
76
|
9
|
400
|
|
Phosphore (P)
|
14
|
35
|
23
|
50
|
21
|
47
|
27
|
58
|
|
Magnésium (Mg)
|
14
|
19
|
11
|
56
|
21
|
35
|
7
|
126
|
|
Silice (Si02)
|
14
|
22
|
14
|
36
|
21
|
36
|
13
|
72
|
|
Silicium (Si)
|
10
|
8,9
|
7,2
|
11,7
|
10
|
14
|
5,4
|
28,3
|
|
Fer(Fe)
|
10
|
24.
|
1,2
|
4,8
|
10
|
9,4
|
0,7
|
35,5
|
|
Manganèse (Mn)
|
10
|
0,3
|
0,17
|
0,44
|
10
|
4,09
|
0,52
|
9,53
|
|
Cuivre(Cu)
|
10
|
0,29
|
0,14
|
0,70
|
10
|
0,56
|
0,35
|
1,04
|
3.2.3. Le Dosage des sucres
Chaque miel est susceptible de contenir une bonne dizaine de
sucres. Ce sont des mono, di, tri ou polysaccharides représentant au
total plus de 80% du poids total du miel.
Deux d'entre eux, le glucose et le fructose,
dominent nettement et font à eux seuls près de 70%. Les autres
sucres, loin d'être tous présents, dans un
même miel, peuvent se trouver à
l'état de traces ou en quantité
plus ou moins importantes mais toujours dans des proportions ne
dépassant pas quelques pour cent.
La détermination de ces sucres et leur dosage
s'obtient par l'analyse chromatographique
effectuée par un laboratoire spécialisé.
Les méthodes officielles d'analyse du
miel (arrêté publié au journal officiel 1977)
prévoient les méthodes suivantes: chromatographie en couche
mince, chromatographie sur papier et chromatographie en phase gazeuse. On fait
de plus en plus appel actuellement à la chromatographie en phase liquide
(H.P.L.C. mis pour Hight Pressure Liquide Chromatography -Chromatographie en
phase liquide sous haute pression)
Dans ce contexte, nous pouvons citer l'exemple
de la législation Française (décret sur le miel 1976)
prévoit:
- une teneur apparente en sucres réducteurs
exprimés en sucre intervertis pas moins de 65% pour le miel de nectar,
et une teneur apparente en saccharose inférieur à 5% exception
faite pour les miels d'acacia, lavande et bauksie (flore
Australienne).
3.2.4. Rapports Glucose/eau et
Fructose/Glucose
Du rapport glucose/fructose et surtout du rapport glucose/eau
vont dépendre en grande partie la rapidité de cristallisation
d'un miel ainsi que sa structure cristalline avant de
procéder aux principales opérations technologique que sont la
pasteurisation, la cristallisation dirigée, le mélange ou la
refonte des miels, il faut connaître ces données essentielles,
elles aident au choix du traitement à appliquer.
Les méthodes employées pour le dosage des sucres
sont nombreuses, elles font appel à la chimie analytique classique ou
à la chromatographie de partage.
Certaines méthodes apportent des résultats
globaux, elles ne permettent pas de différencier glucose et fructose
d'autres par contre sont longues et délicates.
L'analyse par chromatographie en phase gazeuse (C.P.G) mise au
point par POURTALLIER (1967), (Cité par GONNET, 1977), constitue la
méthode officielle pour le dosage des différents sucres dans le
miel mais la technique est très délicate, adaptée à
certains laboratoires et représente aussi un investissement assez
lourd.
Les dosages par voie enzymatique proposés par BERGMEYER
et al. (1970) (cité par GONNET, 1977) sont cependant parfaitement
adaptés à la solution du problème posé. Cette
méthode est rapide et permet le dosage du glucose et fructose à
part.
3.2.5. L'hydroxyméthylfurfural (HMF)
Le principal critère d'évaluation mesurable de la
qualité du miel est la concentration en
HMF.
L'apparition de ce composé est le
résultat de la transformation des sucres simples et plus
particulièrement du fructose en hydroxyméthylfurfural:
5-(hydroxyméthyl)-2- furaldéhyde (HMF). L'acidité et une
teneur en eau élevée favorisent cette transformation, mais
l'excès de chaleur et un entreposage prolongé sont des facteurs
encore plus importants dans ce processus (MARCEAU, et al. 1994).
Figure 3: Processus de la formation de
l'HMF
Selon BOGDANOV, (2001) Dans le commerce international, un taux
maximal de 40mg/kg s'est
révélé acceptable.
La teneur en HMF d'un miel est pratiquement
nulle au moment de la récolte, elle augmente progressivement, lentement
tout d'abord pour s'accélérer
par la suite.
L'HMF est un indicateur de la fraicheur et le
surchauffage du miel.
D'après ZEGGANE, ANTINELLI et al,
(1996) cité par MOKADDEM (1997), la méthode du dosage
d'H.M.F. utilisant l'acide barbiturique et la
paratoluidine n'est pas sélective de
l'H.M.F. et surestime le taux réel de ce produit, une
nouvelle méthode donc est déterminée, pour évaluer
le taux de H.M.F par chromatographie liquide à haute performance
(H.P.L.C.), cette méthode permet de déterminer le taux
d'H.M.F. qui est plus fiable et plus proche de la valeur
exacte.
La proposition du Codex (1998), prévoit un taux maximal
de 60 mg/kg, cette proposition d'un taux maximal plus
élevé se base sur le faite que dans les pays chauds, la teneur en
HMF augmente rapidement avec la durée de stockage.
3.2.6. Le Dosage des protéines
Les protéines sont dosées selon la
méthode de KJELDAHL. La matière azotée contenue dans la
prise d'essai est minéralisée par
l'action de l'acide sulfurique
concentré en présence d'un catalyseur sous
l'action de la chaleur.
L'azote est libéré à
l'état d'ammoniac qui, en
présence d'acide sulfurique se retrouve à
l'état de sulfate d'ammonium. Un
excès de soude neutralise l'acide sulfurique et
libère l'ammoniac qui est entraîné par
distillation dans une solution d'acide borique.
L'ammoniac contenu dans le distillat est dosé avec
H2SO4 en présence d'un indicateur coloré. Le
taux de protéine est obtenu en multipliant le taux
d'azote par 6,25.
3.2.7. L'acidité
LOUVEAUX (1985), signale que tous les miels ont une
réaction acide. Cette acidité provient d'acides
organiques, certains de ces acides proviennent du nectar et
d'autres de miellat, mais `leur origine
principale est recherchée du côté des
sécrétions salivaires de 1'abeille et dans les
processus enzymatiques et fermentatifs (LOUVEAUX, 1968). La fermentation de
miel provoque une augmentation de l'acidité.
L'ancienne norme prescrit été une valeur
maximale de 40 mq/kg. Dans le projet de Codex alimentarius elle a
été augmentée à 50 mq/kg et ont donné
qu'il existe des miels qui ont une teneur naturelle en acide
plus élevée.
Lors de l'analyse on considère:
a) L `acidité libre
Cette acidité est titrée par
l'hydroxyde de sodium jusqu'au pH du point
équivalent soit pHE (pont de neutralisation de tous les acides
libres).
L'acidité libre est exprimée
en milliéquivalent d'hydroxyde de sodium
nécessaire pour porter à pHE, 1000 grammes de miel, elle ne doit
pas être supérieure à 50 meq/kg (Codex, 2001).
b) L `acidité
combinée
Cette acidité correspond à
l'acidité des lactones, cette acidité
(combinée) est non titrable, l'acidité due aux
lactones (acidité combinée) est exprimée en
milliéquivalents d'hydroxyde de sodium pour 1000
grammes de miel.
e) L `acidité totale
L'acidité totale est la somme de
l'acidité libre et de l'acidité
des lactones, elle peut varier de 10 et 60 meq/kg.
Le pH est mesuré sur une solution de miel 10%, cette
acidité totale peut varier de 10 et 60 meq/kg.
Tableau 7 : Les valeurs de
l'acidité de quelques miels (MOKEDDEM, 1998)
|
Miel
|
Acidité libre pH équivalent
|
Acidité combinée (lactone)
|
Acidité totale
|
|
Moyenne
|
Val. limite
|
Moyenne
|
Val. limite
|
Moyenne
|
Val. limite
|
|
Acacia (meq/kg)
|
8,0
|
5,7 - 11.9
|
5,5
|
2,2-9,4
|
13,7
|
8,9-20,4
|
|
Colza
|
8,8
|
5,7 - 14,6
|
6,0
|
1,4-9,7
|
14,9
|
8,9-24,3
|
|
Lavande (meq/kg)
|
19,0
|
11,6 - 26,2
|
15,3
|
10,0-21,4
|
34,2
|
26,0-40,6
|
|
Romarin (meq/kg)
|
7,4
|
4,0 - 11,0
|
6,2
|
1,0-10,4
|
13,6
|
8,7-19,1
|
|
Sapin Vosges (meq/k)
|
25,2
|
17,4 - 31,2
|
3,4
|
0,4-9,0
|
28,7
|
20,4-36,9
|
|
Autres sapins (meq/kg)
|
19,8
|
14,4 - 26,2
|
3,0
|
1,0-9,0
|
22,9
|
15,8-30,6
|
|
Oranger (meq/kg)
|
1,21
|
0,7 - 16
|
0,99
|
0,4-1,4
|
-
|
1,2-3
|
Source: «CN.A.P.F.»
France -Miel
3.2.8. L'Activité diastasique (ou
enzymatique)
Le miel contient de nombreuses diastases parmi lesquelles on
cite:
· Les amylases et qui provoquent la dégradation de
l'amidon en donnant des dextrines puis du maltose.
· La gluco-invertase (glucosidase) qui joue un rôle
essentiel dans la scission des molécules de saccharose.
· La gluco-oxydase qui est à
l'origine de la formation de l'acide
gluconique.
Avec le vieillissement du miel, la teneur en diastases
diminue progressivement et tend vers zéro comme l'on
démontré de nombreux auteurs (HADORN et al. 1962 et WHITE et al.
1962 et GONNET, 1962 cité par LOUVEAUX, 1668). Cet affaiblissement
intéresse aussi bien l'amylase que
l'invertase. La destruction des diastases est fortement
accélérée par l'élévation
de la température.
D'après WHITE et al. (1962),
confirmé par GONNET (1965), cette perte
d'activité serait de l'ordre de 10
à 33% en un an et de 31 à 3 7,5% en deux ans pour
l'amylase. L'invertase est encore plus
fragile.
L'activité diastasique et en
particulier celle de l'amylase est susceptible
d'apporter de précieux renseignement sur
l'état de fraîcheur d'un miel ou
sur les dégradations éventuellement subies lors
d'un excès de chauffage par exemple.
On appelle activité de l'amylase du
miel, le nombre de millilitre d'une solution dilution aqueuse
à 1% d'un amidon standard hydrolysé en une heure
par lg de miel (GONNET, 1973).
La mesure est effectuée à
l'aide d'un spectrophotomètre ou
d'un colorimètre et s'exprime en
indice diastasique (I.D) (Echelle de Schade). En
général, il doit être inférieur à 8
(toléré à 3 pour les miels à faible teneur en
diastase, comme les miels d'agrumes et ayant un taux
d'H.M.F. inférieur à 15) (Anonyme, 1976).
3.3. La mélisso-palynologie
La palynologie appliquée à
l'apidologie ou la Mélisso-palynologie est une
discipline très ancienne puisqu'elle a ses origines
dans les observations de PFISTER (1895) sur la présence constante des
grains de pollen dans les miels. Le terme
«Mélisso-palynologie»
n'est apparu qu'en 1966 et
c'est MAURIZIO qui lui a donné le statut
d'une discipline scientifique moderne dont
l'ouverture sur l'apidologie est de plus en
plus prouvée.
Selon A.PONS (1958) et DARRIGOL (1979),
l'analyse pollinique est un moyen de comparaison valable. Elle
permet à tous les pays de connaître leurs miels indigènes
et de les différencier des miels étrangers.
La Mélisso-palynologie est donc une garantie sûre
de contrôle de qualité, de prévention et de
répression des fraudes.
Les méthodes utilisées en
mélisso-palynologie
Depuis les travaux fondamentaux de ZANDER (1935, 1937,
1941,1949 et 1951), un grand nombre d'examens microscopiques
de miels ont été faits dans beaucoup de pays Européens ou
autre. L'expérience ainsi acquise, rend souhaitable de
donner une nouvelle version des « méthodes
d'analyse pollinique des miels »
publiées par la Commission Internationale de Botanique Apicole de
l'Union Internationale des Sciences Biologiques UISB
(19621963) in J. LOUVEAUX, A. MAURIZIO et G. VORWOHL (1970).
Le principe de ces méthodes repose sur le fait que
tous les miels naturels contiennent en suspension avant et après leur
extraction des constituants figurés microscopiques dont les plus
importants sont les grains de pollen provenant des fleurs que
l'abeille a visitées pour la récolte du nectar.
Outre les grains de pollen, les miels naturels peuvent contenir en très
faibles
quantites: des spores de champignons, des algues microscopiques,
des levures, des grains d'amidon, des fragments
d'insectes et des poussières atmospheriques.
Par centrifugation d'une solution de miel
dans l'eau, les elements figures peuvent être concentres
dans un très faible volume pour en confectionner des preparations dont
l'examen sous microscope apporte les informations sur son
origine botanique, son origine geographique, son mode
d'extraction, sa souillure eventuelle par des matières
insolubles dans l'eau, son etat de conservation et son degre
de filtration.
L'identification des pollens, des spores de
champignons et autres elements figures d'origine vegetale
renseigne sur l'origine botanique et geographique du miel.
La mesure ou la simple estimation du volume de culot de
centrifugation permet d'obtenir des informations sur le mode
d'extraction et le degre de filtration du miel.
L'abondance relative des levures renseigne
sur l'etat de conservation du miel, quand à
l'abondance relative des poussières atmospheriques, des
particules minerales, des fragments d'insectes ou des grains
d'amidon renseigne sur la purete du miel (Anonyme, 1977).
3.3.1. Méthode classique
La technique d'extraction et de montage des
pollens a ete codifiee par la Commission Internationale de Botanique Apicole
sous la forme suivante:
10 g de miel sont mis en solution dans l'eau
chaude (< 40°c) et centrifuge à 3000
tours/minutes pendant 10 minutes. Le culot de centrifugation est preleve,
depose sur lame, seche, inclus dans la glycerine gelatinee et recouvert
d'une lamelle. Après solidification complète du
milieu, la preparation est lutee au baume du Canada (LOUVEAUX, MAURIZIO et
VORWOHL, 1970).
Ces mêmes auteurs recommandent, pour les miels riches
en colloïdes, de centrifuger non pas dans l'eau distillee
mais dans l'eau acidulee (5 g d'acide
sulfurique par litre d'eau distillee) afin de permettre la
dissolution d'une grande partie de ces colloïdes. Le
culot doit être rince à l'eau distillee par une
nouvelle centrifugation pour eliminer l'acide qui pourra se
concentrer dangereusement lors du sechage du frottis.
Une autre methode preconisee par LOUVEAUX, A.MAURIZIO, VORWOHL
(1970), P.M.LUTIER et B.E.VAISSLERE (1993) consiste à
l'elimination de la plus grande partie des colloïdes
ainsi que des petites particules qui gênent
l'observation des grains de pollens par la filtration du
sediment mis en suspension dans l'eau sur un filtre Millipore
de porosite 3 ou 5 i. Le pollen restant sur le filtre est lave, filtre puis le
sediment est inclut comme decrit plus haut.
Bien que ces techniques donnent satisfaction dans presque tous
les cas, il semble que de nouveaux progrès soient possibles. En effet,
d'après LOUVEAUX (1968), les preparations
obtenues présentent très souvent deux
défauts: elles manquent de clarté, ce qui rend plus difficiles
les observations, et elles se conservent mal.
3.3.2. Méthode
d'acétolyse
Jusqu'à 1970, la Commission
Internationale de Botanique Apicole de l'U.I.S.B, ne mentionne
pas l'acétolyse du miel parmi les méthodes de
Mélisso-palynologie.
En 1967, VORWHOL exclut l'acétolyse
des méthodes d'analyse du miel comme prenant trop de
temps et provoquant la destruction d'éléments
figurés accessoires tels que les algues, levures, morceaux
d'insectes intéressant pour
l'étude du miel (GADBIN, 1979).
Les arguments de VORWHOL demeurent valables pour
l'étude des divers composants du miel, mais en
Mélisso-palynologie plusieurs faits ont rendu nécessaire
l'application des méthodes de traitement
acétolytique mises au point par ERDTMAN (1936, 1943, 1952 et 1960).
L'acétolyse seule, permet par la
clarification des structures de la paroi pollinique qu'elle
opère, une observation assez fine permettant la détermination des
formes polliniques et l'identification des taxons inconnus et
douteux (GADBIN, 1979). Ce type de traitement permet une bonne conservation des
préparations.
La méthode de l'acétolyse peut se
schématiser ainsi:
· Déshydratation du matériel par
l'acide acétique pur.
· Traitement au bain-marie du matériel dans un
mélange des parties d'anhydride acétique et
d'une partie d'acide sulfurique.
· Lavages multiples par centrifugation.
3.4. L'analyse sensorielle :
C'est une technique qui fait appel tout
d'abord au sens de l'observation (couleur,
propreté, homogénéité de la masse, défaut
éventuel de cristallisation etc...), on procède ensuite à
un examen olfactif qui permet de déceler les odeurs et les arômes.
Enfin, la dégustation permet d'apprécier les
saveurs du miel, d'en percevoir les différentes
composantes (goût sucré, acidité ou amertume) on peut
aussi, de cette façon apprécier éventuellement la finesse
de la cristallisation (GONNET et VACHE, 1985).
Selon leurs origines, les différents miels
présentent des caractères visuels, olfactifs, gustatifs et
tactiles particulièrement diversifiés. L'examen
organoleptique d'un produit est la fiche descriptive
donnée par l'ensemble des perceptions sensorielles
ressenties par le consommateur. Il peut ainsi apprécier ses
qualités essentielles mais aussi ses défauts. Il ne remplace
cependant pas les examens physico- chimiques et botaniques mais intervient
pour
confirmer une appellation. Ces analyses sont
réalisées dans des pièces inodores, climatisées
à 20 °C, 60 % d'humidité
et en lumière diurne. Les dégustateurs travaillent loin des repas
et ne doivent pas porter d'odeurs avec eux. Le miel
étudié est versé dans un verre à pied.
3.4.1. La Couleur
La couleur se détermine généralement par
comparaison entre la couleur de l'échantillon et celle
d'une gamme de couleur de référence
(Procédé Lovobond) ou par analyse de
l'intensité lumineuse perçue au travers de deux
prismes, l'un coloré servant de référence
et l'autre de forme identique contenant
l'échantillon de miel à analyser
(procédé Pfund, color grader),
l'intensité de la coloration
s'exprime, pour le procédé Lovibond, par la
désignation du numéro de filtre de référence
(N° allant de 30 à 850). Pour le
procédé Pfund, on utilise une mesure métrique,
correspondant au déplacement lors de l'examen, du
chariot portant les prismes dans l'appareil, exprimé en
millimètre (1,1 à 14). Il existe une table de comparaison des
deux mesures ou 1,1 Pfund correspond à des miels pratiquement incolores,
850L. ou l4p. à des miels presque noirs.
3.4.2. La Granulation
White et al. (1962), ont établi une échelle de
granulométrie qui présente une hiérarchie de
cristallisation allant de 0 (miel totalement liquide) à 9
(cristallisation complète et dure). Les cristaux
peuvent être facilement observés à l'aide
d'un polarimètre ou simplement entre deux feuilles de
plastique Polaroïd, cependant, la cristallisation du miel est
généralement appréciée par analyse sensorielle.
En ce cas elle est simplement qualifiée de: très
fine, fine, assez grossière, homogène, irrégulière,
etc... Appréciation laissée à la discrétion de
l'observateur.
4. Qualité du miel et normes internationales
:
4.1. La qualité du miel :
Un miel de qualité doit être un produit sain,
extrait dans de bonnes conditions d'hygiène,
conditionné correctement, qui a conservé toutes ses
propriétés d'origine et qui les conservera le
plus longtemps possible. Il ne doit pas être adultéré et
doit contenir le moins possible (peut-on encore dire pas du tout) de polluants
divers, antibiotiques, pesticides, métaux lourds ou autres produits de
notre civilisation industrielle (SCHWEITZER 2004).
4.1.1. Facteurs essentiels de composition et de
qualité :
Le miel vendu en tant que tel ne doit pas contenir
d'ingrédient alimentaire, y compris des additifs alimentaires, et seul
du miel pourra y être ajouté. Le miel ne doit pas avoir de
matière, de goût, d'arôme ou de contamination inacceptable
provenant de matières étrangères absorbées durant
sa transformation et son entreposage. Le miel ne doit pas avoir commencé
à fermenter ou être effervescent. Ni le pollen ni les constituants
propres au miel ne pourront être éliminés sauf si cette
procédure est inévitable lors de l'élimination des
matières inorganiques ou organiques étrangères.
-Le miel ne doit pas être chauffé ou
transformé à un point tel que sa composition essentielle soit
changée et/ou que sa qualité s'en trouve
altérée.
- Aucun traitement chimique ou biochimique ne doit être
utilisé pour influencer la cristallisation du miel (CODEX STAN 1981).
4.1.2. Les normes internationales relatives aux miels
:
Les normes internationales concernant le miel sont
spécifiées dans une directive européenne relative au miel
et dans la norme pour le miel du Codex Alimentarius qui font tous deux
actuellement l'objet d'une
révision.
Vu qu'aujourd'hui on utilise
des méthodes d'analyse à la fois nouvelles et
plus performantes, il est nécessaire de revoir les normes qui
s'appuient sur ces nouvelles méthodes (BOGDANOV
1999).
-Projets du Codex Alimentarius et de
l'UE relatifs aux normes pour le miel
Cette norme valable pour le commerce international du miel
devra être respectée par tous les gouvernements. Les
critères spécifiques relatifs à la composition du miel de
qualité (tableau n°8) n'ont par
contre pas force de loi et les partenaires commerciaux sont libres de les
appliquer (BOGDANOV 1999).
Tableau 8: Norme concernant la qualité
du miel selon le projet CL 1998/12-S du Codex
Alimentarius et selon le
projet de l`UE 96/0114 (CNS)
|
Critères de qualité
|
Projet du Codex-
|
Projet de l`UE
|
|
Teneur en eau
|
|
|
|
Général
|
= 21 g/100g
|
= 21 g/100g
|
|
Miel de bruyère, de trèfle
|
= 23 g/100g
|
= 23 g/100g
|
|
Miel industriel ou miel de pâtisserie
|
= 25 g/100g
|
= 25 g/100g
|
|
Teneur en sucres réducteurs
|
|
|
|
Miels qui ne sont pas mentionnés ci-dessous
|
= 65 g /100 g
|
= 65 g /100 g
|
|
Miel de miellat ou mélanges de miel de miellat et de
nectar
|
= 45 g /100 g
|
= 60 g /100 g
|
|
Xanthorrhoea pr.
|
= 53 g /100 g
|
= 53 g /100 g
|
|
Teneur en saccharose apparent
|
= 5 g/100 g
|
= 5 g/100 g
|
|
Miels qui ne sont pas mentionnés ci-dessous
|
|
|
|
Robini, Lavandula, Hedysarum, Trifolium, Zitrus,
Medicago,
|
= 10 g/100 g
|
= 10 g/100 g
|
|
Eucalyptus cam., Eucryphia luc. Banksia menz.*
|
= 15 g/100 g
|
-
|
|
Calothamnus san., Eucalyptus scab., Banksia
gr.,Xanthorrhoea pr. Miel de miellat et mélanges
de miel de miellat et de nectar
|
|
|
|
Teneur en matières insolubles dans
l`eau
|
|
|
|
Général
|
= 0,1 g/100 g
|
= 0,1 g/100 g
|
|
Miel pressé
|
= 0,5 g/100 g
|
= 0,5 g/100 g
|
|
Teneur en matières minérales
(cendres)
|
= 0,6 g/100 g
|
= 0,6 g/100 g
|
|
Miel de miellat ou mélanges de miel de miellat et de
nectar, miel de châtaignier
|
= 1,2 g/100 g
|
= 1,2 g/100 g
|
|
Acidité
|
= 50 meq/kg
|
= 40 meq/kg
|
|
Activité diastasique, (indice diastasique
en unités de Schade)
|
|
|
|
Après traitement et mise en pot (Codex)
|
|
|
|
Tous les miels du commerce (UE)
|
= 8
|
= 8
|
|
Général
|
= 3
|
= 3
|
|
Miels avec une teneur enzymatique naturellement faible
|
|
|
|
Teneur en hydroxyméthylfurfural
|
= 60 mg/kg
|
= 40 mg/kg
|
|
Après traitement et mise en pot (Codex)
|
|
|
|
Tous les miels du commerce (UE)
|
|
|
Tableau 9. Teneur en sucre et
conductivité électrique: Proposition d`une
nouvelle norme
BOGDANOV et al. (2001)
|
Nouveaux critères de qualité
proposés
|
Valeur
proposée
|
|
Teneur en sucre
|
|
|
Somme du fructose et du glucose
|
|
|
Miel de nectar
|
= 60 g / 100 g
|
|
Miel de miellat ou mélanges de miel de miellat et de
nectar
|
= 45 g / 100 g
|
|
Saccharose
|
|
|
= 5 g/ 100 g
|
|
Miels qui ne sont pas énumérés ci-dessous
|
|
|
Banksia, Zitrus, Hedysarum, Medicago, Robinia,
Rosmarinus
|
= 10 g/ 100 g
|
|
Lavandula
|
= 15 g/ 100 g
|
|
Conductivité électrique
|
|
|
Miel de nectar à l`exception des miels
énumérés ci-dessous et des mélanges de ceux-ci;
mélanges de miel de miellat et de nectar.
|
= 0,8 mS/cm
|
|
Miel de miellat et de chataîgnier, à
l`exception des miels énumérés ci-
dessous et des mélanges de ceux-ci.
|
= 0,8 mS/cm
|
|
Exceptions: Banksia, Erika, Eucalyptus, Eucryphia,
Leptospermum,
|
|
|
Melaleuca, Tilia.
|
|
Partie
Expérimentale
Quatrième
Chapitre
Matériels et
méthodes
Chapitre. IV. Matériels et méthodes
1. Choix des échantillons de miel
Nous avons travaillé sur 9 échantillons de miel
des années 2008 et 2009 provenant de différentes régions
de la wilaya de Djelfa et 1 échantillon provenant de la région de
la Mitidja et 4 autres échantillons des miels importés, à
chaque échantillon, il à été attribué un
code désignant :
- l'origine géographique du miel ;
- l'origine florale présumée ;
- la date de récolte ;
- mode d'extraction.
Tableau 10: Présentation des
échantillons du miel étudiés
|
N° de
l'échantillon
|
Date de
récolte
|
Lieu de récolte
|
Origine florale
présumée
|
Type
d'extraction
|
|
Miels locaux
|
01
|
Aout 2008
|
Messâad (Oued
Djdey)
|
Jujubier
|
Mécanique
|
|
02
|
Avril 2009
|
Messâad (El
gahera)
|
Toutes fleurs
|
Manuel
|
|
03
|
Juin 2008
|
Amn Ouassara
(Sersou)
|
Toutes fleurs
|
Mécanique
|
|
04
|
Juin 2008
|
Amn el-bel
|
Toutes fleurs
|
Manuel
|
|
05
|
Juin 2008
|
Amn Ouassara
(Sersou)
|
Toutes fleurs
|
Mécanique
|
|
06
|
Juin 2009
|
Messâad (Tamdit)
|
Toutes fleurs
|
Mécanique
|
|
07
|
Juin 2009
|
Messâad (Mlaga)
|
Les épineux
|
Mécanique
|
|
08
|
Juin 2009
|
Hassi bahbah
|
Toutes fleurs
|
Mécanique
|
|
09
|
Mai 2009
|
Amn Ouassara
(Sersou)
|
Toutes fleurs
|
Mécanique
|
|
10
|
Juin 2009
|
Mitidja (Boufarik)
|
Les agrumes
|
Mécanique
|
|
Miels import&
|
11
|
Juin 2008
|
Espagne
|
Toutes fleurs
|
Mécanique
|
|
12
|
Juin 2008
|
Arabie saoudite
|
Toutes fleurs
|
Mécanique
|
|
13
|
Juin 2008
|
Inde
|
Toutes fleurs
|
Mécanique
|
|
14
|
Juin 2008
|
Mali
|
Toutes fleurs
|
Mécanique
|
2. Le Protocole expérimental
Nous avons adopté le protocole expérimental
présenté au niveau de l'organigramme ci
après :
Miels purs
Répartition en flacons et
conservation à
l'abri de
l'humidité et de
la
lumière
Analyses physico-
chimiques et polliniques
Analyses polliniques
Teneur en eau, Degré brix,
l'HMF,
les protéines, l'acidité.
Analyses chimiques
Indice de réfraction,
Absorbance,
Densité,
pH, Conductibilité
électrique
Analyses physiques
- Examen microscopique de la
présence des grains de
pollen
(quantité), des différentes formes
de grains de
pollen.
- Prise des photos
Caractérisation chimique
Caractérisation
physiques
Identification du pollen et
estimation de
l'origine florale
Evaluation de la qualité et
comparaison des miels
Figure 6 : Le protocole expérimental
3. Analyse physique 3.1. La densité
La densité est obtenue en calculant le quotient de la
masse volumique d'un miel et de la même masse volumique
d'eau distillée.
On pèse 5 mg d'eau distillée et on
note le poids, également pour l'échantillon
à analyser dont on note le poids aussi, La densité est
exprimée par la relation:
D = M / M'
Où:
M : Masse du volume du miel;
M' : Masse de même volume
d'eau distillée. 3.2. Le pH
Selon LOUVEAUX (1985), le pH est mesuré en solution dans
l'eau à 10%, à l'aide
d'un pH-mètre. (figure 7 et 8)
Le pH (ou potentiel hydrogène ou indice de
Sorênsen) est défini comme le cologarithme de la concentration en
ions H dans une solution. Pour le miel, c'est un indice de la
« réactivité acide »
du produit.
Le miel est mis en solution à 10 % dans
l'eau distillée. Il suffit de plonger la pointe de
l'électrode dans le liquide la valeur du pH
s'affiche au potentiomètre au centième
d'unité. Le pH-mètre doit être
étalonné avant son utilisation à. l'aide
des solutions tampons (de 7 et 4 par exemple).

Figure 7 : Préparation des Solutions du
miel Figure 8 : Le pH-mètre utilisé
3.3. La conductibilité
électrique
Selon LOUVEAUX (1985), la mesure de la conductibilité
électrique se fait au moyen d'un conductimètre
dans une solution de miel à 20 % de matière sèche (figure
n° 9). On opère à
20°C. La mesure est rapide, mais la préparation de
la solution exige une pesée précise et une mesure de la teneur en
eau.
Cette méthode a pour objet de vérifier si la valeur
de la conductivité électrique du miel analysé est
compatible avec son appellation florale.
Pour la mesure de la conductibilité électrique, il
suffit de préparer une solution à 20% de miel avec de
l'eau distillée, puis plonge la pointe de
l'électrode du conductimètre
électrique.
Lire directement sur l'écran la valeur de
la conductivité électrique.

Figure 9 : Le conductimètre
électrique utilisé 3.4. L'absorbance
La mesure de l'absorbance a été
faite selon la méthode de la FAO (1969). Peser 5g de miel et dissoudre
dans 100 ml d'eau distillée pour une solution de 5% de
concentration. La mesure de l'absorbance est
réalisée à l'aide d'un
spectrophotomètre à 575 nm après avoir étalonner
l'appareil avec de l'eau distillée.
4. Analyse chimique 4.1. Teneur en eau
Selon LOUVEAUX (1982), la mesure de la teneur en eau se fait
très simplement au moyen d'un refractomètre. Le
miel à analyser doit être parfaitement liquide.
La goutte de miel est déposée sur la platine du
prisme d'un réfractomètre de type Abbé
à thermomètre incorporé et répartie en couche
mince. La lecture est faite à travers l'oculaire au
niveau de la ligne horizontale de partage entre une zone claire et une zone
obscure. Cette ligne coupe une échelle verticale graduée
directement en pourcentage d'humidité dans le miel. La
température du prisme est notée.
En se rapportant au Tableau de CHATAWAY (1932) (tableau
n°6), nous obtenons le pourcentage d'eau
correspondant à l'indice de réfraction à
20°C.

Figure 10 : Refractomètre spécial
pour le miel
4.2. Degré brix
Grâce à la méthode de
réfractométrie, on peut évaluer le taux de matière
sèche.
La lecture est faite sur l'échelle qui
indique la teneur en matière sèche ou degré brix qui se
trouve en parallèle avec l'échelle de
l'indice de réfraction.
4.3. Dosage des protéines
Le dosage de protéine s'effectue selon la
méthode de BIURET, en réalisant la gamme
d'étalonnage à partir d'une
solution étalon en SAB de 10g/L. (voir annexe n°
3)
A partir d'une solution de 10% de miel, 1 ml
est versé dans un tube à essai, et on ajoute 4 ml de
réactif de Gornall, on met le mélange dans une cuvette au
spectrophotomètre réglé à une longueur
d'onde X = 540 nm. Le
spectrophotomètre doit être étalonné par une
solution composée par 4 ml de réactif de Gornall et 1 ml
d'eau physiologique (comme blanc).
La teneur en protéine est exprimée comme suite :
= x 2.163 x 10
A : absorbance, 2.163 : le coefficient de correction
retiré à partir la courbe
d'étalonnage.
4.4. La détermination de
l'acidité
L'acidité libre est obtenue en
traçant la courbe de neutralisation du miel par une solution
d'hydroxyde de sodium et la détermination du pH du
point équivalent.
Pour cela, 5g de miel sont pesé et dissout dans
quelques millilitres d'eau distillée et la solution est
amenée à un volume de 50 ml dans une fiole jaugée. Avec
une pipette, 25 ml sont prélevés et versés dans un
bécher. Le liquide est agité à l'aide
d'un agitateur magnétique puis dosé à
l'aide d'un potentiomètre avec
l'hydroxyde de sodium à 0,05 N. Le pH doit être
noté immédiatement après chaque addition
d'hydroxyde de sodium.
Lorsque les variations de pH deviendront minimes, pH compris
entre 8,5 et 9, le volume de l'hydroxyde de sodium
versé dans le bécher doit être calculé pour
déterminer l'acidité libre.
L'acidité libre est exprimée en
milliéquivalent d'hydroxyde de sodium nécessaire
pour porter le pH au point équivalent E, pour 1000 grammes de miel.
|
1000 x x
Acidité libre =
|
|
|
Où:
|
|
|
|
V : le volume en milliéquivalents
d'hydroxyde de sodium verse pour atteindre le pH du point
équivalent (E) lors de la neutralisation du miel;
N : la normalité de l'hydroxyde de sodium
(0,05); M : prise d'essai (5 g).
4.5. La détermination de la teneur en HMF
:
L'HMF est un dérivé de déshydratation des
sucres ; qui apparaît par réaction chimique naturelle lors du
vieillissement ou du chauffage des miels.
L'analyse a été effectuée selon la
méthode de WINKLER parue dans le rapport de la commission international
du miel (2002). Cette mesure de la teneur en HMF est basée sur la mesure
de l'absorbance de cette molécule par spectrophotométrie
réglée à une longueur d'onde de 550nm, en présence
d'acide barbiturique et de la paratoluidine.
Dans une fiole jaugée de 100 ml, on dissout 500 mg
d'acide barbiturique dans 70 ml d'eau distillée au bain marie, on
refroidit et en complète avec de l'eau distillée jusqu'au trait
de jauge.
Solution de paratoluidine :
Dans une fiole jaugée de 250 ml, on dissout 25 g de
paratoluidine dans 50 ml de isopropanole, on ajoute 25 ml d'acide
acétique cristallisable puis on complète jusqu'au trait de jauge
avec le isopropanole.
Laisser la solution de paratoluidine à l'obscurité
24 heures avant son utilisation. Dissoudre 2 g de miel dans 10 ml d'eau
distillée (2tubes par échantillon).
Le dosage est réalisé selon le tableau suivant :
|
Essai Réactifs
|
Tube d'essai
|
Tube témoin
|
|
Solution de miel
|
1 ml
|
1 ml
|
|
Réactif de la paratoluidine à 10%
|
2,5 ml
|
2,5 ml
|
|
Solution d'acide
barbiturique à 0,5%
|
0,5 ml
|
-
|
|
Eau distillée
|
-
|
0,5 ml
|
La préparation du tube à essai ne doit pas
dépasser deux minutes. Expression des résultats
:
L'absorbance d'essai est mesurée par rapport au blanc
à 550 nm dans les trois à quatre minutes en maximum.
La teneur en HMF est exprimée en mg pour 1 kg de miel,
elle est donnée par la formule suivante :
HMF (mg/kg)= (192 x A x 10) / prise d'essai en g
Dont :
192 : facteur de dilution et coefficient d'extinction, obtenue
expérimentalement à partir de l'HMF pur. A : absorbance.
5. Analyse pollinique
L'analyse pollinique des miels donne une
information précise sur les principales plantes mellifères et
permet de caractériser les miels par leur origine botanique ou
géographique. Elle apporte des informations importantes sur le
comportement de butinage des abeilles. Par ailleurs, la teneur en pollen des
miels permet de contrôler leur qualité, augmentant ainsi leur
valeur économique.
Méthode classique
Nous avons utilisé la méthode classique
donnée par LOUVEAUX et al. (1970), 10 g de miel (pesés exactement
à 0,1 g près) sont dissous dans 20 ml d'eau
chaude (ne pas dépasser 40 °C). La solution
obtenue est centrifugée pendant cinq minutes et le liquide restant est
séparé du sédiment; le liquide peut être
versé ou aspiré. Pour une meilleure élimination des sucres
du miel il est recommandé de reprendre le dépôt par 10 ml
d'eau distillée, de le transvaser dans un tube à
centrifugation plus petit et de centrifuger à nouveau pendant cinq
minutes.
On porte le dépôt (au moyen
d'une anse de platine ou d'une fine baguette
de verre), autant que possible de façon quantitative, sur une lame
porte-objet et on le répartit sur une surface d'environ
20 X 20 mm.
Après séchage (plus avantageusement à la
chaleur mais sans excéder 40 °C) on
l'inclut dans la glycérine-gélatine et on
recouvre d'une lamelle. La glycérine-gélatine
est préalablement liquéfiée au bain- marie à 40
°C (MAURIZIOU, 1970).
La détermination de l'origine
géographique et de l'origine botanique repose sur
l'identification des pollens et des autres constituants du
sédiment d'un miel ainsi que sur leur
dénombrement. L'identification se fait avec
l'aide des données tirées des publications
spécialisées comme ceux de Mm NAAS. O (2006), et au moyen de
préparations de comparaison. (Voir les figures 11 à 15)

Figure 11: Centrifugeuse de type SIGMA

Figure 12: Les calibres de la Centrifugeuse

Figure 13: Solution du miel
après
centrifugation (le dépôt de pollens)

Figure 15 : Microscope optique a
appareil
photo numérique

Figure 14 : Lames préparées et
séchées
6. Analyse statistique :
Dans l'analyse statistique nous sommes
basé sur l'analyse de la variance (ANOVA), à
travers cette analyse, nous avons essayé de comparer entre les
différents échantillons du miel, ainsi entre les miels locaux et
les introduits.
Lors de cette analyse, nous avons établi le test de
NEWMAN-KEULS, qui est un test de comparaison de moyennes par paires,
pratiqué à l'issue d'une ANOVA.
(Annexe n°2)
Pour cela nous avons utilisé le logiciel de Statistica
version 6.1.
Cinquième
Chapitre
Résultats et
discussions
Chapitre. V. Résultats et discussions
1. L'analyse physique 1.1. La densité
:
L'examen du tableau n°
11 nous révèle les densités des miels pris en
échantillons pour notre étude, nous remarquons ainsi que la
densité des 14 échantillons de miel analysés est comprise
entre 1.41 et 1.49.
Tableau 11 : Valeurs de la densité des
échantillons du miel:
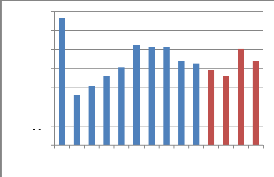
Densité
1.47 1.46 1.46
1.46
1.49
1.45
1.44
1.43
1.43
1.42
1.41
1.45 1.45
1.44
1 2 3 4 5 6 7 8 9 10 11 12 13 14
1.50
1.48
1.46
1.44
1.42
1.40
1.38
1.36
Figure 16 : Représentation graphique
des valeurs de la
densité
Miels locaux
|
N° Ech
|
Densité
|
Origine florale
|
|
1
|
1.49
|
Jujubier
|
|
2
|
1.41
|
Toutes fleurs
|
|
3
|
1.42
|
Toutes fleurs
|
|
4
|
1.43
|
Toutes fleurs
|
|
5
|
1.44
|
Toutes fleurs
|
|
6
|
1.47
|
Toutes fleurs
|
|
7
|
1.46
|
Les épineux
|
|
8
|
1.46
|
Toutes fleurs
|
|
9
|
1.45
|
Toutes fleurs
|
|
10
|
1.45
|
Les agrumes
|
|
import&
|
11
|
1.44
|
Toutes fleurs
|
|
12
|
1.43
|
Toutes fleurs
|
|
13
|
1.46
|
Toutes fleurs
|
|
14
|
1.45
|
Toutes fleurs
|
|
Moyenne
|
1.45
|
|
|
E. Type
|
0.02
|
|
Var
|
0.0004
|
De là nous pouvons dire que tous les
échantillons de miel répondent aux normes
préconisées par l'Association française
de normalisation et qui sont de 1.39 à 1.41
jusqu'à 1.52. LOUVEAUX (1985), indique que les
variations de la densité des miels proviennent surtout des variations de
la teneur en eau. Plus un miel est riche en eau et moins il est dense,
c'est ainsi que l'échantillon 1
présente le miel le plus dense à 1.49 avec une teneur en eau la
plus faible soit 13.10%.
En revanche, on observe que l'échantillon
2 est le moins dense avec une densité de 1.41, ce miel présente
une teneur en eau de 18.50%.
L'analyse de la variance relative à la
densité des miels des différents échantillons montre une
différence hautement significative (p=0.01) entre les
différents miels. (Voir l'annexe
n° 1)
Tandis qu'elle ne montre aucune
différence significative entre les miels locaux et les miels
importés.
1.2. Le pH :
Les résultats issus de cette analyse nous donnent
indication sur la réaction acide des miels analysés. Les valeurs
du pH sont présentées dans le tableau ci-dessous.
Tableau 12 : Les valeurs du pH obtenues:
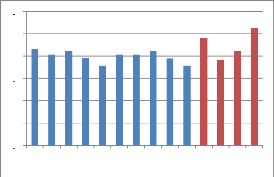
1 2 3 4 5 6 7 8 9 10 11 12 13 14
6
pH
5.25
4.82
5
4.23
3.82
4
3.57
3
2
1
0
4.32 4.07 4.243.91
4.06 4.07 4.213.89
3.56
Figure 17 : Représentation graphique des
valeurs du pH
Miels locaux
|
N° Ech
|
pH
|
Origine florale
|
|
1
|
4.32
|
Jujubier
|
|
2
|
4.07
|
Toutes fleurs
|
|
3
|
4.24
|
Toutes fleurs
|
|
4
|
3.91
|
Toutes fleurs
|
|
5
|
3.56
|
Toutes fleurs
|
|
6
|
4.06
|
Toutes fleurs
|
|
7
|
4.07
|
Les épineux
|
|
8
|
4.21
|
Toutes fleurs
|
|
9
|
3.89
|
Toutes fleurs
|
|
10
|
3.57
|
Les agrumes
|
|
import&
|
11
|
4.82
|
Toutes fleurs
|
|
12
|
3.82
|
Toutes fleurs
|
|
13
|
4.23
|
Toutes fleurs
|
|
14
|
5.25
|
Toutes fleurs
|
|
Moyenne
|
4.14
|
|
|
E. Type
|
0.45
|
|
Var
|
0.2034
|
Les valeurs du pH de nos échantillons de miel miels
oscillent entre 3.56 et 5.25 avec une moyenne de 4.14. Donc touts les miels
étudiés sont acides.
DONADIEU (1984), et GONNET (1982), signale que le miel est
acide, son pH est en moyenne entre 3.5 et 6. Le pH d'un miel
est en relation avec la quantité d'acides ionisables
qu'ils renferment (ions H+), ainsi de sa
composition minérale.
GONNET (1986), ajoute que le pH est une mesure qui permet la
détermination de l'origine florale du miel. Ainsi les
miels issus de nectar ont un pH compris entre 3.5 et 4.5, par contre ceux
provenant des miellats sont compris entre 5 et 5.5.
Nous remarquons ainsi que les échantillons 14 et 11,
ont un pH de 5.25 et 4.82 respectivement, ces échantillons
représentent les miels importés, et peuvent être issus des
mélanges de nectar et de miellat. Les autres échantillons sont
tous, des miels de nectar selon les normes préconisées par GONNET
(1986).
Le même auteur, affirme qu'un pH faible
de l'ordre de 3.5 pour un miel, prédétermine un
produit << fragile >> pour la
conservation duquel faudra prendre beaucoup de précautions. Par contre
un miel à pH 5 ou 5.5 se conservera mieux et plus longtemps.
Une relation indirecte peut apparaître entre le pH et la
conductibilité électrique des miels, et nous avons trouvé
que les miels ont une CE élevée, enregistrent un pH
élevé, cette relation peut donner une idée sur
l'origine des miels.
L'analyse de la variance du pH montre une
différence très hautement significative
(p=0.001) entre les différents échantillons
expérimentés, tandis qu'elle montre une
différence significative (p=0.05) entre les miels
locaux et les miels importés.
Comparativement aux normes préconisées relatives
au pH des miels, nous pouvons conclure que les miels locaux sont des miels de
nectar, tandis que les miels introduits contiennent une quantité de
miellat.
1.3. La Conductibilité
électrique
Les résultats issus de cette analyse sont portés
sur le tableau N° 13. Les valeurs de la
conductibilité électrique obtenues comprises entre 2.23 et 7.60,
avec une moyenne de 4.02 x10-4 s/cm.
Ces valeurs correspondent à ceux rapportées par
le Codex, ces dernières ne dépassent pas
8x10-4 s/cm pour les miels de nectar, et
n'abaissent pas moins de 8 x10-4
s/cm pour les miels de miellat.
GONNET (1982), signale que les miels foncés sont les
plus riches en matières minérales ionisables, donc bon conducteur
de courant. LOUVEAUX (1976), affirme que les sels sont apportés par le
pollen, par le nectar des fleurs ou par les miellats.
Nous remarquons que les échantillons 14 (CE=
7.60x10-4 s/cm) et 13 (CE=
7.01x10-4 s/cm) sont des miels importés,
peuvent contenir une certaine quantité du miellat, ils sont les plus
foncés (allant à la couleur noire), ces miels sont les meilleurs
conducteurs du courant électrique.
Tableau 13 : Les valeurs de la
conductibilité électrique :
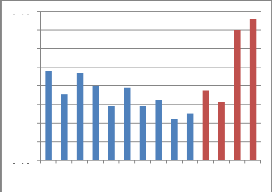
1 2 3 4 5 6 7 8 9 10 11 12 13 14
8.00
7.6
CE
7.01
7.00
6.00
4.80
4.68
5.00
4.00
3.89
3.76
4.00
3.55
3.14
3.00
2.53
2.23
2.00
1.00
0.00
2.933.25
2.92
Figure 18 : Représentation graphique
des valeurs de la
conductibilité électrique
Miels locaux
|
N° Ech
|
CE ×10-4 s/cm
|
Origine florale
|
|
1
|
4.80
|
Jujubier
|
|
2
|
3.55
|
Toutes fleurs
|
|
3
|
4.68
|
Toutes fleurs
|
|
4
|
4.00
|
Toutes fleurs
|
|
5
|
2.92
|
Toutes fleurs
|
|
6
|
3.89
|
Toutes fleurs
|
|
7
|
2.93
|
Les épineux
|
|
8
|
3.25
|
Toutes fleurs
|
|
9
|
2.23
|
Toutes fleurs
|
|
10
|
2.53
|
Les agrumes
|
|
import&
|
11
|
3.76
|
Toutes fleurs
|
|
12
|
3.14
|
Toutes fleurs
|
|
13
|
7.01
|
Toutes fleurs
|
|
14
|
7.6
|
Toutes fleurs
|
|
Moyenne
|
4.02
|
|
|
E. Type
|
1.58
|
|
Var
|
2.4843
|
Nous remarquons par contre que les autres échantillons
sont des miels de nectar, ils sont les plus clairs et conduisent relativement
mal le courant.
Dans ce conteste, GONNET, (1986), affirme que la
conductibilité électrique du miel apporte une indication
précieuse dans la définition d'une appellation,
les miels issus de nectar ont une CE allant de 1 à 5
x10-4 s/cm, et ceux issus de miellats de 10
à 15 x10-4 s/cm, par contre, les valeurs
médianes correspondent souvent à des mélanges naturels des
deux origines.
Donc, nous pouvons conclure que tous nos miels sont des miels
de fleurs, excepté les échantillons importés
n° 14 et 13 qui présentent des valeurs
médianes, donc ils s'agissent d'un
mélange de nectar et de miellat. Nous remarquons ainsi au niveau de
l'analyse statistique relative à la CE une
différence significative (p=0.05) entre les miels
locaux et les miels introduits. (Annexe n°1)
1.4. L'absorbance
Le tableau ci-après, nous donne les valeurs de la teneur
de l'absorbance obtenue des différents
échantillons et qui varie de 0.045 à 0.292 avec une moyenne de
0.097.
Les échantillons 14 et 13, qui sont des miels
importés, présentent respectivement une absorbance de 0.292 et
0.144, cela est dû à leur couleur très foncée. Cette
couleur pourra être expliquée par la présence de certaine
quantité de miellat.
WHITE et al (1962), cités par CHAUVIN (1968), et
LOUVEAUX (1968), indique que la couleur du miel est liée à la
teneur en matière minérale et en protéines. Ainsi les
miels foncés sont plus riches en cendres, en protéines, et en
colloïdes.
Tableau 14 : Classement des valeurs de
l'absorbance:
|
Miels locaux
|
N° Ech
|
Abs
|
Origine florale
|
|
1
|
0.101
|
Jujubier
|
|
2
|
0.106
|
Toutes fleurs
|
|
3
|
0.053
|
Toutes fleurs
|
|
4
|
0.120
|
Toutes fleurs
|
|
5
|
0.062
|
Toutes fleurs
|
|
6
|
0.074
|
Toutes fleurs
|
|
7
|
0.066
|
Les épineux
|
|
8
|
0.058
|
Toutes fleurs
|
|
9
|
0.045
|
Toutes fleurs
|
|
10
|
0.069
|
Les agrumes
|
|
import&
|
11
|
0.079
|
Toutes fleurs
|
|
12
|
0.084
|
Toutes fleurs
|
|
13
|
0.144
|
Toutes fleurs
|
|
14
|
0.292
|
Toutes fleurs
|
|
Moyenne
|
0.097
|
|
|
E. Type
|
0.062
|
|
Var
|
0.0039
|
Figure 19 : Représentation graphique
des valeurs de
l'absorbance
Absorbance
0.350
0.300
0.250
0.200
0.150
0.100
0.050
0.000
1 2 3 4 5 6 7 8 9 10 11 12 13 14
0.292
101
0.106
0.053
0.120
0.062
0.074
0.066
0.058
0.045
0.069
0.079
0.084
0.144
La comparaison des moyennes de l'absorbance
ne montre pas une différence significative entre les différents
échantillons de miel. Tandis qu'elle montre une
différence significative (p<0.05) entre les miels
locaux et les miels introduits. Nous pouvons expliquer cette différence
par :
> L'origine du miel, nectar ou miellat,
> L'espèce végétale
dont provient ce miel ;
> La composition chimique et notamment la concentration en
cendres et la teneur en protéines.
2. L'analyse chimique 2.1. La teneur en eau
Après avoir rapporté les indices de
réfraction obtenus à la table de CHATAWAY (tableau
n°5), nous avons obtenus les résultats suivants
classés dans le tableau ci-après.
Tableau 15 : Les valeurs de la teneur en eau
des échantillons de miel:
T. en eau
1 2 3 4 5 6 7 8 9 10 11 12 13 14
3.10
18.50
16.20
18.20
16.00
17.40
15.10 14.30
15.80
18.8018.90
18.00
17.80
17.30
20.00
15.00
10.00
5.00
0.00
Figure 20 : Représentation graphique
des valeurs de la
teneur en eau
Miels locaux
N° Ech
|
Eau%
|
Origine florale
|
|
13.10
|
Jujubier
|
|
18.50
|
Toutes fleurs
|
|
16.20
|
Toutes fleurs
|
|
18.20
|
Toutes fleurs
|
|
16.00
|
Toutes fleurs
|
|
17.40
|
Toutes fleurs
|
|
14.30
|
Les épineux
|
|
15.10
|
Toutes fleurs
|
|
15.80
|
Toutes fleurs
|
|
18.80
|
Les agrumes
|
import&
|
11
|
18.90
|
Toutes fleurs
|
|
18.00
|
Toutes fleurs
|
|
17.80
|
Toutes fleurs
|
|
17.30
|
Toutes fleurs
|
Moyenne
|
16.81
|
|
E. Type
|
1.78
|
|
3.1644
|
|
Nous remarquons que la teneur en eau de nos
échantillons du miel varie de 13.10 à 18.90, avec une moyenne de
16.81. Ces valeurs se situent bien dans l'intervalle
préconisé par le Codex alimentarius, et qui ne
dépasse pas 21% en général, et ne dépasse pas 25%
pour les miels industriels. Selon CHAUVIN (1968), les miels
commercialisés ont une teneur en eau très variées, allant
de 14 à 25, l'optimum se situe en 17 et 18.
La teneur en eau est une donnée très importante
à connaitre, car elle conditionne la qualité du miel, en effet
seuls les miels dont la teneur en eau est inférieur à 18% sont
bon à conserver (GONNET, 1982).
Les valeurs enregistrées de nos miels
n'excèdent pas cette norme excepté les
échantillons 11, 10, 2, et 4, qui présentent les plus
élevées, soit 18.90%, 18.80%, 18.50%, 18.20% respectivement. Ceci
pourra être expliqué par :
> une récolte précoce de ce miel,
c'est-à-dire avant leur maturation. C'est le cas de
l'échantillon 2 qui est récolté au mois
d'avril 2009, avant la maturation et
l'operculation totale.
> le nombre de jours que ces miels ont passé dans les
maturateurs.
> une extraction dans un milieu humide. LOUVEAUX (1968),
et PROST (1972) signalent que l'extraction du miel dans un
milieu assez humide peut entrainer une absorption
d'humidité.
> des conditions dans les quelles ce miel est
élaboré, récolté, transformé et
entreposé dans la ruche, c'est le cas de
l'échantillon n° 10 qui provient
de la Mitidja région caractérisée par le taux
élevé de l'humidité atmosphérique
surtout durant le printemps, la période de récolte de cet
échantillon de miel, dans ce contexte GONNET (1993) signale
qu'une humidité relativement élevée
pendant la récolte va conduire à une déshumidification
difficile du nectar par l'abeille, donc production
d'un miel riche en eau, instable sur le plan physique et
biologique et susceptible de se dégrader rapidement.
Les échantillons 1 et 7 sont les miels les plus
pauvres en eau, soit respectivement 13.10% et 14.30 %, ces derniers offrent une
très bonne conservation. Leur faible teneur en eau pourra être
expliquée par :
> l'extraction qui est effectuée
durant une période très chaude (mois
d'août pour l'échantillon 1)
ainsi que le miel de jujubier est pratiquement sec, et qui se conserve quelque
soit la température du stockage et le nombre de levure qui contient, car
selon GONNET (1982), en dessous de 15 % d'eau, la fermentation
n'intervient jamais.
Les 6 échantillons les plus pauvres en eau
n° (3, 5, 9, 8, 7 et 1) présentent des miels
locaux de la région steppique caractérisée par un climat
chaud et sec.
Les miels importés ont une teneur de 17.30 à
18.90, ils sont conservés longtemps à température ambiante
dans les étalages de commerce, mais ils n'ont pas
montrés des signes de fermentation, ceci pourra être
expliqué par une pasteurisation qui a tué les levures
responsables de la fermentation.
La comparaison des valeurs de la teneur en eau montre une
différence très hautement significative
(p<0.001) entre les différents miels
analysés. Tandis qu'elle montre qu'il
n y a aucune différence significative entre les miels locaux et les
miels introduits.
2.2. La teneur en protéines
L'analyse de tableau n° 16
nous a permet de constater que les miels présentent une teneur en
protéines comprise entre 0.09 et 0.88% avec une moyenne de 0.50.
LOUVEAUX (1968), signale que la teneur en protéines est
d'environ 0.26% en moyenne avec un maximum de 0.83%. Il ajoute
que les matières azotées peuvent être présente dans
les secrétions salivaires de l'abeille.
WHITE (1962), signale que les miels convenablement
récolté sont pauvres ou très pauvres en
protéines.
Tableau 16 : Les valeurs de la teneur en
protéines obtenues:
teneur en pro nes
1 2 3 4 5 6 7 8 9 10 11 12 13 14
0.45
0.39
0.29 0.31
0.21
0.09
0.18
0.55
0.66
0.51
0.80
0.60
0.40
0.20
0.00
Figure 21 : Représentation graphique
des valeurs de la
teneur en protéines
Miels locaux
|
N° Ech
|
Prot%
|
Origine florale
|
|
1
|
0,29
|
Jujubier
|
|
2
|
0,31
|
Toutes fleurs
|
|
3
|
0,21
|
Toutes fleurs
|
|
4
|
0,45
|
Toutes fleurs
|
|
5
|
0,39
|
Toutes fleurs
|
|
6
|
0,83
|
Toutes fleurs
|
|
7
|
0,84
|
Les épineux
|
|
8
|
0,09
|
Toutes fleurs
|
|
9
|
0,18
|
Toutes fleurs
|
|
10
|
0,87
|
Les agrumes
|
|
import&
|
11
|
0,55
|
Toutes fleurs
|
|
12
|
0,66
|
Toutes fleurs
|
|
13
|
0,51
|
Toutes fleurs
|
|
14
|
0,88
|
Toutes fleurs
|
|
Moyenne
|
0.50
|
|
|
E. Type
|
0.27
|
|
Var
|
0.0755
|
Nos échantillons sont conformes aux normes requises.
Les échantillons 14 et 10 sont exceptés, avec une teneur en
protéines de 0.88 et 0.87% respectivement, ces échantillons
enregistrent des valeurs dépassent la norme, mais sont très
proches. Cette teneur peut être expliquée par :
> La forte concentration du pollen dans ces miels. GONNET
(1985), rapporte que lors de l'extraction manuelle par
pression des gâteaux de cire, quelques larves d'abeilles
ainsi que des pollens sont très souvent écrasés.
32.0
35.0
|
Miels locaux
|
N° Ech
|
Ac L meq/kg
|
Origine florale
|
|
1
|
15.0
|
Jujubier
|
|
2
|
25.0
|
Toutes fleurs
|
|
3
|
11.0
|
Toutes fleurs
|
|
4
|
25.0
|
Toutes fleurs
|
|
5
|
25.0
|
Toutes fleurs
|
|
6
|
22.5
|
Toutes fleurs
|
|
7
|
19.0
|
Les épineux
|
|
8
|
17.5
|
Toutes fleurs
|
|
9
|
15.0
|
Toutes fleurs
|
|
10
|
25.0
|
Les agrumes
|
|
import&
|
11
|
23.0
|
Toutes fleurs
|
|
12
|
29.0
|
Toutes fleurs
|
|
13
|
32.0
|
Toutes fleurs
|
|
14
|
14.0
|
Toutes fleurs
|
|
Moyenne
|
22.0
|
|
|
E. Type
|
5.81
|
|
Var
|
33.7308
|
Figure 22 : Représentation graphique
des valeurs de
l'acidité
Acidité
1 2 3 4 5 6 7 8 9 10 11 12 13 14
30.0
25.0
20.0
15.0
10.0
5.0
0.0
15.0
25.0
11.0
25.0 25.0
22.5
19.017.5
15.0
25.023.0
29.0
24.0
Les autres échantillons présentent des teneurs
en protéines répondent à la norme requise, ces
échantillons sont convenablement récoltés et par
conséquent, ils sont généralement pauvres en
protéines (LOUVEAUX, 1968).
L'analyse de la variance de la teneur en
protéines révèle une différence très
hautement significative (p=0.001) entre les différents
échantillons du miel. Ceci pourra être expliqué par la
variation de la quantité de pollens présentent dans chaque miel,
récolté dans des conditions différentes.
En revanche, elle ne marque aucune différence
significative entre les miels locaux et les miels importés.
D'après LOUVEAUX (1968), les miels
foncés sont plus riche en azote que les miels clairs. Les
échantillons 14, 10, et 7, les plus foncés se montre les plus
riches en protéines que les échantillons 1, 3, 9, 8.
La plus faible valeur est enregistrée pour
l'échantillon n°8 qui est le plus
clairs avec une valeur de 0.09%.
2.3. L'acidité
D'après le tableau
n° 17, nous remarquons que les valeurs de
l'acidité libre des miels varient de 11.0 à 32.0
milliéquivalent/kg, avec une moyenne de 22.0.
Tableau 17 : Les valeurs de
l'acidité libre:
Selon les normes internationales de Codex (2001),
l'acidité libre du miel ne doit pas dépasser 50
milliéquivalents d'acide par 1000 g. Nos miels sont conformes aux normes
préconisées.
GONNET (1982), affirme que tous les miels sont acides. Ils
contiennent des acides organiques libres ou combinés sous forme de
lactones.
D'après BOGDANOV (1999), et GONNET
(1992), l'acidité est un critère de
qualité important, elle donne des indications fort importantes de
l'état du miel. Les échantillons 12, 2, 4, 5, 10
et plus particulièrement l'échantillon 13,
prédéterminent des produits fragiles pour la conservation car
l'acidité forte de milieu favorise la
dégradation des hexoses en HMF qui déprécie la
qualité du miel. La fermentation du miel provoque une augmentation de
l'acidité dans le miel.
La présence de certains acides dans ces miels est
probablement due au nectar ou miellat, mais leur origine principale est
à recherché dans les secrétions salivaires de
l'abeille et dans les processus enzymatiques et fermentatifs
(LOUVEAUX, 1968).
La comparaison des moyennes de
l'acidité révèle une différence
très hautement significative (p=0.001) entre les
différents miels analysés. Tandis qu'elle ne
marque aucune différence significative entre les miels locaux et les
miels d'importation commercialisés.
2.4. L'Hydroxyméthylfurfural (HMF):
Le tableau n° 18 nous a permet de constater
que les miels présentent une teneur en HMF comprise entre 0.05 et 98.80
mg/kg, avec une moyenne de 18.91 mg/kg.
MARCEAU, et al. (1994), signale que le principal critère
d'évaluation mesurable de la qualité du miel est la concentration
en Hydroxyle méthyle furfural.
D'un point de vue législatif, tous les
miels analysés sont conformes aux normes de Codex alimentarius qui
limitent l'HMF à 60 mg/kg, à
l'exception l'échantillon
n° 11 et 12, qui sont des miels importés, ils
enregistrent une teneur d'HMF élevée, soit 98.80
et 67.69 mg/kg. Cette teneur élevée pourra être
expliqué par :
> la teneur élevée en eau, selon MARCEAUX et
al. (1994), une teneur en eau élevée favorise la transformation
des sucres en HMF, nous avons enregistré une teneur en eau
respectivement de 18.90 % et 18.00 %.
> l'excès de la chaleur et
l'entreposage prolongé sont des facteurs encore plus
importants dans ce processus (MARCEAUX et al. 1994).
> une acidité élevée du miel
favorisent la dégradation du fructose en HMF (GONNET, 1982 et MARCEAUX
et al. 1994), nous avons enregistré pour ces deux échantillons
une acidité de 23.0 et 29.0 meq/kg.
> PROST (1987), mentionne que la
pasteurisation peut augmenter très sensiblement la couleur et le taux de
l'HMF qu'il caractérise les miels
chauffés et vieux, de là nous pouvons dire que les
échantillons 11 et 12 sont des vieux miels chauffés, et leur date
de récolte ne pourra pas être celle mentionnée sur
l'étiquette.
Tableau 18 : Les des valeurs de
l'HMF :
HMF
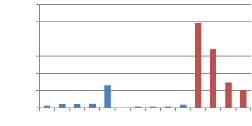
120.00
100.00
80.00
67.69
60.00
29.32
40.00
25.89
3.89
20.39
1.20
1.19 3.44
20.00
2.69
4.194.79
0.05
1.15
0.00
98.80
1 2 3 4 5 6 7 8 9 10 11 12 13 14
Figure 23 : Représentation graphique
des valeurs de la
teneur en HMF
Miels locaux
|
N° Ech
|
HMF mg/kg
|
Origine florale
|
|
1
|
2.69
|
Jujubier
|
|
2
|
3.89
|
Toutes fleurs
|
|
3
|
4.19
|
Toutes fleurs
|
|
4
|
4.79
|
Toutes fleurs
|
|
5
|
25.89
|
Toutes fleurs
|
|
6
|
0.05
|
Toutes fleurs
|
|
7
|
1.15
|
Les épineux
|
|
8
|
1.20
|
Toutes fleurs
|
|
9
|
1.19
|
Toutes fleurs
|
|
10
|
3.44
|
Les agrumes
|
|
import&
|
11
|
98.80
|
Toutes fleurs
|
|
12
|
67.69
|
Toutes fleurs
|
|
13
|
29.32
|
Toutes fleurs
|
|
14
|
20.39
|
Toutes fleurs
|
|
Moyenne
|
18.91
|
|
|
E. Type
|
29.57
|
|
Var
|
874.1539
|
Les échantillons 10, 1, 8, 9, 7, et 6 ont une teneur
faible en HMF, ces échantillons présentent des miels frais de
l'année 2009. D'après BOGDANOV,
(2001), la teneur en HMF d'un miel est pratiquement nulle au
moment de la récolte. Ces le cas du miel n° 6 qui
est récolté avant quelques jours de faire
l'analyse. Le même auteur ajoute
qu'elle augmente progressivement, lentement tout
d'abord pour s'accélérer par la
suite.
L'analyse de la variance du dosage
d'HMF révèle une différence très
hautement significative (p=0.001) entre les différents
échantillons de miel. Elle révèle aussi une
différence très hautement significative
(p=0.001) entre les miels locaux et les miels
importés.
Les miels 11 et 12 sont des miels importés, dont on
ignore leurs dates de récolte, ils peuvent être des miels qui ont
passé une longue durée pour être commercialiser (vieux
miels).
3. L'analyse pollinique :
Nous avons observé nos échantillons de miel sous le
microscope, de là et selon la quantité de pollens
présente, nous avons classé les miels analysées en 3
groupes :
Classa I : Beaucoup de pollens (+++)
Classe II : peu de pollens (++)
Classe III : Très peu de pollens (+)
Les variations quantitative et qualitative en pollens sont due
à :
> La diversité des espèces
végétales butinées par l'abeille, et leur
intérêt apicole: soit l'espèce
butinée est pollinifère, nectarifère ou les deux à
la fois.
> Le travail et les besoins de la colonie
d'abeille.
> La technologie du miel : le mode
d'extraction (mécanique ou manuelle), LOUVEAUX et al, (1970),
constatent que les miels d'extracteur centrifuge contiennent
peu de sédiment. La filtration : Les miels
importés (commercial) qui ont subit à une ultrafiltration, va
causer l'élimination des pollens.
Classa I : Beaucoup de pollens (+++) :
Ce sont les miels qui renferment un nombre important de pollens,
dans cette classe, nous avons observé beaucoup de pollens dans les
échantillons 1, 2, et 6.
Nos observations au niveau de
l'échantillon N°01 nous
révèle la présence d'un nombre important
de graines de pollen, et après l'identification par
comparaison avec des pollens de référence, nous pouvons dire
qu'il confirme son appellation florale présumée,
puisque il est dominé par les grains de pollen de Ziziphus
lotus, et nous pouvons dire aussi qu'il est un miel
monofloral.
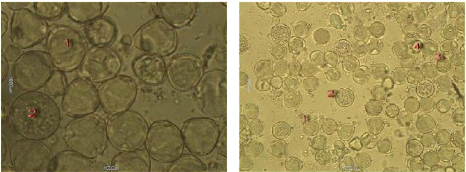
Figure 24 : Vue microscopique des grains de
pollen du miel n°1 (gx100)
Figure 25 : Vue microscopique des grains de
pollen du miel n°1 (gx40)
Les échantillons 2 et 6, sont des miels de toute fleur,
ils présentent des déférentes formes de pollens,
après identification par comparaison avec des pollens de
référence nous citons par exemple quelques pollens trouvé
dans ces échantillons "1- Prunus sp. 2- Papaver rhoeas.
3- Malva sylvestris 5- Eucalyptus sp" pour
l'échantillon 2, et "1- Rosmarinus officinalis
2-Borrago officinalis 3- Galactites tomentosa 4- Prunus
sp. 5- Eucalyptus sp. 6-, vicia sp ", pour
l'échantillon 6, donc nous pouvons dire
qu'ils confirment l'appellation florale
présumée, donc ce sont des miels toutes fleurs.
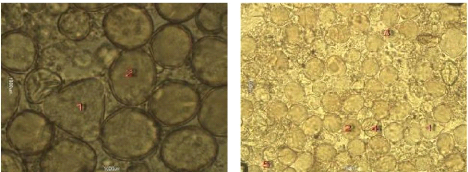
Figure 26 : Vue microscopique des grains de
pollen du miel n°2 (g×100)
Figure 27 : Vue microscopique des grains de
pollen du miel n°2 (g×40)
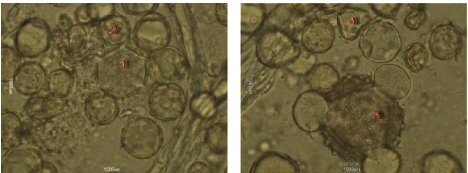
Figure 28 : Vue microscopique des grains de
pollen du miel n°6 (g×100)
Figure 29 : Vue microscopique des grains de
pollen du miel n°6 (g×100)
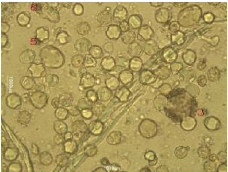
Figure 30 : Vue microscopique des grains de
pollen du miel n°6 (g×40)
Classe II : peu de pollens (++) :
Dans cette classe nous avons regroupé les miels qui
représentent une faible quantité en pollens sous le microscope,
nous retiendrons ainsi dans cette classe les échantillons 4, 5, 7, et
12.
Nous remarquons que les échantillons 4, et 5 renferment
plusieurs formes de pollens, donc ils confirment l'appellation
et sont tous des miels multifloraux.
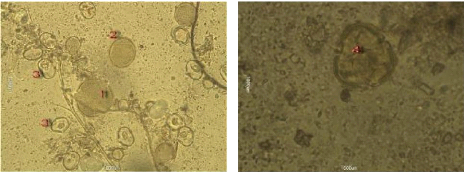
Figure 31 : Vue microscopique des grains de
pollen du miel n°4 (g×40)
Figure 32 : Vue microscopique des grains de
pollen du miel n°4 (g×100)
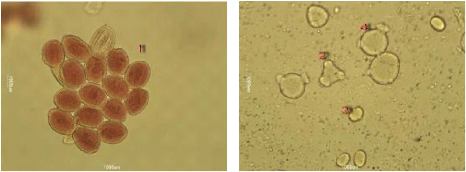
Figure 33 : Vue microscopique des grains de
pollen du miel n°5 (g×40)
Figure 34 : Vue microscopique des grains de
pollen du miel n°5 (g×40)
Après l'identification des pollens de
l'échantillon 7 (les épineux), nous constatons
qu'il ne confirme pas l'appellation florale
présumée puisque il renferme plusieurs formes de pollens, 1-
Galactites tomentosa 2- Peganum harmala. 3- Vicia sp.
4- pyrus sp. 5- Raphanus raphanistrum. 6- Olea
europaea. Ainsi que les pollens du chardon (Galactites tomentosa)
ne sont pas dominants, donc c'est un miel de toutes fleurs.
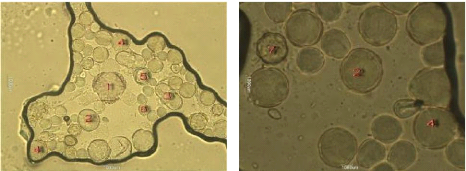
Figure 35 : Vue microscopique des grains de
pollen du miel n°7(g×40)
Figure 36 : Vue microscopique des grains de
pollen du miel n°7(g×40)
Tandis que l'échantillon 12 illustre
des formes variées de grains de pollen tels que 1- pyrus sp. 2-
Achillea sp. 3- Vicia sp. 6- Aster sp, ce miel
présente un miel importé qu'il
confirme son appellation florale.
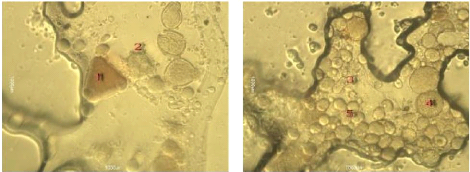
Figure 37 : Vue microscopique des grains de
pollen du miel n°12 (g×40)
Figure 38 : Vue microscopique des grains de
pollen du miel n°12 (g×40)
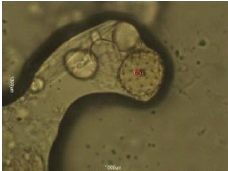
Figure 39 : Vue microscopique des grains de
pollen du miel n°12 (g×100)
Classe III : Très peu de pollens (+) :
C'est la classe qui regroupe les
échantillons de miel qui ont une très faible quantité de
grains de pollen sous le microscope, les échantillons 3, 8, 9, 10, 11,
13, et 14 appartiennent à cette classe.
L'échantillon 10,
présumé miel d'agrumes, cette miel ne confirme
pas cette appellation car les grains de pollen trouvées
présentent des différentes formes, parmi ces dernières
nous citons : 1- Polygonum equisteforme 2- Eucalyptus sp et
les pollens de Citrus sp (3) qui ne sont pas dominantes.

|
Figure 40 : Vue microscopique des grains de
pollen du miel n°10 (g×100)
|
Figure 41 : Vue microscopique des grains de
pollen du miel n°10 (g×100)
|
|
|
|
Figure 42 : Vue microscopique des grains de
pollen du miel n°10 (g×100)
|
|
Les échantillons 3, 8, et 9, découvrent des
différentes formes de pollens en faible quantité, ils confirment
l'appellation présumée, qui sont tous provenant
des miels multifloraux.

Figure 43 : Vue microscopique des grains de
Figure 44 : Vue microscopique des grains
pollen du miel n°3
(g×40) de pollen du miel n°3
(g×40)
Les échantillons 11, 13, et 14, qui sont des
miels importés, contiennent un très peu nombre
de pollens, qui n'ont pas la même forme, donc ils
confirment l'appellation présumée, qui sont des
miels polyfloraux.
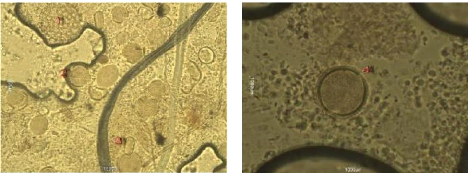
Figure 45 : Vue microscopique des grains de
pollen du miel n°11 (g×40)
Figure 46 : Vue microscopique des grains de
pollen du miel n°11 (g×100)
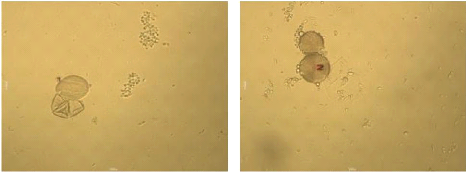
|
Figure 47 : Vue microscopique des grains de
pollen du miel n°13 (g×40)
|
Figure 48 : Vue microscopique des grains de
pollen du miel n°13 (g×40)
|
|
|
|
Figure 49 : Vue microscopique des grains de
pollen du miel n°14 (g×40)
|
|
Les résultats de l'analyse pollinique
sont résumés au niveau de tableau 19 Tableau 19
: Le spectre pollinique de 14 échantillons.
|
Echantillon
|
Origine
florale
|
Présence/
Absence
|
Pollens déterminés
|
|
1
|
Jujubier
|
+++
|
1- Ziziphus lotus (Jujuber) 2- Peganum harmala
(Harmal) 3- Aster sp. 4- Eucalyptus sp.
|
|
2
|
Toutes fleurs
|
+++
|
1- Prunus sp, Pyrus sp. 2- Papaver rhoeas. 3-
Malva sylvestris (Malvacées) 4-Indéterminé. 5-
Eucalyptus sp.
|
|
3
|
Toutes fleurs
|
+
|
1- Arbre fruitier de type Pyrus sp. 2- Helianthus
anuus (Tournesol) 3- Arbre fruitier de type Prunus sp.
|
|
4
|
Toutes fleurs
|
++
|
1- Indéterminé. 2- Caryophylacées. 3-
Hedysarum coronarium (sulla). 4- Raphanus raphanistrum.
|
|
5
|
Toutes fleurs
|
++
|
1- Indeterminé. 2- Prunus sp. 3- Apiacées
(Tapsia garganica) 4- Trifolium sp.
|
|
6
|
Toutes fleurs
|
+++
|
1- Lamiacées, (Salvia verbinaca), ou
Rosmarinus officinalis (romarin) 2- Boragonacées (Borrago
officinalis) 3- Genre Achillea, ou Galactites tomentosa (chardon
laiteux) (composées). 4- Vitacées (Vitis vinifera),
Prunus sp. 5- Eucalyptus sp. (Myrtacées)
6- Daucus carota, vicia sp (v.faba)
|
|
7
|
Les épineux
|
++
|
1- Sclofilariacées, ou Achellia sp ou
Galactites tomentosa (chardon laiteux) 2- Peganum harmala.
3- Vicia sp. 4- Prunus sp, pyrus sp. 5-
Raphanus raphanistrum. (Cruciferes) 6- Olea europaea.
(Oléacées) 7- Borrago officinalis.
(Borraginacées)
|
|
8
|
Toutes fleurs
|
+
|
Indéterminé
|
|
9
|
Toutes fleurs
|
+
|
Indéterminé
|
|
10
|
Les agrumes
|
+
|
1- Polygonum equisteforme (Polygonacées).
2- Eucalyptus sp. (Myrtacées) 3- Citrus
sp (Rutacées).
|
|
11
|
Toutes fleurs
|
+
|
1- Indéterminé. 2- Acacia cyanophylla
(mimosa). 3- Indeterminé. 4- Olea europaea ou Citrus sp
5- Centauria sp, Raphanus sp.
|
|
12
|
Toutes fleurs
|
++
|
1- Arbre fruitier de type pyrus sp. 2- Achillea
sp. 3- Vicia sp. 4- Oscalis prescaprae (oscalis)
(Oxalidacées). 5- Indéterminé. 6- Aster sp.
|
|
13
|
Toutes fleurs
|
+
|
1 et 2 sont Indéterminés.
|
|
14
|
Toutes fleurs
|
+
|
1 est indéterminé.
|
(+++) : Beaucoup de pollens, (++) : Peu de pollens, (+) :
Très peu de pollen.
Conclusion
Générale
Conclusion
L'étude que nous avons menée nous a permis
d'évaluer la qualité des miels à partir des
différentes analyses effectuées et par conséquent de
comparer les miels locaux et ceux importés. Au terme de ce travail nous
pouvons constater les particularités suivantes:
v' Les miels locaux enregistrent des teneurs faibles
relativement en eau, ces miels offrent une très bonne conservation,
à l'exception de l'échantillon
de la Mitidja, récolté dans un milieu assez humide, les
échantillons 2, et 4 ont une teneur en eau qui dépasse 18 car ils
sont récoltés avant l'operculation totale et il leur faut de
passer un temps dans les maturateurs avant d'être
commercialisé.
v' Nous avons remarqué que les miels les plus pauvres en
eau, sont des miels locaux
récoltés dans la région steppique, qui est
caractérisé par un climat chaud et sec.
v' Les miels importés ont une teneur en eau de 17.30
à 18.90, ils sont conservés à température ambiante
dans les étalages de commerce pendant longtemps, mais ils
n'ont pas montrés aucuns signes de fermentation, ceci
s'explique par une pasteurisation qui a tué les levures
responsables de la fermentation.
1' L'échantillon
n°1 qui provient de la région de Messâad,
est un miel mono floral de jujubier, il est pratiquement sec, se conserve
quelque soit la température du stockage et le nombre de levure qui
contient.
v' Comparativement aux normes préconisées
relatives aux pH et la CE des miels, nous pouvons conclure que les miels locaux
sont des miels de nectar. Tandis que les miels importés, sont un
mélange de nectar et de miellat.
v' Les échantillons des miels importés,
présentent des valeurs d'absorbance importantes, dues
à leurs couleurs foncées ou très foncées. Ces
couleurs pourront être expliquées par l'abondance
de certaine quantité de miellat, généralement la couleur
des miels due à leur constitution en matière minérale et
en protéines.
v' Tous les miels locaux répondent aux normes
internationales préconisées, sauf
l'échantillon 10, il a un taux de protéine
dépassant légèrement la norme. Les miels locaux sont
généralement pauvres en protéines, ces miels sont
convenablement récoltés.
1' Les miels locaux de l'année 2009
ont un taux de l'hydroxyméthylefurfural presque nul, par contre deux
échantillons de miel importé (11 et 12) ont
présenté un taux d'HMF supérieur à la norme
autorisé par le codex. L'HMF est un indicateur de surchauffage de miel,
sa mauvaise conservation et de sa vieillesse. Cette analyse nous a permis de
déterminer l'âge de miels importés qui dépasse
l'année 2008 inscrite sur leurs étiquettes de commerce.
v' L'échantillon 13 qui provient de
l'Inde prédétermine un produit fragile à
la conservation car il contient une quantité importante des acides
libres, atteint à 32.0 meq/kg.
v' L'analyse de la variance montre une
différence très hautement significative entre les miels locaux et
les miels importés pour l'HMF, ainsi, elle montre une
différence significative pour le pH, la conductibilité
électrique, et l'absorbance. Tandis que ne marque
aucune différence significative entre les miels locaux et les miels
importés pour la densité, la teneur en eau, la teneur en
protéines et pour l'acidité.
v' Au niveau de l'analyse pollinique, nous
avons classé nos échantillons de miel en 3 classes,
d'une façon quantitative, nous avons remarqué
que la plupart des miels importés se situent dans la troisième
classe, qui renferme les échantillons les plus pauvres en pollens, ces
miels peuvent subir un traitement d'ultrafiltration, mais cela
devrait être mentionné sur l'étiquette ce qui n'est pas le
cas.
Notre étude nous conduit à déduire que
les miels locaux répondent aux normes internationales, car ils sont
naturels n'ayant subi aucun traitement technologique qui pourra nuire à
leur qualité. Tous les auteurs sont unanimes, le chauffage des miels
cause sa dégradation. Cependant on aurait complété notre
étude par l'analyse des sucres et l'étude du rapport glucose
fructose qui pourra nous aider à mieux interpréter sur la
qualité et l'âge des miels en générale et ceux
importés en particuliers. Nous tenons à citer que
l'absence des moyens encore une fois nous a
empêché de procéder à ce type d'analyse très
importante pour l'étude des qualités des miels.
Ces résultats sont des informations utiles surtout
actuellement, et avec l'ouverture du marché, la commercialisation d'un
miel de qualité nécessite de développer sa technologie,
suivre de bonnes conduites d'hygiène à fin
d'offrir un produit sain, et propre à la consommation
et à la conservation. Il faut aussi aider et encourager les apiculteurs
en matière de disponibilité des produits sanitaires et des moyens
matériels divers, oeuvré à la labialisation des miels de
terroir avec la création d'une marque, sensibiliser les consommateurs
sur les bienfaits des produits de l'abeille, et enfin
élaborer des réglementations (lois) sur la qualité des
miels locaux, et travailler sérieusement sur la normalisation des miels
algériens afin de faire face à l'importation frauduleuse sur
certains miels de très mauvaise qualité.
Références
Bibliographiques
Références Bibliographiques
ANCHLING. F, (2001) : Raconte-moi le
miel..., l'abeille de la France. Revue autorisées
par Apicervices françaises.
ANONYME, (1977): Méthodes officielles
d'analyse du miel, Arrêté du 15 février 1977,
N°77-79. Paris.
ANONYME, (2002): Journal Officiel des
Communités Européen, Annexe
ÉÉ. Direction 2001 /1 10/ce du conseille du 20
décembre 2001 relative au miel caractéristique de composition des
miels.06p.
ANONYME, (2003): Journal Officiel de la
République Française, Décret
n°2003-587 pris pour l'application de
l'article L.214-1 du code de la consommation en ce qui
concerne le miel.
AUBERT. S, GONNET. M, JOURDAN. P, (2004) :
Technique de réflectométrie usuelle pour la mesure de la
couleur des miels, Apidologie 303,313. 11p.
BARBIER .E, Claude-Yolande. P, (1961) :
Origine botanique et caractéristiques physicochimiques des
miels, Laboratoire apicole, Nice. 15p.
Barkani. M, (1994) : Les résultats de
recherche apicole obtenus à l'institut national agronomique
d'Alger. INA, Alger.
BELAID. M, (1999) : Etude
physico-chimique et palynologique de quelques miels d'Algérie :
Etablissement des normes d'identification. Thèse de Magister. INA
El Harrach. 213p.
BIRI. M, (1999): Le grand livre des
abeilles. L'apiculture moderne. Edition vecchi S.A paris. 260p.
BOGDANOV. S, (1999): Stockage,
cristallisation et liquéfaction du miel. Centre suisse de recherche
apicoles .05p.
BOGDANOV. S, LULLMANN. C, MARTIN. P, (2001):
Qualité du miel et norme international relative au miel.
Rapport de la commission international du miel. Abeille Cie
N° 71-4.1 2p.
BOGDANOV. S, RUOFF. K, ODDO PL, (2004):
Physicochemical methods for the characterisation of unifloral
honeys. Apidologie 35. 17p.
BOGDANOV. S, BIERI. K, GREMAUD. G, (2004) :
Produits apicoles, Pollen, Agroscope Liebefeld-Posieux, Station
fédérale de recherches en production animale et laitière
(ALP), Centre de recherches apicoles, Liebefeld-Berne, 6p.
BOGDANOV. S, BIERI. K, GREMAUD. G, (2004) :
Produits apicoles, Miel, Agroscope Liebefeld-Posieux, Station
fédérale de recherches en production animale et laitière
(ALP), Centre de recherches apicoles, Liebefeld-Berne, 37p.
BOGDANOV. S, K. BIERI, P. GALLMANN, (2005) :
Miels monofloraux suisses, Centre de recherches apicoles,
Station de recherches en production animale et laitière. 55p.
BÜDEL. A, (1968) : Microclimat des
sources de pollen, de nectar et de miellat, in Traité biologique de
l'abeille, Tome 3. Edition Masson de Cie, Paris. Pp
155-167.
CETAM-Lorraine, (2006) : Informations sur
les différentes analyses des miels, Laboratoire des analyses et
d'écologie apicole, 6p.
CHAHRA M, PAUL. S, BLEL. A, (2007): Some
Properties of Algerian Honey, APIACTA (42) 2007 PAGES, pp73 - 80.
CHAUVIN. R (1968) : Traité biologique
de l'abeille, Tome 3. Edition Masson de Cie, Paris. Pp :
298-310.
CHAUVIN. R (1968) : Actions
physiologiques et thérapeutiques des produits de la ruche, in
Traité biologique de l'abeille, Tome 3. Edition
Masson de Cie, Paris. Pp : 116-155.
DARRIGOL. J, (1979) : Le miel pour votre
santé.
DJERD. A, (2008) : Contrôle de
qualité des miels de la région de Djelfa, comparaison avec des
miels nationaux et des miels importés. Thèse
d'Ingéniorat en biologie, Université de
Djelfa.
DONADIEU. Y, (1982): Pollen :
thérapeutique naturelles. 5éme Ed Maloine S.A
Paris. 31p.
DONADIEU. Y, (1978): Le miel
thérapeutique. 2éme Ed Maloine S.A .Paris.28
p.
EMMANUELLE. R, (2002) : Le marché
mondial du miel, Centre d'Economie Sociale,
Université de Liège. 9p.
GADBIN. C, (1979): L'intérêt
de l'acétolyse en mélissopalynologie, Die Bedeutung der Acetolyse
in der Melissopalynologie, Laboratoire de Botanique historique et
Palynologie, E.R.A. n° 404 du C.N.R.S.
6p.
GONNET. M, (1982) : Le miel ; composition,
propriétés, conservation. INRA station expérimentale
d'apiculture. Pp : 1-18.
GONNET. M, (1986) : L'analyse des miels.
Description de quelques méthodes de contrôle de
qualité. Bul. Tech. Apic, 54, 13(1). Pp 17-36.
GONNET. M, VACHE. G, (1985) : Le gout de
miel. Ed. UNAF, Paris. 150p.
GONNET. M, (1963) :
L'hydroxyméthylfurfural dans les miels. Mise au point d'une
méthode de dosage. Station expérimentale
d'Apiculture, Ceyevct de Recherches agronomiques du Sud-Est,
Montfavet (Vaucluse). 15p.
HUCHET. E, COUSTEL. J, GUINOT. L, (1996):
Les constituants chimiques du miel. Méthode d'analyse
chimique. Département de science et l'aliment. Ecole Nationale
Supérieure des Industries Agricoles et Alimentaire. France. 16p.
JEAN-PROST. P, (1987): L'apiculture.
Connaître l'abeille .conduire le rucher. 6éme édition
Lavoisier.597p.
KHENFER. A et FETTAL. M, (2001): Le miel.
. Ministère de l'agriculture. Direction de la formation de la
recherche et de la vulgarisation.23p.
KLOFT. W, (1968) : Les insectes producteurs
de miellat, in Traité biologique de l'abeille, Tome 3.
Edition Masson de Cie, Paris. Pp : 248-262.
LAGACHERI. M et CABBANES. B, (2001): Les
plantations mellifères. Revue l'abeille de France
.N° 635.
LOBREAU-CALLEN. D et MARIE-CLAUDE. C, (2001) :
Les miels, Techniques de l'Ingénieur,
traité Agroalimentaire, 20p.
LOUVEAUX. J, (1968): Composition
propriété et technologie du miel. Les produits de la ruche,
in Traité de biologie de l'abeille. Tome 03. Ed Masson et Cie. 389p.
LOUVEAUX. J, (1968): L'analyse pollinique
des miels, in Traité biologique de l'abeille, Tome 3.
Edition Masson de Cie, Paris. Pp 324-361.
LOUVEAUX. J, (1985) : Les abeilles et leur
élevage. Edition Opida. Pp : 165-181.
LOUVEAUX. J, MAURIZIO. A et VORWOHL. G, (1970),
Les méthodes de la mélisso-palynologie, commission
internationale de botanique apicole de l'U.I.S.B. 17p.
LOUVEAUX. J, MAURIZIO. A, (1965) : Pollens
de plantes mellifères d'Europe, Ed. Union des Groupements Apicoles
Français.
MARCEAU. J, NOREAU. J et HOULE. E, (1994):
Les HMF et la qualité du miel. Volume 15
numéros 2. Fédération des Apiculteurs du Québec
.service de zootechnie, MAPAQ.04p.
MAURICE MARY, (2006) : Conditionnement du
miel pour sa vente en pots, Galerie Apicole Virtuelle.
MAURIZIO. A, (1968): La formation du miel.
Les produits de la ruche, in Traité de biologie de
l'abeille. Tome 03 .Ed Masson et Cie .389p.
MOKEDDEM. T, (1998) : Contribution
à l'analyse physicochimique et pollinique du miel d'oranger,
région de Mitidja. Thèse
d'Ingéniorat en agronomie. Université des
sciences et de la technologie de Blida
NAAS.O, (2006) : Analyse des grains de
pollen de quelques espèces steppiques par microscopie
électronique. Mémoire de magister. Université Z. A de
Djelfa.
SAINT ISMIER, (1996) : L'Analyse Pollinique
des Miels par l'Amateur.11p.
ZIEGLER. H, (1968) : La
sécrétion du nectar, in Traité biologique de l'abeille,
Tome 3. Édition Masson de Cie, Paris. Pp :
218-247.
Annexes
Annexe n°1 : Résultats de l'analyse
statistique : analyse de la variance et test Newman-Keuls
1. La densité
|
Analyse de la Variance de la densité. Effets
significatifs marqués à p < .05000
|
|
SC
|
dl
|
MC
|
SC
|
dl
|
MC
|
F
|
p
|
|
Densité
|
0.010099
|
13
|
0.000777
|
0.002061
|
14
|
0.000147
|
5.277199
|
0.001971
|
Test Newman-Keuls ; Variable Densité Différences
significatives marquées à p < .05000
|
{1}
|
{2}
|
{3}
|
{4}
|
{5}
|
{6}
|
{7}
|
{8}
|
{9}
|
{10}
|
{11}
|
{12}
|
{13}
|
{14}
|
|
e1 {1}
|
|
0.0015
|
0.0050
|
0.0181
|
0.0539
|
0.1217
|
0.2436
|
0.3081
|
0.0822
|
0.0751
|
0.0438
|
0.0184
|
0.2893
|
0.0754
|
|
e2 {2}
|
0.0015
|
|
0.4238
|
0.2591
|
0.1850
|
0.0204
|
0.0194
|
0.0212
|
0.1309
|
0.1433
|
0.1995
|
0.3453
|
0.0284
|
0.1336
|
|
e3 {3}
|
0.0050
|
0.4238
|
|
0.4238
|
0.4704
|
0.0748
|
0.0714
|
0.0774
|
0.3812
|
0.4001
|
0.4725
|
0.6452
|
0.1018
|
0.3932
|
|
e4 {4}
|
0.0181
|
0.2591
|
0.4238
|
|
0.8224
|
0.2493
|
0.2381
|
0.2533
|
0.7707
|
0.7762
|
0.7903
|
0.9356
|
0.3159
|
0.7929
|
|
e5 {5}
|
0.0539
|
0.1850
|
0.4704
|
0.8224
|
|
0.5504
|
0.5134
|
0.5118
|
0.8938
|
0.7773
|
0.8398
|
0.7193
|
0.5644
|
0.9489
|
|
e6 {6}
|
0.1217
|
0.0204
|
0.0748
|
0.2493
|
0.5504
|
|
0.9678
|
0.9852
|
0.6794
|
0.6569
|
0.4850
|
0.2529
|
0.9756
|
0.6369
|
|
e7 {7}
|
0.2436
|
0.0194
|
0.0714
|
0.2381
|
0.5134
|
0.9678
|
|
0.9035
|
0.6127
|
0.6074
|
0.4578
|
0.2384
|
0.9275
|
0.5428
|
|
e8 {8}
|
0.3081
|
0.0212
|
0.0774
|
0.2533
|
0.5118
|
0.9852
|
0.9035
|
|
0.5669
|
0.5885
|
0.4674
|
0.2495
|
0.8084
|
0.4525
|
|
e9 {9}
|
0.0822
|
0.1309
|
0.3812
|
0.7707
|
0.8938
|
0.6794
|
0.6127
|
0.5669
|
|
0.8715
|
0.9106
|
0.7316
|
0.5464
|
0.9356
|
|
e10 {10}
|
0.0751
|
0.1433
|
0.4001
|
0.7762
|
0.7773
|
0.6569
|
0.6074
|
0.5885
|
0.8715
|
|
0.8751
|
0.7118
|
0.6154
|
0.9670
|
|
e11 {11}
|
0.0438
|
0.1995
|
0.4725
|
0.7903
|
0.8398
|
0.4850
|
0.4578
|
0.4674
|
0.9106
|
0.8751
|
|
0.5733
|
0.5354
|
0.9429
|
|
e12 {12}
|
0.0184
|
0.3453
|
0.6452
|
0.9356
|
0.7193
|
0.2529
|
0.2384
|
0.2495
|
0.7316
|
0.7118
|
0.5733
|
|
0.3052
|
0.7707
|
|
e13 {13}
|
0.2893
|
0.0284
|
0.1018
|
0.3159
|
0.5644
|
0.9756
|
0.9275
|
0.8084
|
0.5464
|
0.6154
|
0.5354
|
0.3052
|
|
0.3396
|
|
e14 {14}
|
0.0754
|
0.1336
|
0.3932
|
0.7929
|
0.9489
|
0.6369
|
0.5428
|
0.4525
|
0.9356
|
0.9670
|
0.9429
|
0.7707
|
0.3396
|
|
2. Le pH
|
Analyse de la Variance de pH. Effets significatifs
marqués à p < .05000
|
|
SC
|
dl
|
MC
|
SC
|
dl
|
MC
|
F
|
p
|
|
ph
|
5.289886
|
13
|
0.406914
|
0.065600
|
14
|
0.004686
|
86.84146
|
0.000000
|
Test Newman-Keuls ; Variable pH
Différences significatives marquées à p <
.05000
|
{1}
|
{2}
|
{3}
|
{4}
|
{5}
|
{6}
|
{7}
|
{8}
|
{9}
|
{10}
|
{11}
|
{12}
|
{13}
|
{14}
|
|
e1 {1}
|
|
0.0255
|
0.2622
|
0.0008
|
0.0002
|
0.0251
|
0.0187
|
0.4064
|
0.0006
|
0.0002
|
0.0002
|
0.0003
|
0.4106
|
0.0002
|
|
e2 {2}
|
0.0255
|
|
0.1504
|
0.0833
|
0.0002
|
0.8861
|
1.0000
|
0.1380
|
0.0825
|
0.0002
|
0.0002
|
0.0187
|
0.1365
|
0.0002
|
|
e3 {3}
|
0.2622
|
0.1504
|
|
0.0040
|
0.0002
|
0.1537
|
0.1065
|
0.9003
|
0.0031
|
0.0002
|
0.0002
|
0.0008
|
0.8861
|
0.0002
|
|
e4 {4}
|
0.0008
|
0.0833
|
0.0040
|
|
0.0014
|
0.0460
|
0.1365
|
0.0049
|
0.7746
|
0.0012
|
0.0002
|
0.4106
|
0.0040
|
0.0002
|
|
e5 {5}
|
0.0002
|
0.0002
|
0.0002
|
0.0014
|
|
0.0002
|
0.0002
|
0.0002
|
0.0015
|
0.8861
|
0.0002
|
0.0053
|
0.0002
|
0.0002
|
|
e6 {6}
|
0.0251
|
0.8861
|
0.1537
|
0.0460
|
0.0002
|
|
0.9884
|
0.1736
|
0.0640
|
0.0002
|
0.0002
|
0.0164
|
0.1504
|
0.0002
|
|
e7 {7}
|
0.0187
|
1.0000
|
0.1065
|
0.1365
|
0.0002
|
0.9884
|
|
0.0602
|
0.1179
|
0.0002
|
0.0002
|
0.0255
|
0.0833
|
0.0002
|
|
e8 {8}
|
0.4064
|
0.1380
|
0.9003
|
0.0049
|
0.0002
|
0.1736
|
0.0602
|
|
0.0040
|
0.0002
|
0.0002
|
0.0010
|
0.7746
|
0.0002
|
|
e9 {9}
|
0.0006
|
0.0825
|
0.0031
|
0.7746
|
0.0015
|
0.0640
|
0.1179
|
0.0040
|
|
0.0011
|
0.0002
|
0.3240
|
0.0031
|
0.0002
|
|
e10 {10}
|
0.0002
|
0.0002
|
0.0002
|
0.0012
|
0.8861
|
0.0002
|
0.0002
|
0.0002
|
0.0011
|
|
0.0002
|
0.0028
|
0.0002
|
0.0002
|
|
e11 {11}
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
0.0002
|
0.0002
|
0.0002
|
|
e12 {12}
|
0.0003
|
0.0187
|
0.0008
|
0.4106
|
0.0053
|
0.0164
|
0.0255
|
0.0010
|
0.3240
|
0.0028
|
0.0002
|
|
0.0008
|
0.0002
|
|
e13 {13}
|
0.4106
|
0.1365
|
0.8861
|
0.0040
|
0.0002
|
0.1504
|
0.0833
|
0.7746
|
0.0031
|
0.0002
|
0.0002
|
0.0008
|
|
0.0002
|
|
e14 {14}
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
3. La conductibilité électrique
|
Analyse de la Variance CE Effets significatifs marqués
à p < .05000
|
|
SC
|
dl
|
MC
|
SC
|
dl
|
MC
|
F
|
p
|
|
Ce
|
64.92207
|
13
|
4.994005
|
0.110000
|
14
|
0.007857
|
635.6007
|
0.000000
|
Test Newman-Keuls ; Variable CE
Différences significatives marquées à p <
.05000
|
{1}
|
{2}
|
{3}
|
{4}
|
{5}
|
{6}
|
{7}
|
{8}
|
{9}
|
{10}
|
{11}
|
{12}
|
{13}
|
{14}
|
|
e1 {1}
|
|
0.0002
|
0.0265
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
e2 {2}
|
0.0002
|
|
0.0002
|
0.0010
|
0.0002
|
0.0050
|
0.0002
|
0.0046
|
0.0002
|
0.0002
|
0.0329
|
0.0012
|
0.0002
|
0.0002
|
|
e3 {3}
|
0.0265
|
0.0002
|
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
e4 {4}
|
0.0002
|
0.0010
|
0.0002
|
|
0.0002
|
0.2351
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0424
|
0.0002
|
0.0002
|
0.0002
|
|
e5 {5}
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
0.0002
|
0.9119
|
0.0109
|
0.0002
|
0.0007
|
0.0002
|
0.0642
|
0.0002
|
0.0002
|
|
e6 {6}
|
0.0002
|
0.0050
|
0.0002
|
0.2351
|
0.0002
|
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.1647
|
0.0002
|
0.0002
|
0.0002
|
|
e7 {7}
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.9119
|
0.0002
|
|
0.0076
|
0.0002
|
0.0014
|
0.0002
|
0.0329
|
0.0002
|
0.0002
|
|
e8 {8}
|
0.0002
|
0.0046
|
0.0002
|
0.0002
|
0.0109
|
0.0002
|
0.0076
|
|
0.0002
|
0.0002
|
0.0003
|
0.2351
|
0.0002
|
0.0002
|
|
e9 {9}
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
0.0046
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
e10 {10}
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0007
|
0.0002
|
0.0014
|
0.0002
|
0.0046
|
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
e11 {11}
|
0.0002
|
0.0329
|
0.0002
|
0.0424
|
0.0002
|
0.1647
|
0.0002
|
0.0003
|
0.0002
|
0.0002
|
|
0.0002
|
0.0002
|
0.0002
|
|
e12 {12}
|
0.0002
|
0.0012
|
0.0002
|
0.0002
|
0.0642
|
0.0002
|
0.0329
|
0.2351
|
0.0002
|
0.0002
|
0.0002
|
|
0.0002
|
0.0002
|
|
e13 {13}
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
0.0002
|
|
e14 {14}
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
|
Analyse de la Variance (données importés et
locaux.sta) Effets significatifs marqués à p < .05000
|
|
SC
|
dl
|
MC
|
SC
|
dl
|
MC
|
F
|
p
|
|
Var4
|
10.30886
|
1
|
10.30886
|
21.98703
|
12
|
1.832253
|
5.626329
|
0.035274
|
|
Test Newman-Keuls ; Variable CE
Différences
significatives marquées à p < .05000
|
|
{1}
|
{2}
|
|
e1 {1}
|
|
0.035420
|
|
e2 {2}
|
0.035420
|
|
4. L'absorbance
|
Analyse de la Variance (miels importés et locaux) Effets
significatifs marqués à p < .05000
|
|
SC
|
dl
|
MC
|
SC
|
dl
|
MC
|
F
|
p
|
|
absorbance
|
0.015794
|
1
|
0.015794
|
0.035217
|
12
|
0.002935
|
5.381718
|
0.038778
|
Test Newman-Keuls; Variable absorbance
Différences significatives marquées à p <
.05000 entre les miels locaux et les miels importés
|
{1}
|
{2}
|
|
e1 {1}
|
|
0.038921
|
|
e2 {2}
|
0.038921
|
|
5. La teneur en eau
|
Analyse de la Variance de la teneur en eau. Effets
significatifs marqués à p < .05000
|
|
SC
|
dl
|
MC
|
SC
|
dl
|
MC
|
F
|
p
|
|
T. eau
|
82.27429
|
13
|
6.328791
|
0.333600
|
14
|
0.023829
|
265.5968
|
0.000000
|
Test Newman-Keuls ; Variable t en eau Différences
significatives marquées à p < .05000
|
{1}
|
{2}
|
{3}
|
{4}
|
{5}
|
{6}
|
{7}
|
{8}
|
{9}
|
{10}
|
{11}
|
{12}
|
{13}
|
{14}
|
|
e1 {1}
|
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
e2 {2}
|
0.0002
|
|
0.0002
|
0.0725
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0725
|
0.0526
|
0.0155
|
0.0025
|
0.0002
|
|
e3 {3}
|
0.0002
|
0.0002
|
|
0.0002
|
0.2162
|
0.0002
|
0.0002
|
0.0002
|
0.0526
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
e4 {4}
|
0.0002
|
0.0725
|
0.0002
|
|
0.0002
|
0.0009
|
0.0002
|
0.0002
|
0.0002
|
0.0045
|
0.0025
|
0.2162
|
0.0526
|
0.0005
|
|
e5 {5}
|
0.0002
|
0.0002
|
0.2162
|
0.0002
|
|
0.0002
|
0.0002
|
0.0003
|
0.2162
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
e6 {6}
|
0.0002
|
0.0002
|
0.0002
|
0.0009
|
0.0002
|
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0045
|
0.0215
|
0.5277
|
|
e7 {7}
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
0.0003
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
e8 {8}
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0003
|
0.0002
|
0.0003
|
|
0.0006
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
e9 {9}
|
0.0002
|
0.0002
|
0.0526
|
0.0002
|
0.2162
|
0.0002
|
0.0002
|
0.0006
|
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
e10 {10}
|
0.0002
|
0.0725
|
0.0002
|
0.0045
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
0.5277
|
0.0009
|
0.0003
|
0.0002
|
|
e11 {11}
|
0.0002
|
0.0526
|
0.0002
|
0.0025
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.5277
|
|
0.0005
|
0.0002
|
0.0002
|
|
e12 {12}
|
0.0002
|
0.0155
|
0.0002
|
0.2162
|
0.0002
|
0.0045
|
0.0002
|
0.0002
|
0.0002
|
0.0009
|
0.0005
|
|
0.2162
|
0.0025
|
|
e13 {13}
|
0.0002
|
0.0025
|
0.0002
|
0.0526
|
0.0002
|
0.0215
|
0.0002
|
0.0002
|
0.0002
|
0.0003
|
0.0002
|
0.2162
|
|
0.0155
|
|
e14 {14}
|
0.0002
|
0.0002
|
0.0002
|
0.0005
|
0.0002
|
0.5277
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0025
|
0.0155
|
|
6. La teneur en protéines
|
Analyse de la Variance protéines. Effets significatifs
marqués à p < .00100
|
|
SC
|
dl
|
MC
|
SC
|
dl
|
MC
|
F
|
p
|
|
prot
|
196.3906
|
13
|
15.10697
|
0.015105
|
14
|
0.001079
|
14002.08
|
0.000000
|
Test Newman-Keuls ; Variable protéines Différences
significatives marquées à p < .05000
|
{1}
|
{2}
|
{3}
|
{4}
|
{5}
|
{6}
|
{7}
|
{8}
|
{9}
|
{10}
|
{11}
|
{12}
|
{13}
|
{14}
|
|
e1 {1}
|
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
e2 {2}
|
0.0002
|
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
e3 {3}
|
0.0002
|
0.0002
|
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
e4 {4}
|
0.0002
|
0.0002
|
0.0002
|
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
e5 {5}
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
e6 {6}
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
0.0161
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
e7 {7}
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0161
|
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
e8 {8}
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
e9 {9}
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
e10 {10}
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
0.0002
|
0.0002
|
0.0002
|
0.0068
|
|
e11 {11}
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
0.0002
|
0.0002
|
0.0002
|
|
e12 {12}
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
0.0002
|
0.0002
|
|
e13 {13}
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
0.0002
|
|
e14 {14}
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0068
|
0.0002
|
0.0002
|
0.0002
|
|
7. L'acidité
|
Analyse de la Variance de l'acidité. Effets
significatifs marqués à p < .05000
|
|
SC
|
dl
|
MC
|
SC
|
dl
|
MC
|
F
|
p
|
|
Acidité
|
877.0000
|
13
|
67.46154
|
11.84000
|
14
|
0.845714
|
79.76871
|
0.000000
|
Test Newman-Keuls ; Variable Acidité Différences
significatives marquées à p < .05000
|
{1}
|
{2}
|
{3}
|
{4}
|
{5}
|
{6}
|
{7}
|
{8}
|
{9}
|
{10}
|
{11}
|
{12}
|
{13}
|
{14}
|
|
e1 {1}
|
|
0.0002
|
0.0019
|
0.0002
|
0.0002
|
0.0002
|
0.0019
|
0.0168
|
1.0000
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
e2 {2}
|
0.0002
|
|
0.0002
|
1.0000
|
1.0000
|
0.1641
|
0.0004
|
0.0002
|
0.0002
|
1.0000
|
0.3074
|
0.0008
|
0.0002
|
0.8101
|
|
e3 {3}
|
0.0019
|
0.0002
|
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0008
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
e4 {4}
|
0.0002
|
1.0000
|
0.0002
|
|
1.0000
|
0.1327
|
0.0004
|
0.0002
|
0.0002
|
1.0000
|
0.2447
|
0.0019
|
0.0002
|
0.7027
|
|
e5 {5}
|
0.0002
|
1.0000
|
0.0002
|
1.0000
|
|
0.1012
|
0.0003
|
0.0002
|
0.0002
|
1.0000
|
0.1782
|
0.0034
|
0.0002
|
0.5371
|
|
e6 {6}
|
0.0002
|
0.1641
|
0.0002
|
0.1327
|
0.1012
|
|
0.0021
|
0.0004
|
0.0002
|
0.0704
|
0.5953
|
0.0003
|
0.0002
|
0.2658
|
|
e7 {7}
|
0.0019
|
0.0004
|
0.0002
|
0.0004
|
0.0003
|
0.0021
|
|
0.1253
|
0.0034
|
0.0002
|
0.0019
|
0.0002
|
0.0002
|
0.0006
|
|
e8 {8}
|
0.0168
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0004
|
0.1253
|
|
0.0415
|
0.0002
|
0.0004
|
0.0002
|
0.0002
|
0.0002
|
|
e9 {9}
|
1.0000
|
0.0002
|
0.0008
|
0.0002
|
0.0002
|
0.0002
|
0.0034
|
0.0415
|
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
e10 {10}
|
0.0002
|
1.0000
|
0.0002
|
1.0000
|
1.0000
|
0.0704
|
0.0002
|
0.0002
|
0.0002
|
|
0.1107
|
0.0052
|
0.0002
|
0.2954
|
|
e11 {11}
|
0.0002
|
0.3074
|
0.0002
|
0.2447
|
0.1782
|
0.5953
|
0.0019
|
0.0004
|
0.0002
|
0.1107
|
|
0.0004
|
0.0002
|
0.2954
|
|
e12 {12}
|
0.0002
|
0.0008
|
0.0002
|
0.0019
|
0.0034
|
0.0003
|
0.0002
|
0.0002
|
0.0002
|
0.0052
|
0.0004
|
|
0.0058
|
0.0011
|
|
e13 {13}
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0058
|
|
0.0002
|
|
e14 {14}
|
0.0002
|
0.8101
|
0.0002
|
0.7027
|
0.5371
|
0.2658
|
0.0006
|
0.0002
|
0.0002
|
0.2954
|
0.2954
|
0.0011
|
0.0002
|
|
8. L'HMF
|
Analyse de la Variance HMF. Effets significatifs marqués
à p < .05000
|
|
SC
|
dl
|
MC
|
SC
|
dl
|
MC
|
F
|
p
|
|
HMF
|
22728.00
|
13
|
1748.308
|
3.283600
|
14
|
0.234543
|
7454.108
|
0.000000
|
Test Newman-Keuls; Variable HMF
Différences significatives marquées à p <
.05000
|
{1}
|
{2}
|
{3}
|
{4}
|
{5}
|
{6}
|
{7}
|
{8}
|
{9}
|
{10}
|
{11}
|
{12}
|
{13}
|
{14}
|
|
e1 {1}
|
|
0.0647
|
0.0352
|
0.0053
|
0.0002
|
0.0008
|
0.0302
|
0.0084
|
0.0203
|
0.1439
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
e2 {2}
|
0.0647
|
|
0.5457
|
0.1875
|
0.0002
|
0.0002
|
0.0008
|
0.0005
|
0.0007
|
0.3687
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
e3 {3}
|
0.0352
|
0.5457
|
|
0.2359
|
0.0002
|
0.0002
|
0.0005
|
0.0003
|
0.0004
|
0.2995
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
e4 {4}
|
0.0053
|
0.1875
|
0.2359
|
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0622
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
e5 {5}
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
e6 {6}
|
0.0008
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
0.0396
|
0.1282
|
0.0809
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
e7 {7}
|
0.0302
|
0.0008
|
0.0005
|
0.0002
|
0.0002
|
0.0396
|
|
0.9942
|
0.9355
|
0.0026
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
e8 {8}
|
0.0084
|
0.0005
|
0.0003
|
0.0002
|
0.0002
|
0.1282
|
0.9942
|
|
0.9839
|
0.0012
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
e9 {9}
|
0.0203
|
0.0007
|
0.0004
|
0.0002
|
0.0002
|
0.0809
|
0.9355
|
0.9839
|
|
0.0020
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
e10 {10}
|
0.1439
|
0.3687
|
0.2995
|
0.0622
|
0.0002
|
0.0002
|
0.0026
|
0.0012
|
0.0020
|
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
e11 {11}
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
0.0002
|
0.0002
|
0.0002
|
|
e12 {12}
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
0.0002
|
0.0002
|
|
e13 {13}
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
0.0002
|
|
e14 {14}
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
0.0002
|
|
|
Analyse de la Variance (données importés et
locaux.sta) Effets significatifs marqués à p < .05000
|
|
SC
|
dl
|
MC
|
SC
|
dl
|
MC
|
F
|
p
|
|
Var8
|
6916.677
|
1
|
6916.677
|
4447.325
|
12
|
370.6104
|
18.66293
|
0.000996
|
|
Test Newman-Keuls ; Variable HMF.
Différences
significativesmarquées à p < .05000
|
|
{1}
|
{2}
|
|
e1 {1}
|
|
0.001132
|
|
e2 {2}
|
0.001132
|
|
Annexe 2 : Quelques photos de pollen de
référence :
Type Vicia sp
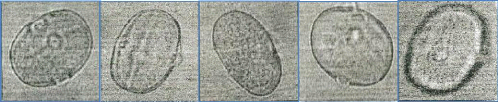
Asteracées, type aster.
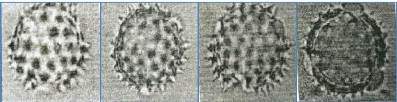
Fagacées
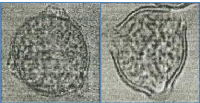
Vitacées

Caryophylacées

Achillea sp

Centauria sp

Trifolium sp
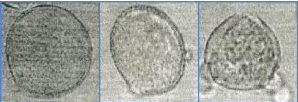
Zuzuphis sp
Malava sylvestis
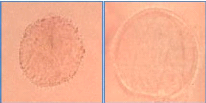
Peganum harmala
Salvia vebenaca
Tapsia garganica
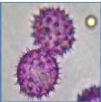
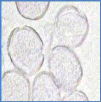
Helianthus annuus
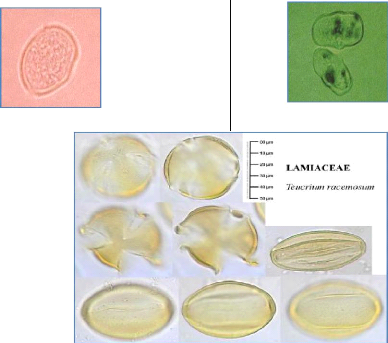

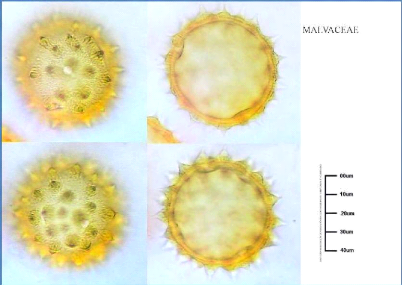
Annexe 3. Méthode de BIURET de dosage des
protéines.
Annexe 3 : Méthode de BIURET de dosage des
protéines.
Cette méthode permet d'obtenir un dosage rapide des
protéines. Contrairement à la méthode de KJELDAHL (qui
reste une méthode de référence légale), les
protéines sont dosées sans minéralisation. La technique
est donc plus facile à mettre en place et aussi moins
onéreuse.
Réalisation de la gamme
d'étalonnage
A partir d'une solution étalon de SAB à 1,0 g/L, on
réalise une gamme de 5 tubes contenant de 0.1 à 1.0 mg de SAB par
tube.
On réalise la gamme d'étalonnage
selon le tableau suivant :
|
tube N°
|
0
|
1
|
2
|
3
|
4
|
5
|
|
Eau physiologique (mL)
|
1
|
0.8
|
0.6
|
0.4
|
0.2
|
0
|
|
Réactif de Gornall (mL)
|
4
|
4
|
4
|
4
|
4
|
4
|
|
SAB (mg)
|
0
|
0.2
|
0.4
|
0.6
|
0.8
|
1.0
|
|
DO
|
0
|
0.102
|
0.186
|
0.257
|
0.376
|
0.459
|
DO
0.45
0.35
0.25
0.15
0.05
0.5
0.4
0.3
0.2
0.1
0
0 0.2 0.4 0.6 0.8 1 1.2
SAB mg/L
Série1
Linéaire (Série1)
La gamme d'étalonnage


| 


