1-3-Masses moléculaires de
l'á-glucosidase
Les masses moléculaires de
l'á-glucosidase déterminées en gel de
filtration sur la colonne TSK et en électrophorèse sur gel de
polyacrylamide en présence de SDS et de
âmercaptoéthanol ont été
respectivement de 60 kDa et 55 kDa. Cette similarité de masse
moléculaire montre que l'enzyme est monomérique (Tableau
8).
2 1
|
97,4 kDa 66,2 kDa
35,1 kDa 28,4 kDa
|
|
Figure 15 : á-glucosidase du suc digestif de la
larve de Rhynchophorus palmarum (Curculionidae) purifiée par
électrophorèse
Gel de polyacrylamide en présence de SDS et de
beta-mercapto-éthanol. Ligne 2, Protéines de
référence. ligne 1, á-glucosidase.
Tableau 8 : Masses moléculaires de
l'á-glucosidase du suc digestif de la larve du Rhynchophorus
palmarum (Curculionidae)
|
Masse
Méthode de détermination de la masse
moléculaire moléculaire
(kDa)
|
Nombre de
sous unité
|
Gel filtration 60
1
Electrophorèse sur gel de polyacrylamide en
présence de 55
SDS et de beta-mercapto-éthanol
1-4-Influence du pH sur l'activité de
l'á-glucosidase
1-4-1-pH optimum d'hydrolyse
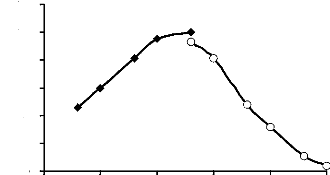
L'á-glucosidase a
présenté un maximum d'activité hydrolytique dans le tampon
acétate 100 mM pH 5,6 (Tableau 9). Elle a
conservé plus de 80 % de cette activité hydrolytique dans le
domaine de pH allant de 5,0 à 6,0. Aux pH compris entre 7,6 et 8,0 ;
l'enzyme a présenté une activité catalytique faible ne
dépassant pas 35 % d'activité (Fig. 16).
1-4-2-Stabilité au pH
L'á-glucosidase a été
stable pendant 2 h dans le tampon acétate 100 mM aux pH compris entre
4,0 et 5,6 (Fig. 17).
1-4-3-Influence de la force ionique du tampon
La force ionique du tampon n'a exercé aucune influence
sur les valeurs des pH optima d'hydrolyse de
l'á-glucosidase purifiée du suc digestif de la
larve de Rhynchophorus palmarum (Curculionidae) (Tableau
9).





120
100
Aelivite relative (%)
80
60
40
20
0
|
Activite relative (%)
|
100 80 60 40 20 0
|
3 4 5 6 7 8
pH
|
Tampon acétate 100 mM (pH3,6 - 5,6) Tampon phosphate 100
mM (pH5,6 - 8)
|
Figure 16 : pH optimum d'hydrolyse de
l'á-glucosidase du suc digestif de la larve de Rhynchophorus
palmarum (Curculionidae)
Le pH optimum d'hydrolyse du
p-nitrophényl-á-glucoside a
été déterminé dans les tampons acétate 100
mM (pH 3,6 à 5,6) et phosphate 100 mM (pH 5,6 à 8,0).
L'activité enzymatique a été déterminée dans
les conditions standard.
120

3 4 5 6 7 8 9
pH
Figure 17 : Stabilité au pH de
l'á-glucosidase du suc digestif de la larve de Rhynchophorus
palmarum (Curculionidae)
L'enzyme a été pré-incubée pendant
2 h à 37 °C dans les tampons acétate et phosphate 100 mM
pour des valeurs de pH comprises entre 3,6 et 8,0. L'activité
résiduelle a été déterminée dans les
conditions standard.
| 


