1-7-Paramètres cinétiques
Selon la représentation de Lineweaver et Burk
(1934), la valeur de KM de l'áglucosidase
obtenue avec le pNP-á-D-glucopyranoside a
été de 0,30 mM tandis que la vitesse maximale (Vmax) a
été de 142,20 UE /mg de protéine. Avec le maltose, le
saccharose et le kojibiose, les valeurs de KM ont été
respectivement de 1,31 ; 0,42 et 0,57 mM, avec des vitesses maximales
respectives de 48,23 ; 77,54 et 62,23 UE/mg de protéine. Les
efficacités catalytiques (Vmax/KM) des substrats naturels
tels que le maltose, le kojibiose et le saccharose montrent que
l'á-glucosidase a eu un meilleur pouvoir catalytique
pour le saccharose (Tableau 12).
1-8-Action des agents chimiques
Les ions métalliques K+ et Na+ et
le triton X-100 n'ont pas exercé d'effet sur
l'áglucosidase. Tous les autres agents chimiques
testés sont des inhibiteurs. Les ions métalliques Zn2+
et Cu2+ ont complètement inhibé l'activité de
l'á-glucosidase. Le DTNB et l'ion Fe3+ ont
fortement inhibé cette activité (Tableau 13).
Tableau 12 : Quelques paramètres cinétiques
de l'á-glucosidase du suc digestif de la larve de Rhynchophorus
palmarum (Curculionidae)
|
Substrat
|
KM
|
Vmax
|
Vmax/ KM
|
|
(mM)
|
(U/mg)
|
(U/mM x mg)
|
|
p-nitrophényl-á-D-glucopyranoside
|
0,30
|
142,20
|
474,00
|
|
Maltose
|
1,31
|
48,23
|
36,81
|
|
Saccharose
|
0,42
|
77,54
|
184,61
|
|
Kojibiose
|
0,57
|
62,23
|
109,17
|
Tableau 13 : Effet de quelques agents chimiques sur
l'activité de l'á-glucosidase du suc digestif de la larve de
Rhynchophorus palmarum (Curculionidae)
|
Agents chimiques
|
Concentration
(mM ou %)
|
Activité relative (%)
|
|
Témoin
|
1
|
100
|
|
Ba2+
|
1
|
56
|
|
Mg2+
|
1
|
76
|
|
Mn2+
|
1
|
50
|
|
Sr2+
|
1
|
81
|
|
Ca2+
|
1
|
82
|
|
Ions
|
Cu2+
|
1
|
0
|
|
Zn2+
|
1
|
0
|
|
Na+
|
1
|
100
|
|
K+
|
1
|
100
|
|
EDTA
|
1
|
82
|
|
Fe3+
|
1
|
7
|
|
Tris
|
1
|
10
|
|
â-mercaptoéthanol
|
0,1
|
86
|
|
Réducteurs
|
pCMB
|
0,1
|
73
|
|
DTNB
|
0,1
|
2
|
|
Triton X-100
|
0,1
|
100
|
|
Tween 80
|
0,1
|
90
|
|
Détergents
|
SDS
|
0,1
|
44
|
|
Urée
|
0,1
|
88
|
|
Guanidine
|
0,1
|
78
|
1-9-Réactions de transglucosylation
catalysées par l'á-glucosidase
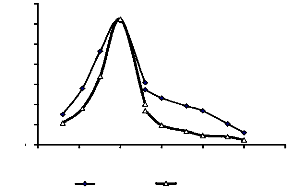
1-9-1-Influence du pH
Les pH optima de transglucosylation de
l'á-glucosidase lorsque le saccharose et le maltose ont
été utilisés comme donneurs de glucosyle et le
2-phényléthanol comme accepteur de glucosyle ont
été identiques. La valeur a été de 5,0
(Fig. 21).
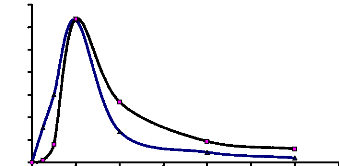
1-9-2-Influence du temps d'incubation
Les pourcentages maxima de synthèse de
phényléthylglucoside ont été obtenus en 12 h de
réaction quel que soit le donneur de glucosyle utilisé. Les deux
valeurs sont identiques (62 %). Après 12 h de réaction, les
pourcentages de transglucosylation ont considérablement
diminué (Fig. 22).
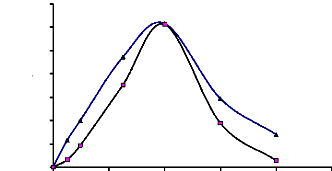
1-9-3-Influence de la concentration de l'accepteur sur
l'activité de transglucosylation
Les rendements d'activité de transglucosylation ont
été meilleurs pour une concentration d'accepteur de 100 mM quel
que soit le donneur utilisé. Entre 400 et 600 mM, les pourcentages de
transglucosylation ont été très faibles. Il en a
été de même pour les concentrations comprises entre 25 et
50 mM (Fig. 23).
L'ensemble des paramètres physico-chimiques des
réactions catalysées par l'áglucosidase
du suc digestif de la larve de Rhynchophorus palmarum (Curculionidae)
est repris dans le tableau 14.
1-9-4-Influence de la concentration du donneur sur
l'activité de transglucosylation
Le meilleur pourcentage de transglucosylation a
été obtenu avec des concentrations de donneur de glucosyle de 400
mM. Au-delà de cette concentration, les pourcentages de
transglucosylation ont considérablement diminué (Fig.
24).
Le Tableau 14 récapitule les donnés relatif
à la détermination des conditions optimales de
transglycosylation
3 4 5 6 7 8 9
pH
Maltose Saccharose
70
60
Transg,lucosylalion (%)
50
40
30
20
10
0
Figure 22 : Influence du pH sur les réactions de
transglucosylation catalysées par l'áglucosidase du suc digestif
de la larve de Rhynchophorus palmarum (Curculionidae) Donneur
de glucosyle : saccharose ou maltose 400 mM. Accepteur de glucosyle : 2-
phényléthanol 100 mM. Tampon acétate 100 mM (pH 3,6-5,4)
phosphate 100 mM (pH 5,4-8). Enzyme 12 UE. Temps d'incubation : 12 h.






70
60
|
Transglueosylalion CY()
|
50 40 30 20 10
|
0
0 10 20 30 40

Temps d'incubation (h) Maltose Sucrose
Figure 23 : Influence du temps d'incubation sur les
réactions de transglucosylation catalysées par
l'á-glucosidase du suc digestif de la larve de Rhynchophorus
palmarum (Curculionidae)
Donneur de glucosyle : saccharose ou maltose 400 mM. Accepteur
de glucosyle: 2 phényléthonal 100 mM. Tampon acétate 100
mM pH 5,0. Enzyme 12 UE. Temps d'incubation : 0 à 36 h.
Transglucolylation (%)
40
20
70
60
50
30
10
0
0 100 200 300 400 500 600 700

2-Phényléthanol (mM)
Maltose Saccharose
Figure 24 : Influence de la concentration de
l'accepteur de glucosyle (2-phényléthanol) sur les
réactions de transglucosylation catalysées par l'
á-glucosidase du suc digestif de la larve de Rhynchophorus palmarum
(Curculionidae)
Donneur de glucosyle : saccharose ou maltose 400 mM. Accepteur
de glucosyle: 2- phényléthanol (100 à 600 mM). Tampon
acétate 100 Mm pH 5,0. Enzyme 12 UE. Temps d'incubation : 12 h.
Transglucosylation (%)
40
20
70
60
50
30
10
0
0 200 400 600 800 1000
Saccharose ou maltose (mM)
Figure 25 : Influence de la concentration du donneur
de glucosyle sur les réactions de transglucosylation catalysées
par l'á-glucosidase de suc digestif de la larve Rhynchophorus
palmarum (Curculionidae)
Donneur de glucosyle : saccharose ou maltose (0 à 800
mM). Accepteur de glucosyle: 2- phényléthanol (100 à 600
mM). Tampon acétate 100 Mm pH 5,0. Enzyme 12 UE. Temps d'incubation : 12
h.
Tableau 14 : Récapitulatif des conditions
optimales des réactions de transglycosylation catalysées par
l'á-glucosidase du suc digestif de la larve de Rhynchophorus
palmarum (Curculionidae) et le meilleur pourcentage de
transglucosylation.
|
Paramètre physicochimique
|
Valeur
|
|
|
Saccharose
|
Maltose
|
|
pH optimum de transglucosylation
Temps d'obtention du meilleur pourcentage de transglucosylation
(h)
Concentration du donneur pour l'obtention du meilleur pourcentage
de transglucosylation (mM)
Concentration de l'accepteur pour l'obtention du meilleur
pourcentage de transglucosylation (mM)
|
5,0
12
400
100
|
5,0 12 400 100
|
|
Meilleur pourcentage de transglucosylation
(%)
|
62
|
62
|
2- Discussion
La purification à homogénéité
électrophorétique de l'á-glucosidase du
suc digestif de la larve de Rhynchophorus palmarum (Curculionidae) du
palmier Elaeis guineensis a nécessité l'utilisation de
trois étapes chromatographiques à basse pression. Ce sont les
chromatographies d'échangeuse d'anion, d'exclusion moléculaire et
d'interaction hydrophobe.
La courbe de variation d'activité en fonction de la
température de l'enzyme purifiée a donné une
température optimale d'hydrolyse de 45 °C indiquant que
l'á-glucosidase est un biocatalyseur mésophile.
Cette valeur de température optimale est identique à celle de
l'áglucosidase du microorganisme Xanthophyllomyces
dendrorhous (Marin et al., 2006) et
différente de celles des á-glucosidases de la
fraction insoluble du cristallin de bovin (50 °C) (Kamei et
Fujiyama, 1995) et des microorganismes Candida albicans (37
°C) (TorreBouscoulet et al., 2004) et
Thermomonospora curvata (54 °C) (Janda et al.,
1997).
Le pH optimum d'hydrolyse de
l'á-glucosidase est de 5,6. Il s'agit donc d'une enzyme
acide. Lorsque ce pH optimum d'hydrolyse est comparé à ceux des
á-glucosidases du muscle de lapin (pH 4,5)
(Matsui et al., 1984), du foie du lapin (pH 4,7)
(Onodera et al., 1989) et de Pichia pastoris
(pH 3,5-4,5), cette enzyme parait moins acide mais elle est plus acide
lorsqu'elle est comparée à ceux des
á-glucosidases du tube digestif de l'insecte
Rhynchosciara americana ( pH 6,0) (Terra et al.,
1977), des organes reproducteurs et du plasma du taureau (6,5-7)
(Jauhiainen et vanha-Perttula, 1985), des microorganismes
Torulaspora pretoriensis YK-1 (pH 6,8) (Oda et al.,
1993) et Thermotoga maritima (pH 7,5) (Raasch et
al., 2000).
L'á-glucosidase du suc digestif de la
larve de Rhynchophorus palmarum (Curculionidae) est une
protéine monomérique. Cette situation est identique à
celles des áglucosidases de l'insecte Drosophila
melanogaster (á-glucosidase II and III)
(Tanimura et al., 1979), de l'abeille Apis
mellifera (Nishimoto et al., 2001 ; Lee et al.,
2001) et de l'intestin de rat (Sasajima et al.,
1975), mais différente de celles des
á-glucosidases du foie de porc (Tashiro et
al., 1986), du cortex rénal de lapin (Pereira et
sivakami, 1989) et du microorganisme Sulfolobus solfutaricus
98/2 (Suzuki et al., 1987 ; Nakao et al., 1994 ;
Rolfsmeier et Blum, 1995) qui sont oligomériques.
L'á-glucosidase est inhibée par
le DTNB et le pCMB, ce qui indique la présence de groupement(s)
sulfhydryle(s) dans le site actif de l'enzyme. Ce résultat est en accord
avec ceux trouvés par Sasajima et al. (1975) et Yoshiki
et al. (2005) respectivement sur les
á-
82
glucosidases de la muqueuse de l'intestin de rat et des grains de
mil. Il est différent de celui de Prakash et al.
(1983) avec l' a-glucosidase de l'intestin de
pigeon.
L'a-glucosidase est inactive sur les
polymères de poids moléculaires élevés comme le
lichenane, le xylane, la carboxyméthylcellulose, l'inuline, l'amidon,
l'arabino-galactane. Ce résultat a été déjà
observé avec les a-glucosidases de la graine
d'épinard Spinacia oleracea (Sugimoto et al.,
1995), de Thermomonospora curvata (Janda et
al., 1997), des champignons Aspergillus niger et A.
oryzae (Kita et al., 1991). Cette enzyme ne
possède aucune activité glycosidasique contaminante telles que
les activités a-galactosidasique,
a-fucosidasique, amanosidasique,
a-arabinosidasique a-xylosidasique. Ce
comportement cinétique montre que cette enzyme est hautement
spécifique du résidu glucosyle. Elle hydrolyse de
préférence les liaisons a-(1-2) et
a-(1-4). La détermination des paramètres
cinétiques a permis d'obtenir une constante de Michaelis-Menten de 0,30
mM lorsque le
p-nitrophényl-a-D-glucopyranoside est
utilisé comme substrat. Ce résultat est identique à celui
rapporté par Kita et al. (1991), dont les
travaux ont porté sur l'étude de la spécificité de
l'a-glucosidase du champignon Aspergillus niger. Il
est différent des études réalisées par
Suzuki et al. (1997) sur
l'aglucosidase de la bactérie Bacillus
Thermoamylotiquefaciens dont la constante déterminée est de
0,56 mM. Les constantes de Michaelis Menten
déterminées avec l'a-glucosidase de la larve de
Rhynchopholorus palmarum (Curculionidae) utilisant comme substrat le
saccharose, le maltose, et le kojibiose sont respectivement de 0,42 ; 1,31 et
0,57 mM. Ces valeurs sont plus faibles que celles des
a-glucosidases du foie de rat (Lavrenova et Presnova,
1994), de l'insecte Drosophila melanogaster (Tanimura
et al., 1979) et du muscle de lapin (Matsui et
al., 1984). Les valeurs des efficacités catalytiques
(Vmax/KM) permettent de dire que l'enzyme purifiée hydrolyse
efficacement le saccharose. Cette situation laisse penser que le rôle
biologique principal de l'a-glucosidase la larve de
Rhynchophorus palmarum (Curculionidae) est la dégradation du
saccharose contenu dans la sève du palmier. Il s'agit d'une saccharase.
En plus de cette action principale, l'a-glucosidase peut
assurer efficacement la digestion du maltose et des maltodextrines (sauf
l'isomaltose) qui sont des produits d'hydrolyse de l'amidon.
La capacité de l'a-glucosidase de la
larve de Rhynchophorus palmarum (Curculionidae) à catalyser des
réactions de transglucosylation a été testée. Le
saccharose et le maltose ont été utilisés comme donneurs
de glucosyle et le 2-phényléthanol comme accepteur de
glucosyle.
L'intérêt du choix de ces substrats comme donneurs
de glucosyle est dû à leur capacité à
être
facilement hydrolysés par l'a-glucosidase
du suc digestif de la larve de Rhynchophorus
palmarum (Curculionidae). Quant à l'accepteur
de glucosyle, il présente également des avantages. En effet, le
phényléthanol est un composé insoluble dans l'eau. Cette
propriété est caractéristique de la plupart des
macromolécules naturelles. Les produits
(phényléthylglucoside) des réactions de transglucosylation
sont facilement quantifiables par absorbance UV. Pour cette facilité de
détection, le phényléthanol a été
déjà utilisé pour étudier les activités de
transglycosylation de glycosidases du champignon Aspergillus
oryzae (Fortun et Colas, 1991), de l'escargot
géant Achatina achatina (Leparoux et al.,
1997), de la bactérie Thermus
thermophilus (Dion et al., 1999) et de
Macrotermes subhyalinus (Kouamé et al., 2001,
2005a). Les conditions expérimentales de transglucosylation ont
été optimisées au niveau de certains facteurs capables
d'influencer le taux de transglucosylation. Le pH optimum de transglucosylation
de l'a-glucosidase du suc digestif de la larve de
Rhynchophorus palmarum (Curculionidae) est de 5,0. Cette valeur est
différente du pH optimum d'hydrolyse (5,6). Pour expliquer cette
différence de pH, Huber et al. (1983) ont
suggéré l'existence d'un groupement ionique avec une grande
valeur de pKa au niveau du site actif, ce qui affecterait l'hydrolyse mais pas
la transglycosylation. Aussi, cette différence pourrait-elle s'expliquer
par le taux d'hydrolyse de la liaison glycosidique qui décroît
avec une augmentation du pH de manière à induire le changement
observé (Huber et al., 1983). Dans le cas de
l'a-glucosidase du suc digestif de la larve de
Rhynchophorus palmarum (Curculionidae), la différence de pH
optimum des réactions d'hydrolyse et de transglucosylation n'est pas
significative, ce qui ne permet pas de conduire à des réactions
de synthèse à cause de l'hydrolyse rapide des produits de
transglucosylation formés. Ainsi, le taux de transglucosylation est plus
important que celui de l'hydrolyse du produit formé. Le temps de
réaction apparaît comme un paramètre important car certains
produits formés durant les réactions de transglucosylation
peuvent être utilisés comme substrats et être
hydrolysés. Pour l'a-glucosidase étudiée,
un taux maximum de transglucosylation a été obtenu dans un temps
relativement court (environ 12 h) sans qu'il n'y ait eu hydrolyse des produits
formés au cours de la transglucosylation. Apres 12 h de réaction,
le pourcentage de transglucosylation a diminué. Le produit formé
au cours de la réaction de transglucosylation pourrait être le
phényléthyl-a-D-glucoside. Ce résultat
suggère que l'a-glucosidase hydrolyse le produit
formé par son extrémité non réducteur en
libérant l'a-glucose. Ce comportement montre que
l'a-glucosidase purifiée a opéré par
rétention de configuration anomérique. Le taux de
transglucosylation obtenu avec le 2-phényléthanol (62 %) est plus
élevé que ceux rapportés dans la littérature avec
les sources conventionnelles de glycosidases (E.coli, A. oryza).
| 


