|
 
Mémoire de Master 2
Sciences Chimiques Marines - IUEM 2008/2009
|
Influence du sédiment sur les flux
énergétiques et le métabolisme oxydatif chez
l'huître creuse Crassostrea gigas
|

PERHIRIN Antoine
Maîtres de stage : Jeanne Moal et Catherine
Séguineau
Ifremer, Centre de Brest
Laboratoire de Physiologie des Invertébrés
BP70
29280 Plouzané
Abréviations
ATP : Adénosine triphosphate
CAT : Catalase
CCO : Cytochrome C Oxydase
CS : Citrate Synthase
DPPH : diphenyl-1-picrylhydrazyl
ETS : Electron Transport System
FRD : Fumarate Réductase
GR : Glutathion Réductase
HAP : Hydrocarbure aromatique polycyclique
INSU : Institut national des sciences de l'Univers
NADH : Nicotinamide adénine dinucléotide
NTB : nitrothiobenzoate
PCB : Polychlorobiphényle
PEP : Phosphoénol Pyruvate
PEPCK : Phosphoénol Pyruvate Carboxykinase
PK : Pyruvate Kinase
ROS : Espèce Réactive de
l'Oxygène
SOD : Superoxide Dismutase
Sommaire
ABRÉVIATIONS
1
SOMMAIRE
2
INTRODUCTION
3
LES ENJEUX - MORTALITÉS ESTIVALES DES
HUÎTRES :
3
PROGRAMME MOREST :
3
RISCOSOL : DANS LA CONTINUITÉ DE
MOREST
5
OBJECTIFS DU STAGE :
6
MESURES BIOCHIMIQUES ET
INTÉRÊTS :
6
MATÉRIEL ET MÉTHODES
9
1. MATÉRIEL BIOLOGIQUE
9
2. PRÉPARATION DES
ÉCHANTILLONS POUR LES MESURES D'ACTIVITÉS ENZYMATIQUES
10
3. PRINCIPE DES DOSAGES
10
4. TRAITEMENT STATISTIQUE
13
RÉSULTATS
13
1. CROISSANCE - MORTALITÉS
13
2. MÉTABOLISME
ÉNERGÉTIQUE
14
3. MÉTABOLISME OXYDATIF
16
4.
CORRÉLATIONS D'ACTIVITÉS ENZYMATIQUES RISOCOSOL
18
DISCUSSION
18
CONCLUSION
23
BIBLIOGRAPHIE
24
ANNEXES
27
Introduction
Les enjeux - mortalités
estivales des huîtres :
Après son introduction dans les années 70 sur le
littoral français, l'huître creuse a toujours été
touchée par une mortalité plus ou moins importante selon les
années. Cependant, on assiste ces dernières années
à une augmentation de l'intensité de ce phénomène
avec par exemple une mortalité touchant les juvéniles pour
l'année 2008 exceptionnellement élevée par rapport aux
suivis des mortalités effectués depuis une vingtaine
d'année. Entre 2000 et 2005, le défi Morest
(Mortalité estivale des
huîtres), un projet réunissant une quinzaine de laboratoires, a
permis d'identifier le caractère multifactoriel des mortalités
estivales avec d'une part des caractéristiques intrinsèques de
l'animal (gamétogénèse, croissance, système
antioxydant) mais aussi son interaction avec l'environnement
(pluviométrie, température, nature du sédiment,
pesticides) ainsi que des agents pathogènes (vibrio).
Programme Morest :
Le risque de mortalité lié à la
proximité du sédiment a été identifié dans
ce cadre: les huîtres cultivées à 15 cm du sol
présentent des mortalités nettement plus élevées
que celles cultivées à 70 cm du sol (Figure 1).
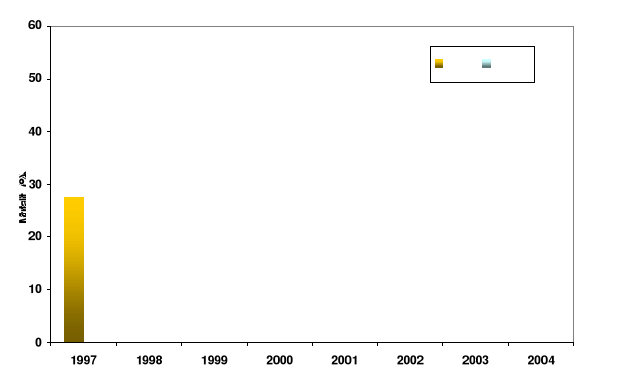
Figure 1 : Mortalités comparées entre les
élevages à 0-15cm (plat) et 50-70cm du sol (table) sur le site
atelier de Perquis dans le sud du bassin de Marennes Oléron.
Huîtres 2 ans.[1, 2]
De plus, les huîtres transférées au cours
du printemps à proximité du sédiment (0-15cm) montrent des
mortalités corrélées au temps de résidence
près du sédiment ce qui suggère l'existence d'un stress
chronique lié au sédiment provoquant un affaiblissement
progressif des individus. L'épisode de mortalité en juin est
alors plus important pour les huîtres qui ont séjourné plus
longtemps à proximité du sédiment que par des
huîtres situées à 70 cm du sédiment (Figure 2).

Figure 2 : Mortalités corrélées
à leur temps de séjour à proximité du
sédiment, en pointillé : lot témoin situé
à 70cm du sédiment sur table [3].
Pour expliquer cet effet sédiment, plusieurs
hypothèses ont été avancées :
a) Les facteurs environnementaux liés au
sédiment
La mesure du taux d'oxygène dans les sédiments
montre une montée du niveau anoxique à la fin du printemps et en
été. Cette évolution du taux d'oxygène dissout est
expliquée par la sédimentation de matière organique
provenant principalement de la production primaire et de l'activité
nutritive des huîtres ainsi que des apports du continent. La chaîne
microbienne présente à la surface et dans le sédiment
recycle ce substrat en consommant de l'oxygène [4]. Lors d'un bloom
printanier très productif, ce processus peut même provoquer
l'anoxie totale au niveau du benthos [5].
De plus, ces baisses saisonnières du taux
d'oxygène dans les sédiments correspondent avec l'apparition de
composés réduits tel que l'ammoniac et les sulfures (Figure 3).
Le caractère saisonnier de l'apparition de ces composés
représenterait donc une source de stress potentiel dans les zones
ostréicoles. Par exemple en France, les crises anoxiques survenant en
été dans l'étang de Thau (Hérault) sont à
l'origine de production de sulfures à des taux très
élevés. Plusieurs travaux ont montré qu'un déficit
en oxygène dissout chez Crassostrea gigas peut provoquer une
dépression métabolique qui sensibiliserait les huîtres
pendant l'épisode de mortalité estivale [6]. La réduction
de l'activité de nutrition et de la respiration sont des réponses
fréquemment observées à l'hypoxie et aux sulfures chez les
invertébrés comme l'a montré Le Moullac et al.
chez l'huître creuse [6]. De plus, les sulfures sont directement toxiques
pour les organismes vivants car ils sont des inhibiteurs de la cytochrome c
oxydase, l'enzyme terminale de la chaîne de transport d'électrons
[6].
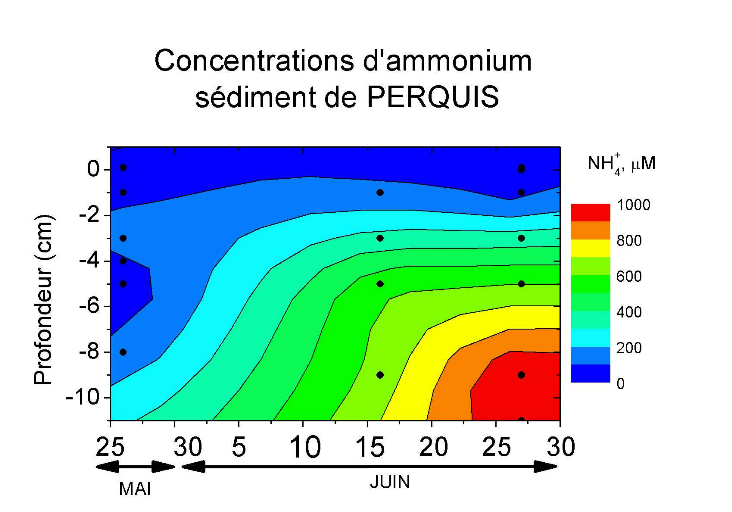 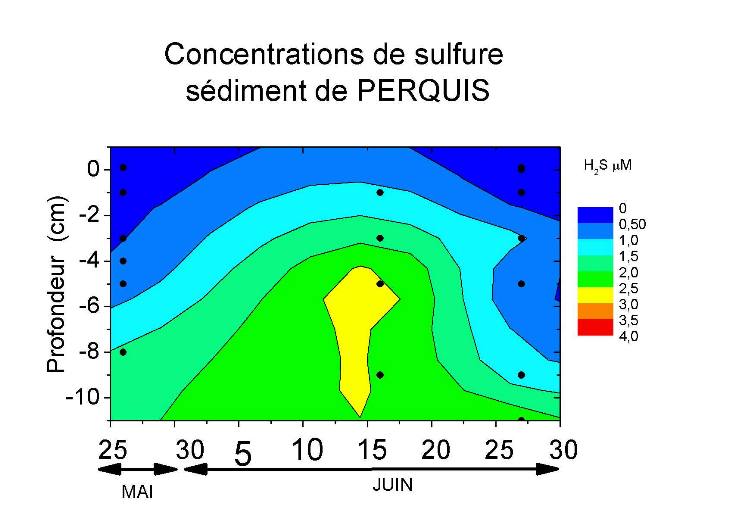
Figure 3: Variation de la teneur en ammonium et en sulfures
dans les sédiments de PERQUIS pendant l'été
2006[3]
D'autres facteurs peuvent également expliquer cet effet
sédiment sur les mortalités. Les apports terrigènes sont
sources de pesticides, HAP, PCB, métaux lourds sous forme particulaire
et d'autres polluants qui, par leur nature hydrophobe, se retrouvent
piégés dans les sédiments.
L'augmentation des phénomènes de
mortalités de ces dernières années pourrait aussi
être corrélée à l'envasement progressif des sites de
conchyliculture. Par exemple, dans le parc conchylicole de Grandcamp Maisy
(baie des Veys - Normandie), le taux de pélite (vases fines) est de 8%
maximum en 1992, 21% maximum en 1998 et de 64% maximum en 2003 [3].
b) Caractéristiques intrinsèques de
l'huître
La création dans le projet Morest de deux souches
d'huîtres « R » et « S », souches
dites Résistantes ou Sensibles aux
mortalités estivales a permis de décrire des différences
au niveau du métabolisme et de l'expression des gènes dans ces
deux souches '[7]. Parmi les gènes différentiellement
exprimés, on retrouve la catalase et la superoxide dismutase, des
enzymes du métabolisme oxydatif. L'hypoxie, les composés
réduits, les métaux lourds ou les pesticides sont connus pour
pouvoir créer un stress oxydant. On observe au niveau des cellules du
système immunitaire de Crassostrea gigas que la production
d'espèces réactives de l'oxygène (ROS) est plus importante
pour les huîtres de la souche « S » [8]. La
régulation du stress oxydatif aurait potentiellement un rôle dans
les mortalités estivales.
Riscosol : dans la
continuité de Morest
La méthode d'élevage en baie de Quiberon est
traditionnellement l'élevage des huîtres « à
plat », c'est-à-dire directement sur le sédiment et en
eau profonde où les huîtres ne découvrent jamais. La baie
de Quiberon est le premier site de conchyliculture de Bretagne avec 60% du
potentiel de production breton. Depuis 2003, on assiste à des
mortalités passant de l'ordre de 35-40% à près de 75%
(Enquête SRC Bretagne Sud). Des essais de cultures sur table en eau
profonde pour l'année 2007 ont aussi clairement montré l'impact
de la proximité du sédiment dans ce cas (Figure 4). La
mortalité est plus importante pour les huîtres
élevées au sol que les huîtres surélevées sur
tables. La question de la qualité du sédiment est donc
particulièrement importante et le projet Riscosol a été
créé pour répondre à cette problématique.
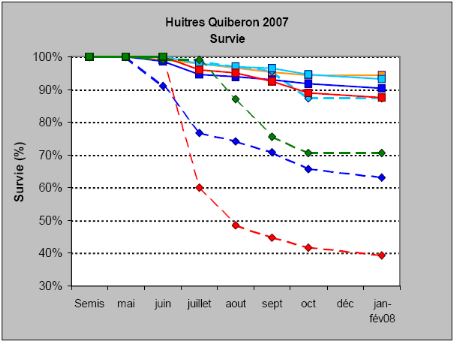
Figure 4 : en pointillé - huître
élevées au sol, traits continus - huîtres
élevées sur table (bleu clair - station QB02, bleu foncé -
station QB03, rouge - station QB04, orange - station QB 05, vert - station
QB06) Rapport interne Ifremer Fleury et al. - 2008
Financée pour la période 2008-2010, cette
étude a pour objectif de mieux cerner l'effet du sédiment sur les
mortalités des huîtres à travers une étude
équivalente à celle développée dans MOREST
(Ecophysiologie et physiologie, Analyse physicochimique et microbiologique,
écologie).
L'objectif majeur du projet est donc de caractériser le
sédiment, d'étudier les échanges et flux de matière
organique avec le sédiment, leur intégration par la flore
microbienne et d'étudier comment cela peut influencer la physiologie de
l'huître.
Objectifs du stage :
L'objectif de cette étude est de documenter la partie
physiologie pour le projet Riscosol. Comment la physiologie des huîtres
est-elle affectée par ces variations de qualité du
sédiment ? Peut-on identifier des stress chroniques et
aigus ?
Pour répondre à ces questions, un certain nombre
de paramètres caractéristiques du métabolisme
énergétique et oxydatif de l'huître creuse ont
été étudiés.
Le matériel biologique utilisé proviendra d'une
part d'une comparaison d'huîtres élevées sur
différents types de sédiment dans la baie de Quiberon en eau
profonde (projet Riscosol) et d'une expérimentation en milieu
contrôlé au cours de laquelle des huîtres ont
été soumises à un milieu hypoxique [6] et pour lesquelles
des mesures écophysiologiques et biochimiques sont déjà
disponibles. La plupart des méthodes font appel à des
cinétiques enzymatiques et à des dosages colorimétriques
qui sont réalisés en microplaque sur un lecteur Biotek. Ces
techniques seront validées chez l'huître par la recherche des
conditions optimales d'extraction et de dosage.
Mesures biochimiques et
intérêts :
Les analyses biochimiques ont pour but d'évaluer
l'état de santé général de l'huître en
appréciant la gestion de l'énergie et la régulation du
métabolisme oxydatif des animaux :
a) Métabolisme énergétique :
L'état des réserves énergétiques
est évalué par la mesure des glucides totaux (glycogène
principalement) ainsi que les lipides totaux. L'utilisation de cette
énergie sera appréciée par des mesures d'activités
enzymatiques au carrefour Phosphoénolpyruvate (PEP). A partir du PEP, la
voie de la PEPCK permet la synthèse de précurseurs du
métabolisme anaérobie tandis que la voie de la Pyruvate Kinase
est considérée comme la voie donnant les précurseurs du
métabolisme aérobie (Figure 5).
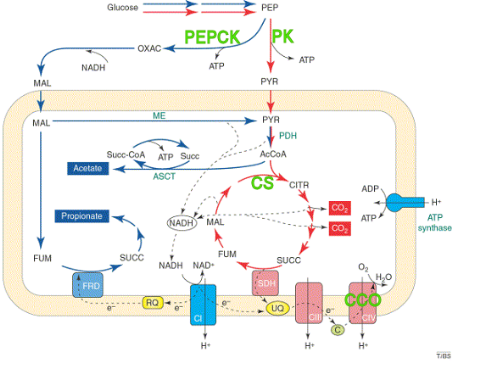
Figure 5 : Exemple de métabolisme
général aérobie et anaérobie (chez la douve du
foie), en flèche rouge : métabolisme aérobie, en
flèche bleue : métabolisme anaérobie,
pointillées : transport d'électrons, en
encadrés : produits finaux, en vert : enzymes dosés
dans le cadre du stage. Abréviations : AcCoA, acetyl-CoA; ASCT,
acetate:succinate CoA-transferase; C, cytochrome c, C I, complex I; C III,
complex III; CIV, complex IV; CITR, citrate; FRD, fumarate reductase; FUM,
fumarate; MAL, malate; ME, malic enzyme; OXAC, oxaloacetate; PDH, pyruvate
dehydrogenase; PEP, phosphoenolpyruvate; PYR, pyruvate; RQ, rhodoquinone; SDH,
succinate dehydrogenase; SUCC, succinate; Succ-CoA, succinyl-CoA; UQ,
ubiquinone. Modifié d'après Tielens [9]
Le niveau de l'activité métabolique, que l'on
peut associer aux besoins en ATP de la cellule, sera apprécié par
les mesures d'activité enzymatique du cycle de Krebs (CS : Citrate
Synthase) et de la phosphorylation oxydative (CCO : Cytochrome C Oxydase).
Le couple PK/PEPCK permettra éventuellement d'observer un glissement
vers un métabolisme anaérobie.
b) Métabolisme oxydatif :
Le métabolisme cellulaire est obligatoirement
associé à la production de ROS, des composés radicalaires
ou non issus de l'oxygène et fortement réactifs vis-à-vis
des macromolécules de la cellule. On considère que cette
production de ROS provient à 80% de la chaîne respiratoire dans la
mitochondrie, le reste étant principalement dû au fonctionnement
d'une enzyme transmembranaire, la NADPH oxydase.
Le long de la chaine respiratoire, une proportion
significative de l'oxygène (2 % à 6 %) échappe
à la réduction complète en H2O et subit une
réduction mono-électronique au niveau des complexes I et III (cf
CI et CIII Figure 5), pour donner naissance à l'ion superoxyde
(O-.2) : cette production est absolument
indissociable du processus respiratoire [10].
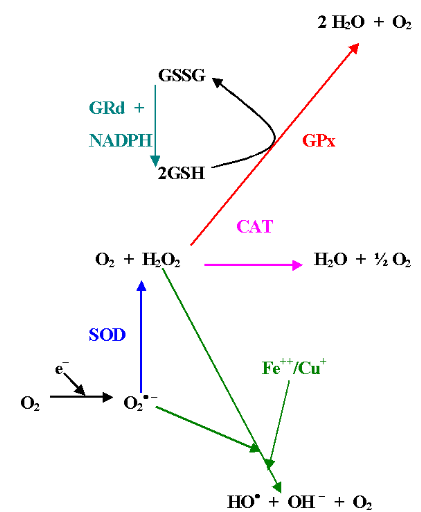
Figure 6 : Schéma des réponses
antioxydantes de la cellule face aux ROS : GRd - Glutation
Réductase, GPx - Glutathion Peroxydase, CAT - Catalase, SOD - Superoxide
Dismutase, en vert - Réaction de Fenton, GSSG - Glutathion
oxydé, GSH - Glutathion réduit
L'anion superoxide initial est pris en charge par une cascade
de réactions d'oxydoréductions ou enzymatiques pour donner des
dérivés oxygénés activés ou inertes. La
Superoxide Dismutase (SOD) est dosée dans le cadre de ce stage. C'est la
première étape de ce système antioxydant. Les
activités Catalase et Glutathion Peroxydase (GPx) permettent
l'élimination de l'eau oxygénée. Cette étape doit
être la plus efficace possible car H2O2 produit,
par la réaction de Fenton, le radical hydroxyle (OHÿ) qui est, de
tous les ROS, l'espèce la plus réactive et la plus dommageable
pour la cellule.
De plus, les défenses antioxydantes sont liés
par le système des glutathions à la phase II de
détoxication de molécules exogènes comme les hydrocarbures
type HAP ou encore les herbicides par exemple. Le glutathion réduit
(GSH), en plus de sa capacité antioxydante, est une
molécule-clé dans la signalisation et l'élimination de
composés biotransformés. Le glutathion réduit est
également connu pour ses capacités de chélation et
d'élimination des métaux lourds. La mesure de l'activité
GR (glutathion réductase) permettra d'évaluer les besoins de la
cellule en glutathion réduit.
Le stress oxydant résulte d'un excès de la
production de ROS par les systèmes pro-oxydant par rapport à la
prise en charge de ces ROS par les systèmes antioxydants. Les
conséquences de ce stress oxydant sont des dommages non
spécifiques et irréversibles de molécules comme l'ADN, les
lipides ou des protéines. Si des macromolécules
endommagées par les ROS sont activées en radicaux libres, des
réactions en chaîne peuvent apparaitre. La cellule a mis en place
des défenses antiradicalaires, principalement des vitamines, pour se
protéger de ce type de réaction. La mesure de l'activité
antiradicalaire est réalisée avec le dosage DPPH.
La deuxième source de ROS dans la cellule est issue du
fonctionnement de la NADPH oxydase dans des cellules spécialisées
de l'immunité. En cas d'attaques de pathogènes, ces cellules
produisent massivement des anions superoxydes dans les phagosomes avec la NADPH
oxydase afin de lyser les agents infectieux. Cette activité ne sera pas
étudiée dans le cadre de ce stage.
Matériel et
Méthodes
1. Matériel biologique
Les huîtres sélectionnées pour le projet
Riscosol proviennent de captage naturel d'Arcachon. Les juvéniles de 18
mois ont été répartis sur 6 stations dans la baie de
Quiberon. Trois sites seulement ont été retenus pour les analyses
biochimiques (Stations QB02, QB04 et QB05 - Figure 7). La présence d'un
gradient d'envasement a justifié ce choix, la station 5 étant la
plus envasée, la station 2 la moins envasée, la station 4
étant intermédiaire (Annexe 3). Les stations 2 et 5 sont à
une profondeur moyenne de 7-8 mètres tandis que la station 4 est
à environ 13 mètres de profondeur. Les eaux du fond pour cette
dernière station sont plus froides, plus turbides et sont davantage
soumises aux phénomènes de stratification pendant
l'été.
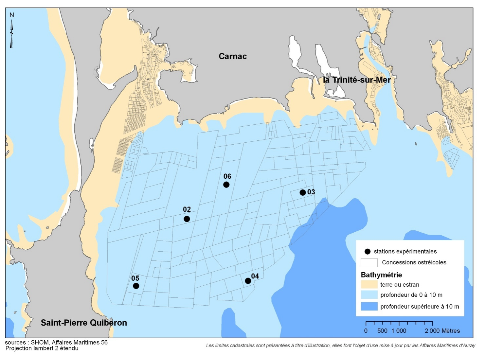
Figure 7 : Carte de situation des sites retenus dans la
baie de Quiberon pour le projet Riscosol
Un prélèvement de 30 huîtres pour les
mesures physiologiques est réalisé à date fixée.
Pendant la durée du stage les prélèvements de juillet
2008, septembre 2008 et mars 2009 ont été analysés. Des
mesures biométriques sont effectuées le jour du
prélèvement (poids total, poids de chair, poids de coquille). Sur
les 30 huîtres, 3 pools de 5 huîtres sont réalisés
sur l'animal entier et 3 autres pools de 5 huîtres sont constitués
par tissus (glande digestive, les branchies et le muscle). Les pools d'animaux
entiers et des tissus sont congelés dans l'azote liquide aussitôt
après dissection jusqu'à l'analyse.
Le matériel biologique et le protocole de la
manipulation en milieu contrôlé hypoxie - normoxie est
décrit par Gilles Le Moullac [6]. Nous avons retenu les
échantillons d'huîtres issues de la manipulation de juin 2005 (ce
qui correspond à une température de 20°C) et pour les
huîtres de la souche R seulement. La souche R est une souche
d'huître sélectionnée en une génération pour
ses qualités de résistance face aux mortalités
estivales.
Après une phase d'acclimatation d'une semaine en milieu
contrôlé, un lot est placé en condition hypoxique (2.0mg
O2/L d'eau de mer) et un deuxième lot témoin est
gardé en normoxie (environ 8.5mg O2/L d'eau de mer). Des
prélèvements sont effectués à T0, T2, T10 et T20
jours pour les mesures biochimiques.
2. Préparation des
échantillons pour les mesures d'activités enzymatiques
Les échantillons d'huîtres congelés sont
broyés au Dangoumeau. La poudre fine obtenue est ensuite
aliquotée par 100 ou 200mg dans des tubes eppendorfs. Les aliquots sont
extraits dans un tampon dont la composition spécifique dépend des
conditions du dosage :
Dosages GR-CS-CAT-SOD : Tampon PBS (Phosphate
Buffer Saline) + 0.1% Triton X-100 + 1mM EDTA
Dosage CCO : Tampon PBS + 0.1% Tween 20 + 1mM
EDTA
Dosages PK-PEPCK : Tampon Imidazole-HCl 0.2M pH7.2 +
NaF 100mM + EDTA 5mM + EGTA 5mM + 2-âmercaptoéthanol 15mM +
Antiprotéases
Dosage DPPH : Mélange méthanol-eau
50/50
L'homogénéisation est réalisée
à l'aide d'un broyeur mécanique (polytron). Pendant toute la
durée de l'homogénéisation, les échantillons sont
maintenus dans un bain de glace. Seule exception, pour le dosage DPPH,
l'homogénéisation est uniquement réalisée par
ultrasons. Les broyats sont ensuite centrifugés :
Dosages CS-GR-SOD-CAT-PK-PEPCK : 15000g pendant
10mn à 4°C
Dosage DPPH : 3500g pendant 15mn à
20°C
Dosage CCO : Extraction de mitochondries :
première centrifugation à 1400g pendant 5mn à 4°C. Le
surnageant est isolé puis centrifugé une deuxième fois
à 9000g pendant 9mn à 4°C. Le culot est ensuite redissout
dans un tampon phosphate 50mM pH 7.8 pour les analyses.
Les dosages sont réalisés en microplaques de 96
puits et les cinétiques sont lues avec un lecteur
spectrophotométrique Biotek UV/visible. Les résultats sont
exprimés par rapport à des mg de protéines solubles,
dosage réalisé par la méthode de LOWRY (kit BioRad).
Le poids sec moyen de l'huître ainsi que le taux de
matière organique moyen par huître est obtenu après
séchage d'un aliquot de poudre à 80°C et 450°C.
3. Principe des dosages
a) Métabolisme énergétique :
Principe du dosage de la pyruvate kinase (PK)
:
La PK est une enzyme de la glycolyse. La réaction
qu'elle catalyse est irréversible, ce qui est très surprenant au
vu du nom de l'enzyme qui décrit la réaction inverse. Elle est
régulée au niveau allostérique (phosphorylation) ainsi que
par l'alanine qui est le principal inhibiteur de cette enzyme.
Le principe de dosage est le suivant :
PEP + ADP PK Pyruvate + ATP
Pyruvate + NADH + H+ LDH
L-Lactate + NAD+
La décroissance du NADH est suivie à 340nm et
permet de suivre la cinétique de la première réaction.
Principe du dosage de la phosphoénolpyruvate
carboxykinase (PEPCK) :
La PEPCK est la première enzyme de la
néoglucogénèse. Elle catalyse également la
réaction inverse contrairement à la PK. Cette étape permet
de dériver la glycolyse vers d'autres voies du métabolisme
anaérobie au lieu d'aboutir au cycle de Krebs par la voie classique (via
la PK). La PEPCK est régulée au niveau transcriptionnel.
PEP + IDP PEPCK Oxaloacétate + ITP
Oxaloacétate + NADH + H+ MDH
L-malate + NAD+
Le principe du dosage est similaire à celui de la PK.
On mesure la production d'oxaloacétate avec le suivi de l'absorbance du
NADH à 340nm.
Principe du dosage de la citrate synthase (CS)
:
CS
La condensation de l'acétyl-CoA et de
l'oxaloacétate pour former le citrate est catalysée par cette
enzyme. C'est une enzyme mitochondriale, la première enzyme du cycle de
Krebs. Chez l'huître creuse, sa régulation est basée sur le
fait que son produit, le citrate, l'inhibe à forte concentration [11].
La disponibilité en oxaloacétate serait également un
facteur limitant selon Fields [11].
COO--CH2-CO-COO- + CH3-CO-S-CoA
COO--CH2-COHCOO--CH2-COO- + CoA-SH
2 CoA-SH + DTNB 2 NTB + CoA-S-S-CoA
La réaction est suivie en dosant les résidus
thiols avec le DNTB (dinitrothiobenzoate) dont le produit de la réaction
(NTB) absorbe à 412nm.
Principe du dosage de la cytochrome c oxydase (CCO)
:
La cytochrome c oxydase (CCO) catalyse l'étape finale
de transfert d'électrons vers l'oxygène moléculaire au
cours de la phosphorylation oxydative (Figure 5). C'est un gros complexe
transmembranaire mitochondrial organisé en dimère. Chaque
monomère comporte 13 sous-unités codées à la fois
par le génome mitochondrial et le génome nucléaire. La
stabilité du complexe est donc très sensible et une extraction de
mitochondrie est nécessaire pour avoir des conditions optimales de
dosage.
CCO
Cyt.C réduit + 4H+ + O2
Cyt.C oxydé + H2O
Le principe du dosage consiste simplement à ajouter
à l'extrait le donneur d'électron normal de l'enzyme : le
cytochrome c réduit dont le pic d'absorbance se situe à 550nm. On
suit l'oxydation du cytochrome C à 550nm.
Réserves
énergétiques :
Les lipides totaux sont dosés selon la méthode
de Bligh et Dyer dont le principe consiste à réaliser
plusieurs extractions au mélange éthanol/dichlorométhane.
Les glucides totaux sont dosés selon la méthode de
Dubois. Les glucides se combinent avec le phénol et donnent une
coloration rose-saumon absorbant à 490 nm.
b) Métabolisme oxydatif :
Principe du dosage de la glutathion réductase
(GR) :
Bien que ne réagissant pas directement avec une
espèce réactive de l'oxygène, on considère que
cette enzyme fait quand même parti du métabolisme oxydatif car
elle recycle le glutathion réduit (GSH). En effet, le GSH sert à
la fois de co-substrat pour la glutahion peroxydase mais sert aussi à
détoxifier la cellule de xénobiotiques qui sont potentiellement
une source de production de ROS.
GR
GSSG + NADPH + H+ 2GSH + NADP+
2 GSH + DTNB 2 NTB + GSSG
Comme pour le dosage de la Citrate Synthase, la
deuxième réaction fait intervenir un indicateur coloré (le
nitrothiobenzoate) qui permet de suivre la cinétique de la
réaction initiale à 412nm.
Principe du dosage de la superoxyde dismutase (SOD)
:
La superoxyde dismutase est une
métalloprotéine qui catalyse la dismutation de l'anion superoxyde
en oxygène et en peroxyde d'hydrogène. Il existe plusieurs formes
de SOD utilisant différents noyaux métalliques. On retrouve la
Cu/Zn-SOD dans le cytosol et de la Mn-SOD dans les mitochondries
principalement. Seule l'activité SOD cytosolique est mesurée dans
le protocole utilisé ici.
2 O2ÿ + 2
H+ SOD O2 + H2O2
Des anions superoxydes sont
générés par la réaction entre l'hypoxanthine et la
xanthine oxydase. Ces anions réduisent le cytochrome C. La SOD
présente dans l'échantillon dismute les anions superoxydes et
ceux-ci sont en quantité moindre pour réduire le cytochrome C.
L'analyse est donc basée sur la
« compétition » entre la SOD et le cytochrome C pour
les anions superoxydes. On dose la production de cytochrome C réduit
à 550nm en présence ou en absence d'échantillon.
Principe du dosage de la catalase :
La catalase permet de catalyser la dismutation de l'eau
oxygénée (peroxyde d'hydrogène) en eau et en
dioxygène. C'est une des enzymes les plus performantes connues (sa
vitesse est seulement limitée par la diffusion du substrat).
H2O2 CAT H2O + 1/2
O2
Le dosage est réalisé avec un kit Invitrogen. L'
H2O2 non dégradé par la catalase
réagit avec l'Amplex Red, un composé qui réagit en
présence de peroxydase pour produire un composé
fluorescent : la résorufine qui absorbe à 560 nm.
Principe du dosage DPPH :
La méthode est basée sur la dégradation
du radical DPPH (diphenyl-1-picrylhydrazyl) solubilisé dans un
mélange Méthanol/eau à 80%. Un antioxydant aura la
capacité de donner un électron singulet au radical
synthétique DPPH de coloration violette pour le stabiliser en DPPH non
radicalaire de coloration jaune-verte. La mesure de la décroissance de
coloration violette au bout de 30 minutes d'incubation permet de
déterminer le pourcentage d'inhibition par rapport au blanc dont
l'absorbance ne varie pas.
4. Traitement Statistique
Une Anova à deux facteurs a été
réalisée pour toutes les analyses de Riscosol (facteur temps +
facteur station, méthode LSD à 95% de confiance). Si le
découplage du facteur temps est possible, une analyse de variance sur un
seul point temporel a pu être réalisée pour mettre en
évidence des différences entre stations. Un test T est
réalisé pour différencier sur le plan statistique les
données d'hypoxie et de normoxie (alpha=5%).
Résultats
1. Croissance - Mortalités
Les résultats des données biométriques
obtenues en baie de Quiberon permettent d'évaluer la croissance et la
mortalité des huîtres pour les différentes stations (Figure
8).
 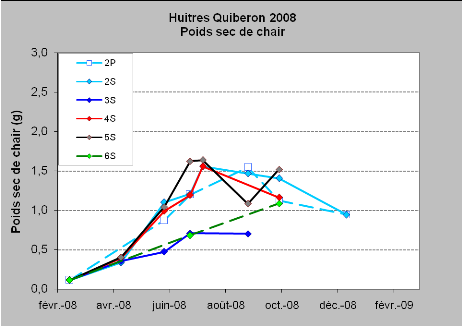
Figure 8 : suivi des mortalités et de la
croissance sur les sites de la baie de Quiberon, S : huîtres sur le
sédiment, P : huîtres en poche surélevées -
Résultats préliminaires Riscosol, Mazurié et al.
2009
La croissance a principalement lieu entre février et
juin. Il n'y a pas de différences notables de croissance entre les trois
stations (2, 4 et 5). Les stations 2 et 5 sont caractérisées par
des mortalités peu élevées contrairement à la
station 4 où la totalité des huîtres est morte en octobre
2008. Pour cette dernière station, des huîtres du même lot
mais élevées sur l'estran depuis février 2008 ont
été resemées en février 2009 afin de continuer le
suivi. On note que le gain de poids des huîtres élevées sur
l'estran est presque trois fois plus faible que celles élevées
dans la baie en eau profonde. En mars 2009, les huîtres de la station 2
ont un poids sec moyen de 1.41g tandis que les huîtres du même
âge issues de l'estran font 0.53g de poids sec en moyenne (tableau annexe
2).
2. Métabolisme
énergétique
a) Réserves énergétiques
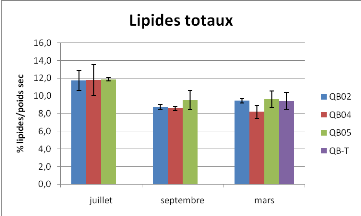 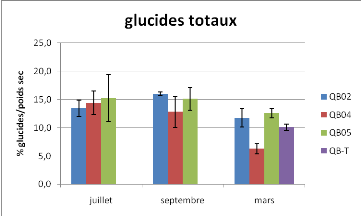
Figure 9 : Taux de lipides totaux et de glucides totaux
en %/poids sec, Moyenne +/- Ecart-type, n=3
Les taux de lipides des huîtres des trois sites
étudiés sont plus élevés en juillet qu'aux autres
dates (Anova à deux facteurs, P<0.05). Aucune différence
significative entre stations n'est observée. Toutes les valeurs de
glucides totaux sont équivalentes sur le plan statistique
exceptée celle de la station 04 en mars (Anova à un facteur pour
le mois de mars, P<0.05).
b) Activités enzymatiques Riscosol
Les résultats sont exprimés en Unité
enzymatique par mg de poids de chair fraiche ou par mg de protéines
solubles.
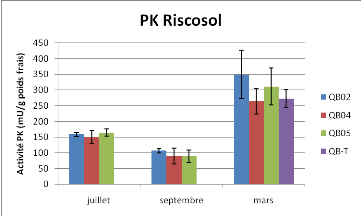 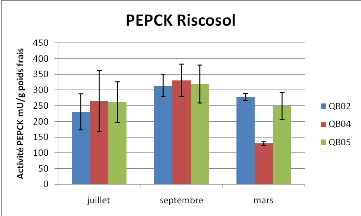
Figure 10 : Activité Pyruvate kinase et
Phosphoénolpyruvate Carboxykinase sur les échantillons Riscosol
d'huîtres entières, Moyenne +/- Ecart-type, n=3
Les variations de l'activité PK sont statistiquement
différentes dans le temps (Anova à deux facteurs P<0.01).
Aucun effet station n'est observé. Il n'y a pas de différences
statistiques entre les différents points pour l'activité PEPCK
(Anova à 2 facteurs, P<0.05) hormis le point de mars pour la station
04 (Anova 1 facteur en mars, P<0.05).
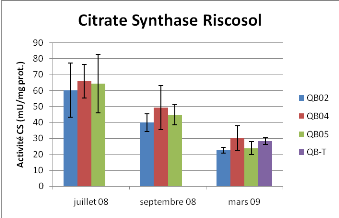 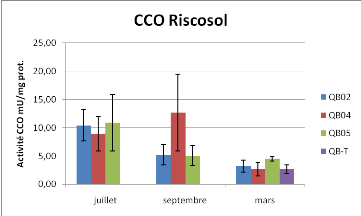
Figure 11 : Activité Citrate Synthèse et
Cytochrome C oxydase sur les échantillons Riscosol d'huîtres
entières, Moyenne +/- Ecart-type, n=3
Comme la PK, les variations de l'activité Citrate
Synthase sont essentiellement expliquées par les variations
saisonnières (Anova à deux facteurs, P<0.01), aucun effet
station n'est observé. Concernant la CCO, les variations de
l'activité sont uniquement expliquées par le temps et aucun effet
station n'est observé par l'analyse statistique. L'activité CCO
de la station 4 en septembre est différente des autres stations à
ce temps mais avec un intervalle de confiance plus faible (92% - méthode
LSD).
c) Manipulation Hypoxie
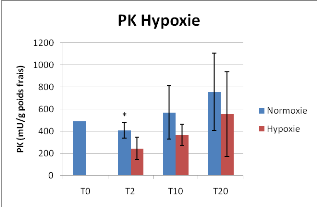 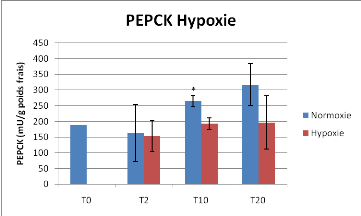
Figure 12 : Activité Pyruvate Kinase et
Phosphoénolpyruvate Carboxykinase en conditions contrôlées
de normoxie et d'hypoxie (~25% de la saturation en O2), Moyenne +/-
Ecart-type,* différence significative entre Normoxie et Hypoxie
La mise en conditions hypoxiques des huîtres provoque
une baisse de l'activité de la PK et PEPCK. Cependant la
différence n'est statistiquement significative que pour le temps T2
jours pour la PK et T10 jours pour la PEPCK.
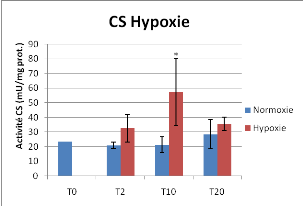 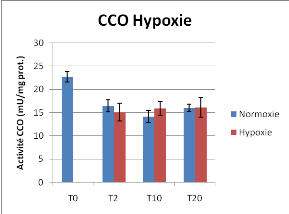
Figure 13 : Activité Citrate Synthèse et
Cytochrome C oxydase en conditions contrôlées de normoxie et
d'hypoxie, Moyenne +/- Ecart-type,* différence significative
On observe une activité Citrate Synthase plus
importante en condition hypoxique particulièrement pour le temps
T10jours (P<0.05). Aucune différence significative n'a
été mise en évidence concernant l'activité CCO
entre condition d'hypoxie et de normoxie.
3. Métabolisme oxydatif
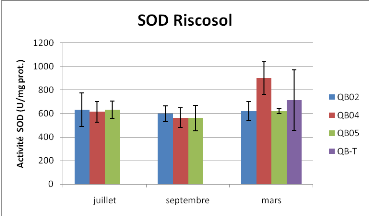 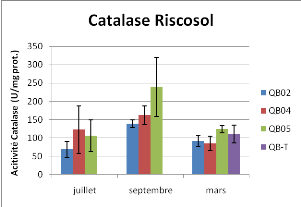
Figure 14 : Activité Superoxide Dismutase et
Catalase sur les échantillons Riscosol d'huîtres entières,
Moyenne +/- Ecart-type, n=3
Pour l'activité Superoxide Dismutase, l'analyse de
variance ne révèle aucune différence statistique quelque
soit le facteur. Cependant, pour le mois de mars, une ANOVA à un facteur
permet de différencier les activités SOD entre la station 4 et
les stations 2 et 5(P<0.05). L'activité Catalase est
caractérisée par un effet station significatif (P<0.001),
ainsi qu'un effet du à la saison (P<0.05) ; (ANOVA à deux
facteurs).
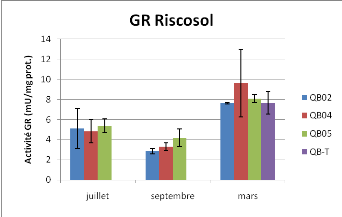 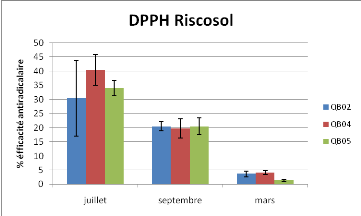
Figure 15 : Activité Glutathion Réductase
et dosage DPPH sur les échantillons Riscosol d'huîtres
entières Moyenne +/- Ecart-type, n=3
Les variations de l'activité GR sont statistiquement
différentes au cours du temps (Anova à deux facteurs P<0.001).
Pour cette enzyme, l'activité GR de la station 5 semble plus haute que
celle de la station 2, en particulier lors du mois de septembre, mais cette
différence n'est pas significative au seuil de 5% (P=0.067). Les
variations de l'activité DPPH sont fortement expliquées par
l'effet temps (P<0.001) mais aucune différence statistique ne permet
de déceler des variations entre stations.
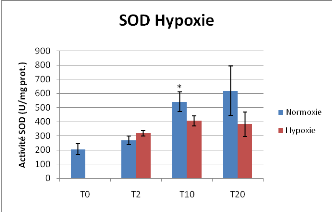 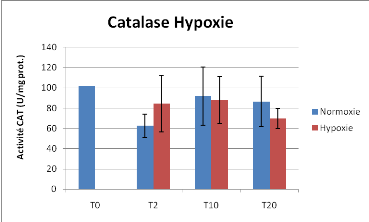
Figure 16 : Activité Superoxide Dismutase et
Catalase en condition contrôlée d'hypoxie, Moyenne +/-
Ecart-type,* différence significative entre Normoxie et Hypoxie
En condition d'hypoxie l'activité SOD est plus faible
par rapport à la normoxie de façon significative à T10
jours(P<0.05) et presque significative à T20 jours (P=0.051). Tout
comme comme les activitées PK et PEPCK, on observe une augmentation de
l'activité SOD au cours de l'expérience pour les individus
témoin (normoxie). L'activité Catalase ne varie pas avec les
conditions hypoxiques.
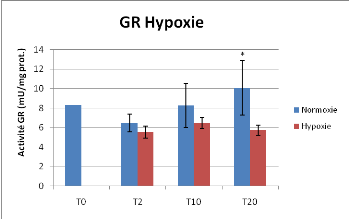
Figure 17 : Activité Glutathion Réductase
en condition contrôlée d'hypoxie, Moyenne +/- Ecart-type,*
différence significative entre Normoxie et Hypoxie
L'activité Glutathion Réductase est
significativement réduite en condition d'hypoxie, la différence
est significative pour le point T20 jours (P<0.05) et confirme donc la
tendance observée aux temps précédents.
4.
Corrélations d'activités enzymatiques Risocosol
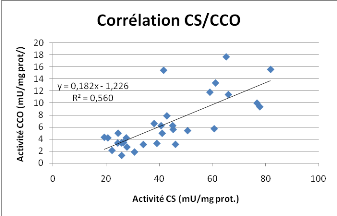 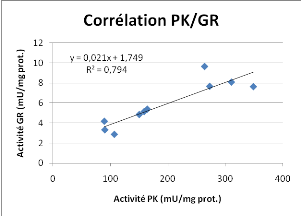
Figure 18 : Corrélation linéaire entre les
données de CS et CCO (par réplicats biologiques) et
corrélation linéaire entre les activités PK et GR (par
point de mesure).
Une corrélation est observée entre les
activités de CS et de CCO ainsi qu'entre les activités de PK et
de GR. Les coefficients de corrélation R² sont supérieurs
à 0.5.
Discussion
Croissance - Mortalités
La croissance observée en baie de Quiberon en eau
profonde est très importante. Pour comparaison, le taux de croissance
printanier des huîtres de Marennes-Oléron est 0.18g poids sec/mois
(données « Morest » Soletchnik et al. [3]) tandis
qu'il atteint 0.38g poids sec/mois en baie de Quiberon pour la station QB05.
Les mortalités sont faibles pour les stations 2 et 5 et sont
relativement régulières (environ 20% sur une année),
tandis que la station 4 a subi une forte mortalité pendant cette
première année d'élevage au sol (Figure 8). La
présence sur ce site de nombreux bigorneaux perceurs pourrait être
une des explications à ce taux de mortalité. La perte de poids de
l'ensemble des animaux pendant l'été correspond principalement
à l'émission de gamètes. Par ailleurs, on observe des
différences au niveau physiologique des huîtres stockées
sur l'estran qui ont subi l'exondation et qui ont été
resemées en mars. La taille moyenne et le poids sec moyen de ces
huîtres sont beaucoup plus faibles (annexe 2). Les réserves
énergétiques sont plus faibles, le niveau de métabolisme
énergétique est également plus faible tandis que le
métabolisme oxydatif est davantage activé par rapport aux
huîtres cultivées en pleine eau. Tous ces éléments
attestent du fait que les huîtres resemées ont été
ou sont, dans ces nouvelles conditions environnementales, stressées et
ne sont pas comparables aux huîtres des autres stations.
Mesures des réserves
énergétiques
Les réserves d'énergie chez l'huître
creuse sont principalement constituées de glycogène et de
lipides. Le taux de lipides suit essentiellement la
gamétogénèse, les gonades ayant le plus fort taux de
lipides dans l'organisme. La baisse du taux de lipides entre juillet et
septembre 2008 (Figure 9) concomitante à la perte de poids sec peut
correspondre à la ponte. Le taux de lipides est en accord avec les
données bibliographiques [12]. Concernant les glucides totaux, les taux
sont classiques pour cette espèce qui est connue pour stocker beaucoup
de glucides par rapport à d'autres huîtres comme l'huître
plate par exemple [12, 13]. Les huîtres n'ont pas encore commencé
à stocker des sucres en mars. On note également un taux de sucres
plus faible pour les nouveaux individus de la station 04 arrivés en
mars.
Mesures des activités enzymatiques du
métabolisme énergétique
L'activité PK pendant juillet et septembre est assez
faible (100-150mU/g poids frais) comparée aux taux mesurés en
condition contrôlé normoxie-hypoxie qui sont plutôt de
l'ordre de 500-700mU/g poids frais. L'activité PK plus
élevée en mars atteste que la glycolyse fonctionne bien à
cette période et pourrait correspondre à la présence de
ressources nutritives dans l'environnement.
Les données de CS sur Crassostrea gigas dans
la littérature montrent des activités comparables aux
nôtres (Activité CS de 1.5mU/mg ph soit environ 50mU/mg prot. pour
Fields et al. [11], activités de 0.8mU/mg ph soit environ 30mU/mg prot.
pour Dunphy et al. [13]). Les valeurs de CS estivales paraissent tout de
même plus élevées pour les échantillons Riscosol
(~60mU/mg prot.) que les échantillons témoins de la manipulation
hypoxie (~20mU/mg prot.) ce qui peut s'expliquer par le stress environnemental
naturel (marées, sédiment,...) subi par les huîtres par
rapport à des conditions en milieu contrôlé en
laboratoire.
L'absence de hausse de la CS en mars peut signifier que les
produits de la glycolyse ne sont pas essentiellement utilisés pour les
dépenses energétiques de l'animal. Ils peuvent être
orientés vers des voies de stockages (synthèse lipidique par
exemple) ou pour la gamétogénèse. Des niveaux faibles
d'activité Citrate Synthase peuvent également être le signe
d'une contamination aux métaux lourds [14]. Hormis une contamination de
ce type, la CS (et le métabolisme plus généralement)
serait régulé par la température essentiellement [14].
Pour la PK, outre la température, plusieurs autres facteurs peuvent
participer à sa régulation. Le Moullac indique que
l'activité PK chez Crassostrea gigas peut être lié
au processus reproductif [6]. Les facteurs comme l'alimentation et le type de
métabolisme (aérobie/anaérobie) seraient également
liés aux variations saisonnières de l'activité PK [15].
Des conditions limitantes d'oxygène pendant
l'été 2008 pourraient provoquer la baisse de l'activité PK
aux niveaux mesurés. La baisse de l'activité PK a
été plusieurs fois confirmée en condition hypoxique [6,
16]. L'influence de l'hypoxie sur l'activité Citrate Synthase est
contradictoire selon les auteurs dans la littérature. Certains montrent
la baisse de l'activité en condition hypoxique chez E. Coli [17] ou chez
le rat [18], tandis que d'autres études montrent l'inverse chez les
bivalves marins [19]. Nos résultats pour l'expérimentation
hypoxie tendent à confirmer la hausse de l'activité CS en
condition d'hypoxie chez l'huître creuse.
La réponse de ces deux enzymes à l'hypoxie est
donc totalement différente. Cela contribue à expliquer le
découplage observé entre les données de PK et CS.
Il n'y a pas de variations saisonnières de
l'activité PEPCK. L'activité PEPCK est connue pour ses faibles
variations d'activité, sa régulation étant surtout
allostérique. L'activité est principalement régulée
par les variations de pH observées en condition d'hypoxie ou
d'émersion qui influe sur le sens de la réaction. On note
toutefois une activité plus basse pour les huîtres issues de
l'estran de la station QB04 en mars.
Concernant l'activité CCO, la variabilité des
taux entre les différents réplicats biologiques est très
élevée. Elle correspond à une grande
hétérogénéité au sein de la population. Cela
est particulièrement mis en évidence pour la station 04 en
septembre 2008. A cette date, la station 04 est touchée par de fortes
mortalités. La probabilité d'échantillonner des
huîtres moribondes ou en état de stress est donc non
négligeable et pourrait correspondre à cette forte
différence entre individus. Une hausse de l'activité CCO pourrait
être liée à un stress environnemental. En effet, certains
résultats de « Morest » en conditions
contrôlées (hypoxie) montraient une augmentation de
l'activité ETS (mesure du transport d'électron de la chaîne
respiratoire) en été et en automne alors que la consommation
d'oxygène des huîtres en hypoxie a baissé de 70% [6]. Ce
résultat peut être expliqué par un processus de
compensation de l'huître qui essaye de maintenir le plus possible un
métabolisme aérobie. L'hypothèse d'une régulation
au niveau du gène est alors envisageable puisqu'une
sur-régulation de la sous-unité III de la cytochrome c oxydase a
été montrée dans la glande digestive d'huîtres
soumises à l'hypoxie [20]. Cependant, les résultats de nos
mesures de l'activité CCO sur les huîtres soumises à
l'hypoxie ne montrent pas de réponse de l'activité de la CCO
spécifiquement au manque d'oxygène. Cette différence entre
l'expression de gène et l'activité enzymatique pour la CCO en
condition d'hypoxie a déjà été discutée par
Ripamonti et al. Il s'étonnait de voir l'expression du gène
augmenter alors que l'activité baissait pour cette enzyme lors de ses
essais sur le rat [18]. De nombreuses étapes régulatrices entre
l'expression au niveau d'un gène et l'activité d'une
protéine existent et peuvent expliquer ce résultat.
L'activité CCO peut également être induite par une
contamination au cadmium [21]. L'activité CCO plus haute en
été serait davantage due à des facteurs comme la
température, l'hypoxie ou les métaux lourds qu'aux sulfures,
ceux-ci provoquant une baisse de l'activité CCO [22].
La corrélation entre les activités CS et CCO est
représentative du lien entre production du pouvoir réducteur par
le cycle de Krebs et le fonctionnement de la chaîne respiratoire. Marie
et al. [23] ont déjà montré ce type de corrélation
chez le ver hydrothermal Paralvinella g.. La CS et la CCO peuvent
être utilisées comme des indices du niveau de métabolisme.
La CS est même parfois considérée comme un indice de la
croissance de l'individu (chez l'huître creuse [13, 24].
Mesure des activités enzymatiques du
métabolisme oxydatif
La mesure de l'activité GPx a mis en évidence
des taux très faibles. Les activités étant à la
limite du seuil de détection, les données ne sont pas
interprétables. La faible activité GPx chez Crassostrea
gigas est tout de même un résultat important. Il confirme les
résultats de Valavanidis et al. [25] qui indique que l'activité
GPX est de deux ou trois ordres de grandeur plus faible chez les
invertébrés que chez les vertébrés.
Pour les échantillons Riscosol, aucune
différence d'activité de SOD n'est visible, aussi bien entre les
différentes stations qu'entre les différents points temporels. On
note toujours une activité différente pour le lot d'huître
provenant de l'estran (station QB04 en mars) ainsi qu'une plus grande
variabilité concernant les huîtres de la station 02 en table
(hors-sol). Pourtant la SOD répond assez bien à l'hypoxie, comme
le confirme nos analyses ainsi que les travaux de Monari et al. chez la petite
praire [26] ou Pannuzio et al. chez la littorine [27]. Nos données
confirment le schéma de réponse de l'activité SOD en
condition hypoxique décrit par Chen et al. chez le
pétoncle [28] : dans un premier temps, la SOD est activée
par l'hypoxie puis l'activité décroit rapidement à partir
de 7 jours d'hypoxie. Les faibles valeurs observées pour la SOD en Baie
de Quiberon ne plaident pas forcement en faveur d'un sédiment peu
anoxique tout au long de l'année car l'activité SOD varie
également avec la contamination par les pathogènes et la
pollution (chez la moule [29]). Box et al. [30] soulignent que la
rapidité d'adaptation de cette activité enzymatique à des
changements environnementaux en fait un bon biomarqueur de la qualité de
l'environnement.
L'évolution de l'activité catalase au cours de
l'année ne suit pas la tendance générale des autres
activités enzymatiques qui semblent indiquer que le métabolisme
de l'huître est plus actif en juin qu'en septembre. En effet, le taux de
catalase est globalement plus élevé en septembre qu'en juillet. A
cette date, les taux de catalase de l'ordre de 150-200U/mg prot. semblent assez
élevés par rapport aux taux mesurés en conditions
contrôlées de la manipulation hypoxie qui sont de 80-100U/mg prot.
La bibliographie donne aussi des activités catalase
généralement plus faibles : 20-60U/mg prot. dans la glande
digestive de la palourde [31], 80-100U/mg prot. chez la moule bleue [32].
La catalase est connue pour répondre assez bien aux
polluants [33, 34] mais très peu à l'hypoxie [35] ce que confirme
nos essais en conditions d'hypoxie. La variation observée dans le milieu
est peut-être due à un incident qui a remis de la vase en
suspension (grande marée, tempête, dragage,...) et qui a
provoqué ce pic en septembre. Cependant, les fluctuations
saisonnières de l'activité catalase peuvent également
varier en ce sens : on observe un pic de l'activité catalase chez
Mytilus galloprovencialis en novembre alors que l'activité est
minimale en mai (mesures sur les branchies, [36]). C'est pour cette
activité enzymatique que l'on dénote la plus grande
différence entre les différentes stations de la baie de Quiberon
à chaque date. Comme pour la GR, on pourrait associer ces
différences au gradient d'envasement des stations. Ici, la station 02
(la moins envasée) a le taux le plus faible de catalase tandis que la
station 05 présente le taux le plus fort.
Les activités de GR des huîtres de la baie de
Quiberon, en juillet et en septembre sont relativement basses (environ 3-4
mU/mg prot.) si on les compare aux taux de GR des huîtres témoins
pour l'expérimentation hypoxie qui atteignent 10mU/mg prot. Nos essais
montrent une baisse de cette activité en hypoxie conformément aux
travaux de Pannuzio et al. qui ont également relevé une baisse de
la GR chez la littorine en condition d'hypoxie : le taux d'activité
GR passe de 13.8#177;1.5 mU/mg prot. en normoxie à 8.3#177;0.8 mU/mg
prot. après 6 jours d'hypoxie [27].
La GR suit essentiellement le rythme de l'activité
métabolique de l'individu en temps normal, c'est-à-dire une
activité corrélée essentiellement à la
température ou à l'activité d'assimilation nutritive.
Manduzio et al. ont observé des fluctuations
saisonnières de GR chez la moule bleue avec un pic d'activité en
juin alors qu'elle est minimale pendant l'hiver [29]. Dans notre cas,
l'activité GR est moins importante en septembre et juillet qu'en mars.
Cela peut être expliqué par une reprise de l'activité
d'assimilation nutritive dès mars ou bien par la forte répression
de cette activité pendant l'été. La modification de
l'activité GR avec des conditions hypoxiques en été n'est
donc pas à exclure.
On peut noter également que pour cette activité
enzymatique, on retrouve une légère différence entre
stations (non significative sur le plan statistique) qui est
corrélée avec le taux d'envasement de la station. Cela est peut
être lié avec le rôle de la GR dans la détoxication
des xénobiotiques et des métaux lourds qui sont surtout
présents dans les sédiments.
La corrélation observée entre l'activité
PK et l'activité GR est surprenante car elle lie le métabolisme
oxydatif et la glycolyse et non la chaîne respiratoire. Le rôle de
la GR dans la production du glutathion réduit pourrait expliquer ce
lien. L'activité de filtration apporte à la fois des nutriments
et des matières en suspensions non nutritives. Ces dernières
peuvent être des métaux lourds ou des xénobiotiques. La
détoxication de ces composés faisant intervenir le glutathion, on
peut coupler ces activités de détoxications avec l'assimilation
de glucose qui dépend également du rythme de filtration.
Concernant le DPPH, on remarque que l'organisme mobilise ses
capacités antiradicalaires surtout en été ce qui est en
accord les travaux de Seguineau et al. chez Crassostrea gigas qui
montrent une baisse hivernale du taux de vitamines [37]. Le système
antioxydant non enzymatique, est principalement représenté par
des vitamines, mais certains acides aminés (cystéine
méthionine) ou le glutathion réduit (GSH) ont également un
rôle de défense contre les radicaux libres. En mars, le taux
très faible d'antioxydants peut être interprété par
le fait que l'animal n'a pas besoin à ce moment de l'année de
mobiliser des défenses antioxydantes. On peut considérer que des
conditions eutrophes du milieu devraient permettre une réaction rapide
des organismes en cas de stress. Toutefois certains antioxydants comme l'acide
ascorbique et le tocophérol n'interviennent pas dans le dosage DPPH
[38]. Le protocole utilisé ciblerait donc une partie des défenses
antiradicalaires qui n'est pas activée pendant le printemps.
Concernant les activités enzymatiques mesurées,
aucune différence significative n'est observée entre les
huîtres de la station 2 à plat sur le sédiment (QB02) ou en
surélevé sur table (QB-T) pour le prélèvement du
mois de mars. Cependant, la croissance des huîtres sur le sédiment
est meilleure : 1.43g de poids frais contre 1.09g pour les huîtres
surélevées en mars 2009 (table annexe 2). On observe aussi une
mortalité légèrement supérieure pour les
huîtres sur le sédiment (Figure 9). Cette mortalité
différentielle n'est peut être pas due à un stress
physiologique mais à facteur externe comme la prédation par
exemple. Il est probable que des différences entre les huîtres
surélevées et les huîtres au contact du sédiment
devront apparaître davantage au moment de l'épisode de
mortalité vers juin.
Conclusion
La majorité des mesures effectuées mettent en
évidence le cycle saisonnier des huîtres sans pour autant pouvoir
discriminer les différentes stations dans la baie. L'absence d'effet
station pour la plupart de mesures effectuées indique que les
huîtres sont dans des conditions environnementales très proches.
En baie de Quiberon, l'année 2008 a été
caractérisée par des mortalités relativement faibles chez
les huîtres adultes. La faible amplitude de cet évènement
peut expliquer l'absence de différences entre les différentes
stations de la baie.
Les résultats préliminaires des
biogéochimistes semblent converger vers le fait que les sédiments
des différentes stations présentent de faibles taux d'ammoniac,
de l'ordre de 60uM à 2cm en dessous de la surface et pas de traces de
sulfures et que les flux sont faibles traduisant une faible activité
biologique du sédiment.
Les résultats sont confirmés par les analyses
microbiologiques qui révèlent une faible concentration des
bactéries totales et cultivables aussi bien dans les sédiments
que dans l'hémolymphe des huîtres. Cependant les stations 5 et 4
présentent respectivement le plus faible et le plus fort pourcentage en
vibrios, bactéries le plus souvent impliquées dans la
mortalité des huîtres.
Toutefois, l'activité catalase est à surveiller
car elle serait un bon marqueur du taux d'envasement de la station. De
même, l'activité Cytochrome C oxydase pourrait être
corrélée à un état de stress physiologique
prémortem. Les analyses réalisées sur les huîtres
placées en condition d'hypoxie ont permis de mieux comprendre les
réponses des différents systèmes enzymatiques au manque
d'oxygène. En effet, en milieu naturel, une multitude de facteurs
(température, salinité, oxygène dissout,
photopériode, prédation,...) peuvent influer la physiologie de
l'animal et il est toujours très difficile de découpler les
divers facteurs causant un stress.
Bibliographie
1. Soletchnik, P., Le Moine, O., Faury, N., Razet, D., Geairon,
P., Goulletquer, P., Summer mortality of the oyster in the Bay
Marennes-Oléron: Spatial variability of environment and biology using a
geographical information system (GIS). Aquatic Living Resources, 1999.
12: p. 131-143.
2. Gagnaire, B., Soletchnik, P., Madec, P., Gealron, P., Le
Moine, O., Renault, T., Diploid and triploid Pacific oysters, Crassostrea
gigas (Thunberg), reared at two heights above sediment in Marennes-Oleron
Basin, France: Difference in mortality, sexual maturation and hemocyte
parameters. Aquaculture, 2006. 254(1-4): p. 606-616.
3. Samain, J.F., McCombie, H., Mortalités estivales de
l'huître creuse Crassostrea gigas - Défi Morest. Edition
Quae, 2007.
4. Sornin, J.M.F., M. Heral, M. Deslous-Paoli, J. M., Effet
des biodépôts de l'huître Crassostrea gigas (Thunberg) sur
l'accumulation de matières organiques dans les parcs du bassin de
Marennes-Oléron. J. Mollus. Stud., 1983.
49(supp12A): p. 185-197.
5. Kristensen, E. and T.H. Blackburn, The Fate of
Organic-Carbon and Nitrogen in Experimental Marine Sediment Systems - Influence
of Bioturbation and Anoxia. Journal of Marine Research, 1987.
45(1): p. 231-257.
6. Le Moullac, G., Fleury, P. G., Le Coz, J. R., Moal, J.,
Samain, J. F., Effect of sediment nearness on the metabolic enzyme activity
and energy state of the oyster Crassostrea gigas. Aquatic Living
Resources, 2007. 20(3): p. 279-286.
7. Fleury, E., Influence du sédiment sur les flux
énergétiques et le métabolisme oxydatif chez
l'huître creuse Crassostrea gigas. Thèse de docteur
d'état - Université de Rennes 1, 2009.
8. Delaporte, M., Soudant, P., Lambert, C., Jegaden, M., Moal,
J., Pouvreau, S., Degremont, L., Boudry, P., Samain, J. F.,
Characterisation of physiological and immunological differences between
Pacific oysters (Crassostrea gigas) genetically selected for high or low
survival to summer mortalities and fed different rations under controlled
conditions. Journal of Experimental Marine Biology and Ecology, 2007.
353(1): p. 45-57.
9. Tielens, A.G.M., Rotte, C., van Hellemond, J. J., Martin, W.,
Mitochondria as we don't know them. Trends in Biochemical Sciences,
2002. 27(11): p. 564-572.
10. Carriere, A., Galinier, A., Fernandez, Y., Carmona, M. C.,
Penicaud, L., Casteilla, L., Physiological and physiopathological
consequences of mitochondrial reactive oxygen species. M S-Medecine
Sciences, 2006. 22(1): p. 47-53.
11. Fields, J.H.A. and P.W. Hochachka, Oyster Citrate
Synthase - Control of Carbon Entry into Krebs Cycle of a Facultative
Anaerobe. Canadian Journal of Zoology-Revue Canadienne De Zoologie, 1976.
54(6): p. 892-895.
12. Pazos, A.J., Ruiz, C., GarciaMartin, O., Abad, M., Sanchez,
J. L., Seasonal variations of the lipid content and fatty acid composition
of Crassostrea gigas cultured in El Grove, Galicia, NW Spain. Comparative
Biochemistry and Physiology B-Biochemistry & Molecular Biology, 1996.
114(2): p. 171-179.
13. Dunphy, B.J., Wells, R. M. G., Jeffs, A. G., Oxygen
consumption and enzyme activity of the subtidal flat oyster (Ostrea chilensis)
and intertidal Pacific oyster (Crassostrea gigas): responses to temperature and
starvation. New Zealand Journal of Marine and Freshwater Research, 2006.
40(1): p. 149-158.
14. Ivanina, A.V., Habinck, E., Sokolova, I. M., Differential
sensitivity to cadmium of key mitochondrial enzymes in the eastern oyster,
Crassostrea virginica Gmelin (Bivalvia : Ostreidae). Comparative
Biochemistry and Physiology C-Toxicology & Pharmacology, 2008.
148(1): p. 72-79.
15. Greenway, S.C. and K.B. Storey, Seasonal change and
prolonged anoxia affect the kinetic properties of phosphofructokinase and
pyruvate kinase in oysters. Journal of Comparative Physiology
B-Biochemical Systemic and Environmental Physiology, 2000.
170(4): p. 285-293.
16. Greenway S.C. and StoreyK.B., The effect of prolonged
anoxia on enzyme activities in oysters (Crassostrea virginica) at different
seasons. Journal of Experimental Marine Biology and Ecology 1999.
242(2): p. 259-272.
17. Park, S.J., Mccabe, J., Turna, J., Gunsalus, R. P.,
Regulation of the Citrate Synthase (Glta) Gene of Escherichia-Coli in
Response to Anaerobiosis and Carbon Supply - Role of the Arca
Gene-Product. Journal of Bacteriology, 1994. 176(16): p.
5086-5092.
18. Ripamonti, M., Vigano, A., Moriggi, M., Milano, G., von
Segesser, L. K., Samaja, M., Gelfi, C., Cytochrome c oxidase expression in
chronic and intermittent hypoxia rat gastrocnemius muscle quantitated by
CE. Electrophoresis, 2006. 27(19): p. 3897-3903.
19. Portner, H.O., Contributions of Anaerobic Metabolism to
Ph Regulation in Animal-Tissues - Theory. Journal of Experimental Biology,
1987. 131: p. 69-87.
20. David, E., Tanguy, A., Pichavant, K., Moraga, D.,
Response of the Pacific oyster Crassostrea gigas to hypoxia exposure under
experimental conditions. Febs Journal, 2005. 272(21): p.
5635-5652.
21. Cherkasov, A.A., Overton, R. A., Sokolov, E. P., Sokolova, I.
M., Temperature-dependent effects of cadmium and purine nucleotides on
mitochondrial aconitase from a marine ectotherm, Crassostrea virginica: a role
of temperature in oxidative stress and allosteric enzyme regulation.
Journal of Experimental Biology, 2007. 210(1): p. 46-55.
22. Le Moullac, G., Cheize, M., Gastineau, O., Daniel, J. Y., Le
Coz, J. R., Huvet, A., Moal, J., Pouvreau, S., van Wormhoudt, A., Samain, J.
F., Ecophysiological and metabolic adaptations to sulphide exposure of the
oyster Crassostrea gigas. Journal of Shellfish Research, 2008.
27(2): p. 355-363.
23. Marie, B., Genard, B., Rees, J.F., Zal, F., Effect of
ambient oxygen concentration on activities of enzymatic antioxidant defences
and aerobic metabolism in the hydrothermal vent worm, Paralvinella
grasslei. Marine biology, 2006. 150: p. 273-284.
24. Garcia-Esquivel, Z., V.M. Bricelj, and H. Felbeck,
Metabolic depression and whole-body response to enforced starvation by
Crassostrea gigas postlarvae. Comparative Biochemistry and Physiology
a-Molecular and Integrative Physiology, 2002. 133(1): p.
63-77.
25. Valavanidis, A., Vlahogianni, T., Dassenakis, M., Scoullos,
M., Molecular biomarkers of oxidative stress in aquatic organisms in
relation to toxic environmental pollutants. Ecotoxicology and
Environmental Safety, 2006. 64(2): p. 178-189.
26. Monari, M., Matozzo, V., Foschi, J., Marin, M. G., Cattani,
O., Exposure to anoxia of the clam, Chamelea gallina II: Modulation of
superoxide dismutase activity and expression in haemocytes. Journal of
Experimental Marine Biology and Ecology, 2005. 325(2): p.
175-188.
27. Pannunzio, T.M. and K.B. Storey, Antioxidant defenses and
lipid peroxidation during anoxia stress and aerobic recovery in the marine
gastropod Littorina littorea. Journal of Experimental Marine Biology and
Ecology, 1998. 221(2): p. 277-292.
28. Chen, J.H., Mai, K. S., Ma, H. M., Wang, X. J., Deng, D.,
Liu, X. W., Xu, W., Liufu, Z. G., Zhang, W. B., Tan, B. P., Ai, Q. H.,
Effects of dissolved oxygen on survival and immune responses of scallop
(Chlamys farreri Jones et Preston). Fish & Shellfish Immunology, 2007.
22(3): p. 272-281.
29. Manduzio, H., Monsinjon, T., Galap, C., Leboulenger, F.,
Rocher, W., Seasonal variations in antioxidant defences in blue mussels
Mytilus edulis collected from a polluted area: major contributions in gills of
an inducible isoform of Cu/Zn-superoxide dismutase and of glutathione
S-transferase. Aquatic Toxicology, 2004. 70(1): p.
83-93.
30. Box, A., et al., Assessment of environmental pollution at
Balearic Islands applying oxidative stress biomarkers in the mussel Mytilus
galloprovincialis. Comparative Biochemistry and Physiology C-Toxicology
& Pharmacology, 2007. 146(4): p. 531-539.
31. Irato P., P.E., Cassini A., Santovito G. , Antioxidant
responses to variations in dissolved oxygen of Scapharca inaequivalvis and
Tapes philippinarum, two bivalve species from the lagoon of Venice. .
Marine Pollution Bulletin, 2007.
32. Leinio, S. and K.K. Lehtonen, Seasonal variability in
biomarkers in the bivalves Mytilus edulis and Macoma balthica from the northern
Baltic Sea. Comparative Biochemistry and Physiology C-Toxicology &
Pharmacology, 2005. 140(3-4): p. 408-421.
33. Zanette, J., Nunes, F. F., Medeiros, I. D., Siebert, M. N.,
Mattos, J. J., Luchmann, K. H., de Melo, C. M. R., Bainy, A. C. D.,
Comparison of the antioxidant defense system in Crassostrea rhizophorae and
Crassostrea gigas exposed to domestic sewage discharges. Marine
Environmental Research, 2008. 66(1): p. 196-198.
34. Zanette, J., Monserrat, J. M., Bianchini, A., Biochemical
biomarkers in gills of mangrove oyster Crassostrea rhizophorae from three
Brazilian estuaries. Comparative Biochemistry and Physiology C-Toxicology
& Pharmacology, 2006. 143(2): p. 187-195.
35. Wilhelm, D., Torres, M. A., Zaniboni, E., Pedrosa, R. C.,
Effect of different oxygen tensions on weight gain, feed conversion, and
antioxidant status in piapara, Leporinus elongatus (Valenciennes, 1847).
Aquaculture, 2005. 244(1-4): p. 349-357.
36. Santovito, G., Piccinni, E., Cassini, A., Irato, P.,
Albergoni, V., Antioxidant responses of the Mediterranean mussel, Mytilus
galloprovincialis, to environmental variability of dissolved oxygen.
Comparative Biochemistry and Physiology C-Toxicology & Pharmacology, 2005.
140(3-4): p. 321-329.
37. Seguineau, C., et al., Changes in tissue concentrations
of the vitamins B1 and B2 during reproductive cycle of bivalves Part 2. The
Pacific oyster Crassostrea gigas. Aquaculture, 2001.
196(1-2): p. 139-150.
38. Bhadra, A., Yamaguchi, T., Takamura, H., Matoba, T.,
Radical-scavenging activity: Role of antioxidative vitamins in some fish
species. Food Science and Technology Research, 2004.
10(3): p. 264-267.
Annexes
Annexe 1 : Détails des sites retenus dans le projet
Riscosol
|
code
|
nom
|
|
Latitude
|
Longitude
|
sédiment
|
|
|
2P
|
Men-er-Roué - poche
|
47°32'340
|
3°05'464
|
|
|
|
2S
|
Men-er-Roué - sol
|
47°32'341
|
3°05'465
|
Sablo-vaseux avec maërl
|
|
3S
|
Beaumer sud -sol
|
47°32'857
|
3°02'600
|
Vase molle
|
|
|
4S
|
Angle sud - sol
|
47°31'228
|
3°04'549
|
Vase molle
|
|
|
5S
|
St-Pierre-Qb -sol
|
47°31'012
|
3°06'772
|
Vase dure
|
|
|
6S
|
Karrek-Bernard - sol
|
47°33'010
|
3°05'312
|
Sable vaseux
|
Annexe 2 : Table poids sec moyen par huître, poids sec
initial en février 2008 : 0.11g, QB04 en mars 2009 correspond
à un semis de la même population restée sur estran en
2008/2009, QB-T en mars 2009 correspond à des huîtres de station
QB02 surélevées en table.
|
Temps
|
Station
|
Poids sec moyen
|
|
Juillet 08
|
QB02
|
1,560
|
|
|
QB04
|
1,564
|
|
|
QB05
|
1,641
|
|
Septembre 08
|
QB02
|
1,409
|
|
|
QB04
|
1,311
|
|
|
QB05
|
1,361
|
|
Mars 09
|
QB02
|
1,432
|
|
|
QB04
|
0,531
|
|
|
QB05
|
1,510
|
|
|
QB-T
|
1,092
|
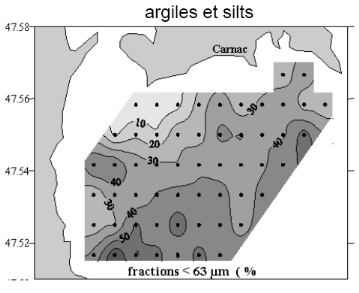
Annexe 3 : Etude préliminaire Riscosol, vases
fines/argiles et sables de la baie de Quiberon, données non
publiées, Fleury et al. 2007.
Résumé :
Dans le contexte des mortalités estivales de
l'huître creuse sur le littoral français, le projet
« Riscosol » a été initié pour
comprendre les échanges de matière et d'énergie au niveau
du sédiment dans la baie de Quiberon. En effet, une hypothèse
majeure pour expliquer la mortalité des huîtres est que la
proximité et la qualité du sédiment provoquerait une
dépression métabolique des individus pendant la phase de
croissance printanière. Une sensibilisation plus ou moins forte selon
la qualité du sédiment provoquerait des mortalités.
L'objectif de ces travaux est de documenter comment la physiologie de
l'huître est affectée par des variations de la qualité du
sédiment. Les huîtres proviennent de trois stations situées
en baie de Quiberon ainsi que d'une expérimentation en condition
contrôlée d'hypoxie. La mesure de paramètres du
métabolisme énergétique (PK : Pyruvate Kinase,
PEPCK : Phosphoénolpyruvate Carboxiykinase, CS : Citrate
Synthase et CCO : Cytochrome c oxydase) et du métabolisme oxydatif
(GR : Glutathion Réductase, GPx : Glutathion Peroxydase,
CAT : Catalase, SOD : Superoxide Dismutase et DPPH :
activité antiradicalaire) permet d'évaluer les conditions
physiologiques des huîtres. Les résultats mettent en
évidence de faibles différences au niveau physiologique pour les
huîtres des différentes stations de la baie de Quiberon. Les
variations d'activité observées sont principalement
expliquées par des fluctuations saisonnières. Toutefois,
l'activité catalase semblerait être un bon marqueur du taux
d'envasement et l'activité Cytochrome C oxydase pourrait être
corrélée à un état de stress physiologique. La
poursuite du suivi en 2009 pourra confirmer ces hypothèses. Cette
étude a permis également de documenter certaines variations
d'activités enzymatiques en réponse à l'hypoxie chez
Crassostrea gigas.
Abstract :
The program named «Riscosol», aiming to study the
exchange of energy and matter on the sediment interface in the Quiberon bay,
was initiated to understand the role of sediment quality in the summer
mortality phenomenon of the Pacific oyster on the French coast. The major
hypothesis to explain the mortality of oysters is that the low quality and the
proximity of the sediment could affect the metabolism of the organisms during
the spring growth. Therefore, this sensitivity could cause abnormal mortality
in the early summer. The purpose of this study is to examine how the physiology
of oysters is affected by the variations of the quality of the sediment.
Oysters were sampled from three sites in the Quiberon bay and from a controlled
experiment inducing hypoxia. The measurement of several energetic metabolism
parameters (PK : Pyruvate Kinase, PEPCK : Phosphoénolpyruvate
Carboxykinase, CS : Citrate Synthase and CCO : Cytochrome c oxidase)
and the oxidative metabolism (GR : Glutathion Réductase, GPx :
Glutathion Peroxydase, CAT : Catalase, SOD : Superoxide Dismutase and
DPPH (total antioxydant capacity) was performed to determine oyster
condition. The results show small differences of physiological state between
the three studied sites in the Quiberon bay. The fluctuations of activity are
mostly related to seasonal variations. However, the catalase activity appeared
to be a good marker of the silting of the sampled sites and the Cytochrome C
oxidase activity could be a good marker of physiological stress. The
continuation of the monitoring in 2009 will allow to test these hypotheses. Our
study also provides novel information about the response of Pacific oyster
under hypoxia condition.
| 


