Table des matières
FICHE DE CERTIFICATION DE L'ORIGINALITE DU
TRAVAIL
iv
DEDICACES
v
REMERCIEMENTS
vii
LISTE DES PHOTOGRAPHIES
ix
LISTE DES FIGURES
ix
LISTE DES TABLEAUX
x
LISTE DES ABREVIATIONS
x
RESUME
xi
ABSTRACT
xii
INTRODUCTION
1
CHAPITRE 1 : REVUE DE LA
LITTERATURE
4
I Généralités sur les
champignons
5
I.1 Les champignons
5
I.1.1 Définition
5
I.1.2 Caractéristiques structurales
5
I.1.3 Reproduction
5
I.1.4 Classification
8
I.1.5 Importance des champignons
9
I.2 Les mycoses
10
I.2.1Facteurs favorisant les infections
fongiques
10
I.2.2 Classification
11
I.3 Les dermatophytes et les dermatophytoses
12
I.3.1 Les dermatophytes
12
I.3.2 Les dermatophytoses
16
II Traitement des mycoses et perspectives offertes
par les plantes
17
II.1 Les antifongiques de synthèse
utilisés dans le traitement des mycoses
17
II.1.1 Les azoles
17
II.1.2 Les polyènes
18
II.1.3 Les pyrimidines
19
II.1.4 Les allylamines
19
II.1.5 Les échinocandines
20
II.2 Les perspectives offertes par les plantes
médicinales
21
II.2.1 Les principaux groupes de composés
phytochimiques antimicrobiens
22
II.3 Méthodes d'évaluation de
l'activité antidermatophytique
28
II.3.1 Evaluation de l'activité
antidermatophytique in vitro
28
II.3.2 Evaluation de l'activité
antidermatophytique in vivo
28
II.3.3 Les facteurs qui influencent
l'activité antimicrobienne
29
II.4 Généralités sur les
plantes étudiées
30
II.4.1 Acalypha manniana
30
II.4.2 Tristemma hirtum
31
CHAPITRE 2 : MATERIEL ET
METHODES
32
I Matériel
33
I.1 Matériel végétal
33
I.2 Matériel animal
33
I.3 Microorganismes et milieux de culture
33
II Méthodes
34
II.1 Extraction et partitionnement
34
II.2 Criblage phytochimique des extraits et
fractions
34
II.2.1 Test de Shinoda (flavonoïdes)
35
II.2.2 Test de Meyer (alcaloïdes)
35
II.2.3 Test de Liebermann-Buchard
(triterpènes et des stéroïdes)
35
II.2.4 Test des phénols et
polyphénols
35
II.2.5 Test des saponines
35
II.2.6 Test des tannins
36
II.2.7 Test des anthraquinones
36
II.2. 8 Test des anthocyanines
36
II.2.9 Test des coumarines
36
II.3 Evaluation de l'activité
antidermatophytique in vitro
36
II.3.1 Evaluation de l'effet des extraits et
fractions sur la croissance radiale mycélienne des dermatophytes
36
II.3.2 Détermination des Concentrations
minimales inhibitrices (CMI) et fongicides(CMF)
38
II.4 Evaluation de l'activité
antidermatophytique in vivo de la fraction résiduelle de
Tristemma hirtum
39
II.4.1Préparation de l'inoculum et
conditionnement des animaux
39
II.4.2 Infection des animaux
40
II.4.3 Formulation de la pommade et traitement des
animaux
40
II.5Analyses statistiques
41
CHAPITRE 3: RESULTATS ET
DISCUSSION
42
I Résultats
43
I.1Extraction et fractionnement
43
I.2 Criblage phytochimique des extraits et
fractions
43
I.3 Evaluation de l'activité
antidermatophytique in vitro
45
I.3.1 Influence de la durée d'incubation et
de la concentration des extraits et fractions sur l'activité
antidermatophytique
45
I.3.2 Activité antidermatophytique
comparée des extraits et fractions
46
I.3.3 Effet des extraits et fractions sur la
morphologie et la structure des dermatophytes
49
I.4 Activité antidermatophytique in
vivo
54
I.4.1 Efficacité clinique du traitement
54
I.4.2 Efficacité mycologique du
traitement
57
II Discussion
58
II.1 Criblage phytochimique et activité
antidermatophytique in vitro
58
II.2 Activité antidermatophytique in
vivo
60
CONCLUSIONS ET PERSPECTIVES
61
REFERENCES BIBLIOGRAPHIQUES
63
ANNEXES
73
FICHE DE CERTIFICATION DE
L'ORIGINALITE DU TRAVAIL
Je soussigné MOMO DONGMO Rosine Clémence atteste
que la présente thèse intitulée : Evaluation
de l'activité antidermatophytique des extraits au méthanol et
fractions d'Acalypha manniana (Euphorbiacée) et de
Tristemma hirtum (Melastomatacée), est le fruit de mes
propres travaux de recherche effectués au Laboratoire de Microbiologie
et des Substances Antimicrobiennes (LAMSA) du Département de Biochimie
de l'Université de Dschang, sous la direction du Pr KUIATE
Jules-Roger.
Cette thèse est authentique et n'a pas
été antérieurement présentée pour
l'acquisition de quelque grade universitaire que ce soit.
Auteur :
MOMO DONGMO Rosine Clémence
Licenciée es Sciences
Date .......................................
Visa du directeur:
Pr KUIATE Jules-Roger
Maître de Conférences
Date.......................................
FICHE DE CERTIFICATION DES
CORRECTIONS APRES SOUTENANCE
La présente thèse a été revue et
corrigée conformément aux observations du jury.
Visa du directeur :
Pr KUIATE Jules-Roger
Date............................
Visa du président du jury :
Pr KAMANYI Albert
Date...........................
Visa des membres du jury
Dr GATSING Donatien
Date...........................
Dr TUME Christopher
Date...........................
Visa du chef de Département:
Pr KUIATE Jules-Roger
Date.........................
DEDICACES
Je dédie cette thèse à :
ü Dieu, rien n'aurait été possible sans sa
volonté.
ü Mes parents, WACKLEJIO Jeannette et MOMO Martin,
ü Mes frères et soeurs MOMO Christian Didier,
TCHOUMPMI Nathalie, KOUAHOU Carine, ATEMKENG Alex, MOMO Hermann Patrick, MOMO
Anicet,
ü Mes neveux et nièces TCHOUMPMI McLarry, YOMBE
Bill Cindy, YANDJA Allison, Amira Jen CALEB, Aksa Latifah CALEB, Jonathan MOMO,
Hannah MOMO.
Je vous suis infiniment reconnaissante pour tout votre soutien
et tout l'amour que vous me porté. Grâce à vous j'ai pu me
surpasser et donner le meilleur de moi. Que ce travail puisse être pour
vous un réel motif de fierté.
REMERCIEMENTS
J'adresse mes sincères remerciements à toutes les
personnes qui ont participé de près ou de loin à la
réalisation de ce travail :
ü Pr KUIATE Jules-Roger, qui a non seulement mis son
matériel à ma disposition, mais m'a encadré tout au long
de ce travail. Vos remarques, critiques et suggestions m'ont permi de mieux
comprendre mon travail et de m'améliorer
ü Dr KUETE Victor pour sa disponibilité, ses
encouragements et suggestions
ü Mr TAMOKOU Jean de Dieu, ses conseils, sa
disponibilité et ses instructions rigoureuses ont contribué
à l'amélioration de ce travail.
ü Mr MOUOKEU Raymond Simplice, qui a consacré
beaucoup d'efforts à la réalisation de ce travail. Dieu seul
saura vraiment vous remercier.
ü Mr NJATENG Guy Sedar Singhor, pour sa
disponibilité, ses remarques et ses conseils.
ü Mr NGO TEKE Gerald, ses instructions rigoureuses et ses
critiques ont contribuées à l'amélioration de ce
travail.
ü Mes aînés de laboratoire : LUNGA
Paul, NDEUTOU Armelle, MEFFO Carole, TIFUH Roger pour leurs encouragements.
ü Mes camarades de promotion : AWOUNTSA S. Rodrigue,
DJAFOUA Yves Marcel, FOGUE Pythagore, FOUAPON M. Héroïne, NOUMEDEM
K. Jaures, MAGNIFOUET N. Hugette, LIENOU L. Landry, KAMTCHUENG M. Odette,
NGOUFACK K. Martine, METANGOUE Hermione, MOKALE K. A. Laurel, TODJOU
Valéry, TANING Clovis, TSOFACK Serge P., FONGANG D. Hervet, MAFOKOUE
Nina, CHOUATCHO N. Eric, pour leur franche collaboration.
ü Mes amis du Département de Chimie : HOUDJEU
P. Christian, SEUYEP Denis, TSEUMEGNE Joseph pour leurs encouragements.
ü Mes amis PANGI Princely, LONTSI Raoul, MOUSSA
Mohamadou, JIEKAK N. S. Aurélien et TCHAHA Merlin pour tout leur
soutien moral
ü Mr KOUAHOU Caleb Franz pour son aide matériel
et financière
ü Tous les enseignants du Département de Biochimie
de l'Université de Dschang pour leurs conseils et leurs enseignements.
ü Le laboratoire de Botanique appliquée de la
Faculté des Sciences et le laboratoire des Sols de la FASA pour leur
franche collaboration
ü A tous ceux dont les noms ne figurent pas ici et qui
ont contribué d'une manière ou d'une autre à la
réalisation de ce travail.
LISTE DES PHOTOGRAPHIES
Photographie 1:aspects a) macroscopique b)
microscopique de Microsporum gypseum (Ellis, 2006)
14
Photographie 2:aspects a) macroscopique b)
microscopique de Trichophyton equinum (Ellis, 2006)
15
Photographie 3:aspects a) macroscopique b)
microscopique de Trichophyton mentagrophytes (Ellis, 2006)
15
Photographie 4:aspects a) macroscopique et b)
microscopique de Trichophyton terrestre (Ellis, 2006)
16
Photographie 5:Aspect physique des
différentes pommades.
41
Photographie 6: Aspects microscopiques de T.
equinum en absence a) et aux concentrations 8mg/ml , 2mg/ml , et 1mg/ml de
l'extrait au méthanol de T. hirtum.
50
Photographie 7: Aspect microscopique de M.
gypseum en absence et aux concentrations 8mg/ml 4mg/ml et 1mg/ml de
l'extrait au méthanol de T. hirtum.
51
Photographie 8: Aspect microscopique de T.
terrestre en absence et aux concentrations 8mg/ml , 4mg/ml et 2mg/ml de
l'extrait au méthanol de T. hirtum.
52
Photographie 9: Aspect microscopique de T.
mentagrophytes en absence et aux concentrations 8mg/ml , 4mg/ml et
0,25mg/ml de l'extrait au méthanol de T. hirtum.
53
Photographie 10: Illustration de l'aspect des
lésions au cours de l'expérimentation
56
LISTE DES FIGURES
Figure 1: Evolution de l'inhibition de la
croissance radiale mycélienne des dermatophytes par l'extrait au
méthanol de T. hirtum en fonction de la durée
d'incubation
45
Figure 2: Evolution du diamètre de la
lésion au cours du traitement
56
Figure 3 : Pourcentage de recouvrement des
différents lots au cours du traitement
57
Figure 4:Evolution de l'inhibition (%) de la
croissance mycélienne des dermatophytes par la fraction à l'AE de
T. hirtum en fonction de la durée d'incubation
b
Figure 5:Evolution de l'inhibition (%) de la
croissance mycélienne des dermatophytes par l'extrait à l'hexane
de T. hirtum en fonction de la durée d'incubation
c
Figure 6:Evolution de l'inhibition (%) de la
croissance mycélienne des dermatophytes par la fraction
résiduelle de T. hirtum en fonction de la durée
d'incubation
d
Figure 7:Evolution de l'inhibition (%) de la
croissance mycélienne des dermatophytes par l'extrait au méthanol
d'A. manniana en fonction de la durée d'incubation
e
Figure 8:Evolution de l'inhibition (%) de la
croissance mycélienne des dermatophytes par la fraction à l'AE
d'A. manniana en fonction de la durée d'incubation
f
Figure 9:Evolution de l'inhibition (%) de la
croissance mycélienne des dermatophytes par la fraction à
l'hexane d'A. manniana en fonction de la durée d'incubation
g
Figure 10:Evolution de l'inhibition (%) de la
croissance mycélienne des dermatophytes par la fraction
résiduelle d'A. manniana en fonction de la durée
d'incubation
h
LISTE DES TABLEAUX
Tableau 1: protocole de préparation des
différentes concentrations d'extraits et fractions testées
37
Tableau 2: Formulation de la pommade
40
Tableau 3: Rendement d'extraction et
caractéristiques physiques des extraits et fractions
43
Tableau 4: Groupes de constituants chimiques
identifiés dans les extraits et fractions de T. hirtum et
A. manniana
44
Tableau 5: Activité antidermatophytique
(%#177; ESM) des extraits et fractions en fonction du champignon et de la
concentration
47
Tableau 6: Concentrations Minimales Inhibitrices
(CMI) et Fongicides (CMF) des extraits et fractions sur les spores (en ug/ml)
des dermatophytes étudiés
48
Tableau 7: Concentrations Minimales Inhibitrices et
Fongicides (ug/ml) des extraits et fractions sur le mycélium
48
LISTE DES ABREVIATIONS
SDA :
Sabouraud dextrose agar
SDB :
Sabouraud dextrose broth
CMI:
Concentration minimale inhibitrice
CMF:
Concentration minimale fongicide
DO :
Densité Optique
UFC:
Unité Formant Colonie
ESM:
Erreur Standard Moyenne
SPSS : Statistic Package for Sciences
RESUME
Les dermatophytes sont des champignons capables de
digérer la kératine et de causer des dermatophytoses qui
affectent 20 à 40% de la population mondiale, principalement les
enfants. Acalypha manniana (Euphorbiacée) et
Tristemma hirtum (Mélastomatacée) sont des plantes
médicinales Camerounaises, utilisées dans le traitement des
maladies de la peau. Dans l'optique de trouver des extraits de plantes à
activité antidermatophytique, les feuilles d'A. manniana, les
feuilles et tiges de T. hirtum, ont été
macérées dans du méthanol. Les extraits
méthanoliques obtenus ont été fractionnés
successivement à l'hexane et à l'acétate d'éthyle.
Les extraits et fractions des deux plantes ont été soumis au
criblage phytochimique par des méthodes standards, puis testés
in vitro sur quatre dermatophytes (Trichophyton
mentagrophytes, Trichophyton terrestre, Trichophyton equinum et
Microsporum gypseum) par les méthodes d'incorporation en milieu
solide et de dilution en milieu liquide. L'évaluation in vivo
de l'efficacité d'une pommade à base de la fraction
résiduelle de T. hirtum a été
réalisée sur des cochons d'Inde mâles infectés par
inoculation dermique d'une suspension de spores de T. mentagrophytes.
La caractérisation chimique des extraits et fractions a
révélé la présence des saponines, des
flavonoïdes, des triterpènes, des anthraquinones et des tannins,
avec des différences de composition entre extraits et fractions. In
vitro, l'activité antidermatophytique des extraits et fractions des
deux plantes a été dose-dépendante. L'extrait brut et la
fraction résiduelle de T. hirtum ont présenté des
activités comparables (P > 0,05) et significativement plus
importantes sur tous les dermatophytes avec des CMI comprises entre 128 et 512
ug/ml, traduisant le fait que le fractionnement n'améliore pas
l'activité antidermatophytique de cet extrait. L'extrait brut d'A.
manniana a montré une activité plus importante que ses
fractions sur T. mentagrophytes avec une CMI de 256 ug/ml.. Toutes les
fractions hexanique et à l'acétate d'éthyle ont
montré des CMI comprises entre 256 et 1024 ug/ml. Excepté
l'extrait au méthanol d'A. manniana qui a eu une action
fongicide sur T. equinum avec une CMF de 1024 ug/ml ,tous les
autres extraits ont eu une action fongistatique (CMF > 4096 ug/ml). In
vivo, la pommade à 2,5% de la fraction résiduelle de T.
hirtum a induit une diminution du diamètre des lésions de
60% et un taux de guérison de 50% des animaux après 25 jours
de traitement. Les résultats justifient en partie l'usage d'A.
manniana et T. hirtum en médecine traditionnelle contre
les maladies de la peau et montrent que la fraction résiduelle de T.
hirtum, sous réserve d'études toxicologique,
pharmacocinétique et pharmacodynamique, pourrait constituer une
substance antidermatophytique potentielle.
ABSTRACT
Dermatophytes are fungi that infect keratinized tissues of
the body, producing dermatophytosis. These skin diseases affect 20 to 40% of
the world population and are very frequent in developing countries.
Acalypha manniana (Euphorbiaceae) and Tristemma
hirtum (Melastomataceae) are Cameroonian medicinal plants used in the
treatment of skin diseases. In order to find new substances with
antidermatophytic properties, in vitro and in vivo
antidermatophytic activities of methanolic extracts and fractions of these two
plants were investigated. Leaves of A. manniana, stems and leaves of
T. hirtum powdered, were macerated in methanol. The
methanolic extracts of both plants were then fractionated successively with
hexane and ethyl acetate. Phytochemical tests were done using standard methods.
The extracts and fractions were tested in vitro on four species of
dermatophytes (Trichophyton mentagrophytes, Trichophyton equinum,
Trichophyton terrestre and Microsporum gypseum) by using agar
and broth dilution methods. In vivo activity of a cream, based on
the T. hirtum residual fraction was carried out on male guinea pigs
previously infected with a spore suspension of T. mentagrophytes.
Phytochemical screening of the extracts and fractions revealed
the presence of saponins, flavonoids, triterpenoids, anthraquinones and
tannins, with differences between the crude extracts and fractions, and within
fractions. None of the extracts and fractions contained coumarins. The
in-vitro study showed that all the extracts and fractions exerted a
dose-dependent antidermatophytic activity. T. hirtum crude extract and
its residual fraction were most active (P > 0,05) on all the strains with
MIC values ranging from 128 to 512 ug/ml, showing that the fractionation does
not improve the antidermatophytic activity of the extract. The crude extract
of A. manniana was more active than its fractions on T.
mentagrophytes with MIC value of 256 ug/ml and exhibited fungicidal
activity against T. equinum with MFC value of 1024 ug/ml. Hexane and
ethyl acetate fractions of both plant were less active and presented MIC
values ranging from 256 to1024 ug/ml. Except the A. manniana crude
extract, T. hirtum extract and fractions of both plants exerted a
fungistatic activity. The in-vivo efficiency test of a 2.5% T.
hirtum-based cream displayed a 60% reduction of diameters of lesions and a
recovering of 50% guinea pigs after twenty five days of treatment. These
results partially justify the traditional use of A. manniana and
T. hirtum to cure skin diseases, and provide promising baseline
information for the potential use of these plants in the treatment of
dermatophytosis. The T. hirtum residual fraction, after further
toxicological, pharmacokinetic and pharmacodynamic studies, could be useful as
an antidermatophytic substance.
INTRODUCTION
Dans le domaine de la dermatologie, les dermatoses
généralement rencontrées sont causées par les
dermatophytes (Samuel et al., 2000). Les dermatophytes sont des
champignons capables de digérer la kératine et de causer les
dermatophytoses chez l'Homme et les animaux (Kuiate et al., 2006).
L'incidence des dermatophytoses a augmenté durant ces dernières
années, surtout chez les patients immunodéprimés (Santos
et Hamdan, 2005). Elles affectent environ 20 à 40% de la population
mondiale, principalement les enfants en âge scolaire (Sepahvand et
al., 2009). Dans certaines régions du Cameroun, la
prévalence des dermatophytoses chez les enfants est d'environ 31%
(Maslin et al., 2005). Elles ne sont certes pas mortelles, mais
constituent un problème de santé publique en raison des
difficultés rencontrées pour la guérison de certains cas,
la récidivité, et le nombre limité d'antifongiques
efficaces (Samuel et al., 2000). Ces antifongiques sont par ailleurs
coûteux, donc pas facilement accessibles par les populations pauvres
(Bennet et al., 2000). A ces limites, s'ajoutent l'émergence de
la résistance de certaines souches aux médicaments disponibles
qui présentent quelques fois une toxicité assez
élevée (Granier, 2003). Tous ces facteurs rendent
nécessaire la recherche de nouveaux médicaments antifongiques
efficaces, de faible coût et de faible toxicité.
Les recherches ethnobotaniques et ethnopharmacologiques
reçoivent depuis des années une attention particulière,
avec un intérêt croissant pour les plantes médicinales et
leurs extraits comme source potentielle de médicaments antimicrobiens
(Cowan, 1999). Les plantes constituent en effet un bon réservoir
d'agents chimiothérapeutiques à potentiel curatif
considérable (Zhang et Björn, 2009). La recherche des substances
antimicrobiennes constituent le principal axe de recherche du Laboratoire de
Microbiologie et de Substances Antimicrobiennes de l'Université de
Dschang (LAMSA), où les travaux présentés dans cette
thèse ont été menés. L'objectif de ce travail a
consisté à l'étude des propriétés
antidermatophytiques des extraits et fractions d'Acalypha manniana et
Tristemma hirtum, deux plantes de la flore Camerounaise
utilisées en médecine traditionnelle dans le traitement des
maladies de la peau . Pour y parvenir, nous avons
procédé à :
· L'extraction et la caractérisation chimique des
extraits
· L'évaluation de l'activité
antidermatophytique in vitro des extraits et fractions
· L'évaluation de l'efficacité
antidermatophytique d'une pommade à base de la fraction
résiduelle de T. hirtum sur un modèle animal.
CHAPITRE 1 : REVUE DE LA
LITTERATURE
I
Généralités sur les champignons
I.1
Les champignons
I.1.1
Définition
Les champignons sont des êtres eucaryotes,
hétérotrophes, unicellulaires ou filamenteux, sans organisation
tissulaire et qui peuvent se reproduire soit sexuellement soit de façon
asexuée (Murray et al .,2008).
I.1.2
Caractéristiques structurales
Les champignons sont
caractérisés par une paroi cellulaire qui contient, des glucanes
(â-1,3-glucane), des mannanes et la chitine. La membrane cellulaire des
champignons est constituée de stérols (l'ergostérol
principalement), et un cytoplasme dépourvu de chlorophylle. La plupart
des champignons possèdent un mycélium, constitué de tubes
appelés hyphes. Chez les champignons supérieurs, les hyphes sont
cloisonnés ou septés, tandis que chez les champignons
inférieurs ou primitifs, les cloisons intercellulaires sont rares
(Stevens et al., 2006).
Les champignons les plus simples sont les levures
(unicellulaires), et peuvent être regroupées selon leur mode de
reproduction en levures vraies (issues d'une reproduction sexuée) et
levures imparfaites (issues d'une reproduction asexuée). Les autres
champignons, pluricellulaires, sont pour la plupart filamenteux (Alexopoulos
et al.,1996).
I.1.3
Reproduction
La reproduction des champignons est complexe, reflétant
ainsi l'hétérogénéité de leur mode de vie.
Elle peut être sexuée ou asexuée, bien que certains
champignons alternent entre les deux types de reproduction (Nester et
al., 1998).
a) Reproduction
asexuée
La reproduction asexuée se fait sans fusion de
gamètes. C'est un mode de reproduction commun à presque tous les
champignons. La reproduction asexuée chez les champignons peut se faire
par bourgeonnement, fission binaire, fragmentation, ou par formation de spores
(Alexopoulos et al.,1996).
· Le bourgeonnement et la fission
binaire
Le bourgeonnement et la fission binaire sont les formes de
reproduction asexuée les plus simples. Le bourgeonnement est une
division inégale du cytoplasme, résultant en une cellule parent
et une cellule fille, celle-ci étant plus petite que la cellule parent.
La fission binaire par contre aboutit à deux cellules identiques. Ces
deux formes de reproduction suivent la mitose.

Fission binaire
Bourgeonnement
Illustration de la fission binaire et du bourgeonnement
chez les levures (Abedon, 1997)
· La fragmentation et la sporulation
La fragmentation est une forme de reproduction asexuée
où un nouvel organisme se développe à partir d'un
fragment parent. La sporulation est la plus importante forme de reproduction
asexuée chez les champignons. Elle se fait à travers les spores
asexuées, formées au cours de la phase asexuée du cycle de
vie des champignons (phase anamorphe). Suite à une mitose, ces spores
se transforment en cellules reproductives appelées mitospores qui,
après dispersion, se développent en de nouveaux organismes.
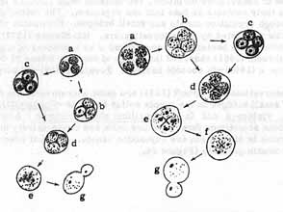
Après fragmentation du protoplasme en plusieurs parties
(a, b), il se forme des parois autour des prospores
(c) puis la maturation s'arrête et les parois
disparaissent. Le protoplasme devient moins dense(d) et les
prospores fusionnent (e) pour donner une nouvelle cellule
végétative (f) puis le bourgeonnement commence
(g). Illustration des différentes
étapes de la sporulation chez Saccharomyces paradoxus
(Solomon, 2007)
b) Reproduction sexuée
Pour qu'une reproduction sexuée se
réalise, il est nécessaire d'avoir deux noyaux haploïdes
capables de s'accoupler, ou un seul noyau diploïde. Les deux noyaux
haploïdes doivent d'abord fusionner pour donner un noyau diploïde qui
subit par la suite une méiose. Cette méiose est à
l'origine de la variation au sein de la progéniture fongique. Ces
évènements sont suivis par la formation de spores (les
ascospores, les basidiospores, zygospores), dont le processus varie en fonction
des différentes classes de champignons (Deacon, 2005).
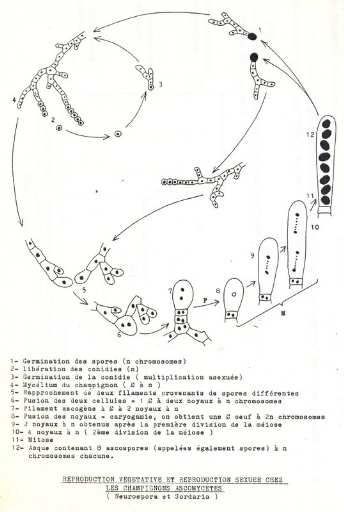
1 germination des spores ;
2 libération des conidies ;
3 germination de la conidie ;
4 mycélium du champignon ;
5 rapprochement de deux filaments provenant de spores
différentes ; 6 fusion des deux cellules à
deux noyaux à n chromosomes ; 7 filament
ascogène à 2 noyaux à n chromosomes ;
8 fusion des deux noyaux (2n) ;
9 deux noyaux à n obtenus après la
première division de la méiose ; 10 4
noyaux à n (deuxième division de la méiose) ;
11 mitose ; 12 asque contenant
8 ascospores à n chromosomes chacune.
Illustration de la reproduction sexuée chez les
ascomycètes (Florimont, 2009)
Plusieurs champignons alternent entre la reproduction
sexuée et asexuée, dépendant des conditions. A titre
indicatif, la moisissure du genre Dictyostelium effectue une fission
binaire lorsque les conditions sont favorables. Mais lorsque celles-ci
deviennent défavorables (dessiccation, rayons UV, augmentation ou
baisse de la température), le champignon procède à une
reproduction sexuée qui aboutit à la formation de spores.
Certains champignons échangent également leur matériel
génétique par des processus parasexués. La
fréquence et l'importance relative de ce mode de reproduction ne sont
pas bien claires et peuvent être inférieures comparées
à celles de la reproduction sexuée. Mais, ce mode de reproduction
est nécessaire dans l'hybridation qui est associée à
l'évolution des espèces fongiques (Bruns, 2006).
I.1.4
Classification
La classification des champignons est
généralement basée sur les caractéristiques de
leurs structures de reproduction qui permettent de distinguer quatre classes de
champignons :
a)
Zygomycètes
Les champignons de ce groupe ont la particularité de
croître rapidement. Ils possèdent des cellules non mobiles et des
hyphes non septés. Les zygomycètes peuvent se reproduire
sexuellement et asexuellement. La reproduction sexuée aboutit à
la production de zygospores spores immobiles à parois épaisses.
La reproduction asexuée aboutit quant à elle à des spores
(chlamydoconidies, sporangiospores) contenues dans un sporange issu de
sporangiophores simples ou branchés. Le Rhizoporus stolonifer
est une espèce courante qui appartient à ce groupe
(Alexopoulos et al.,1996).
b)
Hyphomycètes
Tous les champignons connus de ce groupe se reproduisent de
façon asexuée par des conidies (Redecker et Raab, 2006). Les
hyphes sont septés et présentent des pores simples. Cette
classe contient la majorité des champignons d'importance médicale
tels que les dermatophytes.
c)
Ascomycètes
Les ascomycètes possèdent des hyphes
septés présentant de simples pores qui permettent une migration
cytoplasmique et nucléaire. La reproduction sexuée aboutit
à la formation d'ascospores endogènes dans un ascus,
contrairement à la reproduction asexuée qui aboutit à des
conidies. On retrouve dans ce groupe des champignons tels que
Pneumocystis jirovecii (Alexopoulos et al.,1996).
d)
Basidiomycètes
Les basidiomycètes possèdent des hyphes
septés à pores complexes appelés dolipores, permettant
une migration cytoplasmique. Ils produisent sexuellement des spores
exogènes appelées basidiospores. On retrouve dans ce groupe des
champignons tels que Ustilago maydis, les espèces commensales
de l'Homme du genre Malassezia et le pathogène opportuniste de
l'Homme Cryptococcus neoformans (Alexopoulos et al., 1996).
I.1.5 Importance des
champignons
a) Utilité des
champignons
Les champignons sont d'un grand intérêt pour
l'homme dans plusieurs domaines d'activité :
En industrie agroalimentaire, certains champignons, à
l'instar de la levure Saccharomyces cereviceae, sont utilisés
en fromagerie et en pâtisserie, mais également dans la production
de boissons alcooliques par fermentation (Piskur et al., 2006).
En écologie, les champignons saprophytes participent au
maintient de l'équilibre écologique en libérant dans
l'environnement, à partir de la matière qu'ils
décomposent, du carbone et des sels minéraux (Joffin, 2005).
En biotechnologie, les champignons tels que Ashbya
gossypii, sont exploités dans la production de vitamines A, B ou D
(Santos et al.,2005).
En pharmacie, plusieurs espèces de champignons sont
utilisées pour la synthèse de médicaments. Le
polysaccharide K, produit chimique dérivé de Trametes
versicolor, est utilisé comme adjuvant dans le traitement du cancer
(Fisher et Yang, 2002).
En agriculture, les champignons à l'instar
de Beauveria bassiana sont utilisés dans la lutte
biologique. Ce champignon permet de lutter contre le doryphore dans la culture
des pommes de terre ou contre une chenille responsable de la pyrale du
maïs (Becker, 1998).
Bien que les champignons soient exploités dans tous ces
domaines, plusieurs sont des parasites des plantes, des animaux et de
l'homme.
b) Méfaits des
champignons
Les champignons envahissent occasionnellement l'air que nous
respirons par l'intermédiaire de leurs spores disséminés
par le vent. Ces spores sont responsables de certaines allergies et maladies
graves. L'aspergillose pulmonaire par exemple, est une maladie de l'appareil
respiratoire, causée par inhalation des spores de moisissures du genre
Aspergillus ( Kamanfu et al.,1993).
Plusieurs champignons produisent des composés
biologiquement actifs, parmi lesquels des mycotoxines. A titre indicatif, les
espèces d'Aspergillus, notamment Aspergillus favus,
produisent des aflatoxines, toxines du foie qui croissent dans ou sur les
graines d'arachides. La consommation de ces graines contaminées conduit
à une aspergillose hépatique récurrente dans le
tiers-monde (Maslin, 2004).
Certains champignons peuvent causer des maladies graves voir
fatales si elles ne sont pas traitées. Les levures du genre
Candida, sont responsables du muget chez les nouveaux nés
caractérisé par un dépôt blanchâtre sur la
langue.
Les champignons s'attaquent également aux plantes et
constituent un obstacle considérable pour l'agriculture. Parmi ces
champignons phytopathogènes, on peut citer Phytophthora infestans,
responsable du mildou des solanacées (Tamokou, 2002).
I.2
Les mycoses
I.2.1Facteurs favorisant les infections fongiques
Les mycoses sont des infections causées par des
champignons pathogènes (Feuilhade et al.,2002). La
réceptivité des individus aux champignons pathogènes
dépend principalement des facteurs extrinsèques et
intrinsèques (Böhlen et al.,2001) :
Les facteurs extrinsèques comprennent l'état de
santé de l'individu, les conditions d'hygiène et l'abus des
médicaments. Certains troubles métaboliques aggravent des
infections mycosiques habituellement peu graves et favorisent la
dissémination viscérale des champignons pathogènes. Les
personnes souffrant d'une déficience immunitaire sont
particulièrement susceptibles aux mycoses causées par les
champignons des genres Aspergillus, Candida et Cryptococcus
(Hube, 2004 ; Brakhage, 2005). La vie en milieux chaud et humide, propice
au développement et à la conservation des champignons dans le
milieu extérieur, favorise l'infection de l'homme et des animaux. La
prise prolongée de certains médicaments peut perturber la flore
intestinale et entrainer des formes très graves de mycoses.
Les facteurs intrinsèques font intervenir la
spécificité à une espèce animale, la race,
l'âge et le sexe. Les souris mâles sont plus sensibles que les
femelles à l'infection par Coccidioïdes immitis.
Microsporum audouinii qui n'infecte que l'Homme, ne se
développe que chez les enfants avant la puberté. Les individus
de race blanche sont moins sensibles à la coccidioïdomycose que les
sujets de race noire.
I.2.2
Classification
Les mycoses suivent plusieurs modes de classification. Elles
peuvent être classées suivant la partie du corps envahie
(dermatomycose et onymycose), le syndrome provoqué ( pieds
d'athlète ), et le champignon infectieux (aspergillose,
candidose).
En fonction de l'affinité de l'agent causal pour un
tissu de l'organisme, les mycoses peuvent être réparties en 3
grands groupes (Daniel et Elewski, 2000) :
· Les mycoses superficielles qui se localisent au niveau
de l'épiderme et des muqueuses, n'induisent aucune réponse
cellulaire de l'hôte, ni aucun changement pathologique. C'est le cas de
la malasseziose, causée par une levure lipophile, saprophyte de la peau
Malassezia fufur. D'autres mycoses superficielles par contre,
induisent des changements pathologiques. Parmi ces mycoses, on peut citer les
dermatophytoses où la présence du dermatophyte et ses produits
métaboliques induisent généralement une allergie et une
réponse inflammatoire chez l'hôte (Feuilhade et
al.,2002).
· Les mycoses sous-cutanées sont des infections
chroniques localisées de la peau et des tissus sous-cutanés. La
sporotrichose à titre d'exemple, mycose sous-cutanée due
à l'implantation dans la peau ou quelques fois à l'inhalation de
Sporothrix schenckii, affecte le tissu conjonctif et les voies
lymphatiques (Aubry, 2002).
· Les mycoses profondes ou systémiques
sont des infections fongiques du corps. Elles peuvent être opportunistes
ou dimorphiques. Les mycoses systémiques opportunistes sont
causées par des champignons (Candida albicans, Cryptococcus
neoformans) qui n'expriment leur pouvoir pathogène qu'en
présence de facteurs de risques. Les mycoses systémiques
dimorphiques sont causées par des champignons pathogènes
dimorphiques (Histoplasma capsulatum var. duboisii), qui peuvent
pénétrer les défenses physiologiques et cellulaires d'un
hôte normal en changeant leur morphologie (Aubry, 2002 ;
Sangaré et al.,2008). Les mycoses systémiques
surviennent généralement chez les patients
immunodéprimés (Aubry, 2002).
I.3
Les dermatophytes et les dermatophytoses
I.3.1
Les dermatophytes
a) Définition et
Classification
Les dermatophytes sont des champignons microscopiques
filamenteux qui attaquent avec prédilection les structures
kératinisées chez l'homme et les animaux (Feuilhade et
al., 2002).
Les dermatophytes sont classés en trois genres
d'importance inégale, définis d'après les
caractéristiques morphologiques des éléments de
reproduction rencontrés en culture (Baran et al.,
2001):
· Le genre Epidermophyton qui est
caractérisé par une absence de microconidies et des macroconidies
en forme de massues et à parois minces.
· Le genre Microsporum qui est
caractérisé par des microconidies piriformes et des macroconidies
en fuseau et à parois épaisses. Les espèces de ce genre
attaquent la peau, les poils et les cheveux.
· Le genre Trichophyton
caractérisé par des microconidies rondes ou piriformes. Les
macroconidies ont des parois minces et lisses, à bouts arrondis. Les
espèces de ce genre attaquent la peau, les ongles, les poils et les
cheveux.
Sur la base de leurs habitats naturels et de leurs hôtes
préférentiels, on distingue trois espèces de dermatophytes
(Feuilhade et al.,2002):
· Les espèces anthropophiles, parasites humains
exclusifs, se transmettent soit directement par contact interhumain, soit
indirectement par le linge ou les vêtements. Trichophyton tonsurans
en est un exemple (Maleska et Ratka,1998).
· Les espèces zoophiles telles que Microsporum
canis, se transmettent à l'homme par le contact d'un animal
contaminé ou par l'intermédiaire de ses poils
parasités.
· Les espèces géophiles telles que
Microsporum gypseum , qui se retrouvent dans le sol, sont rarement
impliquées en pathologie humaine. Toutefois, certaines espèces
zoophiles comme Trichophyton mentagrophytes, sont souvent
retrouvées dans le sol.
b) Epidémiologie et
physiopathologie
Les dermatophytes causent des maladies dont la propagation est
associée à leurs structures. Ainsi, les espèces dont la
sporulation est faible se révèlent très
contagieuses ; ceci dû au fait qu'elles possèdent des formes
de résistances (chlamydospores et arthospores) attachées
extérieurement aux extrémités des cheveux ou à des
squames de la peau. Ces dermatophytes sont majoritairement des espèces
anthropophiles (Weitzman et Summerbell, 1995). En général, plus
l'infection est chronique et l'agent pathogène adapté à
l'hôte, moins sévère est la réponse inflammatoire
(Böhlen et al., 2001). De même, les espèces
zoophiles et géophiles ont tendance à produire des lésions
qui sont plus inflammatoires que celles des espèces anthropophiles mais
qui se résorbent facilement (Feuilhade et al.,
2002).
Le parasitisme des dermatophytes débute par
l'adhérence d'une spore qui germe. Les filaments produits vont
progresser de façon centrifuge et pénétrer dans la couche
cornée grâce aux enzymes protéolytiques, créant
ainsi une lésion arrondie érythématosquameuse où
le champignon est actif sur le pourtour. Dans le poil et le cheveu,
l'envahissement du dermatophyte se fait à partir de l'ostrium
folliculaire, avec une propagation descendante vers le bulbe.
Dans les ongles, le dermatophyte pénètre
généralement par le bord libre et progresse en direction de la
matrice sans la détruire (Feuilhade et al., 2002).
c) Caractéristiques
macroscopiques et microscopiques des dermatophytes étudiés
· Microsporum
gypseum
Microsporum gypseum est un dermatophyte
géophile qui cause chez l'animal des herpès circinées.
Chez l'enfant, il cause des kérions du cuir chevelu, et chez l'adulte,
des kérions de la barbe. Sur milieu de Sabouraud dextrose agar, la
culture de M. gypseum est granuleuse, légèrement
plâtreuse, avec une teinte chamois. Le verso de la boîte de
Pétri est identique. L'aspect microscopique, présente peu de
filaments qui sont généralement cachés dans l'abondance
des macroconidies. Les macroconidies sont de petites taille (30-60 um ×
8-12 um), en forme de cocon à cloisons minces et parois
échinulées. Certaines souches montrent des microconidies.
macroconidie a b b filament mycélien filament mycélien
Photographie 1:aspects a)
macroscopique b) microscopique de Microsporum gypseum (Ellis,
2006)
· Trichophyton
equinum
Trichophyton equinum est un dermatophyte zoophile,
de forme sexuée inconnue qui provoque chez l'animal des teignes
tondantes avec de nombreuses plaques d'alopécies, et chez l'homme des
herpès circinés, folliculites et kérions. La culture de
T. equinum est lente, a un aspect duveteux. Le verso est jaune
acajou. Les microconidies sont piriformes et en grappe. Les macroconidies sont
de formes variées, ont une paroi lisse et mince avec plusieurs cloisons
(1- 10), et ont des cloisons variant de 10- 85 um sur 4 - 15 um.
macroconidie
 b b microconidies microconidies
Photographie 2:aspects a)
macroscopique b) microscopique de Trichophyton equinum (Ellis, 2006)
· Trichophyton
mentagrophytes
Trichophyton mentagrophytes est responsable de 90% de
dermatophytoses chroniques (Ikuta et al.,1997). Il est par ailleurs
responsable des teignes inflammatoires et des kérions du cuir chevelu
chez la femme et l'enfant. Chez l'homme, il cause des kérions de la
barbe. Il s'agit d'un dermatophyte géophile. La culture sur milieu de
Sabouraud dextrose agar diffère selon les variétés. On
observe des filaments articulés avec des branchements à angles
droits sur lesquels se greffent de nombreuses microconidies rondes et parfois
allongées. Les macroconidies, lorsqu'elles sont présentent, ont
des parois minces.
microconidies
a b b filament mycélien filament mycélien
Photographie 3:aspects a)
macroscopique b) microscopique de Trichophyton mentagrophytes (Ellis,
2006)
· Trichophyton
terrestre
Trichophyton terrestre est un dermatophyte
présent dans le sol et le pelage des animaux. Sur milieu de Sabouraud
dextrose agar, les cultures de T. terrestre sont planes, poudreuses,
rapides et extensives, devenant un peu duveteuses en périphérie.
Les microconidies sont nombreuses et piriformes. Les macroconidies sont lisses,
allongées avec 4-8 logets.
Microconidie Macroconidie
a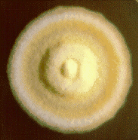 b b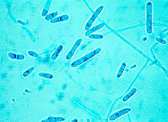
Photographie 4:aspects a)
macroscopique et b) microscopique de Trichophyton terrestre (Ellis,
2006)
I.3.2
Les dermatophytoses
Les dermatophytoses sont des infections causées par des
champignons filamenteux, à mycélium cloisonné,
appartenant aux trois genres Microsporum, Epidermophyton et
Trichophyton (Feuilhade et al., 2002). Elles peuvent affecter le
scalp, la barbe, la bouche, les ongles, les pieds. Elles se
caractérisent par des affections variant des inflammations moyennes aux
réactions vésiculaires aiguës.
· Diagnostic :
prélèvement, isolement et identification des
dermatophytes
Le diagnostic des dermatophytoses n'est pas toujours
évident cliniquement. Devant une lésion évoquant une
dermatophytose, un examen mycologique s'impose. Pour obtenir des
résultats fiables, le biologiste doit surmonter plusieurs niveaux
d'obstacles : la réalisation du prélèvement selon le
type de lésion, l'examen direct des différents produits
biologiques ainsi que leur mise en culture, l'identification des champignons
isolés et l'interprétation des résultats (Chabasse et
Pihet, 2008).
L'examen direct repose sur la recherche du dermatophyte
à partir d'un prélèvement local de squames, ongles,
cheveux, etc. La culture est réalisée sur milieu
gélosé supplémenté aux antibiotiques (Boiron,
2005). L'identification, qui se fait entre le 3ème et le
10ème jour après la mise en culture, est basée
sur l'observation des caractéristiques morphoculturales (couleur,
diamètre des colonies), biochimiques (ADN et ARN) et physiologiques du
dermatophyte (Patterson et Bridge, 1994).
II
Traitement des mycoses et perspectives offertes par les plantes
Le traitement des dermatophytoses, qui se fait par des
antifongiques administrés soit par voie orale, soit par application
cutanée est généralement de longue durée. Le
traitement est généralement double. Il est général
par administration d'un antifongique (très souvent la
griséofulvine per os à la dose 15- 20 mg/kg/j), en
association avec une application locale d'un antifongique pendant au moins six
mois (Hamoir et al.,2001).
II.1
Les antifongiques de synthèse utilisés dans le traitement des
mycoses
En fonction de leurs structures chimiques, on distingue
plusieurs classes d'antifongiques de synthèse (Hamoir et al.,
2001).
II.1.1
Les azoles
Les azoles (ketonazole, fluconazole) sont des substances
synthétiques qui dérivent soit de l'imidazole, soit du triazole
(Colanceska-Ragenivic et al.,2001). Ces substances modulent la
synthèse de l'ergostérol, biorégulateur de la
fluidité et de la symétrie membranaire (Boiron, 2005), en
interagissant avec la lanostérol 14-á-déméthylase
qui forme un complexe avec le cytochrome P-450. L'inhibition de cette enzyme
induit un changement de la fluidité membranaire, puis une diminution de
la croissance de la cellule fongique, et la mort de celle-ci. Mais, une
inhibition croisée du système cytochrome P-450 de l'hôte
peut faire apparaître des effets secondaires tels que la perturbation du
métabolisme des molécules endogènes et exogènes
(Hamoir et al.,2001). Les champignons résistent aux azoles
soit par modification de la qualité et la quantité de la
14-á-déméthylase qui est l'enzyme cible (Sanglard et Odds,
2002) soit par diminution de la concentration intracellulaire
d'ergostérol par un système de pompe à efflux (Ghannoum et
Rice, 1999).
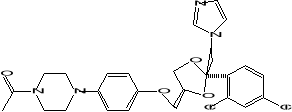 
Kétonazole
Fluconazole
(Ghannoum et Rice, 1999)
II.1.2
Les polyènes
Cette classe d'antifongiques renferme notamment
l'Amphotéricine B et la nystatine qui sont d'origine bactérienne.
Ils possèdent une grande affinité pour l'ergostérol et
provoquent la formation de pores aqueux qui altèrent la
perméabilité la membrane fongique, ce qui aboutit à une
fuite du matériel intracellulaire et la mort de la cellule fongique
(Ghannoum et Rice, 1999). Les polyènes sont relativement actifs contre
les levures, certains champignons filamenteux , mais, sont
réputés moins efficaces contre les dermatophytes (Hamoir et
al., 2001).
L'Amphotéricine B, dont le spectre d'action inclut
Candida, Aspergillus, est utilisée dans le traitement des
mycoses profondes. Malgré sa néphrotoxicité,
l'Amphotéricine B est un outil thérapeutique de choix pour le
traitement de certaines mycoses profondes (Hamoir et al.,2001). La
résistance aux polyènes serait due aux modifications de
l'ergostérol membranaire ayant une faible affinité avec les
polyènes, et une diminution de l'ergostérol cellulaire qui
entrainerait une baisse de la sensibilité des cellules fongiques aux
polyènes (Ghannoun et Rice, 1999).
R=  Amphotéricine B R= Amphotéricine B R=  nystatine (Hamoir et al.,2001) nystatine (Hamoir et al.,2001)
II.1.3
Les pyrimidines
La classe des pyrimidines comprend la Flucytosine ou
5-Fluorocytosine (5-FC). Cet antifongique présente une activité
inhibitrice contre les levures (Candida et Cryptococcus). La
Flucytosine interfère avec le métabolisme des pyrimidines de
l'ARN et la synthèse protéique de la cellule fongique. Elle y
pénètre à l'aide d'une perméase, puis est
convertie en 5- Fluorouracyl (5-FU) par la cytosine déaminase. La 5-FU
est à son tour convertie en acide 5-Fluorourydilique par l'UMP
pyrophosphorylase. Tout ce mécanisme aboutit à l'arrêt de
la synthèse protéique. La résistance à la 5-FC
serait due au blocage de la formation de l'acide 5-Fluorourydilique par perte
de l'activité de la cytosine déaminase (Ghannoun et Rice, 1999).
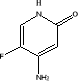
Flucytosine (Ghannoum et Rice, 1999)
II.1.4
Les allylamines
Cette classe d'antifongiques possède un spectre
d'action relativement large qui englobe les espèces de Trichophyton,
Microsporum, mais aussi certains Aspergillus, Candida
albicans et cryptococcus neoformans (Hamoir et
al.,2001). On retrouve dans ce groupe des antifongiques tels que la
terbinafine et la naftifine. Les allylamines inhibent la squalène
époxydase, enzyme de la conversion du squalène en
squalène-2,3-epoxide, première étape de la
biosynthèse de l'ergostérol, ce qui provoque une accumulation
intracellulaire du squalène (Ryder et Favre, 1997). Un taux
élevé de squalène peut augmenter la
perméabilité membranaire et désorganiser la cellule
fongique (Ghannoum et Rice, 1999). Contrairement à la
14-á-déméthylase, la squalène époxydase
n'est pas liée au système cytochrome P-450. Les allylamines ne
perturbent donc pas le métabolisme des molécules endogènes
et exogènes de l'hôte (Hamoir et al.,2001). La
résistance aux allylamines n'a pas encore été
rencontrée chez les champignons pathogènes de l'Homme (Ghannoum
et Rice, 1999).
naftifine
terbinafine
(Hamoir et al.,2001)
II.1.5 Les
échinocandines
Les échinocandines (caspofongine) agissent comme
inhibiteurs non compétitifs de la â(1,3)-D-glucane synthase,
enzyme responsable de synthèse du â(1,3)-D-glucane, constituant
important de la paroi des champignons. De cette inhibition, résultent
des changements cytologiques et structuraux tels que l'épaississement de
la paroi fongique et l'absence de bourgeonnement. Les échinocandines
ont une activité fongicide in vitro et in vivo contre
les espèces de Candida et Aspergillus. La
résistance aux échinocandines pourrait être due à
une mutation du gène codant pour l'une des sous-unités de la
â(1,3)-D-glucane synthase (Letscher-Bru et Herbrecht, 2003).
Caspofongine (Letscher-Bru et Herbrecht, 2003)
Il existe d'autres antifongiques qui interviennent dans le
traitement des dermatophytoses, notamment la griséofulvine. C'est un
antifongique isolé de Penicillium griseofulvum qui inhibe la
division cellulaire des champignons par désorganisation du fuseau
mitotique, bloquant ainsi le processus en métaphase (Hamoir et
al.,2001). La griséofulvine a un effet fongistatique contre les
dermatophytes, est peu onéreuse et présente
généralement peu d'effets secondaires (troubles
gastrointestinaux, neurotoxiques) bien que certains adultes la tolèrent
mal (Feuilhade et al., 2002).
griséofulvine (Hamoir et al.,2001)
II.2
Les perspectives offertes par les plantes médicinales
Malgré les progrès en chimie de synthèse,
les plantes restent une source importante de composés pharmaceutiques
(Zhang et Björn, 2009). Environ 80% de la population mondiale ont recours
aux plantes pour des soins de santé primaires, et il est estimé
à environ 25% les prescriptions médicales dérivées
directement ou indirectement des plantes (Fowler, 2006). La recherche de
nouveaux principes actifs menée par les laboratoires universitaires a
déjà permis d'expliquer certaines utilisations traditionnelles
(Kuiate et al.,2006 ; Kuete et al.,2008 ; Tamokou
et al.,2009a ; Tamokou et
al.,2009b ; Tene et al.,2009). Ces travaux font
ressortir une grande diversité de structures chimiques ayant des
activités antimicrobiennes potentielles.
II.2.1
Les principaux groupes de composés phytochimiques antimicrobiens
Les principaux groupes de métabolites secondaires
rencontrés dans les plantes et qui possèdent
généralement une activité antimicrobienne sont : les
composés phénoliques, les alcaloïdes, les
terpénoïdes et stéroïdes.
a) Les composés
phénoliques et les polyphénols
Les composés phénoliques et
les polyphénols constituent le plus vaste groupe de métabolites
secondaires retrouvé dans les plantes. On distingue comme principaux
composés phénoliques : les phénols simples et les
acides phénoliques, les flavonoïdes, les coumarines, les quinones,
les saponines et les tannins (Robbers et al., 1996).
· Les phénols
simples et les acides phénoliques
Les phénols simples et les acides phénoliques
sont les plus simples composés phytochimiques qui consistent en un seul
noyau aromatique substitué (Cowan, 1999). Les phénols simples
et les acides phénoliques possèdent des activités
antivirale, antibactérienne et antifongique (Brantner et al.,
1996). L'acide caféique et le catéchol, contenus dans le thym et
le piment de Bethel respectivement, sont responsables des
propriétés antimicrobiennes de ces plantes (Cowan, 1999). Leur
mécanisme d'action n'est pas bien connu, mais, il pourrait inclure une
inhibition enzymatique, probablement à travers une réaction avec
les groupes sulfhydriles ou des interactions non-spécifiques avec les
protéines. De plus, le nombre et la position des groupements hydroxyles
sur le noyau aromatique pourrait être en relation avec leur
toxicité relative sur les microorganismes (Cowan, 1999).
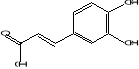 
Acide caféique
Catéchol
(Cowan,1999)
· Les
quinones
Les quinones sont des molécules très
réactives, à noyaux aromatiques, avec deux substitutions
cétoniques (Cowan, 1999). Les quinones sont des composés qui
régénèrent des radicaux libres et par conséquent,
se complexent irréversiblement aux acides aminés
nucléophiles des protéines (Stern et al., 1996). Les
quinones sont ubiquitaires et possèdent généralement des
propriétés antimicrobiennes (Kazmi et al., 1997). Leurs
principales cibles dans la cellule microbienne sont les adhésines, les
polypeptides et les enzymes membranaires. Aljabre et al.(2005) ont
décrit le thymoquinone isolé de l'extrait de Nigella sativa
comme responsable des propriétés antidermatophytiques de
cette plante vis-à-vis de Trichophyton mentagrophytes,
Epidermophyton flococcum et Microsporum canis.
L'hypéricine , un anthraquinone isolé de Hypericum
perforatum, possède également des propriétés
antifongiques (Cowan, 1999).
Hypéricine (Cowan,1999)
· Les
flavonoïdes
Les flavonoïdes sont des composés
phénoliques qui possèdent une unité C6-C3 liée
à un noyau aromatique (Zhang et Björn, 2009). Etant donné
que les flavonoïdes sont synthétisés par les plantes suite
à une infection microbienne, il n'est donc pas surprenant qu'ils
possèdent des propriétés antimicrobiennes (Cowan, 1999).
La catéchine, flavonoïde isolée du thé vert, est
douée de propriétés antimicrobiennes (Cowan, 1999). Prasad
et al.(2004) ont décrit la 4'-méthoxyflavone extraite de
Psoralea corylifolia comme possédant des
propriétés antidermatophytiques contre Trichophyton
mentagrophytes, T. rubrum, Microsporum gypseum et Epidermophyton
flococcum. Leur activité est probablement due à leur
capacité de se complexer aux protéines extracellulaires et
solubles. Mais, les flavonoïdes à caractère lipophile
peuvent détruire les membranes microbiennes en augmentant la
fluidité des lipides membranaires (Prasad et al., 2004).
 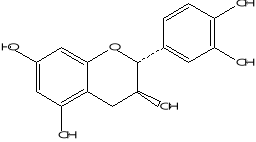
4'-méthoxyflavone (Prasad et al.,2004)
Catéchine (Cowan, 1999)
· Les
tannins
Le terme « Tannin » décrit en
général un groupe de composés phénoliques
polymériques capables de tanner le cuir ou de précipiter la
gélatine (Cowan, 1999). Plusieurs activités physiologiques
humaines et une large variété d'actions anti-infectives sont
attribuées aux tannins (Haslani, 1996). Les tannins
possèderaient une activité toxique contre les champignons
filamenteux, les levures et les bactéries (Scalbert, 1991). Souza et
al.(2008) ont montré que les tannins isolés de
l'écorce de Mimosa tenuifloria seraient responsables de
l'activité de cette plante contre les dermatophytes Microsporum
canis, Microsporum gypseum, Trichophyton mentagrophytes et
Trichophyton rubrum. L'activité antimicrobienne des tannins
serait due à leur capacité à se complexer aux
protéines de transport (Stern et al., 1996).
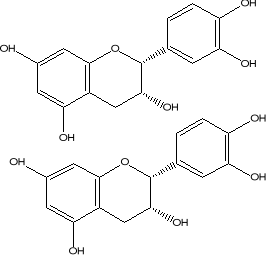
Procyanidine B2 condensée (Cowan, 1999)
· Les
coumarines
Les coumarines sont des composés phénoliques
constitués d'un benzène et des noyaux á-pyrènes
(Cowan, 1999). Les coumarines possèdent des propriétés
physiologiques et antimicrobiennes (Fernandez et al., 1996). La
warfarine est une coumarine utilisée comme anticoagulant qui
possèderait également des propriétés antivirales
(Cowan, 1999). De même, les coumarines présentes dans la plante
Galium odoratum, seraient responsables de l'activité
antibactérienne et antifongique de cette plante (Hambeuger et
Hostettmann, 1991).
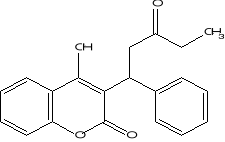
Warfarine (Cowan, 1999).
· Les saponines
Les saponines sont des métabolites secondaires
constitués d'un noyau glucidique attaché à un aglycone.
Suivant la structure de l'aglycone, on distingue deux types de saponines :
le type triterpénoïde tétracyclique et le type
triterpénoïde pentacyclique. Les saponines sont présents
dans plusieurs espèces végétales et sont doués de
propriétés antimicrobiennes. A titre illustratif, on peut citer
les saponines contenus dans les racines du ginseng (Panax notoginseng)
actifs contre les espèces de Trichophyton (Cowan, 1999). De
même, le
3-O-(4-acétyl-â-D-xylopyranosyl)-(1?3)-á-L-rhamnopyranosyl-(1?2)-á-L-arabinopyranosyl-hederagenine,
saponine isolé de la fraction hydroalcoolique du péricarpe de
Sapindus saponaria possède une activité antifongique
importante contre Candida parapsilosis (Tsuzuki et
al.,2007).
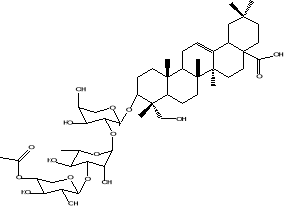
3-O-(4-acétyl-â-D-xylopyranosyl)-(1?3)-á-L-rhamnopyranosyl-(1?2)-á-L-arabinopyranosyl-hederagenine
(Tsuzuki et al.,2007)
b) Les
alcaloïdes
Les alcaloïdes sont des composés organiques
azotés de faibles poids moléculaires. Ils possèdent des
structures hétérocycliques et se retrouvent dans environ 20% de
toutes les espèces de plantes (Zhang et Björn, 2009). Les
alcaloïdes sont connus comme doués de propriétés
antimicrobiennes (Faizi et al., 2003). Ainsi, la berbérine
isolée de Hydrastis canadensis, est un important
représentant des alcaloïdes. Il est potentiellement actif contre
les trypanosomes et les plasmodiums (Freiburghaus et al.,1996). Le
mécanisme d'action des alcaloïdes est attribué à leur
capacité à s'intercaler avec l'ADN.
berbérine (Cowan,1999)
c) Les
terpénoïdes
Les terpènes constituent un groupe de composés
dont la structure de base est une unité isoprénique. Lorsque le
composé contient un autre élément
(généralement l'oxygène), on parle de
terpénoïde. Les terpénoïdes sont connus comme
doués de propriétés antifongiques (Rana et al.,
1997) et antibactériennes (Amarel et al., 1998). A titre
illustratif, la buteline et l'acide 12-oxohardwickique isolés de
l'écorçe de Croton macrostachys, ont montré des
activités antifongiques et antibactériennes (Tene et
al.,2009). Le mécanisme des terpénoïdes n'est pas bien
connu mais, il pourrait induire une destruction de la membrane du
microorganisme par une action lipophilique (Cowan, 1999). Les
terpénoïdes sont les plus représentés dans la
constitution chimique des huiles essentielles (Brunetton, 1999).
buteline acide
12-oxohardwickique
(Tene et al.,2009)
II.3 Méthodes
d'évaluation de l'activité antidermatophytique
Pour une analyse scientifique des extraits de plantes,
différentes méthodes d'évaluation de l'efficacité
de celles-ci sont utilisées.
II.3.1
Evaluation de l'activité antidermatophytique in vitro
Plusieurs méthodes permettent d'évaluer
l'activité antidermatophytique in vitro. Cette
évaluation peut se faire avec des substances pures (Afolayan et Meyer,
1996) ou des extraits bruts (Freiburghaus et al., 1996). Les
principales méthodes généralement utilisées
sont : la méthode d'incorporation en milieu solide et la
méthode de dilution en milieu liquide (Cowan, 1999).
a) La méthode d'incorporation en
milieu solide
La substance à tester est incorporée au milieu
de culture en surfusion, puis l'homogénat est coulé dans une
boite de Pétri ou dans des puits d'une plaque de macrotitration.
Après gélification, un explant fongique (mycélium, spores)
y est ensemencé. Pendant toute la durée de l'incubation, le
diamètre de la croissance des champignons est mesuré (Kuiate,
2005). Cette méthode est généralement utilisée pour
des substances hydrophobes (Rios et al., 1998).
b) La méthode de dilution en milieu
liquide
La méthode de dilution en milieu liquide est
généralement utilisée pour la détermination des
concentrations minimales inhibitrices. Dans le milieu de culture, des volumes
d'extraits sont introduits pour des concentrations précises. Un
même volume d'homogénat obtenu est ensuite coulé dans des
puits. L'inoculum y est ensuite ajouté. Après incubation, la CMI
est déterminée soit par colorimétrie (Eloff, 1998) ou par
observation de la turbidité (Santos et Hamdan, 2005).
II.3.2
Evaluation de l'activité antidermatophytique in vivo
L'utilisation du modèle expérimental animal
constitue une étape importante en pharmacologie moderne. Cette
étape apporte des informations indispensables pour le traitement de
certaines infections. En effet, elle permet de déterminer les
paramètres pharmacocinétiques et pharmacodynamiques
prédictifs de l'activité in vivo. L'étude in
vivo aide également à donner des recommandations sur les
modalités optimales d'administration chez l'homme.
Pendant plusieurs années, des infections
dermatophytiques expérimentales ont été produites sur la
peau de l'homme et des animaux avec des succès variés (Knight,
1972). Plusieurs techniques ont été utilisées, mais
quelques ont été standardisées pour les cochons d'Inde
expérimentaux (Greenberg et al.,1976). Ces procédures
permettent une observation directe du développement des lésions
chez les individus vierges et ceux ayant subi une première infection.
Elles donnent également une idée du nombre de spores
nécessaire pour initier une infection. Le meilleur model
expérimental pour l'induction des dermatophytoses est le cochon d'Inde
(Cavia porcellus). Cette position remarquable occupée par cet
animal est due au fait qu'il est facilement manipulable et susceptible à
une grande variété de maladies infectieuses qui attaquent
l'Homme et les animaux (Harkness et Wagner, 1989).
II.3.3
Les facteurs qui influencent l'activité antimicrobienne
a) Activité
antimicrobienne in vitro
Plusieurs facteurs influencent de façon significative
l'activité antimicrobienne in vitro (Jawetz et
al.,1973):
· Le pH de l'environnement : certains agents
antimicrobiens sont plus actifs à pH acide.
· Les composantes du milieu : les sels peuvent
inhiber fortement l'activité antimicrobienne.
· Etendue de l'inoculum : en général,
plus l'inoculum est grand plus la sensitivité du microorganisme est
faible.
· Durée d'incubation : plus l'incubation
persiste, plus il y'a de fortes chances que des souches mutantes
résistantes émergent ou que les membres les moins susceptibles de
la population microbienne commencent à se multiplier à mesure que
l'agent antimicrobien se détériore.
· Stabilité de l'agent antimicrobien :
à température d'incubation, plusieurs agents antimicrobiens
perdent leur activité.
b) Activité antimicrobienne in
vivo
Le problème de l'activité des agents
antimicrobiens in vivo est beaucoup plus complexe qu'in
vitro. Il implique non seulement l'agent antimicrobien et le parasite,
mais aussi l'hôte (Jawetz et al.,1973):
· La distribution de l'agent antimicrobien : dans
l'organisme, l'agent se distribue inégalement dans les liquides et
tissus.
· La concentration de l'inoculum: in vitro,
les microorganismes sont exposés à des concentrations
invariables d'inoculum, dans le corps il en est autrement. Suite à
l'absorption, l'agent antimicrobien peut être inactivé ou
éliminé. Par conséquent son taux disponible dans le corps
est soumis à des fluctuations constantes.
· Substances interférentes : l'agent
antimicrobien peut se lier à des protéines sanguines et
tissulaires ou à des lipides.
II.4
Généralités sur les plantes étudiées
II.4.1
Acalypha manniana
Acalypha manniana Müll Arg. est une herbe
forestière de la classe des dicotylédones et de la famille des
Euphorbiacées. Elle possède des tiges cylindriques à la
base de l'axe principal. Les feuilles, d'environ 1,5 - 4 cm de long et 1- 2,5
cm de large, sont de forme ovale, graduellement troncaturées à
leur base, grossièrement dentées, membraneuses, peu velues de
chaque face et portant 5 - 6 nervures latérales de chaque
côté. Le pétiole, d'1,5 - 4 cm de long, est mince. Les
fleurs sont rares et lorsqu'elles sont présentes, sont rosâtres
et monoïques. Le genre Acalypha comprend environ 460
espèces et se localise dans les tropiques et les régions
chaudes, excluant l'Europe. Au Cameroun, on retrouve surtout Acalypha
manniana à Buea, Manfé et Yaoundé (Schmelzer et
al., 2008).
Acalypha manniana est utilisée en
médecine traditionnelle à l'Ouest Cameroun pour soigner les
mycoses. Au Ghana, en Ouganda, au Rwanda et au Burundi elle est utilisée
comme antidiarrhéique (Schmelzer et al., 2008). A notre
connaissance, Acalypha manniana n'a pas encore fait l'objet
d'études antimicrobiennes et chimiques.
II.4.2
Tristemma hirtum
Tristemma hirtum P. Beauv. est un arbuste
forestier d'environ 1,25 m de haut, appartenant à la famille des
Mélastomatacées. Les tiges sont angulées (4
côtés) et les feuilles, d'environ 16 cm de long et 7,5 cm de
large, ont une base légèrement atténuées, sont
recouvertes de petits poils sur chaque face et sont légèrement
dentées. Les nervures, au nombre de 5-7, sont protubérantes en
dessous de la feuille. Le pédoncule a une longueur inférieure
à 5 mm. Le pétiole, de plus de 2,5 cm de long, a une
inflorescence terminale. La couleur des fleurs varie de lilac à
rouge.
Tristemma hirtum croît dans des zones
marécageuses et humides du Sénégal, de l'Ouest Cameroun,
au Nigéria, au Congo démocratique, au Libéria et en
Côte d'Ivoire. Dans ce dernier pays, cette plante est utilisée
comme emménagogue et ses fruits y sont également consommés
(Parmentier et Geerinck, 2003). A l'Ouest Cameroun, cette plante est
utilisée en association avec d'autres plantes pour le traitement de la
fièvre typhique, pour soigner les hémorroïdes, pour des
problèmes de reproduction et pour des maladies de la peau. A notre
connaissance, Tristemma hirtum n'a pas encore fait l'objet
d'études chimiques et antimicrobiennes.
CHAPITRE 2 : MATERIEL ET
METHODES
I
Matériel
I.1 Matériel
végétal
Cinq kilogrammes de feuilles d'Acalypha manniana et
de tiges et feuilles de Tristemma hirtum ont été
récoltés dans la ville de Dschang au mois de Février.
Ces plantes ont été identifiées à l'Herbier
Nationale du Cameroun (Yaoundé) par comparaison aux échantillons
authentiques de codes 18223/SRF/CAM et 12725/HNC respectivement.

Tristemma hirtum 12725/HNC
Acalypha manniana 18223/CAM

I.2
Matériel animal
Trente cochons d'Inde mâles de deux mois d'âge,
de poids corporels compris entre 400 g et 450 g, ont été
répartis à raison d'un animal par cage pour l'évaluation
de l'activité antidermatophytique in vivo.
I.3 Microorganismes et milieux de
culture
Les dermatophytes utilisés dans cette étude
proviennent du Laboratoire de Microbiologie et des Substances Antimicrobiennes
(LAMSA) de l'Université de Dschang. Les souches de dermatophytes
étudiés sont Trichophyton mentagrophytes (E1425),
Trichophyton terrestre (E1501), Microsporum gypseum (E1420)
et un isolat Trichophyton equinum. L'entretien des dermatophytes et
l'évaluation des activités antidermatophytiques ont
été effectués avec les milieux Sabouraud dextrose agar
(SDA) et le bouillon de Sabouraud dextrose (SDB, Conda, Madrid).
II Méthodes
Afin
de guider le choix des plantes, une enquête a été
effectuée dans la ville de Dschang et ses environs (Annexe III). Suite
à cette enquête, à l'identification et à une
étude bibliographique, des échantillons de plantes ont
été récoltés et séchés avant
extraction.
II.1 Extraction et
partitionnement
Les tiges et feuilles de Tristemma hirtum d'une
part, et les feuilles d'Acalypha manniana d'autre part, ont
été découpées et séchées à
l'abri de la lumière, à température ambiante pendant
environ 5 jours puis réduites en poudre. Un kilogramme de poudre de
chaque plante a été macéré dans 4 L de
méthanol pendant 3 jours. Le mélange était remué
deux fois par jour . Le macérât a ensuite été
filtré à l'aide du papier Watmann N°3, puis le solvant des
filtrats a été évaporé à 65°C à
l'aide d'un évaporateur rotatif (BÜCHI R-200/205).
Deux extractions ont été effectuées pour chaque
échantillon et le rendement d'extraction a été
calculé par rapport à la masse du matériel
végétal sec.
Les extraits de plantes ont été
épuisés successivement à l'hexane et à
l'acétate d'éthyle comme suit. Cent grammes d'extrait au
méthanol ont été dissouts dans 1litre d'hexane. La phase
supérieure hexanique a ensuite été
récupérée après 2h de repos par décantation
et l'hexane a été évaporé à 70°C. Le
résidu a une fois de plus été dissout dans 1 litre
d'acétate d'éthyle, puis, le mélange a été
laissé au repos pendant 2 heures. La phase supérieure à
l'acétate d'éthyle a ensuite été
récupérée par décantation, puis son solvant
évaporé à 78°C. Toutes les fractions obtenues
(hexanique, à l'acétate d'éthyle et résiduelle)
ont été séchées à l'étuve à
40°C pour évaporation complète des solvants et le rendement
d'extraction a été déterminé par rapport à
la masse d'extrait brut.
II.2 Criblage phytochimique des
extraits et fractions
Les principaux groupes de substances antimicrobiennes ont
été recherchés dans les différents extraits et
fractions par les méthodes standards décrites par Brunetton
(1999).
II.2.1 Les
flavonoïdes : test de Shinoda
L'extrait/fraction (0,1 g) a été dissout dans 3
ml de méthanol. 0,05 g de copeau de magnésium et 4 gouttes
d'acide sulfurique y ont ensuite été ajoutés. Le
développement de la couleur orange a indiqué la présence
des flavonoïdes.
II.2.2 Les
alcaloïdes :test de Mayer
Cent milligrammes d'extrait/fraction ont été
introduits dans un tube à essai contenant 3 ml d'acide sulfurique 1%.
L'ensemble a été porté à ébullition au
bain-marie (100°C) pendant 5 min. Après refroidissement et
filtration, 5 gouttes de réactif de Meyer ont été
ajoutées. La formation d'un précipité blanc a
indiqué la présence des alcaloïdes.
II.2.3
Les triterpènes et les stéroïdes : test de
Liebermann-Burchard
Cent milligrammes d'extrait/fraction ont été
dissouts dans 3 ml de chloroforme et 4 gouttes d'anhydride acétique et
d'acide sulfurique concentré y ont été ajoutées.
La formation d'une phase supérieure rouge-violacé a
indiqué la présence des triterpènes, alors que le
développement d'une coloration bleue à l'interface a
indiqué la présence des stéroïdes.
II.2.4 Test des composés
phénoliques
L'extrait/fraction (0,1 g) a été dissout dans 3
ml d'éthanol et 5 gouttes de FeCl3 y ont été
ajoutées. Le développement de la coloration verdâtre a
indiqué la présence des phénols. La présence des
composés phénoliques a été marquée par
l'apparition de la coloration bleue-verdâtre.
II.2.5 Test des
saponines
Cent milligrammes d'extrait/fraction ont été
introduit dans un tube à essai contenant 5 ml d'eau et l'ensemble a
été chauffé pendant 5 min. Après refroidissement
et filtration, 10 ml de filtrat ont été introduits dans un second
tube à essai et agités pendant 1 min. Après 15min de
repos, l'épaisseur de la mousse a été mesurée
à l'aide d'une règle graduée. Une hauteur de mousse d'au moins un centimètre
a indiqué la présence des saponines.
II.2.6
Test des tannins
Cent milligrammes d'extrait/fraction ont été
dissouts dans 5 ml d'eau distillée et la solution a été
chauffée pendant 5 min. Après refroidissement et filtration, 4
gouttes de chlorure de fer 0,5% ont été ajoutés à 2
ml de filtrat. La présence des tannins a été
indiquée par la formation d'un précipité bleu.
II.2.7 Test des
anthraquinones
L'extrait/fraction (0,1 g) a été ajouté
à 4 ml du mélange éther-chloroforme (1:1 v/v). La solution
ainsi obtenue a été traitée avec 4 ml de soude 10% et
l'apparition d'une coloration rouge a indiquée la présence des
anthraquinones.
II.2.
8 Test des anthocyanines
L'extrait/fraction (0,1 g) a
été ajouté à 5 ml d'une solution d'acide
sulfurique 1%. L'apparition d'une coloration orange a montré la
présence des anthocyanines.
II.2.9 Test des coumarines
Cent milligrammes d'extrait/ fraction ont été
dissouts dans 3 ml de méthanol contenu dans un tube à essais,
puis le tube a été recouvert d'un morceau de papier imbibé
d'une solution de soude 10%. L'absence de la fluorescence jaune-vert à
l'UV (254 nm) a révélé l'absence des coumarines.
II.3 Evaluation de
l'activité antidermatophytique in vitro
II.3.1 Evaluation de l'effet des
extraits et fractions sur la croissance radiale mycélienne des
dermatophytes
a) Préparation de
l'inoculum fongique
Le front de croissance d'une culture de dermatophyte
âgée de 10 jours a été inondé avec 10 ml
d'eau physiologique stérile (NaCl 0,9%). Après agitation et
filtration, 1 ml de la suspension obtenue a été répandu
sur la surface du milieu Sabouraud dextrose agar (SDA) préalablement
coulé et gélifié dans une boîte de Pétri de
90 mm de diamètre intérieur. Les boîtes de Pétri ont
ensuite été incubées pendant 10 jours à 30°C
(Kuiate et al.,2006).
b) Préparation des solutions mères
d'extrait et des concentrations tests
L'extrait/fraction (0,08 g) a été dissout dans
500 ul de diméthylsulfoxide (DMSO), puis le volume de la suspension a
été complété à 5 ml avec de l'eau
distillée stérile pour une concentration finale de 16 mg/ml. A
partir de cette solution mère des dilutions successives en
série de 2 ont été effectuées pour obtenir des
concentrations tests comprises allant de 8 à 0,25 mg/ml (Tableau 1).
Tableau 1: protocole de
préparation des différentes concentrations d'extraits et
fractions testées
|
Echantillons Témoin
négatif Tests
|
|
volume de solution mère 0
2,25 1,13 0,56 0,28 0,14 0,07
d'extrait (ml)
volume de SDA en 4,5
2,25 3,37 3,94 4,22 4,36 4,43
surfusion (ml)
concentration test (mg/ml) 0
8 4 2 1 0,5 0,25
|
c) Procédure
L'évaluation de l'inhibition de la croissance radiale
mycélienne a été réalisée par la
méthode d'incorporation en milieu solide (Kuiate et al., 2006).
A cet effet, nous avons utilisé des plaques de 24 puits
(NUNC®). Nous avons introduit 1,5 ml de SDA
supplémenté à différentes concentrations
d'extrait/fraction dans chaque puit. Trois essais ont été
réalisés pour chaque concentration. Après
gélification du milieu, chaque puit a été inoculé
en son centre à l'aide d'un explant (2 mm de diamètre
intérieur) prélevé du front de croissance d'une culture
âgée de 10 jours. Les plaques ont ensuite été
recouvertes et incubées à 30°C pendant 7 jours. La
croissance radiale mycélienne des dermatophytes a été
mesurée chaque jour, à la même heure, à l'aide d'une
règle graduée, dans deux directions perpendiculaires passant par
le centre de l'explant et ôtée du diamètre de l'explant.
A partir de ces mesures, les pourcentages d'inhibition de la croissance radiale
mycélienne de chaque dermatophyte par l'extrait/fraction ont
été calculés en utilisant la formule :
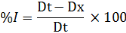
%I : pourcentage d'inhibition
Dt : diamètre moyen de la colonie du
témoin négatif
Dx : diamètre de la colonie dans le
puit test
Les explants dont la croissance a été totalement
inhibée ont été prélevés et
ensemencés sur un autre milieu non supplémenté en extraits
ou fractions, puis incubés pendant 7 jours à 30°C pour
déterminer si la substance est fongicide ou fongistatique (Thompson,
1989).
II.3.2 Détermination des
Concentrations minimales inhibitrices (CMI) et fongicides (CMF)
Les CMI et CMF ont été déterminées
par la méthode de microdilution en milieu liquide, dans des plaques de
microtitration de 96 puits (Santos et Hamdan, 2005).
a) Préparation de la suspension de
spores
Les suspensions de spores ont été
préparées à partir de cultures âgées de 10
jours, incubées à 30°C sur milieu SDA. Les colonies
fongiques ont été immergées avec 5ml d'eau physiologique
stérile et la surface de culture a été grattée
doucement à l'aide d'une anse stérile. La suspension obtenue a
ensuite été filtrée à l'aide d'un papier filtre
qui retient les fragments de mycélium et laisse passer les spores. Des
dilutions successives ont permis d'ajuster le nombre de spores à environ
104 UFC/ml.
b) Préparation des solutions mère
d'extraits et fractions
L'extrait/ fraction (16,4 mg) a été dissout dans
400ul de diméthylsulfoxide, puis le volume de la solution a
été complété à 2 ml pour une concentration
finale d'extrait/fraction de 8192 ug/ ml.
c) Procédure
Des dilutions en série de deux des solutions d'extraits
et fractions ont été effectuées dans chaque puit. Pour
se faire, 100 ul de bouillon de Sabouraud dextrose (SDB)
supplémenté à un extrait/fraction (8192ug/ml) ont
été introduits dans un puit. 100 ul de SDB
supplémenté à l'inoculum y ont été
ajoutés pour donner une concentration de 4096 ug/ml. 100 ul de cette
dernière solution a été prélevée et
additionnée à 100 ul de SDB contenant l'inoculum pour donner une
concentration de 2048 ug/ml et ainsi de suite jusqu'à la plus petite
concentration (32 ug/ml). Trois essais ont été
réalisés pour chaque concentration, et trois contrôles ont
été effectués : le contrôle stérile
(SDB), le contrôle négatif (SDB et inoculum) et le contrôle
positif (SDB, inoculum et griséofulvine). La griséofulvine,
antifongique de référence a été testée selon
la même procédure. Les plaques ont ensuite été
recouvertes de parafilm dans des conditions aseptiques, puis incubées
à 30 °C pendant 7 jours. Au terme de cette période,
l'inhibition de la croissance des dermatophytes a été
vérifiée par ajout de 25 ul de para- iodonitrotétrazolium
(INT) 0,3M dans chaque puit (Eloff, 1998), suivi d'une incubation à
30°C pendant 2 heures. La CMI a été définie comme la
plus petite concentration d'extrait/ fraction pour laquelle il n'ya pas eu
apparition d'une coloration rose après ajout d'INT.
La nature fongistatique ou fongicide a été
confirmée par repiquage sur SDA (en stries d'environ 5 cm de long) de
10 ul du contenu des puits ne présentant aucune croissance visible.
Après 7 jours d'incubation à 30°C, l'absence d'une reprise
de croissance a été considérée comme indicatrice
d'une action fongicide, alors qu'une reprise de croissance a indiqué
une action fongistatique (Escaliente et al., 2002).
II.4 Evaluation de
l'activité antidermatophytique in vivo de la fraction résiduelle
de Tristemma hirtum
L'évaluation de l'activité antidermatophytique
in vivo a été effectuée en plusieurs
étapes suivant les méthodes
décrites par Iwata et al.(1989) et Cavalcanti et
al.(2002).
II.4.1Préparation de
l'inoculum et conditionnement des animaux
a) Préparation de l'inoculum
Dans un premier temps, une suspension de spores a
été préparée en ajoutant 5 ml d'eau physiologique
dans une boîte de Pétri de 55 mm de diamètre contenant une
culture de T. mentagrophytes âgée de trois semaines. La
surface de cette culture a été brossée très
doucement. La suspension obtenue a été filtrée à
l'aide d'un papier filtre qui retient les fragments de mycélium et
laisse passer les spores. Des dilutions successives ont permis d'ajuster le
nombre de spores à environ 106 UFC/ml. L'inoculum ainsi
préparé a été utilisé pour l'infection des
animaux.
b) Conditionnement des animaux
Une aire de 4×4 cm du dos de chaque cochon d'Inde a
été rasée à l'aide d'une lame, puis une zone de 2
cm de diamètre à l'intérieur de cette aire a
été frottée avec du papier vert n° 120 tout en
évitant de blesser l'animal.
II.4.2 Infection des
animaux
Cinq cents ul d'inoculum (105 spores)
préalablement préparé ont été
déposés sur la zone frottée. Cette zone a ensuite
été recouverte d'une compresse maintenue en place à
l'aide d'un ruban adhésif pour une durée de 24 h. Trois jours
après inoculation, des observations microscopiques et des cultures des
prélèvements sur milieu SDA, ont permi de savoir si l'infection
était établie.
II.4.3 Formulation de la pommade
et traitement des animaux
Trente grammes de beurre de karité ont
été introduits dans un mortier, puis chauffés au bain
marie (100°C) jusqu'à dissolution complète (5 min environ).
15 ml d'eau distillée et 0,25 g de sulfure y ont été
ajoutés, et le mélange a été agité
jusqu'à homogénéisation totale. 7,5 g de cire d'abeille
ont ensuite été ajoutés, et le tout a été
porté au bain marie (100°C) pour une solubilisation totale. Deux
concentrations de la fraction dans la pommade ont été obtenues
comme indiqué dans le tableau ci-dessous.
Tableau 2: Formulation de la
pommade
|
Masse (en gramme) des ingrédients pour 10g de
pommade(p/p) %pommade
|
|
Véhicule
Extrait
9,5 0,5
5%
9,75 0,25
2 ,5%
|
Véhicule :beurre de karité+sulfure+cire
d'abeille
Les aspects physiques des pommades obtenues sont illustrés
par la photographie5
II.4.2 Tristemma hirtum
Tristemma hirtum P. Beauv. est un arbuste
forestier d'environ 1,25 m de haut, appartenant à la famille des
Mélastomatacées. Les tiges sont angulées (4
côtés) et les feuilles, d'environ 16 cm de long et 7,5 cm de
large, ont une base légèrement atténuées, sont
recouvertes de petits poils sur chaque face et sont légèrement
dentées. Les nervures, au nombre de 5-7, sont protubérantes en
dessous de la feuille. Le pédoncule a une longueur inférieure
à 5 mm. Le pétiole, de plus de 2,5 cm de long, a une
inflorescence terminale. La couleur des fleurs varie de lilac à
rouge.
Tristemma hirtum croît dans des zones
marécageuses et humides du Sénégal, de l'Ouest Cameroun,
au Nigéria, au Congo démocratique, au Libéria et en
Côte d'Ivoire. Dans ce dernier pays, cette plante est utilisée
comme emménagogue et ses fruits y sont également consommés
(Parmentier et Geerinck, 2003). A l'Ouest Cameroun, cette plante est
utilisée en association avec d'autres plantes pour le traitement de la
fièvre typhique, pour soigner les hémorroïdes, pour des
problèmes de reproduction et pour des maladies de la peau. A notre
connaissance, Tristemma hirtum n'a pas encore fait l'objet
d'études chimiques et antimicrobiennes.
CHAPITRE 2 : MATERIEL ET METHODES
I Matériel
I.1 Matériel végétal
Cinq kilogrammes de feuilles d'Acalypha manniana et
de tiges et feuilles de Tristemma hirtum ont été
récoltés dans la ville de Dschang au mois de Février.
Ces plantes ont été identifiées à l'Herbier
Nationale du Cameroun (Yaoundé) par comparaison aux échantillons
authentiques de codes 18223/SRF/CAM et 12725/HNC respectivement.

Tristemma hirtum 12725/HNC
Acalypha manniana 18223/CAM

I.2 Matériel animal
Trente cochons d'Inde mâles de deux mois d'âge,
de poids corporels compris entre 400 g et 450 g, ont été
répartis à raison d'un animal par cage pour l'évaluation
de l'activité antidermatophytique in vivo.
I.3 Microorganismes et milieux de culture
Les dermatophytes utilisés dans cette étude
proviennent du Laboratoire de Microbiologie et des Substances Antimicrobiennes
(LAMSA) de l'Université de Dschang. Les souches de dermatophytes
étudiés sont Trichophyton mentagrophytes (E1425),
Trichophyton terrestre (E1501), Microsporum gypseum (E1420)
et un isolat Trichophyton equinum. L'entretien des dermatophytes et
l'évaluation des activités antidermatophytiques ont
été effectués avec les milieux Sabouraud dextrose agar
(SDA) et le bouillon de Sabouraud dextrose (SDB, Conda, Madrid).
II Méthodes
Afin de guider le choix des plantes, une enquête a
été effectuée dans la ville de Dschang et ses environs
(Annexe III). Suite à cette enquête, à l'identification et
à une étude bibliographique, des échantillons de plantes
ont été récoltés et séchés avant
extraction.
II.1 Extraction et partitionnement
Les tiges et feuilles de Tristemma hirtum d'une
part, et les feuilles d'Acalypha manniana d'autre part, ont
été découpées et séchées à
l'abri de la lumière, à température ambiante pendant
environ 5 jours puis réduites en poudre. Un kilogramme de poudre de
chaque plante a été macéré dans 4 L de
méthanol pendant 3 jours. Le mélange était remué
deux fois par jour . Le macérât a ensuite été
filtré à l'aide du papier Watmann N°3, puis le solvant des
filtrats a été évaporé à 65°C à
l'aide d'un évaporateur rotatif (BÜCHI R-200/205).
Deux extractions ont été effectuées pour chaque
échantillon et le rendement d'extraction a été
calculé par rapport à la masse du matériel
végétal sec.
Les extraits de plantes ont été
épuisés successivement à l'hexane et à
l'acétate d'éthyle comme suit. Cent grammes d'extrait au
méthanol ont été dissouts dans 1litre d'hexane. La phase
supérieure hexanique a ensuite été
récupérée après 2h de repos par décantation
et l'hexane a été évaporé à 70°C. Le
résidu a une fois de plus été dissout dans 1 litre
d'acétate d'éthyle, puis, le mélange a été
laissé au repos pendant 2 heures. La phase supérieure à
l'acétate d'éthyle a ensuite été
récupérée par décantation, puis son solvant
évaporé à 78°C. Toutes les fractions obtenues
(hexanique, à l'acétate d'éthyle et résiduelle)
ont été séchées à l'étuve à
40°C pour évaporation complète des solvants et le rendement
d'extraction a été déterminé par rapport à
la masse d'extrait brut.
II.2 Criblage phytochimique des extraits et
fractions
Les principaux groupes de substances antimicrobiennes ont
été recherchés dans les différents extraits et
fractions par les méthodes standards décrites par Brunetton
(1999).
II.2.1 Les flavonoïdes : test de Shinoda
L'extrait/fraction (0,1 g) a été dissout dans 3
ml de méthanol. 0,05 g de copeau de magnésium et 4 gouttes
d'acide sulfurique y ont ensuite été ajoutés. Le
développement de la couleur orange a indiqué la présence
des flavonoïdes.
II.2.2 Les alcaloïdes :test de Mayer
Cent milligrammes d'extrait/fraction ont été
introduits dans un tube à essai contenant 3 ml d'acide sulfurique 1%.
L'ensemble a été porté à ébullition au
bain-marie (100°C) pendant 5 min. Après refroidissement et
filtration, 5 gouttes de réactif de Meyer ont été
ajoutées. La formation d'un précipité blanc a
indiqué la présence des alcaloïdes.
II.2.3 Les triterpènes et les
stéroïdes : test de Liebermann-Burchard
Cent milligrammes d'extrait/fraction ont été
dissouts dans 3 ml de chloroforme et 4 gouttes d'anhydride acétique et
d'acide sulfurique concentré y ont été ajoutées.
La formation d'une phase supérieure rouge-violacé a
indiqué la présence des triterpènes, alors que le
développement d'une coloration bleue à l'interface a
indiqué la présence des stéroïdes.
II.2.4 Test des composés phénoliques
L'extrait/fraction (0,1 g) a été dissout dans 3
ml d'éthanol et 5 gouttes de FeCl3 y ont été
ajoutées. Le développement de la coloration verdâtre a
indiqué la présence des phénols. La présence des
composés phénoliques a été marquée par
l'apparition de la coloration bleue-verdâtre.
II.2.5 Test des saponines
Cent milligrammes d'extrait/fraction ont été
introduit dans un tube à essai contenant 5 ml d'eau et l'ensemble a
été chauffé pendant 5 min. Après refroidissement
et filtration, 10 ml de filtrat ont été introduits dans un second
tube à essai et agités pendant 1 min. Après 15min de
repos, l'épaisseur de la mousse a été mesurée
à l'aide d'une règle graduée. Une hauteur de mousse d'au
moins un centimètre a indiqué la présence des
saponines.
II.2.6 Test des tannins
Cent milligrammes d'extrait/fraction ont été
dissouts dans 5 ml d'eau distillée et la solution a été
chauffée pendant 5 min. Après refroidissement et filtration, 4
gouttes de chlorure de fer 0,5% ont été ajoutés à 2
ml de filtrat. La présence des tannins a été
indiquée par la formation d'un précipité bleu.
II.2.7 Test des anthraquinones
L'extrait/fraction (0,1 g) a été ajouté
à 4 ml du mélange éther-chloroforme (1:1 v/v). La solution
ainsi obtenue a été traitée avec 4 ml de soude 10% et
l'apparition d'une coloration rouge a indiquée la présence des
anthraquinones.
II.2. 8 Test des anthocyanines
L'extrait/fraction (0,1 g) a été ajouté
à 5 ml d'une solution d'acide sulfurique 1%. L'apparition d'une
coloration orange a montré la présence des anthocyanines.
II.2.9 Test des coumarines
Cent milligrammes d'extrait/ fraction ont été
dissouts dans 3 ml de méthanol contenu dans un tube à essais,
puis le tube a été recouvert d'un morceau de papier imbibé
d'une solution de soude 10%. L'absence de la fluorescence jaune-vert à
l'UV (254 nm) a révélé l'absence des coumarines.
II.3 Evaluation de l'activité antidermatophytique in
vitro
II.3.1 Evaluation de l'effet des extraits et fractions
sur la croissance radiale mycélienne des dermatophytes
d) Préparation de l'inoculum fongique
Le front de croissance d'une culture de dermatophyte
âgée de 10 jours a été inondé avec 10 ml
d'eau physiologique stérile (NaCl 0,9%). Après agitation et
filtration, 1 ml de la suspension obtenue a été répandu
sur la surface du milieu Sabouraud dextrose agar (SDA) préalablement
coulé et gélifié dans une boîte de Pétri de
90 mm de diamètre intérieur. Les boîtes de Pétri ont
ensuite été incubées pendant 10 jours à 30°C
(Kuiate et al.,2006).
e) Préparation des solutions mères
d'extrait et des concentrations tests
L'extrait/fraction (0,08 g) a été dissout dans
500 ul de diméthylsulfoxide (DMSO), puis le volume de la suspension a
été complété à 5 ml avec de l'eau
distillée stérile pour une concentration finale de 16 mg/ml. A
partir de cette solution mère des dilutions successives en
série de 2 ont été effectuées pour obtenir des
concentrations tests comprises allant de 8 à 0,25 mg/ml (Tableau 1).
Tableau 1: protocole de préparation des
différentes concentrations d'extraits et fractions
testées
|
Echantillons Témoin
négatif Tests
|
|
volume de solution mère 0
2,25 1,13 0,56 0,28 0,14 0,07
d'extrait (ml)
volume de SDA en 4,5
2,25 3,37 3,94 4,22 4,36 4,43
surfusion (ml)
concentration test (mg/ml) 0
8 4 2 1 0,5 0,25
|
f) Procédure
L'évaluation de l'inhibition de la croissance radiale
mycélienne a été réalisée par la
méthode d'incorporation en milieu solide (Kuiate et al., 2006).
A cet effet, nous avons utilisé des plaques de 24 puits
(NUNC®). Nous avons introduit 1,5 ml de SDA
supplémenté à différentes concentrations
d'extrait/fraction dans chaque puit. Trois essais ont été
réalisés pour chaque concentration. Après
gélification du milieu, chaque puit a été inoculé
en son centre à l'aide d'un explant (2 mm de diamètre
intérieur) prélevé du front de croissance d'une culture
âgée de 10 jours. Les plaques ont ensuite été
recouvertes et incubées à 30°C pendant 7 jours. La
croissance radiale mycélienne des dermatophytes a été
mesurée chaque jour, à la même heure, à l'aide d'une
règle graduée, dans deux directions perpendiculaires passant par
le centre de l'explant et ôtée du diamètre de l'explant.
A partir de ces mesures, les pourcentages d'inhibition de la croissance radiale
mycélienne de chaque dermatophyte par l'extrait/fraction ont
été calculés en utilisant la formule :
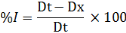
%I : pourcentage d'inhibition
Dt : diamètre moyen de la colonie du
témoin négatif
Dx : diamètre de la colonie dans le
puit test
Les explants dont la croissance a été totalement
inhibée ont été prélevés et
ensemencés sur un autre milieu non supplémenté en extraits
ou fractions, puis incubés pendant 7 jours à 30°C pour
déterminer si la substance est fongicide ou fongistatique (Thompson,
1989).
II.3.2 Détermination des Concentrations
minimales inhibitrices (CMI) et fongicides (CMF)
Les CMI et CMF ont été déterminées
par la méthode de microdilution en milieu liquide, dans des plaques de
microtitration de 96 puits (Santos et Hamdan, 2005).
d) Préparation de la suspension de
spores
Les suspensions de spores ont été
préparées à partir de cultures âgées de 10
jours, incubées à 30°C sur milieu SDA. Les colonies
fongiques ont été immergées avec 5ml d'eau physiologique
stérile et la surface de culture a été grattée
doucement à l'aide d'une anse stérile. La suspension obtenue a
ensuite été filtrée à l'aide d'un papier filtre
qui retient les fragments de mycélium et laisse passer les spores. Des
dilutions successives ont permis d'ajuster le nombre de spores à environ
104 UFC/ml.
e) Préparation des solutions mère
d'extraits et fractions
L'extrait/ fraction (16,4 mg) a été dissout dans
400ul de diméthylsulfoxide, puis le volume de la solution a
été complété à 2 ml pour une concentration
finale d'extrait/fraction de 8192 ug/ ml.
f) Procédure
Des dilutions en série de deux des solutions d'extraits
et fractions ont été effectuées dans chaque puit. Pour
se faire, 100 ul de bouillon de Sabouraud dextrose (SDB)
supplémenté à un extrait/fraction (8192ug/ml) ont
été introduits dans un puit. 100 ul de SDB
supplémenté à l'inoculum y ont été
ajoutés pour donner une concentration de 4096 ug/ml. 100 ul de cette
dernière solution a été prélevée et
additionnée à 100 ul de SDB contenant l'inoculum pour donner une
concentration de 2048 ug/ml et ainsi de suite jusqu'à la plus petite
concentration (32 ug/ml). Trois essais ont été
réalisés pour chaque concentration, et trois contrôles ont
été effectués : le contrôle stérile
(SDB), le contrôle négatif (SDB et inoculum) et le contrôle
positif (SDB, inoculum et griséofulvine). La griséofulvine,
antifongique de référence a été testée selon
la même procédure. Les plaques ont ensuite été
recouvertes de parafilm dans des conditions aseptiques, puis incubées
à 30 °C pendant 7 jours. Au terme de cette période,
l'inhibition de la croissance des dermatophytes a été
vérifiée par ajout de 25 ul de para- iodonitrotétrazolium
(INT) 0,3M dans chaque puit (Eloff, 1998), suivi d'une incubation à
30°C pendant 2 heures. La CMI a été définie comme la
plus petite concentration d'extrait/ fraction pour laquelle il n'ya pas eu
apparition d'une coloration rose après ajout d'INT.
La nature fongistatique ou fongicide a été
confirmée par repiquage sur SDA (en stries d'environ 5 cm de long) de
10 ul du contenu des puits ne présentant aucune croissance visible.
Après 7 jours d'incubation à 30°C, l'absence d'une reprise
de croissance a été considérée comme indicatrice
d'une action fongicide, alors qu'une reprise de croissance a indiqué
une action fongistatique (Escaliente et al., 2002).
II.4 Evaluation de l'activité antidermatophytique
in vivo de la fraction résiduelle de Tristemma hirtum
L'évaluation de l'activité antidermatophytique
in vivo a été effectuée en plusieurs
étapes suivant les méthodes décrites par Iwata et
al.(1989) et Cavalcanti et al.(2002).
II.4.1Préparation de l'inoculum et
conditionnement des animaux
c) Préparation de l'inoculum
Dans un premier temps, une suspension de spores a
été préparée en ajoutant 5 ml d'eau physiologique
dans une boîte de Pétri de 55 mm de diamètre contenant une
culture de T. mentagrophytes âgée de trois semaines. La
surface de cette culture a été brossée très
doucement. La suspension obtenue a été filtrée à
l'aide d'un papier filtre qui retient les fragments de mycélium et
laisse passer les spores. Des dilutions successives ont permis d'ajuster le
nombre de spores à environ 106 UFC/ml. L'inoculum ainsi
préparé a été utilisé pour l'infection des
animaux.
d) Conditionnement des animaux
Une aire de 4×4 cm du dos de chaque cochon d'Inde a
été rasée à l'aide d'une lame, puis une zone de 2
cm de diamètre à l'intérieur de cette aire a
été frottée avec du papier vert n° 120 tout en
évitant de blesser l'animal.
II.4.2 Infection des animaux
Cinq cents ul d'inoculum (105 spores)
préalablement préparé ont été
déposés sur la zone frottée. Cette zone a ensuite
été recouverte d'une compresse maintenue en place à
l'aide d'un ruban adhésif pour une durée de 24 h. Trois jours
après inoculation, des observations microscopiques et des cultures des
prélèvements sur milieu SDA, ont permi de savoir si l'infection
était établie.
II.4.3 Formulation de la pommade et traitement des
animaux
Trente grammes de beurre de karité ont
été introduits dans un mortier, puis chauffés au bain
marie (100°C) jusqu'à dissolution complète (5 min environ).
15 ml d'eau distillée et 0,25 g de sulfure y ont été
ajoutés, et le mélange a été agité
jusqu'à homogénéisation totale. 7,5 g de cire d'abeille
ont ensuite été ajoutés, et le tout a été
porté au bain marie (100°C) pour une solubilisation totale. Deux
concentrations de la fraction dans la pommade ont été obtenues
comme indiqué dans le tableau ci-dessous.
Tableau 2: Formulation de la pommade
|
Masse (en gramme) des ingrédients pour 10g de
pommade(p/p) %pommade
|
|
Véhicule
Extrait
9,5 0,5
5%
9,75 0,25
2 ,5%
|
Véhicule :beurre de karité+sulfure+cire
d'abeille
Les aspects physiques des pommades obtenues sont illustrés
par la photographie5
II.4.2 Tristemma hirtum
Tristemma hirtum P. Beauv. est un arbuste
forestier d'environ 1,25 m de haut, appartenant à la famille des
Mélastomatacées. Les tiges sont angulées (4
côtés) et les feuilles, d'environ 16 cm de long et 7,5 cm de
large, ont une base légèrement atténuées, sont
recouvertes de petits poils sur chaque face et sont légèrement
dentées. Les nervures, au nombre de 5-7, sont protubérantes en
dessous de la feuille. Le pédoncule a une longueur inférieure
à 5 mm. Le pétiole, de plus de 2,5 cm de long, a une
inflorescence terminale. La couleur des fleurs varie de lilac à
rouge.
Tristemma hirtum croît dans des zones
marécageuses et humides du Sénégal, de l'Ouest Cameroun,
au Nigéria, au Congo démocratique, au Libéria et en
Côte d'Ivoire. Dans ce dernier pays, cette plante est utilisée
comme emménagogue et ses fruits y sont également consommés
(Parmentier et Geerinck, 2003). A l'Ouest Cameroun, cette plante est
utilisée en association avec d'autres plantes pour le traitement de la
fièvre typhique, pour soigner les hémorroïdes, pour des
problèmes de reproduction et pour des maladies de la peau. A notre
connaissance, Tristemma hirtum n'a pas encore fait l'objet
d'études chimiques et antimicrobiennes.
CHAPITRE 2 : MATERIEL ET METHODES
I Matériel
I.1 Matériel végétal
Cinq kilogrammes de feuilles d'Acalypha manniana et
de tiges et feuilles de Tristemma hirtum ont été
récoltés dans la ville de Dschang au mois de Février.
Ces plantes ont été identifiées à l'Herbier
Nationale du Cameroun (Yaoundé) par comparaison aux échantillons
authentiques de codes 18223/SRF/CAM et 12725/HNC respectivement.

Tristemma hirtum 12725/HNC
Acalypha manniana 18223/CAM

I.2 Matériel animal
Trente cochons d'Inde mâles de deux mois d'âge,
de poids corporels compris entre 400 g et 450 g, ont été
répartis à raison d'un animal par cage pour l'évaluation
de l'activité antidermatophytique in vivo.
I.3 Microorganismes et milieux de culture
Les dermatophytes utilisés dans cette étude
proviennent du Laboratoire de Microbiologie et des Substances Antimicrobiennes
(LAMSA) de l'Université de Dschang. Les souches de dermatophytes
étudiés sont Trichophyton mentagrophytes (E1425),
Trichophyton terrestre (E1501), Microsporum gypseum (E1420)
et un isolat Trichophyton equinum. L'entretien des dermatophytes et
l'évaluation des activités antidermatophytiques ont
été effectués avec les milieux Sabouraud dextrose agar
(SDA) et le bouillon de Sabouraud dextrose (SDB, Conda, Madrid).
II Méthodes
Afin de guider le choix des plantes, une enquête a
été effectuée dans la ville de Dschang et ses environs
(Annexe III). Suite à cette enquête, à l'identification et
à une étude bibliographique, des échantillons de plantes
ont été récoltés et séchés avant
extraction.
II.1 Extraction et partitionnement
Les tiges et feuilles de Tristemma hirtum d'une
part, et les feuilles d'Acalypha manniana d'autre part, ont
été découpées et séchées à
l'abri de la lumière, à température ambiante pendant
environ 5 jours puis réduites en poudre. Un kilogramme de poudre de
chaque plante a été macéré dans 4 L de
méthanol pendant 3 jours. Le mélange était remué
deux fois par jour . Le macérât a ensuite été
filtré à l'aide du papier Watmann N°3, puis le solvant des
filtrats a été évaporé à 65°C à
l'aide d'un évaporateur rotatif (BÜCHI R-200/205).
Deux extractions ont été effectuées pour chaque
échantillon et le rendement d'extraction a été
calculé par rapport à la masse du matériel
végétal sec.
Les extraits de plantes ont été
épuisés successivement à l'hexane et à
l'acétate d'éthyle comme suit. Cent grammes d'extrait au
méthanol ont été dissouts dans 1litre d'hexane. La phase
supérieure hexanique a ensuite été
récupérée après 2h de repos par décantation
et l'hexane a été évaporé à 70°C. Le
résidu a une fois de plus été dissout dans 1 litre
d'acétate d'éthyle, puis, le mélange a été
laissé au repos pendant 2 heures. La phase supérieure à
l'acétate d'éthyle a ensuite été
récupérée par décantation, puis son solvant
évaporé à 78°C. Toutes les fractions obtenues
(hexanique, à l'acétate d'éthyle et résiduelle)
ont été séchées à l'étuve à
40°C pour évaporation complète des solvants et le rendement
d'extraction a été déterminé par rapport à
la masse d'extrait brut.
II.2 Criblage phytochimique des extraits et
fractions
Les principaux groupes de substances antimicrobiennes ont
été recherchés dans les différents extraits et
fractions par les méthodes standards décrites par Brunetton
(1999).
II.2.1 Les flavonoïdes : test de Shinoda
L'extrait/fraction (0,1 g) a été dissout dans 3
ml de méthanol. 0,05 g de copeau de magnésium et 4 gouttes
d'acide sulfurique y ont ensuite été ajoutés. Le
développement de la couleur orange a indiqué la présence
des flavonoïdes.
II.2.2 Les alcaloïdes :test de Mayer
Cent milligrammes d'extrait/fraction ont été
introduits dans un tube à essai contenant 3 ml d'acide sulfurique 1%.
L'ensemble a été porté à ébullition au
bain-marie (100°C) pendant 5 min. Après refroidissement et
filtration, 5 gouttes de réactif de Meyer ont été
ajoutées. La formation d'un précipité blanc a
indiqué la présence des alcaloïdes.
II.2.3 Les triterpènes et les
stéroïdes : test de Liebermann-Burchard
Cent milligrammes d'extrait/fraction ont été
dissouts dans 3 ml de chloroforme et 4 gouttes d'anhydride acétique et
d'acide sulfurique concentré y ont été ajoutées.
La formation d'une phase supérieure rouge-violacé a
indiqué la présence des triterpènes, alors que le
développement d'une coloration bleue à l'interface a
indiqué la présence des stéroïdes.
II.2.4 Test des composés
phénoliques
L'extrait/fraction (0,1 g) a été dissout dans 3
ml d'éthanol et 5 gouttes de FeCl3 y ont été
ajoutées. Le développement de la coloration verdâtre a
indiqué la présence des phénols. La présence des
composés phénoliques a été marquée par
l'apparition de la coloration bleue-verdâtre.
II.2.5 Test des saponines
Cent milligrammes d'extrait/fraction ont été
introduit dans un tube à essai contenant 5 ml d'eau et l'ensemble a
été chauffé pendant 5 min. Après refroidissement
et filtration, 10 ml de filtrat ont été introduits dans un second
tube à essai et agités pendant 1 min. Après 15min de
repos, l'épaisseur de la mousse a été mesurée
à l'aide d'une règle graduée. Une hauteur de mousse d'au
moins un centimètre a indiqué la présence des
saponines.
II.2.6 Test des tannins
Cent milligrammes d'extrait/fraction ont été
dissouts dans 5 ml d'eau distillée et la solution a été
chauffée pendant 5 min. Après refroidissement et filtration, 4
gouttes de chlorure de fer 0,5% ont été ajoutés à 2
ml de filtrat. La présence des tannins a été
indiquée par la formation d'un précipité bleu.
II.2.7 Test des anthraquinones
L'extrait/fraction (0,1 g) a été ajouté
à 4 ml du mélange éther-chloroforme (1:1 v/v). La solution
ainsi obtenue a été traitée avec 4 ml de soude 10% et
l'apparition d'une coloration rouge a indiquée la présence des
anthraquinones.
II.2. 8 Test des anthocyanines
L'extrait/fraction (0,1 g) a été ajouté
à 5 ml d'une solution d'acide sulfurique 1%. L'apparition d'une
coloration orange a montré la présence des anthocyanines.
II.2.9 Test des coumarines
Cent milligrammes d'extrait/ fraction ont été
dissouts dans 3 ml de méthanol contenu dans un tube à essais,
puis le tube a été recouvert d'un morceau de papier imbibé
d'une solution de soude 10%. L'absence de la fluorescence jaune-vert à
l'UV (254 nm) a révélé l'absence des coumarines.
II.3 Evaluation de l'activité antidermatophytique
in vitro
II.3.1 Evaluation de l'effet des extraits et
fractions sur la croissance radiale mycélienne des dermatophytes
g) Préparation de l'inoculum fongique
Le front de croissance d'une culture de dermatophyte
âgée de 10 jours a été inondé avec 10 ml
d'eau physiologique stérile (NaCl 0,9%). Après agitation et
filtration, 1 ml de la suspension obtenue a été répandu
sur la surface du milieu Sabouraud dextrose agar (SDA) préalablement
coulé et gélifié dans une boîte de Pétri de
90 mm de diamètre intérieur. Les boîtes de Pétri ont
ensuite été incubées pendant 10 jours à 30°C
(Kuiate et al.,2006).
h) Préparation des solutions mères
d'extrait et des concentrations tests
L'extrait/fraction (0,08 g) a été dissout dans
500 ul de diméthylsulfoxide (DMSO), puis le volume de la suspension a
été complété à 5 ml avec de l'eau
distillée stérile pour une concentration finale de 16 mg/ml. A
partir de cette solution mère des dilutions successives en
série de 2 ont été effectuées pour obtenir des
concentrations tests comprises allant de 8 à 0,25 mg/ml (Tableau 1).
Tableau 1: protocole de préparation des
différentes concentrations d'extraits et fractions
testées
|
Echantillons Témoin
négatif Tests
|
|
volume de solution mère 0
2,25 1,13 0,56 0,28 0,14 0,07
d'extrait (ml)
volume de SDA en 4,5
2,25 3,37 3,94 4,22 4,36 4,43
surfusion (ml)
concentration test (mg/ml) 0
8 4 2 1 0,5 0,25
|
i) Procédure
L'évaluation de l'inhibition de la croissance radiale
mycélienne a été réalisée par la
méthode d'incorporation en milieu solide (Kuiate et al., 2006).
A cet effet, nous avons utilisé des plaques de 24 puits
(NUNC®). Nous avons introduit 1,5 ml de SDA
supplémenté à différentes concentrations
d'extrait/fraction dans chaque puit. Trois essais ont été
réalisés pour chaque concentration. Après
gélification du milieu, chaque puit a été inoculé
en son centre à l'aide d'un explant (2 mm de diamètre
intérieur) prélevé du front de croissance d'une culture
âgée de 10 jours. Les plaques ont ensuite été
recouvertes et incubées à 30°C pendant 7 jours. La
croissance radiale mycélienne des dermatophytes a été
mesurée chaque jour, à la même heure, à l'aide d'une
règle graduée, dans deux directions perpendiculaires passant par
le centre de l'explant et ôtée du diamètre de l'explant.
A partir de ces mesures, les pourcentages d'inhibition de la croissance radiale
mycélienne de chaque dermatophyte par l'extrait/fraction ont
été calculés en utilisant la formule :
%I : pourcentage d'inhibition
Dt : diamètre moyen de la colonie du
témoin négatif
Dx : diamètre de la colonie dans le
puit test
Les explants dont la croissance a été totalement
inhibée ont été prélevés et
ensemencés sur un autre milieu non supplémenté en extraits
ou fractions, puis incubés pendant 7 jours à 30°C pour
déterminer si la substance est fongicide ou fongistatique (Thompson,
1989).
II.3.2 Détermination des Concentrations
minimales inhibitrices (CMI) et fongicides (CMF)
Les CMI et CMF ont été déterminées
par la méthode de microdilution en milieu liquide, dans des plaques de
microtitration de 96 puits (Santos et Hamdan, 2005).
g) Préparation de la suspension de
spores
Les suspensions de spores ont été
préparées à partir de cultures âgées de 10
jours, incubées à 30°C sur milieu SDA. Les colonies
fongiques ont été immergées avec 5ml d'eau physiologique
stérile et la surface de culture a été grattée
doucement à l'aide d'une anse stérile. La suspension obtenue a
ensuite été filtrée à l'aide d'un papier filtre
qui retient les fragments de mycélium et laisse passer les spores. Des
dilutions successives ont permis d'ajuster le nombre de spores à environ
104 UFC/ml.
h) Préparation des solutions mère
d'extraits et fractions
L'extrait/ fraction (16,4 mg) a été dissout dans
400ul de diméthylsulfoxide, puis le volume de la solution a
été complété à 2 ml pour une concentration
finale d'extrait/fraction de 8192 ug/ ml.
i) Procédure
Des dilutions en série de deux des solutions d'extraits
et fractions ont été effectuées dans chaque puit. Pour
se faire, 100 ul de bouillon de Sabouraud dextrose (SDB)
supplémenté à un extrait/fraction (8192ug/ml) ont
été introduits dans un puit. 100 ul de SDB
supplémenté à l'inoculum y ont été
ajoutés pour donner une concentration de 4096 ug/ml. 100 ul de cette
dernière solution a été prélevée et
additionnée à 100 ul de SDB contenant l'inoculum pour donner une
concentration de 2048 ug/ml et ainsi de suite jusqu'à la plus petite
concentration (32 ug/ml). Trois essais ont été
réalisés pour chaque concentration, et trois contrôles ont
été effectués : le contrôle stérile
(SDB), le contrôle négatif (SDB et inoculum) et le contrôle
positif (SDB, inoculum et griséofulvine). La griséofulvine,
antifongique de référence a été testée selon
la même procédure. Les plaques ont ensuite été
recouvertes de parafilm dans des conditions aseptiques, puis incubées
à 30 °C pendant 7 jours. Au terme de cette période,
l'inhibition de la croissance des dermatophytes a été
vérifiée par ajout de 25 ul de para- iodonitrotétrazolium
(INT) 0,3M dans chaque puit (Eloff, 1998), suivi d'une incubation à
30°C pendant 2 heures. La CMI a été définie comme la
plus petite concentration d'extrait/ fraction pour laquelle il n'ya pas eu
apparition d'une coloration rose après ajout d'INT.
La nature fongistatique ou fongicide a été
confirmée par repiquage sur SDA (en stries d'environ 5 cm de long) de
10 ul du contenu des puits ne présentant aucune croissance visible.
Après 7 jours d'incubation à 30°C, l'absence d'une reprise
de croissance a été considérée comme indicatrice
d'une action fongicide, alors qu'une reprise de croissance a indiqué
une action fongistatique (Escaliente et al., 2002).
II.4 Evaluation de l'activité antidermatophytique
in vivo de la fraction résiduelle de Tristemma hirtum
L'évaluation de l'activité antidermatophytique
in vivo a été effectuée en plusieurs
étapes suivant les méthodes décrites par Iwata et
al.(1989) et Cavalcanti et al.(2002).
II.4.1Préparation de l'inoculum et
conditionnement des animaux
e) Préparation de l'inoculum
Dans un premier temps, une suspension de spores a
été préparée en ajoutant 5 ml d'eau physiologique
dans une boîte de Pétri de 55 mm de diamètre contenant une
culture de T. mentagrophytes âgée de trois semaines. La
surface de cette culture a été brossée très
doucement. La suspension obtenue a été filtrée à
l'aide d'un papier filtre qui retient les fragments de mycélium et
laisse passer les spores. Des dilutions successives ont permis d'ajuster le
nombre de spores à environ 106 UFC/ml. L'inoculum ainsi
préparé a été utilisé pour l'infection des
animaux.
f) Conditionnement des animaux
Une aire de 4×4 cm du dos de chaque cochon d'Inde a
été rasée à l'aide d'une lame, puis une zone de 2
cm de diamètre à l'intérieur de cette aire a
été frottée avec du papier vert n° 120 tout en
évitant de blesser l'animal.
II.4.2 Infection des animaux
Cinq cents ul d'inoculum (105 spores)
préalablement préparé ont été
déposés sur la zone frottée. Cette zone a ensuite
été recouverte d'une compresse maintenue en place à
l'aide d'un ruban adhésif pour une durée de 24 h. Trois jours
après inoculation, des observations microscopiques et des cultures des
prélèvements sur milieu SDA, ont permi de savoir si l'infection
était établie.
II.4.3 Formulation de la pommade et traitement des
animaux
Trente grammes de beurre de karité ont
été introduits dans un mortier, puis chauffés au bain
marie (100°C) jusqu'à dissolution complète (5 min environ).
15 ml d'eau distillée et 0,25 g de sulfure y ont été
ajoutés, et le mélange a été agité
jusqu'à homogénéisation totale. 7,5 g de cire d'abeille
ont ensuite été ajoutés, et le tout a été
porté au bain marie (100°C) pour une solubilisation totale. Deux
concentrations de la fraction dans la pommade ont été obtenues
comme indiqué dans le tableau ci-dessous.
Tableau 2: Formulation de la pommade
|
Masse (en gramme) des ingrédients pour 10g de
pommade(p/p) %pommade
|
|
Véhicule
Extrait
9,5 0,5
5%
9,75 0,25
2 ,5%
|
Véhicule :beurre de karité+sulfure+cire
d'abeille
Les aspects physiques des pommades obtenues sont illustrés
par la photographie5

Photographie 1:Aspect
physique des différentes pommades.
Deux lots d'animaux (L1,
L2) ont été traités respectivement à l'aide des
pommades à 2,5% et 5% à raison de 0,1g par
application et deux applications par jour. Les animaux des lots L3 et L4 ont
été traités de la même manière à
l'aide du véhicule et de la griséofulvine (témoin positif)
respectivement. Le lot L5 n'a reçu aucun traitement (témoin
négatif). Le traitement a duré 3 semaines au cours desquelles les
animaux étaient observés quotidiennement.
II.5Analyses statistiques
L'analyse statistique a été effectuée
à l'aide du logiciel SPSS (version 12.0) pour Windows. Les
résultats ont été comparés par le test de
Waller-Duncan au seuil de probabilité 5% et exprimés sous forme
de moyenne #177; erreur standard moyenne (ESM).
CHAPITRE 3: RESULTATS ET
DISCUSSION
I Résultats
I.1Extraction et
fractionnement
Les extraits et fractions obtenues ont présenté
des aspects physiques et des rendements différents (Tableau 3).
|
Espèce
végétale
|
Extrait
|
Rendement (%)
|
Couleur
|
Aspect
|
|
A.. manniana (feuilles)
|
Brut
|
21,22
|
Vert foncé
|
Collant
|
|
Hexane
|
9,5
|
Noir
|
onctueux
|
|
Fraction AE
|
5,86
|
Vert
|
Collant
|
|
Résidu
|
82,79
|
Vert marron
|
poudreux
|
|
T. hirtum
(feuilles + tiges)
|
Brut
|
11,5
|
Vert sombre
|
collant
|
|
Hexane
|
14,53
|
Noir
|
onctueux
|
|
Fraction AE
|
5,87
|
Vert
|
Collant
|
|
Résidu
|
76,95
|
Marron clair
|
poudreux
|
Tableau 1: Rendement
d'extraction et caractéristiques physiques des extraits et
fractions
Le rendement de l'extrait au méthanol d'A. manniana
est environ le double de celui de T. hirtum. En
général, les rendements d'extraction des fractions
résiduelles sont plus grands que ceux des fractions à
l'acétate d'éthyle et à l'hexane.
I.2 Criblage phytochimique des
extraits et fractions
Les tests phytochimiques des extraits et fractions ont
révélés des différences de composition chimique
plus ou moins importantes entre les extraits bruts et les fractions (Tableau
4).
On a noté l'absence des coumarines et la
présence des anthocyanines dans tous les extraits et fractions.
L'extrait brut de T. hirtum contient les saponines et les
triterpènes qui sont absents dans l'extrait brut d'A. manniana
et toutes ses fractions. Les alcaloïdes, les tannins, les composés
phénoliques, les flavonoïdes, sont présents dans tous les
extraits bruts et fractions à l'acétate d'éthyle. La
fraction résiduelle de T. hirtum contient des stérols et
des flavonoïdes qui sont absents dans la fraction résiduelle
d'Acalypha manniana. Les fractions hexaniques des deux plantes ont une
même constitution chimique.
Tableau 2: Groupes de
constituants chimiques identifiés dans les extraits et fractions de
T. hirtum et A. manniana
|
Classe de
composés
|
Extraits et fractions
|
|
A.manniana A .manniana A .manniana A.
manniana
(MeOH) (AE) (Hexane)
(Résidu)
|
T. hirtum T. hirtum T. hirtum
T. hirtum
(MeOH) (AE) (Hexane)
(Résidu)
|
|
Saponines -
- - -
Triterpènes -
- - -
Stérols +
+ + -
Alcaloïdes +
+ - +
Flavonoïdes +
+ - -
Anthraquinones +
- - +
Anthocyanines +
+ + +
Tannins +
+ - +
Phénols/polyphénols +
+ - +
Coumarines -
- - -
|
+ -
- +
+ +
- -
+ + +
+
+ +
- +
+ +
- +
+ -
- +
+ +
+ +
+ +
- +
+ +
- +
- - -
-
|
- : absence ; + :
présence, MeOH : méthanol, AE :
acétate d'éthyle
I.3 Evaluation de
l'activité antidermatophytique in vitro
Les différents extraits et fractions ont exercé
des effets dépressifs variables sur la croissance radiale des
différents dermatophytes. Ces effets dépendent de la
durée d'incubation, de la concentration des extraits et fractions et du
dermatophyte étudié.
I.3.1 Influence de la
durée d'incubation et de la concentration des extraits et fractions sur
l'activité antidermatophytique
Indépendamment du champignon, on constate que l'effet
dépressif des extraits et fractions sur la croissance radiale
mycélienne des dermatophytes diminue progressivement avec la
période d'incubation lorsque l'inhibition n'est pas totale (Annexe II).
Par ailleurs, pour un champignon et un extrait/fraction, l'effet
dépressif augmente avec la concentration (Figure 1).
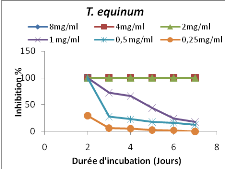 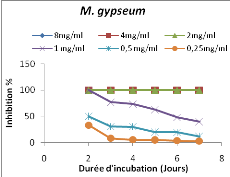
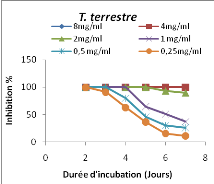 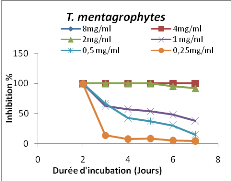
Figure 1: Evolution de
l'inhibition de la croissance radiale mycélienne des dermatophytes par
l'extrait au méthanol de T. hirtum en fonction de la
durée d'incubation
I.3.2 Activité
antidermatophytique comparée des extraits et fractions
On observe une saturation de l'activité à la
concentration 8 mg/ml vis-à-vis de tous les dermatophytes,
exceptés pour les fractions hexanique et à l'acétate
d'éthyle d'A. manniana sur T. terrestre, et la
fraction à l'hexane de T. hirtum sur M. gypseum
(Tableau 5). Les extraits bruts des deux plantes et la fraction
résiduelle de T. hirtum présentent en
général une meilleure activité sur T. mentagrophytes
et M. gypseum. De plus, la fraction résiduelle de T.
hirtum présente également une meilleure activité sur
T. equinum. Sur T. terrestre, l'activité de cette
dernière fraction atteint la saturation à partir de 2 mg/ml.
Tous ces résultats sont confirmés par les
valeurs de CMI et CMF obtenues (Tableau 6) avec de légères
variations. La fraction résiduelle de T. hirtum présente
une CMI de 128 ug/ml vis-à-vis de T. mentagrophytes, T. equinum
, T. terrestre et une CMI de 256 ug/ml contre M.
gypseum. L'extrait au méthanol de T. hirtum ne
présente pas de valeurs de CMI aussi faibles que celles de la fraction
résiduelle, mais montre cependant les plus petites valeurs de CMF
(4096 ug/ml) vis-à-vis de T. mentagrophytes, T. equinum et
M. gypseum. Les résultats montrent par ailleurs que l'extrait
brut d'A. manniana a une nature fongicide vis-à-vis de T.
equinum à partir de la concentration 4 mg/ml (Tableau 7). L'extrait
brut de T. hirtum et sa fraction résiduelle sont fongicides
vis-à-vis de T. terrestre à partir de la concentration 4
mg/ml et 2 mg/ml respectivement.
Tableau 3:
Activité antidermatophytique (%#177; ESM) des extraits et fractions en
fonction du champignon et de la concentration
|
|
|
|
|
Extraits
|
|
|
|
|
|
|
|
Dermatophytes
|
|
Concentration (mg/ml)
|
|
A.m. MeoH
|
A.m.Hexane
|
A.m. AE
|
A.m.Résidu
|
T.h.MeoH
|
T.h.Hexane
|
T.h.AE
|
T.h.Résidu
|
|
Griséofulvine(10ug/ml)
|
|
|
8
|
|
100a
|
100a
|
100a
|
100a
|
100a
|
100a
|
100a
|
100a
|
|
54,3#177;0,45
|
|
|
4
|
|
100a
|
91,74#177; 2,64b
|
62,46#177; 2,64d
|
78,97#177; 2,64c
|
100a
|
100a
|
85,13#177;2,64bc
|
100a
|
|
|
|
2
|
|
76,38#177;3,45c
|
77,06#177;3,45c
|
36,57#177;3,45e
|
88,67#177;3,45b
|
97,99#177;3,45a
|
46,30#177;3,45d
|
46,48#177;3,45d
|
100a
|
|
|
T. mentagrophytes
|
|
1
|
|
48,99#177;3,22c
|
19,95#177;3,22e
|
29,76#177;3,22d
|
53,37#177;3,22bc
|
60,18#177;3,22b
|
16,93#177;3,22e
|
45,64#177;3,22c
|
91,76#177;3,22a
|
|
|
|
0,5
|
|
36,73#177;4,31b
|
19,79#177;4,31c
|
22,54#177;4,31c
|
36,88#177;4,31b
|
56,14#177;4,31a
|
16,48#177;4,31c
|
40,59#177;4,31b
|
40,22#177;4,31b
|
|
|
|
0,25
|
|
19,32#177;4,42bc
|
9,35#177;4,42cd
|
7,93#177;4,42cd
|
24,82#177;4,42ab
|
23,34#177;4,42ab
|
4,78#177;4,42d
|
28,63#177;4,42ab
|
33,41#177;4,42a
|
|
|
|
8
|
|
100a
|
100a
|
100a
|
100a
|
100a
|
100a
|
100a
|
100a
|
|
40,77#177;0,79
|
|
|
4
|
|
100a
|
100a
|
100a
|
100a
|
100a
|
100a
|
100a
|
100a
|
|
|
|
2
|
|
100a
|
85,24#177;1,77b
|
96,73#177;1,77a
|
100a
|
100a
|
86,06#177;1,94b
|
100a
|
100a
|
|
|
T. equinum
|
|
1
|
|
47,55#177;4,33c
|
75,59#177;4,33b
|
78,53#177;4,33b
|
48,78#177;4,75c
|
54,11#177;4,33c
|
68,40#177;4,33b
|
53,19#177;4,75c
|
100a
|
|
|
|
0,5
|
|
36,63#177;5,96bc
|
58,85#177;5,96a
|
40,07#177;5,96b
|
18,63#177;6,53c
|
32,78#177;5,96bc
|
41,20#177;5,96ab
|
32,86#177;6,53bc
|
41,52#177;6,53ab
|
|
|
|
0,25
|
|
8,34#177;2,55c
|
24,44#177;2,55a
|
7,41#177;2,55c
|
8,55#177;2,79c
|
7,76#177;2,55c
|
20,37#177;2,55a
|
12,99#177;2,79bc
|
17,88#177;2,79ab
|
|
|
|
8
|
|
100a
|
87,69#177;0,94c
|
97,26#177;0,94b
|
100a
|
100a
|
100a
|
100a
|
100a
|
|
73,53#177;0,19
|
|
|
4
|
|
100a
|
83,36#177;1,59b
|
80,14#177;1,59b
|
100a
|
100a
|
100a
|
97,39#177;1,59a
|
100a
|
|
|
|
2
|
|
84,04#177;2,70d
|
72,60#177;2,70e
|
73,48#177;2,70e
|
72,15#177;2,70e
|
97,17#177;2,70ab
|
92,86#177;2,70bc
|
86,06#177;2,70cd
|
100a
|
|
|
T. terrestre
|
|
1
|
|
39,82#177;3,93d
|
53,31#177;3,93c
|
63,74#177;3,94b
|
46,35#177;3,93cd
|
75,46#177;3,93a
|
80,51#177;3,93a
|
76,53#177;3,93a
|
53,62#177;3,93c
|
|
|
|
0,5
|
|
17,28#177;4,37e
|
36,07#177;4,37c
|
19,19#177;4,37de
|
23,94#177;4,37de
|
63,57#177;4,37b
|
54,91#177;4,37b
|
75,13#177;4,37a
|
29,25#177;4,37cd
|
|
|
|
0,25
|
|
11,77#177;3,96de
|
27,67#177;3,96bc
|
7,20#177;3,96e
|
8,69#177;3,96de
|
52,94#177;3,96a
|
18,21#177;3,96cd
|
32,50#177;3,96b
|
17,46#177;3,97d
|
|
|
|
8
|
|
100a
|
100a
|
100a
|
89,48#177;1,51a
|
100a
|
80,04#177;1,51c
|
100a
|
100a
|
|
69,40#177;0,16
|
|
|
4
|
|
100a
|
68,55#177;2,58c
|
91,54#177;2,58b
|
57,21#177;2,58d
|
100a
|
47,99#177;2,58e
|
86,02#177;2,58b
|
100a
|
|
|
|
2
|
|
73,79#177;3,56b
|
48,32#177;3,29c
|
51,57#177;3,29c
|
37,66#177;3,29d
|
100a
|
39,91#177;3,29d
|
54,25#177;3,29c
|
93,71#177;3,29a
|
|
|
M. gypseum
|
|
1
|
|
65,67#177;3,92a
|
36,55#177;3,63bc
|
31,88#177;3,63c
|
31,01#177;3,63c
|
66,85#177;3,92a
|
27,43#177;3,63c
|
42,90#177;3,63b
|
42,05#177;3,92b
|
|
|
|
0,5
|
|
55,22#177;3,46a
|
23,75#177;3,20b
|
25,95#177;3,20b
|
13,32#177;3,20c
|
26,94#177;3,46b
|
14,65#177;3,20c
|
20,80#177;3,20bc
|
27,73#177;3,28b
|
|
|
|
0,25
|
|
26,53#177;3,44a
|
14,29#177;3,37bc
|
17,43#177;3,27abc
|
9,99#177;3,27c
|
9,79#177;3,54c
|
7,91#177;3,35c
|
12,26#177;3,27c
|
22,58#177;3,27ab
|
|
MeOH : méthanol, AE :
acétate d'éthyl; A. m. : Acalypha manniana, T.
m.: Tristemma hirtum . Pour chaque ligne , les valeurs
affectées des mêmes lettres ne sont pas significativement
différentes au seuil de probabilité 5% (test de Waller-Duncan).
ESM : Erreur Standard Moyenne
Tableau 4: Concentrations
Minimales Inhibitrices (CMI) et Fongicides (CMF) des extraits et fractions sur
les spores (en ug/ml) des dermatophytes étudiés
|
Extraits
Dermatophytes (spores)
|
|
T.
mentagrophytes T. equinum T. terrestre
M. gypseum
CMI CMF
CMI CMF CMI CMF
CMI CMF
A.m (MeOH) 256
>4096 256 1024 512
>4096 256 >4096
A. m (Hexane) 1024 >4096
256 >4096 256 > 4096
512 >4096
A .m (AE) 512 >4096
256 >4096 512 >4096
256 >4096
A. m. (Résidu) 512
>4096 512 >4096 1024 >4096
1024 >4096
|
|
T. h (MeOH) 512 4096
512 4096 512 >4096
256 4096
T. h. (Hexane) 1024 >4096
256 >4096 512 >4096
1024 >4096
T. h. (AE) 1024 >4096
256 >4096 256 >4096
512 >4096
T. h. (Résidu) 128
>4096 128 >4096 128
>4096 256 >4096
|
|
Griséofulvine 1,25 10
0,325 2,5 0,325 5
1,25 10
|
Les résultats (Tableau 7) montrent par ailleurs que
l'extrait brut d'A. manniana a une nature fongicide vis-à-vis
de T. equinum à partir de la concentration 4 mg/ml. L'extrait
brut de T. hirtum et sa fraction résiduelle sont fongicides
vis-à-vis de T. terrestre à partir de la concentration 4
mg/ml et 2 mg/ml respectivement.
Tableau 5: Concentrations
Minimales Inhibitrices et Fongicides (ug/ml) des extraits et fractions sur le
mycélium
|
Extraits
Dermatophytes (mycelium)
|
T. mentagrophytes
T. equinum T. terrestre M.
gypseum
CMI CMF
CMI CMF CMI CMF CMI
CMF
A.m.( MeoH) 4000 8000
2000 2000 4000 >8000
4000 8000
A.m.(Hexane) 8000 >8000
4000 >8000 >8000
8000 >8000
A.m.(AE) 8000 >8000
4000 8000 >8000
8000 >8000
A.m.(Résidu) 8000
>8000 2000 >8000 4000
>8000 >8000
T.h.(MeoH) 4000 8000
2000 8000 4000 4000 2000
4000
T.h.(Hexane) 4000 >8000
4000 8000 4000 >8000
>8000
T.h.(AE) 8000 >8000
2000 8000 8000 >8000
8000 >8000
T.h.(Résidu) 2000 4000
1000 4000 2000 2000
4000 8000
|
A.m. : Acalypha manniana;
T.h.: Tristemma hirtum, AE: acétate d'éthyle
;MeOH: méthanol
|
I.3.3 Effet des extraits
et fractions sur la morphologie et la structure des dermatophytes
Les extraits et fractions ont des effets plus ou moins
marqués sur l'aspect général, la production et la
structure du mycélium, des éléments de
dissémination et de résistance que sont les microconidies, les
macroconidies et les chlamydospores.
On observe sur la photographie 6 que les filaments
mycéliens de T. equinum sont d'avantage cloisonnés avec
l'augmentation de leur densité. A la concentration 8 mg/ml, les
filaments mycéliens sont plus robustes et tendent à se
déformés pour laisser apparaître des chlamydospores. Cette
évolution s'observe également pour T. equinum et T.
terrestre (photographies 8 et 9). L'augmentation de la concentration en
extrait entraine une diminution du nombre de macroconidies de M. gypseum
et un changement de leur morphologie (Photographie 7). Ainsi, à 1
mg/ml, les macroconidies bien qu'elles soient cloisonnées, sont plus
translucides que celles du témoin négatif. Par contre, à
la concentration 4 mg/ml, les cloisons sont beaucoup moins visibles et les
macroconidies sont translucides, comme vidées de leur contenu.
|
|



