|
ROYAUME DU MAROC

Faculté des Sciences
Semlalia
Département de Biologie
---------------------------------------------------------------------------------------
Master
"Ecologie et Gestion des écosystèmes
aquatiques continentaux"
Eco-Aqua
MEMOIRE DE STAGE DE FIN D'ÉTUDES
ÉTUDE DE LA RELATION ENTRE DES
BACTÉRIES
LEGIONELLA ET DES AMIBES ISOLEES
D'UN
ÉCOSYSTÈME AQUATIQUE A
MARRAKECH
Présenté par :
JEDIYI HICHAM
Encadré par : IMZILN BOUJAMAA
Laboratoire d'accueil : Laboratoire de B iologie et
Biotechnologie des Microorganismes
|
Soutenu le 02/07/2016
|
devant le jury d'examen composé de
|
:
|
Mr. Mohammed LOUDIKi Professeur à la
Mr. Yedir OUHDOUCH Professeur
Mr. Noureddine MEZRIOUI Professeur à
la
Mr. Boujamâa IMZILN Professeur à la
Faculté des Sc
Année universitaire 2015-2016
Faculté des Sciences Semlalia, Marrakech
à la Faculté des Sciences Semlalia, Marrakech Faculté des
Sciences Semlalia, Marrakech iences Semlalia, Marrakech
Président Examinateur Examinateur
Encadrant
A ma mère
A mon père
A ma soeur : Shahrazade
A mes frères : Marouane et
Oussama
A mes professeurs
A mes amis.
REMERCIEMENTS
Au terme de ce travail, je tiens à remercier Dieu le
tout puissant de m'avoir donné le courage, la volonté et la
patience pour achever ce travail.
J'ai l'honneur et le plaisir de présenter ma profonde
gratitude et mes sincères remerciements à mon encadrant le
Professeur Boujamâa IMZILN pour sa précieuse aide
et ses orientations.
Je remercie profondément Monsieur le Professeur
Mohamed LOUDIKI, coordonnateur du Master « Eco-Aqua » pour
sa bonne direction de la filière et pour la qualité de la
formation qu'il nous a prodigué avec l'équipe pédagogique
de la filière.
Mes remerciements vont également à tous les
enseignants chercheurs qui m'ont encouragé et soutenu pendant mon
cursus.
J'adresse également mes remerciements aux Professeurs
: Mr. Yedir OUHDOUCH et Mr. Noureddine MEZRIOUI
pour avoir accepté de juger ce travail.
Un très grand merci, aux membres du laboratoire de
biologie et biotechnologie des microorganismes pour leurs aides, leurs conseils
et pour leurs complicités.
Je remercie toute ma famille et plus particulièrement
mes parents pour leur soutien, leur encouragement et leur confiance.
A mes amis de promotion, j'adresse un grand merci pour leur
soutien et leur aide.
A tous ceux qui ont contribué de prêt ou de loin
à la réalisation de ce travail, MERCI.
LISTE DES ABRÉVIATIONS
% : Pourcent.
ml : Millilitre.
mg : Milligramme.
trm : Tour par minute.
Log : Logarithme en base 10.
ul : Microlitre, unité mesurant le
volume.
u : Vitesse spécifique de croissance
de l'amibe.
umax: Vitesse spécifique de croissance
maximale.
DO600nm: Densité Optique à 600
nm.
MOI: Multiplicity of infection
(Multiplicité d'infection).
UFC : Unité formant colonie.
Log UFC: Logarithme en base 10 d'unité
formant colonie
SA 1,2 : Souche amibienne 1 ou 2.
VBNC : Bactéries viable non
cultivable.
LP : Legionella pneumophilla.
TA : Tampon amibes .
TAR : Tours
aéro-réfrigérants.
Step: Station d'épuration.
rmp : rotation par minute.
BYE: Buffered Yeast Extract.
BCYE: Buffered charcoal yeast extract.
PYG: Protéose peptone, Yeast extract,
Glucose.
Chang (SCGYEM): Serum-Casein-Glucose-Yeast
Extract-Medium.
Culture axénique : Culture
dépourvue d'une source nutritive constituée de
microorganismes.
Culture non axénique : Culture avec
source nutritive constituée de microorganismes.
LBBM : Laboratoire de Biologie et
Biotechnologie des Microorganismes.
Résumé
Le pouvoir incubateur de deux souches amibiennes
environnementales a été mis en évidence envers une souche
bactérienne de Legionella pneumophila sérogroupe 1,
ainsi que l'effet cytotoxique de la bactérie sur ces amibes.
L'étude a été réalisée par co-culture dans
du tampon amibien avec un rapport de multiplicité d'infection de 0,1 et
10. Les deux souches amibiennes testées ont montré une
capacité d'incubation pour la bactérie-testée. Le pouvoir
incubateur de la souche amibienne 1 plus grand que celui obtenu avec la souche
2. La co-culture entre les amibes et la bactérie à
différents rapports de multiplicité d'infection MOI nous a permis
de déterminer le taux de cytotoxicité induit par la souche de
Legionella pneumophila sur les amibes et de démontrer la faible
résistance de la souche amibienne 1 par rapport à la souche
amibienne 2. Des traitements par la chaleur, appliqués sur la souche de
Legionella pneumophila nous ont montré que le choc thermique
était capable de conduire à la formation de formes viables et non
cultivables chez cette bactérie. Les suspensions bactériennes
sont devenues moins détectables sur milieu de culture. Après
passage pendant 72 h des cellules de Legionella pneumophila viables et
non cultivables dans les deux souches amibiennes, les bactérie ont pu
retrouver leur cultivabilité après prolifération
intra-amibienne, ce qui confirme le rôle des amibes comme un facteur
discriminant pour la multiplication de Legionella pneumophila.
Mots clés : Pouvoir incubateur;
souches amibiennes; effet cytotoxique; co-culture; MOI;
Legionella pneumophila.
Abstract
The incubator power of two environmental Amoeba
strains was demonstrated for Legionella pneumophila serogroup 1
bacterial strain. The cytotoxic effect of this bacterium on two amoeba strains
(N1 and N2) was also determined. The latest experiment was conducted by
co-cultivation in buffer amoeba with a Multiplicity Of Infection (MOI) of 0.1
and 10. The two tested strains of amoeba showed an incubation capacity for the
tested bacteria with a higher incubator power for the N1 strain than the strain
N2.The co-culture of the bacterium and Amoebae cells in different MOI
allowed us to determined the cytotoxicity rate did Legionella pneumophila
induced on amoebas and demonstrate the low resistance of the
strain amoebic one compared the amoebic strain two. However,
the heat treatments on the strain of Legionella pneumophila shown us
that these treatments were able to lead to the formation of VBNC in this
bacterium. The bacterial suspensions had initially become less detectable on
agar medium. After a co-culture for 72 hours of Legionella pneumophila
with two amoeba strains, the bacteria could find their cultivability after
intra- amoebic proliferation, confirming the role playing amoeba as a
discriminating factor for the proliferation of L.pneumophila.
Keywords: Power incubator; Strain amoebic;
Cytotoxic effect; Co-culture; MOI; Legionella pneumophila
ÕÎáã
ÉÍæÑÊÓãáÇ
?íäæíÌíááÇ
íåæ ÉíÑíÊßÈ
????? ÉíÆíÈáÇ
ÇÈíã?Ç äã
äíÊá?Óá
ÉäÖÇÍáÇ
ÉæÞáÇ ???
ÁæÖáÇ ØíáÓÊ
ãÊ ÏÞá
äíÈ
ßÑÊÔã ÚÑÒ
ÉØÓÇæÈ
ÉÓÇÑÏáÇ
ÊíÑÌ ÏÞæ .
ÊÇÈíã?Ç åÐå ???
ÉáãÚÊÓãáÇ
ÇíÑíÊßÈáÇ ????
ÑíËÊ ÇÖí
ìáæ?Ç
ÉíáÕãáÇ
ÊÇÐ
äÇÊÑÈÊÎãáÇ
ÇíÈíã?Ç ????? .10
íæÇÓí ÑΠæ 0,1
íæÇÓí
ìæÏÚáÇ ÏÏÚÊ
áãÇÚã ?? áÒÇÚ
ØÓæ ??
ÇíÑíÊßÈáÇ æ
ÊÇÈíã?Ç
|
Çääßã
|
.2 ãÞÑ
|
ÇíÈíã?Ç ????
?? ÉäÑÇÞã 1 ãÞÑ
ÇíÈíã?Ç ????? ÑÈß
????? ÉæÞ ??
ÉÑÈÊÎãáÇ
ÇíÑíÊßÈáá ?????
ÉÑÏÞ
ÇÊÑåÙ
|
?????? íÊáÇ
ÉíæáÎáÇ
ÉíãÓáÇ áÏÚã
ÏíÏÍÊ äã
ìæÏÚáÇ ÏÏÚÊ
Ê?ãÇÚã áÊÎã ??
ÇíÑíÊßÈáÇ æ
ÊÇÈíã?Ç äíÈ
ßÑÊÔãáÇ
ÚÑÒáÇ
ÇíÈíã?Ç ?????
ÉäÑÇÞã 1
ÇíÈíã?Ç ???? äã ??????
ÉãæÇÞã
ÑæåÙæ Ê??ÓáÇ
áÊÎã ?? ??????
ÉÍæÑÊÓãáÇ
?íäæíÌíááÇ
ÏÇãÊÚ?Ç äßãí
ÉíÑÇÑÍáÇ
ÊÇÌ?ÚáÇ ä ÙÍ?ä
ä ?????
ÉÍæÑÊÓãáÇ
ÇíÑíÊßÈáÇ ???? ???
ÉíÑÇÑÍáÇ
ÉÌáÇÚãáÇ
ÑíËÊ äÅ
ßáÇÐß.2 ØÓæ ??? ????
áÞ ÇíÆÏÈã
ÊÍÈÕ
ÇíÑíÊßÈáÇ
åÐå .ÚÑÒáá ?????
ÑíÛáÇ æ
ÉíÍáÇ
ÇíÑíÊßÈáÇ ????
áíßÔÊ ìáÅ
íÏÄÊ á ?????
ÇÈíã?Ç Ê??Ó äã
äíäËÇ ??
?íäæíÌíááÇ
ÉÍæÑÊÓãáÇ
ÇíÑíÊßÈáÇ
ãÖ ???? 72 ÉÏãá
ßÑÊÔã ÚÑÒ
ÏÚÈ åä ?Å . ÑÇÌ
ÚÑÒáÇ
áãÇÚß
ÇÈíã?Ç ????? íÐáÇ
ÑæÏáÇ ÉÏßÄã
ÚÑÒáá
ÇåÊíáÈÇÞæ
ÇåÊÑÏÞ
ÚÌÑÊÓÊ ä
íÈíã áÎÇÏ
ÑÇÔÊäÇ ÏÚÈ
ÉÑíÎ?Ç åÐå
ÊÚÇØÊÓÇ
.?íäæíÌíááÇ
ÉÍæÑÊÓãáÇ
ÇíÑíÊßÈáÇ
ÑÇÔÊä?
ÒííãÊã
ÏÏÚÊ
áãÇÚ? °ßÑÊÔã
ÚÑÒ
°ÉíæáÎáÇ
ÉíãÓáÇ ÑíËÊ
°ÇJ??ã?Ç Ê??Ó ° ?????
ÉÑÏÞ
:ÍÇÊãáÇÇ
ÊÇãáßáÇ
.
ÉÍæÑÊÓãáÇ
?íäæíÌíááÇ°ìæÏÚáÇ
Sommaire
INTRODUCTION GENERALE 1
I- Les légionelles 1
I-1. Historique 1
I-2. Caractéristiques générales de
la bactérie 1
I-3. Position taxonomique. 2
I-4. Écologie des légionelles
2
I-4-1. Les réservoirs de légionelles 2
I-4-2. Mode de vie sessile 2
I-4-1. Cycle de réplication intracellulaire 3
I-5. Maladies du légionnaire 4
I-5-1. Légionellose 4
I-5-2. Fièvre de Pontiac. 4
II- Amibes 5
II-1. Historique 5
II-2. Caractéristiques et morphologie
générales de l'amibe 5
II-2-1. La forme végétative ou trophozoïtes
5
II-2-2. Forme kystique. 5
II-2-3. Cycle de vie 6
II-3. Classification 6
II-4. Répartition dans l'environnement
7
II-5. Maladies Amibiennes. 7
II-5-1. Atteintes du système nerveux. 7
II-5-2. Kératites amibiennes 7
MATÉRIEL ET MÉTHODES 9
I- Souches des micro-organismes 9
I-1. Legionella pneumophila sérogroupe 1
et Escherichia coli 9
I-2. Les amibes 9
I-3. Milieux et conditions de culture des
micro-organismes 10
I-3-1. Culture d'Escherichia coli 10
I-3-2. Culture des légionelles 10
I-3-3. Culture d'amibes 10
I-4. Numération des micro-organismes
11
I-4-1. Dénombrement des légionelles 11
I-4-2. Dénombrement des amibes 11
I-5. Les cultures témoins 11
I-5-1. Témoins amibes 11
I-5-2. Témoins légionelles. 11
I-6. Étude cinétique des co-cultures
12
I-6-1. Pouvoir incubateur des amibes. 12
I-6-2. Cytotoxicité de L. pneumophila
vis-à-vis des amibes 12
I-7. Étude de l'état viable non cultivable
de Legionella pneumophila 13
I-7-1. Traitement thermique 13
I-7-2. Étude de la viabilité des cellules 13
I-8. Analyses statistiques 14
RÉSULTATS 15
I-1. Validation de l'isolement des souches amibiennes
15
I-2. Multiplication intra-amibienne de Legionella
pneumophila 16
I-2-1. Témoins légionelles 16
I-2-2. Témoins amibes 17
I-2-3. Permissivité des souches d'amibes aux L.
pneumophila 17
I-2-1. Cytotoxicité de L.pneumophila
vis-à-vis dessouches amibiennes 20
I-2-2. Affinité de L.pneumophila pour le substrat
(amibes) 21
I-3. Impact du traitement thermique sur Legionella
pneumophila 23
DISCUSSION 25
CONCLUSION ET PERSPECTIVES 27
RÉFÉRENCES BIBLIOGRAPHIQUES 28
ANNEXES 30
ANNEXE 1 30
ANNEXE 2 31
ANNEXE 3 32
Liste des figures
Figure 1: La formation d'un biofilm par les
légionelles (Costerton, 1999) 3
Figure 2: Cycle de vie schématique de
L.p dans les macrophages (Swanson et Hammer, 2000). -4
Figure 3: Photos des souches amibiennes
isolées dans différents types de cultures 15
Figure 4: Suivi de la cultivabilité de
L.p dans le milieu de co-culture aux MOI 0,1 et 10. 16
Figure 5: Croissance des souches amibiennes
(MOI 10) dans le milieu de co-culture 17
Figure 6: Prolifération L.p en
Co-culture avec les deux souches à la MOI 0,1 18
durant 72H d'incubation 18
Figure 7: Prolifération de L.p en
Co-culture avec les deux souches à la MOI 10 18
durant 72H d'incubation 18
Figure 8: Inhibition de la croissance des
amibes sur 72 h de co-culture par L.p a un MOI de 10 19
Figure 9: Inhibition de la croissance des
amibes sur 72 h de co-culture par L.p a un MOI de 0,1 19
Figure 10:Taux de trophozoïtes vivants
après 72h de co-culture avec L.p MOI 0,1 20
Figure 11: Taux de trophozoïtes vivants
après 72h de co-culture avec L.p MOI 10 21
Figure 12: Linéarisation de Lineweaver
et Burke de la relation entre la vitesse spécifique de croissance (u)
de Legionella pneumophilla et du ratio initial
(bactéries/amibes) 21
Figure 13: Impact du traitement thermique sur
la cultivabilité de Legionella pneumophila 23
Figure 14: L'état viable non
cultivable de L.p après co-culture avec les amibes 24
Liste des tableaux
Tableau 1: Souches bactériennes et
amibiennes utilisées lors de l'étude et sont origines 9
Tableau 2: Valeurs de KS
(bactéries/amibe) et umax (h-1) à partir de la
linéarisation 22
INTRODUCTION GENERALE
L'eau est toujours considérée comme étant
un élément indissociable de la vie et en particulier de celle des
populations humaines dont elle a influencé l'histoire et
conditionné le développement. Elle est aussi un des principaux
vecteurs de la transmission de nombreuses maladies qui sont à l'origine
d'importantes épidémies humaines ou animales. Ces maladies
d'origine hydrique sont des infections essentiellement dues à des
(bactéries, virus, algues et/ou protozoaires). Il peut s'agir de
micro-organismes pathogènes ou potentiellement pathogènes
(Opportunistes) et ce en quantité supérieure au seuil
d'infectiosité. Le risque microbiologique provenant du pouvoir
pathogène de ces germes est conditionné non seulement par les
propriétés de l'agent infectieux mais aussi par la
réceptivité de l'hôte (Dupay, 2013).
De nos jours, notre société est à la
recherche d'un équilibre entre le développement et la
préservation des ressources naturelles. L'anthropisation des milieux
aquatiques, suite aux diverses activités humaines, n'est pas sans
conséquence. Il en résulte souvent une modification de leurs
qualités. De telles variations peuvent entraîner la
prolifération de micro-organismes divers. Parmi ces germes,
naturellement présents dans l'environnement, des bactéries du
genre Legionella et des amibes libres sont souvent isolés de
ces milieux (Fliermans et al., 1981). Ces derniers microorganismes
sont souvent reconnus avoir colonisé des systèmes et des
réseaux de distribution d'eau en générant
généralement des biofilms. Malgré la mise en place de
traitements divers, une recolonisation des réseaux par ces
légionelles a été observée (Declerck et al.,
2007).Le maintien de la contamination peut être favorisé par
la présence de biofilms (Declerck et al., 2007). Les biofilms
constituent des réservoirs pour plusieurs espèces de
micro-organismes et fournissent une protection vis-à-vis des agressions
extérieures. Ils permettent aussi aux bactéries de survivre
à l'action des désinfectants et de reformer de nouveaux biofilms.
La présence de protozoaires, surtout les amibes capables de
résister aux désinfectants assure très probablement la
protection de ces bactéries. En effet, les légionelles sont
capables d'infecter des amibes, d'y survivre et de s'y multiplier (Borella et
al, 2005). Ces dernières peuvent être par la suite
libérées dans l'environnement et colonisées des biofilms
ou infectées l'homme.
Dans ce contexte, ce présent travail vise
l'étude de deux aspects biologiques et complémentaires chez les
amibes et les légionnelles à savoir :la réplication de
L.pneumophila chez deux souches amibiennes isolées à
partir de certains écosystèmes aquatiques de Marrakech, d'une
part et l'évaluation de la cytotoxicité des légionelles
vis-à-vis de ces amibes, d'autre part.
Etude de la relation entre des bactéries Legionella et
des amibes 1
Chapitre 1: Aperçu bibliographique
I- Les légionelles
I.1. Historique
En 1976, lors de la 58èmeconvention annuelle
de l'Américain légion à Philadelphie, en Pennsylvanie, et
à la suite d'une épidémie de pneumonie qui eut lieu, le
genre Legionella a été établi en 1978 (McDade et
al, 1977). Cette épidémie a touché parmi les 4400
vétérans réunis, 182 personnes dont 147 d'entre eux
nécessitant l'hospitalisation et entraîna le décès
de 29 individus (Fraser et al, 1977). Une année après,
Joseph McDade et Charles Shepard (Center for Disease Control and
prévention) réussissent à isoler l'agent responsable de
cette épidémie par l'infection des cobayes par voie intra-nasale
selon un protocole utilisé pour la recherche de Rickettsia
(agent responsable du typhus) et de la lèpre (McDade et al,
1977). L'agent pathogène responsable isolé plus tard est
baptisé Legionella pneumophila. Cette bactérie,
jusqu'alors inconnue, avait colonisé le système de climatisation
de l'hôtel et contaminé les vétérans par voie
aérienne.
I.2. Caractéristiques générales de
la bactérie
Les bactéries du genre Legionella, sont des
bacilles à Gram négatif, hétérotrophe,
transitoirement mobile, d'une taille qui varie de 0,3 à 0,9 um de large
et de 2 à 20 um de long, aérobie, non sporulé, non
acido-résistant et non capsulée. Ils peuvent se présenter
en culture sous formes allongées parfois filamenteuses (Diederen et
al,2008). Leur croissance est indispensablement liée au fer et
la L-cystéine, aussi pour son isolement sur des milieux de culture
(Fields et al, 2002). Les variations de taille des légionelles
sont en partie dues, comme pour la plupart des bactéries, à la
modification des conditions environnementales. De plus, chez les
légionelles, la taille de la bactérie est significativement
réduite, avec des longueurs de moins 1um, après leur passage
intra-amibien. Ces bactéries sont capables de croître à des
températures comprises entre 25 et 42 °C, ils survivent à
une température de 60 °C et dans des environnements de pH compris
entre 2,7 et 8,3 (Leoni et al., 2001). Généralement
leurs mode de transmission se fait exclusivement par inhalation
d'aérosols de légionelles issus d'eaux contaminées .
Là encore, la flagellation des légionelles est variable, la
présence ou non du flagelle dépendrait de la température
du milieu puisqu'il est absent au-delà de 37°C. De plus, le
flagelle est absent lorsque la bactérie se trouve à
l'intérieur des macrophages ou protozoaires. Ce flagelle peut atteindre
8 um de long et 14 à 25um de diamètre, il est attaché
à la paroi cellulaire par un corps basal formant un crochet comme c'est
le cas pour les autres bactéries à Gram négatif (Winn et
al, 1988 ).
Etude de la relation entre des bactéries Legionella et
des amibes 1
Chapitre 1: Aperçu bibliographique
I.3. Position taxonomique
Legionella appartient au phylum
Gammaproteobacteria. À ce jour, la famille Legionellaceae
se compose d'un seul genre, Legionella. Le nombre
d'espèces de Legionella isolées par culture est de
l'ordre de 48 espèces appartenant à 70 sérogroupes
différents (Diederen et al., 2008). Legionella pneumophila
est la plus fréquemment identifiée lors des
épidémies de légionellose (80 à 85 % des cas). Elle
comprend entre 15 et 16 sérogroupes selon les auteurs. Parmi lesquels
les sérogroupes 1 et 6 qui sont responsables de deux tiers des
infections (Diederen et al.,2008). Les espèces autres que
L. pneumophila ne sont impliquées que dans environ 20 % des
infections. Les espèces les plus souvent mises en cause sont
L.micdadei (la seconde cause des maladies après L.
pneumophila), L.longbeachae (la plus fréquente en
Australie), L.dumoffii (la quatrième ou cinquième
espèce engendrant la légionellose) et
L.bozemanii. Ces bactéries ont
été isolées principalement chez des
malades
immunodéprimés (Ohnishi et al, 2004).
I.4. Écologie des légionelles
I-4-1. Les réservoirs de légionelles
Les légionelles sont des germes ubiquitaires de
l'environnement qui se développent dans les milieux aquatiques naturels
et les niches hydriques artificielles : eau courante, eau stagnante, eaux
thermales, conduites d'eau potable, pommes des douches, dispositifs de
refroidissement à eau, bains bouillonnants, circuits avec recyclage
d'eau. En 1987, Ortiz et Hazen ont étudié la présence des
bactéries du genre Legionella sur différents sites du
Porto Rico (16 sites marins, 8 d'eau douce et 2 échantillons provenant
d'un estuaire). Sur l'ensemble des sites, l'espèce L. pneumophila
était la plus abondante. De même, La bactérie est
ainsi retrouvée dans les lacs, au niveau de rivières et de leurs
rives, dans des eaux de pluie ou encore dans des nappes phréatiques
(Fliermans et al., 1981). Souvent la bactérie peut coloniser
des environnements hydriques artificiels lorsque les conditions sont
favorables, des températures d'eau comprises entre 35°C et
45°C, une éventuelle stagnation de l'eau, la présence de
certains minéraux (fer, silicone), les dépôts de tartre, la
présence d'autres micro-organismes (Steinert et al, 2002).
I-4-2. Mode de vie sessile
L'activité microbiologique dans un
écosystème (Environnement aquatique, sol, corps humain), provient
en majeure partie d'une flore fixée aux surfaces formant une structure
appelée biofilm (Sutherland, 2001). Le biofilm peut se former sur une
large variété de surfaces comme les
Etude de la relation entre des bactéries Legionella et
des amibes 2
Chapitre 1: Aperçu bibliographique
tissus vivants, les dispositifs médicaux et les
systèmes de distribution d'eau potable ou industrielle. Les
légionelles sont des colonisateurs secondaires
s'associant rapidement à d'autres bactéries ayant
déjà entamé la formation du biofilm. Il a
été observé que L.
pneumophila pouvait coloniser un biofilm en
moins de deux heures (figure1) (Declerck et al.,
2007). Pourtant, à ce jour, aucune étude n
'a pu montrer que les légionelles étaient en
mesure de se multiplier par eux-mêmes dans l'eau.
L'hypothèse de la multiplication extracellulaire
des légionelles dans les biofilms est
évoquée, mais dans la plupart des
expérimentations, la multiplication des bactéries ne s'effectue
qu'en présence de protozoaires (Declerck et al.,
2007).
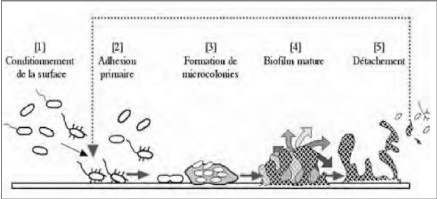
Figure 1: La formation d'un biofilm par les
légionelles ( Costerton, 1999)
I-4-2. Cycle de réplication intracellulaire
Le mode de transmission à l'homme se
fait par inhalation d'aérosols contaminés. Les
aérosols de 1 à 10 um peuvent pénétrer dans
la région alvéolaire des poumons, sachant que la transmission
d'homme à homme n'est pas avérée (Fields, 1996
). Les deux principales espèces de Legionella
pathogènes pour l'homme sont L. pneumophila
et L. longbeachae. Les légionelles
pénètrent dans la cellule par phagocytose
(Figure 2), une fois phagocytées, les bactéries
résident dans un phagosome unique entouré par un
réticulum endoplasmique rugueux (RER), véritable réserve
de nutriments. Quelques heures après l'infection, le phagosome
évolue en s'entourant d'une membrane multicouche issue
du RER. Les bactéries se multiplient alors
dans ce phagosome. En carence nutritionnelle, elles passent
en phase stationnaire où elles expriment plusieurs
gènes de virulence permettant à la fois leur
libération et transmission vers une nouvelle
cellule-hôte (Abu Kwaik et al., 1998).
3
Etude de la relation entre des bactéries
Legionella et des amibes
Chapitre 1: Aperçu bibliographique
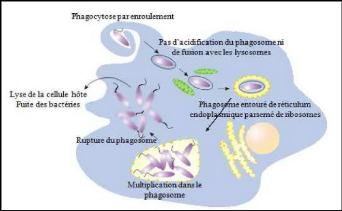
Figure 2: Cycle de vie schématique de L.p
dans les macrophages (Swanson et
Hammer, 2000).
I-5. Maladies du légionnaire
I-5-1. Légionellose
La légionellose est une infection pulmonaire aiguë
dont l'incubation dure de 2 à 10 jours. Elle débute ensuite par
un état grippal avec fièvre, toux sèche,
céphalées, myalgies, anorexie avant qu'apparaisse un tableau plus
sévère associant une température élevée, des
malaises et douleurs abdominales parfois accompagnées de troubles
neurologiques (délire, confusion). Les complications peuvent être
un choc, une coagulation intra vasculaire disséminée, une
insuffisance respiratoire et/ou rénale. Le taux de mortalité est
estimé à 15 % mais peut atteindre 80 % chez certains patients
selon la sévérité des signes cliniques, le statut
immunitaire du patient, la source de l'infection (communautaire ou
nosocomiale), et le choix du traitement antibiotique (Jarraud, 2007).
I-5-2. Fièvre de Pontiac.
Il s'agit d'une forme bénigne de légionellose
découverte en 1968 lors d'une épidémie ayant eu lieu
à Pontiac, qui est analogue à un syndrome pseudo-grippal :
fièvre, frissons, céphalées, myalgies. D'autres
symptômes ont également été recensés à
travers différents épisodes de fièvre de Pontiac tels que
des douleurs abdominales, rougeurs oculaires avec photophobie. Contrairement
à la légionellose, la durée d'incubation de cette maladie
est de 1 à 3 jours et l'infection a lieu dans la gorge douloureuse. La
guérison est habituellement spontanée entre 2 et 5 jours (Glick
et al., 1978).
Etude de la relation entre des bactéries Legionella et
des amibes 4
Chapitre 1: Aperçu bibliographique
II- Amibes
II.1. Historique
Les amibes sont décrites pour la première fois
par August Johann « Rösel van Rosenhof », un microscopiste
amateur, entomologiste et dessinateur, en 1755. Après le naturaliste,
Félix Dujardin décrit en 1841, la famille des amibiens et
définit ainsi les organismes de cette famille : «animaux
formés d'une substance glutineuse, sans tégument, sans
organisation appréciable, changeant de forme à chaque instant par
la protension ou la rétraction d'une partie de leur corps, d'où
résultent des expansions variables» (Dujardin, 1841). C'est dans la
première partie du XXème siècle que les amibes
libres furent mieux identifiées. L'amibe Amoeba polyphage a
été isolée à partir de poussière par
Pushkarew en 1913. En 1930 castellanii a isolé une amibe d'une
contamination dans une culture de levures qui a été ensuite
nommée Acanthamoeba castellanii par Volkonsky en 1931. Depuis,
de nombreuses autres espèces d'amibes ont été
décrites notamment pour le genre Acanthamoeba qui compte plus
de 24 espèces (Dupuy, 2013).
II.2. Caractéristiques et morphologie
générales de l'amibe
II-2-1. La forme végétative ou
trophozoïtes
C'est la forme biologiquement active, capable de se
déplacer, se nourrir et de se diviser, (Bouyer, 2008). Les
trophozoïtes mesurent de 25à 40um en fonction des espèces.
C'est uniquement sous cette forme que les amibes se multiplient, est la
reproduction s'effectue par division binaire. L'organisation cellulaire
correspond typiquement à celle d'une cellule eucaryote, avec
différentes vacuoles. Les vacuoles cytoplasmiques sont des vacuoles
contractiles permettant le contrôle du contenu en eau de la cellule,
ainsi que des vacuoles de sécrétion (contenant des enzymes
spécifiques de certaines fonctions) ou des vacuoles de phagocytose
(Bowers & Korn, 1968). Ils sont nus, ne sont pas entourés d'une
cuticule épaisse. La membrane plasmique est tri-lamellaire. À la
surface de cette membrane plasmique, on distingue de petites projections
appelées acanthopodes.
II-2-2. Forme kystique.
Le kyste est la forme de résistance, biologiquement
inactive. Généralement, les kystes mesurent de 13 à 20 um
en fonction des espèces est se forment lorsque les conditions
environnementales deviennent défavorables à la forme
végétative (froid, dessiccation ou épuisement du milieu
nutritif), et permettent aux amibes de survivre longtemps en état de
latence,
Etude de la relation entre des bactéries Legionella et
des amibes 5
Chapitre 1: Aperçu bibliographique
avec une activité métabolique réduite. La
forme kystique permet également une dissémination aquatique ou
aérienne et l'implantation dans de nouveaux biotopes. Le protoplasme
kystique possède un cytoplasme fortement déshydraté,
entraîne une augmentation de sa densité. De nombreuses vacuoles,
certaines d'entre elles contiennent le matériel nécessaire
à l'édification ou au maintien de la paroi kystique, d'autres
riches en ribonucléoprotéines, sont probablement une source
énergique pour le protoplasme, (Bouyer, 2008).
II-2-3. Cycle de vie
Il comprend deux étapes : une étape
végétative où les amibes libres se multiplient
par mitose ou promitose. Le temps de division est variable selon les genres,
est d'une douzaine d'heures. La deuxième étape du cycle des
amibes libres est une étape kystique. Celle-ci
intervient lorsque les conditions environnementales deviennent
défavorables. La cellule cesse de se déplacer est n'émet
plus de pseudopodes, le cytoplasme s'arrondie au même temps que se
condense, se déshydrate, et sécrète une paroi kystique.
Certaines amibes comme Naegleria sp ou Willaertia sp, possèdent
un stade supplémentaire « la flagellation, observée comme
stade intermédiaire entre la forme enkystée et la forme
végétative ». Certaines amibes ne possèdent pas de
formes kystiques connues comme Vannella sp ou. Thecamoeba sp,
(Dey et al., 2010).
II-3. Classification
Selon Adl et al, 2005, un consortium de biologistes,
la classification a été révisée, les auteurs ont
présenté une hiérarchie simplifiée pour chaque
rang, sans titre formel. Ci-dessous le résumé de la
classification des amibes libres.
· Super-règne :
Eucaryotes
o Règne : Protozoaires
~ Phylum : Amoebozoa
+ Class: Tubulinea
> Famille : Hartmannellidae
V' Genre : Hartmannella
> Famille : Acanthamoebidae
V' Genre : Acanthamoeba V' Genre
: Balamuthia
~ Phylum : Excavata
+ Class: Heterolobosea
> Famille :Vahlkampfiidae
V' Genre :Naegleria
V' Genre : Vahlkampfia
Etude de la relation entre des bactéries Legionella et
des amibes 6
Chapitre 1: Aperçu bibliographique
II.4. Répartition dans l'environnement
Les amibes libres sont présentes dans une large gamme
d'environnement, elles vivent généralement à la surface
des sédiments, sur les matières en suspension dans l'eau mais
aussi dans les biofilms. Acanthamoeba est le genre amibien qui a
été le plus étudié. Ces amibes ont
été isolées du sol, d'eau douce et saumâtre, de
bouteilles d'eau minérale, de circuits de TAR, de réseaux de
chauffages, de ventilations, de systèmes d'air conditionnés,
d'humidificateurs, de Jacuzzis, dans des hôpitaux, d'unités
dentaires, de machines de dialyse. (Visvesvara et al., 2007). La
présence des amibes libres dans les biofilms est démontrée
dans plusieurs études, elles participent à la formation et
à l'équilibre des biofilms (Parry, 2004). Ces micro-organismes
jouent également un rôle dans le cycle de l'azote et du phosphate
notamment dans les environnements oligotrophes (Pickup et al. 2007b).
Les amibes libres sont associées aux biofilms bactériens dans de
nombreux habitats naturels ou artificiels. Le biofilm constitue un
environnement particulièrement propice puisque leurs proies sont
présentes en grand nombre, la prédation par les protozoaires est
considérée comme une source majeure de la mortalité des
bactéries dans les biofilms. Les amibes seraient capables de consommer
30 à 100% de la production bactérienne journalière.
II.5. Maladies Amibiennes.
Les effets pathogènes des amibes touchent
électivement des sujets fragilisés avec des défenses
immunitaires faibles, inexistantes ou inefficaces (patients
immunodéprimés ou atteints d'affections chroniques et
débilitantes).
II-5-1. Atteintes du système nerveux.
L'inoculation s'effectue soit à partir de l'appareil
respiratoire par inhalation, soit à partir de la peau ou de l'oeil
après effraction. La diffusion est hématogène ou par
ascension le long des voies nerveuses optiques ou olfactives. Les amibes sont
alors responsables de la formation dans le système nerveux central de
granulomes tissulaires chroniques centrés par des kystes.
II-5-2. Kératites amibiennes
Dans les pays développés sont en forte
augmentation à cause du port des lentilles de contact. Les
kératites amibiennes se développent également chez des
personnes immunocompétentes. Les atteintes par Acanthamoeba sp
sont actuellement les plus fréquentes des kératites
amibiennes (80% des cas sont des porteurs de lentilles de contact, les autres
cas étant liés
Etude de la relation entre des bactéries Legionella et
des amibes 7
Chapitre 1: Aperçu bibliographique
à un traumatisme oculaire ou ne retrouvant pas de cause
évidente). Elles sont dues aux trophozoïtes qui adhèrent et
se développent sur l'épithélium cornéen.
Après dépôt des amibes sur la cornée, l'incubation
est brève. Les trophozoïtes sécrètent
différentes protéases, en particulier collagénolytiques
provoquant un abcès cornéen (Kim et al, 2006).
Etude de la relation entre des bactéries Legionella et
des amibes 8
Etude de la relation entre des bactéries Legionella et
des amibes 9
Chapitre 2: Matériel et méthodes
MATÉRIEL ET MÉTHODES I- Souches des
micro-organismes
I-1. Legionella pneumophila sérogroupe 1
et Escherichia coli
La souche de Legionella pneumophila
sérogroupe 1 et d'Escherichia coli utilisées dans
cette étude proviennent d'une collection de souches isolées et
identifiées par sérotypage d'une étude antérieure,
dirigé par le Professeur B. IMZILN du laboratoire de biologie et de
biotechnologie des micro-organismes de la Faculté des Sciences Semlalia
de Marrakech.
I-2. Les amibes
Différentes souches amibiennes ont été
isolées à partir de différents écosystèmes
aquatiques à Marrakech. La souche amibienne (SA1) a été
isolée à partir des eaux usées rejetées par la
station d'épuration de Marrakech, alors que La souche amibienne (SA2) a
été isolée à partir de l'eau de puits de la
Faculté des Sciences Semlalia (FSSM) de Marrakech.
Deux méthodes d'isolement ont été
utilisées. La première consiste à filtrer les eaux
prélevées par une pompe à vide sur une membrane de 0,22um
à raison d'un litre d'échantillon par membrane. Le filtre est
ensuite déposé sur de la gélose non nutritive «
NN-Agar » recouvert d'un tapis d'Escherichia coli et
incubée à 28°C pendant 10 jours. La deuxième
méthode consiste à centrifuger un litre de l'échantillon
d'eaux à une vitesse de 1200tpm pendant 10 min et à remettre le
culot en suspension dans un volume précis d'eau distillée
stérile. 500 ul de cette suspension sont ensemencés par
étalement dans des boîtes de pétri contenant de la
gélose non nutritive recouvert d'un tapis d'Escherichia coli.
L'incubation a été faite à 28°c pendant 10
jours. Ci-dessous, le tableau 1 résume l'ensemble des souches
utilisées dans ce présent travail ainsi que leurs origines.
Tableau 1: Souches bactériennes et amibiennes
utilisées lors de l'étude et leur origines
Souches des microorganismes Origines
Escherichia coli LBBM
Legionella pneumophila sérogroupe 1
LBBM
Souche Amibienne 1 (SA1) Rejets eaux
usées step de Marrakech
Souche Amibienne 2(SA2) Puits FSSM
Chapitre 2: Matériel et méthodes
I-3. Milieux et conditions de culture des
micro-organismes
I-3-1. Culture d'Escherichia coli
La purification et l'identification de la souche
bactérienne a été vérifiées avant toute
utilisation. La bactérie a été cultivée sur milieu
riche (Gélose nutritive) à 37°C pendant 24H. La composition
du milieu est motionnée en annexe2.
I-3-2. Culture des légionelles
Après le contrôle de purification, la souche de
Legionella pneumophila sérogroupe 1 a été
cultivée dans des erlenmeyers de 250 ml contenant 100 ml de milieu BYE
liquide. Le milieu inoculé a été ensuite incubé
sous agitation permanente de 150rpm à 37 °C dans un incubateur
agitateur. Le milieu BYE liquide a été préparé
selon la procédure mentionnée en (annexe 1). Il a
été stérilisé par filtration sur membrane de
porosité de 0,22 um puis complémenté par de la
L-cystéine (0,4 g/l final) et du pyrophosphate de fer (0,25g/l final)
préalablement stérilisés par filtration. La souche a
été également cultivée sur milieu
gélosé BCYE supplémenté en « glycine,
Vancomycine, Polymyxine B et. Cycloheximide ». Afin de confirmer la
pureté de la souche utilisée, la souche a été
ensemencée sur milieu sélectif avec cystéine et sur milieu
sélectif sans cystéine.
I-3-3. Culture d'amibes
+ Milieu non axénique
La culture des amibes sur milieu solide a été
réalisée sur la gélose non nutritive « NN-Agar »
composé seulement de 15 g/L d'agar puis recouvert d'un tapis
d'Escherichia coli (d'environ 2.109 à
3.109 bactéries/gélose). L'incubation a
été réalisée à une température de 28
°C pendent 10 jours.
+ Milieu axénique
Le passage en milieu liquide non axénique des souches
environnementales a été réalisé en déposant
un carré de gélose découpé au niveau d'un front de
migration d'une gélose NNA-coli dans une erlenmeyer contenant le milieu
SCGYEM( Chang et al,2007) ou PYG additionné d'un mélange
d'antibiotiques « ampicilline, Cycloheximide, l'acide nalidixique »
(annexes 2 et 3), le milieu est renouvelé chaque 5 jours. Après
croissance, les trophozoïtes ont été
transférés dans un nouveau milieu.
Etude de la relation entre des bactéries Legionella et
des amibes 10
Chapitre 2: Matériel et méthodes
I.4. Numération des micro-organismes
I-4-1. Dénombrement des légionelles + Par
densité optique
La concentration d'une suspension bactérienne peut
être estimée par spectrophotométrie à une longueur
d'onde de 600 nm. Comme l'ont signalé plusieurs travaux
antérieurs (Dupay, 2013), nous avons trouvé qu'à une
densité optique (DO) égale à 1 correspondait environ une
concentration de 109 bactéries/ml.
+ Par dénombrement des UFC sur milieu
gélosé
Le dénombrement des UFC sur milieux
gélosés est l'une des méthodes de référence
pour estimer le comptage des bactéries. Pour ce faire, un
échantillon de volume connu a été déposé sur
milieu gélosé, après incubation pendant 4 à 8 jours
à 37°C, le nombre de colonies a été
dénombré. Celui-ci correspond au nombre de bactéries
viables et cultivables présentes dans l'échantillon.
I-4-2. Dénombrement des amibes
La numération des amibes se réalise sur des
cellules de comptages Malassez. La cellule de comptage a été
remplie avec 10uL de suspension amibienne et observée au microscope au
grossissement de 40x et 100X. La cellule de Malassez se compose d'une grille de
10 carrés et le volume d'un carré est équivalant à
0,1 ul. Le comptage a été effectué pour les 10
carrés différents, leur moyenne a permis de définir la
concentration des amibes.
I-4. Les cultures témoins
I-5-1. Témoins amibes
Un contrôle positif a été
réalisé en introduisant dans un tube à essai 3 ml d'une
suspension amibienne (6.104 amibes/ml) de chaque souche amibienne
avec 0,5 ml d'une suspension d'Escherichia coli 105 et /ou
106 UFC/ml pour avoir les ratios 0,1 et 10 respectivement. Cette
culture a été incubée à 28°C pendant 10
jours.
I-5-2. Témoins légionelles.
Un contrôle de capacité de croissance des
légionelles a été réalisé en introduisant
dans un tube à essai 0,5 ml d'une suspension bactérienne de
Legionella pneumophila (105 et /ou 106
bactéries /ml) selon le ratio, avec 3 ml de tampon d'amibes. Cette
culture a été incubée à 37°C pendant 10
jours.
Etude de la relation entre des bactéries Legionella et
des amibes 11
Chapitre 2: Matériel et méthodes
I-6. Étude cinétique des
co-cultures
I-6-1. Pouvoir incubateur des amibes.
Les co-cultures ont été réalisées
en introduisant dans des tubes de culture cellulaire 3 ml de suspension de
6.104 amibes/ml en tampon Amibe supplémentée avec 10%
de milieu SCGYEM ou PYG, afin d'éviter l'enkystement des amibes. Un
volume de 180 ul d'une suspension bactérienne de 105
bactéries/ml est ajouté pour avoir un ratio de 0,1 et un volume
de
1,8 ml d'une suspension bactérienne à
106 bactéries/ml afin d'obtenir un
(rapport
bactéries/amibes) de 10. Les tubes ont été incubés
pendant 24 à 48 heures à une température de 28°C,
pour obtenir des légionelles intra amibiennes et de 72h pour obtenir des
légionelles post amibiennes. Les co-cultures sont suivies pendant au
moins 3 jours après l'infestation bactérienne. À chaque
intervalle de temps, un tube a été prélevé et
examiné à la fois du point de vue amibien et bactérien
après une agitation vigoureuse au vortex afin de détacher les
amibes des parois.
Pour chaque tube examiné, la numération des
amibes s'effectue directement sur cellule de Malassez. Après vortex
pendant 1 min pour favoriser la lyse des amibes, le dénombrement des
légionelles totales a été effectué par
étalement direct sur milieu de culture BCYE solide en triplicata
à raison de 100ul par boîte. Les boîtes sont alors mises en
incubation à 37°C pendant 6 jours au minimum. Une première
lecture a été réalisée le 4eme jour et
une deuxième lecture a été réalisé le
6eme jour pour confirmer les résultats.
Le nombre des bactéries de Legionella pneumophila
est exprimé en UFC/ml en tenant compte du facteur de dilution et en
supposant que chaque colonie correspond à une bactérie
initialement présente dans la suspension diluée. Pour chaque
souche amibienne, la courbe de croissance de Legionella pneumophila
est représentée en fonction du temps et correspond à
la moyenne de N-essais indépendants avec l'écart-type
correspondant.
I-6-2. Cytotoxicité de L. pneumophila
vis-à-vis des amibes
Des co-cultures des souches amibiennes ont également
été réalisés dans des tubes de culture cellulaire
contenant 3 ml d'une suspension de 6.104 amibes/tube,
infestées avec un ratio (bactéries/amibes) de 0,1 et 10, afin
d'évaluer quantitativement l'effet cytopathogène de la
bactérie vis-à-vis de l'amibe. La cytotoxicité a
été également déterminée au bout de 24 ; 48
et de 72 heures de co-culture par un test d'exclusion au bleu de
méthylène sur les souches amibiennes.
Etude de la relation entre des bactéries Legionella et
des amibes 12
Chapitre 2: Matériel et méthodes
Les amibes sont récupérées par
centrifugation douce des tubes de co-cultures, puis re-suspendues dans 200 uL
de milieu PYG ou SCGYEM avant d'être mélangées avec le bleu
de méthylène selon un ratio de 1/4. Les cellules sont
examinées à l'hématimètre et en déterminant
pour chaque souche amibienne le pourcentage de cellules apparaissant
colorées en bleu.
I-7. Étude de l'état viable non
cultivable de Legionella pneumophila
Pour comparer l'effet de la température sur la souche
bactérienne de Legionella pneumophila sérogroupe1, nous
avons appliqué des traitements de 1 heure et une gamme de
températures correspondant à 50 ; 54 ; 58 et 62°C.
Après le choc thermique les cellules ont été
placées plusieurs jours à 25°C dans un milieu pauvre en
nutriments constitué de BYE dilué au millième
appelé milieu de repos. L'étude de la viabilité des
échantillons traités et non traités, a été
effectuée par test de cultivabilité sur milieu de culture
solide.
I-7-1. Traitement thermique
Les bactéries en phase stationnaire (5 jours, bouillon
BYE) ont été collectées par centrifugation, lavées
deux fois avec de l'eau distillée stérile puis remis en
suspension dans de l'eau distillée stérile de façon
à obtenir une suspension ayant une DO600nm de 1 correspond
environ à une concentration de 109 bactéries/ml. 40 ml
de cette suspension sont ensuite incubées pendant 1 heure, sous
agitation, dans des bains-marie à des températures comprises
entre 50 et 62°C. Après traitement, les cellules sont
récupérées par centrifugation (5 000 trm, 10 min,
4°C),
remises en suspension dans le milieu BYE dilué aux
1000eme puis incubées à
25°C pendant plusieurs
jours. L'impact du traitement thermique et la survie des légionelles
sont estimés par observation de la cultivabilité sur milieu BCYE
solide.
I-7-2. Étude de la viabilité des cellules
+ Dénombrement des bactéries non
cultivables
100 ul de chaque suspension bactérienne traitée
diluée ont été étalés sur la gélose
BCYE en duplicata. La souche a été ensuite incubée
à 37°C dans l'étuve et les colonies formées sont
comptées après 4 à 10 jours.
Etude de la relation entre des bactéries Legionella et
des amibes 13
Chapitre 2: Matériel et méthodes
+ Infection des souches amibiennes
Afin de déterminer si les bactéries viables non
cultivables sont capables de retrouver leur cultivabilité, nous avons
décidé d'infecter les amibes. Pour cela, 0,5 ml de suspension
bactérienne de Legionella pneumophila à une
concentration de l'ordre de 108 bactéries /ml traitées
par la chaleur et non cultivables, ont été mises en
présence de 3 ml de suspension d'amibes (souche 2) à une
concentration de 8.104 amibes/ml dans des tubes de culture
cellulaire. 0,4 ml de la suspension de Legionella pneumophila sont mis
en présence de 3 ml de suspension d'amibes (souche 1) à
6.104 amibes/ml. Ces concentrations ont été choisies
de façon à avoir un MOI de 200. Les co-culture sont ensuite
incubées à 37°C pendant 3 jours. Un contrôle positif a
été réalisé en incubant 50 ul d'une suspension de
légionelles viables et cultivables à
108 UFC/ml avec 3 ml de suspension d'amibes
à 6.105 amibes/ml et/ou à
8.105
amibes/ml selon les souches. Cette culture a été incubée
de la même façon que les tests précédents.
Après incubation, 500 ul des co-culture sont centrifugées pendant
5 min à 12000g puis vortex pendant 1 min pour favoriser la lyse des
amibes. 100 ul de cette suspension est étalée sur milieu BCYE en
duplicata, puis incubée à 37°C pendant 6 à 10
jours.
I-8. Analyses statistiques
Dans notre étude, nous avons testé le pouvoir
incubateur de deux souches amibiennes à permettre la
prolifération d'une souche de Legionella pneumophila
sérogroupe 1. Afin de déterminer qu'il est le facteur qui a
influencé la vitesse spécifique de croissance de L.
pneumophila, une étude statistique de l'ANOVA a été
élaborée par le programme « SPSS 10.0» afin
d'étudier l'effet de la souche ; le MOI et l'effet conjoint des deux. De
même, pour comparer l'effet d'une co-culture après un traitement
thermique à différents degrés sur le maintien et la
récupération de la cultivabilité de la souche
Legionella pneumophila sérogroupe 1, un test de
corrélation a été effectué.
Etude de la relation entre des bactéries Legionella et
des amibes 14
Etude de la relation entre des bactéries Legionella et
des amibes 15
Chapitre 3: Résultats et discussions
RÉSULTATS
I-1. Validation de l'isolement des souches amibiennes
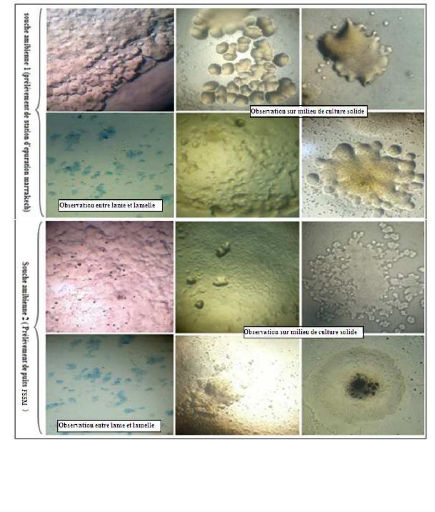
Figure 3: Photos des souches amibiennes isolées
dans différents types de cultures
Les amibes ont été isolées sur la
gélose non nutritive « NN-Agar »,les amibes ont
été collectées en grattant la surface des géloses
puis repiquées dans le milieu axénique PYG, une première
observation microscopique a été effectuée sur les amibes
du milieu gélosé puis une deuxième sur milieu liquide. Les
résultats de validation des isolements sont montrés dans les
photos ci-dessous.
Etude de la relation entre des bactéries Legionella et
des amibes 16
Chapitre 3: Résultats et discussions
I-2. Multiplication intra-amibienne de Legionella
pneumophila
L'objectif des co-cultures était de tester la
permissivité des amibes à L. pneumophila.
Parallèlement, il s'agissait de tester l'influence du rapport de
multiplicité d'infection sur la prolifération intra-amibienne de
L. pneumophila.
I-2-1. Témoins légionelles
La figure 4 représente le suivi des concentrations de
L. pneumophila sérogroupe 1 seule à une
température 28°C et aux concentrations initiales de 105
UFC/ml et 106UFC/ml. Ces concentrations correspondent aux
concentrations initiales en Legionella introduites pour les
co-cultures lors de nos essais, ce sont les concentrations en Legionella
qui ont été ajustées pour faire varier la MOI. Ces
témoins de L. pneumophila seule montrent une diminution des
concentrations bactériennes après 3 jours d'incubation dans le
milieu de co-culture composé de tampon amibe, en passent de « log 5
à log 3,63 » pour le MOI 0,1 et de « log 6 à log 5
» pour MOI 10. La bactérie n'est plus donc capable de
proliférer dans ce milieu. En revanche, elle ne conserve pas sa
cultivabilité pendant au moins 72 heures quelque soit le MOI.
Log UFC
MOI 0,1
MOI 10
Jours
J0 J1 J2 J3
Figure 4: Suivi de la cultivabilité de L. p
dans le milieu de co-culture aux MOI 0,1 et 10.
Etude de la relation entre des bactéries Legionella et
des amibes 17
Chapitre 3: Résultats et discussions
I-2-2. Témoins amibes
La figure 5, montre l'évolution des souches amibiennes
pendant 3 jours d'incubation en présence d'une concentration
d'Escherichia coli de 106 UFC/ml à 28 °C dans
le milieu de co-culture composé de tampon amibe
supplémenté de 10% de milieu PYG. La croissance des amibes est
exponentielle durant les premières 24 heures, pour les deux souches,
avec un nombre d'amibes/ml de 8,20.104 pour la souche-A1, et de
7,20.104 pour la souche-A2. Après 24h de co-culture, la
croissance des amibes entame la phase stationnaire. Toutefois, la vitesse de
croissance est variable d'une souche à l'autre en fonction de la
capacité prédatrice de chaque souche.
Amibes/ml
|
9,00E+04
|
|
|
|
|
8,00E+04
7,00E+04
6,00E+04
|
|
|
5,00E+04
|
|
|
|
|
4,00E+04 3,00E+04
|
|
|
|
|
|
|
|
|
|
|
|
|
T-SA1 T-SA2
Jours
J 0 J1 J2 J3
Figure 5: Croissance des souches amibiennes (MOI 10) dans
le milieu de co-culture I-2-3. Permissivité des souches d'amibes aux
L. pneumophila
Afin de tester la permissivité des souches amibiennes,
les co-cultures ont été réalisées à des
ratios de 0,1 et 10. Les figures 6 et 7 montrent que les deux souches
testées permettent la prolifération de Legionella
pneumophila. Néanmoins, nous n'avons pas observé de
différences entre les deux souches. Il semble que les deux souches
amibiennes se sont montrées permissives à la souche de
L.pneumophila qui atteint environ « 8,676 unités log (UFC)
» en co-culture avec la SA1 et « 8,783 unités log(UFC) »
en co-culture avec la deuxième souche amibienne après 48h au
ratio de 10. Le constat est identique pour les co-cultures
réalisées à un MOI 0,1. Par ailleurs, la vitesse de
croissance observée entre les deux souches ne montre pas de
différence statistiquement significative. D'une manière
générale, nous avons noté que les souches d'amibes
testées sont permissives à Legionella pneumophila.
Etude de la relation entre des bactéries Legionella et
des amibes 18
Chapitre 3: Résultats et discussions
|
Log UFC
|
MOI 0,1
|
|
8
7
6
5
|
|
LP SA1
LP SA2
|
|
4
3
|
Jours
|
J0 J1 J2 J3
Figure 6: Prolifération L.p en
Co-culture avec les deux souches à la MOI 0,1
durant 72H
d'incubation
|
Log UFC
|
MOI 10
|
|
10
9
8
7
6
5
4
|
|
LP SA1
LP SA2
Jours
|
J0 J1 J2 J3
Figure 7: Prolifération de L.p en
Co-culture avec les deux souches à la MOI 10
durant 72H
d'incubation
Les résultats indiqués dans les figures 8 et 9
ont montré que Legionella pneumophila a induit une inhibition
de la croissance des souches amibiennes. Elle est différemment
affectée en fonction de la souche amibienne et du ratio
(bactéries/amibes). Pour le MOI (0,1), nous avons observé que la
souche 1 est plus sensible à la cytopathogènicité de
Legionella pneumophila avec environ (1,8.104 amibes /ml
à 48h) par rapport à la souche 2 avec environ (2,4.104
amibes/ml). Inversement au la MOI de 10 où la souche 1 qui est la plus
résistante (4,4.104 amibes/ml) par rapport a
(3,2.104 amibes/ml) pour la souche 2 à 24h. Donc le
comportement des souches vis-à-vis de la résistance à
l'effet cytopathogène varie en fonction du ratio. L'analyse statistique
de la variance selon le test de Duncan, montre la présence
Etude de la relation entre des bactéries Legionella et
des amibes 19
Chapitre 3: Résultats et discussions
d'une différence significative entre les témoins
et les souches à différents ratios avec (p < 0,05), et une
différence significatif (p<0,05) à l'intérieur de la
SA2 entre les ratios 0,1et 10. Par contre entre la SA1 et la SA2 il n'y a pas
de différence ( p>0,05). Aussi bien, à l'intérieur de
la souche amibienne 1, le test a montré une différence non
significatif (p>0,05). Ces résultats sont une preuve que la
présence de la souche amibienne est essentielle à la
prolifération de L. pneumophila.
|
Amibes/ml
|
MOI 10
|
|
8,0E+04 6,0E+04 4,0E+04 2,0E+04
|
|
SA1
SA2
|
|
0,0E+00
|
|
|
Jours
|
|
|
|
|
J 0 J1 J2 J3
Figure 8: Inhibition de la croissance des amibes sur 72
h de co-culture par L.p a un MOI de 10
|
Amibes/ml
|
MOI 0,1
|
|
8,0E+04 6,0E+04 4,0E+04 2,0E+04 0,0E+00
|
|
SA1
SA2
Jours
|
|
J 0 J1 J2 J3
|
Figure 9: Inhibition de la croissance des amibes sur 72
h de co-culture par L.p a un MOI de 0,1
Etude de la relation entre des bactéries Legionella et
des amibes 20
Chapitre 3: Résultats et discussions
I-2-1. Cytotoxicité de L.pneumophila
vis-à-vis des souches amibiennes
Afin d'étudier l'effet cytopathogène de
L.pneumophila, deux ratios ont été utilisés pour
les co-cultures. Les résultats obtenus nous ont permis d'observer un
taux de cytotoxicité important vis-à-vis des deux souches. Pour
le ratio de 0,1 à J1 (24 h) Legionella pneumophila a induit un
taux de mortalité d'amibes de l'ordre de 36% pour la souche SA1 et de
19% pour la souche SA2. Alors que pour le ratio de 10, nous avons trouvé
62% pour la souche SA1 et de 22 % pour la souche SA2. À J2 (48 h), le
nombre de trophozoïtes continue à diminuer jusqu'à la
moitié 50% pour la SA1 et jusqu'à 28% pour la souche SA2 au ratio
de 0,1. La diminution est de 70% pour SA1 et 40% pour SA2 au MOI de 10. La
confirmation de la mortalité des trophozoïtes est constatée
par un nombre de trophozoïtes dénombré à J3(72 h)
dans lequel nous observons une inhibition cytotoxique des amibes par
Legionella pneumophila qui atteint 68% et 48% pour la SA1 et SA2
respectivement au ratio de 0,1 et un taux d'inhibition de 72% et 62% pour la
souche SA1 et SA2 respectivement au ratio de 10. Donc, le rapport de
multiplicité d'infection à jouer le rôle de facteur
discriminant dans la mortalité des amibes, que ça soit pour la
souche amibienne 1 ou 2 avec une différence (résistance) de la
souches SA2 par rapport à la souche SA1.
|
% cellules vivantes
|
MOI 0,1
|
|
100% 90% 80% 70% 60% 50% 40% 30% 20% 10%
0%
|
|
|
|
|
24h
48h
72h
|
|
SA1 SA2
|
Souches
|
Figure 10:Taux de trophozoïtes vivants
après 72h de co-culture avec L.p MOI 0,1
Etude de la relation entre des bactéries Legionella et
des amibes 21
Chapitre 3: Résultats et discussions
% cellules
vivantes MOI 10
|
100% 90% 80% 70% 60% 50% 40% 30% 20% 10% 0%
|
|
|
|
|
24h
48h
72h
|
|
SA1 SA2
|
Souches
|
Figure 11: Taux de trophozoïtes vivants après
72h de co-culture avec L.p MOI 10 I-2-2. Affinité de
L.pneumophila pour le substrat (amibes)
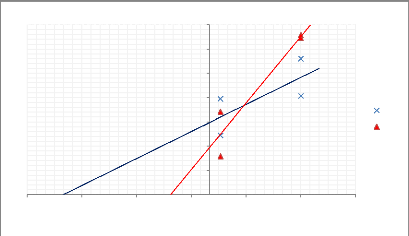
Afin de calculer la constante d'affinité KS, la
linéarisation de Lineweaver et Burke, fondée sur le modèle
cinétique de Michaelis-Menten a été
élaborée. Elle permet d'approcher des valeurs des constantes de
croissance par l'équation :y = x/S + 1/u Où « S » est
la concentration en substrat (densité amibienne) et « 1/u »
est l'inverse de la vitesse de croissance.
-1,00E+00 -7,00E-01 -4,00E-01 -1,00E-01 2,00E-01 5,00E-01
8,00E-01
1/S ( amibe/bactérie)
1/u
20
40
30
50
60
10
70
0
y = 91,39x + 19,44 R2 =
0,906
y = 37,15x + 29,70
R2 = 0,537
SA1
SA2
Figure 12: La relation entre la vitesse spécifique
de croissance (u) de Legionella pneumophilla et du ratio initial
(bactéries/amibes)
Chapitre 3: Résultats et discussions
Dans ce cas, l'intersection entre la droite et l'axe des
ordonnées correspond à la valeur 1/pmax, alors que
l'intersection entre la droite et l'axe des abscisses correspond à la
valeur - 1/KS. KS est la constante d'affinité pour le substrat, en
d'autres termes il correspond au nombre d'amibes initiales nécessaires
pour que la bactérie Legionella pneumophila puisse
croître à une vitesse égale à la moitié de sa
vitesse maximale de croissance, pmax étant la valeur maximale
théorique de p pouvant être atteinte. Le tableau
ci-dessous résume l'ensemble des paramètres calculés.
Tableau 2: Valeurs de KS (bactéries/amibe) et umax
(h-1) à partir de la linéarisation
(-1/ks) 1/umax KS (bactéries/amibe) umax (h-1)
G=ln2/u R2
|
SA1
|
-7,80E-01
|
29,5
|
1,2821
|
0,034
|
20,38
|
0,537
|
|
SA2
|
-2,10E-01
|
19,5
|
4,7619
|
0,051
|
13,59
|
0,906
|
La valeur de KS calculée est plus faible pour l'essai
avec la souche amibienne SA1 que pour la souche amibienne SA2. En particulier,
Legionella pneumophila semble donc avoir besoin d'une plus grande
quantité d'amibe de la souche amibienne SA1 par rapport à la
souche amibienne SA2 pour assurer une croissance rapide. Le fait que la valeur
de KS obtenue ici soit plus élevée pour Legionella
pneumophila vis-à-vis de la SA2 viendrait étayer que la
souche amibienne SA2 peut rapidement augmenter son activité
prédatrice. Cependant, cette observation n'est valable que si les
conditions (température ; souches), plus spécifiquement la
quantité de substrat (amibes) disponible, sont favorables. Les valeurs
de pmax sont corrélées aux valeurs de KS. En effet, la
vitesse spécifique de croissance maximale la plus élevée
correspond au KS le plus grand. Les temps de génération
correspondants sont de 20,38 heures pour Legionella pneumophila en
co-culture avec la souche amibienne SA1,et 13,59 heures en co-culture avec la
souche amibienne SA2. Ces données devront être
complétées par d'autres études. En effet, les
données de départ sont insuffisantes pour l'application du
modèle de Michaelis-Menten ou ce modèle ne peut pas s'appliquer
à la cinétique d'absorption de bactéries par les
amibes.
Etude de la relation entre des bactéries Legionella et
des amibes 22
Etude de la relation entre des bactéries Legionella et
des amibes 23
Chapitre 3: Résultats et discussions
I-3. Impact du traitement thermique sur Legionella
pneumophila
L'objectif de nos travaux, est de chercher la capacité
des bactéries viables non cultivables à se revivifier suite au
passage dans les amibes après un traitement thermique
préliminaire (Figure 13).
|
5,90 5,80 5,70 5,60 5,50
|
|
Témoin
|
|
|
Log ufc/ml
|
|
|
5,40
|
|
|
|
|
5,30
5,20
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T °c
0 c° 50 c° 54 c° 58 c° 62 c°
Figure 13: Impact du traitement thermique sur la
cultivabilité de Legionella pneumophila
.
La figure 13 présente l'évolution du nombre de
bactéries cultivables/ml en fonction du choc thermique appliqué.
Pour les suspensions témoins (sans traitement thermique) la
concentration bactérienne était de 6,53.105 cellules cultivables/
ml. Après le choc thermique nous observons que le nombre de
bactéries cultivables diminue (0,36 unités log environ) suite
à un traitement de 1 h à 62°C. Plus la température
augmente, plus le nombre de cellules cultivables diminue sans qu'il atteigne le
zéro UFC/ml, donc nous ne pouvons pas déterminer la
température moyenne d'inhibition, (TMI) « c'est-à-dire la
température minimale pour laquelle nous n'observons pas de
bactéries cultivables ». Ceci pourrait laisser supposer que les
bactéries à l'état VBNC sont plus résistantes aux
stress environnementaux et spécifiquement la température, ce qui
a déjà été suggéré par Chang et al,
2007.
Etude de la relation entre des bactéries Legionella et
des amibes 24
Chapitre 3: Résultats et discussions
0 c° 50 c° 54 c° 58 c° 62
c°
Log ufc/ml
6,10
6,00 5,90 5,80 5,70 5,60 5,50 5,40
5,30
Figure 14: L'état viable non cultivable de L.
p après co-culture avec les amibes
En ce qui concerne la capacité des bactéries
viables non cultivables à se revivifier suite à une
prolifération intra-amibienne, nous pouvons observer qu'après
infection, les bactéries récupèrent leur
cultivabilité que ça soit pour la souche amibienne SA1 dont la
concentration bactérienne a augmenté à environ 8,13.105
cellules cultivables/ ml pour les bactéries sans traitement avec une
augmentation de (0,1 unités log environ), ou pour la souche amibienne
SA2 qu'après l'incubation des légionelles à
l'intérieur d'elle n'arrivent qu'à une concentration de 7,47.105,
ce qui fait une augmentation de (0,06 unités log environ). Aussi, pour
les bactéries traitées pendant 1 h à 62°C et
incubées par la SA1 une augmentation de concentration d'environ (0,06
unités log) correspond à 3,28.105 par rapport au
témoin qui était de 2,87.105. Par contre les
concentration bactéries, incubées par la SA2 leur concentration
augmente faiblement et atteint un nombre de 2,98.105 cellules cultivables/ ml (
environ 0,02 unités log) sur la courbe d'évolution. Donc
d'après ces résultats on peut dire que nos souches amibiennes
permettent à la Legionella pneumophilla sérogroupe 1 de
retrouver sa cultivabilité après une incubation en co-culture.
L'analyse statistique de corrélation a montré une
différence très hautement significative (p<0,01) entre les
résultats témoin (avant co-culture) et les résultats
obtenus après une co-culture avec la SA1 et la SA2. Donc les
résultats témoin et (R-SA1 ; R-SA2) sont corrélées,
ainsi l'analyse a montré une corrélation entre les
résultats de la souche amibienne 1 et celles de la souche amibienne 2
avec (p<0,01).
Etude de la relation entre des bactéries Legionella et
des amibes 25
Chapitre 3: Résultats et discussions
DISCUSSION
Notre étude s'est intéressée à la
problématique Legionella et notamment à la relation
amibes-légionelles. En effet, dans la littérature 3 genres
amibiens (Acanthamoeba, Naegleria et Hartmannella) permettent la
prolifération de Legionella sont les plus décrites
(Declerck et al, 2007). Pour étudier la problématique dans notre
écosystème, deux souches amibiennes ont été
isolées. Les essais, portant sur les co-cultures, ont montré que
les 2 souches d'amibes testées sont perméables à L.
pneumophila. Dans un premier temps, nous avons cherché à
déterminer la capacité de ces 2 souches amibiennes issues de
différents endroits à permettre la prolifération d'une
souche de L. pneumophila. La souche amibienne est apparue comme un
facteur discriminant pour la prolifération de Legionella, ce
qui est en accord avec ce qui est décrit dans la littérature (Dey
et al, 2010). La souche amibienne SA1 apparaît comme la plus propice
à la multiplication de Legionella pneumophila. Cependant, la
comparaison des proliférations dans différents souches laisse
entrevoir une influence du genre (souche) sur la prolifération. Ce qui
est en accord avec la littérature (Dupuy et al, 2013).
Dans notre étude, nous n'avons pas observé de
différences significatives de prolifération entre les
différentes souches amibiennes. En effet, après 72 heures de
co-culture à la température de 28°C et pour une MOI de 0,1,
une multiplication d'environ 3,8 unités logarithmiques a
été observée dans les 2 souches. Malgré l'absence
de différences significatives, nous avons, tout de même, pu
observer une tendance à une prolifération de Legionella
plus importante dans la souche amibienne SA1. Au regard de nos
résultats, est vu l'absence de différence significative entre les
souches vis-à-vis de la MOI on peut dire que la prolifération de
Legionella est dépendante de la souche et non du ratio.
Ainsi, la souche de Legionella pneumophila
sérogroupe 1 a induit une diminution du nombre de trophozoïtes
due à l'effet cytotoxique. Cependant, après 3 jours de co-culture
au MOI de 10, nous avons observé une résistance de la souche
amibienne SA2 plus que la souche SA1. D'après Messi et al. (2013), la
virulence des souches de Legionella pourrait être liée
à leur capacité à proliférer au sein des amibes et
aussi à leur cyto-phatogénicité, c'est-à-dire
à leur capacité à lyser la cellule hôte.
D'après d'autres auteurs, les souches peu virulentes de Legionella
seraient moins aptes à se multiplier dans les amibes (Tyndall et
Domingue, 1982). Ainsi, au vue des résultats que nous avons obtenus,
nous pouvons dire que notre souche Legionella est plus virulente.
Chapitre 3: Résultats et discussions
Notre travail porté sur l'impact des traitements par la
chaleur sur la souche de Legionella pneumophila nous a permis
d'observer que ces traitements étaient capables de conduire à la
formation de bactérie viables non cultivables. Après une
co-culture de 72 h de Legionella pneumophila avec les deux souches
amibiennes, Legionella a pu retrouver leur cultivabilité. Ces
résultats correspondent à l'hypothèse selon laquelle les
bactéries à l'état VBNC sont potentiellement infectieuses
et virulentes pour les cellules hôtes. Ainsi, si ces bactéries
à l'état VBNC se retrouvent inhalées par l'Homme, on peut
envisager qu'elles puissent être responsables du développement de
la maladie chez celui-ci.
Au final, cette étude a montré la
capacité de Legionella à s'adapter à son
hôte amibien et à se proliférer au sein des amibes. Non
seulement, la présence des amibes permet une prolifération rapide
de Legionella mais la multiplication intracellulaire de Legionella
permet de diminuer la sensibilité de la bactérie aux
traitements (monochloramine, ozonation, etc..). La protection de Legionella
dans les amibes contre la désinfection est un
phénomène bien connu (Greub et Raoult, 2004).
Etude de la relation entre des bactéries Legionella et
des amibes 26
Etude de la relation entre des bactéries Legionella et
des amibes 27
Chapitre 3: Résultats et discussions
CONCLUSION ET PERSPECTIVES
L'objectif principal de ce stage de fin d'études
était d'une part, d'améliorer les connaissances sur les
associations des légionelles avec les amibes. D'autre part, c'est
d'apporter des éléments pour mieux évaluer leur
sensibilité au traitement par la température. Les deux souches
amibiennes testées ont montré une capacité d'incubation
vis-à-vis de la bactérie test. Ainsi, le taux de
cytotoxicité induit par Legionella pneumophila sur ces amibes a
démontré la faible résistance de la souche amibienne SA1
par rapport à la souche SA2. En effet, la souche de Legionella
pneumophila sérogroupe 1 s'est montrée capable de se
revivifier après un choc thermique. Donc le protocole utilisé
in vitro dans notre étude nous a permis d'obtenir des
résultats plus proches d'une réalité environnementale tout
en s'affranchissant des contraintes liées au maintien d'un
véritable biofilm. Ces résultats complètent les
données de la littérature est devraient permettre, en
particulier, d'identifier quelles amibes sont les plus susceptibles
d'héberger et de constituer un réservoir de légionelles.
Suite aux résultats obtenus, nous pouvons conclure que la croissance de
L. pneumophila dépend de la souche bactérienne en
elle-même et de la souche amibienne hôte.
Généralement, il est reconnu que les amibes libres jouent le
rôle des vecteurs grâce auxquels les légionelles se
prolifèrent et se propagent dans l'environnement. A ce jour, les
techniques utilisées pour lutter contre les légionelles font
appel à des traitements physiques (rayons UV, chocs thermiques) ou
à des traitements chimiques, ces derniers étant de loin les plus
utilisées. Néanmoins, ces traitements ne donnent pas
entière, satisfaction vue de la résistance acquise à
chaque fois par les légionelles et les amibes.
Cependant, de nombreuses recherches restent encore à
faire notamment sur l'identification des souches isolées et d'isoler
d'autres hôtes pouvant potentiellement héberger
Legionella. De plus, étudier le biofilm dans différents
réseaux d'eau permettrait de mieux connaître l'effet de
différents paramètres (composition de l'eau, vitesse
d'écoulement, température ...) sur la structure du biofilm et
d'améliorer ainsi les traitements anti-Legionella.
28
RÉFÉRENCES BIBLIOGRAPHIQUES
Adl, S. (2005). The newhigher level
classification of eukaryotes with emphasis on the taxonomy of protists.
J.Eukaryot.Microbiol.52:399-451.
Abu Kwaik, Y., Gao, L.Y., Stone, B.J., Venkataraman, C.,
and Harb, O.S. (1998). Invasion of protozoa by Legionella
pneumophila and its role in bacterial ecology and pathogenesis. Appl.
Environ.Microbiol.64: 3127-3133.
Borella, P., Guerrieri, E., Marchesi, I., and Messi,
P. (2005). Water ecology of Legionella and protozoan:
environmental and public health perspectives.
Biotechnol.Annu.Rev.11: 355-380.
BOUYER, S. (2008). Différenciation
d'Acanthamoeba castellanii et rôle dans l'interaction avec
Legionella pneumophila, thèse de doctorat. Université de
Poitiers, 10-48 p.
Bowers, B. &Korn, E. D. (1968). The fine
structure of Acanthamoeba castellanii.I. The trophozoïtes. J
Cell Biol.39: 95-111.
Chang, C.W., Hwang, Y.H., Cheng, W.Y., and Chang, C.P.
(2007). Effects of chlorination and heat disinfection on long-term
starved Legionella pneumophila in warm water.J Appl.Microbiol.
102: 1636-1644.
Costerton, J. W. (1999). Introduction to
biofilm. International Journal of Antimicrobial Agents. 11 :
217-221.
Dupuy,M. (2013). Association
légionelles amibes et traitements biocides pour les circuits de
refroidissement, thèse de doctorat. École doctorale : Sciences
pour l'environnement - Gay Lussac (La Rochelle), 11-61 p.
Dey, R. (2010). Étude comparée
de la prolifération de Legionella pneumophila dans
différents hôtes amibiens et de leursinter - relations :
implication potentielle de phospholipides amines, thèse de doctorat.
Université Claude Bernard Lyon1, 19-34 p.
Declerck, P., Behets, J., De Keersmaecker, B., and
Ollevier, F. (2007). Receptor-mediated uptake of Legionella
pneumophila by Acanthamoeba castellanii and Naegleria lovaniensis. J
Appl.Microbiol.103: 2697-2703.
Diederen, B.M. (2008). Legionella spp. and
Legionnaires' disease. J Infect. 56: 1-12.
Dey, R., Bodennec, J., Mameri, M.O., and Pernin, P.
(2009). Free-living freshwater amoebae differ in their susceptibility
to the pathogenic bacterium Legionella pneumophila. FEMS MicrobiolLett.
290: 10-17.
Dujardin, F. (1841). Histoire naturelle des
zoophytes. Infusoires.
Fields, B.S., Benson, R.F., and Besser, R.E. (2002).
Legionella and Legionnaires' disease: 25 years of investigation.
Clin.Microbiol. Rev .15: 506-526.
Fraser, D.W., Tsai, T.R., Shepard, C.C., and Brachman,
P.S. (1977). Legionnaires' disease: description of an epidemic of
pneumonia. N Engl J Med. 297: 1189-1197.
Fields, B.S. (1996). The molecular ecology of
legionellae. Trends. Microbiol. 4: 286-290.
Fliermans, C.B., Cherry, W.B., Orrison, L.H., Smith,
S.J., Tison, D.L., and Pope, D.H. (1981). Ecological distribution of
Legionella pneumophila. Appl. Environ.Microbiol.41:
9-16.
29
Greub, G. & Raoult, D. (2004).
Microorganisms resistant to free-living amoebae. Clin. Microbiol.
Rev.17: 413-433.
Glick, T. H.,(1978). Pontiac fever. An epidemic
of unknown etiology in a health department: I. Clinical and epidemiologic
aspects. Am J Epidemiol 107, 149-160.
Jarraud, S. (2007). Légionellose.
Presse. Med. 36: 279-287.
Kim, W. T., Kong, H. H., Ha, Y. R., Hong, Y. C., Yu, H.
S. & Chung, D. I. (2006). Comparison of
specific activity and cytopathic effects of purified 33 kDa
serine proteinase from
Acanthamoebastrains with different degree of
virulence. Korean J. Parasitol.44
: 321-330.
Leoni, E., Legnani, P. P., BucciSabattini, M. A.,
Righi, F. (2001). Prevalence of Legionella spp. in swiming
pool environment.Water Research.. 35: 3749-3753.
Messi, P., Bargellini, A., Anacarso, I., Marchesi, I.,
de Niederhausern, S., and Bondi, M. (2013). Protozoa and human
macrophages infection by Legionella pneumophila environmental strains belonging
to different serogroups. Arch .Microbiol. 195: 89-96.
McDade, J.E., Shepard, C.C., Fraser, D.W., Tsai, T.R.,
Redus, M.A., and Dowdle, W.R. (1977). Legionnaires' disease: isolation
of a bacterium and demonstration of its role in otherrespiratory disease. N
Engl J .Med . 297: 1197-1203.
Ohnishi, H., Mizunoe, Y., Takade, A., Tanaka, Y.,
Miyamoto, H., Harada M., Yoshida, S. I. (2004). Legionella
DumoffiiDjlA, a member of the DnaJ family, is required for intracellular
growth. Infection and Immunity.72: 3592-3603.
Ortiz-Roque, C.M., and Hazen, T.C. (1987).
Abundance and distribution of Legionellaceae in Puerto Rican waters.
Appl. Environ. Microbiol. 53: 2231-2236.
Pickup, Z.L., Pickup, R., and Parry, J.D. (2007b).
A comparison of the growth and starvation responses of
Acanthamoeba castellanii and Hartmannella vermiform is in the
presence of suspended and attached Escherichia coli K12.FEMS. Microbiol
.Ecol. 59: 556-563.
Parry, J.D. (2004). Protozoan grazing of
freshwater biofilms. AdvApplMicrobiol.54:167-196.
Steinert, M., Hentschel, U., and Hacker, J. (2002).
Legionella pneumophila: an aquatic microbe
goesastray.FEMS. Microbiol. Rev .26: 149-162.
Sutherland, I. (2001). Biofilm
exopolysaccharides: a strong and sticky framework. Microbiology
.147:3-9.
Swanson, M.S., and Hammer, B.K. (2000).
Legionella pneumophila pathogesesis: a fateful journey from
amoebae to macrophages. Annu .Rev .Microbiol. 54: 567-613.
Steinert, M., Emody., L., Amann., R. & Hacker, J.
(1997). Resuscitation of viable but nonculturable Legionella
pneumophila Philadelphia JR32 by Acanthamoeba castellanii. Appl.
Environ. Microbiol. 63: 2047-2053.
Tyndall, R.L., and Domingue, E.L. (1982).
Cocultivation of Legionella pneumophila and
free-livingamoebae. Appl Environ Microbiol. 44: 954-959.
Visvesvara G.S, Moura H, et Schuster F.L. (2007).
«Pathogenic and opportunistic free-living amoebae» FEMS
Immunol Med Microbiol. 50: 1-26
Winn, W.C., (1988). Legionnaires?disease :
historical perspective. Clin. Microbiol. 1(1) : 60-61.
30
ANNEXES
ANNEXE 1
Préparation des milieux de culture pour L.
pneumophila Milieu gélosé BCYE : Composition pour 1
litre :
Dissoudre dans 900 ml d'eau distillée:
· Extrait de levure 12 g
· Tampon ACES 10
· Charbon actif 2 g
· Alpha-cétoglutarate 1 g
· Hydroxyde de potassium 2,8 g
· Agar 15 g
Le pH est ajusté à 6.9 #177; 0,05 à l'aide
de solution de HCl 1 M ou de solution de KOH 1 M si nécessaire. Ensuite,
compléter le volume à 1 litre avec de l'eau distillée.
Stériliser à l'autoclave à 121°C pendant 15 min.
Lorsque le milieu est refroidi, il est ajouté stérilement :
· L-cystéine hydrochloride
· Pyrophosphate de fer
La L-cystéine est préparée à une
concentration de 80 g/L et le pyrophosphate de fer à 50 g/L à
l'aide d'eau distillée puis filtrés sur filtre seringue 0,2 um et
seront ajoutées au milieu en surfusion à 50°C lors de
l'utilisation à raison de 2,5 ml/500 ml de milieu.
Milieu liquide BYE
La composition pour 1 litre est la même que celle du
milieu gélosé sans charbon actif ni agar. Le milieu n'est pas
autoclavé mais stérilisé par filtration sur 0,22um..
ANNEXE 2
Milieu PYG liquide : Composition pour 1 litre:
Dissoudre dans 900 ml d'eau distillée:
· Protéose peptone 20 g
· Extrait de levure 1 g
· MgSO4 : 7H2O 0,4M 10 ml
· CaCl2 : 2H2O 0,05M 8 ml
· Citrate de sodium 1 g
· Na2HPO4 : 2H2O 0,25M 10 ml
· KH2PO4 0,25M 10 ml
Le pH est ajusté à 6,5 avec une solution de HCl 1N
ou de NaOH 1N puis le milieu est autoclavé à 120°C pendant
20 min. Lorsque le milieu est refroidi, il est ajouté stérilement
:
- (NH4)2FeII(SO4)2 : 6H2O 5mM stérile (filtré sur
0,22um) 10 ml - Glucose 2M stérile 50 ml
Préparation du tampon amibes pour 1 L :
La préparation est la même que pour le milieu PYG mais sans
peptone, extrait de levure ni glucose.
Milieu riche pour Escherichia coui (
Gélose nutritive ) :
Composition pour 1 litre: Dissoudre dans 900 ml d'eau
distillée: 20 grammes de gélose nutritive, et 5 grammes d'agar, 3
grammes NaCl. Ajusté avec de l'eau distillée jusqu'à 1
litre. Le milieu ensuite est autoclavé a 121°C pendent 15 min.
31
32
ANNEXE 3
Milieu Chang (SCGYEM) liquide : Composition
pour 1 litre
Dissoudre dans 900 ml d'eau distillée:
· 12,5 g de caséine hydrolysée à
l'acide
· 6,25 g d'extrait de levure
· 1 g de KH2PO4
· 1,65 g de Na2HPO4
·2H2O
· 3,1 g de glucose anhydre 99%
Le milieu est autoclavé à 121°C pendant 20
minutes. Le milieu peut être conservé 3 mois à
température ambiante.
Le tampon est préparé de la manière
suivante : pour 1 L, ajouter à 1 L d'eau distillée:
· 1 g de KH2PO4 (Sigma-Aldrich, P-0662),
· 1,65 g de Na2HPO4
·2H2O (Sigma-Aldrich,
N-0876).
De la même manière, le tampon est autoclavé
pendant 20 minutes à 121°C. Le tampon se conserve également
pendant 3 mois à température ambiante.
Préparation de milieux de culture
gélosée LB pour Escherichia coui Composition
pour 1 litre :
· Bactotryptone 10 g
· Extrait de levure 5 g
· Chlorure de sodium 10 g
· Agar 15 g
· Eau distillée q.s.p 1 L
Le milieu est ensuite stérilisé 15 min à
121°C.
| 


