|
Juillet 2016
UNIVERSITE DE LUBUMBASHI
FACULTE DES SCIENCES AGRONOMIQUES
Département
de Phytotechnie
Unité de Recherche en Ecologie, Restauration
Ecologique et Paysage
BP :1825/Lubumbashi

Mesure de la tolérance au cuivre de sept
espèces graminoïdes des affleurements de l'arc cuprifère du
Sud-Est de la République Démocratique du Congo
Par NGOYI NSOMUE Adolphe
Mémoire présenté et défendu en
vue d'obtention du grade d'Ingénieur Agronome


UNIVERSITE DE LUBUMBASHI
FACULTE DES SCIENCES AGRONOMIQUES Département de
Phytotechnie
Unité de Recherche en Ecologie, Restauration
écologique et paysage
BP:1825/Lubumbashi
Mesure de la tolérance au cuivre de sept
espèces graminoïdes des affleurements de l'arc cuprifère du
Sud-Est de la République Démocratique du Congo
Par NGOYI NSOMUE Adolphe
Mémoire présenté et défendu en
vue d'obtention du grade d'Ingénieur Agronome
Défendue le 26 Juillet 2016 devant le jury
composé de :
Michel Mazinga Kwey, Professeur, Université de Lubumbashi
Président du jury
Emery Kasongo Mukozo, Professeur, Université de Lubumbashi
Membre effectif
Edouard Ilunga wa Ilunga, Professeur, Université de
Lubumbashi Directeur
Yannick Useni Sunkuzani, Chef des travaux, Université de
Lubumbashi Secrétaire du jury
Delhaye Guillaume, Assistant, Université Libre de
Bruxelles Co-directeur
II
Epigraphe
« La colonisation végétale
des sols riches en métaux lourds est la condition préalable
à la mise en place d'un phytotraitement »
(Pascale HENNER, 2000)
III
Ngoyi Nsomwe Adolphe
Dédicace
A mes parents, papa Nicolas Nsomwe et maman Thereuse Ngama,
vous qui avez ouvert le chemin de ma vie sur terre et ont sacrifié les
moyens financiers pour que je sois éduqué et instruit, que le
Dieu tout puissant se souvienne de vous et qu'il vous donne une grande
longévité. Je vous aime bien.
A mes frères et soeurs : Nathalie Nsomwe, Willy Nsomwe,
Mamie Nsomwe, Michou Nsomwe, Bienvenu Nsomwe.
A mes cousins et cousines : Francine Nyongani, Alain Kasongo,
Neil Djo Ngoy, Bel Mondo Mutwale, Christoph Kalwa, Jeef Ngyefu, Bea, Ngoy Yaya,
Bavon Kasongo, Etienne Kibambe, Samuel Mukonkole, Derio Mulenda, Muyunga
Mungos, Cédric Lumami, pour votre amour, affection et pour tous les
sacrifices consentis pour mon bien être.
Aux oncles et tantes : Ngoy Fula Bantu, Mukonkole Bwanga
Jean-Marie, Musongiela Johny, Lumami Marcel, Eyambo Dyakitela Sylvain, Nyongani
Alphonsine, Kitengye Jacqueline, Lwengye Danny, c'est grâce à vos
sacrifices que nous sommes parvenus jusqu'à ce niveau.
A vous mes amis Saddam Kingombe, Angel Kibundulu, Malie Ngolo,
Chantal Mujinga pour les conseils, sacrifices, soutient moral et spirituel.
IV
Remerciement
Ce travail que nous vous présentons ce jour est le
fruit de fin d'études en Sciences Agronomiques, lequel reste une
conjugaison des efforts de plusieurs personnes. Ainsi, il nous est
agréable un devoir de pouvoir exprimer notre gratitude à toutes
les personnes qui ont contribué d'une manière ou d'une autre
à la réalisation de ce mémoire.
Je remercie d'une manière exceptionnelle le Professeur
Docteur Ingénieur Ilunga wa Ilunga Edouard, pour m'avoir
réservé un accueil chaleureux et daigné diriger ce
mémoire, en dépit de son calendrier très chargé.
Son expérience et ses conseils, m'ont été
bénéfiques ; ainsi je lui exprime toute ma gratitude et
reconnaissance.
Je tiens à remercier également l'Assistant
Master Guillaume Delhaye de l'Université Libre de Bruxelles, qui
malgré ses multiples occupations a voulu aussi accepter de m'encadrer.
En effet, j'ai été marqué par ses
générosités méthodes de travail toujours efficaces,
son organisation et ses précieux conseils.
Je dis merci au Doyen de la Faculté des Sciences
Agronomiques ; le Professeur Docteur Ingénieur Ngoy Shuctha Mylor et au
vice-Doyen chargé de recherche Professeur Docteur Ingénieur
Mujinya Bazirake Basile pour m'avoir accordé l'accès au
laboratoire en s'appropriant les matériels du laboratoire.
Je tiens à remercier toutes les autorités
académiques et le corps professoral de la Faculté des Sciences
Agronomiques en général pour avoir assuré notre formation
universitaire.
J'exprime ma gratitude : au Chef des Travaux Yanick Useni,
Master Patrick Kasangij, aux assistants Guy David Sebangezi, Magnifique
Chuimika, Messi Nkulu, pour les échanges et les conseils.
Je n'oublie pas les laboratins du laboratoire
Agro-pédologique de la Faculté des sciences Agronomiques, plus
particulièrement à Monsieur Tresor Kisimba, pour leur
hospitalité et leur assistance pendant nos travaux de laboratoire
liés à cette étude.
Je tiens à remercier mes très chers grands amis
Laurent Kidinda Kidinda, John Banza Mukalay, Cédric Ntemunyi Ntata, pour
m'avoir tenu une main forte dans la réalisation de ce mémoire.
Je tiens à remercier également mes charmants
amis Ruffin Nkulu, Kumwimba bob, Eddy Mwilambwe, Bienvenu Esoma, Kalamukie
Mvwama Missete, Marie Kiete, Arnold Lukambil, Jules Kimbeni, pour leurs
générosités marquées durant mon parcours
académique ;
Ngoyi Nsomwe Adolphe.
V
J'adresse mes sincères remerciements à mon cher
ami et compagnon de lutte Héritier Kasongo Kayuma, pour avoir
passé le bon moment ensemble au cours de l'expérimentation du
présent travail.
Je tiens à remercier mes collègues
Lauréats de la promotion 2015-2016 : Byaombe Samuel, Ilunga
Arsène, Rosalie Ngelengele, Kabwiz Jeanine, Mutombo Djo, Mutonkole
Getta, Tshomba Axel,
Kitenge Joseph, Munganguzi Tresor, Ngoy Hardy, Kitengye Fabien
Je remercie mes chers amis avec qui, je passais ma vie
estudiantine au campus Patient Kanka, Rams, Youssouf Kabwe, Jackson Mayobo.
VI
Résumé
Les affleurements cuprifères sont des
écosystèmes prépondérants affectant les
communautés végétales. La flore colonisant ces milieux
développe des mécanismes de tolérance au métaux
afin de survivre. Le présent travail avait pour objectif
général de mesurer la tolérance au cuivre de 7
espèces de graminoïdes et mettre en évidence un
éventuel coût de tolérance au cuivre chez ces
espèces cupricoles. L'expérience en hydroponie dans les tubes
Falcons de 50ml, a été installée suivant un dispositif
split splot comprenant 7 espèces, 2 traitements et 12
répétitions. Sept espèces de graminoïdes ont
été cultivées dans deux milieu de culture
différents. Le traitement a été contaminé avec la
solution du cuivre pour une concentration finale de 50 uM de Cu et le
deuxième traitement sans contamination, a été
considéré comme témoin. Les tests ont porté sur la
biomasse fraîche, la biomasse sèche des espèces et
l'élongation racinaire. Les données ont été
analysées par une analyse de la variance (ANOVA) et un test de
Mann-Whitney. La solution nutritive a été formulée afin
d'apporter les éléments majeurs dont la plante a besoin pour sa
croissance. Les résultats obtenus sur les tests biomasse et radiculaire
montrent que les espèces de savane présentent un indice de
tolérance supérieur (It=147,5) au niveau de test biomasse et un
indice inférieur sur le test radiculaire (It=127,5). Et les
espèces large amplitude donnent des valeurs d'indices de
tolérance faibles de 41et 111,5.
L'apport de dose de sulfate de cuivre a permis de mesurer la
tolérance au cuivre des espèces graminoïdes. Les
résultats obtenus montrent que ces espèces pourraient
apportée un effet bénéfique dans la société
en les utilisant en phytoremédiation ou en
révégétation, vu leurs biomasses et élongation
racinaire enregistrés dans cette expérience.
Mots clés : tolérance, cuivre,
métaux lourds, biomasse, graminoïde, steppe, savane.
VII
Abstract
The copper-bearing outcrops are predominant ecosystems
affecting the plant communities. Flora colonizing these environments develops
tolerance mechanisms in metals to survive. The present work was initiated to
measure the copper tolerance of 7 graminoids species and highlight a potential
cost of copper tolerance in for these cupricole species. The experience in
hydroponics using 50ml Falcon tubes was installed following a split plot device
with 14 treatments and 12 repetitions. Seven graminoids species were cultured
in two different culture conditions. The first culture condition has been
contaminated with copper solution to a final concentration of 50 uM of Cu and
the second without contamination was considered as the control. The tests
focused on the fresh biomass, dry biomass of the species and root elongation.
The analysis of variance (ANOVA) and Mann-Whitney test were performed. The
nutrient solution was formulated to provide the major elements that the plant
needs to grow. The results on biomass and root tests showed that savanna
species have a higher tolerance index (It = 147.5) at test biomass and a lower
index on the root test (It = 127.5). And wide amplitude species gave weak
tolerance index values of 41 and 111.5.
The CuS04 dose in take was measured tolerance copper
graminoids species. The results show that these species could made a positive
impact in society using phytoremediation or revegetation, taking into account
their biomass and root elongation recorded in this experiment.
Keywords: tolerance, copper, heavy metals,
biomass, graminoids, steppe, savannah
2.2.1. Espèces utilisées 18
VIII
Table des matières
Epigraphe II
Dédicace III
Remerciement IV
Résumé VI
Abstract VII
Table des matières VIII
Listes des abréviations XI
Introduction 1
Chapitre 1. Revue Bibliographique 3
1.1.Flores des affleurements du Sud Est de la RDC
3
1.1.1 Origine de la flore des affleurements
3
1.1.2. Description et répartition de la flore
cupricole 4
1.1.3. Relation végétation- sol sur les
affleurements cuprifères du Sud-Est de la RDC _ 5
1.1.4. Effet du gradient de cuivre sur la structure de la
communauté végétale 7
1.2. Tolérance au cuivre 8
1.3. Les grandes stratégies de tolérance
aux métaux 9
1.4. Quantification et mesure de tolérance aux
métaux lourds 13
1.5. Coût de tolérance 14
1.6. Stress de plantes aux métaux lourds
15
Chapitre2 : Milieu, matériel et
méthodes 16
2.1. Description de zone d'étude 16
2.2. Matériels 18
IX
2.2.2. Matériels du laboratoire et du terrain
19
2.2.3. Solutions utilisées 20
2.3. Méthodes 22
2.3.1. Dispositif expérimental 22
2.3.3. Indice de tolérance 25
2.3.4. Paramètres mesurés 25
2.4. Analyse statistique des données
25
Chapitre 3. Résultats 26
3.1. Mesure de l'indice de tolérance au cuivre des
7 espèces de graminoïdes. 26
3.1.1. Biomasse fraîche 26
3.1.2. Elongation racinaire 28
3.2. Comportements des espèces graminoïdes en
fonction des milieux de culture utilisés 30
3.2.1. Biomasse fraîche 30
3.2.2. Elongation racinaire 31
3.3. Détermination des teneurs en matières
sèches des espèces graminoïdes 32
3.4. Evolution des espèces en fonction des jours
de traitement 33
3.4.1. Biomasse fraîche 33
3.4.2. Elongation racinaire 34
3.5. Détermination de l'indice de tolérance
des espèces graminoïdes 35
Chapitre 4. Discussion des résultats
36
Conclusion et perspectives 39
Références bibliographiques
40
X
Liste des figures et tableaux
a. Figures
Figure 1:Vue générale d'un
affleurements de roches de Cu et Co 6
Figure 2: Les huit communautés
végétales caractéristiques des sols
métallifères de l'arc cuprifère
katangaise 8
Figure 3: Divers modes de tolérance des
éléments trace métalliques par les plantes 10
Figure 4: Réponse des plantes à
une concentration croissante en métaux lourds 12
Figure 5: Localisation géographique du
milieu d'étude (source : Google earth @) 17
Figure 6: photos illustratives des
différentes espèces utilisées dans l'essai. 19
Figure 7: Plan du dispositif experimental 23
Figure 8: Photographie du dispositif
expérimental 24
Figure 9: Détermination de biomasse
fraîche moyenne des espèces graminoïdes en fonction de
substrats 30
Figure 10: Détermination
de la biomasse fraîche des espèces graminoïdes en fonction
de
substrats 31
Figure 11: Détermination de la teneur en
matière sèche. 32
Figure 12: Moyennes des biomasses fraîches
34
Figure 13:Moyennes d'élongation racinaire
34
b. Tableaux
Tableau 1:Teneurs en cuivre des sols et
plantes (médiane, minimal et maximale en mg kg-1) ___ 9
Tableau 2: composition chimique de la solution nutritive de
base utilisée en culture
hydroponique 21
Tableau 3:Mesure de la biomasse fraîche
en fonction de jours de traitement et solutions.. 27
Tableau 4: Mesure d'élongation
racinaire en fonction de jours de traitement et solutions. 29
Tableau 5: Indices de tolérance des
espèces graminoïdes des affleurements cuprifères 35
XI
Listes des abréviations
RDC : République Démocratique du Congo
Cu : cuivre
Co : cobalt
pH : potentiel d'hydrogène
CuS04. 5H20 : sulfate de cuivre 5 fois hydraté
ROS: reactive oxygen species
It : indice de tolérance
FSA : Faculté de Sciences Agronomiques
ADN : acide désoxyribonucléique
uM : microgramme
Nacl : chlorure de sodium
Mg (S04) : sulfate de manganèse
EDTA : Ethylène diamine acétate
H3B03 : acide borique
K2S04 : sulfate de potassium
Cu (N03) : Nitrate de cuivre
Zn (S04). 7H20 : sulfate de Zinc 7 fois hydraté
Mn (S04). H20: sulfate de manganèse
Cu (N03)2. 4H20: nitrate de cuivre
(NH4)6M0702. 4H20 : Molybdate d'ammonium
1
Introduction
Les gisements métallifères affleurent à
la surface terrestre et hébergent une végétation toute
particulière. Cette végétation est une résultante
de nombreuses années d'évolution sur des sols enrichis en
métaux lourds. Au sud de la République Démocratique du
Congo, ces sols apparaissant principalement sous forme de collines, forment un
alignement continu qu'on appelle « Arc cuprifère katangais »
et qui s'étale sur 300km de longueur et 50km de largeur, de la partie
Est de Kolwezi (province de Lualaba) jusqu'à la partie Sud de Lubumbashi
dans la province du Haut-Katanga. Cette ceinture est une zone importante de
gisements de cuivre, de cobalt, de manganèse et de nickel (Duvigneaud
& Denaeyer De-Smet, 1963). Sur ces substrats se sont
développées des espèces végétales uniques,
présentant des mécanismes biologiques leurs permettant de
résister aux concentrations élevées en métaux
lourds. Toutefois, Grime (1979) démontre deux facteurs environnementaux
qui déterminent la place d'une plante au sein d'une communauté
végétale : premièrement, les facteurs de stress qui
limitent la production photosynthétique (manque de lumière, eau,
éléments minéraux, ...), et deuxièmement, les
facteurs de perturbation, abiotiques ou biotiques, qui détruisent
partiellement ou totalement la biomasse. Les espèces présentes
sur ces collines constituent ce qu'on appelle la flore du cuivre. Ces
communautés végétales en interaction avec les sols riches
en métaux lourds (sols des mines de zinc, plomb et cuivre)
représentent la forme la plus spectaculaire de l'adaptation aux
contraintes édaphiques car ces espèces végétales
sont capables de pousser sur des concentrations élevées en
métal qui sont au-delà du seuil normalement compatible avec la
croissance. Le mécanisme que ces plantes utilisent pour s'adapter dans
un environnement contaminé en métaux est appelée
tolérance aux métaux lourds. Ces formations de
métallophytes sont des communautés rares et leur conservation est
devenu depuis ces dernières années, une nécessité
(Whiting et al., 2002 ; 2004).
Par ailleurs, Duvigneaud et Denayer-De Smet (1973) ont
distingué dans le comportement des plantes vis-à-vis des
éléments toxiques deux phénomènes différents
: la résistance de l'organisme à une accumulation
toxique d'éléments dans le milieu extérieur et la
tolérance de l'organisme à un excès
d'éléments toxiques dans les cellules de la plante. Nous adoptons
le terme de la tolérance afin de donner un sens strict à la
technique de culture en hydroponie (Wilkins, 1957).
La flore du cuivre est riche de quelques 550 espèces
dont certaines, telles que Microchloa altera, Monocymbium ceresiiforme
ou Ascolepis metallorum qui sont décrites comme
étant les plus
2
tolérantes car étant colonisatrices
pionnières des substrats enrichis en métaux lourds, ceci
s'explique par leur distribution sur les substrats riches en cuivre tels que
les remblais, les alentours des industries métallurgiques (Leteinturier,
2002). Ainsi, l'évaluation de niveau de tolérance de ces
espèces devient intéressante. En outre, Simon et Lefèvre
(1977) ont démontré les techniques les moins coûteuses de
transplantation en jardin commun des individus permettant de mettre en
évidence deux caractéristiques importantes des plantes poussant
sur les milieux contaminés par les métaux lourds, à
savoir, la nature génétique et la spécificité de la
tolérance.
L'objectif général de ce travail est de mesurer
la tolérance au cuivre des 7 espèces de graminoïdes et
mettre en évidence un éventuel coût de tolérance au
cuivre chez ces espèces cupricoles.
Cette étude apporte des réponses aux questions
suivantes :(i) Les espèces de la savane sont-elles réellement
moins tolérantes au cuivre que les espèces de la steppe ? (ii)
Qu'en est-il pour les espèces à large amplitude écologique
? (iii) Peut-on mettre en évidence un coût de la tolérance
?
Hormis l'introduction et la conclusion, ce travail est
subdivisé en quatre chapitres : (1) la revue de littérature, (2)
milieu, matériels et méthodes, (3) résultats et (4) la
discussion des résultats.
3
Chapitre 1. Revue Bibliographique
1.1. Flores des affleurements du Sud Est de la
RDC
Les communautés végétales des collines de
cuivre au Sud-Est de la RDC regroupent environ 550 espèces, dont
certaines sont présentes sur les sols sableux normaux des hauts-plateaux
entourant l'arc cuprifère Katangais ou du Sud-Est de la
République Démocratique du Congo (Leteinturier, 2002 ; Kaya et
al., 2015). Parmis ces espèces, 32 sont endémiques aux
sols riches en cuivre dont 24 présentent une distribution restreinte, ce
sont alors des métallophytes absolus ou eucuprophytes (Duvigneaud,
1963). Vingt-trois autres espèces ont été reconnues en
tant qu'endémiques larges (plus de 75% d'occurrence sur sol riche en
cuivre), ce sont des eucuprophytes locaux (Faucon et al, 2010). Duvigneaud
(1963) remarque que ces espèces inféodées aux
affleurements cuprocobaltifères s'assemblent en groupements
végétaux variant le long du gradient de la niche
écologique. L'auteur émet l'hypothèse selon laquelle la
variation de la teneur en cuivre du sol (diminuant du sommet vers la base de la
colline) serait à l'origine de ces différents groupements
(Duvigneaud, 1963 ; Faucon, 2009).
1.1.1 Origine de la flore des affleurements
L'étude récente de Leteinturier (2002) rapporte
qu'à l'état actuel des connaissances, sur un total d'environ 280
collines métallifères, seules 70 collines ont été
l'objet de certaines études, soit seulement un quart. Sur les collines
étudiées, il a été répertorié environ
548 espèces cupricoles reparties dans diverses familles
végétales et parmi lesquelles selon Leteinturier et al.
(1999), il a été recensé plus ou moins 32 espèces
endémiques des sites métallifères du Katanga, soit un taux
d'endémisme d'environ 7.6 %. Dans cette flore il a également
été établi qu'il y a 28 hyper accumulatrices de cuivre qui
ne sont connues que du Katanga, Sud-est de la République
Démocratique du Congo.
Certaines plantes à large répartition dans la
région Zambézienne sont capables de coloniser les sites
métallifères. Ainsi, sur base des similitudes remarquées
avec les milieux non minéralisés, il a été
établi que les plantes cupricoles dérivent des principales
sources suivantes: la savane steppique périodiquement inondée, la
savane steppique des Haut plateaux sableux (le Dilungu), formations
4
sur les sols rocheux non minéralisés, les
terrains marécageux sur les sols jaunes compacts avec le
Xerobrachystegion comme unité phytosociologique, les espèces de
savane largement dispersées et les espèces rudérales
(Brooks et Malaisse, 1990).
1.1.2. Description et répartition de la flore
cupricole
Au sein de cette même flore, Duvigneaud et Denaeyer-De
Smet (1963) ont distingué divers groupes écologiques, depuis des
polycuprophytes croissant sur les sols riches en cuivre (0.5 à 10%)
jusqu'à des cuprophiles et des oligo- cuprorésistants croissant
sur sols faiblement toxiques (200 à 800 microgrammes de cuivre par
gramme de sol sec).
Ces auteurs ont montré par ailleurs que les
métaux lourds du sol, principalement le cuivre, exercent deux types
d'action sur la végétation du Sud-Est de la RDC : la
sélection naturelle des espèces les mieux adaptées et la
spéciation par isolement écologique et géographique. Ces
deux modes d'actions du milieu conduisent au développement de la flore
cupricoles au sein de laquelle on trouve :
a. Des cuprophytes : les plantes qui
colonisent uniquement sur les gisements métallifères, tout au
moins localement. Dans ce groupe on distingue des eucuprophytes, qui existent
uniquement ou presque uniquement dans les sites métallifères, et
les cuprophytes locaux qui poussent sur des sols très riches en
métaux lourds dans une région particulière mais qui se
rencontrent dans des biotopes non minéralisés, dans des
régions phytogéographiques distinctes.
b. Des cuprophiles : les plantes qui ne sont
pas des métallicoles exclusives mais montrent une fréquence plus
élevée sur les sols riches en cuivre.
c. Des cuprorésistants : les plantes
qui existent aussi bien, dans la même région, sur sols
métallifères que sur sols normaux. Elles sont capables de
supporter des quantités parfois très importantes de cuivre.
5
1.1.3. Relation végétation- sol sur les
affleurements cuprifères du Sud-Est de la ROC
Les sols métallifères représentent des
environnements très contraignants pour la flore. Des affleurements
naturels de roches très riches en cuivre et cobalt forment des collines
qui abritent à la surface de la terre et constituent des effects
néfastes géochimiques (Faucon, 2009 ; Faucon et al.,
2015). La colonisation de tels affleurements par des communautés
végétales adaptées, diversifiées et riches en
espèces, est une caractéristique biogéographique et
écologique du Katanga (Duvigneaud & Denaeyer-De Smet 1963 ; Brooks
& Malaisse, 1985). Ces affleurements se présentent sous forme de
collines portant une végétation herbacée dispersée
dans la forêt claire.
6

Figure 1:Vue générale d'un
affleurements de roches de Cu et Co (Delhaye Guillaume, 2016).
La flore cupricole se distribue suivant le gradient de teneurs
en Cu et Co le long des versants qui diminue depuis les affleurements
minéralisés en position sommitale jusqu'aux dépôts
colluviaux de piémont (Kaya et al 2015). On traverse successivement les
unités d'habitats et de végétation suivantes :
? Le sommet de la colline est constituée de roches
siliceuses cellulaires, très appauvries en cuivre par le lessivage et
porte une végétation saxicole (Aeollanthus saxatilis,
etc.) (concentration en cuivre entre 250 et 900 mg/kg);
7
? Sur les sols caillouteux les plus riches en cuivre : steppe
maigre, ouverte, à Bulbostylis div. sp., Ascolepis metallorum,
Eragrostis racemosa, Haumaniastrum robertii, Xerophyta equisetoides
(la concentration totale en cuivre entre 3500-100000 mg/kg).
? Plus, bas sur la pente, sur sol plus profond riche en
colluvions de malachite : savane steppique riche en graminées
(Loudetia simplex) et Cryptosepalum maraviense ;
? Au pied de la colline, l'auréole de contamination ou
"dembo d'empoisonnement" porte une savane steppique dense, à
base d'Andropogon shirensis, Triumfetta welwitschii, dont la
concentration en cuivre varie entre 100-1000 mg/kg.
? Enfin, la transition vers la forêt claire est souvent
marquée par une lisière à Uapaca robynsii et
Olax obtusifolia
1.1.4. Effet du gradient de cuivre sur la structure de la
communauté végétale
Le cuivre est un micronutriment important pour les plantes,
malgré que sa carence peut être observée dans des
systèmes de culture, les concentrations nécessaires à la
croissance et le développement sont généralement en
fonction de concentrations disponibles dans le sol. A une forte concentration
dans le sol, le Cu peut être toxique pour les plantes, et cela peut
causer de modification remarquable sur la croissance des racines, une
inhibition du développement des racines latérales
(Pâhlsson, 1989). Le taux de phytotoxicité ne dépend pas
seulement de la teneur totale, mais aussi des facteurs qui l'affectent tels que
les facteurs liés au sol tels (le matériau parental, le type de
pédogenèse, le pH, la matière organique...), l'absorption
et le transfert du polluant est fonction de la plante. Au sein de
communautés végétale, il résulte de grandes
différences de tolérance au cuivre (Ernst et al.,1992 ;
Macnair, 1987). Ces tolérances résultent en une distribution
particulière de la flore du Cu sur un gradient de teneurs en Cu et Co le
long du gradient qui diminue depuis les affleurements minéralisés
au sommet jusqu'en bas de la colline (Kaya et al., 2015). Ces derniers
ont montré que la végétation s'organiserait sur ce
gisement métallifère en huit communautés décrites
par Leteinturier et al. (1999)
Sur le plan écologique, les sols
métallifères des collines contiennent des teneurs naturelles en
cuivre extractibles très élevées (10 000
mg.kg-1) comparativement aux sols non contaminés (Malaisse
et al. 1994). La distribution du cuivre et des autres métaux
associés (cobalt, manganèse, nickel et zinc) n'est pas
homogène sur ces écosystèmes. En effet, le sol du sommet
des collines s'est développé sur des affleurements de roches
mères qui les alimentent en métaux par leur
dégradation.
8
Ce phénomène accompagné de
l'érosion des sols du sommet des collines est un facteur responsable des
concentrations élevées retrouvées au long du gradient
supérieur du cuivre. Le reste et le bas de la pente présentent
une granulométrie du sol plus fine et une contamination plus faible et
causée par le ruissèlement de l'eau et des particules de sol du
sommet.
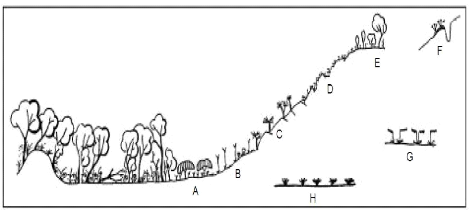
Figure 2: Les huit communautés
végétales caractéristiques des sols
métallifères de l'arc cuprifère katangaise
A. Ceinture de savane arbustive
à Uapaca robynsii; B. Savane steppique à
Loudetia simplex-Monocymbium ceresiiforme avec Acalypha cupricola comme
différentielle cupricole caractéristique ; C.
Steppe enrochée à Xerophyta spp; D.
Végétations sur affleurements rocheux crevassés ;
E. Savane boisée à Hymenocardia acida;
F. Pelouse sur sol cuprifère remanié
composée d'Haumaniastrum robertii ; G. Pelouse sur sol
compact Microchloa altera ; H. Pelouse à Bulbostylis
pseudoperennis. Source : Leteinturier et al. (1999).
1.2. Tolérance au cuivre
Le cuivre est un micronutriment essentiel pour les plantes en
faible concentration dans le sol (5 à 10 mg Cu kg-1)
(Marschner 1995). Il entre dans la composition de nombreuses enzymes et
participe au flux d'électrons des réactions
d'oxydoréduction dans les cellules végétales (Ouzounidou
et al. 1995 ; Burkhead et al. 2009). L'excès de cuivre est un facteur
contraignant pour le développement
9
des plantes. Seules les espèces qui développent
une tolérance au Cu, sont capables de se développer et se
reproduire dans ces conditions extrêmes (Tableau 1).
Tableau 1:Teneurs en cuivre des sols et plantes
(médiane, minimal et maximale en mg kg-1
(Brooks & Malaisse 1985 ; Misra 2000 ; Epstein & Bloom
2005 ; Faucon, 2009).
|
Teneurs en Cu (mg kg-1)
|
|
Sols normaux
|
55 (3-110)
|
|
Plantes sur sols normaux
|
6 (2-50)
|
|
Sols des collines cuprifères
|
10000 (100-90000)
|
|
Plantes des collines cuprifères
|
1000 (10-10000)
|
1.3. Les grandes stratégies de tolérance
aux métaux
Les plantes qui poussent sur des substrats riches en
métaux développent des mécanismes physiologiques qui leur
permettent de tolérer les conditions chimiques néfastes
imposées par ces substrats (Kruckeberg, 1984 ; Kazakou et al.,
2008 ; Ilunga et al, 2014). L'absorption des
éléments toxiques en excès crée dans la
majorité des cas un dysfonctionnement des organismes, en perturbant le
fonctionnement des systèmes enzymatiques dans lesquels ils
n'interviennent habituellement pas (Deneux-Mustin et al., 2003). Les
espèces qui colonisent les milieux riches en métaux
développent des stratégies physiologiques (tolérance) qui
leur permettent de survivre et se reproduire sur ces sols toxiques
contrairement aux espèces non tolérantes (Morrey, 1995).
La tolérance des espèces
végétales à un élément métallique est
donc définie comme étant la capacité liée à
certaines espèces de croitre ou de survivre dans des environnements
extrêmement riches en métaux où d'autres espèces
sont exclues (Antonovics et al., 1971 ; Regvar et Vogel-Miku, 2008 ;
Pardon et al., 2014). On peut classer les métallophytes en
trois principales stratégies de tolérance (figure.3) :
l'exclusion, l'indication et
l'accumulation (Baker et Walker, 1990 ; Morrey, 1995).
10
? L'exclusion : est la stratégie la
plus fréquente chez les espèces qui vivent exclusivement sur le
sol riche en métaux et consiste en une réduction des
prélèvements des métaux par les racines ou une
réduction de leur translocation vers les parties aériennes ;
? L'indication : est une stratégie
adoptée par les plantes qui accumulent les métaux dans les
biomasses aériennes et dont la concentration reflète celle du sol
;
? L'accumulation : comme les indicatrices,
elles accumulent les métaux dans leurs parties aériennes, la
différence est que parties aériennes révèlent des
concentration plus élevées que celles observées dans le
sol. Le terme d'hyperaccumulatrices est réservé
aux espèces dont les feuilles présentent des teneurs en
métaux dépassant 0.1% de Ni, Co, Cu, Cr ou Pb et 1% de Zn, Mn du
poids de la matière sèche (Morrey, 1995 ; Boyd, 2004 ; Reeves,
2006 ; Ngoy, 2007 Faucon et al., 2012a, Ilunga Wa Ilunga, 2014).
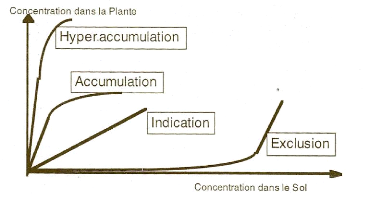
Figure 3: Divers modes de tolérance
des éléments trace métalliques par les plantes (Bourrelier
& Berthelin, 1998)
La tolérance des plantes aux Cu et Co leur
confère un intérêt dans les techniques de
phytoremédiation. La phytoremédiation est définie comme
une technologie d'utilisation des plantes pour éliminer ou transformer
les polluants en composés moins toxiques. La phytoremédiation
regroupe :
11
? La phytoextraction : utilisation des plantes pour
extraire du sol les polluants organiques et les métaux et les concentrer
dans les organes de la plante destinés à la récolte,
? La rhizofiltration, correspond à
l'utilisation des racines pour absorber et accumuler les Polluants
(métaux) des eaux usées,
? La phytostabilisation ; utilisation des plantes
pour limiter l'érosion et immobiliser les polluants dans les couches
superficielles évitant en particulier leur migration vers les eaux de
surface et souterraines,
? La phytovolatilisation : utilisation des plantes
pour extraire les polluants du sol et les transformer en composés
volatils
? La phytodégradation : utilisation de
l'association plantes/microorganismes pour dégrader les polluants
organiques du sol.
La phytotoxicité due aux métaux lourds peut
être schématisée par une courbe dose/réponse. On
remarque deux types de courbes, en fonction de la nature de
l'élément trace (Figure 4). S'il s'agit d'un
élément essentiel, la courbe est en forme de cloche et est
divisible en 3 domaines : la carence, la tolérance et la
toxicité. Dans le cas des éléments traces qui ne sont pas
des oligo-éléments ou éléments essentiels, on ne
différencie que les domaines de tolérance et de
toxicité.
12
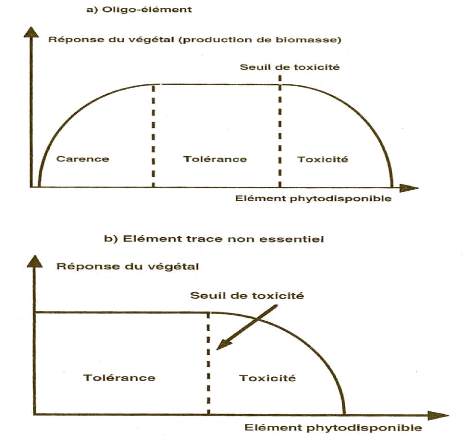
Figure 4: Réponse des plantes à
une concentration croissante en métaux lourds (Bourrelier et Berthelin,
1998)
13
1.4. Quantification et mesure de tolérance aux
métaux lourds
La tolérance des espèces végétales
aux effets de la toxicité du cuivre est viablement mesurable et efficace
lorsque ces espèces sont propagées en utilisant le semis direct
que par bouturage (Davis & Beckett, 1978). L'étude menée par
Bradshaw (1952) sur la tolérance au Plomb de l'espèce
Agrostis capillaris a montré de façon concluante que le
manque de tolérance au plomb de cette espèce s'est
manifesté par une inhibition de la croissance des racines. Les indices
de tolérance dérivés de rapports entre les données
pour les solutions de traitement et témoin peuvent alors être
calculé et utilisé pour caractériser des individus ou des
populations (Wilkins, 1978). Il est admis que cette technique a
été un outil important permettant un criblage à grande
échelle pour mesurer la tolérance. Cependant, le test
d'élongation racinaire a été utilisé
indifféremment pour les tests la tolérance par différents
chercheurs sans attention à ses limites. Malgré que cette
technique a été développée à l'origine pour
les graminées où le système racinaire est fibreux, le test
a été appliqué dans les études sur les plantes
aussi dans la morphologie des racines comme Mimulus guttatus (Allen
& Sheppard, 1971 ; Macnair, 1977), Armeria maritima (Lefebvre,
1968), Plantago lanceolata (Wu & Antonovics, 1975 ; Pollard, 1980)
et Leucanthemum vulgare (Whitebrook, 1986).
Une hypothèse de base de cette technique est qu'il
existe une relation entre l'indice de tolérance tel que mesuré
expérimentalement et certaine estimation de l'effet du cuivre,
évaluée par une simple analyse chimique du sol dans la zone
d'enracinement des plantes testées. Peu de chercheurs ont effectivement
confirmé ce principe fondamental avant d'utiliser la méthode.
Toutefois, de bonnes corrélations ont été établies
par Wilkins (1960), Karataglis (cité dans Bradshaw. 1976) et Wigham,
Martin & Coughtrey (1980) pour des études avec Pb, Cu et Cd,
respectivement, pour différentes espèces. Une autre condition
pour l'utilisation de ce test est qu'au cours de l'expérience, les taux
d'allongement des racines dans les deux solutions de traitement et de
contrôle restent constante.
Ceci est particulièrement traité dans les
études où une méthode « séquentielle »
(consécutive des mesures sur la même racine dans les solutions de
contrôle suivi par les solutions de traitement des métaux) est
employée. Les méthodes « parallèles » (mesures
simultanées des individus réplicats dans les solutions de
contrôle et de traitement) sont moins sensibles aux variations
temporelles d'élongation racinaires. La diminution d'élongation
racinaire des espèces s'exprime non seulement avec le temps, mais aussi
en fonction de la période pendant laquelle la croissance linéaire
est
14
maintenue, et doit être établie avant la
soumission sur des tests et toutes les mesures restreintes à cette phase
de croissance. Humphreys & Nicholas (1984) ont attiré l'attention
sur un autre problème où les indices de tolérance sont
basés sur les ratios de la croissance des racines dans une solution
contaminée en cuivre et une solution témoin. Ils suggèrent
que les composants de ces indices peuvent être sous contrôle
génétique indépendant et donc des conclusions
injustifiées peuvent être tirées si les indices ne sont pas
utilisés avec prudence. La concentration qui peut être choisie est
généralement celle qui provoque la séparation maximale
entre les génotypes tolérants et non tolérants.
La solution dans laquelle les ions métalliques sont
utilisés est une autre variable importante. Traditionnellement, une
seule solution de sel de nitrate de calcium (fournie à 0-5 ou 1-0 g
l-1) a été utilisé et les métaux
ajoutés soit comme le nitrate ou le sulfate pour permettre l'utilisation
de concentrations plus élevées d'ions métalliques sans
crainte de précipitation (Wilkins, 1978). L'attention a
été attirée sur les problèmes susceptibles des
effets de la carence en éléments nutritifs dans une solution de
base, en particulier pour le matériel de semis. Les effets interactifs
possibles sont également masqués. En conséquence, certains
scientifiques ont choisi d'utiliser une solution diluée
d'éléments nutritifs comme fond (Wilkins, 1978 ; Karadaglis, 1980
; Shaw, Rorison & Baker, 1982 ; Baker et al, 1986). Toutefois,
Johnston & Proctor (1981) ont en outre tenté de refléter les
conditions de terrain en utilisant une solution qui était similaire
à la composition de l'eau du sol dans un sol serpentine toxique.
1.5. Coût de tolérance
Les plantes des milieux métallifères ont
généralement développé une tolérance
à plusieurs métaux simultanément. Ces plantes sont
caractérisées par des taux de croissance très faible et de
reproduction très limitée, comme le montre l'espèce
Silene vulgaris tolérante au As, Cd, Cu, Pb et Zn (Ernst et
al., 2000). Il semble qu'une plante diminue la taille et la production
de semences en réponse aux coûts métaboliques des
tolérances métalliques (Ernst,1983 ; Wilson 1988).
15
1.6. Stress de plantes aux métaux
lourds
Les conditions environnementales contraignantes auxquelles les
végétaux sont soumis, leur confèrent un caractère
de ralentissement de la croissance. Ce ralentissement présente certains
symptômes tels que : chlorose foliaire, lésions nécrotiques
importantes, jaunissement progressif, repliement ou dessèchement du
feuillage... Actuellement, les bases moléculaires de ces modifications
ou perturbations sont encore mal connues, toutefois, on suggère
généralement qu'elles résultent d'un stress oxydatif,
causé par la production d'espèces réactives de
l'oxygène ou « Réactive Oxygen Species » (ROS). Les ROS
changent toute une série de substrats biologiques importants, avec comme
conséquence la modification des domaines fonctionnels des
biomolécules : l'inhibition de l'activité enzymatique, la
perturbation du métabolisme végétal (notamment la
photosynthèse et la respiration), l'oxydation de protéines,
l'altération des membranes cellulaires via l'induction de
phénomènes de peroxydation lipidique, l'apparition de cassures au
sein de l'ADN, pouvant conduire à la mort cellulaire (Davis et
al., 2003 ; Dietz et al., 1999 ; Cheng, 2003).
16
Chapitre2 : Milieu, matériel et méthodes
2.1. Description de zone d'étude
L'étude est menée au champ expérimental
de la Faculté des Sciences Agronomiques à Lubumbashi. Cette
station de recherche, situé à 1230m d'altitude dans le
carré formé par les latitudes 11°39' et 11°42' Sud et
les longitudes 27°27' et 27°28 de longitude Est (figure 5). Les
échantillons de plantes ont été récoltés
à Kinsevere situé à 30 Km de la ville de Lubumbashi.
Kinsevere est situé à l'Est de l'Arc Cuprifère Katangais
dans la province de Haut-Katanga, au Nord-Est situé au
coordonnées géographiques (27° 58' E et 11° 36' S).
Elle est la propriété de la société MMG.
Kinsevere est dominé par un climat humide subtropical,
CW6s selon la classification de Köppen (Ilunga et al., 2015). Ce
site est caractérisé par deux saisons dont la saison des pluies
(Novembre à Mars) et une saison sèche (Mai à September),
avec deux mois de transition (Octobre et Avril).Les précipitations
annuelles totales moyennes sont de 1.273 millimètre dont des chutes de
1.122 millimètre pendant la saison des pluies. La température
annuelle moyenne est 21°C. Le début de la saison se
caractérise par une plus basse température(15-17°C). Et les
deux mois de transition Septembre et octobre sont les mois les plus chauds avec
des températures maximum de 31-33°C (Ilunga et al.,
2015).
17
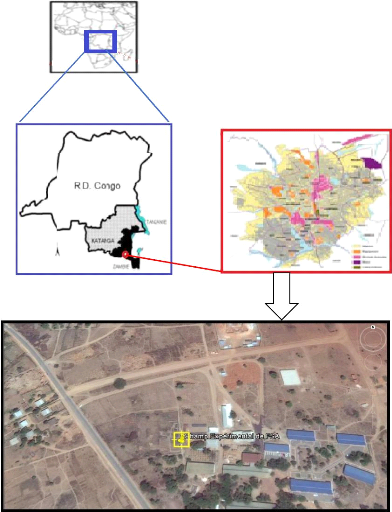
Figure 5: Localisation géographique du
milieu d'étude (source : Google earth @)
18
2.2. Matériels
2.2.1. Espèces utilisées
Dans cette étude 7 espèces graminoïdes
(Poacée et Cypéracée) ont été
utilisées dont 6 espèces ont été
récoltées sur la colline de Kinsevere et une autre espèce
(Microchloa altera) a été récoltée dans le
champ expérimental de la Faculté des Sciences Agronomiques
(figure 6). Ces espèces ont été choisies du fait que ce
sont les espèces qui poussent sur les affleurements
métallifères (Simon et Lefèvre, 1977), et aussi à
cause de leurs niches écologiques sur les gradients de collines
métallifères.
? Espèces de la steppe : est une formation ouverte
dominée par Eragrostis racemosa, Ascolepis metallorum et
Haumaniastrum robertii ou katangense. Les espèces
utilisées dans cette étude sont : Microchloa altera,
Eragrostis racemosa et Ascolepis metallorum.
? Espèces de la savane : est une végétation
fermée dominée par Loudetia simplex et Tristachya
sp. Les espèces utilisées sont : Bulbostylis filamentosa
et Digitaria diagolanis.
? Espèce à large amplitude écologique : Ces
espèces poussent le long de tout le gradient de contamination
métallique. Les espèces utilisées sont :
· Loudetia simplex
· Andropogon shirensis
19

Figure 6: photos illustratives des
différentes espèces utilisées dans l'essai.
Légende : a. Andropogon shirensis
b. Eragrostis racemosa C. Loudetia
simplex d. Ascolepis
metallorum e. Digitaria diagolanis
var. uniglumis f. Bulbostylis filamentosa
g. Microchloa altera. (Source :
Photo
Copperflora.org 2016)
2.2.2. Matériels du laboratoire et du
terrain
Pour réaliser notre étude nous avons utilisé
les équipements suivants :
? Le bécher : il a nous servi à la
préparation de solutions et de mélange.
? pH-mètre de marque HQ multi : il nous a servis
de mesurer le pH de l'eau distillée pour se rassurer de sa nature
20
> La balance de précision de 0.001 de marque KERN : a
servi à mesurer les biomasses
fraiches et sèches de tous les échantillons des
plantes.
> Les gants : ils ont été utilisé en vue
de n'est pas être en contact avec des produits chimiques.
> Le ciseau : il nous servi de couper les veuilles racines des
espèces utilisées,
> Le blouson : a été utiliser pour se
protéger contre les produits toxiques.
> Les bidons : ils ont servi au mélange des solutions
des solutions.
> Les bassines : ils ont servi également au
mélange et la mise de solution dans le tube Falcon.
> Les papiers essuies : ont servi à essuyer les plantes
entières avant d'en déterminer les
biomasses fraiches à la balance.
> La latte graduée de 30cm : elle a permis de mesurer
le test radiculaire
> L'étuve de marque BINDER : il a permis de
sécher les plantes après la récolte afin de
déterminer la biomasse sèche des espèces.
> Un ordinateur : il nous a permis d'encoder les
données ;
> Les tubes Falcon en PVC de 50ml : ont permis de mettre les
espèces en culture
hydroponique ;
> Eprouvette (25et 50mL) : utilisées pour le
prélèvement des solutions ;
> Les embous : ont permis le prélèvement des
solutions avec précision ;
> Le papier parafilm et la mousse : ont servi à fixer
la plante dans le tubes Falcon pour que la
partie du collet soit au-dessus de la solution.
> Le marquer : a servis dans l'étiquetage des
espèces végétales sur les Falcons
> L'eau distillée : a
été obtenue au LAPFSA et au Super marché Hyper
psaro. Ce dernier est
situé sur le croisement des avenues Lumumba, Luvungi et
boulevard M'siri dans la
commune de Lubumbashi. La quantité d'eau utilisée a
été de 90litres et son pH était de 7.01
2.2.3. Solutions utilisées
La solution nutritive utilisée dans cette
expérience est une solution Hoagland classique (Chipeng et al.,
2010). Trois stocks de solutions ont été formulé dans
cette étude : stock1 constitué de K2S04, Nacl ; le stock N
constitué de Ca (NO3)2 4H20, le stock Mg constitué de Mg (SO4).
7H20, FeEDTA et H3BO3 et le stock oligoéléments constitué
de ZnSO4 7H20, MnSo4 H20, CuSO4 5H20, (NH4)6 MO7O.4H20.
21
Les molécules et leurs concentrations sont reprises
dans le tableau 2. En fonction du traitement, cette solution a
été utilisée pure, ou agrémentée de
1,12g/litre de 50uM CuS04
Tableau 2: composition chimique de la
solution nutritive de base utilisée en culture hydroponique
|
Concentration en g/l
|
|
50uM CuSO4 5H20
|
1,12
|
|
Macroéléments
|
|
|
K2SO4
|
13,8
|
|
Nacl
|
0,05
|
|
Ca(NO3)2 4H20
|
21,25
|
|
Mg(SO4) 7H20
|
22,18
|
|
FeEDTA
|
0,78
|
|
H3BO3
|
0,06
|
|
Oligoéléments
|
|
|
ZnSO4 7H20
|
0,03
|
|
MnSo4 H20
|
0,01
|
|
CuSO4 5H20
|
0,01
|
|
(NH4)6 MO7O2. 4H20
|
0,001
|
22
2.3. Méthodes
2.3.1. Dispositif expérimental
L'essai a été installé suivant un
dispositif split plot comprenant 7 espèces, 2 traitements et 12
répétitions. Le premier milieu a été
contaminé avec la solution du CuSO4.7H2O (M=249.68g/mol) et le
deuxième milieu sans contamination a été
considéré comme témoin. La combinaison avec les
différentes espèces a permis d'obtenir les traitements suivants :
E1= Microchloa altera (Cu), E'1= M. altera (Tem), E2=
Eragrostis racemosa (Cu), E'2=E. racemosa (Tem), E3=
Ascolepis metallorum (Cu), E'3= A. metallorum (Tem), E4=
Bulbostylis filamentosa (Cu), E'4=B. filamentosa (Tem),
E5=Digitaria diagolanis (Cu), E'5=D.diagolanis(Tem), E6=
Loudetia simplex (Cu), E'6= L. simplex (Tem), E7=
Andropogon shirensis (Cu), E'7= A. shirensis (Tem). (Figure
8
23
|
T0
|
|
|
|
|
E1
|
E2
|
E3
|
E4
|
E5
|
E6
|
E7
|
|
|
|
E7
|
E3
|
E1
|
E2
|
E3
|
E1
|
E2
|
|
|
|
E2
|
E1
|
E4
|
E1
|
E4
|
E3
|
E4
|
|
|
|
E4
|
E5
|
E2
|
E6
|
E7
|
E5
|
E1
|
|
|
|
E3
|
E6
E5
|
|
E7
|
E2
|
E4
|
E2
|
|
E3
|
|
|
|
E7
|
E6
|
E3
|
E6
|
E1
|
E6
|
|
|
|
|
E4
|
E3
|
E3
|
E5
|
E4
|
E3
E5
|
|
|
|
|
E6
|
E7
|
E2
|
E7
|
E1
|
E7
|
E4
|
|
|
|
E1
|
E4
|
E6
|
E4
|
E3
|
E2
|
E3
|
|
|
E5
|
E2
|
E1
|
E6
|
E5
E6
|
|
E7
|
|
E7
|
E5
|
E7
|
E2
|
E1
|
E7
|
E5
|
|
|
|
E2
|
E6
|
E4
|
E5
E6
|
|
E5
|
E1
|
Figure 7: Plan du dispositif experimental
T1
|
E'7
|
E'5
|
E'2
|
|
E'4
|
E'1
|
E'2
|
E'3
|
|
|
|
E'1
|
E'4
|
E'2
|
E'2
|
E'5
|
E'4
|
E'7
|
|
|
|
E'3
|
E'2
|
E'1
|
E'3
|
E'2
|
E'6
|
E'2
|
|
|
|
E'5
|
E'1
|
E'5
|
|
E'4
|
E'4
|
E'1
|
E'5
|
|
|
|
|
E'1
|
E'7
E'2
|
|
E'1
|
E'6
|
E'3
|
E'1
|
|
E'4
E'3
|
|
|
|
E'6
|
E'3
|
E'1
|
E'5
|
E'6
|
|
|
|
E'6
|
E'5
|
E'4
|
E'7
|
E'3
|
E'2
|
E'7
|
|
|
|
E'2
|
E'7
|
E'1
|
E'5
|
E'4
|
E'4
|
E'1
|
|
|
|
E'7
|
E'3
|
E'7
|
E'6
|
E'6
|
E'7
|
E'6
|
|
|
|
E'5
|
E'6
|
E'3
|
E'2
|
E'5
|
E'1
|
E'3
|
|
E'6
|
E'7
|
E'4
|
E'7
|
E'2
|
E'7
|
E'5
|
|
|
|
E'4
|
E'2
|
E'5
|
E'6
|
E'3
|
E'3
|
E'4
|
24
2.3.2 Conduite de l'essai
L'essai a été conduit en culture hydroponique
dans des tubes Falcon de 50 ml. Chaque individu a été
cultivé pendant un mois afin d'assurer la reprise et la mise en place de
nouvelles racines (figure 8). Après la reprise, les anciennes racines
ainsi que les parties aériennes mortes ont été
supprimées. Au début de l'expérience, la biomasse fraiche
initiale a été mesurée ainsi que la longueur de la racine
la plus longue. Ensuite, chaque plante a été mise en culture dans
un tube Falcon soit dans une solution Hoagland pure (voir constitution
ci-dessus), soit dans cette même solution additionnée de sulfate
de cuivre. Les mesures de la biomasse fraîche, de l'élongation
racinaire de la plus longue racine de chaque plante et le renouvellement des
solutions ont été effectuée une fois par la semaine
pendant 6 semaines.
La préparation des solutions a été
réalisée au laboratoire Agro-pédologique de la FSA. Elle
consistait à prélever 82,5ml dans une pipette de chacun de stock
(1, N, Mg, OLIGO) et en les ajoutant et les mélangeant avec 10l
d'eau distillée dans un grand seau propre de 20 Litres. Une fois
mélangé, 10l de solution ont été
divisé en deux, prélevé dans un bécher et remises
dans les bidons de 5l dont un bidon où nous n'avons rien
ajouter et un autre bidon cuivre, où nous avons ajouté 82,5 ml de
50uMCuSO4.5H20

Figure 8: Photographie du dispositif
expérimental (photo Guillaume, 2016).
25
2.3.3. Indice de tolérance
L'indice de tolérance moyen a été
définit par la formule :
|
100??
|
élongation moyenne en solution de sulfate de cuivre
|
= It
|
|
élongation moyenne en solution témoin
|
2.3.4. Paramètres mesurés
Durant la période d'expérimentation, les mesures
ont portée sur :
? L'élongation racinaire (cm) : elle a
été déterminé à l'aide d'une latte
graduée en prenant la mesure de la plus longue racine.
? La biomasse fraîche (g) : déterminée
à l'aide de la balance électronique de précision. A la fin
de l'expérience, les plantes ont été
récoltées puis séchées à l'étuve
à une température de 70°C pendant 72 heures au laboratoire
Agro-pédologique de la Faculté des Sciences Agronomiques de
l'Université de Lubumbashi en vue de déterminer la teneur en
matières sèches des espèces à l'aide d'une balance
de précision de 0.001 marque KERN.
2.4. Analyse statistique des données
Les analyses statistiques des données ont
été réalisées à l'aide du logiciel Minitab
17. Une analyse de la variance (ANOVA) et le test de Mann-Whitney ont
été utilisés en vue de comparer les différentes
moyennes pour la biomasse fraîche et l'élongation racinaire des
espèces.
26
Chapitre 3. Résultats
3.1. Mesure de l'indice de tolérance au cuivre des
7 espèces de graminoïdes.
3.1.1. Biomasse fraîche
Les résultats obtenus de l'analyse de la variance sur
la biomasse fraîche des espèces montrent qu'il existe des effets
d'apport de sulfate de cuivre sur les espèces étudiées
(tableau 3). Il ressort que M. altera affiche les comportements
similaires dans les deux solutions cuivre et témoin. Les individus de
cette enregistrent une augmentation de biomasse de 0,02g au
14ème dans la solution cuivre, en plus une diminution de
biomasse de 0,05g dans la solution témoin. L'espèce E.
racemosa présente une diminution de biomasse dans les deux
solutions respectivement de 0,12 et 0,15g. au-delà du 14ème
jours, on observe une mortalité des individus témoins de E.
racemosa. Pour ce qui concerne A. metallorum, nous remarquons la
même allure de diminution observée chez E. racemosa.
Toutefois, l'espèces présente les valeurs moyennes dans les deux
milieux de 0, 10 et 0,13g. Par ailleurs, B. filamentosa montre une
réduction de sa biomasse dans les deux solutions cuivre et témoin
respectivement de 0,16 et 0,19g. Au-delà de deux semaines, les individus
de cette espèce ont survécu. Une diminution de la biomasse
fraîche est observée chez L. simplex dans les milieux
cuivre et témoin. Les valeurs moyennes obtenues sont notamment 0,04 et
0,08g. Mais les valeurs supérieures sont enregistrées dans la
solution enrichi au cuivre. Par ailleurs, les individus soumis dans la solution
cuivre enregistrent biomasse élevée de 0,06g. par contre, les
individus cultivés dans la solution témoin présentent une
diminution de leurs biomasses fraîches de 0,27g. Enfin, les individus de
A. shirensis se comportent différemment dans les substrats. Il
ressort que les individus placés dans la solution cuivre augmentent
leurs biomasses fraîches de 0,02g. Par ailleurs, il résulte une
biomasse faible de 0,04g enregistrée chez les individus témoins.
Aux 28ème jours de traitement, n'ont pas toléré dans les
deux milieux (cuivre et témoin.).
27
Tableau 3:Mesure de la biomasse fraîche en
fonction de jours de traitement et solutions. Moyennes #177;
écart-type.,
|
Espèces
|
solution
|
0jour
|
7 jours
|
14jours
|
21jour
|
28 jours
|
35 jours
|
|
Cu
|
0,58#177;0,26
|
0,57#177;0,25
|
0,60#177;0,29
|
0,48#177;0,41
|
0,31#177;0,41
|
0,30#177;0,39
|
|
M. altera
|
Témoin
|
0,59#177;0,45
|
0,55#177;0,31
|
0,54#177;0,37
|
0,38#177;0,45
|
0,30#177;0,48
|
0,30#177;0,48
|
|
P value
|
0,942
|
0,942
|
0,702
|
0,549
|
0,995
|
0,997
|
|
Cu
|
0,38#177;0,23
|
0,28#177;0,24
|
0,26#177;0,29
|
0,24#177;0,36
|
0,24#177;0,36
|
0,24#177;0,36
|
|
E. racemosa
|
Témoin
|
0,27#177;0,32
|
0,23#177;0,29
|
0,12#177;0,28
|
0,00#177;0,00
|
0,00#177;0,00
|
0,00#177;0,00
|
|
P value
|
0,587
|
0,632
|
0,231
|
0,03
|
0,029
|
0,03
|
|
Cu
|
0,17#177;0,05
|
0,12#177;0,10
|
0,07#177;0,09
|
0,04#177;0,09
|
0,03#177;0,08
|
0,01#177;0,06
|
A. metallorum
|
Témoin
|
0,44#177;0,29
|
0,35#177;0,25
|
0,29#177;0,30
|
0,00#177;0,02
|
0,00#177;0,01
|
0,00#177;0,00
|
|
P value
|
0,005
|
0,007
|
0,031
|
0,232
|
0,213
|
0,328
|
|
Cu
|
0,49#177;0,16
|
0,46#177;0,16
|
0,36#177;0,25
|
0,32#177;0,29
|
0,31#177;0,29
|
0,30#177;0,28
|
B. filamentosa
|
|
Témoin
|
0,40#177;0,31
|
0,35#177;0,18
|
0,21#177;0,28
|
0,18#177;0,29
|
0,10#177;0,21
|
0,12#177;0,25
|
|
|
P value
|
0,228
|
0,133
|
0,185
|
0,262
|
0,061
|
0,118
|
|
Cu
|
0,72#177;0,84
|
0,61#177;0,79
|
0,68#177;0,84
|
0,74#177;0,84
|
0,66#177;0,86
|
0,63#177;0,82
|
|
D. diagolanis
|
Témoin
|
0,63#177;0,54
|
0,60#177;0,49
|
0,55#177;0,60
|
0,67#177;0,76
|
0,65#177;0,73
|
0,49#177;0,56
|
|
P value
|
0,774
|
0,98
|
0,684
|
0,83
|
0,97
|
0,634
|
|
Cu
|
0,65#177;0,445
|
0,65#177;0,47
|
0,71#177;0,52
|
0,71#177;0,60
|
0,65#177;0,55
|
0,61#177;0,50
|
|
L. simplex
|
Témoin
|
1,22#177;0,31
|
1,03#177;0,43
|
0,95#177;0,63
|
1,00#177;0,67
|
0,95#177;0,62
|
0,90#177;0,60
|
|
P value
|
0,001
|
0,049
|
0,337
|
0,269
|
0,229
|
0,201
|
|
Cu
|
0,18#177;0,30
|
0,18#177;0,30
|
0,20#177;0,33
|
0,04#177;0,14
|
0,00#177;0,00
|
0,00#177;0,00
|
|
A. shirensis
|
Témoin
|
0,14#177;0,22
|
0,12#177;0,20
|
0,10#177;0,20
|
0,05#177;0,12
|
0,00#177;0,00
|
0,00#177;0,00
|
|
P value
|
0,701
|
0,595
|
0,407
|
0,873
|
0
|
0
|
28
3.1.2. Elongation racinaire
Le tableau 4 montre les différents résultats
obtenus sur l'élongation racinaire sur les espèces
testées. Il ressort que l'espèce M. altera se comporte
différemment dans les deux solutions cuivre et témoin. Les
individus de cette espèce augmentent la longueur de racines de 1,31 cm
au 14ème jours de traitement dans la solution cuivre.
Après le 14ème jour de traitement, les individus
diminuent leurs longueurs racinaires jusqu'à disparaitre à la fin
de l'expérience. Les individus de cette même espèce
enregistrent une diminution de biomasse fraîche durant tous les jours de
traitements. Les racines de E. racemosa diminuent sensiblement. Ces
individus n'ont survécu, ils ont disparu au 28ème
jours. Les racines de A. metallorum présentent réduction
de longueur de racine, mais nous observons une tendance contrairement au
individus de E. racemosa. B. filamentosa présente une
augmentation d'élongation élevée de 0,56cm, au-delà
7ème jours, les individus diminuent la biomasse de 1,95cm. pour ce qui
des individus de D. diagolanis, nous remarquons une réduction
de longueur des racines dans le milieu cuivre et une augmentation de longueur
des racines dans le substrat témoin. Les valeurs moyennes obtenues dans
les milieux cuivre et témoins sont respectivement de 2,06 et 1,83cm.
chez L. simplex, nous remarquons une même allure d'une
légère augmentation dans les deux solutions au 14 premiers jours
de traitement. Enfin, A. shirensis présentent une augmentation
de longueur des racines dans les deux solutions cuivre et témoin au 14
ème jours. Au-delà de 14ème jour, les individus n'ont pas
survécu.
29
Tableau 4: Mesure d'élongation racinaire
en fonction de jours de traitement et solutions. Moyennes #177;
écart-type. Les chiffres en gras indiquent les différences
significatives.
|
Espèces
|
Solution
|
0 jour
|
7 jours
|
14 jours
|
21 jours
|
28 jours
|
35 jours
|
|
M. altera
|
Cu
|
9,19#177;4,27
|
10,96#177;4,10
|
10,50#177;5,22
|
7,59#177;6,36
|
0,00#177;0,00
|
0,00#177;0,00
|
|
Témoin
|
7,35#177;3,63
|
8,59#177;3,74
|
8,35#177;4,85
|
5,80#177;5,,78
|
1,83#177;4,36
|
1,78#177;4,34
|
|
P value
|
0,27
|
0,152
|
0,308
|
0,478
|
0,568
|
0,469
|
|
E. racemosa
|
Cu
|
8,11#177;5,94
|
7,87#177;6,40
|
6,66#177;7,25
|
4,30#177;6,68
|
0,00#177;0,00
|
0,00#177;0,00
|
|
Témoin
|
6,22#177;2,63
|
5,73#177;2,91
|
4,84#177;3,20
|
0,96#177;2,49
|
0,97#177;2,48
|
0,66#177;2,30
|
|
P value
|
0,325
|
0,303
|
0,434
|
0,12
|
0,188
|
0,328
|
A. metallorum
|
Cu
|
6,01#177;1,88
|
4,17#177;3,56b
|
2,29#177;3,00b
|
0,91#177;2,23
|
0,98#177;2,435
|
0,59#177;2,05
|
|
Témoin
|
7,14#177;2,89
|
7,14#177;3,00a
|
5,75#177;4,58a
|
0,09#177;0,31
|
0,13#177;0,46
|
0,00#177;0,00
|
|
P value
|
0,271
|
0,038
|
0,039
|
0,219
|
0,248
|
0,328
|
B. filamentosa
|
|
Cu
|
7,95#177;2,35
|
8,51#177;2,79
|
7,33#177;5,07a
|
6,12#177;5,79
|
6,00#177;5,60a
|
6,00#177;5,62a
|
|
|
Témoin
|
6,23#177;3,74
|
7,05#177;4,23
|
3,30#177;4,31b
|
2,80#177;4,28
|
1,81#177;3,41b
|
1,55#177;3,20b
|
|
P value
|
0,191
|
0,327
|
0,048
|
0,124
|
0,038
|
0,027
|
|
D. diagolanis
|
Cu
|
4,95#177;4,89
|
4,80#177;5,71
|
4,03#177;4,70
|
4,13#177;4,84
|
2,87#177;3,69
|
2,89#177;3,72
|
|
Témoin
|
5,43#177;5,12
|
7,04#177;6,18
|
6,35#177;7,03
|
6,53#177;7,62
|
6,80#177;8,39
|
7,26#177;9,59
|
|
P value
|
0,818
|
0,329
|
0,352
|
0,367
|
0,152
|
0,155
|
|
L. simplex
|
Cu
|
5,53#177;4,60
|
5,55#177;4,68
|
5,96#177;4,86
|
5,40#177;4,81
|
5,25#177;4,66
|
5,12#177;4,54
|
|
Témoin
|
6,81#177;3,34
|
6,52#177;3,47
|
5,45#177;4,27
|
5,25#177;4,15
|
5,10#177;3,98
|
5,13#177;3,91
|
|
P value
|
0,443
|
0,568
|
0,788
|
0,936
|
0,937
|
0,996
|
|
A. shirensis
|
Cu
|
1,29#177;2,13
|
1,43#177;2,34
|
1,50#177;2,44
|
0,34#177;1,18
|
0,00#177;0,00
|
0,00#177;0,00
|
|
Témoin
|
2,16#177;3,57
|
2,47#177;4,38
|
2,36#177;4,89
|
1,84#177;4,70
|
0,00#177;0,00
|
0,00#177;0,00
|
|
P value
|
0,475
|
0,476
|
0,593
|
0,295
|
0
|
0
|
30
3.2. Comportements des espèces graminoïdes en
fonction des milieux de culture utilisés
3.2.1. Biomasse fraîche
Après l'analyse de la variance, les résultats
obtenus sur les comportements des espèces en fonction des solutions
durant 35 jours de culture sont illustrés sur la figure 10.
|
0,25 0,2 0,15 0,1 0,05
0
|
|
|
|
Biomasse fraîche par jour en g
|
|
CuSO4 Témoin
|
|
|
|
|
Espèces
|
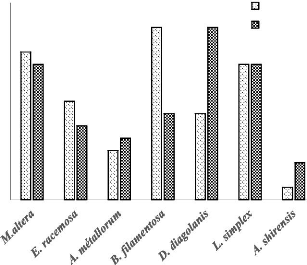
Figure 9: Détermination de biomasse
fraîche moyenne des espèces graminoïdes en fonction de
substrats
Il découle de la figure 9 que trois espèces
présentent une biomasse fraîche moyenne similaire dans les 2
milieux de cultures. Il s'agit de Microchloa altera, Digitaria
diagolanis et Andropogon shirensis. Et deux espèces
Eragrostis racemosa et Bulbostylis racemosa enregistrent une
biomasse supérieure dans le milieu enrichi au cuivre. Par ailleurs,
Loudetia simplex s'est distingué des autres espèces en
présentant une plus grande biomasse dans la solution témoin.
31
3.2.2. Elongation racinaire
La figure 10 représente les valeurs moyennes obtenues
sur la mesure d'élongation racinaire des différentes
espèces soumises dans deux conditions de culture (cuivre et
témoin).
Elongation racinaire par jour en cm
0,8
0,6
0,4
0,2
1,6
1,4
1,2
0
1
CuS04 Témoin
Espèces
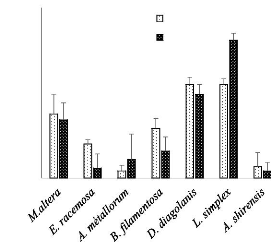
Figure 10: Détermination de la biomasse
fraîche des espèces graminoïdes en fonction de substrats
La figure 11 présente quatre tendances
d'élongation racinaire présentées les espèces
graminoïdes. La première tendance est celle présentée
par les espèces steppiques Microchloa altera et Eragrostis
racemosa. Ces espèces montrent une élongation
supérieure dans le milieu contaminé au cuivre. La deuxième
tendance observée est que Ascolepis metallorum et Digitaria
diagolanis donnent des grandes valeurs moyennes d'élongation
racinaire (respectivement 0,5 et 1,4 cm) dans la solution sans témoin.
La troisième tendance est que Bulbostylis filamentosa se
distingue des autres espèces
Il résulte de la figure 12 que l'espèce
Loudetia simplex s'est comportée bien des autres espèces
M. altera, E. racemosa, B. filamentosa et D. diagolanis
espèces en présentant une grande biomasse
32
en présentant une grande valeur moyenne
d'élongation racinaire (1,4cm) dans la solution cuivre. Enfin,
Loudetia simplex se comporte de la même manière dans les
milieux de culture en présentant une élongation racinaire
similaire de 1,1 cm dans les deux milieux de culture.
3.3. Détermination des teneurs en matières
sèches des espèces graminoïdes
Les résultats de la teneur en matières sèche
issus de l'analyse de la variance sont présentés sur la figure
12.
|
0,45 0,40 0,35 0,30 0,25 0,20 0,15 0,10 0,05 0,00
|
|
|
|
Teneur en matière sèche en g
|
|
CuS04 Témoin
|
|
Espèces étudiées
Figure 11: Détermination de la teneur en
matière sèche.
N.B : les espèces Ascolepis
metallorum et Andropogon shirensis qui ne sont pas sur le
graphique n'ont pas survécu à la fin de l'expérience.
Légende : les individus de Ascolepis metallorum
et Andropogon shirensis étaient morts à la fin de
l'expérience.
33
Moyenne de biomasse fraîche en g
0,8
0,6
0,4
0,2
1,2
0
1
Espèces étudiées
CuSO4 Témoin
sèche dans les deux solutions cuivre et témoin,
mais elle enregistre la teneur la plus élevée dans la solution
témoin. Les valeurs moyennes obtenues sont respectivement de 0,25 et
0,39g. Il ressort également que l'espèce Bulbostylis
filamentosa donne une biomasse élevée (0,28g) dans le milieu
témoin, mais cette valeur est inférieure par rapport à
celle obtenue chez Loudetia simplex. En effet, Microchloa altera
présente des biomasses sèches presque similaires 0,08 et
0,07g dans les conditions de culture (cuivre et sans cuivre). Deux autres
espèces Eragrostis racemosa et Digitaria diagolanis
montrent une teneur en matière sèche élevée
dans le substrat enrichi en cuivre. Par ailleurs.
3.4. Evolution des espèces en fonction des jours
de traitement
3.4.1. Biomasse fraîche
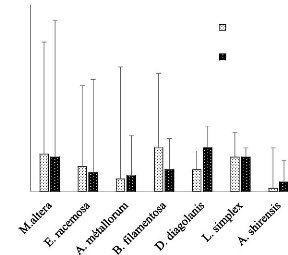
La figure 12 représente les moyennes des valeurs
obtenus dans 35 jours d'évolution des biomasses fraîches.
Figure 13:Moyennes d'élongation
racinaire
34
Figure 12: Moyennes des biomasses
fraîches
Les résultats de l'analyse de la variance
révèlent que M. altera, L. simplex et D. diagolanis
sont très tolérants au cuivre. Ces espèces
présentent des valeurs moyennes supérieures de 0,66g dans le
milieu enrichi en cuivre. En plus E. racemosa et B. filamentosa
sont un peu tolérant au cuivre donnent. Ces espèces
enregistrent des biomasses moyennes respectivement 0,25 et 0,35g. enfin, A.
shirensis est moins tolérant au cuivre et donne des moyennes
presque nulles.
3.4.2. Elongation racinaire
Les valeurs moyennes obtenues sur la longueur des racines en
fonction de 36 jours d'expérience sont représentées sur la
figure13.
CuS04 Témoin
Moyenne d'élongation racinaire (cm)
6
5
4
3
2
1
0
Espèces étudiées
35
Il découle de cette analyse que trois espèces
M. altera, B. filamentosa et L. simplex présentent une
longueur de racine supérieur en présence du cuivre. Leurs valeurs
moyennes enregistrées sont notamment 1,2, 1,4 et 1,1cm. ces
espèces sont très tolérant au cuivre. Toutefois, E.
racemosa, A. Metallorum et D. diagolanis donnent des valeurs
inférieures et elles sont moins tolérants au cuivre. Aussi A.
shirensis enregistre des plus petites valeurs d'élongation
racinaire quasiment nulles.
3.5. Détermination de l'indice de tolérance
des espèces graminoïdes
Le tableau 5 montre les différents indices de
tolérance au cuivre des espèces graminoïdes. Il ressort que
les espèces de la steppe présentent une valeur moyenne de
l'indice de tolérance élevé de biomasse fraîche
(It =163) par rapport aux espèces de la savane et de large
amplitudes écologiques. Il ressort au niveau d'élongation
racinaire que les espèces de la savane enregistrent un indice de
tolérance supérieur (It=127,5) comparativement aux
espèces de la steppe et de large amplitude écologique. Cet indice
de tolérance obtenu reste inférieur à celui obtenu sur la
biomasse fraîche sur les mêmes espèces. Toutefois, les
espèces de larges amplitudes écologiques présentent des
indices de tolérances inférieures sur la biomasse fraîche
et élongation racinaire respectivement 11,5cm et 7,4 g.
Tableau 5: Indices de
tolérance des 7 espèces graminoïdes
étudiées.
|
Espèces
|
Indice de tolerance au cuivre
|
|
Biomasse fraîche
|
Elongation racinaire
|
|
Microchloa altera
|
91
|
111
|
|
Eragrostis racemosa
|
357
|
142
|
|
Ascolepis metallorum
|
41
|
65
|
|
Moyen des espèces Steppiques
|
163
|
106
|
|
Bulbostylis filamentosa
|
184
|
200
|
|
Digitaria diagolanis
|
111
|
55
|
|
Moyenne des espèces de la savane
|
147,5
|
127,5
|
|
Loudetia simplex
|
68
|
100
|
|
Andropogon shirensis
|
155
|
48
|
|
Moyenne des espèces de large
|
111,5
|
74
|
36
Chapitre 4. Discussion des résultats
Quel que soit les conditions de culture, il résulte que
les espèces présentent des comportements similaires sur la
biomasse fraîche, l'élongation racinaire et les indices de
tolérances au cuivre.
Les résultats obtenus sur la biomasse fraîche des
espèces présentent trois niveaux d'évolution de la
biomasse fraîche. La première tendance est observée sur les
deux espèces Microchloa altera et Digitaria diagolanis
qui ont augmenté leurs biomasses, mais leurs valeurs moyennes
restent inférieures dans la solution cuivre. La diminution des biomasses
fraiches de ces espèces seraient dus aux concentrations de cuivre
utilisées par rapport à celles retrouvées dans la solution
aqueuse sur la colline du cuivre (Kaya et al., 2015). Pour ce qui
concerne Microchloa altera, la biomasse fraîche
élevée obtenue pourrait être expliqué par le fait
que cette espèce est généralement colonisatrice des
substrats cuprifères les plus toxiques constitués par les
remblais miniers et les friches industrielles à proximités des
usines métallurgiques (Ngoy, 2010). Microchloa altera alloue
beaucoup de ressources en reduisant les prélèvements des
métaux par les racines ou une réduction de leur translocation
vers les parties aériennes pour s'adapter aux stress
édaphiques.
La deuxième tendance observée chez Loudetia
simplex a montré une même de tolérance. Toutefois, la
biomasse élevée a été obtenue dans la solution
témoin. L'hypothèse émise pour ce résultat obtenu
est que cette espèce s'adapterait dans un milieu enrichi au cuivre et
sans cuivre. Ces résultats obtenus permettraient de qualifier cette
espèce comme espèce de large amplitude écologique. Enfin,
quatre espèces Eragrostis racemosa ; Ascolepis metallorum,
Bulbostylis filamentosa et Andropogon shirensis ont
présenté une diminution de leurs biomasses fraîches dans
les deux solutions. Cette diminution serait dû à la concentration
du cuivre utilisée dans cette recherche qui pourrait être en
faible concentration.
Cependant, les résultats obtenus sur
l'élongation racinaire des espèces indiquent deux situations
d'évolution de racines. Premièrement, une augmentation de
longueur des racines chez trois espèces Microchloa altera,
Bulbostylis racemosa et Digitaria diagolanis dans le substrat
cuivre. Cette situation serait due aux mécanismes adaptation des plantes
dans un milieu. Deuxièmement, une diminution d'élongation
racinaire de Eragrostis racemosa, Loudetia simplex et
Andropogon shirensis dans tous les milieux de culture. Eragrostis
racemosa présente une élongation supérieure dans la
solution Cuivre. Contrairement à Eragrostis racemosa,
Andropogon shirensis donne la
37
longueur des racines élevée dans la solution
témoin. Par ailleurs, Loudetia simplex présente la
même allure de diminution d'élongation racinaire dans tous les
substrats utilisés. Ceci pourrait être expliquée par les
réponses des plantes à un stress abiotique qui sont
différentes. L'hypothèse de la diminution d'élongation
racinaire de ces espèces seraient les racines sont des organes sensibles
au cuivre par le contact direct (Stiborva et al., 1986 ; Jarvis et
Whitehead, 1993, Kopittke et al., 2007). Cette sensibilité au
cuivre serait une réponse de la forte accumulation dans ces organes
ainsi que la faible translocation du cuivre vers les parties aériennes.
Cependant, certaines littératures mettent en évidence que la
réduction de longueur des racines est une des réponses les plus
fréquentes et la première observable lorsque des plantes sont
soumises à un stress édaphiques (Baker et Walker, 1989 ; Adriano,
2001 ; Sandalio et al., 2001 ; Jiang et al., 2005 ; Yrueia,
2005). Le comportement d'Andropogon shirensis résulte du
gradient de cuivre rencontrée sur les affleurements
métallifères. Ces résultats obtenus sont en corroboration
parfaite avec ceux de Mench et al. (1988) chez la culture de maïs
dans les mêmes conditions de culture. L'élongation racinaire de
maïs dépendait de la nature des métaux et de leur
concentration dans la solution. En présence de Pb, Zn ou Cd,
l'élongation racinaire des plantules ne diffère pas de celui du
témoin
Le test d'indices de tolérance des espèces
graminoïdes indique trois niveaux de tolérance. Le premier niveau
concerne les espèces de la savane qui ont présenté un
indice de tolérance supérieur sur les tests de biomasse
fraîche et élongation racinaire. Ces résultats obtenus
expliqueraient le principe d'allocation des ressources des plantes pour leur
tolérance dans le milieu. Ngoy (2010), Baker & Walker (1990) ont
rapporté trois stratégies de tolérance que les plantes
font recours dans le milieu à forte concentration élevée
des métaux lourds : (i) les plantes réduisent les
prélèvements des métaux au niveau des racines ainsi
qu'à leurs translocations dans les parties aériennes pour une
large gamme de concentration des métaux dans le sol.; (ii) les plantes
font une translocation des métaux dans les parties aériennes dont
la concentration est corrélée aux concentrations des
métaux dans le sol, (iii) les plantes accumulent les métaux dans
leurs parties aériennes en concentrations plus élevées que
celles observées dans les racines.
Le second niveau porte les espèces de la steppe qui ont
montrées des indices de tolérance faible sur les tests
radiculaire et biomasse. Ces résultats obtenus résulteraient des
mécanismes de tolerance au cuivre que ces espèces utilisent pour
s'adapter dans le milieu empoissoneux au cuivre en investissant leurs
ressources sur au niveau de l'enracinement.
38
Le troisième niveau de tolérance concerne les
espèces de large amplitude écologique Loudetia simplex
et Andropogon shirensis qui ont présentées des indices
de tolérance faibles sur les deux test biomasse et élongation
racinaire. Ce résultat obtenu impliquerait que ces espèces
peuvent s'adapter dans le milieu en présence ou en absence du cuivre.
Ilunga wa Ilunga (2010) a démontré les différents groupes
écologiques aux affinités contrastées pour le cuivre,
parmi lesquels nous avons (1) Cuprophytes, les plantes colonisant presque
uniquement sur gisement de cuivre. (2) Cuprophiles ; qui se distribuent
localement dans les zones à concentration relativement faible en cuivre
mais supérieure à la normale. (3) Cuprorésistantes : les
plantes qui existent dans la même région sur sol cuprifères
que sur sols normaux. En rapport de nos résultats obtenus, le
résultat a permis de classer les espèces dans la classe de
Cuprorésistantes.
39
Conclusion et perspectives
Le présent travail avait pour objectif principal de
mesurer la tolérance au cuivre des 7 espèces de graminoïdes
et mettre en évidence un éventuel coût de tolérance
au cuivre chez ces espèces cupricoles.
L'essai a été installé suivant un
dispositif split splot comprenant 7 espèces, 2 traitements et 12
répétitions. Le premier milieu a été
contaminé avec la solution 50uMCuSO4.5H2O M=249.68g/mol et le
deuxième milieu sans contamination, a été
considéré comme témoin. Les résultats de cette
étude ont permis de mettre en évidence trois tendances de
tolérance au cuivre des espèces de graminoïdes. Il a
été prouvé que les espèces savanes investissent
beaucoup de ressources aux parties aériennes que l'élongation
racinaire. En plus, les espèces de la steppe présentent un indice
de tolérance faible au test de biomasse en compensant leurs
énergies à l'enracinement.
Les indices de tolérance des espèces
récoltées sur la colline cuprifère varient en grande
quantité. Ces résultats montrent les espèces de la savane
peuvent être utilisées dans l'application de
phytoremédiation vues leurs biomasses et accumulations des plantes.
D'une manière générale, il revient de
signaler que les espèces du sommet de gisement métallifère
tolèrent bien le cuivre. Cette tolérance de ces espèces
peut être valorisable dans la phytoremédiation et
phytostabilisation des milieux contaminés aux métaux lourds.
Les suggestions que nous pouvons recommander aux futurs
chercheurs intéressés sur le domaine de notre étude sont
telles que :
? Utiliser les doses variées de sulfate de cuivre et
soumettre les mêmes espèces en vue de mesurer leurs
tolérances au cuivre,
? Envisager un essai en utilisant les graines des espèces
dans le but d'estimer les coûts de tolérance.
Nous supposons que les résultats obtenus dans cette
expérience permetter aient la valorisation des espèces
graminoïdes dans la révégétation et la
phytoremédiation des milieux contaminés aux métaux
lourds.
40
Références bibliographiques
Adriano, D.C. (2001). Trace elements in terrestrial
environments: Biochemistry, bioavailability and risks of metals.
Springer-Verlag, New York.
Allen, W.R., Sheppard, P.M., 1971. Copper Tolerance in Some
Californian Populations of the Monkey Flower, Mimulus guttatus. Proceedings of
the Royal Society of London Series B Biological Sciences. 177, 177-196.
Antonovics J., Bradshaw A.D., Turner R.G., 1971. Heavy metal
tolerance in plants. Advances in Ecological Research 7: 1-85.
http://dx.doi.org/10.1016/S0065-2504(08)60202-0.
Baker A.J.M. et al. (1983). Studies on copper and
cobalt tolérance in three closely related taxa within the genus Silene
L. (Caryophyllaceae) from Zaïre. Plant and Soil 73 : 377385.
Baker AJM, Brooks RR., 1989a. Terrestrial higher plants which
hyperaccumulate metallic elements: A review of their distribution, ecology and
phytochemistry. Biorecovery 1:81-126.
Baker, A. J. M., Grant, C. J., Martin, M. H., Shaw, S. C.
& Whitebrook, J.,1986. Induction and loss of cadmium tolerance in
Holcus lanatus L. and other grasses. New Phytologist,
102, 575-587.
Baker, A.J.M. and Walker, P.L.,1989b. Ecophysiology of metal
uptake by tolerant plants. In Heavy
metal tolerance in plants - Evolutionary aspects. Shaw, A.
(Eds). CRC Press, Baker, A.J.M., Walker, P.L., 1990. Ecophysiology of Metal
uptake by tolerant plants, in: Shaw
A.J. ed, Heavy Metal tolerance in plants: Evolutionary
Aspects, 155-177.
Benavides MP, Gallego SM et Tomaro ML., 2005. Cadmium toxicity
in plants. Braz J Plant Physio. 17 :21-34.
Bourrelier P.H., Berthelin J., 1998. Contamination des sols
par les éléments en traces : les risques et leur gestion.
Académie des sciences, rapport n°42. Paris : Tec & Doc
Lavoisier.
Boyd, R.S., 2004. Ecology of metal hyperaccumulation. New
Phytologist. 162, 563-567.
41
Bradshaw, A. D. (1976). Pollution and evolution. In:
Effects of Air Pollutants on Plants (Ed. by T. A. Mansfield), pp.
135-159. Cambridge University Press,
Bradshaw, A.D., 1952. Populations of Agrostis tenuis
resistant to lead and zinc poisoning. Nature 169: 1098.
Bradshaw, AD., 2000. The use of natural processes in
reclamation-advantages and difficulties. Landscape and Urban Planning
51:89-100.
Bradshaw. AD, 1984. In evolutionary ecology. Shorrocks, B.Ed.).
pp1-25.
Bradshaw. Pollution and evolution. In: Effects of Air
Pollutants on Plants (Ed. by T. A.
Bratteler, M., 2005: Genetic architecture of traits associated
with habitat adaptation in Silene vulgaris (Caryophyllaceae).
Doctorate Thesis. Zürich, ETH Zürich.
Briat JF et Lebrun M, 1999. Plant reponses to metal toxicity.
Plant Bio Patho. 322 :42-53
Brooks, Malaisse. 1990. Metal-Enriched sites in South Central
Africa. In Heavy Metal Tolerance in
Plants: Evolutionary Aspects. Shaw J. A. (ed.). CRC Press,
New York 18, 53-73 Brooks, R. R. & Malaisse, E. ,1985. The Heavy
Metal-tolerant Flora of South-Central Africa.
Balkema, Rotterdam.
Brooks, R. R., A. J. M. Baker, and F. Malaisse. 1992. Copper
flowers. National Geographic Research & Exploration 8:338-351.
Cailteux, J.L.H., Kampunzu, A.B., Lerouge, C., Kaputo, A.K.,
Milesi, J.P., 2005a. Genesis of sediment-hosted stratiform copper-cobalt
deposits, central African Copperbelt. Journal of African Earth Sciences
42, 134-158.
Cheng SP, 2003. Heavy metal pollution in China: origin,
pattern and control. Environ Sci Pollut. Chipeng, F., Hermans, C.,
Colinet, G., Faucon, M.P., Ngongo Luhembwe, M., Meerts, P.,
Verbruggen, N., 2010. Copper tolerance in the cuprophyte
Haumaniastrum
katangens (S. Moore) P.A. Duvign. & Plancke.
Plant and Soil. 328, 235-245. Clemens, 2006. Toxicity metal
accumulation, reponses to exposure and mechanisms of tolerance in
plants. Biochem. 88(11) :1707-1719.
42
Craig, 1977. A method of measuring heavy metal tolerance in
grasses. Transactions of the Rhodesian Scientific Association, 58, 9-16.
Davis R.D., Beckett P.H.T., 1978. Upper critical levels of
toxic elements in plants. II. Critical levels of copper in young barley, wheat,
rape, lettuce and ryegrass, and of nickel and zinc in young barley and
ryegrass. New Phytologist, 80, 23-32.
Davis TA, Volesky B, Mucci A (2003) A review of the
biochemistry of heavy metal biosorption by brown algae. Water Res 37
:4311-4330.
Deneux-Mustin, S., Roussel-Debet, S., Mustin, C., Henner, P.,
Munier-Lamy, C., Colle, C., Berthelin, J., Garnier-Laplace, J., Leyval, C.,
2003. Mobilité et transfert racinaire des éléments en
traces (influence des micro-organismes du sol).
Dietz KJ, Baier M, Krämer U., 1999 Free radicals and
reactive oxygen species as mediators of heavy metal toxicity in plants. In:
Prasad MNV, Hagemeyer J (eds) Heavy metal stress in plants: from molecules
to ecosystems. Springer, Berlin.
Duvigneaud P. et Denaeyer-De Smet S., 1973.
Considération sur l'écologie de la nutrition minérale des
tapis végétaux naturels. Oecol. Plant., 8, (3),
219-246.
Duvigneaud P., 1958. La végétation du Katanga et
des sols métallifères. Bull. de la Soc. Roy. De
Botanique de Belgique 90: 127-286.
Duvigneaud P., Denaeyer-de Smet S.,1963. Cuivre et
végétation au Katanga. Bull. Soc. r.Bot. Belg. 96 : 92-
231.
Duvigneaud, P., 1958a. La végétation du Katanga
et des sols métallifères. Bulletin de la Societe Royale De
Botanique De Belgique. 90, 127-286.
Duvigneaud, P., 1959. Plantes cobaltophytes dans le
Haut-Katanga. Bulletin de la Société Royale de Botanique de
Belgique. 91, 111-134.
Duvigneaud, P., and S. Denaeyer-De Smet. 1963. Cuivre et
végétation au Katanga. Bulletin de la Société
Royale de Botanique Belge 96 :92-231.
Ernst WHO (1990) Mine vegetation in Europe. In Heavy Metal
Tolerance in Plants: Evolutionary Aspects. Shaw J. A. (ed.). CRC
Press, New York 18:21-38
Ernst, W. (1974a). Schwermetallvegetation der Erde.
Eischer-Verlag, Stuttgart.
Ernst, W.H.O., 1983: Ökologische Anpassungsstrategien an
Bodenfaktoren. Ber. Dtsch. Bot. Ges. 96: 49-71.
43
Ernst, W.H.O.; Nelissen, H.J.M.; Ten Bookum, W.M., 2000:
Combination toxicology of metal enriched soils: physiological responses of a
Zn- and Cd-resistant ecotype of Silene vulgaris on polymetallic soils.
Environ. Exp. Bot. 43: 55-71.
Ernst, W.H.O.; Schat, H.; Verkleij, J.A.C., 1990: Evolutionary
biology of metal resistance in Silene vulgaris. Evolutionary Trends in
Plants 4: 45-51.
Ernst, W.H.O.; Verkleij, J.A.C.; Schat, H.; 1992: Metal
tolerant plants. Acta Bot. Neerl. 41: 229- 248.
Ernst, W.H.O.; Verkleij, J.A.C.; Schat, H.; 1992: Metal
tolerant plants. Acta Bot. Neerl. 41:229- 248.
Faucon, E Ilunga, B Lange, S. Boisson, M Seleck, S Le Stradic,
M. Shutcha, C. Grison, O. Pourret, P. Meerts, G. Mahy, 2015. Implications des
relations sol-plante en ingénierie écologique des habitats et
sols métallifères dégradés, le cas des habitats
riches en cuivre du Katanga (République Démocratique du
Congo).
Faucon, M. P., Chipeng, F., Verbruggen, N., Mahy, G., Colinet,
G., Shutcha, M., Pourret, O., & Meerts, P. 2012a. Copper tolerance and
accumulation in two cuprophytes of South Central Africa: Crepidorhopalon
perennis and C. tenuis (Linderniaceae). Environmental and
Experimental Botany, 84, 11-16.
Faucon, M.-P., A. Meerseman, M. Ngoy Shutcha, G. Mahy, M.
Ngongo Luhembwe, F. Malaisse, and P. Meerts. 2010. Copper endemism in the
Congolese flora: a database of copper affinity and conservation value of
cuprophytes. Plant Ecology and Evolution 143:5-18.
Faucon, M.-P., I. Parmentier, G. Colinet, G. Mahy, M. Ngongo
Luhembwe, and P. Meerts, 2009. May rare metallophytes benefit from disturbed
soils following mining activity? The case of the Crepidorhopalon tenuis
in Katanga (D. R. Congo). Restoration Ecology (in press), doi:
10.1111/j.1526-100X.2009.00585. x.
44
Grime, J.P., 1979. Plant Strategies and Vegetation Processes.
John Wiley & Sons, ChichesterHaeupler, H.; Schonfelder, P., 1988: Atlas der
Farn- und Blütenpflanzen der Bundesrepublik Deutschland. Stuttgart, E.
Ulmer.
Haldane, J.B.S., 1954: The biochemistry of genetics. London,
G. Allen
Harper FA, Smith SE, Macnair MR (1997) Can an increased copper
requirement in coppertolerant Mimulus guttatus explain the cost of
tolerance? Vegetative growth. New Phytol 136:455-467.
Humphreys M.O., Nicholls M.K., 1984 - Relationships between
tolerances to heavy metals in Agrostis capillaris l. (A. Tenuis Sbth).
New Phytol. 98, pp. 177-190.
Ilunga wa Ilunga Edouard, Mahy Grégory, Piqueray
Julien, Séleck Maxime, Ngoy Shutcha Mylor, Pierre Meerts, Faucon
Michel-Pierre, 2015. Plant functional traits as a promising tool for the
ecological restoration of degraded tropical metal-rich habitats and
revegetation of metal-rich bare soils: A case study in copper vegetation of
Katanga, DRC. Ecological Engineering. 82(2015) :214-221.
Ilunga Wa Ilunga, 2010. Caractérisation des relations
plantes- sol sur la colline cuprifère de Kinsevere. DEA.
Inédit.
Ilunga wa Ilunga, 2014. Les communautés
végétales des affleurements de roches métallifères
: Une ressource biologique pour la restauration des mines et des sols
dégradés par les activités minières dans le Haut
Katanga (R.D.Congo). Thèse de doctorat en sciences
agronomiques.131p
Ilunga wa Ilunga, E., Séleck, M., Colinet, G., Faucon,
M.-P., Meerts, P., Mahy, G., 2013. Small-scale diversity of plant communities
and distribution of species niches on a copper rock outcrop in Upper Katanga,
D.R. Congo. Plant Ecology and Evolution. 146,
Jiang LY, Yang XE, Chen JM., 2008. Copper tolerance and
accumulation of Elsholtzia splendens Nakai in a pot environment. J Plant
Nutr 31:1382-1392
Jiang W., Liu D., Li A., 2000 - Effects of Cu2+ on
root growth; Cell Division and Nucleolus of Helianthus annuus L. Sci. Tot.
Environ. 256, p 59.
Jiang, R.F., Ma, D.Y., Zhao, F.J., McGrath, S.P., 2005.
Cadmium hyperaccumulation protects Thlaspi caerulescens from leaf
feeding damage by thrips (Frankliniella occidentalis). New Phytol.
167, 805-814.
45
Johnston & Proctor (1981. Growth of serpentine and
non-serpentine races of Festuca rubra in solutions simulating the
chemical conditions in a toxic serpentine soil. Journal of Ecology,
69, 855-869.
Karadaglis, 1980. Behaviour oi Agrostis tenuis
populations against copper ions in combination with the absence of some
macro-nutrient elements. Bericht der Deutschen Botanischen Gesellschaft,
93, 417-424.
Kaya D, 2008. Contribution à l'étude des
facteurs de distribution spatiale des teneurs en éléments trace
métalliques dans le sol et les sédiments dans le quartier
Gécamines. Mémoire DEA. Inédit.
Kazakou E, Dimitrakopoulos PG, Baker AJM, Reeves RD, 2008.
Hypotheses, mechanisms and trade-offs of tolerance and adaptation to serpentine
soils: from species to ecosystem level. Biological Reviews
83:485-508
Kopittke PM, Asher C.J, Blamey FPC et Menzies NW, 2007. Toxic
effect of Pb2+on growth of cowpea (vigna unguiculata).
Environ Poll. 150 :280-287.
Kruckeberg, A.R., 1984. California serpentines: flora,
vegetation, geology, soils and management problems, University of California
Press, California.
Lefebvre, 1968. Note sur un indice de tolerance au zinc chez
des populations d'Armeria maritima
(Mill.) Willd. Bulletin de la Societe Royale de Botanique
de Belgique, 102, 5-11. Leteinturier et Malaisse. 1999. The copper flora
of Katanga : a phytogeographical analysis. Geo-
Eco-Trop. 23 : 31-48.
Leteinturier, B. 2002 Evaluation du potentiel
phytocénotique des gisements cuprifères d'Afrique centro-australe
en vue de la phytoremédiation de sites pollués par
l'activité minière. PhD. Thèses de doctorat,
Faculté des Sciences Agronomiques de Gembloux, Belgium. 361 pp.
Lou LQ, Shen ZG, Li XD., 2004. The copper toleranc mechanisms
of Elsholtzia haichowensis, a plant from copper-enriched soils. Environ Exp
Bot 51:111-120. doi: 10.1016/j.envexpbot.2003.08.002.
Macnair MR., 1981. The uptake of copper plants of Mimulus
guttatus differing in genotype primary at a single major copper tolerance
locus. New Phytologist 88 :723-730.
Macnair, 1977. Major genes for copper tolerance in Mimulus
guttatus. Nature, 268, 428-430.
46
Macnair, M.R. & Watkins, A.D.,1983. The fitness of the
copper tolerance gene in Mimulus guttatus in uncontaminated soil.
New Phytologist 95, 133-137.
Macnair, M.R., 1987: Heavy metal tolerance in plants: a model
evolutionary system. Trends Ecol. Evol. 2: 354-359.
Malaise F., Brooks, R.R. et Baker, R.R, 1994. Diversity of
vegetation communities in relation to soil heavy content at the Shinkolobwe
copper cobalt/ uranium minerazation, Upper Shaba, Zaïre. Belg. Journ.
Bot., 127(7) :3-16.
Malaisse F., Brooks R.R., Baker A.J.M. (1994) Diversity of
vegetation communities in relation to soil heavy metal content at the
Shinkolobwe copper/cobalt/uranium mineralisation, Upper Shaba, Zaïre.
Belgian Journal of Botany 127: 3-16.
Malaisse F.,1995. Cuivre et végétation au Shaba
(Zaïre): Bull. Séances. Acad. r. Sci. Outre-Mer 40 (1994-4) :
561-580.
Marschner H (1995). Mineral nutrition of higher plants 2nd edn.
Academic Press, London.
Mench M., Morel J., Guckertet.A. (1988) Action des
métaux [Cd(II), Cu(II), Pb(II), Zn(II)] sur la production d'exsudats
racinaires solubles chez le maïs (Zea mays L.). Biol. Fertil. Soils.,
3, 165-169.
Morrey, D.R., 1995. Using metal-tolerant plants to reclaim
mining wastes. Mining Engineering. 47, 247-249.
Morrison RS, Brooks RR, Reeves RD, Malaisse F., 1979. copper
and cobalt uptake by metallophytes from Zaïre. Plant Soil
53:535-539
Ngoy, 2010. Phytostabilisation des sols contaminés en
métaux lourds par l'activité minière au Katanga « Cas
du quartier Gécamines/Penga Penga contaminés en métaux par
les émissions de la fonderie de cuivre de l'Usine
Gécamines/Lubumbashi ». Gestion des Ressources Naturelles.
Lubumbashi : Université de Lubumbashi).
Nicholls & McNeilly, 1979. Sensitivity of rooting and
tolerance to copper in Agrostis tenuis Ouzounidou, G., 1995: Effect of
copper on germination and seedling growth of Minuartia, Silene, Alyssum
and Thlaspi. Biol. Plant. 17: 411-416.
Pardon, R. Clemente, L. Epelde, C. Garbisu, 2014. Evaluation of
the phytostabilisation efficiency in a trace elementscontaminated soil using
soil health indicatorsT. Journal of Hazardous Materials 268: 68-
76.
47
Pollard, 1980. Diversity of metal tolerance in Plantago
lanceolata L. from the southeastern United States. New Phytologist,
86, 109-117.
Pollard, A. J., Powell, K. D., Harper, F. A. & Smith, J.
A. C. (2002). The Genetic Basis of Metal
Hyperaccumulation in Plants. Critical Reviews in Plant Science
21, 539-566. Pollard, A.J., Baker, A.J.M., 1997. Deterrence of herbivory by
zinc hyperaccumulation in Thlaspi
caerulescens (Brassicaceae). New Phytol. 135, 655-658
Potters G, Pasternak TP, Guisez Y, Palme KJ, Jansen MAK, 2007
Stress-induced
Prasad MNV, Freitas HMO (2003) Metal hyperaccumulation in
plants-biodiversity prospecting for phytoremediation technology. Electron
Biotechol 6(3). doi:10.2225/vol6-issue3-fulltext-6.
Reeves R (2006) Hyperaccumulation of trace elements by plants.
In: Phytoremediation of metal contaminated soils. NATO Sci Ser IV Earth
Environ Sci 68 :25-52.
Saad Layla, Ingrid Parmentier, Gilles Colinet, Francois
Malaisse, Michel-Pierre Faucon, Pierre Meerts, and Gregory Mahy, 2012.
Investigation the Vegetation-Soil Relationships on the Copper-Cobalt Rock
Outcrops of Katanga (D. R. Congo), an Essential Step in a Biodiversity
Conservation Plan.
Sandialo L.M., Dalurzo H.C., Gómez M., Romero-Puertas
M.C., del Río L.A., 2001. Cadmium-induced changes in the growth and
oxidative metabolism of pea plants. J. Exp. Bot., 52: 2115-2126.
Schachtman D.P. & R. Munns, 1992.- Sodium accumulation in
leaves of Tritium species that differ in salt tolerance. Austr. J.
Plant Physiol., 19 (3), 333-339.
Schat, H.; Sharma, S.S.; Voojs, R., 1997b: Heavy metal-induced
accumulation of free proline in a metal-tolerant and a nontolerant ecotype of
Silene vulgaris. Physiol. Plant.101: 477-482.
Schat, H.; Vooijs, R., 1997a: Multiple tolerance and
co-tolerance to heavy metals in Silene vulgaris: a co-segregation
analysis. New Phytol. 136: 489-496.
Schwanitz, F.; Hahn, H.,1954:
Genetisch-entwicklungsphysiologische Untersuchungen an Galmeipflanzen. I.
Pflanzengrösse und Resistenz gegen Zinksulfat bei Viola lutea Hudson,
Minuartia verna L., und Silene inflata Sm. Zeitschrift für Botanik
42: 179- 190.
Sharma et Dubey, 2005. Lead toxicity in plants. Braz J
Plant Physio. 17 (1):35-52.
48
Shaw, Rorison & Baker, 1982. Physiological mechanisms of
heavy metal tolerance in plants. Annual Report, Unit of Comparative Plant
Ecology (NERC), University of Sheffield, pp. 13-15.
Stiborva M.M., Doubravou A.A., Brezinova E., Friedricha A.,
1986 - Effect of heavy ions on growth and biochemical characteristics of
photosynthesis of barley. Photosynthetica 20 ; pp. 418-425.
Taleisnik E.L. & K. Grunberg, 1994.- Ion balance in tomato
cultivars differing in salt tolerance. Sodium and potassium accumulation and
fluxes under moderate salinity. Physiol. Plant., 92, 528-534.
Verkleij, J.A.C.; Koevoets, P.L.M.; Blake-Kalff, M.M.; A.,
Chardonnens, A.N., 1998: Evidence for an important role of the tonoplast in the
mechanism of naturally selected zinc tolerance in Silene vulgaris. J.
Plant Physiol. 153 : 188-191.
Vidic T, N Jogan, D Drobne et B Vihlar, 2006. Natural
revegetation in the vicinity of the former lead smelter in Zerjav, Slovenia.
Environment Science & Technology 40: 41194125.
Violle, C. & Jiang, L. 2009. Towards a trait-based
quantification of species niche --Journal of Plant Ecology 2: 87-93.
Whitebrook, 1986. Heavy metal tolerance and tetraploidy in
Leucanthemum vulgare L. (Compositae). Ph.D. thesis. University of
Bristol
Whiting S.N., Reeves R.D., Baker A.J.M. (2002) Mining,
metallophytes and land reclamation. Mining Environmental Management 10:
11-16.
Whiting, S.N., Reeves, R.D., Richards, D., Johnson, M.S.,
Cooke, J.A., Malaisse, F., Paton, A., Smith, J.A.C., Angle, J.S., Chaney, R.L.,
Ginocchio, R., Jaffré, T., Johns, R., McIntyre, T., Purvis, O.W., Salt,
D.E., Schat, H., Zhao, F.J., Baker, A.J.M., 2004. Research priorities for
conservation of metallophyte biodiversity and their potential for restoration
and site remediation. Restoration Ecology. 12, 106-116.
Wilkins D.A., 1960. The measurement and genetical analysis of
lead tolerance in Festuca ovina. Rep. Scott. Pl. Br. St., 85-98.
Wilkins, 1978. The measurement and genetical analysis of lead
tolerance in Festuca ovina. Report of the Scottish Plant Breeding Station,
I960, pp. 85-98.
49
Wilkins, D.A., 1957.Atechnique for the measurement of lead
tolerance in plants. Nature 180, 37- 38.
Wilson, J.B.,1988. The cost of heavy-metal tolerance : an
example. Evolution, 42, 408-403
Wong, M.H., 1982: Metal cotolerance to copper, lead, and zinc
in Festuca rubra. Environmental Research 29: 42-47.
Wu L. & Antonovics J. (1975). Zinc and copper uptake by
Agrostis stolonifera tolerant to zinc and copper. New
physiologist. 75 : 231-237 p.
Wu, L.; Bradshaw, A.D.; Thurman, D.A., 1975: The potential for
the evolution of heavy metal tolerance in plants. III. The rapid evolution of
copper tolerance in Agrostis stolonifera. Heredity 34: 165-187.
Wyn Jones R.G., 1981. Salt tolerance. In:
Physiological process limiting plant productivity. C.B.P. Johnson
(ed.), 271-292.
Yruela, 2005. Copper in plants. Braz J Plant Physiol.
17: 145-156;
|
|



