|

BURKINA FASO
Unité - Progrès -
Justice
MINISTERE DES ENSEIGNEMENTS
SECONDAIRE, SUPERIEUR ET
DE LA
RECHERCHE SCIENTIFIQUE
(MESSRS)
CENTRE INTERNATIONAL DE
RECHERCHE-DEVELOPPEMENT
SUR
L'ELEVAGE EN ZONE SUBHUMIDE
UNIVERSITE POLYTECHNIQUE DE
BOBO-
DIOULASSO
(UPB)
INSTITUT DU DEVELOPPEMENT
RURAL
(IDR)
UNITE DE RECHERCHE SUR LES BASES BIOLOGIQUES DE LA LUTTE
INTEGREE
(URBIO)
DEPARTEMENT : ELEVAGE
.
Présenté en vue de l'obtention du
DIPLOME D'INGENIEUR DU DEVELOPPEMENT RURAL Option
Elevage.
THEME :
PRODUCTION DE MASSE DE GLOSSINES DE
QUALITE :
CONTRIBUTION A LA CAMPAGNE
PANAFRICAINE D'ERADICATION DE LA
MOUCHE
TSE-TSE ET DES TRYPANOSOMOSES (PATTEC)
Glossine avant et après piqûre et
succion
Directeur de mémoire : Pr. Adrien
BELEM
Maîtres de stage :
Ir. KABORE R. Idrissa. Dr BANCE Z. Augustin
PERCOMA Lassane
Juin 2006
a
EN MEMOIRE.
Le 2 juin 2005 marquait le début des
72 heures de l'ingénieur du développement rural de l'IDR avec au
menu : des expositions, un tournoi inter- départements et un match de
clôture administration - AMEIDR.
Le 03 juin, après le match de
clôture à laquelle j'ai pris part, et après un retour en
ville 18 h, en partance pour la maison, j'ai été victime d'un
accident de circulation et transféré d'urgence au Centre
Hospitalier National Sanon Souro (CHNSS) dans un état inconscient.
Le 04 juin, informés de
l'événement, les uns et les autres n'ont ménagé
aucun effort pour faire parler leur coeur. C'est le lieu ici pour moi de leur
témoigner ma profonde gratitude. Je voudrais citer
particulièrement entre autres :
- la Direction de l'IDR
dirigé par le Dr ILBOUDO Jean- Baptiste
à qui je renouvelle mes vifs remerciements pour son esprit
d'ouverture et son humanisme; - Tous les
étudiantes et étudiants de l'U.P.B en
général, et à mes collègues de
l'IDR en particulier les présidents de l'A.N.E.B (SAMPOUGDOU
Alexis) et de l'A.E.E.M.B (OUEDRAOGO Harouna);
- les Dr BEOGO Rasmané et KOHOUN Michel
du CHNSS,
- mon oncle SAWADOGO Seydou de la Librairie
Savadogo et Frères (LISAF) ; - M. SEKO Amadou
enseignant béninois;
- Mes frères et soeurs ainsi que tous les
autres parents et amis,
Je leur dis merci, merci et merci encore pour leurs soutiens
tant financiers que moral, ce qui m'a permis non seulement un retour à
l'université après un mois d'absence, mais surtout mon admission
au stage de fin de cycle. Je manque vraiment de mots pour leur témoigner
toute ma profonde gratitude !
Qu'ALLAH le Tout Puissant leur accorde sa
grâce et sa miséricorde.

b
Je dédie ce présent mémoire
· à mon père PERCOMA
Koure,
· à ma mère SAVADOGO
Bouga.
· à mon grand frère PERCOMA Boukary ;
· à tous mes petits frères & soeurs
;
· à Ir. RAYAISSE ainsi qu'à sa famille
;
· à mon oncle SAWADOGO Seydou ;
· au Dr ILBOUDO J. Baptiste (Directeur de l'IDR)
;
·
· à Allah enfin, lui qui guide nos pas.
c
TABLE DES MATIERES
EN MEMOIRE. a
Remerciements c
Liste des Tableaux ii
LISTE DES FIGURES iv
Sigles et abréviations vi
RESUME vii
ABSTRACT viii
Introduction. 1
CHAPITRE 1 : REVUE BIBLIOGRAPHIQUE 3
1.1. Généralité sur les mouches
tsé-tsé. 4
1.1.2 Systématique. 4
1.1.2 Morphologie. 7
1.1.3. Anatomie. 8
1.1.3.1. Appareil digestif. 8
1.1.3.2. Le système circulatoire. 9
1.1.3.3. Le système respiratoire. 9
1.1.3.4. Le système nerveux. 9
1.1.3.5. Le système excréteur. 9
1.1.3.6. Le système reproducteur. 9
1.1.4. Cycle de reproduction. 10
1.1.4.1. L'accouplement. 10
1.1.4.2. La fécondation. 11
1.1.4.3. La larviposition. 12
1.1.4.4. Avortement. 12
1.1.5. Ecologie. 13
1.1.5.1. Facteurs déterminants la répartition des
glossines. 13
a. Facteurs abiotiques. 13
b. Facteurs biotiques. 14
1.1.5.2. Distribution des différentes espèces
(Annexe 4). 14
1.1.5.3. Répartition géographique des glossines.
15
1.1.6 Rôle vecteur des glossines. 16
d
1.2. Nouvelles méthodes de luttes. 18
1.2.1 Facteurs déterminant la lutte contre les glossines.
18
1.2.1.1 Facteurs socio-économiques. 18
a. Facteurs sociaux. 18
b. Facteurs économiques. 19
1.2.1.2. Facteurs écologiques. 20
1.2.2. Méthodes de luttes. 21
1.2.2.1. Le système des attractifs toxiques (SAT). 21
1.2.2.2 Epandage séquentiel d'insecticides. 24
1.2.2.3 Régulateurs de croissance (Insect Growth
Regulators ou IGR). 25
1.2.2.4 Technique de l'insecte stérile (TIS). 26
a. La méthode du lâcher de mâles
stériles 26
b. Projets réussis de males stériles. 27
1.3. Tentatives de production de masse des glossines de
qualité. 27
Chapitre 2 : MATERIELS ET METHODES 29
2.1. Matériels. 30
2.1.1. Matériel biologique. 30
a. Les glossines 30
b. Le sang. 30
2.1.2. Matériel technique. 31
a. Les cages de contention. 31
b. Autres matériels, 32
2.2. Méthodes. 33
2.2.1 Fréquence de l'alimentation. 33
2.2.1 1. Effet de l'alimentation 3/7jours. 33
2.2.1.2. Effet de l'alimentation 4/7 jours (Lundi - Mardi - jeudi
et vendredi). 33
2.2.1.3. Effet de l'alimentation 5/7 jours. 34
2.2.2 Utilisation du sang congelé pour l'alimentation des
glossines. 35
2.2.3. Evaluation de l'importance de l'ATP dans l'alimentation
sanguine des glossines. 36
2.2.3.1. Quantité de sang absorbée par mouche
lors d'un repas sanguin et gain moyen
de poids des femelles. 36
2.2.3 2. Evaluation des
paramètres de productivité des femelles en fonction de
l'ATP.37
e
2.2.4. Densité optimale des mouches dans les nouvelles
cages TPU3. 38
CHAPITRE 3 RESULTAS ET DISCUSSIONS 39
3.1 Résultats. 40
3.1.1. Effet de l'alimentation sur les glossines. 40
3.1.1.1. Effet de l'alimentation sur Glossina palpalis.
40
3.1.1.2. Effet de l'alimentation (3/7jours ou 4/7jours) sur
Glossina morsistans
submorsitans. 42
3.1.1.3. Effet de l'alimentation (4/7 jours ou 5 /7 jours)
sur G. tachinoides. 44
3.1.2. Utilisation du sang congelé dans l'alimentation
artificielle des mouches tsé-tsé. 46
3.1.3. Importance de l'ATP dans l'alimentation des mouches
tsé-tsé. 50
3.1.3.1. Quantité de sang absorbé. 50
3.1.3.2. Mortalité des femelles. 51
3.1.3.3. Gain moyen de poids par type de sang. 52
3.1.3.4. Production de pupes et éclosion. 53
3.1.4. Densité optimale. 54
3.2. DISCUSSION. 58
3.2.1. Effet de l'alimentation sur les glossines. 58
3.2.1.1. Effet sur G. palpalis gambiensis. 58
3.2.1.2. Effet de sur G. morsitans submorsitans. 59
3.2.1.3 Effet sur G . tachinoides. 60
3.2.2. Utilisation du sang congelé dans l'alimentation des
glossines. 61
3.2.3. Importance de l'ATP dans l'alimentation sanguine des
glossines. 63
3.2.3.1. Quantité de sang absorbé. 63
3.2.3.2. Gain moyen de poids des mouches. 64
3.2.4. Densité optimale des glossines par nouvelle cage
TPU-3. 66
3.2.4.1. Densité optimale de Glossina
palpalis gambiensis. 66
3.2.4.2. Densité optimale de Glossina morsistans
submorsitans. 68
3.2.4.3. Densité optimale de Glossina tachinoides
68
3.2.5. Suggestions et perspectives. 69
Conclusion. 70
BIBLIOGRAPHIE. 71
ANNEXES I
i
REMERCIEMENTS
Au terme du stage de fin d'étude à l'IDR,
j'aimerais remercier tous ceux qui, d'une manière ou d'une autre ont
contribué à la réalisation de mon objectif. Entre autres,
mes remerciements vont :
- à L'ensemble du corps professoral de l'IDR pour la
qualité de leurs enseignements qu'il ma donné. En particulier,
j'aimerais remercier du fond du coeur Pr. Adrien BELEM, mon directeur de
mémoire pour son soutien, ses remarques et contributions tout au long du
stage.
- à Monsieur le directeur général du
CIRDES pour m'avoir accepter dans son centre et de ne ménager n'aucun
effort pour nous accompagner dans la bonne marche du stage.
- à Ir. KABORE, mon maître de stage qui,
malgré son admission à l'AIEA, n'a jamais pas cesser d'être
à mes cotés. J'aimerais vraiment le remercier pour son esprit de
travail, sa disponibilité, sa détermination au travail bien
fait.
- à Ir RAYAISSE pour avoir porter des remarques et
corrections à mon document ainsi que pour ses nombreux soutiens ;
- au Dr BANCE, mon second encadreur pour sa volonté au
travail bien fait;
- à M. SAWADOGO, chef de personnels du CIRDES pour sa
contribution et sa correction ;
- aux Dr BENGALY Zakaria et SIDIBE Issa respectivement chef du
département URBIO et directeur scientifique du centre pour ne
ménager aucun effort pour nous accompagner dans la bonne marche du
stage.
- à SANOU Guy, SANOU Phelix, OUATTARA Bakoffi, KABORE
Simom St. Pierre, OUEDRAOGO Deni et SIE Pacome de l'insectarium, pour leurs
soutiens et leurs ambiances sans cesse qui nous ont permis de travailler dans
la quiétude et la gaieté.
-Aux techniciens de l'U.R.BIO : YONLY Wilfrid pour ses
nombreuses contributions, BILA Cène et SANOGO Lacina pour leur esprit de
fraternité.
- à A tous ceux qui de près ou de loin ont
contribué à la réalisation de stage, qu'il trouve ici ma
profonde gratitude
- Merci à vous tous. Que Allah, le gracieux, le
miséricordieux vous le rend au centuple.
ii
LISTE DES TABLEAUX
Pages
Table des matières c
TABLEAU 1 : SYSTHEMATIQUE DES ESPECES ET SOUS ESPECES
DE
GLOSSINES. 5
TABLEAU 2 : RESUMER DE LA COMPARAISON DES
DIFFERENTES
PRODUCTIONS DE PUPES 41
A p = 5% (SEUIL DE SIGNIFICATIONS° AU COURS DU
TEST
D'ALIMENTATION. 41
TABLEAU 3 : NOMBRE MOYEN DE PUPES DE G. palpalis
gambiensis PAR
RECOLTE AU COURS DU TEST D'ALIMENTATION.
42
TABLEAU 4 : PARAMETRES DE PRODUCTIVITE DES FEMELLES DE
G. palpalis
gambiensis AU COURS DU TEST D'ALIMENTATION.EN
(%) 42
TABLEAU : 5 COMPARAISON DES DIFFERENTES PRODUCTIONS DE
PUPES
DES FEMELLES ALIMENTEES 3 , 4 ET TEMOIN A 5%.
44
TABLEAU 6 : PARAMETRES DE PRODUCTIVITE DES FEMELLES DE
G.
morsitans submorsitans AU COURS DU TEST
D'ALIMENTATION. 44
TABLEAU 7 :PARAMETRES DE PRODUCTIVITE DES FEMELLES DE
G.
tachinoides AU COURS DU TEST D'ALIMENTATION.
46
TABLEAU 8 : PRODUCTIVITE PAR FEMELLE REPRODUCTIVE AU
COURS DU
TEST AU SANG CONGELE. 49
TABLEAU 9 : RESUME DE L'ANALYSE COMPARATIVE DES
PRODUCTIONS DE
PUPES DES DIFFERENTS TRAITEMENTS A P = 5%
49
TABLEAU 10 : PRODUCTION MOYENNE DE PUPES PAR RECOLTE
ET PAR
TRAITEMENT 50
TABLEAU 11 : PARAMETRES DE PRODUCTIVITE DES
FEMELLES
AU COURS DU TEST AU SANG CONGELE 50
iii
TABLEAU 12 : POIDS (mg) DES FEMELLES A LA NAISSANCE
(G. palpalis
gambiensis) 53
TABLEAU 13 : PARAMETRES DE PRODUCTIVITE DES FEMELLES PAR
TYPE
DE SANG. 54
TABLEAU 14 : PARAMETRES DE PRODUCTIVITES DES FEMELLES
PAR
DENSITE (Glossina palpalis gambiensis).
57
TABLEAU 15 : PARAMETRES DE PRODUCTIVITES DES FEMELLES
PAR
DENSITE (G. m. submorsitans). 58
TABLEAU 16 : PARAMETRES DE PRODUCTIVITES PAR FEMELLE ET
PAR
DENSITE (G. tachinoides). 58
iv
LISTE DES FIGURES
Pages
FIGURE 1 : ARMATURE GENITAL : 6
A Mâle, B femelle, C plaques génitales
(pg), 6
FiGURE 2 : CLEF DE DISTINCTION DES TROIS SOUS GENRES :
a; G.austeni; b;
G. longipalpis; c, G. morsitans; d,
G.pallidipes 6
FIGURE 3 : MORPHOLOGIE GENERALE D'UNE MOUCHE TSE-TSE
(G.
pallidipse), (SOURCE IRD, 2000 Pollock ;
1982) 7
FIGURE 4 : SYSTEME DIGESTIF D'UNE GLOSSINE, (IRD,
2000) 8
Figure 5 : APPAREILS GENITAUX: A & B: (IRD, 2000)
10
FIGURE 6 : CARTE DE REPARTITION DES GLOSSINES, FAO,
1998. 16
FIGURE 7 : TAUX DE MORTALITE (%) DES FEMELLES DE
G. palpalis gambiensis
AU COURS DU TEST D'ALIMENTATION. 40
FIGURE 8 : EVOLUTION DES TAUX DE MORTTALITE DES
FEMELLES DE G. morsitans submorsitans AU COURS DU TEST DE LA
FREQUENCE
D'ALIMENTATION. 43
FIGURE 9 : EVOLUTION DE LA MORTALITE CUMULEE DES
FEMELLES DE G. tachinoides AU COURS DU TEST DE RESTRICTION ALIMENTAIRE
A 4 ET 5
JOURS /7. 45
FIGURE 10: EVOLUTION DES TAUX DE MORTALITE CUMULATIVE
DES
MALES (%) AU COURS DES 30ers JOURS DU TEST
AU SANG CONGELE 47
FIGURE 11 : EVOLUTION DES TAUX DE MORTALITE CUMULATIVE
(%) DES
FEMELLES AU COURS DU TEST AU SANG CONGELE.
48
FIGURE 12 : QUANTITE DE SANG ABSORBE PAR FEMELLE.
51
FIGURE 13 : EVOLUTION DES TAUX DE MORTALITES DES
FEMELLES
NOURRIES AUX SANGS DE BOVINS Sg 1, Sg 2, Sg 3, Sg 4 ET
DE PORCS (Sp) 52
FIGURE 14 : GAIN MOYEN DE POIDS PAR FEMELLE ET PAR
SANG 53
V
FIGURE 15 : EVOLUTION DES TAUX DE MORTALITE DES
FEMELLES (%) DE Glossina palpalis gambiensis AU COURS DU TEST DE
DETERMINATION DE LA
DENSITE OPTIMALE 55
FIGURE 16 : EVOLUTION DES TAUX DE MORTALITE DES
FEMELLES (%) DE Glossina m submorsitans AU COURS DU TEST DE
DETERMINATION DE LA
DENSITE OPTIMALE 56
FIGURE 17 : EVOLUTION DES TAUX DE MORTALITE DES
FEMELLES (%) DE Glossina tachinoides AU COURS DU TEST DE DETERMINATION
DE LA DENSITE
OPTIMALE 56
SIGLES ET ABREVIATIONS
Abréviations
AIEA ATP CIRAD
CIRDES
CRTA FAO IEMVT OMS PATTEC PMA PMp PPF
PPFJ PPFR PPFRJ PVC Sg
SAT TAA TIS
TPU UA
IGR
VIH/SIDA
vi
Significations
Agence Internationale de l'Energie Atomique.
Adenosine Tri-Phosphate.
Centre coopération International en Recherche Agronomique
pour le
Développement.
Centre International de Recherche-Développement sur
l'Elevage en zones
Subhumides.
Centre de Recherche sur les Trypanosomoses Africaines.
Organisation des Nations Unies pour l'alimentation et
l'agriculture.
Institut d'Elevage et de Médecine
Vétérinaire des Pays Tropicaux.
Organisation mondiale de la Santé.
Campagne Panafricaine d'Eradication des Tsé-tsé et
des la Trypanosomoses
Production Moyenne d'Avortons
Poids Moyen des pupes (mg).
Production de Pupes par Femelle.
Production de Pupes par Femelle et par Jour.
Production de Pupes par Femelle Reproductive.
Production de Pupes par Femelle Reproductive et par Jour.
Polychlorure de Vinyle.
Sang.
Système des Attractifs Toxiques.
Trypanosomoses Animales Africaines.
Technique de l'Insecte Stérile.
Unité de production des tsé-tsé 3.
Union Africaine.
Régulateurs de croissance des insectes.
Virus de l'Immunodéficience Humaine/Syndrome
Immunodéficience
Acquise.
vii
RESUME
En juillet 2000 à Lomé (Togo), l'Union Africaine
a approuvé la création d'une campagne panafricaine
d'éradication de la mouche tsé-tsé et de la trypanosomose
(PATTEC). Cette campagne a pour objectif d'améliorer la santé
humaine et animale par la création de zones indemnes de glossines. Le
lancement officiel de sa première phase a eu lieu en octobre 2001
à Ouagadougou au Burkina Faso. Ce programme s'appuie sur une
intégration des méthodes dont celle du lâcher de
mâles stériles qui requiert une production de masse de glossines
au laboratoire. C'est dans ce cadre que des études sont menées au
CIRDES afin d'aider à la résolution progressive des contraintes
de production industrielle des glossines. Au total 9903 femelles de glossines
dont 6302 G. palpalis gambiensis, 2212 G. morsitans submorsistans
et 1389 G. tachinoides ont été utilisées
dans la période de septembre 2005 à mai 2006 pour des
investigations sur divers aspects très importants de la chaîne de
production de masse des glossines. Ces trois espèces ont
été soumises à différents régimes
alimentaires variant entre 3 et 5 jours par semaine afin de réduire la
fréquence d'alimentation des colonies de production qui est actuellement
de 6/7 jours. Du sang congelé pendant 5 mois a été
utilisé avec rajout ou pas de glucose ou d'ATP pour réduire
à terme la dépendance de l'élevage vis-à-vis de la
source d'approvisionnement de sang frais. L'effet de l'ATP et de son mode
d'administration avant ou après irradiation du sang a été
évalué à travers les quantités de sang
absorbées ainsi que les productivités de femelles individuelles.
Des essais en vue de déterminer la densité optimale des mouches
dans les nouvelles cages TPU-3 (Tsetse Production Unit) ont également
été réalises. L'analyse statistique des résultats a
été faite par la régression binomiale après une
transformation en racine carrée. Il n'y a pas de différence
significative entre les productions des femelles de G. m. submorsitans
alimentées trois, quatre et six fois par semaine (p > 0,05).
Cette espèce est donc apte à supporter une diète de 24
à 48 heures sans effets sur les performances de production. Il est
cependant préférable d'alimenter G. p. gambiensis et
G. tachinoides 4 fois par semaine, bien qu'aucune différence
significative n'ait été révélée entre les
productions de pupes des femelles alimentées trois, quatre, cinq et six
fois par semaine. Aucune différence significative n'a été
décelée entre les productions de pupes de femelles nourries aux
sangs congelé et frais (p > 0,05). Le sang congelé offre des
performances meilleures de production, même sans rajout d'ATP et de
glucose et est propice à une production de masse des glossines. L'ATP
joue un rôle stimulateur de l'appétit des mouches
tsé-tsé, mais n'est pas en revanche, le seul facteur
déterminant pour une bonne productivité des femelles. Les
réserves nutritives à l'éclosion y sont pour beaucoup. Les
essais de stockage dans les cages TPU-3 indiquent une densité optimale
de 80 glossines dont 64 femelles et 16 mâles pour chacune des
espèces. L'ensemble des résultats obtenus autorise
déjà des suggestions en vue d'une amélioration de la
production de masse de glossines de qualité, composante importante du
succès de la PATTEC.
viii
ABSTRACT
In July, 2000 in Lome/Togo, the African Union approved the
PATTEC (Pan African Tsetse and Trypanosomosis Eradication Campaign, which main
purpose is to improve human and animal health, by the creation of tsetse free
areas. This programme is based on the use of integrated strategies, including
sterile males release, which requires tsetse mass rearing facilities. It is in
this context that experiments have been conducted in CIRDES, in order to find
out solutions to the different constraints to tsetse mass rearing.
From September 2005 to May 2006, about 10 thousands tsetse
flies from three species (Glossina palpalis gambiensis, G. tachinoides
and Glossina morsitans submorsitans) were used to study the
effect of the feeding frequency, the effect of blood quality (frozen blood,
addition or not of ATP) and the way of the ATP administration before or after
the irradiation of the blood.
In addition, other trials were undertaken to determine the
optimal density of tsetse flies in the new TPU-3 cages.
Negative binomial regression has been used for statistical
analysis with the Software Stata 6.0 as support.
Concerning the effect of feeding frequency on the production
performances of females tsetse, there was no significant difference between
Glossina morsitans submorsitans fed, three, four or six times per week
(p>0.05), what means that this specie could support one to two days diet
without no consequences on the pupae production. Although the same situation
was noted with the two other species, one may suggest to feed them four times
per week.
Frozen and fresh blood also didn't lead to a significant
difference of females' pupae production. Frozen blood offers best production
performances, even without ATP and glucose, and is this way more indicated for
tsetse feeding in a mass rearing system.
ATP is probably a stimulant of the tsetse appetite but is not
the only one determinant factor for females' good productivity. Nutritive
reserves at hatching certainly also play an important role.
The TPU-3 essay indicates an optimal density of 64 females for
16 males, that is 80 tsetse per box.
With theses different results, some suggestions could already
by made to improve tsetse mass rearing, a key component for success of the
PATTEC.
1
Introduction.
L'infestation par la mouche tsé-tsé des zones de
hautes potentialités agricoles est l'une des contraintes majeures au
développement rural en Afrique au Sud du Sahara (UA, 2000). En effet, la
mouche tsé-tsé ou glossine transmet à l'homme et aux
animaux par sa piqûre, respectivement la maladie du sommeil et la
trypanosomose animale. Selon l'UA (2000), l'infestation glossinienne et
l'incidence de la trypanosomose chez l'homme et les animaux domestiques ont
atteint ces dernières années, un niveau sans
précédent. Elle estime à environ 10 millions de
km2 de terre, la superficie infestée par les glossines. Ces
terres sont celles qui se prêtent le mieux aux activités
agro-pastorales. Dans ces régions, l'OMS (2000) estime que 60 millions
de personnes sont exposées aux risques d'être infectées de
la maladie du sommeil. Sur 500 000 personnes estimées déjà
atteintes, 25 000 meurent chaque année et la situation se
détériore rapidement. Plus de 40 000 nouveaux cas sont
notifiés chaque année sans compter les nombreux cas non
signalés dans les zones inaccessibles et déchirées par la
guerre.
La FAO (2000) estime à 3 millions, le nombre de bovins
et d'autres animaux domestiques que l'Afrique perd chaque année à
cause de la trypanosomose. Pourtant, aucun vaccin n'a encore été
trouvé pour prévenir la maladie et aucun nouveau
médicament n'est en cours de mise au point (UA, 2000). Les trypanocides
actuellement utilisés pour traiter la trypanosomose animale sont de plus
en plus rendus inefficaces par une résistance répandue à
ces médicaments et certains produits pharmaceutiques utilisés
pour traiter la maladie du sommeil sont hautement toxiques selon cette
même organisation. L'élimination de l'insecte vecteur est
essentielle pour arriver à bout de ce fléau. Les efforts
consacrés dans la lutte contre la glossine depuis un siècle, ont
toute fois été limités à cause de la
réinvasion des zones déjà assainies par les populations de
mouches, même résiduelles, des zones avoisinantes (UA, 2000).
A la suite de nombreuses pressions de la part de leurs
communautés de prendre des initiatives de lutte et réalisant que
les solutions ponctuelles ne résoudront pas le problème, les
chefs d'Etats et de gouvernements africains, réunis en session ordinaire
à Lomé (Togo) ont approuvé l'idée d'une campagne
panafricaine pour l'éradication de la mouche tsé-tsé et de
la trypanosomose (PATTEC). Cette structure technique va contribuer à
l'amélioration de la santé humaine et animale ainsi qu'à
la prospérité en Afrique par la création de zones
2
durablement indemnes de mouches tsé-tsé. Une des
méthodes qui a retenu l'attention des experts chargés par la
PATTEC d'élaborer la stratégie globale de lutte est la Technique
de l'Insecte Stérile (TIS). La TIS a d'abord été
expérimentée au Burkina Faso (1975 - 1984), au Nigeria (1984) et
en Tanzanie (1976), puis appliquée avec succès sur l'île de
Zanzibar (1997).
Cependant, la mise en oeuvre de cette technique requiert la
production de masse de mâles stériles de qualité au
laboratoire pour des lâchers dans les zones d'intervention. Les experts
estiment déjà les besoins en males stériles à
plusieurs millions par semaine durant plusieurs années. Ceci justifie
les efforts importants consentis au niveau des centres d'élevage en vue
d'une résolution rapide des contraintes de production industrielle des
glossines. Le taux de reproduction très bas chez la
tsé-tsé, les nombreuses manipulations qui jalonnent toujours la
chaîne de production et l'assurance d'un approvisionnement en
quantité et en qualité du sang pour l'entretien des colonies de
mouches constituent l'essentiel des domaines prioritaires de recherche.
Les récentes expériences entreprises dans
l'élevage du CIRDES visent logiquement à
terme à une amélioration du système
d'élevage et de la qualité des mouches tsé-tsé
produites.
Ces travaux portent en particulier sur les aspects suivants :
- l'effet de la fréquence d'alimentation sur les
performances des glossines ;
- l'utilisation du sang congelé dans l'alimentation des
glossines ;
- l'évaluation de l'importance de l'ATP dans
l'alimentation des mouches tsé-tsé;
- la détermination de la densité optimale de
mouches dans de nouvelles cages TPU-3
3
CHAPITRE 1 : REVUE BIBLIOGRAPHIQUE.
4
1.1. Généralité sur les mouches
tsé-tsé.
1.1.1 Systématique.
Les glossines sont des diptères Brachycères
cycloraphes, Schizophores, Calyptérates, proches des Muscidae.
Un seul genre, le genre Glossina a été crée
pour ces insectes. Des auteurs comme Brue et al, 1966, cité par M.
Laird, 1977 ; Pollock, 1982, cité par Sawadogo, 1990 le
considèrent comme un genre isolé qui forme à lui seul la
famille des Glossinidae.
Selon plusieurs caractéristiques anatomiques (couleur
de la partie dorsale de l'abdomen, l'armature mâle et femelle (Fig.1 A et
B), le genre Glossina se subdivise en trois sous genres. Au total 23
espèces et 8 sous-espèces appartenant à ces trois
sous-genres ont été décrites (Tableau 1).
Sous-genres

Caractéristiques
Espèces et sous espèces
1.- a-G. palpalis gambiensis Robineau Desvoidy. 1830 1.
b-G. palpalis gambiensis Vanderplank 1949
2.-G. tachinoides Westwood.1850
3.a-G. pallicera Bigot.1891 3.b-G. pallicera
newsteadi Austen.1929
4.a-G. fuscipes Newstead,1910 4.b-G. fuscipes
martini Zumpt,1935
4.c-G. fuscipes quanzensis Pires,1948
5-G. caligenea Austen, 1911
Cinq (05) espèces Quatre sous espèces
1.G. longipalpis Wiedman,1830
2.a-G. morsitans morsitans Westwood ,1830 2.b-G.
morsitans centralis Marchado,1970 2.c-G. morsitans
submorsitans
3.-G. pallidipes Austen,1903
4.-G. austeni Newstead,1912
5.-G. swinnertoni Austen, 1923
Cinq (05) espèces Deux sous espèces
5
TABLEAU 1 : SYSTHEMATIQUE DES ESPECES ET SOUS ESPECES
DE GLOSSINES.
Nemorhina
l Taille moyenne (8-10mm)
l Abdomen brun noir
l tarses pattes postérieures brun foncées ou
noires
l c' forcipule > reliés par une membrane
connective ; extrémité distale
séparée (Fig.2)
l ? 6 plaques génitales avec plaque medio dorsale
l signum uteral absent
l Génotype: 3 paires des chromosomes
|
|
Glossina str.
l Taille moyenne (8-10mm)
l Abdomen Jaunâtre +taches sombres
l 2 derniers segments des pattes postérieures noirs
l c' forcipule > renflé à l'apex et
relié par une membrane connective
l ?6 plaques génitales absence de plaques dorsale
l signum uteral absent
l Génotype: 6 paires de chromosomes+2 chromosomes
surnuméraires
|
|
Austenia
l Taille 11-14mm
l Abdomen brun #177;clair
l 2 derniers segments des pattes postérieures, Brun ou
brun noirâtre
l c' forcipule > libres
l ?5 plaques génitales
avec présence de plaques medio dorsale
l présence de signum uteral Génotype : 6
chromosomes étudiés chez deux espèces (G. fusca
congolensis- G. brevipalpis)
|
|
1.a-G. fusca fusca Walker,1849
1.b-G. fusca congolensis Newstead&Evans,1921
2.a-G .nigrofusca nigrofusca Newstead,1910 2.b-G.
nigrofusca hopkinsi Van Emden,1944 3.-G. fuscipleuris Austen,1911
4.-G. severini Newstead,1911 5.-G. vanhoofi Henrard,1952
6-G. nashi Potts.1955
7-G. tabaniformis Weswood,1850 8-G. longipenis
Corti,1895 9-G .brevipalpis Newstead,1910 10-G. medicorum
Austen, 1911,
11-G. schewtzi Newstead&Evans, 1922
12-G. haningtoni Newstead&Evans, 1922
13- G. frezili Gouteux,1986 treize (13) espèces
deux sous espèces
|
6
A B
C
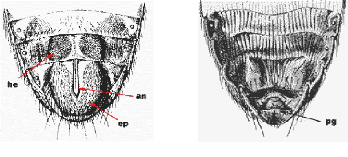
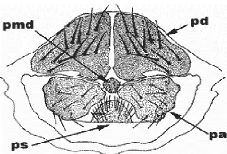
FIGURE 1 ARMATURE GENITAL :
A Mâle, B femelle, C plaques génitales
(pg),
Hector (he) ; epandrium : (ep) ; anus : (an) ; Plaque dorsale
: (pd) ; plaque medio dorsale : (pmd) plaque anale : (pa) plaque sternale :
(ps)
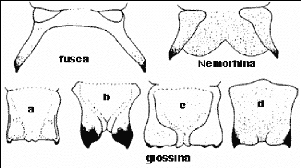
FiGURE 2 CLEF DE DISTINCTION DES TROIS SOUS GENRES :
a; G.austeni; b; G.
longipalpis; c, G.
morsitans; d, G.pallidipes
7
1.1.2 Morphologie.
La glossine est un diptère de grande taille 6- 16 mm de
long. Elle est de teint brun
ou gris brun jamais métallique. Le mâle est
généralement plus petit que la femelle. La morphologie
générale est celle des mouches (Fig.3). Le corps est
subdivisé en trois parties qui sont :
- la tête qui porte les yeux (yeux composés au
milieu desquels se trouvent des yeux simples), les antennes et les
pièces buccales. Ces pièces buccales sont adaptées
à la piqûre si bien que la glossine est classée dans le
groupe des Muscidae piqueurs ;
- le thorax qui porte à sa face inférieure les
trois paires de pattes, et à son sommet une paire d'ailes. Ces ailes, au
repos sont croisées sur le dos de l'abdomen, ce qui donne une forme
mince à la glossine. En outre, le thorax porte à la base des
ailes deux haltères ou balanciers qui permettent le maintien en
équilibre de la mouche lors du vol (Pollock, 1982) ;
- l'abdomen qui comporte huit segments dont sept (7) visibles
dorsalement. Chaque segment porte un tergite dorsal rigide et un ternite
ventral souple qui peut s'étirer pour permettre à la mouche de
recevoir une quantité importante de sang et dans le cas de la femelle de
grosses larves. Le huitième segment porte les genitalia mâle et
femelle dont la forme et la dimension couplées à la coloration de
l'abdomen constituent une base de la systématique.
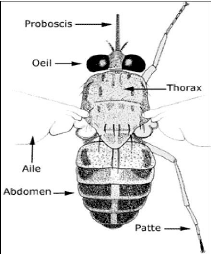
FIGURE 3 : MORPHOLOGIE GENERALE D'UNE MOUCHE TSE-TSE
(G. pallidipse),
(SOURCE IRD, 2000 Pollock ; 1982)
1.1.3. Anatomie.
1.1.3.1. Appareil digestif.
La glossine est un diptère piqueur. Son appareil digestif
comprend :
- les glandes salivaires, logées dans l'abdomen se
prolongent par un canal salivaire traversant le thorax. Elles se
réunissent au niveau de la tête par un canal salivaire qui abouti
à l'hypopharynx. L'hors de la piqûre, elle injecte à son
hôte de la salive contenant un anticoagulant provenant de ces glandes
salivaires ;
- le canal alimentaire qui est l'association du labium et du
labre. Il se prolonge par le pharynx ;
- l'oesophage;
-le jabot, poche très extensible
servant à stocker provisoirement le sang avant la digestion;
- le proventricule (entre le thorax et l'abdomen). Il fabrique
un long manchon, la membrane péritrophique qui enveloppe tout au long de
l'intestin en direction de l'intestin moyen ;
- l'intestin moyen dans lequel se déroule le
métabolisme du sang ;
- l'intestin postérieur dans lequel l'aliment non
digéré se mélange aux produits d'excrétion des
tubes de malpighie ;
- l'anus.
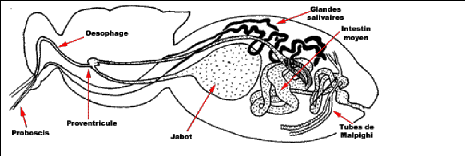
8
FIGURE 4 : SYSTEME DIGESTIF D'UNE GLOSSINE, (IRD,
2000)
9
1.1.3.2. Le système circulatoire.
Il comprend un coeur tubulaire véhiculant un
hémolymphe qui assure le transport des
aliments digérés de l'intestin moyen vers le
reste du corps.
1.1.3.3. Le système respiratoire.
Il est constitué de tubes (trachées) s'ouvrant
sur les faces latérales par des orifices
appelés stigmates.
1.1.3.4. Le système nerveux.
IL coordonne le sens et le comportement de la mouche. Il
comprend le cerveau, les ganglions
thoraciques et les nerfs.
1.1.3.5. Le système excréteur.
Il se compose de quatre longs tubes blanchâtres ou
jaunâtres, les tubes de Malpighi réunis par
paire sur un canal connecté à la limite entre
les segments moyen et postérieur de l'intestin.
1.1.3.6. Le système reproducteur.
Il comprend un organe reproducteur male et un organe
reproducteur femelle (Fig. 5)
L'appareil génital mâle est composé de
:
- deux testicules ;
- deux glandes accessoires aboutissant à un canal
éjaculateur qui débouche dans le
pénis.
L'appareil génital femelle est formé :
- d'un utérus ;
- de deux ovaires comportant chacun deux ovarioles ;
- de deux spermatèques bruns servant à stocker
le sperme ;
- des glandes utérines.
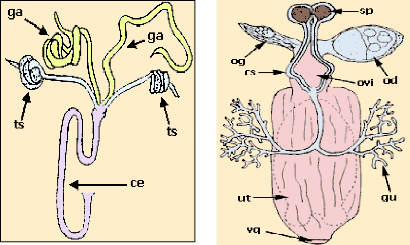
10
A : APPAREIL GENITAL MALE B : APPAREIL GENITAL
FEMELLE
Figure 5 APPAREILS GENITAUX: A & B: (IRD, 2000)
-testicules (ts) ; canal éjaculateur (ce), des
accessoires (ga) ovaire droit : (od) ovaire gauche : (og) spermatèques :
(sp.) utérus : (ut) glande utérine : (gu) canaux des
spermatèques : (cs) oviductes : (ovi)
1.1.4. Cycle de reproduction.
Les glossines se caractérisent par leur mode de
reproduction qui a été qualifié par Roubaud (1909) de
pupuparité, ce qui les approche des pupipares hématophages
(Itard, 2000). Le cycle comprend :
1.1.4.1. L'accouplement.
Dans la nature, les femelles des glossines s'accouplent
précocement avant la prise de leurs premiers repas sanguin ou à
peu près à l'époque de ce dernier (Pollock, 1982). Le
meilleur âge pour l'accouplement est de 3 à 4 jours pour les
femelles et 6 à 8 jours pour les mâles (Kaboré, 2003). En
général la femelle s'accouple une seule fois au cours duquel elle
remplit ses spermatèques de sperme du mâle qui peut y demeurer
à l'état actif pendant toute son existence. Cependant, les jeunes
femelles (inférieure à 10 jours) peuvent effectuer plusieurs
accouplements et remplir progressivement leurs spermatèques (Itard,
2000). Selon Itard (2000), après la première ovulation, il y' a
une impossibilité mécanique pour le sperme, lors d'un nouveau
accouplement d'atteindre les spermatèques. Les males quant à eux
peuvent effectuer jusqu'à 12 à 15 accouplements si ceux-ci sont
espacés, mais le pouvoir inséminant diminue à partir de 6
à 7 accouplements (Itard, 1986). L'accouplement peut durer une heure
11
ou plus.
L'ovulation normale a lieu après l'accouplement qui
stimule le système endocrinien et est absente chez une femelle non
accouplée (Dudd, 1971, Odhambo 1971, Ejegie & Davey 1977, Chaudhury
et Dhadialla. 1976, Chaudhury et al, 1980, Wall, 1989, Bancé, 2003).
Chez les femelles non accouplées, les oeufs se
désintègrent éventuellement. Apres l'accouplement, la
première ovulation a lieu en moyenne entre le 8e et le
10e jour, suivant l'espèce et les conditions de
température. Les ovulations suivantes ont lieu en moyenne tous les neufs
ou dix jours dans les premières heures qui suivent une ponte larvaire
précédente.
1.1.4.2. La fécondation.
La fécondation est l'union du spermatozoïde et de
l'ovule aboutissant à la formation d'une cellule oeuf. Au cours de
l'ovulation, le follicule est recouvert de chorion pourvu de micropyle qui sera
le point de pénétration du spermatozoïde provenant des
spermatèques. La fécondation se fait donc par
l'extrémité antérieure. L'oeuf issu de la
fécondation séjourne dans l'utérus pendant trois jours
environ puis donne naissance à une larve que la femelle conserve dans
une poche analogue à l'utérus d'un mammifère. Pendant la
vie intra utérine, la larve s'alimente à partir des
secrétions des glandes annexées à l'utérus. Trois
stades larvaires sont distingués. Ce sont :
- Le stade 1 qui dure 1,5 jours. La larve est toujours
enfermée dans le chorion de l'oeuf qu'elle déchirera avec les
« dents d'éclosion ». Elle ne possède aucune structure
visible sauf les deux stigmates respiratoires. A la fin du stade 1 la larve
issue de l'oeuf atteint 1,8 mm (G. morsitans);
- Le stade 2 : après une première mue, la larve
commence à se structurer et se nourrit de la sécrétion des
glandes lactifères. Il est marqué par un développement et
une croissance rapide de la larve qui atteint 4,5mm (G. morsitans), Il
dure 2,5 jours ;
- Le stade 3. Une seconde mue aboutit au stade 3 qui est
également marqué par un développement et une croissance
accélérée. Les lobes polyneustiques initialement blancs
deviennent noirs peu avant son expulsion. Ce stade dure 3 jours et la larve
atteint 6 à 7mm (G. morsitans).
La durée totale de la vie larvaire est donc de 8-10
jours.
12
1.1.4.3. La larviposition.
Les glossines sont des pupipares. La seule différence
entre elles et les pupipares vrais réside dans la mobilité de la
larve des glossines, qui se déplace activement après son
expulsion de l'utérus, alors que la larve des pupipares vrais
s'immobilise immédiatement pour la nymphose. Aux températures de
25°c, une femelle donne naissance à une larve entièrement
développée tous les 9 à 10 jours sauf la première
qui est pondue 17 à 20 jours d'âge (Itard, 1986).
Une femelle peut vivre plus de trois mois et donner naissance
à 8 à 10 larves, ce qui représente un taux de production
plutôt faible. Les lieux de ponte sont généralement
situés à proximité de l'eau en saison sèche et plus
éloignés des rives en saison de pluie. La larve a des
difficultés de s'enfouir dans le sol si la texture est très fine.
La dimension convenable des particules pour un bon enfouissement des larves est
comprise entre 1,8mm et 2,5 mm de diamètre. Le taux de larviposition
peut doubler dans les quinze minutes qui suivent si la température tend
à baisser rapidement (Robinson et al, 1985, Bancé, 2003)
Les larves pondues sont ensuite transformées en pupes.
La durée du stade pupal varie selon l'espèce et
les conditions climatiques. Selon Itard (2000), cette durée est comprise
entre vingt cinq et trente cinq jours dans les régions où la
température oscille autour de 25°c. Celle-ci est courte lorsqu'elle
aboutit à une femelle.
1.1.4.4. Avortement.
Il arrive souvent que la larve n'atteigne pas sa taille
normale et soit expulsée de l'utérus avant terme habituellement.
On parle d'avortement et la larve n'est pas viable. Il peut être
provoqué par une alimentation insuffisante de la glossine mère,
par les manipulations sans précaution de celle-ci ou quand elle entre en
contact avec un insecticide.
e) Eclosion.
L'éclosion est l'émergence des mouches adultes
du puparium. Elle met fin au stade pupal. La durée du stade pupal
dépend de la nymphose qui est fonction de la température et de
l'espèce. Cette durée est donnée chez Glossina
tachinoides par la formule :
D = 18+e-0,1183m-0,0871M+7,8707
(Laveissière et Penchenier, 2005). D'une manière
générale, la durée du stade pupal est comprise entre 25 et
35 jours à 25°c, les femelles ayant une durée de pupaison
plus courte que celle des mâles d'environ 2 à 3 jours (Itard,
2000).
La mouche nouvellement éclose et n'ayant pas encore
pris son premier repas sanguin est dite ténérale. Elle devient
adulte après la prise de celui- ci. Chez les femelles nouvellement
13
écloses, les quatre ovarioles sont tous à des
stades différents. Le plus grand follicule est dans l'ovariole interne
de l'ovaire droit. Le follicule suivant le plus développé est
dans l'ovariole interne de l'ovaire gauche, l'ovariole externe de l'ovaire
droit ne contient qu'un follicule encore accolé au germanium et
l'ovariole externe de l'ovaire gauche ne contient que le germanium. Le
mâle quant à lui a son stock spermatique constitué
dès l'éclosion mais ne réussit à accoupler avec
succès que lorsqu'il est âgé d'environ
sept jours.
1.1.5. Ecologie.
1.1.5.1. Facteurs déterminants la
répartition des glossines.
En général, deux facteurs conditionnent la
répartition des glossines, Il s'agit des facteurs abiotiques et des
facteurs biotiques :
a. Facteurs abiotiques.
- La température.
La température est le facteur le plus important qui
conditionne l'expansion des glossines. En effet, les glossines vivent bien
entre 25° et 26°c et c'est à cette température que sont
maintenues les différentes colonies au laboratoire (Pollock, 2000). Si
elle s'écarte plus de ce chiffre, en plus ou en moins, la mouche peut
souffrir. Au delà de 36°c l`adulte soufre et meurt aux
températures supérieures à 38 - 40°c. La mort
survient rapidement (en 5 mn) si Glossina morsistans adulte est
maintenue à 46°c ; G. tachinoides à 44°c
pendant une heure (Pollock, 2000). En deçà de 16°c il ne
peut plus se développer normalement. Elle a également un impact
sur les pupes : 32°c représente la limite maximale pour leur
développement normal et 16°c la limite minimale (Pollock ;
2000).
- La pluviosité et
l'humidité,
La pluviosité a une influence indirecte sur la
glossine. En effet, elle favorise le maintien de la température,
l'humidité et la végétation indispensable à leur
vie. L'optimum hygrométrique varie entre 50 à 60%
d'humidité pour les espèces savanicoles, 65 à 80% pour les
espèces de galeries forestières (Laveissière, 2003). Quant
aux pupes, celles de Glossina pallidipes et G. tachinoides
peuvent se développer dans des sols assez secs (humidité
d'environ 3-40%) tandis que celles de G. palpalis gambiensis exige une
humidité d'environ 70%,
14
- La végétation.
Un des facteurs déterminant la répartition des
glossines est l'ombrage, La végétation joue un rôle triple,
Elle offre non seulement un écran aux radiations favorisant le maintien
d'une température optimale mais en plus un ombrage pour le repos des
glossines, En outre, elle permet le maintien d'une bonne humidité, C'est
ainsi que les différentes espèces se trouvent être
confinées dans des végétations caractéristiques.
b. Facteurs biotiques.
- Les animaux hôtes.
Chez les glossines, mâles et femelles sont tous
hématophages et dépendent des animaux hôtes pour leur
nourriture. L'aire de répartition correspond donc à des zones de
présence de mammifères. Ce facteur a été mis en
évidence lors de l'effet de la flambée de peste bovine qui a
frappé en Afrique, entre 1889 et 1896 les animaux nourriciers des
glossines (buffle, girafe, élan, potamochère, phacochère)
(POLLOCK, 2000). On a assisté à une disparition importante des
glossines et leur reconstitution après le fléau.
Les populations de Glossina morsistans submorsistans
diminuent quand les densités humaines sont supérieures
à 40 habitants/km2, et disparaissent au-delà de 100
habitant/km2 (Cuisance et de la Rocque, 2003).
- L'activité de l'homme.
Il s'agit de l'impact des activités de l'homme sur le
milieu biogéographique des glossines entraînant leur
redistribution. La croissance démographique et l'augmentation des
surfaces cultivées conduisent à une modification de l'habitat
naturel des glossines. Les vallées sont de plus en plus occupées
par l'homme, dont l'impact sur l'environnement est direct (déboisement,
destruction des mammifères sauvages) ou indirect (amplification de
l'érosion, surpâturage, occupation des points d'eau), Ces
différentes activités entraînent un cantonnement des
glossines aux formations végétales compatibles avec leurs
exigences.
1.1.5.2. Distribution des différentes
espèces (confère Annexe 4).
Les glossines sont inégalement distribuées dans
leurs aires de répartition selon leur adaptabilité aux conditions
ci-dessus citées:
- Les individus du sous-genre glossina sont strictement
liés à la savane. Ils :
· occupent les zones suffisamment boisées
(pluviométrie comprise entre 500 à
15
1000 mm)
· évitent les zones arides et sahéliennes
;
· reculent dans les régions où l'homme
s'établie (Itard, 2000).
C'est un groupe composé d'espèces les plus
répandues et leur aire de répartition semble être
limitée par les rigueurs de l'hiver dans le sud (Zimbabwe, Botswana)
(Pollock, 1982) et au nord de l'Afrique occidentale et centrale par la chaleur
sèche.
- Les individus du sous-genre Nemorhina sont
confinés au système hydraulique qui se déverse dans
l'Atlantique et à celui du haut Nil, en Ethiopie (Itard, 2000). Ils sont
absents de l'Afrique de l'Est et toute l'Afrique Australe à partir du
12è et 13è parallèle. Ils occupent les zones
forestières de l'Afrique occidentale et centrale où les
conditions climatiques et la disponibilité des hôtes sont
idéales. En zone de forêt, G. palpalis gambiensis occupe
les lisières, les alentours des villages, des champs, des plantations de
café et de cacaoyer, G. tachinoides en revanche occupe une zone
septentrionale dans les végétations bordant les grands cours
d'eau qui pénètrent jusque dans les steppes boisées
(Itard, 2000).
- Les individus du sous genre Austenia ont trois
modes de répartition :
· Glossina longipenis occupe la savane aride du
Kenya et des pays limitrophes ;
· Glossina breviplapis vit dans les
fourrées de l'Afrique orientale ;
· Les autres individus du groupe occupent les
forêts denses humides équatoriales de basse et moyenne altitudes
formées du bloque forestier guinéen et du bloque forestiers
nigéro-congolais et dans les zones de transition entre les vraies
forêts et la savane boisée ainsi que les îlots forestiers et
les grosses galeries forestières. Inféodés à la
faune sauvage et très sensibles aux modifications de leurs habitats, ils
sont rencontré principalement dans des forêts
éloignées des zones d'activités humaines. (Itard, 2000)
1.1.5.3. Répartition géographique des
glossines.
Les glossines ou mouches tsé-tsé sont des
insectes piqueurs uniquement africains. Ce sont des espèces diurnes
existant au sud du Sahara dans la région intertropicale où la
température est supérieure à 20°c et la
pluviométrie annuelle supérieure à 600 mm. Elles occupent
une superficie d'environ dix millions de km2 qui s'étend sur
trente sept (37) pays
16
(Itard, 2000).
Le climat et la végétation déterminent
les limites septentrionales et méridionales de l'aire d'extension des
espèces (Itard, 2000). En 1955, Buxton localisait les glossines en
Afrique entre le 14è degré de latitude nord et le 29è
degré de latitude Sud (Ouédraogo, 1990). Selon la FAO, 1998
cité par Kam (2003), la limite nord de l'aire de répartition suit
approximativement 15° de latitude nord et la limite sud correspond
à peu près à 20° latitude sud et s'infléchie
le long de la côte orientale de l'Afrique pour descendre jusqu'au
30è degré latitude sud (Fig. 6). Cette répartition
actuelle s'explique par les différentes modifications de l'habitat
naturel des glossines dues aux phénomènes naturels
(sécheresse par exemple) et de l'activité humaine
(déforestation, feux de brousses, les plantations,...).
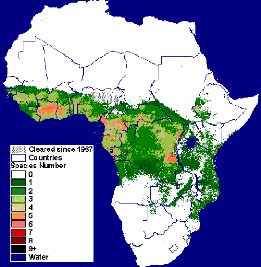
FIGURE 6 : CARTE DE REPARTITION DES GLOSSINES, FAO,
1998.
1.1.6 Rôle vecteur des glossines.
La trypanosomose est une affection parasitaire
provoquée par la présence dans le plasma sanguin ou dans divers
liquides organiques d'un protozoaire flagellé appartenant à la
famille des Trypanosomatidae et au genre Trypanosoma. C'est
une affection typiquement africaine et prépondérante dans les
régions peuplées de glossines. Trois modes de transmissions
sont
17
connus de la maladie:
- la transmission mécanique par les vecteurs
mécaniques tels que les tabanidea et les stomoxes ;
- la transmission sexuelle ;
- la transmission cyclique par les glossines.
Dans les régions où les glossines sont
absentes, la transmission no cyclique n'entraîne qu'une faible incidence
des trypanosomoses, sauf si la densité des vecteurs mécaniques,
dont les fluctuations liées aux variations saisonnières
augmentent (Itard, 2000).
L'importance des affections dépend donc
essentiellement de la présence des glossines. Les glossines ou mouches
tsé-tsé constituent les vrais vecteurs biologiques de la
trypanosomose animale africaine. Elles s'infestent lors de la prise de leur
repas sanguin sur un hôte malade. Au sein de la glossine, le protiste
pour l'homme et l'animal subit un cycle évolutif complexe
(transformations et des multiplications) dans le tube digestif et les glandes
salivaires aboutissant à l'apparition de formes infectantes dans
l'hypopharynx prêtes à être inoculées à un
hôte vertébré.
Les trypanosomes dont l'évolution se passe dans la
partie antérieure et moyenne du tube digestif appartiennent à la
section des salivaria. Elle s'applique à Trypanosoma
congolense, T. vivax, T. brucei ainsi qu'aux trypanosomes responsables de
la maladie du sommeil (T. b. gambiense et T. b. rhodesiense).
Certains autres trypanosomes classés dans la section des stercoraria
ont leur développement qui se déroule dans la partie
postérieure du tube digestif de l'insecte. La transmission du protiste
se fait par les fèces déposés sur la peau et les muqueuses
après une piqûre. Ils sont sans importance médicale. C'est
le cas de Trypanosoma grayi et T. grayi-like parasites des
reptiles (varans et crocodiles). La durée du cycle de
développement varie selon les espèces de trypanosomes :
T. vivax effectue un cycle beaucoup plus court qui
dure environ 10 à 15 jours. Parasite des bovins, ovins, caprins,
dromadaires et chevaux, ce protozoaire évolue successivement dans
l'oesophage, le labre et enfin l'hypopharynx. Toutes les espèces de
glossines sont susceptibles de le transmettre.
Chez T, congolense, les trypanosomes issus de
l'alimentation sanguine de la mouche, après l'intestin moyen remontent
les glandes salivaires, gagnent le labre et enfin l'hypopharynx. Son cycle dure
dix huit jours et il parasitent de nombreux mammifères domestiques
(bovins, moutons, chèvres, dromadaires, chiens et parfois les porcs).
18
Les trypanosomes du genre brucei notamment T.
brucei gambiense, T. b. rhodesiense et T. b. brucei ont un cycle
beaucoup complexe et dure une trentaine de jours. Trois formes sont connues de
ces trypanosomes dont la forme courte. Seule cette forme peut se
développer chez la glossine une fois ingérée. Après
avoir traversé ou contourné la membrane péritrophique,
elle se retrouve dans l'espace ecto-périthrophique où elle se
différencie en trypomastigote procyclique. Après une division
active, elles donneront des mesotrypanosomes dans le pro-ventricule. Ceux ci
gagnent la trompe et se différencient ensuite en epimastigotes qui,
après une autre division et transformation aboutiront à des
formes infectantes (metacycliques) dans les glandes salivaires.
T. b. gambiense est responsable de la maladie du
sommeil en Afrique de l'ouest et centrale. Il est transmis par Glossina
palpalis et G. tachinoides. T. b. rhodesiense quant à lui
est transmis par les glossines du groupe morsistans. Il est
responsable de la maladie du sommeil en Afrique de l'Est.
Une glossine infectée reste infectante durant tout le
reste de sa vie et peut héberger plusieurs milliers de trypanosomes dont
une seule piqûre suffit pour infecter un mammifère, Au sein d'une
population de vecteurs, 3 à 10% seulement des glossines seraient
capables de transmettre la maladie (Koné, SD).
1.2. Nouvelles méthodes de luttes.
1.2.1 Facteurs déterminant la lutte contre les
glossines.
Dans l'histoire de l'Afrique, la Trypanosome Animale
Africaine (TAA) transmise par les glossines est considérée comme
la plus importante maladie parasitaire qui a retardé son
développement agro-pastoral. Cette importance résulte de
l'étendue des zones infestées par ces insectes nuisibles et leurs
impacts directs et indirects sur le développement socio -
économique de l'Afrique.
1.2.1.1 Facteurs socio-économiques. a. Facteurs
sociaux.
La trypanosomose humaine est une maladie parasitaire qui
sévit uniquement en Afrique au sud du Sahara dans les zones de
répartition des glossines. Elle est due à des trypanosomes du
groupe brucei (T. b. gambiense et T. b. rhodesiense) et
transmise par la
19
piqûre de mouches tsé-tsé ou glossines,
C'est une maladie qui frappe surtout la population des zones rurales qui
dépend exclusivement de l'agriculture, l'élevage, la pêche
ainsi que la chasse. Selon l'OUA (2000), 60 millions de personnes, dont
seulement 3 à 4 millions sous surveillance médicale sont
exposées aux risques trypanosomiens. L'OMS (2000) estime à 500
milles le nombre de personnes déjà atteintes dont 80% meurent
chaque année. La situation se détériore rapidement avec
40000 nouveaux cas notifiés chaque année. Par conséquent,
la force de travail pour la production agropastorale se trouve
considérablement réduite. La maladie du sommeil représente
la principale cause de mortalité dans certaines régions de la
République Démocratique du Congo (RDC) devant le VIH/SIDA.
b. Facteurs économiques.
« Dans les milieux fragiles soumis à des
contraintes multiples, l'animal, qu'il soit domestique ou sauvage, constitue un
élément essentiel pour la vie et souvent la survie des individus,
des communautés et des peuples avec qui il partage les espaces, les
milieux et les ressources » (Monicat (F), cité par de la Rocque
(S), Michel (J.F), Cuissance (D) ; 2001). Dans les pays en voie de
développement, l'animal est utilisé comme moyen de lutte contre
la pauvreté et constitue un élément clé de
l'identité socio-culturelle des populations. Cependant, dans le domaine
de la production animale, les glossines restent les principaux facteurs
limitants en Afrique sub-Saharienne en empêchant ou en gênant sa
production sur près de 10 millions de km2 de terres qui
offrent pourtant de fortes potentialités fourragères et
agricoles. Les experts estiment qu'en l'absence de glossines, il serait
possible d'élever 33 millions de têtes de bétail
supplémentaire, correspondant à une production potentielle de 0,5
millions de tonnes de viande et 1,6 millions de tonnes de lait par an (Winrock
International Institute, 1992 cité par de la Rocque (S), Michel (J.F),
Cuissance (D) ; 2001).
Généralement dans les systèmes
d'élevage sous risque de trypanosomose, elles entraînent :
- une réduction du vêlage 1 à 12% : races
trypanotolerantes ;
- une réduction du vêlage de 11 à 12% races
sensibles ;
- une augmentation de la mortalité des veaux : 0 à
10% races tolérantes ; - une augmentation de la mortalité des
veaux 10 à 20% races sensibles.
En outre, dans ces zones, la perte de production de viande
est de 30%, celle du lait, de 40%. La puissance du travail est réduite
du tiers et un paysan élève deux fois moins de boeufs de
20
traits et cultive trois fois moins de surface (Swallow, 1998),
En Asie, on estime à 50% la culture agricole bénéficiant
d'animaux de trait. En Afrique, la proportion est de 5 à 10%. En
conséquence, l'Afrique pourrait perdre tous les ans 4,5 milliards de
production agricole (FAO, 2000).
Par ailleurs, l'usage des trypanocides préventifs et
curatifs pour le maintien de la santé animale est fréquent avec
pour corollaire, l'émergence de problèmes de
chimiorésistance. Environ 35 millions de doses de trypanocides
préventifs (d'une valeur de 35 millions de dollars) sont achetées
par an pour empêcher le bétail de contracter la maladie mais en
vain estime la FAO (2000).
La production de viande bovine est de 85,7kg/animal/an dans
les pays développés contre 20,7 dans les pays en voie de
développement dont seulement 15,75 kg en Afrique Subsaharienne (Tacher
et Letenneur, 1997 cité par de la Rocque (S), Michel (J.F), Cuissance
(D) ; 2001) Or selon winrock International Institute for Agricultural
Developement 1992, Hursey& Slingeberg ; (1995), citée par ces
mêmes auteurs (2001), la banque mondiale estime que les productions
animales devront croître de 4% durant les trente années à
venir pour faire face à la croissance démographique africaine.
Une maîtrise de la trypanosomose constitue donc un défi majeur de
développement
1.2.1.2. Facteurs écologiques.
L'importance écologique s'explique par
l'étendue des zones qui sont sous l'emprise de mouches
tsé-tsé ou glossines et leur impact sur la production
agropastorale. L'U.A (2000) estime à environ 10 millions de km2 de
terres fertiles, en particulier les vallées fluviales, les terres
humides qui se prêtent le mieux à la production agropastorale, la
superficie est infestée par les mouches tsé-tsé. Ces zones
s'étendent sur 37 pays classés parmi les plus pauvres au monde.
Si on retranche de la superficie totale du continent, les régions
désertiques, on constate que les glossines occupent plus que la
moitié de l'Afrique habitable (Itard, 2000). Selon l'OUA, ces zones
n'abritent pratiquement plus de bovins ni d'autres animaux.
Sur 165 millions de têtes de bétail que compte
l'Afrique, seuls 10 millions se trouvent dans les zones infestées par
les mouches tsé-tsé (U.A. 2000); soit une tête/km2 contre
85 têtes/km2 en zone indemne de glossines. Par conséquent, les
terres des zones exemptes de glossines se trouvent être
confrontées à un surpâturage et une surexploitation des
surfaces
21
pour la production vivrière. Sans les mouches
tsé-tsé, le nombre de tête de bétail augmenterait.
Il se produirait une répartition plus égale du bétail, ce
qui réduirait ce problème de surpâturage dans les zones
à cheptel excessif actuellement exempte de glossines, ainsi qu'une
orientation du marché vers les races productives (A.I.E.A. 2002).
Une éradication des mouches tsé-tsé et
par-là même la trypanosomose reste un défi à lever
pour accroître la production vivrière et favoriser
l'épanouissement de la population africaine. L'éradication des
glossines sur l'île de Zanzibar a permis de tripler la production de lait
; celle de boeufs a doublé et l'utilisation du fumier animal dans
l'agriculture a été multipliée par cinq, d'après le
ministre de l'agriculture de cette île (Naututu Okhoya, 2003).
1.2.2. Méthodes de luttes.
Les glossines sont les vecteurs importants des trypanosomes
responsables de la maladie du sommeil chez l'homme et la trypanosomose animale
africaine. La lutte anti -vectorielle est donc très déterminante
dans les stratégies d'intervention contre cette affection. Cependant,
depuis un siècle, les méthodes classiques de lutte n'ont pas
permis d'enrayer le mal. Les connaissances sur la biologie de ces insectes ont
permis la mise en oeuvre de nouvelles méthodes de lutte dont le
système des attractifs toxiques (SAT), épandage séquentiel
d'insecticides, les régulateurs de croissance (IGR) et la Technique de
l'Insecte Sterile (TIS)
1.2.2.1. Le système des attractifs toxiques
(SAT).
La première idée sur le piégeage vient
de Maldonado (1910), cité par Da Costa (1915), Pa. Buxton (1955) et par
Sawadogo (1990). Selon ce même auteur, cette méthode a connu un
grand succès sur l'île de Principes où 183778 individus de
G. palpalis gambiensis ont été attrapés en 20
mois. Depuis la fin des années 1970, grâce à une meilleure
connaissance des facteurs attractifs visuels et olfactifs, cette méthode
a été améliorée, ce qui a permis la mise en oeuvre
des attractifs toxiques.
Le S.A.T est un ensemble d'objets (pièges,
écrans) attractifs par leur forme, leur taille, leur couleur ou par
adjonction d'attractifs olfactifs et rendu toxique par la présence d'un
insecticide (Chalier, 1984). Il vise donc à tuer les glossines en grand
nombre ou à les stériliser au moyen de chimiostérilisant.
Selon Lambrecht (1973), cuisance (1989), la couleur joue un rôle
très important dans l'attractivité et l'efficacité de
capture du SAT ; Les couleurs bleus et
22
noires ont une attractivité supérieure (Rupp,
1952, Cuisance (1989)).
L'efficacité de capture du système est
améliorée par l'adjonction des attractifs olfactifs
(acétone, l'urine de boeufs,...). Ces attractifs olfactifs auraient
plusieurs types d'effets sur les glossines. Non seulement, ils augmentent le
nombre de glossines arrivant près des pièges mais accroissent
leur efficacité (glossines attirées et capturées). Selon
Cuisance (1989), les attractifs olfactifs permettent de réduire la
densité de leurres de 30 à 5 et d'accroître
l'efficacité des barrières contre G. morsitans submorsistans
tout en abaissant le coût de surveillance et d'entretien. Cet
accroissement va jusqu'à 8 à 12 fois avec un débit
croissant de 0.02 à 20 l/mn chez G. morsitans et G.
pallidipes (Vale et al, 1985 ; Cuisance, 1989).
De nos jours l'insecticide le plus utilisé est la
deltamethrine. Elle :
- est très toxique pour les glossines à faible
dose;
- a peu d'effet sur les mammifères et l'environnement,
- est stable à l'air et à l'environnement,
- a une accumulation faible voir négligeable dans la
chaîne alimentaire.
- est bon marché.
Dans la campagne de lutte contre les glossines au Burkina
Faso, l'analyse des doses de deltamethrine imprégnée sur des
morceaux de tissus bleus (100% coton) montre, après trois et demi
à quatre mois d'exposition aux conditions naturelles des galeries
forestières, des qualités résiduelles encore en moyenne de
4% (Cuisance et al, 1984).
Actuellement, dans les campagnes de lutte contre les
glossines, le SAT présente deux rôles. Il est utilisé
comme:
- un moyen de lutte contre les glossines ;
- une barrière contre une nouvelle colonisation des
zones déjà assainies.
Utilisé comme moyen de lutte, le SAT permet une
réduction rapide de la population de glossines grâce à
l'effet foudroyant de l'insecticide utilisé. Du fait de la faible
fécondité des glossines, il est établi qu'il suffit d'un
taux journalier de capture de 1 à 7% de la population femelles pour
aboutir à une réduction importante de sa densité (Weidhaas
et al, 1978, Cuisance, 1989).
Il est calculé qu'un retrait journalier de 4% de la
population femelle doit conduire à l'extinction et que 2 à 3%
sont probablement suffisants (Hagrove, 1988) ; 2,5% aboutissent à 95% de
réduction de la population en un an (Hargrove et al, 1979, Cuisance,
1989). Ceci rend important le S.A.T. Par exemple selon ce même auteur,
après avoir traité 62 Km de la rivière
23
Leraba en Côte d'Ivoire, par six cent pièges
insecticides Laveissière et al (1980) emploient 876 écrans
insecticides sur 79 Km de la même rivière obtenant une
réduction de 99,6% et 99% des populations de G. tachinoides et
G. p. gambiensis.
Les chutes de densité de glossines importantes et
rapides rendent son usage particulièrement judicieux dans l'interruption
du cycle de transmission de la maladie de sommeil chez l'homme.
Comme moyen de protection, le SAT permet de réaliser
des barrières assez vastes contre la recolonisation des zones
déjà traitées par des glossines immigrantes. Selon Itard,
2000, contre les glossines riveraines, l'étanchéité des
barrières est totale avec un piège tous les 100 m le long de 10
Km de galeries si les pièges sont uniquement capteurs, ou sur 7 Km si
les piges et écrans sont imprégnés de pyrethrioides,
à condition de les réimprégner tous les deux mois.
Comme toute méthode, le SAT présente des
avantages et des inconvénients.
Avantages :
Le SAT est une technique qui a l'avantage d'être peu
coûteux et réalisable localement. De plus, la dose très
faible de la pyréthrinoide utilisée réduit les risques de
pollution. Il n'a pas d'effets négatifs sur la faune aquatique et a un
effet très négligeable sur les autres insectes autres que les
glossines. Il permet en outre une analyse très fine des récoltes
afin de déterminer la carte de répartition des vecteurs
(dispersion, densité, dynamique,...). Enfin c'est une méthode qui
peut être intégrée avec d'autres méthodes telles que
écrans insecticides suivis de lâcher de males stériles
(Cuissance et al, 1983 Merot, 1984, 1985, Tachen et al ; 1986, Kaboré et
al ; 1986) ou la pulvérisation aérienne d'insecticides.
Inconvénients :
L'efficacité de capture du SAT est variable selon les
saisons et les espèces. Selon Cuisance, 1983, non publié ; 1989,
la couleur marron peu attractive en saison sèche (savanes
brûlées) vis-à-vis de G. morsitans le devient en
saison des pluies en raison probablement du contraste En plus, selon Merot
(1988) cité par ce même auteur (1989), un piège
mono-conique dont la partie supérieure des écrans est noire et la
partie inférieure bleue donne de résultats meilleurs en saison de
pluie qu'en saison sèche pour G. m. submorsistans et G.
tachinoides en savane humide au Burkina Faso. Le matériel est
très vulnérable (vol, feux, eaux ...) et doit être
renouvelé au moins une fois par an. Le rythme de imprégnations
(chaque 3 à 6 mois) et un
24
nombre élevé de pièges et écrans
pour une bonne couverture constitue une contrainte pour sa réalisation.
En outre, la maîtrise du SAT nécessite une bonne maîtrise de
l'écologie, de l'éthologie et la répartition des
espèces en fonction des conditions climatiques. C'est une méthode
qui demande la réalisation de voies d'accès aux pièges et
écrans si bien qu'elle est difficilement réalisable dans les
zones marécageuses, en zone de montagne ainsi que dans les forêts
boisées.
1.2.2.2 Epandage séquentiel d'insecticides.
Selon l'objectif visé et la nature de la zone à
traiter, la technique d'épandage de l'insecticide est différente
:
- Epandage séquentiel par avion :
Il s'agit d'épandage d'insecticide non rémanent
à faible dose en petites gouttelettes au moyen d'atomiseur rotatif
monté sur un avion, Les vols s'effectuent pendant les périodes
d'inversion de la température entre une heure avant le coucher et deux
heures après le lever du soleil, La vitesse des vols est comprise entre
250-300 km/h, à 10 à 15m au-dessus des cimes des arbres, Pour
obtenir une éradication totale, il faut 5 à 6 survols à
des intervalles de 10 à 18 jours pour toucher les mouches nouvellement
émergées des pupes déposées à terre, C'est
une technique adaptée en milieu de savane,
La technique a l'avantage d'être rapide et
nécessite peu de personnels De plus, la dose faible de l'insecticide a
peu d'effet sur la faune non cible. Cependant, elle est non discriminative,
onéreuse et applicable uniquement en région de faible relief
à végétation ouverte.
- Epandage par hélicoptère :
C'est une pulvérisation d'insecticide rémanent
à l'aide d'appareillage monté sur hélicoptère. Le
vol s'effectue à faible vitesse entre 30-40km/h à 1 à 2
mètres au-dessus des arbres. Le traitement se déroule en saison
sèche tôt le matin ou en fin d'après midi.
Contrairement à l'épandage par avion, cette
technique est discriminative et destinée à des zones
difficilement accessibles. C'est une méthode chère mais le
coût reste inférieur à celle par avion.
25
1.2.2.3 Régulateurs de croissance (Insect Growth
Regulators ou IGR).
Le principe consiste à utiliser des pièges ou
des écrans imprégnés de régulateurs de croissance
pour attirer les glossines et les stériliser grâce à
l'effet de ces produits.
Selon Bancé (2003), il existe deux groupes de
régulateurs de croissance qui agissent par ingestion ou par contact. Il
s'agit :
- des analogues des hormones juvéniles. Ce sont :
· le methoprène ;
· le genocycarb ;
· le pyriproxyfene ;
· l'hydropène ;
- les inhibiteurs de la mue (synthèse de chitine) qui
sont :
· le diflubenzuron ;
· le teflybenzuron ;
· le flufenuxuron ;
· le chlorfluazuron ;
· le dicyclail ;
· le triflumuron
Le diflubenzuron est une hormone qui est très peu
toxique pour les vertébrés et biodégradable, Elle peut
donc être utilisée sur grande échelle dans la nature, Elle
n'a pas d'effet sur la longévité des glossines adultes mais les
larves pondues n'atteignent pas le stade de pupes (stade nymphal), En Ouganda.
une application du triflumuron, inhibiteur de la synthèse de chitine sur
des pièges pyramidaux comme action préalable à des
lâchers de mâles stériles en évitant l'emploi
d'insecticides sur les piéges a permis de concilier les effets du
piégeage et ceux de l'insecte stérile (Langley, 1997), Selon
Bauer et al, 1997, son application sur 1667 écrans à la dose de
6mg/m2 dans une zone de forte densité de Glossina tachinoides
et G. morsitans submorsistans montre une forte réduction
et même disparition de Glossina morsistans et G. tachinoides
âgé de moins de 30 jours,
A l'effet stérilisant des femelles qui entrent en
contact avec les régulateurs de croissance s'ajoute la
possibilité de transfert par les mâles (tarses
imprégnés) aux femelles vierges lors des trois accouplements
ultérieurs successifs. Les IGR ont donc l'avantage d'étendre le
rayon d'action du fait que les mâles traités peuvent se disperser
beaucoup plus
26
loin et d'agir à distance.
1.2.2.4 Technique de l'insecte stérile
(TIS).
Elle consiste à utiliser toute méthode capable
de rendre l'insecte cible stérile et compromettre ainsi sa descendance.
Parmi les méthodes qui utilisent la TIS on peut citer principalement le
lâcher de mâles stériles.
a. La méthode du lâcher de mâles
stériles
Elle consiste à lâcher de façon continue,
dans une population sauvage, des individus de la même espèce,
physiquement ou chimiquement stérilisés pour compromettre la
descendance et, à long terme aboutir à l'extinction de cette
population. Cette technique repose sur le fait que chez les diptères,
les glossines en particulier les femelles ne s'accouplent en
général qu'une seule fois au cours de leur vie et conservent le
sperme du mâle dans leurs spermatèques. Une femelle
inséminée par un mâle stérile ne produit pas de
descendance durant tout le reste de sa vie.
Le principe consiste à produire des mâles
stériles au laboratoire qui vont s'accoupler avec les femelles sauvages
sans les féconder. La stérilisation peut être obtenue par
des rayons gamma fournis par le cobalt 60. Des doses de 8kilorad à 16
krad sur des mâles ténéraux donnent des individus
stériles à 95% (CIRAD, 2001). Cependant l'utilisation des rayons
gamma diminue la longévité des mâles irradiés, sauf
si le traitement a lieu après le seizième jour de pupaison.
Pour que le lâcher de mâles stériles soit
efficace, il est préconisé sept à dix mâles
stériles pour un mâle sauvage (Kaboré, 2001), C'est une
méthode qui nécessite une production de masse des glossines au
laboratoire. Cependant bien que les méthodes d'élevage des
tsé-tsé soit bien améliorées, elles restent
délicates et le taux de production des glossines faible (une larve
chaque 8 à 10 jours) rend la production de masse très difficile,
Elle nécessite donc un grand soutien financier,
En zone de forêt, le lâcher se fait sur tous les 2
km alors qu'en savane il a lieu sur tous les 1km,
C'est une technique qui présente un grand nombre
d'avantages:
- C'est une méthode non polluante et spécifique
dirigée seulement contre les
27
glossines ;
- C'est un système pouvant être
intégré à d'autres méthodes notamment
l'épandage d'insecticides et le SAT ;
Cependant son utilisation requiert un personnel consciencieux
et qualifié. En plus, il n'est applicable que sur une population
réduite et sur une surface isolée pour éviter les
réinvasions: d'où l'importance de l'approche régionale de
lutte. De plus, chez les glossines, mâles et femelles sont capables de
transmettre la trypanosomose. Donc, un lâcher de mâle,
associé au risque d'une mauvaise stérilisation accroissent
momentanément les risques de contamination.
b. Projets réussis de mâles
stériles.
La lucilie bouchère présente en Amérique
latine a fait son apparition en Afrique du Nord (Libye) en 1988, après
maintes tentatives de lutte, on est arrivé à la technique du
mâle stérile. En une année, après une
réduction de la population par des insecticides, un lâcher de 400
millions de mouches stériles par semaine a permis d'éradiquer ce
mal.
De 1983 à 1985, G. tachinoides, G. p.
gambiensis et G. morsitans submorsistans ont
été éradiquées dans la zone pastorale de
Sidéradougou au Burkina Faso par une équipe du CRTA, actuel
CIRDES, par une méthode intégrée : SAT en saison
sèche plus le lâcher de mâles stériles en saison
pluvieuse (Cuisance et al 1984,1985 ; Politzar et al 1983 ; 1984 ; Merot et al
1984 ; Kaboré et al 1986),
1.3. Tentatives de production de masse des glossines de
qualité.
Les glossines ont été pour la première
fois décrites par WIEDMANN (1830) mais c'est ROUBAUD (1913) qui
réussi le premier à réaliser son élevage à
partir de pupes de Glossina morsistans submorsistans en provenance du
Sénégal (Kaboré, 1982 : Honoré Kam, 2003). Au
début, les glossines étaient élevées pour la
recherche sur leur physiologie et pathogenicité ainsi que pour des
lâchers de males stériles. De nos jours c'est ce dernier point qui
retient plus l'attention des éleveurs de glossines.
Le premier élevage de masse a été
possible grâce à l'utilisation des plaques chauffantes, des
chariots de stockage, des hottes de manipulation. Grâce à ce
procédé, cinq personnes suffissent pour s'occuper de 10.000
femelles reproductrices en une matinée (Bauer et al, 1984
28
Kam 2003). Selon Bouchon et Cognet (1984), le CRTA aurait
produit plus de 5 000 000 pupes et lâchers 900.000 mâles
irradiés pour la campagne de lutte à Sidéradougou
grâce à ce procédé.
Dans le but d'une production de masse, la FAO/AIEA a
conçu plusieurs systèmes de productions depuis les années
1995. Le premier système (TPu-1) qui avait pour objectif
l'élevage d'un maximum de glossines sur une surface réduite a
connu un échec. En effet, ce système était
confronté à une mortalité très importante par
rapport aux pupes produites. Cet échec conduit à la mise en place
d'un TPU-2 qui malheureusement ne connaîtra pas non plus un
succès. Les cages oblongues de ce deuxième système
entraînaient une mauvaise répartition de la lumière dans
celles-ci. Ce qui avait pour conséquence une forte mortalité.
L'expérience de ce second système entraîne la mise en place
d'un TPU-3. Contrairement aux deux premiers où les cages des mouches
étaient déplacées pour leur alimentation, dans le TPU-3,
les chariots de stockage des mouches tsé-tsé sont fixes. La
préparation des membranes pour l'alimentation sanguine des mouches se
fait selon la méthode conventionnelle de préparation des
membranes (FAO/AIEA, 2000 ; Kam, 2003). Ces membranes, montées sur un
train sont déplacé vers les chariots portant les mouches pour
leur alimentation. Ce dernier peut être commandé par un
ordinateur. Il promet la réduction des travaux de l'ordre de 90% (Kam,
2003).
29
Chapitre 2 : MATERIELS ET METHODES
30
2.1. Matériels.
Le suivi des expériences s'est déroulé dans
un laboratoire dont les conditions atmosphériques
sont propices à la vie des glossines. La
température interne du laboratoire était de 25#177;1°c et
l'humidité de 70%. Ces conditions sont réalisées
grâce à des climatiseurs fonctionnant 24/24h et des
humidificateurs automatiques fixés sur le bâtiment et
réglés à 70%.
Le matériel d'expérience se compose de
matériel biologique et de matériel technique
2.1.1. Matériel biologique.
.
a. Les glossines
Trois espèces de glossines ont fait l'objet d'un suivi.
Il s'agit de Glossina tachinoides, de G.
palpalis gambiensis et de G. morsitans
submorsistans. G. palpalis et G. tachinoides
appartiennent au sous genre Nemorhina. G. morsitans
submorsistans quant à elle appartient au sous genre Glossina
str. Ces trois espèces sont élevées dans
l'insectarium du CIRDES.
En rappel, Glossina gambiensis palpalis et G.
morsitans sont originaires du Burkina Faso. G. tachinoides quant
à elle vient du Tchad. Les pupes de G. palpalis gambiensis
furent récoltées dans la forêt classée de la
marre aux hippopotames à Satiri et de la forêt classée de
la Guinguette au bord du fleuve Kou. Après être envoyé au
laboratoire d'entomologie de maison-Alfort en France pour une analyse, 10 024
pupes étaient admises à Bobo Dioulasso de ce dernier le
25/03/1975, pour le démarrage de l'élevage. En 1979, les pupes de
G. tachinoides arrivaient du Tchad au CIRDES ex CRTA. Les pupes de
G. morsitans submorsitans enfin, furent récoltées dans
la région de Samorougouan dans les années 19801981.
Après une alimentation « in vivo» sur des
animaux (chèvres, cobayes et lapins) en 1979 fut introduit le mode de
l'alimentation sur membrane artificielle (Bauer et Politzar, 1982 Kam, 2003).
Dès lors, on aboutit à une alimentation mixte et ce, jusqu'en
1984. Actuellement, les glossines sont exclusivement nourries sur membrane de
silicone très mince (400-600um) recouvrant du sang.
b. Le sang.
Deux types de sang sont utilisés. IL s'agit du sang frais
et du sang congelé.
- Le sang frais.
Il est récolté les lundis et jeudis à 1
heure du matin à l'abattoir frigorifique de Bobo-
31
Dioulasso. Il est immédiatement defibriné. Ce
sang est ensuite conditionné dans des flacons de 0,5l après un
ajout d'ATP (700mg/l) et de glucose (1000mg/l). Les flacons de sang sont
après irradiés au rayon gamma par du césium 137 à
la dose de 50 krad (0,5 krad / mn pendant 1h 40 mns). L'utilisation du sang
n'intervient que 24 h après un contrôle bactériologique. Il
est conservé au réfrigérateur à 4°c. et n'est
pas utilisé au-delà d'une semaine
- Sang congelé.
Une partie du sang frais récolté est
conditionnée dans des flacons en plastique et conservée dans un
congélateur fonctionnant à -12°c. Pour être
utilisé, ce sang doit être décongelé.
Deux méthodes ont été utilisées
pour la décongélation du sang. La première consiste
à placer deux flacons dans un réfrigérateur fonctionnant
à 4°c pendant 24h. Au bout de ce temps, le sang est
décongelé et prêt à la préparation. Quant
à la deuxième, il suffit de plonger deux flacons dans de l'eau de
robinet pendant quelques heures. Cette deuxième méthode a
l'avantage de provoquer une décongélation rapide mais
présente des inconvénient sur la qualité du sang, La
première qui demande plus de temps est la meilleure.
La préparation est idem à celle du sang frais
à la différence qu'un des flacons de sang est irradié sans
ajout d'ATP ni de glucose. L'irradiation est faite pendant 1h45mn (105 minutes)
à la dose de 52,5 krad. Chaque flacon est utilisé pendant trois
jours.
2.1.2. Matériel technique. a. Les cages de
contention.
Plusieurs cages sont utilisées pour le conditionnement
des mouches. Ce sont :
- Les grandes cages. Ce sont des cages
parallélépipédiques en fil d'acier inoxydable de 3 mm de
diamètre. Ces cages de dimensions 6 cm X 39 cm X 19 cm sont
habillées de tulles moustiquaires dont le diamètre des mailles
est fonction de l'espèce. Celles des cages de Glossina morsistans
et G. palpalis ont un diamètre 2 mm X 2 mm alors que celle de
G. tachinoides est de 2 mm X 1 mm. Cependant une des faces
latérales porte une bande de tulle dont les mailles sont de 2 mm X 2 mm
afin de laisser passer les larves. Les tulles débordent à l'une
des extrémités formant un manchon que l'on noue avec un lacet
après l'introduction des glossines. Une grande cage peut supporter 150
femelles et 50 mâles.
- Les cages TPU-3,
Ce sont des cages cylindriques en polychlorure de Vinyle
(P.V.C) de 19 cm de diamètre et de hauteur 5 cm. Les deux faces
latérales sont ouvertes et recouvertes de tulles moustiquaires
32
dont les mailles sont suffisamment grandes pour laisser passer
les pupes (2 mm X 2 mm). Les deux tulles, solidairement fixés par des
élastiques sont liés l'un à l'autre par
l'intermédiaire de pinces. La face fermée par une plaque est
percée d'un trou par lequel on introduit ou prélève les
mouches, Elles ont un volume de 1417,64 cm3.
- Cages Roubaud,
Ce sont de cages parallélépipédiques de
dimensions 13 cm X 8 cm X 4,5 m. Elles sont habillées de tulles
moustiquaire de mailles de diamètre 1 mm X1 mm. Elles débordent
d'une extrémité par laquelle on les noue à l'aide d'un
lacet. Chaque cage Roubaud peut contenir 150 males et 50 femelles.
- Les cages individuelles,
Ce sont de petites cages cylindriques de 6cm de
diamètre et de 2.7cm de hauteur faites de PVC. Elles présentent
l'avantage de permettre la détermination facile du poids ou de la
quantité de sang ingéré par les glossines.
- Les plaques chauffantes,
L'alimentation des mouches se fait au moyen de plaques
chauffantes à l'abri de toute lumière. Sur ces plaques sont
déposées support et membranes en silicone et entre lesquelles est
étalé du sang. Elles servent à chauffer le sang à
une température avoisinant celle de l'organisme (37°c). Ces plaques
fonctionnent à 41°c et sont placées dans une enceinte
où les conditions sont optimums (température 25°c,
humidité 70%).
- Les cages d'éclosion.
b. Autres matériels,
Plusieurs autres matériels sont utilisés. Ce
sont:
- les chariots sur lesquels sont déposées les cages
;
- les étuves fonctionnant à 105°c et servant
à stériliser le matériel de manipulation,
après utilisation,
- les pondoirs individuels en aluminium permettant la
récolte des pupes par cage. Il
est fait de deux plans inclinés entraînant les
larves à un collecteur central,
- des tubes à essais pour l'accouplement des glossines
;
- des congélateurs pour l'anesthésie des glossines
afin de pouvoir les repartir par
sexes dans les cages;
- une balance pour la prise de la masse des mouches et celle des
pupes ;
33
- un microscope et une binoculaire pour la dissection ;
- des boites de pétries;
- une trousse de dissection ;
- du papier pour les étiquettes.
2.2. Méthodes.
2.2.1 Fréquence de l'alimentation.
La fréquence de l'alimentation des mouches
tsé-tsé se définie comme étant le nombre de jours
par semaine au cours desquels ces glossines sont nourries. Actuellement, elle
est de 6/7 jours. Cette fréquence très élevée
engendre des coûts de productions très élevés.
Une réduction de la fréquence de l'alimentation
contribuera à une optimisation de la production à un coût
relativement faible. La mise en place d'une telle fréquence
nécessite au préalable une expérimentation, Ainsi les
trois espèces seront soumises à des restrictions
différentes de l'alimentation.
2.2.1 1. Effet de l'alimentation 3/7jours.
Deux espèces G. palpalis gambiensis et G.
morsitans submorsitans seront utilisées pour cette
expérience. Glossina morsistans submorsitans tolérerait
l'alimentation 3/7jours pour sa taille moyenne (Kam, 2003). Pour
vérifier afin de confirmer ou d'infirmer cette conclusion,
réalisons deux traitements avec G. morsitans submorsitans et
G. palpalis gambiensis.
- Traitement 1 : 400 femelles de G morsistans
submorsitans,
- Traitement 2 : 600 femelles de G. palpalis
gambiensis.
Ces traitements sont régulièrement
alimentés jusqu'au quatrième jour de vie. Après quoi,
elles sont soumises à une alimentation trois fois par semaine (3/7
jours) (Lundi - Mercredi et Vendredi. Afin de permettre au maximum des mouches
de s'engorger, elles sont alimentées, pendant quinze minutes à
chaque alimentation.
Au troisième jour d'âge elles sont
accouplées avec des mâles adultes de six jours d'âge
à la norme de 1/3 (un mâle pour trois femelles).
2.2.1.2. Effet de l'alimentation 4/7 jours (Lundi -
Mardi - jeudi et vendredi).
600 ; 400 et 200 femelles respectivement de G. palpalis
gambiensis; Glossina morsitans submorsitans et G. tachinoides
vont subir une restriction alimentaire 4/7 jours. Au début, les
glossines sont placées dans les mêmes conditions que celles de
l'expérience 3/7jours jusqu'au quatrième jour d'âge. Apres
le quatrième jour, elles subissent la restriction alimentaire 4/7
34
jours. Ces mouches sont alimentées les mardi et
vendredi pendant dix minutes. Les deux jours extrêmes, c'est à
dire les lundi et jeudi, le temps de l'alimentation est porté à
15 minutes pour permettre au maximum de mouches de mieux se gorger.
2.2.1.3. Effet de l'alimentation 5/7 jours.
Dans cette expérience, seules G. palpalis et
G. tachinoides seront utilisé. G. morsitans sumorsitans
tolérant déjà l'alimentation 3/7 jour. 600 et deux
250 femelles respectivement de G. palpalis gambiensis et G.
tachinoides sont utilisées. Comme précédemment, elles
sont continuellement alimentées jusqu'au quatrième jour
d'âge. Après un accouplement le troisième jour de vie,
elles sont soumises à une restriction de la fréquence alimentaire
après le quatrième jour d'âge. Cependant les lundis et
vendredi le temps d'alimentation est porté à 15 minutes.
Pour toutes ces expériences, un lot témoin de
chaque espèce est réalisé pour la vérification des
différents résultats. Pour cela dans trois cages mettons dans
chacune d'elles 150 femelles de chaque espèce (Glossina morsistans
submorsitans, G. palpalis gambiensis et G. tachinoides). Ces
mouches sont alimentées selon les conditions actuelles de l'insectarium
c'est à dire à la fréquence 6/7 jours. Elles sont
accouplées le troisième jour d'âge avec des mâles
à la norme de 1/3.
Les cages sont ensuite placées sur un chariot, Au cours
de cette expérience la mortalité est quotidiennement
relevée. La date de première larviposition est relevée.
Après la ponte larvaire, les pupes récoltées sont
tamisées isolées des avortons et pesées pour
déterminer le poids moyen. Le vingt cinquième jour, elles sont
emballées dans une cage d'éclosion. La date de la première
éclosion est déterminée ainsi que le ratio de sexes entre
mâles et femelles. Le taux d'éclosion final est
déterminé.
35
2.2.2 Utilisation du sang congelé pour
l'alimentation des glossines.
Les glossines sont des insectes strictement
hématophages. Leur élevage artificiel est tributaire de
l'approvisionnement d'un sang de bonne qualité indemne de tout agent
pathogène. Cependant l'utilisation du sang frais pour l'alimentation des
glossines pose des contraintes suivantes à cet élevage :
- une très grande dépendance à l'abattoir
pour son acquisition ;
- des contaminations bactériennes importantes causent de
grandes mortalités ; - un nombre élevé de sorties cause
d'un coût élevé de production.
Des recourt à d'autres modes de conservations plus
efficient du sang dont la congélation s'est avéré
nécessaire. La mise en place d'un tel système d'alimentation
requiert au préalable des recherches.
Pour ce faire mille huit cent femelles de Glossina
palpalis gambiensis sont utilisées. Ces femelles, reparties en deux
lots de six répétitions de 150 femelles/ répétition
sont affectées au hasard à deux types de sang :
- du sang sans ATP et glucose (sang 1 ou ATP-Glu-)
- du sang congelé additionné d'ATP et de glucose
(sang 2 ou ATP+Glu+).
Afin d'obtenir des mâles adultes de six jours à
accoupler avec des femelles de trois jours, deux lots de six cages Roubaud de
cinquante cinq (55) mâles par cage sont préalablement
réalisés quatre jours avant celle des femelles. Chaque lot de
cages mâle et femelle est tiré au hasard et affecté
à chacun de ces deux types donnés de sang.
Parallèlement, un lot témoin de 150 glossines
femelles et cinquante et cinq mâles est alimenté au sang frais
témoin.
Au troisième jour de vie des femelles, c'est à
dire au sixième jour d'âge des mâles, nous réalisons
leur accouplement à la norme de 1/3 c'est à dire un mâle
pour trois femelles. Les cages sont ensuite placées sur un chariot et
chaque jour la mortalité est notée. Après la larviposition
les pupes sont récoltées, les avortons triés, le poids
moyen des pupes est déterminé. Le taux d'éclosion ainsi
que le pourcentage de mâles et de femelles écloses sont enfin
déterminés.
36
2.2.3. Evaluation de l'importance de l'ATP dans
l'alimentation sanguine des glossines.
Plusieurs facteurs mettent en évidence l'importance de
l'ATP dans l'élevage des glossines. Ce
sont :
- la quantité de sang absorbé ;
- le gain moyen journalier de poids ;
- les différents paramètres de
productivité.
2.2.3.1. Quantité de sang absorbée par
mouche lors d'un repas sanguin et gain moyen de poids des femelles.
Une détermination de la quantité absorbée de
sang présente une importance capitale à
un moment où l'on désire optimiser la production de
glossines. En effet, elle permet la
détermination:
- du seuil de rentabilité de la production ;
- le coût de production par mouche ;
- une prévision d'une quantité donnée de
sang pour l'alimentation d'un nombre
déterminé de glossines.
Pour cela des études préalables sont
indispensables.
Cinq types de sang congelé sont utilisés à
savoir :
- sang de bovin préparé différemment
:
Sang (Sg1) sang dans lequel l'ATP et le Glucose sont
additionnés avant irradiation,
Sang (Sg2) dans lequel le glucose et l'ATP ont été
ajoutés respectivement avant et après
irradiation ;
Sang (Sg3): sang sans ATP mais contenant du glucose;
Sang (Sg4) ne contenant ni glucose, ni ATP,
- Sang de porc (Sg5),
20 cages individuelles contenant chacune trois femelles sont
reparties en cinq traitements de
quatre répétions chacun. Les femelles de chaque
cage seront accouplées par trois mâles le
troisième jour. Ces derniers sont ensuite retirés
après accouplement. Ces différents traitements
sont ensuite tirés et assignés aux
différents types de sang ci-dessus définis. Au début,
afin
d'obtenir le poids des femelles à l'éclosion,
déterminons le poids de l'ensemble cage plus
tulle sans mouche. Ensuite, pesons l'ensemble en présence
des femelles. La différence de ces
deux poids constitue le poids des jeunes femelles mouches
à l'éclosion. A chaque jour
37
d'alimentation, la quantité de sang absorbé par
repas sanguin est déterminée par la différence de poids de
l'ensemble « cage plus glossines », avant et après
l'alimentation. Cette expérience est poursuivie jusqu'à la fin de
la première larviposition.
Au cours de l'expérience, l'évolution du poids
est relevée par type différent de sang et le gain moyen de poids
par mouche est déterminé à la fin. Les pupes issues des
différentes femelles seront récoltées et pesées.
2.2.3 2. Evaluation des paramètres de
productivité des femelles en fonction de l'ATP.
Le glucose joue un rôle très important lors de la
préparation du sang pour l'alimentation artificielle des glossines. En
effet, il permet la protection des hématies contre l'hémolyse
lors de l'irradiation. En outre, il est associé à divers
éléments nutritifs indispensables au métabolisme des
mouches tsé-tsé (Annexe 2). L'ATP quant à lui jouerait un
rôle stimulateur de l'appétit des glossines. Mais il fait l'objet
de plusieurs questions. Aurait t'il un effet sur la qualité du sang lors
de l'irradiation ? Quel effet aurait- t'il sur les performances de
productivité des mouches tsé-tsé quand il est
utilisé après l'irradiation ?
Une autre question qui se pose quant à l'utilisation de
l'ATP est son prix très élevé. En effet l'utilisation de
l'ATP accroît le coût de production des glossines. Le kilogramme
est acheté à plus d'un million de Francs CFA. Ce coût
très élevé constitue un facteur limitant à la
production de masse des glossines. Une réduction de sa fréquence
d'utilisation aura-t-elle un impact sur la production ? Pour répondre
à ces différentes questions, des études se sont
avérées indispensables. Pour cela, réalisons
l'expérience suivante avec cinq types de sang : Sg1, Sg2, Sg3, Sg4 et
Sg5.
20 cages TPU3 contenant chacune quarante cinq (45) femelles de
Glossina palpalis gambiensis sont reparties en cinq traitements. Chaque
traitement est donc composé de quatre répétitions. Ils
sont ensuite tirés au hasard et affectés aux différents
types de sang, Tous les traitements sont continuellement alimentés
jusqu'au quatrième jour. Le reste de l'alimentation se fera quatre fois
par semaine de la manière suivante :
- Lundi 15 minutes ; - Mardi 10 minutes ; - Jeudi 15 minutes
et - Vendredi 10 minutes.
38
La mortalité des glossines est déterminée
à chaque jour d'alimentation. Après les différentes
larvipositions, les pupes sont récoltées, tamisées et
pesées.
2.2.4. Densité optimale des mouches dans les
nouvelles cages TPU3.
Actuellement, dans l'insectarium du CIRDES les cages
utilisées pour la contention des femelles de glossines sont les grandes
cages. Elles ont un volume de 4446 cm3. La densité optimale
dans ces cages est de 4446 cm3/200 mouches (males et femelles
inclus) = 22,23 cm3/mouche tsé-tsé. Elles sont chaque
jour déplacées du chariot sur une plaque pour l'alimentation. La
production de masse des glossines nécessite un système
automatisé qui réduit les temps de travaux dont le TPU-3. La mise
au point de ce nouvel système demande qu'on détermine la
densité optimale dans ses cages.
Dans le but de déterminer cette densité
optimale, réalisons l'expérience suivante.
Pour chaque espèce, dans le but d'obtenir 60, 70, 80,
100 et 120 mouches/cage mettons dans cinq cages, respectivement 45femelles,
53femelles, 60femelles, 75femelles et 90femelles/cage. Chaque traitement est
répété quatre fois et est alimenté au sang frais
six fois par semaine pendant dix minutes/repas sanguin. La mortalité
quotidienne est relevée. Au troisième jour d'age ces femelles
sont accouplées respectivement avec 15, 17, 20, 25 et 30 males de six
jours. La mortalité par traitement ainsi la production de pupes sont
ensuite déterminées.
39
CHAPITRE 3 RESULTAS ET DISCUSSIONS
40
3.1 Résultats.
3.1.1. Effet de l'alimentation sur les glossines.
3.1.1.1. Effet de l'alimentation (3/7jours, 4/7 jours
ou 5/7 jours) sur Glossina palpalis.
a). Mortalité.
Les mortalités des mouches alimentées aux
différentes fréquences en fonction du
temps sont plus ou moins identiques lors des 16 premiers jours
avec un niveau inférieur observé dans le lot de femelles
alimentées trois fois par semaine. Apres le seizième jour, on
note une augmentation rapide de la courbe représentative de la
mortalité cumulative des femelles alimentée au rythme de 3/7
jours matérialisant une augmentation importante de la mortalité.
Elle demeure ainsi jusqu'à la fin de l'expérience. Celles
observées dans les lots des mouches alimentées 4/7 jours et 5/7
jours sont presque identiques et restent légèrement
supérieures par rapport à la mortalité observée
chez les glossines alimentées 6/7 jours ( Fig.1) Des accouplements
isolés, quel que soit le type de traitement sont toujours observé
trois jours après la mise en commun des males et femelles.
100
40
20
90
70
60
50
30
80
10
0
3 16 26 64
mortalité comparée
temoin 5/7jrs 3/7jrs
4/7jrs
jours
FIGURE 7 : TAUX DE MORTALITE (%) DES FEMELLES DE
G. palpalis gambiensis AU
COURS DU TEST D'ALIMENTATION.
41
b). La production de pupes et
éclosion.
La première ponte larvaire est intervenue quatorze
jours après l'accouplement c'est-à-dire le dix-septième
jour de vie des femelles dans tous les lots avec cependant un nombre de pupes
plus élevé dans le lot de mouches alimentées 5 fois par
semaine.
L'analyse statistique par la régression binomiale
après une vérification de la loi de Poisson n'a montré
aucune différence significative (p> 5%) entre les productions des
mouches alimentées 3, 4 ou 5 fois par semaine (Tableau :2). Cependant,
les femelles alimentées trois fois par semaine ont une
productivité faible par rapport à celle des femelles nourries
quatre, cinq, et six fois par semaine. La production moyenne de pupes par
récolte pour huit récoltes était de:
- femelles alimentées trois fois par semaine 39,5
pupes/récolte;
- femelles nourries quatre fois par semaine 45,875
pupes/récolte;
- femelles nourries cinq fois par semaine 46,75
pupes/récolte (Tableau 3).
Les poids moyens des pupes des mouches alimentées 3/7
jours sont relativement bas. Il est de 23,74 #177; 0,865 mg contre 24,616 #177;
0,957 et 24,183 #177; 0,201 mg respectivement pour les pupes des mouches
alimentées quatre fois par semaines et cinq fois par semaine et 26,979
mg pour le témoin.
Le taux d'éclosion est de 90,286 #177; 1,318, 89,923
#177; 1,793, 88,787 #177; 2,315 et 93,175% respectivement chez les pupes des
femelles alimentées trois, quatre, cinq et six fois par semaine
(Tableau. 4).
TABLEAU 2 : RESUMER DE LA COMPARAISON DES DIFFERENTES
PRODUCTIONS DE PUPES A p = 5% ° AU COURS DU TEST
D'ALIMENTATION.
Test d'alimentation [intervalle de confiance : 95%]
|
3/7jours
|
4/7 jours
|
5/7 jours
|
|
3/7jours
|
|
0.670
|
0.632
|
|
4/7 jours
|
0.670
|
|
0.959
|
|
5/7 jours
|
0.632
|
0.959
|
|
42
TABLEAU 3 : NOMBRE MOYEN DE PUPES DE G. palpalis
gambiensis PAR RECOLTE AU COURS DU TEST D'ALIMENTATION.
|
traitements
|
Nombre de
récoltes
|
Moyenne/récolte
|
Déviation standard
|
Nombre
minimum/récolte
|
Nombre
maximum/récolte
|
|
3/4jrs
|
8
|
39.25
|
31,585
|
9
|
86
|
|
4/7jrs
|
8
|
45,875
|
35,244
|
10
|
109
|
|
5/7jrs
|
8
|
46,75
|
36,589
|
8
|
113
|
TABLEAU 4 : PARAMETRES DE PRODUCTIVITE DES FEMELLES DE
G. palpalis gambiensis AU COURS DU TEST D'ALIMENTATION.EN
(%)
|
Traitements
|
PMPFI
|
PMPFIJ
|
PM pupes
(mg)
|
Taux avor
tons (%)
|
Taux d'éclo sion (%)
|
|
3/7 jrs
|
1,75#177;0,01
|
0,037#177;0,002
|
23,74#177;0,87
|
0,76#177;0,31
|
90,29#177;1,31
|
|
4/7 jrs
|
2,10#177;0,35
|
0,044#177;0,007
|
24,62#177;0,95
|
0,56#177;0,38
|
89,92#177;1,79
|
|
5/7 jrs
|
2,12#177;0,20
|
0,044#177;0,004
|
24,18#177;0,20
|
0,55#177;0,87
|
88,79#177;2,31
|
|
témoin
|
2,27
|
0,047
|
26,98
|
0,88
|
93,18
|
PMPFI = Production Moyenne de Pupes par Femelle Initiale (NMP
X 100/PFI avec PMP = Production Moyenne de Pupes et NFI = Nombre de Femelles
Initiales)
PMPFIJ = Production Moyenne de Pupes par Femelle Initiale et par
Jour (PMPFI/nombre de jours de ponte) PM pupes = Poids Moyen des pupes. (Poids
total/nombre de pupes).
3.1.1.2. Effet de l'alimentation (3/7jours ou 4/7jours)
sur Glossina morsistans submorsitans.
a). mortalité
Au cours des seize premiers jours, on note une augmentation
rapide de la mortalité des
femelles témoins juste après l'accouplement.
Celles des femelles nourries trois ou quatre fois par semaine sont
restées inférieures à 10% avec cependant un taux
légèrement plus élevé dans le second lot. Du
seizième au vingt-sixième jour les taux de mortalités dans
ces cages continuaient de croître alors qu'elle est restée
stationnaire chez les témoins, Après la deuxième
larviposition c'est-à-dire le 26ème jour, les
mortalités dans les cages des mouches subissant la restriction
alimentaire sont marquées par une forte croissance et parviennent
même à dépasser celle des femelles témoins. Il
faudrait remarquer que tout au long de l'expérience la mortalité
dans les cages des glossines alimentées trois fois par semaine est
toujours restée inférieure à celle observée chez
les femelles nourries quatre fois par semaine (Fig.8).
70
mortalité G.morsitans
submorsitans (%)
60
50
40
30
20
10
0
temoin
4/7 jrs
3/7 jrs
43
FIGURE 8 EVOLUTION DES TAUX DE MORTTALITE DES
FEMELLES DE G. morsitans
submorsitans AU COURS DU TEST DE LA
FREQUENCE D'ALIMENTATION.
3 16 26 64 temps
- Production de pupes et éclosions,
Les premières larvipositions ont été
observées le dix-septième jour dans tous les traitements avec une
moyenne respectivement de 33 pupes et 28,5 pupes dans les cages femelles
alimentées trois fois par semaine et quatre fois par semaine. De
l'analyse statistique par la régression linéaire après une
transformation en racine carrée, il ne ressort aucune différence
significative entre les productions des femelles alimentées à ces
différentes fréquences (p> 5%) (Tableau.5). Néanmoins,
les femelles alimentées six fois par semaine ont une production
supérieure à celle des mouches subissant une alimentation 4 et 5
fois par semaine (Tableau 6). Les poids moyens sont de 30,06#177;1,82 mg, 30,09
#177; 0,95 mg et 30,26 #177; 1,29 mg
44
respectivement pour les pupes des femelles alimentées
3/7 jours, 4/7 jours et le témoin. Les PPFI sont de 0,061#177;0,01 ;
0,061#177;0,00 et 0,066 respectivement pour les femelles alimentées
trois fois ; quatre fois par semaine et témoin.
L'éclosion, en générale a
été tardive. Elle est survenue au trente-quatrième jour
après la première ponte larvaire dans les premières
répétitions et trente jours dans les dernières. Il
faudrait noter que les répétitions ont été
réalisées à des moments différents ; les
premières étant faites pendant les périodes
décembre -janvier et les secondes entre le 17 janvier et le 22 mars. Les
taux d'éclosions sont de 91,65#177;6.23, 95,20#177;2,80 et 97,076 pour
cent respectivement pour les femelles alimentées 3, 4 et 6 fois par
semaine.
TABLEAU : 5 COMPARAISON DES DIFFERENTES PRODUCTIONS DE
PUPES DES FEMELLES ALIMENTEES 3, 4 ET 6 jours/7 (TEMOIN) A p = 5%.
Fréquence d'alimentation [intervalle de
confiance:95%]
Sang Témoin 3/7 jours 4/7 jours
Témoin 0.401 0.657
3/7 jours 0.401 0.686
4/7 jours 0.657 0.686
On ne décèle aucune différence significative
(P> 0,05)
TABLEAU 6 : PARAMETRES DE PRODUCTIVITE DES FEMELLES DE
G. morsitans submorsitans AU COURS DU TEST D'ALIMENTATION.
|
traitements
|
PMPFI
|
PMPFIJ
|
Taux d'avortons Pm pupes (mg) taux d'éclosion
(%)
|
|
3/7j
|
2,93#177;0,50
|
0,061#177;0,01
|
1,24#177;0,08
|
30,06#177;1,82
|
91,65#177;6.23
|
|
4/7 jrs
|
2,926#177;0,07
|
0,061#177;0,00
|
2,17#177;0,35
|
30,09#177;0,95
|
95,20#177;2,80
|
|
témoin
|
3,146
|
0,066
|
0,978
|
30,26#177;1,29
|
97,076
|
PMPFI = Production Moyenne de Pupes par Femelle Initiale (NMP
X 100/PFI avec PMP = Production Moyenne de Pupes et NFI = Nombre de Femelles
Initiales)
PMPFIJ = Production Moyenne de Pupes par Femelle Initiale et par
Jour (PMPFI/nombre de jours de ponte) PM pupes = Poids Moyen des pupes. (Poids
total/nombre de pupes).
3.1.1.3. Effet de l'alimentation (4/7 jours ou 5 /7
jours) sur G. tachinoides. - Mortalité
Le septième jour de vie des glossines fut marqué
par une mortalité très importante dans une des
répétitions du lot de femelles nourries cinq fois la semaine
où on dénombrait 39,36% de l'ensemble des mortalités au
niveau de ce lot. Par conséquent, avant la première ponte
45
larvaire, l'effectif cumulatif de la mortalité en
pourcentage dans ce traitement restait plus élevé (43,16 % de la
mortalité totale du traitement) par rapport à celle
observée dans le lot subissant une restriction à quatre fois la
semaine. De la première ponte larvaire à la deuxième
larviposition, cette mortalité a légèrement
évoluée passant de 34 #177; 36,7 à 39,5 #177; 36%. Celle
observée dans le lot de femelles nourries 4 fois la semaine quant
à elle a nettement accrue allant de 17,33 #177; 9,42 % à 35,833
#177; 15,79%. A la fin de l'expérience, on marquait une nette
supériorité de la mortalité des femelles alimentées
quatre fois la semaine (78,33 #177; 10,84%) par rapport à celle des
femelles soumises à la restriction alimentaire à 5 fois la
semaine (69,5#177;34,65). Chez les femelles témoins, la mortalité
est restée toujours basse durant toute la durée des observations
(9,33% à la première larviposition, 36,67% en fin
d'expérience) (Fig.9).
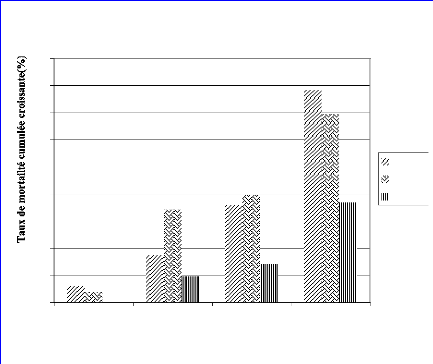
40
90
70
20
60
50
30
80
10
0
3 16 26 64
mortalité de G.
tachinoides
jours
4/7jrs
5/7jrs
temoin
FIGURE 9 : EVOLUTION DE LA MORTALITE CUMULEE DES
FEMELLES DE G.
tachinoides AU COURS DU TEST DE RESTRICTION
ALIMENTAIRE A 4 ET 5 JOURS /7.
46
- Production de pupes et éclosion.
La première ponte larvaire est intervenue le dix
huitième jour de vie des femelles soit quinze jour après
accouplement dans tous les lots avec cependant un nombre de pupes plus
élevée pour les femelles 4/7 jours (19 pupes) que les femelles
5/7 jours (13 pupes). Les poids moyens sont relativement sont de
18,79#177;1,49, 16,511#177;1,04 et 16,604#177; 0,640 mg respectivement pour les
pupes des femelles nourries quatre fois la semaine, cinq fois la semaine et
témoin. Il faudrait cependant noter que ces poids concernent ceux des
pupes produites les premiers jours de ponte pour le témoin et les
femelles nourries quatre fois la semaine et une moyenne des poids des pupes
produites pour les femelles alimentées 5 fois la semaine. La PPFIJ est
faible en générale. Elle est de 0,044#177;0,004 ; 0,029#177;0,005
et 0,031pupes/femelle/jour respectivement pour les femelles alimentées
4, 5 et 6 fois par semaine (Tableau 7).
Les premières émergences des mouches furent
constatées le 28è jour après la première
larviposition dans tous les lots. Les taux d'éclosions sont de tournent
autour de 93,61#177;3,75 ; 95,10#177;1,23 ; et 91,93 respectivement pour les
pupes des femelles alimentées 4, 5 et 6 fois par semaine.(Tableau 7)
TABLEAU 7 :PARAMETRES DE PRODUCTIVITE DES FEMELLES DE
G. tachinoides AU COURS DU TEST D'ALIMENTATION.
|
traitement
|
PMPFI
|
PMPFIJ
|
PM pupes
|
taux d'avortons
|
taux d'éclosion
|
|
4/7j
|
2,11#177;0,20
|
0,044#177;0,004
|
18,789#177;1,49
|
1,058#177;1,02
|
93,61#177;3,75
|
|
5/7j
|
1,42#177;0,22
|
0,029#177;0,005
|
16,511#177;1,04
|
1.114#177;0,67
|
95,10#177;1,23
|
|
témoin
|
1,49
|
0,031
|
16,604#177;0,64
|
1,35
|
91,93
|
PMPFI = Production Moyenne de Pupes par Femelle Initiale (NMP
X 100/PFI avec PMP = Production Moyenne de Pupes et NFI = Nombre de Femelles
Initiales)
PMPFIJ = Production Moyenne de Pupes par Femelle Initiale et par
Jour (PMPFI/nombre de jours de ponte) PM pupes = Poids Moyen des pupes. (Poids
total/nombre de pupes).
3.1.2. Utilisation du sang congelé dans
l'alimentation artificielle des mouches tsé-tsé.
Le sixième jour d'age des mâles, lors de la mise
en accouplement, les mâles du lot1 mettaient un temps avant de s'envoler
vers les femelles alors que la réaction était prompte pour ceux
des deux autres lots. Cependant quelque soit le lot des accouplements
isolés étaient
47
observé trois jours après la mise en commun des
mâles et femelles.
- Mortalité.
Les mâles du au sang congelé sans ATP et glucose
accusent une forte mortalité du début jusqu'au
30ème jour de l'expérience. Cette mortalité
atteint 14,85 #177; 3,34% le 6ème jour c'est-à-dire
avant même la mise en commun des mâles et femelles. Celle
observée chez les mâles alimentés au sang avec ATP et
glucose ainsi que témoin sont demeurés faibles pendant ces 30
jours. Les mâles du sang congelé avec ATP et glucose ont une
longévité supérieure à celle de témoin si
bien qu'au 30ème jour il restait 34,54% contre 29,09% de
mâles respectivement dans ces deux lots (Fig.10). Les courbes
représentatives des taux de mortalité cumulées des
femelles sont restées presque confondues au cours des 64 jours
d'observation. Remarquons cependant une forte croissance de celles-ci à
partir du vingtième jour mais plus marquée dans le lot de
femelles nourries au sang congelé sans ATP et glucose
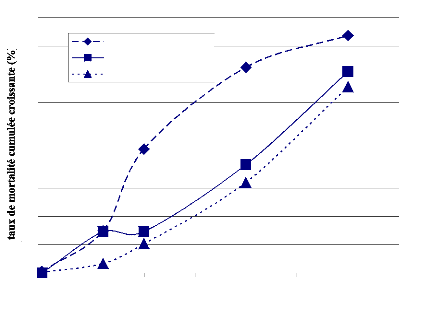
40
20
90
70
60
30
80
50
10
0
0 5 10 15 20 25 30 35
sang cgl ATP-GLU-
temoin
Sang cong ATP+; Glu+
jours
FIGURE 10: EVOLUTION DES TAUX DE MORTALITE
CUMULATIVE DES MALES (%)
AU COURS DES 30ers JOURS DU TEST AU SANG
CONGELE
Sang congelé sans ATP et glucose (sang cgl é ATP-,
glu-) ; Sang congélé plus ATP et glucose (sang conglé
ATP+, glu+)
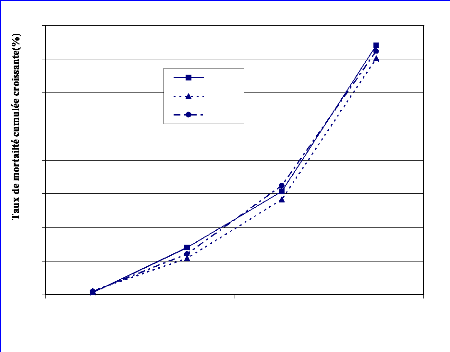
40
20
70
60
30
80
50
10
0
3 16 26 64
jours
temoin
ATP+
ATP-
48
FIGURE 11 : EVOLUTION DES TAUX DE MORTALITE
CUMULATIVE (%) DES
FEMELLES AU COURS DU TEST AU SANG CONGELE.
- La larviposition.
Les premières pontes larvaires sont intervenues le
seizième jour dans tous les lots avec cependant un retard de 8 heures
dans le lot témoin. En effet, au seizième jour d'âge des
glossines soit treize jours après l'accouplement, à 8H des pupes
étaient observées dans un sixième (1/6) des pondoirs
individuels de chaque traitement excepté celui du lot témoin. A
18h des pupes étaient observées dans tous les lots avec une
moyenne de 11,14 ; 10 et 10 pupes respectivement dans les lots 1, 2 et
témoin. Des pontes étaient régulièrement
observées avec un maximum tous les 9 à 10 jours.
- Production de pupes et éclosion.
Les PPFIJ sont de 0,047#177;0,008, 0,064#177;0,005 et 0,047
respectivement pour les lots de femelles nourries au sang congelé sans
ATP et glucose, avec ATP et glucose et témoin. Les
49
productions de pupes par femelle reproductive et par jour sont
0,05, 0,07 et 0,05 respectivement pour les femelles de ces différents
lots (Tableau.8). L'analyse statistique par la régression
négative binomiale après une vérification de la loi de
Poisson n'a décelé aucune différence significative entre
ces productions (p>0,05) (Tableau 9). La production moyenne de pupes par
récolte est respectivement de 22,8, 32,7 et 24,07 avec les sangs 1, 2 et
témoin respectivement pour 15, 14 et 14 récoltes (Tableau.10).
Les poids moyens des pupes en générale sont de
24,34#177;1,03 ; 24,86 #177; 1,34 et 26,98 mg respectivement pour les lots 1,2
et témoin. Le taux d'avortons est plus élevé chez les
femelles nourries au sang congelé dans lequel aucun produit n'a
été ajouté.
L'éclosion est intervenue le trentième jour dans
les lots 1 et 2. En effet, au trentième jour de la ponte larvaire, une
femelle a émergée des pupes des deux lots alimentés au
sang sans ATP et glucose et avec ATP et glucose. La seconde éclosion
effective n'est intervenue que quatre jours pus tard dans chacun de ces lots.
Les taux d'éclosion sont de : lot 1 : 91,61 #177; 3,12% ; lot 2 : 89,3
#177; 5,21% ; lot témoin 93,18% (Tableau 11). Après avoir
écrasé les pupes non écloses on note dans certaines des
mouches mortes et rien dans d'autres.
TABLEAU 8 : PRODUCTIVITE PAR FEMELLE REPRODUCTIVE AU
COURS DU TEST AU SANG CONGELE.
|
Traitements
|
Sang 1
|
Sang 2
|
Sang 0
|
|
NMFA
|
149
|
148
|
149
|
|
PMP
|
341,33
|
459,00
|
340,00
|
|
PFR
|
2,30
|
3,10
|
2,28
|
|
PFRJ
|
0,05
|
0,06
|
0,05
|
PFRJ Productivité par Femelle Reproductive par Jour.
PFR : Productivité par Femelle Reproductive =PMP/NFL.
NMFA : Nombre moyen de Femelles restantes au moment de la
première Larviposition.
TABLEAU 9 : RESUME DE L'ANALYSE COMPARATIVE DES
PRODUCTIONS DE PUPES DES DIFFERENTS TRAITEMENTS A P = 5%
Sang
Sang Sang 0 Sang 1 Sang 2
Sang 0 0,896 0,465
Sang 1 0,896 0,382
Sang 2 0,465 0,382
On ne décèle aucune différence significative
(P> 0,05)
50
TABLEAU 10 : PRODUCTION MOYENNE DE PUPES PAR RECOLTE ET
PAR TRAITEMENT.
Sang
Sang 0 (n = 14) Sang 1(n = 15) Sang 2 (n = 14)
Moyenne [IC 95%] 24,07 [9,83 - 38,30] 22,8 [9,64 - 35,95] 32,71
[10,21 - 55,21]
Sang 0 : sang frais + glucose + ATP (sang témoin)
Sang 1 : sang congelé sans glucose et ATP ;
Sang 2 : sang congelé + glucose + ATP.
IC : Intervalle de Confiance.
n = nombre de récolte.
TABLEAU 11 : PARAMETRES DE PRODUCTIVITE DES FEMELLES AU
COURS DU TEST AU SANG CONGELE
|
1
2
|
PMP
|
PPFI
|
PMA
|
TAUX
AVORTONS
|
PM PUPES
(MG)
|
TAUX
D'ECLOSION
|
|
Sang 0
|
341,33#177;57
|
2,28#177;0,38
|
5,83#177;2,99
|
1,712#177;0,89
|
24,34#177;1,03
|
91,61#177;3,12
|
|
Sg 1
|
459#177;36,66
|
3,07#177;0,25
|
4,33#177;3,14
|
0,963#177;0,71
|
24,87#177;1,34
|
89,3#177;5,21
|
|
Sg 2
|
340
|
2,27
|
3
|
0,88
|
26,98
|
93,18
|
PMP : Production Moyenne de Pupes (PMP = Nombre de pupes par
traitement/nombre de répétitions); PMA : Production Moyenne
d'Avortons ; PPFI : Production de Pupes par Femelle Initiale (PPFI= PMP/NMFI
avec NMFI : Nombre Moyen de Femelles Initiales) ; Poids Moyen des pupes (PM
pupes (mg)).
3.1.3. Importance de l'ATP dans l'alimentation des
mouches tsé-tsé.
3.1.3.1. Quantité de sang absorbé
.
La quantité de sang absorbé est relativement
faible le jour de l'éclosion des mouches. Elle est en moyenne de
3,56#177;4,22, 6#177;1,53 et 2,67#177;3,88mg respectivement pour le Sg1, Sg2 et
Sg5. Cette quantité augmente significativement lorsque le nombre de
jours de diète augmente. Elle atteint un maximum de 33,00#177;4,36 et
44,44#177;31,01 respectivement avec le sang Sg3 et Sg5 après une
diète de 48 heures. Cependant elle a été faible avec le
sang Sg1, Sg2 et Sg4 après une diète de 48 heures (fig. : 12).
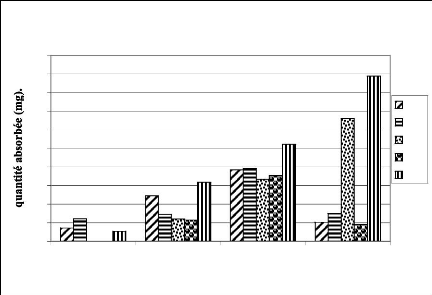
45
40
35
30
25
20
50
15
10
0
5
A1 A2 A3 A4
Quantité de sang absorbé par
alimentation
jour de diete
Sg1
Sg2
Sg3
Sg4
Sg5
51
FIGURE 12 : QUANTITE DE SANG ABSORBE PAR FEMELLE.
A1 : quantité absorbée le jour de l'éclosion
; A2 : quantité absorbée lorsque la mouche est successivement
alimentée d'un jour à l'autre ; A3 :
quantité absorbée après une diète de 24 heures ; A4
: quantité absorbée après une diète de 48
heures.
3.1.3.2. Mortalité des femelles.
Au cours des seize premiers jours de vie des glossines, les
femelles du lot alimenté au sang Sg1 ont été
marquées par une forte mortalité par rapport à celles du
lot du sang Sg2. En générale, toutes les femelles ont
été sévèrement affectées entre le
17ème (samedi) et le 18eme (dimanche) jour avec
une incidence plus marquée dans le lot de mouches alimentées au
sang Sg2. En effet, entre le 17 et 18e jour on a recensé
41,69#177;9,86 de la mortalité dans le lot 2. Il faudrait noter que les
mouches avaient été nourries à un sang de cinq jours et
qu'aucune femelle morte ne portait du sang dans son abdomen. Dans les lots de
femelles nourries aux sangs Sg1 et Sg3 les mortalités sont
restées presque identiques jusqu'au 26è jour à partir
duquel elles se sont dissociées. La mortalité est demeurée
faible dans le lot de mouches nourries au sang de porcs durant toute la
durée de l'expérience (Fig. 13).
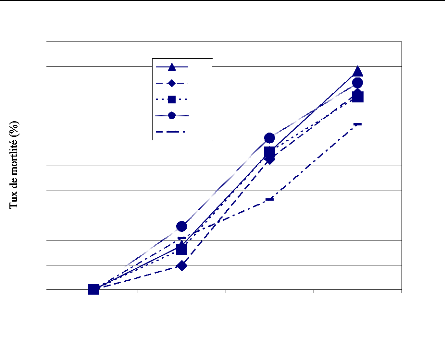
100
40
20
90
70
60
30
80
50
10
0
3 16 26 48
sg1
sg 2
sg 3
sg 4
SP
jours
52
FIGURE 13 : EVOLUTION DES TAUX DE MORTALITES DES
FEMELLES NOURRIES
AUX SANGS DE BOVINS : Sg 1, Sg 2, Sg 3, Sg 4 ET DE
PORC (Sp). 3.1.3.3. Gain moyen de poids par type de sang.
Le gain moyen de poids varie d'une mouche à l'autre et
d'un type donné de sang à l'autre. Il est plus
élevé chez les mouches alimentées au sang sans ATP et
glucose (3,64#177;1,53 mg/jour) que chez les femelles alimentées aux
autres types de sang (fig.14). Cependant, ce gain évolue dans le
même sens que le poids des femelles à la naissance (tableau 12)
Gain moyen de poids
|
4 4 3 3 2
2 1 1 0
|
|
Sg1
Sg2
Sg3
Sg4
Sg5
|
53
Sg1 Sg2 Sg3 Sg4 Sg5
types de sang
FIGURE 14 : GAIN MOYEN DE POIDS PAR FEMELLE ET PAR
SANG. TABLEAU 12 : POIDS (mg) DES FEMELLES A LA NAISSANCE (G. palpalis
gambiensis)
|
Répeti tions.
Sangs.
|
Rep1
|
Rep2
|
Rep3
|
Rep4
|
Moyenne
|
Poids moyen général
|
|
Sg1
|
15,67
|
16,00
|
15,33
|
15,00
|
15,50 #177; 0,43
|
16,23 #177; 1,47
|
|
Sg2
|
19,33
|
15,33
|
16,00
|
16,00
|
16,67 #177; 1,81
|
|
Sg3
|
16,67
|
18,33
|
14,67
|
18,33
|
17,00#177;1,74
|
|
Sg4
|
18,00
|
14,33
|
19,33
|
17,67
|
17,33 #177; 2,13
|
|
Sg5
|
14,33
|
13,33
|
16,33
|
14,67
|
14,67 #177; 1,25
|
3.1.3.4. Production de pupes et éclosion.
La première production des pupes est intervenue le
17è jour dans les lots Sg1et Sg2. Elle a été tardive dans
les autres lots. En effet, dans les lots de mouches alimentées aux sangs
Sg3, Sg4 et Sg5, la ponte larvaire a été observée au
20è jour de vie des femelles. La production de pupes des femelles du
sang Sg1 est faible par rapport à celle des autres. Les poids moyens
54
sont compris entre 23 et 25 mg (Tableau 13)
L'éclosion quant à elle est survenue autour du
30ème jour dans tous les lots. Le taux moyen d'éclosion est de
89% dans le lot de femelles alimentées au sang dans lequel l'ATP a
été ajouté avant l'irradiation et plus élevé
(94%) pour les pupes des glossines nourries au sang congelé de porcs
(Tableau 13).
TABLEAU 13 : PARAMETRES DE PRODUCTIVITE DES FEMELLES PAR
TYPE DE SANG.
|
P
T
|
PMP
|
PMP (MG)
|
PMA
|
TAUX D'AVOR TONS (%)
|
TAUX D'ECLO SION (%)
|
|
Sg1
|
37,00#177;7,81
|
23,28#177;0,45
|
4,00#177;1,00
|
10,81#177;5,59
|
89,19#177;1,34
|
|
Sg1
|
37,00#177;7,81
|
23,28#177;0,45
|
4,00#177;1,00
|
10,81#177;5,59
|
89,19#177;1,34
|
|
Sg3
|
54,67#177;26,35
|
23,64#177;0,18
|
1,67#177;1,53
|
3,05#177;4,71
|
91,52#177;4,63
|
|
Sg4
|
58,50#177;16,26
|
25,21#177;2,57
|
4,00#177;1,41
|
6,84#177;0,54
|
93,25#177;5,50
|
|
Sg5
|
84,33#177;11,59
|
23,32#177;0,16
|
2,00#177;1,00
|
2,37#177;1,25
|
94,84#177;0,46
|
PMP : Production Moyenne de Pupes (PMP = Nombre de pupes par
traitement/nombre de répétitions); PMA : Production Moyenne
d'Avortons.
P : Paramètres de productivité et T :
traitements.
3.1.4. Densité optimale.
- Mortalités.
Chez de Glossina palpalis gambiensis, plus la
densité de femelles par cage est élevée plus la
mortalité croît. En effet, tout au long de l'expérience,
les mortalités observées dans les cages à 45, 50, 60 et 75
femelles croissent en fonction du temps tout en restant inférieures
à celle du témoin Dans le traitement à 90 femelles par
cage, elle croît fortement avant même l'accouplement et se
maintient jusqu'à la fin de l'expérience de telle sorte que nous
dénombrons 100% de mortalité dans une des
répétitions. La figure15 illustre la mortalité en fonction
du temps et par densité.
Au niveau des G. morsitans submorsitans, on note une
forte mortalité dans les cages à 60 femelles alors qu'elle est
moindre au niveau des cages à 75 jusqu'à la deuxième ponte
larvaire. Après la deuxième larviposition, la mortalité
dans les cages à 75 femelles augmente et devient supérieure
à celle observée dans les autres traitements (Fig.16). Il
faudrait noter que
55
la mortalité des femelles témoins est
restée faible durant toute l'expérience. Pour des raisons de
forte mortalité constatée dans un premier témoin qui avait
été réalisé à la même période
(16 Novembre au 18 janvier) que les lots expérimentaux, un second a
été réalisé entre le 16 février au 20
avril.
Quant à la mortalité chez les Glossina
tachinoides, une des répétitions des cages à 60
femelles a été fortement affectée et ceci depuis le
début des observations. La figure 17 illustre le taux de
mortalité des mâles et femelles en fonction de la densité.
Elle a demeuré forte dans les cages à 60 femelles durant tout le
suivie.
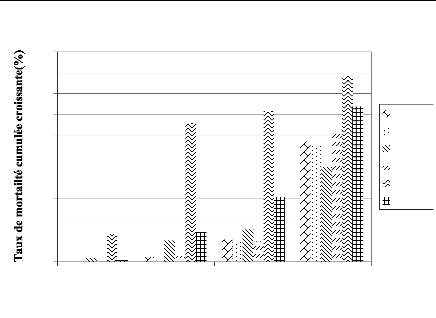
100
40
90
70
20
60
50
30
80
10
0
3 16 26 64
Evolution des taux de
mortalité
jours
d 1
d 2
d 3
d 4
d 5
Temoin
FIGURE 15 : EVOLUTION DES TAUX DE MORTALITE DES
FEMELLES (%) DE Glossina
palpalis gambiensis AU COURS DU
TEST DE DETERMINATION DE LA DENSITE
OPTIMALE.
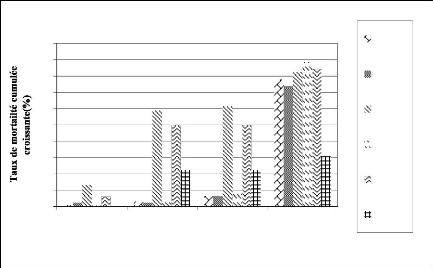
100
40
20
90
70
60
30
80
50
10
0
3 16 26 64
Evolution de la mortalité
temps(jours)
d1
d2
d3
d4
d5
Temoin
56
FIGURE 16 : EVOLUTION DES TAUX DE MORTALITE DES
FEMELLES (%) DE Glossina
m submorsitans AU COURS DU TEST DE
DETERMINATION DE LA DENSITE OPTIMALE.
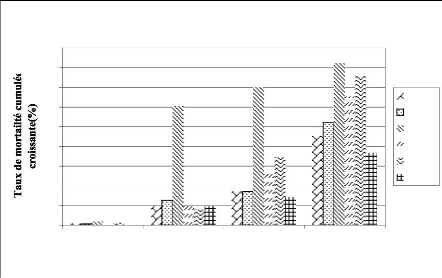
40
20
90
70
60
30
80
50
10
0
3 16 26 64
Evolution des taux de
mortalité
jours
d 1
d 2
d 3
d 4
d 5
temoin
FIGURE 17 : EVOLUTION DES TAUX DE MORTALITE DES
FEMELLES (%) DE Glossina
tachinoides AU COURS DU TEST DE
DETERMINATION DE LA DENSITE OPTIMALE
57
- La production de pupes et
éclosion.
En générale, les premières pontes sont
intervenues le 17ème et le 18ème jour
respectivement chez Glossina palpalis, G. tachinoides et G. morsitans
submorsitans.
Chez Glossina palpalis, la productivité des
femelles sont presque similaires dans les cages à 45 femelles, 53
femelles, 60 femelles et témoin. Elle est très faible dans les
cages à densité très élevée (Tableau 14).
Chez G. m. submorsitans, elle est très faible
dans les cages à 60 femelles sévèrement affectées
par la mortalité. Elle augmente pourtant chez les femelles des cages
à 75 et est considérablement faible dans les cages à
90.
Chez G. tachinoides la productivité est faible
dans la majeure partie des traitements. Les femelles des cages à 75
femelles ont une productivité de 0,058 pupes/femelle/jour. Celles
recensées dans les autres traitements sont de 0,046 #177; 0,01, 0,046
#177; 0,02 et 0,031 pupes/femelle respectivement pour les femelles des cages
à 45 ; 53 et témoin.
Les poids moyens sont supérieurs à 24 mg quelque
soit la densité chez G. palpalis gambiensis. Chez G.
morsitans, il est fable au niveau des pupes des femelles dans les cages de
densité élevée (Tableau 15). Il en est de même chez
Glossina tachinoides chez qui on récence un poids de 15,98 mg
pour les pupes des femelles de forte densité (Tableau.16).
Le taux d'avortons est également plus
élevé au niveau des cages de forte densité (90 femelles
par cage) quelque soit le type d'espèce.
La première émergence des mouches a
été tardive dans tous les traitements quelque soit
l'espèce. Elle est intervenue 33 jours après la ponte
larvaire.
TABLEAU 14 : PARAMETRES DE PRODUCTIVITES DES FEMELLES PAR
DENSITE (Glossina palpalis gambiensis).
|
P
N
|
PPFI
|
PPFIJ
|
PM PUPES
(MG)
|
TAUX
D'AVOR
TONS (%)
|
TAUX
D'ECLO
SION (%)
|
|
45?
|
3,71#177;0,67
|
0,08#177;0,01
|
27,78#177;1,88
|
1,79#177;1,36
|
91,72#177;2,85
|
|
53?
|
4,06#177;0,82
|
0,08#177;0,02
|
26,72#177;1,62
|
2,15#177;0,73
|
93,48#177;2,10
|
|
60?
|
3,27#177;0,14
|
0,07#177;0,00
|
25,32#177;1,20
|
2,28#177;0,56
|
94,26#177;3,03
|
|
75?
|
2,34#177;0,78
|
0,05#177;0,02
|
25,38#177;3,67
|
2,23#177;0,53
|
95,69#177;1,55
|
|
90?
|
0,91#177;1,3
|
0,02#177;0,03
|
26,63#177;1,59
|
4,35#177;5,60
|
78,99#177;20,1
|
|
témoin
|
2,27
|
0,047
|
26,98
|
0,88
|
93,18
|
P : paramètres de productivité ; N : nombre de
femelles/cage.
58
TABLEAU 15 : PARAMETRES DE PRODUCTIVITES DES FEMELLES PAR
DENSITE (G. m. submorsitans).
|
P
N
|
PPFI
|
PPFIJ
|
PM PUPES
(MG)
|
TAUX
D'AVOR
TONS (%)
|
TAUX
D'ECLO
SION (%)
|
|
45?
|
3,14#177;0,71
|
0,07#177;0,02
|
29,71#177;2,6
|
1,24#177;0,60
|
90,98#177;2,30
|
|
53?
|
3.46#177;0.88
|
0,07#177;0,02
|
31.15#177;1,74
|
2,29#177;2,10
|
90,28#177;4,08
|
|
60?
|
1.13#177;0,98
|
0,02#177;0,02
|
32,70#177;1,50
|
0,16#177;0,33
|
76,71#177;21.14
|
|
75?
|
2,49#177;0,34
|
0,05#177;0,01
|
29,50#177;4,60
|
1,71#177;1,36
|
93,43#177;2,83
|
|
90?
|
1,54#177;1,87
|
0,03#177;0,04
|
28,11#177;1,30
|
2,69#177;3,26
|
90,74#177;1,04
|
|
témoin
|
3,15
|
0,066
|
30,26
|
0,98
|
97,08
|
TABLEAU 16 : PARAMETRES DE PRODUCTIVITES PAR FEMELLE ET
PAR DENSITE (G. tachinoides).
|
P
N
|
PPFI
|
PPFIJ
|
PM PUPES
(MG)
|
TAUX
D'AVOR
TONS (%)
|
TAUX
D'ECLO-
SION (%)
|
|
45?
|
2,23#177;0,69
|
0,046#177;0,01
|
16,72#177;1,34
|
1,99#177;0,79
|
92,50#177;5,64
|
|
53?
|
2,20#177;1,03
|
0,046#177;0,02
|
17,52#177;0,77
|
1.19#177;1,05
|
88,72#177;4,98
|
|
60?
|
0,86#177;0,71
|
0,026#177;0,01
|
0,86#177;0,71
|
0,56#177;0,79
|
95,68#177;3,54
|
|
75?
|
2,76
|
0,058
|
17,73
|
0,48
|
92,23
|
|
90?
|
1,66
|
0,034
|
15,98
|
1,34
|
83,89
|
|
témoin
|
1,487
|
0,031
|
16,60#177;0,6
|
1,35
|
91,93
|
3.2. DISCUSSION.
3.2.1. Effet de l'alimentation sur les glossines.
3.2.1.1. Effet sur G. palpalis gambiensis.
Il n'y a pas de différence significative entre les
productions de pupes des femelles alimentées
3, 4, 5 et 6 fois par semaine au seuil de 5 pour cent. Cependant,
comparativement à la production des lots de femelles nourries 4, 5 et 6
fois par semaine, celles qui sont alimentées 3 fois par semaine se
caractérisent par :
- une faible productivité (0,037 #177; 0,002
pupes/femelle/jour) ;
- un poids de pupes faible : 23.74 #177; 0.86 mg.
La qualité de pupes produites indique que l'alimentation
des femelles et le transfert de nutriments de la mère à la larve
en développement « in utero » sont normaux ou anormaux
59
(Opiyo et al, 2000 ; Kam, 2003). Selon la FAO/AIEA cité
par Kam (2003), la mauvaise qualité des pupes mesurées à
travers leur faible poids indiquerait que l'alimentation et les conditions
d'élevage sont inadéquates. Cependant, compte tenu du fait que
toutes les femelles étaient placées dans les mêmes
conditions optimum de température (25 #177; 1°c) et
d'humidité (75%), seule la quantité ingérée de sang
pourrait expliquer cette faible productivité. L'intervalle entre les
repas sanguins est en moyenne de 3 à 5 jours selon les espèces
(Itard, 2000). Selon lui, chez G. palpalis gambiensis, le cycle de
faim est en moyenne de 3 jours. Mais malgré bien que ce cycle soit de 72
heures, l'irrégularité des repas, même si elle n'affecte
pas considérablement la mortalité, aurait un effet sur la
productivité des femelles. Linen (L.G-V.D) (1981) en étudiant
l'effet de l'alimentation 4/7 jours sur la productivité de G.
pallidipes, a constaté qu'une alimentation
irrégulière se traduit par une augmentation de la période
inter- larvaire, une productivité irrégulière de pupes et
une chute de leur poids.
La similarité entre les productivités des
femelles de même que les poids moyens des pupes produites, indiqueraient
que ce n'est pas le nombre de repas par semaine mais la quantité de sang
absorbée qui déterminerait les performances des femelles. En
effet, au cours du test de détermination de la quantité de sang
absorbée par femelles, les glossines alimentées
régulièrement pouvaient prendre une quantité maximale de
15,82 #177; 11.17 mg. Apres 24 heures de diète, elles absorbaient au
maximum 26,13 #177; 15.5 mg et 44,44 #177; 31,01 mg après une
interruption de 48 heures.
Les taux d'éclosion des pupes produites par les
femelles des différents lots expérimentaux et témoins ne
présentent pas de différences notables. Le type d'alimentation
n'influerait donc pas sur les taux d'éclosion mais plutôt sur la
quantité de pupes produites. Les travaux de Kaboré et Bauer
(1984) sur l'utilisation du sang lyophilisé dans l'alimentation des
glossines confirme cette observation ; en effet, ils ont obtenu un taux
d'éclosion supérieur à 93% quelque soit le lot mais la
longévité des femelles avait été durement
affectée.
3.2.1.2. Effet de sur G. morsitans submorsitans.
Il n'y a pas de différences significatives entre les
productivités des femelles alimentées 3, 4 et 6 fois par semaine.
Il en est de même pour les poids des pupes. Ces résultats
confirment les travaux de Kam (2003) sur l'effet de l'alimentation 3/7 sur
G. morsitans submorsitans. Il était arrivé à la
conclusion qu'il n'y a pas de différences significatives entre
60
les productions des femelles de G. morsitans submorsitans
alimentées 3 fois par semaine et 6 fois par semaine et que cette
espèce tolérait l'alimentation 3/7 jours. Cela s'expliquerait par
le fait que G. morsitans submorsitans est une espèce de taille
moyenne et aurait un jabot qui lui permet d'absorber une quantité
importante de sang pour une diète de 24 à 48 heures. En outre,
G. morsitans submorsitans a un cycle de faim plus long que ceux des
deux autres espèces. Cette durée est de 4 jours, pouvant
même aller jusqu'à 8 à 10 jours en saison humide (Itard,
2000). Cela aurait un lien avec la taille de son jabot. Selon Itard (2000),
lorsqu'elle est affamée, G. morsitans submorsitans mâle
peut absorber 37,3 mg et la femelle 62,3 mg de sang par repas.
3.2.1.3 Effet sur G. tachinoides.
Glossina tachinoides a un optimum de
productivité de 0,06 pupes par femelle et par jour (Kyendrebeogo, 1981).
Mais seules les femelles nourries 4/7 jours se rapprochent plus de cet optimum.
La faiblesse de la production des femelles alimentées 5/7 jours
s'expliquerait par une mortalité importante enregistrée avant
même la première larviposition dans certaines
répétitions. Ceci est vérifié par l'écart
type à la première ponte larvaire très élevé
(36,8%). La mortalité fulgurante des femelles dans ce lot, pourrait
être causée par une contamination bactérienne du sang. Il
est très difficile d'avoir du sang frais indemne de toute contamination
car l'animal lui-même en représente une source. Et le sang peut
être souillé par :
- les couteaux de saignée ; - la peau de l'animal ; - les
palettes de défibrination ; - le matériel de collecte.
Malgré les précautions prises notamment
l'irradiation du sang, l'analyse bactériologique et la conservation au
froid à 4°c, une asepsie totale est très difficile. Certes,
l'irradiation réduit le développement des trypanosomes mais elle
ne permet pas de tuer les bactéries. L'analyse bactériologique a
ses limites car elle ne permet que la quantification des bactéries sans
pour autant déterminer leur pouvoir pathogène. Le sang est retenu
pour l'alimentation des glossines lorsque le nombre de colonies est
inférieur à 13. La présence d'un seul agent
pathogène peut causer des dommages au sein des mouches qui s'en sont
gorgées. L'alimentation artificielle des glossines requiert donc une
utilisation de sang indemne de toute contamination. C'est ce
61
qui motive l'AIEA sur la recherche sur l'utilisation de la
congélation dans l'élevage des glossines.
Les poids moyens des pupes, indicateurs d'une bonne
alimentation sont supérieurs à 16 mg, ce qui est
considéré comme optimum chez G. tachinoides.
Au regard des différents résultats
enregistrés, on peut dire que, bien que l'alimentation 3 /7 jours
réduise les coûts de production, il ne contribue pas à une
production de masse des glossines. G. morsitans submorsistans à
cause de sa capacité à tolérer la faim peut être
alimenté 3 fois par semaine ; les autres espèces quant à
elles ne le seront que 4 fois la semaine. L'alimentation sera faite de la
façon suivante :
- une alimentation régulière pendant 10 minutes
par repas au cours des quatre premiers jours de vie des glossines ;
- après le 4ème jour, une trêve
d'une journée sera observée ; les glossines seront
alimentées pendant 15 minutes non pas pour les permettre de prendre une
quantité considérable de sang mais pour qu'elles puissent se
gorger au maximum .
Une alimentation 3/7 jours G. morsitans submorsistans
et 4/7 jours G. palpalis gambiensis et G. tachinoides
contribuera à réduire considérablement les temps
consacrés par mouche.
3.2.2. Utilisation du sang congelé dans
l'alimentation des glossines.
Les glossines sont des mouches strictement
hématophages. La réussite de leur élevage est fortement
conditionnée par la qualité de sang qui leur est offert.
Plusieurs expériences ont donc été réalisées
en vue de leur trouver un sang de qualité indemne de toute contamination
bactérienne. Des essais de New et al (1976) avec du sang
lyophilisé ont donné de mauvais résultats (Bauer et
Kaboré, 1984). Selon ces mêmes auteurs, ceux
réalisés à Vienne par l'AIEA ont donné de bons
résultats. De nos jours, L'AIEA travaille pour un certain nombre de
décontaminations du sang destiné à l'alimentation des
mouches dont la congélation.
Le sang congelé est gardé à l'AIEA
à -20°c. Ce sang utilisé pour l'alimentation des glossines
n'a pas permis la production de glossines de bonne performance (Itard, 1984).
Notre expérience entreprise au CIRDES avec du sang congelé a
quant à elle donné de bons résultats. En effet, pour une
productivité satisfaisante, l'élevage des glossines doit
répondre aux critères suivants:
- Mortalité journalière < 2%;
62
- Taux d'éclosion > 85%;
- Nombre de pupes en 30 jours > 1.8/femelle (Itard,
1984).
L'expérience réalisée au CIRDES a
donné en 30 jours les résultats suivants:
- une mortalité journalière de 1,13 #177; 0,18 ,
1,10 #177; 0,05 et 1,16% respectivement pour les femelles nourries au sang sans
ajout d'ATP et glucose, le sang avec ATP et glucose et témoin ;
- une productivité de pupes par femelle de 1.51 #177;
0.19, 1.98 #177; 0.12 et 1.51 respectivement pour les femelles
alimentées au sang sans ATP et glucose, avec ATP et glucose et
témoin.
- Un taux d'éclosion supérieur à 85%.
Ces bons critères de productivité sont le signe
d'une bonne qualité du sang congelé. Cette qualité
pourrait s'expliquer par l'effet de la congélation sur les
micro-organismes pathogènes du sang.
L'abattoir n'étant pas un lieu stérile, le sang
qui y est récolté souffre d'une certaine contamination
bactérienne émanant non seulement des différentes
manipulations mais aussi du matériel de collecte et de l'animal
lui-même. Malgré les précautions prises pour le maintien de
la qualité du sang notamment, l'irradiation et la conservation à
-4°c, le sang frais ne peut pas être utilisé au-delà
d'une semaine pour des raisons de forte mortalité au sein des mouches.
Cette mortalité serait due à une pullulation des germes
pathogènes dans le sang.
Cependant, en dépit de la conservation du sang par la
congélation, certaines mouches mortes avaient un abdomen noir. Cette
mortalité pourrait s'expliquer par une atteinte de la qualité du
sang. Ces observations font croire que la congélation ne tuerait pas les
bactéries mais inhiberait le processus de leur développement.
Après une décongélation, lorsque la température
leur est favorable, elles reprennent leur activité normale causant donc
la mort des mouches. Cette hypothèse trouve sa justification dans
l'assertion de Itard, 1984 qui disait que : « Lorsque les conditions
d'asepsie ne sont pas respectées, des mortalités importantes se
produisent chez les mouches, dont l'abdomen devient noir et dont le contenu
intestinal renferme des bactéries du genre Pseudomonas, Aeromonas,
Micrococcus causes de la mortalité » Les mortalités
enregistrées seraient encore plus réduites et la
productivité encore améliorée si le contenu d'un flacon
avait été utilisé pour une alimentation journalière
au lieu de trois par semaine. La congélation a l'avantage de mieux
préserver la qualité du sang. C'est cette qualité qui
justifie l'utilisation croissante de la congélation dans la conservation
des
63
produits alimentaires.
Dans le même lot de mouches nourries au sang sans ATP et
glucose, la mortalité élevée tant chez les mâles que
chez les femelles et leur durée de vie plus courte que celle des
femelles, nous fait croire que les femelles tolèrent plus le sang de
qualité défectueuse.
L'addition de toute substance n'est importante que lorsqu'elle
concourt à l'amélioration de sa qualité. Ce qui est le cas
de l'ATP et le glucose. En effet, le sang congelé avec ATP et glucose a
donné des bons résultats par rapport au reste. Mais la
similarité entre la production de pupes des femelles alimentées
au sang congelé sans ATP et glucose nous fait penser que ce n'est pas
l'ATP et le glucose seuls qui déterminent la productivité des
mouches. Le degré de développement bactérien pourrait y
jouer un très grand rôle en causant la mort des femelles. Cette
mortalité réduit la productivité des femelles.
La campagne de lutte contre les glossines nécessite une
production de masse de mâles à lâcher à un coût
de production moindre. Le sang congelé sans ATP ni glucose, bien qu'il
réduise fortement le coût de production n'est pas celui qui est
approprié à une production de masse de mâles. Il pourrait
cependant être utilisé pour alimenter uniquement les femelles.
Toutefois cette utilisation ne contribuera pas à augmenter la
productivité par rapport à l'alimentation au sang frais mais la
maintiendrait stationnaire. Les mâles quant à eux ne pourront
qu'être alimentés au sang congelé additionné d'ATP
et glucose, ce qui réduira fortement les coûts de production.
L'utilisation du sang congelé offre une bonne
opportunité de production pour plusieurs raisons:
- Possibilité de stocker une importante quantité
pour l'alimentation continue des mouches ;
- Réduction du nombre de sorties à une par
semaine voire une en deux semaines ;
- Possibilité de produire en masse des mâles en
nombre pour le lâcher. En un mois, les mâles de laboratoire
auraient inséminé un maximum de femelles sauvages.
3.2.3. Importance de l'ATP dans l'alimentation sanguine
des glossines.
3.2.3.1. Quantité de sang absorbé.
Plusieurs facteurs conditionnent la quantité de sang
ingéré. Il s'agit : - du stade de faim ;
64
- la qualité du sang offert.
En général l'ingestion est faible le jour de
l'éclosion. Elle est maximum avec le sang de bovin dans lequel l'ATP a
été ajouté après l'irradiation (6,00 #177; 1,53
mg). Cette quantité augmente lorsque le nombre de jours de diète
augmente.
Chez la glossine, à son premier repas, la membrane
péritrophique qui n'a pas encore atteint son développement
complet, forme un sac clos dans l'intestin moyen qui délimite le volume
de sang absorbé. Apres l'éclosion, plus la mouche est
affamée et déshydratée, plus la quantité
absorbée est importante ; les glossines pouvant absorber plus que leur
propre poids de sang soit 15 à 16 mg selon l'espèce (Itard,
2000). C'est ce qui justifie le fait que le lendemain de l'éclosion, le
maximum de sang absorbé par des femelles de 14,65 #177;1,25 mg soit
15.82 #177; 11,17 mg avec du sang de porc.
En une semaine, la quantité moyenne de sang
ingéré est maximum avec les sangs contenant le glucose et l'ATP.
Elle est faible avec le sang qui ne contient ni d'ATP, ni le glucose.
L'importance de cette consommation est due à la présence de
l'ATP. En effet, il stimule l'appétit des mouches, entraînant
ainsi une consommation importante. De ces observations, nous retiendrons que
l'ATP contribue à accroître l'absorption sanguine des glossines
par stimulation de leur appétit.
3.2.3.2. Gain moyen de poids des mouches.
Le gain journalier de poids est plus élevé chez
les mouches alimentées au sang qui ne contient ni glucose, ni ATP. En
revanche, ces mouches sont celles qui avaient les poids les plus
élevé à l'éclosion. Le gain moyen journalier de
poids est la plus faible chez les femelles qui ont la plus forte ingestion de
sang. Ce gain moyen dépendra donc :
- de la réserve nutritive qu'a la mouche à
l'éclosion.
En effet, chez les glossines, la mortalité commence
trois jours après une diète (Bambara, 1984). Ces
dernières, à l'éclosion disposent d'une réserve
nutritive issue de la mère et qui leur permet d'assurer une
continuité de la vie jusqu'à trois jours. Selon Itard (2000), le
tube digestif de la larve présente en son milieu un vaste
réservoir remplie de matière nutritive fournie par les glandes
utérines maternelles. Elles serviront à l'alimentation nymphale
pendant le stade pupal. Pendant cette phase pupal, un tiers du poids de cette
réserve n'est guère affecté par les conditions climatiques
(Lartigue, 1964). Plus la glossine à l'éclosion a un
65
poids élevé, plus sa réserve nutritive
est importante.
- d'un minimum de sang.
Les glossines prennent plus de leur propre poids de sang et se
débarrassent d'un quart de ce dernier en quinze minutes. Glossina
morsistans submorsistans peut excréter dans le premier quart
d'heure 0 à 8 mg. Apres 24 heures, les deux tiers du poids du repas sont
excrétés (Lartigue, 1964). C'est donc dire que ce n'est pas
l'importance de l'absorption qui détermine la croissance des mouches
mais une petite quantité qui est retenue par cette dernière pour
ses besoins. L'ATP qui est le produit qui favorise une ingestion importante de
sang ne contribue pas à une croissance rapide des glossines.
Cependant, il contribue indirectement à la
productivité des pupes. En effet, tous les lots qui ont une production
importante de pupes sont ceux qui sont nourris avec du sang contenant et du
glucose et de l'ATP excepté les femelles du traitement Sg1. La faible
production de ce lot est due à la mortalité qui a affectée
les femelles avant même la première ponte larvaire. Cette
mortalité a contribué à réduire le nombre de
reproductives donc à compromettre leurs productions.
Les mortalités dans les lots de glossines nourries avec
les sangs dont l'ajout de l'ATP à été fait avant et
après irradiation seraient dues à une contamination
bactérienne. Après la récupération de ces sangs,
l'analyse bactériologique avait décelé 10 et 13 colonies
de germes respectivement, sans pour autant déterminer leur nature. La
congélation n'a d'effet que d'inhiber le processus de
développement de ces germes. Après la
décongélation, lorsque qu'ils retrouvent leur condition optimum
de développement, ils commencent à pulluler. La présence
parmi eux, d'un seul germe pathogène peut entraîner des dommages
au sein des glossines qui seront alimentées de ce sang.
A l'issue de toutes ces observations, nous retenons que :
- l'ATP permet une bonne ingestion de sang ;
- le gain moyen journalier de poids est conditionné par
les réserves nutritives de la mouche à l'éclosion ainsi
que d'une quantité minimum de sang de bonne qualité et non par la
présence de l'ATP ;
- l'ATP peut être ajouté au sang avant ou
après l'irradiation sans effet sur la durée de vie des mouches
qui en sont alimentées. La mortalité enregistrée
après une alimentation au sang décongelé de quatre jours
ne nous permet malheureusement pas de dire si ce mode d'ajout a une influence
positive sur la production de pupes. Mais il ne réduit pas la
66
production.
- le sang sans ATP et glucose, certes réduit
considérablement les coûts de production mais, compte tenu de la
production faible de pupes observée, il n'est malheureusement pas celui
qui est approprié pour une production de masse des glossines. Le sang
contenant du glucose et sans ATP a une production et un poids de pupes faible,
il n'est pas non plus apte à une production de masse des glossines.
L'importance de la congélation dans l'alimentation
sanguine du sang a une fois de plus été mise en évidence.
Les femelles alimentées à la fréquence de 4/7 jours avec
les sangs de bovins et de porc contenant du glucose de l'ATP et dont l'ajout a
été effectué respectivement après et avant
irradiation ont une productivité de 0,051#177;0,01 et 0,062#177;0,009
pupes/femelle.
- le sang de porc offrirait une bonne productivité par
rapport à celui du bovin.
3.2.4. Densité optimale des glossines par nouvelle
cage TPU-3.
3.2.4.1. Glossina palpalis gambiensis.
Les cages à 45, 53, 60 et 75 femelles sont
marquées par une mortalité faible comparativement à celle
du témoin, en témoigne l'analyse statistique par le calcul du
taux de mortalité. Dans les cages à 90 femelles par contre, on
note une forte mortalité avec un écart considérable entre
les différentes répétitions (écart type de 43,39%)
avant même la première larviposition.
La mortalité dans les cages témoin (grandes
cages) pourrait s'expliquer par une insuffisance d'ingestion de sang. Les
femelles affamées finissent par périr de faim avec un abdomen
blanc. Les causes de la mortalité peuvent être liées
à :
- la grande taille et à la possibilité
éventuelle de déformation des cages qui
n'adhèrent pas correctement à la membrane
couvrant le sang ;
- une éventuelle contamination du sang.
Selon Otiono et Youdeowei (1981) cité par Kaboré
(1982), dans l'alimentation « in vitro », les mouches
tsé-tsé ont besoin d'un contact tarsal avant de se gorger. Les
mauvaises conditions réalisées par non seulement la taille mais
aussi par les déformations des cages pourraient entraîner une
mauvaise prise alimentaire. C'est cette mortalité qui serait à
l'origine de la productivité faible des témoins par rapport
à celle des femelles dans les cages à 45, 53 et 60.
67
Les cages TPU-3, à raison de leur taille relativement
petite par rapport à la membrane de silicone, a l'avantage de mieux
s'adhérer à celle-ci et de permettre une bonne ingestion des
glossines. C'est ce qui expliquerait le fait que, après un premier repas
sanguin, toutes les femelles des cages TPU-3 aient un abdomen bien rouge et
gonflé par rapport à celui des témoins. Selon Itard
(2000), le sang contenu dans le jabot d'une mouche qui vient de se gorger est
rouge brillant, alors qu'au cours de la digestion, celui de l'intestin prend la
couleur du sang veineux. L'aspect de l'abdomen ainsi que sa couleur rouge
impliquent que les femelles des cages TPU-3 ont ingéré une
quantité importante de sang par rapport aux femelles témoins. Il
est probable qu'il y'ait une relation entre la quantité de sang
ingéré et la longévité ainsi que la
productivité des femelles. Une colonie de Glossina palpalis
maintenue 7/7 jours par Bauer et Politzar (1982) sur membrane artificielle
a donné des performances qui se caractérisent par une
mortalité journalière haute, une productivité basse et des
pupes de faible poids. La plupart des femelles mortes étaient
affamées. C'est donc à dire que le facteur nutritif a une
influence certaine sur la longévité, la productivité et le
poids des pupes. La productivité des femelles des cages à 45, 53
et 60 s'explique par une bonne alimentation de celle-ci.
La forte mortalité dans les cages à 90 femelles
pourrait s'expliquer par une densité élevée des femelles
qui peut être une source de stress causant de nombreuses pertes chez ces
dernières.
Malgré un taux de mortalité faible dans les
cages à 75 femelles, la productivité est approximativement
égale à celle des témoins, aussi le poids moyen des
femelles y est faible. En revanche le taux d'avortons dans ce lot est
élevé. Melamby (1937) a montré qu'une alimentation
insuffisante et interrompue peut être cause de nombreux avortements. Le
poids faible des pupes, le taux d'avortons élevé de même
que cette faiblesse de productivités pourraient s'expliquer par des
conditions d'élevage inadéquates des femelles. Ce sont ces
conditions qui entraîneraient un fort avortement des femelles.
Un des facteurs qui rend difficile la production de masse des
glossines est son taux de productivité des femelles (une larve tous les
9 à 10 jours). Au regard des résultats obtenus, les femelles des
cages à 75 ont certes un taux de mortalité faible mais sa
productivité ne favorise pas une amélioration de la production
des colonies. Il convient donc de garder par cage 60 femelles soit au total 80
mouches (mâles et femelles compris). Selon les normes acceptables
données par l'AIEA, à savoir un mâle pour quatre femelles,
chaque cage peut donc contenir 64 femelles et 16 mâles.
68
3.2.4.2. Glossina morsistans submorsitans.
Chez Glossina morsistans, les femelles témoins
ont une mortalité faible avec une productivité de 0.066
pupes/femelle. Les femelles des cages TPU-3 à 53 femelles ont quant
à elles une productivité de pupes supérieure à
0.066 avec un taux de mortalité élevé en comparaison avec
le témoin. Les femelles des cages TPU-3 ont un taux de mortalité
très élevé avant même la première
larviposition avec un écart considérable entre les
répétitions (écart type de 39,47%). C'est cette
mortalité qui explique en partie la productivité de pupes faible
dans ce lot (0.024#177;0.02 pupes/femelle). Elle mortalité serait due
à de nombreuses causes notamment :
- une contamination probable du sang.
Cette hypothèse ne serait pas vérifiée
car si tel était le cas, plusieurs lots seraient également
touchés car ils ont été soumis aux mêmes conditions
d'alimentation ;
- une infection probable de certaines cages avant leur
utilisation.
Les glossines sont des insectes très sensibles à
l'effet du parfum, à de nombreux produits chimiques. Le fait que les
cages proviennent de loin et qu'elles aient été utilisées
sans précautions préalables (par exemple bouillir) pourraient
être contaminées par un quelconque produit. Par conséquent,
le contact des mouches avec ce produit serait à l'origine des grandes
mortalités. La forte mortalité rapide observée surtout
dans toutes les cages à 60 femelles par rapport à celle des cages
à 75 rend cette hypothèse plus probable.
Durant la période avant les deux premières
larviposition, la mortalité au niveau des femelles des cages à 75
est la plus faible par rapport à celle du témoin. Cette
mortalité s'est accrue après la deuxième ponte larvaire de
telle sorte qu'elle était la plus forte dans tous les lots. Cependant,
malgré cette faiblesse du taux de mortalité au cours des
premières périodes de vie des femelles, ce lot est
caractérisé par une productivité analogue à celle
du témoin et un taux d'avortons élevé.
Compte tenu du fait que toutes les femelles ont
été mises dans les mêmes conditions tant environnementales
que alimentaire, les différences entre les productivités
pourraient s'expliquer par la densité. Considérant que la
mortalité dans les cages à 60 femelles ont d'autres causes que la
densité, Glossina morsistans submorsitans peut être
stockée dans les cages TPU-3 au même nombre que G. palpalis
gambiensis c'est-à-dire 64 femelles/cages.
3.2.4.3. Glossina tachinoides
Chez Glossina tachinoides l'optimum de
productivité est 0.06 pupes/femelle/jour
69
(Kyendrebeogo, 1981). Aucun lot de femelles n'a atteint cet
optimal. Cela s'expliquerait par non seulement la mortalité des femelles
mais aussi par un taux d'insémination de ces dernières qui
pourrait être faible.
Seules la productivité des femelles des cages à
75 femelles s'approche plus de l'optimum. En outre, le poids des pupes est
supérieur à 16 mg également considéré comme
acceptable chez G. tachinoides. Elles ont en outre un taux d'avortons
faible. Ces bons paramètres sont le signe d'un bon état des
femelles. Cela serait due au fait que G. tachinoides est une
espèce de petite taille donc supporterait mieux les fortes
densités par rapport au deux autres. Cependant, le nombre de
répétitions faibles rend incertains ces résultats.
Les femelles des cages à 90 femelles ont une
productivité et un poids de pupes faibles. Elles sont marquées
par un taux de mortalité au cours du temps faible en comparaison
à celui des autres espèces. Néanmoins, sa
productivité n'est pas satisfaisante. Ceci serait dû à la
densité très élevée dans ces cages.
Pour harmoniser le nombre de femelles par cages et compte tenu
du nombre de femelles de G. tachinoides relativement bas dans
l'élevage par rapport aux deux autres, il est préférable
de les garder au même nombre que G. palpalis gambiensis et
G. morsitans c'est-à-dire à 64 femelles par cage.
3.2.5. Suggestions et perspectives.
En guise de suggestions et de perspectives pour une
éventuelle amélioration du système de production des
glossines, nous préconisons :
- des recherches sur la possibilité de diminuer la
quantité d'ATP utilisée par litre de sang. Plusieurs lots de
femelles pourraient être alimentés avec des sangs contenant une
quantité variable d'ATP par litre (30, 40, 50 et 60 mg). Cela pourrait
conduire à une réduction des coûts de production ;
- un test de comparaison de performance entre les mâles
produits avec du sang frais et ceux produits avec du sang congelé ;
- une étude sur les possibilités de
réduction de la fréquence d'utilisation de l'ATP. Etant
donné que l'alimentation commence toujours par les plus jeunes une
réduction de la quantité d'ATP par âge peut être
envisageable.
70
Conclusion.
La réussite d'une campagne de grande envergure comme la
PATTEC dépend étroitement d'une production de masse de glossines
de qualité au laboratoire. Dans ce présent travail,
l'amélioration du système de production a fait l'objet
d'étude. De nos travaux nous retenons que :
- G. morsitans, par sa taille moyenne est apte pour
une alimentation trois fois par semaine (Lundi- Mercredi- Vendredi). G.
palpalis gambiensis et G. tachinoides quant à elles,
pourront être alimentées quatre fois par semaine (Lundi- Mardi-
Jeudi et Vendredi).
- la congélation, compte tenu des résultats
satisfaisants obtenus est envisageable pour une bonne conservation du sang. Le
sang congelé sans glucose et ATP est comparable au sang frais qui
contient ces deux produits ;
- l'ATP stimule l'appétit des glossines mais il ne
contribue pas forcement à leur croissance ;
- la densité de glossines qui optimise leur production
de pupes dans les cages TPU-3 est de quatre vingt dont soixante quatre femelles
et seize mâles.
Une autre expérience qui à terme contribuerait
à réduire considérablement le processus manuel de tris des
mouches par sexe, n'a malheureusement pas été
réalisée pour des raisons de retard dans l'exécution des
travaux de réaménagement de l'insectarium. Il s'agit de l'auto
émergence dans les cages TPU-3 qui nécessite une
température constante de 26°c.
La mise en place d'une méthode de lutte contre les
glossines nécessite des connaissances préalables de leurs
dispersions et de leurs modes de déplacement. Une autre
expérience à issue capitale mais onéreuse a
malheureusement avorté par manque de financement. Il s'agit de la
comparaison des performances des souches sauvages et celles des glossines
produites au laboratoire. Cette expérience consistait à
récolter des pupes sauvages, à les faire éclore et
effectuer des croisements entre mâles sauvages-femelles domestiques et
vice versa. Elle constituerait la base d'une nouvelle colonie de glossines qui
serviront à des recherches qui porteront sur leur
génétique.
Pour une automatisation de la chaîne de production et le
succès de la PATTEC, ces deux expériences méritent
d'être réalisées.
71
BIBLIOGRAPHIE.
n BAMBARA (X), 1984 :
Elevage de Glossina morsistans submorsistans
NEWSTEAD, 1910 (DIPTERA : MUSCIDAE) à
Bobo-Dioulasso:
- Effet de la température; Effet de la
lumière ;
- Taux d'infection trypanosomienne des bovins de
l'abattoir de Bobo : sondage par la centrifugation en tubes à
hématocrites. CRTA/I.S.P. IEMVT/GTZ. Mémoire
n BANCE (Z), 1979 :
Technologie et économie de la lutte chimique
par voie terrestre contre les glossines : application à la zone
du (PEOV). Mémoire U.O/I.S.P 34 p.
n BANCE (Z. A.) ; 2003 :
Efficacité et rémanence du triflumuron,
inhibiteur de la synthèse de la chitine sur la glossine, Glossina
palpalis gambiensis dans une perspective de lutte autocide.
Thèse UFR/SVT.
n Bouchon (D) et Cognet (P) ; 1984 :
Progrès technique dans l'élevage en
masse des glossines au Burkina Faso. Revue d'Elevage et de
Médecine Vétérinaire des Pays Tropicaux, 37(numéro
spécial) p18-30. IEMVT/CRTA Bobo Dioulasso.
n Chalier (A) ; 1984 :
Perspectives d'utilisation des systèmes
attractifs toxiques dans la lutte contre les glossines (Diptèra,
Glossinidae). Revue d'Elevage et de Médecine
Vétérinaire des Pays Tropicaux, 37(numéro spécial)
p31 - 59. IEMVT/CRTA Bobo Dioulasso.
n Cuisance (D), Merot (P), Politzar (H) Tamboura (I)
; 1984:
Résultat d'une campagne de lutte contre les
glossines riveraines au Burkina par l'emploi d'écrans
imprégnés de deltametrine. Revue d'Elevage et de
Médecine Vétérinaire des Pays Tropicaux, 37 (numéro
spécial) p175 - 184 IEMVT/CRTA Bobo Dioulasso.
n Cuissance (D), Itard (J), Solano (P), Donesqesnes
(M), Frezil (J.L) et Authié (E), 2003: Trypanosomoses : Méthodes
de lutte. Les principales maladies infectieuses et parasitaires du
bétail p1695-1724. Editions TEC & Doc.
n
72
Cuissance (D) et de la Rocque (S) ; 2003 :
Trypanosomoses Environnement. Les
principales maladies infectieuses et parasitaires du bétail. Tome 2 :
1651-1656. Editions TEC& Doc.
n CUISSANCE (D), 2001 :
Lutte contre les tsé-tsé :
Document pour servir au cours; CIRAD.
n CUISANCE (D), 1989 :
Le piégeage des
tsé-tsé. Institut d'Elevage et de Médecine
Vétérinaire des Pays Tropicaux (IEMVT) 171p.
n de la Rocque (S), J.F. Michel, Cuissance (D) ;
2001:
Le risque trypanosomien : une approche globale pour
une décision locale .CIRAD.
ITARD (J), 2000 :
Trypanosomoses animales africaines. Précis de
parasitologie vétérinaire tropicale. Edition Tec & Doc, p 206
- 450.
n Itard (J), Bauer (B) ; 1984:
Evolution de la productivité des
glossines. Revue d'Elevage et de Médecine
Vétérinaire des Pays Tropicaux, 37(numéro spécial)
IEMVT/CRTA Bobo Dioulasso p143 -175.
n Itard (J), Cuissance (D), Tacher (G) ;2003
:
Trypanosomes : Historique - Répartition
géographique. Les principales maladies infectieuses et
parasitaires du bétail. Tome 1. Editions TEC & doc.
n Itard (J) et Cuissance (D) ; 2003:
Vecteur cyclique des trypanosomes. Les
principales maladies infectieuses et parasitaires du bétail. tome1,
p139- 161. édition TEC&DOC.
n Itard (J), Cuisance (D)et Politzar (H), juin 1983 :
Lutte génétique contre les mouches
tsé-tsé. Edition Alfort.
n FINELLE (P) ; 1983 :
La trypanosomose animale africaine. Revue
mondiale de zootechnie. FAO ; p 1 - 19.
n KABORE, 1982 :
Rationalisation des techniques d'élevage de
Glossina palpalis gambiensis VANDERPLANK 1949 (Diptera :
Muscidea) à Bobo Dioulasso :
73
- Possibilité d'utilisation de sang
lyophilisé dans l'alimentation « in vitro » -
Nouvelle modalité de stockage des glossines en grande
cages. Mémoire U.O/I.S.P ; 81 p
n KABORE(I), BAUER (B); 1984:
L'élevage de G. palpalis gambiensis
VANDERPLANK 1949 (Diptera ; Muscidae) avec du sang lyophilisé
importé de différentes espèces et avec du sang
defibriné local de boeuf. Comparaison des performances
obtenues. Revue d'Elevage et de Médecine
Vétérinaire des Pays Tropicaux (IEMVT/ CRTA Bobo Dioulasso), 37
(1) ; p 35-41.
n KABORE (I); 2001 :
Les vecteurs cycliques des trypanosomoses du
bétail. Diagnostic et contrôle des hémoparasitoses
animales et leurs vecteurs ; Cours international de formation tenu du 5 au 17
novembre 2001 au CIRDES. P 87 - 97.
n KABORE (I); 2001 :
Lutte contre les glossines. Diagnostic et
contrôle des hémoparasitoses animales et leurs vecteurs ; Cours
international de formation tenu du 5 au 17 novembre 2001 au CIRDES. P 98 -
103.
n KABORE (I); 20003 :
Vecteurs des trypanosomoses : Les glossines
: Etudes épidémiologiques des trypanosomoses bovines et
suivi-évaluation des campagnes de lutte ; Cours international de
formation du 31 au 17 avril 2003 tenu au CIRDES. p 66-67.
n KABORE (I) ; 2003 :
Lutte contre les vecteurs : Techniques de
piégeage des insectes. Etudes épidémiologiques
des trypanosomoses bovines et suivi-évaluation des campagnes de lutte ;
Cours international de formation du 31 au 17 avril 2003 tenu au CIRDES. P
77-79.
n KAM (H), 2003 :
Validation de techniques de production industrielle
des glossines et évaluation de la compétitivité
vis-à-vis des souches sauvages. Mémoire de fin
d'étude CIRDES/IDR.
n KAMUANGA (M) ; 2003 :
Aspects socio-économiques et impacts de la lutte
contre la trypanosomose animale
74
africaine. Etudes
épidémiologiques des trypanosomoses bovines et
suivi-évaluation des campagnes de lutte ; Cours international de
formation du 31 au 17 avril 2003 tenu au CIRDES. P 53-65.
n Koné André (SD) :
Contribution à la caractérisation des
espaces à risque de maladies du sommeil dans un foyer en zone
forestière Zoukougbeu (Cote d'Ivoire). Thèse pour
obtenir le grade de docteur de l'université de ROUEN : Discipline
:Géographie. Tome 1.
n 1981 KYENDRBEOGO (L.E),
Essai de détermination de la qualité de sang la
mieux appropriée à l'élevage « in vitro » de
Glossina tachinoides Westwood, 1850 (Diptera,
Muscidae) à Bobo Dioulasso :
Facteur espèces nourricières
Facteur irradiation. Mémoire CRTA/I.S.P. UO
n LARTIGUE (J.J), 1964 :
Cours de formations professionnelles sur les
trypanosomiases africaines au Centre Muraz de Bobo/OMS. Tome 1.
n LAVEISSIERE (C), GREBAUT (P), HERDER (S),
PENCHENIER (L), 2000: Les glossines vectrices de la trypanosomiase
humaine africaine. (246p) IRD.
n LAVEISSIERE (C) ; PENCHENIER (L), 2005
:
Manuel de lutte contre la maladie du sommeil.
365 pages. IRD édition 2005.
n MALENNAN (K.J.R) :
Incidence de la trypanosomiase transmise par la
mouche tsé-tsé sur l'économie rurale en Afrique.
Revue mondiale de zootechnie. FAO, 1983 : 19 - 46.
n Ouédraogo (S), 1999 :
Contribution à l'efficacité et de la
rémanence du triflumuron en pulvérisation sur tissus pour
l'amélioration des techniques de luttes non polluantes contre les
glossines ou mouche tsé-tsé (Essai contre Glossina palpalis
gambiensis). Mémoire de fin de cycle, IDR ; 65 p
n POLLOCK (J.N), 2000:
Manuel de lutte contre la mouche tsé-tsé
Volume 1 : Biologie, systématique et répartition des
tsé-tsé 308p; Volume 2 : Ecologie et comportement des
tsé-tsé. 114p. (FAO).
n
75
POLLOCK (J.N), 1982 réimpression 1992 : Manuel de
lutte contre la mouche tsé-tsé. Volume 1
FAO.
n RAYAISSER (J.B), 1995 :
Contribution à l'amélioration des
systèmes de piégeages et de lutte contre les glossines et autres
insectes hemathophages par l'utilisation d'attractif olfactifs.
Mémoire de fin d'étude CIRDES/IDR.
n SAWADOGO (R. D), 1990 :
Contribution à la lutte anti -
tsé-tsé : Etude de l'efficacité et de la rémanence
de pyréthrinoides imprégnés sur tissus ou enduits sur
bovins. Mémoire de fin d'études :
n Somé (B.D), 1986 :
Elevage de Glossina morsistans submorsistans :
Lésions cutanées. Mémoire de fin de cycle
CRTA/IDR.
I

II
Annexe 1 : Tableaux récapitulatifs de quelques
protocoles.
TABLEAU FREQUENCE DE
L'ALIMENATATION,
|
Fréquences de
|
Espèces
|
Femelles/
|
nombre de
|
Total de
|
Temps de
|
Observations
|
|
L'alimentation
|
|
cage
|
répétitions
|
femelles
|
l'alimentation
|
|
|
|
|
|
|
(mns)
|
|
|
3/7jours : LUN
|
-G.palpalis
|
150
|
4
|
900
|
10
|
_Mortalité
|
|
Mer
|
-
|
|
|
|
|
-Date de larviposition
|
|
Vend
|
G.morsistans
|
150
|
4
|
900
|
10
|
-poids moyen des pupes
|
|
4/7jours
|
--G. palpalis
|
150
|
4
|
900
|
|
-productivité
|
|
LUN
|
-
|
|
|
|
15
|
-taux d'avortons
|
|
MAR
|
G.morsistans
|
150
|
3
|
900
|
10
|
-taux d'éclosion
|
|
Jeu
|
-G.
|
|
|
|
10
|
|
|
Vend
|
tchinoides
|
150
|
2
|
900
|
15
|
|
|
5/7jours
|
--G. palpalis
|
150
|
4
|
900
|
|
|
|
LUN
MAR
|
G.
tchinoides
|
150
|
2
|
900
|
15
10
|
|
|
Mer
|
|
|
|
|
10
|
|
|
Jeu
|
|
|
|
|
10
|
|
|
Vend
|
|
|
|
|
15
|
|
|
Témoin :6/7jours
|
--G. palpalis
|
150
|
3
|
450
|
10
|
|
|
-
|
|
|
|
|
|
|
G.morsistans
|
150
|
2
|
300
|
|
|
|
-G.
|
|
|
|
|
|
|
tchinoides
|
150
|
2
|
300
|
|
|
TABLEAU UTILISATION DU SANG CONGELE DANS
L'ALIMENTATION DES GLOSSINES,
|
Traitement
|
espèces
|
Femelles/ cage
|
Nombre de
répétitions
|
Total
femelles
|
Observations
|
|
Sang congelé irradié
ATP+Glu+
|
-
G.palpalis
|
150
|
6
|
900
|
-mortalité
quotidienne
|
|
Sang congelé irradié ATP-
|
G. palpalis
|
150
|
6
|
900
|
-date de larviposition
|
|
Glu-
|
|
|
|
|
-poids moyen des
|
|
Témoin : sang frais
Irradié
ATP+Glu+
|
G. palpalis
|
150
|
Même que
fréquences
alimentation
|
|
pupes
-taux d'éclosion
-productivité
|
TABLEAU DENSITE OPTIMALE DES CAGES
TPU-3,
|
Espèces
|
|
|
G. palpais, G. morsitans, G. tachismes
|
|
|
|
Total tsé-tsé/cage
|
60
|
70
|
80 90
|
100
|
120
|
|
Femelles ?
|
45
|
53
|
60 68
|
75
|
90
|
|
Males ?
|
15
|
17
|
20 22
|
25
|
30
|
|
Nb répétitions
|
4
|
4
|
4 4
|
4
|
4
|
|
Observations
|
|
|
-Mortalités
|
|
|
|
|
|
-Larviposition
|
|
|
|
|
|
-Poids moyen des pupes
|
|
|
|
|
|
-productivité
|
|
|
Annexe 2 : Composition des différents
nutriments.
Adenosine 5'Triphospate
(C10H14N5Na2O13P3)(5'ATP, NO2)
Glucose (C6H12O6, H2O) D+ Glucose monohydrate
composition Cl =0.005% k = 0.005%
SO4=0.005% Mg = 0.0005% As= 0.00001% Mn = 0.0005% Ca =0.001% Na =
0.005% Cd= 0.0004% Ni = 0.0005% Co =0.0005% Pb = 0.0005% Cr =0.0005 % Zn
=0.0005% Cu =0.0005%
Fe =0.0005%
III
Annexe 3 : Quelques photos prises au cours des
expériences.

IV

V

VI
annexe 4 : Distribution des différentes
espèces des trois sous genres de glossines.
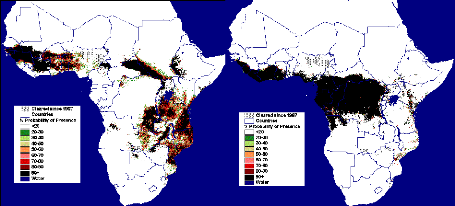
|
REPARTITION DES ESPECES DU GROUPE MORSITANS
|
REPARTITION DES ESPECES DU GROUPE FUSCA
|
REPARTITION DES ESPECES DU GROUPE PALPALIS
| 


