
REPUBLIQUE DEMOCRATIQUE DU CONGO
UNIVERSITE DE LUBUMBASHI
ECOLE SUPERIEURE DES
INGENIEURS INDUSTRIELS
Département de Génie des
procédés
BP.1825
LUBUMBASHI
Influence de la granulométrie sur la
cinétique de lixiviation du minerai
oxydé du gisement de KIBOLWE.
PAR UMBA KINDA Daniel
Mémoire présenté et défendu en
vue de l'obtention du grade de Bachelier en science de l'Ingénieur en
génie des procédés chimiques.
Février 2022
REPUBLIQUE DEMOCRATIQUE DU CONGO
UNIVERSITE DE
LUBUMBASHI
ECOLE SUPERIEURE DES INGENIEURS
INDUSTRIELS
Département de Génie des
procédés
BP.1825
LUBUMBASHI
Influence de la granulométrie sur la
cinétique de lixiviation du minerai oxydé
du gisement de KIBOLWE.
Par UMBA KINDA Daniel
Mémoire présenté et défendu en
vue de l'obtention du grade de Bachelier en science de l'Ingénieur en
génie des procédés chimiques.
Dirigé par : Augustin ILUNGA NDALA
Professeur émérite
Encadré par : Delphin MUKALAY UMBA
Chef des travaux
Février 2022
Page | I
RESUME
Ce travail présente les résultats d'une
étude qui avait pour objectif de déterminer l'influence de la
granulométrie (tailles des particules) sur la cinétique de
lixiviation du cuivre du minerai oxydé de KIBOLWE en milieu acide.
Pour mener à bien cette étude, nous avons
effectué d'une part des préparations et des
caractérisations physiques et d'autre part des caractérisations
chimiques et minéralogiques du minerai. Et pour les essais de
lixiviation, nous avons utilisé quatre granulométries
différentes offrant des % des passants différents sur un tamis de
75um que nous avons pris comme tamis de référence, et nous avons
maintenu les autres paramètres constants, il faut signaler que ces
essais ont été effectués en réacteur
agité.
Pour pouvoir évaluer la cinétique de lixiviation
nous avons effectué des prélèvements à des instants
différents durant nos essais afin de pouvoir déterminer
l'évolution de la mise en solution du cuivre.
Les meilleurs résultats cinétiques sont ceux
obtenus avec la granulométrie offrant 70% de passant qui ont
donné une extraction de 24.8796 g/L de cuivre en 120 minutes avec un
rendement de lixiviation de 82.64% et une solubilisation de 74.34 Kg de cuivre
par tonne de minerai.
Page | II
Table des matières
RESUME I
LISTE DES FIGURES V
LISTE DE TABLEAUX VI
EPIGRAPHE VII
DEDICACE VIII
REMERCIEMENTS IX
INTRODUCTION GENERALE 1
I-1. HISTORIQUE : 3
I-2. PRESENTATION DU PROJET KIBOLWE 3
I-3. SIEGE SOCIALE 4
I-4. SITUATION GEOGRAPHIQUE DU GISEMENT DE KIBOLWE 4
CHAPITRE II : GENERALITE SUR LA LIXIVIATION
5
II-1. PRINCIPE ET APPLICATION DE L'HYDROMETALLURGIE
5
II-2. LA LIXIVIATION 6
II-2-1. Réactifs de lixiviation 6
II-3. TYPE DE LIXIVIATION 7
II-3-1. Lixiviation chimique : 7
A. Lixiviation acide: 7
? Lixiviation acide oxydante : 7
? Lixiviation acide réductrice: 7
B. Lixiviation ammoniacale: 7
C. Lixiviation par cyanuration : 7
D. Lixiviation par les chlorures : 8
E. Lixiviation par la soude caustique : 8
II-3-2. Lixiviation bactérienne : 8
A. La biolixiviation : 8
B. La biosorption 9
II-3-4. Technologie de la lixiviation 9
II-4-1. Lixiviation in-situ: 9
II-4-2. Lixiviation en tas ou lixiviation statique : 10
II-4-3. Lixiviation par percolation : 11
II-4-4. Lixiviation en réacteur agité :
12
II-4-5. Lixiviation sous pression(en autoclave) :
12
Page | III
II-5. CHIMIE DE LA LIXIVIATION 12
II-5-1. Paramètres physiques : 13
II-5-2. Réactions de Lixiviation : 13
II-5-2-1.Réaction de solubilisation physique :
13
II-5-2-2.Lixiviation par réaction chimique simple
: 13
II-6. APPROCHE THERMODYNAMIQUE ET CINETIQUE DE LA
LIXIVIATION 14
II-6-1. Généralités 14
II-6-2. Diagrammes de POURBAIX 14
II-6-2-1. Structure des diagrammes de POURBAIX 15
II-6-2-2. Diagramme de POURBAIX de l'eau 15
II-6-2-3. Diagramme de POURBAIX du système Cu-H2O
18
II-7. APPROCHE CINETIQUE DE LA LIXIVIATION
18
II-7-1. Facteurs influençant la cinétique de
lixiviation 19
II-8. LE RENDEMENT DE LIXIVIATION 20
II-9. OPERATIONS SUBSEQUENTES A LA LIXIVIATION
20
II-9-1. Séparation Solide-Liquide 20
? La décantation : 21
? La filtration : 21
? La centrifugation : 21
Partie II : Partie expérimentale 22
CHAPITRE III : MATERIEL ET METHODES 22
III.1 INTRODUCTION 22
III-1. MATERIELS ET APPAREILS 22
III-1-1. Matériel 22
III-1-2. Appareils 22
III-2. ECHANTILLONNAGE 23
III-2-1. Origine de l'échantillon 23
III-2-2. Caractérisation de
l'échantillon 23
III-2-2-1. Caractérisation chimique 23
III-2-2-2. Caractérisation minéralogique de
l'échantillon 23
III-2-2-3. Caractérisation granulométrique
23
III-2-2-4. Procédure expérimentale :
23
III-2-2-5. Analyse granulochimique 24
III-2-2-6.Etude de broyabilité
24
Page | IV
III-2-2-7. Mode opératoire 24
III-3. ESSAIS DE LIXIVIATION 24
III-3-1. Préparation de la pulpe 25
III-3-1-1. Calcul de la pulpe pour une densité de
1200 25
III-3-2. Mode opératoire pour la lixiviation 25
III-4. CALCUL DES CARACTERISTIQUES HYDROMETALLURGIQUES
26
? Calcul du rendement de lixiviation
26
? La solubilisation 27
? Calcul expérimental de la vitesse de
mise en solution 27
CHAPITRE IV : PRESENTATION ET ANALYSE DES RESULTATS
28
IV-1.INTRODUCTION 28
IV-2. CARACTERISATION DE L'ECHANTILLON 28
IV-2-1. Analyse chimique de l'échantillon 28
IV-2-2. Caractérisation minéralogique 29
IV-2-3. Caractérisation granulométrique 29
IV-2-4. Résultats d'étude de broyabilité
31
IV-3. RESULTATS DES ESSAIS DE LIXIVIATION
33
IV-3-1. Essais de lixiviation 33
IV-3-2. Essai de lixiviation avec 65 % de passant 33
IV-3-2-1. Résultats de l'essai de lixiviation avec
une granulométrie offrant 65% de passant 33
IV-3-3. Essai de lixiviation avec 70 % de passant 36
IV-3-3-1. Résultats de l'essai de lixiviation avec
une granulométrie offrant 70% de passant 36
IV-3-3. Essai de lixiviation avec 75 % de passant 39
IV-3-3-1. Résultats de l'essai de lixiviation avec
une granulométrie offrant 75% de passant 39
IV-3-4. Essai de lixiviation avec 80 % de passant
41
IV-3-4-1. Résultats de l'essai de lixiviation avec
une granulométrie offrant 80% de passant 42
IV-4. RESULTATS DES QUATRE ESSAIS 44
Conclusion générale et perspectives
48
REFERENCES BIBLIOGRAPHIQUES 49
ANNEXES 1
Annexe 1. : Résultats des analyses des gâteaux
1
Page | V
LISTE DES FIGURES
FIGURE II- 1 : TECHNIQUE D'EXPLOITATION PAR LIXIVIATION IN
SITU. 10
FIGURE II- 2 : LIXIVIATION EN TAS, MINE DE NICKEL EN FINLANDE
(
WWW.WROMP-INT.COM).
11
FIGURE II- 3: ZONE DE STABILITE THERMODYNAMIQUE DE L'EAU
VIS-A-VIS DES OXYDANTS ET DES
REDUCTEURS. 17
FIGURE II- 4: DIAGRAMME E-PH DU SYSTEME CU-H2O 18
FIGURE IV- 1 : COURBE DE LA REPARTITION GRANULOMETRIQUE
31
FIGURE IV- 2 : COURBES DE L'EVOLUTION DE PASSANTS ET REFUS.
32
FIGURE IV- 3 : COURBE D'EVOLUTION EXPRIMANT LA CINETIQUE DE
LIXIVIATION DU CUIVRE
AVEC 65% DE PASSANT 34
FIGURE IV- 4 : COURBE D'EVOLUTION DU RENDEMENT DE LIXIVIATION
AVEC 65% DE PASSANT 35
FIGURE IV- 5 : COURBE DE LA VARIATION DE LA VITESSE DE MISE
EN SOLUTION DU CUIVRE 35
FIGURE IV- 6 : COURBE D'EVOLUTION EXPRIMANT LA CINETIQUE DE
LIXIVIATION DU CUIVRE
AVEC 70% DE PASSANT 37
FIGURE IV- 7: COURBE D'EVOLUTION DU RENDEMENT DE LIXIVIATION
AVEC 70% DE PASSANT 38
FIGURE IV- 8: COURBE DE LA VARIATION DE LA VITESSE DE MISE EN
SOLUTION DU CUIVRE AVEC
70% DE PASSANT 38
FIGURE IV- 9 : COURBE D'EVOLUTION DE LA
CINETIQUE DE LIXIVIATION DU CUIVRE AVEC 75% DE
PASSANT 40
FIGURE IV- 10 : COURBE D'EVOLUTION DU RENDEMENT
DE LIXIVIATION AVEC 75% DE PASSANT 40 FIGURE IV- 11 : COURBE DE LA VARIATION DE
LA VITESSE DE MISE EN SOLUTION DU CUIVRE AVEC
75% DE PASSANT 41
FIGURE IV- 12 : COURBE D'EVOLUTION DE LA
CINETIQUE DE LIXIVIATION DU CUIVRE AVEC 80%
DE PASSANT 42
FIGURE IV- 13 : COURBE D'EVOLUTION DU
RENDEMENT DE LIXIVIATION AVEC 80% DE PASSANT 43 FIGURE IV- 14 : COURBE DE LA
VARIATION DE LA VITESSE DE MISE EN SOLUTION DU CUIVRE AVEC
80% DE PASSANT 43
FIGURE IV- 15 : COURBES CINETIQUES DE LIXIVIATION DES QUATRE
ESSAIS 45
FIGURE IV- 16 : COURBE D'EVOLUTION DES RENDEMENTS DE
LIXIVIATION DES 4 ESSAIS 46
FIGURE IV- 17 : COURBES DES VARIATIONS DES VITESSES
D'EXTRACTION 46
Page | VI
LISTE DE TABLEAUX
TABLEAU I- 1: COORDONNEES GEOGRAPHIQUE DU GISEMENT DE KIBOLWE
4
TABLEAU IV- 1 : RESULTATS DE L'ANALYSE CHIMIQUE 28
TABLEAU IV- 2: RESULTATS DE L'ANALYSE GRANULOMETRIQUE
30
TABLEAU IV- 3 : RESULTATS DE L'ETUDE DE BROYABILITE DE
L'ECHANTILLON 31
TABLEAU IV- 4 : RESULTATS DE LIXIVIATION AVEC 65% DE
PASSANT 34
TABLEAU IV- 5 : VARIATION DE LA VITESSE D'EXTRACTION
34
TABLEAU IV- 6: RESULTATS DE LIXIVIATION AVEC 70% DE
PASSANT 37
TABLEAU IV- 7 : VARIATION DE LA VITESSE D'EXTRACTION
37
TABLEAU IV- 8: RESULTATS DE LIXIVIATION AVEC 75% DE
PASSANT 39
TABLEAU IV- 9 : VARIATION DE LA VITESSE D'EXTRACTION
39
TABLEAU IV- 10 : RESULTATS DE LIXIVIATION AVEC 80% DE
PASSANT 42
TABLEAU IV- 11 : VARIATION DE LA VITESSE D'EXTRACTION
42
TABLEAU IV- 12 : VARIATION DE LA CONCENTRATION EN FONCTION
DU TEMPS 44
TABLEAU IV- 13 : RESULTATS DU RENDEMENT DE LIXIVIATION EN
FONCTION DU TEMPS 44
TABLEAU IV- 14 : VARIATION DES VITESSES DE QUATRE ESSAIS
45
Page | VII
EPIGRAPHE
Que l'évolution soit poussée par le passé
ou tirée par le futur, c'est avec l'homme et ses techniques que
l'univers
devient intelligent.
Albert Jacquard
Page | VIII
DEDICACE
A vous Familles BANZA et KAMALENGE pour m'avoir soutenu, pour
avoir été présentes à mes côtés et
pour m'avoir aidé,
A vous tous frères, soeurs, oncles, tantes, cousins,
cousines, amis et amies,
Et à ceux qui nous ont précédé dans
l'au-delà, Je dédie ce travail.
Page | IX
REMERCIEMENTS
La reconnaissance et l'honnêteté font partie des
grandes valeurs que doivent avoir un homme intègre, aspirant donc
à cette fin il nous est donc impossible de terminer la présente
étude sans pour autant présenter notre reconnaissance et nos
remerciements les plus sincères aux personnes qui ont été
à nos côtés durant notre parcours académique et
à tous ceux qui nous ont soutenu d'une manière ou d'une autre
durant celui-ci.
Nous ne pourrons pas terminer ce travail sans pour autant
exprimer notre sincère reconnaissance et nos remerciements à Dieu
qui nous a permis de tenir jusqu'au bout malgré les aléas de la
vie.
Qu'il nous soit aussi permis d'exprimer au sein de ce travail
nos remerciements les plus sincères au professeur émérite
Augustin ILUNGA NDALA qui a accepté de diriger la réalisation de
ce travail malgré ses multiples et importantes occupations. Au chef de
travaux Delphin MUKALAY qui nous a encadré et orienté durant la
réalisation du présent travail. Au corps professoral de l'Ecole
Supérieure des Ingénieurs Industriels qui nous a encadré
durant notre parcours académique.
Nos remerciements s'adressent une fois de plus à ma
famille biologique et plus particulièrement à ma chère
Viviane KATUMBA mère et femme forte, à ma tante Marie KAPAPA,
à mes tantes Agnès et Médiatrice KANZA, à mes
Oncles : Albert TWITE, Xavier KAZEMBE, Benjamin DYANDA ; à mes
frères et soeurs : Betty MANDE, Jean MONGA, Barth MALUNGA, Marie BANZA
et Albert TWITE ; à mes cousins et cousines : Ben DYANDA, Olivier
MATANGA, Chris NSAMBI, Christian, Marie KAPAPA, Alice, Laurène MUKUMBI,
Nathalie, Jojo, Junior KANZA, Patrick KANZA ; à Préfina, Brieuc,
Candide, Soan, à Tantine Cendra et à papa Joseph MATANGA.
Nos remerciements s'adressent également à toutes
les personnes qui me sont chères et à tous mes amis : Hauvette
PEZU, Mardochée HAMICI, Benjamin MWENDA, Lucien KALULUA, Robert KIBOKO,
Tharsis KABUNJI, Justin MALANGO, Blandy MWENZE, Blaise MBUYU, Orline KYUMA,
Thassi KIKUNI, Jonathan PAYISAYO, Marc KASAMBAY, Karol Xavier IMWA, Dany
MAZANGA, Toussaint, Sael, Gift, Esther, Tendresse, Tatiana, Christian, Gladys ,
Benita, Merveille, Prisca, Patrick, Lorack, Osé, Kadingi, MWALABA ainsi
qu'à tous ceux qui de loin ou de près ont apportés d'une
manière ou d'une autre une touche à ce travail.
Nos remerciements s'adressent aussi aux salésiens de
DON BOSCO et particulièrement ceux qui nous ont encadrés au sein
de la communauté DON MARIO ZANIN, Père Didace KATELE, Père
Pamphile, Père Jacques S, Frère Thaddée B, Père
Antoine W, Père Dieudonné M, Père Jean-Luc V, Père
Pierre M, Abbé Evariste, merci au Home ZANIN qui nous a donné un
toit, un couvert, un abri durant notre parcourt académique et à
tous ses hôtes pour leurs soutient.

Page | 1
INTRODUCTION GENERALE
Les ressources minérales sont omniprésentes dans
notre quotidien, aussi bien dans la construction, la production
d'énergie ou encore les produits technologiques. Leur importance dans
notre vie n'est plus à démontrer dans notre monde en pleine
évolution technologique. La demande en métal devient de plus en
plus croissante et malheureusement les métaux ne sont plus
trouvés à leur état natif comme il y a des
siècles.
Actuellement les métaux se retrouvent associés
les uns aux autres à des faibles teneures, ce qui rend leurs
utilisations et leurs valorisations impossibles dans ces états. Pour
leurs valorisations on a recours à certains procédés plus
efficaces, respectueux de l'environnement et économiquement rentables,
dans un contexte où le marché des métaux fluctue
fortement. Ces procédés reposent sur deux technologies : la
pyrométallurgie et l'hydrométallurgie mettant en jeux
différentes techniques. L'hydrométallurgie est l'une des
meilleures perceptives pour arriver à cette fin car elle est moins
énergivore et permet de traiter des minerais complexes en
réduisant au maximum les pertes. Elle fait intervenir différents
techniques entre et autre la lixiviation qui fait objet de notre étude
et plus particulièrement pour la valorisation du cuivre.
Plusieurs techniques peuvent se prêter au traitement des
minerais pauvres en cuivre. La lixiviation est un processus simple d'extraction
par dissolution basé sur le fait que tous les minerais ont des
coefficients de dissolution différents et peuvent donc se retrouver
séparer par la circulation d'un solvant et est facilement
réalisable pour des minerais oxydés. Et elle dépend des
différents facteurs et paramètres pour sa bonne
réalisation qui peuvent être évalués ensemble ou
séparément.
Le minerai faisant l'objet de notre travail provenait du
gisement de Kibolwe exploité par la Société d'exploitation
minière du Haut-Katanga (SEMHKAT), minerai cupro-cobaltifère dont
la teneur en cuivre est largement supérieure à celle des autres
métaux présents soit 9,50%. Notre objectif sera d'étudier
l'influence de la granulométrie (taille des particules) sur la
cinétique de lixiviation du cuivre en milieu acide, afin de
déterminer la granulométrie qui donne une meilleure
cinétique et par conséquent son rendement de lixiviation. Pour ce
faire nous proposons de réaliser quatre essais avec 4
granulométries différentes et gardant les autres
paramètres (tels que : le temps de séjours, la densité de
la pulpe, ...) constants.
C'est dans cette optique que notre travail intitulé :
« Influence de la granulométrie sur la cinétique de
lixiviation du minerai oxydé du gisement de Kibolwe. » a
été initié.
Page | 2
Outre l'introduction et la conclusion, ce travail comprend
quatre chapitres qui sont :
? le premier présente une
généralité sur le gisement de Kibolwe et sur la SEMHKAT
qui
l'exploite ;
? le second présente une
généralité sur la lixiviation ;
? le troisième décrit les matériels et
les méthodes à utiliser, et
? le quatrième est focalisé sur la
présentation et l'analyse des résultats obtenus.
Partie I : Partie bibliographique

Page | 3
CHAPITRE I : GENERALITE SUR LE GISEMENT DE
KIBOLWE
ET SUR LA SEMHKAT
I-1. HISTORIQUE :
Mwana Africa est une société panafricaine des
ressources multiples. Les principales opérations et activités
d'exploration de Mwana couvrent l'or, le Nickel et d'autres métaux de
base, ainsi que les diamants au Zimbabwe, en RDC et en Afrique du Sud. Mwana a
été la première entreprise minière détenue
et gérée par des Africains à être coté sur le
marché AIM de Londres. La mine d'or Freda Rebecca de Mwana au Zimbabwe a
atteint son taux de production cible de 50000 onces d'or par an en 2011. En
Février 2012, Mwana a annoncé une ressource minérale
aurifère de 2.01 millions d'onces sur son projet Zani Kodo en
République démocratique du Congo.
La SEMHKAT a pour but l'exploitation du cuivre, du cobalt, du
zinc, du Nickel... Elle a reçu le permis d'exploitation N°740 qui
lui confère le droit exclusif d'effectuer, à l'intérieure
du périmètre défini par l'article 1 de son accord avec
Zhejiang Hailiang Company Limited (Hailiang), les travaux de prospection, de
recherche et d'exploitation des éléments suivants : le Zinc, le
Cobalt, le Nickel et le Cuivre.
I-2. PRESENTATION DU PROJET KIBOLWE
MWANA Africa a dévoilé une impulsion
significative au développement de ses licences de cuivre SEMHKAT avec un
accord de 40 millions de dollars avec un transformateur de cuivre chinois de
classe mondiale.
L'accord conclu avec Zhejiang Hailiang Company lumited
(Hailiang) porte sur les 28 licences SEMHKAT, dans lesquelles Mwana
détient 100% du capital en République Démocratique du
Congo. Hailiang investira 25millions de dollars américains sur un
minimum de quatre ans pour acquérir une participation avec droit de 62%
dans la coentreprise d'exploration.
La société chinoise dispose d'une option
supplémentaire de six mois sur le prospect de Kibolwe, qui, si elle est
exercée, Kibolwe sera transférée à sa propre
société de développement. Mwana y détiendra une
participation non diluable de 40% et Hailiang s'est engagé à
verser 15 millions de dollars supplémentaires dans les 12 mois suivant
le transfert de la licence. Pour les licences SEMHKAT, Hailiang aura le droit
de transférer une licence à une société de
développement à tout moment.
Page | 4
I-3. SIEGE SOCIALE
Le siège social de la SEMHAT se trouve à
Lubumbashi au numéro 207 de l'avenue KASHOBWE, commune de Lubumbashi
dans la province du Haut-Katanga.
I-4. SITUATION GEOGRAPHIQUE DU GISEMENT DE KIBOLWE
Le gisement appartient au polygone minier de la société
d'exploitation minière du Haut-Katanga (SEMHKAT).
Il s'agit d'une ancienne carrière d'exploitation
artisanale, ce polygone est situé au Nord-ouest de la ville de
Lubumbashi à environ 225Km de Lubumbashi et à #177; 100Km de la
ville de Likasi dans le territoire de Kambove et couvre une superficie de
70Km2.
Kibolwe est un gisement stratiforme riche en cuivre
hébergé par des roches minérales, le minéral
oxydé dominant de Kibolwe est la malachite avec des quantités
mineures de cuprite et de ténorite, se produisant dans des calcaires
argileux altérés. Les forages ont délimité des
unités minéralisées à plat près de la
surface jusqu'à 40m d'épaisseur, s'étendant sur une
grève de 1500 m.
Les coordonnées géographiques définissant
cette zone sont les suivantes :
Tableau I- 1: coordonnées géographique du
gisement de Kibolwe
|
Coordonnées géographiques
|
|
Longitude S
|
Longitude E
|
|
11°10'15,2'
|
26°11'28,3»
|
Page | 5
CHAPITRE II : GENERALITE SUR LA LIXIVIATION
L'épuisement progressif des gisements riches et
facilement accessible, ainsi que le besoin croissant en métaux et autre
ressources minérales, et la nécessité d'économiser
l'énergie utilisée a obligé l'industrie minérale
à se diriger vers l'exploitation de gisements plus pauvres, plus
complexes et d'accès plus difficile, l'industrie minérale subit
de fortes pression pour réduire l'impact qu'elle a sur
l'environnement.
Face à ces réalités,
l'hydrométallurgie est à ce jour un des procédés
qui offre actuellement des alternatives et occupe une place importante dans
l'exploitation des minerais à faible teneur en élément
recherché. Elle consiste en une succession d'opération en
solution aqueuse impliquant des réactions chimiques, dont la lixiviation
est la principale étape dans ce type de traitement (BOUKHEMIKHEM
Zahira, 2010).
Ainsi nous rappellerons donc dans ce chapitre les principes de
l'hydrométallurgie et de la lixiviation.
II-1. PRINCIPE ET APPLICATION DE L'HYDROMETALLURGIE
L'hydrométallurgie est un procédé de
production des nombreux métaux. Elle consiste en un ensemble de
transformations chimiques et de processus physiques effectués en
solution aqueuse. Les transformations chimiques sont
caractérisées par l'étape de la lixiviation qui est la
dissolution sélective du métal recherché contenant dans le
minerai et les étapes de purification de cette solution ainsi que
l'élaboration du métal à partir de la solution
purifiée.
L'application de l'hydrométallurgie ne se limite pas
seulement à l'extraction et la purification à partir de jus de
lixiviation des minerais, de métaux tels que le cuivre, le cobalt, le
zinc...
Mais elle s'étend aussi à d'autres domaines comme
:
? le nucléaire ;
? la pétrochimie ;
? l'environnement ;
(BOUKHEMIKHEM Zahira, 2010).
Page | 6
II-2. LA LIXIVIATION
La lixiviation est un processus simple d'extraction par
dissolution basé sur le fait que tous les minerais ont des coefficients
de dissolution différents et peuvent donc se retrouver séparer
par la circulation d'un solvant. Ce principe est mondialement utilisé
pour extraire l'or (le solvant étant majoritairement le cyanure), mais
d'autres métaux comme le cuivre, le cobalt, l'uranium etc. peuvent
être extrait ainsi.
II-2-1. Réactifs de lixiviation
Les réactifs de lixiviation les plus couramment
utilisés sont :
· l'eau : Elle est utilisée pour
la lixiviation des minerais solubles dans l'eau tels que les oxydes et
même les sulfates (NOUIOUA, 2018).
· les acides : Les acides sont
utilisés pour l'attaque de plusieurs constituants parfois d'une
manière sélective. L'acide chlorhydrique, l'acide sulfurique,
l'acide nitrique sont les réactifs les plus utilisé
(NOUIOUA, 2018).
· les bases : Les bases telles
que l'hydroxyde de sodium (NaOH) et l'hydroxyde d'ammonium (NH4OH) sont
utilisées respectivement pour la lixiviation des bauxites ainsi que
celle des minerais de cuivre et de nickel (NOUIOUA, 2018).
· les sels solubles : Le
sulfates ferreux, les chlorures, les carbonates et cyanures de sodium
permettent la lixiviation de certains minerais sulfurés tels que le CuS
(NOUIOUA, 2018).
· les bactéries : Les
microorganismes tels que ; les thiobacillus pour les sulfures des
métaux, les minerais complexes ainsi que pour les roches à faible
teneur en minerai (< 0.4%). On effectue donc une biolixiviation
(NOUIOUA, 2018).
· les gaz dissouts : Le
Dioxyde de soufre, Dichlore, Oxygène sont utilisés par exemple
pour la lixiviation du Zinc (NOUIOUA, 2018).
Page | 7
II-3. TYPE DE LIXIVIATION
Les types de lixiviation sont classés suivant les agents
lixiviant utilisés on distingue : II-3-1. Lixiviation
chimique :
A. Lixiviation acide :
Cette lixiviation est utilisée pour les minerais à
gangue acide, le milieu solvant est
constitué de l'acide.
On distingue dans cette catégorie la lixiviation acide
oxydante et acide réductrice.
? Lixiviation acide oxydante :
Il y a lixiviation oxydante lorsqu'il y a montée
d'état d'oxydation de l'élément dans la solution que dans
le solide. Ce type de lixiviation s'applique aux minerais mixtes (oxyde et
sulfures). L'acide sulfurique est le solvant le plus utilisé. Les
conditions oxydantes peuvent être réalisées par l'air
(oxygène) ou par les ions ferriques présents (provenant des
minerais ou ajoutés intentionnellement).
? Lixiviation acide réductrice :
Dans ces types de lixiviation, la solution lixiviante est
rendue réductrice par un agent réducteur tels que le SO2, le fer
ferreux, le NO2, le metabisulfite de sodium. La réduction permet la
dissolution des oxydes tels que MnO2 et CO2O3 qui ne sont pas solubles dans
l'acide sulfurique dilue (Schlesinger et al, 2011).
B. Lixiviation ammoniacale :
La lixiviation ammoniacale est utilisée pour les
minerais à gangue dolomitique (CaO, MgO) qui se prêtent mal
à une attaque acide. Pour les minerais sulfurés, la lixiviation
ammoniacale se fait en présence d'oxygène comme agent
lixiviation.
C. Lixiviation par cyanuration :
Ce type de lixiviation est appliqué essentiellement au
traitement des métaux précieux. On utilise une solution
diluée de NaCN, KCN, Ca(CN)2 en milieu basique pour éviter
l'hydrolyse du cyanure (The Chemistry of Gold
Extraction,2009).
Page | 8
D. Lixiviation par les chlorures :
Cette lixiviation est utilisée pour les minerais
sulfurés mais l'utilisation de l'acide chlorhydrique est exclue compte
tenu de son prix qui est élevé, cependant on emploie une solution
acide de FeCl3.
E. Lixiviation par la soude caustique :
Cette lixiviation est pour dissoudre les oxydes tels que la
bauxite.
II-3-2. Lixiviation bactérienne :
Elle est utilisée pour la mise en solution des mineras
sulfurés, pauvres et complexes. Les microorganismes comme les
thiobacilles et les ferrobacilles possèdent des propriétés
catalytiques permettant d'augmenter la cinétique de lixiviation.
A. La biolixiviation :
La biolixiviation (appelée aussi lixiviation biologique
ou lixiviation bactérienne) est une technique d'extraction de
métaux à grands intérêts économiques d'une
roche, mettant en jeu des micro-organismes capables de convertir ces
métaux de la forme solide à la forme soluble, qui pourront
ensuite être extraits.
Cette technique est naturelle, économique et important
sur le plan environnemental. Elle s'effectue à des températures
et pressions faibles avec une vitesse de réaction lente, mais leur
inconvénient est l'obtention des solutions diluées.
On a trois catégories des bactéries suivant
qu'elles procèdent à température faible, moyenne où
exagérée sont :
? les bactéries mésophiles largement connus par
leur activité métabolique à température faible et
moyenne (30°C à 35°C) sont Acidithiobacillus ferrooxidans,
Acidithiobacillus thiooxidans, Leptospirillum ferrooxydans (thermotolerant
up to 50°C) et Thiobacillus caldus ;
? les bactéries thermophiles moyenne (biolixiviation de
50°C à 55°C) : Thiobacillus caldus, Sulfobacillus
(tolérant jusqu'à 63°C), Sulfobacillus
thermosulfidooxydans, Sulfobacillus acidophilus et Acidimicrobium ;
? les bactéries thermophiles exagérées
(60°C à 85°C) : Sulfolobus (sulfolobus metallicus,
sulfolobus acidocaldarius), Acidianus brierleyi (DJENETTE EL BAR /
Ep. BOUCHERITTE, 2016).
Aucune mine en RDC n'a eu recours à cette
méthode et sa mise en oeuvre future n'est pas certaine.
Page | 9
B. La biosorption
La biosorption est un terme utilisé pour décrire
tous les processus reliés à la récupération des
métaux en présence des absorbant, qui sont des cellules vivantes
ou morte. La biosorption se fait avec des bactéries active ; lorsque les
interactions métaux-bactéries ses font avec des cellules vivantes
(précipitations, oxydation-réduction, ...), passives ; lorsque
les métaux sont transformés suite à des réactions
physico-chimiques (complexation par des substances produites par les cellules,
absorption du métal sur la paroi cellulaire) (NOUIOUA Asma,
2018).
II-3-4. Technologie de la lixiviation
Une fois que l'agent de lixiviation a été
déterminé, la prochaine étape est le choix du type
d'appareil et de la méthode qui seront utilisés pour effectuer la
lixiviation.
En fonction des critères de choix cités
précédemment, la lixiviation peut être
réalisée selon cinq méthodes différentes :
II-4-1. Lixiviation in-situ:
Cette technique (« in situ leaching » en
anglais) permet d'exploiter des gisements à basse teneur
minérale, stratiformes, encaissés dans des horizons
gréseux perméables et encadrés par des horizons
très peu ou pas perméables (ex. grès rouges à
cuivre ou « red-bed»). A l'aide d'une série de puits
injecteurs et producteurs, une circulation de solution lixiviante (souvent de
l'acide sulfurique ou du carbonate de soude) est établie, permettant
l'attaque du Minerai (Figure II-1). La solution est, par la suite,
récupérée pour la phase de traitement. Le principal
avantage de cette technique est de pouvoir récupérer des
métaux ou minerais de valeur sans avoir recours aux techniques
minières traditionnelles impliquant : explosions, découverture
coûteuse ou infrastructures souterraines. Cette technique a donc une
faible emprise en surface et ne crée aucune verse à
stérile. Toutefois elle présente un risque de contamination des
eaux souterraines (Exploitation minière et traitement des
minerais, février 2017).
Page | 10
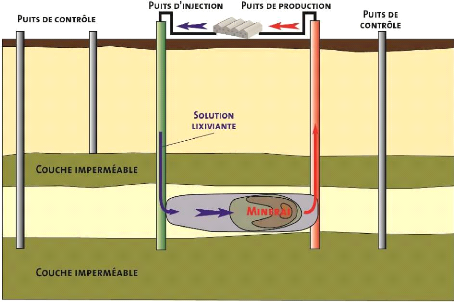
Figure II- 1 : Technique d'exploitation par lixiviation in
situ.
II-4-2. Lixiviation en tas ou lixiviation statique :
Lixiviation en tas (Figure II-2). Préalablement
à la lixiviation en tas, le minerai tout venant ou le minerai
concassé est chargé sur des dépôts (ou tas ou pile)
de 10 à 20 m de hauteur qui sont empilés sur une couche
imperméable. Une solution lixiviante est pulvérisée sur le
tas, se lixivie à travers la pile puis dissout le métal
rechercher. La solution est ensuite dirigée dans un bassin. La solution
lixiviante, qui est dite être « sursaturée » en
métal recherché, est ensuite pompée vers des colonnes
à résine où le métal est
récupéré. Une lixiviation en tas rentable offre un certain
nombre d'avantages, y compris :
? coûts de broyage réduits puisque le minerai est
uniquement concassé non meulé ;
? la solution lixiviante recyclée à travers le
tas, réduisant la quantité de l'agent lixiviant utilisée
dans l'exploitation ;
? processus particulièrement adapté aux minerais
à plus faible teneur et à ceux ayant une teneur
élevée en argile ;
(Exploitation minière et traitement des minerais ;
février 2017).
Page | 11

Figure II- 2 : Lixiviation en tas, mine de nickel en Finlande
(
www.wromp-int.com).
II-4-3. Lixiviation par percolation :
Cette méthode s'applique à des minerais plus
riches (de l'ordre du pour-cent dans le cas du cuivre). Le minerai
concassé est introduit dans des réservoirs dont la partie
inferieur soulevant le lit de minerai joue le rôle de filtre. L'agent de
lixiviation est ajouté continuellement sur la surface minérale,
pouvant percoler à travers le lit lixiviant le minéral
recherché.
La lixiviation par percolation permet une très bonne
utilisation du réactif et fournit une solution clarifiée qui peut
être directement recyclée afin qu'elle s'enrichisse. Elle est
utilisée pour traiter des minerais d'or, de cuivre et d'uranium.
La durée d'un cycle de percolation, en
général, varie de quelques jours à deux semaines, et donc
nettement plus réduite que celle de la lixiviation en tas
(BOUKHEMIKHEM Zahira, 2010).
Page | 12
II-4-4. Lixiviation en réacteur agité :
Etant la méthode la plus employée dans le
traitement des minerais riches ou déchets. Elle peut être
réalisée en continu ou en discontinu, un contre-courant à
plusieurs étages peut être mis en place. Son principe est
basé sur la mise en suspension d'un solide sous forme
pulvérulente, dans une solution de lixiviation. La densité de la
pulpe ainsi produite est fonction du solide traité, du type de solution
employée et de l'agitation.
L'agitation servant principalement à éviter la
sédimentation des particules et permet d'accélérer la
lixiviation et de diminuer le temps de séjour (étant donné
que les réactions de lixiviation sont des réactions
hétérogènes, l'agitation joue un rôle important dans
les phénomènes de transfert de matières) et à bien
disperser les bulles de gaz (si des produits gazeux sont utilisés).
II-4-5. Lixiviation sous pression (en autoclave) :
La technologie des autoclaves, qui fonctionne un peu comme un
gros autocuiseur, est utilisé pour libérer les métaux du
minerai lorsqu'il est difficile de les extraire par d'autres moyens. Dans le
cas des minerais réfractaire, par exemple, que l'on retrouve dans
l'industrie de l'or, du métal peut être présent sous
diverses formes, intégré dans d'autres matériaux ou
associé à d'autres matériaux, ce qui rendra l'extraction
plus complexe. En travaillant dans un environnement sous plus haute pression et
avec des températures plus élevées, il est alors possible
d'obtenir les conditions permettant la lixiviation des métaux
recherchés en une solution en dehors de la matrice du minerai
(
www.snclavali.com/fr-fr/beyond-engineering/under-pressure-and-feeling-the-heat).
II-5. CHIMIE DE LA LIXIVIATION
La lixiviation a pour but de transférer un
élément chimique de la phase solide (minerai) à la phase
aqueuse (solution d'attaque) : elle fait donc intervenir, d'une part, des
phénomènes physiques de transfert, et d'autre part, des
phénomènes chimiques de transformation des espèces
(BOUKHEMIKHEM Zahira, 2010).
Page | 13
II-5-1. Paramètres physiques :
Il est nécessaire de réaliser une bonne mise en
contact des phases solide et liquide. La nature du solide (type de liens
moléculaires, granulométrie, porosité) a une influence
directe sur la surface d'échange et joue un rôle essentiel dans la
cinétique de la mise en solution. Le degré de fractionnement du
minerai est donc un paramètre très important qui dépend de
la méthode de lixiviation utilisée. Le transfert de
l'espèce solubilisée de l'interface Solide-Liquide au sien de la
solution constitue une autre étape importante de la cinétique.
Afin d'accélérer ce phénomène, on réalise
une agitation de la solution (mécanique ou par bullage d'un gaz
comprimé). L'élévation de la température
accélère également le phénomène de transfert
(BOUKHEMIKHEM Zahira, 2010).
II-5-2. Réactions de Lixiviation :
Les procédés hydrométallurgiques font
appel à la libération du métal recherché par
destruction de la matrice chimique le contenant, c'est-à-dire mettent en
jeu des réactions chimiques entre les particules et les réactifs
utilisées en phase liquide. Les réactions de lixiviation sont
classées selon les catégories ci-après
? réaction de solubilisation physique;
? lixiviation par réaction chimique simple.
II-5-2-1. Réaction de solubilisation physique :
Le caractère dipolaire des molécules d'eau
permet à celles-ci d'exercer une attraction sur l'anion et le cation de
l'espèce ionique à dissoudre, formant des hydrates. Si la force
d'hydratation est supérieure à la force qui retient l'anion et le
cation ensemble, ceux-ci passeront dans la solution. Ce type de solubilisation
est utilisé dans le cas de certains sels formés lors des
opérations pyrométallurgiques préliminaires à
l'étape de lixiviation, comme le grillage sulfurant ou chlorurant
NaCl(s) + (n+m)
H2O Na(H2O)n++
Cl(H2O)m- (II-1)
CuSO4 + (n + m)H2O Cu
(H2O)n+
+ SO4(H2O)m2- (II-2)
(BOUKHEMIKHEM Zahira, 2010).
II-5-2-2.Lixiviation par réaction chimique simple
:
La lixiviation d'une espèce solide peut être
accomplie par l'action directe d'un acide, d'une base ou des ions d'un autre
sel. Cette action peut prendre la forme d'une neutralisation,
Page | 14
d'un simple remplacement d'ions ou d'une complexation. Cas de
la lixiviation acide directe, l'objectif est de fournir des ions
??+ (protons). Ce qui mène à
l'utilisation d'acide forts (HCl, H2SO4 ou HNO3). Un cas typique est la
lixiviation des oxydes de cuivre par l'acide sulfurique dilué :
CuO(s) +
2H+ (aq) +
SO2-4(aq)2
Cu2+ (aq) + SO2-4 + H2O
(II-3)
(BOUKHEMIKHEM Zahira, 2010).
II-6. APPROCHE THERMODYNAMIQUE ET CINETIQUE DE
LA
LIXIVIATION
II-6-1. Généralités
Comme mentionnée précédemment la
lixiviation un processus simple d'extraction par dissolution basé sur le
fait que chaque minerais a un coefficient de dissolution différents et
peut donc se retrouver séparer de sa la gangue par la circulation d'un
solvant, et les réactions chimiques mises en oeuvre sont du type
acido-basique et redox.
La thermodynamique chimique est une branche de la chimie
physique qui prévoit sous certaines conditions bien définies :
? la stabilité ou l'instabilité d'un composé
chimique ;
? la possibilité ou l'impossibilité d'une
réaction chimique de se dérouler ;
? le sens dans lequel se déroule la réaction
ainsi que le point d'équilibre que peut atteindre le système
réactionnel (Jacques ILUNGA, 2017)..
II-6-2. Diagrammes de POURBAIX
Aussi appelés sous le nom du diagramme potentiel-pH (ou
E-pH), furent initialement développés par Marcel Pourbaix en
1938. Ils indiquent sur un plan E-pH les domaines d'existence ou de
prédominance des différentes formes (ions, complexe,
précipité, métal) d'un élément. Ils sont
essentiellement basés sur l'équation de Nernst. Ils peuvent faire
apparaitre le domaine de stabilité de l'eau (Wikipédia).
Page | 15
II-6-2-1. Structure des diagrammes de POURBAIX
Le diagramme E-pH d'un élément métallique
fait en général apparaitre trois domaines :
? la zone d'immunité : zone de stabilité
thermodynamique du métal ;
? la zone de corrosion : zone où il y a attaque du
métal avec formation d'ions (libres ou complexe)
? la zone de passivation : zone où la surface du
métal en solution est recourt par une couche d'oxydes ou
d'hydroxydes.
II-6-2-2. Diagramme de POURBAIX de l'eau
L'hydrogène dans la molécule d'eau intervient
comme réducteur dans le couple H+aq/H2 de la
demi-réaction suivante :
2H2O + 2è H2(g)? + 2OH- (II.4)
Ou
2H+ + 2è H2(g)? (II.5)
L'oxygène intervient comme oxydant dans le couple
O2/H2O, de demi-réaction ci-
après :
2H2O ? O2(g) + 4H+ + 4è (II.6)
Les deux demi-réactions peuvent être
effectuées dans une cuve électrolytique connectée à
une source d'énergie à courant continue qui entretien une
différence de potentiel suffisante entre deux électrodes. Si le
potentiel électrique de l'anode est suffisamment positif, l'anode
fournira les électrons nécessaires selon la réaction
d'oxydation (II.6). Si par contre le potentiel électrique de la cathode
est suffisamment négatif, la cathode sera le siège de la
réaction de réduction (II.4 ou II.5). On aura d'un
côté (la cathode) un dégagement d'hydrogène et de
l'autre (Anode) un dégagement d'oxygène.
Les potentiels correspondant à ces deux
demi-réactions, lorsque nous tenons compte de ce que l'eau est
très peu dissociée et lorsque nous admettons que
l'activité de l'eau est égale à l'unité et que la
température est de 298K, peuvent s'écrire respectivement :
Page | 16
E1=E° (H+aq/H2) + 0,06/2.log
[H+]2 (II.7)
E1=E° (H+aq/H2) +0,06.log[H+]
(II.8)
Or nous savons que pH = -log [H+], on aura donc
E1=E°(H+aq/H2) -0,06.pH (II.9)
Et
E2=E°(O2/H2O) +0,06.log[H+]4
(II.10)
E2= E°(O2/H2O) - 0,06pH (II.11)
Par convention, le potentiel de référence
E°(H+aq/H2) du couple H+/H2 est nul à toute
température et le potentiel standard E°(O2/H2O) du couple O2/H2O
vaut 1.23 à pH nul ; les relations (II.9) et (II.11) deviennent
après calcul :
E1= -0,06.???? (II.12)
E2= 1.3 - 0,06. pH (II.13)
Sur la Figure II.3 ci-dessous sont représentés les
graphes des potentiels E1 et E2 qui sont des fonctions linéaires avec le
pH comme variable indépendant.
Les droites obtenues divisent le diagramme en plusieurs domaines
dits d'existence des espèces réactionnelles (Jacques
ILUNGA, 2017).
Page | 17
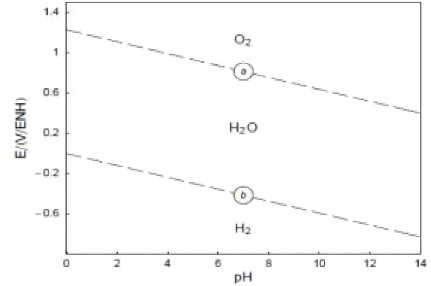
Figure II- 3: Zone de stabilité thermodynamique de
l'eau vis-à-vis des oxydants et des réducteurs.
La Droite (b) correspond à la demi-équation
(II-5) sépare le plan (E-pH) en deux régions. Au-dessus, l'eau
est thermodynamiquement stable vis-à-vis des réducteurs,
au-dessous, elle est instable vis-à-vis d'eux ; de l'hydrogène se
forme.
La droite (b) correspond à la demi-équation
d'oxydation (II.6) sépare également le plan (E-pH) en deux
régions ; au-dessous, l'eau est thermodynamiquement stable
vis-à-vis des oxydants. Au-dessus, elle est instable vis-à-vis
d'eux : de l'oxygène se forme.
Lors de l'étude du comportement d'un
élément métallique vis-à-vis de l'eau, les choses
ont tendance à se compliquer davantage du fait que le dit
élément peut s'oxyder en ions, mais aussi précipiter sous
forme d'hydroxyde en milieu suffisamment basique selon l'équation :
Me + 2OH- Me(OH) + 2è (II.14)
En exploitant tous ces comportements, on peut construire le
diagramme de POURBAIX de tout système réactionnel pour lequel on
connaitrait les différentes espèces participantes et leurs
potentiels standards (Jacques ILUNGA, 2017).
Page | 18
II-6-2-3. Diagramme de POURBAIX du système
Cu-H2O
Dans le diagramme du système cuivre -eau à
25°C, comme illustre à la figure II-4 nous remarquons que le cuivre
sous forme Cu2+ est stable à des pH acides et en milieu
oxydant d'une façon générale, il faudrait des conditions
acides et oxydantes pour rompre l'équilibre afin d'obtenir les ions
cuivriques, les conditions acides sont suffisantes pour se retrouver dans le
domaine de stabilité de Cu2+ (Lauth SANGUYA,
2020).
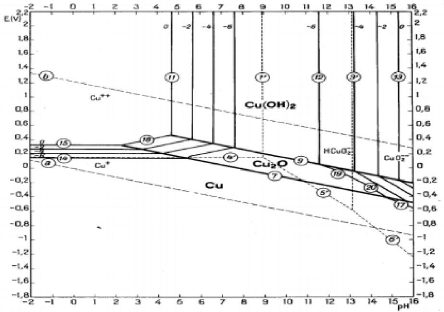
Figure II- 4: Diagramme E-pH du système Cu-H2O
II-7. APPROCHE CINETIQUE DE LA LIXIVIATION
La cinétique a pour objectifs principaux la mesure des
vitesses de réactions et la recherche des facteurs dont elles
dépendent ou qui déterminent leur évolution dans le temps.
Elle permet d'évaluer la durée de transformation qu'on veut
effectuer dans des conditions physico-chimiques déterminées ou de
définir, pour une transformation donnée, les meilleures
conditions opératoires des points de vue technique et économique
(ROGER RUMBU, 2018).
Page | 19
II-7-1. Facteurs influençant la cinétique de
lixiviation
Étant donné le caractère
hétérogène des réactions de lixiviation (plus d'une
phase), la vitesse de réaction peut être influencée par les
facteurs suivants :
s Dimension des particules
Les particules fines permettent une meilleure lixiviation. Alors
que les trop fines particules posent cependant des problèmes lors des
procédés subséquents de séparation Solide-Liquide
(BOUKHEMIKHEM Zahira, 2010).
s Concentration des réactifs
La vitesse de la réaction est favorisée par
l'augmentation de la concentration des agents de lixiviation, quoi qu'une perte
de sélectivité puisse aussi en résulter
(BOUKHEMIKHEM Zahira, 2010).
s Agitation
Étant donné que les réactifs doivent se
rendre à la surface solide pour l'attaquer, les phénomènes
de transfert de matière sont très importants. Les coefficients de
transfert de matière sont fonction du nombre de Reynolds, donc du
degré de turbulence de la suspension, d'où le besoin d'avoir un
bon niveau d'agitation (BOUKHEMIKHEM Zahira, 2010).
s Densité de la pulpe
En général, la vitesse de lixiviation augmente
lorsqu'il s'agit de pulpes diluées. Cependant une telle opération
est plus dispendieuse et elle implique des coûts supplémentaires
lors de la purification de la solution et la récupération du
métal (BOUKHEMIKHEM Zahira, 2010).
s Température
Comme toute réaction chimique, les réactions de
lixiviation sont accélérées par la température
(effet sur la constante cinétique, équation d'Arrhenius).
Cependant, lorsqu'il ya des gaz impliqués dans la réaction, leur
plus grande volatilité oblige à établir un compromis
(BOUKHEMIKHEM Zahira, 2010).
Page | 20
II-8. LE RENDEMENT DE LIXIVIATION
Le rendement de lixiviation est déterminé par
la teneur des solutions de lixiviations et la teneur résiduelle
après traitement :
Mlixivié
R(%) = X 100 (II-15)
Mlixivié+Mrésiduel
La récupération varie avec le temps car au fur
et à mesure que celle-ci avance, moins de matière lixiviable
reste dans le réacteur.
Il est donc important de connaitre l'évolution de la
récupération avec le temps afin de pouvoir décider du
meilleur moment pour arrêter le processus (BOUKHEMIKHEM Zahira,
2010).
II-9. OPERATIONS SUBSEQUENTES A LA
LIXIVIATION
Les solutions de lixiviation contiennent des proportions de
solide variables selon le type d'opération effectuée : faible
dans les jus de lixiviation en tas, importante dans ceux issus de la
lixiviation en réacteurs agités.
Les étapes de séparation Solide-Liquide
constituent une partie essentielle des usines de lixiviation car elles
permettent de séparer la solution riche des résidus solide sans
valeur.
II-9-1. Séparation Solide-Liquide
L'efficacité des procédés
subséquents de purification (extraction par solvant, échange
ionique, etc.) nécessite des solutions exemptes de solide en suspension
et dépend fortement de la présence de l'espèce
recherchée dans la solution d'alimentation. Si le résidu
contienne un minimum de solution de lixiviation, cela signifierait une perte de
métal et une pollution de résidu.
L'obtention de solutions claires requiert des
séparations Solide-Liquide assez complexes et dispendieuses. Le
degré de finesse des particules utilisées dans certaines
opérations de lixiviation ne facilite pas la tâche de
séparation Solide-Liquide en raison de la faible vitesse de
sédimentation de ces particules (BOUKHEMIKHEM Zahira,
2010).
Page | 21
Les techniques de séparation Solide-Liquide principalement
mise en oeuvre sont :
? La décantation :
La décantation est très employée en
industrie, elle permet un fonctionnement en continu des installations. Elle
consiste en un déplacement dans un milieu fluide de particules solides
sous l'action du champ de pesanteur. Les particules solides coulent au fond des
décanteurs sous forme de boues. Cette technique est très
répandue dans les usines d'épuration et de traitement des
eaux.
? La filtration :
Souvent réalisée en continu : Lors de la
filtration, on fait passer la pulpe ou le liquide turbide à travers une
membrane poreuse ou un lit de particules (milieu filtrant) qui retient les
particules solides, laissant par contre passer le liquide (filtrat).
? La centrifugation :
Très rarement mise en oeuvre à l'échelle
industrielle, La centrifugation est largement mise en oeuvre à
l'échelle de laboratoire, son utilisation dans l'industrie est rare du
fait du coût d'entretien élevé et des contraintes
exigées par l'appareillage. Elle consiste à appliquer aux
particules en suspension un champ de forces centrifuges infiniment plus grand
que le champ de pesanteur. La centrifugation permet d'améliorer la
séparation dans les cas délicats (la granulométrie est
faible <50ìm) (BOUKHEMIKHEM Zahira, 2010).
Partie II : Partie expérimentale

Page | 22
CHAPITRE III : MATERIEL ET METHODES
III.1 INTRODUCTION
Ce chapitre présente, le matériel et les
méthodes utilisés lors de nos essais de lixiviation.
III-1. MATERIEL ET APPAREILS
III-1-1. Matériel
Lors de notre travail, nous avons utilisé le
matériel ci-dessous :
· Un bécher de 1000 ml ;
· Un verre à pied de 1000 ml ;
· Des seringues de 10 ml ;
· Deux bassins ;
· Une série des tamis ;
· Des bouteilles en plastiques ;
· Un barreau aimanté ;
· Une fiole gaugée ;
· Un entonnoir ;
· Papier filtre ;
· Une burette ;
· Une brosse.
III-1-2. Appareils
Les appareils que nous avons utilisés sont les suivants
:
· Un agitateur magnétique ;
· Un pH-mètre de marque HANNA;
· Un broyeur à boulet ;
· Une balance électronique ;
· Un chronomètre ;
· Un filtre à vide.
Page | 23
III-2. ECHANTILLONNAGE
III-2-1. Origine de l'échantillon
L'échantillon du minerai sur lequel nous avons
effectué nos essais provient du gisement de KIBOLWE exploité par
la SEMHKAT. Nous l'avons reçu sous forme d'un lot provenant de leur
concasseur que nous avons homogénéisé pour la suite du
travail.
III-2-2. Caractérisation de
l'échantillon
Avant de passer aux essais de lixiviation, la
caractérisation du minerai est très importante car elle permet
d'établir le type de traitement qui conviendrait pour celui-ci.
La caractérisation implique nécessairement des
analyses : chimique, minéralogique, granulométrique,
granulochimique...
III-2-2-1. Caractérisation chimique
Cette caractérisation consiste en une
détermination quantitative et qualitative des éléments qui
constituent l'échantillon à analyser, elle est
réalisée à l'aide d'un spectromètre d'absorption
atomique.
III-2-2-2. Caractérisation minéralogique de
l'échantillon
L'analyse minéralogique est faite dans le but
d'identifier les minéraux constitutifs de l'échantillon du
minerai à traiter, elle est faite au microscope optique.
III-2-2-3. Caractérisation
granulométrique
Cette analyse consiste à déterminer la
répartition granulométrique de l'échantillon
préalablement broyé c'est-à-dire la manière dont
les particules se répartissent du point de vue de leur taille.
III-2-2-4. Procédure expérimentale :
Cette analyse s'est réalisée comme suit :
? peser 2500 g de l'échantillon ;
? tamiser l'échantillon à l'aide d'une
série des tamis (1700, 1400, 1000, 850, 600, 300,
250, 150 et 125, um) ;
? peser les refus de chaque tamis ;
? peser les passants de chaque tamis ;
? calculer le pourcentage des refus et des passants ;
Afin d'évaluer la cinétique de lixiviation nous
avons effectué des prélèvements après chaque 30
minute dès le lancement d'un essai.
Page | 24
· tracer la courbe de répartition
granulométrique.
III-2-2-5. Analyse granulochimique
Cette analyse nous renseigne sur la teneur et la
répartition des éléments constitutifs du minerai dans
différentes tranches granulométriques.
III-2-2-6.Etude de broyabilité
Cette étude a pour but de déterminer le temps
de broyage nécessaire qui correspond à tel pourcentage de passant
ou de refus par rapport à un tamis de référence.
III-2-2-7. Mode opératoire
· peser 300 g du minerai :
· broyer les 300 g à des temps différents
;
· tamiser les 300 g ;
· peser les refus et les passants des 300 g ;
· calculer le pourcentage des refus et des passants ;
· tracer la courbe de broyabilité et
déterminer le temps de broyage nécessaire qui correspond à
tel pourcentage de passant ou de refus.
III-3. ESSAIS DE LIXIVIATION
Le but est de déterminer l'influence qu'a la
granulométrie sur cinétique de lixiviation du minerai de KIBOLWE,
dans le but de déterminer la granulométrie donnant une meilleure
cinétique de lixiviation et par conséquent un bon rendement de
lixiviation.
Nous n'avons varié que la granulométrie et les
autres paramètres sont restés constants,
Nous avons donc utilisé une granulométrie qui
offre 65% de passant et 35% de refus, 70% de passant et 30% de refus, 75% de
passant et 25% de refus, 80% de passant et 20% de refus sur un tamis de
75um.
Et les paramètres qui ont été
fixé sont : le temps de séjours à 2heures, l'acide
sulfurique à 98%, la densité de la pulpe de 1200, la
température (à la température ambiante).
Page | 25
III-3-1. Préparation de la pulpe
III-3-1-1. Calcul de la pulpe pour une densité de
1200
Pour pouvoir connaitre la proportion en solide et en volume
d'eau qui constituerons notre pulpe de densité nous avons
utilisés la relation suivante :
???? x (????-????
(%)s= ????-????) x 100 (III-1)
????
Ms= (%)??x ???? (III-2)
100
Ml= ???? - ???? (III-3)
Avec :
ds: densité de solide ;
dp : densité de la pulpe ;
dl : densité de l'eau ;
Ms : masse du solide à peser en grammes ;
Mp: masse de la pulpe grammes ;
Ml : masse de l'eau grammes ;
(%)s : pourcentage solide.
III-3-2. Mode opératoire pour la lixiviation
Pour conduire nos essais de lixiviation, nous avons
appliqué le mode opératoire ci-dessous :
· peser la masse requise du minerai ;
· prélever la quantité d'eau requise à
l'aide d'un verre à pied de 1000ml
· placer l'eau dans un bécher de 2000ml ;
· placer le bécher sur l'agitateur magnétique
au-dessus duquel est montée la burette sur un statif et mettre un
barreau aimanté dans le bécher ;
· mettre de l'acide sulfurique à une concentration
indiquée dans la burette ;
· plonger l'électrode du pH-mètre dans l'eau
;
· démarrer l'agitateur à la vitesse
d'agitation recommandée ;
Page | 26
· ajouter progressivement de l'acide sulfurique contenu
dans la burette tout en prenant soins de maintenir le pH de consigne (1.5) et
démarrer le chronomètre ;
· Prélever des échantillons après
chaque 30 minute pour analyse afin d'évaluer la cinétique ;
· Poursuivre durant la durée prévue ;
· Arrêter et filtrer sous vide dans l'immédiat
;
· Mesurer le volume du filtrat ;
· Sécher le gâteau à l'étuve
;
· Evaluer la cinétique de lixiviation ;
· Calculer le rendement de lixiviation en fonction du temps
pour chaque granulométrie ;
· Représenter graphiquement la cinétique et
le rendement pour chaque granulométrie.
III-4. CALCUL DES CARACTERISTIQUES HYDROMETALLURGIQUES
? Calcul du rendement de
Le rendement de solubilisation mathématiques
ci-après :
??= ?? = ?? = ?? =
|
lixiviation
d'un métal
???? .????-????.????
.
|
100
peut être calculé par une des expressions
(III-4)
(III-5)
100 (III-6)
(III-7)
|
|
|
|
|
|
Où : ?? : Rendement de solubilisation d'un métal
;
Pm : poids en gramme du minerai à lixivier ;
Pr : Poids en gramme du résidu de lixiviation ;
Cm : Teneur du métal dans le minerai à lixivier
exprimé en [%] ;
Cr : Teneur du métal dans le résidu de lixiviation
exprimé en [%] ;
Page | 27
Cf : concentration en ions du métal exprimée en
gramme par litre de filtrat ; Vf : Volume du filtrat.
> La solubilisation
La solubilisation est la quantité du métal (en
kilogramme) mise en solution pour une tonne de minerai alimenté.
Elle est exprimée par la relation (III-8).
P1*T1 ,P2*??2)
SSol= ( 100 ) l 100
??1
Où :
|
* 1000 en [Kg/ts] (III-8)
|
|
Sol : est la solubilisation en [Kg/tonne de minerai]
P1 : est le poids du matériau sec à lixivier (g)
;
P2 : est le poids du résidu de lixiviation sec (g) ;
T1 : est la teneur de l'élément dans le
matériau à lixivier (%) ;
T2 : est la teneur de l'élément dans le
résidu de la lixiviation (%). > Calcul expérimental de
la vitesse de mise en solution
De manière expérimentale nous avons
évalué la vitesse de la mise en solution en faisant le quotient
de la variation des concentrations entre deux temps donnés lors des
essais sur la différence de ces temps.
???
??= En [g/s??c ?? ?? ???? ???? g/?????? ??
??] (III-9)
???
Où :
· ?? est la vitesse de mise en solution ;
· ??? est la variation de la concentration en [g/l] ;
· ??? est la variation du temps en [s] ou en [minutes]
selon qu'on veut exprimer la vitesse en g.sec-1.l-1 ou en
g.min-1 .l-1.
Page | 28
CHAPITRE IV : PRESENTATION ET ANALYSE DES
RESULTATS
IV-1. INTRODUCTION
Dans ce chapitre, nous présenterons les
résultats obtenus lors de la caractérisation du minerai, et ceux
obtenus aux cours des essais de lixiviation et leur analyse.
IV-2. CARACTERISATION DE L'ECHANTILLON
IV-2-1. Analyse chimique de l'échantillon
Les résultats de l'analyse chimique sont consignés
dans le tableau IV-1.
Tableau IV- 1 : résultats de l'analyse
chimique
|
Cu tot
|
9.50%
|
|
Cu ox
|
8,95%
|
|
Co
|
0,21%
|
|
Fe
|
4,50%
|
|
Mn
|
0,50%
|
|
Al
|
1,06%
|
|
Mg
|
2,10%
|
|
Ca
|
1,11%
|
|
Ni
|
0,01%
|
|
Pb
|
0,50%
|
|
Zn
|
<0,0055%
|
L'examen des résultats du tableau IV-1 montre que
l'échantillon analysé est un minerai cupro-cobaltifère
ayant une teneur de 94.21% de cuivre oxydé et de 5.7% sulfuré
tandis que celle du cobalt est relativement faible soit 0.21%.
Page | 29
IV-2-2. Caractérisation minéralogique
La caractérisation minéralogique a
révélé la présence des minéraux suivants
:
a) Minéraux de valeurs
· Malachite : [Cu2CO3(OH)2]2 ;
· Pseudo malachite : Cu5(PO4)2(OH) 4 ;
· Chrysocole : CuSiO32H2O ;
· Chalcopyrite : CuFeS2 ;
· Hétérogénéité :
aCoO.bCo2O3.H2O.
b) Minéral de la gangue :
· Dolomie : CaCO3.MgCO3.
L'examen des résultats ci-dessus montre que notre
échantillon est un minerai cupro-cobaltifère à gangue
dolomitique. Et le cuivre y est sous forme de malachite, de pseudo malachite,
de chrysocole et de chalcopyrite.
IV-2-3. Caractérisation granulométrique
Les résultats de la caractérisation
granulométrique de notre échantillon sont donnés dans le
Tableau IV-2 ci-dessous. L'analyse de ces résultats montre que
près de 64% des particules minérales ont une dimension
supérieure à 125um.
Page | 30
Tableau IV- 2: Résultats de l'analyse
granulométrique
|
Poids
|
Refus cumulé
|
Passant cumulé
|
Dimension des tamis
um
|
g
|
%
|
%
|
%
|
1700
|
199,2
|
8,47659574
|
8,47659574
|
91,5234043
|
1400
|
88,2
|
3,75319149
|
12,2297872
|
87,7702128
|
1000
|
194,2
|
8,26382979
|
20,493617
|
79,506383
|
850
|
106,6
|
4,53617021
|
25,0297872
|
74,9702128
|
600
|
199,8
|
8,50212766
|
33,5319149
|
66,4680851
|
300
|
393,4
|
16,7404255
|
50,2723404
|
49,7276596
|
250
|
67,4
|
2,86808511
|
53,1404255
|
46,8595745
|
150
|
220,9
|
9,4
|
62,5404255
|
37,4595745
|
125
|
51,5
|
2,19148936
|
64,7319149
|
35,2680851
|
-125
|
828,8
|
35,2680851
|
100
|
0
|
total
|
2350
|
100
|
|
|
|
Page | 31
100
90
80
70
60
50
40
30
20
repartition des passants cumulés (%)
10
0
0 200 400 600 800 1000 1200 1400 1600 1800
Ouverture des tamis (um)
Figure IV- 1 : Courbe de la répartition
granulométrique IV-2-4. Résultats d'étude de
broyabilité
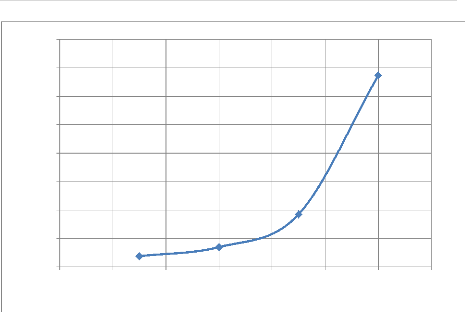
L'étude de broyabilité s'avère
indispensable pour pourvoir trouver les temps des broyages nécessaires
pour avoir les différentes granulométries nécessaires pour
la suite de notre travail.
Nous avons réalisé trois broyages aux temps de
5,10 et 15 minutes et en faisant un tamisage sur un tamis de 75um. Les
résultats obtenus sont donnés dans le tableau IV-3 et
l'illustration graphique sur la figure IV-2.
Tableau IV- 3 : Résultats de l'étude de
broyabilité de l'échantillon
Masse
alimentée
(g)
|
temps (min)
|
masse refus
|
% Refus Cumulé
|
% Passants Cumulé
|
300
|
0
|
140
|
46,66
|
53,33
|
300
|
5
|
90
|
30
|
70
|
300
|
10
|
65
|
21,66
|
78,33
|
300
|
15
|
35
|
11,66
|
88,33
|
|
Page | 32
% Passants Cumulé Refus cumulé(%) Poly. (%
Passants Cumulé )
100
y = -0,06
90
80
70
60
50
40
30
20
10
0
pourcentage passant (refus)
67x2 + 3,2667x + 53,833
R2 = 0,9924
0 2 4 6 8 10 12 14 16
temps (min)
Figure IV- 2 : Courbe de l'évolution de passants et
refus.
L'examen des résultats de la figure IV-2 nous montre que
pour avoir une granulométrie offrant sur un tamis de 75um :
? 65% de passant et 35% de refus il faut broyer le minerai
durant environ 4 minutes ;
? 70% de passant et 30% de refus il faut broyer le minerai
durant environ 6minutes ;
? 75% de passant et 25% de refus il faut broyer le minerai
durant 8 minutes ;
? 80% de passant et 20% de refus il faut broyer le minerai
durant 10 minutes.
Page | 33
IV-3. RESULTATS DES ESSAIS DE LIXIVIATION
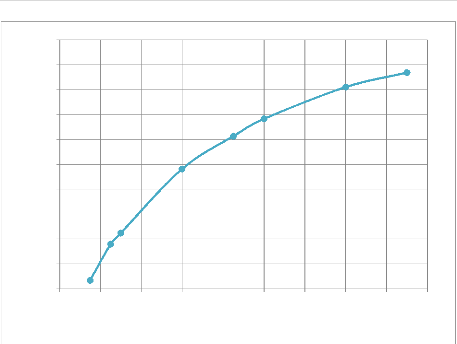
Les essais de lixiviation sont présentés dans
cette partie, ils ont pour objectif de connaitre l'influence de la
granulométrie sur la cinétique de lixiviation et par
conséquent de connaitre la granulométrie qui donne un meilleur
rendement de lixiviation.
Quatre granulométries ont été
étudiées lors de ces essais afin de déterminer
l'interaction entre la cinétique et la granulométrie du minerai
provenant du gisement de Kibolwe. L'acide sulfurique à 98% de
pureté, Le pH, le temps de séjour, la vitesse de rotation ainsi
que le pourcentage des solides ont été maintenus constants mais
nous avons effectué des prélèvements à après
chaque 30 minute durant l'opération.
Les résultats des analyses des gâteaux sont
représentés dans le tableau de l'annexe1.
IV-3-1. Essais de lixiviation
Quatre essais ont été effectués pour
étudier l'influence de la granulométrie sur la cinétique
de lixiviation. Les résultats de ces essais sont consignés dans
les tableaux et illustrés aux figures ci-dessous, en premier des
résultats individuels par granulométrie et en second lieu des
résultats globaux.
IV-3-2. Essai de lixiviation avec 65 % de passant
Conditions opératoires :
· temps : 2heures ;
· pH : 1,5 ;
· vitesse d'agitation : 700 tr/min ;
· masse alimentée : 317,66 grammes ;
· volume d'eau : 882 ml ;
· volume d'acide : 21,1 ml ;
· teneur du cuivre dans cette granulométrie :
8.57%.
IV-3-2-1. Résultats de l'essai de lixiviation
avec une granulométrie offrant 65% de passant Les tableaux
IV-5 et IV-6 et les figures IV-3 ; IV-4 et IV-5 présentent les
résultats de l'essai réalisé avec 65% de passant sur tamis
de 75um.
Figure IV- 3 . Courbe d'évolution exprimant la
cinétique de lixiviation du cuivre avec 65% de passant
Page | 34
Tableau IV- 4 . Résultats de lixiviation avec 65% de
passant
Temps (min)
|
30
|
60
|
90
|
120
|
Rendement de lixiviation
|
74,75
|
75,39
|
77,69
|
87,48
|
Cuivre mis en solution (g/L)
|
17,91
|
20,35
|
20,41
|
20,81
|
Solubilisation
|
|
|
|
75.27
|
|
Tableau IV- 5 . Variation de la vitesse d'extraction
Variation du temps en min
|
De 0 à 30
|
De 30 à 60
|
De 60 à 90
|
De 90 à 120
|
Vitesse d'extraction en
g.l-1.min-1
|
0,597
|
0,081
|
0,002
|
0,013
|
|
Concentration du Cu en g L-1
25
20
15
10
5
0
0
17,91
20,34

20,40

20,80
0 10 20 30 40 50 60 70 80 90 100 110 120 130
Temps en minutes
Figure IV- 5 : Courbe de la variation de la vitesse de mise
en solution du cuivre
Page | 35
90
88
Rendement de lixiviation en %
86
84
82
80
78
76
74
74,75
75,39
77,69
87,48
0 20 40 60 80 100 120 140
Temps (min)
Figure IV- 4 : Courbe d'évolution du rendement de
lixiviation avec 65% de passant
0,7
0,6
Vitesse d'extraction en g L-1
min-1
0,5
0,4
0,3
0,2
0,1
0
0
-0,1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,597
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,081
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,002
|
|
0,013
|
|
0 20
|
|
40
|
60
80
|
|
100
|
120
14
|
|
Temps en min
Page | 36
L'analyse des résultats des tableau IV-5 ; IV-6et des
Figures IV-3, IV-4 et IV-5 nous montre que la cinétique de mise en
solution varie avec le temps, elle est relativement grande dans les 30
premières minutes et diminuent au fur et à mesure que
l'opération continue ; soit avec une mise en solution de 17.9 g/L de
cuivre durant les 30 premières minutes, tandis qu'à 60 minutes la
concentration du cuivre dans la solution est de 20.34 g/L sois 2.44 g/L de
cuivre seulement sont passées en solution durant la deuxième
demi-heure de l'opération, durant la troisième demi-heure
seulement 0.06 g/L de cuivre sont passés en solution et la
quatrième demi-heure seul 0.40 g/L sont passés en solution ce qui
nous a permis d'atteindre un total de 20.80 g/l à deux heures de
lixiviation. Ce qui nous permet d'affirmer qu'avec une granulométrie
offrant 65% de passant de notre minerai sur un tamis de 75um la
cinétique de lixiviation est relativement grande durant les 30
premières minutes et elle diminue avec le temps et tend à devenir
statique. Cette décroissance peut s'expliquer par la diminution du
cuivre soluble dans notre réacteur. Le rendement de mise en solution
quant à lui augmente avec le temps, il part de 74.75% à 30
minutes et augmente jusqu'à atteindre 87.48% à 2heures de notre
opération. Tout comme la cinétique la vitesse diminue avec le
temps elle part de 0.597
g.L-1.min-1 durant les
30 premières minutes à 0.013
g.L-1.min-1 durant la
quatrième demi-heure elle est aussi fonction de la quantité du
cuivre mis en solution et du temps.
IV-3-3. Essai de lixiviation avec 70 % de passant
Conditions opératoires :
· Temps : 2heures ;
· pH : 1,5 ;
· vitesse d'agitation : 700 tr/min ;
· masse alimentée : 317,66 grammes ;
· volume d'eau : 882 ml ;
· volume d'acide : 27 ml ;
· teneur du Cuivre dans cette granulométrie :
8.799%.
IV-3-3-1. Résultats de l'essai de lixiviation avec
une granulométrie offrant 70% de passant
Les tableaux IV-7 ; IV-8 présente les résultats
de l'essai réalisé avec 70% de passant sur tamis de 75um lesquels
sont représentés dans les Figures IV-6, IV-7 et IV-8
successivement celle de l'évolution de la cinétique d'extraction,
celle du rendement de lixiviation et celle de la vitesse de mise en
solution.
Page | 37
Tableau IV- 6. Résultats de lixiviation avec 70% de
passant
Temps (min)
|
30
|
60
|
90
|
120
|
Rendement de lixiviation en %
|
74,305432
|
79,466758
|
81,902887
|
82,6412092
|
Cuivre mis en solution (g/L)
|
18,2337
|
20,4745
|
22,7728
|
24,8796
|
solubilisation
|
|
|
|
74,3412114
|
|
Tableau IV- 7 . Variation de la vitesse d'extraction
Variation du temps en min
|
De 0 à 30
|
De 30 à 60
|
De 60 à 90
|
De 90 à 120
|
Vitesse d'extraction en
g.L-1.min-1
|
0,608
|
0,075
|
0,077
|
0,070
|
|
|
|
|
|
|
|
|
|
|
|
20,4745
|
|
22,7728
|
24,8796
|
|
18,2337
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0
|
|
|
|
|
|
|
|
0 20 40 60 80 100 120 140
temps en min
30
0
25
20
15
10
5
Concentration du Cu en g L-1
Figure IV- 6 . Courbe d'évolution exprimant la
cinétique de lixiviation du cuivre avec 70% de passant
Figure IV- 8: Courbe de la variation de la vitesse de
mise en solution du cuivre avec 70% de passant
Page | 38
0 20 40 60 80 100 120 140
Temps en minutes
Rendement de lixiviationen %
84
74,30543244
79,46675759
81,90288669
82,64120923
73
83
82
81
80
79
78
77
76
75
74
Figure IV- 7: Courbe d'évolution du rendement de
lixiviation avec 70% de passant
0,7
Vitesse d'extractionen g L-1
min-1
0,6
0,5
0,4
0,3
0,2
0,1
0
0 20 40 60 80 100 120 140
Temps en min
Page | 39
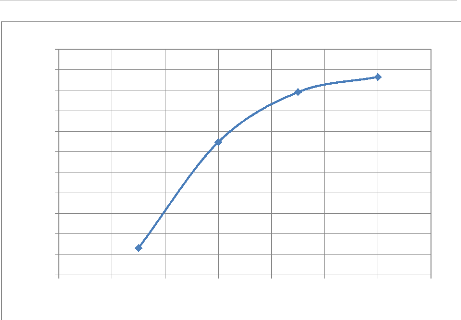
L'analyse des résultats des tableaux IV-6 ; IV-7 et
des figures IV-6 ; IV-7 ; IV-8 nous montre que comme pour le cas
précédent la mise en solution est grande dans les 30
premières minutes et elle décroit en fonction du temps à
la seule différence que les concentrations du cuivre misent en solution
sont supérieures à celles eut avec la granulométrie
offrant 65% de passant respectivement 18.23g/L à 30 minutes, 20.47 g/L
à 60 minutes, 22.77 g/L à 90 minutes et 24.87 g/L à 120
minutes. Tandis que son rendement est inférieur à celui du cas
précédent et part de 74.30% à 30 minutes et atteint 82.64%
à la fin de l'opération sois à deux heures. La vitesse
d'extraction quant à elle est de 0.608
g.L-1min-1durant la
première demi-heure et reste à peu près constant durant le
reste de l'opération soit à 0.07
g.L-1min-1.
IV-3-3. Essai de lixiviation avec 75 % de passant
Conditions opératoires :
· temps : 2heures ;
· pH : 1,5 ;
· vitesse d'agitation : 700 tr/min ;
· masse alimentée : 317,66 grammes ;
· volume d'eau : 882 ml ;
· volume d'acide : 34.7 ml ;
· teneur du Cuivre dans cette granulométrie :
8.9583%.
IV-3-3-1. Résultats de l'essai de lixiviation
avec une granulométrie offrant 75% de passant Les tableaux
IV-9 ; IV-10 et les figures IV-9 ; IV-10 et IV-11 ci-dessous présentent
les résultats obtenus au court et après de cet essai.
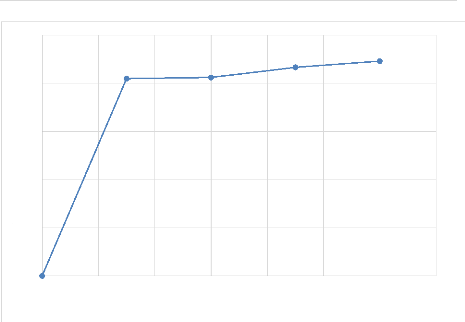
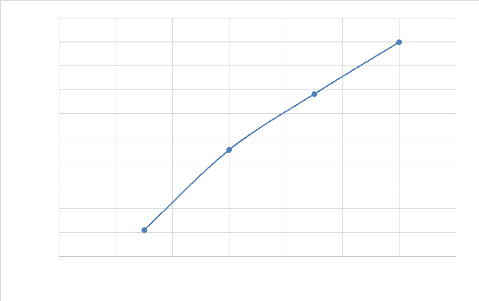
Tableau IV- 8. Résultats de lixiviation avec 75% de
passant
|
Temps (min)
|
30
|
60
|
90
|
120
|
|
Rendement de lixiviation (%)
|
67.107933
|
70.465443
|
72.809629
|
74.989116
|
|
Cuivre mis en solution (g/L)
|
20,4849
|
20,6074
|
21,6577
|
22.3071
|
|
solubilisation
|
|
|
|
69,0003323
|
Tableau IV- 9 . Variation de la vitesse d'extraction
|
Variation du temps en min
|
De 0 à 30
|
De 30 à 60
|
De 60 à 90
|
De 90 à 120
|
|
Vitesse d'extraction en
g.L-1.min-1
|
0,68283
|
0,00408
|
0,03501
|
0,02165
|
Figure IV- 10 : Courbe d'évolution du rendement de
lixiviation avec 75% de passant
Page | 40
25
20,4849
21,6577
22,3071
20,6074
20
Concentration Cu en g/L
15
10
5
0
0 20 40 60 80 100 120 140
Temps en min
76
75
74
73
72
71
70
69
68
67
Rendement de lixiviation en %
66
72,8096
70,4654
67,1079
74,9891
0 20 40 60 80 100 120 140
Temps en min
Figure IV- 9 : Courbe d'évolution de la
cinétique de lixiviation du cuivre avec 75% de passant
Page | 41
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,68283
|
|
|
|
|
|
|
|
|
|
|
|
0,00408
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,03501
|
|
0,02165
|
|
|
|
|
|
0
|
|
20
40
|
|
|
80
|
100
|
|
120
14
|
|
60
|
Temps en min
0
-0,1
0,8
0,7
0,6 0,5 0,4 0,3 0,2
Vitesse d'extraction en g
L-1min-1
0,1
Figure IV- 11 : Courbe de la variation de la vitesse de mise
en solution du cuivre avec 75% de passant
L'analyse des résultats des tableaux IV-8 ;IV-9 et des
figures IV-9 ; IV-10 et IV-11 ci-dessus nous montre que durant le 30
premières minutes la cinétique de lixiviation soit 20.48 g/L
à cet instant et elle décroit avec le temps sois 20.60 g/L
à 60 minutes, 21.65 g/L à 90 minutes et 22.30 g/L à la fin
de l'opération soit à 120 minute nous pouvons expliquer cette
décroissance par le fait que plus l'opération continue plus le
cuivre sous forme soluble diminue dans notre minerai alimenté et ceci
peut continuer jusqu'à ce que la cinétique deviennent constante
après un temps donné et le rendement durant cet essai a
varié de 67.10% à 30 minutes, 70,46 à 60 minutes, 72,80
minutes et atteint 74.98% à la fin de l'essai. Tout comme le montre la
courbe de la Figure IV-12 la vitesse de mise en solution est grande durant les
trente premières minutes sois 0.682 g L-1min-1 et
décroit considérablement durant le reste de l'opération
soit 0,00408 g L-1 min-1 durant la deuxième
demi-heure, 0,03501 g L-1min-1 durant la troisième
demi-heure et atteint les 0,02165 g
L-1min-1 durant la quatrième
demi-heure.
IV-3-4. Essai de lixiviation avec 80 % de passant
Conditions opératoires :
? temps : 2heures ;
? pH : 1,5 ;
? vitesse d'agitation : 700 tr/min ;
? masse alimentée : 317,66 grammes ;
? volume d'eau : 882 ml ;
Figure IV- 12 . Courbe d'évolution de la
cinétique de lixiviation du cuivre avec 80% de passant
Page | 42
? volume d'acide : 25,1 ml ;
? teneur du Cuivre dans cette granulométrie : 9.32%.
IV-3-4-1. Résultats de l'essai de lixiviation avec
une granulométrie offrant 80% de passant
Les résultats de l'essai effectué avec 80% de
passant sont présentés dans les Tableaux IV-11 ; IV-12 et les
Figures IV-12 ; IV-13 et IV-14.
Tableau IV- 10 . résultats de lixiviation avec 80% de
passant
|
Temps en min
|
30
|
60
|
90
|
120
|
|
Evolution du Rendement en %
|
71,8591201
|
77,0359978
|
77,9143240
|
81,3666845
|
|
Cuivre mis en solution (g/L)
|
19,8052
|
21,8432
|
22,9835
|
24,5528
|
|
solubilisation
|
|
|
|
80,1452826
|
Tableau IV- 11 . Variation de la vitesse d'extraction
|
Variation du temps en min
|
De 0 à 30
|
De 30 à 60
|
De 60 à 90
|
De 90 à 120
|
|
Vitesse d'extraction en
g.L-1.min-1
|
0,660
|
0,068
|
0,038
|
0,052
|
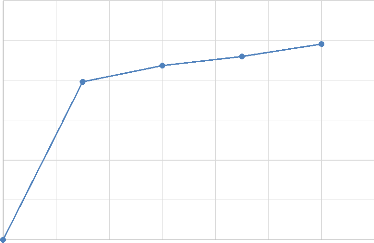
0
19,8052
21,8432
22,9835
24,5528
30
25
20
15
10
5
Concentration du Cuivre en g/L
0
0 20 40 60 80 100 120 140
Temps en min
Page | 43
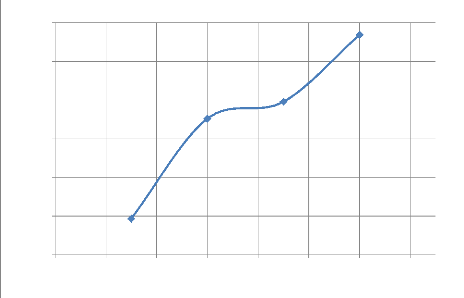
Rendement de lixiviation en %
82
80
78
76
74
72
70
0 20 40 60 80 100 120 140
71,85912017
Temps en min
77,03599785
77,91432403
81,36668455
Figure IV- 13 : Courbe d'évolution du rendement de
lixiviation avec 80% de passant
|
Vitesse d'extraction en g/L min
|
0,7 0,6 0,5 0,4 0,3 0,2 0,1
0
|
Figure IV- 14 : Courbe de la variation de la vitesse de
mise en solution du cuivre avec 80% de passant
0 20 40 60 80 100 120 140
Temps en min
Page | 44
L'analyse des résultats des Tableaux IV-11 ; IV-12et
des Figures IV-12 ; IV-13 et IV-14 nous montres que la cinétique de
lixiviation varie de manière croissante et décroissante à
des temps différents ce qui peut s'expliquer par le fait que la
variation de la concentration du cuivre dans la solution de lixiviation
évolue en fonction du temps. Durant les 30 premières minutes on a
pu extraire 19.8 g/L de cuivre, 2.038 g/L durant la deuxième demi-heure,
1.1403 g/L durant la troisième demi-heure et 1.5693 g/L. le rendement
quant à lui contrairement à la cinétique ne varie que de
manière croissante soit 71.85% après la première
demi-heure, 77.03% après la deuxième, 77.91 après la
troisième et 81.36% après la dernière demi-heure de notre
essai. Tout comme la cinétique la vitesse d'extraction croit durant les
30 premières minutes soit avec une vitesse d'extraction d'environ 0.660
g L-1min-1 ;
durant la deuxième demi-heure elle décroit
jusqu'à atteindre 0.068 g
L-1min-1 ;
durant la troisième demi-heure elle atteint les
0.038g.L-1min-1et
durant la dernière demi-heure de notre essai elle croit encore de peu
par rapport à celle de la troisième demi-heure et atteint les
0.052 g
L-1min-1.
IV-4. RESULTATS DES QUATRE ESSAIS
Tableau IV- 12 : variation de la concentration en fonction du
temps
|
Granulométrie
(%passant sur
un tamis
de
75um)
|
Concentration du cuivre en g/L
|
|
Temps de prélèvement (min)
|
|
30
|
60
|
90
|
120
|
|
65%
|
17,91
|
20,35
|
20,41
|
20,81
|
|
70%
|
18,2337
|
20,4745
|
22,7728
|
24,8796
|
|
75%
|
20,4849
|
20,6074
|
21,6577
|
21,6577
|
|
80%
|
19,8052
|
21,8432
|
22,9835
|
24,5528
|
Tableau IV- 13 : Résultats du rendement de lixiviation
en fonction du temps
|
Granulométrie
(%passant sur
un tamis
de
75um)
|
Rendement de lixiviation (%)
|
|
Temps de prélèvement (min)
|
|
30
|
60
|
90
|
120
|
|
65%
|
74,75
|
75,39
|
77,69
|
87,48
|
|
70%
|
74,30
|
79,46
|
81,90
|
82,64
|
|
75%
|
67.10
|
70.46
|
72.80
|
74.98
|
|
80%
|
72,39
|
77,47
|
78,33
|
81.36
|
Page | 45
Tableau IV- 14 : variation des vitesses de quatre
essais
|
Granulométrie
(%passant sur
un tamis
de
75um)
|
Vitesse d'extraction en g.L-1.min-1
|
|
Variation du temps de prélèvement (min)
|
|
De 0 à 30
|
De 30 à 60
|
De 60 à 90
|
De 90 à 120
|
|
65%
|
0,597
|
0,081
|
0,002
|
0,013
|
|
70%
|
0,608
|
0,075
|
0,077
|
0,070
|
|
75%
|
0,68283
|
0,00408
|
0,03501
|
0,02165
|
|
80%
|
0,660
|
0,068
|
0,038
|
0,052
|
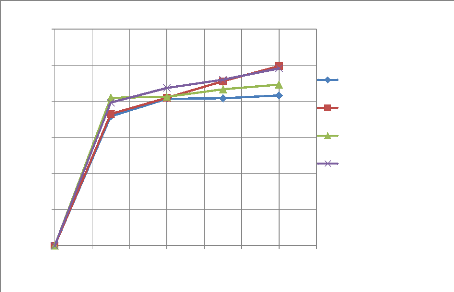
Concentration en g/L
30
25
20
15
10
0
5
0 20 40 60 80 100 120 140
Temps en minutes
24,8796
24,5528
22,3071
20,81
Courbe cinétique avec 65% de passant
Courbe cinétique avec 70% de passant
Courbe cinétique avec 75% de passant
Courbe cinétique avec 80% de passant
Figure IV- 15 : courbes cinétiques des quatre
essais
Page | 46
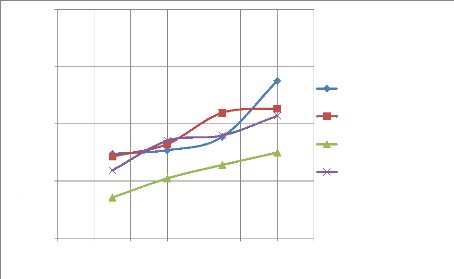
Rendement de lixiviation en %
100,00
90,00
80,00
70,00
60,00
0 20 40 60 80 100 120 140
Temps en %
Rendement avec 65% de passant Rendement avec 70% de passant
Rendement avec 75% de passant Rendement avec 80% de passant
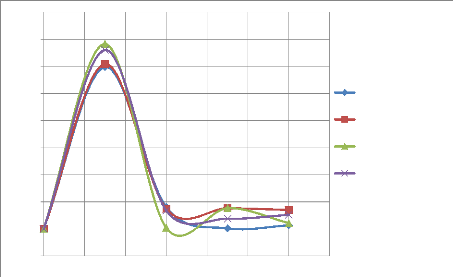
0,8
0,7
0,6
-0,1
0
0,1
0,2
0,3
0,4
0,5
Vitesse d'extraction en
g.L-1.min-1
Temps en minutes
Variationde la vitesse avec 65% de passant
Variationde la vitesse avec 70% de passant
Variationde la vitesse avec 75% de passant
Variationde la vitesse avec 80% de passant
0 20 4
0 60 8
0 100 120 140
Figure IV- 17 . courbes des Variations de lixiviation des
vitesses d'extraction
Figure IV- 16 . courbe d'évolution des rendements des
4 essais
Page | 47
Durant les essais cinétiques nous avons
constatés que durant les premières demi-heures des quatre essais
la granulométrie ayant 75% a donné le meilleur résultat,
soit 20.4849g/L de cuivre, suivi de celle ayant 80% de passant 19.8052g/L de
cuivre, et pour la granulométrie ayant 70% de passant 18.2337 g/L de
cuivre et enfin la granulométrie ayant 65% de passant a fait passer en
solution 17.91 g/L de cuivre ; et la cinétique de lixiviation a
varié comme le montre le tableau IV-9 et la figure IV-15 jusqu'à
atteindre à la fin de nos essais 24.879 g/L de cuivre en 120 minutes
avec la granulométrie offrant 70% de passant, 24.5528g/L de cuivre en
120 minutes avec la granulométrie offrant 80% de passant, 22.3071g/l de
cuivre en 120 minutes avec la granulométrie offrant 75% de passant et
20.81 g/L de cuivre en 120 minutes avec la granulométrie offrant 65% de
passant.
Tandis qu'en comparant les rendements de lixiviation nous nous
rendons compte que c'est la granulométrie offrant 65% de passant donne
un meilleur rendement après un temps de séjours de 2 heures soit
87.48%, 82.64% pour la granulométrie ayant 70% de passant, 81.36% pour
la granulométrie ayant 80% de passant et 74.98% pour la
granulométrie ayant 75% de passant.
Page | 48
Conclusion générale et perspectives
L'objectif poursuivi dans ce travail était de
déterminer l'influence de la granulométrie sur la
cinétique de lixiviation du minerai de KIBOLWE provenant du concasseur
de SEHMKAT ayant une teneur de 9.50% en cuivre, ce qui permettrait de
déterminer la granulométrie optimale pour le traitement de ce
minerai par lixiviation si cette option sera envisagée.
Pour ce faire, quatre essais ont été
réalisés avec des granulométries différentes mais
en gardant constant le pH, la densité de la pulpe, la concentration de
l'agent lixiviant, le temps de séjour et la vitesse d'agitation, La
première série d'essais avec une granulométrie offrant 65%
des passant sur un tamis de 75um ; la deuxième avec une
granulométrie offrant 70% des passant sur un tamis de 75um ; la
troisième avec une granulométrie offrant 75% des passant sur un
tamis de 75um et la quatrième a été effectuée avec
une granulométrie offrant 80% des passant sur un tamis de 75um.
Les meilleurs résultats cinétiques sont ceux
obtenus avec la granulométrie offrant 70% de passant qui ont
donné une extraction de 24.8796 g/L de cuivre en 120 minutes avec un
rendement de lixiviation de 82.64% et une solubilisation de 74.34 kg de cuivre
par tonne de minerai.
Au regard des résultats obtenus dans ce travail, nous
nous proposons d'orienter la poursuite des travaux additionnels de la
manière suivante :
Du point de vue technique, nous proposons que des
études soient menées en augmentant le temps de séjour, en
variant la vitesse d'agitation et en variant la densité de la pulpe afin
de pouvoir améliorer tant soit peu le rendement de lixiviation.
Et du point de vue étude cinétique, nous
proposons que des études plus approfondies soient menées afin de
pouvoir déterminer un mécanisme réactionnel,
déterminer l'ordre des réactions qui se produisent lors de cette
opération afin de pouvoir la modéliser.
Page | 49
REFERENCES BIBLIOGRAPHIQUES
1. RUMBU, R. (2018). Métallurgie
Générale (éd.1). 2RA
2. Marsden, O. & House, C. (2009), The
chimistry of gold extraction (éd. 2). SME.
3. BOUKHEMIKHEM, Z. (2010),
Récupération du nickel et du manganèse dans les
effluents industriels, Mémoire, Université des sciences et
de la technologie HOUARI BOUMEDIENE, Algérie.
4. Djenette, E. (2016), Lixiviation du
Minerai du Zinc de Chabert El Hamra et Extraction Sélective des
Métaux par la Salicylidèneaniline, thèse,
Université Mohamed Khider-Biskra, Algérie.
5. Schlesinger , M., King, M., Sole, K., &
Davenport, W. (2011). EXTRACTIVE METALLURGY OF COPPER (éd.
5). ELSEVIER.
6. Asma, N. (2018), Lixiviation et
extraction du fer à partir de la roche ferrique de la mine de l'ouenza,
Thèse, Université Mohamed Khider - Biskra,
Algérie.
7. Poulard F., Daupley X., Didier C., Pokryska Z.,
D'Hugues P., Charles N., Dupuy J.-J., Save M. (2017), -
Exploitation minière et traitement des minerais. Collection
« La mine en France ». Tome 6.
8. Paul, P. (2021), Optimisation des
paramètres de lixiviation d'un minerai mixte cuprocobaltifère cas
du gisement de KAPULO), Mémoire G3, Université technologique
KATUMBA MWANKE, RDC.
9. Jacques, I. (2017), Etude du comportement
d'un minerai mixte à la lixiviation en tank agité et
décantation avec floculation au flomin » Cas du Black Shale de
l'entreprise MMG KINSEVERE, Mémoire, Université de Likasi,
RDC.
10. Lauth, S.(2020), Optimisation des
quelques paramètres de lixiviation del a
trancheinférieureà75um du remblai MG2 (cas du minerai de la
carrière de KIBOLWE), Mémoire, Université de
Lubumbashi, RDC.
11. Under Pressure and feelin the
Heat-SNC-Lavalin. Disponible sur ;
http://www.snclavali.com/fr-fr/beyond-engineering/under-pressure-and-feeling-the-heat.
[Page consultée le 24-10-2021 à 10h].
12. diagramme de Pourbaix, Wikipedia.
Disponible sur :
http://Fr.m.wikipedia.org/wiki/Diagramme_de_Pourbaix.
[page consultée le 21-01-2022 à 16h].

Page | 1
ANNEXES
Annexe 1. : Résultats des analyses des
gâteaux
|
Granulométrie
(%passant sur un
tamis de 75um)
|
Temps de prélèvements
|
|
30
|
60
|
90
|
120
|
|
65%
|
2,338375
|
2,260865
|
2,94657
|
2,62273
|
|
70%
|
2,398645
|
1,80672
|
2,645795
|
2,140245
|
|
75%
|
2,11923
|
1,592365
|
2,435795
|
2,058385
|
|
80%
|
1,189235
|
1,5274
|
2,24055
|
1,736625
|



