II-6-1. Généralités
Comme mentionnée précédemment la
lixiviation un processus simple d'extraction par dissolution basé sur le
fait que chaque minerais a un coefficient de dissolution différents et
peut donc se retrouver séparer de sa la gangue par la circulation d'un
solvant, et les réactions chimiques mises en oeuvre sont du type
acido-basique et redox.
La thermodynamique chimique est une branche de la chimie
physique qui prévoit sous certaines conditions bien définies :
? la stabilité ou l'instabilité d'un composé
chimique ;
? la possibilité ou l'impossibilité d'une
réaction chimique de se dérouler ;
? le sens dans lequel se déroule la réaction
ainsi que le point d'équilibre que peut atteindre le système
réactionnel (Jacques ILUNGA, 2017)..
II-6-2. Diagrammes de POURBAIX
Aussi appelés sous le nom du diagramme potentiel-pH (ou
E-pH), furent initialement développés par Marcel Pourbaix en
1938. Ils indiquent sur un plan E-pH les domaines d'existence ou de
prédominance des différentes formes (ions, complexe,
précipité, métal) d'un élément. Ils sont
essentiellement basés sur l'équation de Nernst. Ils peuvent faire
apparaitre le domaine de stabilité de l'eau (Wikipédia).
Page | 15
II-6-2-1. Structure des diagrammes de POURBAIX
Le diagramme E-pH d'un élément métallique
fait en général apparaitre trois domaines :
? la zone d'immunité : zone de stabilité
thermodynamique du métal ;
? la zone de corrosion : zone où il y a attaque du
métal avec formation d'ions (libres ou complexe)
? la zone de passivation : zone où la surface du
métal en solution est recourt par une couche d'oxydes ou
d'hydroxydes.
II-6-2-2. Diagramme de POURBAIX de l'eau
L'hydrogène dans la molécule d'eau intervient
comme réducteur dans le couple H+aq/H2 de la
demi-réaction suivante :
2H2O + 2è H2(g)? + 2OH- (II.4)
Ou
2H+ + 2è H2(g)? (II.5)
L'oxygène intervient comme oxydant dans le couple
O2/H2O, de demi-réaction ci-
après :
2H2O ? O2(g) + 4H+ + 4è (II.6)
Les deux demi-réactions peuvent être
effectuées dans une cuve électrolytique connectée à
une source d'énergie à courant continue qui entretien une
différence de potentiel suffisante entre deux électrodes. Si le
potentiel électrique de l'anode est suffisamment positif, l'anode
fournira les électrons nécessaires selon la réaction
d'oxydation (II.6). Si par contre le potentiel électrique de la cathode
est suffisamment négatif, la cathode sera le siège de la
réaction de réduction (II.4 ou II.5). On aura d'un
côté (la cathode) un dégagement d'hydrogène et de
l'autre (Anode) un dégagement d'oxygène.
Les potentiels correspondant à ces deux
demi-réactions, lorsque nous tenons compte de ce que l'eau est
très peu dissociée et lorsque nous admettons que
l'activité de l'eau est égale à l'unité et que la
température est de 298K, peuvent s'écrire respectivement :
Page | 16
E1=E° (H+aq/H2) + 0,06/2.log
[H+]2 (II.7)
E1=E° (H+aq/H2) +0,06.log[H+]
(II.8)
Or nous savons que pH = -log [H+], on aura donc
E1=E°(H+aq/H2) -0,06.pH (II.9)
Et
E2=E°(O2/H2O) +0,06.log[H+]4
(II.10)
E2= E°(O2/H2O) - 0,06pH (II.11)
Par convention, le potentiel de référence
E°(H+aq/H2) du couple H+/H2 est nul à toute
température et le potentiel standard E°(O2/H2O) du couple O2/H2O
vaut 1.23 à pH nul ; les relations (II.9) et (II.11) deviennent
après calcul :
E1= -0,06.???? (II.12)
E2= 1.3 - 0,06. pH (II.13)
Sur la Figure II.3 ci-dessous sont représentés les
graphes des potentiels E1 et E2 qui sont des fonctions linéaires avec le
pH comme variable indépendant.
Les droites obtenues divisent le diagramme en plusieurs domaines
dits d'existence des espèces réactionnelles (Jacques
ILUNGA, 2017).
Page | 17
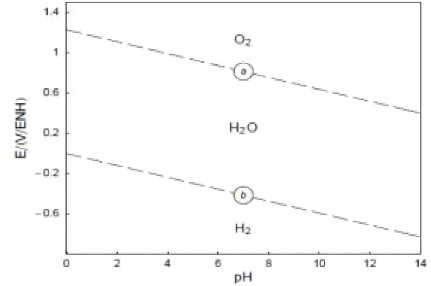
Figure II- 3: Zone de stabilité thermodynamique de
l'eau vis-à-vis des oxydants et des réducteurs.
La Droite (b) correspond à la demi-équation
(II-5) sépare le plan (E-pH) en deux régions. Au-dessus, l'eau
est thermodynamiquement stable vis-à-vis des réducteurs,
au-dessous, elle est instable vis-à-vis d'eux ; de l'hydrogène se
forme.
La droite (b) correspond à la demi-équation
d'oxydation (II.6) sépare également le plan (E-pH) en deux
régions ; au-dessous, l'eau est thermodynamiquement stable
vis-à-vis des oxydants. Au-dessus, elle est instable vis-à-vis
d'eux : de l'oxygène se forme.
Lors de l'étude du comportement d'un
élément métallique vis-à-vis de l'eau, les choses
ont tendance à se compliquer davantage du fait que le dit
élément peut s'oxyder en ions, mais aussi précipiter sous
forme d'hydroxyde en milieu suffisamment basique selon l'équation :
Me + 2OH- Me(OH) + 2è (II.14)
En exploitant tous ces comportements, on peut construire le
diagramme de POURBAIX de tout système réactionnel pour lequel on
connaitrait les différentes espèces participantes et leurs
potentiels standards (Jacques ILUNGA, 2017).
Page | 18
| 


