|

|
Université de Liège
Université de Namur
|
|
Influence du mode d'incubation sur le fitness et la
qualité biochimique des larves de saumon
Atlantique (Salmo
salar) destinées au repeuplement dans le bassin mosan.
Travail de fin d'étude en vue de l'obtention du
diplôme de Master de spécialisation en Gestion des Ressources
Aquatiques et Aquaculture
Présenté par:
Bradford Emmanuel BAYARD
Promoteurs : Encadrants :
Professeur Patrick KESTEMONT Dr. Florian
GEAY
Dr. Robert MANDIKI Mme Enora
FLAMION
Septembre 2017
i
|
Influence du mode d'incubation sur le fitness et la
qualité
biochimique des larves de saumon Atlantique
(Salmo
salar) destinées au repeuplement dans le bassin
mosan
|
II
Remerciements
Je remercie le professeur Patrick Kestemont et le Dr Robert
Mandiki d'avoir accepté d'être mes promoteurs dans le cadre de ce
travail de recherche. Vos conseils avisés, vos corrections et votre
disponibilité pour moi tout au long de ce mémoire ont
été hors prix. Je vous en suis très reconnaissant.
Toutes mes gratitudes à mes encadrants, le Dr Florian
Geay et madame Enora Flamion. Vous avez été toujours disponible
pour moi. Vous m'avez donné de très bons conseils, des
corrections et pardessus tout vous avez été très patient
avec moi.
Je remercie madame Mélusine Van Larebeke de
l'Université Catholique de Louvain (UCL) de m'avoir aidé avec les
tests de lipides et d'acides gras. Gentille comme vous seule,
méticuleuse et patiente; votre aide a été totale. Merci
infiniment.
Merci également au Dr Carole Rougeot d'avoir
corrigé ma première synthèse bibliographique.
Je veux remercier très sincèrement toute
l'équipe de l'URBE de l'Université de Namur en
général et particulièrement M. Sascha Antipine et M. Yves
Mine. Merci de votre franche et entière collaboration.
Merci à M. Benoît Thomassen que j'ai eu la chance de
rencontrer à Erezée.
Merci aux membres du Jury qui me font l'honneur de lire et
d'évaluer ce travail de fin d'étude.
Enfin, je désire remercier tous mes proches, mes amis
et toute personne qui de près ou de loin ont contribué à
la réalisation de ce mémoire. Je m'en passerai de citer des noms
afin d'éviter toutes omissions. Toutes mes profondes gratitudes.
.
III
Résumé
Influence du mode d'incubation sur le fitness et la
qualité biochimique des larves de saumon
Atlantique (Salmo
salar) destinées au repeuplement dans le bassin mosan.
Le déclin du saumon Atlantique dans les eaux naturelles
rend nécessaire des programmes de repeuplement. Cependant, ces
programmes ne donnent pas encore les résultats escomptés dans
certaines rivières. Face à ce constat, il est important de faire
des recherches afin de trouver des solutions. La présente étude a
pour but de déterminer l'influence du mode d'incubation sur le fitness
et la qualité biochimique des larves de saumon Atlantique à
l'émergence, dans la perspective d'améliorer le succès des
programmes de repeuplement. Ainsi nous avons utilisé des oeufs
génétiquement identiques et produits dans les mêmes
conditions, venant du conservatoire de saumon de Chanteuges (France) pour
réaliser nos expériences. Ces expériences consistaient
à tester un mode d'incubation semi-naturelle en 2 rivières (Aisne
et Samson) et 4 autres modes d'incubation en écloserie dont deux en
tiroirs et deux sur claies. Pour les tiroirs, nous avons testé l'eau de
rivière face à l'eau de forage tandis que pour les claies, nous
avons testé la claie avec galets face à la claie sans substrat.
L'objectif étant de confirmer l'importance du substrat ainsi que celle
de la qualité de l'eau dans l'incubation. À l'émergence
des larves, nous avons réalisé des mesures biométriques
sur 54 alevins que nous avons ensuite euthanasiés afin de
procéder à des analyses de lipides et d'acides gras. Au
début de la phase de post-émergence, nous avons testé dans
des bassins en triplicat, l'impact des modes d'incubation en écloserie
sur la croissance et la survie des alevins durant 19 jours.
La dynamique d'émergence entre les rivières a
été similaire. Beaucoup de larves sont quand même
restées dans certains incubateurs à la fin de
l'expérience, ce qui parait être en relation avec une
différence entre individus plutôt qu'aux conditions du milieu. Le
taux de survie à l'émergence dans les rivières est faible
(34% et 25%) comparé aux systèmes tiroirs et claies en
écloserie (entre 98% et 99%). Aucune différence significative n'a
été observée pour la survie à l'émergence en
écloserie. Cependant, ce paramètre varie chez les alevins
élevés en bassins en début de post-émergence et est
significativement meilleur pour les individus issus du système tiroir
alimenté avec l'eau de forage. Le poids corporel et la longueur des
larves à l'émergence en milieu naturel et ceux des individus
issus des systèmes tiroir alimenté avec l'eau de forage et des
claies avec galets, sont significativement plus élevés que les
individus des systèmes tiroir alimenté avec l'eau de la
rivière Aisne et des claies sans substrat. Pour la phase
post-émergence, le taux de croissance (SGR) était compris entre
4,1%/jour et 5%/jour, et aucune différence significative n'a
été détectée entre les modes d'incubation. Les
modes d'incubation semblent ne pas trop influencer le statut lipidique global
des larves à l'émergence. Cependant, l'incubation en tiroir
alimenté avec l'eau de forage, paraît donner des larves avec une
meilleure teneur en lipides (totaux et neutres) et un meilleur profil d'acides
gras notamment. D'autres études seraient intéressantes pour
tester l'impact des modes d'incubation sur la capacité de nage et sur le
comportement anti-prédateur des alevins.
iv
TABLE DES MATIERES
REMERCIEMENTS II
RESUME III
TABLES ET FIGURES VI
GLOSSAIRE VII
|
I.
|
INTRODUCTION
|
1
|
|
1.1.
|
Problématique
|
1
|
|
1.2.
|
Synthèse bibliographique
|
2
|
|
1.2.1.
|
Rappel du cycle biologique du saumon
|
2
|
|
1.2.2.
|
Incubation en milieu naturel et en écloserie
|
4
|
|
1.2.3.
|
Rôle de la qualité de l'eau d'incubation
|
7
|
|
1.2.4.
|
Influence des modes d'incubation sur la qualité des larves
|
8
|
|
1.2.5.
|
Objectifs
|
12
|
|
II.
|
MATERIELS ET METHODES
|
12
|
|
2.1.
|
Matériels biologiques
|
12
|
|
2.2.
|
Sites d'étude
|
12
|
|
2.3.
|
Description des rivières
|
12
|
|
2.4.
|
Protocole expérimental pour la phase entre oeuf
oeillé et émergence
|
13
|
|
2.5.
|
Protocole expérimental du suivi
post-émergence
|
14
|
|
2.6.
|
Paramètres étudiés pour la phase
entre oeuf oeillé et émergence
|
15
|
|
2.6.1.
|
Emergence
|
15
|
|
2.6.2.
|
Analyse biochimique (lipides et acides gras)
|
15
|
|
2.6.3.
|
Mesures biométriques
|
17
|
|
2.6.4.
|
Paramètres étudiés au cours du stade suivi
post-émergence
|
17
|
|
2.6.5.
|
Traitements statistiques
|
17
|
3.1. Dynamique d'émergence et survie
17
III. RESULTATS 17
V
3.2. Poids et longueur des alevins à
l'émergence 18
3.3. Capacité de croissance en bassins au
début de la phase post-émergence 18
3.4. Coefficient de variation du poids 19
3.5. Lipides et acides gras 19
IV. DISCUSSION 25
4.1. Influence du mode d'incubation sur le fitness des
larves 25
4.1.1. Dynamique d'émergence et survie 25
4.1.2. Poids et longueur des larves 26
4.2. Influence du mode d'incubation sur la
qualité des larves 28
V. CONCLUSIONS ET PERSPECTIVES 30
VI. REFERENCES 31
ANNEXE 1 XXXII
PARAMETRES PHYSICO-CHIMIQUES XXXII
ANNEXE 2 XXXII
TESTS STATISTIQUES ( ANOVA) XXXII
vi
Tables et figures
Tables
Tableau 1: Lipides, tocophérol et acides gras libres au
cours du développement de l'oeuf du saumon
Atlantique 11
Tableau 2: Paramètres physico-chimiques moyens de l'eau
enregistrés dans les rivières. 13
Tableau 3: Composition en lipides corporels (mg/g de poids sec)
des larves à l'émergence en fonction du
mode d'incubation 22
Tableau 5: Composition en acides gras
corporels (mg/g de poids secs) des larves à l'émergence en
fonction
du mode d'incubation, fraction LN 23
Tableau 6: Composition en
acides gras corporels (mg/g de poids secs) des larves à
l'émergence en fonction
du mode d'incubation, fraction PL 24
Figures
Figure 1: Cycle biologique du saumon Atlantique (Salmo
salar) (webographie 1) 3
Figure 2: Cycle de production du saumon atlantique en aquaculture
(FAO, 2004) 3
Figure 3: Tapis astroturf utilisé comme substrat
d'incubation (webographie 2) 6
Figure 4: Effet de la température d'incubation sur le
poids corporel (A) et la longueur de l'alevin (B) du
saumon Atlantique 6 et 21 semaines après première
alimentation 7
Figure 5: Comparaison de la longueur moyenne des alevins
à l'émergence incubés dans le Bamberger-box
(colonne bleue) et incubés en écloserie.
9
Figure 6: Comparaison du poids moyen des alevins à
l'émergence incubés dans le Bamberger-box (colonne
bleue) et incubés en écloserie 10
Figure 7: Evolution du taux de lipide corporel du saumon
Atlantique durant son cycle de vie. 11
Figure 8: Modèle d'un incubateur en tiroir (A) et de bacs
d'alevinage (B) au conservatoire de saumon à
Erézée 14
Figure 9: Modèle d'incubateur semi-naturel placé en
rivière 14
Figure 10:Evolution de l'émergence dans les
rivières Aisne (A) et Samson (B) 20
Figure 11: Variation du taux de survie à
l'émergence (A) et après 19 jours post émergence (B) en
fonction
des conditions d'incubation 21
Figure 12: Variation du poids
moyen (A) (N= 54, P= 3,6E-39) et de la longueur (B) (N= 54, P= 8,98E-30)
des larves à l'emergence en fonction des conditions
d'incubation 21
Figure 13: Variation du gain de poids relatif (A) (N= 3, P=
0,06) et du SGR ( B) (N= 3, P= 0.69) des alevins
post-émergents 22
Figure 14 : Evolution du coefficient de variation du poids en
fonction des conditions d'incubation 22
VII
Glossaire
AGS: Acides gras saturé
AGMI: Acide gras monoinsaturé
AGPI: Acide gras polyinsaturé
C14: 0: Acide myristique
C16: 0: Acide palmitique
C18: 0: Acide stéarique
0: 0: Acide arachidique
C16:1 (n-7): Acide Palmitoleïque
C18: 1 (n-7): Acide Vaccenique
C18: 1 (n-9): Acide oléïque
0: 1 (n-9): Acide gondoïque
C18:3 (n-3): Acide alpha linolenique (ALA)
C18:4 (n-3): Acide stéaridonique (SDA)
0:5 (n-3): Acide eicosapentaenoïque
(EPA)
2:5 (n-3): Acide docosapentaenoïque
(DPA)
2:6 (n-3): Acide docosahexaenoïque (DHA)
C18:2 (n-6): Acide linolenique ( LA)
C18:3 (n-6): Acide gama linolenique ( GLA)
0:2 (n-6): Acide eicosadienoïque
0:3 (n-6): Acide eicosatrienoïque 0:4 (n-6):
Acide arachidonique (AA) 2:4 (n-6): Acide
docosatetraenoïque (DTA)
1
I. INTRODUCTION
1.1. Problématique
Le saumon Atlantique (Salmo salar) est devenu de plus
en plus rare en milieu naturel (Beau, 2002; Prevost et Rivot, 2004; Cazeneuve
et Lascaux, 2008; Clave et al, 2013). En Europe, le saumon Atlantique est
considéré comme une espèce menacée depuis la fin
des années 80 (Porcher et Baglinière, 2001); il a disparu de
certains bassins hydrographiques comme celui de la Meuse Belge depuis les
années 1930. Les causes de ce déclin sont diverses mais sont
surtout liées à l'action des hommes (Beau, 2002 ; Prevost et
Rivot, 2004). Les actions humaines directement identifiées pour
responsable de la disparition progressive de l'espèce sont surtout la
surpêche, la construction des barrages hydroélectriques pour la
navigation et la pollution (Beau, 2002 ; Lenders et al, 2016). En effet, le
saumon aime les eaux pures. C'est pourquoi il délaisse les
rivières polluées notamment à cause du
développement industriel, urbain et agricole (Gueguen et Prouzet, 1994).
Pourtant, l'importance du saumon en rivière est triplement capital
puisqu'elle est à la fois d'ordre socio-économique (Beau, 2002 ;
Selly et al, 2014), gastronomique et surtout, cette espèce renseigne sur
la qualité de l'eau des rivières (Beau, 2002).
Il a été constaté dans les programmes de
réhabilitation, que le taux de mortalité chez les saumoneaux
d'écloserie était plus important que celui de leur
congénères sauvages, directement après déversement
dans les rivières et au cours de la période de migration (Serrano
et al, 2009 ; Bamberger, 2009; Larsson et al, 2011; Kallio-Nyberg et al, 2015).
Il se pourrait que cela soit dû au stress subi par les saumoneaux lors de
leur adaptation à leur nouvel environnement sauvage (Serrano et al,
2009). Il a été montré également que la vitesse de
croissance des juvéniles issus d'écloserie était
également plus faible en milieu naturel. On pense que cela pourrait
être dû notamment à une faible activité dans la prise
des proies (Serrano et al, 2009 ; Descroix et al, 2010; Larsson et al, 2011).
D'après Jonsson et Jonsson (2006), ce comportement défavorable
des saumoneaux d'écloserie par rapport aux saumoneaux sauvages pourrait
être le résultat d'un changement génétique dû
à une sélection naturelle dans les écloseries, ce qui
toutefois selon Solberg et al (2015) n'a pas encore été
prouvé.
Les conditions d'élevage du saumon Atlantique jouent un
rôle crucial dans sa croissance, sa survie, sa capacité de nage et
finalement dans son comportement anti-prédateur (Chittenden et al,
2010;). Les techniques d'élevage utilisées dans les
écloseries pour produire les tacons et smolts destinés au
repeuplement sont les mêmes que celles utilisées pour produire des
saumons à finalité commerciale. Ces techniques de productions
commerciales sont surtout destinées à favoriser la croissance des
individus. Elles peuvent donc se révéler défavorables
vis-à-vis de la résistance et de la survie du saumoneau en milieu
naturel, qui est forcément un milieu plus sélectif que celui
d'élevage. Plusieurs facteurs au cours de l'élevage dont le mode
d'incubation, pourraient rendre les alevins et juvéniles
d'écloserie plus vulnérables aux conditions environnementales, et
ainsi moins compétitifs que leurs congénères sauvages en
milieu naturel.
2
En effet, les méthodes d'incubation utilisées en
écloserie (tiroir ou claie) pour les saumons à finalité
commerciale ont pour objectif la protection maximale des oeufs afin d'avoir le
meilleur taux d'éclosion possible. Cependant malgré l'importance
du mode d'incubation sur la qualité du saumon, très peu de
données existent sur l'impact des méthodes d'incubation sur la
croissance et la survie des saumons destinées au repeuplement.
Dès lors, il s'avère intéressant de
tester plusieurs modes d'incubation et de comparer leur influence sur le
fitness et la qualité biochimique des larves.
1.2. Synthèse bibliographique
1.2.1. Rappel du cycle biologique du saumon
Le saumon a un cycle de vie assez particulier. C'est un
poisson migrateur appartenant à la famille des salmonidés. Lors
de la première partie de sa vie en eau douce, il y a certains
paramètres importants dont il faut absolument tenir compte en
aquaculture (Audic, 2006).
? La sélection des oeufs notamment la taille de
ceux-ci;
? L'environnement de l'élevage particulièrement la
température et l'éclairement; ? Le régime alimentaire;
? L'hygiène
Poisson anadrome, le saumon passe sa vie à la fois en
rivière et en mer (Prevost et Rivot, 2004). En rivière, il attend
les proies qui passent dans la colonne d'eau (stratégie individuelle)
tandis qu'en mer il recherche activement les proies (stratégie de
groupe) (Audic, 2006). La durée totale du cycle de vie en milieu naturel
est de 3 à 7 ans.
Le saumon se reproduit en rivière sur les têtes
de radiers en général de novembre à janvier. La femelle
creuse un ou plusieurs nids dans des galets et y déposent les ovules.
Les nids peuvent atteindre 20 à 30 cm de profondeur pour 50 à 80
cm de diamètre. La surface du nid va de 1 à 3 m2 et
l'enfouissement des oeufs entre 5 et 25 cm (Crisp, 1996; Bardonnet et
Baglinière, 2000). Une fois les ovules déposés, les
mâles viennent immédiatement les féconder. L'incubation des
oeufs dans ce cas dure en général 3 mois. Après
l'éclosion, les larves restent dans les frayères jusqu'au mois de
mars-avril.
La vie du saumon est divisée en 3 grandes phases : la
phase embryo-larvaire, la phase juvénile et la phase adulte (figure 1).
La phase embryo-larvaire débute avec la fécondation des oeufs et
prend fin à l'émergence des larves. La phase juvénile va
de l'émergence de la larve jusqu'au stade smolt. La smoltification est
un ensemble de modifications anatomiques, physiologiques et comportementales
sous la dépendance de facteurs externes (Gueguen et Prouzet, 1994) et se
déclenche notamment par la photopériode (FAO, 2004). Ces
modifications permettent la transition du saumon de l'eau douce à l'eau
de mer grâce à une transformation interne et complexe, plus
particulièrement au niveau des branchies (Gueguen et Prouzet, 1994). Les
smolts devenus adultes vont retourner vers
Figure 2: Cycle de production du saumon
atlantique en aquaculture (FAO, 2004)
3
la rivière. Leur entrée en estuaire peut
s'étaler sur l'année ou de l'automne au printemps. À ce
stade, ils vont cesser de manger et vont vivre exclusivement de leurs
réserves (Thorstad, 2011).
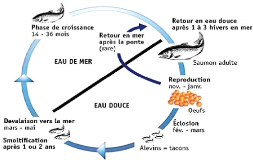
Figure 1: Cycle biologique du saumon Atlantique
(Salmo salar) (webographie 1)
En aquaculture, le cycle de production débute avec la
sélection des géniteurs et des oeufs à féconder
(figure 2). Tout de suite après, on passe à l'incubation des
oeufs.
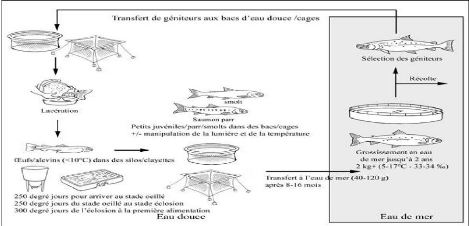
Il faut noter qu'en écloserie la période
d'incubation pose peu de problèmes contrairement à la phase de
résorption du vitellus, durant laquelle la larve ne vit que de ses
réserves et prélève de
4
1.2.2. Incubation en milieu naturel et en
écloserie
a) Incubation en milieu naturel
Généralement la femelle du saumon pond en
automne dans le gravier et les oeufs éclosent au printemps. Il y a
d'abord le stade entre la fécondation des oeufs et l'éclosion qui
dure environ 430 à 500 degrés-jours. Ensuite il y a le stade
allant de l'éclosion à l'émergence (Crisp, 1996; FAO,
2006) qui dure en général 400 à 430 degrés-jour au
cours de laquelle la larve épuise complètement les
réserves contenues dans sa vésicule vitelline (Porcher et
Baglinière, 2001; FAO, 2006; Sutterby et Greenhalgh, 2015). Durant cette
dernière, la larve reste sous le gravier et continue son
développement. Pour le saumon Atlantique, le temps d'incubation est
tributaire des conditions de température (Heggberget et Wallace, 1984;
Salveit et Brabrand, 2013). Il est rapporté qu'en automne, la
température de l'eau de la Meuse varie de 5 à 10°C
(Philippart, 1989). Ainsi dans les eaux relativement chaudes où la
température peut atteindre les 10°C en moyenne, la durée
d'incubation est de 2 mois environ. Par contre dans les eaux plus froides
où la température moyenne ne dépasse pas 5°C, elle
est de trois 3 mois environ.
b) Incubation en écloserie
En écloserie, les incubations sont
réalisées par des incubateurs artificiels. Les incubateurs
artificiels sont des structures aménagées pour protéger et
entretenir de façon artificielle des oeufs dans un environnement
favorable jusqu'à leur éclosion ou jusqu'au stade de la
première alimentation de la larve. Le succès de l'incubation va
dépendre d'un ensemble de paramètres dont la qualité de
l'eau et celle du substrat. La maitrise de ces paramètres est
essentielle pour obtenir un bon taux d'éclosion et avoir des larves de
bonne qualité. Tout cela est tributaire non seulement de la conception
de l'incubateur mais également du protocole de manipulation (Kirkland,
2012).
Normalement les larves sont élevées avec un
substrat qui a pour rôle de remplacer le gravier naturel et sont
maintenus dans des conditions d'obscurité. L'incubation des oeufs et
l'élevage des alevins se fait dans l'eau dont la température ne
dépasse pas 10°C. À la suite de la résorption du sac
vitellin, les larves nagent vers le haut dans la colonne d'eau, ce qui indique
qu'elles sont prêtes à recevoir la nourriture exogène.
En écloserie plusieurs modèles d'incubateurs
sont utilisés dont celui en tiroir et les auges d'alevinage (Gueguen et
Prouzet, 1994). L'incubateur en tiroir est un système dans lequel
plusieurs plateaux sont disposés les uns au-dessus des autres. L'eau
rentre par le dessus, circule à travers les oeufs, se dirige vers la
sortie et recommence ensuite avec le plateau inférieur. Les composantes
inferieures sont normalement en plastique pour éviter la contamination
chimique (Vibert, 1959). La claie avec un substrat comme support peut
être utilisé pour incuber les oeufs également. La claie
étant une sorte de grillage qui est généralement en
inox.
5
l'eau dans le milieu. L'énergie disponible
dépendra alors de la taille de l'oeuf et elle doit permettre à la
larve de subvenir à la totalité de ses besoins de
développement et de nage, jusqu'à ce qu'elle puisse
ingérer l'aliment exogène. Si la nage est constante et
forcée, elle se fera au dépend de la croissance (Gueguen et
Prouzet, 1994).
Les conditions d'incubations sont extrêmement
importantes pour le fitness des larves. Elles ont une influence sur la longueur
et sur le poids à l'émergence de ces dernières. Des
substrats d'incubation adéquats permettent d'avoir une meilleure
utilisation des réserves du sac vitellin pour la croissance en lieu et
place de leur utilisation pour d'autres fonctions (Hansen et al, 1984).
Quel que soit le type d'incubateur utilisé, la
qualité des oeufs ainsi que celle du substrat sont extrêmement
importantes pour la réussite de l'élevage. Parmi les autres
paramètres importants à prendre en compte, nous insisterons sur
la température et les conditions hydrauliques.
? Substrat d'incubation et particules
fines
En écloserie, plusieurs types de matériaux
peuvent être employés comme substrat d'incubation. Les plus
fréquemment utilisés sont l'astroturf (figure 3) et la moquette
industrielle. Cependant n'importe quel type de substrat pouvant permettre
à la larve de se maintenir sans nager peut convenir (Gueguen et Prouzet,
1994).
En milieu naturel, les particules fines jouent un rôle
important dans le substrat. Ceci a été mis en évidence par
Lapointe et al (2004). En effet, ces auteurs ont testé la
sensibilité des oeufs incubés aux variations de limon
(diamètre inférieure à 0,63mm) en interaction avec le
sable (0,63<diamètre< 2mm) dans les graviers d'incubation et avec
différentes forces de gradient hydraulique. Ils ont constaté
qu'à partir de 0,5% de limon, le taux de survie des larves à
l'émergence diminuait fortement. De plus, si la charge des limons dans
le substrat atteint le seuil de 1,5%, il n'est plus possible d'atténuer
leur effet en augmentant la force du gradient hydraulique.
En conclusion, si le pourcentage d'éléments fins
dans les substrats notamment dans les graviers n'est pas très faible, il
y a une forte chance de compromission du développement des oeufs et des
larves, particulièrement dans les zones de frai (Gueguen et Prouzet,
1994; Lapointe et al, 2004; Julien et Bergeron, 2006; Dumas et al, 2007). En
effet, les sédiments fins qui pénètrent dans le substrat
réduisent la circulation de l'eau interstitielle et les apports en
oxygène en provenance de l'eau de surface (Dumas et al, 2007). Le
diamètre du substrat est donc probablement le paramètre le plus
important de l'éclosion à l'émergence (Bardonnet et
Baglinière, 2000).
En plus de la taille, l'origine de l'élément fin
du substrat joue également un rôle important dans l'incubation. En
simulant l'environnement d'incubation pour le saumon Atlantique en mettant
plusieurs quantités de sédiments fins provenant de 4 sources
différentes : couche de terre arable, berges des cours d'eau
érodés et des sédiments issus des traitements des eaux
usées, Sear et al (2016) ont pu montrer que la masse et la source de
sédiment sont indépendantes pour déterminer la
mortalité et l'aptitude des larves. L'origine du sédiment a un
impact supplémentaire qui est surtout
6
contrôlé par la teneur de matière
organique en suspension. La composition et la structure du gravier influence
donc la survie de 2 façons différentes : elle agit sur la
perméabilité par conséquent sur le taux d'apport en
oxygène mais elle agit également sur le déplacement des
métabolites toxiques dont l'ion ammonium (NH4 +) et l'ammoniaque (NH3 +)
et dans un degré moindre les nitrites; ensuite elle influence la
capacité de l'alevin à émerger (Crisp, 1996).

Figure 3: Tapis astroturf utilisé comme
substrat d'incubation (webographie 2)
? Qualité des oeufs
La qualité des oeufs dépend de leur origine et
est définie par leur taux de fécondation, leur taux
d'éclosion et leur composition (Czesny et al, 2005). Les larves issues
des oeufs de grandes tailles ont un meilleur taux de survie et un meilleur
fitness comparées aux individus issus des oeufs de petites tailles
(Einum et Fleming, 1999-2000). Ces oeufs contiennent plus d'énergie et
ont une meilleure réserve de nutriments durant la première phase
de développement. Le sac vitellin étant la seule source de
nutriments et d'énergie pour l'embryon (Lubzens et al, 2010).
? Température
La température d'incubation de l'oeuf est importante
pour la survie et pour la croissance musculaire du poisson à long terme
(Crisp, 1996). Une température faible diminue les proportions de
vitellus utilisés pour l'élaboration des tissus et pour le
métabolisme (Gibson, 1993; Crisp, 1996). Des oeufs incubés
à 10°C donnent des larves avec une meilleure vitesse de croissance
musculaire que des oeufs incubés à 5°C jusqu'à 21
semaines (figure 4) (Albokhadaim et al, 2007; Macqueen et al, 2008). Des oeufs
de saumon Atlantique soumis immédiatement après
fécondation à des températures constantes
inférieures à 4°C ont eu un taux de mortalité de plus
de 20% tandis qu'à des températures constantes de plus de
4°C, on a enregistré un taux de mortalité de 5% ou moins
(Peterson et Sprinney, 1977; Gibson, 1993). Un abaissement soudain de
température au stade oeuf embryonné et à l'éclosion
provoque un grave oedème du sac vitellin de la larve, entrainant un
ralentissement de la croissance et une augmentation de la mortalité
(Peterson et Sprinney, 1977).
? Effet des conditions hydrauliques
De fortes crues entrainent un déplacement des oeufs et
des larves. Chez certaines populations de saumon, les crues constituent une
cause majeure de mortalité (Crisp, 1996; Dumas et al, 2007). L'effet du
déterrement des oeufs est mortel si ces derniers heurtent un objet avant
le stade oeillé (Bardonnet et Bagliniere, 2000). Si le niveau de l'eau
tombe sous le niveau d'enfouissement des
7
oeufs, la mortalité par le gel ou par l'exondation
devient possible (Crisp, 1996). La qualité de l'eau joue
également un rôle important dans la qualité des larves
qu'il convient de bien contrôler. La maitrise de ces différents
facteurs est donc très importante dans l'objectif d'avoir des alevins de
très bonne qualité.
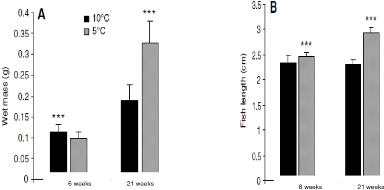
Figure 4: Effet de la température
d'incubation sur le poids corporel (A) et la longueur de l'alevin (B) du saumon
Atlantique 6 et 21 semaines après première alimentation. ***:
différence significative avec p<0,001 et N=20 (Albokhadaim et al,
2007).
1.2.3. Rôle de la qualité de l'eau
d'incubation
Les critères de bonne qualité de l'eau
d'incubation dépendent des exigences de l'espèce en question.
Cette qualité de l'eau peut donc tout aussi dépendre de son
origine. Dans le cas de notre étude, nous présentons
brièvement les différences qualitatives éventuelles entre
l'eau de rivière et l'eau de forage
Eau de rivière et eau de forage
Les eaux des rivières étant des eaux de surface,
sont plus exposées aux pollutions d'origine anthropiques
comparées aux eaux de forage qui sont des eaux profondes (Guergazi et
al, 2005). Leur température varie fortement en fonction de la
période de l'année et du régime pluvial. Leur pH est
également très variable et tombe parfois jusqu' à 4. La
concentration en oxygène dissous est tributaire des actions anthropiques
notamment l'eutrophisation et les pollutions organiques. Elle dépend
également du régime thermique (Phillipart, 1989).
L'eau de forage est en général composée
strictement d'eau de nappe et d'eau de rivière (Doussan et al, 1995). Si
les forages sont à faible distance des rivières, l'eau de la
nappe au sens strict peut représenter seulement entre 0 à 30%
(Bize et al, 1981). Cependant, même quand l'eau de forage est
composée majoritairement d'eau de rivière, elle présente
des caractéristiques physico-chimiques totalement différentes de
l'eau de la rivière dont elle est dérivée grâce au
phénomène appelé effet
8
filtre des berges. Dès lors, on constate qu'elle a
beaucoup moins de polluants que l'eau de rivière (Sontheimer, 1980;
Bourg, 1992).
L'eau de forage est réputée pour contenir
très peu de chlore et d'autres produits chimiques. La concentration en
ions nitrates/nitrites ainsi que la conductivité est normalement plus
élevées dans les eaux de rivière que dans les eaux de
forage. Les eaux de forage peuvent toutefois avoir une concentration en fer et
en ammonium plus élevée (Doussan et al, 1995).
1.2.4. Influence des modes d'incubation sur la
qualité des larves
La qualité des larves peut se définir comme
étant leur aptitude à poursuivre un développement normal
jusqu'au stade juvénile et adulte. Elle dépend de plusieurs
aspects :
? Malformations
En écloserie, on observe souvent de nombreuses
malformations chez les larves tandis qu'en milieu naturel, la pression de
sélection est très importante et ne permet pas aux individus
anormaux de survivre. Plusieurs facteurs environnementaux peuvent induire des
malformations chez les larves (l'hydrodynamique, la température,
l'intensité lumineuse, la salinité et certaines bactéries)
(Cahu et al, 2004). Des cas de malformations chez les larves peuvent être
aussi liés à des carences et déséquilibres
nutritionnelles (Audic, 2006).
Les anomalies physiques sont liées à un
dysfonctionnement au cours du développement du squelette. Cela entraine
une diminution de la croissance et une augmentation de la mortalité.
Parmi ces anomalies, on observe les déformations de la colonne
vertébrale telle que la lordose, la scoliose et le fusionnement des
vertèbres. On peut observer également les anomalies des arcs
branchiaux et les anomalies de la région céphalique notamment la
malformation des mâchoires et du crâne (Cahu et al, 2004).
Cependant, la déformation de la colonne vertébrale peut toutefois
être de nature génétique. D'où la
nécessité de choisir des géniteurs qui ne
présentent pas de malformation eux-mêmes ou qui ne sont pas issus
de famille dont l'incidence de malformation est élevée (Gjerde,
2005; Fjelldal et al, 2009).
Les conditions d'incubation jouent un rôle majeur dans
l'apparition des malformations en écloserie (Boglione et al, 2001). En
effet si le courant est trop élevé au cours de l'incubation, on
peut enregistrer des cas de lordose dus à des exercices de nage
compliqués (Chatain, 1994). Si l'incubation est faite sur des claies
sans substrat, on retrouve facilement des malformations relatives au sac
vitellin (Poon, 1977).
? La taille et la masse
La taille de la larve va dépendre majoritairement de la
température d'incubation. Elle dépend également de la
taille des oeufs (Heinimaa et Heinimaa, 2004). L'utilisation du vitellus par
l'embryon dépend surtout de la température ambiante.
9
Le mode d'incubation influence la taille et la masse de la
larve à l'émergence. Chez certaines espèces de
salmonidés, la croissance est meilleure quand l'incubation est faite
avec substrat que quand elle est faite sans substrat (Poon, 1977; Gainon et
Prouzet, 1982; Krieg et al., 1988). Incubée sur substrat, la larve
dépense moins d'énergie pour la nage et fait donc une meilleure
utilisation de ses réserves vitellines pour la croissance somatique.
Plus le substrat est rugueux, plus la croissance est meilleure (Poon, 1977 ;
Gainon et Prouzet, 1982; Peterson et Martin-Robichaud, 1995). Incubées
sur claie avec astroturf comme substrat, les larves de saumon Atlantique
résorbent plus rapidement et plus efficacement leur vésicule
vitelline en comparaison aux individus incubés sur claie sans astroturf.
Cependant, il a été constaté qu'à partir du
début de la période post émergence, les alevins
dérivés de l'éclosion des oeufs sans astroturf ont eu une
meilleure vitesse de croissance (Hansen et Moller, 2011).
L'incubation en écloserie est une méthode
largement utilisée dans les programmes de repeuplement. Cependant une
fois déversé dans les rivières, le taux de
mortalité des alevins d'élevage est très
élevé. Un moyen éventuel d'augmenter la survie et la
qualité des alevins d'écloserie, serait de s'approprier des
techniques qui se rapprochent de l'incubation en milieu naturel. A cet effet,
Bamberger (2009) a comparé le poids et la longueur des alevins à
l'émergence venant de 5 origines différentes et durant 5 saisons.
Pour cela, il a utilisé un incubateur semi-naturel (Bamberger-box) et
les écloseries traditionnelles. Les alevins incubés dans les
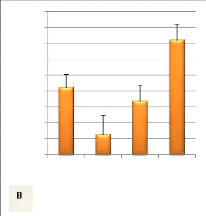
Bamberger-box étaient plus grands en taille et en masse (figure 5 et
6).
Toutefois, malgré l'importance économique du
saumon Atlantique et de son rôle comme indicateur de bonne qualité
des eaux, il n'existe pas encore assez d'informations sur l'influence du mode
d'incubation sur la taille et la masse des larves à l'émergence
et sur leur croissance post-émergence.
Figure 5: Comparaison de la longueur moyenne
des larves à l'émergence incubées dans le Bamberger-box
(colonne bleue) et incubées en écloserie. N: nombre de mesures.
Barres d'erreur: erreur standard (Bamberger, 2009).
10
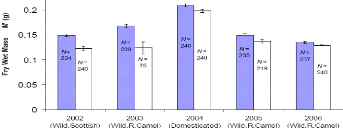
Figure 6: Comparaison du poids moyen des
larves à l'émergence incubées dans le Bamberger-box
(colonne bleue) et incubées en écloserie. N: nombre de mesures.
Barres d'erreur : erreur standard (Bamberger, 2009).
? Contenu lipidique
Chez tous les téléostéens, les lipides
sont des constituants importants de l'oeuf et constituent une source majeure de
nutriments pour l'embryon et la larve (Wiegand, 1996). Ils constituent pour la
larve fraichement éclose, une réserve énergétique
importante. Cette énergie est nécessaire notamment pour les
exercices de nage et pour limiter le catabolisme oxydatif des protéines
(Gatesoupe et al, 1999).
Les exercices influencent le dépôt lipidique, la
croissance et la maturation avec des effets possibles sur les performances de
reproduction et de fitness dans la nature (Berg et al, 2006). Les saumoneaux
d'écloserie peuvent dès lors, suite à un manque d'exercice
avoir un fitness plus faible dans la nature comparés aux saumoneaux
sauvages (Okland et al, 1993). Ils sont normalement plus riches en lipides que
les saumoneaux sauvages car en écloserie, en plus d'avoir une
alimentation plus riche en lipides, l'environnement est moins agressif et donc
ils dépensent moins d'énergie (Peng et al, 2003; Medale et al,
2003; Bourre et al, 2006). Le contenu lipidique d'un poisson sauvage et sain
est seulement égal à 25% des contenus trouvés chez les
poissons d'écloserie. Les poissons sauvages ont cependant une plus forte
proportion d'acide arachidonique (Ackman et Takeuchi, 1986).
Le contenu lipidique du saumon évolue tout au long de
son cycle de vie. Ce profil connait une première chute au moment de la
première alimentation et une deuxième plus marquée au
cours de la smoltification (figure 7).
Chez la larve fraichement éclose, l'utilisation du
vitellus se fait par hydrolyse et transport des nutriments vers l'embryon
(Fishelson, 1995). Certains facteurs augmentent la consommation des
réserves vitellines et peuvent influencer la rétention des
lipides corporels chez la larve. Dès lors, les conditions d'incubation
peuvent jouer un rôle sur le métabolisme lipidique des larves.
(Wiegand et al. 1991). En effet, toute activité qui augmente l'agitation
et donc l'activité de nage, augmente la consommation des réserves
vitellines. C'est pourquoi chez les salmonidés, l'incubation sans
substrat qui oblige les larves à nager pour maintenir un
équilibre hydrostatique, a
11
pour conséquence une plus faible proportion
d'énergie disponible pour la croissance par rapport à celle
réalisée sur substrat. Sans substrat, la larve utilise beaucoup
de vitellus comme carburant pour se stabiliser et non à des fins de
croissance (Audic, 2005).
Les contenus énergétiques peuvent varier d'une
méthode d'incubation à une autre. Ces contenus sont
peut-être plus élevés si les oeufs sont incubés sur
claie avec substrat que sur claie vide (Srivastrava, 1990). Il se pourrait que
les contenus lipidiques à l'émergence des larves issues d'oeufs
incubés en milieu semi-naturel soient plus élevés que ceux
des individus incubés en écloserie. En effet, pour 2
années combinées, des larves issues d'oeufs incubés en
milieu semi-naturel avec substrat ont eu une teneur en énergie de 10,6
kj.g-1 de matière sèche de plus que celles qui
dérivent d'oeufs incubés en écloserie traditionnelle
(Bamberger, 2009).
Tableau 1: Lipides, tocophérol et
acides gras libres au cours du développement de l'oeuf du saumon
Atlantique (valeur moyenne par unité ontogénétique #177;
erreur standard, n=3). Température moyenne journalière de
9°C (Cowey et al, 1985).
|
OEufs fécondés
|
OEufs oeillés
|
Sacs vitellins
|
Alevins émergents
|
|
Jours après fécondation
|
0,5
|
20
|
98
|
138
|
|
Lipides en mg
|
7,02#177;0,07a
|
5,90#177;0,02b
|
5,23#177;0,08c
|
3,50#177;0,03c
|
|
?-tocopherol en mg
|
3,10#177;0,13a
|
3,15#177;0,06a
|
2,93#177;0,05b
|
2,29#177;0,11c
|
|
Acides gras libres en mg
|
ND
|
0,65#177;0,024
|
ND
|
0,191#177;0,081
|
Les valeurs dans la même rangée avec
différentes lettres superposées sont significativement
différentes (p <0,05). Lorsqu'aucune lettre n'apparaît, il n'y
a pas de différence significative.
ND: n'a pas été détectée
Lipid (% wet weight basis)
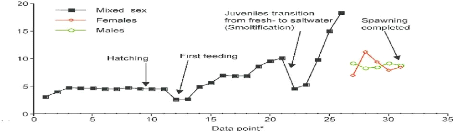
Figure 7: Evolution du taux de lipide corporel
du saumon Atlantique durant son cycle de vie.
Data point: 1-8 représente le double
du nombre de degrés-jours de la fertilisation jusqu'à
l'éclosion tandis que 12-26 représente approximativement le
double de la masse corporelle à chaque point (Elskus et al, 2005).
12
1.2.5. Objectifs
Cette étude a comme objectifs :
? d'évaluer l'influence du milieu d'incubation
(rivière vs écloserie) sur le développement des larves de
saumon Atlantique entre le stade oeillé et l'émergence.
? de déterminer l'influence de l'interaction entre le
mode d'incubation et la qualité de l'eau d'incubation en
écloserie sur le développement des larves. Plus
spécifiquement, on a comparé dans un premier temps ;
? Le taux de survie des larves à l'émergence
? La longueur et le poids des larves à
l'émergence.
? La qualité des larves à l'émergence en
termes de taux de lipides et d'acides gras corporels. Dans un second temps, on
a déterminé l'impact des modes d'incubation sur la croissance et
la survie des alevins post-émergents.
Pour la première phase, 6 conditions d'incubation ont
été testées: deux conditions d'incubation en milieu
naturel (rivière Aisne et rivière Samson), 2 modalités en
claies (claie sans substrat et claie avec galets) et 2 modalités en
tiroirs (tiroir avec eau de rivière et tiroir avec eau de forage). Dans
la seconde phase, on a réalisé un suivi de croissance des alevins
issus des conditions d'incubation en écloserie dans des bassins en
triplicat durant 19 jours.
II. MATERIELS ET METHODES
2.1. Matériels biologiques
Dans le cadre de cette étude, des oeufs oeillés
provenant du conservatoire de saumon sauvage de Chanteuges (France) ont
été transférés au conservatoire du saumon de Meuse
à Erezée (Belgique). Ces oeufs sont arrivés à 44%
de développement en se basant sur la formule logeY= 6,003e
(-0,0307X) (Kane, 1988) avec Y: le nombre de jours depuis la fécondation
jusqu'à la première alimentation et X: la température
moyenne en degré Celsius.
2.2. Sites d'étude
L'expérience d'incubation a été
réalisée à la fois en milieu naturel et en milieu
contrôlé. Pour le milieu naturel, 2 rivières ont
été sélectionnées à savoir le Samson et
l'Aisne. Pour le milieu contrôlé, on a mené
l'expérience au conservatoire de Saumon de Meuse à
Erezée.
2.3. Description des rivières
Nous ne présentons qu'un résumé concernant
la localisation et les caractéristiques des rivières.
? L'Aisne
L'Aisne est une rivière de l'Ardenne Belge. Elle mesure
40 km de longueur. Sa largeur varie de 1 m en amont à 15 m au plus en
aval. Son bassin hydrographique mesure 184 km2. L'Aisne est
réputée pour avoir un régime torrentiel souvent
caractérisé par des crues (Laffineur, 1982).
13
? Le Samson
Le Samson est une rivière de la province de Namur.
C'est un affluent de la rive droite de la Meuse, qui se jette dans celle-ci au
niveau de Namêche dans l'entité d'Andenne. Son bassin versant a
une superficie de 116 km2 et mesure 22 km de longueur (Chérot
et al, 2008).
Durant la période de l'étude, les valeurs
moyennes de température, de pH, d'oxygène dissous, de
turbidité, de conductivité et de vitesse du courant
enregistrées pour les deux rivières sont résumées
dans le tableau 2.
Tableau 2 : Paramètres physico-chimiques
moyens de l'eau enregistrés dans les rivières.

Paramètres Rivières
Samson Aisne
Moyenne Max Min Moyenne Max Min
Température (°C)
|
8#177;2
|
12
|
6
|
8#177;2
|
12
|
5
|
|
pH
|
8#177;0,2
|
9
|
8
|
8#177;0,3
|
8
|
7
|
|
Oxygène dissous (mg/l)
|
12#177;0,5
|
12
|
11
|
12#177;0,5
|
13
|
11
|
|
Turbidité (FAU)
|
8#177;5
|
18
|
2
|
6#177;3
|
16
|
4
|
|
Conductivité (?S/cm)
|
501#177;51
|
573
|
398
|
107#177;8
|
120
|
98
|
|
Vitesse courant (m/s)
|
0,65#177;0,04
|
1,1
|
0,3
|
0,58#177;0,05
|
1,2
|
0,3
|
2.4. Protocole expérimental pour la phase entre oeuf
oeillé et émergence
Au total six (6) conditions d'incubations ont été
testées :
1) Incubateurs semi-naturels avec galets disposés dans la
rivière Aisne
2) Incubateurs semi-naturels avec galets disposés dans la
rivière Samson
3) Tiroirs avec substrat artificiel et alimentés avec
l'eau de la rivière Aisne (figure 8A)
4) Tiroirs avec substrat artificiel et alimentés avec
l'eau de forage
5) Claies sans substrat et alimentées avec l'eau de la
rivière Aisne (figure 8 B)
6) Claies avec substrat et alimentées avec l'eau de la
rivière Aisne
L'incubateur semi-naturel est un tube de forme cylindrique
(figure 9 (1)). Il mesure 20 cm de long et 8cm de diamètre. Les tubes
ont été fermés et enterrés dans le substrat tout au
long de l'expérience. Un collecteur a été ajouté au
dispositif peu avant l'émergence pour récupérer les larves
(figure 9 (2)). On a enterré un tube en PVC à proximité
des incubateurs afin de procéder à des mesures de
paramètres de l'eau (température, concentration en oxygène
dissous etc) dans le substrat à hauteur des larves en plus des mesures
de surface.
10 000 et 8 000 oeufs oeillés ont été
incubés respectivement dans les conditions tiroirs et les conditions
claies au conservatoire de saumon de Meuse à Erézée.
En milieu naturel, 3 radiers ont été
sélectionnés par rivière et 4 incubateurs ont
été déposés par radier. Chaque incubateur a
été rempli avec des galets et 3 couches successives de 50 oeufs,
ce qui a fait au total 150 oeufs incubés par incubateur et 600 par
radier. Les galets utilisés ont été de 34,5#177;16,1mm de
diamètre. Les proportions d'interstices dans le substrat ont
été de 31,5#177;0,1%.

A

B
14
Figure 8: Modèle d'un incubateur en
tiroir (A) et de bacs d'alevinage (B) au conservatoire de saumon à
Erézée

1
2
Figure 9: Modèle d'incubateur
semi-naturel placé en rivière
Les paramètres physico-chimiques de l'eau de
rivière à savoir le pH, la concentration en oxygène
dissous, la conductivité et la turbidité ont été
mesurés 2 fois par semaine. Les valeurs moyennes et extrêmes pour
ces paramètres sont présentées plus haut. La
température dans les incubateurs a été enregistrée
continuellement grâce à des enregistreurs de température
placés dans les différents systèmes étudiés.
La valeur moyenne quotidienne de la température de l'eau a
été utilisée pour calculer le pourcentage de
développement en appliquant la formule de Kane (1988). Ainsi dans chaque
système d'incubation, les prélèvements pour les
paramètres étudiés ont été faits entre 95%
et 97% de développement. Les paramètres physico-chimiques
complets pour l'expérience en écloserie et ceux
enregistrés dans les rivières sont présentés en
annexe 1.
2.5. Protocole expérimental du suivi
post-émergence
Le suivi post-émergence a été
réalisé dans les installations de l'URBE de l'Université
de Namur. La température moyenne quotidienne dans les bassins
était de 13,4#177; 1,1°C [max 16,6; min 12,5] et la concentration
en oxygène dissous de 10,3 #177; 0,8 mg.l-1 [max 12 ; min
6,6]. Pour cette phase, 4 conditions d'incubation ont été
testées :
1) Tiroir alimenté avec eau de forage
2) Tiroir alimenté avec eau de rivière
3)
15
Claie avec galets
4) Claie sans substrat
Pour l'évaluation de la vitesse de croissance au cours
de cette phase post-émergence, 100 alevins ont été
pesés pour chaque condition afin d'en déduire le poids moyen d'un
alevin et ainsi ajuster la biomasse à 35 g par bassin. Au début
de cette phase, notre densité d'élevage était de 400
mg.l-1. Chaque condition d'incubation a été
testée en triplicat. Après la mise en charge, on a
également pesé de façon individuelle 10 alevins par bassin
soit 30 par condition. Cependant, pour la condition claie sans substrat,
seulement 20 alevins ont été pesés au total (7 dans 2
bassins et 6 dans l'autre). Ces données nous ont permis d'estimer le
poids moyen d'un alevin pour chaque bassin. Chaque jour, les
bassins ont été nettoyés. Nous avons effectué un
test de nitrite dans chaque bassin 2 fois par semaine. Les paramètres
physico-chimiques comme la température et la concentration en
oxygène dissous ont été mesurés dans tous les
bassins. Les morts ont été enlevés et comptés
quotidiennement et continuellement. Les alevins ont été nourris
avec un aliment commercial spécifique pour larves de saumon à 3%
du poids corporel. La ration journalière à distribuer dans les
bassins a été calculée comme suit :
Ration= pma*1,02*nombre de survivants*0,03 avec pma: poids
moyen d'un alevin et 0.03 : taux de rationnement.
Après 19 jours de nourrissage, on a pesé tous
les alevins dans les bassins pour avoir la biomasse finale par bassin. Ensuite
comme en début d'expérience, on a pesé individuellement 10
alevins par bassin soit 30 par condition. Encore une fois, pour la condition
claie vide, on a pesé 20 alevins par bassin. Ainsi nous avons
estimé le poids moyen final d'un alevin pour chaque bassin.
2.6. Paramètres étudiés pour la phase
entre oeuf oeillé et émergence
2.6.1. Emergence
Un suivi d'émergence a été
réalisé dans les rivières. En effet, du 6 au 15 Avril 2017
pour le Samson et du 7 au 20 Avril 2017 pour l'Aisne, nous avons
été quotidiennement récupérés et
dénombrés les larves qui ont émergé dans les
incubateurs. À la fin, on a retiré les larves qui sont
restées dans les incubateurs puis en les additionnant avec ceux qui
avaient déjà émergés, nous avons calculé le
taux de survie à l'émergence dans les rivières.
L'émergence en écloserie n'a pas été
étudiée car il n'y a pas de système pour discriminer les
larves qui sont restées en permanence dans les tiroirs.
2.6.2. Analyse biochimique (lipides et acides gras)
A l'émergence en rivière, 20 larves ont
été prélevées par radier. Elles ont
été euthanasiées et pesées pour analyse de la
teneur en lipides totaux et d'acides gras sur la larve entière. Ces
analyses ont été faites également sur les larves issues
des autres conditions d'incubation en milieu contrôlé au
conservatoire de saumon de Meuse (Erezée). Les échantillons
à analyser ont été homogénéisés, puis
on a extrait les lipides et les acides gras par la méthode de Bligh et
Dyer (1959).
16
Extraction des lipides et des acides
gras
Un échantillon de 10 mg de tissus a été
prélevé et ajouté dans 800 tl d'eau milli-Q. Cette
solution a été ensuite homogénéisée dans le
MagNA lyser durant 2 cycles de 30 sec à vitesse 6000. Tout
l'homogénat a été transféré dans un tube GC
(tube pour chromatographie sous phase gazeuse).On a mis les tubes au vortex
individuel pendant 10 sec. Ensuite on a ajouté 1ml de standard interne
(acides gras libres (C13)-phospholipides (C15)- triglycérides (C17))
préalablement préparé et 2 fois 1 ml de chloroforme dans
les tubes avant de les mettre au vortex pendant 30sec. Un ml d'eau mili-Q a
été ensuite ajouté aux tubes puis, ils ont
été mis à nouveau au vortex pendant 30 secondes. Ensuite
on a ajouté 3 gouttes d'éthanol absolu avant de centrifuger 10
minutes à 3000 rpm. Enfin on a éliminé la phase
supérieure de l'échantillon et récupéré 1,7
ml du contenu de la phase inférieure dans un autre tube GC qu'on a
placé au congélateur à -20°C.
? Extraction de la phase solide
On a sorti les échantillons du congélateur puis
on les a fait évaporer sous flux d'azote. Ensuite on a ajouté 200
ml de chloroforme plus 3 ml d'hexane, qu'on a récupéré par
la suite dans un tube GC. L'échantillon a été ensuite
placé en tête d'une colonne. Dès lors, de façon
chronologique on a :
· ajouté sur la colonne 1,8 tl de chloroforme
/2-propanol et on a fait couler à sec ensuite pour
récupérer dans des tubes GC la fraction des lipides neutres.
· ajouté sur la colonne 2,4 ml de
diéthyléther /acide acétique et de la même
façon que précédemment on a récupéré
la fraction des acides gras.
· ajouté sur la colonne 1,8 ml de méthanol
et toujours comme avant, récupéré la fraction des
phospholipides.
? Méthylation
Les acides gras pour être analysés par
chromatographie en phase gazeuse, doivent subir une methylation. Cette
opération consiste à transformer chimiquement les acides gras en
des esters methyliques d'acides gras qui sont des composées volatiles.
Pour cela, on a sorti le standard interne du congélateur et on l'a
laissé refroidir à la température ambiante. Ensuite on l'a
méthylé au bain-marie à 70°C avant de
l'évaporer sou flux d'azote. A la fin de cette étape, on a
ajouté 20 tl de standard méthylé sur 780 tl
d'échantillon à analyser. Ensuite de ce mélange, on a
prélevé 250 tl de contenu qu'on a ajouté à 250 tl
d'hexane. Les acides gras ont été ensuite identifiés par
chromatographie sous phase gazeuse. Les lipides totaux par contrainte
temporelle n'ont pas été analysés. Ils ont
été estimés comme suit: Total acides gras / 0,7 en
considérant que le total des acides gras est égal à 70%
des lipides totaux chez les poissons.
17
2.6.3. Mesures biométriques
A l'émergence, on a pris les poids et les longueurs des
larves pour les 6 modes d'incubation. Les longueurs ont été
mesurées au moyen d'une règle graduée et les poids au
moyen d'une balance de 1/1000 de gramme de précision. Ces mesures ont
été réalisées sur les 60 alevins de chaque
condition expérimentale destinés aux analyses de lipides.
2.6.4. Paramètres étudiés au cours du
stade suivi post-émergence
Pour le suivi des alevins post-émergents, les
paramètres étudiés ont été le taux de survie
qui est le rapport en pourcentage du nombre d'alevins à la fin de
l'expérience avec le nombre d'alevins en début
d'expérience (survie= 100*nombre de survivants / nombre d'alevins mise
en charge), le gain de poids relatif [(poids final-poids initial)/poids
initial]*100 et le SGR qui lui, a permis d'évaluer le gain de poids
quotidien des alevins en pourcentage par rapport à leur poids initiaux
(SGR (%.j-1) =100*( ln poids final-ln poids initial/ durée de
l'expérience en jour). Enfin on a déterminé le coefficient
de variation (CV) en début et en fin d'expérience. Les CV
calculés ont permis de comparer
l'hétérogénéité des lots en début
d'expérience à celle trouvée en fin d'expérience.
CV (%) =100* écart-type/moyenne. Pour cette phase, les longueurs des
alevins n'ont pas été prises en compte.
2.6.5. Traitements statistiques
Pour chaque paramètre étudié, on a
comparé globalement les moyennes obtenues pour chaque condition
d'incubation testée. Les résultats obtenus sont reportés
sous forme de moyenne #177; écart-type. Ces résultats ont
été comparés statistiquement par analyse de variance
(ANOVA) à 1 facteur (annexe 2). Ensuite afin de relever les moyennes qui
sont deux à deux différentes, on a utilisé un test de
Scheffe. Notre risque d'erreur ? était de 0,05.
III. RESULTATS
3.1. Dynamique d'émergence et survie
Dans le milieu naturel, la dynamique d'émergence ne
diffère pas beaucoup entre rivières et d'un radier à
l'autre. Pour les deux rivières, l'émergence a commencé
entre le 6-7 avril, soit 264 degrés-jours environ après
éclosion. Elle a duré 9 et 12 jours respectivement pour le Samson
et l'Aisne. Le profil d'émergence et le nombre de larves
émergées est proche entre les radiers pour l'Aisne tandis que
pour le Samson, le profil est proche entre les radiers mais le nombre de larves
émergées est plus élevées pour le radier 3, sans
que nous ayons pu détecter une différence significative. À
la fin de l'expérience, bon nombres de larves ont été
récupérées dans les incubateurs (figure 10). Dans le
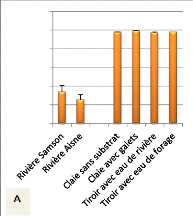
Samson, le taux de survie à l'émergence était de 34%
tandis que dans l'Aisne il était de 25% (figure 11 A). Ces moyennes ne
diffèrent pas statistiquement à cause d'une grande
variabilité entre radiers (annexe 2, page VII). Le taux de survie
à l'émergence dans les écloseries est très
18
élevé comparativement aux valeurs obtenues en
rivières. Il est compris entre 98% et 99% (figure 11A). Aucune
différence n'a été calculée entre les valeurs
moyennes de survie des larves à l'émergence des diverses
modalités d'incubation.
Après 19 jours de nourrissage en bassins au
début de la phase post-émergence, le meilleur taux de survie a
été observé chez les alevins venant de la condition tiroir
alimenté avec de l'eau de forage (72#177;12%) tandis que les valeurs les
plus faibles ont été enregistrées pour les alevins issus
de la condition claie sans substrat (13 #177; 10%) (Figure 11B). L'analyse
statistique a montré des différences très hautement
significatives entre les modes d'incubation (figure 11B, p = 0,000615)
3.2. Poids et longueur des alevins à
l'émergence
? Poids
Les meilleurs poids vifs à l'émergence ont
été observés chez les larves issues des oeufs
incubés dans la condition tiroir alimenté avec l'eau de forage et
des individus incubés sur claie avec galets (138#177; 12 mg pour les 2
conditions). Les oeufs incubés en tiroir alimenté avec l'eau de
la rivière Aisne donnent des larves avec un poids moyen de 128#177;13
mg. Le poids le plus faible (107#177; 13mg) a été
enregistré chez les larves venant de l'incubation sur claie sans
substrat. L'analyse statistique a montré des différences
très hautement significatives entre les modes d'incubation (figure 12 A,
P= 3,6E-39)
? Longueur
À l'émergence, les larves significativement les
plus longues sont issues des oeufs incubés dans la rivière Samson
(26,7#177;1 mm), en tiroir avec de l'eau de forage (27,2#177;0,8 mm) et sur
claie avec galets (27,3#177;0,7 mm). Les larves les moins longues sont
dérivées des oeufs incubés sur claie sans substrat
(25,8#177; 0,8 mm). Les différences statistiques entre les conditions
sont hautement significatives (figure 12 B, p = 8,98E-30)
3.3. Capacité de croissance en bassins au
début de la phase post-émergence
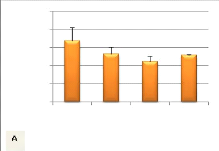
Après 19 jours d'alimentation, le gain de poids relatif
le plus élevé a été observé chez les alevins
de la condition claie sans substrat (169#177; 36%) tandis que le plus faible a
été observé chez les individus de la condition tiroir
alimenté avec l'eau de rivière (111#177;15%). La condition tiroir
alimenté avec l'eau de forage et la condition claie avec galets ont
donné respectivement 129#177; 1% et 132#177;19% (figure 13 A). Aucune
différence entre les moyennes n'a été calculée pour
ce paramètre. Le taux de croissance spécifique (SGR) des alevins
venant de la condition d'incubation tiroir avec l'eau de rivière semble
être plus faible (4#177; 0,3 %.j-1) par rapport aux autres
conditions testées tandis qu'il semble plus élevé pour les
alevins de la condition claie sans substrat (5,2#177; 0,8 %.j-1).
Cependant l'analyse statistique n'a pas permis de détecter des
différences significatives pour ce paramètre (figure 13 B).
19
3.4. Coefficient de variation
L'évolution du coefficient de variation (CV final/CV
initial) parait moins importante chez les alevins venant de la condition tiroir
alimenté avec l'eau de forage (1,1#177;0,1). En revanche, elle semble
avoir été plus élevée chez les individus venant des
conditions claies sans substrat (1,2#177; 0,8) et chez ceux venant de la
condition tiroir alimenté avec l'eau de rivière (1,3#177;0,8).
Cependant l'analyse statistique n'a permis de détecter
aucune différence significative entre les moyennes.
3.5. Lipides et acides gras
? Lipides totaux
Pour les lipides totaux, une différence significative a
été détectée entre les larves de la condition
tiroir alimenté avec l'eau de forage (210#177;13 mg/g de poids sec) et
celles de la claie avec galets (193 #177;12 mg/g de poids sec) (p = 0,001333).
Aucune autre différence significative n'a été mis en
évidence entre les larves des autres conditions.
Aucune différence significative n'a pas non plus
été détectée entre les larves de toutes les
conditions en ce qui concerne les phospholipides (PL). En revanche, pour les
lipides neutres (LN), une différence significative a été
trouvée entre les individus de la condition tiroir alimenté avec
l'eau de forage (92 #177;8 mg/g de poids sec) et ceux de la condition claie
avec substrat (77#177; 7mg/g de poids sec) ou celle de la rivière Aisne
(p = 0,000324) (tableau 3).
? Acides gras saturés et
monoinsaturés
Les conditions d'incubation semblent influencer la
qualité énergétique des larves à l'émergence
au niveau de la fraction des LN. En effet, au niveau des acides gras
saturés, une différence significative a été
trouvée pour le C14: 0 entre les larves de la condition claie sans
substrat (2,3 mg/g poids sec) et celles de la condition claie avec galets (1,7
mg/g poids sec). Pour le C16:0, une différence significative a
été trouvée entre les larves de la condition tiroir
alimenté avec l'eau de forage (10,4 mg/g poids sec) et celle de la
condition claie avec galets (7 mg/g poids sec). Une différence
significative a été également détectée entre
les larves de la condition tiroir alimenté avec l'eau de forage (3,9
mg/g poids sec) et celles de la condition claie avec galets (3,2 mg/g poids sec
pour le C18: 0. Cette influence des conditions d'incubation sur la
qualité énergétique des larves à l'émergence
a été également observée pour les acides gras
monoinsaturés (AGMI) de cette fraction lipidique. Une différence
significative a été trouvée entre les larves de la
condition tiroir alimenté avec l'eau de forage (6,3#177;0,7 mg/g poids
sec) et les larves de la condition claie avec galets (4,1#177;0,7 mg/g poids
sec) pour le C16: 1 (n-7). Pour le C18: 1 (n-7), une différence
significative a été trouvée entre les individus de la
condition tiroir alimenté avec l'eau de forage (3,4#177;0,3 mg/g poids
sec) et ceux de la condition claie avec galets (2,6#177;0,5 mg/g poids sec).
Aucune différence significative n'a été
détectée pour le 0 : 1 (n-9) (tableau 4).
Dans la fraction des PL, aucune différence
significative n'a été trouvée pour les acides gras
saturés C14:0 et C16: 0. En revanche, une différence
significative a été mise en évidence entre les larves de
la condition tiroir alimenté avec l'eau de forage (3,5#177;0,4 mg/g
poids sec) et celles de la
Nombre de larves émergées
A
140
120
100
40
80
60
20
0
Radier 1 Radier 2 Radier 3
Nombre de larves émergées
B
40
90
80
70
60
50
30
20
10
0
Radier 1 Radier 2 Radier 3
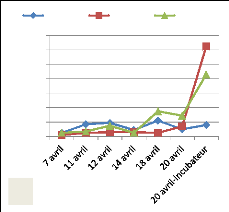
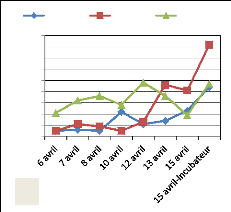
Figure 10:Evolution de l'émergence dans
les rivières Aisne (A) et Samson (B)
20
condition claie avec galets (2,8#177;0,5 mg/g poids sec). Pour
les AGMI, C16: 1 (n-7), C18 : 1 (n-7) et C18: 1 (n-9), aucune différence
significative n'a été détectée entre les larves des
différentes conditions d'incubation. Par contre, une différence
significative a été trouvée entre les larves de la
condition claie sans substrat (0,19#177;0,03 mg/g poids sec) et les larves de
la condition claie avec galets (0,13#177;0,02 mg/g poids sec) pour le 0: 1(n-9)
(tableau 5).
? Acides gras (n-3 et n-6)
Le DHA (2:6(n-3)) est l'acide gras de la série n-3
présent en plus forte proportion dans les PL et les LN. La
qualité biochimique relative aux acides gras de la série n-3 et
n-6 des larves à l'émergence était peu différente
entre les différentes conditions d'incubation.
Toutefois pour la fraction LN, des différences
significatives ont été détectées pour des acides
gras importants. A ce titre, les larves de la condition tiroir alimenté
avec l'eau de forage sont significativement plus riches en acide arachidonique
(0: 4 (n-6)) (1,2#177;0,10 mg/g poids sec) que les individus de la condition
claie sans substrat (0,94#177;0,07 mg/g poids sec). La teneur en EPA (0: 5
(n-3)) est significativement plus élevée chez les larves issues
des conditions tiroir alimenté avec l'eau de forage (7,2#177;0,7 mg/g
poids sec). Les larves issues de cette variante d'incubation sont aussi
significativement plus riches en DHA (13,4#177;1,4 mg/g poids sec) que les
larves de toutes les autres conditions.
Pour la fraction PL, les larves de la condition claie sans
substrat sont significativement plus riches en acide arachidonique (1,2 mg/g
poids sec) que les larves de la condition rivière Samson (1mg/g poids
sec). L'EPA est significativement plus élevé chez les larves de
la condition tiroir alimenté avec l'eau de forage (4,7#177;0,3 mg/g
poids sec) que chez celles de la condition claie avec galets (4#177;0,2 mg/g
poids sec). Les larves de la condition claie sans substrat sont
significativement plus riches en DHA (16#177;0,7 mg/g poids sec) que celles de
la condition rivière Samson (14#177;0,4 mg/g poids sec) (tableau 6).
Taux de survie à l'émergence
(%)
120
100
40
80
60
20
0
b b
a
a
a a
Taux de survie post-émergence (%)
40
90
80
70
60
50
30
20
10
0
Claie
avec
galets
b
Claie
sans
substrat
c
Tiroir
avec eau
de
rivière
bc
Tiroir
avec eau
de
forage
a
21
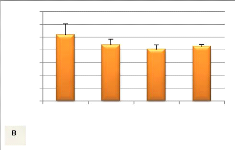
Figure 11: Variation du taux de survie
à l'émergence (A) et après 19 jours post émergence
(B) en fonction des conditions d'incubation (moyenne + écart-type). (A):
N= 3, P= 0,37 pour les rivières ; (B): N= 3, P= 0,000615).

Poids des larves (mg)
160
140
120
100
40
80
60
20
0
a a a a
b
c
Longueu r des larves (mm)
30 b a c a a bc
25
20
15
10
0
5
Figure 12 : Variation du poids moyen (A) (N=
54, P= 3,6E-39) et de la longueur (B) (N= 54, P= 8,98E-30) des larves à
l'émergence en fonction des conditions d'incubation ( moyenne +
écart-type).
22
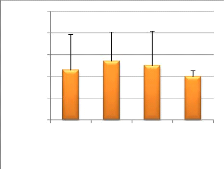
Gain de poids (%)
250
200
150
100
50
0
Claie
sans
substrat
Claie
avec
galets
Tiroir
avec eau
de rivière
Tiroir
avec eau
de forage
SGR ( %/ jou r)
4
0
7
6
5
3
2
1
claie sans substrat
Claie avec galets
Tiroir avec
eau de
rivière
Tiroir avec
eau de
forage
Figure 13 : Variation du gain de poids relatif
(A) (N= 3, P= 0,06) et du SGR (B) (N= 3, P= 0.69) des alevins
post-émergents ( moyenne + écart-type).
CV final / CV initial
0,5
2,5
1,5
0
2
1
Claie sans substrat
Claie avec galets
Tiroir
avec eau
de rivière
Tiroir
avec eau
de forage
Figure 14 : Evolution du coefficient de
variation du poids en fonction des conditions d'incubation ( moyenne +
écart-type). (N= 3, P= 0,89)
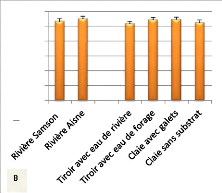
Tableau 3 : Composition en lipides corporels
(mg/g de poids sec) des larves à l'émergence en fonction du mode
d'incubation. Les moyennes sur une même ligne
accompagnées de lettres différentes sont significativement
différentes (P<0,05). Lorsqu'aucune lettre n'apparaît, il n'y a
pas de différence significative. N=6.
|
Fractions
lipidiques
|
Rivière Aisne
|
Rivière Samson
|
Claie avec
galets
|
Claie sans
substrat
|
Tiroir alimenté
avec eau de
forage
|
Tiroir alimenté
avec eau de
rivière
|
|
Lipides totaux
|
184,1#177;18,1ab
|
185,3#177;8,1ab
|
171,7#177;13,4b
|
192,7#177;12,2ab
|
210,2#177;12,7a
|
193,5#177;15,3ab
|
|
Phospholipides
|
43,0#177;1,3
|
39,9#177;1,1
|
42,7#177;6,5
|
45,2#177;3,0
|
43,7#177;1,9
|
43,4#177;0,9
|
|
Lipides neutres
|
73,5#177;11,5b
|
77,9#177;5,1ab
|
65,3#177;8,5b
|
77,4#177;6,5ab
|
91,9#177;8,4a
|
78,0#177;8,4ab
|
23
Tableau 5 : Composition en acides gras corporels
(mg/g de poids secs) des larves à l'émergence en fonction du mode
d'incubation, fraction LN. Les moyennes sur une même ligne
accompagnées de lettres différentes sont significativement
différentes (P<0,05). Lorsqu'aucune lettre n'apparaît, il n'y a
pas de différence significative. N=6. NQ : valeur présente mais
non quantifiable
|
Acides gras
|
Rivière Aisne
|
Rivière
Samson
|
Claie avec
galets
|
Claie sans
substrat
|
Tiroir alimenté avec eau de forage
|
Tiroir alimenté
avec eau de
rivière
|
|
Saturés
|
|
|
|
|
|
|
|
C14 :0
|
1,8#177;0,3ab
|
2,1#177;0,3ab
|
1,7#177;0,3b
|
2,3#177;0,2a
|
2,2#177;0,2ab
|
1,9#177;0,3ab
|
|
C16 :0
|
8,0#177;1,2ab
|
8,8#177;0,8a
|
7#177;0,8b
|
8,4#177;0,8ab
|
10,4#177;0,8a
|
8,4#177;0,9ab
|
|
C18:0
|
3,6#177;0,6ab
|
3,8#177;0,2ab
|
3,2#177;0,3b
|
3,2#177;0,5b
|
3,9#177;0,4a
|
3,6#177;0,5ab
|
|
0 :0
|
NQ
|
NQ
|
NQ
|
NQ
|
NQ
|
NQ
|
|
Monoinsaturés
|
|
|
|
|
|
|
|
C16 : 1(n-7)
|
4,7#177;0,8b
|
4,8#177;0,6b
|
4,1#177;0,7b
|
5,3#177;0,5ab
|
6,3#177;0,7a
|
5,0#177;0,6ab
|
|
C18: 1(n-7)
|
2,8#177;0,4ab
|
3,1#177;0,3ab
|
2,6#177;0,5b
|
3,1#177;0,4ab
|
3,4#177;0,3a
|
3,1#177;0,5ab
|
|
C18: 1(n-9)
|
19,3#177;3,2b
|
20,8#177;1,4ab
|
18,8#177;2,6b
|
21,7#177;1,7ab
|
24,9#177;2,4a
|
21,4#177;2,5a
|
|
0: 1(n-9)
|
0,47#177;0,01
|
0,53#177;0,01
|
0,41#177;0,07
|
0,52#177;0,06
|
0,46#177;0,04
|
0,49#177;0,09
|
|
n-3
|
|
|
|
|
|
|
|
C18 :3(n-3)
|
1,40#177;0,2b
|
1,50#177;0,2ab
|
1,20#177;0,2b
|
1,60#177;0,1ab
|
1,80#177;0,2a
|
1,50#177;0,2ab
|
|
C18 :4(n-3)
|
0,40#177;0,1ab
|
0,46#177;0,1ab
|
0,38#177;0,1b
|
0,50#177;0,1ab
|
0,51#177;0,1a
|
0,44#177;0,1ab
|
|
0 :5(n-3)
|
5,59#177;0,85b
|
5,62#177;0,63b
|
4,80#177;0,68b
|
5,17#177;0,52b
|
7,17#177;0,70a
|
5,86#177;0,47b
|
|
2 :5(n-3)
|
3,30#177;0,58ab
|
3,51#177;0,51ab
|
2,75#177;0,33b
|
3,13#177;0,22ab
|
3,68#177;0,38a
|
3,26#177;0,39ab
|
|
2 :6(n-3)
|
11,08#177;1,6b
|
10,5#177;1,2b
|
9,23#177;1,07b
|
10,03#177;0,94b
|
13,39#177;1,37a
|
11,36#177;1,08ab
|
|
n-6
|
|
|
|
|
|
|
|
C18 :2(n-6)
|
6,28#177;1,1b
|
7,2#177;0,9ab
|
5,80#177;0,86b
|
7,24#177;0,47ab
|
8,23#177;0,82a
|
6,81#177;0,83ab
|
|
C18 :3(n-6)
|
0,14#177;0,0b
|
0,16#177;0,02ab
|
0,15#177;0,04ab
|
0,19#177;0,04ab
|
0,21#177;0,04a
|
0,18#177;0,02ab
|
|
0 :2(n-6)
|
0,43#177;0,08
|
0,48#177;0,08
|
0,38#177;0,05
|
0,47#177;0,03
|
0,47#177;0,04
|
0,45#177;0,07
|
|
0 :3(n-6)
|
0,68#177;0,11
|
0,72#177;0,08
|
0,65#177;0,12
|
0,77#177;0,08
|
0,79#177;0,09
|
0,73#177;0,10
|
|
0 :4(n-6)
|
0,99#177;0,11b
|
1,00#177;0,08ab
|
0,91#177;0,11b
|
0,94#177;0,07b
|
1,16#177;0,10a
|
1,05#177;0,08ab
|
|
2 :4(n-6)
|
NQ
|
NQ
|
NQ
|
NQ
|
NQ
|
NQ
|
24
Tableau 6 : Composition en acides gras corporels
(mg/g de poids secs) des larves à l'émergence en fonction du mode
d'incubation, fraction PL. Les moyennes sur une même
ligne accompagnées de lettres différentes sont significativement
différentes (P<0,05). Lorsqu'aucune lettre n'apparaît, il n'y a
pas de différence significative N=6. NQ : valeur présente mais
non quantifiable
|
Acides gras
|
Rivière Aisne
|
Rivière
Samson
|
Claie avec galets
|
Claie sans substrat
|
Tiroir alimenté
avec eau de
forage
|
Tiroir alimenté
avec eau de
rivière
|
|
Saturés
|
|
|
|
|
|
|
|
C14 :0
|
0,4#177;0,0
|
0,3#177;0,0
|
0,4#177;0,3
|
0,4#177;0,0
|
0,4#177;0,0
|
0,4#177;0,0
|
|
C16 :0
|
9,4#177;0,3
|
9#177;0,1
|
9,6#177;1,4
|
9,4#177;0,7
|
9,9#177;0,4
|
9,7#177;0,2
|
|
C18:0
|
3#177;0,1ab
|
2,7#177;0,2b
|
2,8#177;0,5b
|
3,6#177;0,5a
|
3,5#177;0,4a
|
3,1#177;0,3ab
|
|
0 :0
|
NQ
|
NQ
|
NQ
|
NQ
|
NQ
|
NQ
|
|
Mono insaturés
|
|
|
|
|
|
|
|
C16 : 1(n-7)
|
0,7#177;0,1
|
0,6#177;0,1
|
0,6#177;0,1
|
0,7#177;0,1
|
0,6#177;0,1
|
0,7#177;0,1
|
|
C18: 1(n-7)
|
0,9#177;0,1
|
1#177;0,1
|
0,9#177;0,1
|
1#177;0,1
|
1#177;0,1
|
0,9#177;0,1
|
|
C18: 1(n-9)
|
4,7#177;0,1
|
4,4#177;0,2
|
5,3#177;2
|
4,8#177;0,2
|
4,8#177;0,2
|
4,7#177;0,1
|
|
0: 1(n-9)
|
0,16#177;0,03ab
|
0,13#177;0,03b
|
0,13#177;0,02b
|
0,19#177;0,03a
|
0,14#177;0,02ab
|
0,14#177;0,01ab
|
|
n-3
|
|
|
|
|
|
|
|
C18 :3(n-3)
|
0,18#177;0,08
|
0,13#177;0,01
|
0,14#177;0,05
|
0,12#177;0,01
|
0,13#177;0,01
|
0,15#177;0,02
|
|
C18 :4(n-3)
|
0,03#177;0,0
|
0,03#177;0,0
|
0,05#177;0,05
|
0,03#177;0,0
|
0,03#177;0,0
|
0,03#177;0,0
|
|
0 :5(n-3)
|
4,53#177;0,20ab
|
4,05#177;0,25b
|
3,98#177;0,22b
|
4,51#177;0,46ab
|
4,74#177;0,26a
|
4,45#177;0,13ab
|
|
2 :5(n-3)
|
1,52#177;0,11a
|
1,32#177;0,13ab
|
1,19#177;0,08b
|
1,57#177;0,16a
|
1,49#177;0,14a
|
1,38#177;0,10ab
|
|
2 :6(n-3)
|
14,50#177;0,42b`
|
13,63#177;0,41`
|
14,21#177;0,49
b`
|
15,76#177;0,72a
|
14,19#177;0,49b
|
15,06#177;0,34ab
|
|
n-6
|
|
|
|
|
|
|
|
C18 :2(n-6)
|
0,90#177;0,03
|
0,77#177;0,02
|
1,32#177;1,36
|
0,88#177;0,08
|
0,83#177;0,06
|
0,83#177;0,04
|
|
C18 :3(n-6)
|
NQ
|
NQ
|
NQ
|
NQ
|
NQ
|
NQ
|
|
0 :2(n-6)
|
0,13#177;0,01ab
|
0,11#177;0,02ab
|
0,10#177;0,02b
|
0,14#177;0,02a
|
0,12#177;0,01ab
|
0,12#177;0,01ab
|
|
0 :3(n-6)
|
0,025#177;0,02
|
0,21#177;0,01
|
0,23#177;0,05
|
0,25#177;0,02
|
0,24#177;0,02
|
0,24#177;0,02
|
|
0 :4(n-6)
|
1,02#177;0,02ab
|
0,94#177;0,04b
1,00#177;0,07ab
|
1,20#177;0,09a
|
1,05#177;0,06ab
|
1,07#177;0,03ab
|
|
2 :4(n-6)
|
NQ
|
NQ NQ
|
NQ
|
NQ
|
NQ
|
25
IV. DISCUSSION
4.1. Influence du mode d'incubation sur le fitness des
alevins
4.1.1. Dynamique d'émergence et survie
Entre les rivières, il y a eu une dynamique
d'émergence assez similaire. Toutefois, dans certains incubateurs, la
plupart des larves ont émergé dès le 7 avril tandis que
pour d'autres beaucoup y étaient encore 13 jours après. Ce
décalage semble surtout lié à la différence entre
individus et non aux conditions du milieu car les profils d'émergence
étaient similaires entre rivières et radiers.
Le taux de survie à l'émergence dans les
rivières pourrait être considéré comme satisfaisant
si l'on se réfère à certaines études
antérieures rapportant des taux de survie de 2 à 35 %
généralement observés dans certaines rivières
européennes de la Suisse, de la Suède et particulièrement
la rivière Bush en Irlande du nord (Bley et Moring, 1988; Pauwels et
Haines, 1994; Rubin, 1995; O'Connor et Andrew, 1998). Les résultats de
la littérature varient fortement d'une rivière à une autre
car, des taux de 80% ou plus ont été observés pour des
fraies naturelles dans les frayères de bonne qualité par Cuinat
(1971).
Notre densité d'incubation dans les rivières
était d'un oeuf/cm2 dans les incubateurs. Cette
densité est plus élevée comparée au
0,70/cm2 proposé par Pepper (1984) dans les substrats
artificiels et un peu plus faible que 1,5/cm2 utilisé par
Bamberger (2009) dans des incubateurs semi-naturels. En effet, si la
densité d'incubation est trop élevée, il peut y avoir une
agglomération de larves vésiculées qui par la suite peut
engendrer une forte mortalité (Muray et Beacham, 1986).
La taille moyenne des graviers utilisés dans notre
substrat (35#177;16 mm) correspond parfaitement à la taille optimale
comprise entre 16 et 64 mm (Crips, 1996). Si la taille du gravier est faible
voire inférieure à 6 mm de diamètre, le taux de survie
peut être faible (entre 0 et 20%) (Crisp 1996; Bardonnet et
Baglinière, 2000; Amstrong et al, 2003; Louhi et al, 2008).
Les profondeurs à utiliser pour l'incubation des oeufs
en milieu naturel doivent être comprises entre 20 et 50 cm (Bardonnet et
Baglinière, 2000; Amstrong et al, 2003). Dans le cas de notre
étude, on était parfois en dessous de 20cm quand il n'y a pas eu
de pluies et que le niveau de l'eau continuait de baisser au cours de
l'expérience. Parfois on était au-delà de 50cm durant les
périodes de crues. Ceci pourrait expliquer même partiellement
notre taux de survie relativement faible.
La vitesse du courant mesurée dans les rivières
était globalement toujours très proches des vitesses optimales de
35 à 65 cm.s-1 rapportées par certains auteurs
(Bardonnet et Baglinière, 2000; Amstrong et al, 2003 ; Louhi et al,
2008). Les températures et les concentrations en oxygène dissous
enregistrées sont respectivement conformes aux 5 à 8°C
(Jobling et al, 1992;Jungwirth; Winkler, 1984) et au plus de 5
mg.l-1 (Mac Crimon et Gots, 1986) recommandées.
Autres paramètres importants qui pourraient expliquer
notre taux de survie est la turbidité via l'effet des particules fines.
En effet, au cours de l'expérience il y a eu des crues dont une plus
importante le jour de la mise en place des incubateurs. Or on sait que les
particules fines infiltrent le substrat lors des crues (Dumas et Darolles,
1999). Les particules fines ont comme conséquence la réduction de
l'apport d'oxygène et du même coup, peuvent provoquer une forte
mortalité (Greig et al, 2005). Des oeufs morts ont été
trouvés dans les incubateurs, ce qui peut bien prouver que la
26
mortalité a lieu avant éclosion. La
conductivité élevée observée dans la rivière
Samson comparativement à l'Aine est probablement due à la
différence de longueur entre les 2 rivières (40 km pour l'Aisne
et 22 km pour le Samson). Cependant, cette différance de
conductivité ne semble influencée ni la taille, ni le poids ni
même la survie des larves à l'émergence. Vallée
(2004) a déjà souligné que ce paramètre en
deçà de 750?S/cm, n'était pas contraignant pour
la vie piscicole. De plus, cette conductivité élevée du
Samson semble être compensée par une meilleure vitesse du courant
(0,58 m/s pour l'Aisne et 0,68 m/s pour le Samson).
Le taux de survie à l'émergence de plus de 97%
dans l'écloserie pour les conditions claies et tiroirs est très
satisfaisant. Ce paramètre est généralement toujours
très élevé en écloserie pour des oeufs
oeillés, comme le rapporte la FAO (2005) pour la truite (95%). Etant
donné que les valeurs de survie ont été très
proches entre toutes les modalités d'incubation comparées dans
cette étude, le substrat d'incubation et la qualité de l'eau de
la rivière Aisne n'ont pas eu une grande influence sur la
capacité de survie. Dumas et al (2007) a trouvé des
résultats similaires dans le bassin de la Nivelle. Ces auteurs ont
trouvé une survie à l'émergence de 30% et 89%
respectivement en milieu naturel et sur un lot témoin en
écloserie.
Le faible taux de survie généralement
observé en rivière est dû principalement au colmatage des
interstices via les particules fines, qui réduisent les apports
d'oxygène et l'évacuation des déchets métaboliques
(Burkhalter et Kaya, 1977;Chapman 1988; Crips, 1993 ; Guerin et Dumas 2001).
Massa (2000) a déjà souligné la forte probabilité
des eaux de rivières d'être soumises à l'effet des
nitrites. En écloserie, l'absence de ce phénomène de
colmatage rend très perméable le substrat d'incubation. Baril
(1999) a déjà mentionné l'importance de la
perméabilité du substrat d'incubation pour la bonne circulation
de l'eau et donc l'apport de l'oxygène vers les oeufs. Toujours selon
cet auteur, cette perméabilité favorise l'élimination des
déchets toxiques. De plus, l'incubateur utilisé en rivière
n'était peut-être pas le plus approprié pour éviter
le colmatage du substrat et donc favoriser une survie plus importante. Une
expérience similaire menée dans les rivières Carmel et
Fowey avec un autre modèle d'incubateur en forme de boîte (de 31,2
litres, profondeur de 23 cm) a donné 93% de survie à
l'émergence (Bamberger, 2009). Les boites d'incubation contrairement aux
tubes, augmenteraient la perméabilité du substrat. Contrairement
au taux de survie à l'émergence en écloserie où
aucune différence significative n'a pu être mise en
évidence, la survie des alevins post-émergents
élevés en bassins était meilleure chez alevins issus des
conditions tiroir alimenté avec eau de forage et la plus faible chez
ceux issus des conditions claie sans substrat. Ces résultats corroborent
certaines études (Einum et al., 2002) qui ont déjà
montré l'impact de l'incubation sur la survie post-émergence des
alevins de saumon Atlantique Ceci est une confirmation de l'importance de la
qualité de l'eau et du substrat pour l'incubation des oeufs de saumon
Atlantique.
4.1.2. Poids et longueur des larves
A l'émergence, nos résultats confirment
clairement l'importance de la qualité de l'eau d'incubation sur la
taille des larves. En effet, incubées dans les mêmes conditions,
les larves venant des tiroirs alimentés avec l'eau de forage sont
significativement de poids plus important que ceux venant des
27
tiroirs alimentés avec l'eau de rivière. L'eau
de forage étant une eau relativement pure est par conséquent de
meilleur qualité que l'eau de rivière (Sontheiner, 1980; Bourg,
1992 ; Guergazi et al, 2005). Ensuite on voit l'importance du substrat dans
l'incubation. En effet, les larves venant des claies sans substrat ont
montré des poids plus faibles comparées à toutes les
autres conditions. Par contre, celles qui sont dérivées des oeufs
incubés sur claie avec galets, ont eu le même poids moyens
statistiquement à l'émergence que ceux incubés en milieu
naturel.
Pour la longueur à l'émergence, le constat reste
le même. Nos résultats sont en accord avec d'autres études
qui ont mis en évidence l'importance du substrat sur le poids et la
longueur des larves des salmonidés à l'émergence (Poon,
1977;Gainon et pouzet, 1982; Krieg et al.1988; Bamberger, 2009). Le substrat
permet à la larve de faire une meilleure utilisation de ses
réserves vitellines pour la croissance somatique (Hansen et al., 1990;
Peterson et Martin-Robichaud, 1995; Weil et al, 2001). Il a été
démontré que le substrat réduisait le stress entre
l'éclosion et l'émergence. Le stress a pour conséquence
une réallocation de l'énergie qui n'est donc plus disponible pour
la croissance (Mc Cornick et al, 1998).
Après l'émergence, certaines études
antérieures ont montré que les alevins de poids
élevé auraient une meilleure vitesse de croissance (Einum et al,
2002) due principalement à une meilleure efficacité dans la prise
alimentaire (Nislow et al, 2000). Ils auraient également une meilleure
capacité de nage (Ottaway et Forrest, 1983; Armstrong, 1997; Heggenes et
Traaen, 1998) en rapport avec une meilleure réserve
énergétique (Berg et al, 2001). Les résultats
trouvés dans notre étude concernant la vitesse de croissance
spécifique ou le gain de poids relatif après 19 jours de
nourrissage post-émergence ne confirment pas cet avantage car, aucune
différence significative n'a pu être mise en évidence entre
les groupes d'alevins issus des différents modes d'incubation. Nos
résultats corroborent ceux de Czerniawski et al (2010) pour des alevins
de saumons nourris avec un aliment mixte (artémia et un aliment
commercial) durant 2 semaines. Ils sont également très proches
des résultats trouvés chez la truite arc-en-ciel
(Oncorhynchusmykiss) par Bargherie et al (2008). La vitesse de
croissance quasi identique pourrait s'expliquer par l'hypothèse que les
alevins les plus vulnérables dans chaque lot ont été
éliminés par une mortalité élevée suite au
transfert de la station d'Erezée aux installations RAS de l'URBE
à Namur. Il pourrait s'en suivre qu'il n'ait eu aucune différence
dans la prise alimentaire et dans sa transformation en biomasse. Malgré
cette réserve méthodologique, nos résultats peuvent
vouloir dire qu'il n'y a eu aucune croissance compensatoire chez les alevins
qui ont été moins grands à l'émergence. Ce qui
laisse croire, qu'à toutes autres conditions égales, les alevins
les moins grands à l'émergence le resteront toujours dans le
temps. Or, les poissons les plus grands sont ceux qui ont plus de chance de
survivre dans la nature face à la compétition et à la
prédation (Cuinat, 1971).Toutefois, nous n'avons aucune garantie
qu'au-delà de nos 19 jours d'expérimentation, que la tendance
serait restée la même. Car jusqu'à 6 semaines
d'alimentation, Hansend et Torrissen (1984) n'ont détecté aucune
différence significative pour le SGR entre les alevins de saumons
incubés avec substrat et des individus incubés sans substrat.
Tandis qu'après cette période, ils ont pu mettre en
évidence le niveau significativement plus élevé de ce
paramètre, chez les alevins incubés sur substrat
comparés
28
aux individus incubés sans substrat. Cette
différence augmentait de jours en jours jusqu'au
198èmejour.
Concernant les coefficients de variation du poids en
début d'expérience, les valeurs observées dans cette
étude sont quasi similaires à celles trouvées en fin
d'expérience sauf pour la condition claie avec galets, dans laquelle ce
paramètre paraît légèrement augmenter, mais pas
assez pour que cette différence soit significative. Ce paramètre
permet d'apprécier la rusticité des poissons (Durvile et al,
2003). La rusticité étant ici la capacité des alevins
à supporter les conditions d'élevage, à survivre et
à croitre (Barnabé, 1991). A la fin de notre expérience,
le rapport CVf/CVi pour les conditions d'incubation était compris entre
1 et 1,3. Cela laisse croire que nos alevins on eu du mal à s'adapter
aux conditions de notre élevage. Toutefois, même si la
différence pour ce paramètre entre les conditions d'incubation
n'est pas significative, on peut tenter de voir le rôle de la
qualité de l'eau d'incubation sur le fitness des alevins. En effet, les
alevins de la condition tiroir alimenté avec l'eau de forage paraissent
quand même les mieux adaptés aux conditions de notre
expérimentation (CVf/CVi = 1) comparativement à la condition
tiroir alimenté avec l'eau de rivière où ce
paramètre parait le plus élevé (CVf/CVi = 1,3)
4.2. Influence du mode d'incubation sur la qualité
des larves
Le statut lipidique est un indicateur qui permet
d'apprécier le succès de l'ontogenèse précoce chez
les poissons. Les lipides neutres sont en général des lipides de
réserves fournissant notamment l'énergie tandis que les
phospholipides jouent un rôle plus structurel et physiologique au niveau
de la membrane cellulaire (Henderson et Torcher, 1987;Socknes et al, 2004). Des
différences significatives ont été détectées
pour les niveaux des lipides totaux et des lipides neutres entre la condition
tiroir alimenté avec l'eau de forage (respectivement 212 #177;13 mg/g de
poids sec et 92 #177; 8 mg/g de poids sec) et la condition claie avec galets
(respectivement 172 #177;13 mg/g de poids sec et 65#177; 9 mg/g de poids sec).
Les larves à l'émergence dans la condition tiroir alimenté
avec l'eau de forage ont également les poids et longueurs les plus
importants. Bamberger (2009) a déjà montré que les larves
de saumon les plus grosses à l'émergence avaient également
une meilleure réserve énergétique. Au même
âge, les larves de saumon avec les meilleurs caractéristiques
poids-longueurs ont également les meilleurs niveaux de lipides totaux et
de lipides neutres (Murzina et al, 2016). Pour les autres modalités
d'incubation, il est difficile de faire le lien entre la taille de l'alevin
à l'émergence et la composition lipidique dans le cas de notre
étude. Les larves des conditions claie avec galets ont eu à
l'émergence, des tailles statistiquement similaires avec celles des
conditions tiroirs à eau de forage. Pourtant, ces larves semblent
présenter les plus faibles taux de lipides totaux et de lipides neutres.
De plus, les plus petites larves à l'émergence venaient des
conditions claies sans substrat. Cependant, les larves de cette condition n'ont
pas montré une mauvaise composition lipidique. Ces résultats ne
sont pas en accord (en sachant que les lipides sont hautement
énergétiques) aux conclusions d'autres recherches qui stipulent
que les contenus énergétiques des larves sont beaucoup plus
élevées chez les individus incubés sur substrat que chez
ceux incubés sans substrats (Audic, 2006;). Toutefois, nos
résultats pourraient bien rejoindre les conclusions de Berg et al
(2001), à savoir que le statut énergétique des larves
à l'émergence est
29
surtout influencé par l'efficacité de
l'utilisation des protéines après éclosion et non par la
synthèse lipidique. En effet après éclosion,
l'augmentation de la synthèse et du stockage des lipides chez les
larves, révèle que ces composés sont critiques pour la
survie post-émergente. Les stocks de lipides après
émergence peuvent favoriser la survie, la capacité
concurrentielle et la croissance parce que ces composées sont efficaces
et rapidement métabolisables. Après éclosion, le
métabolisme augmente de façon logarithmique tandis que le
stockage des protéines décroît très
considérablement. Ceci peut vouloir dire que la grande majorité
de l'énergie métabolique à ce moment-là, provient
des protéines stockées. De plus, les larves semblent transformer
les protéines en graisses dans le but de maximiser leur fitness (Berg et
al, 2001). Ceci pourrait expliquer le fait que même dans la condition
claie sans substrat qui est considérée comme un témoin
négatif, le statut lipidique n'est pas trop affecté. La larve
semble, au lieu de perturber sa synthèse et stockage lipidique pour
s'adapter à une condition défavorable, préférer
diminuer sur l'allocation de l'énergie métabolisable des
protéines destinées à la formation de ses tissus.
Les acides gras saturés particulièrement le C14
et le C16, sont des importants précurseurs des acides gras
nécessaires à la vie des cellules et à la formation des
tissus. Ils proviennent de la synthèse de novo à partir de
précurseurs non lipidiques, particulièrement les acides
aminés (Mellinger, 95). Les acides gras monoinsaturés sont
essentiellement utilisés comme source d'énergie pour le
catabolisme. Dans les lipides neutres, les larves de la condition tiroir
alimenté avec l'eau de forage présentent des niveaux plus
élevés en acide palmitique (C16:0) et stéarique (C18:0)
(respectivement 3 #177; 0,8 mg/g de poids sec et 4 #177; 0,4 mg/g de poids sec)
comparées aux larves des modalités claie avec galets
(respectivement 8,4 #177; 0,8 mg/g de poids sec et 4 #177; 0,4 mg/g de poids
sec). La même tendance persiste avec le C18:0 dans les phospholipides.
Les juvéniles de saumon ont besoin des AGPI n-3
particulièrement l'ALA ((C18:3 (n-3)), l'EPA (0:5 (n-3)), le DHA (2:6
(n-3)) et des AGPI n-6 dont l'acide linolenique (C18:2(n-6) et surtout l'acide
arachidonique (0: 4 (n-6)) comme facteurs nutritionnels importants liés
aux mécanismes biochimiques et physiologique de leur
développement (Bell et al, 1997; Arts et al, 2001; Huang et al, 2008).
Le 2:6 (n-3) est un composé essentiel des cellules rétiniennes
oculaires et nerveuses des jeunes vertébrés (Arts et al, 2001)
tandis que le 0: 4 (n-6) est à l'origine de la synthèse des
eicosanoïdes, composés impliqués dans plusieurs fonctions
biologiques (osmo-régulation, défense humanitaire...) (Bell et
al, 1997). Dans la fraction des lipides neutres et des phospholipides, ces
acides gras n-3 et n-6 sont significativement plus élevés chez
les larves de la condition tiroir à eau de forage comparées aux
larves du système claie avec galets. Peng et al (2003) a trouvé
des résultats similaires chez de gros alevins de saumon Atlantique
comparés aux individus plus petits.
Nos résultats en général semblent montrer
que les conditions claies sont moins performantes comparées aux
modalités tiroir, plus particulièrement alimenté avec
l'eau de forage qui semble donner de meilleurs résultats pour ces AGPI.
De plus, ces résultats révèlent le rôle de la
qualité de l'eau d'incubation. Car incubé dans les mêmes
conditions, les larves issues des tiroirs alimentés avec l'eau de
rivière ne sont pas toujours significativement plus riches en ces AGPI
que les larves
.
30
venant des conditions claies contrairement aux individus des
modalités tiroir alimenté avec l'eau de forage.
Qu'ils s'agissent des contenus lipidiques en
général ou d'acides gras en particulier, les résultats
trouvés dans les rivières sont très similaires à
ceux trouver en écloserie. Or l'on sait que généralement,
les saumoneaux d'écloserie sont plus riches en lipides que leur
congénères sauvages au même âge et après une
même période d'alimentation (Peng et al, 2003;Medale et al, 2003;
Bourre et al, 2006). Cela pourrait bien montrer, que cette différence de
contenu lipidique généralement observée, est d'avantage
liée à l'alimentation exogène des larves et non celle de
la mère.
V. CONCLUSIONS ET PERSPECTIVES
Cette étude a montré que les conditions du
milieu d'incubation du saumon Atlantique (rivières vs écloserie)
affectent significativement le taux de survie et non la qualité des
larves à l'émergence en termes de poids vif et qualité des
lipides corporels. Elle a aussi montré que les modes d'incubation en
écloserie pourraient jouer un rôle dans le développement
des alevins destinés au repeuplement. Une incubation en écloserie
sur substrat et avec une eau de bonne qualité, peut permettre d'avoir
des larves à l'émergence de bonne qualité, quasi similaire
à une incubation semi-naturelle en rivière. L'incubation dans le
système tiroir alimenté avec l'eau de forage et dans les claies
avec galets, ont permis d'avoir les plus grandes larves à
l'émergence. Les longueurs et poids de ces larves sont très
similaires à ceux trouvés en rivières après
incubation semi-naturelle. L'adaptation aux conditions d'élevage au
début de la phase post-émergence a confirmé la bonne
qualité des larves issues des modalités du système tiroir
alimenté en eau de forage en termes de survie. Mais cette
supériorité n'a pas été confirmée en termes
de capacité de croissance car aucune différence n'a
été détectée entre les diverses conditions
d'incubation testées en écloserie. De plus, la composition en
acides gras chez les larves issues d'incubation tiroir en eau de forage n'est
pas significativement meilleure comparativement à celle des larves
issues d'incubation du même système mais alimenté en eau de
rivière.
Les résultats de notre étude ne permettent donc
pas d'affirmer de manière précise le mode d'incubation le plus
adapté pour les programmes de repeuplement. Pour des juvéniles
destinés au repeuplement, il serait préférable de faire
plus d'analyses biochimiques sur les muscles, afin de mieux associer les
résultats à certaines fonctions biologiques comme la
capacité de nage et la réponse inflammatoire. Il serait
intéressant également de tester le comportement
anti-prédateur des alevins afin de mieux évaluer leur chance de
survie en milieu naturel.
31
VI. REFERENCES
(c) FAO 2004-2017.
Programme d'Information sur les espèces aquatiques
cultivées. Salmo salar. Programme d'Information sur les
espèces aquatiques cultivées. Texte par Jones, M. Dans:
Département des pêches et de l'aquaculture de la FAO [en ligne].
Rome. Mis à jour 1 Janvier 2004. [Cité le 14 Avril 2017].
http://www.fao.org/fishery/culturedspecies/Salmo_salar/fr
(c) FAO 2005-2017.
Programme d'Information sur les espèces aquatiques
cultivées. Oncorhynchus mykiss. Programme d'Information sur les
espèces aquatiques cultivées.Texte par Cowx, I. G. Dans:
Département des pêches et de l'aquaculture de la FAO [en ligne].
Rome. Mis à jour 15 Juin 2005. [Cité le 14 August 2017].
http://www.fao.org/fishery/culturedspecies/Oncorhynchus_mykiss/fr
Ackman, R. G., & Takeuchi, T. (1986). Comparison of fatty
acids and lipids of smolt in hatchery-fed and wild Atlantic salmon Salmo salar.
Lipids, 21(2), 117-120.
Albokhadaim, I., Hammond, C. L., Ashton, C., Simbi, B. H.,
Bayol, S., Farrington, S., & Stickland, N. (2007). Larval programming of
post-hatch muscle growth and activity in Atlantic salmon (Salmo salar). Journal
of Experimental Biology, 210(10), 1735-1741.
Altukhov, Y. P., Salmenkova, E. A., & Omelchenko, V. T.
(2008). Salmonid fishes: population biology, genetics and management. John
Wiley & Sons. Atlantic salmon (Salmo salar). Evolution. 54:628-639.
Armstrong, J. D. 1997. Self-thinning in juvenile sea trout and
other salmonid fishes revisited. Journal of Animal Ecology 66: 519-526
Armstrong, J. D., Kemp, P. S., Kennedy, G. J. A., Ladle, M.,
& Milner, N. J. (2003). Habitat requirements of Atlantic salmon and brown
trout in rivers and streams. Fisheries research, 62(2), 143-170.
Arts, M. T., Ackman, R. G., & Holub, B. J. (2001). "
Essential fatty acids" in aquatic ecosystems: a crucial link between diet and
human health and evolution. Canadian Journal of Fisheries and Aquatic Sciences,
58(1), 122-137.
Audic, M. (2006). Etude de la nutrition des saumons et
contribution à la création d'une filière de production de
saumons label rouge. Thèse de doctorat. Ecole Nationale
Vétérinaire de TOULOUSE.
32
Bagheri, T., Hedayati, S. A., Yavari, V., Alizade, M., &
Farzanfar, A. (2008). Growth, survival and gut microbial load of rainbow trout
(Onchorhynchus mykiss) fry given diet supplemented with probiotic during the
two months of first feeding. Turkish Journal of Fisheries and Aquatic Sciences,
8(1), 43-48.
Bamberger, A. (2009). Semi-natural incubation techniques for
atlantic salmon, salmo salar: Opportunities and limitations for
restocking. Aquaculture, 293(3-4), 221-230. doi:10.1016/j. Aquaculture.
2009.03.040
Bardonnet, A., & Baglinière, J. L. (2000). Fresh
water habitat of Atlantic salmon (Salmo salar). Canadian Journal of Fisheries
and Aquatic Sciences, 57(2), 497-506
Barnabé, G. 1991. Bases biologiques et
écologiques de l'aquaculture. Coll. TEC & DOC. Lavoisier (ed). 489
p.
Beau, A. (2002). Contribution à l'étude de la
restauration du saumon atlantique (Salmo salar Linné) dans le
bassin de l'Adour.Thèse de doctorat. Université de Toulouse.
Bell, M. V., Henderson, R. J., & Sargent, J. R. (1986).
The role of polyunsaturated fatty acids in fish. Comparative Biochemistry and
Physiology Part B: Comparative Biochemistry, 83(4), 711719.
Berg, O. K., Arnekleiv, J. V., & Lohrmann, A. (2006). The
influence of hydroelectric power generation on the body composition of juvenile
Atlantic salmon. River research and Applications, 22(9), 993-1008.
Berg, O. K., Hendry, A. P., Svendsen, B., Bech, C., Arnekleiv,
J. V., & Lohrmann, A. (2001). Maternal provisioning of offspring and the
use of those resources during ontogeny: variation within and between Atlantic
salmon families. Functional Ecology, 15(1), 13-23.
Bize, J., Grenet, B., & Maneglier, H. (1981). Le pouvoir
épurateur du complexe alluvial en bordure de rivière. Techniques
et Sciences Municipales-L'eau, 393-401.
Bligh, E. G., & Dyer, W. J. (1959). A rapid method of
total lipid extraction and purification. Canadian journal of biochemistry and
physiology, 37(8), 911-917.
Bley P.W. & Moring J.R. (1988). Freshwater and ocean
survival of Atlantic salmon and steelhead: A synopsis, U.S. Fish and Wildlife
Service, Biological Report, 88 (9), 22 p.
Boglione, C., Gagliardi, F., Scardi, M., & Cataudella, S.
(2001). Skeletal descriptors and quality assessment in larvae and post-larvae
of wild-caught and hatchery-reared gilthead sea bream (Sparus aurata L. 1758).
Aquaculture, 192(1), 1-22.
33
Bourg, A. (1992). Effet filtre des berges et qualité
des eaux pompées en nappe alluviale. Courants, 14, 14-19.
Bourre, J. M., Oaland, O., & Lea, T. B. (2006). Les
teneurs en acides gras oméga-3 des saumons Atlantique sauvages
(d'Écosse, Irlande et Norvège) comme références
pour ceux d'élevage. Médecine et nutrition, 42(1), 36-49.
Burkhalter, D. E., & Kaya, C. M. (1977). Effects of
prolonged exposure to ammonia on fertilized eggs and sac fry of rainbow trout
(Salmo gairdneri). Transactions of the American Fisheries Society, 106(5),
470-475.
Cahu, C., Zambonino, J., Villeneuve, L., & Gisbert, E.
(2004). Nutrition, développement et morphogenèse chez les larves
de poisson. UMR 1067 Nutrition. Aquaculture et génomique. IFREMER Brest.
Aquafilia, 2004, 6: 5-9
Cazeneuve, L., et Lascaux, J.M., (2008). Synthèse des
capacités d'accueil en juvéniles et géniteurs de Saumon
atlantique (Salmo salar L.) des cours d'eau du bassin de la Dordogne.
41 p. (Rapport
MI.GA.DO. 19D-08-RT).
Chapman, D. W. (1988). Critical review of variables used to
define effects of fines in redds of large salmonids. Transactions of the
American Fisheries Society, 117(1), 1-21.
Chatain, B. (1994). Abnormal swimbladder development and
lordosis in sea bass (Dicentrarchus labrax) and sea bream (Sparus auratus).
Aquaculture, 119(4), 371-379.
Chérot F., Cammaerts R. et Richez S. (2008).
Qualité biologique du réseau hydrographique wallon.
Contrôle d'enquete. Rapport concernant la pollution du saumon du 11 juin
2008: analyse sur base de l'indicateur Macroinvertébrés, SPW :
DGO Agriculture, Ressources naturelles et Environnement (DGARNE-SPW).
Chittenden, C. M., Biagi, C. A., Davidsen, J. G., Davidsen, A.
G., Kondo, H., McKnight, A., & Zuehlke, B. (2010). Genetic versus
rearing-environment effects on phenotype: hatchery and natural rearing effects
on hatchery-and wild-born coho salmon. PLoS One, 5(8), e12261.
Clave, D., gracia, S., Sénamaud, J. C., & Guilhen,
L. (2013). Restauration du saumon atlantique (salmo salar l.) sur le
bassin de la Dordogne: production, alevinages et suivis, année 2012.
(Rapport
MI.GA.DO. 28-13-RT)
34
Cowey, C. B., Bell, J. G., Knox, D., Fraser, A., & Youngson,
A. (1985). Lipids and lipid antioxidant systems in developing eggs of salmon
(Salmo salar). Lipids, 20(9), 567-572.
Crisp, D. T. (1996). Environmental requirements of common
riverine European salmonid fish species in fresh water with particular
reference to physical and chemical aspects. Hydrobiologia, 323(3), 201-221.
Crisp, D. T. (1993). The environmental requirements of salmon and
trout in fresh water. In Freshwater forum (Vol. 3, No. 3, pp. 176-202).
Cuinat R. (1971). Écologie et repeuplement des cours
d'eau à truites (1ère partie). Bulletin français de
pisciculture, (240), 71-106.
Czerniawski, R., Pilecka-Rapacz, M., Domagaa, J., &
Krepski, T. (2010). Larval rearing of Atlantic salmon and sea trout using
nauplii of Artemia salina. Sea, 99, 0-40.
Czesny, S., Rinchard, J., & Dabrowski, K. (2005).
Intrapopulation variation in egg lipid and fatty acid composition and embryo
viability in a naturally spawning walleye population from an inland reservoir.
North American Journal of Fisheries Management, 25(1), 122-129
Descroix, A., Desvilettes, C., Bec, A., Martin, P., &
Bourdier, G. (2010). Impact of macro invertebrate diet on growth and fatty acid
profiles of restocked Atlantic salmon ( Salmo salar ) parr from a large
European river (the Allier). Canadian Journal of Fisheries and Aquatic
Sciences, 67(4), 659-672
Doussan, C., Ledoux, E., Poitevin, G., & Detay, M. (1995).
Transferts rivière-nappe et effet filtre des berges. Application aux
transferts de l'azote. La Houille Blanche, (8), 16-21.
Dumas J., Darolles V. (1999). Caractéristiques
environnementales et survie embryo larvaire du Saumon atlantique, Salmo
salar L., dans un cours d'eau du piémont pyrénéen, la
Nivelle (France), Cybium, 23 (1) suppl., 29-44.
Dumas, J., & Marty, S. (2006). A new method to evaluate
egg-to-fry survival in salmonids, trials with Atlantic salmon. Journal of
Fish Biology, 68(1), 284-304.
Dumas, J., Olaïzola, M., & Barrière, L.
(2007). Survie embryonnaire du saumon Atlantique (Salmo salar L.) dans
un cours d'eau du sud de son aire de répartition, la Nivelle. Bulletin
Français de la Pêche et de la Pisciculture, (384), 39-60.
35
Durville, P., P. Bosc, R. Galzin and C. Conand (2003).
Aptitude à l'élevage des post-larves de poissons coralliens.
Bulletin de la CPS, 11: 21-30
Einum, S., & Fleming, I. A. (2000). Selection against late
emergence and small offspring in Atlantic salmon (Salmo salar). Evolution,
54(2), 628-639.
Einum, S., Thorstad, E. B., & Næsje, T. F. (2002).
Growth rate correlations across life-stages in female Atlantic salmon. Journal
of Fish Biology, 60(3), 780-784.
Elskus, A. A., Collier, T. K., & Monosson, E. (2005).
Interactions between lipids and persistent organic pollutants in fish.
Biochemistry and molecular biology of fishes, 6, 119-152
Fishelson, L. (1995). Comparative morphology and cytology of the
olfactory organs in moray eels with remarks on their foraging behaviour. Anat.
Rec. 243: 403-412.
Fjelldal, P. G., Glover, K. A., Skaala, Ø., Imsland,
A., & Hansen, T. J. (2009).Vertebral body mineralization and deformities in
cultured Atlantic salmon (Salmo salar L.): effects of genetics and
off-season smolt production. Aquaculture, 296(1), 36-44.
Gaignon, J. L., & Prouzet, P. (1982). Élevage du
saumon atlantique (Salmo salar) en écloserie: essai
d'utilisation de substrats durant la résorption vitelline. Bulletin
Français de Pisciculture, (287), 1-5.
Garcia de Leaniz, C., Fleming, I. A., Einum, S., Verspoor, E.,
Jordan, W. C., Consuegra, S.,& Webb, J. H. (2007). A critical review of
adaptive genetic variation in Atlantic salmon: implications for conservation.
Biological Reviews, 82(2), 173-211.
Gatesoupe J., Zambonino-Infante J.-L, Cahu, C., & Bergot P
(1999). Ontogenèse, développement et physiologie chez les larves
de poissons in nutrition et alimentation des poissons (Editions INRA).
http://archimer.ifremer.fr/doc/00086/19713/
Gibson, R. J. (1993).The Atlantic salmon in fresh water:
spawning, rearing and production. Reviews in Fish Biology and Fisheries, 3(1),
39-73.
Gjerde, B., Pante, M. J. R., & Baeverfjord, G. (2005).
Genetic variation for a vertebral deformity in Atlantic salmon (Salmo
salar). Aquaculture, 244(1), 77-87.
Greig S.M., Sear D.A., Smallman D & Carling P.A. (2005).
Impact of clay particles on the cutaneous exchange of oxygen across the chorion
of Atlantic salmon eggs, Journal of Fish Biology, 66, 1681-1691.
Jonsson, B., Jonsson, N., & Hansen, L. P. (2003). Atlantic
salmon straying from the River Imsa. Journal of Fish Biology, 62(3),
641-657.
36
Guergazi, S., & Achour, S. (2005). Caractéristiques
physico-chimiques des eaux d'alimentation de la ville de Biskra. Pratique de la
chloration. Larhyss Journal, 4, 119-127.
Guerrin, F., & Dumas, J. (2001). Knowledge representation
and qualitative simulation of salmon redd functioning. Part I: qualitative
modeling and simulation. Biosystems, 59(2), 75-84.
Gueguen, J. C., & Prouzet, P. (Eds.). (1994). Le saumon
atlantique: biologie et gestion de la ressource. Editions Quae.
Hansen, T., & Torrissen, K. R. (1984). Artificial hatching
substrate and different time of transfer to start feeding: effect on growth and
protease activities of the Atlantic salmon (salmo salar). ICES, Coun.
Meet. 1984 (F:22).
Hansen, T., Christiansen, R., Nortvedt, R., Stefansson, S.,
& Taranger, G. L. (1990). Artificial hatching substrates improve growth and
yolk absorption of salmonids. Canadian Technical Report of Fisheries and
Aquatic Sciences, 1761, 69-75.
Heggberget, T. G., & Wallace, J. C. (1984). Incubation of
the Eggs of Atlantic Salmon, Salmo salar, at low temperatures.
Canadian Journal of Fisheries and Aquatic Sciences, 41, 2, 389-391.
Heggenes, J., and T. Traaen. 1988. Downstream migration and
critical water velocities in stream channels for fry of four salmonid species.
Journal of Fish Biology 32: 717-727.
Heinimaa, S., & Heinimaa, P. (2004). Effect of the female
size on egg quality and fecundity of the wild Atlantic salmon in the sub-arctic
River Teno. Boreal Environment Research, 9(1), 55-62.
Henderson, R. J., & Tocher, D. R. (1987). The lipid
composition and biochemistry of freshwater fish. Progress in lipid research,
26(4), 281-347.
Jobling M., Jorgensen E.H., Christiansen J.S., Arnesen A.M.,
Palsson J.O. (1992). Investigation of growth requirements and aquaculture
potential of Arctic charr (Salvelinus alpinus). Aquaculture of Arctic
charr and brown trout. In S. Adalsteinsson Ed., Reykjavik, sous presse.
Jonsson, B., & Jonsson, N. (2006). Cultured Atlantic
salmon in nature: a review of their ecology and interaction with wild fish.
ICES Journal of Marine Science: Journal du Conseil, 63(7), 11621181.
Louhi, P., Mäki-Petäys, A., & Erkinaro, J.
(2008). Spawning habitat of Atlantic salmon and brown trout: general criteria
and intra gravel factors. River Research and Applications, 24(3), 330-339.
37
Julien, H. P., & Bergeron, N. E. (2006). Effect of fine
sediment infiltration during the incubation period on Atlantic salmon
(Salmo salar) embryo survival. Hydrobiologia, 563(1), 61-71.
Jungwirth M., Winkler H.(1984). The temperature dependence of
embryonic development of grayling (Thymallus thymallus), Danube salmon
(Hucho hucho), Arctic charr (Salvelinus alpinus) and brown
trout (Salmo trutta fario). Aquaculture, 38, 315-327
Kallio-Nyberg, I., Romakkaniemi, A., Jokikokko, E., Saloniemi,
I., & Jutila, E. (2015). Differences between wild and reared Salmo
salar stocks of two northern Baltic Sea rivers. Fisheries Research, 165,
85-95.
Kane, T. R. (1988). Relationship of temperature and time of
initial feeding of Atlantic salmon. The Progressive Fish-Culturist, 50(2),
93-97.
Kirkland, D. (2012). A review of factors influencing
artificial salmonid incubation success and a spate river-specific incubator
design. Fisheries Management and Ecology, 19(1), 1-9.
Krieg, F., Guyomard, R., Maisse, G., & Chevassus, B.
(1988). Influence du substrat et du génotype sur la croissance et la
survie au cours de la résorption vitelline chez la truite commune
(Salmo trutta L.). Bulletin Français de la Pêche et de la
Pisciculture, (311), 126-133.
Laffineur, B., (1982). Interprétations des
résultats et analyses physico-chimiques et biologiques d'une
rivière ardennaise, l'Aisne (influence des camplings). Mémoire
d'Agronomie, faculté agronomique de Gembloux
Lapointe, M. F., Bergeron, N. E., Bérubé, F.,
Pouliot, M. A., & Johnston, P. (2004). Interactive effects of substrates
and silt contents, redd-scale hydraulic gradients, and interstitial velocities
on egg-to-emergence survival of Atlantic salmon (Salmo salar).
Canadian Journal of Fisheries and Aquatic Sciences, 61(12), 2271-2277.
Larsson, S., Linnansaari, T., Vatanen, S., Serrano, I., &
Haikonen, A. (2011).Feeding of wild and hatchery reared Atlantic salmon
(Salmo salar L.) smolts during downstream migration. Environmental
Biology of Fishes, 92(3), 361-369.
Lenders, H. J. R., Chamuleau, T. P. M., Hendriks, A. J.,
Lauwerier, R. C. G. M., Leuven, R. S. E. W., & Verberk, W. C. E. P. (2016).
Historicalrise of water power initiated the collapse of salmon stocks.
Scientific Reports, 6.
38
Lubzens, E., Young, G., Bobe, J., & Cerdà, J. (2010).
Oogenesis in teleosts: how fish eggs are formed. General and Comparative
Endocrinology, 165(3), 367-389.
MacCrimmon, H. R., & Gots, B. L. (1986). Laboratory
observations on emergent patterns of juvenile Atlantic salmon, Salmo
salar, relative to sediment loadings of test substrate. Canadian journal
of zoology, 64(6), 1331-1336.
Macqueen, D. J., Robb, D. H., Olsen, T., Melstveit, L., Paxton,
C. G., & Johnston, I. A. (2008). Temperature until the `eyed stage'of
embryogenesis programmes the growth trajectory and muscle phenotype of adult
Atlantic salmon. Biology Letters, 4(3), 294-298.
Massa, F. (2000). Sédiments, physico-chimie du
compartiment interstitiel et développement embryo-larvaire de la truite
commune (Salmo trutta): Etude en milieu naturel anthropisé et en
conditions contrôlées (Doctoral dissertation, INAPG).
Matschak, T. W., Stickland, N. C., Mason, P. S., &Crook,
A. R. (1997). Oxygen availability and temperature affect embryonic muscle
development in Atlantic salmon (Salmo salar L.). Differentiation,
61(4), 229-235
McCormick, S. D., Shrimpton, J. M., Carey, J. B., O'dea, M.
F., Sloan, K. E., Moriyama, S., & Björnsson, B. T. (1998). Repeated
acute stress reduces growth rate of Atlantic salmon parr and alters plasma
levels of growth hormone, insulin-like growth factor I and cortisol.
Aquaculture, 168(1), 221-235.
Médale, F., Lefèvre, F., & Corraze, G.
(2003). Qualité nutritionnelle et diététique des poissons.
Cahiers de Nutrition et de Diététique, 38, 37-44.
Mellinger, J. (1995). Les réserves lipidiques de l'oeuf
des poissons. Annee Biologique, 34(2), 6390.
Murray, C. B., & Beacham, T. D. (1986). Effect of
incubation density and substrate on the development of chum salmon eggs and
alevins. The Progressive Fish-Culturist, 48(4), 242-249.
Murzina, S. A., Nefedova, Z. A., Pekkoeva, S. N., Veselov, A.
E., Efremov, D. A., & Nemova, N. N. (2016). Age-Specific Lipid and Fatty
Acid Profiles of Atlantic Salmon Juveniles in the Varzuga River.
International journal of molecular sciences, 17(7), 1050.
Nislow, K. H., Folt C. L., and Parrish D. L. (2000). Spatially
explicit bioenergetic analysis of habitat quality for age-0 Atlantic salmon.
Transactions of the American Fisheries Society 129: 1067-1081.
Prevost, E., & Rivot, E. (2004). Aide à la
décision pour la gestion des populations naturelles de saumon Atlantique
(Salmo salar). INRA-CIRAD. Rapport.
39
O'Connor W.C.K., Andrew T.E. (1998). The effects of siltation
on Atlantic salmon, Salmo salar L., embryos in the River Bush,
Fisheries Management and Ecology, 5, 393-401.
Okland, F., Jonsson, B., Jensen, A. J., & Hansen, L. P.
(1993). Is there a threshold size regulating seaward migration of brown trout
and Atlantic salmon? Journal of Fish Biology, 42(4), 541-550.
Ottaway, E. M., & Forrest D. R. (1983). The influence of
water velocity on the downstream movement of alevins and fry of brown trout.
Journal of Fish Biology 19: 135-145
.
Pauwels S.J. & Haines T.A. (1994). Survival, hatching, and
emergence success of Atlantic Salmon eggs planted in three Maine streams, North
American Journal of Fisheries Management, 14, 125130.
Peng, J., Larondelle, Y., Pham, D., Ackman, R. G., &
Rollin, X. (2003). Polyunsaturated fatty acid profiles of whole body
phospholipids and triacylglycerols in anadromous and landlocked Atlantic salmon
(Salmo salar L.) fry. Comparative Biochemistry and Physiology Part B:
Biochemistry and Molecular Biology, 134(2), 335-348.
Pepper, V. A. (1984). Deep-substrate incubators: a field guide
for Atlantic salmon enhancement (Vol. 71). Dept. of Fisheries and Oceans.
Peterson, R. H., & Martin-Robichaud, D. J. (1995). Yolk
utilization by Atlantic salmon (Salmo salar L.) alevins in response to
temperature and substrate. Aquacultural Engineering, 14(1), 85-99.
Peterson, R. H., Spinney, H. C. E., &Sreedharan, A.
(1977). Development of Atlantic salmon (Salmo salar) eggs and alevins under
varied temperature regimes. Journal of the Fisheries Board of Canada, 34(1),
31-43.
Phillipart, J. C. P. (1989). Ecologie des populations de
poissons et caractéristiques physiques et chimiques des rivières
dans le bassin de la Meuse belge. Bulletin de la Société
Géographique de Liège, 25, 175-198.
Poon, D.C. (1977). Quality of salmon fry from gravel
incubators. Ph.D. Thesis, Oregon State University, Corvallis, OR., 253 p.
Porcher, J. P., & Bagliniere, J. L. (2001). Le Saumon
atlantique. Atlas des poisons d'eau douce de France, 240-243.
Sutterby, R. & Greenhalgh, M. (2005). Atlantic salmon: an
illustrated natural history. Shropshire: Merlin Unwin Books.
40
Rossignol, O. (2011).Ontogénie des capacités
physiologiques du saumon atlantique (Salmo salar L.):
héritabilité et tactique de reproduction (Doctoral dissertation,
Université Laval).
Rowe, D. K., Thorpe, J. E., & Shanks, A. M. (1991). Role
of fat stores in the maturation of male Atlantic salmon (Salmo salar)
parr. Canadian Journal of Fisheries and Aquatic Sciences, 48(3), 405-413.
Rubin J.-F. (1995). Estimating the success of natural spawning
of salmonids in streams. Journal of Fish Biology, 46, 603-622.
Saltveit, S. J., & Brabrand, Å. (2013). Incubation,
hatching and survival of eggs of Atlantic salmon (Salmo salar) in
spawning redds influenced by groundwater. Limnologica-Ecology and Management of
Inland Waters, 43(5), 325-331.
Sear, D. A., Jones, J. I., Collins, A. L., Hulin, A., Burke,
N., Bateman, S., & Naden, P. S. (2016). Does fine sediment source as well
as quantity affect salmonid embryo mortality and development? Science of the
Total Environment, 541, 957-968.
Selly, S. L. C., Hickey, J., & Stevens, J. R. (2014). A
tale of two hatcheries: Assessing bias in the hatchery process for Atlantic
salmon (Salmo salar L.). Aquaculture, 434, 254-263.
Serrano, I., Rivinoja, P., Karlsson, L., & Larsson, S.
(2009). Riverine and early marine survival of stocked salmon smolts, Salmo
salar L., descending the Testebo River, Sweden. Fisheries Management and
Ecology, 16(5), 386-394
Silverstein, J. T., Shearer, K. D., Dickhoff, W. W., &
Plisetskaya, E. M. (1999). Regulation of nutrient intake and energy balance in
salmon. Aquaculture, 177(1), 161-169.
Solberg, M. F., Zhang, Z., & Glover, K. A. (2015). Are
farmed salmon more prone to risk than wild salmon? Susceptibility of juvenile
farm, hybrid and wild Atlantic salmon Salmo salar L. to an artificial
predator. Applied Animal Behaviour Science, 162, 67-80
Sontheimer, H. (1980). Experience with river bank filtration
along the Rhine River. Journal American Water Works Association, 386-390
Stoknes, I. S., Økland, H. M., Falch, E., & Synnes,
M. (2004). Fatty acid and lipid class composition in eyes and brain from
teleosts and elasmobranchs. Comparative Biochemistry and Physiology Part B:
Biochemistry and Molecular Biology, 138(2), 183-191.
41
Thorstad, E. B., Whoriskey, F., Rikardsen, A. H., &
Aarestrup, K. (2011). Aquatic nomads: the life and migrations of the Atlantic
salmon. Atlantic salmon ecology, 1, 6.
Tkilbrei, O. T., & Holm, M. (1998). Effects of long-term
exercise on survival, homing and straying of released Atlantic salmon smolts.
Journal of Fish Biology, 52(5), 1083-1086.
Vallée, C. (2004). Sélection des sites de fraye
chez l'omble de fontaine Salvelinus fontinalis (Mitchill) et
succès reproducteur associé dans deux rivières naturelles
(Doctoral dissertation, Université du Québec à
Trois-Rivières).
Vaz-Serrano, J., Ruiz-Gomez, M. L., Gjøen, H. M., Skov,
P. V., Huntingford, F. A., Øverli, Ø., & Höglund, E.
(2011). Consistent boldness behaviour in early emerging fry of domesticated
Atlantic salmon (Salmo salar): decoupling of behavioural and
physiological traits of the proactive stress coping style. Physiology &
behavior, 103(3), 359-364.
Vibert, R. (1959). Dispositif vertical d'incubation en masse.
Bulletin Français de Pisciculture, (192), 104-115.
Webographie 1:
http://www.petitecamarguealsacienne.com/fr/la-pisciculture/activite-piscicole.html,
consulté le 6/13/2017
Webographie 2:
http://www.aquamerik.com/catalogue/produits.cgi?category=incubation_tapisastroturf,
consulté le 7/8/2017
Wiegand, M.D., Kitchen, C. & Hataley, J.M. (1991)
Incorporation of yolk fatty acids into body lipids of goldfish (Carassius
auratus L.) larvae raised at two different temperatures. Fish Physiol.
Biochem. 9, 199-213
Wiegand, M. D. (1996). Composition, accumulation and
utilization of yolk lipids in teleostfish. Reviews in Fish Biology and
Fisheries, 6(3), 259-286.

|
Annexe 1
Paramètres physico-chimiques
|
II
Concentration en oxygène dissous,
turbidité, température et pH dans la
rivière Aisne
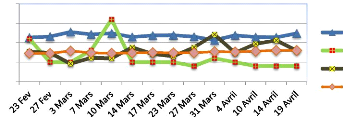
20
15
10
5
0
Oxygene dissous (mg/l) Turbidité (FAU) Température
(°C) pH
conductivité -Rivière Aisne
150
125
100
75
50
25
0
conductivité (uS/cm)
|
23 Fev
|
27 Fev
|
3 Mars
|
7 Mars
|
10 Mars
|
14 Mars
|
17 Mars
|
23 Mars
|
27 Mars
|
31 Mars
|
4 Avril
|
10
Avril
19
Avril
14
Avril
Concentration en oxygène dissous,
turbidité, température et pH dans la
rivière
Samson
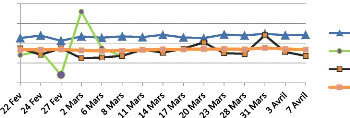
20
15
10
5
0
Oxygene dissous (mg/l) Turbidité (FAU) Température
(°C) pH
Figure 1: Paramètres physico-chimiques
enregistrés dans les rivières
conductivité -Rivière Samson
|
600 500 400 300 200 100
0
|
|
conductivité (uS/cm
|
Figure 2: paramètres physico-chimiques
enregistrés dans les rivières (suite)
Suivi de température, oxygène dissous, pH
et de turbidité: conditions Claies et tiroir à eau de
rivière
|
18 16 14 12 10 8 6 4 2 0
|
|
Température (°C) oxygène (mg/l)
pH
Turbidité (FAU)
|
|
23 fev
|
27 fev
|
3
mars
|
7 mars
|
10 mars
|
14 mars
|
17 mars
|
23 mars
|
27 mars
|
31 mars
|
4 avril
|
10
avril
14
avril
Suivi de température, oxygène dissous, pH
et de turbidité: conditions tiroir à eau de forage
|
14 12 10 8 6 4 2 0
|
|
Température (°C) oxygène (mg/l)
pH
|
|
23 fev
|
27 fev
|
3
mars
|
7 mars
|
10 mars
|
14 mars
|
17 mars
|
23 mars
|
27 mars
|
31 mars
|
4 avril
|
10
avril
14
avril
Figure 3 : Paramètres physico-chimiques
enregistrés en écloserie
IV
vitesse du courant (m/s)-Rivière Aisne
|
m/s
|
1,20 1,00 0,80 0,60 0,40 0,20 0,00
|
|
|
|
|
|
Radier 1
Radier 2
Radier 3
|
22 Fev24 Fev27 Fev2 Mars6 Mars8 Mars11 Mars14 Mars17 Mars20
Mars23 Mars28 Mars31 Mars3 Avril7 Avril
Hauteur d'eau (cm)-Rivière Aisne
cm
|
50 40 30 20 10
0
|
|
|
|
|
Radier 1
Radier 2
Radier 3
|
17
Mars
3 Avril
28
Mars
23
Mars
20
Mars
31
Mars
2 Mars 6 Mars 8 Mars 11 14
Mars Mars
Figure 4 : Vitesse courant et hauteur d'eau
enregistrées dans la rivière Aisne
V
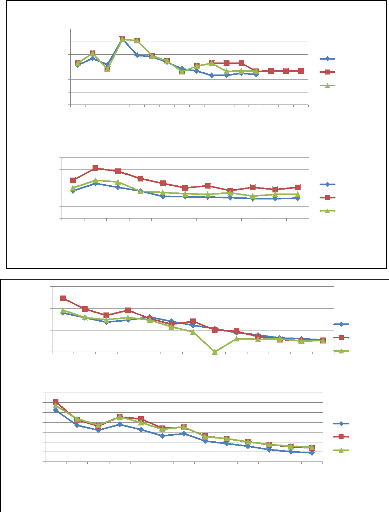
m/s
1,20
1,00
0,80
0,60
0,40
0,20
0,00
Radier 1
Radier 2
Radier 3
50
40
30
20
10
0
Radier 1
Radier 2
Radier 3
vitesse du courant (m/s)-Rivière Aisne
22 Fev24 Fev27 Fev2 Mars6 Mars8 Mars11 Mars14 Mars17 Mars20
Mars23 Mars28 Mars31 Mars3 Avril7 Avril
Hauteur d'eau (cm)-Rivière Aisne
cm
2 Mars 6 Mars 8 Mars 11 14
Mars Mars
Figure 5 : Vitesse courant et hauteur d'eau
enregistrées dans la rivière Aisne
17
Mars
3 Avril
23
Mars
31
Mars
28
Mars
20
Mars
vitesse du courant (m/s)-Rivière
Samson
Radier 1
Radier 2
Radier 3
31
Mars
23
Mars
27
Mars
14
19
Avril
Avril
4 Avril 10
Avril
23 Fev 27 Fev 3 Mars 7 Mars 14 17
Mars Mars
70
cm
60
Hauteur d'eau (cm)-Rivière Samson
50
Radier 1
Radier 2
Radier 3
4 avril 10
avril
0
19
14
avril
avril
40
30
20
10
23 fev 27 fev 3 mars 7 mars 14 17
31 mars
27 mars
23
mars mars mars
Figure 6 : Vitesse courant et hauteur d'eau
enregistrées dans la rivière Samson
1,5
(m/s)
1,0
0,5
0,0
|
Annexe 2
Tests statistiques ( ANOVA)
|
VII
A) SURVIE A L'EMERGENCE
Test de Hartley : homogénéité
des variances (P=0,95)
S : Samson ; A : Aisne
|
Radier 1-S
|
Radier 2-S
|
Radier 3-S
|
Radier 1-
A
|
Radier 2-A
|
Radier 3-A
|
|
32.7
|
43.3
|
56.0
|
8.7
|
44.7
|
44.7
|
|
6.0
|
0.0
|
57.3
|
0.0
|
40.0
|
42.7
|
|
28.7
|
50.7
|
36.7
|
6.0
|
20.0
|
31.3
|
|
19.3
|
47.3
|
28.0
|
50.7
|
4.0
|
2.7
|
|
moy
|
21.7
|
35.3
|
44.5
|
16.4
|
27.2
|
30.4
|
|
var
|
140.2963
|
563.8519
|
210.1852
|
537.63
|
353.3892
|
374.6233
|
|
ni
|
4
|
|
|
|
|
|
|
dl
|
3
|
|
|
|
|
|
|
na
|
6
|
|
|
|
|
|
|
dl
|
5
|
|
|
|
|
|
|
H calculé
|
4.019007
|
|
|
|
|
|
|
H tabulé
|
62
|
|
|
|
|
|
|
Concl
|
Homogénéité var ok
|
|
|
|
Test d'ANOVA
|
|
|
|
|
|
|
|
SCE
|
dl
|
CM
|
Fobs
|
P-value
|
|
|
Total
|
8535.925
|
23
|
|
|
|
|
|
Fact
|
1995.998
|
5
|
399.1995
|
1.098726
|
0.395116
|
ns
|
|
Res
|
6539.928
|
18
|
363.3293
|
|
|
|
B) SURVIE POST-EMERGENCE
Test de Hartley : homogénéité des
variances (P=0,95)
|
Tiroir eau rivière
|
Tiroir eau forage
|
Claie substrat
|
Claie vide
|
|
32.5925
|
59.4936
|
45.2915
|
16.6667
|
|
26.6666
|
73.4177
|
50.4273
|
1.3333
|
|
41.8518
|
83.1223
|
31.1965
|
20
|
|
MOYENNE
|
33.70363
|
72.0112
|
42.3051
|
12.66666667
|
|
VAR
|
58.57354
|
141.0625
|
99.14485588
|
99.11162222
|
|
ni
|
3
|
|
|
|
|
dl
|
2
|
|
|
|
|
na
|
4
|
|
|
|
|
dl
|
3
|
|
|
|
|
H calculé
|
2.408298
|
|
|
|
|
H tabulé
|
142
|
|
|
|
|
conclusion: Htab>Hcal, homogéneité des
variances ok
|
VIII
Test d'ANOVA
|
|
|
|
|
|
|
|
SCE
|
dl
|
CM
|
Fobs
|
P-value
|
|
|
Total
|
6245,789
|
11
|
|
|
|
|
|
Fact
|
5450,004
|
3
|
1816,6679
|
18,2629
|
0,000615
|
sss
|
|
Res
|
795,7851
|
8
|
99,4731
|
|
|
|
C) POIDS A L'EMERGENCE
Test de Hartley : homogénéité des
variances (P=0,95)
|
Samson
|
Aisne
|
Tiroir+eau de rivière
|
Tiroir+eau de forage
|
Claie+
substrat
|
Claie sans substrat
|
|
MOYENNE
|
142.3519
|
139.8704
|
128.1296
|
137.9259
|
138.1296296
|
107.3704
|
|
VAR
|
254.6852
|
195.8131
|
175.7753
|
134.6359
|
146.3413697
|
173.181
|
|
ni
|
54
|
|
|
|
|
|
|
dl
|
53
|
|
|
|
|
|
|
na
|
6
|
|
|
|
|
|
|
dl
|
5
|
|
|
|
|
|
|
Hcal
|
1.891659
|
|
|
|
|
|
|
Htab
|
2.11
|
|
|
|
|
|
|
conclusion: Htab>Hcal, homogeneite des variances
ok
|
Test d'ANOVA
|
|
|
|
|
|
|
|
SCE
|
dl
|
CM
|
Fobs
|
P-value
|
|
|
Total
|
103857,6
|
323
|
|
|
|
|
|
Fact
|
46594,67
|
5
|
9318,933
|
57,7516
|
3,6E-39
|
sss
|
|
Res
|
57262,89
|
318
|
180,072
|
|
|
|
D) LONGUEUR A L'EMERGENCE
Test de Hartley : homogénéité des
variances (P=0,95)
|
Samson
|
Aisne
|
Tiroir+eau de rivière
|
Tiroir+eau de forage
|
Claie+
substrat
|
Claie sans
substrat
|
|
MOYENNE
|
26.66667
|
27.57407
|
25.81481
|
27.22222
|
27.31481
|
26.24074074
|
|
VAR
|
|
0.867925
|
0.664221
|
0.719776
|
0.591195
|
0.521663
|
0.752271139
|
|
ni
|
54
|
|
|
|
|
|
|
|
dl
|
53
|
|
|
|
|
|
|
|
na
|
6
|
|
|
|
|
|
|
|
dl
|
5
|
|
|
|
|
|
|
|
Hcal
|
1.663764
|
|
|
|
|
|
|
|
Htab
|
2.11
|
|
|
|
|
|
|
conclusion: Htab>Hcal, homogéneité des
variances ok
|
IX
Test d'ANOVA
|
|
|
|
|
|
|
|
SCE
|
dl
|
CM
|
Fobs
|
P-value
|
|
|
Total
|
344,75
|
323
|
|
|
|
|
|
Fact
|
126,54
|
5
|
25,3092
|
36,8845
|
8,98E-30
|
sss
|
|
Res
|
218,20
|
318
|
0,6861
|
|
|
|
E) TAUX DE CROISSANCE SPECIFIQUE (SGR)
Test de Hartley : homogénéité des
variances (P=0,95)
|
Tiroir eau
rivière
|
Tiroir eau
forage
|
Claie substrat
|
Claie vide
|
|
4.33
|
4.37
|
4.90
|
4.24
|
|
3.69
|
4.15
|
4.19
|
5.60
|
|
4.14
|
4.37
|
4.15
|
5.75
|
|
MOYENNE
|
4.1
|
4.3
|
4.4
|
5.2
|
|
VAR
|
0.11
|
0.02
|
0.18
|
0.69
|
|
ni
|
3.00
|
|
|
|
|
dl
|
2.00
|
|
|
|
|
na
|
4.00
|
|
|
|
|
dl
|
3.00
|
|
|
|
|
H calculé
|
42.10
|
|
|
|
|
H tabulé
|
142.00
|
|
|
|
|
conclusion: Htab>Hcal, homogéneité des
variances ok
|
Test d'ANOVA
|
|
|
|
|
|
|
|
SCE
|
dl
|
CM
|
Fobs
|
P-value
|
|
|
Total
|
4.18
|
11.00
|
|
|
|
|
|
Fact
|
2.10
|
3.00
|
0.70
|
|
|
|
|
Res
|
11.02
|
8.00
|
1.38
|
0.51
|
0.69
|
ns
|
X
F) Lipides totaux
Test de Hartley : homogénéité des
variances (P=0,95)
|
Claie+
substrat
|
Claie sans
substrat
|
Samson
|
Aisne
|
Tiroir+eau de rivière
|
Tiroir+eau de forage
|
|
MOYENNE
|
171.7
|
192.7
|
184.1
|
185.3
|
210.2
|
193.5
|
|
VAR
|
179.93719
|
148.67173
|
327.850052
|
64.895099
|
160.87075
|
233.18772
|
|
Max var
|
327.850052
|
|
|
|
|
|
|
Min Var
|
64.895099
|
|
|
|
|
|
|
ni
|
6
|
|
|
|
|
|
|
dl
|
5
|
|
|
|
|
|
|
na
|
6
|
|
|
|
|
|
|
dl
|
5
|
|
|
|
|
|
|
Hcal
|
5,05
|
|
|
|
|
|
|
Htab
|
18,7
|
|
|
|
|
|
|
conclusion: Htab>Hcal, homogeneite des variances
ok
|
Test d'ANOVA
|
|
|
|
|
|
|
|
SCE
|
dl
|
CM
|
Fobs
|
P-value
|
|
|
Total
|
10496
|
35
|
|
|
|
|
|
Fact
|
4918.94
|
5
|
983.7881
|
5.291969
|
0.001333
|
sss
|
|
Res
|
5577.063
|
30
|
185.9021
|
|
|
|
G) LIPIDES NEUTRES
Test de Hartley : homogénéité des
variances (P=0,95)
|
Claie+
substrat
|
|
Claie sans
substrat
|
Samson
|
Aisne
|
Tiroir+eau de rivière
|
Tiroir+eau de forage
|
|
MOYENNE
|
65.3
|
|
77.4
|
73.5
|
77.9
|
91.9
|
78.0
|
|
VAR
|
73.0
|
|
37.3
|
133.2
|
25.7
|
70.3
|
71.0
|
|
ni
|
6
|
|
|
|
|
|
|
|
dl
|
5
|
|
|
|
|
|
|
|
na
|
6
|
|
|
|
|
|
|
|
dl
|
5
|
|
|
|
|
|
|
|
Hcal
|
5,12
|
|
|
|
|
|
|
|
Htab
|
18,7
|
|
|
|
|
|
|
|
conclusion: Htab>Hcal, homogeneite des variances
ok
|
Test d'ANOVA
|
SCE
|
dl
|
CM
|
Fobs
|
P-value
|
|
|
Total
|
4284.344
|
35
|
|
|
|
|
|
Fact
|
2231.955
|
5
|
446.391
|
6.524948
|
0.000324
|
sss
|
|
Res
|
2052.389
|
30
|
68.41297
|
|
|
|
XI
H) LIPIDES NEUTRES
1) 0 :4 (n-6)
Test de Hartley : homogénéité des
variances (P=0,95)
|
Claie+
substrat
|
Claie sans
substrat
|
Samson
|
Aisne
|
Tiroir+eau de rivière
|
Tiroir+eau de forage
|
|
MOYENNE
|
0.91
|
0.94
|
0.99
|
1.00
|
1.16
|
1.05
|
|
VAR
|
0.012016147
|
0.0045755
|
0.012825
|
0.007217
|
0.0100001
|
0.0060396
|
|
ni
|
6
|
|
|
|
|
|
|
|
dl
|
5
|
|
|
|
|
|
|
|
na
|
6
|
|
|
|
|
|
|
|
dl
|
5
|
|
|
|
|
|
|
|
Hcal
|
2,8
|
|
|
|
|
|
|
|
Htab
|
18,7
|
|
|
|
|
|
|
|
conclusion: Htab>Hcal, homogeneite des variances
ok
|
Test d'ANOVA
|
|
|
|
|
|
|
|
SCE
|
dl
|
CM
|
Fobs
|
P-value
|
|
|
Total
|
0.502637
|
35
|
|
|
|
|
|
Fact
|
2.39E-01
|
5
|
4.79E-02
|
5.5
|
0.001102776
|
sss
|
|
Res
|
0.263367
|
30
|
0.008778884
|
|
|
|
2) 0 : 5(n-3)
Test de Hartley : homogénéité des
variances (P=0,95)
|
Claie+ substrat
|
Claie sans
substrat
|
Samson
|
Aisne
|
Tiroir+eau de rivière
|
Tiroir+eau de forage
|
|
MOYENNE
|
4.80
|
5.17
|
5.59
|
5.62
|
7.17
|
5.86
|
|
VAR
|
0.388915415
|
0.3360789
|
0.7198171
|
0.4018814
|
0.4923698
|
0.2245573
|
|
ni
|
6
|
|
|
|
|
|
|
|
dl
|
5
|
|
|
|
|
|
|
|
na
|
6
|
|
|
|
|
|
|
|
dl
|
5
|
|
|
|
|
|
|
|
Hcal
|
3,21
|
|
|
|
|
|
|
|
Htab
|
18,7
|
|
|
|
|
|
|
|
conclusion: Htab>Hcal, homogeneite des variances
ok
|
Test d'ANOVA
|
|
|
|
|
|
|
|
SCE
|
dl
|
CM
|
Fobs
|
P-value
|
|
|
Total
|
32.53443
|
35
|
|
|
|
|
|
Fact
|
1.97E+01
|
5
|
3.94E+00
|
9.23E+00
|
2.11159E-05
|
sss
|
|
Res
|
12.8181
|
30
|
0.427270003
|
|
|
|
XII
3) 2 : 6(n-3)
Test de Hartley : homogénéité des
variances (P=0,95)
|
Claie+ substrat
|
Claie sans
substrat
|
Samson
|
Aisne
|
Tiroir+eau de rivière
|
Tiroir+eau de forage
|
|
MOYENNE
|
9.23
|
10.03
|
11.08
|
10.51
|
13.39
|
11.36
|
|
VAR
|
1.149657682
|
0.89099
|
2.7933286
|
1.4603948
|
1.8791131
|
1.1745631
|
|
ni
|
6
|
|
|
|
|
|
|
|
dl
|
5
|
|
|
|
|
|
|
|
na
|
6
|
|
|
|
|
|
|
|
dl
|
5
|
|
|
|
|
|
|
|
Hcal
|
3,14
|
|
|
|
|
|
|
|
Htab
|
18,7
|
|
|
|
|
|
|
|
conclusion: Htab>Hcal,
homogénéité des variances ok
|
Test d'ANOVA
|
|
|
|
|
|
|
|
SCE
|
dl
|
CM
|
Fobs
|
P-value
|
|
|
Total
|
107.5414
|
35
|
|
|
|
|
|
Fact
|
6.08E+01
|
5
|
1.22E+01
|
7.80E+00
|
8.38721E-05
|
sss
|
|
Res
|
46.74024
|
30
|
1.558007866
|
|
|
|
I) PHOSPHOLIPIDES
1) 0 : 4(n-6)
Test de Hartley : homogénéité des
variances (P=0,95)
|
Claie+ substrat
|
Claie sans
substrat
|
Samson
|
Aisne
|
Tiroir+eau de
rivière
|
Tiroir+eau de forage
|
|
MOYENNE
|
1.00
|
1.20
|
1.02
|
0.94
|
1.05
|
1.07
|
|
VAR
|
0.005449255
|
0.0077767
|
0.0006017
|
0.0015465
|
0.004042
|
0.0010481
|
|
ni
|
6
|
|
|
|
|
|
|
|
dl
|
5
|
|
|
|
|
|
|
|
na
|
6
|
|
|
|
|
|
|
|
dl
|
5
|
|
|
|
|
|
|
|
Hcal
|
13
|
|
|
|
|
|
|
|
Htab
|
18,7
|
|
|
|
|
|
|
|
conclusion: Htab>Hcal,
homogénéité des variances ok
|
Test d'ANOVA
|
|
|
|
|
|
|
|
SCE
|
dl
|
CM
|
Fobs
|
P-value
|
|
|
Total
|
0.329698
|
35
|
|
|
|
|
|
Fact
|
2.27E-01
|
5
|
4.55E-02
|
13.3
|
7.02E-07
|
sss
|
|
Res
|
0.102322
|
30
|
0.003410737
|
|
|
|
XIII
2) 0 : 5(n-3)
Test de Hartley : homogénéité des
variances (P=0,95)
|
Claie+
substrat
|
Claie sans
substrat
|
Samson
|
Aisne
|
Tiroir+eau de rivière
|
Tiroir+eau de forage
|
|
MOYENNE
|
3.98
|
4.51
|
4.53
|
4.05
|
4.74
|
4.45
|
|
VAR
|
0.047071294
|
0.2071286
|
0.0395173
|
0.0615099
|
0.0687501
|
0.0174825
|
|
ni
|
6
|
|
|
|
|
|
|
|
dl
|
5
|
|
|
|
|
|
|
|
na
|
6
|
|
|
|
|
|
|
|
dl
|
5
|
|
|
|
|
|
|
|
Hcal
|
12,17
|
|
|
|
|
|
|
|
Htab
|
18,7
|
|
|
|
|
|
|
|
conclusion: Htab>Hcal,
homogénéité des variances ok
|
Test d'ANOVA
|
|
|
|
|
|
|
|
SCE
|
dl
|
CM
|
Fobs
|
P-value
|
|
|
Total
|
4.814098
|
35
|
|
|
|
|
|
Fact
|
2.61E+00
|
5
|
5.21E-01
|
7.09E+00
|
0.000177
|
sss
|
|
Res
|
2.207298
|
30
|
0.073576604
|
|
|
|
3) 2 : 6(n-3)
Test de Hartley : homogénéité des
variances (P=0,95)
|
Claie+
substrat
|
Claie sans
substrat
|
Samson
|
Aisne
|
Tiroir+eau de rivière
|
Tiroir+eau de forage
|
|
MOYENNE
|
14.21
|
15.67
|
14.50
|
13.63
|
14.19
|
15.06
|
|
VAR
|
0.244565589
|
0.5213105
|
0.1788946
|
0.1720832
|
0.242714
|
0.113977
|
|
ni
|
6
|
|
|
|
|
|
|
|
dl
|
5
|
|
|
|
|
|
|
|
na
|
6
|
|
|
|
|
|
|
|
dl
|
5
|
|
|
|
|
|
|
|
Hcal
|
4,57
|
|
|
|
|
|
|
|
Htab
|
18,7
|
|
|
|
|
|
|
|
conclusion: Htab>Hcal,
homogénéité des variances ok
|
Test d'ANOVA
|
|
|
|
|
|
|
|
SCE
|
dl
|
CM
|
Fobs
|
P-value
|
|
|
Total
|
22.9711
|
35
|
|
|
|
|
|
Fact
|
1.56E+01
|
5
|
3.12E+00
|
1.27E+01
|
1.13E-06
|
sss
|
|
Res
|
7.367725
|
30
|
0.245590824
|
|
|
|
XIV
J) EVOLUTION DU COEFFICIENT DE VARIATION DU POIDS Test de
Hartley : homogénéité des variances (P=0,95)
|
Claie vide
|
Tiroir eau
forage
|
Tiroir eau rivière
|
Claie substrat
|
|
0.400678
|
1.100328
|
1.018229
|
0.769079
|
|
2.016791
|
1.047625
|
0.614308
|
2.075816
|
|
1.034614
|
0.858701
|
2.127489
|
1.221863
|
|
MOYENNE
|
1.150694
|
1.002218
|
1.253342
|
1.355586
|
|
VAR
|
0.663062
|
0.016142
|
0.613888
|
0.440302
|
|
ni
|
3
|
|
|
|
|
dl
|
2
|
|
|
|
|
na
|
4
|
|
|
|
|
dl
|
3
|
|
|
|
|
H calculé
|
4,11
|
|
|
|
|
H tabulé
|
142
|
|
|
|
|
conclusion: Htab>Hcal, homogéneité des
variances ok
|
Test d'ANOVA
|
|
|
|
|
|
|
|
SCE
|
dl
|
CM
|
Fobs
|
P-value
|
|
|
Total
|
3.67
|
11.00
|
|
|
|
|
|
Fact
|
0.20
|
3.00
|
0.07
|
0.10
|
0.95
|
ns
|
|
Res
|
5.20
|
8.00
|
0.65
|
|
|
|
|
|



