|
FACULTE DE MEDECINE
N° de thèse : ___________
CENTRE HOSPITALIER UNIVERSITAIRE
« LE BON SAMARITAIN »
WALIA - N'DJAMENA - TCHAD

Devenir à moyen et long terme des 50 enfants
cardiaques Tchadiens opérés par la chaîne de l'espoir de
2003 à 2012
THESE DE DOCTORAT EN MEDECINE
Présentée et soutenue publiquement le
11/11/2013
Par NEGUEMADJI NGARDIG NGABA
Sous la direction de :
Pr Jean Philippe LESBRE
Composition du jury :
Président :....................................................................................
Membres.....................................................................................................................................................................................................................................................................................
Année 2013
FACULTE DE MEDECINE
N° de thèse : ___________
CENTRE HOSPITALIER UNIVERSITAIRE
« LE BON SAMARITAIN »
WALIA - N'DJAMENA - TCHAD
Devenir à moyen et long terme des 50 enfants
cardiaques Tchadiens opérés par la Chaîne de l'Espoir de
2003 à 2012
Le Directeur de thèse
Pr Jean Philippe LESBRE
Le Doyen de la faculté
Pr Pierre FARAH
Pr
CANDIDAT : NEGUEMADJI NGARDIG NGABA
Vu, bon pour soutenir
Vu bon pour soutenir

SOMMAIRE
SOMMAIRE
ii
PERSONNEL ADMINISTRATIF ET
ENSEIGNANTS
iv
ADMINISTRATION
iv
LISTE DES ENSEIGNANTS
iv
DEDICACES
viii
REMERCIEMENTS
x
LISTE DES TABLEAUX
xii
LISTE DES FIGURES
xv
SIGLES ET ABREVIATIONS
xvii
RESUME
xx
OBJECTIFS DE L'ETUDE
3
I-GENERALITES
4
I-1-INTRODUCTION GENERALE
4
I-2-1. Le coeur : anatomie et
fonctionnement
6
I-3-LES PATHOLOGIES CARDIAQUES ET
TRAITEMENTS ASSOCIES
9
I-3-1.Cardiopathies
congénitales
10
I-3-2-Les valvulopathies
15
I-3-2-2.Insuffisance mitrale
15
I-3-2-3-Sténose
aortique
16
a-Sténoses pulmonaires
16
I-3-5-2-Les pathologies valvulaires
associées
17
I-4-1-Les interventions
classiques
18
I-4-2-1-La voie d'abord
20
I-4-3.La CEC et la
cardioplégie
21
I-5-Prothèse valvulaire
23
I-5-1.Critères de choix et
devenir
27
I-5-2-1-Plastie mitrale
29
I-5-2-2-Plastie aortique
29
I-5-2-3-Plastie tricuspidienne
30
I-5-2-4-Commissurotomie percutanée pour
sténose mitrale
30
II-METHODOLOGIE DE RECHERCHE
32
II-1-Cadre d'étude
32
II-2-Type et période de
l'étude
34
II-3-Population d'étude
34
II-4-Critères
d'opérabilité exigés par la Chaine de
l'Espoir
34
II-5-Critère de non
inclusion
35
II-5-Matériel
35
II-7-Recueil des
données
36
II-7-1-Echantillonnage
36
II-9-Analyse statistique
40
II-10-Ethique
40
III-RESULTATS
41
III-1.Caractéristiques
démographiques des patients opérés
41
III-2-Etiologies des maladies
cardiovasculaires des patients opérés
42
III.3-Evaluation des patients
opérés
44
III.3-Données
opératoires
51
IV-4.Devenir des patients
opérés
54
III-DISCUSSION
67
IV-1-Caractéristiques
démographiques des patients
67
V-Devenir des patients
opérés
71
CONCLUSION
76
V-RECOMMANDATIONS
78
REFERENCES
80
ANNEXES
i
Fiche pré opératoire de collecte de
données du .... / .... /......
i
Fiche post opératoire de collecte de
données du .... / .... /......
v
PERSONNEL ADMINISTRATIF ET ENSEIGNANTS
ADMINISTRATION
Doyen
: Pr Pierre Farah
Chargé des études
: Dr Mouassede Madengar
Chargé de stage
: Dr Loubasra Emmanuel
Chargé des affaires estudiantines : Père
Mayanan Nodjitan Camille
Secrétaire
: Mr Moudede RichardPERSONNEL ADMINISTRATIF
ET ENSEIGNANTS
LISTE DES ENSEIGNANTS
|
MEDECINE
|
|
Nom et prénoms
|
Matière enseignée
|
Ville / Pays
|
|
Pr Jean-Philippe Lesbre
|
Cardiologie
|
Amiens (France)
|
|
Pr Madeleine Ngandeu
|
Rhumatologie
|
Yaoundé (Cameroun)
|
|
Pr Georges Halabi
|
Endocrinologie
|
Beyrouth (Liban)
|
|
Pr Christophe Strady
|
Maladies infectieuses
|
Reims (France)
|
|
Dr Fady Haddad
|
Médecine interne
|
Beyrouth (Liban)
|
|
Dr George Khayat
|
Pneumologie
|
Beyrouth (Liban)
|
|
Dr Sami Richa
|
Psychiatrie
|
Beyrouth (Liban)
|
|
Dr Frederic Machai
|
Maladies infectieuses
|
Paris (France)
|
|
Dr Paul Desjacques
|
Neurologie
|
Genève (Suisse)
|
|
Dr Antoine Petit
|
Dermatologie
|
Paris (France)
|
|
Dr Xavier Cuevas
|
Néphrologie
|
Barcelone (Espagne)
|
|
Dr Maximo Mariotti
|
Pathologie générale
|
Milan (Italie)
|
|
Dr Ndeïta Kondji
|
Gastro-entérologie
|
N'Djamena (Tchad)
|
|
Dr Ngaryass Alphonse
|
Psychologie du malade
|
N'Djamena (Tchad)
|
|
|
GYNECO - OBSTETRIQUE ET PEDIATRIE
|
|
Nom et prénoms
|
Matière enseignée
|
Ville / Pays
|
|
Pr Carlo Akatcherian
|
Pédiatrie
|
Beyrouth
|
|
Dr Chantal Harb
|
Pédiatrie
|
Beyrouth (Liban)
|
|
Dr Lluis Marcet
|
Gynéco-obstétrique
|
Barcelone (Espagne)
|
|
Dr Mahamat Koyalta
|
Gynéco-obstétrique
|
N'Djamena (Tchad)
|
|
CHIRURGIE
|
|
Nom et prénoms
|
Matière enseignée
|
Ville / Pays
|
|
Pr Pierre Farah
|
Pathologies chirurgicales
|
N'Djamena (Tchad)
|
|
Pr Khalil Kharrat
|
Orthopédie
|
Beyrouth (Liban)
|
|
Pr Alain Le Duc
|
Urologie
|
Paris (France)
|
|
Dr Claudia Moscheni
|
Anatomie
|
Milan (Italie)
|
|
Dr Nadim Ayoub
|
Urologie
|
Beyrouth (Liban)
|
|
Dr Viscasillas
|
O.R.L
|
Barcelone (Espagne)
|
|
Dr Marc Garcia D'elias
|
Orthopédie
|
Barcelone (Espagne)
|
|
Dr Arnaud Geffroy
|
Anesthésie - réanimation
|
Paris (France)
|
|
Dr Patrick Baz
|
Ophtalmologie
|
Beyrouth (Liban)
|
|
Dr Rimtebaye Kimassoum
|
Anatomie uro-génitale
|
N'Djamena (Tchad)
|
|
SCIENCES BIOMEDICALES
|
|
Nom et prénoms
|
Matière enseignée
|
Ville / Pays
|
|
Pr AlbertoClivio
|
Immunologie
|
Milan (Italie)
|
|
Pr Ricardo Feshe
|
Physiologie
|
Milan (Italie)
|
|
Pr Ricardo Feshe
|
Neurophysiologie
|
Milan (Italie)
|
|
Pr Antonio Siccardi
|
Génétique
|
Milan (Italie)
|
|
Pr Antonio Siccardi
|
Virologie
|
Milan (Italie)
|
|
Pr Laurent Andreoletti
|
Virologie
|
Reims (France)
|
|
Pr Chalbi Belkahia
|
Pharmacologie générale
|
Tunis (Tunisie)
|
|
Pr Chalbi Belkahia
|
Pharmacologie spéciale
|
Tunis (Tunisie)
|
|
Pr Manuel Mark
|
Embryologie générale
|
Strasbourg (France)
|
|
Pr Manuel Mark
|
Embryologie spéciale
|
Strasbourg (France)
|
|
Pr Gerard Abadjian
|
Anatomie pathologique
|
Beyrouth (Liban)
|
|
Pr Giovanna Viale
|
Biologie cellulaire
|
Milan (Italie)
|
|
Pr Brahim Boy Otchom
|
Biochimie clinique
|
N'Djamena (Tchad)
|
|
Pr Ngarkodje Ngarasta
|
Math - statistiques
|
N'Djamena (Tchad)
|
|
Dr Claudia Khayat
|
Hématologie
|
Beyrouth (Liban)
|
|
Dr Fady Nasr
|
Hématologie
|
Beyrouth (Liban)
|
|
Pr Mauro Bruguani
|
Biochimie générale
|
Milan (Italie)
|
|
Dr Mbainodji Lodoum
|
Biochimie métabolique
|
N'Djamena (Tchad)
|
|
Pr Mauro Bruguani
|
Nutrition
|
Milan (Italie)
|
|
Dr Virgilio Cruccu
|
Microbiologie
|
Milan (Italie)
|
|
Pr Agostino Riva
|
Bactériologie
|
Milan (Italie)
|
|
Dr Pierre Manivit
|
Radiologie
|
France
|
|
Dr Virgilio Crucu
|
Parasitologie
|
Milan (Italie)
|
|
Dr Nanga Marcel
|
Mathématiques
|
N'Djamena (Tchad)
|
|
M. Joseph Baruthio
|
Biophysique
|
Strasbourg (France)
|
|
SANTE PUBLIQUE
|
|
Nom et prénoms
|
Matière enseignée
|
Ville / Pays
|
|
Pr Fréderic Deschamps
|
Médecine du travail
|
Reims (France)
|
|
Pr Bernard Proust
|
Médecine légale
|
Rouen (France)
|
|
Pr François Kohler
|
Epidémiologie
|
Nancy (France)
|
|
Dr Othingué Nadjitolna
|
Epidémiologie
|
N'Djamena (Tchad)
|
|
Dr Sani Charles
|
Santé publique
|
N'Djamena (Tchad)
|
|
Dr Riad Sarkis
|
Méthodologie recherche
|
Beyrouth (Liban)
|
DEDICACES
- A Dieu Tout Puissant : pour sa miséricorde et sa
clémence, et pour m'avoir soutenu durant cette longue période.
- A ma « feu » maman, bien aimée,
qui pour la première fois m'a montré le chemin de la
réussite par l'école. Trouve à travers ce modeste travail
toute mon affection et mon amour.
- A mon « feu » père pour le
soutien au cours de mon cursus scolaire. Que ce travail soit le
témoignage de tes efforts pour mon éducation.
- A mes grandes soeurs défuntes (Mané, Lata et
Modjirangal), mes frères (Tanguy et Roadoum) et mes soeurs (Madjibeye et
Linda) pour les moments de vicissitudes passés ensemble;
- A mes oncles paternels et maternels, respectivement, Dr
Madjiadoum Ngonkanyngayo, Dr Simon Madengar et le défunt Maire
Bérémadji Madengar Marc pour leurs conseils et soutiens dans
mes études;
- A toute ma famille paternelle et maternelle (tantes, oncles
et cousins) pour votre attention à mon égard;
- A toute la famille Nadjaldongar pour cette bonne relation
familiale entretenue avec moi depuis mon enfance ;
- Au Père Angelo Ghérardi d'avoir crée
cette institution au service des soins des malades ;
- Au Docteur Mario Ubach et sa femme Isabel d'avoir
été à l'origine de fonds pour mes études
médicales ;
- A mes parrains Espagnols pour leur gratitude à
financer mes études médicales ;
- A Monsieur le président de l'A.T.C.P (Association
Tchadienne pour la Communauté et le Progrès), Me
ISSA NGARMBASSA pour son souci à propos des malades et
sa lutte pour la cause des étudiants. Qu'il trouve à travers ce
travail l'expression de notre profonde gratitude.
- A toute l'équipe médicale et para
médicale du CHU « Le Bon Samaritain » et de
l'Hôpital de District de Goundi que j'ai côtoyé durant mon
cursus universitaire;
- A la Chaine de l'Espoir d'avoir créé cette
institution de bienfaisance salvatrice des enfants cardiaques
démunis ;
- A Nafissa pour son affection et toute son attention à
mon égard, et à qui j'exhorte de faire plus que moi.
Ce travail est le vôtre, soyez rassurés de mon
attachement et de mon amour
- A tous ceux qui nous ont précocement quitté,
que Dieu le Tout Puissant Allah vous accueille dans sa grâce.
- A tous les malades du monde entier : Prompt
rétablissement!
REMERCIEMENTS
Je le fais avec humilité et ferveur :
- Pour ceux qui m'ont donné le meilleur
d'eux-mêmes et qui m'ont éveillé aux valeurs
sociales ;
- Pour ceux qui, patiemment ont guidé mes pas
balbutiants dans la quête du savoir et dans l'appropriation des
connaissances qui enrichissent ce travail ;
- Pour ceux qui m'ont accepté avec mes insuffisances ou
qui se sont accommodés à mes exigences ;
- Enfin pour ceux qui par leurs conseils, leur soutien autant
moral que matériel ont permis que ce travail voie le jour et
s'élabore.
- Pendant que j'exprime à ces hommes et à ces
femmes de qualité ma sympathie et ma reconnaissance émue, mes
pensées vont à l'endroit de ceux mes proches rappelés
à l'omniscient et dont le souvenir continue à m'inspirer sur la
voie de l'effort.
Mes remerciements vont particulièrement à
l'endroit:
- De toute l'équipe professorale (Italienne, Espagnole,
Française, Libanaise, Suisse, Tchadienne, Camerounaise et
Tunisienne) : merci pour tout le savoir que j'ai hérité de
vous.
- Du Doyen de la faculté, Professeur Pierre
Farah : votre disponibilité, votre convivialité et le
désir de nous faire apprendre me marquent.
- De mon Directeur de Thèse Professeur Jean Philippe
Lesbre : les mots me manquent pour exprimer mes sentiments. Cher
Maître, c'est un privilège pour nous d'être parmi vos
élèves. Votre compétence et la qualité de votre
enseignement, font de vous un maître de référence. Tout ce
travail est votre oeuvre. Vous m'avez initié et vous m'avez donné
l'enthousiasme de la recherche scientifique et la connaissance dans le domaine
de la cardiologie par le suivi des malades cardiaques. Recevez ici l'expression
de mes sentiments les distingués.
- Du Docteur Serge Boey : homme simple et ouvert, je vous
remercie pour l'ajustement de ce travail de thèse et mon initiation
à l'échocardiographie m'ayant permis de diagnostiquer les
pathologies cardiaques opérables ;
- Du Professeur Brahim Boy Otchom : Mon cher maître
cela ne surprend guère ceux qui ont le privilège de vous
côtoyer. Votre rigueur scientifique, votre amour du travail illustrent
vos qualités d'homme de science. C'est l'occasion de vous exprimer mes
sincères remerciements.
- Du Docteur Fatimé Hadjé Ngoua, au Tchad, et
Nicole Ardaillou, en France, pour leur collaboration et leur facilitation
quant à l'accès aux dossiers permettant l'acheminement de ce
travail de thèse ;
- De mes condisciples et cadets de l'université :
nous avons connu des bons moments et ceux durs. Que cette flamme
d'amitié initiale
soit de plus en plus vive et grande dans nos vies futures.
LISTE DES TABLEAUX
Tableau I : Estimation globale de chirurgie
cardio-thoracique...............5
Tableau II : Fréquence des principales
cardiopathies malformatives...10
Tableau III: Aberrations chromosomiques correspondant aux
cardiopathies
congénitales.........................................................11
Tableau IV: Représentation de syndrome
associé aux cardiopathies et leur localisation
chromosomique...................................................12
Tableau V: cardiopathies secondaires à une
pathologie ou un traitement
maternel..................................................................................13
Tableau VI: Cardiopathies rhumatismales revues et non revues
en post
opératoire..............................................................................45
Tableau VII: Cardiopathies congénitales revues et non
revues en post
opératoire..............................................................................45
Tableau VIII : signes fonctionnels, gestes et résultats
des patients opérés pour IM et MM rhumatismales et
revus..............................46
Tableau IX: signes fonctionnels, gestes et résultats
des patients opérés pour IA rhumatismale et
revus...................................................47
Tableau X: Les résultats imparfaits de la plastie
mitrale....................47
Tableau XI : Mécanisme des IM et matériels
prothétiques utilisés chez les patients avec IM résiduelle
significative après plastie mitrale.........48
Tableau XII : Caractéristiques cliniques et
matériels prothétiques utilisés chez les patients avec
sténose mitrale après plastie mitrale pour IM....49
Tableau XIII: signes fonctionnels, gestes et résultats
des patients opérés pour RM rhumatismale et
revus....................................................50
Tableau XIV: signes fonctionnels, gestes et résultats
des patients opérés pour valvulopathies congénitales (3
IM, 1 IA) et revus.....................50
Tableau XV: signes fonctionnels, gestes et résultats
des patients opérés pour cardiopathies congénitales (shunt
et tétralogie de Fallot) et revus.51
Tableau XVI : Résultats des patients
opérés pour RM......................56
Tableau XVIII: Résultats des patients
opérés pour maladie mitrale (IM +
RM)........................................................................................57
Tableau XIX: Résultats post opératoires des IA
opérés et revus..........57
Tableau XX: Répartition des patients traités
pour IT........................58
Tableau XXI: Répartition des patients selon les
résultats de plastie d'IT................59
Tableau XXII: Répartition des patients selon le
degré de persistance de fuite tricuspide après
plastie......................................................59
Tableau XXIII: Analyse des caractéristiques cliniques
préopératoire et types d'anneau utilisé chez les patients
présentant une IT mineure après
plastie...........................................................................60
Tableau XXIV: Résultats des cardiopathies
congénitales opérées.......61
Tableau XXV: Gestes et résultats
opératoires immédiats des perdus de
vue.......................................................................................63
Tableau XXVI: Répartition des patients
opérés et décédés en fonction d'intervalle
et de cause du
décès................................................64
Tableau XXVII: Patients retenus mais
décédés avant l'opération........65
Tableau XXVIII : Récapitulatif des patients
retenus et opérés............66
LISTE DES FIGURES
Figure 1: Anatomie du coeur : coupe horizontale des quatre
cavités et gros
vaisseaux...........................................................................7
Figure 2: ECG : représentation schématique et
phases de contraction
cardiaque.................................................................................9
Figure 3 : Coupe schématique d'une sternotomie
médiane................20
Figure 4 : Représentation schématique d'un
stabilisateur mécanique fixé sur un écarteur sternal
(Octopus., Medtronic Inc)...........................22
Figure 5 : Anneau d'annuloplastie (valve mitrale) -
SJM™Séguin.........24
Figure 6 : Valve de prothèse mécanique
Carbomédics......................24
Figure 7 : Anneau d'annuloplastie Carpentier Edwards
physio............27
Figure 8: Distribution des patients selon le sexe et par
tranche
d'âge.......................................................................................41
Figure 9 : Nombre de patients opérés par
an...................................42
Figure 10 : Répartition des patients selon
l'étiologie........................42
Figure 11 : Répartition des patients avec
cardiopathies rhumatismales et atteinte des valves ayant
nécessité un geste opératoire..................43
Figure 12 : Répartition des patients selon les
cardiopathies congénitales
opérées.................................................................................44
Figure 13 : Patients revus et non revus après
l'opération..................44
Figure 14 : Plasties valvulaires des valvulopathies
rhumatismales opérées et
revus.....................................................................51
Figure 15: Répartition des différents types
d'anneau dans les plasties
mitrales.................................................................................52
Figure 16 : Numéro d'anneau Carpentier Edwards
utilisé dans les plasties mitrales
.....................................................................52
Figure 17 : Répartition des différents
types d'anneau dans les plasties
tricuspides...............................................................................53
Figure 18 : Numéro d'anneau de Carpentier Edwards
dans les plasties
tricuspides...............................................................................53
Figure 19 : Type de prothèses dans les
remplacements valvulaires (valves aortique et
mitrale).........................................................54
Figure 20 : Répartition des patients selon les
intervalles de consultation après
l'opération........................................................................54
Figure 21: Répartition des patients selon le nombre de
consultation après l'opération
.....................................................................55
Figure 22 : Répartition des patients selon les
résultats d'IM opérés et revus en
postopératoire..............................................................55
Figure 23: Patients revus en consultation après
l'opération et évalués..62
SIGLES ET ABREVIATIONS
°C : Degré Celsius
ACFA : arythmie complète par fibrillation
auriculaire
AEG : altération de l'état
général
ALAT : Alanine transaminase
ASAT: Aspartate transaminase
ASLO: antistreptolysine O
C.E: Carpentier Edwards
CEC: Circulation extracorporelle
CHU « BS » : Centre hospitalier
universitaire « Le Bon Samaritain »
CIA : Communication inter auriculaire
CIV : Communication inter ventriculaire
Cm : centimètre
DD : Diamètre diastolique
DE : Dyspnée d'effort
DS : Diamètre systolique
ECG : Electrocardiogramme
Epp : Epaisseur postérieur
FC : Fréquence cardiaque
FE : Fraction d'éjection
FR : Fraction de raccourcissement
HAD: Hypertrophie auriculaire droite
HAG: Hypertrophiée auriculaire gauche
HE: Hémoptysie d'effort
HMG: Hépatomégalie
HVD: Hypertrophie ventriculaire droite
HVG: Hypertrophie ventriculaire gauche
IAo: Insuffisance aortique
IM: Insuffisance mitrale
IMC :Indice de masse corporelle
Mm : millimètre
mmHg: millimètre mercure
NFS: Numération formule sanguine
OAP : OEdème aigu pulmonaire
OD : Oreillette droite
OG : Oreillette gauche
OMI: OEdèmes des membres inférieurs
OMS : Organisation mondiale de santé
Pvm : petite valve mitrale
RAA : Rhumatisme articulaire aigu
RHJ : Reflux hépato jugulaire
RM : Rétrécissement mitral
Rx : radiographie
SE : Syncope d'effort
SIV : Septum inter ventriculaire
SJM : Saint Jude médical
T° : Température
TA : Tension artérielle
TM : Temps mouvement
TVJ : Turgescence veineuse jugulaire
VD : Ventricule gauche
VG : ventricule gauche
VHB : Virus de l'hépatite B
VHC : Virus de l'hépatite C
VIH : Virus de l'immunodéficience humaine
VS : Vitesse de sédimentation
RESUME
Introduction: Les pathologies
cardiovasculaires, de nos jours, affectent toutes les classes sociales du monde
entier. Sur les 57 millions de décès survenus dans le monde en
2008, selon les estimations, 36 millions (63 %) étaient dus à des
maladies non transmissibles dont 17 millions par maladies cardiovasculaires.
Les cardiopathies valvulaires sévissent pour la plupart dans les pays,
tels que l'Afrique Sub-saharienne, l'Asie du sud-est, le Pacifique et les
populations indigènes de l'Australie et la Nouvelle Zélande.
Elles sont causées le plus souvent par le rhumatisme articulaire aigu
(RAA), avec atteinte de l'endocarde valvulaire et sous valvulaire
résultant de l'inflammation et des lésions cicatricielles du RAA.
Le but de cette étude est de contribuer à l'amélioration
de la prise en charge des cardiopathies des enfants.
Matériels et méthodes: il
s'agit d'une étude rétrospective et prospective
réalisée dans l'Hôpital Général de
Référence Nationale et le Centre Hospitalier Universitaire Bon
Samaritain de N'Djaména au Tchad. Il a été retenu 50
patients sur la base des dossiers, comportant une observation médicale
et un compte rendu opératoire. Les moyens d'évaluation
utilisés ont été cliniques, radiologiques, électro
cardiographiques, écho cardiographiques et biologiques.
Résultats: Il y avait 31 (62%) filles
et 19 (38%) garçons, âgés en moyenne de 10,68 ans
(extrêmes : 1 et 17 ans). La chirurgie a concerné 38 malades
ayant présenté une cardiopathie rhumatismale (76%), 12 une
cardiopathie congénitale (24%). La cardiopathie rhumatismale
était : mitrale (n=37), aortique (n=10) et tricuspide (n=7). La
cardiopathie congénitale était une tétralogie de Fallot
(n=4), une communication inter-ventriculaire (n=2), une insuffisance mitrale
congénitale (n=3), une cardiomyopathie obstructive du ventricule droit
(n=1), une communication inter-auriculaire associée à une
communication inter-auriculaire (n=1), une insuffisance mitrale associée
à une insuffisance aortique (n=1). Des 50 patients opérés,
38 sont revus et évalués après l'opération. Les
actes chirurgicaux pour les valvulopathies rhumatismales revues ont
consisté en : 29 plasties (21 mitrale, 6 tricuspide et 2
aortique) ; 9 remplacements valvulaires (5 aortique et 4 mitral) et
deux commissurotomies. En outre ont été réalisées
pour les cardiopathies congénitales (communication interauriculaire,
communication inter ventriculaire, tétralogie de Fallot) 9 cures
radicales et 4 plasties pour les valvulopathies congénitales (3
insuffisances mitrales et une insuffisance aortique). Des 50 patients
opérés : 38 cas ont été évalués,
23 avec des résultats satisfaisants, 6 cas à surveiller, 8 en
attente de réintervention, 8 patients perdus de vue, et la
létalité était de 14% (7 cas sur 50) pour l'ensemble des
opérés.
Conclusion: La prise en charge chirurgicale
des affections cardiaques est un problème majeur en raison des
difficultés de suivi. La plastie apparait comme l'option de choix pour
l'insuffisance mitrale, mais ne doit pas être réalisée
très tôt chez les enfants en croissance au risque d'une
sténose, elle est par contre à discuter pour la valve aortique
sans indication justifiée.
Mots-clés: enfants cardiaques
opérés, Chaîne de l'Espoir, Tchad
ABSTRACT
Introduction: Heart diseases affect the whole
world now. Among 57 millions of persons dead in 2008, according estimation, 36
millions (63%) were from non transmissible disease of which 17 million by the
heart diseases. Valvular heart diseases most of the time act severely in areas
like, sub-Saharan Africa, south-east Asia, Pacific and native populations of
Australia and New Zeland. It is caused the most of the time by the rheumatic
acute fever, with nuisance of endocardium's valvular and beneath valvular
apparatus resulting of inflammation and scared lesion. The aim of this study is
a contribution to the improvement in management of children's heart disease.
Materials and methods: A retrospective and
prospective study was conducted in National Reference General Hospital and
University Hospital center of Bon Samaritain in N'Djamena. We selected 50
patients on the basis of records containing medical observation and reporting
procedures of patients operated from 2003 to 2012. Clinical, radiological,
electrocardiographic, echocardiographic, and biological assessment tools were
used.
Results: There were 31 girls (62%) and 19
boys (38%), mean age of 10,68 (range: 1 to 17). The surgery involved 38
patients presented with rheumatic heart disease (76%), 12 patients presented
with congenital heart disease (24%). Rheumatic heart disease was: mitral
(n=37), aortic (n=10) and tricuspid (n=7). Congenital heart disease was a
tetralogy of Fallot (n=4), a ventricular sept defect (n=3), a mitral
regurgitation (n=2), an obstuctive cardiomyopahy of right ventricle (n=1), a
ventricular sept defect associated with patient atrial sept defect (n=1), a
mitral regurgitation associated with aortic regurgitation (n=1). Among 50
patients operated, 38 were re-examined after operation. The surgery of
rheumatic heart disease involved: 29 plasties (21 mitral valves, 6 tricuspid
valves, and 2 aortic valves); 9 valves replacements (5 aortic valves and 4
mitral valves); and 2 commissurotomies for mitral valve. In addition, were
performed a radical cure for the congenital heart disease (ventricular sept
defect, atrial sept defect and tetralogy of Fallot), and 4 plasties for other
congenital heart disease (3 mitral regurgitation and 1 aortic regurgitation).
From 50 patients operated : 38 were re-examined, 23 patients get
successful results, 6 patients to follow, 8 were awaiting for second operation,
8 patients were lost sight of, and the mortality rate was 14% for all operated
from the heart.
Conclusion: The surgical management of heart
disease remains a major concern because of following up difficulties. Plasty
appear like the best choice for mitral regurgitation, but must not be performed
early for young patient in growing at risk of mitral stenosis, on the other
hand plasty is debated without justified indication for aortic
regurgitation.
Key words: Cardiac children operated,
Chaîne de l'Espoir, Chad
INTRODUCTION
Les pathologies cardiovasculaires, de nos jours, affectent
toutes les classes sociales du monde entier. Sur les 57 millions de
décès survenus dans le monde en 2008, selon les estimations, 36
millions (63 %) étaient dus à des maladies non transmissibles
dont 17 millions par maladies cardiovasculaires [1,2]. D'après les
projections, le nombre annuel de décès par maladie
cardiovasculaire devrait passer de 17 millions en 2008 à 25 millions en
2030 [2].
Les cardiopathies valvulaires et congénitales sont
une cause fréquente de mortalité dans les pays en voie de
développement.
Selon l'OMS, au moins 15,6 millions de personnes ont une
valvulopathie rhumatismale (VR) [3]. Des 500.000 personnes qui
développent le rhumatismale articulaire aigu (RAA) chaque année,
presque la moitié développe une cardite.
Les cardiopathies valvulaires sévissent pour la
plupart dans les pays, tels que l'Afrique Sub-saharienne, l'Asie du sud-est,
le Pacifique et les populations indigènes de l'Australie et la Nouvelle
Zélande [4]. Elles sont causées le plus souvent par le rhumatisme
articulaire aigu (RAA), avec atteinte de l'endocarde valvulaire et sous
valvulaire résultant de l'inflammation et des lésions
cicatricielles du RAA. Cette maladie causée par une bactérie Gram
positif, le streptocoque, commence habituellement par une angine ou une
amygdalite. L'angine à Streptocoque A atteint
préférentiellement l'enfant de 5 à 15 ans. Le risque de
RAA chez les enfants d'âge scolaire vivant en milieu
défavorisé est de 0,2 à 0,5% par an, et la
prévalence des valvulopathies rhumatismales de 2% ou plus (étude
chez les aborigènes du Nord de l'Australie) [5].
Diverses études montrent que la prévalence des
cardiopathies rhumatismales varie de 15 à 20 cas pour 1000 [6].
La cardiopathie congénitale représente plus
d'un tiers (1/3) de toutes les pathologies congénitales chez les
nouveau-nés [7, 8, 9].
Il y a une pénurie aigüe de centre de chirurgie
cardio-thoracique dans les pays du tiers monde. Pénurie à
laquelle se surajoutent les difficultés d'accessibilité de ces
centres.
Les centres de chirurgie cardiaque pédiatrique en
Afrique et même dans le Maghreb sont rares pour ne pas dire
inexistants.
Par manque de centre de chirurgie cardiaque, en cas de
pathologies cardiovasculaires opérables chez les enfants, les patients
sont adressés à la Chaine de l'Espoir en France.
Nous nous sommes intéressés dans cette
étude à décrire l'évaluation clinique et
paraclinique des enfants retenus et opérés par la Chaîne de
l'Espoir de 2003 à 2012.
OBJECTIFS DE
L'ETUDE
1-Objectif général
· Contribuer à l'amélioration de la prise
en charge des cardiopathies des enfants.
2-Objectifs spécifiques
· Déterminer le nombre des cardiopathies
rhumatismales et congénitales des patients.
· Evaluer les résultats de la chirurgie cardiaque
en fonction de l'étiologie et du type d'intervention.
· Enumérer les complications post
opératoires.
· Identifier la mortalité post opératoire
et hospitalière des patients cardiaques.
I-GENERALITES
I-1-INTRODUCTION GENERALE
La chirurgie peut être définie, de façon
étymologique, comme la pratique du soin par l'usage des mains. Cette
discipline de la médecine a longtemps été freinée
dans son développement par trois facteurs : les connaissances
limitées en anatomie, les infections post-opératoires, et la
douleur. L'amélioration des connaissances sur le corps humain, les
découvertes sur les microbes et l'anesthésie (deuxième
moitié du XIXe siècle) ont permis aux chirurgiens de
perfectionner leur art. Les améliorations techniques
considérables et les réflexions profondes sur les protocoles
opératoires ont permis une progression fulgurante pendant le XXe
siècle.
Parmi les différentes spécialités
chirurgicales, la chirurgie cardiaque permet de traiter les affections du coeur
et des gros vaisseaux thoraciques. Pour les pionniers en chirurgie du coeur,
opérer cet organe ou même le voir battre dans la poitrine d'un
homme vivant relevait de la pure fiction. Malgré quelques tentatives
désespérées au début du XIXe siècle, la
première intervention sur cet organe n'a eu lieu qu'en 1896 :
réalisation d'une suture à coeur battant pour fermer une plaie du
ventricule droit. Cependant, il faut attendre les années 1950 et
l'apparition de la machine coeur-poumon pour permettre à la
spécialité de s'épanouir complètement.
La fin du XXe siècle a apporté une
nouvelle révolution dans le domaine chirurgical avec l'apparition de
nouvelles technologies dans le milieu hospitalier. Outre l'avènement des
techniques d'imagerie médicale, l'assistance par ordinateur offre des
possibilités d'amélioration de l'acte chirurgical en apportant
une assistance aux chirurgiens à la fois en pré- et en
per-opératoire (diagnostic, planification des interventions,
réalité augmentée pendant l'opération).
L'introduction des systèmes robotiques au sein des blocs
opératoires lors de ces 20 dernières années ouvre de
nouvelles perspectives pour les différentes spécialités,
en particulier pour la chirurgie cardiaque à coeur battant.
D'après un séminaire de l'International Cardiac Surgery en 2002
[10] sur la chirurgie cardiovasculaire et thoracique à propos de
l'estimation globale sur la chirurgie cardio-thoracique on a :
· Plus de 4.000 centres de chirurgies cardiaques
ouverts ;
· Plus de 6.000 chirurgiens cardio-thoraciques ;
· 93% de non accessibilité à la chirurgie
cardiaque en dehors de l'Amérique du Nord, l'Europe et l'Australie,
Tableau I : Estimation globale de la chirurgie
cardio-thoracique
|
Cas par population Centre par
population
|
|
Amérique du Nord : 1222/million
1/120.000
|
|
Australie : 780/million
1/1 million
|
|
Europe : 369/million 1/1 million
|
|
Afrique du Sud 147/million
|
|
Russie : 57/million
|
|
Asie : 25/million
|
|
Afrique : 18/million
|
|
|
|
Adapted from World health organization: The world health
Report 2000.
I-2-LE COEUR :
ANATOMIE ET FONCTIONNEMENT [11]
I-2-1. Le coeur : anatomie et fonctionnement
Le coeur est un organe creux et musculaire qui assure la
circulation du sang en pompant le sang par des contractions rythmiques vers les
vaisseaux sanguins et les cavités du corps.
Il consiste en quatre chambres, appelées cavités
cardiaques : les atria ou oreillettes en haut, et les ventricules en bas
(figure 1). Un mur musculaire épais, le septum, divise l'atrium et le
ventricule gauche de l'atrium et du ventricule droit, évitant le passage
de sang entre les deux moitiés du coeur. Des valves assurent le passage
unidirectionnel du sang depuis les oreillettes vers les ventricules puis vers
les gros vaisseaux (aorte et artères pulmonaires). La fonction de
pompage est assurée par les ventricules qui éjectent le sang vers
le corps (ventricule gauche) ou vers les poumons (ventricule droit). Leurs
parois sont plus épaisses que celles des oreillettes, et la contraction
des ventricules est plus importante pour assurer la distribution du sang alors
que la contraction des oreillettes contribue seulement à vider
complètement ces cavités. Le ventricule gauche est bien plus
massif que le droit parce qu'il doit fournir une pression considérable
pour forcer le sang à traverser tout le corps contre la pression
corporelle.
La paroi du coeur est composée de muscles qui, à
la différence des muscles squelettiques, ne se fatiguent pas. Elle
consiste en trois couches distinctes. La première est l'épicarde
qui se compose d'une couche de cellules épithéliales et de tissu
conjonctif. La deuxième est le myocarde ou muscle cardiaque. A
l'intérieur se trouve l'endocarde, une couche additionnelle de cellules
épithéliales et de tissu conjonctif. Le coeur a besoin pour
fonctionner d'une quantité importante de sang, distribuée par les
artères coronaires gauche et droite issues des embranchements de
l'aorte.
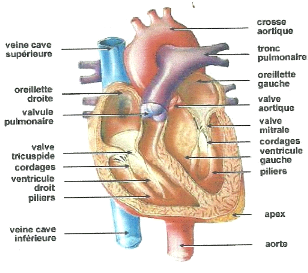
Fig. 1: Anatomie du coeur : coupe horizontale des quatre
cavités et gros vaisseaux
(Source : www.e-cardiologie.com (c))
Le coeur a un rythme au repos de 50 (sportif pratiquant une
activité endurante) à 80 battements par minute. Pendant un
effort, la fréquence cardiaque théorique est 220 moins
l'âge de la personne. Chaque battement du coeur entraîne une
séquence d'événements dont la succession est
appelée révolution cardiaque. Celle-ci consiste en trois
étapes majeures :
a)la systole auriculaire ou atriale : après le
remplissage passif des oreillettes droite et gauche grâce aux veines
caves et pulmonaires, ces deux cavités se contractent et éjectent
le sang accumulé vers les ventricules (remplissage actif).
b)la systole ventriculaire : c'est la contraction des
ventricules, expulsant le sang vers le système circulatoire. Sous la
pression sanguine, les valves auriculo-ventriculaires entre les oreillettes et
les ventricules se ferment (valve mitrale à gauche et valve tricuspide
à droite), ceci afin d'empêcher un reflux du sang vers les
oreillettes. Une fois le sang expulsé, les deux valves sigmoïdes
(la valve pulmonaire à droite et la valve aortique à gauche) se
ferment. Ainsi le reflux vers les ventricules est empêché. Pendant
cette systole, les oreillettes maintenant relâchées (diastole
atriale) se remplissent de sang.
c)la diastole : les deux ventricules sont relaxés
permettant le remplissage passif. La contraction des oreillettes vient terminer
le remplissage (remplissage actif).
La régulation des séquences de contraction du
muscle cardiaque est obtenue par le noeud sinusal situé dans la paroi
supérieure de l'atrium droit. Le courant électrique induit est
transmis dans l'ensemble des oreillettes et passe dans les ventricules par
l'intermédiaire du noeud auriculo-ventriculaire. Il se propage dans le
septum par le faisceau de His, constitué de fibres
spécialisées appelées fibres de Purkinje (fibres
musculaires permettant une bonne conduction électrique), assurant la
contraction simultanée des parois ventriculaires.
Ce système électrique explique la
régularité du rythme cardiaque et assure la coordination des
contractions auriculo-ventriculaires. L'analyse de cette activité
électrique est réalisée sur les mesures fournies par des
électrodes posées à la surface de la peau et qui
constituent l'électrocardiogramme ou ECG. Chaque phase de
l'activité électrique est associée à un état
du coeur (Figure 2).
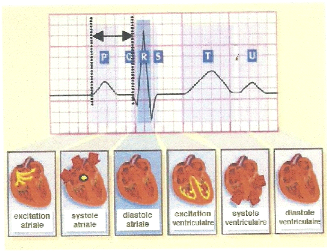
Fig. 2: ECG : représentation schématique et
phases de contraction cardiaque
(Source : http: //interstices.info).
I-3-LES PATHOLOGIES CARDIAQUES ET TRAITEMENTS ASSOCIES
Comme tous les organes, le coeur est susceptible d'être
malade ou de montrer un dysfonctionnement.
Des anomalies congénitales entrainent un
dysfonctionnement du coeur à la naissance regroupé en :
shunt (communication interventriculaire ou CIV, communication inter auriculaire
ou CIA, canal atrioventriculaire ou CAV, persistance du Canal artériel
ou CA), obstacle (rétrécissement pulmonaire ou RP,
rétrécissement aortique ou RA, et coarctation de l'aorte), et les
pathologies cyanogènes (tétralogie de Fallot).
Parmi certaines maladies cardiovasculaires acquises, certaines
touchent les vaisseaux coronariens et donc l'alimentation du coeur, alors que
d'autres concernent une ou plusieurs valves cardiaques et entraînent un
dysfonctionnement de la pompe cardiaque.
I-3-1.Cardiopathies congénitales
I-3-1-1-Etiologies des
pathologies congénitales [12, 13, 14]
Dans la grande majorité des cas, l'étiologie
d'une cardiopathie congénitale reste inconnue. L'incidence globale sur
la population est de l'ordre de 5 à 8 %o. Cette incidence augmente
lorsqu'il existe une cardiopathie congénitale chez un des parents (2
à 14%) ou dans la fratrie (3%).
Le tableau ci-après indique en pourcentage la
fréquence des principales malformations. De loin, la plus
fréquente est la communication interventriculaire (CIV).
Tableau II : Fréquence des principales
cardiopathies malformatives
|
Cardiopathies malformatives Fréquence
(%)
|
|
Communication inter ventriculaire (CIV) 30
|
|
Communication inter auriculaire (CIA) 8
|
|
Canal artériel (CA) 7
|
|
Rétrécissement pulmonaire (RP)
7
|
|
Coarctation de l'aorte 6
|
|
Tétralogie de Fallot 6
|
|
Rétrécissement aortique (RA) 5
|
|
Canal atrioventriculaire (CAV) 4,5
|
|
Transposition des gros vaisseaux (TGV) 4,5
|
Les cardiopathies congénitales peuvent être
rencontrées d'une part dans les anomalies de l'information
génétique, qu'elles soient chromosomiques ou
génétiques, et elles peuvent être d'autre part acquises au
cours de la grossesse.
a-Aberrations chromosomiques
La plupart des anomalies chromosomiques majeures
s'accompagnent d'une incidence élevée de cardiopathie. Dans ce
groupe, la trisomie 21 est la plus fréquente. Environ deux fois sur
trois, la cardiopathie est un CAV. Le tableau suivant représente les
aberrations chromosomiques associées aux cardiopathies.
Tableau III: Aberrations chromosomiques correspondant aux
cardiopathies congénitales
|
Aberrations
Cardiopathies
(fréquence des cardiopathies)
|
|
Trisomie 21 (50%) CAV, CIV, CIA, Tétralogie
de Fallot
|
|
Trisomie 18 (90%) CAV, CIV, CIA, canal
|
|
Trisomie 13 (90%) CAV, CIV, CIA, ventricule unique
|
|
Trisomie 22 CIV, CIA,
canal
|
|
4p- (50%) CAV, CIV,
CIA, Tétralogie de Fallot
|
|
5p- (20%) CIV, canal
|
*p : extrémités distales des bras courts
de chromosome
b-Anomalies génétiques
Malgré les avancées récentes dans
l'identification des mutations génétiques, peu de malades
atteints de cardiopathie congénitale ont une étiologie
génétique reconnue. Le tableau suivant indique les principales
cardiopathies, le plus souvent intégrées dans un syndrome, dont
l'anomalie génétique est maintenant connue. A un syndrome ne
corresponde pas toujours une anomalie génétique et une anomalie
génétique n'entraîne pas systématiquement un
syndrome complet.
Tableau IV: Représentation de syndrome
associé aux cardiopathies et leur localisation chromosomique
|
Syndrome
|
Cardiopathies
|
Localisation chromosomique
|
|
|
Di George
|
TAC, Fallot, int.arc aortique
|
22q11
|
|
|
Holt-Oram CIA
|
|
12q24
|
|
Noonan RP,myocardiopathie
Hypertrhophique,CIA
|
|
12q
|
|
Williams Sténose supraaortique
|
|
7q11.23
|
|
Retour veineux RVPAT
Pulmonaire anormal
Total (RVPAT) familial
|
|
4
|
*q : extrémités distales des bras longs des
chromosomes
c-Anomalies acquises mais survenant au cours de la
grossesse
Ces anomalies surviennent sur un foetus sain, atteint au cours
de la grossesse par un traitement, une intoxication, une virose ou une maladie
maternelle. Le tableau suivant représente les principales causes de
cardiopathies survenant au cours de la grossesse.
Tableau V: cardiopathies secondaires à une
pathologie ou un traitement maternel
|
Etiologies
infections
|
Cardiopathies
|
|
|
Rubéole
|
Canal, sténoses pulmonaires
|
|
|
Toxique
|
|
|
Antiépileptique
|
Diverses
|
|
Lithium
|
Anomalies d'Ebstein
|
|
Alcool
|
CIV, CIA
|
|
Antiprostaglandines
|
Myocardiopathie du ventricule droit (VD) par fermeture du
canal in utero
|
|
Maladies maternelles
|
|
|
Diabète
|
CIV, TGV, hypo-VG
|
|
|
Phénylcétonurie
|
Fallot, CIV, canal
|
|
I-3-1-2.Devenir des cardiopathies congénitales
opérées
Si l'on peut habituellement prévoir l'avenir à
court, voire à moyen terme des cardiopathies congénitales
opérées, il est difficile de prévoir leur avenir à
long terme. Soit que l'intervention adaptée n'ait pas assez de recul,
soit que les progrès médicochirurgicaux aient entièrement
modifié les séquences thérapeutiques, rendant illusoires
les projections à partir des premiers malades.
Néanmoins on peut tenter, schématiquement, de
classer les malformations suivant leurs espoirs thérapeutiques :
- Cardiopathies avec espoir de réparation
anatomique : cardiopathies guérissables : CIA, CIV, canal
artériel, RVPAT, TGV avec réparation anatomique (3/4 des cas), RP
(valvulotomie), certaines coarctations isolées
- Cardiopathies ayant souvent, après
« réparation » des dysfonctions
résiduelles : CAV (insuffisance mitrale), malformations mitrales
(insuffisance mitrale ou rétrécissement mitral),
tétralogie de Fallot (insuffisance pulmonaire, dysfonction ventriculaire
droite et dilatation de l'aorte ascendante), sténose pulmonaire
après valvulectomie (insuffisance pulmonaire), sténose valvulaire
aortique (sténose résiduelle ou fuite), tronc artériel
commun (tube ou insuffisance pulmonaire, valve aortique, dilatation de l'aorte
ascendante), doubles discordances (trouble de conduction, insuffisance
tricuspide et insuffisance cardiaque), coarctation avec dysplasie valvulaire
aortique (HTA et dilatation de l'aorte) ;
- Cardiopathies ne permettant que des interventions
palliatives : atrésie tricuspide (intervention de Fontan),
atrésie pulmonaire avec communication interventriculaire et
vascularisations pulmonaires multiples d'origine systémique, hypoplasie
ventriculaire droite ou gauche.
I-3-2-Les valvulopathies
Les maladies des valves cardiaques sont
caractérisées par un dysfonctionnement d'une des quatre valves.
Dans cette situation, les valves n'assurent plus leur fonction anti-retour et
des reflux surviennent.
I-3-2-1.Sténose mitrale
La sténose mitrale est principalement d'origine
rhumatismale [15,16]. Cette étiologie se trouve dans 99% de
sténose mitrale per opératoire au moment de remplacement
valvulaire. Vingt cinq pour cent environ de personnes avec une cardiopathie
rhumatismale ont un rétrécissement mitral pur, et 40 % ont une
maladie mitrale (rétrécissement et insuffisance mitrale) [17].
I-3-2-2.Insuffisance mitrale
L'anomalie de la structure anatomique de la valve mitrale
entraine une régurgitation mitrale [18,19]. Les principales causes d'une
insuffisance mitrale sont par prolapsus valvulaire, une cardiopathie
rhumatismale, une endocardite infectieuse, valves calcifiées, une
cardiomyopathie et une cardiopathie ischémique. Lorsque les
lésions anatomiques le permettent, une reconstruction artificielle est
envisageable : réparation de cordage reliant le feuillet de la valve
à la paroi du coeur, retrait d'un fragment de valvule
excédentaire (résection quadrangulaire), pose d'un anneau
imposant une forme à l'orifice. Dans les autres cas, le remplacement de
la valve est réalisé en utilisant soit une valve
mécanique, soit une prothèse biologique.
I-3-2-3-Sténose aortique
Le rétrécissement aortique a 3 principales
étiologies qui sont : congénitale (bicuspidie), rhumatismale
et dégénérative (maladie de Monckoberg). La sténose
valvulaire aortique sans affection valvulaire se rencontre plus chez l'homme
que chez la femme. Elle survient rarement dans une étiologie
rhumatismale, mais soit congénitale ou dégénérative
comme origine [20,21].
I-3-2-4-Insuffisance aortique
L'insuffisance aortique peut être primaire ou secondaire
(dégénérescence prothétique ou désinsertion
annulaire) à un remplacement valvulaire aortique. Le pourcentage de
l'insuffisance aortique primaire est en pleine croissance ces décennies
récentes. L'insuffisance aortique primaire est la cause la plus commune
avec plus de 50% de nos jours [22].
I-3-2-5.Pathologie tricuspide, pulmonaire et
association de plusieurs valvulopathies
I-3-2-5.1-Pathologies valvulaires pulmonaires
a-Sténoses pulmonaires
La principale cause de la sténose pulmonaire est la
forme congénitale [23]. L'inflammation rhumatismale de la valve
pulmonaire n'est pas commune, elle est habituellement associée à
l'affection de plusieurs valves cardiaques, et entraine rarement destruction
sérieuse de la valve pulmonaire.
b-Insuffisance pulmonaire
L'insuffisance pulmonaire est le plus souvent secondaire
à une hypertension pulmonaire (pour toute cause confondue) ou à
la dilatation de l'artère pulmonaire. Elle peut être idiopathique
ou consécutive à une maladie de système tel le syndrome de
Marfan. La seconde cause de l'insuffisance pulmonaire est l'endocardite
infectieuse.
I-3-5-2-Les pathologies valvulaires associées
Les pathologies valvulaires associées sont le plus
souvent d'origine rhumatismale, il y a également d'autres
variétés cliniques pouvant aboutir aux affections valvulaires
associées. La maladie de Marfan (entraine une dilatation de l'aorte
thoracique) et certaines pathologies systémiques pourraient causer des
prolapsus valvulaires et dilatation annulaire sur plusieurs valves cardiaques.
La calcification dégénérative aortique pourrait s'associer
à une calcification de l'anneau mitral, ceci aboutit à une
sténose aortique et une insuffisance mitrale. Différentes
conditions pathologiques pourraient affecter deux valves cardiaques chez un
même patient, tel le cas de l'endocardite infectieuse qui entraine une
insuffisance aortique et une ischémie qui cause une insuffisance
mitrale. Une insuffisance pulmonaire et une insuffisance tricuspide secondaire
à la dilatation de la valve pulmonaire et de l'anneau tricuspide, peut
être consécutive à une hypertension pulmonaire secondaire
à une pathologie valvulaire mitrale et/ou aortique. Cette situation est
une combinaison de l'affection organique rhumatismale de la valve tricuspide et
mitrale.
Il est important de reconnaître une affection de
plusieurs valves avant l'opération pour permettre la cure de toute valve
atteinte. Et réduire le risque d'échec de tentative de
réparation valvulaire pour minimiser la mortalité.
Quelle que soit la pathologie, lorsque le recours à
l'intervention chirurgicale est nécessaire, l'acte est lourd pour le
patient puisqu'il nécessite une ouverture du thorax pour accéder
au coeur. De plus, certaines pathologies entraînent aussi l'ouverture
d'une des 4 cavités.
I-4-LES INTERVENTIONS DE
CHIRURGIE CARDIAQUE [11]
I-4-1-Les interventions classiques
La difficulté majeure des interventions de chirurgie
cardiaque repose sur le fait que le coeur est un organe en mouvement :
contractions cardiaques et mouvements respiratoires induisent des
déplacements à forte dynamique et d'amplitude importante par
rapport au geste à réaliser (dans le cas d'un pontage coronarien,
les sutures sont réalisées sur des artères d'environ 2 mm
de diamètre). De plus, son activité doit être
assurée en permanence pour irriguer en oxygène tous les organes
du corps. Que ce soit pour des interventions à la surface du coeur ou
pour des actes endovasculaires, le problème du mouvement du coeur et de
ses composants se pose.
Pour progresser, les chirurgiens ont proposé une
méthode pour travailler sur coeur arrêté. Cependant, un
arrêt prolongé de la pompe cardiaque n'est pas possible pour la
survie du patient. Deux approches ont été étudiées.
Des expérimentations menées au début des années
1940 ont montré qu'il était possible de maintenir en vie un
patient avec un coeur arrêté en abaissant sa température
corporelle. Néanmoins, cette méthode présente un
problème majeur : la durée de l'hypothermie reste limitée
à une dizaine de minutes, ce qui réduit fortement le type
d'intervention réalisable. La seconde méthode repose sur
l'idée de mettre en place une circulation extra-corporelle (CEC)
assurant les fonctions de pompe et d'oxygénation du sang. La CEC est
assurée par une machine appelée « machine
coeur-poumon » mise au point dans les années 1950. C'est cette
deuxième solution qui s'est imposée.
Malgré des améliorations techniques, le principe
de la machine coeur-poumon reste le même : la circulation
extra-corporelle collecte le sang appauvri en oxygène provenant des
veines, l'enrichit en oxygène et l'injecte dans le réseau
artériel qui irrigue les organes. Ce matériel est donc
constitué de pompes et d'un oxygénateur. Pratiquement, un tuyau
est placé dans l'aorte et un autre est placé dans les veines
caves ou dans l'oreillette droite.
L'aorte et les veines qui arrivent au coeur sont
clampées. De manière à ce qu'il n'y ait plus de mouvements
dus à la respiration, le respirateur est arrêté. Ainsi, le
coeur et les poumons se trouvent totalement court-circuités. Le
médecin responsable de la circulation extracorporelle décidera du
moment où il est possible d'arrêter le coeur qui continue à
battre de façon automatique. Son arrêt complet est obtenu par la
réalisation d'une cardioplégie (injection directement dans les
artères coronaires d'un liquide très riche en potassium qui va
immédiatement provoquer l'arrêt du coeur lors de sa phase de
relaxation). Ensuite, l'intervention chirurgicale à proprement parler
peut commencer. Une fois l'intervention terminée, le coeur est à
nouveau branché sur l'aorte et perfusé par du sang. Les poumons
sont ventilés par un respirateur artificiel. Le coeur doit
théoriquement repartir de lui même, sinon il est
défibrilé. Ainsi une intervention classique de chirurgie
cardiaque peut se résumer comme suit :
a. Préparation du patient ;
b. Voie d'abord du coeur (sternotomie médiane puis
ouverture du péricarde) ;
Figure 3 : Coupe schématique d'une sternotomie
médiane
http://edoc.hu-berlin.de/habilitationen/rueckert-jens-carsten-2003-10-23/HTML/chapter3.html
(consulté le 02/03/2013)
c. Mise en place de la CEC et cardioplégie ;
d. Intervention chirurgicale ;
e. Arrêt de la CEC et relance de la pompe
cardiaque ;
f. Fermeture de la voie d'abord et surveillance
postopératoire.
I-4-2-Limitations de
l'intervention classique et solutions employées
Dans cette procédure, deux points sont la cause de
problèmes à la fois pour l'équipe chirurgicale et pour le
patient : la voie d'abord et l'emploi de la CEC.
I-4-2-1-La voie d'abord
La voie d'abord classique par sternotomie médiane offre
un accès visuel et manuel direct du coeur. Cette ouverture du thorax est
traumatisante pour le patient. L'idée est donc de proposer une voie
d'abord plus respectueuse du patient. Une première solution consiste
à remplacer la sternotomie médiane par une incision de moins de
10 cm dans le thorax: c'est la mini-thoracotomie. Cette voie d'abord est
réalisée entre les côtes du côté gauche de la
poitrine. Cependant, cette voie d'abord est restreinte aux patients qui ne
nécessitent qu'un simple pontage de l'artère coronaire principale
sur la face antérieure du coeur.
Une autre solution est la chirurgie mini-invasive. En
chirurgie mini-invasive, la voie d'abord est réduite à quelques
incisions, de 1 à 2 cm de long, où sont placés des
trocarts. A travers ces orifices sont introduits :
- un endoscope équipé d'une caméra qui
donne un retour visuel du champ opératoire sur un moniteur
vidéo.
- les instruments spécifiquement conçus pour ce
genre d'intervention, d'un diamètre de 8 à 10 mm et d'une
longueur d'environ 30 cm
L'apport pour le patient est indéniable. La taille des
incisions réduit les traumatismes de la voie d'abord, et permet une
diminution de la durée du séjour postopératoire.
I-4-3.La CEC et la cardioplégie
Malgré des taux de réussite proches de 100%, la
CEC n'est pas une solution parfaite et des problèmes liés
à son utilisation sont constatés par les équipes
chirurgicales. Des contraintes médicales et chirurgicales sont
liées à l'utilisation de la CEC : durée de mise en place
et d'arrêt (entre 30 et 45 minutes pour chaque phase), utilisation
d'héparine pour empêcher la coagulation du sang pendant la CEC,
cardioplégie. De plus, des problèmes cliniques ont
été observés (complications neurologique,
hématologique et pulmonaire). Les auteurs ont constaté une
réponse inflammatoire systémique due au contact du sang avec le
circuit extra-corporel [24]. Chez certains patients à haut risque, des
complications neurologiques ont été observées [25]. Les
taux de certaines protéines telles que la troponine 5 montrent une
souffrance du muscle cardiaque pendant l'arrêt [26].
Une solution réservée au pontage coronarien est
l'utilisation d'un stabilisateur mécanique pour contraindre
mécaniquement et localement la surface du coeur et ainsi assurer une
stabilisation locale (figure 4). L'approche par stabilisation passive
présente néanmoins deux inconvénients.
Fig.4 : Représentation schématique d'un
stabilisateur mécanique fixé sur un écarteur sternal
(Octopus., Medtronic Inc).
Le premier est lié à la technique, la
stabilisation mécanique étant en effet limitée à
des zones d'intervention « accessibles ». Le second
problème a été relevé par différentes
équipes de recherche qui ont constaté qu'à
l'intérieur de la zone stabilisée, des mouvements
résiduels de l'ordre de 1 à 2 mm étaient observés :
d'après Lemma et al. [27], des déplacements maxima de 2.4 mm ont
été mesurés. Compte tenu du diamètre moyen d'une
artère coronaire (environ 2 mm), ces déplacements
résiduels posent un réel problème au chirurgien qui doit
les compenser manuellement.
I-5-Prothèse valvulaire
Les différents types de prothèses valvulaires
sont classés en valves mécaniques et en valves biologiques. Les
prothèses mécaniques comprennent essentiellement trois
modèles.
· Valve à bille (Starr-Edwards), constituée
d'une bille en Silastic™ oscillant à l'intérieur d'une cage
faite de deux arcs fixés sur un anneau (acier) recouvert de Teflon™
; à l'ouverture, le flux passe autour de la bille ; la valve est
étanche lorsqu'elle est fermée; la surface efficace d'ouverture
est faible et l'encombrement considérable. Cette prothèse n'est
plus implantée, mais on croise encore quelques patients qui en sont
porteurs.
· Valve à disque oscillant (Medtronic-Hall™,
Bjork-Shiley™) : un disque en pyrolocarbone oscille autour d'un pivot
excentré à l'intérieur d'un anneau, laissant le passage
par deux orifices de taille inégale ; lorsqu'elle est fermée, la
valve a des petites fuites sur ses bords ou sur le pivot central. Ces
prothèses ne sont plus guère utilisées sauf dans certains
coeurs artificiels, mais on peut en rencontrer occasionnellement.
· Valve à double ailette (St.Jude Medical™,
Carbomedics™, ATS™, On-X™) en titane et pyrolocarbone :
lorsqu'elles sont ouvertes, les ailettes forment un angle de 85° avec le
flux, qui passe par 2 orifices en demi-lune de chaque côté et par
un petit orifice central de section rectangulaire où le gradient est
plus important. En position fermée, les ailettes font un angle de
25° avec le plan de l'anneau et présentent de petites fuites sur
les bords (jonction ailette - anneau) et au niveau des pivots. La
prothèse On-X™, faite en pyrolocarbone sans alliage, se fixe en
position supra-annulaire, ce qui permet de gagner une taille, soit 2 mm de
diamètre. Le flux et le gradient se mesurent dans les deux orifices
latéraux et non dans le petit orifice central, où le gradient est
jusqu'à 40-50% plus élevé [28,29]. Ces prothèses
ont une durée de vie d'au-moins 25 ans.

Figure 5 : Anneau d'annuloplastie (valve mitrale) -
SJM™Séguin

Figure 6 : Valve de prothèse mécanique
Carbomédics
Les anneaux sont recouverts de Dacron™ ou de Teflon™
tressé permettant l'ancrage des sutures. Les valves à double
ailette sont les plus couramment utilisées, car elles offrent le
meilleur profil hémodynamique. Les prothèses mécaniques
ont normalement des fuites d'autolavage dont le but est de prévenir le
dépôt de fibrine et de plaquettes sur le bord libre des ailettes
et sur la partie interne de l'anneau, car cela pourrait bloquer le mouvement ou
empêcher l'étanchéité. Ces fuites
représentent une fraction de régurgitation = 5%. Les
prothèses mécaniques nécessitent une anticoagulation
à vie en visant un INR 3.0 - 3.5 pour les RVM et 2.0 - 3.0 pour les RVA,
avec addition d'aspirine (75-250 mg/j) s'il n'y a pas de contre-indication
[30,31].
Les valves biologiques sont faites en tissu valvulaire de
porc ou en péricarde bovin; cette catégorie comprend aussi les
homogreffes (tissu humain) et les hétérogreffes (tissu animal).
Le tissu est préparé dans un bain de glutarate aldéhyde
qui en réduit l'antigénicité mais en altère les
propriétés mécaniques ; les valvules deviennent moins
souples, se calcifient et dégénèrent à long terme.
Leur durée de vie fonctionnelle est de 10 à 15 ans; elle est
inversement proportionnelle à l'âge du patient, étant plus
prolongée chez les personnes âgées. Les bioprothèses
ont un taux d'attrition plus élevé en position mitrale qu'en
position aortique. Elles peuvent être montées ou non sur une
armature. Elles ne réclament une anticoagulation que pendant 3 mois (INR
2.5), après quoi l'endothélialisation est complète [30].
L'administration d'aspirine à long terme est discutable dans les
bioprothèses, à moins qu'il y en ait d'autres raisons
(coronaropathie, stent, artériopathie, etc) [31], mais elle est le plus
souvent prescrite de routine [30].
· Bioprothèses montées classiques ; valve
aortique porcine (Carpentier-Edwards™, Hancock™), ou valvules en
péricarde bovin (Carpentier-Edwards Perimount™) montées sur
un anneau métallique et suspendues par leurs commissures à 3
picots verticaux. Les valvules ont une certaine inertie à l'ouverture
à cause de leur relative rigidité. A taille égale, les
orifices effectifs de ces valves sont plus petits que ceux des autres types ;
leurs gradients sont plus élevés. Lorsqu'elles sont
fermées, ces valves sont étanches, ou présentent de
petites fuites en général centrales mais parfois aux commissures.
A taille égale, les valves en péricarde bovin ont de meilleures
performances que les valves porcines et un taux d'attrition inférieur
[32]: à 15 ans, 75% des valves en péricarde bovin sont
fonctionnelles contre < 50% des valves porcines [33].
· Bioprothèses montées de nouvelle
génération; un anneau plus fin (Carpentier-Edwards Perimount
Magna™, en péricarde bovin) permet d'augmenter le diamètre
interne de 2 mm pour le même diamètre externe; sa configuration
particulière autorise une fixation supra-annulaire qui permet de gagner
une taille par rapport à une prothèse standard. Une
réduction de la taille des picots (St.Jude Biocor™, valve porcine)
et un traitement particulier de la valve porcine (Medtronic Mosaic™)
donnent un avantage mécanique, réduisent le risque de
calcification et augmentent la durée de vie (70% à 20 ans)
[34].

Figure 7 : Anneau d'annuloplastie Carpentier Edwards
physio
· Autogreffe : l'opération de Ross consiste
à substituer la valve aortique par la valve pulmonaire du patient ;
cette dernière est remplacée par une hétérogreffe
ou une homogreffe. Le principal intérêt de la technique est de
permettre la croissance, car la néo-valve aortique se développe
en même temps que l'enfant.
I-5-1.Critères de choix et devenir
Les valves mécaniques ont une longue durée de
vie (> 20 ans sans lésion mécanique) mais réclament une
anticoagulation permanente (INR 2.0-3.5 pour la valve aortique et 2-4 pour la
valve mitrale), alors que les bioprothèses ne nécessitent plus
d'anticoagulation dès que l'endothélialisation est
complète (> 3 mois). Par contre, la dégradation structurelle
(calcifications, fibrose, déchirures) des valves biologiques fait que
30% d'entre elles ne sont plus fonctionnelles au-delà de 10 ans [35,36].
Le taux monte à 50% à 15 ans, ce qui impose une
réopération dont la mortalité est élevée
(4-15%) [36]. Les bioprothèses Carpentier-Edwards Perimount™ ont un
taux de dégénérescence sensiblement inférieur aux
autres modèles [37]. Par contre, le taux d'embolie, de thrombose,
d'endocardite et de mortalité à long terme est pratiquement
similaire avec les valves mécaniques et avec les bioprothèses. Le
choix repose donc entre deux alternatives.
· Prothèses mécaniques: risques liés
à l'anticoagulation, mais très longue survie de la
prothèse;
· Bioprothèse: survie de la valve limitée
à 10-12 ans, mais pas d'anticoagulation.
I-5-2-Plasties valvulaires
Une valvuloplastie, qui est faisable dans au moins 60% des
insuffisances valvulaires, est toujours préférable à un
remplacement, parce qu'elle rétablit l'anatomie normale au lieu
d'échanger la pathologie de la valve native contre celle de la
prothèse. Une plastie présente plusieurs avantages par rapport
à une prothèse :
· Absence d'anticoagulation ;
· Préservation de la fonction ventriculaire (la
géométrie du ventricule et l'intégrité de
l'appareil sous-valvulaire sont préservées après plastie
mitrale ou tricuspidienne) ;
· Risques thrombo-emboliques et infectieux (endocardite)
très faibles ;
· Risque de détérioration structurelle
quasi inexistant ;
· Possibilité de croissance de la valve chez
l'enfant et l'adolescent ;
· Morbi-mortalité 2-4 fois plus basse.
I-5-2-1-Plastie mitrale
La technique de plastie de la valve mitrale (PVM) est
adaptée en fonction du type de lésion. Parmi les nombreuses
techniques possibles, les plus fréquemment utilisées sont les
suivantes.
· Annuloplastie avec un anneau souple ou rigide (de type
Carpentier-Edwards™, Duran™, ETlogics™, GeoForm™) ; la
taille de l'anneau est fonction de la distance intertrigonale que l'on veut
obtenir après plastie (distance intertrigonale = 0.8 · longueur de
la base du feuillet antérieur en vue bicommissurale 60° avec
rotation horaire de la sonde). Cet anneau est indispensable pour empêcher
une dilatation secondaire et pour assurer un succès à long terme.
Il a quatre fonctions : restaurer la géométrie de l'anneau
mitral, prévenir la dilatation, diminuer la tension sur les sutures, et
augmenter la surface de coaptation.
· Transfert, raccourcissement, réinsertion ou
remplacement de cordages (Gore-Tex™ Chord) ; les cordages sont
fixés au feuillet sur des patchs et enfouis au sein du muscle papillaire
; la longueur exacte des néocordages est souvent difficile à
évaluer.
I-5-2-2-Plastie aortique
La plastie est une option qui est de plus en plus
pratiquée dans les centres spécialisés lors d'insuffisance
aortique due au prolapsus d'une cuspide ou à la dilatation de l'anneau
par une maladie de la racine de l'aorte. Le but est de restaurer l'anatomie et
la fonction de tous les composants de la racine aortique. L'examen ETO
(échographie transoesophagienne) avant CEC doit évaluer la
faisabilité de la plastie et le mécanisme de
l'incompétence valvulaire.
Le taux d'échec de la plastie aortique est
supérieur à celui de la plastie mitrale (14% versus 6%) [38,39],
et le risque de complications de 12% à 10 ans [40]. Mais la
mortalité opératoire est inférieure à celle du
remplacement valvulaire : 1% pour la plastie isolée d'une cuspide et
3.4% pour la plastie de la racine aortique [40]. La plastie n'est pas plus
difficile dans les bicuspidies, sauf lorsque les cuspides sont
fibrosées, calcifiées ou épaissies aux commissures [41] ;
mais l'indication est importante parce que les patients sont plus jeunes
(Exemples de plastie en cas de bicuspidie).
I-5-2-3-Plastie tricuspidienne
La présence d'une IT (insuffisance tricuspide)
résiduelle modérée à sévère
péjore le pronostic de toute intervention cardiaque et tend à
s'aggraver ultérieurement malgré la correction des valvulopathies
gauches [42,43].
La plastie consiste la plupart du temps en points de
rétrécissement annulaires selon De Vega ou en mise en place d'un
anneau (rigide ou souple). Cet anneau est interrompu au niveau septal pour
éviter les lésions du noeud auriculo-ventriculaire et du faisceau
de His.
I-5-2-4-Commissurotomie
percutanée pour sténose mitrale
Si l'anatomie la permet, la commissurotomie percutanée
est l'opération de premier choix. Les indications reconnues sont les
situations suivantes [30,31].
· Patient symptomatique (classe NYHA II, III et IV) avec
une sténose modérée (1.0-1.5 cm2) ou
sévère (< 1 cm2) ;
· Patients asymptomatiques avec une sténose
modérée ou sévère et une hypertension pulmonaire
(PAPsyst > 50 mmHg au repos ou > 60 mmHg à l'effort) ;
· Morphologie favorable : feuillets souples, pas de
calcifications aux commissures ni sur le corps des feuillets, pas de fusion de
cordages, appareil sous-valvulaire minimalement restrictif ;
· Absence d'IM, ou IM mineure (IM
modérée-à-sévère : contre-indication) ;
· Absence de thrombus auriculaire.
L'intervention se pratique par cathétérisme avec
contrôle radiologique et échocardiographique transoesophagien. Un
cathéter muni d'un ballon est introduit dans les cavités gauches
par voie transseptale; un ballon en forme de sablier ou en diabolo (ballon
d'Inoué) est placé à cheval sur la mitrale, il dilate
l'orifice mitral par la mise en tension élective et la rupture des
symphyses commissurales : on parle de bon résultat dès lors que
la surface mitrale est portée à > 2 cm².
II-METHODOLOGIE DE RECHERCHE
II-1-Cadre d'étude
L'étude a été effectuée dans le
service de Cardiologie de l'Hôpital Général de
Référence Nationale (HGRN) puis dans le service de
pédiatrie du Centre Hospitalier Universitaire « Le Bon
Samaritain » (CHU BS) de Walia à N'Djaména. Les
patients ont été envoyés en France et
opérés par la Chaîne de l'Espoir.
- Hôpital Général de
Référence Nationale
Cet hôpital reçoit les malades
référés des centres de santé de la ville et des
autres hôpitaux régionaux et des districts de l'ensemble du
territoire national.
Nommé avant hôpital central de N'djaména,
il fut créé en 1958 et devient l'Hôpital
Général de Référence Nationale (HGRN) en 1994 avec
une gestion autonome et un conseil d'administration.
L'hôpital Général de
Référence Nationale compte 11 services hospitaliers dont le
service de Cardiologie.
Les textes statuaires lui attribuent un triple
objectif :
ü La prestation des services ;
ü La formation du personnel médical et
paramédical ;
ü La recherche médicale.
- CHU « Le Bon Samaritain » de Walia
L'hôpital du CHU « Le Bon
Samaritain » a été inauguré le 10 octobre 2007.
C'est une structure privée à but non lucratif dans le quartier
Walia, au Sud de la capitale. Elle possède un service de médecine
interne (40 lits), un service de chirurgie (27 lits), un service de
pédiatrie (40 lits), un service de Gynécologie obstétrique
(33 lits), un bloc opératoire, un service de radiologie, un laboratoire
de biologie, un service de consultation externe, et un centre de santé.
Tous les 2 à 3 mois arrivent de l'Europe des médecins
spécialistes et enseignants chercheurs. Ils interviennent dans la prise
en charge des patients et la formation des étudiants en
médecine.
La chaîne de l'Espoir
La chaîne de l'Espoir a été fondée
en 1988 sous l'égide de Médecins Monde, et a été
reconnue comme Association de Bienfaisance, ce qui lui permet d'être
assimilée fiscalement à une association reconnue d'utilité
Publique. Elle est devenue une association indépendante et autonome
régie par la loi 1901 depuis 1995.
En 1988, les deux premiers malades transférés
en France par la Chaîne de l'Espoir pour y être
opérés sont Sénégalais. Environ 80% des enfants
transférés chaque année en France par la Chaîne de
l'Espoir sont originaires d'Afrique. Chaque année, 180 à 200
enfants sont opérés dans leurs pays lors des missions de la
Chaîne de l'Espoir.
La Chaîne de l'Espoir a signé une convention avec
le Tchad le 18 Avril 1988. Ensuite, il y a eu la guerre au Kossovo et toutes
les activités de la Chaîne de l'Espoir se sont portées vers
ce pays d'où la cessation des actions au Tchad. C'est en décembre
2001, lors du séjour du Professeur Edmond Bertrand au Tchad pour un
atelier sur les maladies non transmissibles organisé par l'OMS, que ses
activités ont repris au Tchad. Dr Hadjé Fatimé Ngoua est
la représentante actuelle de la Chaîne de l'Espoir au Tchad.
Antenne de cardiologie
Il est mis sur pied une antenne de cardiologie depuis
l'année 2009 par le professeur Jean Philippe Lesbre. Elle est
constituée de cardiologues venant de la France, à savoir le
professeur Jean Philippe Lesbre lui-même, Docteur Serge Boey, Docteur
Yves Chabrillat et Docteur François Chostakoff. Ils viennent à
tour de rôle, assurant le suivi des malades, et prennent des
décisions opératoires. La consultation s'effectue dans le bureau
médical du service de médecine interne où se trouvent un
appareil d'échographie cardiaque doté d'une sonde adulte et
pédiatrique, et un appareil d'électrocardiographie. Les
hospitalisations des enfants cardiaques se font au service de
Pédiatrie.
II-2-Type et période de l'étude
Nous avons effectué une étude descriptive
rétrospective et prospective. Elle est transversale. L'étude
s'est étalée sur 2 ans (2010 à 2012), sur les dossiers des
enfants opérés en France par la Chaine de l'Espoir de 2003
à 2012.
II-3-Population d'étude
Les patients faisant partie de notre étude sont
âgés de 1 à 18 ans. Ils sont tous opérés par
la Chaîne de l'Espoir.
II-4-Critères d'opérabilité exigés
par la Chaine de l'Espoir
- Les enfants cardiaques de > 1an et de < 18 ans.
- Cardiopathie simple, accessible à un geste
chirurgical simple apportant si possible une guérison
définitive.
- Cardiopathie sans risque opératoire majeur du
fait d'un stade évolutif dépassé ou d'une pathologie
associée.
II-5-Critère de non inclusion
- Cardiopathies congénitales complexes :
ventricule unique, transpositions des gros vaisseaux, et Hypoplasie du coeur
gauche
- Patients avec hypertension pulmonaire majeure > 70/80 mm
Hg
- Patient avec dysfonction du Ventricule gauche ou ventricule
droit sévère avec FE < 35%.
- Patients cachectiques ou avec altération
sévère de l'état général.
II-5-Matériel
- 1. Toise et balance : balance salus milano avec un
complexe de balance graduée de 0 à 150kg et une toise
graduée de 0 à 205 cm.
- 2. Stéthoscope : de marques diverses
- 3. Radiographie : pour la radiographie thoracique
(télé thorax) nous avons utilisé un système
radiologique intégré de marque RAYMAT 4.
Electrocardiogramme : il s'agissait d'un appareil de marque hp HEWLETT
PACKARD model M1701A(S/N 3123A30873) pouvant enregistrer sur un mode
automatique. L'enregistrement comportait 12 dérivations.
- 5. Echocardiographie : l'appareil utilisé est un
HP sonos 5500 muni d'une sonde adulte et d'une sonde pédiatrique. Il a
permis d'obtenir des images en mode bidimensionnel et TM (Temps mouvement)
selon les incidences standards classiques (fenêtre parasternale,
fenêtre apicale, fenêtre sous costale, et fenêtre
suprasternale) et une exploration en mode doppler (continu, pulsé et
couleur) des quatre appareils valvulaires.
II-7-Recueil des données
II-7-1-Echantillonnage
Les enfants porteurs d'une cardiopathie ont été
dépistés. L'étude est essentiellement
rétroprospective avec 44 dossiers des patients opérés, et
6 patients pour la partie prospective de l'étude. Chaque enfant passe
par les différentes étapes suivantes :
- Première consultation auprès du
généraliste en raison de signes fonctionnels importants, souvent
de type dyspnée d'effort ou accès de cyanose conduisant à
une consultation de cardiologue ;
- lors d'une deuxième consultation seront
pratiqués examen clinique, ECG , Radio pulmonaire et echo-doppler
cardiaque , examen fondamental sur lequel repose le diagnostic exact de la
cardiopathie , son stade évolutif , son retentissement et son
accessibilité à un recours chirurgical ;
- si l'enfant satisfait aux critères de la Chaîne
de l'Espoir (CDE), il est pris contact immédiatement par internet avec
les membres de la CDE- Prof DELOCHE et Prof SIDI - pour demander leur accord
quant à la prise en charge du petit malade
- Ce stade fondamental franchi, dès que le feu vert de
la CDE est donné, il est pris contact avec Dr Hadjé Fatimé
Ngoua au Tchad pour la constitution du dossier CDE qui comporte les
éléments suivants, médicaux et administratifs:
identité de l'enfant, situation de sa famille, renseignements concernant
le mode de vie de l'enfant, caractère de l'enfant, dossier
médical, et décharge de consentement parental.
- Ce dossier est envoyé à la CDE qui donne alors
la date et le lieu de l'intervention - Paris le plus souvent
- Commencent alors pour la famille les démarches pour
l'obtention du passeport et du visa qui sont à leur frais ;
- Selon l'état de l'enfant, le voyage de l'enfant est
accompagné ou non par un médecin
-A l'entrée dans le service de chirurgie, un dossier
nouveau -clinique et paraclinique avec echocardiographie est
réalisé pour toute certitude diagnostique et le bilan biologique
complété éventuellement par les examens non
réalisables à N'Djamena ;
- L'intervention a lieu et le compte rendu opératoire
dicté le jour même par le chirurgien ;
- L'enfant entre en réanimation post-opératoire
pendant 2 à 3 jours
- Puis, dès que son état est stable, il est
confié en Hôpital périphérique, dans le service de
cardiologie du Dr Didier Fremont ;
- Il achève sa convalescence en famille d' accueil
volontaire pendant un (1) à deux (2) mois avant le retour
définitif au Tchad avec une lettre détaillée du Dr Fremont
, le Compte-rendu opératoire et une ordonnance ;
- Commence alors la phase de surveillance cardiologique locale
Le paramètre clinique est l'analyse de la disparition
ou la persistance de signes et symptômes, en post opératoire, qui
peuvent être : auscultation pathologique (souffle, roulement,
B3...), oedème des membres inférieurs (OMI), tachycardie,
arythmie, palpitation, toux, dyspnée d'effort (DE) ou dyspnée de
décubitus, douleur thoracique, hémoptysie d'effort(HE), syncope
d'effort(SE). Et le paramètre para clinique comporte
l'appréciation en pré opératoire puis post
opératoire ; il y a donc l'électrocardiogramme (ECG), la
radiographie (Rx) pulmonaire de face ou télé coeur et
l'échographie cardiaque.
II-7-2-Techniques
d'étude
a-Etude rétrospective
Toutes les données nécessaires dans les dossiers
des patients opérés avant le début de la période
d'étude ont été exploitées.
b-Etude prospective
Nous avons effectué un interrogatoire à l'aide
d'une fiche de collecte de données. Le poids et la taille sont
mesurés par une toise et sont quantifiés respectivement en
kilogramme (kg) et en centimètre (cm). La pression artérielle est
prise par un sphygmanomètre manuelle et quantifiée en
millimètre mercure mmHg. Il y a eu l'examen des pouls, des veines
jugulaires, la palpation abdominale pour l'appréciation de la taille du
foie et le reflux hépato-jugulaire, l'auscultation cardiaque et
pulmonaire. Le laboratoire du Centre Hospitalier Universitaire « Le
Bon Samaritain » (CHU BS) a permis d'analyser la sérologie du
virus de l'immunodéficience humaine (VIH), du virus de l'hépatite
B (VHB) et du virus de l'hépatite C (VHC), les antigènes
streptolysine O (ASLO), la vitesse de sédimentation (VS) et la
numération formule sanguine (NFS). Pour l'index cardiothoracique et les
arcs du coeur nous avons eu recours, pour les patients vus, à la
radiographie (Rx) du CHU « BS ». L'activité
électrique du coeur est enregistré à base d'un ECG pour
déterminer le rythme cardiaque, l'axe électrique du coeur, les
hypertrophies cavitaires, les blocs de branche ou auriculo-ventriculaire et les
troubles du rythme. L'échographie cardiaque est l'examen clé pour
préciser la pathologie valvulaire responsable des fuites (les
quantifier) et des sténoses, dépister les cardiopathies
congénitales, afin de poser l'indication opératoire.
II-7-3-Modalités pratiques
De façon générale de 2003 à 2012,
50 patients ont pu bénéficier d'une évacuation en France
pour subir une intervention chirurgicale cardiaque grâce à la
Chaine de l'Espoir. Chaque patient proposé a fait l'objet d'une
préparation au Tchad en vue de l'évacuation. Un bilan
médical a été fait, à savoir : la radiographie
pulmonaire de face, l'ECG, l'échocardiographie, la glycémie, la
créatininémie, la NFS, la VS, la sérologie VIH, la
sérologie VHB, la sérologie de l'hépatite C. Cette
préparation préliminaire était nécessaire car
presque tous les patients étaient vus dans un état de
décompensation cardiaque. Les drogues utilisées étaient
à base de diurétiques, digitaliques, et les inhibiteurs de
l'enzyme de conversion. Chaque fois qu'un dossier était accepté
les parents avaient à leur charge le passeport et le visa pour la
France. Avant le départ de l'enfant il y a une famille d'accueil en
France, volontaire d'héberger l'enfant malade.
Un formulaire d'information et d'engagement personnel
était soumis à l'approbation de quelques attestations entre
autres :
- Une attestation de reconnaissance d'information et de
consentement
- Des renseignements concernant l'enfant et sa famille
étaient fournis à la famille d'accueil volontaire en France pour
faciliter le séjour de l'enfant.
Une fois ces conditions réunies l'enfant était
évacué en France pour y subir une intervention cardiaque.
II-8- Difficultés
rencontrées
Notre étude étant rétrospective et
prospective, nous n'avons pas pu recueillir toutes les données
préétablies dans nos fiches de collecte de données. Les
patients avaient été évalués par divers
médecins au fil des années avant leur envoi en France pour
l'intervention chirurgicale cardiaque. Ajouter à cela il ressort des
difficultés financières et du fonctionnement du système
sanitaire pour réaliser systématiquement un certain nombre de
bilan des patients revus en consultation post opératoire. C'est ainsi
que certaines données n'ont pas pu être exploitées bien que
figurant dans les fiches de collecte de données. Parmi ces
données nous pouvons citer les paramètres
anthropométriques, la classification NYHA, les résultats de la
radiographie pulmonaire de face, et les examens réalisés au
laboratoire.
II-9-Analyse statistique
Les données recueillies entre 2003 à 2012 sont
saisies dans un tableur Excel. Les résultats sont exprimés en
terme de nombre, de pourcentage et sous forme de tableaux et figures.
II-10-Ethique
Le consentement éclairé des parents est
recueilli tant pour l'accord de la décision opératoire que pour
le travail scientifique occasionné par cette thèse.
III-RESULTATS
III-1.Caractéristiques démographiques des
patients opérés
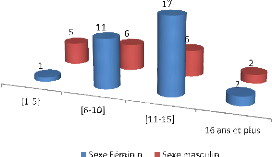
Figure 8: Distribution des patients selon le sexe et
l'âge. n=50
Sur ce graphe la tranche d'âge comprise entre 11-15 ans
prédomine avec 23 cas sur 50 (soit 46%). L'âge moyen est de 10,68
avec les extrêmes de 1 an et 17 ans.
Il y a 31 (62%) patients de sexe féminin et 19 (38%) de
sexe masculin avec une sex-ratio de 1,63 en faveur du sexe féminin.
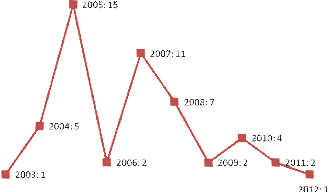
Figure 9 : Nombre de patients opérés par
an.
Il y a eu plus d'enfants opérés en 2005 avec 30%
(15 cas sur 50) des cas. La moyenne des enfants opérés par an est
de 5 avec un minimum de 1 et un maximum de 15 par an.
III-2-Etiologies des maladies cardiovasculaires des patients
opérés
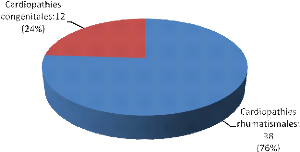
Figure 10 : Répartition des patients selon
l'étiologie
Sur cette figure l'étiologie rhumatismale est
prédominante avec 76% (38 sur 50) des cas.
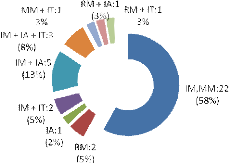
Figure 11 : Répartition des patients avec
cardiopathies rhumatismales et atteinte des valves ayant
nécessité un geste opératoire.
La valve Mitrale est atteinte et opérée 37 fois,
l'Aorte l'est 10 fois, la Tricuspide 7 fois. L'atteinte est monovalvulaire
mitrale 24 fois Aortique 1 fois ; il n'y a pas d'atteinte Tricuspide
isolée. En plus de ces 7 cas d'IT rhumatismales il y a en plus 14 IT
fonctionnelles associées à d'autres valvulopathies rhumatismales
(mitrale ou aortique). L'atteinte monovalvulaire prédomine dans la
plupart des cas : au total 25 patients sont monovalvulaires, et 14 sont
plurivalvulaires.
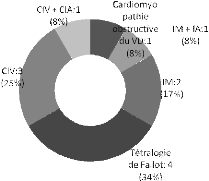
Figure 12 : Répartition des patients selon les
cardiopathies congénitales opérées.
La tétralogie de Fallot est prédominante parmi
les pathologies congénitales avec 4 cas sur 11(37%).
III.3-Evaluation des patients opérés
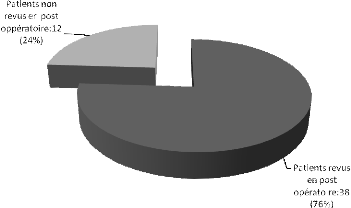
Figure 13 : Patients revus et non revus après
l'opération
Il y a eu 24% (12 cas sur 50) patients non revus en
consultation post opératoire parmi les opérés.
Tableau VI: Cardiopathies rhumatismales revues et non revues
en post opératoire
|
Valvulopathie
|
Opérée
|
Revue
|
Non revue
|
|
IM, MM
|
22
|
15
|
7
|
|
RM
|
2
|
2
|
0
|
|
IA
|
1
|
1
|
0
|
|
IM + IT
|
2
|
2
|
0
|
|
IM + IA
|
5
|
3
|
2
|
|
IM + IA + IT
|
3
|
3
|
0
|
|
MM + IT
|
1
|
0
|
1
|
|
RM + IA
|
1
|
1
|
0
|
|
RM + IT
|
1
|
1
|
0
|
|
Total
|
38
|
28
|
10
|
La majorité a été revue après
l'opération
Tableau VII: Cardiopathies congénitales revues et non
revues en post opératoire
|
Pathologie
|
Opérée
|
Revue
|
Non revue
|
|
Tétralogie de Fallot
|
4
|
3
|
1
|
|
CIV
|
3
|
2
|
1
|
|
CIV + CIA
|
1
|
1
|
0
|
|
IM
|
2
|
2
|
0
|
|
IM + IA
|
1
|
1
|
0
|
|
Cardiomyopathie obstructive du VD
|
1
|
0
|
1
|
|
Total
|
12
|
9
|
3
|
Seule une petite minorité n'a pas été
revue après l'opération
Tableau VIII : signes fonctionnels, gestes et résultats
des patients opérés pour IM et MM rhumatismales et revus
|
Signes fonctionnels
|
Geste opératoire
|
Résultats
|
|
Pré op
|
Post op
|
|
|
|
|
|
Dyspnée
|
23
|
7
|
Plastie (n=19)
|
Bons
8
|
Moyens
4
|
A reprendre
7
|
|
Toux
|
14
|
4
|
|
|
|
|
|
Dlr thoracique
|
6
|
0
|
Rvm (n=4)
|
2
|
1
|
1 (décédé)
|
|
Palpitation
|
4
|
6
|
|
|
|
|
|
HE
|
3
|
0
|
|
|
|
|
|
SE
|
2
|
0
|
|
|
|
|
La douleur thoracique, l'hémoptysie d'effort et la
syncope d'effort ont disparu après l'opération. La dyspnée
et la toux ont diminué, sauf les palpitations qui ont augmenté de
4 à 6 cas. La plastie mitrale et le remplacement valvulaire mitral ont
donné des résultats satisfaisants.
Tableau IX: signes fonctionnels, gestes et résultats
des patients opérés pour IA rhumatismale et revus
|
Signes fonctionnels
|
Geste opératoire
|
Résultats
|
|
Pré op
|
Post op
|
|
|
|
|
|
Dyspnée
|
7
|
2
|
Plastie (2)
|
Bons
0
|
Moyens
0
|
A reprendre
2
|
|
Toux
|
2
|
0
|
|
|
|
|
|
Dlr thoracique
|
2
|
0
|
Rvm (5)
|
3
|
2
|
0
|
Amélioration clinique favorable pour la
dyspnée, la toux et la douleur thoracique. Les patients avec plastie
aortique sont tous à reprendre.
Tableau X: Les résultats imparfaits de la plastie
mitrale
|
Type
|
Effectif
|
Fréquence (%)
|
|
N=13
|
|
|
Sténose
|
5
|
38,46
|
|
Fuite + sténose
|
1
|
7,7
|
|
Fuite persistante (2/4)
|
4
|
30,7
|
|
Fuite significative persistante (= 3/4)
|
1
|
7,7
|
|
Insuffisance cardiaque globale par défaillance du VG
hypokinétique (décédé)
|
1
|
7,7
|
La sténose est plus importante parmi les résultats
imparfaits.
Tableau XI : Mécanisme des IM et matériels
prothétiques utilisés chez les patients avec IM résiduelle
significative après plastie mitrale
|
Age (an)
|
Mécanisme
|
Anneau
|
Résultats
|
|
9
|
Anneau dilaté,prolapsus de A1
|
CE n°28
|
IM 2/4
|
|
9
|
Dilatation annulaire,rétraction valvulaire
|
CE n°26
|
IM 3A/4
|
|
12
|
Anneau dilaté,rétraction des 2 feuillets
valvulaires
|
CE n°26
|
IM 2/4
|
|
11
|
Fusion commissurale, épaississement de la gvm
|
Commissurotomie
|
IM 2/4
|
|
16
|
Anneau dilaté,rétraction pvm
|
CE n°30
|
IM 2/4
|
Les résultats imparfaits par IM résiduelle
s'expliquent par leur mécanisme de départ.
Tableau XII : Caractéristiques cliniques et
matériels prothétiques utilisés chez les patients avec
sténose mitrale après plastie mitrale pour IM
|
Age (an)
|
Délai de consultation
|
Poids/taille
|
Anneau
|
Résultats de sténose
|
|
|
Préop Postop
|
|
|
|
7
|
4 ans
|
17/1,22
|
32/1,44
|
CE n°28
|
RM 0,7-0,8cm².HTP 100
|
|
9
|
4 ans
|
27/1,32
|
32/1,47
|
CE n°28
|
RM 1cm² HTP à 65
|
|
10
|
5 ans
|
23/1,34
|
35/1,55
|
CE -n°26
|
RM 1,2cm². HTP à 60
|
|
15
|
4
|
37/1,45
|
43/1,51
|
CE n°30
|
RM à 1cm². PAPs à 30
|
|
14
|
1
|
37/1,45
|
48/1,65
|
CE n°34
|
RM à 1 cm² PAPS à 45
|
|
13
|
8
|
48/1,58
|
54/1,60
|
CE n°28
|
RM à 1,1cm² PAPS à 23
|
|
|
|
|
|
|
Tous nos patients avec RM post plastie d'IM ont
augmenté de taille et de poids après l'opération.
Tableau XIII: signes fonctionnels, gestes et résultats
des patients opérés pour RM rhumatismale et revus
|
Signes fonctionnels
|
Geste opératoire
|
Résultats
|
|
Pré op
|
Post op
|
|
|
|
|
|
Dyspnée
|
4
|
1
|
Rvm (3)
|
Bons
2
|
Moyens
0
|
A reprendre
1
|
|
Toux
|
1
|
0
|
|
|
|
|
|
|
|
Commissurotomie
|
1
|
0
|
0
|
Les techniques opératoires (remplacement valvulaire
mitral et commissurotomie) utilisées dans le cadre de RM ont
donné de résultats satisfaisants.
Tableau XIV: signes fonctionnels, gestes et résultats
des patients opérés pour valvulopathies congénitales (3
IM, 1 IA) et revus
|
Signes fonctionnels
|
Geste opératoire
|
Résultats
|
|
Pré op
|
Post op
|
|
|
|
|
|
Dyspnée
|
3
|
0
|
Plastie mitrale
|
Bons
2
|
Moyens
1 (IM 2/4)
|
A reprendre
0
|
|
Toux
|
1
|
0
|
Rvm
|
1
|
0
|
0
|
Le résultat de plastie pour les valvulopathies
congénitales est satisfaisant.
Tableau XV: signes fonctionnels, gestes et résultats
des patients opérés pour cardiopathies congénitales (shunt
et tétralogie de Fallot) et revus
|
Signes fonctionnels
|
Geste opératoire
|
Résultats
|
|
Pré op
|
Post op
|
|
|
|
|
|
Dyspnée
|
7
|
0
|
Correction des communications
|
Bons
7
|
Moyens
0
|
A reprendre
0
|
|
Toux
|
1
|
0
|
|
|
|
|
Très bon résultat opératoire dans le
cadre de fermeture des shunts et tétralogie de Fallot.
III.3-Données opératoires
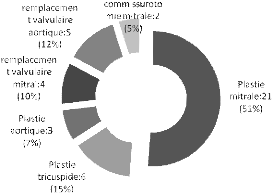
Figure 14 : Plasties valvulaires des valvulopathies
rhumatismales opérées et revus.
Sur cette figure la plastie mitrale a été
prédominante avec 18 sur 38 des cas (47%).

Figure 15: Répartition des différents types
d'anneau dans les plasties mitrales
Cette figure montre que l'anneau de Carpentier Edwards a
été le plus utilisé dans les plasties mitrales avec 90%
suivit de l'anneau Taillor et Seguin avec chacun 5%.
Figure 16 : Numéro d'anneau Carpentier Edwards
utilisé dans les plasties mitrales
L'anneau de Carpentier Edwards numéro 28 a
été utilisé en grande majorité avec 47,36% des
cas.
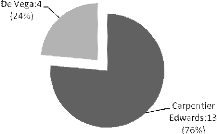
Figure 17 : Répartition des différents
types d'anneau dans les plasties tricuspides
Cette figure nous montre la prédominance de l'anneau de
Carpentier Edwards dans les plasties tricuspides avec 77,8% suivie de l'anneau
de De Vega avec 13,2%.
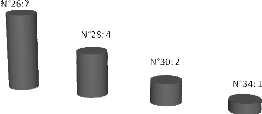
Figure 18 : Numéro d'anneau de Carpentier Edwards
dans les plasties tricuspides.
L'anneau de Carpentier Edwards numéro 26 a
été le plus utilisé dans les plasties tricuspides avec 7
(50%) cas sur 14.
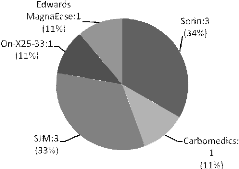
Figure 19 : Type de prothèses dans les
remplacements valvulaires (valves aortique et mitrale)
Cette figure montre que pour les remplacements valvulaires,
les prothèses Sorin et SJM ont été les plus
utilisés avec chacun 33,33% des cas.
IV-4.Devenir des patients opérés
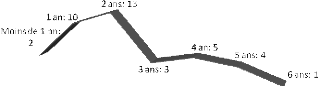
Figure 20 : Répartition des patients selon les
intervalles de consultation après l'opération
L'intervalle de consultation post opératoire de 2 ans
prédomine, soit 34,21% (13 cas sur 38) des cas suivi de 1 an, soit
26,31% (10 cas sur 38) des cas.
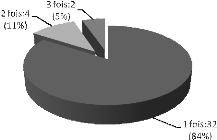
Figure 21: Répartition des patients selon le nombre de
consultation après l'opération
La majorité de nos patients n'a été revu
en consultation qu'une seule fois, soit 84% des cas.
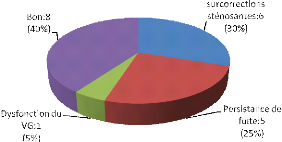
Figure 22 : Répartition des patients selon les
résultats d'IM opérés et revus en
postopératoire.
Parmi les IM opérés et revues en post
opératoire les bons résultats sont prédominants avec 42%
des cas.
Tableau XVI: Résultats des patients
opérés pour RM
|
Technique
|
Nature
|
Age(an)
|
Résultats
|
|
Commissurotomie
|
|
14
|
RM 0,8cm²
|
|
15
|
Bon
|
|
Remplacement valvulaire
|
Sorin n°25
|
14
|
Bon
|
|
SJM n°27
|
11
|
Bon
|
Le remplacement valvulaire pour RM n'a eu que des
résultats satisfaisants (2 cas). Un cas de commissurotomie sur 2 a
donné un résultat non satisfaisant.
Tableau XVII: Résultats des patients
opérés pour maladie mitrale (IM + RM)
|
Technique
|
Nature
|
Age (an)
|
Résultats
|
|
Commissurotomie
|
|
11
|
IM 2/4
|
|
Remplacement valvulaire
|
SJM n°27
|
15
|
Bon
|
Une commissurotomie a été réalisée
parmi les 2 cas de maladie mitrale avec un résultat de persistance de
fuite mitrale (passé de grade 4 à 2/4), par contre le
remplacement valvulaire a donné un résultat satisfaisant.
Tableau XVIII: Résultats post opératoires des
IA opérés et revus
|
Technique
|
Geste
|
Mécanisme
|
Résultats
|
|
Plastie
Aortique
|
Comssurotmi,extension sigmd
|
Fusion comissurale
|
IA 2/4 fort,RA 1,5
|
|
Extension des 3 feuillets
|
Rétraction feuillet valv
|
IA 2/4
|
|
Remplacemnt
de la valve
|
Sorin n°23
|
Rétraction des sigmoides
|
Bon
|
|
Carbomedics n°25
|
Rétrct,épaissi,fibrose sigmd
|
Bon
|
|
Carbomedics n°21
|
Végét valv,rupture sigmoïd
|
Bon
|
|
Sorin n°21
|
Epaississmt, rétract feuillet
|
Bon
|
|
Sorin n°21
|
Feuillets épaissi et rétracté
|
Bon
|
Les plasties s'avèrent incapables de corriger
complètement les fuites Ao: elles ne font que diminuer temporairement
leur sévérité
Tableau XX: Répartition des patients traités
pour IT
|
Etiologie
|
Effectif (fréquence) (n=24)
|
Revu/Non revu
|
|
|
|
|
IT fonctionnelle
|
17 (71%)
|
13 / 4
|
|
IT organique
|
7 (29%)
|
6 / 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Mécanisme d'IT (effectif)
|
Geste
|
Résultat
|
|
Dilatation annulaire (1)
|
Plicature commissurale bilatérale
|
Bon
|
|
|
|
|
Dilatation annulaire, rétraction valvulaire (1)
|
Plastie (CE)
|
Maladie Tric
|
|
Dilatation annulaire, rétraction valvulaire (5)
|
Plastie (De Vega (2), CE (3))
|
Bon
|
|
Dilatation annulaire (16)
|
Plastie (CE, De Vega (1))
|
Non revu
|
|
Rétraction du feuillet septal, dilatation
annulaire(1)
|
Plastie
|
Non revu
|
|
|
|
L'IT apparait comme la seconde atteinte valvulaire en
fréquence, après la Mitrale; qu'elle est organique dans 29% des
cas par rétraction et épaississement des feuillets - qu'elle est
fonctionnelle dans 71% - n'appelant une plastie que lorsqu'elle est de grade 3
ou 4 ou qu'elle s'accompagne d' une HTP sévère > 50 mmHg .
Ces IT fonctionnelles sont une conséquence de l'HTP,
elle-même consécutive à l'atteinte mitrale.
Il faut préciser aussi le devenir des IT
modérées : régressent-elles complètement
après correction de la Pathologie mitrale ? Cela doit dépendre de
la régression de l' http
Tableau XXI: Répartition des patients selon les
résultats de plastie d'IT revus
|
Type
|
Effectif
|
Fréquence (%)
|
|
Bon résultat
|
14
|
73,68
|
|
Persistance de fuite
|
5
|
26,32
|
|
Total
|
19
|
100
|
Il y a de bon résultat pour la plastie d'IT avec 14 cas
sur 19 (bons résultats équivaut à absence d'IT)
Tableau XXII: Répartition des patients selon le
degré de persistance de fuite tricuspide après plastie
|
Type d'IT
|
Effectif
|
Fréquence (%)
|
|
Mineure (IT<2/4)
|
3
|
60
|
|
Modérée (IT=2/4)
|
2
|
40
|
|
Total
|
5
|
100
|
La persistance de fuite tricuspide est mineure 3 cas sur 5,
contre 2 cas sur 5 de fuite majeure.
Tableau XXIII: Analyse des caractéristiques cliniques
préopératoire et types d'anneau utilisé chez les patients
présentant une IT mineure et modérée après
plastie
|
Age (an)
|
|
Mécanisme d'IT
|
Anneau
|
Résultats
|
|
|
9
|
|
Importante dilatation annul
|
CE n°26
|
IT1/4,Vmax=3,5,PAPs 60
|
|
|
15
|
|
Importante dilatation annul
|
CE n°26
|
IT 1/4,PAPs 41
|
|
|
15
|
|
Dilatation rétraction valvul
|
CE n°26
|
IT1/4,Vmax=2,18,PAPs 30
|
|
|
14
|
|
Forte dilatation annulaire
|
CE n°28
|
IT 2/4,Vmax=2,8,PAPs 36
|
|
|
10
|
|
IT rhumatismale type III
|
CE n°30
|
IT 2/4,Vmax=3,5,PAPs 61
|
|
L'IT organique est la seule à avoir un résultat
d'IT modérée en post opératoire
Tableau XXIV: Résultats des cardiopathies
congénitales opérées
|
Type
|
Mécanisme
|
Gestes
|
Résultats
|
|
Tétralogie de Fallot (4)
|
CIV sous Ao, dextroposition
|
Correction
|
|
Bons
|
|
CIV (3)
|
CIV
|
Correction
|
|
Bons
|
|
CIV + CIA (1)
|
CIV + PFO
|
Correction
|
|
Bons
|
|
Cardiomyopathie
obstructive du VD (1)
|
Anneau tric distendu, hypoplasie feuillet ant, hypertrophie de
bande modératrice
|
Incision bande, anneau
|
|
?
|
|
IM
|
Dilatation annulaire dystrophique
|
plastie
|
|
Bon
|
|
IM
|
Dilatation annulaire, luxation A2
|
plastie
|
|
Bon
|
|
IM + IA
|
Mit : dilat ann, prolapsus A1. Ao : prolapsus
sigmoïde coronaire
|
Mit :plastie.Ao:plicature sigmoïde
|
|
IM2/4,IA4/4
|
|
|
|
|
|
Le résultat chirurgical est satisfaisant dans le cadre des
affections congénitales
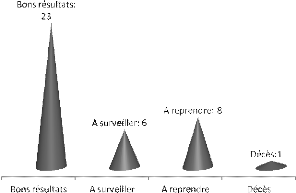
Figure 23: Patients revus en consultation après
l'opération et évalués
Parmi les patients revus en consultation post
opératoire il y a eu 60,52% des cas avec de bons résultats suivis
de 16% des cas à surveiller. L'unique décès parmi les
évalués concerne le patient avec insuffisance cardiaque par
dysfonctionnement du VG.
Tableau XXV: Gestes et résultats
opératoires immédiats des perdus de vue
|
Type
|
Gestes
|
Résultat immédiat
|
|
|
|
|
IM rhumatismale (4)
|
Plastie (CE)
|
Bons
|
|
MM rhumatismale
|
commissurotomie
|
MM résiduelle
|
|
|
|
|
|
|
|
MM rhumatismale
|
Plastie (CE n°32)
|
IM modérée,Gm 5-6mmHg
|
|
IM + IA rhumatismales
|
Mit (plastie,CE n°34),Ao (Sorin n°21)
|
Bon
|
|
|
|
|
MM rhumatismale
|
Plastie (CE n°32)
|
IM modérée
|
|
IM + IT rhumatismales
|
Plastie :Mit (CE n°30), Tric (CE n°26)
|
Bon
|
|
IM congénitale
|
Plastie (Tailor n°25)
|
Bon
|
|
Cardiomyopathie obstructive du VD
|
Plastie,anastomose cavo-pulmonaire
|
Bon
|
|
|
|
Il y a des patients à surveiller parmi les perdus de
vue
Tableau XXVI: Répartition des patients
opérés et décédés en fonction d'intervalle
et de cause du décès
|
Etiologie
|
Temps de décès
en postopératoire
|
Cause de décès
|
|
|
|
|
IM + IA rhumatismale
|
Non connu
|
Non connue
|
|
IM rhumatismale
|
Non connu
|
Non connue
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Triple valvulopathie rhumatismale
|
2008 (3 ans)
|
Non connue
|
|
|
|
|
IM + IT
|
Non connu
|
Non connue
|
|
IM
|
Non connu
|
Insuffisance cardiaque sur grossesse
|
|
IM
|
2012 (3 mois)
|
Insuffisance cardiaque globale par défaillance du VG
hypokinétique
|
|
|
|
|
IM
|
Non connue
|
Non connue
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
La plupart des décès en postopératoire est
restée sans cause identifiée
Tableau XXVII: Patients retenus mais
décédés avant l'opération
|
Age (an)
|
Etiologie
|
Date et lieu du décès
|
|
|
|
|
12
|
-
|
HGRN
|
|
10
|
MM
|
24 septembre 2007
|
|
11
|
IM
|
04 Octobre 2007
|
|
|
|
|
4
|
-
|
Paris (08/11/2004
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14
|
-
|
HGRN (04/04/2005)
|
|
|
|
|
10
|
-
|
HGRN (22/06/2005)
|
|
|
|
|
12
|
IM + IA
|
Nantes (1er Décembre 2005)
|
|
15
|
-
|
HGRN
|
|
10
|
-
|
N'djaména (2007)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(- inconnu)
La plupart de diagnostic des décès avant
l'opération ne figure pas dans le dossier consulté
Tableau XXVIII : Récapitulatif des patients
retenus et opérés
|
Type
|
Effectif (N = 50)
|
Fréquence (%)
|
|
Patients opérés
|
50
|
100
|
|
Patients revus
|
38
|
76
|
|
Bons résultats
|
21
|
42
|
|
A surveiller
|
6
|
12
|
|
A reprendre
|
8
|
16
|
|
Perdus de vue
|
8
|
16
|
|
Patients décédés après
l'opération
|
7
|
14
|
Nous avons 42% de bons résultats parmi nos patients
opérés. De tous nos patients opérés 16%
étaient perdus de vue. Il y a eu 14% de décès
enregistré (soit 7 sur 50 patients opérés).
III-DISCUSSION
59 patients tchadiens de 1 à 17 ans malades du coeur
ont été enregistrés et retenus de 2003 à 2012
à l'hôpital Général de Référence
National (52 patients) et au Centre Hospitalier Universitaire « Le
Bon Samaritain » de Walia (7 patients) à N'Djaména au
Tchad. Les patients comportent 37 filles et 22 garçons. Il s'agissait
des patients de provenance pour la plus part hors de N'djaména et
référés à la capitale pour prise en charge
adéquate avec ou sans diagnostic de cardiopathie évoquée.
Parmi les 59 patients, 7 patients sont décédés avant leur
transfert en France, et 2 décédés en France avant leur
opération. Ces 9 patients décédés ne sont pas
inclus dans l'étude.
IV-1-Caractéristiques démographiques des
patients
IV-1-1-Sexe
L'étude a montré que parmi les 50 enfants
opérés le sexe féminin a dominé avec 62% des cas
soit une sex-ratio de 1,63 en faveur du sexe féminin, tout comme Goeh
Akue et al. à Lomé au Togo en 2007 (66% de femmes) [44],
Marijon et al. au Mozambique en 2007 [45], 52,5% de femmes au
Mozambique, Kimbally-Kaky et al. (52,5% de femmes) à
Brazzaville au Congo [46]. Le RAA et les VR sont fréquentes chez les
femmes dans beaucoup de populations pour plusieurs raisons, incluant une
augmentation de l'exposition au streptocoque du groupe A durant l'enfance aussi
bien que la difficulté d'accès aux soins médicaux pour les
femmes dans certaines cultures [47]. Par contre Khriesat et al. [48]
en Jordanie, Toure et al. en Guinée [49] ont retrouvé
une prédominance masculine, avec respectivement 52 et 56%.
IV-1-2-Age
46% (23 cas) des 50 patients opérés avaient un
âge compris entre 11 et 15 ans. Nos résultats sont comparables
à celui de Diarra Begnam à Bamako au Mali qui a obtenu 57,33% des
cas [50]. La fréquence élevée de cette tranche d'âge
pourrait s'expliquer d'une part par la difficulté à poser
cliniquement le diagnostic d'une pathologie cardiaque chez un enfant, et
d'autre part à la possibilité d'expression des signes
fonctionnels à cet âge par l'enfant même. Elle s'explique
aussi par les limites d'âge imposées par la CDE, le refus des
cardiopahies congénitales du nourrisson de moins d'1 an : les plus
graves s'expriment dès les premiers mois de la vie et entrainent la mort
en l'absence d'intervention : CIV larges , Transposition des gros vaisseaux ,
Tétralogie de Fallot, hypoplasie du coeur gauche, ventricule unique.
IV-1-3- Nombre de patients opérés par
an
L'année 2005 fut l'année où il y a eu
plus d'enfants opérés avec 30% des cas soit 15 sur 50 patients.
Ce taux élevé est explicable par la disponibilité du
personnel à apprêter les dossiers cliniques et administratifs pour
l'évacuation des patients cardiaques opérables en France.
IV-2-Etiologies des maladies cardiovasculaires
opérées
Les cardiopathies des 50 patients opérés ont pu
être classées en 2 types : les cardiopathies rhumatismales
qui ont représenté 38 cas (76%) de l'échantillon, et 12
cas sur 50 de cardiopathies congénitales, soit 24%. Il y a la
prédominance des cardiopathies rhumatismales qui ont disparu dans les
pays industrialisés, mais demeurent un fléau en Afrique
Subsaharienne. L'évolution des causes des valvulopathies acquises dans
les pays occidentaux se caractérise par la diminution progressive de la
fréquence des valvulopathies rhumatismales et l'augmentation de la
fréquence des causes dystrophiques et dégénératives
dans les pays occidentaux [51, 52]. Ceci est dû à l'augmentation
de l'espérance de vie et à la diminution de l'incidence du RAA.
La prévalence de la maladie rhumatismale est élevée en
Afrique subsaharienne comme en témoignent les études de
Kimbally-Kagy G, Gombet T et Voumbo Y à Brazzaville au Congo qui ont
retrouvé une prévalence clinique des cardiopathies rhumatismales
de 3,5%o (3,6%o chez les écoliers de classe sociale basse et 3%o chez
ceux de haut statut socio-économique, p<0,05) [46]. Ces
résultats élevés de cardiopathies rhumatismales pourraient
s'expliquer par : la fréquence élevée du RAA qui est
le facteur étiologique de ces valvulopathies ; le recrutement des
patients à un stade où le RAA a déjà atteint les
valves cardiaques avec des séquelles ; une absence totale de
traitement des angines streptococciques responsables du RAA -et
considérées comme affections vénielles par les parents
-qui ne consultent donc pas : c' est à ce niveau que se situe la faille
et que tout un travail d' éducation sanitaire collective des
enseignants du primaire et secondaire est indispensable -ainsi qu'auprès
des enfants scolarisés et de toute la population.
IV-2-1-Cardiopathies rhumatismales
Globalement, l'atteinte de la valve mitrale (IM, MM et RM)
ayant nécessité un acte chirurgical est de 37 (68%) cas, 10
(20%) cas pour la valve aortique et 7 (14%) pour la tricuspide. Dans
l'étude, les atteintes de la valve mitrale étaient les plus
représentées. Il s'agissait le plus souvent d'une IM, mais aussi,
une maladie mitrale chez 3 patients. Cet ordre est le même dans
l'étude : Yayehd K. et al. en 2012 à Lomé au Togo
[53] sur 15 enfants atteints de valvulopathie rhumatismale 7
cas d'IM et 2 de maladie mitrale. Après la valve mitrale, la valve
aortique était la plus touchée : elle était l'objet d'une
insuffisance chez 20% de nos patients. Cet ordre est respecté dans
l'étude citée ci-dessus. Chez les patients jeunes, l'IM est la
lésion cardiaque prédominante ; l'insuffisance aortique est moins
fréquente, et la fréquence du rétrécissement mitral
diminuerait progressivement de l'enfance à l'âge adulte [54].Pour
l'atteinte valvulaire tricuspide, dans les 24 cas d'IT, il s'agissait
toujours de polyvalvulopathie comportant 18 cas d'insuffisance tricuspidienne
fonctionnelle et 6 cas d'étiologie post-rhumatismale. L'atteinte
tricuspide est la plus rare si l'on ne prend en compte que les seules IT
organiques, marquées par un une fibrose rétractile d'un ou
plusieurs feuillets de la valve.
En revanche, elle vient en deuxième position,
immédiatement derrière la Mitrale, si l'on prend en compte toutes
les IT fonctionnelles, 3 fois plus fréquentes que les IT organiques -et
dont plus de la moitié exige une annuloplastie correctrice pour
éviter la persistance de signes droits irréversibles.
L'atteinte valvulaire tricuspide est la plus rare de toutes
les valvulopathies; elle est la plus souvent associée ou secondaire
à une atteinte valvulaire gauche [55, 56] La prévalence de
l'atteinte tricuspide significative au cours de la maladie rhumatismale est 14%
dans l'étude. Ce taux est supérieur à celui de Youssef Ben
Ameur. et al. en 2010 en Tunisie [57] qui ont obtenu 8,42 %
de prévalence de l'atteinte tricuspide significative au cours de la
maladie rhumatismale.
IV-2-2-Cardiopathies congénitales
Par rapport aux 12 cardiopathies congénitales
la tétralogie de Fallot a prédominé avec 4 (34%)
cas suivie par la CIV avec (25%) puis la CIA + CIV 1 (8%) cas. La
littérature révèle plutôt la prédominance de
CIV (30%), sur la CIA (8%) et la tétralogie de Fallot (6%) [7, 8, 12,
13, 14]. En n'acceptant que les enfants de plus d'un an, on laisse mourir -
toutes les TGV qui sont de grandes urgences, mais surtout un nombre
considérable de CIV larges qui évoluent en quelques mois vers la
grande HTP irréversible : ainsi s'explique la faible
représentation des CIV dans l'étude.
V-Devenir des patients opérés
V-1- Chronologie des consultations de
surveillance à long terme: La majorité de nos patients
ont été vus après 2 ans de l'intervention avec 34,21% (13
sur 38) des cas. Ceci est expliqué par le grand nombre de patients qui
étaient opérés 2 ans avant l'année où il y a
eu l'évaluation globale de tous les patients opérés en
France. 26,31% (10 sur 38) ont été revus après 1 an de
l'opération. 15,8% (6 sur 38) ont été vus après 4
ans de l'opération. 10,52% (4 sur 38) ont été revus
à moins d'1 an et 5 ans après l'opération. 7,9% (3 sur 38)
de patients ont été revus après 3 ans après
l'opération. Seulement 1 sur 38 (2,63%) a été vu
après 6 ans de l'opération.
V-2-Nombre de consultation après
l'opération : la majorité des patients ne sont
revus qu'une seule fois soit 92,1% (35 sur 38) des cas. Ce chiffre souligne
tous les progrès que nous avons à accomplir dans la surveillance
systématique de ces patients qui partout au monde sont revus
systématiquement au moins tous les ans jusqu'à l'âge
adulte.
V-3-Résultats d'IM opérés et
revus en consultation : 8 cas sur 19 (42%) de bons
résultats ont été retrouvés. Les résultats
de la plastie sont satisfaisants en majoritaire. Nos résultats
inférieurs au travail de Cissa A. G. et al. [58] au
Sénégal qui ont eu après plastie mitrale « 84%
des résultats satisfaisants »
Parmi les résultats imparfaits il y a 30% (6 sur 20) de
sténose mitrale, 20% (4 sur 20) de fuite persistante, 5% (1 cas sur 20)
chacune : d'une association de fuite + sténose, d'une fuite
persistante significative, et d'une insuffisance cardiaque globale par
défaillance du VG hypokinétique. Le patient avec insuffisance
cardiaque globale par défaillance du VG hypokinétique est
décédé au CHU BS 80 jours après son
opération. Il apparait donc que la plastie mitrale -est une chirurgie
palliative -et non pas curative : elle est soumise au risque inflammatoire
évolutif du RAA -qui demeure d'autant plus important que le patient est
plus jeune et de milieu défavorisé. Il se surajoute le risque de
constitution de sténose mitrale relative par inextensibilité de
l'annuloplastie lors des années de croissance. Ceci se rapporte aux
études de Vahanian A. et al [59] :« Les échecs
peuvent être expliqués par des lésions anatomiques
causées par le RAA, par une dilatation annulaire non corrigée, un
prolapsus valvulaire persistant, l'altération valvulaire et sous
valvulaire ».
V-4-Caractéristiques cliniques et
matériels prothétiques utilisés chez les patients avec IM
résiduelle après plastie mitrale
Les mécanismes d'IM en pré opératoire
étaient entre autre une forte dilatation de l'anneau mitrale, une
rétraction des feuillets de la valve mitrale, une fusion commissurale et
un épaississement de la grande valve mitrale. Ces mécanismes
cités expliquent l'imperfection des résultats
opératoires.
V-5-Caractéristiques cliniques et
matériels prothétiques utilisés chez les patients avec
sténose mitrale après plastie mitrale pour IM
Les patients avec sténose mitrale post plastie pour IM
ont tous augmenté en taille et poids après l'opération.
Leur évaluation post opératoire varie pour chaque patient de 1
à 8 ans. L'augmentation du débit cardiaque, proportionnel
à la prise de poids et de taille considérable - et l'absence de
croissance de la surface de l'anneau mitral qui rend compte du
développement d'une sténose mitrale progressive : mis match
-c'est à dire discordance entre débit cardiaque et surface
mitrale.
V-6-Résultats des patients selon les
résultats d'IA opérés et revus en consultation
post-opératoire
Il n'y a pas de rétrécissement aortique,
uniquement des insuffisances aortiques. Des 2 plasties aortiques
réalisées il y a une persistance de fuite aortique et une
association de fuite et sténose de la valve aortique. Nos
résultats corroborent l'étude de JP Lesbre et al. [60] à
Phnom-Penh au Cambodge en 2004 qui ont obtenu sur 11 plasties aortiques
d'insuffisance aortique rhumatismale, 11 échecs complets avec 1 an de
recul - si bien que ces plasties ont été abandonnées. La
plastie aortique a été une extension par patch de
péricarde autologue. Ce qui expliquerait les résultats
décevants car cette technique n'est réalisable avec succès
que dans les bicuspidies aortiques.
V-7-Devenir des IT opérées par
plastie
Pour toutes les IT (13 fonctionnelles et 6 rhumatismales)
revues la plastie a été la technique pratiquée avec 14
(73,68%) sur 19 cas de bons résultats et 5 (26,32%) sur 19 de
persistance de fuite tricuspide. Parmi les 5 fuites tricuspides
résiduelle 3 sont mineures et 2 modérées. l'annuloplastie
tricuspide est une bonne intervention s'il s'agit d'une IT fonctionnelle par
simple dilatation annulaire. En revanche, elle ne suffit pas en cas de
tricuspidite rhumatismale organique qui comporte rétraction des
feuillets valvulaires et des cordages et symphyses commissurales : il faut
là des gestes associés (commissurotomies partielles,
libération de cordages) pour obtenir un bon résultat.
L'utilisation de prothèses mécanique tricuspide est
définitivement abandonnée en raison du nombre élevé
de thromboses de valves et de mort subite. Quand on est au stade IV de la NYHA
(New York Heart Association) avec état d'IVD (insuffisance ventriculaire
droite) avérée -oedèmes massifs d'insuffisance
hépatique clinique et biologique le taux de mortalité
opératoire est très élevé. Le taux de
mortalité tardive est également très élevé
si la dysfonction VD persiste, c'est-à-dire si l'on intervient trop
tardivement pour autoriser une récupération du VD [61]. La
plastie tricuspide, comme la plastie mitrale n'est pas une solution
définitive s'il n'y a pas simultanément une prévention
rhumatismale rigoureuse.
Résultats d'évaluation des patients
opérés revus en consultation : Nous avons obtenu
68,42% (soit 26 sur 38) des patients avec un bon résultat
opératoire, 15,78% (6 sur 38) des patients à surveiller, 21,05%
(8 sur 38) à reprendre, et 1 cas (2,63%) de décès.
Récapitulatif des patients retenus et
opérés : 50 patients ont
bénéficié de la chirurgie cardiaque en France, et sont
rentrés au Tchad. 76% (soit 38 sur 50 patients) des cas ont
été revus en consultation post opératoire. Parmi les
patients revus nous avons enregistré 42% des cas (21 sur 50 patients) de
bons résultats, 16% des cas (8 sur 50 patients) à reprendre
chirurgicalement et 12% des cas (6 sur 50 patients) à surveiller. Il y a
eu par ailleurs 16% des cas (8 sur 50 patients) de perdus de vue, et 14% des
cas (7 sur 50 patients) de décès après
l'opération.
CONCLUSION
Ce travail tout à fait énumératif montre
la prédominance des cardiopathies rhumatismales. La plastie mitrale
apparait comme l'option de choix pour plusieurs raisons : pas de
nécessité d'un traitement anti vitamine K à vie, avec
risque d'accident thromboembolique ou hémorragique, préservation
de l'appareil sous valvulaire et de la fonction VG.
Notre expérience en matière de cardiopathies
congénitales est très embryonnaire pour justifier des
commentaires. Il s'agit d'un domaine très délicat des nourrissons
et bébés en insuffisance cardiaque où nous
commençons « sur pointe de pieds ».
Un des apports de notre étude est d'avoir mis en
évidence une conclusion encore peu connue des plasties mitrales pour IM
ou MM rhumatismales : ce développement post opératoire d'un
RM après implantation annulaire mitrale chez l'adolescent qui augmente
de taille et de poids. Il apparait clairement que la plastie mitrale ne doit
pas être pratiquée trop tôt ni sur des poids trop faibles
sous peine d'assister au développement inexorable d'une sténose
mitrale lors de la croissance et de l'augmentation du
«miss-match » entre anneau mitral et débit cardiaque.
Nous avons retrouvé 5 cas sur 23 plasties mitrales avec
IM bien tolérée pour le moment. Elles imposeront à terme
une reprise chirurgicale qui sera vraisemblablement une prothèse
mécanique.
Les plasties aortiques pour insuffisances aortiques
rhumatismales ont produit des résultats décevants. Et ceci
corrobore avec la littérature qui ne retient que 3 indications
favorables de plastie aortique : les insuffisances aortiques par
dilatation annulaire, la bicuspidie avec prolapsus, et la perforation des
cuspides. L'IA importante nécessite la mise en place d'une
prothèse.
Quant aux plasties tricuspides elles se sont
avérées dans 14 cas sur 19 d'une remarquable efficacité
autant que ne subsiste pas une hypertension pulmonaire importante fixée
à plus de 50mmHg ou une dilatation annulaire importante.
Le grand nombre de perdus de vue (8 cas sur 50) parmi les
patients opérés et les décédés avant
l'opération (9 sur 57), nous donne des interrogations quant à la
recherche d'une solution locale pour des patients souffrant de pathologies
cardiaques opérables. Ce taux élevé de patients perdus de
vue témoigne la grande difficulté à suivre les patients
opérés, faute de centre de référence cardiologique
reconnu, et en raison de l'éloignement et de la dispersion des malades,
enfin de l'incompréhension du malade vis-à-vis de sa maladie et
de la stricte nécessité du traitement anticoagulant en cas de
prothèse.
V-RECOMMANDATIONS
Nous recommandons ce qui suit :
- Aux pouvoirs publics et politiques :
· Une stratégie nationale du traitement de toute
angine non virale, une détection précoce de traitement
adapté au RAA, une prévention des récidives chez l'enfant
atteint de RAA par la pénicilline benzathine, des soins dentaires et
tonsilectomie le cas échéant ;
· Le renforcement de la formation continue du personnel
soignant en promouvant les stages de perfectionnement dans le domaine de la
cardiologie, et l'octroi des bourses pour la spécialité en
Cardiologie ;
- La création d'un centre national
spécialisé en cardiologie pour les explorations
cardio-vasculaires et la chirurgie cardiaque.
- Aux agents socio-sanitaires :
· Informer de façon correcte les parents des
enfants malades en vue d'éviter les écarts de régime et de
traitement qui ont toujours émaillé le bon suivi des patients.
· Prévenir systématiquement et cela de
façon extensive le RAA par l'éducation pour la santé des
mères de famille du risque que court un enfant dès sa
première crise d'angine ou toute infection ORL.
- A la communauté :
· Une adhésion rigoureuse au traitement
médical de toute infection ORL.
· Une consultation précoce devant toute toux ou
dyspnée d'un enfant qui persiste.
· La promotion de la vaccination contre les
différents germes à tropisme ORL.
REFERENCES
1. Cause-specific mortality: regional estimates for 2008.
Geneve, 2011 (
http://www.who.int/healthinfo/global_burden_disease/estimates_regional/en/index.html).
2. Causes of death 2008: data sources and methods. Geneve,
Organisation mondiale de la Sante, 2011 (
http://www.who.int/healthinfo/global_burden_disease/cod_2008_sources_methods.pdf).
3. Moore AG., 2007.- Rheumatic heart disease. In:
Murphy JG, Lloyd MA, eds. Mayo Clinic Cardiology - concise Textbook. Rochester:
Mayo Clinic Scientific Press.
4. Carapetis JR, McDonald M, Wilson NJ.Acute Rheumatic Fever.
Lancet. 2005; 366: 155-68
5. Michael A.Gerber, Robert S.Baltimore, Charles B.Eaton,
Michael Gewitz, Anne H.Rowley, Stanford T.Shulman et al. Prevention of
rheumatic fever and diagnosis and treatment of acute streptococcal pharyngitis.
circ. 2009; 119: 1541-51
6.
Longo-Mbenza
B,
Bayekula
M,
Ngiyulu
R,
Kintoki
VE,
Bikangi
NF,
Seghers
KV et al. Survey of rheumatic heart disease in school children of Kinshasa
Town. Int J Cardiol. 1998; 63(3): 287-294.
7.
Ishikawa
T,
Iwashima
S,
Ohishi
A,
Nakagawa
Y,
Ohzeki
T.
Prevalence of congenital heart disease assessed by
echocardiography in 2067 consecutive newborns.
Acta Paediatr. 2011;
100(8):255-60.
8.
Sípek
A,
Gregor
V,
Sípek
A Jr,
Hudáková
J,
Horácek
J,
Klaschka
J et al.Incidence of congenital heart defects in the Czech
Republic--current data.
Ceska
Gynekol. 2010;75(3):221-42
9.
van
der Linde D,
Konings
EE,
Slager
MA,
Witsenburg
M,
Helbing
WA,
Takkenberg
JJ et al. Birth prevalence of congenital heart disease worldwide: a
systematic review and meta-analysis. Am Coll of Cardiol
10 .A Thomas Pezzella M.D. Seminars in Thoracic CV Surgery.
International Cardiac surgery.2002; 14:298-320
11. Mickaël Sauvée. Contribution à l'aide
aux gestes pour la chirurgie cardiaque à coeur battant. Guidage
échographique par asservissement prédictif non linéaire.
Thèse de doctorat en systèmes automatiques et
microélectronique. Montpélier; 2006.p 186
12. Hoffman JI. Incidence of congenital heart disease :
I. Postnatal incidence. Pediatr Cardiol. 1995; 16: 103-13
13. Kobrynski LJ, Sullivan KE. Velocardiofacial syndrome,
DiGeorge syndorme : The chromosome 22q11.2 deletion syndrome. Lancet. 2007
; 370 (9596):1443-52
14.
Pierpont
ME,
Basson
CT,
Benson
DW Jr,
Gelb
BD,
Giglia
TM,
Goldmuntz
E et al. Genetic basis for congenital heart defects: current knowledge: a
scientific statement from the American Heart Association Congenital Cardiac
Defects Committee, Council on Cardiovascular Disease in the Young: endorsed by
the American Academy of Pediatrics. Circ. 2007; 115 (23): 3015-38
15. Roberto O.Bonow RO, Blasé Carabello, Antonio De
Leon, L.Henry
Edmunds, Bradley J.Fedderly, Michael D.Freed et al. :
ACC/AHA
guidelines for the management of patients with valvular heart
disease. J
Am Coll Cardiol (Journal of American of College Cardiology).
1998. Vol
32, n°5:1486-588.
16. Shahbudin H.Rahimtoola, Alex Durairaj, Anil Mehra, Ismael
Nuno: current evaluation and management of patients with mitral
stenosis.Circ.AHA. 2002; 106:1183.
17. Waller B, Howard J, Fess S: pathologies of mitral valve
stenosis and pure regurgitation: I. Clin Cardiol. 1994; 17(6): 330-6
18. Otto CM: evaluation and management of chronic mitral
regurgitation.
N Engl J Med. 2001. Vol.345 n°10:740-746.
19. Carabello BA: progress in mitral and aortic regurgitation.
Prog
Cardiovasc Dis. 2001; 43 (6) 28: 457-75.
20. Levinson GE, Alpert JS. Aortic stenosis. In Alpert JS,
Dalen JE,
Rahimtoola SH (eds): valvular heart disease 3rd ed.
Phyladelphia,
Lipincott Williams & Wilkins, 2000, pp 183-211
21. Carabello BA: aortic stenosis. N Engl J Med 346:
677,2002
22. Rahimtoola SH: Aortic regurgitation. In Rahimtoola SH (ed)
: valvular
heart disease. Atlas of heart disease. Vol.11. Braunwald E
(series ed).
Philadelphia, current medicine, 1997, p 7.9.
23. Otto CM: Right-sided valve disease. Otto CM (ed): Valvular
heart
disease 2nd ed. Philadelphia, WB Saunders, 2004, pp
415-436.
24. Picone AL, Lutz CJ, Finck C, Carney D, Gatto LA, Paskanik
A et al. Multiple sequential insults cause post-pump syndrome .The Annals of
Thoracic Surgery (Ann Thorac Surg).1999; 67(4):978-85.
25. Rastan AJ, Bittner HB, Gummert JF, Walther T, Schewick CV,
Girdauskas E et al. On-pump beating heart versus off-pump coronary artery
bypass surgery - evidence of pump-induced myocardial
injury. Eur J Cardiothorac Surg. 2005; 27 (6):1057-1064.
26. Diegeler A, Hirsch R, Schneider F, Schilling L, Falk V,
Rauch T et al. Neuromonitoring and neurocognitive outcome in off-pump versus
conventional coronary bypass operation. Ann Thorac Surg. 2000. 69
(4):1162-1166.
27. Lemma M, Mangini A, Reaelli A, Acocella F. Do cardiac
stabilizers really stabilize ? experimental quantitative analysis of mechanical
stabilization. Interact Cardiovasc Thorac Surg. 2005; 4 (3):222-226.
28. Vandervoort PM, Greenberg NL, Powell KA, Cosgrove DM,
Thomas JD. Pressure recovery in bileaflet heart valves prostheses. Localized
high velocities and gradients in central and side orifices with implications
for Doppler-catheter relation in aortic and mitral position. Circ. 1995; 92
(12) :3464-72
29. Zoghbi WA, Chamber JB, Dumesnil JG, Foster E, Gotdiener
JS, Gravburn PA et al. Recommendations for evaluation of prosthetic valves with
echocardiography and Doppler ultrasound. J Am Soc Echocardiogr. 2009; 22 (9)
:975-1014
30. Robert O.Bonow, Blasé A.Carabello, Antonio C.de
Leon, David P.Faxon, Michel D.Freed, William H.Gaasch et al. Focused update
incorporated into the ACC/AHA 2006 guidelines for the management of patients
with valvular heart disease. J Am Coll Cardiol. 2008 august; 52 (8):676-685.
31. Alec Vahanian, Helmut Baumgartner, Jeroen Bax, Eric
Butchart, Robert Dion, Gerasimos Filippatos et al.Guidelines on the management
of valvular heart disease: The task force on the management of valvular heart
disease of the European Society of Cardiology.Eur Heart J .2007; 28:230-68
32. Walther T, Lehmann S, Falk V, Metz S, Doll N, Rastan A et al.
Prospective randomized evaluation of stented xenograft hemodynamic function in
the aortic position.Circ.2004; 110 (11) :II74-8
33. Pelletier LC, Carrier M,
Leclerc Y, Dyrda I.The Carpentier-Edwards pericardial bioprosthesis: clinical
experience with 600 patients. Ann Thorac Surg.1995; 60 (2):S297-302
34.
Eichinger WB, Hettich IM, Ruzicka DJ, Holper K, Shricker C, Bleiziffer S et
al.Twenty-year experience with the St.Jude medical Biocor bioprosthesis in the
aortic position. Ann Thorac Surg.2008; 86 (4):1204-10
35.Bandury MK, Cosgrove DM, White JA, Blackstone EH, Frater
RW, Okies JE. Age and valve size effect on the long-term durability of the
Carpentier-Edwards aortic pericardial bioprosthesis. Ann Thorac Surg. 2001;
72(3) :753-7
36. Rahimtoola SH. Choice of prosthetic heart valve in adults.
J Am Coll Cardiol. 2010; 55 (22):2413-26.
37. Ruel M, Kulik A, Rubens FD, Bedard P, Masters RG, Pipe AL et
al. Late incidence and determinants of reoperation in patients with prosthetic
heart valves. Eur J Cardiothorac Surg. 2004; 25 (3):364-70
38.Grimm RA,
Stewart WJ. The role of intraoperative echocardiography in valve surgery.
Cardiol Clin. 1998;16 (3):477-89
39. Mazzucotelli JP, Deleuze PH, Beaufreton
C, Duval AM, Hillion ML, Loisance DY et al. Preservation of the aortic valve in
acute aortic dissection: long-term echocardiographic assessment and clinical
outcome. Ann Thorac Surg. 1993; 55 (6):1513-17
40. Aicher D, Fries R, Rodionycheva S, Schmidt K, Langer F,
Schäfers
HJ. Aortic valve repair leads to a low incidence of valve-related
comnplications. Eur J Cardiothorac Surg. 2010; 37 (1):127-32
41. Nash PJ, Vitvitsky E, Li J, Cosgrove DM, Petterson G,
Grimm RA. Feasibility of valve repair for regurgitant bicuspid aortic valves -
An echocardiographic study. Ann Thorac Surg. 2005; 79 (5):1473-9
42. Nath J, Foster E, Heidenreich PA. Impact of tricuspid
regurgitation on long-term survival. J Am Coll Cardiol. 2004; 43 (3):405-9
43. Singh SK, Tang GH, Maganti MD, Armstrong S, Williams WG,
David TE et al. Midterm outcomes of tricuspid valve repair versus replacement
for organic tricuspid disease. Ann Thorac Surg. 2006; 82 (5):1735-41
44. Goeh AE, Gbeassor F, Baragou S, Damarou F, Gbadoe D,
Kessie K. et al. Les cardiopathies rhumatismales au Centre Hospitalier
Universitaire Tokoin de Lomé. CAMES - Série
A.2008; 06: 12-17.
45. Marijon E, Phalla O, Celermajer D, Ferreira B, Mocumbi AO,
Dinesh J. et al. Prevalence of Rheumatic Heart Disease Detected by
Echocardiographic Screening. N. Engl. J. Med. 2007; 357:
470-6.
46. Kimbally-Kaky G, Gombet T, Voumbo Y, Ikama-Méo S,
Elenga-Mbola B, Mbika-Cardorelle A et al. Les Cardiopathies rhumatismales en
milieu scolaire à Brazzaville. Med Trop. 2008; 68 (6): 603-605
47. MOORE AG., 2007.- Rheumatic heart disease. In: Murphy JG,
Lloyd MA, eds. Mayo Clinic Cardiology - concise Textbook. Rochester:
Mayo Clinic Scientific Press; p. 553
48. Khriesat I, Najada A, Al-hakim F, Abuhaweleh A. - Acute
rheumatic fever in Jordanian children. East Mediterranean Health J.
2003 ; 9: 981-87.
49. Touré S, Balde MD, Conde A, Toure BM, Fofana M.-
Aspects épidémiologiques, cliniques et évolutifs de 89 cas
de maladie mitrale rhumatismale. Med Afr Noire. 1998 ; 45:
318-23.
50. Diarra Begnam. Cardiopathies juvéniles
opérables et ou opérées du service de cardiologie de
l'Hôpital Gabriel Touré : diagnostic et évolution: à
propos de 268 cas. Thèse Med, Bamako, 2002
51. Acar J, Michel P.L, Dorent R, Luxereau P, Vahanian A,
Cormier B et al. Évolution des étiologies des
valvulopathies opérées en France sur une période de 20
ans. Arch Mal Coeur. 1992; 85: 411-5.
52. Soler-Soler J, Galve E. Worldwide
perspective of valve disease. Heart 2000 ; 83 : 721-5
53. Yayehd K., Kouleke D., Tchamdja T., Ttcherou T, Pessinaba
S., Damarou F. Valvulopathies rhumatismales à Lomé : aspects
épidémiologiques et prise en charge. J. Rech. Sci. Univ.
Lomé (Togo), 2012, Série D, 14(2) : 51-58
54. MOORE AG., 2007.- Rheumatic heart disease. In:
Murphy JG, Lloyd MA, eds. Mayo Clinic Cardiology - concise Textbook. Rochester:
Mayo Clinic Scientific Press
55. Acar J. Les cardiopathies valvulaires acquises. Paris :
Flammarion Médecine Sciences, 1985:1-665
56. Recommandations de la Société
Française de Cardiologie concernant la prise en charge des
valvulopathies acquises et des dysfonctions de prothèse valvulaire. Arch
Mal Coeur Vaiss 2005;98:2.
57. Youssef Ben Ameur, Ihsen Zairi, Kamel Kamoun, Mahdi Ben
sassi, Salma Longo, Kais Battikh, et al. La tunisie Medicale - 2010 ; Vol 88 (n°011 ) : 820 - 828 La tunisie Medicale - 2010 ; Vol 88 (n°011 ) : 820 - 828
58. Cissa AG
,
Diarra O, Dieng PA, N'Diaye A, Ba PS, Touré A et al. La plastie mitrale
sur valve rhumatismale chez l'enfant au Sénégal : 100
observations. Institut de Médecine tropicale du service de santé
des armées, Marseille, France. 2009 ; vol.69 n°3 :
pp.278-280
59. Alec Vahanian, Eric Garbarz, Bernard Lung. Cardiopathies
acquises de l'enfant dans les pays en voie de développement. Bull. Acad.
Natle Méd. 2011; 195, n°2, 315-326
60. S.Morestin, J.P Lesbre, J.M Grinda et A.Deloche. Bilan de
17 mois d'activité chirurgicale au centre de cardiologie de Phnom-Pehn.
Arch Mal Coeur 2004 ; 97 : 285-90
61. J. Aurelio Saralde, José M.Bernarl, Javier Llorca,
Alejandro Ponton, Lorena Diez-Solorzano, Juan R.Gimenez-Rico. Repair of
rheumatic ticuspid valve disease : predictors of very long term mortality
and reoperation. The Annal of Thoracic surgery. 2010 ; volume 90, Pages
503-508
ANNEXES
Fiche pré
opératoire de collecte de données du .... / .... /......
Nom : ............. Prénom :
........................... Sexe : .... Age : ....
INTEROGATOIRE
Ø Antécédents
Personnels : Notion de souffle cardiaque connu depuis
...................
Familiaux : Insuffisance cardiaque Mort subite
Age du décès : ....
Ø Signes fonctionnels et motifs de
consultation : .............................................
Dyspnée d'effort Distance : .........km
Toux d'effort Hémoptysie d'effort
Cyanose Dyspnée de décubitus
Syncope d'effort
OEdème aigu du poumon (OAP) Stade de la NYHA
...............
Traitements :
................................................................................................
EXAMEN PHYSIQUE du ..... / .... /.....
Ø Paramètres :
Poids à l'entrée :.......Kg Taille :......m
T° :......°C
FC :
....... Battement/min TA : ........... cmHg
Pouls :
réguliers irréguliers
Ø Auscultation
cardiaque :
..............................................................................................................................................................................................................................
Ø Signes de stase pulmonaire :
.....................................................................
Ø Signes d'IVD : OMI symétrique prenant le
godet TVJ
HMG douloureuse RHJ
Index hépatique :... cm
Ascite : .....................
· Diagnostic clinique
EXAMEN PARACLINIQUE
v Téléthorax de face :
Index cardio thoracique ......... Arc inférieur (VG)
...............
Arc moyen : convexe
rectiligne Aorte élargie
Stase pulmonaire Epanchement pleural
Hyper flot pulmonaire Artère
pulmonaire dilatée
v Electrocardiogramme :
......................................................................................
v Biologie ;
Créatininémie :.......mg/dl
Urée ......... VIH......... ASLO ...... VS.../.... NFS
...................................................
Shistosomiase (urines et selles) .....................
ALAT/ASAT ......
TRAITEMENTS MIS EN OEUVRE
..........................................................................................................................................................................................................................
v Echographie cardiaque
Ø Ventricules
VG: DD=...... mm DS = ..... mm FR : ...... % FE =
.......% Epp = ...... mm
VG: DD = ....mm SIV = .....mm
Epanchement péricardique
Ø Oreillettes :
OG : Surface ...........
Diamètre : ...............
OD : Surface .............
Diamètre : ...............
Ø Valves
Valve
mitrale : ...........................................................................
................................................................................................
Valve
aortique :............................................................................
................................................................................................
Valve
tricuspide :........................................................................
................................................................................................
Valve pulmonaire :
.....................................................................
Shunt :
................................................................................................
Veine cave inférieure : Diamètre .........
Compliance inspiratoire ...................................
Veines sus hépatiques :
.......................................... .....................
Conclusion :
Avant toute évacuation pour l'opération il est
lu et approuvé une décharge parentale dont 3 paragraphes
importants stipulent :
« Les responsables de la CHAÎNE DE L'ESPOIR
sont autorisés à faire pratiquer toute intervention
médicale ou chirurgicale jugée nécessaire.
Il est renoncé à toute prétention
à la perception de dommages et intérêts dans le cas
où une aggravation de l'état de cet enfant, ou un accident
quelconque viendrait à survenir durant son séjour en France.
Si le malheur voulait qu'il vienne à
décéder durant son séjour à l'étranger, il
ne serait pas procéder à son rapatriement aux frais de
l'Association LA CHAÎNE DE L'ESPOIR. »
Fiche post
opératoire de collecte de données du .... / .... /......
Nom : ............. Prénom :
........................... Sexe : .... Age : ....
Type de cardiopathie :
.................................................................................
Evaluation du ....... /
.........../..........
INTEROGATOIRE
v Signes fonctionnels et motifs de consultation :
Dyspnée d'effort Distance : .........km
Toux d'effort Hémoptysie d'effort
Cyanose Dyspnée de décubitus
Syncope d'effort
OEdème aigu du poumon (OAP) Stade de la NYHA
...............
Traitements :
................................................................................................
EXAMEN PHYSIQUE du ..... / .... /.....
v Paramètres : Poids
à l'entrée :.......Kg Taille :......m
T° :......°C
FC :
....... Battement/min TA : ........... cmHg
Pouls :
réguliers irréguliers
v Auscultation cardiaque :
..............................................................................................................................................................................................................................
Ø Signes de stase pulmonaire :
.....................................................................
Ø Signes d'IVD : OMI symétrique prenant le
godet TVJ
HMG douloureuse RHJ
Index hépatique :... cm
Ascite : .....................
· Diagnostic clinique
EXAMEN PARACLINIQUE
v Téléthorax de face :
Index cardio thoracique ......... Arc inférieur (VG)
...............
Arc moyen : convexe rectiligne
Aorte élargie
Stase pulmonaire Epanchement pleural
Hyper flot pulmonaire Artère
pulmonaire dilatée
v Electrocardiogramme :
......................................................................................
v Biologie ;
Créatininémie :.......mg/dl
Urée ......... VIH......... ASLO ...... VS.../.... NFS
...................................................
Shistosomiase (urines et selles) .....................
ALAT/ASAT ......
TRAITEMENTS MIS EN OEUVRE
..........................................................................................................................................................................................................................
v Echographie cardiaque
Ø Ventricules
VG: DD=...... mm DS = ..... mm FR : ...... % FE =
.......% Epp = ...... mm
VG: DD = ....mm SIV = .....mm
Epanchement péricardique
Ø Oreillettes :
OG : Surface ...........
Diamètre : ...............
OD : Surface .............
Diamètre : ...............
Ø Valves
Valve
mitrale : ...........................................................................
............................................................................................................................................................................................................
Valve
aortique :............................................................................
................................................................................................
Valve
tricuspide :........................................................................
................................................................................................
Valve pulmonaire :
.....................................................................
Shunt :
................................................................................................
Veine cave inférieure : Diamètre .........
Compliance inspiratoire ...................................
Veines sus hépatiques :
.......................................... .....................
Conclusion :
| 
