Introduction
Depuis quelques décennies, l'industrie des colorants
constitue un secteur capital de la chimie moderne. L'industrie alimentaire
mondiale utilise une quantité importante de plus en plus importante de
colorants naturels ou artificiels. Les colorants sont employés dans
différents domaines à savoir : la coloration du papier, de
cuir, des matières plastiques, vernis, peintures, encres,
cosmétiques, fourrures, produits alimentaires et pharmaceutiques ainsi
qu'en photographie (sensibilisateurs) et en biologie (coloration des
préparations microscopiques) ainsi que les indicateurs colorés de
pH.
Ces derniers sont responsables de la coloration des eaux et
sont susceptibles de présenter une toxicité. En effet il est
connu que certains colorants se fixent plus ou moins efficacement malgré
l'emploi d'agents fixants. Il en résulte alors des eaux colorées,
qu'il est nécessaire de traiter avant rejet.
1.3.1. Généralités sur le colorant
Un colorant est une matière colorée par
elle-même, capable de se fixer sur un support. La coloration plus ou
moins intense des différentes substances est liée à leur
constitution chimique. Un colorant est un corps susceptible d'absorber
certaines radiations lumineuses et de réfléchir alors les
couleurs complémentaires. Ce sont des composés organiques
comportant dans leurs molécules trois groupes essentiels : le
chromophore, l'auxochrome et la matrice. Le site actif du colorant est le
chromophore, il peut se résumer à la localisation spatiale des
atomes absorbant l'énergie lumineuse. Le chromophore est
constitué de groupes d'atomes dont les plus classiques sont le nitro
(-NO2), le diazo (-N-N-), le nitroso (-N-O), le thiocarbonyl (-C-S),
le carbonyl (-C-O), ainsi que les alcènes (-C-C-).
L'absorption des ondes électromagnétiques par le
chromophore est due à l'excitation des électrons d'une
molécule. La molécule qui les contient devient chromogène.
La molécule chromogène n'a des possibilités tinctoriales
que par l'adjonction d'autres groupements d'atomes appelés
«auxochrome». Ces groupes auxochromes permettent la fixation des
colorants et peuvent modifier la couleur du colorant. Ils peuvent être
acides (COOH, SO3, OH) ou basiques (NH2, NHR,
NR2). Le reste des atomes de la molécule correspond à
la matrice, la troisième partie du colorant (Mehdjoubi et Belmimouni,
2010 ; Benaissa, 2012 ; Chawki, 2014 ; Benamraoui, 2014 ;,
Benmakhlouf et Bouiche, 2015). Le tableau 1 présente les principaux
groupements chromophores et auxchromes :
Tableau 1 : Principaux groupements chromophores et
auxochromes (Benamraoui, 2014)
|
Groupements chromophores
|
Groupements auxochromes
|
|
Azo (-N=N-)
|
Amino (-NH2)
|
|
Nitroso (-NO ou -N-OH)
|
Méthylamino (-NHCH3)
|
|
Carbonyl (=C=O)
|
Diméthylamino (-N(CH3)2)
|
|
Vinyl (-C=C-)
|
Hydroxyl (-HO)
|
|
Nitro (-NO2 ou =NO-OH)
|
Alkoxyl (-OR)
|
|
Sulphure (>C=S)
|
Groupements donneurs d'électrons
|
1.3.2. Utilité et applications des
colorants
Une alimentation sans additifs est
désormais inconcevable. Les aliments à l'état brut
paraîtraient aux yeux des consommateurs comme « moins bons ».
La couleur, l'aspect de la nourriture ont une influence psychologique sur le
goût perçu des aliments. On consommerait avec réticence des
aliments de couleur inhabituelle (poulet bleu, frites vertes, viande jaune),
alors que le goût resterait le même (Amrouche et Arouri, 2013)
Amrouche et Arouri (2013), stipulent que les colorants ont
parfois une utilité autre que commerciale comme les
caroténoïdes qui sont transformés en vitamine A1. La
tartrazine stabilise la vitamine C dans les boissons. Les couleurs sombres font
office d'écran solaire et protègent les éléments
photosensibles. Le marché des colorants alimentaires représente
plusieurs milliards de francs, ce qui montre bien l'importance des colorants
dans notre alimentation.
Les grands domaines d'application des colorants sont les
suivants (Saoudi et Hamouma, 2013) :
· dans l'industrie textile de la fourrure, du cuir
(textile à usage vestimentaire, de décoration de bâtiment,
de transport, textile à usage médical, etc) ;
· des matières plastiques (pigments),
pharmaceutique (colorants), des cosmétiques, agroalimentaire (colorants
alimentaires) ;
· diverses industries utilisées pour des
carburants et des huiles ;
· dans l'imprimerie (encre, papier).
1.3.3. Classification des colorants
Chawki (2014) rapporte qu'il existe
seulement une dizaine de colorants naturels, alors que l'on compte des milliers
de colorants synthétiques. Ces derniers peuvent être
classés en fonction de leur mode d'application sur les substrats ou de
leur structure chimique. La seconde classification est fondée sur la
nature du chromophore.
En fonction de la nature du chromophore, les colorants sont
regroupés selon certains dispositifs structuraux chimiques communs.
Suivant cette méthode de classification un colorant textile peut
être classé selon son groupement chromophore qui lui
confère la couleur, ou selon son groupement auxochrome, qui permet sa
fixation, (voire tableau 1)
En fonction du mode d'application sur les substrats, les
méthodes pour teinter varient avec la structure chimique de la fibre
à colorer. Un colorant approprié aux laines ou la soie peut
être insuffisant pour le coton. Le tableau 2 résume la
classification des colorants en fonction du mode d'application sur les
substrats.
Tableau 2 : Classification des colorants
synthétiques (Chawki,2014)
|
Colorant
|
Application
|
Systèmes
|
Exemple
|
|
Acides
|
Polyamide (70 à 75 %)
Laine (25 à 30 %)
Soie, fibres acryliques
|
Azoïques
|
|
|
Mordant
|
Laine
Soie
|
Azoïques avec du chrome favorisant sa fixation
|
|
|
Métallifères
|
Fibres polyamides
|
Mono-Azoïques
Contenant des groupements carboxyles et aminés pour
former des complexes métalliques (Cr, Co, Ni,Cu)
|
|
|
Directs
|
Viscose, le lin, le jute, la soie, les fibres polyamides et le
coton
|
Azoïques,
longues structures moléculaires planes qui permettent
à ces molécules de s`aligner avec les macromolécules
plates de cellulose
|
|
|
Basiques (cationiques)
|
Fibres : acryliques, polyamide
|
Azoïques
contiennent un groupe amine quaternaire
|
|
|
Au Soufre
|
Coton et viscose les polyamides et polyesters rarement la
soie
|
Structure chimique exacte n`est pas toujours connue
|
|
|
De Cuve et leurs Leuco-esters
|
Teinture et l`impression du coton et de fibres
cellulosiques
polyamide et de polyester avec des fibres cellulosiques
|
Indigoïdes et anthraquinoniques
|
Colorant de cuve
Colorant leuco-esters
|
|
Dispersés
|
Polyester fibres cellulosiques fibres de polyamide et
d'acrylique
|
- Azoïques 50%
- Anthraquinoniques (25 %), + méthine, nitro et
naphthoquinone.
Caractéristiques : l`absence de
groupes de solubilisation et un poids moléculaire faible
|
|
|
Réactifs
|
|
Azotiques,
ont la particularité de posséder des groupements
chimiques spécifiques capables de former des liaisons covalentes avec le
support textile
|
|
|
Pigments
|
Utilisés dans les procédés
d`impression
|
Les pigments organiques sont en grande partie des
dérivés benzoïques. Les pigments inorganiques
(minéraux) sont des dérivés de métaux tels que Ti,
Zn, Ba, Pb, Fe, Mo, Ca, Al, Ma, Cd, Cr.
|
|
1.3.4. Toxicité et Impact
environnemental
1.3.4.1. Généralités
La toxicité des différents types de colorants
(mortalité, effet muta génique et Cancérigène) a
été étudiée par plusieurs travaux de recherche
aussi bien sur des organismes aquatiques (poissons, algues, bactéries,
etc.) que sur les mammifères.
Kifuani (2018), Karim et al, (2018) indiquent que le colorant
organique Bleu de Méthylène, est susceptible de provoquer des
brûlures oculaires chez l'homme ou l'animal. L'inhalation induit des
difficultés respiratoires et l'ingestion buccale provoque des
nausées, des vomissements, transpiration et sueurs froides abondantes.
Un certain nombre de colorants
présente un caractère toxique sur le milieu aquatique provoquant
la destruction directe des communautés aquatiques (Madani, 2014).
· La fuchsine, en concentration supérieure
à 1mg/L, exerce un effet de ralentissement sur l'activité vitale
des algues (Madani, 2014).
· Les rejets des usines de teinturerie et de textile sont
à l'origine de diverses pollutions telles que : l'augmentation de la
DBO5 et la DCO, diminuant la capacité de
réaération des cours d'eau et retardant l'activité de
photosynthèse (Madani, 2014).
1.3.4.2. Impact sur l'environnement
Beaucoup de colorants sont visibles dans l'eau même
à de très faibles concentrations (< 1 mg L-1).
Ainsi, ils contribuent aux problèmes de pollution liés à
la génération d'une quantité considérable d'eau
usée contenant des colorants résiduels. Le rejet
de ces eaux résiduaires dans l'écosystème est une source
dramatique de pollution, d'eutrophisation et de perturbation non
esthétique dans la vie aquatique et par conséquent
présente un danger potentiel de bioaccumulation, qui peut affecter
l'homme par transport à travers la chaîne alimentaire.
Sous l'action des microorganismes, les colorants
libèrent des nitrates et des phosphates dans le milieu naturel. Ces ions
minéraux introduits en quantité trop importante peuvent devenir
toxiques pour la vie piscicole et altérer la production d'eau potable.
Leur consommation par les plantes aquatiques accélère leur
prolifération anarchique et conduit à l'appauvrissement en
oxygène par inhibition de la photosynthèse dans les strates les
plus profondes des cours d'eau et des eaux stagnantes (Errais, 2011 ;
Meroufel, 2015 ; BenHaoued, 2017)
Lorsque des charges importantes de matière organique
sont apportées au milieu aqueux via des rejets ponctuels, les processus
naturels de régulation ne peuvent plus compenser la consommation
bactérienne d'oxygène. Manahan (1994), estime que la
dégradation de 7 à 8 mg de matières organiques par des
micro-organismes suffit pour consommer l'oxygène contenu dans un litre
d'eau (Benmakhlouf et Bouiche, 2013 ; Meroufel, 2015).
L'accumulation des matières organiques dans les cours
d'eau induit l'apparition de mauvais goûts, une prolifération
bactérienne, des odeurs pestilentielles et des colorations anormales.
Willmott et al. (1998) ont évalué qu'une coloration
pouvait être perçue par l'oeil humain à partir de
5.10-6 g/L. En dehors de l'aspect inesthétique, les agents
colorants ont la capacité d'interférer avec la transmission de la
lumière dans l'eau, bloquant ainsi la photosynthèse des plantes
aquatiques (Belaroussi et Belkacem, 2013 ; Benmakhlouf et Bouiche,
2013 ; Meroufel, 2015, Ben Haoued, 2017)
Les colorants organiques synthétiques sont des
composés très difficiles à épurer par
dégradations biologiques naturelles (Meroufel, 2015). Cette persistance
est en étroite relation avec leur réactivité chimique
(Meroufel, 2015 et Ben Haoued, 2017):
- Les composés insaturés sont moins persistants
que les saturés ;
- Les alcanes sont moins persistants que les
aromatiques ;
- La persistance des aromatiques augmente avec le nombre des
substituants ;
- Les substituants halogènes augmentent la persistance
des colorants plus que les groupements alkyles.
Si un organisme ne dispose pas de mécanismes
spécifiques, soit pour empêcher la résorption d'une
substance, soit pour l'éliminer une fois qu'elle est absorbée,
alors cette substance s'accumule. Les espèces qui se trouvent à
l'extrémité supérieure de la chaîne alimentaire, y
compris l'homme, se retrouvent exposées à des teneurs en
substances toxiques pouvant être jusqu'à mille fois plus
élevées que les concentrations initiales dans l'eau (Errais,
2011 ; Benmakhlouf et Bouiche, 2013 ; Ben Haoued, 2017)
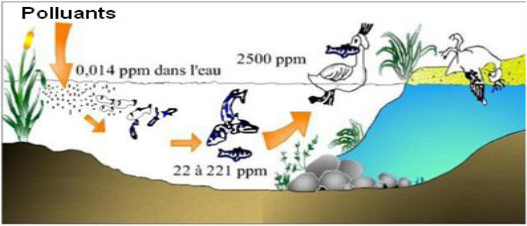
Figure 1: Bioaccumulation (BenHaoued, 2017)
Si la plupart des colorants ne sont pas toxiques directement,
une portion significative de leurs métabolites l'est. Leurs effets
mutagènes, tératogène ou cancérigène
apparaissent après dégradation de la molécule initiale en
sous-produits d'oxydation : amine cancérigène pour les
azoïques, leuco-dérivé pour les
triphénylméthanes (Gouarir, 2014).
1.3.5. Traitement et Elimination des colorants
Vu l'ampleur de dégât que peuvent avoir les
colorants sur l'environnement biophysique et la santé de l'homme, le
traitement des rejets industriels contenant les colorants s'avèrent d'un
grand intérêt. Une large variété de techniques
physiques, chimiques et biologiques a été
développée et testée dans le traitement des effluents
chargés en colorants. Ces procèdes incluent la floculation, la
précipitation, l'échange d'ions, la filtration sur membrane,
l'irradiation et l'ozonation. Toutefois, ces procédés sont
coûteux et ne peuvent être utilisés efficacement pour
traiter des larges gammes des eaux chargées en colorants.
1.3.5.1. Méthodes biologiques
Les procédés d'épuration par voie
biologique sont basés sur la biotransformation microbienne des
colorants. La majorité des colorants sont très stables et non
biodégradables ; néanmoins, beaucoup de recherche ont
démontré la biodégradation partielle ou complète
des colorants par voie biologique. Si ces techniques sont adaptées
à un nombre de polluants organiques, elles ne sont pas toujours
applicables sur les effluents industriels en raison de fortes concentrations de
polluants, de leur toxicité qui entraînent la mort des
microorganismes ou de leur très faible biodégradabilité.
De plus, ces techniques génèrent des quantités importantes
de boues biologiques, à retraiter. Selon Loehr, la
biodégradabilité est favorable pour les eaux usées
présentant un rapport DBO5/DCO > 0,5 ; par contre
elle est très limitée lorsque ce rapport devient inférieur
à 0,2. Ce rapport, appelé degré de dégradation
biochimique, sert de mesure pour la dégradation biochimique des
polluants dans les eaux usées (Bouafia, 2010). Principalement, on
distingue deux méthodes de biodégradation: aérobie et
anaérobie.
a) Méthode Aérobie
C'est un traitement biologique usant de micro-organismes, en
présence d'oxygène. Des réacteurs dits à lits
bactériens sont utilisés pour cet effet. Ils sont
constitués d'une unité de boue activée où les
polluants sont décomposés par des bactéries
aérobies. Après épuration, la boue est
séparée des eaux usées par sédimentation dans un
décanteur. Une partie des eaux est recyclée et le surplus est
évacué après pressage ou centrifugation. Ce
procédé est resté longtemps un moyen pour dégrader
un grand nombre de polluants organiques Il s'est avéré efficace
pour une certaine catégorie de rejets textiles. Notons cependant que des
colorants tels que les azoïques, les colorants acides et les colorants
réactifs se sont révélés persistants à ce
mode de traitement (Gouarir, 2014 ; Benaouda et Bentaiba 2016).
b) Méthode anaérobie
En l'absence d'oxygène, la digestion anaérobie
des composés organiques conduit à la formation du dioxyde de
carbone, du méthane et de l'eau. Ce procédé est d'une
grande efficacité dans le traitement des effluents très
chargés, caractérisés par une DCO relativement
élevée. Ce procédé utilisé dans les stations
d'épuration des eaux, permet de produire des quantités
importantes de méthane. Ce dernier est utilisé comme source
d'énergie notamment pour le chauffage et l'éclairage. Des
études ont montré que la réduction voire la disparition de
la couleur n'est pas synonyme d'une minéralisation totale des colorants.
Par-contre, la formation de composés intermédiaires plus
toxiques, notamment des amines a été signalée (Gouarir,
2014).
1.3.5.2. Méthodes physico-chimiques
a. Coagulation - floculation
La coagulation - floculation est un processus physico-chimique
par lequel des particules colloïdales ou des solides en fine suspension
sont transformés, à l'aide des coagulants et floculants chimiques
en espèces plus visibles et séparables (les flocs). Les
particules colloïdales sont déstabilisées tout d'abord par
l'addition des sels tels que Al2(SO4)3 ou
Fe2(SO4)3. Les floculants facilitent
l'agglomération des particules déstabilisées conduisant
à la formation des flocs. Les flocs formés sont ensuite
séparés par décantation et filtration, puis
évacués. Les coagulants inorganiques tels que l'alun,
(Al2(SO4)3.14H2O),
donnent les résultats les plus satisfaisants pour la décoloration
des effluents textiles contenant des colorants dispersés, de cuve et au
soufre, mais sont totalement inefficace pour les colorants réactifs,
azoïques, acides et basiques. Par ailleurs, la coagulation - floculation
ne peut être utilisée pour les colorants fortement solubles dans
l'eau. D'importantes quantités de boue sont formées avec ce
procédé : leur régénération ou
réutilisation reste la seule issue mais demande des investissements
supplémentaires (Bouafia, 2010).
b.
Filtration sur membrane
La filtration sur membrane pilotée par pression
hydraulique se décline en microfiltration, ultrafiltration,
nanofiltration et osmose inverse. L'effluent passe à travers une
membrane semi-perméable qui retient en amont les contaminants de taille
supérieure au diamètre des pores, pour produire un perméat
purifié et un concentrât qui reçoit les impuretés
minérales ou organiques. D'après Taylor et Jacobs, parmi les
quatre types de procédés, la nanofiltration et l'osmose inverse
sont les plus adaptés à la réduction partielle de la
couleur et des petites molécules organiques, mais selon Calabro,
l'osmose inverse reste la plus répandue (Bouafia, 2010). La
nanofiltration s'applique surtout au traitement des bains de teinture de
colorants réactifs en agissant comme un filtre moléculaire tandis
que la microfiltration retient les matériaux colloïdaux, tels que
les colorants dispersés ou de cuve grâce à une "membrane
écran". L'ultrafiltration ne s'applique qu'à la réduction
de DCO et des solides en suspension, et ne se montre réellement efficace
qu'en combinaison avec la coagulation/ floculation (Bouafia, 2010).
c.
Adsorption
L'adsorption est un procédé de transfert de
matière entre une phase liquide (ou gazeuse) chargée en
composés organiques ou inorganiques et une phase solide, l'adsorbant.
Pendant des décennies, les charbons actifs commerciaux ont
été les principaux, voire les seuls adsorbants utilisés
dans les filières de traitement d'eaux. En effet, l'adsorption sur
charbons actifs présente de nombreux avantages : elle permet
l'élimination d'une large gamme de polluants, dont différents
types de colorants, mais aussi d'autres polluants organiques et inorganiques,
tels que les phénols, les ions métalliques, les pesticides, les
substances humiques, les détergents, ainsi que les composés
responsables du goût et de l'odeur. A l'inverse de la
précipitation, l'adsorption est plutôt efficace dans le domaine
des faibles concentrations.
d. Traitement par oxydation
Les techniques d'oxydation chimiques sont
généralement appliquées quand les procédés
biologiques sont inefficaces. Elles peuvent être ainsi utilisées
en étapes de prétraitement pour les procédés
biologiques. L'oxydation chimique est souvent appliquée pour le
traitement des composés organiques dangereux présents en faibles
concentrations et des effluents chargés de constituants
résistants aux méthodes de biodégradation. Les
réactifs les plus souvent énumérés pour ce type de
traitement sont H2O2, Cl2 et O3. Le
peroxyde d'hydrogène est un oxydant moyennement fort et son application
pour le traitement des polluants organiques et inorganiques est bien
établie. L'oxydation seule par H2O2 n'est pas
suffisamment efficace pour de fortes concentrations en colorant. Hamada et al
(2009) ont proposé de traiter les colorants azoïques par
l'hypochlorure de sodium mais même si la molécule initiale est
oxydée, les halogènes sont susceptibles de former des
trihalométhanes cancérigènes pour l'homme avec les
sous-produits de dégradation (Bouafia, 2010).
Le tableau 3 présente les principaux avantages et
inconvénients des techniques citées précédemment
pour le traitement des colorants (Zawlotski et al, 2004). On peut constater que
chaque technique peut être employée en décoloration,
moyennant des objectifs bien établis et des conditions
opératoires de traitement bien déterminées.
Tableau 3 : Principaux avantages et
inconvénients des techniques de traitements des colorants (Zawlotski et
al, 2004).
|
Technologies
|
Exemples
|
Avantages
|
Inconvénients
|
|
Coagulation/
Floculation
|
Chaux,
FeCl3,
Polyélectrolyte
|
-Equipement simple
-Décoloration relativement rapide
-Réduction significative de la DCO
|
-Formation de boues
-Adjonction de produits
chimiques nécessaires
-Fonctionnement onéreux
-Coagulants non réutilisables
-Réduction spécifique de la
couleur
-Peu d'informations sur la
réduction de DBO et DCO
|
|
Filtration
sur
membranes
|
Osmose
inverse,
Nanofiltration,
Microfiltration,
Ultrafiltration.
|
-Utilisation simple et rapide
-Pas d'addition de produits chimiques
-Faible consommation
énergétique
-Réduction de la couleur
|
-Investissement important
-Sélectif
-Encrassement rapide des
membranes
-Pré et post traitement
Nécessaires
|
|
Adsorption
|
Charbon actif,
Silice,
|
-Réduction efficace de la
couleur
-Technologie simple
-Faible coût d'utilisation
pour certains adsorbants
|
-Investissement et coût de
fonctionnement élevés
-Lent et limité en volume
-Régénération des adsorbants
Onéreuse, voire impossible
-Sélectif
-Formation de boue
|
|
Oxydation
Chimique
|
Ozone
Réactifs de
Fenton
Chloration
|
-Traitement de gros volumes
-Diminution nette de la
Chloration
-Décoloration rapide et
efficace
-Opération simple
-oxydant puissant
|
Investissement et coût de
fonctionnement très élevés
-Efficacité limitée pour certains colorants
-Produits d'oxydation inconnus
-Cout élevé
-Produits d'oxydation inconnus
-Formation de sous produits de chloration
(cancérigènes)
|
|
Procédés
biologiques
|
Aérobie
|
-Approprié pour les colorants Insolubles
|
-Spécifique à certains colorants
-Décoloration variable
-Grandes quantités de boues
générées
-Besoins énergétiques
Importants
|
|
Anaérobie
|
Décolore la plupart des
colorants par un mécanisme
de réduction
-Réutilisation du méthane produit comme source
d'énergie sur le site
|
-Produits de dégradation
inconnus
-Beaucoup de produits toxiques non dégradés
-Nécessite de grands réservoirs
d'aération
|
1.4. Bleu de méthylène
1.4.1. Propriétés du bleu de
méthylène
Il est soluble dans l'eau (50 g/L à 20 °C) et
plus légèrement dans l'alcool (10 g/L dans l'éthanol
à 20 °C). Il existe sous plusieurs formes : poudre (appelé
aussi cristaux) d'un bleu sombre, soluble dans l'eau moins soluble dans
l'alcool. Les solutions aqueuses ou alcooliques ont une couleur bleu peu
profonde. C'est un colorant non toxique. Le bleu de méthylène est
utilisé comme colorant bactériologique et aussi comme
indicateur.
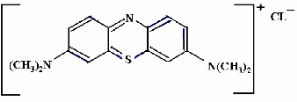
Figure 2: Structure chimique du bleu de
méthylène
Tableau 4: Caractéristiques et
Propriétés physico-chimiques du Bleu de Méthylène
(Zawlotski et al, 2004).
|
Nom Usuel
|
Bleu de méthylène (Chlorure de bis
dimethylamino)- 3,7 phenazathionium
|
|
Synonymes
|
Chlorure de méthylthioninium C.I. 52015 C.I. Basic bleu
9
|
|
Formule chimique
|
C16H18ClN3S
|
|
Masse molaire
|
319.86 g.mol-1
|
|
Solubilité dans l'eau
|
Elevée
|
|
ëmax (nm)
|
663
|
|
pKa
|
3.8
|
|
I.C.
|
52015
|
1.4.2. Utilisation
C'est le plus important des colorants basiques. On peut
utiliser le bleu de méthylène en prévention contre toutes
les maladies dues à un champignon. En biologie le bleu de
méthylène est un colorant extrêmement pratique pour
étudier les cellules en milieu aqueux. Il s'agit d'un colorant vital,
c'est à dire susceptible d'être utilisé sur les cellules
vivantes.
· Il sert d'indicateur coloré redox : sa forme
oxydée est bleue, tandis que sa forme réduite est incolore.
· Il est employé comme colorant histologique. Le
bleu de méthylène teint le collagène des tissus en bleu.
Il tache la peau durant plusieurs semaines. Il est donc utilisé comme
encre alimentaire pour les viandes, par tampon.
· Il permet de calculer le taux de dureté de
l'eau.
· En médecine, il est fréquemment
utilisé comme marqueur afin de tester la perméabilité
d'une structure.
· C'est un bon antiseptique à usage interne et
externe.
1.4.3. Toxicité
Le bleu de méthylène est le colorant le plus
couramment utilisé dans la teinture du coton, du bois et de la soie. Il
peut provoquer des brûlures oculaires responsables de blessures
permanentes aux yeux de l'homme et des animaux. Son inhalation peut donner lieu
à des difficultés respiratoires, entrainer des cas
d'anémie après une absorption prolongée et son ingestion
par la bouche produit une sensation de brûlure, provoque des
nausées, des vomissements, transpiration et sueurs froides abondantes.
Il est aussi toxique pour les algues et les petits crustacés à
partir des concentrations de 0,1 mg L-1 et 2 mg L-1 ,
respectivement.
| 


