|
UNIVERSITE CHEIKH ANTA DIOP DE DAKAR
************
ECOLE INTER-ETATS DES
FST SCIENCES ET MEDECINE
VETERINAIRE DE DAKAR

Année : 2009 N° : 26

Evolution spatiale et temporelle de la
leishmaniose
cutanée au Mali
MEMOIRE DE DIPLOME DE MASTER II
SANTE PUBLIQUE
VETERINAIRE
Présenté et soutenu publiquement le 25
Juillet 2009 à 12 heures
A l'EISMV de Dakar Par :
Claude Laurel BETENE A DOOKO
Né le 24 Juillet 1983 à Ntouessong
(Cameroun)
MEMBRES DU JURY
Président: M. Louis Joseph
PANGUI
Professeur à l'EISMV de Dakar
Membres: M. Bhen Sikina TOGUEBAYE
Professeur à la FST à l'UCAD
Germain Jérôme SAWADOGO Professeur à
l'EISMV de Dakar
Rapporteur de mémoire: M. Ayayi Justin
AKAKPO
Professeur à l'EISMV de Dakar
Directeur de recherche: M. Seydou
DOUMBIA
Professeur à la FMPOS de Bamako et chercheur au
MRTC
Dédicaces et Remerciements
A toi seul Seigneur Jésus-Christ soit la gloire
!
Nous tenons a exprimer notre gratitude a l'endroit de :
Monsieur le Professeur Ayayi J. AKAKPO notre Rapporteur de
mémoire Monsieur le Professeur Seydou DOU MBIA, notre Directeur de
recherche
Monsieur le Professeur Louis Joseph PANGUI, Directeur de l'EIS MV
de Dakar
Monsieur le Docteur Philippe KONE, Assistant a l'EIS MV
Tous les membres du GBEE M en particulier du point G
Mon papa et ma maman : Mr et Mme DOOKO
Ma fiancée Kate THERRIEN et sa mere
Tous ceux qui, de pres ou de loin, ont rendu ce travail
possible.
LISTE DES FIGURES
Figure 1: Stades amastigotes chez les
vertébrés Figure 2: Stades promastigotes chez l'insecte
3
Figure 3: Phlébotome Figure 4: Phlébotome
femelle suçant un végétal 4
Figure 5: Cycle parasitaire de Leishmaniose 5
Figure 6: Réparation Mondiale de la Leishmaniose
7
Figure 7: Cas cliniques de leishmaniose cutanée au
Mali par région entre 1957 et 1966 8
Figure 8: Cartographie des cas de LC entre 1957 et 1966
9
Figure 9: Carte régionale et climatique du Mali
12
Figure 10:Répartition des cas de LC par
région au Mali de 1957 à 1966 15
Figure 11: Répartition des cas de LC par
région au Mali de 1997 à 2008 15
Figure 12: Répartition des cas de LC par
région au Mali entre 1997 et 2008 16
Figure 13: Répartition par Cercles des cas de LC
au Mali de 1957 à 1966 16
Figure 14: Répartition par Cercles des cas de LC
au Mali de 2005 à 2008 17
Figure 15: Cas de LC provenant de pays frontaliers du
Mali a l'échelle régionale 17
Figure 16: Cas de LC provenant de pays frontaliers du
Mali a l'échelle des cercles 18
Figure 17: Présence de phlébotomes par
région au Mali 19
Figure 18: Répartition des cas de LC et
présence de phlébotomes au Mali entre 1997 et 2008 19
Figure 19: Répartition des genres
Phlebotomus et Sergentomyia en fonction de la zone climatique
20
Figure 20: Répartition par région des
espèces de phlébotomes du genre Phlebotomus
20
Figure 21: Répartition par cercle des cas de LC
entre 2005 et 2008 et des espèces de phlébotomes du
genre Phlebotomus 21
Figure 22: Répartition des cas de LC par la zone
climatique entre 1997 et 2008 21
Figure 23: Répartition des cas de LC par mois
22
LISTE DES TABLEAUX
Tableau 1: Complexes et espèces de Leishmania
retrouvés en Afrique 4
Tableau 2: Réaction positive au test cutané
à la leishmanine par région au Mali entre 1957 et
1966
8
Tableau 3: Résultat de la recherche des corps de
Leishman (1997-2008) 14
Tableau 4: Répartition des cas de LC par
année entre 1997 et 2008 14
Tableau 5: Répartition des cas de LC par saison au
Mali entre 1997 et 2008 22
Tableau 6: Evolution de l'incidence annuelle nationale
entre 1997 et 2008 23
Tableau 7: Incidence par région entre 1997 et 2008
23
SIGLES ET ABREVIATIONS
CDC: Centers for Disease Control and Prevention CIA:
Central Intelligence Agency
CNAM: Centre National d'Appui à lutte contre la
Maladie
DNSI: Direction Nationale de la Statistique EQDSM:
Enquête Démographique de Sante au Mali FMI: Fond Monétaire
International
GIS: Geographic Information System GPS: Global
Positioning System
LC: Leishmaniose Cutanée
LV: Leishmaniose Viscérale
MRTC: Malaria Research and Training Center OMS:
Organisation Mondiale de la Santé
SIG: Système d'Information Géographique
TDR: Tropical Diseases Research
VIH: Virus de l'Immunodéficience
Humaine
SOMMAIRE
INTRODUCTION 1
PREMIERE PARTIE : REVUE BIBLIOGRAPHIQUE SUR LA
LEISHMANIOSE 3
Chapitre 1: Généralité sur la
Leishmaniose 3
1.1. Définition 3
1.2. Étiologie 3
1.3. Vecteur : Le Phlébotome 4
1.4. Cycle parasitaire de leishmaniose 5
1.5. Symptomatologie 5
Chapitre 2 : Répartition géographique de la
leishmaniose 7
2.1. Situation dans le monde 7
2.2. Situation au Mali 7
2.3. Problématique/Hypothèse 9
DEUXIEME PARTIE: EVOLUTION SPATIALE ET TEMPORELLE DE LA
LEISHMANIOSE CUTANEE AU
MALI 11
Chapitre 1 : Matériel et Méthodes
11
1.1. Milieu d'étude 11
1.2. Matériel 12
1.2.1. Population étudiée 12
1.2.2. Collecte des données 12
1.2.3. Matériel d'étude 13
1.2.3.1. Logiciels utilisés pour l'analyse
statistique 13
1.2.3.2. Matériel de SIG 13
1.3. Méthodes 13
1.3.1. Analyses statiques et traitement des
données 13
1.3.1.1. Détermination de l'incidence
13
1.3.1.2. Analyse spatiale 13
Chapitre 2 : Résultats 14
2.1. Recherche positive des corps de Leishman par
période d'étude 14
2.1.1. Nombre de cas de LC entre 1997 et 2008
14
2.1.2. Cartographie de la LC au Mali entre 1957 et 1966
14
2.1.3. Cartographie de la LC au Mali entre 1997 et 2008
15
2.1.4. Cas provenant des pays voisins 17
2.2. Répartition nationale des phlébotomes
18
2.2.1. Répartition des phlébotomes par
genre 18
2.2.2. Répartition des espèces du genre
Phlebotomus 20
2.3. Répartition des cas de LC par saison et par
zone climatique de 1997 à 2008 21
2.4. Répartition des cas de LC par saison entre
1997 et 2008 22
2.5. Evolution de l'incidence annuelle entre 1997 et 2008
22
2.5.1. Incidence nationale 22
2.5.2. Incidence par région 23
Chapitre 3 : Discussion et Recommandations 24
3.1. Discussion 24
3.1.1. Méthodologie 24
3.1.1.1. Collecte des données 24
3.1.1.2. Méthode diagnostique 24
3.1.1.3. Méthode de cartographie 25
3.1.2. Résultats 25
3.1.2.1. Répartition des cas par année
25
3.1.2.2. Répartition des cas par région
25
3.1.2.3. Répartition des cas par zone climatique
25
3.1.2.4. Répartition des cas par saison
26
3.2. Recommandations 26
3.2.1. Au Ministère de la Santé Publique du
Mali 26
3.2.2. Aux chercheurs 26
CONCLUSION 27
BIBLIOGRAPHIE ET WEBOGRAPHIE 28
Bibliographie 28
Webographie 30
INTRODUCTION
La leishmaniose est une zoonose parasitaire, transmise
à l'homme par la piqûre de la femelle hématophage d'un
insecte diptère dénommé Phlébotome. Le parasite est
un protozoaire flagellé du genre Leishmania (OMS, 2007). Le
phlébotome s'infeste en piquant un homme ou un animal malade, absorbant
ainsi des monocytes sanguins ou des histiocytes dermiques parasités.
Chez l'homme la maladie existe sous trois (3) formes principales : la forme
cutanée, la forme muco-cutanée et la forme viscérale
létale (PRADINAUD et coll., 1987 ; AUBRY, 2006). Les réservoirs
sont les rongeurs sauvages et le chien (MAZALET, 2004 ; DENGUEZLI, 2006). La
transmission de la forme viscérale (LV) peut être également
interhumaine par l'utilisation de la même aiguille, comme cela arrive
souvent entre les toxicomanes (OMS, 1999). Par ailleurs, selon une étude
récente, les modifications du contexte épidémiologique et
de mutations génétiques vers des souches plus pathogènes
sont désormais des scenarii envisageables (PIN-DIOP et coll., 2008). Sur
le plan clinique, la leishmaniose cutanée (LC) entraînerait une
déformation du faciès et une invalidité dans la population
productrice car les zones corporelles les plus touchées sont surtout les
jambes et les bras (NDIAYE, 1983 ; OUMEISH, 1999). Elle se caractérise
par le caractère indélébile de la cicatrice de la plaie
consécutive à la piqûre des phlébotomes.
La leishmaniose est endémique dans 88 pays du
monde (OMS, 2007). La forme cutanée est la plus courante avec 50
à 75% des cas de leishmaniose et reste à ce jour la seule
à avoir été signalée au Sud du Sahara. La maladie
est un facteur qui contribue au sous-développement pour les pays
d'Afrique (OMS, 2006). La maladie a été identifiée au Mali
depuis le début du 20e siècle (GUARIN et coll., 1914 ; LEFROU,
1948), cependant elle reste très mal connue. Pourtant des structures
hospitalières ne cessent depuis quelques années de tirer la
sonnette d'alarme sur la recrudescence des cas observées au début
des années 2000 (KEITA et coll., 2003). L'incidence nationale est mal
connue mais a été estimée en 2005 à 8 pour mille
(KEITA, 2004). La cartographie des cas de LC, quant à elle, date de 1970
et l'étude vectorielle est restée à un stade superficiel.
Plusieurs questions restent donc sans réponses à ce jour. Quelle
serait à l'heure actuelle la distribution nationale des cas de
leishmaniose cutanée connus selon des données existantes au Mali
? Comment a évolué la répartition de la maladie au Mali
depuis sa découverte ? Existerait-il une concordance entre l'origine des
cas signalés et les zones déjà connues comme abritant les
phlébotomes? Quelles sont les zones climatiques du Mali les plus
favorables à la maladie? Quelle est la saison la plus propice à
la maladie au Mali ?
La présente étude a pour objectif
général d'étudier la distribution spatiale et temporelle
de la leishmaniose cutanée au Mali sur 22 ans en deux (2)
périodes : de 1957 à 1966 (soit 10 ans), puis 1997 à 2008
(soit 12 ans). Les objectifs spécifiques de l'étude sont
:
> Actualiser la cartographie des cas entre 1957 et
1966 puis, la comparer avec celles issues des données les plus
récentes (1997 à 2008);
> Cartographier la provenance des malades de la
leishmaniose cutanée venant en consultation au CNAM pendant la
période allant de 1997 à 2008;
> Cartographier la distribution nationale des
Phlébotomes au Mali selon les genres et les espèces jusque
là identifiée grâce aux résultats des études
sur les phlébotomes au Mali en cours ou déjà
publiées ;
> Déterminer la saison et la zone climatique
les plus favorables à la maladie ; Déterminer l'incidence de la
LC au Mali au niveau National, Régional et Départemental
(Cercles) sur 12 ans (1997-2008).
Ce travail comporte deux parties : la première
partie est une revue bibliographique sur la LC dans le monde et au Mali en
particulier. La deuxième partie présente l'évolution de la
LC au Mali sur une période de 22 ans.
PREMIERE PARTIE : REVUE BIBLIOGRAPHIQUE SUR LA
LEISHMANIOSE
Chapitre 1: Généralité sur la
Leishmaniose 1.1. Définition
La leishmaniose est une
réticulo-endothéliose parasitaire dont l'agent pathogène
est un protozoaire appartenant au genre Leishmania transmis par la
piqûre d'un insecte appartenant au genre Phlebotomus. Cet agent
pathogène infecte les macrophages des mammifères dont l'humain.
Il existe trois formes de leishmaniose : la leishmaniose cutanée, la
leishmaniose muco-cutanée et la leishmaniose
viscérale.
La leishmaniose est devenue dans certains pays un
problème sanitaire d'urgence : c'est le cas notamment en Ethiopie, en
Erythrée et au Soudan où la maladie est endémique depuis
quelques années. Le taux de létalité de la maladie est
d'ailleurs très élevé en raison de l'absence de moyens
diagnostiques et de médicaments. La leishmaniose non-traitée a un
taux de létalité de 100%, alors que sous traitement, ce taux
passe à 10%.
1.2. Étiologie
Les parasites Leishmania dont il existe environ 17
espèces pathogènes chez l'homme sont des protozoaires
flagellés lesquels envahissent des cellules appelées macrophages
(DEDET, 2001). Les Leishmania sont des parasites dimorphiques avec deux stades
:
> Stades amastigotes : intracellulaires dans les
cellules macro-phagiques du
système des phagocytes mononuclées chez les
vertébrés (Figure 1).
> Stades promastigotes: libres et mobiles dans le
tube digestif de l'insecte
et en culture (Figure 2).phj

Figure 1: Stades amastigotes chez les
vertébrés Figure 2: Stades promastigotes chez
l'insecte
(Source : DEDET, 2001)
On regroupe habituellement les espèces de
Leishmania en complexes selon la similarité biochimique de leurs iso
enzymes. Ceux existants en Afrique sont nommés dans le tableau ci
après (ROBERTS et coll., 2000):
Tableau 1: Complexes et espèces de
Leishmania retrouvés en Afrique
|
Complexe
|
Nombre d'espèces
|
Espèce par pays en Afrique
|
|
L. donovani
|
2
|
L. archibaldi
|
Soudan, Éthiopie
|
|
L. infantum
|
2
|
L. infantum
|
Nord-ouest d'Afrique
|
|
L. tropica
|
2
|
L. killicki
|
Tunisie
|
|
L. major
|
1
|
L. major
|
Afrique
|
|
L. aethiopica
|
1
|
L. aethiopica
|
Éthiopie, Kenya
|
1.3. Vecteur : Le Phlébotome

Le phlébotome (Figure 3) est un petit insecte
ayant l'aspect d'un très petit moustique velu, de couleur
jaunâtre, à gros yeux noirs dont les ailes
lancéolées, frangées de longs poils qui sont
relevées au repos. Il existe environ 800 espèces de
phlébotomes dans le monde parmi lesquelles environ 40 sont vectrices de
Leishmanioses et d'autres Arboviroses. Les males et les femelles des
phlébotomes se nourrissent des sucs végétaux. Seules les
femelles sont hématophages (Figure 4). Ces insectes volent en silence et
ont un mode de vie nocturne : ils sont particulièrement actifs au
crépuscule et la nuit. On les rencontre dans les zones rurales ou les
aires boisées des villes (jardins et parcs). La saison classique des
phlébotomes s'étend d'Avril-Mai à Septembre-Octobre mais
cette saison peut varier en fonction des conditions climatiques (SCALIBOR,
2008). Depuis quelques années les phlébotomes apparaissent de
plus en plus tôt dans la saison (dès le mois de Mars) (SCALIBOR,
2008 ; SAMAKE, 2006).

Figure 3: Phlébotome Figure 4: Phlébotome
femelle suçant un végétal
(Source : DEDET, 2001)
Environ huit cents espèces de
phlébotomes ont été décrites dans le monde parmi
lesquelles quarante assurent la transmission de la leishmaniose et des
arboviroses (BALDET, 2004). Dix neuf espèces appartenant à deux
genres ont été confirmées comme vecteurs des
différentes espèces de Leishmania (HAUSMANN et coll.,
1996) le genre Phlebotomus prédominant dans l'Ancien Monde (sud
de l'Europe, Afrique, Proche-Orient et Asie) et Lutzomyia dans le
Nouveau Monde (Amériques du Nord, du Sud et Centrale). Quatre autres
genres existent et ne transmettent pas la maladie chez l'homme. Il s'agit de
Sergentomyia spp, Werileya spp, Hertigia spp et Brumptomyia
spp (BALDET, 2004).
1.4. Cycle parasitaire de leishmaniose
Comme le montre la Figure 5, la leishmaniose est
transmise par la piqûre infectante des phlébotomes femelles lors
des repas de sang (1). Ces larves au stade infectieux (promastigotes
méta cycliques) déposées au niveau du point de la
piqûre sont phagocytées par les macrophages (2) et se transforment
en amastigotes (3) chez les vertébrés. Les amastigotes se
multiplient dans les cellules infectées et atteignent différents
tissus, suivant (du moins en partie) l'espèce de Leishmania qui
est impliquée (4). Ces spécificités d'atteinte tissulaires
différentes sont la cause des manifestations cliniques qui
diffèrent dans les diverses formes de leishmaniose. Les
phlébotomes s'infectent lors d'un nouveau repas de sang sur un
hôte infecté quand ils ingèrent des macrophages porteurs
d'amastigotes (5-6). Dans l'intestin du phlébotome, les parasites se
différencient en promastigotes (7), qui se multiplient et se
différencient en promastigotes méta cycliques et migrent dans la
trompe du phlébotome (8) et le cycle reprend de nouveau.
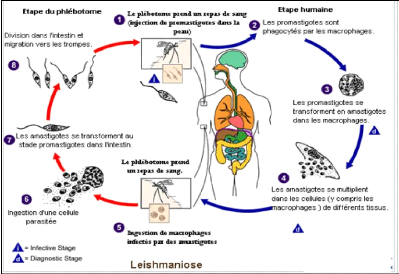
Figure 5: Cycle parasitaire de Leishmaniose
(Source
: CDC, 2009)
1.5. Symptomatologie
Les leishmanioses regroupent un large éventail
de maladies parasitaires qui ont pour caractéristiques
symptomatologiques communes : fièvre, abdomen volumineux, faiblesse
généralisée, maux de tête et vertiges, perte de
poids, transpiration abondante et diarrhée. On distingue principalement
trois types de leishmanioses.
1.5.1. La leishmaniose viscérale
Le parasite coupable est le complexe Leishmania
donovani, (ROBERTS et coll., 2000) également connue sous le nom de
Kala Azar (PAMPIGLIONE et coll., 1975). La leishmaniose viscérale
constitue la forme la plus grave de la maladie. Si elle n'est pas
traitée, le taux de létalité est de 100%. Elle se
caractérise par des poussées de fièvre
irrégulières, une perte de poids, une
hépato-splénomégalie et une anémie.
1.5.2. La leishmaniose cutanée
La forme cutanée est causée par
Leishmania tropica, Leishmania mexicana, Leishmania
major (ROBERTS et coll., 2000). C'est une papule prurigineuse rouge
sombre, généralement unique, siégeant sur une
région découverte, le plus souvent au niveau de la face, qui se
vésiculise, s'ulcère, s'infiltre en profondeur et se recouvre de
fines squames évoluant très lentement (bouton d'un an) sous forme
sèche ou sous forme humide, vers la guérison au prix d'une
cicatrice indélébile.
1.5.3. La leishmaniose
cutanéo-muqueuse
Cette forme est causée par Leishmania
braziliensis (ROBERTS et coll., 2000). Elle se distingue de la
précédente par une ulcération plus extensive, plus
profonde et d'évolution plus torpide, par une propagation cutanée
à distance, enfin et surtout par une atteinte de la peau du visage
souvent extrêmement mutilante. Les lésions peuvent en effet
conduire à une destruction étendue et défigurante des
muqueuses du nez, de la bouche et de la gorge.
Chapitre 2 : Répartition géographique de la
leishmaniose 2.1. Situation dans le monde
Selon l'Organisation Mondiale de la Santé
(OMS), la leishmaniose est endémique dans 88 pays du monde (Figure 6),
dont 13 parmi les pays les moins développés. D'après les
estimations de l'OMS, 14 millions de personnes sont atteintes. L'incidence
annuelle globale est d'environ 1,5 à 2 millions de cas pour la
leishmaniose cutanée (LC) et à 500.000 pour la leishmaniose
viscérale (LV). Selon l'OMS (2007) la leishmaniose menace 350 millions
de personnes dans le monde. La forme cutanée est la plus courante avec
50 à 75% des cas. Les leishmanioses font parti des 6 maladies
prioritaires du programme « Tropical Diseases Research » (TDR) de
l'OMS (OMS, 1990). En réalité, la maladie contribue beaucoup
à propager la pauvreté, car le traitement coûte cher et
dépasse les moyens financiers des malades ou leur impose une lourde
charge économique, y compris une perte de revenu. (OMS,
2006).
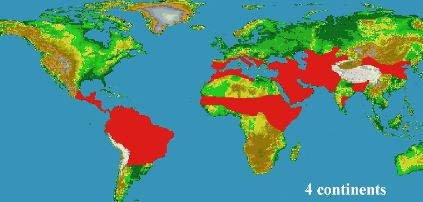
Figure 6: Réparation Mondiale de la
Leishmaniose
(Source : DEDET, 2001)
2.2. Situation au Mali
Au Mali, la maladie a été
signalée bien avant les indépendances (GUARIN et coll., 1914 ;
LEFROU, 1948). Seules les formes cutanées ont été
décrites, et le pays en est endémique excepté la zone
désertique du Nord. En 1960, le règlement de Santé
Publique du Mali a exigé de rapporter des cas de leishmaniose
viscérale et cutanée (ABONNEC et coll., 1970 ; IMPERATO et coll.,
1969 ; SANKALE et coll., 1958). Les résultats trouvés n'ont
jamais rapporté le cas de la leishmaniose viscérale au Mali alors
que la leishmaniose cutanée était très bien connue dans le
temps. Deux principaux foyers d'endémies étaient
identifiés, le cercle de Niono dans la région de Kayes et le
cercle de Ségou dans la région de Ségou (Figure
7).
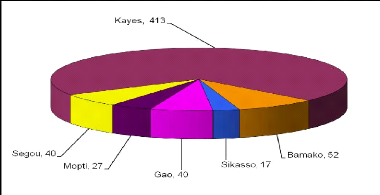
Figure 7: Cas cliniques de leishmaniose cutanée
au Mali par région entre 1957 et 1966
Au cours de la période de 1957 à 1966,
la leishmaniose cutanée a été rapportée dans
plusieurs autres localités du Mali grâce au test cutané
à la leishmanine (Leishmanin skin test)ND. Une récente
étude estime le taux moyen d'incidence annuelle de la forme
cutanée à 8 pour mille (KEITA et coll., 2003). L'application du
test cutané à la leishmanine a permis de mieux comprendre
l'épidémiologie de la maladie au Mali et de déterminer sa
prévalence (Tableau 2).
Tableau 2: Réaction positive au test
cutané à la leishmanine par région au Mali entre 1957 et
1966
|
Région
|
Nombre testé
|
Nombre positif
|
% positif
|
|
Bamako (Bamako, Nara, Koulikoro)
|
344
|
60
|
17,4
|
|
Ségou
|
112
|
34
|
30,4
|
|
Sikasso
|
87
|
29
|
33,3
|
|
Kayes
|
101
|
26
|
25,7
|
|
Mopti
|
64
|
25
|
39,1
|
|
Gao
|
56
|
10
|
17,9
|
|
Bamako Ville
|
705
|
90
|
12,7
|
|
Total
|
1469
|
274
|
18,65
|
(Source : IMPERATO et coll., 1969)
La leishmaniose est une maladie rurale qui touche
surtout les adultes jeunes (à partir de 20 ans). La maladie peut se
présenter sous plusieurs formes cliniques et tous les âges sont
concernés (IMPERATO et coll., 1969 ; KEITA et coll., 2003). Il existe
une bonne corrélation entre la prévalence de cas cliniques et
celle de la positivité au test cutané à la leishmanine
(IMPERATO et coll., 1969). Cependant, l'absence de cas cliniquement
notifié ne peut exclure l'existence de la LC dans une
localité.
Leishmania major est responsable de la
maladie au Mali (GUARIN et coll., 1914; IZRI et coll., 1989). Le vecteur
principal est Phlebotomus duboscqi (IMPERATO et coll., 1969 ; SANGARE,
1974 ; SISSOKO, 2008). Cependant, 14 espèces de phlébotomes ont
été identifiées dans les villages de Sougoula et
Kemena
dans le cercle de Baroueli (SAMAKE, 2006). Par
ailleurs, le CNAM a récemment signalé une recrudescence des cas
de LC accompagnée de complications cliniques graves. Ce centre a
également constaté l'apparition de co-infection à
Leishmania et au VIH du fait de la superposition croissante des deux maladies
(KEITA et coll., 2003) confirmant ainsi les conclusions de l'OMS (OMS, 1990)
qui en a rapporté dans 34 des 88 pays atteints tant en Europe qu'en
Afrique (DESJEUX et coll., 2001).
2.3. Problématique/Hypothèse
Sur les dix (10) dernières années, la
leishmaniose cutanée représente environ 7 consultations
dermatologiques sur 1000 au CNAM avec une moyenne de 54 cas par an (KEITA et
coll., 2003). Ces cas généralement référés
en milieu hospitalier ne permettent cependant pas de déterminer
l'étendue de la distribution de la maladie au Mali. La majorité
des malades ne se présente même pas dans un centre de
santé. Une étude récente estime d'ailleurs la
prévalence dans les villages de Kemena et Sougoula respectivement
à 45,44 % (sur 663 testés) et 19,32% (sur 827 testés)
(GUINDO, 2008) et les taux annuels d'incidence d'exposition au parasite
Leishmania entre 6 à 19%. Les individus de sexe masculin sont
les plus atteints et sont ceux qui, dans ce contexte, s'occupent des travaux
champêtres. Les femmes et même les enfants ne sont pas
épargnés, mettant ainsi toute la population active en danger. La
population la plus atteinte est surtout celle qui a une occupation rurale, donc
ayant un niveau de vie très bas (YIOUGO et coll., 2007).
Ce sombre tableau est aggravé par le manque de
connaissances approfondies sur l'épidémiologie de la maladie
consécutive au nombre réduit d'études qui ont
été faites sur cette pathologie au Mali. La distribution de la
maladie est donc assez mal connue. Ainsi, la cartographie des cas
enregistrés au niveau national (Figure 8) date de 1970 (IMPERATO et
coll., 1970), et la cartographie récente se limite à
l'échelle locale avec des échantillons assez réduits ne
couvrant que des périodes assez courtes allant de 2 à 5 ans
maximum (TALL, 2008 ; SAMAKE, 2006 ; DIARRA, 2008).
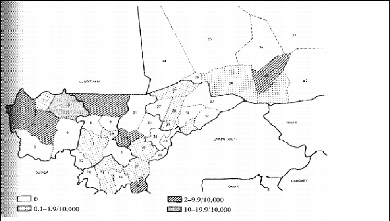
Figure 8: Cartographie des cas de LC entre 1957 et
1966
(Source : IMPERATO et coll., 1970)
Au niveau vectoriel, l'existence des
phlébotomes au Mali est avérée depuis la découverte
de la maladie en 1914 (GUARIN et coll., 1914). Mais, seules quelques captures
de phlébotomes ont été faites à l'échelle
locale (SAMAKE, 2006). La répartition vectorielle est donc, elle aussi,
mal connue à l'échelle nationale. Pourtant, la mise en oeuvre de
stratégies de lutte efficace contre cette maladie passe par une
meilleure connaissance de la répartition géographique de cas
connus, ainsi que des espèces vectorielles responsables de la
maladie.
Ainsi, la leishmaniose est donc un problème de
santé publique dans le monde et au Mali en particulier. Cette
endémie débouche sur une mini-crise humanitaire
négligée qui se vit en silence dans les zones rurales du Mali.
Cette situation épidémiologique précaire soulève
donc quelques interrogations. Quelle serait à ce jour la distribution
nationale des cas de leishmaniose cutanée connus selon des
données existantes au Mali ? Comment a évolué la
répartition de la maladie au Mali depuis sa découverte ?
Existerait-il une concordance entre l'origine des cas signalés et les
zones déjà connues comme abritant les phlébotomes? Quelles
sont les zones climatiques du Mali les plus favorables à la maladie?
Quelle est la saison la plus propice à la maladie au Mali. Nous
tenterons de répondre à toutes ces questions dans la
deuxième partie de notre travail.
DEUXIEME PARTIE: EVOLUTION SPATIALE ET TEMPORELLE DE LA
LEISHMANIOSE CUTANEE AU MALI
Chapitre 1 : Matériel et Méthodes 1.1.
Milieu d'étude
Le site de l'étude a couvert tout le territoire
du Mali. Le climat comprend deux saisons principales : une saison sèche
(Novembre - Avril) et une saison des pluies (Mai - Octobre). Excepté le
désert du Sahara, le pays est entièrement endémique pour
la leishmaniose. La population est estimée selon les Nations Unies en
2003 à environ 13.000.000 d'habitants (ENCYCLOPEDIA OF THE NATIONS,
2005). Le Mali est traversé par deux fleuves principaux (le
Sénégal et le Niger) et compte 4 zones ecoclimatiques distinctes
(Figure 9):
> La zone saharienne : de 200 mm de pluie annuelle
avec 16°C d'amplitude thermique moyenne annuelle ;
> La zone sahélienne : avec 200 à 700 mm
de précipitations annuelles réparties sur
3 mois et une amplitude thermique annuelle moyenne
d'environ de 12°C ;
> La zone nord soudanienne : elle couvre environ 18%
du territoire avec environ 700 à 1300 mm de précipitations
annuelles réparties sur 4 à 5 mois ;
> La zone sud soudanienne: environ 6 % du
territoire national, dans l'extrême sud. Les précipitations
comprises entre 1300 et 1500 mm d'eau par an, s'étendent de Mai à
Octobre avec une amplitude thermique annuelle moyenne (différence entre
le maximum moyen et la température minimum moyenne) de 5 à
6°C.
Signalons au passage l'existence du delta
intérieur du Niger qui est une véritable mer intérieure.
Cette nappe d'inondation est au coeur même du Sahel. Le delta, avec ses
300 km de long sur 100 km de large, joue un rôle de régulation
dans le climat de la région (DIRECTION NATIONALE DE LA STATISTIQUE
(DNS-I), 1998).
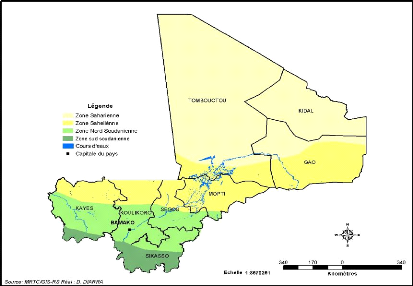
Figure 9: Carte régionale et climatique du
Mali
(Source : MRTC/GIS-RS Réal : DIARRA)
1.2. Matériel
1.2.1. Population étudiée
Nous avons considère comme cas de leishmaniose
cutanée : tout individu enregistré comme souffrant de
leishmaniose par le CNAM ; ceci après examen clinique et ou
identification des corps de Leishman au laboratoire.
1.2.2. Collecte des données
Nous avons procédé à une
étude rétrospective descriptive des dossiers de cas de
leishmaniose cutanée colligés au CNAM à Bamako, entre 1997
et 2008 (soit 12 ans). Ainsi :
> De 1997 à 2001: nous avons utilisé
les résultats de l'étude rétrospective
portant sur 320 dossiers menée par KEITA (KEITA et
coll., 2003);
> De 2002 à 2004: nous avons utilisé
les résultats de la thèse de Médecine de
KEITA portant sur 150 échantillons
analysés au laboratoire du CNAM
(KEITA, 2004);
> De 2005 à 2008 : nous avons utilisé
les résultats issus du registre des consultations cliniques et du
laboratoire du centre.
Pour la période allant de 1957 à 1966
nous avons utilisé les données issues du rapport des cas
cliniques de leishmaniose cutanée par région et district
publié par le Ministère de la Santé et des Affaires
Sociales du Mali.
Concernant l'aspect entomologique, nous avons
également utilisé les résultats des études
publiées et non publiées ou encore en cours sur les
phlébotomes effectuées par l'unité d'Entomologie du
Malaria Research and Training Center (MRTC).
1.2.3. Matériel d'étude
1.2.3.1. Logiciels utilisés pour l'analyse
statistique
Nous avons utilisé les logiciels:
> Microsoft Excel pour la saisie des données et
pour la production des courbes ;
> SPSS pour l'analyse descriptive et la
détermination des fréquences ; > R pour
l'analyse de variance (ANOVA).
1.2.3.2. Matériel de SIG
Nous avons travaillé avec les ordinateurs du
laboratoire GIS / RS de l'unité d'entomologie du MRTC. Grace au logiciel
Arcveiw nous avons pu produire les cartes.
1.3. Méthodes
1.3.1. Analyses statiques et traitement des
données 1.3.1.1. Détermination de l'incidence
L'incidence a été
déterminée sur 12 ans (1997-2008) grâce aux données
du recensement de 1998 (DIRECTION NATIONALE DE LA STATISTIQUE (DNS-II), 1998)
et celle de CIA et du FMI (CIA, 2008). Le taux de croissance annuel a permis
d'estimer la population des régions pour lesquelles nous disposions du
nombre de cas de leishmaniose (1997-2001 et 2005-2008).
1.3.1.2. Analyse spatiale
Nous avons répertorié les villages que
nous avons classé par cercle et par régions pour les
années dont on disposait de données exactes (1997 à 2001
et 2005 à 2008) et suffisantes grâce aux cartes trouvées en
ligne sur Wikipedia (WIKIPEDIA, 2008) et Google Maps (GOOGLE MAPS, 2008). Ces 2
sites en ligne nous ont permis de situer les villages sur les cartes en
confirmant avec le découpage administratif du Mali et l'aide des cartes
disponibles au niveau du laboratoire GIS / RS de l'unité d'entomologie
du MRTC. Enfin, nous avons utilisé le logiciel Arcveiw pour la
production des cartes de distribution des cas de la leishmaniose
cutanée.
Chapitre 2 : Résultats
2.1. Recherche positive des corps de Leishman par
période d'étude
Sur 743 dossiers traités au CNAM en 12 ans, nous
avons obtenu un total de 567 dont la recherche des corps de Leishman a
été positive soit 76% (Tableau 3).
Tableau 3: Résultat de la recherche des corps de
Leishman (1997-2008)
|
Résultats
|
Nombre de cas
|
Pourcentage
|
|
1997-2001
|
2002-2004
|
2005-2008*
|
Total
|
|
Inconnu
|
2
|
0
|
18
|
20
|
3%
|
|
Négatif
|
67
|
24
|
65
|
156
|
21%
|
|
Positif
|
251
|
126
|
190
|
567
|
76%
|
|
Total
|
320
|
150
|
273
|
743
|
100%
|
|
Pourcentage
|
43%
|
20%
|
37%
|
100%
|
|
*Diagnostique clinique positif
2.1.1. Nombre de cas de LC entre 1997 et 2008
Nous avons obtenu un total de 650 cas de LC sur les 12
ans soit une moyenne de 54 cas par an (Tableau 4). Le maximum de cas a
été enregistré en 2006 (86 cas) et le minimum en 2004 (18
cas).
Tableau 4: Répartition des cas de LC par
année entre 1997 et 2008
|
Année
|
Nombre de cas
|
Pourcentage
|
|
1997
|
46
|
7,08%
|
|
1998
|
59
|
9,08%
|
|
1999
|
54
|
8,31%
|
|
2000
|
47
|
7,23%
|
|
2001
|
45
|
6,92%
|
|
2002
|
51
|
7,85%
|
|
2003
|
57
|
8,77%
|
|
2004
|
18
|
2,77%
|
|
2005
|
77
|
11,85%
|
|
2006
|
86
|
13,23%
|
|
2007
|
55
|
8,46%
|
|
2008
|
55
|
8,46%
|
|
Total
|
650
|
100%
|
2.1.2. Cartographie de la LC au Mali entre 1957 et
1966
Les Figures 10 et 13 montrent que la maladie se
concentre à l'Ouest avec un maximum de cas dans la région de
Kayes (413 cas). Aucun cas n'est enregistré dans les régions de
Tombouctou et de Kidal.
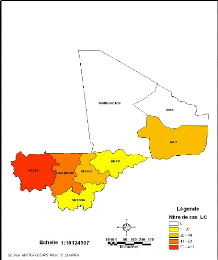
Figure 10:Répartition des cas de LC par
région au Mali de 1957 à 1966
2.1.3. Cartographie de la LC au Mali entre 1997 et
2008
Les résultats révèlent que seule la
région de Kidal située au Nord Est du pays ne présente
aucun cas de LC enregistrée au CNAM (Figure 11).
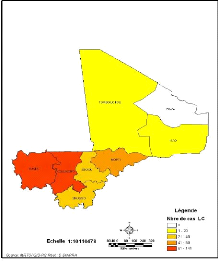
Figure 11: Répartition des cas de LC par
région au Mali de 1997 à 2008
Les régions de Kayes (141 cas) et de Koulikoro
(134 cas) à l'Ouest du pays sont les plus atteintes (Figure
12).
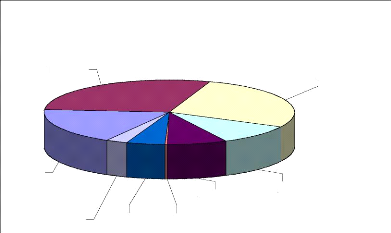
Bamako, 88
Tombouctou, 13 Sikasso, 25 Gao, 2
Kayes, 141
Segou, 38
Mopti, 48
Koulikoro, 134
Figure 12: Répartition des cas de LC par
région au Mali entre 1997 et 2008
Au niveau des cercles (départements), les
résultats montrent une concentration des cas dans le sud du pays. Nous
remarquons aussi une absence de cas dans les zones désertiques. Entre
1957 et 1966 (Figure 13), le cercle le plus atteint est celui de Nioro dans la
région de Kayes (339 cas) ; par contre entre 2005 et 2008 il s'agit du
cercle de Banamaba (32 cas) dans la région de Koulikoro (Figure
14).
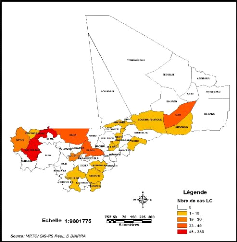
Figure 13: Répartition par Cercles des cas de LC
au Mali de 1957 à 1966
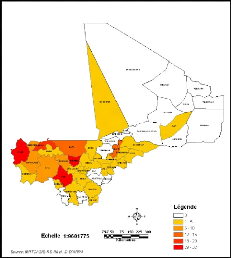
Figure 14: Répartition par Cercles des cas de LC
au Mali de 2005 à 2008
2.1.4. Cas provenant des pays voisins
Nous avons enregistré 8 cas provenant de pays
frontaliers du Mali durant l'année 2008 à savoir la Guinée
(5), le Burkina (1), la Mauritanie (1) et la Gambie (1) (Figures 15 et
16).
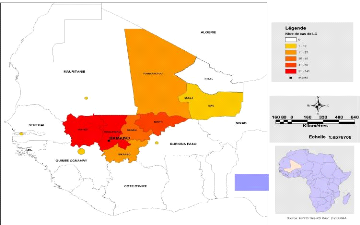
Mali
Figure 15: Cas de LC provenant de pays frontaliers du
Mali a l'échelle régionale
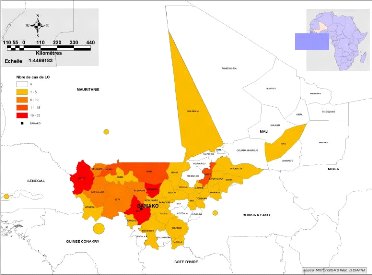
Mali
Figure 16: Cas de LC provenant de pays frontaliers du
Mali a l'échelle des cercles
2.2. Répartition nationale des
phlébotomes
Les études révèlent que les
phlébotomes existent sur toute l'étendue du territoire malien
sauf dans la région de Kidal tout comme le révèle la
répartition des cas de LC rapportées dans notre
étude.
2.2.1. Répartition des phlébotomes par
genre
Les deux principaux genres : Phlebotomus et
Sergentomyia sont présents dans toutes les régions
(Figure 17). Les études rapportent la présence du genre
Sengentomyia dans toutes les régions du Mali (Figure 18). Par
contre le genre Phlebotomus est absent de la région de
Ségou. On constate également que toutes les zones climatiques du
Mali sont propices au développement des phlébotomes (Figure
19).
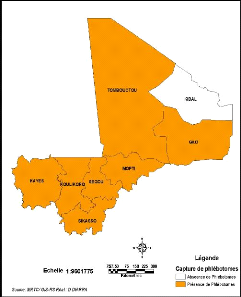
Figure 17: Présence de phlébotomes par
région au Mali
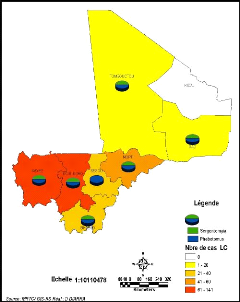
Figure 18: Répartition des cas de LC et
présence de phlébotomes au Mali entre 1997 et 2008
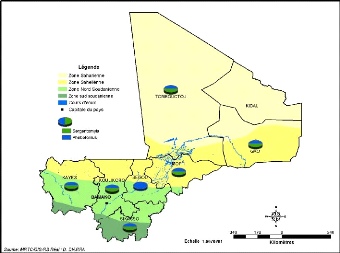
Figure 19: Répartition des genres Phlebotomus
et Sergentomyia en fonction de la zone cimatique
2.2.2. Répartition des espèces du genre
Phlebotomus
Le genre Phlebotomus est présent dans
5 des 8 régions : Mopti, Tombouctou, Koulikoro, Ségou et Sikasso.
Les 3 espèces capturées jusque-là sont
Phlebotomus : P. duboscqi, P. rodhaini, P. sergenti (Figure
20). Au niveau des cercles on constate que les cercles de Baraoueli
(région de Ségou) et Kati (région de Koulikoro)
hébergent à la fois toutes les trois (3) espèces connues
au Mali (Figure 21).
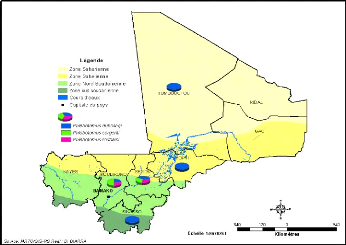
Figure 20: Répartition par région des
espèces de phlébotomes du genre Phlebotomus
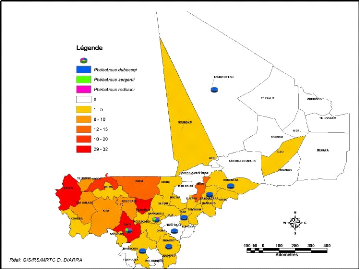
Figure 21: Répartition par cercle des cas de LC
entre 2005 et 2008 et des espèces de phlébotomes du
genre
Phlebotomus
2.3. Répartition des cas de LC par saison et par
zone climatique de 1997 à 2008
La majorité des cas de LC se concentre dans la
zone Nord Soudanienne, soit environ 90% (Figure 22).
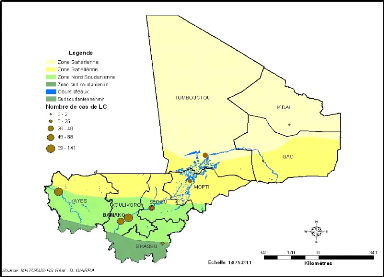
Figure 22: Répartition des cas de LC par la zone
climatique entre 1997 et 2008
2.4. Répartition des cas de LC par saison entre
1997 et 2008
La maladie est présente toute l'année.
Cependant on constate une légère augmentation des cas durant la
saison sèche (371 sur 650 soit 57,08 %) par rapport à la saison
pluvieuse (Tableau 5). Toutefois la différence n'est pas significative
sur le plan statistique.
Tableau 5: Répartition des cas de LC par saison au
Mali entre 1997 et 2008
|
Saison sèche
(Novembre - Avril)
|
Saison des pluies
(Mai - Octobre)
|
Total
|
|
Nombre de cas
|
371
|
279
|
650
|
|
Pourcentage
|
57,08%
|
42,92%
|
100%
|
Les mois d'Octobre et Novembre enregistrent le plus grand
nombre de consultations (57 et 55) et ceux d'Avril et de Juin les plus faibles
(17 et 16)
(Figure 23).
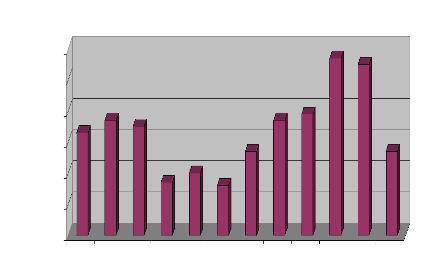
Nombre de cas de LC
50
40
30
20
60
10
0
Janvier Fevrier Mars Avril Mai Juin Juillet Aout Septembre
Octobre Novembre Decembre
Mois
33
37
35
17
20
16
27
39
37
57
55
27
Figure 23: Répartition des cas de LC par
mois
2.5. Evolution de l'incidence annuelle entre 1997 et 2008
2.5.1. Incidence nationale
L'incidence moyenne annuelle est de 4.87 cas pour 1
million d'habitants. L'incidence est plus élevée en 2006 et plus
faible en 2004 (Tableau 6). Cette différence n'est pas significative sur
le plan statistique.
Tableau 6: Evolution de l'incidence annuelle nationale
entre 1997 et 2008
|
Année
|
Population
|
Taux
de croissance
|
Nombre de cas de LC
|
Incidence nationale (1 pour 1 million)
|
|
1997
|
9516584,64
|
3,00%
|
46
|
4,83
|
|
1998
|
9810912
|
2,30%
|
59
|
6,01
|
|
1999
|
10036563
|
2,30%
|
54
|
5,38
|
|
2000
|
10286964
|
2,98%
|
47
|
4,57
|
|
2001
|
10605405,2
|
2,97%
|
45
|
4,24
|
|
2002
|
10932358,2
|
2,97%
|
51
|
4,67
|
|
2003
|
11269170,5
|
2,82%
|
57
|
5,06
|
|
2004
|
11597029,8
|
2,78%
|
18
|
1,55
|
|
2005
|
11929428,5
|
2,74%
|
77
|
6,45
|
|
2006
|
12266216,4
|
2,63%
|
86
|
7,01
|
|
2007
|
12574369
|
2,68%
|
55
|
4,37
|
|
2008
|
12895965,8
|
2,73%
|
55
|
4,26
|
|
Moyenne
|
|
|
54,17
|
4,87
|
2.5.2. Incidence par région
L'incidence la plus forte s'observe à Kayes et
la plus faible à Gao (Tableau 7). La population de Gao étant plus
nombreuse que celle de Kidal, l'incidence de la maladie y est donc moins
élevée malgré les 5 cas enregistres contre 2 à
Kidal.
Tableau 7: Incidence par région entre 1997 et
2008
|
Nombre de cas de LC
|
Incidence par région (1 pour 1
million)
|
|
Kidal
|
2
|
4,64
|
|
Bamako
|
68
|
8,62
|
|
Gao
|
5
|
1,24
|
|
Kayes
|
141
|
10,08
|
|
Koulikoro
|
134
|
8,38
|
|
Mopti
|
48
|
3,19
|
|
Segou
|
38
|
2,23
|
|
Sikasso
|
25
|
1,38
|
|
Tombouctou
|
8
|
1,65
|
Chapitre 3 : Discussion et Recommandations 3.1.
Discussion
3.1.1. Méthodologie
3.1.1.1. Collecte des données
L'étude étant rétrospective, les
données sont loin de refléter la situation exacte, elles ne
donnent qu'un bref aperçu de la répartition de la maladie sur une
période de 22 ans sur la base des données disponibles. Ces
données provenant du CNAM ne correspondent qu'aux cas cliniques
décrits au sein de cette structure hospitalière et ne permettent
donc pas de dégager l'étendue de la maladie dans tout le pays
comme l'avait déjà souligné des études
antérieures (KEITA et coll., 2003 ; KEITA, 2004). Nous ne disposions pas
de données complètes sur toute la période d'étude.
En réalité, nous n'avions les données sur les cercles de
provenance des patients qu'entre 2005 et 2008. Ainsi nous n'avons pas pu
produire la carte de répartition par cercles que durant cette
période (Figure 14, page 19).
Nous avons trouvé une moyenne de 54 cas par an
entre 1997 et 2008 (soit 12 ans). Cette moyenne est assez faible
comparativement aux 1.534 cas trouvés uniquement pour la ville de
Ouagadougou au Burkina, entre 1997 à 2006 (YIOUGO et coll., 2007). Par
ailleurs cette sous-estimation des cas n'est pas propre au Mali seulement. En
réalité, des études menées au Niger et au Cameroun
dénombrent respectivement 64 cas (sur 96) entre 1985 et 1987 (DEVELOUX
et coll., 1987) et 298 (sur 7180) cas entre 1996 et 1997 (DONDJI, 2001). Ceci
est dû au manque de données car la déclaration de la
leishmaniose n'est obligatoire que dans 33 pays du monde (OMS,
2006).
Selon L'OMS, seulement un tiers des malades sont
déclarés (OMS, 2006), ainsi une bonne partie des malades n'est
pas pris en compte dans nos données. Au même rang se trouvent
également ceux qui sont l'objet de guérisons spontanées
qui ont été rapportées au Mali (SAMAKE, 2006). En Afrique
en général, ce problème est plus accru du fait que la
majorité des malades fréquentent les tradipraticiens ou se
livrent à l'automédication et ne sont donc pas pris en compte
dans les statistiques officielles (TRAORE, 2000 ; YIOUGO et coll., 2007).
Ainsi, selon une Enquête Démographique de Santé
menée au Mali en 2006 (EDSM, 2006), 67% des malades ont recours à
l'automédication ou à la recherche des conseils hors des
formations sanitaires. En milieu rural, ce taux avoisine 70%.
3.1.1.2. Méthode diagnostique
Le diagnostic microscopique par la recherche des corps
de Leishman est pour nous une limite à la fiabilité des
résultats. En effet, 173 dossiers sur 743 (soit 24%) ont
été exclus faute de résultats des analyses ou pour
résultats négatifs. Des études similaires ont
montré que la PCR donnait de meilleurs résultats en
Algérie où on a pu passer de 48% de positif à la
microscopie à 81% en PCR (MIHOUBI et coll., 2006). De plus, la recherche
au microscope des corps de Leishman n'est devenue systématique
après le diagnostic clinique au CNAM qu'à partir de 2005, ce qui
explique la bonne qualité de données entre 2005 et 2008 du fait
de l'existence d'un registre.
3.1.1.3. Méthode de cartographie
Les malades enregistrés au CNAM proviennent de
toutes les régions du Mali, ce qui confirme que le pays soit
endémique de la maladie. La distance entre les zones rurales et Bamako
où se trouve le seul centre de référence pour le
diagnostic et la prise en charge, contribue très probablement à
la sous-estimation de l'incidence de la maladie au Mali. Les malades parcourent
en moyenne 620 km en considérant juste les capitales des régions.
Par ailleurs, 30 villages n'ont pas pu être classés à cause
d'une impossibilité de les retrouver sur la carte. Il arrive souvent que
plusieurs villages portent le même nom. En plus, la
non-numérisation du registre du CNAM a rendu la lecture et
l'identification de ces villages impossibles.
3.1.2. Résultats
Nous avons remarqué que nos résultats
sous-estiment l'incidence de la maladie pour plusieurs raisons.
3.1.2.1. Répartition des cas par
année
L'année 2004 est celle qui a enregistré
le plus petit nombre de cas (18 cas, Tableau 4, page 14). Ceci s'explique par
le fait que les données dont nous disposions s'arrêtent au mois
d'Octobre. Ce cas reflète encore l'absence et la mauvaise organisation
dans la récolte des données dont souffre le Mali sur cette
pathologie.
Entre 2005 et 2008 nous avons enregistré 8 cas
provenant de pays frontaliers du Mali (Guinée: 5, Burkina: 1,
Mauritanie: 1 et Gambie: 1). Ceci confirme que la maladie est endémique
dans la sous-région car les cercles frontaliers de ces pays comptent
tous, des cas de LC (Figures 15 et 16, pages 17 et 18). Ceci traduit l'absence
de structures sanitaires adéquates pour les prises en charge des malades
dans la sous-région.
3.1.2.2. Répartition des cas par
région
Pour la période de 1997 à 2008,
l'étude révèle que les régions de Kayes (141 cas)
et Koulikoro (134 cas) sont les plus atteintes, et que les cercles les plus
atteints sont : Banamba (32), Kayes (31) et Kati (32). La région de
Kayes se confirme donc comme la plus atteinte (KEITA et coll., 2003). La
maladie semble s'étendre à tout le pays comme l'a signalé
TALL (2008). Aucune explication logique à ce phénomène ne
peut être donnée avec le niveau actuel des connaissances et les
données disponibles sur la maladie au Mali.
Nous avons également remarqué un fort
pourcentage de cas provenant de Bamako (17,71%). Nous pensons que ce
pourcentage est plus bas en réalité, bien qu'étant
située dans la zone Sud soudanienne qui est la plus atteinte. En effet
les patients arrivant au CNAM donnent souvent leur lieu de résidence
temporaire à Bamako comme leur provenance (TALL, 2008). En
réalité, ils ont été contaminés par le
parasite dans leurs villages d'origine avant d'arriver à
Bamako.
3.1.2.3. Répartition des cas par zone
climatique
On rencontre les phlébotomes beaucoup plus dans
les zones rurales ou les aires boisées des villes (LIGHTBURN, 2002;
SCALIBOR, 2008). Ainsi est il donc normal que nous observions une concentration
des cas de LC dans les zones nord et sud soudanienne qui renferment à la
fois les régions de Kayes, Koulikoro et Ségou.
3.1.2.4. Répartition des cas par
saison
Sachant que la saison classique des phlébotomes
s'étend d'Avril/Mai à Septembre/Octobre (SCALIBOR, 2008), nous
concluons que les fortes contaminations se font en Avril/Mai et
Septembre/Octobre. Le temps d'incubation dure trois mois, ainsi les
premières lésions apparaissent environ trois (3) mois
après les piqûres contaminantes. D'autre part, une étude
menée au CNAM révèle que les malades se font consulter
trois mois après le début des premières lésions
(TALL, 2008 ; SAMAKE, 2006). En réalité, les trois mois mis pour
venir en consultation sont liés à la durée
nécessaire pour réunir les moyens financiers pour le
déplacement à Bamako et les frais médicaux.
L'Enquête Démographique de Santé du Mali de 2006 (EDSM,
2006) révèle en effet qu'environ 59% des maliens couvrent leur
frais médicaux à partir de leurs disponibilités
financières, 8% le font avec des dettes. Par ailleurs, 64 % des maliens
vivent en dessous du seuil de la pauvreté et ont donc du mal à
couvrir les frais médicaux. Ainsi, les pics observées en
Octobre/Novembre traduisent les fortes contaminations qui ont eu lieu en
Avril/Mai et ceux de Mars/Avril, les fortes contaminations de Septembre/Octobre
toutes les deux due à la prolifération des phlébotomes. Il
s'écoule donc 6 mois entre la contamination et la consultation des
patients au CNAM. Nous concluons donc que la saison des pluies est celle qui
concentre les plus fortes contaminations et non la saison sèche comme le
montre les données. Toutefois, la maladie sévit toute
l'année et les deux saisons sont propices à la maladie. La
différence entre ces deux périodes de forte consultation se
justifie par le fait que les travaux champêtres se terminent en
Septembre, et donc les populations peuvent plus facilement faire le
déplacement pour Bamako. Notre étude révèle que les
mois d'Octobre et de Novembre sont ceux oil le plus grand nombre de cas sont
signalés. Ces résultats sont assez proches de ceux de YIOUGO (et
coll., 2007) qui trouve des pics de contamination aux mois de Février et
d'Octobre.
3.2. Recommandations
Sur la base des résultats obtenus dans cette
étude, nous recommandons : 3.2.1. Au Ministère de la Santé
Publique du Mali> L'élaboration d'un système
d'épidémiosurveillance ;
> La création d'une base de données
nationale et numérisée commune entre les cliniques et les
hôpitaux régionaux et ruraux pour la centralisation des
informations et l'analyse de ces données afin d'établir la carte
des foyers d'infection et de calculer l'impact réel de la LC grâce
à des études exactes de la prévalence et de
l'incidence;
> L'actualisation régulière de la
distribution de la LC au Mali;
> Le renforcement des capacités sur la LC pour
les agents de santé des zones
rurales les plus atteintes (Kayes et Koulikoro) pour
servir de sentinelles ; > La sensibilisation des
populations sur les moyens de prévention de la LC.
3.2.2. Aux chercheurs
> La réalisation d'une étude pour
déterminer l'impact socio-économique de la LC au
Mali;
> Des recherches poussées en vue de
déterminer le réservoir de l'agent de la maladie.
CONCLUSION
La présente étude confirme la situation
d'endémie de la leishmaniose cutanée sur toute l'étendue
du territoire du Mali exception faite de la zone désertique. L'incidence
nationale est de 5 cas pour 1 million d'habitants entre 1997 et 2008 selon
notre étude. Les deux (2) régions les plus atteintes sont Kayes
et Koulikoro avec plus de 55% des cas enregistrés ; et les cercles les
plus atteints sont : Banamba (32), Kati (32) et Kayes (31). La maladie semble
se déplacer vers le centre du pays depuis une dizaine d'années.
La maladie est présente en saisons sèche et pluvieuse, la
période du mois d'Avril à Septembre est celle des plus fortes
contaminations. La zone climatique la plus atteinte est la zone Nord
soudanienne. Les régions où les phlébotomes ont
déjà été identifiés sont effectivement
endémiques de la maladie.
Le nombre de cas de leishmanioses qui ne sont ni
signalés, ni diagnostiqués est élevé et les
statistiques officielles ne permettent pas de connaître le nombre
réel de malades et donc l'incidence réelle de la maladie dans le
pays. Les données disponibles sur la prévalence et l'incidence
pour évaluer pleinement l'impact de la leishmaniose ne sont pas
complètes. Il n'existe pas en réalité de données
objectives. Nous constatons que la maladie se transmet dans des zones rurales
reculées ; beaucoup de cas ne sont pas diagnostiqués parce que
les malades ne sont pas soignés. On ne peut donc qu'estimer la
prévalence et l'incidence réelles vu qu'aucune étude
prospective de grande ampleur n'a jamais été effectuée et
que la situation globale n'a toujours pas été établie
à partir des données fragmentaires existantes. Pourtant, la mise
en oeuvre de stratégies de lutte efficace contre cette maladie passe par
une meilleure connaissance de la répartition géographique de cas
connus, ainsi que des espèces vectorielles responsables de la maladie.
La leishmaniose demeure donc un important problème de santé
publique qui est cependant très négligé.
BIBLIOGRAPHIE ET WEBOGRAPHIE
Bibliographie
1. ABONNEC E., et PASTER J.P., 1970. Phlébotomes
de la Haute- Volta (Wiptem, Pkycbodidm) Notes biologiques. Cah. ORSTOM.,
Sér. Enf. Med. Parasitol.; VIII : 32-37
2. BALDET T., 2004. Biologie et contrôle des
maladies vectorielles émergentes, - Montpelier :
CIRAD/EMVT.-30p.
3. DEDET J.P., 2001. Leishmanioses, Biologie, chimique
et thérapeutique. Encycl. Med. Chir.; Maladies infectieuses,
8-506-A-10 : 11
4. DESJEUX P.B., PIOT K., et O'NEILL J-P., 2001.
Co-infections a leishmania/vih dans le sud de l'Europe, revue
générale, Med. Trop.; 61 : 187-193
5. DEVELOUX M., BLANC L., GARBA S., MAMOUDOU H.,
RAVISSE P., et CENAC A., 1987. Etude clinique et épidémiologique
de la Leishmaniose au Niger. Cahiers Santé ; 1 :
130-134
6. DIARRA S.S., 2008. Etude de l'incidence de la
Leishmaniose cutanée et les facteurs de risque d'exposition parasitaire
en zone d'endémie de Barouéli (Kémena et Sougoula)
Région de Ségou (Mali). Thèse : Médecine :
Université de Bamako
7. DONDJI B., 2001. Leishmanioses et
phlébotomes du Cameroun : le point sur les données actuelles.
Ent. Méd. ; Yaoundé : Laboratoire de parasitologie,
Faculté de médecine et des sciences biomédicales,
Université de Yaoundé I. 94 : 277-279
8. GUARIN P., PEYROMOND D., PIENS M.A., RIOUX J.P.,
GODEREY D.G., LANOTE G., et PORATLENG F., 1914. Présence de
Leishmania major au Mali, Identification enzymatique d'une souche
d'origine humaine, Ann. Parasitol. Hum. Comp. :
60-91
9. GUINDO B., 2008. Système d'information
géographique pour la cartographie du risque de la leishmaniose
cutanée. Mémoire : master : Système d'information
géographique : Université de Bamako
10. HAUSMANN K., et ÜLSMANN N., 1996. Protozoology,
New York : Thieme MedicalPublishers, Inc. 30 : 365-371
11. IMPERATO Pj., COULIBALY B., et TOGOLA T., 1970.
Leishmanin skin sensitivity in Northwestern Mali. In: Annual Report of the
National Communicable Disease Center, U.S.P.H.S. : 260-265
12. IMPERATO Pj., et DIAKITE S., 1969. Leishmaniasis in
the Republic of Mali. Trans. R. Soc. Trop. Med. Hyg.; 63 :
236-241
13. IZRI M.A., et DOUMBO O., 1989. Présence de
leishmania major. Mon-26 au Mali. Ann. Parasitol. Hum. Comp.;
61 : 510-511
14. KEITA F., 2004. La leishmaniose cutanée
chez les patients reçus à l'unité biologie du CNAM de
janvier 2002 à octobre 2004. Thèse : Pharmacie :
Université de Bamako; th-p06
15. KEITA S., FAYE O., NDIAYE H.T, et KONARE H.D.,
2003. Épidémiologie et polymorphisme clinique de la leishmaniose
cutanée observée, au CNAM (ex-institut MARCHOUX) Bamako (Mali),
2003. Mali Méd.; XVIII (1-229) : 1
16. LEFROU G., 1948. La leishmaniose cutanée au
Soudan français, Fréquence de la forme sèche
Paulo-tuberculeuse. Bull. Soc. Path. Exot.; 41 : 622-627
17. LIGHTBURN E., 2002. Surveillance
épidémiologique des leishmanioses tégumentaires en Guyane
- Synthèse de données militaires sur 10 ans. Méd.
Trop.; 62 : 545-553
18. MALI. MINISTRE DU PLAN, DE L`AMENAGEMENT DU
TERRITOIRE. DIRECTION NATIONALE DE LA STATISTIQUE (DNS-I), 1998. Recensement
Général de la Population et de l'Habitat, tome I. - Bamako : DNSI
: 180-250
19. MALI. MINISTRE DE LA SANTE. ENQUETE DEMOGRAPHIQUE
DE SANTE AU MALI, 2006. Enquête Démographique de Santé du
Mali, tome IV. -Bamako : EDSM : 80-120
20. MAZALET L., 2004. La leishmaniose canine dans le
bassin méditerranéen français. - Paris : Université
Pierre Marie Curie - Paris VI. -9p.
21. MIHOUBI I., DE MONBRISON F., ROMEUF N., MOULAHEM
T., et PICOT S., 2006. Diagnostic délocalisé par PCR temps
réel de la leishmaniose cutanée sévissant dans le foyer de
Constantine (Algérie). Med. Trop.; 66 : 39-44
22. NDIAYE B., 1983. Une maladie fréquente au
Sénégal : la leishmaniose cutanée. Dakar Méd.
; 28 (4) : 725-734
23. OMS, 1990. Maladies tropicales, Progrès de la
recherche 1989-1990 : deuxième rapport du programme TDR. -Genève
: OMS : 79-87
24. OMS, 1999. La lutte anti-vectorielle,
méthodes à usage individuel et communautaire sous la direction de
J. A. Rozendaal. -Genève : OMS : 79-87
25. OMS, 2006. Lutte contre la leishmaniose. Rapport du
secrétariat conseil exécutif cent dixhuitième session.
-Geneve : OMS : 118 (4) : 1-7
26. OMS, 2007. Lutte contre la leishmaniose. Rapport du
secrétariat, soixantième assemblée mondiale de la
santé. -Genève : OMS : 1-5
27. OUMEISH O.Y., 1999. Cutaneous leishmaniasis : a
historical perspective, Clin. Dermatol.; 17 : 249-254
28. PAMPIGLIONE, S., MANSON-BAHR, P.E.C., LA PLACA,
BORGATTI M.A., et MUSUMECI S., 1975. The leishmanin skin test in Kalaazar,
Transactions of the Royal Society of Tropical Medicine and Hygiene in
Mediterranean leishmaniasis. Med. Trop.; 3 (18) : 60-69
29. PIN-DIOP R., MARTY P., DELAUNAY P., et LANCELOT
R., 2008. Environnement et leishmaniose canine dans les Alpes-Maritimes.
-Montpellier : Laboratoire Vétérinaire Départemental des
Alpes-Maritimes. -3p.
30. PRADINAUD R., et STROBEL M., 1987. La Leishmaniose
tégumentaire. Le concours Médical ; 21 (3) :
979-983
31. ROBERTS L.S., JANOVY J.J., GERALD D., SCHMIDT S., et
LARRY, 2000. Roberts' Foundations of Parasitology.-Boston: Mc Graw-Hill Higher
Education. 6: -670 p.
32. SAMAKE S., 2006. Etude entomo-clinique de la
leishmaniose cutanée dans trois villages du cercle de Barouéli
(Mali). Thèse : Pharmacie : Université de Bamako :
th-p-06
33. SANGARE C.S., 1974. Systématique et
écologie d'une population de phlébotomes (Diptera
-psychodidae) vivant dans des biotopes à Damans de rocher
(Procavia refipès, mammifères hyracoïdes) sur le
flanc de la colline du point G, Bamako (Mali). Thèse : troisième
cycle : biologie : Université de Bamako
34. SANKALE M., LEVIGUELLOUX J., RIVOAL, et LA PALCE
Mj., 1958. Les zoonoses dans la pathologie du Soudan Français.
Bulletin of the Exotic Pathology Society ; 203 (9) : 51
35. SISSOKO I., 2008. Etude du rôle de P.
duboscqi dans la transmission de la leishmaniose cutanée au Mali.
Mémoire : master : Entomologie Médicale et
Vétérinaire : Université de Bamako
36. TALL K., 2008. Etude Epidemio-clinique et prise
en charge de la leishmaniose cutanée à Bamako et dans les
villages endémiques du Mali. Thèse : Médecine :
Université de Bamako
37. TRAORE K.S., 2000. Etude de la leishmaniose
cutanée dans les formations sanitaires de la ville de Ouagadougou de
1996 à 1998. Thèse : Médecine : Université de
Ouagadougou
38. YIOUGO L., SANON T., et OUEDRAOGO S., 2007.
Facteurs de recrudescence de la leishmaniose cutanée et ses
conséquences socio économiques et sanitaires dans le secteur 30
de la ville d'Ouagadougou. In : Rapport de recherche annuel. -Ouagadougou :
Ministère de la Santé -ISBA/CRDI. -103p.
Webographie
39. AUBRY, P., 2006. Leishmanioses Actualité
[en ligne] accès internet :
http://medecinetropicale.free.fr/cours/leishmanioses.htm
(page consultée le 1er Février 2009)
40. CENTERS FOR DISEASE CONTROL AND PREVENTION (CDC),
2009. Cycle parasitaire de Leishmaniose [en ligne] accès internet:
http://www.dpd.cdc.gov/dpdx/
(page consultée le 12 Février 2009)
41. CENTRAL INTELLIGENCE AGENCY (CIA), 2008. The
World Fact Book: field listing-population [en ligne] accès internet:
https://www.cia.gov/library/publications/theworld-factbook/fields/2119.html
(page consultée le 31 Janvier 2009)
42. DENGUEZLI, M., 2006. Leishmaniose cutanée [en
ligne] accès internet :
http://www.atlasdermato.org/atlas/leishmfin
(page consultée le 20 Décembre 2008)
43. DIRECTION NATIONALE DE LA STATISTIQUE (DNS-II),
1998. Géographie du Mali [en ligne] accès internet:
http://www.dnsi.gov.ml/Infogen/Geographie/
Geographie.htm
(page consultée le 3 Mars 2009)
44. ENCYCLOPEDIA OF THE NATIONS, 2005. Mali
Population [en ligne] accès internet :
http://www.nationsencyclopedia.com/Africa/Mali-POPULATION.html
(page consultée le 10 Janvier 2009)
45. GOOGLE MAPS, 2008. [en ligne] accès internet
:
http://maps.google.com
(page consultée le 08 Février 2009)
46. SCALIBOR, 2008. [en ligne] accès internet :
http://www.scalibor.fr/publicleishmaniose/phlebotome.asp
(page consultée le 20 Janvier 2009)
47. WIKIPEDIA, 2008. [en ligne] accès internet :
http://fr.wikipedia.org/wiki/Mali
(page consultée le 20 Janvier 2009)
| 


