Chapitre 2 : Résultats
2.1. Recherche positive des corps de Leishman par
période d'étude
Sur 743 dossiers traités au CNAM en 12 ans, nous
avons obtenu un total de 567 dont la recherche des corps de Leishman a
été positive soit 76% (Tableau 3).
Tableau 3: Résultat de la recherche des corps de
Leishman (1997-2008)
|
Résultats
|
Nombre de cas
|
Pourcentage
|
|
1997-2001
|
2002-2004
|
2005-2008*
|
Total
|
|
Inconnu
|
2
|
0
|
18
|
20
|
3%
|
|
Négatif
|
67
|
24
|
65
|
156
|
21%
|
|
Positif
|
251
|
126
|
190
|
567
|
76%
|
|
Total
|
320
|
150
|
273
|
743
|
100%
|
|
Pourcentage
|
43%
|
20%
|
37%
|
100%
|
|
*Diagnostique clinique positif
2.1.1. Nombre de cas de LC entre 1997 et 2008
Nous avons obtenu un total de 650 cas de LC sur les 12
ans soit une moyenne de 54 cas par an (Tableau 4). Le maximum de cas a
été enregistré en 2006 (86 cas) et le minimum en 2004 (18
cas).
Tableau 4: Répartition des cas de LC par
année entre 1997 et 2008
|
Année
|
Nombre de cas
|
Pourcentage
|
|
1997
|
46
|
7,08%
|
|
1998
|
59
|
9,08%
|
|
1999
|
54
|
8,31%
|
|
2000
|
47
|
7,23%
|
|
2001
|
45
|
6,92%
|
|
2002
|
51
|
7,85%
|
|
2003
|
57
|
8,77%
|
|
2004
|
18
|
2,77%
|
|
2005
|
77
|
11,85%
|
|
2006
|
86
|
13,23%
|
|
2007
|
55
|
8,46%
|
|
2008
|
55
|
8,46%
|
|
Total
|
650
|
100%
|
2.1.2. Cartographie de la LC au Mali entre 1957 et
1966
Les Figures 10 et 13 montrent que la maladie se
concentre à l'Ouest avec un maximum de cas dans la région de
Kayes (413 cas). Aucun cas n'est enregistré dans les régions de
Tombouctou et de Kidal.
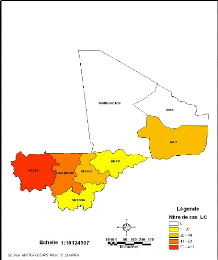
Figure 10:Répartition des cas de LC par
région au Mali de 1957 à 1966
2.1.3. Cartographie de la LC au Mali entre 1997 et
2008
Les résultats révèlent que seule la
région de Kidal située au Nord Est du pays ne présente
aucun cas de LC enregistrée au CNAM (Figure 11).
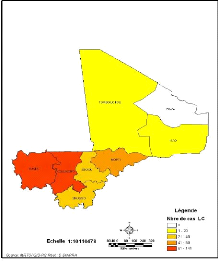
Figure 11: Répartition des cas de LC par
région au Mali de 1997 à 2008
Les régions de Kayes (141 cas) et de Koulikoro
(134 cas) à l'Ouest du pays sont les plus atteintes (Figure
12).
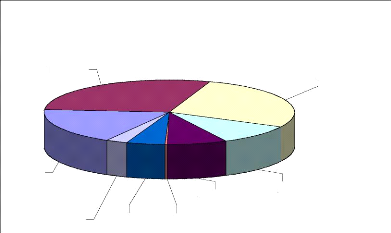
Bamako, 88
Tombouctou, 13 Sikasso, 25 Gao, 2
Kayes, 141
Segou, 38
Mopti, 48
Koulikoro, 134
Figure 12: Répartition des cas de LC par
région au Mali entre 1997 et 2008
Au niveau des cercles (départements), les
résultats montrent une concentration des cas dans le sud du pays. Nous
remarquons aussi une absence de cas dans les zones désertiques. Entre
1957 et 1966 (Figure 13), le cercle le plus atteint est celui de Nioro dans la
région de Kayes (339 cas) ; par contre entre 2005 et 2008 il s'agit du
cercle de Banamaba (32 cas) dans la région de Koulikoro (Figure
14).
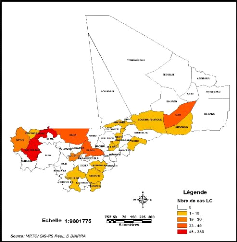
Figure 13: Répartition par Cercles des cas de LC
au Mali de 1957 à 1966
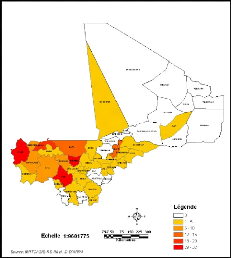
Figure 14: Répartition par Cercles des cas de LC
au Mali de 2005 à 2008
2.1.4. Cas provenant des pays voisins
Nous avons enregistré 8 cas provenant de pays
frontaliers du Mali durant l'année 2008 à savoir la Guinée
(5), le Burkina (1), la Mauritanie (1) et la Gambie (1) (Figures 15 et
16).
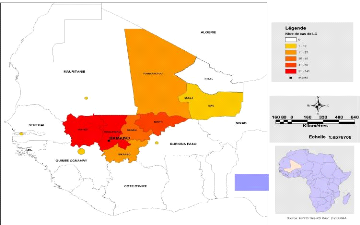
Mali
Figure 15: Cas de LC provenant de pays frontaliers du
Mali a l'échelle régionale
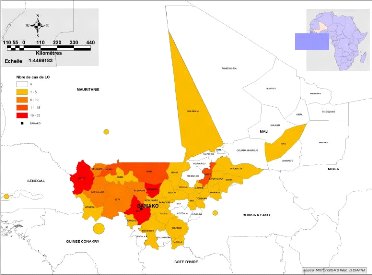
Mali
Figure 16: Cas de LC provenant de pays frontaliers du
Mali a l'échelle des cercles
2.2. Répartition nationale des
phlébotomes
Les études révèlent que les
phlébotomes existent sur toute l'étendue du territoire malien
sauf dans la région de Kidal tout comme le révèle la
répartition des cas de LC rapportées dans notre
étude.
2.2.1. Répartition des phlébotomes par
genre
Les deux principaux genres : Phlebotomus et
Sergentomyia sont présents dans toutes les régions
(Figure 17). Les études rapportent la présence du genre
Sengentomyia dans toutes les régions du Mali (Figure 18). Par
contre le genre Phlebotomus est absent de la région de
Ségou. On constate également que toutes les zones climatiques du
Mali sont propices au développement des phlébotomes (Figure
19).
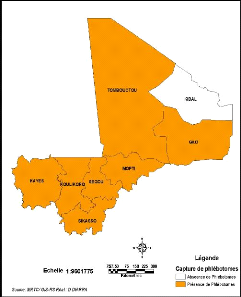
Figure 17: Présence de phlébotomes par
région au Mali
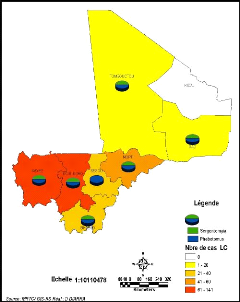
Figure 18: Répartition des cas de LC et
présence de phlébotomes au Mali entre 1997 et 2008
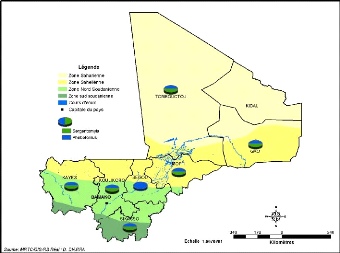
Figure 19: Répartition des genres Phlebotomus
et Sergentomyia en fonction de la zone cimatique
2.2.2. Répartition des espèces du genre
Phlebotomus
Le genre Phlebotomus est présent dans
5 des 8 régions : Mopti, Tombouctou, Koulikoro, Ségou et Sikasso.
Les 3 espèces capturées jusque-là sont
Phlebotomus : P. duboscqi, P. rodhaini, P. sergenti (Figure
20). Au niveau des cercles on constate que les cercles de Baraoueli
(région de Ségou) et Kati (région de Koulikoro)
hébergent à la fois toutes les trois (3) espèces connues
au Mali (Figure 21).
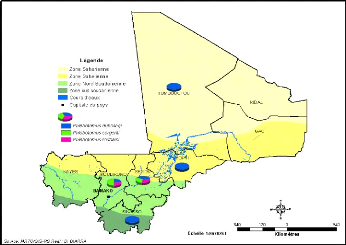
Figure 20: Répartition par région des
espèces de phlébotomes du genre Phlebotomus
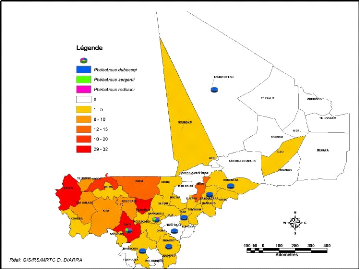
Figure 21: Répartition par cercle des cas de LC
entre 2005 et 2008 et des espèces de phlébotomes du
genre
Phlebotomus
2.3. Répartition des cas de LC par saison et par
zone climatique de 1997 à 2008
La majorité des cas de LC se concentre dans la
zone Nord Soudanienne, soit environ 90% (Figure 22).
Figure 22: Répartition des cas de LC par la zone
climatique entre 1997 et 2008
2.4. Répartition des cas de LC par saison entre
1997 et 2008
La maladie est présente toute l'année.
Cependant on constate une légère augmentation des cas durant la
saison sèche (371 sur 650 soit 57,08 %) par rapport à la saison
pluvieuse (Tableau 5). Toutefois la différence n'est pas significative
sur le plan statistique.
Tableau 5: Répartition des cas de LC par saison au
Mali entre 1997 et 2008
|
Saison sèche
(Novembre - Avril)
|
Saison des pluies
(Mai - Octobre)
|
Total
|
|
Nombre de cas
|
371
|
279
|
650
|
|
Pourcentage
|
57,08%
|
42,92%
|
100%
|
Les mois d'Octobre et Novembre enregistrent le plus grand
nombre de consultations (57 et 55) et ceux d'Avril et de Juin les plus faibles
(17 et 16)
(Figure 23).
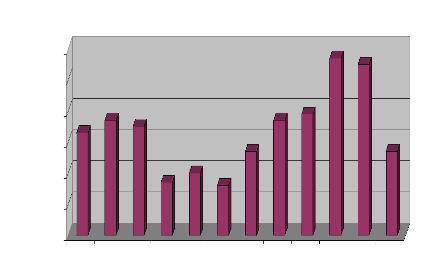
Nombre de cas de LC
50
40
30
20
60
10
0
Janvier Fevrier Mars Avril Mai Juin Juillet Aout Septembre
Octobre Novembre Decembre
Mois
33
37
35
17
20
16
27
39
37
57
55
27
Figure 23: Répartition des cas de LC par
mois
2.5. Evolution de l'incidence annuelle entre 1997 et 2008
2.5.1. Incidence nationale
L'incidence moyenne annuelle est de 4.87 cas pour 1
million d'habitants. L'incidence est plus élevée en 2006 et plus
faible en 2004 (Tableau 6). Cette différence n'est pas significative sur
le plan statistique.
Tableau 6: Evolution de l'incidence annuelle nationale
entre 1997 et 2008
|
Année
|
Population
|
Taux
de croissance
|
Nombre de cas de LC
|
Incidence nationale (1 pour 1 million)
|
|
1997
|
9516584,64
|
3,00%
|
46
|
4,83
|
|
1998
|
9810912
|
2,30%
|
59
|
6,01
|
|
1999
|
10036563
|
2,30%
|
54
|
5,38
|
|
2000
|
10286964
|
2,98%
|
47
|
4,57
|
|
2001
|
10605405,2
|
2,97%
|
45
|
4,24
|
|
2002
|
10932358,2
|
2,97%
|
51
|
4,67
|
|
2003
|
11269170,5
|
2,82%
|
57
|
5,06
|
|
2004
|
11597029,8
|
2,78%
|
18
|
1,55
|
|
2005
|
11929428,5
|
2,74%
|
77
|
6,45
|
|
2006
|
12266216,4
|
2,63%
|
86
|
7,01
|
|
2007
|
12574369
|
2,68%
|
55
|
4,37
|
|
2008
|
12895965,8
|
2,73%
|
55
|
4,26
|
|
Moyenne
|
|
|
54,17
|
4,87
|
2.5.2. Incidence par région
L'incidence la plus forte s'observe à Kayes et
la plus faible à Gao (Tableau 7). La population de Gao étant plus
nombreuse que celle de Kidal, l'incidence de la maladie y est donc moins
élevée malgré les 5 cas enregistres contre 2 à
Kidal.
Tableau 7: Incidence par région entre 1997 et
2008
|
Nombre de cas de LC
|
Incidence par région (1 pour 1
million)
|
|
Kidal
|
2
|
4,64
|
|
Bamako
|
68
|
8,62
|
|
Gao
|
5
|
1,24
|
|
Kayes
|
141
|
10,08
|
|
Koulikoro
|
134
|
8,38
|
|
Mopti
|
48
|
3,19
|
|
Segou
|
38
|
2,23
|
|
Sikasso
|
25
|
1,38
|
|
Tombouctou
|
8
|
1,65
|
Chapitre 3 : Discussion et Recommandations 3.1.
Discussion
3.1.1. Méthodologie
3.1.1.1. Collecte des données
L'étude étant rétrospective, les
données sont loin de refléter la situation exacte, elles ne
donnent qu'un bref aperçu de la répartition de la maladie sur une
période de 22 ans sur la base des données disponibles. Ces
données provenant du CNAM ne correspondent qu'aux cas cliniques
décrits au sein de cette structure hospitalière et ne permettent
donc pas de dégager l'étendue de la maladie dans tout le pays
comme l'avait déjà souligné des études
antérieures (KEITA et coll., 2003 ; KEITA, 2004). Nous ne disposions pas
de données complètes sur toute la période d'étude.
En réalité, nous n'avions les données sur les cercles de
provenance des patients qu'entre 2005 et 2008. Ainsi nous n'avons pas pu
produire la carte de répartition par cercles que durant cette
période (Figure 14, page 19).
Nous avons trouvé une moyenne de 54 cas par an
entre 1997 et 2008 (soit 12 ans). Cette moyenne est assez faible
comparativement aux 1.534 cas trouvés uniquement pour la ville de
Ouagadougou au Burkina, entre 1997 à 2006 (YIOUGO et coll., 2007). Par
ailleurs cette sous-estimation des cas n'est pas propre au Mali seulement. En
réalité, des études menées au Niger et au Cameroun
dénombrent respectivement 64 cas (sur 96) entre 1985 et 1987 (DEVELOUX
et coll., 1987) et 298 (sur 7180) cas entre 1996 et 1997 (DONDJI, 2001). Ceci
est dû au manque de données car la déclaration de la
leishmaniose n'est obligatoire que dans 33 pays du monde (OMS,
2006).
Selon L'OMS, seulement un tiers des malades sont
déclarés (OMS, 2006), ainsi une bonne partie des malades n'est
pas pris en compte dans nos données. Au même rang se trouvent
également ceux qui sont l'objet de guérisons spontanées
qui ont été rapportées au Mali (SAMAKE, 2006). En Afrique
en général, ce problème est plus accru du fait que la
majorité des malades fréquentent les tradipraticiens ou se
livrent à l'automédication et ne sont donc pas pris en compte
dans les statistiques officielles (TRAORE, 2000 ; YIOUGO et coll., 2007).
Ainsi, selon une Enquête Démographique de Santé
menée au Mali en 2006 (EDSM, 2006), 67% des malades ont recours à
l'automédication ou à la recherche des conseils hors des
formations sanitaires. En milieu rural, ce taux avoisine 70%.
3.1.1.2. Méthode diagnostique
Le diagnostic microscopique par la recherche des corps
de Leishman est pour nous une limite à la fiabilité des
résultats. En effet, 173 dossiers sur 743 (soit 24%) ont
été exclus faute de résultats des analyses ou pour
résultats négatifs. Des études similaires ont
montré que la PCR donnait de meilleurs résultats en
Algérie où on a pu passer de 48% de positif à la
microscopie à 81% en PCR (MIHOUBI et coll., 2006). De plus, la recherche
au microscope des corps de Leishman n'est devenue systématique
après le diagnostic clinique au CNAM qu'à partir de 2005, ce qui
explique la bonne qualité de données entre 2005 et 2008 du fait
de l'existence d'un registre.
3.1.1.3. Méthode de cartographie
Les malades enregistrés au CNAM proviennent de
toutes les régions du Mali, ce qui confirme que le pays soit
endémique de la maladie. La distance entre les zones rurales et Bamako
où se trouve le seul centre de référence pour le
diagnostic et la prise en charge, contribue très probablement à
la sous-estimation de l'incidence de la maladie au Mali. Les malades parcourent
en moyenne 620 km en considérant juste les capitales des régions.
Par ailleurs, 30 villages n'ont pas pu être classés à cause
d'une impossibilité de les retrouver sur la carte. Il arrive souvent que
plusieurs villages portent le même nom. En plus, la
non-numérisation du registre du CNAM a rendu la lecture et
l'identification de ces villages impossibles.
3.1.2. Résultats
Nous avons remarqué que nos résultats
sous-estiment l'incidence de la maladie pour plusieurs raisons.
3.1.2.1. Répartition des cas par
année
L'année 2004 est celle qui a enregistré
le plus petit nombre de cas (18 cas, Tableau 4, page 14). Ceci s'explique par
le fait que les données dont nous disposions s'arrêtent au mois
d'Octobre. Ce cas reflète encore l'absence et la mauvaise organisation
dans la récolte des données dont souffre le Mali sur cette
pathologie.
Entre 2005 et 2008 nous avons enregistré 8 cas
provenant de pays frontaliers du Mali (Guinée: 5, Burkina: 1,
Mauritanie: 1 et Gambie: 1). Ceci confirme que la maladie est endémique
dans la sous-région car les cercles frontaliers de ces pays comptent
tous, des cas de LC (Figures 15 et 16, pages 17 et 18). Ceci traduit l'absence
de structures sanitaires adéquates pour les prises en charge des malades
dans la sous-région.
3.1.2.2. Répartition des cas par
région
Pour la période de 1997 à 2008,
l'étude révèle que les régions de Kayes (141 cas)
et Koulikoro (134 cas) sont les plus atteintes, et que les cercles les plus
atteints sont : Banamba (32), Kayes (31) et Kati (32). La région de
Kayes se confirme donc comme la plus atteinte (KEITA et coll., 2003). La
maladie semble s'étendre à tout le pays comme l'a signalé
TALL (2008). Aucune explication logique à ce phénomène ne
peut être donnée avec le niveau actuel des connaissances et les
données disponibles sur la maladie au Mali.
Nous avons également remarqué un fort
pourcentage de cas provenant de Bamako (17,71%). Nous pensons que ce
pourcentage est plus bas en réalité, bien qu'étant
située dans la zone Sud soudanienne qui est la plus atteinte. En effet
les patients arrivant au CNAM donnent souvent leur lieu de résidence
temporaire à Bamako comme leur provenance (TALL, 2008). En
réalité, ils ont été contaminés par le
parasite dans leurs villages d'origine avant d'arriver à
Bamako.
3.1.2.3. Répartition des cas par zone
climatique
On rencontre les phlébotomes beaucoup plus dans
les zones rurales ou les aires boisées des villes (LIGHTBURN, 2002;
SCALIBOR, 2008). Ainsi est il donc normal que nous observions une concentration
des cas de LC dans les zones nord et sud soudanienne qui renferment à la
fois les régions de Kayes, Koulikoro et Ségou.
3.1.2.4. Répartition des cas par
saison
Sachant que la saison classique des phlébotomes
s'étend d'Avril/Mai à Septembre/Octobre (SCALIBOR, 2008), nous
concluons que les fortes contaminations se font en Avril/Mai et
Septembre/Octobre. Le temps d'incubation dure trois mois, ainsi les
premières lésions apparaissent environ trois (3) mois
après les piqûres contaminantes. D'autre part, une étude
menée au CNAM révèle que les malades se font consulter
trois mois après le début des premières lésions
(TALL, 2008 ; SAMAKE, 2006). En réalité, les trois mois mis pour
venir en consultation sont liés à la durée
nécessaire pour réunir les moyens financiers pour le
déplacement à Bamako et les frais médicaux.
L'Enquête Démographique de Santé du Mali de 2006 (EDSM,
2006) révèle en effet qu'environ 59% des maliens couvrent leur
frais médicaux à partir de leurs disponibilités
financières, 8% le font avec des dettes. Par ailleurs, 64 % des maliens
vivent en dessous du seuil de la pauvreté et ont donc du mal à
couvrir les frais médicaux. Ainsi, les pics observées en
Octobre/Novembre traduisent les fortes contaminations qui ont eu lieu en
Avril/Mai et ceux de Mars/Avril, les fortes contaminations de Septembre/Octobre
toutes les deux due à la prolifération des phlébotomes. Il
s'écoule donc 6 mois entre la contamination et la consultation des
patients au CNAM. Nous concluons donc que la saison des pluies est celle qui
concentre les plus fortes contaminations et non la saison sèche comme le
montre les données. Toutefois, la maladie sévit toute
l'année et les deux saisons sont propices à la maladie. La
différence entre ces deux périodes de forte consultation se
justifie par le fait que les travaux champêtres se terminent en
Septembre, et donc les populations peuvent plus facilement faire le
déplacement pour Bamako. Notre étude révèle que les
mois d'Octobre et de Novembre sont ceux oil le plus grand nombre de cas sont
signalés. Ces résultats sont assez proches de ceux de YIOUGO (et
coll., 2007) qui trouve des pics de contamination aux mois de Février et
d'Octobre.
3.2. Recommandations
Sur la base des résultats obtenus dans cette
étude, nous recommandons : 3.2.1. Au Ministère de la Santé
Publique du Mali> L'élaboration d'un système
d'épidémiosurveillance ;
> La création d'une base de données
nationale et numérisée commune entre les cliniques et les
hôpitaux régionaux et ruraux pour la centralisation des
informations et l'analyse de ces données afin d'établir la carte
des foyers d'infection et de calculer l'impact réel de la LC grâce
à des études exactes de la prévalence et de
l'incidence;
> L'actualisation régulière de la
distribution de la LC au Mali;
> Le renforcement des capacités sur la LC pour
les agents de santé des zones
rurales les plus atteintes (Kayes et Koulikoro) pour
servir de sentinelles ; > La sensibilisation des
populations sur les moyens de prévention de la LC.
3.2.2. Aux chercheurs
> La réalisation d'une étude pour
déterminer l'impact socio-économique de la LC au
Mali;
> Des recherches poussées en vue de
déterminer le réservoir de l'agent de la maladie.
| 


