|
RÉPUBLIQUE DE CÔTE
D'IVOIRE
Union-Discipline-Travail
Ministère de l'Enseignement Supérieur et de la
Recherche Scientifique
|
UFR BIOSCIENCES
Laboratoire de Botanique
|
|
Année Universitaire : 2007-2008
MÉMOIRE
Présenté à l'UFR
Biosciences pour obtenir le
DIPLÔME D'ÉTUDES APPROFONDIES DE
BOTANIQUE
Option : ÉCOLOGIE
VÉGÉTALE
Par
KONAN
Djézou
THÈME
ÉVALUATION DE L'IMPACT DE LA CACAOCULTURE SUR
LA FLORE ET LA VÉGÉTATION EN ZONE DE FORÊT DENSE HUMIDE
SEMI-DÉCIDUE : CAS DU DÉPARTEMENT D'OUMÉ.
Soutenue publiquement, le 30 Avril 2009, devant
le jury composé de :
M. N'GUESSAN Kouakou Edouard Maître de Conférences,
Université de Cocody-Abidjan Président
M. TRAORÉ Dossahoua Professeur Titulaire,
Université de Cocody-Abidjan Directeur
M. GOETZE Dethardt Docteur, Université de Rostock,
Allemagne Co-directeur
M. KOUAMÉ N'guessan François
Maître-Assistant, Université de Cocody-Abidjan Examinateur
Résumé
La pratique de l'agriculture itinérante
incontrôlée dans le Centre-Ouest de la Côte d'Ivoire,
précisément à Oumé a eu des effets négatifs
sur les blocs forestiers qui sont des réserves de ressources
génétiques forestières très importantes. Nous
assistons impuissamment à la régression des surfaces
forestières au profit des plantations de cacaoyers ainsi que la
disparition de certaines espèces importantes.
La présente étude effectuée dans cette
région avait pour objectif d'évaluer l'impact de la cacaoculture
sur la flore et la végétation. Pour atteindre cet objectif, notre
étude a porté sur la comparaison de la structure de la
végétation des plantations de différentes classes
d'âge, des fragments de forêt et des jachères
considérées ici comme stade intermédiaire entre les
plantations et les fragments forestiers. Nous avons évalué
également le potentiel de régénération des
espèces ligneuses des milieux anthropisés dans le but d'envisager
une reprise de la végétation dans les milieux post-culturaux.
Les résultats obtenus, nous ont permis de comprendre
que la cacaoculture entraîne la disparition de certaines espèces
naturelles en lieu et place des espèces introduites pour l'alimentation,
la médicine et l'artisanat. Les espèces ligneuses sont
très rares dans les plantations. Les milieux post-culturaux
(jachères) sont colonisés par les espèces de brousses
secondaires. L'influence humaine se perçoit également dans les
fragments de forêt où la structure de la végétation
est plus dense dans la basse strate. Les pratiques agricoles à
Oumé constituent donc une menace pour la préservation de la
biodiversité forestière.
Mots clés : Évaluation, impact,
cacaoculture, flore, végétation, Département
d'Oumé.
Abstract
The practice of uncontrolled itinerant agriculture in the
central West of Côte d'Ivoire, precisely in Oumé, has negatively
affected the forests which are very important reserves of genetic forest
resources. Due to the unhampered creation of new cacao plantations forest
surfaces continue to decline and certain important species are disappearing.
The present study carried out in this area aimed to evaluate
the impact of cacao culture on flora and vegetation. To achieve this objective,
our study focused on comparing the vegetation structure of the plantations of
various age classes, of forest fragments and of fallows, which were considered
here as intermediate stage between plantations and forest fragments. We also
evaluated the regeneration potential of woody species in the anthropogenically
disturbed areas in order to study the regeneration of the vegetation on the
post-cultivation areas.
The achieved results revealed that cacao culture leads to the
disappearance of certain natural species and to the presence of species that
are introduced for purposes of feeding, medicine and crafts. Yet the woody
species are very rare in the plantations. The post-cultivation areas (fallows)
are colonized by species of secondary shrubs. Human impact is also notable in
the forest fragments where vegetation structure is dense in the bottom stratum.
The practice of agriculture in the Oumé region thus threatens the
conservation of forest biodiversity.
Key words: Evaluation, impact, cacao culture,
flora, vegetation, Department of Oumé.
AVANT-PROPOS
Dans le cadre de la préparation du mémoire du
Diplôme d'Études Approfondies, nous avons
bénéficié du soutien matériel et financier du
projet BIOTA sur une période d'un an (du 1er Août 2006 au 31
Juillet 2007). Nous tenons à remercier le Professeur Stefan
POREMBSKI de l'Université de Rostock qui nous a accepté
dans le projet.
La présente étude n'aurait pu être
possible sans le concours de plusieurs personnes auxquelles nous voudrions
rendre hommage et exprimer nos sincères remerciements. Qu'elles trouvent
ici l'expression de nos sincères gratitudes. Nos remerciements vont
particulièrement à l'endroit:
- du Professeur N'GUESSAN Kouakou Edouard,
Responsable du D.E.A de Botanique, pour nous avoir autorisé notre
inscription au D.E.A ;
- du Professeur TRAORE Dossahoua, Directeur de
recherche de notre travail. Nous le
remercions pour son soutien et pour ses conseils pendant nos
moments difficiles ;
- du Docteur Dethardt GOETZE, qui malgré
la distance qui nous sépare, a toujours suivi
de près nos travaux ;
- du Docteur KOUAME N'Guessan François,
qui au moment où nous nous souscions de trouver un stage, nous
a fait confiance en nous intégrant dans le projet BIOTA, Docteur, votre
geste nous a permis de bénéficier d'une bourse qui a
facilité nos travaux de recherche ; malgré tous les
problèmes rencontrés, vous n'aviez cessé de nous donner
des conseils ;
- du Docteur KOULIBALY Annick Victoire, pour
avoir été toujours à nos côtés, pendant les
moments difficiles de nos travaux ; nous vous remercions pour notre formation
à la statistique ;
- des Professeurs AKÉ ASSI Laurent et
NGUETTA Assanvo Simon Pierre, des
Docteurs EGNANKOU Wadja Mathieu, BORAUD M'Takpé
Kama Maxime,
DIAWARA Adama, DA Kouhété
Philippe pour leur formation théorique à l'A.E.A ; - des
Docteurs IPOU Ipou Joseph et ADOU Yao Yves
Constant, pour leurs conseils.
Nos remerciements s'adressent également à
Monsieur DOUGOUNÉ Bi Saturnin qui, malgré son
calendrier chargé, a accepté de nous aider sur le terrain, pour
l'identification des espèces. Nous remercions nos parents, en
l'occurrence Monsieur KONAN N'Dri Prosper et le Colonel
KONAN N'Goran qui nous ont toujours soutenu et prodigué
de sages conseils. Enfin, nos sincères gratitudes aux nombreux anonymes
et à tous ceux que nous aurons omis involontairement et qui ont
contribué à la réalisation de ce travail. Nous ne saurons
terminer sans rendre gloire à Dieu pour ses grâces qui ont
marqué notre vie.
SOMMAIRE
Titres Pages
DÉFINITION DE QUELQUES TERMES TECHNIQUES . ..iv
LISTE DES ABRÉVIATIONS ET SIGLES UTILISÉS ..v
LISTE DES FIGURES . ..vi
LISTE DES TABLEAUX .vii
INTRODUCTION .1
CHAPITRE I: GÉNÉRALITÉS SUR LE MILIEU
D'ÉTUDE 3
I-1- Situation géographique 3
I-2- Facteurs du milieu ..3
I-2-1- Climat 3
I-2-2- Hydrographie ..3
I-2-3- Sol et sous-sol . .7
I-2-4- Végétation . 7
I-3- Population riveraine .7
I-4- Activités socio-économiques . ...9
CHAPITRE II : MATÉRIEL ET MÉTHODES D'ÉTUDE
10
II-1- MATÉRIEL ..10
II-2- MÉTHODES DE TERRAIN 10
II-2-1- Choix des sites ..10
II-2-2-Relevés floristiques itinérants 10
II-2-3- Relevés de surfaces 10
II-3- MÉTHODES D'ANALYSE 13
II-3-1- Analyses floristiques 13
II-3-1-1- Richesse floristique 13
II-3-1-2- Diversité générique ..13
II-3-1-3- Répartition des types biologiques . 13
II-3-1-4- Analyse de correspondance (AC) 15
II-3-1-5- Coefficient de similitude 15
II-3-1-6-Classification ascendante des relevés sur la base
d'indices de Distance .15
II-3-2- Analyses structurales . 15
II-3-2-1-Distribution des Classes de hauteur et de
circonférence 15
|
II-3-2-2- Boîte à moustaches .
|
16
|
|
II-3-3- Fréquence spécifique (Fs)
|
.16
|
|
CHAPITRE III : RÉSULTATS .
|
17
|
|
III-1- Composition floristique
|
17
|
|
III-1- 1-Richesse floristique
|
17
|
|
III-1-2- Influence de la densité des cacaoyers sur la
richesse floristique des plantations .
|
..19
|
|
III-1- 3- Répartition des types biologiques
|
19
|
|
III-1- 4- Distribution spatiale des relevés
|
21
|
|
III-2- STRUCTURE DE LA VÉGÉTATION .
|
23
|
|
III-2-1-Distribution des classes de hauteur
|
..23
|
|
III-2-2-Distribution des classes de circonférence
|
.25
|
|
III-3- RÉGÉNÉRATION LIGNEUSE
|
27
|
|
CHAPITRE IV: DISCUSSION
|
..29
|
|
CONCLUSION
|
32
|
|
RÉFÉRENCES BIBLIOGRAPHIQUES
|
34
|
|
ANNEXE 1: Flore des fragments forestiers et des plantations de
cacaoyers dans la région
|
|
|
d'Oumé
|
37
|
|
ANNEXE 2 : INDEX ALPHABÉTIQUE DES TAXONS CITÉS
|
45
|
DÉFINITION DE QUELQUES TERMES
TECHNIQUES
Flore : liste de toutes les espèces
végétales vivant dans une contrée;
ouvrage dans lequel sont énumérées toutes
les espèces végétales d'une région.
Forêt secondaire : se dit d'une formation
végétale non originelle, liée à l'action de
l'homme.
Hauteur totale : distance verticale
séparant le niveau du sol du sommet de l'arbre
(bourgeon terminal).
Jachères : se dit d'une plantation
abandonnée suite à la mort des pieds de
cultures (cacaoyers).
Similarité : expression de la
ressemblance écologique entre des espèces ou des
sites d'étude, pris 2 à 2.
Souche : partie d'un arbre qui reste
enracinée après que l'arbre ait été
coupé.
Végétation : ensemble des
individus des espèces végétales groupées en
quantité
diverse, constituant la couverture végétale d'une
région.
LISTE DES ABREVIATIONS ET SIGLES
UTILISÉS
Types biologiques
Ch : Chaméphyte
Gb : Géophyte à bulbe
Gr : Géophyte à rhizome
Gt : Géophyte à tubercule
Hc : Hémicryptophyte
np : Nanophanérophyte (0,25 à 2 m de hauteur)
mp : Microphanérophyte (2 à 8 m de hauteur)
mP : Mésophanérophyte (8 à 30 m de
hauteur)
MP : Mégaphanérophyte (>30 m de hauteur)
Th : Thérophyte
Sigles
BIOTA : Biodiversity Monitoring Transect Analysis
BNETD : Bureau National d'Études Techniques et de
Développement
CSM-BGBD : Conservation and Sustainable Management of
Below-Ground Biodiversity
FAO : Organisation des Nations Unies pour l'Alimentation et
l'Agriculture
SODEFOR : Société de Développement des
Forêts
OIBT : Organisation Internationale des Bois Tropicaux
Autres
F1 : Fragment de forêt 1
F2 : Fragment de forêt 2
F3 : Fragment de forêt 3
Fig. : Figure
L : Lianescent
p.c : Pourcentage
PL.= 1 an : Plantations de 1 ans
PL.> 1an : Plantations de plus de 1 an
PL.1-5 : Plantations de 1 à 5 ans
PL.6-10 : Plantations de 6 à 10 ans
PL.11-20 : Plantations de 11 à 20 ans
PL.21-40 : Plantations de 21 à 40 ans
LISTE DES FIGURES
Pages
Fig. 1 : Localisation du Département d'Oumé 4
Fig. 2 : Localisation des sites d'étude dans la
Région d'Oumé 5
Fig. 3 : Diagramme ombrothermique de la région
d'Oumé, de 1990 à 2004 6
Fig. 4 : Carte de la végétation de la Côte
d'Ivoire et localisation de la zone d'étude ...8
Fig. 5 : Installation d'une parcelle de relevé floristique
dans une plantation de cacaoyer
de 18 ans .12
Fig. 6 : Jachère à Chromolaena odorata
dans la région d'Oumé ...12
Fig. 7 : Jachère à Terminalia spp. dans la
région d'Oumé 12
Fig. 8 : Fragment de forêt à Borassus
aethiopum dans la région d'Oumé 12
Fig. 9 : Configuration de la parcelle .........14
Fig. 10 : Placette de régénération . .14
Fig. 11 : Histogramme des familles les plus dominantes de la zone
d'étude 18
Fig. 12 : Relation entre la densité des cacaoyers et le
nombre d'espèces dans
les plantations de cacaoyers 20
Fig. 13 : Histogramme des types biologiques de chaque type de
milieu 20
Fig. 14 : Distribution des 54 relevés
étudiés par Analyse de correspondance 22
Fig. 15: Classification hiérarchique des 6 milieux
inventoriés basée sur
l'indice de distances de liaisons euclidiennes 24
|
Fig. 16 : Classe de circonférence de 1 à 5 cm
|
.26
|
|
Fig. 17 : Classe de circonférence de 5 à 10 cm
|
26
|
|
Fig. 18 : Classe de circonférence de 10 à 20 cm
|
.26
|
|
Fig. 19 : Classe de circonférence de 20 à 40
cm
|
26
|
|
Fig. 20 : Classe de circonférence de plus de 40 cm
|
.26
|
LISTE DES TABLEAUX
Pages
Tableau I : Caractéristiques des différents milieux
inventoriés .11
Tableau II : Similarité floristique en p.c 22
Tableau III : Nombre d'individus ligneux à l'hectare par
classe de hauteur (m) 24
Tableau IV : Fréquences relatives des espèces dans
la régénération des 6 milieux, exprimées en p.c .
...28
INTRODUCTION
La couverture forestière de la Côte d'ivoire dans
les années 1900, était de 16 millions d'hectares (CHATELAIN
et al., 2004). En 2000, le BNETD (2005), l'a évalué
à 6,38 millions d'hectares, composée de 4,2 millions d'hectares
de forêts classées constituées par les plantations
forestières industrielles et les réserves biologiques de la flore
et de 2,18 millions d'hectares d'aires protégées sous forme de
Parcs nationaux et de Réserves. Aujourd'hui, la zone forestière
est réduite à quelques lambeaux de forêts secondaires,
isolés au sein d'une succession de plantations villageoises ou
industrielles et de jachères.
L'essor démographique ayant entraîné des
besoins alimentaires et économiques plus accrus, la pression sur le
patrimoine forestier de la Côte d'Ivoire est devenue très forte.
La dégradation de l'environnement forestier et de sa biodiversité
a touché toutes les régions de la Côte d'Ivoire,
particulièrement celles du Sud-Ouest qui, en 1996, représentaient
91 p.c. des zones forestières du pays (CHATELAIN et al., 2004).
La diminution, voire même la disparition des forêts ivoiriennes
trouve son origine dans les feux de forêts, l'exploitation abusive et
anarchique des ressources foncières et forestières, à
savoir l'abattage, l'agriculture itinérante et surtout l'extension de
l'agriculture traditionnelle en agriculture industrielle (FAO, 2003).
L'agriculture constitue la principale cause de la déforestation en
Côte d'ivoire, car les agriculteurs ont recours à un
système cultural caractérisé par une pratique agricole sur
brûlis, ce qui entraîne une destruction rapide de la biomasse.
Comme dans la plupart des pays, en Afrique de l'Ouest, la
Côte d'Ivoire a hérité, de la période coloniale, la
création des plantations de cacaoyers dans le Sud-Est et le Centre-Est
du pays, qui fut la première boucle de cacao. Dès la fin des
années 1950, les plantations de cacaoyers ont été
créées dans le Centre-Ouest en drainant les anciens planteurs du
Centre-Est et les agriculteurs originaires des savanes baoulé. Quelques
années après, cette région devient la deuxième
boucle de cacao de la Côte d'Ivoire avant de faire place aujourd'hui au
Sud-Ouest forestier après la construction des voies de communication et
l'ouverture du port de San-Pédro. Les plantations de cacaoyers occupent
15,62 p.c. de la couverture forestière de la Côte d'Ivoire
(MANYONG et al., 1996 ; SONWA et al., 2000, 2001). Leur
création à la périphérie des forêts
entraîne des répercutions sur le patrimoine forestier.
Aujourd'hui, suite à la destruction du massif forestier
de la Côte d'Ivoire, pour la création des plantations de
cacaoyers, le projet BIOTA a initié une étude dans le
Département d'Oumé, la précédente boucle de cacao.
L'objectif principal de cette étude est porté sur
l'évaluation de l'impact de la cacaoculture sur la
biodiversité et les ressources naturelles végétales de ce
Département.
Le premier objectif spécifique de notre étude
s'intéresse à la description de la composition floristique des
fragments de forêt et des milieux anthropisés. Cette partie fait
l'objet d'un inventaire floristique de ces différents types de
végétation afin d'avoir une idée de la diversité
végétale actuelle de notre zone d'étude.
Le second objectif porte sur l'analyse de la structure
verticale et horizontale de ces différents biotopes. Ce volet nous
permettra d'apprécier l'état de dégradation ou de
conservation de l'environnement de cette zone.
La connaissance de la dynamique de la
régénération, en terme de potentiel de reconstitution de
la forêt, reste une information essentielle pour les plans
d'aménagement des milieux perturbés (KOULIBALY, 2008). C'est dans
cette optique que le troisième objectif traitera la dynamique de la
régénération des espèces ligneuses dans les
plantations de cacaoyers, des jachères et des îlots forestiers.
Cette dernière partie donnera une idée du potentiel de
restauration des plantations après leur abandon.
Ce manuscrit est composé de quatre parties essentielles
outre l'introduction et la conclusion suivie de perspectives et de
recommandations :
- la première partie est consacrée aux
généralités sur le milieu d'étude ; - la
deuxième traite du matériel et des méthodes ;
- la troisième est relative aux résultats
- la quatrième s'intéressera à la
discussion.
CHAPITRE I : GÉNÉRALITÉS SUR LE
MILIEU D'ÉTUDE
I-1- Situation géographique
Située en Afrique de l'Ouest, la Côte d'Ivoire
couvre une superficie de 322 462 km2. Elle est subdivisée en
19 Régions, elles-mêmes subdivisées en 58
Départements.
Le Département d'Oumé, notre zone
d'étude, est localisé dans le Centre-Ouest de la Côte
d'Ivoire entre 6° et 8° de latitude Nord et entre 4° et 6°
de longitude Ouest (Fig. 1). Il est limité à l'Est par le
Département de Toumodi, à l'Ouest par le Département de
Sinfra, au Nord par le Département de Yamoussoukro et au Sud par le
Département de Divo et le Chef lieu de Département de Gagnoa. Le
Département d'Oumé couvre environ 4400 km2, avec pour
Sous-Préfectures : Oumé, Diégonéfla et
Guépahouo. L'aire d'étude est localisée dans la zone de
Goulikaho, village situé à 26 km de la ville d'Oumé
précisément entre l'axe OuméSinfra et la division de la
SODEFOR Téné (Fig. 2).
I-2- Facteurs du milieu
I-2-1- Climat
La température moyenne annuelle entre 1990 et 2004 du
Département d'Oumé, enregistrée à la station de la
SODEFOR Téné, est de 26,72 °C avec un minimum de 24,77
°C en Juillet et un maximum de 28,12 °C en Février. La
pluviométrie totale annuelle est de 1100.74 mm.
Le climat de ce Département est qualifié par
LECOMTE (1990) de type Subéquatorial à pluviométrie
bimodale. Le diagramme ombrothermique (fig. 3) présente quatre saisons :
une grande saison sèche de Novembre à Février, très
marquée en Janvier, suivie d'une longue saison des pluies, allant de
Mars en Juin, d'une petite saison sèche s'étendant de Juillet
à Août et enfin d'une courte saison des pluies de Septembre
à Octobre.
I-2-2- Hydrographie
Oumé appartient au bassin versant du fleuve Bandama
situé vers l'Est du Département (GIRARD, 1971), qui en constitue
la limite naturelle avec le Département de Toumodi. La région est
arrosée par la Téné et la Sangoué, deux affluents
du Bandama, eux-mêmes alimentés par de petits cours d'eaux.

Capitale économique Capitale politique Ville
Parc national ou réserve
Autoroute
Route principale Autre route Piste
Limite de région
Fleuve
Zone d'étude
N
ECHELLE 1 : 5000000
Fig. 1 : Localisation du Département
d'Oumé.
(Source : Division Géographique du
Ministère des Affaires Étrangères, 2009)

6°30
Petit Bouaké
GouliKaho
N'Kroidjô
Djè Koffikro
Mafia
5°30
6°30
5°30 ECHELLE 1 : 50000 N

Piste carrossable
Cours d'eau permanent Cours d'eau temporaire
Sites des Fragments de forêt
Sites des Jachères
Sites des Plantations
LEGENDE
Forêt primaire
Forêt dégradée Culture ou
Jachère Habitat
Route secondaire

Village
Fig. 2 : Localisation des sites
d'étude dans la région d'Oumé.
(Source : Bureau National d'Etudes Techniques et de
Développement, 2002. Centre de Cartographie et de
Télédétection. Projet CIAT-TSBF/GF/2715-02.)

Pluviometrie (mm)
100
40
20
80
60
0
J F M A M J J A S O N D Période (Mois)
Pluviométrie (mm) Température
(°c)
30
50
40
20
0
10
Temperature (°c)
Fig. 3 : Diagramme ombrothermique de la région
d'Oumé, de 1990 à 2004
I-2-3- Sol et sous-sol
Le Département est couvert par des sols ferrallitiques
moyennement désaturés sous une pluviométrie
atténuée (CLEMENT, 1970). On y distingue trois grandes nuances
pédologiques selon le relief, avec des différenciations sur des
toposéquences (LECOMTE, 1990) :
· les sols ferrallitiques moyennement
désaturés avec recouvrement issus de granite, sont argileux et
profonds vers les bas-fonds ;
· les sols désaturés d'origine granitiques et
des textures variant de sabloargileux en bas de pente, à argileuse
gravillonnaire en haut de pente ;
· au Sud-Est de la région, on rencontre des sols
bruns eutrophes et des sols ferrallitiques faiblement
désaturés.
I-2-4- Végétation
Le Département d'Oumé appartient au Secteur
mésophile du Domaine guinéen (MONNIER, 1983). Il marque la
transition entre la forêt et la savane où les formations sont
représentées par des lambeaux ou des îlots forestiers dont
la composition floristique est celle des forêts semi-décidues
(Fig. 4), caractérisée par Celtis
spp. et Triplochiton scleroxylon
(AMAN et al., 1996). Ces forêts, qui répondent
à la définition de formations forestières fermées,
ont une architecture pluristratifiée et sont caractérisées
par la chute quasi simultanée des feuilles des grands arbres (GUILLAUMET
et al., 1971). On note très peu d'épiphytes et le
sous-bois est constitué de nombreux sous arbrisseaux et
d'herbacées.
La végétation actuelle du Département
d'Oumé est caractérisée par une anthropisation
aiguë.
Elle est constituée de quelques îlots forestiers
appauvris, de grandes proportions de jachères à
Chromolaena
odorata et de Albizia spp., de cultures
pérennes tels que le café, le cacao et de plantations
artificielles
d'essences forestières (OIBT, 2004). Ces plantations
forestières sont réalisées par la SODEFOR avec les
espèces comme Terminalia superba, Tectona grandis,
Cedrela odorata, Gmelina arborea, Triplonchiton
scleroxylon, Terminalia ivorensis.
I-3- Population riveraine
La population du Département d'Oumé est
répartie entre 33 p.c. d'autochtones constitués par les Gagou et
les Gouro et 67 p.c. d'allogènes et d'étrangers. Les
allogènes, composés de Baoulé, de Malinké et de
Sénoufo, viennent des régions des savanes, du Centre

8
Zone d'étude
Oumé
Zone d'étude
Fig. 4 : Carte de la végétation de la
Côte d'Ivoire et localisation de la zone d'étude. (Source : BNETD,
2007)
et du Nord de la Côte d'Ivoire. Les étrangers avec
32 p.c. sont constitués en majorité par les Burkinabé et
les Maliens (GNIMA, 2002).
I-4- Activités socio-économiques
L'agriculture est la principale activité dans le
Département d'Oumé. Le cacaoyer : Theobroma cacao et le
caféier : Coffea canephora, occupent le premier rang dans
l'activité économique de la population (GNAHOUA, 1996).
Dans les premières années de plantation,
l'agriculteur associe les cacaoyers aux bananiers : Musa paradisiaca,
aux ignames : Dioscorea spp. ou au taro : Colocasia
esculenta. En plus de ces cultures, les paysans cultivent également
le maïs : Zea mays, le riz : Oryza sativa et bien
d'autres cultures.
CHAPITRE II : MATÉRIEL ET MÉTHODES
D'ÉTUDE
II-1- MATÉRIEL
La collecte des données de terrain a
nécessité l'utilisation du matériel suivant :
v' des rubans gradués pour mesurer les parcelles et les
circonférences des troncs des ligneux de plus de 2 m de hauteur.
v' une ficelle pour matérialiser les limites des parcelles
;
v' des jalons de 1 m, plantés dans les quatre angles de
chaque parcelle ;
v' des jalons de 2 m, emboîtables, pour la mesure de la
hauteur totale des individus ligneux ;
v' une paire de jumelles, pour identifier le feuillage des
grands arbres.
II-2- MÉTHODES DE TERRAIN
II-2-1- Choix des sites
Les sites (tableau I) ont été
sélectionnés à partir de la carte établie par le
projet CSMBGBD. Nous avons retenu 24 plantations localisées pour la
plupart aux abords des îlots forestiers. Dans le but de faire une
étude comparative et complémentaire avec les travaux de KOULIBALY
(2008) effectués à Lamto, nous avons réparti ces
plantations en 4 classes d'âge distribuées comme suit : [1-5 ans]
; [6-10 ans] ; [11-20 ans] (Fig. 5) et [21-40 ans]. Trois jachères ont
été étudiées (Fig. 6 et 7). Nous avons retenu enfin
3 fragments de forêt bordés par des plantations de cacaoyers (Fig.
8). À l'issus de nos choix, nous avons procédé finalement
à une prospection des sites.
II-2-2- Relevés floristiques itinérants
Cette méthode de relevé botanique a
été utilisée par CHEVALIER (1948), AUBREVILLE (1959) et
AKE ASSI (1984, 2001, 2002). Elle consiste à parcourir le milieu dans
toutes les directions, en notant toutes les espèces de plantes
rencontrées (AKE ASSI, 1984). Nous avons adopté cette
méthode à l'intérieur des fragments de forêt, des
plantations et des jachères dans le but d'établir la liste
floristique de la zone d'étude.
II-2-3- Relevés de surfaces
Dans chaque catégorie de végétation, nous
avons installé des parcelles de forme rectangulaire de 50 m de longueur
et 10 m de largeur, soit une superficie de 500 m2. Chaque parcelle
est ensuite subdivisée en 5 placettes de 10 m de côté, soit
100 m2 de surface où nous avons caractérisé la
structure verticale et horizontale des différents types de
végétation, en
Tableau I : Caractéristiques des différents
milieux inventoriés
|
Identités
|
Campements
|
Groupes
ethniques
des
propriétaires
|
Ages
(années)
|
Parcelles
|
|
Plantation
|
Goulikaho
|
Gagou
|
1
|
R1, R2, R3
|
|
Plantation
|
N'Kroidjô
|
Gagou
|
2
|
R4
|
|
Plantation
|
Goulikaho
|
Gagou
|
3
|
R5
|
|
Plantation
|
Goulikaho
|
Baoulé
|
3
|
R6
|
|
Plantation
|
Mafia
|
Baoulé
|
5
|
R7, R8
|
|
Plantation
|
Mafia
|
Baoulé
|
5
|
R9
|
|
Plantation
|
Goulikaho
|
Gagou
|
6
|
R10
|
|
Plantation
|
Goulikaho
|
Gagou
|
7
|
R11
|
|
Plantation
|
Petit Bouaké
|
Baoulé
|
7
|
R12
|
|
Plantation
|
Mafia
|
Baoulé
|
7
|
R13
|
|
Plantation
|
Djè Koffikro
|
Baoulé
|
8
|
R14, R15
|
|
Plantation
|
Djè Koffikro
|
Baoulé
|
10
|
R16
|
|
Plantation
|
N'Kroidjô
|
Baoulé
|
10
|
R17, R18
|
|
Plantation
|
Djè Koffikro
|
Baoulé
|
11
|
R19, R20
|
|
Plantation
|
Goulikaho
|
Gagou
|
13
|
R21, R22
|
|
Plantation
|
Djè Koffikro
|
Baoulé
|
13
|
R23
|
|
Plantation
|
Petit Bouaké
|
Baoulé
|
18
|
R24
|
|
Plantation
|
Mafia
|
Baoulé
|
18
|
R25, R26
|
|
Plantation
|
Djè Koffikro
|
Baoulé
|
18
|
R27
|
|
Plantation
|
Goulikaho
|
Gagou
|
21
|
R28
|
|
Plantation
|
Goulikaho
|
Mossi
|
27
|
R29, R30, R31
|
|
Plantation
|
Goulikaho
|
Gagou
|
27
|
R32, R33, R34
|
|
Plantation
|
N'Kroidjô
|
Gagou
|
39
|
R35
|
|
Plantation
|
Goulikaho
|
Gagou
|
40
|
R36
|
|
Jachère
|
Petit Bouaké
|
Baoulé
|
48
|
R37, R38, R39
|
|
Jachère
|
Goulikaho
|
Gagou
|
46
|
R40, R41, R42
|
|
Jachère
|
Petit Bouaké
|
Mossi
|
41
|
R43, R44, R45
|
|
Fragment de forêt 1
|
Petit Bouaké
|
Gagou
|
-
|
R46, R47, R48
|
|
Fragment de forêt 2
|
Goulikaho
|
Gagou
|
-
|
R49, R50, R51
|
|
Fragment de forêt 3
|
Goulikaho
|
Gagou
|
-
|
R52, R53, R54.
|

Fig. 5 : Installation d'une parcelle de
relevé Fig. 6 : Jachère à Chromoleana
odorata dans la
floristique dans une plantation de cacaoyers de 18 région
d'Oumé. (Photo Konan Djézou, Mai 2008).
ans. (Photo Konan Djézou, Mai 2008).

|
Fig. 7 : Jachère à
Terminalia spp. dans la région d'Oumé. (Photo Konan
Djézou, Mai 2008).
|
Fig. 8 : Fragment de forêt à
Borassus aethiopum dans la région d'Oumé. (Photo Konan
Djézou, Mai 2008)
|
mesurant la hauteur totale et la circonférence du tronc
de tous les individus de plus de 2 m de hauteur (Fig. 9). Pour les
espèces inférieures à 2 m de hauteur, on ne note que leur
présence pour établir la liste floristique de la zone
d'étude.
Nous avons choisi la placette centrale (Fig. 10), où
nous avons compté tous les individus dans le but d'évaluer la
densité des espèces ligneuses inférieures à 2 m de
hauteur dans les fragments forestiers et les milieux agroforêts.
II-3- MÉTHODES D'ANALYSE
II-3-1- Analyses floristiques
II-3-1-1- Richesse floristique
La richesse floristique est définie par AKE ASSI (1984)
comme le nombre d'espèces recensées à l'intérieur
des limites d'un territoire, compte tenu de sa surface. Elle désigne
donc le nombre de taxons qui se trouvent dans ce milieu, sans juger de leur
fréquence, ni de leur abondance, ni même de la taille et de la
productivité des espèces rencontrées (KOUAME, 1998). La
richesse floristique a permis de faire une étude comparative des
fragments de forêt et des milieux anthropisés.
II-3-1-2- Diversité générique
La diversité générique, au sein d'une
famille donnée, est le rapport du nombre total des espèces par
celui des genres (AKÉ ASSI, 1984). Il se calcule selon la formule
suivante : Ig = G / E avec Ig l'indice de diversité
générique, G le nombre total de genres et E celui des
espèces. Cet indice permet d'apprécier la diversité
floristique de chaque milieu. Selon AKÉ ASSI (1984), plus Ig est faible,
plus la flore est diversifiée ; mais lorsque Ig est élevé
la flore est moins diversifiée. La valeur seuil en dessous de laquelle
l'indice est qualifié de faible est 4 (AKÉ ASSI, 1998).
II-3-1-3- Répartition des types biologiques
Les types biologiques sont un système de classification
des végétaux initié par RAUNKIAER (1934), afin d'organiser
tous les végétaux selon le positionnement des organes de survie
de la plante durant la période défavorable. Nous nous sommes
basés sur cette classification pour caractériser la flore des 6
milieux inventoriés en différents groupes qui sont : les
mégaphanérophytes, les mésophanérophytes, les
microphanérophytes, les nanophanérophytes, les
thérophytes, les chaméphytes, les géophytes à
tubercule, les géophytes à rhizome, les géophytes à
bulbe et les hémicryptophytes.

10 m
10 m
Fig. 9 : Configuration de la parcelle

10 m
10 m
Fig. 10 : Placette de
régénération
II-3-1-4- Analyse de correspondance (AC).
Dans l'objectif de comparer les 54 relevés des
fragments de forêt et des milieux anthropisés sur la base de leur
composition floristique, nous avons opté pour l'analyse de
correspondance qui est une technique d'analyse indirecte de gradient traitant
des données floristiques indépendamment des variables
environnementales (LLOYD et al., 1994). Elle produit une
représentation graphique étalant dans un plan les relevés
floristiques sur deux axes. Dans notre étude nous avons utilisé
cette analyse pour la distribution spatiale des 54 relevés des fragments
de forêt, des jachères et des plantations en fonction des
paramètres floristiques et environnementaux. L'analyse de correspondance
a été menée avec le logiciel CANOCO version 4.5.
II-3-1-5- Coefficient de similitude
Le coefficient de similitude permet d'apprécier le
degré de ressemblance des listes d'espèces des différents
milieux inventoriés pris deux à deux. Ce coefficient ne tient pas
compte de l'effectif des espèces rencontrées, mais plutôt
de la présence ou de l'absence des espèces. Parmi diverses
formules valables les unes que les autres (GOUNOT, 1969), nous avons retenu
celle proposée par SØRENSEN (1948). En effet, si nous
désignons par A et B les nombres respectifs d'espèces des deux
listes I et II et par C, le nombre d'espèces communes aux deux listes.
SØRENSEN (1948) a défini ce coefficient comme suit :
Cs = [(2C) x (A+B)] x 100. Deux milieux comparés sont
proches sur le plan de la composition floristique, si le coefficient de
similitude est supérieur ou égal à 50 p.c.
II-3-1-6-Classification ascendante des relevés sur
la base d'indices de distance
La classification ascendante est une méthode qui groupe
des objets semblables dans des catégories respectives. Plusieurs
méthodes de regroupement existent pour la construction d'un dendrogramme
de ressemblance entre relevés floristiques. Pour la distribution de nos
différents milieux, nous avons utilisé la classification
ascendante sur la base d'indices de distance euclidienne avec le logiciel
XLSTAT version 12.0.
II-3-2- Analyses structurales
II-3-2-1-Distribution des classes de hauteur et de
circonférence
La hauteur totale et la circonférence du tronc des
ligneux sont des paramètres importants à mesurer ou à
estimer en vue de déterminer le degré de perturbation
indiqué par une strate inférieure dense, ou de protection avec
une strate supérieure dense des formations
végétales. Dans le but de caractériser
les strates des fragments de forêt, des jachères et des
plantations, nous avons effectué des mesures structurales au sein de ces
milieux. Nous avons comparé les strates des fragments forestiers
à celles des milieux anthropisés afin de détecter
l'évolution de la végétation ligneuse dans les milieux
anthropisés. Les données ont été regroupées
dans 5 classes de hauteur et de circonférence. Les classes de hauteur
retenues sont : [2-4 m] ; ] 4-8 m] ; ]8-12 m] ; ]12-20 m] ; [> 20 m] et
celles des circonférences sont réparties comme suit : [0-5 cm] ;
]5-10 cm] ; ]10-20 cm] ; ]20-40 cm] et [> 40 cm].
II-3-2-2- Boîte à moustaches
La boîte à moustaches est une invention de TUKEY
(1977) pour représenter schématiquement la distribution d'une
variable. Cette représentation graphique résume la dispersion
d'une série de données à partir de 5 valeurs : le minimum,
les 3 quartiles Q1, Q2 (médiane), Q3 et le maximum. Les boîtes
à moustaches servent principalement à comparer un même
caractère dans des populations de tailles différentes. Elles sont
utilisées dans ce mémoire pour détecter si l'âge est
un facteur significatif du changement des paramètres structuraux durant
les années de plantation. Nous avons appliqué le test de TUKEY
pour détecter les différences significatives entre les fragments
de forêt, des jachères et des plantations de différentes
classes d'âge avec une erreur de 5 p.c. (p < 0.05). Cette analyse a
été effectuée avec le logiciel SPSS version 16.0.
II-3-3- Fréquence spécifique (Fs)
La fréquence spécifique d'une espèce est
le nombre de points où cette espèce a été
rencontrée (LAMOTTE, 1962). Elle exprime la présence ou l'absence
de l'espèce. Dans le cas de notre étude, la fréquence
spécifique d'une espèce est le rapport entre le nombre de
placettes dans lesquelles l'espèce est présente et le nombre
total de placettes de chaque unité de végétation à
savoir les fragments de forêt, les jachères et les plantations. La
fréquence spécifique a été adoptée dans le
but de détecter les espèces rares ou abondantes dans la
recolonisation des différents milieux inventoriés. Elle a permis
également de faire ressortir la préférence des
espèces dans la régénération des différents
milieux en suivant un gradient allant des fragments de forêt aux
jachères, en transitant par les plantations de différentes
classes d'âge.
CHAPITRE III : RÉSULTATS
III-1- Composition floristique
III-1-1-Richesse floristique
La synthèse de la flore issue de l'inventaire
itinérant et des relevés de surfaces a donné une liste de
387 espèces végétales distribuées dans 86 familles
(Annexe). Dans les fragments de forêt nous avons dénombré
224 espèces réparties entre 64 familles dominées par les
Rubiaceae. Les jachères ont une richesse floristique de 143
espèces réparties entre 47 familles plus
représentées en Euphorbiaceae. Les plantations de 21 à 40
ans renferment 130 espèces réparties entre 53 familles
dominées par les Euphorbiaceae (Fig. 11). Les plantations de 11 à
20 ans ont donné 124 espèces réparties entre 49 familles
avec une prédominance des Euphorbiaceae. La richesse floristique des
plantations de 6 à 10 ans est de 114 espèces réparties
entre 50 familles, où les Euphorbiaceae renferment plus
d'espèces. Enfin, dans les plantations de 1 à 5 ans, nous avons
dénombré 214 espèces réparties entre 69 familles
dont les Poaceae sont les plus abondantes. Certaines espèces se
retrouvent aussi bien dans les fragments de forêt que dans les
jachères et les plantations à savoir Antiaris toxicaria
var. africana, Albizia adianthifolia, Albizia zygia, Allophyllus
africanus, Baphia nitida, Blighia sapida, Blighia unijugata, Celtis
mildbraedii, Cola gigantea, Deinbollia pinnata, Ficus exasperata, Ficus mucuso,
Funtumia africana, Lecaniodiscus cupanioides, Pterygota macrocarpa et
Trichilia heudelotii (Annexe). Les espèces ligneuses les plus
abondantes dans les plantations de 1 à 5 ans sont par ordre d'importance
: Millettia zechiana, Mansonia altissima, Albizia
zygia et Nesogordonia papaverifera. Dans les plantations de 6
à 10 ans, le nombre de ligneux est moins abondant. Les plantations de 11
à 20 ans se distinguent des autres milieux avec une Mangifera
indica comme espèce dominante. Celles de 21 à 40 ans se
caractérisent avec Ficus exasperata. Les espèces comme
Millettia zechiana, Trichilia heudelotii, Albizia
zygia, Ficus exasperata, Mallotus oppositifolius et
Albizia adianthifolia sont bien représentées dans les
jachères.
L'indice de diversité générique des
fragments de forêt est de 1,2 contre 1,1 pour les plantations et les
jachères. On constate que, malgré la richesse de la flore des
fragments forestiers, elle n'est pas plus diversifiée que celle des
milieux anthropisés.

Families
Caesalpiniaceae
Anacardiaceae
Euphorbiaceae
Sterculiaceae
Apocynaceae
Mimosaceae
Sapindaceae
Annonaceae
Solanaceae
Rubiaceae
Meliaceae
Moraceae
Rutaceae
Fabaceae
Poaceae
0 5 10 15 20 25 30 35 40 45 50 55 60 65 70
PL.1-5 PL.6-10 PL.11-20 PL.21-40 Jachères
Forêts
Nombre d'espèces
Fig. 11 : Histogramme des familles les plus dominantes de
la zone d'étude.
Légende: PL.1-5 = plantations de 1
à 5 ans PL.6-10 = plantations de 6 à 10 ans PL.11-20 =
plantations de 11 à 20 ans PL.21-40 = plantations de 21 à 40
ans
III-1-2-Influence de la densité des cacaoyers sur la
richesse floristique des plantations
L'influence de la densité des cacaoyers sur le nombre
d'espèces dans les plantations se définie en trois phases (figure
12). La première phase part de la première à la
cinquième année de plantation, où la courbe de la
densité des cacaoyers est inférieure à celle du nombre
d'espèces. Nous assistons par la suite à la diminution du nombre
d'espèces pendant que la densité des cacaoyers augmente
considérablement. L'augmentation de la densité des cacaoyers dans
les plantations de 1 à 5 ans s'explique par une intensification du
nombre de pieds de cacaoyers au début de la création des
plantations, dont la réussite se fait de manière progressive.
Nous avons également des apports extérieurs des fèves de
cacao par les animaux tels que les rats et les écureuils.
La deuxième phase s'étend entre les plantations
de 6 à 10 ans avec la densité des cacaoyers atteignant un maximum
de 227 indiv./ha et le nombre d'espèces un minimum de 114
espèces/ha.
Enfin la troisième phase débute dans les
plantations de 11 à 20 ans et se prolonge dans les jachères. La
densité des cacaoyers diminue fortement jusqu'à une valeur
très faible de 26 indiv./ha dans les jachères dont l'âge
est au-delà de 40 ans. Quant au nombre d'espèces, on assiste
à une augmentation progressive, au fur et à mesure que les
plantations prennent de l'âge. La diminution du nombre de pieds de
cacaoyers dans les plantations jeunes et âgées est due à un
élagage effectué par les paysans pour favoriser le grossissement
de certains pieds afin d'accroître la production. La mort d'un nombre
important de pieds de cacaoyers dans les plantations âgées,
entraîne une très faible densité dans les
jachères.
III-1-3- Répartition des types biologiques.
La figure 13 montre la répartition des types
biologiques dans les fragments de forêt et des milieux
anthropisés. La flore des fragments de forêt, des jachères
et des plantations de cacaoyers inventoriée, est dominée par les
microphanérophytes arbustifs. Les fragments de forêt renferment 32
p.c. de microphanérophytes arbustifs, 18,22 p.c de
mésophanérophytes et 14, 22 p.c. de
mégaphanérophytes arborescents. Les thérophytes sont
absentes dans ce milieu.
Dans les jachères, la proportion des
microphanérophytes arbustifs est presque similaire aux fragments de
forêt avec 30,21 p.c. Les mésophanérophytes et les
mégaphanérophytes arborescents occupent une place importante avec
des proportions respectives de 14,38 p.c et 10,79 p.c. Les plantations de 21
à 40 ans sont caractérisées par les
mégaphanérophytes arborescents avec une proportion de 8,48 p.c.
À l'intérieur des plantations de 11 à 20 ans, on

Nombre d'espèces Densité des
cacaoyers
250
200
Nombre d'especes
150
100
50
0
250
200
50
0
Densites a Phectare
150
100
PL.1-5 PL.6-10 PL.11-20 PL.20-40
Jachères
Types de milieu
Fig. 12 : Relation entre la densité des cacaoyers
et la richesse floristique des plantations de cacaoyers

Pourcentage de recouvrement (p.c.)
100
00
20%
20
60%
60
80%
80
40%
40
0
PL.1-5 PL.6-10 PL.11-20 PL.21-40 Jachères
Forêts
26,19
14,47
13,33
12,85
7,61
Th MP mP mp np Autres
7,8
26,08
14,78
13,91
6,08
9,55
16,5
26,19
19,83
16,66
10,31
4,76
7,93
Types de milieu
29,23
15,37
11,53
9,22
8,48
12,3
30,21
10,12
11,51
14,38
10,79
7,24
10,22
18,22
14,22
8,88
32
Fig. 13 : Histogramme des types biologiques de chaque
type de milieu
observe une proportion importante de nanophanérophytes
avec 16,66 p.c. Les mégaphanérophytes arborescents se font rares
avec 4,76 p.c. de représentativité. Les plantations de 1 à
5 ans et de 6 à 10 ans ont les mêmes caractéristiques que
les plantations de 11 à 20 ans, avec une proportion élevée
de nanophanérophytes et de mésophanérophytes.
III-1-4-Distribution spatiale des relevés
L'analyse de correspondance des 54 relevés des 6
milieux étudiés, a fait ressortir 5 groupes suivant les deux
premiers axes (Figure 14). L'axe 1 traduit un gradient de perturbation de la
flore sous l'influence des pratiques culturales. Ce gradient part des milieux
les moins perturbés du côté négatif de l'axe 1 vers
les milieux les plus perturbés du côté positif. La partie
négative de l'axe 1, correspondant aux milieux les moins
perturbés, est constituée des relevés des fragments de
forêt distribués en deux groupes, I et II et des relevés
des plantations de 1 an. Le groupe I renferme les relevés des fragments
de forêt 2 et 3, le groupe II les relevés du fragment de
forêt 1et le groupe 3 celles des plantations de 1 an. Dans la partie
positive, traduisant les milieux les plus perturbés, on ne rencontre que
les relevés des milieux anthropisés : les jachères et les
plantations. Ces milieux sont repartis en deux groupes, III et IV. Le groupe
III est constitué de tous les relevés des jachères et le
groupe IV les relevés des plantations. La dissimilarité de la
composition floristique entre les fragments de forêt et les milieux sous
influence de la cacaoculture se démontre avec l'axe 1. Les
relevés des plantations de 1 an du côté négatif,
proche des fragments forestiers, montre qu'au début de la
création des plantations, les paysans conservent
l'écosystème forestier pour protéger les jeunes plants de
cacaoyers contre les rayonnements solaires. Les relevés des
jachères se situent entre les parties positive et négative de
l'axe 1. Cela traduit une évolution des milieux pos-culturaux vers des
formations de forêts secondaires. La séparation des relevés
des 3 fragments de forêt en 2 groupes, des jachères et des
plantations peut s'expliquer par l'axe 2. La composition floristique est le
paramètre qui caractérise l'axe 2. Cet axe traduit un gradient de
ressemblance floristique entre les différents groupes. Ce gradient part
des milieux floristiquement différents du côté
négatif, constitué du fragment forestier 1 et des plantations de
plus de 1 an vers les milieux floristiquement presque semblables du
côté positif, renfermant les fragments de forêt 2 et 3, les
plantations de 1 an et les jachères.
Ce gradient de ressemblance floristique se justifie avec la
matrice de similarité entre les 5 groupes (tableau II). Nous observons
des coefficients de similitude élevés entre les fragments de
forêt 2 et 3 avec les plantations de 1 an et les jachères
respectivement 56,2 p.c.
- 1.4
- 1.4
Axe 2
1.4
0
|
F2 & F3
I R49 R52
R51 R54 III
R50
R53
R1
|
R2
|
PL.=1 an
R3 R44
R43
|
R37
Jachères
IV
R38
R45 R40
R41
R39 R35
R42 R36 R21
|
|
|
R28 R31 R7R13
|
|
II R48
R47
R46
|
F1
|
|
|
|
R18 R23 R8
R27 R33 R12 R4
R29 R26
R9 R22 R30
R19 R17 R20
R24 R10 R16 R14
R25 R34
R5 R11 R15
R32 R6
V
|
PL>1 an
|
0 1.4
Axe 1
R1-R9 : relevés des plantations de 1 à 5 ans
R10-R18 : relevés des plantations de 6 à 10 ans R19-R27 :
relevés des plantations de 11 à 20 ans R28-R36 : relevés
des plantations de 21 à 40 ans R37-R45 : relevés des
Jachères
R46-R54 : relevés des fragments de forêt
Fig. 14 : Distribution des 54 relevés
étudiés par Analyse de Correspondance
Tableau II : Similarité floristique en
p.c.
|
PL.=1 an
|
PL. > 1 an
|
Jachères
|
F1
|
F2&3
|
|
PL. =1 an PL. > 1 an Jachères
F1
F2&3
|
1
|
63,3
1
|
64,3
76,2
1
|
49,0
51,0
53,8
1
|
56,2 46,2 51,0 48,6
1
|
et 51 p.c., puis faible avec le fragment forestier 1 et les
plantations de plus de 1 an avec 48,6 p.c. et 46,2.
La classification ascendante des 5 milieux basée sur la
présence ou l'absence des espèces, confirme la distribution de
similarité des 5 groupes suivant l'axe 2 (Fig. 15). Ainsi en fonction du
degré de ressemblance floristique, on remarque que la première
division sépare les plantations de plus de 1 an et les jachères
des plantations de 1 an et des fragments forestiers. Les plantations de plus de
1 an sont les plus distantes des fragments forestiers. Cette observation montre
que la flore des plantations âgées est très
perturbée suite aux actions mécaniques et chimiques des paysans
pendant plusieurs années. Les plantations de 1 an se séparent au
deuxième niveau de division avec les fragments de forêt 2 et 3 du
fragment forestier 1, et se situent entre les deux groupes de fragments de
forêt. Cela signifie que la flore des plantations très jeunes est
moins perturbée, à tel enseigne que leur composition floristique
est presque similaire à celle des fragments de forêt.
III-2- STRUCTURE DE LA VÉGÉTATION
III-2-1-Distribution des classes de hauteur
La stratification de la végétation des fragments
de forêt, des jachères et des plantations autre que les cacaoyers
montre une densité importante de ligneux à l'intérieur des
fragments de forêt dans toutes les strates par rapport aux milieux
anthropisés (tableau III). Les plantations de 1 à 5 ans et les
jachères se distinguent des autres plantations avec un nombre
élevé de ligneux dans les strates de 2 à 12 m de
hauteur.
Les plantations de 1 à 5 ans sont dominées par
les arbrisseaux et les arbustes avec respectivement 18 et 30 indiv./ha. Cela
traduit que, lors de la mise en place des plantations de cacaoyers, les paysans
détruisent les arbres et ne laissent que les arbustes. Les
espèces dominantes dans ces strates sont Millettia zechiana, 15
indiv./ha et Ficus exasperata, 13 indiv./ha. À
l'intérieur des plantations âgées, les ligneux se font
rares dans toutes les strates. Les quelques espèces naturelles
rencontrées sont Irvingia gabonensis et Ricinodendron
heudelotii. Les plantations de 6 à 10 ans sont pratiquement
dépourvues des ligneux naturels.
La structure des jachères est plus
représentée par les arbres de petites tailles de 8 à 12 m
de hauteur avec 77 indiv./ha, dominée par Spondias mombin,
Alstonia boonei et Antiaris toxicaria var. africana.
Les arbrisseaux et les arbustes sont également nombreuses,
caractérisés par Trichilia heudelotii, Millettia
zechiana et Mallotus oppositifolius.

Forêts 2 & 3
Forêt 1 Jachères PL. > 1
an
PL.=1 an
0 50 100 150 200 250 300
Distance de liaison euclidienne
Fig. 15 : Classification hiérarchique des 6
milieux inventoriés basée sur l'indice Distances de liaisons
euclidiennes.
Tableau III : Nombre d'individus ligneux à
l'hectare par classe de hauteur (m)
|
Classes de hauteur Milieux
|
[2-4 m]
|
] 4-8 m]
|
] 8-12 m]
|
] 12-20 m]
|
]> 20 m]
|
|
PL.1-5 ans
|
18
|
30
|
7
|
5
|
3
|
|
PL.6-10 ans
|
-
|
2
|
1
|
-
|
-
|
|
PL.11-20 ans
|
2
|
6
|
4
|
2
|
-
|
|
PL.21-40 ans
|
7
|
4
|
4
|
2
|
-
|
|
Jachères
|
41
|
27
|
77
|
4
|
1
|
|
Forêts
|
161
|
100
|
31
|
19
|
8
|
La flore ligneuse des fragments de forêt est
caractérisée par une forte densité d'arbrisseaux de 161
indiv./ha et d'arbustes de 100 indiv./ha. Ils sont dominés par
Nesogordonia papaverifera avec 149 indiv./ha suivie de Funtumia
africana avec 148 indiv./
ha. et de Millettia zechiana, 115
indiv./ha. Dans la strate de plus de 12 m de hauteur, on rencontre quelques
pieds de Nesogordonia papaverifera, de Antiaris toxicaria
var. africana, de Pycnanthus angolensis, de
Trichilia heudelotii et de Trichilia prieureana.
III-2-2- Distribution des classes de
circonférence
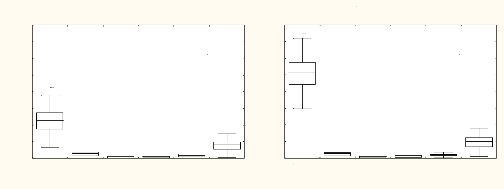
L'analyse de variance avec le test de TUKEY montre une
différence significative entre les fragments de forêt et les
milieux anthropisés dans toutes les classes de circonférence avec
p = 0,001.
La structure des fragments forestiers est
caractérisée par les individus de petites circonférences
de 1 à 10 cm, qualifiés de classe de
régénération (Fig. 16 et 17). Nous remarquons une forte
densité d'individus ligneux avec une valeur moyenne de 1000 indiv./ha
dans la classe de 5 à 10 cm par rapport aux autres classes. Cette
observation démontre que les fragments forestiers perturbés sont
en pleine reconstitution dominée par Nesogordonia papaverifera,
Funtumia africana, de Trichilia heudelotii et Trichilia
prieureana, avec une densité comprise entre 55 et 91 indiv/ha.
L'analyse des milieux anthropisés montre une
différence significative entre les jachères et les plantations
à p = 0,0037 dans la classe des individus de 1 à 10 cm de
circonférence (Fig. 16 et 17). Ces individus de
régénération sont presque inexistants dans les
plantations. Ils réapparaissent dans les milieux post-culturaux
(jachères) avec une valeur moyenne de 200 indiv./ha
représentés en grand nombre par Millettia zechiana.
La différence entre les plantations se situe au niveau
des classes de circonférence moyennes de 10 à 40 cm, où
nous observons une différence significative de 0,0038 entre les
plantations très jeunes de 1 à 5 ans et les plantations de 6
à 40 ans (Fig. 18 et 20). À l'intérieur des plantations de
1 à 5 ans, nous dénombrons dans cette classe 200 indiv./ha en
moyenne, dominés par Millettia zechiana, Mansonia
altissima, Nesogordonia papaverifera, Antiaris toxicara
var. africana et Cola gigantea. Ce qui traduit que dans
les premières années de plantation, les paysans coupent les
individus de petites circonférences au profit des moyens. Dans la classe
des individus de plus de 40 cm de circonférences au sein des milieux
anthropisés, seules les plantations de plus de 20 ans renferment en
moyenne 100 indiv./ha. Les espèces les plus abondantes sont Spondias
mombin, Mangifera indica et Ficus exasperata.
Nombre d'individus / ha
1600
1400
1200
1000
800
600
400
200
0
Forêts PL.1-5 PL.6-10 PL.11-20 PL.21-40
Jachères
a
b b b b
Types de milieu
A : 1 à 5 cm
P = 0,0037
c
Nombre d'individus / ha
1600
1400
1200
1000
800
600
400
200
0
Forêts PL.1-5 PL.6-10 PL.11-20 PL.21-40
Jachères
a
b b b b
B : 5 à 10 cm
Types de milieu
P = 0,0037
c
Fig. 16 : Classe de circonférence de 1 à 5
cm Fig. 17 : Classe de circonférence de 5 à 10 cm

Nombre d'individus / ha
1600
1400
1200
1000
800
600
400
200
0
Forêts PL.1-5 PL.6-10 PL.11-20 PL.21-40
Jachères
a
c
C : 10 à 20 cm
Types de milieu
b b b
P = 0,0038
c
Nombre d'individus / ha
1600
1400
1200
1000
800
600
400
200
0
Forêts PL.1-5 PL.6-10 PL.11-20 PL.21-40
Jachères
a
c
D : 20 à 40 cm
Types de milieu
b b b
P = 0,0038
c
Fig. 18 : Classe de circonférence de 10 à
20 cm Fig. 19 : Classe de circonférence de 20 à 40 cm
Écart type
Moyenne
Différence significative
E : > 40 cm
Forêts PL.1-5 PL.6-10 PL.11-20 PL.21-40
Jachères
Types de milieu
Nombre d'individus / ha
1600
1400
1200
1000
800
400
200
600
0

a
bc bc bc c

Fig. 20 : Classe de circonférence de plus de 40
cm
L'observation de toutes les classes de circonférence
montre que les plantations de 6 à 10 ans sont les milieux où
l'activité agricole se ressent le plus. Nous n'observons presque pas
d'individus ligneux dans ces milieux
III-3- RÉGÉNÉRATION LIGNEUSE
L'étude de la régénération avec la
fréquence spécifique a fait ressortir 4 catégories
d'espèces : les catégories C1, , C3 et C4 (tableau IV).
La catégorie C1 est constituée des
espèces non sensibles à la cacaoculture, qui
régénèrent aussi bien dans les fragments forestiers que
dans les milieux sous influence agricole. Les espèces les plus
fréquentes dans cette catégorie sont Antiaris toxicaria
var. africana, Albizia adianthifolia, Ficus exasperata
et Millettia zechiana.
La catégorie renferme les espèces sensibles
à la cacaoculture. Elles sont présentes dans les fragments de
forêt, rares dans les plantations et réapparaissent dans les
jachères après le passage des paysans. Ces espèces sont
pour la plupart Cola gigantea, Sterculia rhinopetala,
Trichilia heudelotii, et Trichilia prieuriana.
La troisième catégorie, C3 est
caractérisée par les espèces très sensibles et
influencées par les paysans. Les plus remarquables sont Nesogordonia
papaverifera, Mansonia altissima et Leptonychia
pubescens. Présentes dans les fragments forestiers, elles sont
absentes dans les milieux anthropisés. Selon les paysans, ils
empêchent la régénération des espèces
d'exploitation forestière telles que Nesogordonia papaverifera
et Mansonia altissima, pour échapper à la destruction de
leurs plantations par les exploitants forestiers.
Enfin la quatrième catégorie, C4 renferme les
espèces des milieux post-culturaux telles que Ficus exasperata,
Ficus sur, Morinda lucida et Rauvolfia vomitoria avec une
faible fréquence de 22 p.c. Les paysans utilisent le plus souvent ces
espèces dans la médecine traditionnelle.
Tableau IV : Fréquences relatives des
espèces dans la régénération des 6
milieux,
C1
C3
C4
Catégories
exprimées en p.c.
|
|
|
|
|
|
|
|
Espèces Biotopes
|
Forêts
|
PL.1-5
|
PL.6-10
|
PL.11-20
|
PL.21-40
|
Jachères
|
|
Albizia adianthifolia
|
89
|
55
|
11
|
55
|
33
|
55
|
|
Albizia zygia
|
55
|
44
|
33
|
22
|
22
|
22
|
|
Antiaris toxicaria var. africana
|
89
|
44
|
67
|
55
|
55
|
100
|
|
Blighia unijugata
|
67
|
33
|
33
|
22
|
11
|
22
|
|
Deinbollia pinnata
|
67
|
67
|
33
|
44
|
11
|
22
|
|
Ficus exasperata
|
22
|
78
|
78
|
67
|
55
|
33
|
|
Mallotus oppositifolius
|
11
|
22
|
22
|
22
|
44
|
100
|
|
Millettia zechiana
|
33
|
67
|
33
|
44
|
22
|
78
|
|
Blighia sapida
|
44
|
33
|
11
|
-
|
-
|
11
|
|
Celtis zenkeri
|
22
|
-
|
-
|
-
|
-
|
22
|
|
Cola gigantea
|
67
|
11
|
-
|
-
|
-
|
33
|
|
Holarrhena floribunda
|
22
|
-
|
-
|
-
|
11
|
22
|
|
Spondias mombin
|
11
|
11
|
-
|
67
|
33
|
67
|
|
Sterculia rhinopetala
|
67
|
-
|
-
|
-
|
-
|
11
|
|
Trichilia heudelotii
|
55
|
11
|
-
|
11
|
33
|
67
|
|
Trichilia prieuriana
|
55
|
-
|
-
|
-
|
-
|
11
|
|
Cedrela odorata
|
22
|
-
|
-
|
-
|
-
|
-
|
|
Cola reticulata
|
22
|
-
|
-
|
-
|
-
|
-
|
|
Diospyros canaliculata
|
22
|
-
|
-
|
-
|
-
|
-
|
|
Funtumia africana
|
33
|
11
|
-
|
-
|
-
|
-
|
|
Lankesteria brevior
|
33
|
11
|
-
|
-
|
-
|
-
|
|
Leptonychia pubescens
|
67
|
11
|
-
|
-
|
-
|
-
|
|
Mansonia altissima
|
67
|
11
|
-
|
-
|
-
|
-
|
|
Monodora tenuifolia
|
22
|
11
|
-
|
-
|
-
|
-
|
|
Nesogordonia papaverifera
|
100
|
33
|
11
|
-
|
-
|
-
|
|
Strombosia pustulata
|
22
|
-
|
-
|
-
|
-
|
-
|
|
Tetrapleura tetraptera
|
22
|
-
|
-
|
-
|
-
|
-
|
|
Ficus sur
|
-
|
-
|
22
|
11
|
11
|
11
|
|
Ficus thonningii
|
-
|
-
|
-
|
-
|
-
|
11
|
|
Morinda lucida
|
-
|
22
|
-
|
-
|
-
|
22
|
|
Pterygota macrocarpa
|
-
|
-
|
-
|
-
|
-
|
11
|
|
Rauvolvia vomitoria
|
-
|
11
|
-
|
-
|
11
|
22
|
|
Rothmannia longiflora
|
-
|
-
|
-
|
-
|
-
|
11
|
|
Spathodea campanulata
|
-
|
-
|
-
|
-
|
-
|
11
|
|
Tragia chevalleri
|
-
|
-
|
-
|
-
|
-
|
11
|
CHAPITRE IV : DISCUSSION
L'étude de la distribution des espèces
végétales au sein des fragments forestiers, des jachères
et des plantations de cacaoyers a fait ressortir 387 espèces dans notre
zone d'étude. Il y a 5 ans, l'OIBT (2004) évaluait la flore de la
même zone à 367 espèces, soit une marge de 20
espèces. La présence des espèces caractéristiques
des zones forestières : Triplochiton scleroxylon, Mansonia
altissima et des zones de savane : Borassus aethiopum et
Imperata cylindrica (DEVINEAU, 1984) dans les milieux anthropisés
et dans les fragments forestiers, justifie la situation à cheval du
Département d'Oumé sur la zone forestière et la zone
savanicole. Les fragments forestiers sont dominés par les Rubiaceae,
tandis que les plantations et les jachères montrent une flore plus
représentée en Euphorbiaceae. Le nombre d'espèces des
Euphorbiaceae devient de plus en plus important dans les plantations au fur et
à mesure que celles-ci vieillissent. Cette observation est conforme
à celle de VROH BI (2008) dans les plantations de bananier dans la
région de Dabou. Ces résultats montrent que les Euphorbiaceae
s'adaptent le plus aux milieux anthropisés.
Dans le Département d'Oumé tout comme à
Monogaga dans le Département de SanPédro (ADOU YAO et N'GUESSAN,
2006) et à Lamto (KOULIBALY, 2008), les paysans dans les
premières années de plantation, laissent un nombre important
d'arbustes de 10 à 40 cm de circonférence après le
défrichement de la forêt. C'est ce qui traduit le nombre
élevé d'espèces dans les plantations très jeunes de
1an. Les paysans appliquent cette technique culturale pour protéger les
jeunes plants de cacaoyers contre les rayonnements solaires.
Dans les plantations de Lamto, le nombre des espèces
augmente de la première à la troisième année de
plantation puis se stabilise (KOULIBALY, 2008). Cette observation est contraire
aux plantations d'Oumé où le nombre d'espèces diminue de
la première à la cinquième année. Cela est dû
à un entretien régulier des plantations et à une
intensification des pieds de cacaoyers.
L'influence de la cacaoculture se ressent le plus dans les
plantations âgées où nous constatons une diminution du
nombre d'espèces ligneuses à partir de la sixième
année de plantation. Cela s'explique par la coupe de certaines
espèces naturelles dans le but de réduire la compétition
nutritionnelle avec les cacaoyers et augmenter la production de leurs
plantations. Les paysans ne protègent que les espèces naturelles
à vertus alimentaires : Spondias mombin, Ricinodendron
heudelotii, Irvingia gabonensis et médicinales :
Alstonia boonei, Rauvolfia vomitoria, Morinda
lucida. Cette pratique agricole est totalement opposée à
celle employée au Cameroun où les paysans maintiennent les
cacaoyers sous des ligneux dans
toutes les classes d'âge de plantation (SONWA et
al., 2000). L'absence des activités humaines dans les
jachères favorise l'augmentation progressive du nombre des
espèces.
Les types biologiques nous ont permis de constater la
dégradation des fragments de forêt et des milieux
anthropisés à travers la dominance des microphanérophytes
arbustifs dans les fragments de forêt, les jachères et les
plantations. KOKOU et CABALLE (2002 ; 2005) ont fait la même observation
dans les îlots forestiers et les jachères au Togo. L'étude
de la structure verticale et horizontale de la végétation de ces
milieux confirme leur perturbation. La strate des fragments de forêt est
constituée principalement d'arbrisseaux et d'arbustes de petites
circonférences, ce qui entraîne une basse strate fermée.
Cette observation est contraire aux forêts tropicales avec une basse
strate dégagée (BAMBA, 2004). Les forts recouvrements de la basse
strate des fragments forestiers du Département d'Oumé traduisent
une dégradation sous l'influence des actions humaines. La même
configuration structurale s'observe dans les jachères dominées
par les arbustes et les petits arbres, traduisant un peuplement perturbé
en pleine reconstitution. Contrairement aux fragments forestiers et aux
jachères, et à l'exception des plantations de 1 à 5 ans,
l'activité agricole fait son effet sur la flore naturelle dans les
plantations jeunes et âgées de 6 à 40 ans. Il n'existe
pratiquement pas d'espèces ligneuses dans ces plantations.
L'analyse de correspondance et la classification ascendante
nous ont permis de constater une différence entre la composition
floristique des fragments forestiers et les milieux sous influence agricole qui
sont les plantations âgées et les jachères. La composition
floristique des plantations de 1 à 5 ans est presque similaire aux
fragments de forêt ; cela indique une conservation de
l'écosystème forestier dans les premières années de
plantation. Par contre cet écosystème est plus
dégradé dans les plantations de 6 à 20 ans.
Au niveau de la régénération, nous
observons la perturbation des fragments forestiers où la recolonisation
est très importante, dominée par les espèces de
lumière telles que Nesogordonia papaverifera, Antiaris
toxicaria var. africana, Albizia adianthifolia. Les
jachères ayant pendant longtemps subies les effets de l'agriculture,
favorisent l'implantation des espèces de forêt secondaire du type
semi-décidue dont les plus abondantes sont Antiaris toxicaria
var. africana et Mallotus oppositifolius avec une
fréquence de 100 p.c. La régénération
amorcée dans les plantations de 1 à 5 ans est très
tôt freinée dans les plantations de 6 à 40 ans sous
l'influence des actions mécaniques des paysans (coupes,
déracinements) plus accentuées et de la fermeture de la
canopée des cacaoyers.
Pour échapper à la destruction de leurs
plantations par les exploitants forestiers, les paysans empêchent la
régénération des espèces d'exploitations
forestières, telles que
Nesogordonia papaverifera et Mansonia
altissima. Cela entraîne l'absence de ces espèces dans les
milieux post-culturaux.
CONCLUSION
La présente étude a permis de suivre et de
comprendre l'impact de la création des plantations de cacaoyers sur la
flore et la végétation dans le Département d'Oumé.
Les techniques culturales basées sur le défrichement, l'abattage
et les cultures sur brûlis, causent principalement la dégradation
de la biodiversité de l'écosystème forestier original.
Dans les plantations très jeunes de 1 à 5 ans, la
diversité floristique reste relativement élevée. Lorsque
les plantations vieillissent, cette diversité baisse de façon
drastique suite à des destructions massives des ressources naturelles.
Nos résultats confirment donc bien que lorsque l'agriculture se pratique
de façon traditionnelle, c'est-à-dire à la machette et
à la daba, elle maintient de la diversité dans les
premières années de plantation.
Les pratiques culturales utilisées dans les plantations
n'offrent pas de place pour la conservation de la biodiversité dans les
milieux post-culturaux. Les différentes méthodes utilisées
pour l'inventaire ont montré que, le cortège floristique des
jachères s'est appauvri par rapport aux milieux naturels. Nous avons
recensé dans les jachères 143 espèces contre 224 dans les
fragments forestiers soit une perte de 91 espèces.
Les activités agricoles transforment la composition
floristique des fragments forestiers ; la preuve en est que les Rubiaceae et
les Apocynaceae dominantes dans ces fragments forestiers se font rares dans les
milieux anthropisés. Ce sont plutôt les Euphorbiaceae et les
Poaceae qui caractérisent les plantations et les jachères. Les
arbres étant en grande majorité détruits par les paysans,
la végétation est marquée par la prédominance de la
strate arbustive. L'importance des espèces de brousse secondaire dans
les jachères : Ficus exasperata, Albizia zygia, Albizia
adianthifolia, traduit une forme de reconstitution progressive vers des
forêts secondaires
L'influence humaine s'observe également dans les
fragments de forêt par la présence de Ricinodendron
heudelotii, de Spondias mombin et de Elaeis guineensis
qui sont toutes des espèces de milieu secondaire. L'étude de la
dynamique structurale des peuplements confirme bien la perturbation de ces
îlots forestiers avec une structure plus représentée en
strate arbustive. Ceci correspond à une basse strate fermée, donc
en pleine reconstitution selon HIEN (1998).
Les coupes et les déracinements réguliers
effectués dans les plantations agissent négativement sur la flore
de cette localité. Ainsi pour répondre à toutes nos
questions de recherche, il serait intéressant d'étendre cette
étude dans toute la région d'Oumé. D'autres études
plus approfondies pourraient porter sur une évaluation du potentiel
germinatif des
semences dans le sol des plantations ; puis également sur
une comparaison quantitative des semences du sol et des rejets de souches et de
racines dans la recolonisation des jachères.
Fort de toutes les conséquences de la perturbation du
milieu naturel sous l'influence de la cacaoculture, il serait toutefois
souhaitable de formuler quelques recommandations allant dans le sens de la
protection et de la conservation de la biodiversité de ce
Département. Sur ce, nous nous adressons :
> à la SODEFOR et au Ministère de
l'environnement d'encourager les paysans à préserver les
espèces d'exploitations forestiers dans les plantations, et de se
procurer des quelques îlots forestiers ruraux encore existants pour une
gestion plus durable.
> Aux législateurs de voter des lois strictes
interdisant aux exploitants forestiers l'abatage des ligneux dans les
plantations.
> Aux institutions de recherche d'approfondir des
études associant la conservation de la biodiversité et de la
sécurisation des ressources naturelles, à l'augmentation de la
production des plantations des paysans.
RÉFÉRENCES BIBLIOGRAPHIQUES
ADOU C. Y. & N'GUESSAN K. E., 2006.
Diversité floristique spontanée des plantations de Café et
de Cacao dans la Forêt Classée de Monogaga, Côte d'Ivoire.
Schweiz. Z. Forstwes. 157. 2 : pp. 31-36.
AKÉ ASSI L., 1984. Flore de la
Côte d'Ivoire : Etude descriptive et biogéographique, avec
quelques notes ethnobotaniques. Tome I, II, III. Thèse Doct. Es-Sc. Nat.
F.A.S.T., Université de Cocody, Abidjan, 1205 p.
AKÉ ASSI L., 1998. Impact de
l'exploitation forestière et du développement agricole sur la
conservation de la biodiversité biologique en Côte d'Ivoire.
Le flamboyant N° 46 Déc. : pp. 20-21.
AKÉ ASSI L., 2001. Flore de la Côte
d'Ivoire 1 : catalogue systématique, biogéographique et
écologique. Conservatoire et Jard. Bot., Genève, Switzerland,
Boissera 57, 396 p
AKÉ ASSI L., 2002. Flore de la Côte
d'Ivoire 2 : catalogue systématique, biogéographique et
écologique. Conservatoire et Jard. Bot., Genève, Switzerland,
Boissera 58, 401 p.
AMAN S., 1996. Rapport de la mission de
consultance dans le domaine de l'agroforesterie et les systèmes de
cultures vivrières conduite dans la région d'Abengourou. Projet
de stabilisation des systèmes de production agricole dans la
région Centre-Est (PROSTAB). MINAGRA, ANADER/GTZ, Abidjan. 16 p.
AUBREVILLE A., 1958. A la recherche de la
forêt de Côte d'Ivoire. Bois Forêt Trop. 57 : pp.
16-84.
AUBREVILLE A. & KEAY R. W. J., 1959.
Vegetation map of Africa south of the Tropic of Cancer. Oxford, Oxford
University Press.
BAMBA I., 2004. Etude de deux grands fragments
forestiers, entre Zagné et Taï, au Sud-Ouest de la Côte
d'Ivoire. Mémoire de D.E.A. Université de Cocody, Abidjan, 57
p.
BNETD., 2005. Bilan de la
politique forestière en Côte d'Ivoire et proposition
d'orientations, de principes et de règles de fonctionnement du secteur.
Rapport de projet, BNETD, Abidjan.
CHATELAIN C., DAO H., GAUTIER L. & SPICHIGER
R., (2004). Forest cover changes in Côte d'Ivoire and Upper
Guinea. in:. In POORTER L. B., KOUAME N'. F. ; HAWTHORNE W. D (ed),
Biodiversity of West Africa Forests, an Ecological Atlas of Woody plants
Species, Cabi publishing, Cambridge (UK), pp. 15-32.
CHEVALIER A., 1948. Biogéographie de la
forêt dense ombrophile de la Côte d'Ivoire. Rev. Bot.
Appl. Agr. Trop., Tome 28, numéros 305-306 : pp. 101-115.
CLEMENT J., 1970. Rapport d'activité de
la station d'expérimentation forestière d'Oumé de 1965
à 1969. C.T.F.T. -CI, Abidjan, 93 p.
DEVINEAU J. L., 1982. Étude
pondérale des litières d'arbres dans deux types de forêts
tropophiles des régions de Ouango-Fitini et de Lamto (Côte
d'Ivoire). 36 p.
DEVINEAU J. L., 1984. Structure et Dynamique de
quelques forêts tropophiles de l'Ouest Africain (Côte d'Ivoire).
Thèse de Doct. Etat. Université de Paris VI. 294 p.
DUGUMA B., GOCTOWSKI J. & BAKALA J. 2001.
Smallholder cacao (Theobroma cacao Linn.) cultivation in agroforestery
systems of West and Central Africa: challenges and opportunities. Agroforestry
Systems.
FAO., 2003. Atelier FAO/EC LNV/GTZ sur la
gestion des forêts tropicales secondaires en Afrique.
FAO., 2004. Données agricoles de FAOSTAT,
consulté le 22 avril 2004. Disponible sur
http://faostat.fao.org/faostat/collections.subset=agriculture&language=FR
GIRARD G., SIRCOULON J., & TOUCHEBEUF P.,
1971. Aperçu sur les régimes hydrologiques. Dans :
AVENARD J-M., ADJANOHOUN E., ELDIN M., GIRARD G.,
GUILLAUMET J. M., PERRAUD A., SIRCOULON J., TOUCHEBEUF P. (eds.) : Le
milieu naturel de la Côte d'Ivoire, Mémoire O.R.S.T.O.M., N°.
50, 1971, 1 Vol., 391 p.
GNAHOUA M. G. M., 1996. Visite d'étude
sur l'agroforesterie, Côte d'Ivoire ; Étude de cas :
Agroforesterie en zone subhumide d'Oumé. pp.16 - 27.
GNIMA E., 2002. Analyse de la production de
cacao-fèves dans les essais agroforestiers d'Oumé. Mémoire
de B.T.S. Agricole, Ecole Régionale d'agriculture du Sud, Abidjan, 42
p.
GOUNOT M., 1969. Méthode d'étude
quantitative de la végétation. Masson, Paris 314 p.
GUILLAUMET J. L. & ADJANOHOUN E., 1971.
La végétation de la Côte d'Ivoire. Dans : AVENARD
J-M., ADJANOHOUN E., ELDIN M., GIRARD G.,
GUILLAUMET J. M., PERRAUD A., SIRCOULON J., TOUCHEBEUF P. (eds.) : Le
milieu naturel de la Côte d'Ivoire, Mémoire O.R.S.T.O.M., N°.
50, 1971, 1 Vol., 391 p.
HERZOG F. & BACHMANN M., 1992. Les arbres
d'ombrage et leur utilisation dans les plantations de café et de cacao
dans le Sud du V-Baoulé, Côte d'Ivoire, Schweitz Z. Farstwes : pp.
149-165.
HIEN G., 1998. Etude de la répartition
de Burkea africana Hook. dans la Forêt Classée de Nazinon (Burkina
Faso). Mémoire de D.E.A, Sciences Biologiques Appliquées,
Université de Ouagadougou, FA. S.T. / I.N.E.R.A. ; 85 p.
KOKOU K. & CABALLÉ G., 2005.
Climbers in forest fragments in Togo. pp.107-120. In Forest Liana of West
Africa: diversity, ecology and management. Bongers, F. / Parren, M.P.E. /
Traoré, D. (eds.) CABI Publishing, Oxford, UK, 288 pp. ISBN
085199914X.
KOKOU K., COUTERON P., MARTIN A., & CABALLE G.,
2002. Taxonomy diversity of lianas and vines in forest fragments of
southern Togo. Rev. Ecol (Terre Vie) 57 : pp. 3-18.
KOUAME N'. F., 1998. Influence de l'exploitation
forestière sur la végétation et la flore de la forêt
classée du Haut-Sassandra (Centre-Ouest de la Côte d'Ivoire).
Thèse 3è cycle.Univ. Abidjan, 227 p.
KOUASSI K. E., 2007. Flore de la Forêt
Classée de la Haute DODO, dans le Sud-Ouest de la Côte d'Ivoire.
Etude de quelques de espèces commercialisées : Cas de Garcinia
afzelii (Clusiaceae), des Rotins (Palmiers Lianes) des Genres Calamus,
Eremospatha et Laccosperma (Araceae), Université de
Cocody, Abidjan, 279 p.
KOULIBALY A., 2008. Caractéristiques
de la végétation et dynamique de la
régénération, sous l'influence de l'utilisation des
terres, dans des mosaïques Forêts-Savanes, des régions de la
Réserve de Lamto et du Parc National de la Comoé, en Côte
d'Ivoire. Thèse de l'Université de Cocody. 452 p.
LAMOTTE M., 1962. Initiation aux méthodes
statistique en Biologie. Lie Masson, Paris, 144 p.
LECOMTE P., 1990. Place et intégration de
l'arbre dans l'exploitation agricole ivoirienne du CentreOuest. Mémoire
C.N.E.A.R.C., Montpellier, France, 108 p.
LLOYD A.H., ARMBRUSTER W.S. & EDWARDS M.E.,
1994. Ecology of a steppe-tundra gradient in interior Alaska.
Journal of Vegetation Science 5. pp. 897-912.
MANYONG V.M., SMITH J., WEBER G.K., JAGTAP S.S. &
OYEWOLE B., 1996. Macro-characterization of agricultural systems in
West Africa: an overview. RCMD Monograph no 21. Ibadan IITA.
MONNIER Y., 1983. Hydrologie,
végétation, les sols. In : Jeune Afrique, Atlas de la
Côte d'Ivoire., deuxième édition. pp. 10-21.
OIBT, 2004. Etude de la composition floristique
et de la combustibilité des jachères, friches et savanes autour
des forêts classées de la Téné et de la Soungourou.
87 p.
RAUNKIAER C., 1934. The life form of plants and
statistical plant geography. Clarendon press, Oxford. 632 p.
SHNELL R., 1971. La phytogéographie des
pays tropicaux : les milieux, les groupements végétaux.
Gauthier-Villars, Paris 447 p.
SOME N.A., 1996. Les systèmes
écologiques post-culturaux de la zone soudanienne (Burkina Faso).
Structure spatio-temporelle des communautés végétales et
évolution des caractères pédologiques.
Thèse de Doctorat, Université Pierre et Marie Curie, Paris 6,
France, 212 p.
SONWA D.J., WEISE S. F. , NDOYE O.
& JANSSENS M. J.J., 2003. Dacryodes edulis, a neglected
non-timber forest species for the agroforestry system of West and Central
Africa. Forest trees and livelihoods, 12: pp. 41-45.
SONWA D.J., WEISE S.F., TCHATAT M., NKONGMENECK A.B.,
ADESINA A., NDOYE O. & GOCKOWSKI J., 2000. Les agroforêts
cacao : espace intégrant développement de la cacaoculture,
gestion et conservation des ressources forestières au Sud-Cameroun.
Paper presented at the second Pan African Symposium on The sustainable use of
Natural resources in Africa. Ouagadougou, Burkina Faso, pp. 24-27 . July
2000.
SONWA D.J., WEISE S. F., TCHATAT M., NKONGMENECK B.A.,
ADESINA A.A., NDOYE O. & GOCKWOSKI J., 2001. The
role of cocoa agroforests in rural and community forestry in southern Cameroon.
RDFN Paper. 25 : pp. 1 - 10.
SØRENSEN, T.A., 1948. A method of
establishing groups of equal amplitude in plant sociology based on similarity
of species content, and its application to analyses of the vegetation on Danish
commons. Kongelige Danske Videnskabernes Selskabs Biologiske Skrifter,
5. pp.1-34.
TUKEY J.W., 1977. Exploratory Data Analysis.
Addison. Wesley, Reading, Mass.
VROH BI T.A., 2008. Comparaison de la
composition floristique des plantations de bananas et des jachères de
différents âges à celle d'une forêt naturelle
résiduelle, dans le Région de Dabou. Mémoire de D.E.A.
Université de Cocody-Abidjan. U.F.R Biosciences.49 p.
YAMEOGO G., BOUSSIM J., TRAORE D., 2001.
Étude diagnostique de la flore de jachères d'âges
différents dans le terroir de Thiougou (Burkina Faso). Sci. Tech.
25 (1), pp. 72-90.
ANNEXE 1 : Flore des fragments forestiers et des milieux
anthropisés dans la région d'Oumé.
|
N° Espèces
|
Familles
|
Types
biomorph.
|
Forêts
|
Jachères.
|
Plant.
|
|
1 Abrus precatorius L.
|
Fabaceae
|
Lmp
|
-
|
-
|
x
|
|
2 Acacia pennata (L.) Willd.
|
Mimosaceae
|
LmP
|
x
|
x
|
x
|
|
3 Acalypha ciliata Forsk.
|
Euphorbiaceae
|
np
|
x
|
x
|
x
|
|
4 Adansonia digitata L.
|
Bombacaceae
|
MP
|
-
|
-
|
x
|
|
5 Adenia lobata (Jacq.) Engl.
|
Passifloraceae
|
mp
|
x
|
x
|
x
|
|
6 Adiantum vogelii Mett. ex Keys.
|
Adiantaceae
|
Th
|
-
|
-
|
x
|
|
7 Aframomum sceptrum (Oliv. & Hanb.) K.Schum.
|
Zingiberaceae
|
np
|
x
|
-
|
-
|
|
8 Afzelia bella Harms
|
Caesalpiniaceae
|
mP
|
x
|
-
|
-
|
|
9 Agelaea trifolia (Lam) Gilg
|
Connaraceae
|
Lmp
|
x
|
-
|
-
|
|
10 Ageratum conyzoides L.
|
Asteraceae
|
Th
|
-
|
-
|
x
|
|
11 Aidia genipiflora (DC.) Dandy
|
Rubiaceae
|
mp
|
x
|
-
|
x
|
|
12 Alafia whytei Stapf
|
Apocynaceae
|
Lmp
|
x
|
-
|
x
|
|
13 Albizia adianthifolia (Schum.) W. F. Wight
|
Mimosaceae
|
mP
|
x
|
x
|
x
|
|
14 Albizia ferruginea (Guil. & Perr.) Benth.
|
Mimosaceae
|
mP
|
x
|
x
|
x
|
|
15 Albizia zygia (DC.)J. F. Macbr.
|
Mimosaceae
|
mP
|
x
|
x
|
x
|
|
16 Alchornea cordifolia (Schum. & Thonn.) Mull.
Arg.
|
Euphorbiaceae
|
mp
|
x
|
x
|
x
|
|
17 Allophylus africanus P. Beauv.
|
Sapindaceae
|
mp
|
x
|
x
|
x
|
|
18 Alstonia boonei De Wild.
|
Apocynaceae
|
MP
|
x
|
x
|
-
|
|
19 Amorphophallus johnsonii N.E. Br.
|
Araceae
|
Gt
|
x
|
-
|
-
|
|
20 Amphimas pterocarpoides Harms
|
Fabaceae
|
mP
|
x
|
x
|
x
|
|
21 Ananas comosus Mill
|
Bromeliaceae
|
Gr
|
-
|
x
|
x
|
|
22 Anchomanes difformis (Bl.) Engl. var.
difformis
|
Araceae
|
Gt
|
x
|
-
|
x
|
|
23 Aneilema beniniensis (P. Beauv.) Kunth
|
Commelinaceae
|
Ch
|
x
|
x
|
x
|
|
24 Annickia polycarpa Setten & Maas
|
Annonaceae
|
mp
|
x
|
-
|
x
|
|
25 Antiaris toxicaria var africana (Engl) C. C;
Berg
|
Moraceae
|
mP
|
x
|
x
|
x
|
|
26 Antrocaryon micraster (Pierre) A.Chev. &
Guill.
|
Anacardiaceae
|
MP
|
x
|
-
|
-
|
|
27 Aphania senegalensis (Poir.) Radlk.
|
Sapindaceae
|
mp
|
x
|
-
|
-
|
|
28 Aristolochia abyssinica L.
|
Aristolochiaceae
|
Lmp
|
x
|
-
|
-
|
|
29 Aristolochia macrophylla L.
|
Aristolochiaceae
|
Lmp
|
x
|
-
|
-
|
|
30 Artabotrys insignis Engl. & Diels
|
Annonaceae
|
Lmp
|
x
|
-
|
-
|
|
31 Artabotrys jollyanus Pierre ex Engl. E Diels
|
Annonaceae
|
Lmp
|
-
|
-
|
x
|
|
32 Asystasia gangetica (L.) T. Anderson
|
Acanthaceae
|
np
|
-
|
x
|
x
|
|
33 Atroxima liberica Stapf.
|
Polygalaceae
|
np
|
-
|
-
|
x
|
|
34 Azadirachta indica A.Juss.
|
Meliaceae
|
mP
|
-
|
x
|
-
|
|
35 Baissea multiflora A. DC.
|
Apocynaceae
|
LmP
|
-
|
-
|
x
|
|
36 Baissea zygodioides (K.Schum.) Stapf.
|
Apocynaceae
|
Lmp
|
-
|
x
|
-
|
|
37 Baphia bancoensis Aubrév.
|
Fabaceae
|
mp
|
x
|
x
|
x
|
|
38 Baphia nitida Lodd.
|
Fabaceae
|
mp
|
x
|
x
|
x
|
|
39 Belonophora hypoglauca (Hiern) A.Chev.
|
Rubiaceae
|
mp
|
x
|
-
|
-
|
|
40 Bequaertia mucronata (Exell) R. Wilczek
|
Hippocrateaceae
|
Lmp
|
x
|
-
|
-
|
|
41 Bersama abyssinica Fresen
|
Melianthaceae
|
mp
|
x
|
-
|
-
|
|
42 Bidens pilosa L.
|
Asteraceae
|
Th
|
-
|
-
|
x
|
|
43 Blighia sapida Koenig
|
Sapindaceae
|
mP
|
x
|
x
|
x
|
|
44 Blighia unijugata Bak.
|
Sapindaceae
|
mP
|
x
|
x
|
x
|
|
45 Blighia welwitschii (Hiern) Radlk.
|
Sapindaceae
|
mP
|
x
|
-
|
x
|
|
46 Boerhavia diffusa L.
|
Nyctaginaceae
|
np
|
-
|
-
|
x
|
|
47 Bombax buonopozense P. Beauv.
|
Bombacaceae
|
MP
|
x
|
x
|
x
|
|
48 Borassus aethiopum Mart.
|
Arecaceae
|
MP
|
x
|
-
|
-
|
Légende : X : présence dans le
milieu correspondant - : absence dans le milieu correspondant
|
N°
|
Espèces
|
Familles
|
|
49
|
Brachiaria deflexa (Schum.) Robyns
|
Poaceae
|
|
50
|
Brachiaria lata (Schum.) C.E. Hubb.
|
Poaceae
|
|
51
|
Bridelia grandis Hutch.
|
Euphorbiaceae
|
|
52
|
Bridelia micrantha (Hochst.) Baill
|
Euphorbiaceae
|
|
53
|
Bryophyllum pinnatum (Lam.) Oken
|
Crassulaceae
|
|
54
|
Buchholzia coriacea Engl.
|
Capparidaceae
|
|
55
|
Bussea occidentalis Hutch.
|
Caesalpiniaceae
|
|
56
|
Caloncoba echinata (Oliv.) Gilg
|
Flacourtiaceae
|
|
57
|
Caloncoba gilgiana (Sprague) Gilg.
|
Flacourtiaceae
|
|
58
|
Campylospermum flavum Sch. & Thonn. ex Stapf
|
Ochnaceae
|
|
59
|
Canthium venezyssima Gaertn.
|
Rubiaceae
|
|
60
|
Capsicum annuum L.
|
Solanaceae
|
|
61
|
Capsicum frutescensL.
|
Solanaceae
|
|
62
|
Carica papaya L.
|
Caricaceae
|
|
63
|
Carpolobia lutea G.Don
|
Polygalaceae
|
|
64
|
Cassia siamea (Lam) H.S. Irwin &B arneby
|
Caesalpiniaceae
|
|
65
|
Cassia hirsuta L.
|
Caesalpiniaceae
|
|
66
|
Cedrela odorata L.
|
Meliaceae
|
|
67
|
Ceiba pentandra (L.) Gaertn.
|
Bombacaceae
|
|
68
|
Celosia trigyna L.
|
Amaranthaceae
|
|
69
|
Celtis adolfi-friderici Engl.
|
Ulmaceae
|
|
70
|
Celtis mildbraedii Engl.
|
Ulmaceae
|
|
71
|
Celtis philippensis Blanco
|
Ulmaceae
|
|
72
|
Celtis zenkeri Engl.
|
Ulmaceae
|
|
73
|
Centrosema pubescens Benth
|
Fabaceae
|
|
74
|
Chaetachme aristata E. Mey. Ex Planch
|
Ulmaceae
|
|
75
|
Chassalia kolly Benth
|
Rubiaceae
|
|
76
|
Chromolaena odorata (L.) King & H. Rob.
|
Asteraceae
|
|
77
|
Chrysophyllum giganteum A. Chev.
|
Sapotaceae
|
|
78
|
Chrysophyllum perpulchrum Hutch. & Dalz.
|
Sapotaceae
|
|
79
|
Chrysophyllum pruniforme Pierre & Engl.
|
Sapotaceae
|
|
80
|
Chrysophyllum welwitschii Engl
|
Sapotaceae
|
|
81
|
Chytranthus carneus Radlk.
|
Sapotaceae
|
|
82
|
Chytranthus talbotii (Baker) Keay
|
Sapotaceae
|
|
83
|
Cissus aralioides (Welw. Ex Bak.) Planch.
|
Vitaceae
|
|
84
|
Cissus producta Afzel.
|
Vitaceae
|
|
85
|
Cissus quadrangularis L
|
Vitaceae
|
|
86
|
Cissus rotundifolia (Forssk.) Vahl
|
Vitaceae
|
|
87
|
Citrus reticulata L.
|
Rutaceae
|
|
88
|
Citrus sinensis (L.) Osb.
|
Rutaceae
|
|
89
|
Clerodendrum buchholzii Henriq.
|
Verbenaceae
|
|
90
|
Clerodendrum volubile P. Beauv
|
Verbenaceae
|
|
91
|
Cnestis ferruginea Vahl ex DC.
|
Connaraceae
|
|
92
|
Coccinea batteri (Hook. F.) Keay
|
Curcubitaceae
|
|
93
|
Coffea ebracteolata (Hiern) brenan
|
Rubiaceae
|
|
94
|
Coffea liberica Bull. ex Hiern
|
Rubiaceae
|
|
95
|
Cola caricaefolia (G. Don) K. Schum.
|
Sterculiaceae
|
|
96
|
Cola gigantea A. Chev.
|
Sterculiaceae
|
|
97
|
Cola heterophylla (P.Beauv.) Scott & Endl. A.
|
Sterculiaceae
|
|
98
|
Cola nitida (Vent.) Schott & Endl.
|
Sterculiaceae
|
|
99
|
Cola reticulata K.Schum.
|
Sterculiaceae
|
Types
biomorph. Forêts Jachères Plant.
Th - - x
Th - - x
MP x x -
mp - x -
np - - x
mp - - -
mP x - -
mp x - x
mp x - x
mp x - -
mp x - -
np - - x
np - x x
mp - - x
np x - -
mp - x -
np - - -
MP x x x
MP x x x
Th - - x
mP - - -
mP x - x
mp x - -
mP x x x
Lmp - x x
mp x - x
np - - x
np x x x
MP x - -
mP x - -
mp - - x
mp x - -
mp x - -
mP x - x
Lmp x x x
Lmp x x -
Lmp x - -
Lmp - x -
mp - - x
mp - x x
np - - x
Lmp - - x
Lmp x x x
Lnp x - -
np x - -
mp x x x
mp x x x
mP x x x
mp x - -
mP - - x
mp x - -
|
N° Espèces
|
Familles
|
Types
biomorph.
|
Forêts
|
Jachères.
|
Plant.
|
|
100 Colocasia esculenta Schott.
|
Araceae
|
np
|
-
|
x
|
x
|
|
101 Combretum glutinosum Perr. ex DC
|
Combretaceae
|
Lmp
|
-
|
x
|
-
|
|
102 Combretum grandiflorum G. Don
|
Combretaceae
|
Lmp
|
x
|
-
|
-
|
|
103 Combretum paniculatum Vent.
|
Combretaceae
|
Lmp
|
-
|
x
|
x
|
|
104 Combretum racemosum P. Beauv.
|
Combretaceae
|
Lmp
|
-
|
x
|
x
|
|
105 Commelina benghalensis L.
|
Commelinaceae
|
Ch
|
-
|
x
|
x
|
|
106 Conyza floribunda Kunth
|
Asteraceae
|
Th
|
-
|
-
|
x
|
|
107 Conyza sumatrensis (Retz.)E.Walker
|
Asteraceae
|
Th
|
-
|
-
|
x
|
|
108 Cordia platythyrsa Bak.
|
Boraginaceae
|
MP
|
x
|
-
|
x
|
|
109 Cordia vignei Hutch. & Dalziel
|
Boraginaceae
|
mp
|
-
|
-
|
-
|
|
110 Corynanthe pachyceras K. Schum.
|
Rubiaceae
|
mP
|
x
|
-
|
x
|
|
111 Costus afer Ker-Gawl.
|
Zingiberaceae
|
np
|
x
|
-
|
x
|
|
112 Crescentia cujete L.
|
Bignoniaceae
|
np
|
-
|
-
|
x
|
|
113 Crossostemma laurifolium Planch. ex benth.
|
Passifloraceae
|
Lmp
|
-
|
-
|
x
|
|
114 Croton hirtus L'Hérit.
|
Euphorbiaceae
|
Th
|
-
|
x
|
x
|
|
115 Culcasia barombensis Welw. ex Schott.
|
Araceae
|
LmP
|
x
|
-
|
-
|
|
116 Cyathula prostrata (L.) Blum.
|
Amaranthaceae
|
Th
|
-
|
x
|
x
|
|
117 Cyperus rotundus L.
|
Cyperaceae
|
Gr
|
-
|
-
|
x
|
|
118 Dalbergia oblongifolia G. Don
|
Fabaceae
|
Lmp
|
x
|
-
|
x
|
|
119 Dalbergia saxatilis Hook. f.
|
Fabaceae
|
Lmp
|
-
|
-
|
x
|
|
120 Dalbergiella welwitschii (Baker)Baker f.
|
Fabaceae
|
mp
|
x
|
x
|
x
|
|
121 Daniellia oliveri (Rolfe) Hutch. & Dalziel
|
Caesalpiniaceae
|
mP
|
-
|
-
|
x
|
|
122 Daniellia thurifera Benn.
|
Caesalpiniaceae
|
mP
|
x
|
-
|
-
|
|
123 Deinbollia grandifolia Hook. f.
|
Sapindaceae
|
mp
|
-
|
-
|
x
|
|
124 Deinbollia pinnata (Poir.) Schum. & Thonn
|
Sapindaceae
|
np
|
x
|
x
|
x
|
|
125 Desmodium adscendens (SW.) DC.
|
Fabaceae
|
Ch
|
x
|
x
|
x
|
|
126 Desmodium gangeticum (L.) DC.
|
Fabaceae
|
np
|
-
|
-
|
x
|
|
127 Desmodium triflorum (L.) DC.
|
Fabaceae
|
Ch
|
-
|
-
|
-
|
|
128 Desmodium velutinum (Willd) DC.
|
Fabaceae
|
np
|
-
|
-
|
x
|
|
129 Desplatsia chrysochlamys (Mildbr. & Burr.)
Mildbr.
|
Tiliaceae
|
mp
|
-
|
-
|
x
|
|
130 Desplatsia dewevrei (De Wild.& Th.Durand)
Burret
|
Tiliaceae
|
mp
|
x
|
-
|
-
|
|
131 Detarium senegalense J. F. Gmel.
|
Caesalpiniaceae
|
mP
|
-
|
-
|
x
|
|
132 Dialium dinklagei Harms
|
Caesalpiniaceae
|
mp
|
x
|
-
|
-
|
|
133 Dichapetalum madagascariense Poir.
|
Dichapetalaceae
|
Lmp
|
x
|
-
|
-
|
|
134 Dichapetalum toxicarium (G.Don) Baill.
|
Dichapetalaceae
|
Lmp
|
x
|
-
|
-
|
|
135 Dictyandra arborescens Hook. f.
|
Rubiaceae
|
mp
|
x
|
-
|
x
|
|
136 Digitaria horizontalis Willd.
|
Poaceae
|
Th
|
-
|
-
|
x
|
|
137 Dioclea reflexa Hook. f.
|
Fabaceae
|
mP
|
-
|
-
|
x
|
|
138 Diodia rubricosa Hiern.
|
Rubiaceae
|
Ch
|
-
|
-
|
x
|
|
139 Dioscorea alata L.
|
Dioscoreaceae
|
Gt
|
-
|
-
|
x
|
|
140 Dioscorea bulbifera (A.Chev.) Summerh.
|
Dioscoreaceae
|
Gt
|
-
|
-
|
x
|
|
141 Dioscorea cayenensis Lam.
|
Dioscoreaceae
|
Gt
|
-
|
-
|
x
|
|
142 Dioscorea minutiflora Engl.
|
Dioscoreaceae
|
Gt
|
x
|
x
|
x
|
|
143 Diospyros canaliculata De Wild.
|
Ebenaceae
|
mp
|
x
|
-
|
-
|
|
144 Diospyros ferrea (Willd.) Bakh.
|
Ebenaceae
|
mp
|
x
|
-
|
-
|
|
145 Diospyros monbuttensis Gurke
|
Ebenaceae
|
mp
|
x
|
-
|
x
|
|
146 Diospyros soubreana F. White
|
Ebenaceae
|
mp
|
x
|
-
|
-
|
|
147 Diospyros vignei F. White
|
Ebenaceae
|
mP
|
x
|
-
|
x
|
|
148 Diospyros viridicans Hiern
|
Ebenaceae
|
mP
|
x
|
-
|
x
|
|
149 Discoglypremna caloneura (Pax) Prain
|
Euphorbiaceae
|
mP
|
x
|
-
|
-
|
|
150 Distemonanthus benthamianus Baill.
|
Caesalpiniaceae
|
MP
|
x
|
-
|
-
|
|
151 Dorstenia kameruniana Engl.
|
Moraceae
|
np
|
x
|
-
|
-
|
Familles Types
N° Espèces biomorph. Forêts
Jachères Plant.
152 Dracaena mannii Bak. Dracaenaceae mP x - -
153 Dracaena ovata Ker-Grawl. Dracaenaceae np x
- -
154 Drypetes chevalieri Beille Euphorbiaceae mp - - -
155 Drypetes gilgiana (Pax) pax & Hoffm.
Euphorbiaceae mp x - -
156 Duboscia viridiflora (K. Schum.) Mildbr. Tiliaceae
mP x - -
157 Elaeis guineensis Jacq. Arecaceae mP x - x
158 Elaeophorbia grandifolia (Haw.) Croizat
Euphorbiaceae mP - - x
159 Emilia sonchifolia (L.) DC. Asteraceae Th - - -
160 Englerophytum oblanceolatum (S.Moore) Sapotaceae mP
x - -
161 Entandrophragma angolensis (Welw.) C. DC. Meliaceae
MP x - x
162 Entandrophragma candollei Harms Meliaceae MP x -
-
163 Entandrophragma cylindricum (Sprague) Sprague
Meliaceae MP - - x
164 Eragrostis tenella var. tenella (L.) Roem.
& Schult. Poaceae Th - x -
165 Eribroma oblongum (Mast.) Germain Sterculiaceae MP x
- -
166 Erythrina mildbraedii Harms Fabaceae mP x - -
167 Erythroxylum mannii Oliv. Erythroxylaceae mP x -
-
168 Euadenia trifoliolata (Schum. & Thonn.) Oliv
Capparidaceae mp - x x
169 Eugenia salacioides Laws. Ex Hutch. & Dalz
Myrtaceae mp x - -
170 Euphorbia heterophylla L. Euphorbiaceae Ch - x x
171 Euphorbia hirta L. Euphorbiaceae Ch - x X
172 Ficus bongouanouensisWarb. Moraceae mP - x -
173 Ficus exasperata Vahl Moraceae mp x x x
174 Ficus mucuso Ficalho Moraceae mP x x x
175 Ficus recurvata De Wild. Moraceae mP - x x
176 Ficus sagittifolia Warb. ex Milbr. & Burret
Moraceae mp (Ep) - - x
177 Ficus sur Forssk. Moraceae mp - x x
178 Ficus thonningii Blume Moraceae mp x x -
179 Flabellaria paniculata Cav. Malpighiaceae Lmp - x
-
180 Funtumia africana (Benth.) Stapf Apocynaceae mP x x
x
181 Garcinia afzelii Engl. Clusiaceae mp - - x
182 Garcinia kola Heckel Clusiaceae mP - - -
183 Geophila obvallata (Schum.) F.Didr. Rubiaceae Ch x x
x
184 Gloriosa superba L. Liliaceae Gb - - x
185 Glyphaea brevis (Spring.) Monachino Tiliaceae mp x x
x
186 Grewia carpinifolia Juss. Tiliaceae Lmp x - x
187 Griffonia simplicifolia (Vahl ex DC.) Baill.
Caesalpiniaceae Lmp x x x
188 Guarea cedrata (A.Chev.) Pellegr. Meliaceae MP x -
x
189 Guibourtia ehie (A. Chev.) Léonard
Caesalpiniaceae MP x - x
190 Harrisonia abyssinica Oliv. Simaroubaceae Lmp x -
x
191 Hippocratea myriantha Oliv. Hippocrateaceae LMP - -
x
192 Holarrhena floribunda (G. Don) Dur & Schinz
Apocynaceae mP x x x
193 Holoptelea grandis (Hutch.) Mildbr. Lamiaceae MP x -
-
194 Homalium molle Stapf Flacourtiaceae mp x - -
195 Hoslundia opposita Vahl Lamiaceae np - x x
196 Hugonia afzelii R. Br. Ex Planchon Linaceae Lmp - -
x
197 Hugonia planchonii Hook.f. Linaceae Lmp - - -
198 Hunteria eburnea Pichon Apocynaceae mp x - -
199 Hypselodelphys violacea (Ridl.) Milne-Redh
Marantaceae Lmp x - -
200 Idertia morsonii (Hutch. & Dalziel) Farron
Ochnaceae np x - -
201 Imperata cylindrica (L.) Raeusch. Poaceae Gr - x
-
202 Iodes liberica Stapf. Icacinaceae Lmp x - -
203 Ipomoea batatas (L.) Lam Convolvulaceae Lnp - - x
Familles Types
N° Espèces biomorph. Forêts
Jachères Plant.
204 Ipomoea mauritiana Jacq. Convolvulaceae Lmp x x x
205 Irvingia gabonensis (O'Rorke) Baill. Irvingiaceae MP
x - x
206 Isolona campanulata Engl. & Diels Annonaceae mp
- - -
207 Keetia venosa (Oliv.) Bridson Rubiaceae mp x - -
208 Khaya ivorensis A. Chev. Meliaceae MP x x -
209 Kigelia africana (Lam.) Benth. Bignoniaceae mp x -
-
210 Klainedoxa gabonensis Pierre ex Engl. Irvingiaceae
MP x - x
211 Landolphia hirsuta (Hua) Pichon Apocynaceae Lmp x -
-
212 Landolphia incerta (Schumann) Persoon Apocynaceae
Lmp x - -
213 Landolphia mannii (Stapf.) Pierre Apocynaceae Lmp -
- x
214 Lankesteria brevior C. B. Cl. Acanthaceae np x -
x
215 Lannea nigritana (Sc. Elliot) Keay Anacardiaceae mp
x x x
216 Lannea welwitschii (Hiern) Engl. Anacardiaceae mP x
x x
217 Lantana camara L. Verbenaceae np - - x
218 Laportea aestuans (L.) Chew Urticaceae Th - - -
219 Lasiodiscus fasciculiflorus Engl. Rhamnaceae mp x -
-
220 Lecaniodiscus cupaniopides Planch Sapindaceae mp x x
x
221 Leptaspis cochleata Thwaites Poaceae np x - -
222 Leptoderris brachyptera (Benth.) Dunn Fabaceae Lmp -
x x
223 Leptonychia pubescens Keay Sterculiaceae mp x - x
224 Lindackeria dentata (Oliv.) Gilg Flacourtiaceae mp x
x x
225 Lomariopsis guineensis (Underw.)Alston
Lomariopsidaceae Ep x - -
226 Majidea fosteri (Sprague) Radlk. Sapindaceae mP x -
-
227 Mallotus oppositifolius (Geisel.) Mull. Arg.
Euphorbiaceae mp x x x
228 Mangifera indica L. Anacardiaceae mp - x
x
229 Manihot esculenta Crantz Euphorbiaceae np - x x
230 Manihot glaziovii Mull.Arg. Euphorbiaceae np - x
-
231 Manikara obovata Aubrev. Sapotaceae mP - - x
232 Mansonia altissima (A. Chev) A. Chev Sterculiaceae
MP x - x
233 Marantochloa congensis (K.Schum.) leonard &
Muller Marantaceae np - - -
234 Marantochloa leucantha (K.Schum.)Milne-Redh
Marantaceae np x x x
235 Mareya micrantha (Benth.) Muell. Arg. Euphorbiaceae
mp x x x
236 Margaritaria discoidea (Baill.) Webster
Euphorbiaceae mp - x x
237 Megaphrynium macrotachyum (Benth) Milne-Redhead
Marantaceae np x - -
238 Memecylon memecyloides L. Melastomataceae mp - -
-
239 Mezoneuron benthamianum Baill. Caesalpiniaceae mp -
x x
240 Microdesmis keayana Léonard Pandaceae mp x -
x
241 Milicia excelsa (Welw.) C. C Berg Moraceae MP x x
x
242 Millettia lane-poolei Dunn Fabaceae mp x - -
243 Millettia zechiana Harms Fabaceae mp x x x
244 Momordica charantia L. Curcubitaceae Lnp - - x
245 Momordica cissoides Benth. Curcubitaceae Lnp - -
x
246 Momordica grandifolia L. Curcubitaceae Lmp - x -
247 Monodora teniufolia Benth. Annonaceae mp x - x
248 Morinda longiflora G.Don Rubiaceae Lmp - - x
249 Morinda lucida Benth. Rubiaceae mp x x x
250 Morinda morindoides (Bak.)Milne-Redh. Rubiaceae Lmp
- x x
251 Morus mesozygia Stapf Moraceae mP x x x
252 Motandra guineensis (Thonn.) A.DC. Apocynaceae Lmp x
x x
253 Mucuna cordata Adans Fabaceae Lmp - x -
254 Mucuna pruriens (L.) DC. Fabaceae Th - x x
Familles Types
N° Espèces biomorph. Forêts
Jachères. Plant.
255 Musa paradisiaca L. Musaceae mp - x x
256 Mussaenda erythrophylla Schunach. & Thonn.
Rubiaceae Lmp x - -
257 Myrianthus arboreus P. Beauv. Moraceae mp x x x
258 Napoleonaea vogelii (Hook. f.) Planch.
Lecythidaceae mp x - x
259 Nephrolepis biserrata (Sw.) Schott Davalliaceae Ep -
x x
260 Nesogordonia papaverifera (A. Chev.) R Capuron
Sterculiaceae MP x x x
261 Neuropeltis acuminata (P.Beauv.) Benth.
Convolvulaceae LMP x x x
262 Neuropeltis prevosteoides Mangenot Convolvulaceae
LMP - - x
263 Newbouldia laevis (P. Beauv.) Seem. Bignoniaceae MP
x x x
264 Octhocosmus africanus Hook.f. Ixonanthaceae mP x -
x
265 Olax gambecola Baill. Olacaceae np x - -
266 Olyra latifolia L. Poaceae np x x x
267 Oncinotis pontyi Dubard Apocynaceae np x - -
268 Ongokea gore (Hua) Pierre Olacaceae mP x - x
269 Oplismenus burmannii (Retz.) P. Beauv. Poaceae Ch -
x -
270 Oplismenus hirtellus (L.) P. Beauv. Poaceae
Ch x x x
271 Oricia suavuolens (Engl.) Verdoorn Rutaceae mp x -
x
272 Oxyanthus pallidus Hiern Rubiaceae np x - -
273 Oxyanthus subpunctatus (Hiern) Keay Rubiaceae np x -
x
274 Oxyanthus unilocularis Hiern Rubiaceae mp x - x
275 Panicum maximum Jacq. Poaceae Th - x x
276 Parinari excelsa Sabine Chrysobalanaceae MP x - -
277 Paspalum conjugatum Berg. Poaceae Th - - x
278 Paspalum laeve Michx Poaceae Th - - x
279 Passiflora foetida L. Passifloraceae Lmp - - x
280 Paullinia pinnata L. Sapindaceae Lmp x x x
281 Pavetta corymbosa (DC.)F.N.Williams Rubiaceae mp - -
-
282 Penianthus zenkeri Hutch & Dalziel
Menispermaceae np - - x
283 Pergularia daemia (Forssk.) Chiov. Asclepiadaceae mp
- x x
284 Persea americana Mill. Lauraceae mp - - x
285 Periploca nigrescens Afzel. Apocynaceae Lmp x x x
286 Phyllanthus amarus Schum. & Thonn. Euphorbiaceae
Th - - x
287 Phyllanthus muellerianus (O. Ktze.) Exell
Euphorbiaceae np x - x
288 Phyllanthus niruroides Muell. Arg. Euphorbiaceae hnp
x - x
289 Physalis micrantha Link. Solanaceae Th - - -
290 Piptadenistrum africanum (Hook. f.) Brenan
Mimosaceae MP x x x
291 Polyalthia oliveri Engl. Annonaceae mp x - -
292 Pouteria altissima (A. Chev.) Baer. Sapotaceae MP x
- x
293 Pouzolzia guineensis Benth Urticaceae Ch - x x
294 Pseudospondias microcarpa (A.Rich.) Engl
Anacardiaceae mP x - -
295 Psidium guajava L. Myrtaceae mp - x x
296 Psychotria psychotrioides (DC.) Rogerty Rubiaceae mp
x - -
297 Psydrax subcordata (DC.) Bridson Rubiaceae mp x -
x
298 Pterygota macrocarpa Schumann Sterculiaceae MP x x
x
299 Pycnanthus angolensis (Baill.) Warb Myristicaceae MP
x x x
300 Pyrenacantha cordicula Villiers Icacinaceae Lnp x -
x
301 Rauvolvia vomitoria Afzel. Apocynaceae mp - x x
302 Rhigiocarya racemifera Miers Menispermaceae Lmp - -
x
303 Ricinodendron heudelotii (Baill.) Pierre ex Heckel
Euphorbiaceae mP x - x
304 Rinorea ilicifolia (Oliv.) O. Kuntze. Violaceae np x
- -
305 Rinorea oblongifolia (C. H. Wright) Chipp Violaceae
mp x - -
306 Rinorea subintegrifolia (P. Beauv.) O. Kuntze.
Violaceae mp x - -
|
N° Espèces
|
Familles
|
Types biomorph.
|
Forêts
|
Jachères
|
Plant.
|
|
307 Ritchiea capparoides (Andr.) Britten
|
Capparidaceae
|
Lmp
|
-
|
-
|
x
|
|
308 Rothmannia longiflora Salisb.
|
Rubiaceae
|
mp
|
x
|
x
|
x
|
|
309 Rottboellia exaltata L.f.
|
Poaceae
|
Th
|
-
|
x
|
x
|
|
310 Rourea coccinea (Schum.) Benth.
|
Connaraceae
|
Lmp
|
x
|
x
|
x
|
|
311 Ruthalicia longipes (Hook. F.) Jeffrey
|
Curcubitaceae
|
Lmp
|
-
|
x
|
x
|
|
312 Rytigynia canthioides (Benth.) Robyns
|
Rubiaceae
|
mp
|
x
|
-
|
-
|
|
313 Salacia baumannii Loes
|
Hippocrateaceae
|
Lmp
|
-
|
-
|
v
|
|
314 Salacia erecta (G.Don) Walp.
|
Hippocrateaceae
|
Lmp
|
-
|
-
|
x
|
|
315 Salacia nitida (Benth.) N.E.Br.
|
Hippocrateaceae
|
Lmp
|
x
|
-
|
x
|
|
316 Samanea dinklagei (Harms) Keay.
|
Mimosaceae
|
mP
|
x
|
-
|
-
|
|
317 Sansevieria liberica Ger. & Labr
|
Agavaceae
|
Gr
|
-
|
-
|
-
|
|
318 Sarcophrynium brachystachyum (Benth.) K. Schum.
|
Marantaceae
|
np
|
x
|
-
|
-
|
|
319 Scottellia klaineana Pierre
|
Flacourtiaceae
|
MP
|
x
|
x
|
-
|
|
320 Secamone afzelii (Schultes) K. Schum.
|
Asclepiadaceae
|
Lmp
|
x
|
x
|
x
|
|
321 Setaria barbata (Lam.) Kunth
|
Poaceae
|
Th
|
-
|
-
|
x
|
|
322 Sida acuta Brurm. f.
|
Malvaceae
|
np
|
-
|
x
|
x
|
|
323 Smeathmannia pubescens Soland. ex R. Br.
|
Passifloraceae
|
mp
|
x
|
-
|
x
|
|
324 Solanum americanum Mill.
|
Solanaceae
|
hnp
|
-
|
-
|
x
|
|
325 Solanum anomalum Thonn.
|
Solanaceae
|
mp
|
-
|
-
|
x
|
|
326 Solanum erianthum D. Don
|
Solanaceae
|
mp
|
x
|
x
|
X
|
|
327 Solanum rugosum Dunal
|
Solanaceae
|
mp
|
-
|
-
|
x
|
|
328 Solanum torvum Sw.
|
Solanaceae
|
np
|
-
|
-
|
x
|
|
329 Sorghum arundinaceum (Desv.) Stapf
|
Poaceae
|
Th
|
-
|
x
|
x
|
|
330 Spathodea campanulata P. Beauv.
|
Bignoniaceae
|
mp
|
x
|
x
|
x
|
|
331 Sphenocentrum jollyanum Pierre
|
Menispermaceae
|
np
|
x
|
x
|
x
|
|
332 Spigelia anthelmia L.
|
Loganiaceae
|
Th
|
-
|
-
|
x
|
|
333 Spondianthus preussii Engl.
|
Euphorbiaceae
|
mP
|
-
|
-
|
x
|
|
334 Spondias mombin L.
|
Anacardiaceae
|
mp
|
x
|
x
|
x
|
|
335 Sporobolus pyramidalis P. Beauv.
|
Poaceae
|
Th
|
-
|
-
|
x
|
|
336 Sterculia rhinopetala K. Schum.
|
Sterculiaceae
|
MP
|
x
|
x
|
x
|
|
337 Sterculia tragacantha Lindl.
|
Sterculiaceae
|
mP
|
x
|
x
|
x
|
|
338 Streblus usambasrensis (Engl.) Berg
|
Moraceae
|
np
|
x
|
-
|
-
|
|
339 Streptogyna crinita P.Beauv.
|
Poaceae
|
Gr
|
x
|
-
|
x
|
|
340 Strombosia pustulata Olv. (Léonard)
villers
|
Olacaceae
|
mp
|
x
|
-
|
-
|
|
341 Strophanthus gratus (Hook.) Franch.
|
Apocynaceae
|
Lmp
|
-
|
-
|
x
|
|
342 Strophanthus hispidus DC.
|
Apocynaceae
|
Lmp
|
-
|
-
|
x
|
|
343 Strychnos afzelii Gilg
|
Loganiaceae
|
LMP
|
x
|
-
|
x
|
|
344 Strychnos johnsonii Huntch. & M. B. Moss
|
Loganiaceae
|
LmP
|
x
|
-
|
-
|
|
345 Synedrella nodiflora Gaertn.
|
Asteraceae
|
Th
|
-
|
x
|
x
|
|
346 Tabernaemontana crassa Benth.
|
Apocynaceae
|
mp
|
-
|
x
|
-
|
|
347 Talinum triangulare (Jacq.) Willd.
|
Portulacaceae
|
Th
|
-
|
x
|
x
|
|
348 Tamarindus indica L.
|
Caesalpiniaceae
|
mp
|
-
|
-
|
x
|
|
349 Teclea verdoorniana Exell & Mendoçon
|
Rutaceae
|
mp
|
x
|
-
|
-
|
|
350 Tectona grandis L. F.
|
Verbenaceae
|
mp
|
-
|
-
|
x
|
|
351 Terminalia ivorensis A. Chev.
|
Combretaceae
|
MP
|
-
|
-
|
-
|
|
352 Terminalia superba Engl. & Diels
|
Combretaceae
|
MP
|
x
|
x
|
x
|
|
353 Tetracera alnifolia Willd.
|
Dilleniaceae
|
LmP
|
-
|
x
|
-
|
|
354 Tetrapleura tetraptera (Schum. & Thonn.) Taub
|
Mimosaceae
|
mP
|
x
|
x
|
-
|
|
355 Thalia welwitschii (L.) Ridl.
|
Marantaceae
|
np
|
-
|
-
|
x
|
|
356 Thaumatococcus danielii (Bennet) Benth.
|
Marantaceae
|
Gr
|
x
|
-
|
x
|
|
357 Theobroma cacao L.
|
Sterculiaceae
|
mp
|
-
|
x
|
x
|
|
N° Espèces
|
Familles
|
Types biomorph.
|
Forêts
|
Jachères
|
Plant.
|
|
358 Thonningia sanguinea Vahl
|
Balanophoraceae
|
Gb
|
-
|
x
|
-
|
|
359 Tiliacora dinklagei Engl.
|
Menispermaceae
|
LMP
|
x
|
-
|
x
|
|
360 Tragia chevalleri Beille
|
Euphorbiaceae
|
Lnp
|
-
|
-
|
x
|
|
361 Treculia africana Decne
|
Moraceae
|
mP
|
x
|
-
|
x
|
|
362 Trema orientalis (L.) Blume
|
Ulmaceae
|
mp
|
x
|
x
|
x
|
|
363 Trichilia heudelotii Planch. ex. Oliv.
|
Meliaceae
|
mp
|
x
|
x
|
x
|
|
364 Trichilia martineaui Aubrév. &
Pellegr.
|
Meliaceae
|
MP
|
x
|
-
|
-
|
|
365 Trichilia prieureana A. Juss.
|
Meliaceae
|
mp
|
x
|
x
|
x
|
|
366 Triclisia dictyophylla Diels
|
Menispermaceae
|
LmP
|
-
|
-
|
x
|
|
367 Triclisia subcordata Oliv.
|
Menispermaceae
|
mp
|
-
|
-
|
x
|
|
368 Tridax procumbens L.
|
Asteraceae
|
Ch
|
-
|
-
|
x
|
|
369 Trilepisium madagascariensis DC.
|
Moraceae
|
mP
|
x
|
-
|
x
|
|
370 Triplochiton scleroxylon n K. Schum.
|
Sterculiaceae
|
MP
|
x
|
-
|
x
|
|
371 Turraea heterophylla J. Sm.
|
Meliaceae
|
np
|
x
|
x
|
x
|
|
372 Urera occidentalis Letouzey
|
Urticaceae
|
Lnp
|
x
|
-
|
-
|
|
373 Uvaria afzelii Sc.Elliot
|
Annonaceae
|
Lmp
|
x
|
-
|
-
|
|
374 Uvariodendron occidentale Le Thomas
|
Annonaceae
|
mp
|
x
|
-
|
-
|
|
375 Uvariopsis congensis Robyns & Ghesq.
|
Urticaceae
|
mp
|
x
|
-
|
-
|
|
376 Ventilago africana Exell
|
Rhamnaceae
|
LMP
|
x
|
-
|
x
|
|
377 Vitex fosteri C. H. Wright
|
Verbenaceae
|
mp
|
-
|
-
|
x
|
|
378 Vitex grandifolia Gurke
|
Verbenaceae
|
mp
|
-
|
-
|
x
|
|
379 Vitex rivularis Gurke
|
Verbenaceae
|
mp
|
x
|
-
|
-
|
|
380 Wissadula amplissima (L.) R. E. Fries
|
Malvaceae
|
np
|
x
|
-
|
-
|
|
381 Xylopia aethiopica (Dun.) A. Rich.
|
Annonaceae
|
mP
|
-
|
-
|
-
|
|
382 Xylopia parvifolia (A. Rich.) Benth.
|
Urticaceae
|
mp
|
x
|
-
|
-
|
|
383 Xylopia villosa Chipp
|
Annonaceae
|
mP
|
x
|
-
|
x
|
|
384 Zanthoxylum gilletii (De Wild.) P.G. Waterman
|
Rutaceae
|
mP
|
x
|
-
|
-
|
|
385 Zanthoxylum parvifolium A. Chev. ex Keay
|
Rutaceae
|
mp
|
x
|
-
|
-
|
|
386 Zanthoxylum rubescens Hook.f.
|
Rutaceae
|
mp
|
x
|
-
|
-
|
|
387 Zanthoxylum zantoxyloides (Lam.) Zep. &
Timber
|
Rutaceae
|
mP
|
-
|
-
|
x
|
ANNEXE 2 : INDEX ALPHABÉTIQUE DES TAXONS
CITÉS
|
Taxons
A
Abrus precatorius L. (Fabaceae)
Acacia pennata (L.) Willd. (Mimosaceae)
Acalypha ciliata Forsk. (Euphobiaceae)
Adansonia digitata L. (Bombacaceae)
Adenia lobata (Jacq.) Engl. (Passifloraceae)
Adiantum vogelii Mett. ex Keys. (Adiantaceae)
Aframomum sceptrum (Oliv. & Hanb.) K.Schum
(Zingiberaceae)
Afzelia bella Harms (Caesalpiniaceae)
Agelaea trifolia (Lam) Gilg (Connaraceae)
Ageratum conizoides L. (Asteraceae)
Aidia genipiflora (DC.) Dandy (Rubiaceae)
Alafia whytei Stapf (Apocynaceae)
Albizia adianthifolia (Schum.) W. F. Wight (Mimosaceae)
Albizia ferruginea (Guil. & Perr.) Benth.
(Mimosaceae)
Albizia zygia (DC.)J. F. Macbr. (Mimosaceae)
Alchornea cordifolia (Schum. & Thonn.) Mull. Arg.
(Euphorbiaceae)
Allophylus africanus P. Beauv. (Sapindaceae)
Alstonia boonei De Wild. (Apocynaceae)
Amorphophallus johnsonii N.E. Br. (Araceae)
Amphimas pterocarpoides Harms (Fabaceae)
Ananas comosus Mill (Bromeliaceae)
Anchomanes difformis (Bl.) Engl. (Asteraceae)
Anchomanes welwitschii Rendle (Araceae)
Aneilema beniniensis (P. Beauv.) Kunth (Commelinaceae)
Annickia polycarpa Setten & Maas (Annonaceae)
Antiaris toxicaria var africana (Engl) C. C;
Berg (Moraceae)
Antrocaryon micraster (Pierre) A.Chev. & Guill.
(Anacardiaceae)
Aphania senegalensis (Poir.) Radlk. (Sapindaceae)
Aristolochia abyssinica L. (Aristolochiaceae)
Aristolochia macrophylla L. (Aristolochiaceae)
Artabotrys insignis Engl. & Diels (Annonaceae)
Artabotrys jollyanus Pierre ex Engl. E Diels
(Annonaceae)
Asystasia gangetica (L.) T. Anderson (Acanthaceae)
Atroxima liberica Stapf. (Polygaceae)
Azadirachta indica A.Juss. (Meliaceae)
B
Baissea multiflora A. DC. (Apocynaceae)
Baissea zygodioides (K.Schum.) Stapf. (Apocynaceae)
Baphia bancoensis Aubrév. (Fabaceae)
Baphia nitida Lodd. (Fabaceae)
Belonophora hypoglauca (Hiern) A.Chev. (Rubiaceae)
Bequaertia mucronata (Exell) R. Wilczek
(Hippocrateaceae)
Bersama abyssinica Fresen (Melianthaceae)
Bidens pilosa L. (Asteraceae)
Blighia sapida Koenig (Sapindaceae)
Blighia unijugata Bak. (Sapindaceae)
Blighia welwitschii (Hiern) Radlk. (Sapindaceae)
Boerhavia diffusa L. (Nyctaginaceae)
Bombax buonopozense P. Beauv. (Bombacaceae)
Borassus aethiopum Mart. (Araceae)
|
17,
|
17,
23,
|
27,
25,
|
28,
27,
|
30, 17, 23, 28,
17,
17,
12,
|
Pages
37 37 37 37 37 37
37 37 37 37 37 37
32, 37
37
28, 37 15 , 37 17, 37
29, 37 37 37 37 37 37 37
37
30, 37 37 37 37 37 37
37 37 37 37
37
37
37
17,
37
37
37
37
37
28,
37
28, 37
37
37
28,
37
28, 38
|
|
Taxons
Brachiaria deflexa (Schum.) Robyns (Poaceae)
Brachiaria lata (Schum.) C.E. Hubb. (Poaceae)
Bridelia grandis Hutch. (Euphorbiaceae)
Bridelia micrantha (Hochst.) Baill (Euphorbiaceae)
Bryophyllum pinnatum (Lam.) Oken (Crassulaceae)
Buchholzia coriacea Engl. (Capparidaceae)
Bussea occidentalis Hutch. (Caesalpiniaceae)
C
Caloncoba echinata (Oliv.) Gilg (Flacourtiaceae)
Caloncoba gilgiana (Sprague) Gilg. (Flacourtiaceae)
Campylospermum flavum Sch. & Thonn. ex Stapf
(Ochnaceae)
Canthium venezyssima Gaertn. (Rubiaceae)
Capsicum annuum L. (Solanaceae)
Capsicum frutescens L. (Solanaceae)
Carica papaya L. (Caricaceae)
Carpolobia lutea G.Don (Polygalaceae)
Cassia hirsuta L. (Caesalpiniaceae)
Cassia siamea (Lam) H.S. Irwin &B arneby
(Caeslpiniaceae)
Cedrela odorata L. (Meliaceae)
Ceiba pentandra (L.) Gaertn. (Bombacaceae)
Celosia trigyna L. (Amaranthaceae)
Celtis adolfi-friderici Engl. (Ulmaceae)
Celtis mildbraedii Engl. (Ulmaceae)
Celtis philippensis Blanco (Ulmaceae)
Celtis zenkeri Engl. (Ulmaceae)
Centrosema pubescens Benth (Fabaceae)
Chaetachme aristata E. Mey. ex Planch (Ulmaceae)
Chassalia kolly Benth (Rubiaceae)
Chromolaena odorata (L.)King & H. Rob. (Asteraceae)
Chrysophyllum giganteum A. Chev. (Sapotaceae)
Chrysophyllum perpulchrum Hutch. & Dalz.
(Sapotaceae)
Chrysophyllum pruniforme Pierre & Engl. (Sapotaceae)
Chrysophyllum welwitschii Engl.(Sapotaceae)
Chytranthus carneus Radlk. (Sapindaceae)
Chytranthus talbotii (Baker) Keay (Sapindaceae)
Cissus aralioides Welw. ex Bak.) Planch. (Vitaceae)
Cissus producta Afzel. (Vitaceae)
Cissus quadrangularis L. (Vitaceae)
Cissus roduntifolia (Forssk.) Vahl (Vitaceae)
Citrus reticulata L. (Rutaceae)
Citrus sinensis (L.) Osb. (Rutaceae)
Clerodendrum buchholzii Henriq.(Verbenaceae)
Clerodendrum volubile P. Beauv (Verbenaceae)
Cnestis ferruginea Vahl ex DC. (Connaraceae)
Coccinea barteri (Hook. f.) Keay (Curcubitaceae)
Coffea canephora A. Froehner (Rutaceae)
Coffea ebracteolata (Hiern) brenan (Rubiaceae)
Coffea liberica Bull. ex Hiern (Rubiaceae)
Cola caricaefolia (G. Don) K. Schum. (Sterculiaceae)
Cola gigantea A. Chev. (Sterculiaceae)
Cola heterophylla (P.Beauv.) Scott & Endl. A.
(Sterculiaceae)
Cola nitida (Vent.) Schott & Endl. (Sterculiaceae)
Cola reticulata K.Schum. (Sterculiaceae)
|
17,
|
25,
|
7,
27,
|
Pages
38
38
31,
38
38
38
38
38
38
38
38
38
38
38
38
38
38
38
28,
38
28, 38
38
38
17, 38
38
28, 38
38
38
38
7,
38
38
38
38
38
38
38
38
38
38
38
38
38
38
38
38
38
9;
38
38
38
38
28, 38
38
21, 38
28, 38
|
|
Taxons
Colocasia esculenta Schott. (Araceae)
Combretum glutinosum Perr. ex DC (Combretaceae)
Combretum grandiflorum G. Don (Combretaceae)
Combretum paniculatum Vent. (Combretaceae)
Combretum racemosum P. Beauv. (Combretaceae)
Commelina benghalensis L. (Commelinaceae)
Conyza floribunda Kunth (Asteraceae)
Conyza sumatrensis (Retz.) E.Walker (Asteraceae)
Cordia platythyrsa Bak. (Boraginaceae)
Cordia vignei Hutch. & Dalziel (Boraginaceae)
Corynanthe pachyceras K. Schum. (Rubiaceae)
Costus afer Ker-Gawl. (Zingiberaceae)
Crescentia cujete L. (Bignoniaceae)
Crossostemma laurifolium Planch. ex benth.
(Passifloraceae)
Croton hirtus L'Hérit. (Euphorbiaceae)
Culcasia barombensis N. E. Br.( (Araceae)
Cyathula prostrata (L.) Blum. (Amaranthaceae)
Cyperus rotundus L. (Cyperaceae)
D
Dalbergia oblongifolia G. Don (Fabaceae)
Dalbergia saxatilis Hook. f. (Fabaceae)
Dalbergiella welwitschii (Baker)Baker f. (Fabaceae)
Daniellia oliveri (Rolfe) Hutch. & Dalziel
(Caesalpiniaceae)
Daniellia thurifera Benn. (Caesalpiniaceae)
Deinbollia grandifolia Hook. f. (Sapindaceae)
Deinbollia pinnata (Poir.) Schum. & Thonn
(Sapindaceae)
Desmodium adscendens (SW.) DC. (Fabaceae)
Desmodium gangeticum (L.) DC. (Fabaceae)
Desmodium triflorum (L.) DC. (Fabaceae)
Desmodium velutinum (Willd) DC. (Fabaceae)
Desplatsia chrysochlamys (Mildbr. & Burr.) Mildbr.
(Tiliaceae)
Desplatsia dewevrei (De Wild.& Th.Durand) Burret
(Tiliaceae)
Detarium senegalense J. F. Gmel. (Caesalpiniaceae)
Dialium dinklagei Harms (Caesalpiniaceae)
Dichapetalum madagascariense Poir. (Dichapetalaceae)
Dichapetalum toxicarium (G.Don) Baill. (Dichapetalaceae)
Dictyandra arborescens Hook. f. (Rubiaceae)
Digitaria horizontalis Willd. (Poaceae)
Dioclea reflexa Hook. f. (Fabaceae)
Diodia rubricosa Hiern. (Rubiaceae)
Dioscorea alata L. (Dioscoreaceae)
Dioscorea bulbifera (A.Chev.) Summerh. (Dioscoreaceae)
Dioscorea cayenensis Lam. (Dioscoreaceae)
Dioscorea minutiflora Engl. (Dioscoreaceae)
Diospyros canaliculata De Wild. (Ebenaceae)
Diospyros ferrea (Willd.) Bakh. (Ebenaceae)
Diospyros monbuttensis Gurke (Ebenaceae)
Diospyros soubreana F. white (Ebenaceae)
Diospyros vignei F. White (Ebenaceae)
Diospyros viridicans Hiern (Ebenaceae)
Discoglypremna caloneura (Pax) Prain (Euphorbiaceae)
Distemonanthus benthamianus Baill. (Caesalpiniaceae)
Dorstenia kameruniana Engl. (Moraceae)
|
17,
|
Pages
..9, 39 39 39 39 39 39 39
39 39 39 39 39 39
39 39 39 39 39
39
39
39
21; 39 39 39
28, 39 39 39 39 39
39 39 39 39 39 39 39 39
39 39 39 39 39 39
28, 39 39 39 39 39 39
39 39 39
|
|
Taxons
Dracaena mannii Bak. (Dracaenaceae)
Dracaena ovata Ker-Grawl. (Dracaenaceae)
Drypetes chevalieri Beille (Euphorbiaceae)
Drypetes gilgiana (Pax) pax & Hoffm. (Euphorbiaceae)
Duboscia viridiflora (K. Schum.) Mildbr. (Tiliaceae)
E
Elaeis guineensis Jacq. (Arecaceae)
Elaeophorbia grandifolia (Haw.) Croizat (Euphorbiaceae)
Emilia sonchifolia (L.) DC. (Asteraceae)
Englerophytum oblanceolatum (S.Moore) (Sapotaceae)
Entandrophragma angolensis (Welw.) C. DC. (Meliaceae)
Entandrophragma candollei Harms (Meliaceae)
Entandrophragma cylindricum (Sprague) Sprague
(Meliaceae)
Eragrostis tenella (L.) Roem. & Schult. (Poaceae)
Eribroma oblongum (Mast.) Pierre ex Germain
(Sterculiaceae)
Erythrina mildbraedii Harms (Fabaceae)
Erythroxylum mannii Oliv. (Erythroxylaceae)
Euadenia trifoliolata (Schum. & Thonn.) Oliv
(Capparidaceae)
Eugenia salacioides Laws. ex Hutch. & Dalz
(Myrtaceae)
Euphorbia heterophylla L. (Euphorbiaceae)
Euphorbia hirta L. (Euphorbiaceae)
F
Ficus bongouanouensis Warb. (Moraceae)
Ficus exasperata Vahl (Moraceae)
Ficus recurvata De Wild. (Moraceae)
Ficus mucuso Ficalho (Moraceae)
Ficus sagittifolia Warb. ex Milbr. Et Burret (Moraceae)
Ficus sur Forssk. (Moraceae)
Ficus thonningii Blume (Moraceae)
Flabellaria paniculata Cav. (Malpighiaceae)
Funtumia africana (Benth.)Stapf (Apocynaceae)
G
Garcinia afzelii Engl. (Clusiaceae)
Garcinia kola Heckel (Clusiaceae)
Geophila obvallata (Schum.)F.Didr. (Rubiaceae)
Gloriosa superba L. (Liliaceae)
Glyphaea brevis (Spring.) Monachino (Tiliaceae)
Gmelina arborea Roxb (Verbenaceae)
Grewia carpinifolia Juss. (Tiliaceae)
Griffonia simplicifolia (Vahl ex DC.) Baill.
(Caesalpiniaceae)
Guarea cedrata (A. Chev.) Pellegr. (Meliaceae)
Guibourtia ehie (A. Chev.) Léonard
(Caesalpiniaceae)
H
Harrisonia abyssinica Oliv. (Simaroubaceae)
Hippocratea myriantha Oliv. (Hippocrateaceae)
Holarrhena floribunda (G. Don) Dur & Schinz
(Apocynaceae)
Holoptelea grandis (Hutch.) Mildbr. (Ulmaceae)
Homalium molle Stapf (Flacourtiaceae)
Hoslundia opposita Vahl (Lamiaceae)
Hugonia afzelii R. Br. ex Planchon (Linaceae)
Hugonia planchonii Hook.f. (Linaceae)
Hunteria eburnea Pichon (Apocynaceae)
Hypselodelphys violacea (Ridl.) Milne-Redh (Marantaceae)
|
17,
|
23,
|
25,
|
27,
17,
|
28,
27,
23,
|
Pages 40 40 40 40 40
32, 40 40 40 40 40 40 40
40 40 40 40 40 40 40 40
40
32, 40
40
17,
40
40
28, 40
28, 40
40
28, 40
40 40 40 40 40 7 40
40 40 40
40
40
28, 40 40 40 40 40 40 40 40
|
|
Taxons
I
Idertia morsonii (Hutch. & Dalziel) Farron
(Ochnaceae)
Imperata cylindrica (L.) Raeusch. (Poaceae)
Iodes liberica Stapf. (Icacinaceae)
Ipomoea batatas (L.) Lam (Convolvulaceae)
Ipomoea mauritiana Jacq. (Convolvulaceae)
Irvingia gabonensis (O'Rorke) Baill. (Irvingiaceae)
Isolona campanulata Engl. & Diels (Annonaceae)
K
Keetia venosa (Oliv.) Bridson (Rubiaceae)
Khaya ivorensis A. Chev. (Meliaceae)
Kigelia africana (Lam.) Benth. (Bignoniaceae)
Klainedoxa gabonensis Pierre ex Engl. (Irvingiaceae)
L
Landolphia hirsuta (Hua) Pichon (Apocynaceae)
Landolphia incerta (Schumann) Persoon (Apocynaceae)
Landolphia mannii (Stapf.) Pierre (Apocynaceae)
Lankesteria brevior C. B. Cl. (Acanthaceae)
Lannea nigritana (Sc. Elliot) Keay (Anacardiaceae)
Lannea welwitschii (Hiern) Engl. (Anacardiaceae)
Lantana camara L. (Verbenaceae)
Laportea aestuans (L.)Chew (Urticaceae)
Lasiodiscus fasciculiflorus Engl. (Rhamnaceae)
Lecaniodiscus cupanioides Planch (Sapindaceae)
Leptaspis cochleata Thwaites (Poaceae)
Leptoderris brachyptera (Benth.) Dunn (Fabaceae)
Leptonychia pubescens Keay (Sterculiaceae)
Lindackeria dentata (Oliv.) Gilg (Flacourtiaceae)
Lomariopsis guineensis (Underw.)Alston
(Lomariopsidaceae)
M
Majidea fosteri (Sprague) Radlk. (Sapindaceae)
Mallotus oppositifolius (Geisel.) Mull. Arg.
(Euphorbiaceae)
Mangifera indica L. (Anacardiaceae)
Manihot esculenta Crantz (Euphorbiaceae)
Manihot glaziovii Mull.Arg.(Euphorbiaceae)
Manilkara obovata Aubrev. (Sapotaceae)
Mansonia altissima (A. Chev) A. Chev (Sterculiaceae)
Marantochloa leucantha (K.Schum.)Milne-Redh
(Marantaceae)
Mareya micrantha (Benth.) Muell. Arg. (Euphorbiaceae)
Margaritaria discoidea (Baill.) Webster (Euphorbiaceae)
Memecylon memecyloides L. (Melastomataceae)
Mezoneuron benthamianum Baill. (Caesalpiniaceae)
Microdesmis keayana Léonard (Pandaceae)
Milicia excelsa (Welw.) C. C Berg (Moraceae)
Millettia lane-poolei Dunn (Fabaceae)
Millettia zechiana Harms (Fabaceae)
Momordica charantia L. (Curcubitaceae)
Momordica cissoides Benth. (Curcubitaceae)
Momordica grandifolia L. (Curcubitaceae)
Monodora tenuifolia Benth. (Annonaceae)
Morinda longiflora G.Don (Rubiaceae)
Morinda lucida Benth. (Rubiaceae)
|
17,
|
25,
17,
|
17,
27,
23,
|
23,
28,
25,
27,
|
23,
27,
28, 17,
29, 28, 28,
|
Pages
40
29, 40
40
40
41
29, 41
41
41 41 41 41
41
41
41
28, 41
41
41
41
41
41
17,
41
41
41
28, 41
41
41
41
30, 41
25, 41 41 41 41
31, 41 41
31, 41 41 41 41 41 41 41
28, 41 41 41 41
28, 41 41
29, 41
|
|
Taxons
Morinda morindoides (Bak.)Milne-Redh. (Rubiaceae)
Morus mesozygia Stapf ( Moraceae)
Motandra guineensis (Thonn.) A.DC. (Apocynaceae)
Mucuna cordata Adans (Fabaceae)
Mucuna pruriens (L.) DC. (Fabaceae)
Musa paradisiaca L. (Musaceae)
Mussaenda erythrophylla Schunach. & Thonn.
(Rubiaceae)
Myrianthus arboreus P. Beauv. (Moraceae)
N
Napoleonaea vogelii (Hook. f.) Planch. (Lecythidaceae)
Nephrolepis biserrata (Sw.) Schott (Davalliaceae)
Nesogordonia papaverifera (A. Chev.) R Capuron
(Sterculiaceae)
Neuropeltis acuminata (P.Beauv.) Benth. (Convolvulaceae)
Neuropeltis prevosteoides Mangenot (Convolvulaceae)
Newbouldia laevis (P. Beauv.) Seem. (Bignoniaceae)
O
Octhocosmus africanus Hook.f. (Ixonanthaceae)
Olax gambecola Baill. (Olacaceae)
Olyra latifolia L. (Poaceae)
Oncinotis pontyi Dubard (Apocynaceae)
Ongokea gore (Hua) Pierre (Olacaceae)
Oplismenus burmannii (Retz.) P. Beauv. (Poaceae)
Oplismenus hirtellus (L.) P. Beauv. (Poaceae)
Oricia suavuolens (Engl.) Verdoorn (Rutaceae)
Oryza sativa L. (Poaceae)
Oxyanthus pallidus Hiern (Rubiaceae)
Oxyanthus subpunctatus (Hiern) Keay (Rubiaceae)
Oxyanthus unilocularis Hiern (Rubiaceae)
P
Panicum maximum Jacq. (Poaceae)
Parinari excelsa Sabine (Chrysobalanaceae)
Paspalum conjugatum Berg. (Poaceae)
Paspalum laeve Michx (Poaceae)
Passiflora foetida L. (Passifloraceae)
Paullinia pinnata L. (Sapindaceae)
Pavetta corymbosa (DC.)F.N.Williams (Rubiaceae)
Penianthus zenkeri Hutch & Dalziel (Menispermaceae)
Pergularia daemia (Forssk.) Chiov. (Asclepiadaceae)
Persea americana Mill. (Lauraceae)
Periploca nigrescens Afzel. (Apocynaceae)
Phyllanthus amarus Schum. & Thonn. (Euphorbiaceae)
Phyllanthus muellerianus (O. Ktze.) Exell
(Euphorbiaceae)
Phyllanthus niruroides Muell. Arg. (Euphorbiaceae)
Physalis micrantha Link. (Solanaceae)
Piptadenistrum africanum (Hook. f.) Brenan (Mimosaceae)
Polyalthia oliveri Engl. (Annonaceae)
Pouteria altissima (A. Chev.) Baehni (Sapotaceae)
Pouzolzia guineensis Benth (Urticaceae)
Pseudospondias microcarpa (A.Rich.) Engl (Anacardiaceae)
Psidium guajava L. (Myrtaceae)
Psychotria psychotrioides (DC.) Rogerty (Rubiaceae)
Psydrax subcordata (DC.) Bridson (Rubiaceae)
Pterygota macrocarpa Schumann (Sterculiaceae)
|
17,
|
23,
|
25,
|
28,
|
30,
17,
|
Pages
41
41
41
41
41
9, 42
42
42
42
42
31, 42
42
42
18, 42
42 42 42 42 42 42 42 42
9, 42 42 42 42
42 42 42 42 42
42 42 42 42 42 42 42
42 42 42 42 42 42 42 42
42 42 42
28, 42
|
|
Taxons
Pycnanthus angolensis Warb. (Myristicaceae)
Pyrenacantha cordicula Villiers (Icacinaceae)
R
Rauvolfia vomitoria Afzel. (Apocynaceae)
Rhigiocarya racemifera Miers (Menispermaceae)
Ricinodendron heudelotii (Baill.) Pierre ex Heckel
(Euphorbiaceae)
Rinorea ilicifolia (Oliv.) O. Kuntze. (Violaceae)
Rinorea oblongifolia (C. H. Wright) Chipp (Violaceae)
Rinorea subintegrifolia (P. Beauv.) O. Kuntze.
(Violaceae)
Ritchiea capparoides (Andr.) Britten (Capparidaceae)
Rothmannia longiflora Salisb. (Rubiaceae)
Rottboellia cochinchinensis (Lour.) W.D. Clayton
(Poaceae)
Rourea coccinea (Schum.) Benth. (Connaraceae)
Ruthalicia longipes (Hook. F.) Jeffrey (Curcubitaceae)
Rytigynia canthioides (Benth.) Robyns (Rubiaceae)
S
Salacia baumannii Loes (Hippocrateaceae)
Salacia erecta (G.Don) Walp. (Hippocrateaceae)
Salacia nitida (Benth.) N.E.Br. (Hippocrateaceae)
Samanea dinklagei (DC.) Merr. (Mimosaceae)
Sansevieria liberica Ger. & Labr (Agavaceae)
Sarcophrynium brachystachyum (Benth.) K. Schum.
(Marantaceae)
Scottellia klaineana Pierre (Flacourtiaceae)
Secamone afzelii (Schultes) K. Schum. (Asclepiadaceae)
Setaria barbata (Lam.) Kunth (Poaceae)
Sida acuta Brurm. f. (Malvaceae)
Smeathmannia pubescens Soland. Ex R. Br.
(Passifloraceae)
Solanum americanum Mill. (Solanaceae)
Solanum anomalum Thonn. (Solanaceae)
Solanum erianthum D. Don (Solanaceae)
Solanum rugosum Dunal (Solanaceae)
Solanum torvum Sw. (Solanaceae)
Sorghum arundinaceum (Desv.) Stapf (Poaceae)
Spathodea campanulata P. Beauv. (Bignoniaceae)
Sphenocentrum jollyanum Pierre (Menispermaceae)
Spigelia anthelmia L. (Loganiaceae)
Spondianthus preussii subsp. preussii Engl.
(Euphorbiaceae)
Spondias mombin L. (Anacardiaceae)
Sporobolus pyramidalis P. Beauv. (Poaceae)
Sterculia rhinopetala K. Schum. (Sterculiaceae)
Sterculia tragacantha Lindl. (Sterculiaceae)
Streblus usambarensis (Engl.) Berg (Moraceae)
Streptogyna crinita P.Beauv. (Poaceae)
Strombosia pustulata Olv. var. lucida
(Léonard) Villers (Olacaceae)
Strophanthus gratus (Hook.) Franch. (Apocynaceae)
Strophanthus hispidus DC. (Apocynaceae)
Strychnos afzelii Gilg (Loganiaceae)
Strychnos johnsonii Huntch. & M. B. Moss
(Loganiaceae)
Synedrella nodiflora Gaertn. (Asteraceae)
T
Tabernaemontana crassa Benth. (Apocynaceae)
Talinum triangulare (Jacq.) Willd. (Portulacaceae)
Tamarindus indica L. (Caesalpiniaceae)
|
23,
|
25,
|
27,
28,
|
Pages
25, 42
42
28, 29, 42
42
23, 32, 42
42
42
42
43
28, 43
43
43
43
43
43 43 43 43 43 43 43 43 43 43 43 43 43 43 43 43 43
28, 43 43 43 43
29, 32, 43
43
27, 28, 43
16, 43
43
43
22,
43
43
43
43
43
43
43
43
43
|
|
Taxons
Teclea verdoorniana Exell & Mendoçon
(Rutaceae)
Tectona grandis L. F. (Verbenaceae)
Terminalia ivorensis A. Chev. (Combretaceae)
Terminalia superba Engl. & Diels (Combretacae)
Tetracera alnifolia Willd. (Dilleniaceae)
Tetrapleura tetraptera (Schum. & Thonn.) Taub
(Mimosaceae)
Thalia welwitschii (L.) Ridl. (Marantaceae)
Thaumatococcus danielii (Bennet) Benth. (Marantaceae)
Theobroma cacao L. (Sterculiaceae)
Thonningia sanguinea Vahl (Balanophoraceae)
Tiliacora dinklagei Engl. (Menispermaceae)
Tragia chevalleri Beille (Euphorbiaceae)
Treculia africana Decne (Moraceae)
Trema orientalis (L.) Blume (Ulmaceae)
Trichilia heudelotii Planch. ex. Oliv. (Meliaceae)
Trichilia martineaui Aubrév. & Pellegr.
(Meliaceae)
Trichilia prieureana A. Juss. (Meliaceae)
Triclisia dictyophylla Diels (Menispermaceae)
Triclisia subcordata Oliv. (Menispermaceae)
Tridax procumbens L. (Asteraceae)
Trilepisium madagascariensis DC. (Moraceae)
Triplochiton scleroxsylon K. Schum. (Sterculiaceae)
Turraea heterophylla J. Sm. (Meliaceae)
U
Urera occidentalis Letouzey (Urticaceae)
Uvaria afzelii Sc.Elliot (Annonaceae)
Uvariodendron mirabile Engl. & Diels (Annonaceae)
Uvariopsis guineensis Keay (Annonaceae)
V
Ventilago africana Exell (Rhamnaceae)
Vitex fosteri C. H. Wright (Verbenaceae)
Vitex grandifolia Gurke (Verbenaceae)
Vitex rivularis Gurke (Verbenaceae)
W
Wissadula amplissima (L.) R. E. Fries (Malvaceae)
X
Xylopia aethiopica (Dun.) A. Rich. (Annonaceae)
Xylopia parvifolia (A. Rich.) Benth. (Annonaceae)
Xylopia villosa Chipp (Annonaceae)
Z
Zanthoxylum gilletii (De Wild.) P.G. Waterman (Rutaceae)
Zanthoxylum parvifolium A. Chev. ex Keay (Rutaceae)
Zanthoxylum rubescens Hook.f. (Rutaceae)
Zanthoxylum zantoxyloides (Lam.) Zepernick & Timber
(Rutaceae)
Zea mays L. (Poaceae)
|
17,
|
23,
|
25,
21,
|
27,
23,
7,
|
Pages
43 7, 43 7, 43 7, 43
43
28, 43
43
43
9, 43
44
44
28, 44
44
44
28, 44 44
26, 44 44 44 44 44
29, 44 44
44 44 44 44
44 44 44 44
44
44 44 44
44 44 44 44
9, 44
|
| 


