|
|
MINISTERE DE L'AGRICULTURE
ET DES RESSOURCES
HYDRAULIQUES
***********
INSTITUTION DE LA RECHERCHE ET DE L'ENSEIGNEMENT
SUPERIEUR AGRICOLES (IRESA)
|
|
MINISTERE DE
L'ENSEIGNEMENT
SUPERIEUR ET DE LA RECHERCHE
SCIENTIFIQUE
ET DE LA TECHNOLOGIE
***********
UNIVERSITE DU 7 NOVEMBRE A CARTHAGE
|
Institut National Agronomique de
Tunisie
Département d'Agronomie et Biotechnologie
végétale
3 LRjHI GHILC GDDINGHV
Induction de la réaction de défense chez
les plantes pour lutter contre les
maladies
Elaboré par : Ben Hassena Ameni
Présenté et soutenu publiquement le 25 Juin
2009
devant le jury composé de :
Président : Mme. Sonia Hamza
Encadreur: Mr. Walid Hamada
Examinateur: Mr. Taoufik Ouslati
Examinateur: Mr. Ghazi Krida
(Juin 2009)
Dédicaces
Je dédie ce travail
A mon père Najib, à ma mère
Safia
Pour leurs encouragements, leurs conseils et leurs sacrifices
dont toujours font preuve
J'espère que vous trouverez dans ce travail ma
profonde reconnaissance et mon grand amour pour vous
Que dieu m'aide à vous rendre un petit peu de vos
sacrifices
A mes soeurs : Imen, Amal et son mari
Haikal
Pour leur amour, sacrifice et soutien avec mes souhaits de
bonheur
A mon frère Mohameé
Slim
En témoignage de mon affection et mes voeux de
réussite et de bonheur
A toute la famille
A tous mes amis qui me sont
chers
J'espère qu'ils trouveront dans ce travail
l'expression de mon profond amour et de succès dans leur vie
Ameni
Remerciements
Aucune oeuvre humaine ne peut se réaliser sans la
contribution d'autrui. Ce travail est le résultat d'un effort constant.
Cet effort n'aurait pu aboutir sans la contribution de nombre de personnes.
Ainsi se présente l'occasion de les remercier :
J'adresse l'expression de ma grande reconnaissance
à monsieur Walid Hamada, pour la confiance qu'il a investie en acceptant
d'encadrer mes travaux, pour son aide et pour l'attention et l'écoute
qu'il a bien voulu apporter à mon travail dans ces divers stades
d'élaboration.
Je tiens aussi à remercier tous les membres du jury de
m'avoir fait l'honneur d'accepter de juger ce travail.
Mes remerciements et ma profonde gratitude s'adressent
également à Mlle. Kalthoum Harbaoui pour ses précieuses
aides et conseils.
Un grand merci pour tout les membres du laboratoire de
génétique de la résistance aux maladies : Nadia, Lamia,
warda, Wassila, Sonia, Salma, Iheb, Ibrahim, Sahbi et Abdelkader.
Enfin, je remercie tous ceux qui m'ont aidé de
prés ou de loin à la réalisation de ce travail, qu'ils
trouveront ici le témoignage de mes profondes gratitudes.

íÏÄñ íÒäE y
ÓæÔ ò~ä~ Í~Ç~æ
ÎÇÓæÔò~ä~ ÐÏ~
ÇØÇØËä~
ÎÇÐÇË~ ÉòÕÐ
ðÑä~ Ö~Ôíá~ äòÊ
äí
. ÍÑËääÇÊ
ÎÇUÓÐä~ äí
ÏæÐÓí ÌÇÑ~Å
ìäÅ ìåÚ ÐðÑ~Ð
ÌÐñÐÎ ãÆÇÓæ
äÚ ÇäËÓÊ ÐÞ
ÇñæÇòðò~
ÍòÓæÔò~äI
Ö~Ôíá~ ÍÏäÇ~í
Íò~ÇßíÅ æÐ~ä
~ÔÙ~æ ìåÚ
ÌÔÔÇËí ÔòÛ
ÍòäÇ~ Çåä ðÑä~
ÍòÎìäìòËä~
Ï~ìðä~ Ø~Ê ÍÊÔÏÐ
ááÇ~ äí
ÍíæÇÞðä~ ìåÚ
ÍÑËää~ ËÒ
.ÖÔððä~
Alga Bactéricide ãËí
ÍòÎìäìòËä~
ÎÇÏÑäðä~ Ø~Ê
ÍÊÔÏÐ ÍÓ~ÓÐä~
åÒ~ ð ÏðÐ
ßäÒä
ÌÑìðäflh
ÔØ~ä~ äí Ú~ì~ ØLÊ
ìåÚ ÇåÑòäÇ~
ÐñÐÓÑä Ningnan Mycin æ Dalgin Active
ÐÇÞäáÅ~
ÍÞñÔØ ìåÚ
ÐðÑ~Ð ðÑä~ ìðää~
ÔÛ ðæ ÔËÎðäll ð
ÈÓÇÏÐ ÌÐÚ
ááÇL)( äí ßäÑæ
. ðÚÇäØXáÅ~
ìåÚ ÍÑËää~
øËÒ ìåÚ
ÇåÑòäÇ~
ÐñÐÓÑä
ÇØÇØÊ á~ ÍÑË~
ìåÚ Ï~ìðä~ åÒ~
ÍÊÔÏÐ ìÐ
ÍÆÇÑää~ åÒ~
ÁìÙ ìåÚ
. y ÓæÔò~ä~
ÍíæÇÞí
. ÇØÇØËä~
ÍÑË~ ÍòÚÇÏ ã~
ÌÏÓ
ÍòÎìäìòÊ
Ï~ìí ÔØ
ÎÇÐÇËää~ ÓæÔò
: ÑòÐÇ~ðä~ ÎÇðå~
Résumé
Les phytovirus constituent chaque année une menace
grave pesant sur la réussite des cultures et particulièrement
chez la pomme de terre. La méthode de lutte génétique est
actuellement la stratégie la plus précieuse et efficace.
Egalement, le contrôle des maladies virales est devenu possible par le
biais de l'induction de la réaction de défense des plantes.
Le présent travail a pour objectifs de voir l'effet de
certains produits d'origine biologique supposés avoir une action
inductrice de la réaction de défense sur les virus de la pomme de
terre et particulièrement le PVY. C'est pourquoi plusieurs tests de
caractérisation de l'action de ces produits ont été
effectués en utilisant comme modèle certains champignons
phytopathogènes.
Des tests de pathogénicité ont permis de
déduire que les doses recommandées des produits testés,
notamment l'Alga Bactéricide et la Dalgin Active, seraient inefficace
pour déclencher une réaction de défense contre
Botrytis cinerea. Toutefois, l'application du Codaphos cuivre et de la
double dose de la dalgin Active aurait permis d'induire des réactions de
défense. De plus, des essais d'inoculation artificielle sur des
plantules nous ont permis de révélé une action protectrice
des produits Zytroseed et Dalgin Active contre B. cinerea et des
produits Codaphos cuivre et Zytroseed contre Fusarium oxysporum f.sp.
radicis lycopersici.
A la lumière de ces résultats, l'application des
produits Alga Bactéricide et Dalgin Active, à la dose
recommandée, sur des plants de pomme de terre n'a pas permis de diminuer
les risques d'attaques virales pour toutes les variétés
testées dans cette étude. Cependant, une différence
notable a été révélée au niveau de la
résistance variétale vis-à-vis PVY. Ainsi, ces produits
n'auraient pas permis d'induire les réactions de défense chez les
plantes testées. De plus, ces produits auraient une action freinante de
la croissance des plants vu que les rendements des poids
végétatifs et des tubercules enregistrés ont
été faibles en comparaison avec les témoins.
Mots clé : phytovirus, champignons, produits biologiques,
réactions de défense, pomme de terre.
Abstract
Virus infects a range of solanaceous crops including potato.
More efforts are actually investigated to control this threat. However, genetic
control is the most recommended method such as triggering host defence
mechanisms. In this study, we focus on the effect of some organic products
expected to induce potato defence responses against PVY virus.
As a first step, several assays were achieved on fungi in
order to characterise inductive activity of biologic products such as Alga
Bactricide, Dalgin Active and Ningnan Mycin. Pathogenicity trials on detached
leaves showed that recommended dose of Alga Bactericide and Dalgin Active did
not trigger defence responses against Botrytis cinerea. Nevertheless,
the Codaphos Cuivre and the double dose of Dalgin Active could trigger the
defence mechanism of plants against this fungus. In addition, artificial
inoculation of seedlings, Zytroseed and Dalgin Active revealed some protective
activity against B. cinerea. In the same way, the zytroseed and the
codaphos cuivre activated defence responses against Fusarium oxysporum
f. sp. radicis lycopersici.
Refered to these results, the use of Alga Bactricide and
Dalgin Active in recommended dose applied on potato plants did not stimulate
the defence system against PVY. In the other hand, some variability was
revealed between four potato varieties that showed different resistance degree
against this virus.
Key words: Virus, Fungi, biologic products, defence responses,
Potato.
Table des matières
Introduction générale 15
Chapitre 1 : Synthèse Bibliographique
16
1. Les maladies biotiques des cultures maraîchères
16
1.1. Impact des maladies biotiques sur les cultures
maraîchères (cas de la pomme de terre) 16
2. Les phytovirus 16
2.1. Définition 16
2.2. Mode d'infection des phytovirus 17
2.3. Dissémination des phytovirus 18
2.3.1. La transmission verticale 18
2.3.2. La transmission horizontale 19
2.4. Les conséquences des attaques virales sur les
plantes 19
2.4.1. Les symptômes 19
2.4.2. Les dégâts 20
3. Les principaux virus chez la pomme de terre 21
3.1. Le virus Y de la pomme de terre (PVY) 21
3.2. Le virus de l'enroulement de la pomme de terre (PLRV) 23
3.3. Le virus X de la pomme de terre (PVX) 23
4. Les méthodes de diagnostic 24
4.1. Les diagnostics sérologiques 24
4.1.1. Le test Elisa (Enzyme Linked ImmunoSorbent Assay) 24
4.1.2. Les Flashkits 25
4.2. Les diagnostics moléculaires 26
5. Les approches de lutte contre les phytovirus 27
5.1. Les approches préventives 27
5.2. La lutte génétique 27
5.2.1. L'exploitation des ressources existantes 28
5.2.2. L'amélioration génétique 28
5.2.2.1. Les méthodes classiques d'amélioration
28
5.2.2.2. Les méthodes biotechnologiques 29
5.2.3. La protection croisée 31
5.2.4. L'utilisation de produits qui induisent des
réactions de défense chez la plante 32
5.2.4.1. La réaction de défense chez la plante
34
5.2.4.2. Les éliciteurs 34
Chapitre 2 : Matériel et méthodes
37
1. Matériel utilisé 37
1.1. Matériel végétal 37
1.2. Matériel fongique 37
1.3. Produits phytosanitaires 38
1.4. Le Flashkit 41
1.5. Le test ELISA 41
2. Méthodologie de travail 42
2.1. Test de fongitoxicité 42
2.1.1. Les doses appliquées 42
2.1.2. Protocole expérimental 43
2.1.3. Suivi du test de fongitoxicité 44
2.2. Test de pathogénicité sur des feuilles
détachées 46
2.3. Test de pathogénicité sur des plantules 47
2.3.1. Cas du B. cinerea 47
2.3.2. Cas du Fusarium et Verticillium 48
2.3.2.1. Préparation d'une suspension sporale 48
2.3.2.2. Protocole expérimental 48
2.3.2.3. Suivi du test 50
2.4. Essai sur les viroses de la pomme de terre 51
2.4.1.Essai en plein champ 51
2.4.1.1. Présentation générale du site
expérimental 51
2.4.1.2. Conduite de l'essai 51
2.4.1.3. Suivi de l'essai 53
2.4.2. Essai en pot 54
2.4.2.1. Conduite de l'essai 54
2.4.2.2. Suivi de l'essai 55
Chapitre 3 : Résultats et discussions
56
1. Caractérisation des produits 56
1.1. Caractérisation de l'activité fongitoxique des
produits 56
1.1.1. Alga Bactéricide 56
1.1.2. La Dalgin Active 57
1.1.3. Le Ningnan Mycin 58
1.1.4. Le Zytroseed 59
1.2. Tests de pathogénicité sur feuilles
détachées 61
1.2.1. Tomate 61
1.2.1.1. Action des produits après 24h du traitement 61
1.2.1.2. Action des produits après 48 h du traitement
62
1.2.1.3. Action des produits après 72 h du traitement
63
1.2.1.4. Conclusion 63
1.2.2. Vigne 64
1.2.2.1. Action des produits suite à l'inoculation par un
implant mycélien de B.cinerea 64
1.2.2.2. Action des produits suite à l'inoculation par une
suspension sporale de B. cinerea 66
1.3. Test de pathogénicité sur des plantules 67
1.3.1. Action des produits vis-à-vis du B.cinerea
67
1.3.1.1.Cas de la tomate 67
1.3.1.2. Cas du melon 69
1.3.2. Action des produits vis-à-vis des champignons du
sol 69
1.3.2.1. Cas de la tomate 70
1.3.2.2. Cas du melon 71
2. Effet des produits sur les virus de la pomme de terre 71
2.1. Essai en pots 72
2.1.1. Lot n°1 72
2.1.2. Lot n°2 73
2.2. Essai en plein champ 73
2.2.1. Evaluation symptomatique 73
2.2.2. Test ELISA 75
2.2.3. Effet des produits sur le rendement des plants de pomme de
terre 77
2.2.3.1 .Effet sur le poids végétatif 77
2.2.3.2. Effet sur le poids des tubercules 78
Conclusion et perspectives 80
Liste des abréviations
ul : microlitre
AB : Alga bactéricide
ADN : Acide désoxyribonucléique
ARN : Acide ribonucléique
ARNg : Acide ribonucléique génomique
ARNm : Acide ribonucléique messager
AS : Aacide salicyclique
CI50 : concentration qui inhibe 50% de la croissance
mycélienne COCU : Codaphos Cuivre
CTV : citrus tristeza virus, Da: Dalgin Active
DAS: Double Antibody Sandwich
ELISA: Enzyme Linked ImmunoSorbent Assay
Fom: Fusarium oxysprum f.sp melonis
Forl: Fusarium oxysprum f.sp.
radicis-lycopersici
Fs: Fusarium solani
g: gramme
GIL : Groupement interprofessionnel des légumes
ha: hectare
hl : hectolitre
HR : Réaction d'hypersensibilité IEM:
Immunoélectromicroscopie
j: jour
kb : kilo base
l: litre
l'ACP: Antigen Coated plate
m: mètre
m2 : mètre carré
MDI: Mass Disease Index ml: millilitre
mM: millimolaire
My: Mythos
ng: nano gramme
nm: nano mètre
NM: Ningnan Mycin
NO: Monoxyde d'azote
PAM Ps: Pathogen-Associated Molecular Patterns
PCR : Réaction de polymérisation en chaîne
PDA: Potato Dextrose Agar
PDB: Potato Dextrose Broth
PLRV : Virus de l'enroulement de la pomme de terre Ppm: Partie
par million
PTI: PAM P-Triggered Immunity
PVX : Virus X de la pomme de terre
PVY : Virus Y de la pomme de terre
Q-PCR : Réaction de polymérisation en
chaîne en temps réel RT-PCR: Reverse Transcription-Polymerase
Chain Reaction S: Switch
Tach: Tachigaren
TAS: Triple Antibody Sandwich
Te : Témoin
TMV : Virus de mosaïque du tabac
Vaa: Verticillium albo atrum
Zy: Zytroseed
Liste des figures
Figure 1 : Structure des virus à ARN et à ADN 3
Figure 2 : Cycle infectieux des phytovirus 4
Figure 3 : Transmission horizontale des virus par les pucerons
............................ 5
Figure 4 : Symptômes de mosaïques provoqués par
les phytovirus...................... 6
Figure 5 : Symptômes de jaunissement et d'enroulement
provoqués par les phytovirus 6
Figure 6 : Symptômes du PVY sur les feuilles de pomme de
terre 8
Figure 7 : Symptômes du PLRV sur les feuilles de pomme de
terre 9
Figure 8 : Symptômes du PVX sur la partie aérienne
de la plante ...................... 9
Figure 9 : Principe du test ELISA double sandwich
................... 11
Figure 10 : Les flashkits ...................... ... 12
Figure 11 : Le microarray 13
Figure 12 : La fusion de protoplastes 16
Figure 13 : Principe de la
transgenèse..............................................
............ 17
Figure 14 : Différentes étapes suivies lors d'un
test Flashkit 27
Figure 15 : Exemple d'une courbe de régression 31
Figure 16 : Un plateau de tomate traité pour le test
d'inoculation foliaire 33
Figure 17 : Des feuilles de tomate inoculées par un
implant mycélien de B. cinerea~ 33
Figure 18 : Schéma expérimental du test
d'inoculation foliaire par suspension sporale~ 34
Figure 19: Schéma expérimental du test
d'inoculation racinaire 35
Figure 20 : Dispositif expérimental de la parcelle 38
Figure 21 : Marquage des plants douteux 39
Figure 22 : Test de fongitoxicité de B. cinerea
traité par DA (50000 ppm) 44
Figure 23 : Test de fongitoxicité par le produit Zytroseed
avec le Verticillum.......... 46
Figure 24: Inhibition totale de la croissance mycél ienne
de B.cinerea à la dose
recommandée à l'hectare (2000 ppm) 46
Figure 25 : Evolution des nécroses causées par
B.cinerea sur des feuilles de tomate après
24h d'un traitement
préventif................................................................
47
Figure 26 : Evolution des nécroses causées par
B.cinerea sur des feuilles de tomate après
48 h d'un traitement
préventif...............................................................
48
Figure 27 : Evolution des nécroses causées par
B.cinerea sur des feuilles de tomate après
72 h d'un traitement
préventif...............................................................
49
Figure 28 : Test d'inoculation foliaire par implant mycélien des
feuilles de vigne de la
variété Muscat
d'Italie...............................................................................
51
Figure 29 : Evolution des nécroses causées après
inoculation par suspension sporale de
B. cinerea sur des feuilles de vigne après 72 h
d'un traitement préventif..................... 52
Figure 30: Effet
des différents traitements sur la taille des plantules après
inoculation par
B.
cinerea..............................................................................................
54
Figure 31 : Evolution des symptômes de la pourriture grise
après un traitement curatif
par l'acide
salicylique................................................................................
54
Figure 32 : Taille moyenne des plantules pour chaque type de traitement
et de produit~. 55
Figure 33 : Symptômes causés par le
Forl......................................................... 56
Figure 34 : Symptômes causés par le
Fom........................................................ 56
Figure 35 : Le plant témoin
virosée................................................................
59
Figure 36 : Pourcentages d'attaque par le PVY des quatre
variétés selon l'évaluation
visuelle...................................................................................................
61
Figure 37 : Pourcentages d'attaque par le PVY des quatre
variétés selon le test ELISA~. 63 Figure 38 : Poids
végétatif total des plants des quatre variétés de
pomme de terre en
fonction des traitements
appliqués..................................................................
64
Figure 39 : Poids total des tubercules des quatre
variétés de pomme de terre en fonction
des traitements
appliqués..............................................................................
65
Liste des tableaux
Tableau 1 : Les espèces fongiques
utilisées....................................................... 24
Tableau 2 : Gamme de dilutions des produits utilisés par rapport aux
doses
recommandées.........................................................................................
29
Tableau 3 : Les tests de fongitoxicités appliqués
aux différents champignons............... 30 Tableau 4: Classes de
l'échelle de notation de de Trapero-Casas A et Jiminez-Diaz
R.M......................................................................................................
36 Tableau 5 : Date des traitements effectués à la
parcelle......................................... 39 Tableau 6 :
Différentes valeurs de la CI50 calculées pour les tests de
fongitoxicité par
AB et par les produits de
référence.................................................................
42 Tableau 7: Différentes valeurs de la CI50 calculées pour les
tests de fongitoxicité par
DA et par les produits de
référence.................................................................
43
Tableau 8 : Différentes valeurs de la CI50
calculées pour les tests de fongitoxicité par NM et par le
produit de référence
Mythos......................................................... 44 Tableau 9 :
Différentes valeurs de la CI50 calculées pour les tests de
fongitoxicité par
Zy et par les produits de
référence..................................................................
45
Tableau 10 : Diamètres de nécroses mesurés
après trois jours de l'inoculation.............. 50
Tableau 11: Indice d'attaque des plantules de tomate par le
Forl.............................. 57
Tableau 12 : Résultats des évaluations visuelles
et avec flashkit du lot n°1.................. 58 Tableau 13: Evaluations
visuelles et avec flashkit des plants douteux en plein champ~.. 60 Tableau 14 :
Résultats du test ELISA sur les quatre variétés avec les
différents
traitements.............................................................................................
62
Introduction générale
La plante, comme tout organisme vivant, est influencée
durant toute sa vie par les conditions climatiques et édaphiques du
milieu. Ces conditions, vont lui assurer soit un environnement favorable
à la croissance et au développement, soit la soumettre à
des facteurs de stress abiotiques ou biotiques qui vont perturber son
métabolisme et provoquer des anomalies.
Les stress de type biotiques sont dus à l'interaction
de la plante avec d'autres organismes comme les champignons, les
nématodes, les bactéries, les virus et les viroïdes. Ces
pathogènes en infectant les végétaux et
particulièrement les cultures maraîchères vont affecter la
croissance et le rendement et peuvent être à l'origine de leur
mort.
Les méthodes de lutte culturales et chimiques
classiques contre ces pathogènes présentent des limites. En fait,
l'utilisation massive de pesticides s'avère toxique non seulement pour
les pathogènes, les plantes mais aussi les consommateurs. De plus, le
contrôle de certains pathogènes comme les virus est impossible
chimiquement car ils sont incurables. C'est pourquoi des nouvelles
stratégies de lutte essentiellement contre les phytovirus visent
actuellement soit à créer des nouvelles plantes
génétiquement résistantes, soit à induire les
mécanismes de défenses chez les plantes et ceci en utilisant des
produits qui sont responsables de l'induction de la réaction de
défense. Ces derniers ont été utilisés avec
succès pour le contrôle des maladies fongiques.
Dans le présent travail, une caractérisation de
l'action de certains produits à base biologiques supposé avoir
une action inductrice de la réaction de défense, a
été effectuée afin de voir leur effet sur les maladies
virales de la pomme de terre et particulièrement le virus Y. Cette
caractérisation a été réalisée grâce
à un ensemble de tests de fongitoxicité et de
pathogénicité sur des champignons phytopathogènes à
savoir Botrytis cinerea, Fusarium oxysprum f.sp.
radicis-lycopersici, Fusarium oxysprum f.sp melonis,
Fusarium solani et Verticillium albo
atrum.
Chapitre 1 :
Synthèse Bibliographique
1. Les maladies biotiques des cultures
maraîchères
Les maladies biotiques des plantes maraîchères
sont dues à des organismes tel que les bactéries, les virus et
les champignons qui sont normalement présents dans leur environnement et
qui se développent à la faveur d'un stress, d'une blessure ou
d'une piqûre d'insecte provoquant ainsi des pertes considérables
de production qui varient selon le type de la culture.
1.1. Impact des maladies biotiques sur les cultures
maraîchères (cas de la pomme de terre)
Comme tout stress, les maladies parasitaires affectent la
croissance, la fertilité et la productivité des plantes
maraîchères et particulièrement la pomme de terre.
En fait, durant son cycle de développement, la pomme
de terre est soumise à l'attaque de maladies diverses qui sont dues
principalement à des champignons comme le Phytophthora
infestans l'agent causal du mildiou , des virus tel que le virus Y de la
pomme de terre et des bactéries. Ces pathogènes, en infectant le
feuillage, les racines et/ou les tubercules, provoquent des manques à la
levée, un affaiblissement des plantes, une mort prématurée
et/ou une mauvaise qualité des tubercules. De plus, certaines maladies
peuvent apparaître ou continuer à se développer sur les
tubercules pendant la période de conservation ce qui entraîne une
perte importante qui est estimé à presque 30% au niveau mondial
(Rousselle et al, 1996).
2. Les phytovirus 2.1. Définition
Les phytovirus sont des virus qui s'attaquent aux organismes
végétaux. Il s'agit de macromolécules infectieuses
porteuses d'information génétique, parasites obligatoires des
cellules vivantes d'une plante hôte. Ces molécules
pathogènes sont multipliées par les cellules
végétales contaminées en provoquant
généralement des perturbations métaboliques
conduisant à l'expression de symptômes qui sont dans
certains cas masqués (Kummert et Semal, 1996).
Ces virus sont en fait des structures très simple,
formés d'un acide nucléique qui peut être soit un ARN soit
un ADN, simple brin ou double brin protégé par une carapace
constituée de protéines de capside (Astier et al.,
2001).
Chez quelques phytovirus, cette capside peut contenir en outre
des molécules d'une enzyme capable d'assurer la transcription de l'acide
ribonucléique viral (ARN polymérase virale), tandis que dans de
rares cas, elle est entourée d'une enveloppe lipidique (figure 1)
(Kummert et Semal, 1996).
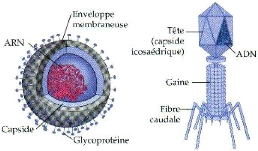
Figure1 : Structure des virus à ARN et à
ADN (Anonyme 1)
2.2. Mode d'infection des phytovirus
Les phytovirus, comme tous les êtres vivants,
possèdent la capacité de répliquer leur propre patrimoine
génétique, mais cette réplication dépend de la
nature de leur génome (Casselyn, 2002).
Généralement, le virus infectant
pénètre dans la cellule par effraction. La
nucléoprotéine virale appelé virion est
désassemblé et libère son ARN génomique (ARNg).
L'ARN polymérase virale est directement traduite à partir de
l'ARNg. En fait, cette enzyme transcrit des ARN messagers (ARNm), dont celui de
la protéine de capside, et synthétise de nouveaux ARNg. Ces
derniers seront ensuite encapsidés, et les virions ainsi formés
vont infecter d'autres cellules par passage trans-cellulaire et transport
à longue distance, et éventuellement d'autres plantes (figure 2)
(Kahn, 1996).
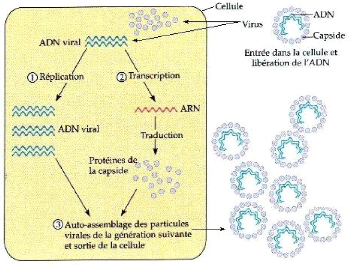
Figure2 : Cycle infectieux des phytovirus (Anonyme
1)
2.3. Dissémination des phytovirus
Les virus des plantes disposent de deux principaux moyens de
dissémination dans la nature, une transmission dite verticale et une
transmission dite horizontale.
2.3.1. La transmission verticale
La transmission verticale correspond à la transmission
du virus à la descendance d'une plante infectée. Elle est
très fréquente chez les plantes à multiplication
végétative. Tous les organes de propagation tel que les boutures,
les greffons, les bulbes et les tubercules prélevés sur une
plante mère virosée seront infectés (Casselyn, 2002).
Dans la majorité des cas, les virus ne sont pas
transmis par les graines. Mais, dans des rares cas, certains virus de plantes
pérennes sont transmis par le pollen disséminé soit par le
vent soit par les insectes pollinisateurs (Kummert et Semal, 1996).
De plus, l'intensification des échanges commerciaux au
niveau mondial fait que la transmission des phytovirus à la descendance
constitue un risque majeur de dissémination des virus d'un pays ou d'un
continent à un autre.
2.3.2. La transmission horizontale
Ce mode de transmission fait le plus souvent intervenir un
intermédiaire qui est le vecteur. Ce dernier prélève le
virus d'une plante malade et l'inocule dans une plante saine. Il contribue
efficacement à la survie et à la dissémination spatiale du
virus (Costa, 2003). Certaines zoospores de champignons affectant les racines
de plantes peuvent servir de transporteurs de virus, mais les principaux
vecteurs sont les insectes tel que les pucerons (figure 3), les aleurodes et
les cochenilles. De même, ces vecteurs peuvent correspondre aux
nématodes, qui acquièrent et transportent les virus, en se
nourrissant, et les retransmettent à de nouvelles plantes (Casselyn,
2002).
De plus, la transmission horizontale peut être
causé par des blessures du feuillage ou des germes occasionnées
par les bris de poils, les outils contaminés et les pratiques culturales
(Kummert et Semal, 1996).

Figure 3 : Transmission horizontale des virus par les
pucerons (Pasche et al., 1994)
2.4. Les conséquences des attaques virales sur les
plantes
L'infection des plantes par des phytovi rus provoque des
effets pathogènes profonds dans l'hôte. Il s'agit en fait de
symptômes qui sont visuellement détecté et de
dégâts concernant surtout la croissance et le développement
de la plante hôte.
2.4.1. Les symptômes
La multiplication des particules virales
généralisée à l'ensemble de la plante provoque des
perturbations métaboliques conduisant à l'expression de
symptômes variés (Kummert et Semal, 1996). Ces symptômes
peuvent varier selon le virus, la variété ou l'espèce
atteinte, l'environnement et l'état physiologique dans le quel se trouve
les plantes.
En effet, sur les feuilles, les symptômes apparaissent
généralement au site d'inoculation, sous
formes de foyers
localisés. Chez certains couples plantes-virus, la multiplication et
l'extension
du virus sont limitées, avec formation de
lésions nécrotiques suite à une réaction
d'hypersensibilité, tandis que dans d'autres cas, le virus envahit
l'ensemble des tissus de la plante hôte en induisant des infections
systémiques (Kummert et Semal, 1996).
Ces phytovirus provoquent en fait des symptômes de
mosaïque sur les feuilles, c'est-à-dire une alternance de zones de
coloration vert foncé et vert pâle due à la
répartition anormale des pigments chlorophylliens dans les feuilles. Si
les taches sont diffuses, on parle de marbrures. Dans le cas d'une coloration
plus intense au niveau des nervures, on parle de mosaïque de nervure et si
la coloration est plus claire on parle d'un éclaircissement des nervures
(Costa, 2003).
De plus, les virus sont responsables de jaunissement des
feuilles. Selon Costa (2003), ce dernier, caractérise les virus
localisés au niveau vasculaire et s'accompagne d'un
épaississement et souvent un enroulement des feuilles.
En plus des symptômes de mosaïque (figure 4) et de
jaunissement des feuilles (figure 5), les virus peuvent être la cause de
plusieurs anomalies de croissance. En fait, le virus utilise le
métabolisme de la plante pour se multiplier, ce qui entraîne un
ralentissement de la croissance révélée par des feuilles
plus petites et des malformations sur feuilles et sur fruits comme un
rabougrissement, des boursouflures, des cloques, des crispations, des
excroissances, et un filiformisme des feuilles (Astier et al.,
2001).

Figure 4 : Symptômes de mosaïques Figure 5 :
Symptômes de jaunissement
provoqués par les phytovirus et d'enroulement
provoqués par les phytovirus
(Babadoost, 2006) (Spire, 2001)
2.4.2. Les dégâts
D'une manière générale, les maladies
virales réduisent la croissance et donc le potentiel
global de
production d'une plante. Dans le cas des fruits et des légumes, ces
virus peuvent
altérer leur aspect et donc la qualité commerciale
de la récolte (Astier et al., 2001) et peuvent même
parfois conduire à la mort de la plante infectée.
Les pertes économiques induites par les virus,
difficiles à évaluer précisément, sont
considérables. Pour le cas de la maladie des feuilles jaunes en
cuillère de la tomate (Tomato Yellow Leaf Curl Virus,TYLCV), les pertes
de rendement quantitatives et qualitative dans la récolte de tomate
atteignent souvent 100 % (Picó et al., 1996), alors que dans le
cas de la vigne, le virus du court noué (Grapevine Fan Leaf Virus,
GFLV), présent dans la plupart des vignobles du monde, y compris en
France où il infecte 60 % de la surface du vignoble national, soit
environ 550 000 hectares, et induit des pertes évaluées à
environ un milliard d'euros par an (Fuchs, 2008a).
Alors, afin de réduire les pertes de récoltes
qu'ils occasionnent les virus phytopathogènes pour pallier
l'insécurité alimentaire et pour maintenir la
compétitivité de certaines filières professionnelles il
faut bien étudier les virus aux quels on s'intéresse, les
diagnostiquer et lutter contre eux.
3. Les principaux virus chez la pomme de terre
La pomme de terre (Solanum tuberosum L.) est
fréquemment infectée par plusieurs virus durant la saison de
croissance provoquant ainsi des réductions de rendements et de la
qualité des tubercules (Agi ndotan et al., 2007).
Aujourd'hui, au moins 38 virus infectent la pomme de terre.
Parmi les quels on trouve essentiellement le virus de l'enroulement de la pomme
de terre (PLRV), le virus Y de la pomme de terre (PVY) et le virus X de la
pomme de terre (PVX) (Kerlan, 2008).
3.1. Le virus Y de la pomme de terre (PVY)
Le virus Y de la pomme de terre est, sur le plan
économique, l'un des virus les plus importants. Décrit pour la
première fois sur pomme de terre en 1930, le PVY est maintenant
présent dans tous les pays producteurs de la pomme de terre (Jacquot
et al., 2005).
Ce virus, membre type du genre Potyvirus de la
famille des Potyviridae et de la superfamille des
Picornaviridae (Pépin, 2004), est un virus à ARN simple
brin, de polarité positive et d'environ 10 kb. Sa particule virale est
filamenteuse flexueuse de 730 nm de longueur et de 20 nm de diamètre
(Glais et al., 2001).
Ce phytovirus se transmet selon le mode non persistent de
manière mécanique, par microblessure ou par l'alimentation des
pucerons surtout le puceron vert du pêcher (Myzus persicae) et
infecte principalement les Solanacées tel que la pomme de terre, la
tomate et le tabac (Pépin, 2004).
L'importante variabilité biologique, sérologique
et moléculaire du PVY supporte la classification complexe des isolats en
groupes (PVYO, PVYC, PVYN pour le cas de la
pomme de terre) et ceci sur la base des symptômes induits sur plantes
indicatrices ou sur la capacité de contournement de certaines sources de
résistance et en variants (PVYNTN, PVYNW,
PVYN:O pour le cas de la pomme de terre) en associant les isolats
présentant des propriétés originales (Kerlan et Moury,
2008).
Sur la culture de pomme de terre, les symptômes
déterminés dépendent essentiellement du type de souches
virales, de la variété cultivée, du caractère
primaire, et dans ce cas de la précocité de l'attaque, ou
secondaire de l'infection ainsi que les conditions d'environnement aux quelles
se trouvent la plante (Rousselle et al, 1996).
Généralement, les principaux symptômes
observés sur les parties aériennes sont des nécroses
noirâtres au niveau des nervures et sur la face inférieure des
feuilles ressemblant à des tâches d'encre et des mosaïques
foliaires qui peuvent être dans certains cas faibles et discrets mais
dans d'autres cas très sévères et ceci dépend du
type de souches virales. Cette mosaïque est souvent accompagnée de
frisolées ou de bigarrure (figure 6) (Pépin, 2004).

Figure 6 : Symptômes du PVY sur les feuilles de
pomme de terre (Spire, 2001)
3.2. Le virus de l'enroulement de la pomme de terre (PLRV)
Le virus de l'enroulement de la pomme de terre (PLRV) est
considéré parmi l'un des plus préjudiciables virus
affectant la pomme de terre qui se transmet par les pucerons. Les pertes de
rendements peuvent atteindre jusqu'à 80 à 90 % (Vazquez Rovere
et al., 2001).
Concernant les symptômes caractéristiques de
l'infection secondaire, il s'agit d'un enroulement des feuilles de la base en
cuillère, un port dressé et un nanisme de la plante (figure 7)
(Rousselle et al, 1996).

Figure 7 : Symptômes du PLRV sur les feuilles de
pomme de terre (Spire, 2001)
3.3. Le virus X de la pomme de terre (PVX)
Le virus X de la pomme de terre, autrefois le virus le plus
commun sur cette culture, a fortement diminué d'importance. Il se
transmet essentiellement par contact entre les plantes au champ ou des
tubercules pendant la période de conservation de ces derniers (Rousselle
et al, 1996).
Les symptômes identifiés sur la culture de la
pomme de terre sont des mosaïques à large plages claires alternant
des zones vertes avec ou sans déformation foliaire (figure 8) (Ryua et
Honga, 2008).

Figure 8 : Symptômes du PVX sur la partie
aérienne de la plante (Te et al., 2005)
4. Les méthodes de diagnostic
Les techniques de diagnostic sont indispensables pour
l'identification et la classification des phytovirus car la lutte contre ces
derniers nécessite tout d'abord un diagnostic correct. Les techniques de
diagnostic les plus importants sont basées sur les
propriétés morphologiques, sérologiques,
moléculaires et pathogènes des phytovirus et très souvent
sur une combinaison entre eux (Koenig et al., 2008).
On distingue quatre méthodes de diagnostic des virus
qui sont biologiques, microscopiques, sérologiques et
moléculaires. Concernant les deux premières méthodes,
elles ne sont pas très efficientes. En fait, l'indexage biologique ne
permet pas toujours la détection du virus car différentes souches
peuvent souvent provoquer des symptômes analogues ou même un virus
peut produire des symptômes variables. Alors que concernant le diagnostic
par microscopie électronique, il permet de détecter les virus
à particules allongées. Bien que ceux qui sont de forme
parasphériques, ils peuvent être confondus avec les composants de
la cellule hôte.
4.1. Les diagnostics sérologiques
Le contrôle des maladies virales des plantes
nécessite une détection spécifique et précoce de
l'agent responsable de l'infection. Les techniques immunologiques de
diagnostic, basées sur la reconnaissance d'épitopes (sites
antigéniques spécifiques de chaque agent pathogène) par
des anticorps, ont apportés, par rapport aux deux autres méthodes
biologiques et microscopiques de diagnostic, une amélioration importante
au niveau de la sensibilité, de la reproductibilité et de la
rapidité de l'exécution (Lemattre et al., 1991).
Plusieurs techniques sérologiques, mettant en oeuvre
l'interaction spécifique entre les anticorps et les antigènes,
sont aujourd'hui appliquées pour la détection des phytovirus.
Parmi ces techniques, on cite la technique de précipitation, la double
immunodiffusion, l'immunoélectromicroscopie (IEM), les techniques
immunoenzymatique correspondant au test ELISA (Enzyme Linked ImmunoSorbent
Assay) et ses variante DAS ( Double Antibody Sandwich) et TAS (Triple Antibody
Sandwich), l'ACP (Antigen Coated plate) et les Flashkits.
4.1.1. Le test Elisa (Enzyme Linked ImmunoSorbent Assay)
Le test ELISA, outil le plus fréquemment utilisé
pour la détection sérologique d'entités
virales, a
été décrite par Clark et Adams en 1977 (Boonham et
al., 2002). En fait, cette
technique permet de s'affranchir des
incertitudes liées à l'étude des symptômes et
d'affirmer
qu'une plante est effectivement infectée par un virus.
Elle est simple, très sensible et permet de détecter entre 1
à 10 ng de virus par ml de broyat (de feuilles ou de fruits), selon le
virus considéré (Costa, 2003).
Le test ELISA, utilisé pour la détection et le
dosage d'antigène ou d'anticorps, présente différentes
variantes faisant appel à un procédé direct qui englobe le
test ELISA simple et le test ELISA double sandwich (DAS) et un autre indirect
(Lepoivre et Kummert, 1996). Le principe du test DAS ELISA consiste à
une adsorption d'anticorps, suivie d'une fixation d'antigènes et puis
d'une autre fixation d'anticorps couplés à une enzyme sur le
couple anticorps-antigène (figure 9).
Cette méthode ELISA, bien qu'elle est simple et rapide,
elle demande beaucoup de temps, elle ne peut être pratiqué qu'au
laboratoire et permet la détection d'un seul virus par chaque test. De
plus, pour le cas de la pomme de terre, ce test ne peut être
réalisé que sur des tubercules qui ne sont pas en dormance
(Bergervoet, 2008).
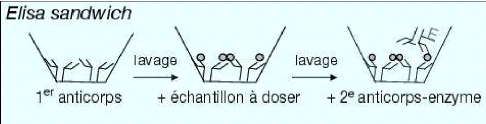
Figure 9 : Principe du test ELISA double sandwich (Pinna
et al., 2004)
4.1.2. Les Flashkits
La réussite du diagnostic des plantes par la
méthode sérologique ELISA nécessite des conditions
optimales d'application du protocole. L'utilisation des Flashkits est une
méthode plus simple pouvant même être utilisé au
champ pour détecter les virus.
Les Flashkits, constitués d'une bandelette de
détection et d'un sachet de broyage rempli d'une solution tampon
d'extraction (figure 10), permettent un diagnostic rapide sur plantes
présentant ou non les symptômes de la maladie provoquée par
des virus ou des bactéries. Ils sont aussi utilisés pour la
détection des événements transgéniques (Organismes
Génétiquement Modifiés, OGM).
Le diagnostic des virus par les flashkits est simple et peut
être effectué en cinq étapes. Il s'agit tout d'abord de
prendre un échantillon de feuilles d'une même plante et le placer
entre les parois tissées du sac de broyage. Ensuite, il faut
écraser le sac de broyage avec un stylo ou un autre outil pour
éclater complètement l'échantillon. Après, il
consiste à insérer l'extrémité de la bandelette de
détection dans l'extrait, à côté des parois
tissées. Enfin, il suffit d'attendre un minimum de 5 minutes et un
maximum de 30 minutes avant de lire et interpréter le résultat.
En fait, si la ligne de contrôle n'apparaît pas, le test est nul et
doit être refait avec une bandelette neuve (Anonyme 2).

Figure 10 : Les flashkits (Anonyme 2)
4.2. Les diagnostics moléculaires
Les méthodes de diagnostic biologique, microscopique et
sérologique permettent le diagnostic des maladies virales mais elles ne
sont pas toujours fiables. Les méthodes de diagnostic moléculaire
tel que les techniques d'hybridation moléculaire, la réaction de
polymérisation en chaîne (PCR), la RT-PCR (Reverse
Transcription-Polymerase Chain Reaction), la PCR en temps réel (Q-PCR,
Real-Time Polymerase Chain), les micropuces d'ADN (Microarray) et plusieurs
autres méthodes ont permis une amélioration au niveau de la
détection des phytovi rus.
Concernant la RT-PCR, cette technique est simple, très
spécifique et sensible garantissant le diagnostic des virus à ARN
seulement. De plus, elle permet le diagnostic de plusieurs virus en un seul
test (Hogue et al., 2006).
Pour la PCR en temps réel, cette technique permet une
détection plus fiable et plus rapide des phytovi rus (Agindotan et
al., 2007).
Alors que concernant les micropuces d'ADN (Microarray), cette
méthode représente une des
avancées de la technologie
moléculaire les plus récentes. Combinées avec la
bioinformatique,
elles possèdent des capacités de
détection simultanée de milliers de gènes ou de
séquences
d'ADN cible et constituent des outils ayant un potentiel
énorme pour la détection simultanée d'un grand nombre de
phytovirus (Kostrzynska et Bachand, 2006).

Figure 11 : Le microarray (Reinke, 2006)
5. Les approches de lutte contre les phytovirus 5.1. Les
approches préventives
Les maladies virales sont actuellement incurables au champ.
Une plante infectée par un virus le restera durant la totalité de
son cycle de développement. De ce fait, les seuls moyens de lutte
possibles sont préventifs visant à éviter les
contaminations (Astier et al., 2001). Parmi ces approches
préventives on trouve l'utilisation de semences certifiées, la
thermothérapie, l'épuration et la destruction des sources de
virus ainsi que la lutte contre les vecteurs des virus notamment les pucerons.
Tous ces moyens de lutte permettent de réduire les risques d'infection
virale mais non pas de les éviter d'une façon absolue.
5.2. La lutte génétique
L'utilisation de plantes résistantes est la
stratégie la plus précieuse et efficace pour contrôler les
maladies virales et atténuer leur impact (Fuchs, 2008a). Cette
résistance, pouvant être horizontale (polygénique)
c'est-à-dire efficace contre toutes souches d'un même virus ou
verticale (monogénique) c'est-à-dire efficace contre certaines
souches d'un virus (Costa, 2003). Son origine peut être soit naturel,
soit résultant de l'amélioration génétique par des
méthodes classiques de croisement ou grâce aux voies
biotechnologiques.
5.2.1. L'exploitation des ressources existantes
La connaissance des ressources génétiques, qu'il
s'agisse des espèces sauvages ou des espèces cultivées
nous permet de déterminer une variabilité génétique
large concernant les gènes de résistance aux virus et notamment
à leurs vecteurs qui vont permettre à la plante de
reconnaître le virus et d'établir une barrière active
empêchant l'infection (Byoung-Cheorl et al., 2005).
Plusieurs gènes de résistances aux phytovirus
ont été identifiés, grâce à la
sélection assistée par marqueurs, à partir de divers
plantes tel que les gènes dominants Rx1 et Rx2 pour le virus X de la
pomme de terre et le gène Y-1 pour le virus Y de la pomme de terre.
D'autres gènes de résistances récessifs ont
été aussi identifiés comme pot-1, pvr1 et pvr21 pour le
virus Y de la pomme de terre (Maule et al., 2007).
Les variétés à résistance
plutôt horizontale sont préférés afin
d'éviter les contournements de résistance ou les pressions de
sélection, alors que l'utilisation des variétés
tolérantes peut servir de réservoir de germes et de sources de
contamination des cultures adjacentes sensibles (Rousselle et al.,
1996).
5.2.2. L'amélioration génétique
Selon Gallais (2000), l'amélioration
génétique des plantes vise la création de matériel
végétal nouveau présentant les meilleures
caractéristiques agronomiques et phytosanitaires.
La sélection pour la résistance ou la
tolérance génétiques vis-à-vis les phytovirus
constitue la méthode de lutte la moins astreignante pour l'agriculteur
et la moins polluante. Elle requiert cependant la mise en oeuvre par le
sélectionneur d'un travail particulièrement long et
délicat puisque elle nécessite des recherches en laboratoire
ainsi qu'en plein champ (Seilleur, 1996).
Cette amélioration de la résistance des
variétés cultivées fait appel à des méthodes
classiques de sélection notamment les croisements et des méthodes
de type biotechnologique qui ont été mises en oeuvre depuis
près d'un demi-siècle.
5.2.2.1. Les méthodes classiques
d'amélioration
Les voies d'amélioration classique, pour lesquelles des
plantes résistantes sont obtenues par croisements et
rétrocroisements entre espèces compatibles, ont permis de
sélectionner des variétés avec une résistance
accrue vis-à-vis de nombreux virus (Lecoq et al., 2004).
Il s'agit en fait d'incorporer des gènes de
résistance par croisement entre deux géniteurs appartenant
à la même espèce, et dans ce cas on parle de croisements
intraspéciphiques, ou
n'appartenant pas à la même espèce, qui
est le cas des croisements interspéciphiques (Sei lleur, 1996). Pour ces
géniteurs, l'un est donneur résistant mais avec de piètres
qualités et l'autre est un receveur potentiel présentant des
caractères agronomiques intéressants (Costa, 2003).
Cette méthode classique de croisement est la plus
simple à mettre en oeuvre par l'améliorateur (Lecoq et
al., 2004). Toutefois, elle est d'une utilité limitée
lorsque aucune source de résistance n'est identifiée dans les
collections de variétés cultivées ou sauvages d'une
espèce donnée et lorsque les difficultés d'hybridation,
voire les incompatibilités entre espèces, compliquent la
tâche des améliorateurs (Fuchs, 2008).
De plus, d'après Astier et al. (2001), la
création de variétés résistantes aux virus par la
génétique classique est un processus très long. Il
s'écoule souvent plus de 10 ans entre le moment où l'on
découvre une résistance et le moment où cette
résistance sera intégrée dans une variété
commerciale.
Le plus souvent la résistance est spécifique
à un virus donné. Il faudra donc créer des
variétés possédant des résistances à
plusieurs virus à la fois pour obtenir une protection optimale des
cultures (Lecoq et al., 2004).
5.2.2.2. Les méthodes
biotechnologiques
L'amélioration des plantes pour la création des
variétés résistantes a connu au cours de ces
dernières années une évolution rapide. Elle
bénéficie désormais des outils biotechnologiques
d'exploration des ressources génétiques et de création de
variétés, qui viennent enrichir les méthodes classiques de
sélection (Charrier et al., 1997). Ces méthodes
biotechnologiques sont diverses, on trouve la création des hybrides
somatique par fusion de protoplastes, la mutagenèse, la
polyploïdisation, la transgenèse etc....
· La fusion de protoplastes
La fusion de protoplastes, permettant la réalisation
d'hybridations dites somatiques entre deux parents génétiquement
différents ou pouvant même être interspécifique, est
une approche très puissante pour l'amélioration
génétique (Pinheiro Dillona, et al., 2008). Elle permet
d'accroître la diversité des pools géniques des
espèces cultivées, non seulement en contournant les
incompatibilités ou contraintes sexuelles, mais également en
combinant les génomes nucléaires, chloroplastiques et
mitochondriaux suivant de nouvelles règles (Ollitrault et al.,
2000).
Un protoplaste désigne en fait une cellule
végétale totipotente, débarrassée de sa paroi, qui
apparaît sous forme d'une cellule sphérique et limitée par
sa membrane plasmique (Cardi et al., 1990).
Concernant la technique de l'hybridation somatique, elle
consiste tout d'abord à isoler des protoplastes.
Transférés sur un milieu de régénération,
les cals se développent en embryons somatiques et donnent des plantules
(Davey et al., 2005).
Figure 12 : La fusion de protoplastes (Nissing et
al., 2002)
· La transgenèse
Le génie génétique et le concept de la
résistance dérivée du pathogène ont ouvert la voie
à des stratégies innovantes de création de
variétés résistantes vis-à-vis des virus
phytopathogènes. Cette nouvelle stratégie de lutte contre les
virus a fait son entrée depuis une douzaine d'années dans la
pratique agricole aux Etats-Unis d'Amérique (Fuchs, 2008 a). Elle a
été tout d'abord démontré en 1986 pour le virus de
mosaïque du tabac (TMV) chez Nicotiana tabacum en introduisant le
gène de la protéine de capside du TMV et les plantes
transgéniques ainsi obtenues étaient résistantes à
ce phytovirus (Fuchs, 2008b).Ultérieurement, de nombreuses plantes
transgéniques contenant le gène de la capside virale ou d'autres
séquences d'origine virale tel que les gènes de la
réplicase, de la protéase, de la protéine de mouvement,
des séquences non codantes, des ARN satellite et des ARN
défectifs interférents (Fuchs et Gonsalves, 2007) ont
été testés mais peu qui ont été
commercialisés et bien adoptés par les agriculteurs (Fuchs, 2008
b) à cause des interrogations légitimes sur leur innocuité
pour la santé humaine et l'environnement (Tepfer, 2002).
Le concept de la transgenèse consiste, dans le cas des
virus phytopathogènes, à transférer une séquence
d'origine virale, codant ou non une protéine, soit sous forme d'ADN
complémentaire dans le cas de virus à génome ARN, soit
sous forme d'ADN dans le cas de virus à génome ADN (Fuchs,
2008a), dans le génome d'une plante afin de perturber le cycle
de multiplication du virus et de conférer un
phénotype de résistance (Sanford et Johnston, 1985).
Figure 13: Principe de la transgenèse (Fuchs,
2008a)
Plusieurs espèces végétales
transgéniques tolérantes aux herbicides, résistantes aux
insectes et aux virus, ont été commercialisées. Parmi les
quelles on peut citer le coton, le soja, le maïs, le papayer etc....
(Fuchs, 2008a).
5.2.3. La protection croisée
Les méthodes de lutte qui ciblent directement les
virus, autre que l'utilisation des variétés résistantes,
reposent sur la protection croisée appelé aussi
prémunition permettant d'induire la résistance chez les
plantes.
En fait, la prémunition consiste à
protéger une plante d'une infection par une souche virale agressive en
l'inoculant au préalable par une souche virale atténuée
(Fuchs et al., 1997) isolé ou obtenue par
mutagénèse ne provoquant pas d'effet sur le rendement mais avec
peu de symptômes (Astier et al., 2001). Elle a été
utilisée avec succès pour protéger plusieurs cultures tel
que les agrumes qui ont été protégés du virus de la
tristeza des agrumes (citrus tristeza virus, CTV) (Fuchs et
al., 1997). La prémunition est mise en oeuvre sans pour autant que
ses mécanismes soient bien cernés, même si l'extinction de
l'expression génique et d'autres phénomènes semblent
impliqués (Roosinck, 2005).
5.2.4. L'utilisation de produits qui induisent des
réactions de défense chez la
plante
La lutte contre les virus phytopathogènes, possible par
l'introduction de gènes de résistance à partir des plantes
cultivées naturellement résistantes par des méthodes
classiques de sélection ou par des méthodes biotechnologiques,
est également possible selon Walters et al., (2005) par
induction de la réaction de défense. Cette dernière, se
traduit par une augmentation de la capacité de la plante à se
défendre contre un large spectre d'agents pathogènes et ceci par
des inducteurs de type biotiques qui incluent les éliciteurs et de type
abiotiques correspondant à des traitements par des produits analogues
aux éliciteurs naturels.
Ces produits ont été utilisés avec
succès pour le cas des maladies fongiques causées par les
champignons aériens et du sol.
· Les champignons aériens (cas de la
pourriture grise)
La pourriture grise est une maladie provoquée par le
champignon saprophyte Botrytis cinerea. Pers. Ce dernier
représente la forme conidienne imparfaite de Botryotinia
fuckeliniana qui fait partie des Deutéromycètes, classe des
Hyphomycètes, ordre des Moniliales et à la famille des
Moniliacées (Bouchet et al., 1999).
Ce champignon est capable d'infecter un grand nombre de
plantes cultivées (tomates, raisins, haricots, fraises, etc.) en les
affaiblissant ou les tuant à n'importe quel stade de leur
développement ou même en période de stockage causant ainsi
des pourritures caractéristiques de coloration grise noire et aux
contours imprécis au niveau des feuilles, du pédoncule, des
fleurs, des sépales, des tiges et des fruits Les pertes
provoquées par ce champignon sont estimées à 20% des
récoltes mondiales (Hmouni et al., 2003).
Le contrôle de cette maladie est basé surtout sur
l'usage répété de fongicides principalement des
benzimidazoles et des dicarboximides. Cependant, cette chimiothérapie
est généralement inefficace vu l'apparition de souches
résistantes (Hmouni et al., 2003). De plus, la lutte contre le
Botrytis est possible par l'utilisation de biofongicides qui
renferment une quantité efficace de souches bactériennes et de
levure et qui présentent également l'avantage d'exercer un effet
d'éliciteur qui se traduit par une activation des défenses
naturelles de la plante (Bouchet et al., 1999). Egalement, le
contrôle de la maladie de la pourriture grise est possible par les
méthodes de lutte biologiques. En fait, cette dernière consiste
à augmenter la population d'un autre microbe qui va parasiter le
champignon (hyperparasite) ou qui va prendre sa place (antagoniste) sans
affecter la culture à protéger (Guetsky et al.,
2001).
· Les champignons du sol (cas du Fusariose et du
verticilliose)
Les champignons du sol qui peuvent infecter les cultures
maraîchères sont diverses parmi les quel on trouve la fusariose et
la verticilliose. Ces pathogènes sont capables de se maintenir dans le
sol, soit en menant une vie saprophytique sur des débris
végétaux, soit sous forme d'organes de conservation comme les
zygotes ou les sclérotes (Boisson et Renard, 1987). Concernant la
fusariose, cette maladie est causée par certains champignons du genre
Fusarium. Les champignons de ce genre sont considéré
comme étant les champignons telluriques les plus agressifs. Ils sont
largement distribués dans le sol représentant 40% de la mycoflore
au niveau de la rhizosphère (Mhiri, 2003).
Les Fusarium appartiennent à la classe des
Adélomycètes, à l'ordre des hyphales et à la
famille des Tuberculariées (Lidell, 1991). Ils représentent un
grand nombre d'espèces comme le Fusarium oxysporum f. sp.
radicis-lycopersici qui attaque la culture de tomate, le Fusarium
oxysporum f. sp. Melonis qui attaque la culture de melon ainsi
que le Fusarium solani qui attaque les solanacées. Ces
champignons, représentant des formes conidiennes d'Ascomycètes
Hypocréacées, sont responsables de symptômes de
jaunissement et de perte prématurée des cotylédons et des
feuilles basales. Egalement, il y a pourriture du système racinaire avec
des chancres brun légèrement déprimés qui se
développent sur un seul côté du collet et de la tige en
forme de flammes (Miller et al., 2000).
En ce qui concerne la verticilliose, cette maladie est
causée par un champignon tellurique du genre Verticillium
attaquant plusieurs cultures tel que la tomate, le melon, l'aubergine et le
coton. Ce champignon comporte deux espèces Verticillium dahliae
et Verticillium albo-atrum qui sont très répondues dans
le sol (Blancard, 1988). Ces pathogènes appartiennent à la classe
des Sordariomycetes, ordre des incertae sedis et à la
famille des Plectosphaerellaceae.
En conditions favorables ces pathogènes peuvent causer
des pertes de rendement de 30 à 69%. Alors que concernant les
symptômes, il s'agit d'un dessèchement des feuilles sous forme de
«V» accompagné d'un jaunissement internervaire suivie d'un
dessèchement des feuilles de la base avec une coloration gris clair
à brun des vaisseaux (Cherif, 2004).
Les caractères biologiques de ces champignons
(Fusarium et Verticillium) montrent qu'il est difficile de
les éliminer du sol. Les dégâts sont souvent importants. A
l'apparition des premiers symptômes, il est déjà trop tard
pour intervenir et contrôler l'extension du parasite. Seules les
méthodes préventives sont alors efficaces pour limiter les pertes
causées par ces maladies (Boisson et Renard, 1987). La lutte
préventive contre les champignons du sol peut être chimique
grâce aux fongicides appliqués sur les semences, les plants ou
même le sol (Monnet, 2001). Cependant, leur efficacité reste
aléatoire à cause de la formation de nouvelles
souches résistantes à ces produits. De plus,
l'utilisation de portes greffes résistants à ces maladies du sol
est possible. En fait, des hybridations interspécifiques entre tomate
Lycopersicum hirsutum et Lycopersicum esculentum ont données
des plantes génétiquement résistantes à la
verticilliose et à la fusariose (Trottin-Caudal et al.,
1995).
Bien que ces deux méthodes de lutte préventives
permettent de diminuer les risques d'infection, ils ne permettent pas une
suppression totale de ces champignons. C'est pourquoi, les stratégies de
lutte biologiques par des biofongicides qui induisent la réaction de
défense chez les plantes et qui diminuent l'impact de la maladie sont
aujourd'hui conseillées (Hibar et al., 2006).
5.2.4.1. La réaction de défense chez la
plante
Lors de l'agression d'une plante par un pathogène,
plusieurs cas de figure peuvent se présenter. L'interaction entre la
plante et le microorganisme peut être compatible si la plante ne
réagit pas assez rapidement ou si les voies de défense sont
« désactivées », et par conséquence il va y
avoir une prolifération du pathogène (Abramovitch et Martin,
2004).
Cependant, il peut y avoir une interaction incompatible
correspondant à une incapacité du pathogène à
infecter la plante (Nurnberger et Lipka, 2005). Ceci est dû à la
présence de barrières physiques naturelles tel que la paroi
cellulaire et la déposition de callose, et/ou chimiques par
sécrétion de substances toxiques tel que les tanins ou la lignine
ou encore grâce à des composés de défense connus
sous le nom d'éliciteurs (Pépin, 2004). La perception de ces
éliciteurs déclenche une cascade de signalisation aboutissant
à l'activation d'une réaction d'hypersensibilité (HR)
(Racapé et al., 2002). Cette réaction,
considéré comme étant la réponse des plantes aux
virus la plus connue, est exprimée dans la plante par le
développement de lésions nécrotiques qui se produisent au
site de l'infection et restreint le développement du microorganisme en
le privant de l'eau et des nutriments nécessaires à sa croissance
(Keen, 1990).
5.2.4.2. Les éliciteurs
Les éliciteurs, composés responsables des
réactions de défense chez la plante hôte, peuvent
être d'une part des éliciteurs naturels produits par les
microorganismes phytopathogènes comme les virus ou de
synthèses.
· Les éliciteurs
naturels
Les éliciteurs de phytopathogènes tel que les
virus ou les champignons, de nature chimique variée (oligomères
de chitine, de pectine, des glucanes, des (glyco) protéines et des
lipides), sont constitués des PAMPs (Pathogen-Associated Molecular
Patterns), non spécifiques, qui sont reconnus par plusieurs plantes et
des composés plus spécifiques, les protéines d'avirulence,
qui sont reconnues par des cultivars particuliers (Montesano et al.,
2003).
Les PAMPs interviennent dans l'immunité PTI
(PAMP-Triggered Immunity) et appartiennent à une large classe
de molécules incluant des composés lipidiques, des glycolipides,
des polymères de sucres, ou des (glyco-) peptides et protéines.
Toutefois, les structures des différentes classes de PAMPs sont
hautement conservées d'un microorganisme à l'autre. Ces
éliciteurs, isolés de virus sont produits de manière
constitutive par le pathogène car ils sont généralement
essentiels à son bon fonctionnement (Nurnberger et Lipka, 2005 ;
Chisholm et al., 2006).
D'autre part, bien qu'elles ne soient pas
considérées comme des PAMPs, les protéines d'avirulence
sont tout de même reprises comme molécules élicitrices de
défense, puisqu'elles sont en mesure de déclencher une
réponse hypersensible chez les plantes possédant les gènes
de résistance. Chez les plantes sensibles, elles facilitent la
pathogénicité, entre autre, en retardant le renforcement de la
paroi (formation de callose), en modifiant l'activité de
protéines dans la cellule-hôte ou en interférant avec la
transcription des gènes de défense (Montesano et al.,
2003 ; Chisholm et al., 2006).
· Les éliciteurs de
synthèse
L'induction de la réaction de défense des
plantes, pour une meilleure résistance contre les phytovirus, est
aujourd'hui devenue possible par la synthèse de substances chimiques
jouant le rôle d'éliciteurs.
En fait, l'étude des voies de signalisation,
grâce à l'utilisation des outils biochimiques, pharmacologiques et
génétiques, des événements biochimiques
observés dans les premières minutes de l'élicitation ainsi
que la compréhension des enchaînements et des régulations
croisées entre ces événements et l'identification des
réponses physiologiques qu'ils contrôlent, constituent aujourd'hui
un défi majeur (Dangl et Jones, 2001). Ces études ont mené
à l'identification de l'efficacité de certaines substances
chimiques tel que le monoxyde d'azote et des oligosaccharides extraits d'algues
marines :
- Le monoxyde d'azote
Récemment, diverses équipes de recherche se sont
intéressées au rôle potentiel du monoxyde d'azote (NO) dans
la résistance des plantes aux micro-organismes pathogènes
(Wendehenne et al., 2004). Selon Morot-Gaudry et al., (2005)
Ces études ont montré que les cellules végétales
produisent le NO lorsqu'elles sont confrontées à l'attaque de
micro-organismes potentiellement pathogènes ou par des éliciteurs
de réactions de défense. Il a été
démontré alors que le NO est un acteur essentiel de la
résistance des plantes aux micro-organismes pathogènes. En effet,
suivant les modèles d'études, le NO est nécessaire au
développement de la réponse hypersensible permettant ainsi de
confiner le pathogène à son site de pénétration. De
plus, ce NO est indispensable à l'expression de gènes de
défense variés codant pour des protéines PR, des
protéines impliquées dans la synthèse de phytoalexines ou
encore dans la protection contre des stress oxydatifs. Finalement, le NO est
nécessaire à la synthèse d'acide salicylique et, en
conséquence, à la mise en place de la réponse
systémique.
- Les oligosaccharides extraits d'algues
marines
Selon Klarzynski (2001), afin d'améliorer par des
moyens naturels la protection des plantes contre les agents pathogènes,
une stratégie consiste à utiliser des éliciteurs capables
de stimuler les mécanismes de reconnaissance impliqués dans la
mise en place des réponses de défense des plantes. Ces
éliciteurs sont des oligosaccharides extraits d'algues marines.
Les résultats obtenus sur une plante modèle de
tabac montrent que des oligomères caractéristiques d'alginates,
de carraghenenes, de fucanes et de laminarine sont perçus efficacement
par les plantes.
Ces éliciteurs provoquent des effets
différentiels. Les structures les plus actives dans les tests
réalisés sont la laminarine et les oligofucanes. Ces
molécules induisent tout un spectre de réponses de défense
dont l'accumulation de peroxyde d'hydrogène, l'induction d'enzymes
clés des voies métaboliques des phenylpropanoïdes et des
oxylipines., l'accumulation de l'acide salicyclique (AS), de plusieurs familles
de protéines PR et de phytoalexine (la scopoletine). L'application de la
laminarine des oligofucanes stimule fortement la résistance du tabac
contre le virus de la mosaïque dans les zones traitées et
également dans les zones non traitées de la plante.
1. Matériel utilisé 1.1. Matériel
végétal
· Pomme de terre
Les variétés de pomme de terre utilisées
lors de cette étude sont Spunta qui est issue du programme national de
multiplication des semences assuré par le GIL, gracieusement fournie par
le Groupement interprofessionnel des légumes et Atlas, Bellini et
Océana qui sont gracieusement fournies par la société
Agrutica-Agripac.
· Tomate et Melon
Les variétés de tomate utilisées sont
Templar F1 et Chriha et celles du melon sont Ananas d'Amérique et Jaune
canari. Les semences fournies par la société Espace vert sont
commercialisées sous la marque Baddar
· Vigne
Des boutures de vigne issues des deux variétés,
Muscat d'Italie et Red Globe, gracieusement fournies par le GOVPF, ont
été utilisés lors des essais de
pathogénicité.
1.2. Matériel fongique
Le matériel fongique utilisé consiste à
un ensemble d'espèces de champignons qui ont été
gracieusement fournies par différents établissements de recherche
agronomique en Tunisie et en France. Le tableau 1 montre l'ensemble des
espèces fongiques utilisées ainsi que leur établissement
d'origine.
Tableau 1 : Les espèces fongiques
utilisées
Espèce fongique Etablissement
d'origine
Fusarium oxysprum f.sp. radicis-lycopersici
(Forl) INRA Tunisie
Fusarium oxysprum f.sp melonis (Fom) ISA Chott
Mariem
Fusarium solani (Fs) IO Sfax
Verticillium albo atrum (Vaa) INRA France
Egalement, un autre champignon aérien, Botrytis
cinerea, a été utilisé. Ce dernier a
été isolé à partir d'un fruit de fraise de la
compagne de cette année montrant des symptômes de la pourriture
grise. Cet échantillon provient de la station expérimentale du
GIL à Korba.
Pour s'assurer de la pureté des champignons ainsi
cités, des observations microscopiques après coloration par le
bleu de méthylène du mycélium de ces derniers, ont
été réalisées. L'identification de ces
pathogènes a été basée sur des caractères
morphologiques.
1.3. Produits phytosanitaires
Dans cette étude plusieurs produits phytosanitaires ont
été utilisés :
· Dalgin Active (DA)
C'est un biofongicide liquide extrait d'algues marines
(Ascophyllum nodosum) qui contient naturellement plus de 60 macro et
micro substances nutritives, des glucides, des acides aminés et des
promoteurs de croissance de la plante. Il nous a été
gracieusement fourni par la société CODA (SAS, Leilda-Espagne)
pour tester son activité antimicrobienne. De plus, ce produit inclut des
micro éléments supplémentaires, des acides aminés
et un complexe de vitamines qui fournit conjointement un effet de stimulation
et augmente le potentiel de défense et de résistance de plantes
aux attaques de pestes et des maladies, avec une large gamme d'action contre
des champignons, des bactéries et des virus. Il est appliqué par
pulvérisation foliaire à raison de 250 ml / 100 l.
· Zytroseed (Zy)
C'est un biofongicide à base d'extrait de pépins
de fruits qui contient des substances
naturelles telles que l'acide
ascorbique et l'acide citrique. Il nous a été gracieusement
fourni
par la société CODA (SAS, Leilda-Espagne) pour
tester son activité antimicrobienne. Il est doté d'action
fongicide et bactéricide comme il est capable de détruire les
membranes cellulaires du pathogène par l'activation des réactions
de défense de la plante. Il est appliqué par pulvérisation
foliaire à raison de 200 ml / hl.
· Alga bactéricide (AB)
C'est un produit liquide à base de bio-iode (> 3 %)
et d'algue, soluble dans l'eau et de potentiel hydrogène qui est
égale à 3. Il est caractérisé par une
activité antimicrobienne et antifongique remarquable et il peut
être utilisé contre la moisissure grise, le fusariose,
l'anthracnose et les virus responsables des symptômes de mosaïques.
De plus, ce produit permet d'induire la réaction de défense chez
la plante. Également, il présente une bonne stabilité avec
absence de résidus et améliore la croissance, la qualité
et le rendement des plantes. Ce produit est appliqué par
pulvérisation foliaire à raison de 1l / 500 l.
· 2% Ningnan Mycin (NM)
C'est un biopesticide à large spectre et de grande
efficacité. Il s'agit en fait d'un agroantibiotique, à base de
maïs et de soja, de basse toxicité et avec peu de résidus en
comparaison avec les pesticides chimiques. Il est caractérisé par
un effet remarquable sur la croissance, la qualité et le rendement des
plantes et par une activité antifongique, antimicrobienne et antivirale
avec plusieurs végétaux en induisant la réaction de
défense chez la plante. Il peut être utilisé pour le cas de
plusieurs maladies virales tel que le virus de la mosaïque de concombre,
les virus de la tomate, les virus de piment et de poivron, les virus de la
pomme de terre, le virus de la mosaïque de tabac et d'autres maladies
bactériennes et fongiques tel que le Fusarium et le
Verticillium. Ce produit est appliqué par pulvérisation
foliaire à raison de 1l / 500 l.
· Tachigaren (Tach)
C'est un fongicide chimique, à base d'hymexazole,
à systémie ascendante (Origine Sumitomo, Japon et qui nous a
été gracieusement fourni par la Société
Agriprotec). Appliqué par arrosage au sol ou par irrigation dans les
supports de culture, il est facilement absorbé par les racines et
véhiculé dans la plante. Ce produit peut être
utilisé en préventif ou en curatif précoce dès
l'apparition de symptômes.
Au-delà de son action sur les champignons, il a une
action physiologique remarquable sur la plante. Celle-ci se traduit par un
développement très intéressant du chevelu racinaire,
permettant une augmentation notable du rendement.
· Codaphos Cuivre (COCU)
Ce produit est riche en phosphore, nitrogène et
cuivre. Il augmente le système de défense naturel de la plante.
Il nous a été gracieusement fourni par la société
CODA (SAS, LeildaEspagne) pour tester son activité antimicrobienne. Il
peut être appliqué par pulvérisation foliaire à
raison de 200 ml/hl ou par fertigation à une concentration de 4 à
5 ml/hl.
· Switch (S)
C'est un fongicide contre Botrytis qui attaque les
cultures maraîchères et la vigne (Origine Syngenta). Ce produit
est une combinaison entre deux matières actives, l'une à
systémique locale et l'autre de contact, qui agissent d'une façon
différente contre ce pathogène. Le fludioxonil bloque le
processus de transport des cellules fongiques au niveau membranaire alors que
le Cyprodinil est une substance à systémique locale. Elle
empêche la biosynthèse des acides aminés du champignon lors
de sa pénétration dans le tissu végétal ou pendant
la croissance de son mycélium. Il est appliqué par
pulvérisation foliaire à une concentration qui est égale
à 90 ml/hl.
· Mythos (My)
C'est un fongicide à base de pyriméthanil contre
Botrytis. Il est appliqué par pulvérisation foliaire
à raison de 100ml/hl.
· Acide salicylique (AS)
L'acide salicylique, naturellement synthétisé
par certains végétaux, est un acide carboxylique incolore et
cristallin qu'on l'extrayait principalement du saule, salix en latin
dont il tire son nom.
Chez les plantes, l'acide salicylique joue un rôle
essentiel dans les mécanismes de défense contre les infections et
les agressions extérieures. En fait, cette molécule agit comme un
signal chimique permettant à la plante de résister aux
bactéries, virus ou champignons microscopiques qui l'attaquent en
déclenchant la production de protéines de défense qui sont
capables de détruire les agresseurs. Il s'agirait d'une sorte de
réaction de défense immunitaire
végétale. Il est appliqué par
pulvérisation foliaire à une concentration qui est égale
à 5mM à partir du produit chimique (Acros, poids
moléculaire=160g/mol).
1.4. Le Flashkit
Le Flashkit, constitué d'une bandelette de
détection et d'un sachet de broyage rempli d'une solution tampon
d'extraction permet un diagnostic rapide sur plantes présentant ou non
les symptômes de la maladie provoquée par le virus.
Le diagnostic des virus par les flashkits est simple et peut
être effectué en quatre étapes (figure 14). Il s'agit tout
d'abord de prendre un échantillon de feuilles d'une même plante et
le placer entre les parois tissées du sac de broyage. Ensuite, il faut
écraser le sac de broyage avec un outil solide pour broyer
complètement l'échantillon. Après, il s'agit
d'insérer l'extrémité de la bandelette de détection
dans l'extrait, à côté des parois tissées. Enfin, il
suffit d'attendre un minimum de 5 minutes et un maximum de 30 minutes avant de
lire et interpréter le résultat. Deux cas peuvent avoir lieu :
soit qu'il y a apparition de la ligne de contrôle seulement qui assure le
bon fonctionnement du test, donc la plante est saine ; soit qu'il y a
apparition de la ligne de contrôle et de la ligne test ce qui preuve que
la plante est virosée. Le test est supposé nul et doit être
refait avec une bandelette neuve, si la ligne de contrôle
n'apparaît pas.

Figure 14 : Différentes étapes suivies
lors d'un test Flashkit (a : Prélèvement d'un
échantillon,
b : Broyage de l'échantillon, c : Insertion de la
bandelette de détection)
1.5. Le test ELISA
Le test ELISA, outil le plus fréquemment utilisé
pour la détection sérologique d'entités virales, a
été réalisé au laboratoire de Mornag du service de
la protection et contrôle de qualité des produits agricoles du
ministère de l'agriculture.
Ce test ELISA comporte en fait quatre étapes
séparées par une période d'incubation et un lavage. La
première étape consiste à une adsorption des anticorps sur
les parois et le fond des puits de la plaque de microtitration « coating
». Ensuite, les particules antigéniques présentes dans
l'échantillon se lient spécifiquement aux anticorps
adsorbés Après, les anticorps couplés à une enzyme
(la phosphatase alcaline) se fixent aux particules antigéniques
déjà liées aux anticorps de «coating». Enfin,
l'addition d'un substrat spécifique à cette enzyme donne par
hydrolyse une couleur jaune caractéristique (Clauzel et Lefebvre,
1991).
Les résultats du test ont été
scorés suite à lecture photométrique de l'intensité
de la coloration.
2. Méthodologie de travail 2.1. Test de
fongitoxicité
Le test de fongitoxicité ayant pour but
d'étudier la résistance des champignons vis-à-vis des
produits phytosanitaires, a été effectué dans cette
étude afin de chercher la dose optimale à utiliser pour quelques
produits phytosanitaires et ceci en calculant la dose qui inhibe 50% de la
croissance mycélienne de. En fait, cette dose de matière active
doit être la plus faible et la plus efficace afin de répondre au
rapport qualité / prix recherché par les agriculteurs. Dans cette
étude, les produits utilisés sont de deux types : des produits
à action indirecte qui induisent la réaction de défense
chez la plante et des fongicides de référence à action
directe fongitoxique sur le pathogène.
2.1.1. Les doses appliquées
Le choix des doses des produits utilisés a
été tributaire de la détermination de la CI50 qui
représente la dose inhibitrice de 50 % de la croissance
mycélienne. C'est pourquoi, une gamme de dilutions ainsi que des
multiples de la dose recommandée par le fournisseur, pour être
appliquée au champ, a été effectuée. Le tableau 2
représente les différentes doses appliquées lors du test
de fongitoxicité calculées par rapport aux doses
recommandées.
Tableau 2 : Gamme de dilutions des produits
utilisés par rapport aux doses recommandées
|
Produits
|
Doses
recommandées
en ppm
|
|
Les doses appliquées en ppm
|
|
|
|
Alga Bactéricide
|
2000
|
8000
|
; 4000 ;
|
2000 ; 1000 ; 700 ; 600 ; 500 ;
|
400 ;
|
|
|
|
|
|
250 ; 200 ; 20
|
|
|
|
Dalgin Active
|
2500
|
|
50000 ;
|
10000 ; 5000 ; 2500 ; 250 ; 25
|
|
|
|
2% Ningnan
Mycin
|
Non
recommandée
|
|
16000
|
; 8000 ; 4000 ; 2000 ; 200 ; 20
|
|
|
|
Zytroseed
|
2000
|
8000 ;
|
4000 ;
|
3000 ; 2000 ; 1000 ; 500 ; 250 ;
|
240 ;
|
|
|
|
|
|
220 ; 200 ; 100 ; 20
|
|
|
|
Tachigaren
|
10000
|
10000
|
; 5000 ;
|
2500 ; 1250 ; 1000 ; 750 ; 500
|
; 250
|
;
|
|
|
|
|
100
|
|
|
|
Mythos
|
1000
|
|
|
1000 ; 500 ; 250
|
|
|
2.1.2. Protocole expérimental
Pour tous les champignons utilisés, chaque dose de
produit a été additionnée à un volume de 20 ml de
milieu de culture PDA (Potato Dextrose Agar) qui est à base de pomme de
terre, saccharose et agar solidifiant. Après
homogénéisation du milieu, ce dernier a été
coulé sous hôte dans des boites de pétri stériles de
8,5 mm de diamètre. Egalement, pour chaque test, un témoin
correspondant à une boite de pétri contenant seulement un volume
de 20 ml de milieu PDA sans aucun produit a été utilisé.
Ensuite, à chaque boite de pétri (contenant le milieu PDA sans ou
avec produit), une portion d'agar de 5 mm de diamètre a
été prélevé à partir du front de croissance
mycélienne des champignons pures et fraîches et ceci à
l'aide d'une pipette pasteur et d'un scalpel désinfectés.
L'incubation de ces tests de fongitoxicité a été
réalisée dans un incubateur à une température de
20° C pour tous les champignons.
Les produits phytosanitaires et leurs doses appliquées
pour chaque champignon dans cette étude sont résumés dans
le tableau 3.
Tableau 3 : Les tests de fongitoxicités
appliqués aux différents champignons
|
Champignons
|
Produits
|
Doses
|
|
BCF1.09
|
Dalgin Active
|
50000 ; 10000 ; 5000 ; 2500 ; 250 ; 25
|
|
Alga Bactéricide
|
2000 ; 1000 ; 700 ; 600 ; 500 ; 400 ; 250 ; 200 ; 20
|
|
Ningnan Mycin
|
16000 ; 8000 ; 4000 ; 2000 ; 200 ; 20
|
|
Zytroseed
|
2000 ; 1000 ; 500 ; 250 ; 240 ; 220 ; 200 ; 20
|
|
Tachigaren
|
10000 ; 1000 ; 100
|
|
Mythos
|
1000 ; 500 ; 250
|
|
Fs
|
Dalgin Active
|
10000 ; 5000 ; 2500 ; 250 ; 25
|
|
Alga Bactéricide
|
8000 ; 4000 ; 2000 ; 200 ; 20
|
|
Ningnan Mycin
|
2000 ; 200 ; 20
|
|
Zytroseed
|
4000 ; 2000 ; 1000 ; 500 ; 250 ; 200 ; 20
|
|
Tachigaren
|
10000 ; 5000 ; 2500 ; 1250 ; 1000 ; 100
|
|
Forl
|
Dalgin Active
|
2500 ; 250 ; 25
|
|
Alga Bactéricide
|
2000 ; 200 ; 20
|
|
Ningnan Mycin
|
2000 ; 200 ; 20
|
|
Zytroseed
|
4000 ; 3000 ; 2000 ; 1000 ; 500 ; 250 ; 200 ; 20
|
|
Tachigaren
|
10000 ; 1000 ; 750 ; 500 ; 250 ; 100
|
|
Fom
|
Zytroseed
|
1000 ; 500 ; 250
|
|
Tachigaren
|
10000 ; 1000 ; 100
|
|
Vaa
|
Zytroseed
|
1000 ; 500 ; 250 ; 200 ; 100
|
|
Tachigaren
|
10000 ; 1000 ; 100
|
2.1.3. Suivi du test de fongitoxicité
Afin d'évaluer l'efficacité des produits
utilisés pour le test de fongitoxicité avec les différents
champignons aérien et du sol, des mesures des deux diamètres
perpendiculaires de la croissance mycélienne ont été
prises chaque jour pour le cas du B. cinerea pendant cinq jours (la
période qui correspond au maximum de développement du champignon
dans un milieu sans produit) et tout les deux jours pour le cas des champignons
du sol et ceci durant presque
15 jours (la période qui correspond au maximum de
développement du champignon dans un milieu sans produit).
Le pourcentage de la croissance mycélienne des
différents champignons repiqués dans les milieux contenants les
différentes doses de produits, a été estimé par
rapport aux témoins qui sont repiqués dans un milieu PDA
seulement et ceci en calculant la vitesse de croissance mycélienne
définie selon la formule suivante :
Vitesse croissance mycélienne = (diamètre
j+1 - diamètre j) / nombre de jours Avec : j = jour
Le pourcentage de la croissance mycélienne est
déterminé en calculant le rapport de la vitesse
110
de la croissance mycélienne journalière du
champignon dans un milieu contenant le produit
100
sur la vitesse de la croissance mycélienne
journalière du champignon dans un milieu sans
90
produit (témoin).
Vitesse de la croissance mycélienne sur milieu
avec produit x 100
70
% Croissance mycélienne =
Vitesse de la croissance mycélienne sur milieu
sans produit
60
Les résultats ainsi obtenus ont été
portés sur une courbe logarithmique où le pourcentage
de
croissance a été exprimé en fonction de la dose
appliquée et la concentration qui inhibe 50%
40
de la croissance mycélienne a été ensuite
déterminée à partir de la droite obtenue.
30
Ci-dessous, un exemple de courbe représentative de la
CI50.
20
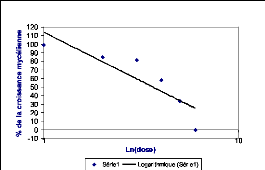
Figure 15 : Exemple d'une courbe de
régression
2.2. Test de pathogénicité sur des feuilles
détachées
Les tests d'inoculation sur des feuilles
détachées ont pour but d'estimer l'effet de quelques produits sur
l'induction de la réaction de défense chez la plante contre
l'agression du champignon aérien B. cinerea. C'est pourquoi des
traitements par différents produits ont été
appliqués sur des plantules de la famille des Solanacées
et des Cucurbitacées qui ont été semées
dans des plaques alvéolées contenant de la tourbe, ainsi que sur
des boutures de vigne placées dans des bac contenant un mélange
de sable et de tourbe. Les produits utilisés sont l'Alga
Bactéricide, la Dalgin Active, le Ningan Mycin, l'acide salicylique et
le Codaphos Cuivre (figure 16). Ces derniers ont été
appliqués par pulvérisation foliaire à l'aide d'un
pulvérisateur manuel. Concernant les plantules témoin, elles ont
été pulvérisées avec de l'eau distillée.
Pour évaluer l'efficacité de ces produits sur
l'activation du système de défense des végétaux
contre B. cinerea, des inoculations artificielles ont
été effectuées selon deux méthodes (inoculation par
implant mycélien ou par suspension sporale) après 24 heures, 48
heures et 72 heures des traitements et ceci pour déterminer la
durée requise pour une meilleure action du produit.
Concernant la première méthode d'inoculation
foliaire par implant mycélien, elle consiste à prélever
des feuilles à partir des plantules traitées et les placer dans
une chambre humide (boite de pétri en verre contenant du papier filtre
imbibé). Ensuite, une portion d'agar de 5 mm de diamètre,
prélevée à l'aide d'une pipette pasteur stérile
à partir du front de croissance mycélienne fraîche du
B. cinerea, a été mise en contact avec la face
inférieure de chaque feuille (figure 17).
En ce qui concerne la deuxième méthode
d'inoculation par suspension sporale,il s'agit en fait de mettre sur chaque
feuille une goutte de 10 ul d'une suspension sporale préalablement
préparée.
Cette suspension sporale a été
préparée à partir d'une culture de B.cinerea sur
milieu PDA qui a été maintenue dans un incubateur à
20°C pendant deux semaines. Les spores ont été
prélevées par raclage de la surface de la culture à l'aide
d'un scalpel préalablement désinfecté en présence
de quelques millilitres d'eau distillée stérile. La concentration
a été déterminée par observation sous microscope
optique à l'aide d'une cellule de malassez. La suspension a
été ensuite ajustée par des dilutions à la
concentration 107 spores/ml.
Pour les deux méthodes d'inoculation artificielle, les
boites de pétries contenant les feuilles inoculées ont
été placés dans un incubateur à 20°C.
Figure 16: Un plateau de tomate traité Figure 17 :
Des feuilles de tomate inoculées
pour le test d'inoculation foliaire par un implant
mycélien de B. cinerea
Les symptômes causés par B. cinerea ont
été évalués en mesurant le diamètre du point
d'infection sur la face inférieure de la feuille. Le suivi des
nécroses a été effectué durant trois jours
après inoculation dans le cas de l'implant mycélien et une
semaine dans le cas de la solution sporale.
2.3. Test de pathogénicité sur des plantules
2.3.1. Cas du B. cinerea
Afin de tester l'effet préventif et curatif des
produits utilisés pour l'induction de la réaction de
défense chez les plantes contre B. cinerea, trois types de
traitements par pulvérisation foliaire ont été
effectués par différents produits (le Switch comme un
témoin positif, le Zytroseed, la Dalgin Active et l'acide salicylique)
:
- Un traitement préventif d'un premier bloc trois jours
avant l'inoculation - Un traitement d'un deuxième bloc le même
jour de l'inoculation
- Un traitement curatif d'un troisième bloc trois jours
après l'inoculation
L'inoculation par la suspension sporale de B. cinerea de
concentration ajustée à 107 spores/ml a
été appliquée par pulvérisation foliaire le
même jour pour les trois blocs.
Bloc 1 : Traitement après inoculation
Bloc 2 : Traitement et inoculation
simultanés
Bloc 3 : Traitement avant inoculation
Te S Zy DA AS
Figure 18 : Schéma expérimental du test
d'inoculation foliaire par suspension sporale
Une fois inoculées, les plantules ont été
placées dans une chambre de culture sous des cages plastiques
humidifiés tous les jours afin de créer un microclimat convenable
au développement du pathogène. L'efficacité des produits
appliqués a été évaluée suite à la
mesure de la taille moyenne des plantules inoculées au niveau de chaque
bloc de traitement et de chaque produit utilisé.
2.3.2. Cas du Fusarium et Verticillium
2.3.2.1. Préparation d'une suspension
sporale
Des suspensions sporales ont été
préparées à partir des cultures de champignons (FOM, Forl,
Fs et Vaa), diluées dans 50 ml de milieu PDB (Potato Dextrose Broth), et
ainsi inocubées pendant quelques jours en agitation continue pour
favoriser la multiplication des spores. Ensuite, la concentration a
été déterminée par observation sous microscope
à l'aide d'une cellule de malassez et ajustée par des dilutions
à la concentration 107 spores/ml.
2.3.2.2. Protocole expérimental
Plusieurs tests d'inoculation racinaire ont été
effectués sur plusieurs espèces végétales afin
d'observer les symptômes caractéristiques causés par les
quatres pathogènes testés. Pour cela deux méthodes
d'inoculation ont été appliquées :
- Inoculation par trempage
Les plantules prélevées à partir des plaques
alvéolées ont été débarrassées de
leur tourbe et trempées jusqu'à l'axe hypocotyle dans la
suspension sporale pendant 15 min. Concernant les
plantules témoins, elles ont été
trempées dans de l'eau distillée. Une fois inoculées, les
plantules ont été repiquées dans des pots contenant de la
tourbe.
- Inoculation par irrigation
Cette méthode d'inoculation consiste à irriguer
les plantules semées dans les plaques alvéolées par une
suspension sporale préalablement préparée de sorte que
chaque plantule reçoit un millilitre de la suspension sporale. Les
plantules témoins ont été irriguées par de l'eau
distillée.
Afin de tester l'efficacité de certains produits sur
l'induction de la réaction de défense des plantes en
présences des champignons telluriques, cette dernière
méthode d'inoculation a été adoptée.
Les produits qui ont été utilisées par
irrigation lors de ce test sont le Codaphos cuivre, le Zytroseed et le
Tachigaren. Ces derniers ont été appliqués selon trois
types de traitement :
- Un traitement préventif d'un premier bloc une semaine
avant l'inoculation - Un traitement d'un deuxième bloc le même
jour de l'inoculation
- Un traitement curatif d'un troisième bloc une semaine
après l'inoculation
|
Bloc 1 : Traitement après inoculation
Bloc 2 : Traitement et inoculation
simultanés
Bloc 3 : Traitement avant inoculation
|
|
|
Te COCU Zy Tach
|
Figure 19: Schéma expérimental du test
d'inoculation racinaire
L'inoculation par la suspension sporale de Fom, Forl et Vaa de
concentration égale à 107 spores/ml a
été appliquée le même jour pour les trois blocs de
plantules.
2.3.2.3. Suivi du test
L'évaluation de l'efficacité des produits
appliqués consiste à déterminer le nombre de plantes
infestées ainsi que leur niveau d'infestation pour chaque produit et
traitement selon l'échelle de notation de Trapero-Casas A et
Jiminez-Diaz R.M (1985) qui se base sur des observations visuelles. En fait,
selon cette échelle, cinq classes ont été adoptées
en se basant sur le pourcentage des feuilles attaquées. Cette
échelle est présentée dans le tableau 4.
Tableau 4: Classes de l'échelle de notation de de
Trapero-Casas A et Jiminez-Diaz R.M (1985)
Classe Pourcentage d'attaque
0 0
1 1 - 33
2 34 - 66
3 67 - 100
4 Mortalité totale
Après évaluation, pour chaque traitement et produit
utilisé, un indice d'attaque ou MDI (Mass Disease Index) a
été calculé selon la formule suivante :
[(ni x 0) + (ni x 1) + (ni x 2) + (ni x 3) + (ni x 4)] x
100
MDI (%) =
N x 5
Avec : ni = nombre de plantules ayant le même niveau
d'attaque
N = nombre de plantules totale pour chaque type de traitement et
de produit 0 à 4 = niveau d'attaque selon l'échelle de notation
adoptée
2.4. Essai sur les viroses de la pomme de terre 2.4.1. Essai en
plein champ
2.4.1.1. Présentation générale du
site expérimental
L'essai en plein champ a été
réalisé dans une parcelle à Korba, qui appartient au
gouvernorat de Nabeul, au niveau de la station expérimentale du GIL
(Groupement interprofessionnel des légumes). Cette station, couvrant une
superficie de 4 ha, s'occupe essentiellement de la réalisation des
essais sur les nouvelles variétés des cultures
maraîchères pour l'inscription variétale, la multiplication
des semences de pomme de terre de la classe « A » à partir des
semences importés de la classe « E » ainsi que la production
de fraise, tomate, aubergine, pomme de terre de consommation et d'autres
plantes ornementales comme l'oiseau de paradis. La région de la station
expérimentale appartient à une zone bioclimatique subhumide avec
un climat typiquement méditerranéen. Concernant le sol, il est
caractérisé par une texture sableux-limoneuse convenant aux
cultures maraîchères.
2.4.1.2. Conduite de l'essai
La parcelle couvre une superficie totale de 72 m2
dont 24 m2 ont été plantés par des tubercules
de la variété Spunta alors que les autres variétés
Atlas, Bellini et Océana occupent chacune 14 m2 de la
totalité de la parcelle. La plantation de toute la parcelle a
été réalisée le 19 Mars avec une densité de
plantation de trois plants dans un mètre linéaire.
Pour chaque variété de pomme de terre, trois
lignes mesurant 12 m de longueur pour le cas de variété Spunta et
7 m de longueur pour les autres variétés ont été
traité chacune par un produit différent. La première
correspond à la ligne témoin non traité (Te), la
deuxième étant traitée par le produit Alga
Bactéricide (AB) alors que la troisième est traitée par le
produit Dalgin Active (DA) (figure 20).
Le traitement des différents produits est appliqué
par pulvérisation foliaire à l'aide d'un pulvérisateur
à dos.
|
Océana Te
|
Océana AB
|
Océana DA
|
|
Bellini Te
|
Bellini AB
|
Bellini DA
|
|
Atlas Te
|
Atlas AB
|
Atlas DA
|
|
Spunta Te
|
Spunta AB
|
Spunta DA
|

7 m

7 m

7 m

12 m

Figure 20 : Dispositif expérimental de la
parcelle
Egalement, dans le cadre de la lutte contre le mildiou, des
traitements ont été effectués par le fongicide
Anthéor C3 qui est à base de cuivre, de folpel et de cymoxamil
dans le cadre de l'entretien de la parcelle.
Le tableau 5 résume les dates d'application des
diffrents traitements effectués pour induire les réactions de
défense de la pomme de terre par les produits Alga Bactéricide et
Dalgin Active ainsi que contre le mildiou par l'Anthéor C3.
Tableau 5 : Dates des traitements effectués
à la parcelle
Date Traitement effectué
08/04/09 Induction Défense
18/04/09 Induction Défense
22/04/09 Anti-mildiou
28/04/09 Induction Défense
08/05/09 Anti-mildiou
15/05/09 Anti-mildiou
16/05/09 Induction Défense
23/05/09 Induction Défense
2.4.1.3. Suivi de l'essai
Afin d'évaluer l'efficience des produits
utilisés pour induire la réaction de défense des plantes
contre le virus PVY de la pomme de terre, un marquage des plantes douteuses a
été effectué en se basant aux symptômes
causés par ce virus (figure 21). Egalement, la notation des
symptômes a été facilitée par le test Flashkit qui
permet une détection immédiate du PVY.
Après le dernier marquage des plantes douteuses, un
test ELISA a été effectué pour chaque traitement des
quatre variétés. Pour cela, pour chaque traitement des
différentes variétés, 8 feuilles ont été
prélevées à partir de plantes douteuses, non douteuses,
testées par le flashkit avec un résultat négatif et
virosées après confirmation par le test flashkit.

Figure 21 : Marquage des plants douteux
2.4.2. Essai en pot
2.4.2.1. Conduite de l'essai
Cet essai conduit en pots à l'INAT réside dans
deux lots. Le premier est formé de 8 plants de la variété
Spunta plantées le 11 mars 2009 dans des pots contenant un
mélange de sable et de tourbe. Après 20 jours (émergence
complète des plants), des traitements par trois produits inducteurs de
la réaction de défense chez les plantes ont été
appliqués. Ces produits sont l'Alga Bactéricide, le Dalgin Active
et le Ningnan Mycin. Les six traitements effectués par ces produits ont
été appliqués par pulvérisation foliaire à
raison d'un traitement chaque semaine et ceci de façon à ce que
chaque produit soit appliqué à deux plants avec deux
témoins non traités. Ce lot a été placé
à proximité d'un plant de pomme de terre virosée par le
PVY afin de favoriser la transmission du virus aux plantes saines par
l'intermédiaire des pucerons vu qu'il s'agit d'un phytovirus qui se
transmet selon le mode non persistent de manière mécanique, par
microblessure ou par l'alimentation des pucerons surtout le puceron vert du
pêcher.
Le deuxième lot est composé de 12 plants des
variétés Spunta, Bellini et Océana plantées le 8
avril 2009. Lorsque les plants ont atteints le stade d'émergence
complète, des traitements par deux produits, l'Alga Bactéricide
avec deux différentes doses (la dose homologuée à
l'hectare et la double dose) et la Dalgin active, ont été
appliquées. Ces traitements par pulvérisation foliaire, ayant
pour but l'induction du système de défense des plantes contre le
virus Y de la pomme de terre, ont été réalisés 4
fois à raison d'un traitement par semaine et de sorte à avoir
pour chaque variété cultivé un plant témoin, un
traité par le Dalgin active, un traité par l'Alga
Bactéricide avec une concentration qui correspond
à la dose homologuée à l'hectare et un autre plant
traité par l'Alga Bactéricide à la double dose. Pour ce
deuxième lot, après le premier traitement, une inoculation
artificielle par le PVY a été effectuée. La
préparation de l'inoculum PVY consiste à broyer dans un mortier
des feuilles virosées par le PVY avec un tampon d'inoculation
dilué ainsi qu'une certaine quantité de charbon actif ayant un
rôle antioxydant. Le mélange ainsi obtenu sera
déposé sur une feuille de chaque plante après avoir mis
une certaine quantité de carborundum servant pour l'ouverture de pores
au niveau de la feuille sans l'endommager et ceci afin de permettre la
pénétration de l'inoculum PVY dans la sève de la
plante.
2.4.2.2. Suivi de l'essai
Dans le cadre de l'appréciation de l'efficacité
des traitements effectués sur les deux lots, un marquage des plants
douteux a été réalisé et ceci en se fondant sur les
symptômes caractéristiques causés par ce virus Y de la
pomme de terre. Cette évaluation a été aussi guidée
par le test flash kit qui permet la détection du virus même sur un
plant qui ne présente pas les symptômes de la maladie.
Egalement, l'évaluation de l'action de ces produits a
concernée non seulement l'induction de la réaction de
défense vis à vis du PVY mais aussi le rendement des plants.
C'est pourquoi, des pesées de la végétation ainsi que des
tubercules de chaque traitement des quatre variétés a
été effectué lors de la récolte.
1. Caractérisation des produits
1.1. Caractérisation de l'activité fongitoxique des
produits
Les concentrations qui inhibent 50 % de la croissance
mycélienne (CI50) ont été calculées après
avoir déterminé les équations de régressions. Ces
concentrations pourraient nous renseigner sur la dose optimale à
appliquer pour chaque produit in vivo ainsi que sur leur mode d'action
direct ou indirect sur le champignon. C'est pourquoi l'ensemble des produits
testés a été comparé avec des produits de
références ayant une action fongitoxique contre les champignons
cibles. Il s'agit en fait du Mythos pour le cas du B. cinerea et du
Tachigaren pour les champignons du sol notamment Verticillium (Vaa) et
Fusarium (Fs, Forl et Fom).
1.1.1. Alga Bactéricide
Afin de préciser son action directe ou indirecte sur
certains champignons, l'Alga Bactéricide, a été
utilisé dans des tests de fongitoxicité. Ceci a été
tributaire de la détermination de la valeur de la CI50.
Le tableau 6 représente les CI50 calculées pour le
AB ainsi que les produits de référence pour chaque champignon.
Tableau 6 : Différentes valeurs de la CI50
calculées pour les tests de fongitoxicité par AB et par les
produits de référence
|
Produit Champignon
|
CI 50 de AB
(mg/l)
|
CI 50 de My
(mg/l)
|
CI 50 de Tach
(mg/l)
|
|
BCF1.09
|
359
|
1
|
-
|
|
Fs
|
> 8000
|
-
|
1,43
|
Selon le tableau 6, la CI50 est très variable d'un
champignon à l'autre. Elle est faible pour le cas du champignon
aérien B. cinerea en comparaison avec celle du produit de
référence, mais très élevée pour le cas du
champignon du sol Fusarium solani (Fs).
En effet, dans le cas du B. cinerea, le taux de
réduction de la croissance mycélienne s'accroît avec
l'augmentation de la concentration du produit AB jusqu'à l'inhibition
totale à la dose 987 ppm. Par conséquent, nous pouvons dire que
le produit AB présenterait une activité fongitoxique
vis-à-vis de B. cinerea mais qui est faible étant
donnée que les doses à appliquer in vivo doivent
être encore plus élevées que celle in vitro
(presque 10 fois la dose obtenue in vitro).
Pour le cas du F. solani, même en augmentant la
dose du produit, jusqu'à 8000 ppm, il n'y a pas inhibition de la
croissance mycélienne. C'est pourquoi, nous pouvons dire que l'Alga
Bactéricide ne présente pas une action directe sur les
champignons du sol mais pourrait éventuellement avoir une action
indirecte en déclenchant une réaction de défense chez la
plante.
En conclusion, l'Alga Bactéricide, à base de
bio-iode, pourrait être un produit à action principalement
indirecte avec une faible activité fongitoxique. Il permettrait de
stimuler les réactions de défense et d'augmenter la
résistance de la plante vis-à-vis de B. cinerea et
certaines espèces de Fusarium.
1.1.2. La Dalgin Active
La Dalgin Active supposée avoir une action inductrice
des réactions de défense chez les plantes agressées par
des pathogènes, a été testée in vitro par
des tests de fongitoxicité avec certains champignons. Ceci a pour but de
voir son action directe ou indirecte en se basant sur la valeur de la CI50.
Le tableau 7 représente les CI50 calculées pour la
DA et les autres produits de référence pour chaque champignon.
Tableau 7: Différentes valeurs de la CI50
calculées pour les tests de fongitoxicité par DA et par les
produits de référence
|
Produit Champignon
|
CI 50 du DA
(mg/l)
|
CI 50 de My
(mg/l)
|
CI 50 de Tach
(mg/l)
|
|
BCF1.09
|
> 50000
|
1
|
-
|
|
Fs
|
> 10000
|
-
|
1,43
|
différentes entre eux. En effet, pour les deux
champignons, l'augmentation de la dose appliquée du produit ne permet
pas de réduire le taux de croissance mycélienne. A titre
d'exemple, l'addition d'une dose de 50000 ppm au milieu de culture PDA n'a pas
permis d'inhiber le développement du champignon aérien
B.cinerea (figure 22).
Te
DA(20D)
Figure 22 : Test de fongitoxicité de B.
cinerea traité par DA (50000 ppm)
Ces résultats ainsi obtenus pourraient confirmer que la
Dalgin Active, à base d'algues marines (Ascophyllum nodosum),
est un produit à action indirecte. Il permettrait de protéger les
cultures contre les agents pathogènes en augmentant le potentiel de
défense et de résistance des plantes.
1.1.3. Le Ningnan Mycin
Le Ningnan Mycin, supposée avoir une action indirecte
contre les pathogènes, a été testée dans des tests
de fongitoxicité avec B. cinerea afin de s'assurer de son mode
d'action et ceci en se basant sur la valeur de la CI50.
Les CI50 calculées pour ce produit ainsi que pour celle
qui correspond au produit de référence Mythos sont
représentées dans le tableau 8.
Tableau 8 : Différentes valeurs de la CI50
calculées pour les tests de fongitoxicité par NM et par le
produit de référence Mythos
|
Produit Champignon
|
NM
|
My
|
Tach
|
|
BCF1.09
|
> 16000
|
1
|
-
|
Pour B. cinerea, en comparaison avec le produit de
référence, la valeur de la CI50 calculée pour le NM est
très élevée. En effet, l'augmentation de la dose du
produit additionnée au milieu de culture PDA n'a aucun effet inhibiteur
sur la croissance mycélienne. Ceci est confirmé par la
présence d'une courbe de régression linéaire constante
à un pourcentage de 90% de la croissance mycélienne par rapport
au témoin (annexe1).
C'est pourquoi, nous pouvons dire que le Ningnan Mycin,
à base de maïs et de soja, pourrait être un produit ayant une
action indirecte sur les pathogènes en induisant une réaction de
défense et stimulant les mécanismes de défense naturels de
la plante.
1.1.4. Le Zytroseed
Dans le but de caractériser son activité
fongitoxique, le Zytroseed a été testé dans des tests de
fongitoxicité servant pour la détermination de la valeur de la
CI50. Les valeurs calculées pour ce produit ainsi que pour les produits
de référence correspondant à chaque champignon sont
présentés dans le tableau 9.
Tableau 9 : Différentes valeurs de la CI50
calculées pour les tests de fongitoxicité par Zy et par les
produits de référence
|
Produit Champignon
|
CI 50 de Zy
(mg/l)
|
CI 50 de My
(mg/l)
|
CI 50 de Tach
(mg/l)
|
|
BCF1.09
|
253
|
1
|
-
|
|
Fss
|
397
|
-
|
1,43
|
|
Forl (IT)
|
575
|
-
|
1,84
|
|
Fom (C)
|
243
|
|
1,27
|
|
Vaa (IF)
|
-
|
-
|
1,64
|
Selon le tableau 9, les valeurs de la CI50 enregistrées
changent d'une espèce fongique à une autre mais elles sont tous
faibles en comparaison avec les valeurs obtenues pour les produits de
référence. Concernant Verticillium albo atrum, la valeur
de la CI50 pourrait être comprise entre 10 et 50 ppm vu que même
une dilution de 20 fois la dose recommandée a permis une
réduction de la croissance mycélienne.
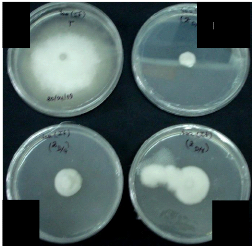
Te
ppm
500
1000
ppm
25O
ppm
Figure 23 : Test de fongitoxicité par le produit
Zytroseed avec le Verticillum
Selon les courbes de régression de tous ces champignons
(annexe1), l'augmentation de la dose du produit utilisée conduit
à une réduction appréciable du pourcentage de la
croissance mycélienne jusqu'à une inhibition totale à une
certaine dose qui varie d'un champignon à l'autre. A titre d'exemple,
l'inhibition totale du champignon aérien B. cinerea in vitro a
été enregistrée à la dose recommandée (2000
ppm) (figure 24).

Te Z(D)
Figure 24: Inhibition totale de la croissance
mycélienne de B.cinerea à la dose recommandée
à
l'hectare (2000 ppm)
Nous concluons alors que le Zytrossed, qui est extrait de
pépins de fruits et qui contient des substances naturelles telles que
l'acide ascorbique et l'acide citrique, présenterait une activité
fongitoxique directe sur les champignons en inhibant leur croissance.
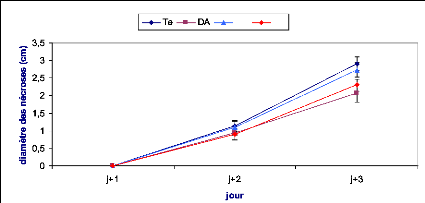
1.2. Tests de pathogénicité sur feuilles
détachées
Après avoir caractériser l'activité
fongitoxique in vitro des différents produits biologiques, un
premier test d'évaluation de leur effet in vivo sur l'induction
de la réaction de défense a été effectué. Ce
test consiste à des inoculations artificielles par le champignon B.
cinerea réalisés sur des feuilles de tomate, de melon et de
vigne. 35
1.2.1. Tomate
L'inoculation des feuilles détachées de tomate
par B.cinerea a été effectué 24h, 48h et
72h
après un traitement préventif du feuillage sur les
plantules par les produits Alga Bactéricide,
Dalgin Active et l'acide
salicylique qui est utilisé comme un témoin positif puisqu'il
est
25
connu par son action inductrice des réactions de
défense chez la plante. Le suivi des nécroses causées par
ce pathogène durant les trois jours post inoculation consiste à
des mesures du 2 diamètre des nécroses au niveau des feuilles.
Les résultats ainsi obtenus pour les trois inoculations
effectuées nous a permis de construire
les courbes qui illustrent
l'action de chaque produit, en comparaison avec le témoin non
traité,
1,5
sur l'évolution au cours du temps des diamètres de
nécroses. 1.2.1.1. Action des produits après 24h du
traitement
La figure 25 montre l'évolution au cours du temps des
diamètres de nécroses causés par le
champignon
aérien B. cinerea sur des feuilles de tomate
prélevées à partir de plantules traités
par
différents produits avant 24h de l'inoculation. Nous remarquons que les
nécroses causées
25
sur les feuilles témoins ainsi que celles causées
au niveau des feuilles traitées suivent une
évolution
pareille. Au cours du premier jour qui suit l'inoculation, nous ne marquons
aucune
nécrose au niveau de toutes les feuilles inoculées.
Alors qu'à partir du deuxième jour post
2
inoculation, il y a un élargissement progressif des
surfaces des nécroses pour toutes les
feuilles. Ces nécroses
sont en fait plus importantes au niveau des feuilles témoins. Alors
que
1,5
le diamètre de nécroses le plus petit a
été enregistré au niveau des feuilles traitées par
la Dalgin Active.
1.2.1.2. Action des produits après 48 h du
traitement
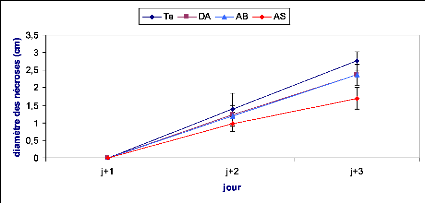
Figure 26 : Evolution des nécroses causées
par B.cinerea sur des feuilles de tomate après
48 h d'un traitement préventif
Les courbes correspondantes aux diamètres de
nécroses au niveau des feuilles témoins et celles
préalablement traitées par les différents produits suivent
une même trajectoire. En fait, l'apparition des nécroses a
été enregistrée à partir du deuxième jour
post inoculation et une évolution du diamètre des nécroses
pour toutes les feuilles inoculées et surtout celles non traitées
a été notée.
Le traitement des plantules par l'Alga Bactéricide et la
Dalgin Active a permis une faible
réduction des nécroses en
comparaison avec le témoin positif correspondant au traitement des
feuilles par l'acide salicylique. Ce dernier a permis une
réduction considérable des nécroses grâce à
son effet inducteur de la réaction de défense.
15
1.2.1.3. Action des produits après 72 h du
traitement
Les mesures des diamètres de nécroses causés
par B. cinerea sur des feuilles de tomate qui ont
1
été traitées 72 h avant l'inoculation sont
représentées par les courbes illustrées dans la figure
30.
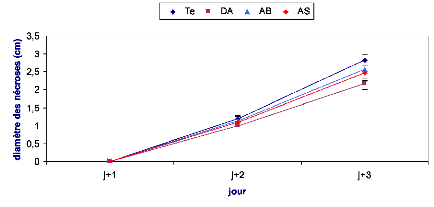
Figure 27 : Evolution des nécroses
causées par B.cinerea sur des feuilles de tomate après
72 h
d'un traitement préventif
Selon la figure 27, nous constatons que l'évolution au
cours du temps des diamètres de nécroses des feuilles
traitées et non traitées est similaire. En effet,
l'élargissement des surfaces nécrosées au niveau des
feuilles commence à partir de la deuxième journée qui suit
l'inoculation artificielle. De plus, nous notons que les feuilles
traitées par les différents produits présentent des
diamètres de nécroses qui sont très proches de ceux
enregistrés au niveau des feuilles prélevées à
partir des plantules témoins.
1.2.1.4. Conclusion
En conclusion, la sévérité des
nécroses enregistrée au niveau des feuilles de tomate
traitées par les produits Alga Bactéricide et Dalgin Active au
niveau des trois dates d'inoculation est similaire à celle des feuilles
témoins. C'est pourquoi, nous pouvons affirmer l'absence d'une
différence entre les nécroses dues au B. cinerea sur les
feuilles de tomate pour les différents traitements et les dates
d'inoculation. Ceci pourrait être dû aux faibles doses
appliquées lors du traitement foliaire ainsi que les conditions
expérimentales. Egalement, il faut noter que
l'acide salicylique nécessiterait une période de
48h après son application pour induire une réaction de
défense chez la plante. Ainsi, une augmentation des doses
appliquées pourrait améliorer l'action de ces produits en
induisant une réaction de défense et rendant la plante plus
résistante au pathogène.
1.2.2. Vigne
Pour les deux variétés de vigne utilisées
dans cette étude, des traitements préventifs ont
été effectués par le Dalgin Active (à la double
dose qui est appliquée à l'hectare), l'Alga Bactéricide,
le Codaphos cuivre et l'acide salicylique. Afin d'évaluer leur
efficacité in vivo dans l'induction de la réaction de
défense, des inoculations foliaires ont été
effectuées d'une part par un implant mycélien et d'autre part par
une suspension sporale de B. cinerea de concentration égale
à 1 07spores/ml.
1.2.2.1. Action des produits suite à l'inoculation
par un implant mycélien de B.cinerea L'inoculation
artificielle, par implant mycélien, des feuilles détachées
de vigne a été réalisée après 48 h et 72 h
du traitement pour les deux variétés.
Le suivi du test consiste à mesurer les diamètres
de nécroses causées par ce champignon au niveau de chaque
feuille. Ainsi, les résultats obtenus sont illustrés dans le
tableau 10.
Tableau 10 : Diamètres de nécroses
mesurés après trois jours de l'inoculation
|
Te
|
AB
|
DA 2D
|
COCU
|
AS
|
|
48 h post
traitement
|
Red Globe
|
1,43
|
1,43
|
1, 1
|
-
|
-
|
|
Muscat d'Italie
|
1,86
|
-
|
1,16
|
0,96
|
2
|
|
72 h post
traitement
|
Red Globe
|
1,16
|
0,91
|
0,8
|
-
|
-
|
|
Muscat d'Italie
|
1,2
|
-
|
0,86
|
0,7
|
1,4
|
Le tableau 10 représente les diamètres de
nécroses mesurés après trois jours de l'inoculation des
feuilles de deux variétés de vigne, par implant mycélien
de Botrytis, et ceci après 48h et 72h du traitement.
Concernant l'inoculation réalisée après
48h du traitement, nous remarquons qu'il y a une
différence entre les
diamètres de nécroses mesurées au niveau des feuilles
témoins non
traitées et celles traitées par les
différents produits excepté l'acide salicylique et l'Alga
Baxtéricide pour la variété Muscat
d'Italie. En effet, pour le cas de la variété Red Globe,
l'utilisation de la double dose de Dalgin Active a permis de réduire les
surfaces de pourriture. Cependant, les traitements avec l'acide salicylique et
l'Alga Bactéricide n'ont pas pu empêcher la pourriture des
feuilles.
Alors que pour le cas de la variété Muscat
d'Italie, les traitements avec la Dalgin Active à la double dose et
surtout avec le Codaphos cuivre ont permis une réduction
considérable des diamètres de nécrose en comparaison avec
le témoin (figure 28).

DA (2D)
COCU AS
Te
Figure 28 : Test d'inoculation foliaire par implant
mycélien des feuilles de vigne de la variété
Muscat
d'Italie
En ce qui concerne l'inoculation réalisée
après 72h du traitement, tous les produits appliqués ont pu
inhibé le développement des nécroses au niveau des
feuilles des deux variétés en comparaison avec le témoin
non traité excepté l'acide salicylique. De plus, nous constatons
que le Codaphos cuivre ainsi que lA Dalgin Active à la double dose ont
permis une réduction encore plus importante après 72h de leur
application qu'après 48h.
Donc, l'augmentation de la dose du Dalgin Active permettrait
d'induire une réaction de défense chez la plante et par
conséquent d'augmenter la résistance de la plante
vis-à-vis du champignon.
De plus, pour la vigne, le Dalgin Active à la double dose,
l'Alga Bactéricide et le Codaphos cuivre nécessiteraient une
période de 72h pour une meilleure action contre B. cinerea.
Alors que concernant l'acide salicylique, l'absence de son
action inductrice de la réaction de
défense pourrait
être due à plusieurs facteurs. En effet, la dose appliquée
(5mM) pourrait être
3
insuffisante pour permettre à la plante de réagir
face aux pathogènes en déclenchant une
réaction de
défense. Egalement, la période nécessaire pour que l'acide
salicylique ait une
meilleure action contre les stress de type biotique
pourrait être plus longue que 72h de la date
2,5
du traitement. Finalement, l'état physiologique des
plantes lors du traitement pourrait
également influencer
l'efficacité de l'action inductrice de la réaction de
défense engendrée par
2
ce produit.
1.2.2.2. Action des produits suite à l'inoculation
par une suspension sporale de B. cinerea
1,5
Une inoculation artificielle des feuilles détachées
de vigne, de la variété Muscat d'Italie, par une suspension
sporale de B. cinerea, a été réalisée
après 72 h du traitement.
Le suivi du test consiste à mesurer les diamètres
de nécroses causées par ce champignon au
1
niveau de chaque feuille. Ainsi, les résultats obtenus ont
été portés sur la courbe suivante (figure 29).
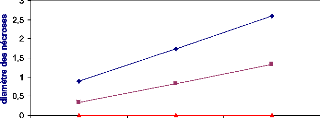
Figure 29 : Evolution des nécroses
causées après inoculation par suspension sporale de
B.
cinerea sur des feuilles de vigne après 72 h d'un
traitement préventif
Selon la figure 32, nous remarquons qu'il y a une
différence entre les nécroses causées au niveau des
feuilles traitées et ceux non traitées ainsi qu'entre les deux
traitements effectués. En fait, l'application du Dalgin Active à
la double dose a permis une réduction considérable des
diamètres de nécroses. Alors que pour le Codaphos cuivre, ce
dernier a inhibé totalement le développement des pourritures.
Ceci confirme alors les résultats enregistrés
pour le cas de l'inoculation par implant mycélien. Par
conséquent, pour la vigne une augmentation de la dose recommandée
de la Dalgin Active pourrait stimuler le système de défense de la
plante après une période de 72h de son application et la rendre
plus résistante vis-à-vis des agressions des pathogènes.
De plus, l'inhibition de développement des nécroses noté
pour le COCU pourrait être expliqué par sa double action
systémique et par contact.
1.3. Test de pathogénicité sur des plantules
Afin d'évaluer l'efficacité des produits
utilisés sur des plantules, différents tests d'inoculation
foliaire et racinaire ont été effectués.
1.3.1. Action des produits vis-à-vis du
B.cinerea
Le test d'inoculation par une suspension sporale de B.
cinerea sur des plantules de tomate et de melon a été
réalisé sur trois types de traitements différents. Il
s'agit en fait, d'un traitement préventif, un traitement au même
jour de l'inoculation foliaire et un autre curatif trois jours après
l'inoculation. Les traitements ont été effectués par
pulvérisation foliaire par les produits Switch, comme un fongicide
témoin, le Zytroseed, la Dalgin Active et l'acide salicylique comme un
témoin positif pour l'induction de la réaction de
défense.
1.3.1.1. Cas de la tomate
Après une semaine de l'inoculation artificielle par
B. cinerea, nous avons remarqué que la taille des plantules
varie sur la même plaque alvéolée. En fait, les plantules
témoins ont gardées la même taille et le même nombre
de feuilles. Alors que les autres plantules traitées surtout par le
switch, le Zytroseed et la Dalgin Active ont continué à
croître d'une façon normale pour les trois types de traitement
(figure 30).

Te S Zy DA AS
Figure 30: Effet des différents traitements sur
la taille des plantules après inoculation par
B.
cinerea
Egalement, nous avons constaté que les plantules
traitées en curatif par l'acide salicylique sont toutes mortes avec
développement d'une pourriture grise caractéristique du B.
cinerea (figure 31). Ceci pourrait être expliqué par le fait
que l'acide salicylique agit dans l'induction de la réaction de
défense seulement s'il est appliqué en préventif.

Prév P+C Cur
Figure 31 : Evolution des symptômes de la
pourriture grise après un traitement curatif par
l'acide
salicylique
La mesure de la taille de toutes les plantules inoculées
au niveau des différents types de traitements, nous a permis de tracer
l'histogramme suivant.
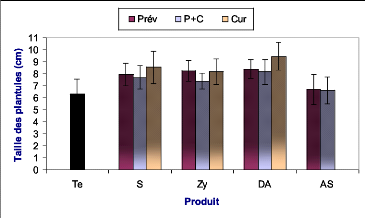
Figure 32 : Taille moyenne des plantules pour chaque
type de traitement et de produit
La différence entre la taille des plantules
témoins inoculées et celles inoculés et traitées
par les différents produits pourrait être expliquée par le
fait que le champignon a inhibé le bourgeon de la croissance
végétative, ce qui a provoqué un blocage des plantules
à leur stade actuel de développement végétatif le
jour de l'inoculation. Egalement, le bon état végétatif
des plantules traitées par le Zytroseed et la Dalgin Active par rapport
aux plantules traitées par l'acide salicylique peut être
expliqué par l'action stimulatrice des produits sur la croissance
végétative.
1.3.1.2. Cas du melon
Concernant l'inoculation des plantules de melon, les
résultats n'étaient pas interprétables vu que les
symptômes n'ont pas apparus au niveau des plantules témoins non
traitées et inoculées. Ces résultats pourraient être
dus à plusieurs facteurs. En fait, le changement des conditions
climatiques au cours du suivi du test, en déplaçant les plantules
inoculées dans une chambre de culture où la lumière et la
température sont différentes de celles dans la serre
vitrée, pourrait perturber le métabolisme de la plante et par
conséquent un mauvais état physiologique des plantules aurait
influencer le développement des symptômes.
1.3.2. Action des produits vis-à-vis des champignons du
sol
Afin de voir les symptômes caractéristiques de
certains champignons telluriques sur la tomate
et le melon, plusieurs tests
préliminaires d'inoculation racinaire par trempage et par irrigation
ont été effectués. Ces tests nous ont
permis de noter des symptômes de chlorose et de flétrissement
sévère ainsi que des pourritures au niveau du collet pour le cas
du Fusarium après un minimum de 15 jours après
l'inoculation (figure 33 et 34).

Figure 33 : Symptômes causés par le Forl
Figure 34 : Symptômes causés par le Fom
Concernant l'évaluation de l'action préventive
et curative des produits utilisés dans cette étude, des tests
d'inoculation artificielle par irrigation d'une suspension sporale de
Fusarium (Forl et Fom) et de Verticillium (Vaa) sur des
plantules de tomate et de melon ont été effectués. Ces
inoculations ont été réalisées sur trois types de
traitements différents : un traitement préventif une semaine
avant l'inoculation, un traitement le jour même de l'inoculation
racinaire et un autre curatif une semaine après l'inoculation. Ces
traitements ont été effectués par irrigation des produits
Codaphos cuivre et Zytroseed.
1.3.2.1. Cas de la tomate
Après trois semaines de l'inoculation par Fusarium
oxysprum f.sp. radicis-lycopersici (Forl), l'évaluation
selon une échelle de notation du degré d'attaque du champignon
sur chaque type de traitement et de produit nous a permis de calculer l'indice
d'attaque correspondant. Le tableau 11 récapitule les résultats
ainsi obtenus.
Tableau 11: Indice d'attaque des plantules de tomate par
le Forl
|
Produit
|
Traitement
|
Indice d'attaque (%)
|
|
Témoin
|
-
|
33
|
|
Codaphos cuivre
|
Préventif
|
6,66
|
|
Le jour de l'inoculation
|
12
|
|
Curatif
|
20
|
|
Zytroseed
|
Préventif
|
28
|
|
Le jour de l'inoculation
|
30
|
|
Curatif
|
23,33
|
Selon le tableau 11, nous remarquons qu'il y a une
différence entre l'indice d'attaque de la maladie correspondant aux
plantules témoins non traitées et celui des plantules qui ont
été irriguées par les deux produits Codaphos cuivre et
Zytroseed.
En effet, pour le Codaphos cuivre, nous avons constaté
qu'en appliquant les traitements une semaine avant l'inoculation par le Forl,
l'indice de la maladie est très faible en comparaison avec le traitement
qui a été effectué le même jour de l'inoculation et
surtout le curatif dont l'indice de la maladie est de 20 %. Par
conséquent, ce produit doit être appliqué en
préventif pour une meilleure action sur le pathogène. Alors que
pour le Zytroseed, une meilleure action a été enregistrée
avec le traitement curatif avec un indice d'attaque de 23,3 %. Ceci s'explique
par l'action fongitoxique directe sur le pathogène.
1.3.2.2. Cas du melon
Concernant les tests d'inoculation sur melon, les
résultats obtenus n'étaient pas interprétables vu que les
symptômes caractéristiques de chaque champignon notamment
Fusarium et Verticillium n'ont pas apparus sur les plantules
témoins. Ces résultats pourraient être dus aux conditions
expérimentales.
2. Effet des produits sur les virus de la pomme de terre
Dans le but d'évaluer l'effet des produits biologiques
testés sur l'induction de la réaction de défense des
plants de la pomme de terre contre les virus, des essais en pot ont
été menés à l'INAT et des essais en plein champ ont
été menés à la station expérimentale du GIL
à Korba.
2.1. Essai en pots
2.1.1. Lot n°1
Pour le premier lot, des évaluations visuelles
quotidiennes des symptômes causées par le virus Y de la pomme de
terre ont été effectuées. Ces évaluations ont
été facilitées par les tests flashkit qui permettent une
détection immédiate de la presence du virus. Les résultats
de ces évaluations sont récapitulés dans le tableau 12.
Tableau 12 : Résultats des évaluations
visuelles et avec flashkit du lot n°1
|
Te1
|
Te2
|
AB1
|
AB2
|
DA1
|
DA2
|
NM1
|
NM2
|
|
1ère évaluation
|
-
|
-
|
-
Test
flashkit
|
-
|
-
Test
flashkit
|
-
|
-
|
-
|
|
2ème évaluation +
1er
Traitement
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
3ème évaluation +
2ème
Traitement
|
+
Test
flashkit
|
-
|
-
Test
flashkit
|
-
|
-
Test
flashkit
|
-
|
-
Test
flashkit
|
-
|
|
4ème évaluation +
3ème
Traitement
|
+
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
5ème évaluation +
4ème
Traitement
|
+
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
6ème évaluation+
5ème
Traitement
|
+
|
-
|
-
|
-
Test
flashkit
|
-
|
-
Test
flashkit
|
-
|
-
Test
flashkit
|
|
7ème évaluation+
6ème
Traitement
|
+
|
-
Test
flashkit
|
-
|
-
|
-
Test
flashki
|
-
|
-
|
-
|
Avec : - : Plant sain
+ : Plant virosé
D'après le tableau 12, après le premier
traitement des plants de pomme de terre, un plant témoin non
traité a été marqué comme douteux. La confirmation
de l'attaque virale a été facilitée par un test flashkit
qui nous a renseigné sur la présence du virus PVY (figure 35).

Figure 35 : Le plant témoin
virosée
Pour les autres plants, durant la période de traitement,
nous n'avons pas révélé la présence de
symptômes du virus. De plus, les tests flashkit effectués ont
donné des résultas négatifs.
Ces résultats ainsi obtenus pourraient être
expliqués soit par l'action protectrice des produits utilisés en
induisant la réaction de défense et empêchant la
transmission du virus de la plante virosée à la plante saine par
l'intermédiaire des pucerons, soit à l'absence de
contamination.
2.1.2. Lot n°2
Concernant le deuxième lot, une inoculation
artificielle par le PVY a été effectuée sur tous les
plants après le premier traitement. Toutefois, aucun symptôme
d'infection virale n'a été marqué pour toutes les
variétés. De plus, des tests flashkit qui ont été
opérés sur tous les plants de la variété Spunta ont
donnés des résultats négatifs. Ceci pourrait être
dû à des contraintes expérimentales lors de l'infection
artificielle.
2.2. Essai en plein champ
2.2.1. Evaluation symptomatologique
En ce qui concerne le suivi de l'effet des traitements
effectués en plein champ sur l'induction de la réaction de
défense des plants de pomme de terre vis-à-vis des virus et
surtout le PVY, un marquage des plants douteux a été
effectué en se basant sur l'évaluation visuelle des
symptômes caractéristiques de PVY ainsi que sur des tests
flashkit. Les résultats des trois évaluations
réalisées sont résumés dans le tableau 13.
Tableau 13: Evaluations visuelles et avec flashkit des
plants douteux en plein champ
|
Variété
|
Traitement
|
Pourcentage des plants douteux (%)
|
|
1ère évaluation
(après
3
traitements)
|
2ère
évaluation
(après 4
traitements)
|
3ère
évaluation
(après 5
traitements)
|
|
Spunta
|
Te
|
8,33
|
30,55
|
36,11
|
|
AB
|
8,33
|
22,22
|
25
|
|
DA
|
2,77
|
11,11
|
13,88
|
|
Traitements
confondus
|
6,47
|
21,29
|
24,99
|
|
Atlas
|
Te
|
0
|
0
|
0
|
|
AB
|
0
|
0
|
0
|
|
DA
|
0
|
0
|
0
|
|
Traitements
confondus
|
0
|
0
|
0
|
|
Bellini
|
Te
|
0
|
0
|
0
|
|
AB
|
4,76
|
4,76
|
9,52
|
|
DA
|
0
|
0
|
0
|
|
Traitements
confondus
|
1,58
|
1,58
|
3,17
|
|
Océana
|
Te
|
9,52
|
9,52
|
19,04
|
|
AB
|
19,04
|
19,04
|
19,04
|
|
DA
|
0
|
0
|
0
|
|
Traitements
confondus
|
9,52
|
9,52
|
12,69
|
En comparant les deux traitements effectués avec le
témoin au niveau de chaque variété de pomme de terre, nous
remarquons qu'il n'y a pas de différence notable. En fait, pour la
variété Bellini, aucun plant témoin douteux n'a
été marqué alors que 9,52 % des plants traités par
l'Alga Bactéricide sont douteux. Cependant, la comparaison des
pourcentages d'attaque par le PVY au niveau de chaque variété,
montre qu'il y a une différence importante (figure 36).
Figure 36 : Pourcentages d'attaque par le PVY des quatre
variétés selon l'évaluation visuelle
D'après la figure 39, nous constatons que selon
l'évaluation visuelle, la majorité des plants marqués
comme douteux est de la variété Spunta qui est la plus
cultivée en Tunisie avec un pourcentage de 72,97%. Concernant les autres
variétés, un nombre moyennement faible de plants douteux ont
été marqués. En fait, 21,62 % des plants présentant
les symptômes du PVY sont de la variété Océana alors
que seulement 5,4 % sont de la variété Bellini. Cependant aucun
plant de la variété Atlas n'a été
révélé comme douteux.
2.2.2. Test ELISA
Après le dernier traitement, un
prélèvement aléatoire d'échantillons de feuilles
à partir de 8 plants de chaque traitement pour les quatre
variétés a été effectué et ceci afin de
préciser les pourcentages d'attaque par les viroses avec un test plus
fiable qui est le test ELISA. Les résultas ainsi obtenus sont
récapitulés au niveau du tableau 14.
Tableau 14 : Résultats du test ELISA sur les
quatre variétés avec les différents
traitements
|
Variété
|
Traitement
|
Pourcentage des
plants virosés par
le
PVY
|
Pourcentage des
plants virosés par
le
PVX
|
Pourcentage des
plants virosés par
le
PLRV
|
|
Spunta
|
Te
|
50
|
0
|
12,5
|
|
AB
|
25
|
0
|
0
|
|
DA
|
87,5
|
0
|
12,5
|
|
Traitements
confondus
|
54,16
|
0
|
8,33
|
|
Atlas
|
Te
|
0
|
12,5
|
0
|
|
AB
|
0
|
12,5
|
0
|
|
DA
|
25
|
12,5
|
12,5
|
|
Traitements
confondus
|
8,33
|
12,5
|
4,16
|
|
Bellini
|
Te
|
12,5
|
0
|
0
|
|
AB
|
25
|
0
|
0
|
|
DA
|
0
|
0
|
0
|
|
Traitements
confondus
|
12,5
|
0
|
0
|
|
Océana
|
Te
|
50
|
0
|
0
|
|
AB
|
37,5
|
0
|
0
|
|
DA
|
0
|
0
|
0
|
|
Traitements
confondus
|
29,16
|
0
|
0
|
D'après les résultats du test sérologique
ELISA, nous remarquons qu'il n'y a pas une différence entre les plants
traités par l'Alga Bactéricide et le Dalgin Active avec ceux non
traité pour toutes les variétés confondues. Cependant, en
comparant les pourcentages d'attaque des quatre variétés
testées, nous constatons qu'il y a une différence au niveau de la
sensibilité de chaque variété au PVY (figure 37).
Figure 37 : Pourcentages d'attaque par le PVY des quatre
variétés selon le test ELISA
En fait, sur l'ensemble des plants virosés qui ont
été détectés par le test ELISA, 52 % appartiennent
à la variété Spunta. Ceci peut confirmer que cette
variété est la plus sensible au virus Y de la pomme de terre
comparé aux autres variétés. De plus, nous constatons que
la variété Océana est moyennement sensible au PVY vu que
28 % des plants virosés appartiennent à cette
variété. Pour les deux autres variétés Bellini et
Atlas, ils peuvent être classées comme étant
résistantes au PVY surtout la variété Atlas vu que
seulement deux échantillons sont virosés.
Concernant la sensibilité des différentes
variétés aux autres virus notamment le PVX et le PLRV, nous avons
remarqué que la variété Atlas est la seule qui a
été attaqué par le PVX avec un pourcentage de 12,5% sur
l'ensemble de plants analysés par le test ELISA. Alors que pour le PL
RV, ce virus a été détecté chez les deux
variétés Spunta et Atlas avec des pourcentages faibles qui sont
respectivement 8,33 et 4,16%.
Par conséquent, il est à signalé que la
sensibilité de la variété Spunta au virus PVY qui est le
virus le plus préjudiciable pourrait être expliqué par le
fait que cette variété la plus communément cultivée
dans les régions de culture de la pomme de terre devienne de plus en
plus sensible au virus en question.
2.2.3. Effet des produits sur le rendement des plants de pomme de
terre
2.2.3.1. Effet sur le poids
végétatif
Dans le but de caractériser l'effet des traitements
effectués sur l'état végétatif des plants de pomme
de terre des quatre variétés testées, des pesées de
la végétation des plants de chaque traitement a été
réalisé à la récolte. Les résultats ainsi
obtenus par ligne ont été estimés par rapport à
l'hectare en tenant compte d'une densité de 30000 plants/ha (figure
38).
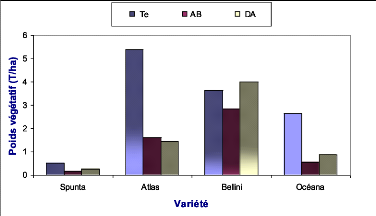
Figure 38 : Poids végétatif total des
plants des quatre variétés de pomme de terre en fonction
des
traitements appliqués
D'après la figure 41, nous remarquons que pour toutes
les variétés testées, le poids végétatif des
plants témoins est supérieur à ceux traités. Ceci
pourrait être expliqué par le fait que les produits ayant un effet
inducteur de la réaction de défense pourraient avoir une action
freinante de la croissance végétative des plants dans les
conditions de l'expérimentation.
En comparant les plants témoins des quatre
variétés, nous remarquons que les trois variétés
Atlas, Bellini et Océana ont des poids végétatifs plus
importants que la variété Spunta. Cette différence serait
due à la précocité de cette dernière par rapport
aux autres variétés et de l'effet des attaques du mildiou qui ont
endommagés la végétation des plants de la
variété Spunta.
2.2.3.2. Effet sur le poids des tubercules
Afin d'apprécier l'effet des produits utilisés
sur le rendement, des pesées du poids des tubercules de chaque
traitement des quatre variétés a été
effectué lors de la récolte. Les résultats obtenus par
ligne ont été estimés par rapport à l'hectare en
tenant compte d'une densité de 30000 plants/ha (figure 39).
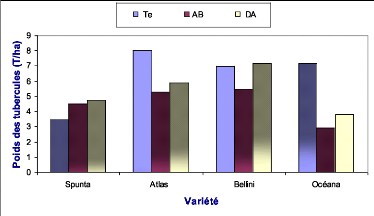
Figure 39 : Poids total des tubercules des quatre
variétés de pomme de terre en fonction des
traitements
appliqués
Nous constatons à partir de la figure 39 que pour
toutes les variétés sauf Spunta, le poids total des tubercules
des plants témoins est supérieur à ceux qui ont
été traités par les deux produits AB et DA. Ce
résultat pourrait être expliqué par le faite que le faible
poids végétatif, qui pourrait être la conséquence de
l'action freinante des produits inducteurs de la réaction de
défense, aurait un impact sur le rendement des plantes.
En comparant entre les quatre variétés, la
variété Spunta a le rendement le plus faible. Ceci pourrait
être dû à l'impact des attaques virales sur le rendement de
cette variété qui a été la plus sensible. En fait,
l'attaque par le PVY aurait engendré des pertes de rendement vu que la
plante affaiblie devienne incapable de produire des tubercules de gros
calibre.
Conclusion et perspectives
Dans le cadre de la recherche d'une nouvelle alternative de
lutte contre les phytovirus de la pomme de terre et particulièrement le
virus PVY, des produits biologiques supposés avoir une action inductrice
de la réaction de défense chez les plantes ont été
testés. Pour évaluer l'efficacité et comprendre le mode
d'action de ces produits des tests ont été réalisés
sur des champignons phytopathogènes.
Les essais réalisés sur ces derniers nous ont
permis de caractériser le mode d'action de ces produits sur certaines
plantes à savoir la tomate, le melon et la vigne. En effet, selon des
tests de fongitoxicité il parait que l'Alga Bactéricide, la
Dalgin Active et le Ningnan Mycin pourraient avoir une action indirecte sur les
champignons. Cependant, le Zytroseed présenterait une action
fongitoxique vis-à-vis des champignons.
De plus, des tests de pathogénicité sur des
feuilles détachées de tomate nous ont permis d'affirmer que
l'utilisation de la dose recommandée des produits Alga
Bactéricide et Dalgin Active n'aurait pas une action inductrice de la
réaction de défense. Néanmoins, chez la vigne, une
application du Codaphos cuivre et de la Dalgin Active à la double dose
aurait permis d'induire une réaction de défense en
réduisant les diamètres de nécroses lors des tests
d'inoculation sur feuilles détachées par B. cinerea.
L'action de ces produits sur des plantules de tomate a
été testée par l'inoculation foliaire et racinaire
respectivement par B. cinerea et Fusarium oxysporum f.sp.
radicis lycopersici (Forl). En fait, selon ces tests, il parait que
les produits Zytroseed et Dalgin Active auraientt permis de rendre les
plantules plus résistantes face au B. cinerea. De même,
le Codaphos cuivre et le Zytroseed pourraient avoir une action protectrice des
plantules face au Forl.
L'application des produits Alga Bactéricide et Dalgin
Active dans le but d'induire des réactions de défense chez la
pomme de terre n'aurait pas un effet sur la réduction des attaques
causées par le PVY sur toutes les variétés testées.
Par conséquent, ces produits n'auraient pas permis d'induire des
réactions de défense chez la pomme de terre contre le virus.
Toutefois, une différence notable a été
révélée au niveau de la sensibilité des
différentes variétés vis-à- vis du PVY. Egalement,
ces produits auraient une action freinante de la croissance des plants vu que
les rendements totaux des poids végétatifs et des tubercules,
enregistrés lors de la récolte, ont été plus
faibles chez les plants traités.
Ce travail qui a permis d'apprécier le mode d'action
des produits devrait être plus approfondies. En fait, des essais multi
sites de différentes variétés de pomme de terre sensibles
au PVY et ayant différents niveaux de résistance induite face
à l'application de différentes doses des produits testés
pourraient aboutir à des résultats plus concrets. De même,
des inoculations artificielles de plants, indemnes de virus, traités par
différentes doses des produits proposés pourraient
également donner une meilleure idée sur l'action inductrice des
réactions de défense chez la pomme de terre par ces produits.
References bibliographiques
1. Abramovitch R.B. et Martin G.B., 2004. Strategies used by
bacterial pathogens to suppress plant defenses Curr. Opin. Plant Biol., 7:
356-364.
2. Agindotan B.O., Shiel P.J., Berger P.H., 2007.
Simultaneous detection of potato viruses, PLRV, PVA, PVX and PVY from dormant
potato tubers by TaqMan® realtime RT-PCR. Journal of Virological Methods,
142: 1-9.
3. Anonyme 1: Les virus [en ligne]. Available from Internet
<URL :
http://membres.lycos.fr/nabiga/definitions/virus.html>
(consulté le 25.12.2008).
4. Anonyme 2: Agdia Biofords. Available from Internet
<URL:
http://www.biofords.com>
(consulté le 22.12.2008).
5. Astier S., Albouy J., Maury Y. et Lecoq H., 2001. Principes
de virologie végétale: Génome, pouvoir pathogène,
écologie des virus. INRA Editions, Paris : 488 p.
6. Babadoost M., 2006. Vegetable Production and Pest
Management: Updates on diseases of squash and pumpkins in Illinois. Illinois
Fruit and Vegetable News, 12, 13: 119-122.
7. Bergervoet J.H.W., Peters J., van Beckhoven J. R.C.M, van
den Bovenkamp G.W., Jacobson J.W. et van der Wolf J.M., 2008. Multiplex
microsphere immuno-detection of potato virus Y, X and PLRV. Journal of
Virological Methods, 149: 63-68.
8. Blancard D., 1988. Maladies de la tomate-observer,
identifier, lutter. Ed INRA, Paris, 232 p.
9. Boisson C. et Renard J.L., 1987. Les maladies cryptogamiques
des plantes maraichères en Cote d'Ivoire. Horticole, 398 : 36-40.
10. Bouchet P., Guignard J. et Villard J., 1999. Les champignons
: Mycologie fondamentale et appliquée. Masson, Paris : 194 p.
11. Boonham N., Walsh K., Smith P., Madagan K., Graham I. et
Barker I., 2002. Detection of potato viruses using microarray technology:
towards a generic method for plant viral disease diagnosis. Journal of
Virological Methods, 108:181-187.
12. Byoung-Cheorl K., Inhwa Y. et Molly M.J., 2005. Genetics of
Plant Virus Resistance. Annual Review of Phytopathology, 43: 581-621.
13. Cardi T., Puite K.J. et Ramulu K.S., 1990. Plant
regeneration from mesophyll protoplasts of Solanum commersonii Dun. Plant
Science, 70: 215-221.
14. Casselyn M., 2002. Modifications structurales du Virus de
la Mosaïque du Brome et interactions entre particules virales en solution
: application à la cristallisation. Thèse de doctorat de
l'université Pierre et Marie Curie, Paris, France. 151 p.
15. Charrier A., Jacquot M., Hamon S. et Nicolas D., 1997.
L'amélioration des plantes tropicales. Montpellier : CIRAD, 623 p.
16. Cherif O, 2004. Effets de 3 biofertilisants sur la
réduction de 2 maladies vasculaires, la fusariose du collet et des
racines et la verticilliose de la tomate. Conséquences sur la
croissance, le développement et le rendement de la plante.
17. Chisholm S.T., Coaker G., Day B. et Staskawicz B.J., 2006.
Host-microbe interactions: shaping the evolution of the plant immune response.
Cell, 124: 803-814.
18. Clauzel J.M. et Lefebvre A., 1991. Les kits de diagnostic
pour la détection des agents phytopathogènes. Phytoma-La
défense des végétaux, 430 :3-5.
19. Costa C., 2003. Watermelon mosaic virus Virus de la
mosaïque de la pastèque : Étude de la variabilité du
virus et épidémiologie moléculaire. Mémoire pour
l'obtention du diplôme de l'Ecole Pratique des Hautes Etudes : Science de
la vie et de la terre, France.
20. Dangl J.L. et Jones J.D., 2001. Plant pathogens and
integrated defence responses to infection. Nature, 411: 826-833.
21. Davey M.R., Anthony P., Power J.B. et Lowe K.C., 2005. Plant
protoplasts: status and biotechnological perspectives. Biotechnology Advances,
23 : 131-1 71.
22. Fuchs M., 2008a. Transgenic plants and control of virus
diseases: state of the art and prospects. Virologie, 12, 1: 27-37.
23. Fuchs M., 2008b. Plant Resistance to Viruses: Engineered
Resistance. Encyclopedia of Virology (Third Edition): 156-164.
24. Fuchs M., Ferreira S. et Gonsalves D., 1997. Management of
virus diseases by classical and engineered protection. Mol Plant Pathol
On-line,
www.bspp.org.uk/mppoll
1997/011 6fuchs.
25. Fuchs M. et Gonsalves D., 2007. Safety of virus-resistant
transgenic plants two decades after their introduction: Lessons from realistic
field risk assessment studies. Annu Rev Phytopathol, 45: 173-202.
26. Gallais A., 2000. Evolution des outils de
l'amélioration des plantes : de la sélection
généalogique à la trans-génèse. C.R. Acad.
Agric. Fr., 86: 13-25.
27. Germundsson A., 2005. Transgenic resistance to PMTV and
PVA provides novel insights to viral long-distance movement. Thèse de
doctorat de la faculté des ressources naturelles et sciences
agronomiques Uppsala, Suisse.51 p.
28. Glais L., Kerlan K. et Robaglia C., 2001. Variability and
evolution of potato virus Y, the type's species of Potyvirus genus, The Haworth
press, New York: 225-253.
29. Guetsky R., Shtienberg D., Elad Y. et Dinoor A., 2001.
Combining biocontrol agents to reduce the variability of biological control.
The American Phytopathological society, 91: 621-627.
30. Hibar K., Daami-Remadi M., Hamada W. et El Mahjoub M.,
2006. Bio-Fungicides as an alternative for Tomato Fusarium Crown and Root Rot
Control. Tunisian Journal of Plant Protection, 1: 19-29.
31. Hmouni A., Oihabi L., Badoc A. et Douira A., 2003. Etude
de la résistance de Botrytis cinerea aux benzimid azoles, dicarboximides
et dithiocarbamates dans les cultures abritées de tomate de la
région du Gharb (Maroc). Bull. Soc. Pharm. Bordeaux, 142 : 79-100.
32. Hogue R., Plante E. et Daigle N., 2006. La qualité
des semences : un nouveau protocole d'analyses post-récolte. In :
Colloque sur la pomme de terre La qualité, on ne peut s'en passer! ,
Vendredi 10 Novembre 2006. Québec.
33. Jacquot E.,Tribodet M., Croizat F., Balme-Sinibaldi V. et
Kerlana C., 2005. A single nucleotide polymorphism-based technique for specific
characterization of YO and YN isolates of Potato virus Y (PVY). Journal of
Virological Methods 125: 8393.
34. Kahn A., 1996. Les plantes transgéniques en
agriculture : dix ans d'expérience de la commission du Génie
Biomoléculaire. John Libbey Eurotext : 165 p.
35. Keen N., Tamaki S. et Kobayashi D., 1990. Bacteria
expressing avirulence gene D produce a specific elicitor of the soybean
hypersensitive reaction. Mol Plant Microbe Interact, 3: 112-121.
36. Kerlan C., 2008. Potato Viruses. Encyclopedia of Virology
(Third Edition): 296-309.
37. Kerlan C. et Moury B., 2008. Potato Virus Y. Encyclopedia of
Virology (Third Edition): 287-296.
38. Klarzynski O., 2001. Study of the induction of defense
responses and of resistances of plants against pathogens by oligosaccharides
from marine algae. Thèse de doctorat de l'université de
Strasbourg 1, Strasbourg, France: 128 p.
39. Koenig R., Lesemann D.-E., Adam G. et Winter S., 2008.
Diagnostic Techniques: Plant Viruses. Encyclopedia of Virology (Third Edition)
: Pages 18-29.
40. Kostrzynska M., Bachand A., 2006. Application of DNA
microarray technology for detection, identification, and characterization of
food-borne pathogens. Canadian Journal of Microbiology, 52, 1: 1-8.
41. Kummert J. et Semal J., 1996. Les virus et viroïdes
phytopathogènes. In : Traité de pathologie
végétale. Semal J. (col.). Les presses agronomiques de Gembloux,
A.S.B.L : pp 85-142.
42. Lecoq H., Moury B., Desbiez C., Palloix A. et Pitrat M.,
2004. Durable virus resistance in plants through conventional approaches: a
challenge. Virus Res, 100: 31- 9.
43. Lemattre M., Albouy J., Balesdent M.H. et Spire D., 1991.
Les méthodes sérologiques appliquées au diagnostic de
routine des agents phytopathogènes. Phytoma-La défense des
végétaux, 430 :3-5.
44. Lepoivre P. et Kummert J., 1996. Le diagnostic des
maladies parasitaires. In : Traité de pathologie végétale.
Semal J. (col.). Les presses agronomiques de Gembloux, A.S.B.L : pp 361-379.
45. Lidell C.M., 1991. Introduction : Reant Advances in Fusarium
Systematics. Phytopathology, 81, 9 : 1044-1045.
46. Maule A.J., Caranta C. et Boulton M.I., 2007. Sources of
natural resistance to plant viruses: status and prospects. Molecular Plant
Pathology, 8, 2: 223-231.
47. Mhiri W., 2003. Maladies cryptogamiques des
graminées à gaeon et biologie des Fusarium spp et
Rhizoctonia spp. Mémoire de diplôme d'études
approfondies en protection des plantes et environnement de l'Ecole
Supérieure d'horticulture et d'Elevage Chott Mariem, Sousse, Tunisie :
107p.
48. Miller S.A., Rowe R.C. et Riedel R.M., 2000. Fusarium and
Verticillium Wilts of Tomato, Potato, Pepper, and Eggplant. Plant Pathology, 5:
13-16.
49. Monnet Y., 2001. Control of soil fungi without recourse to
fumigation: Seed, plant and soil treatments. Phytoma- la défense des
végétaux, 542: 31-34.
50. Montesano M., Brader G. et Palva E.T., 2003. Pathogen
derived elicitors: searching for receptors in plants. Mol. Plant Pathol., 4:
73-79.
51. Morot-Gaudry J.F., Wendehenne D., Meyer R.C., Cellier P.,
Paillotin G., Wendehenne D., Germon J.C., Meyer C., Gerard J.P., Bezard J.,
Cellier P., Chone E., Baratte Y. et Du Mesni l Du Buisson F., 2005. Le monoxyde
d'azote, de l'homme à la plante ; Quelle importance pour l'agriculture
et l'environnement ? Comptes rendus de l'Académie d'agriculture de
France, 91, 2 : 17-26.
52. Nissing E., Müller A. et Weib N., 2002.
Determination of suitable electrofusion parameters for the somatic
hybridization of mint protoplasts with the Eppendorf Multiporator. Available
from Internet <URL:
http://www.
biocompare.com>.
53. Nurnberger T. et Lipka V., 2005. Non-host resistance in
plants: new insights into an old phenomenon. Mol Plant Pathol, 6: 335-345.
54. Ollitrault P., Dambier D., Froelicher Y., Carreel F.,
D'Hont A., Luro F., Bruyère S., Cabasson C., Lotfy S., Joumaa A., Vanel
F., Maddi F., Treanton K. et Grisoni M., 2000. Ressources
génétiques : apport de l'hybridation somatique pour
l'exploitation des ressources génétiques des agrumes. Cahiers
Agricultures, 9, 3: 223-236.
55. Pasche J.S., Secor G.A. et GudmestadN.C., 1994. Potato
Leafroll Virus and Net Necrosis.
56. Pépin G., 2004. Résistance au virus Y de la
pomme de terre (PVY) chez des lignées transgéniques de pomme de
terre exprimant un inhibiteur de protéases de type cystéine.
Mémoire de maîtrise de la Faculté des sciences et de
génie de l'Université Laval, Quebec : 93 p.
57. Picó B., Diez M.J. et Nuez F., 1996. Viral
diseases causing the greatest economic losses to the tomato crop. II. The
Tomato yellow leaf curl virus. Scientia Horticulturae, 67:151-196.
58. Pinheiro Dillona A.J., Camassolaa M., Pegas Henriquesa
J.A., Pelegrinelli Fungarob M.H., Souza Azevedob A.C., Ferreira Velhoa T.A. et
Lagunaa S.E., 2008. Generation of recombinants strains to cellulases production
by protoplast fusion between Penicillium echinulatum and Trichoderma harzianum.
Enzyme and Microbial Technology, 43 : 403-409.
59. Pinna G., Reimund J.M. et Muller C.D., 2004. Comment
doser simultanément par cytométrie en flux six cytokines
sécrétées dans seulement 25 uL d`échantillon ?
Annales de biologie clinique, 62, 1 : 59-63.
60. Racapé J., Belbahri L., Parlange F., Nicole M.,
Boucher C. et Keller H., 2002. La reconnaissance d'éliciteurs proteiques
par les cellules végétales : comparaison entre la
cryptogéine de Phytophthora cryptogea et la PopA de Ralstonia
solanacearum. In : Journées Jean Chevaugeon : IVe rencontres de
phytopathologie - mycologie du 13 au 17 mars 2002. Montpellier : CIRAD.
61. Reinke V., 2006. Germline genomics. WormBook, ed.
The C. elegans Research Community, WormBook, doi/1 0.1 895/wormbook.1
.74.1,
http://www.wormbook.org/.
62. Roosinck M.J., 2005. Symbiosis versus competition in plant
virus evolution. Nat Rev Microbiol, 3 : 917-24.
63. Rousselle P., Robert Y. et Crosnier J.C., 1996. La pomme de
terre: Production, amélioration, ennemis et maladies, utilisation. INRA
Editions, Paris: 607 p.
64. Ryua K.H. et Honga J.S., 2008. Potexvirus. Encyclopedia of
Virology (Third Edition): 210-313.
65. Sanford J.C. et Johnston S.A., 1985. The concept of
parasite-derived resistancederiving resistance genes from the parasite's own
genome. J Theor Biol, 113: 395-405.
66. Seilleur P., 1996. Amélioration
génétique de la résistance aux agents
phytopathogènes. In : Traité de pathologie
végétale. Semal J. (col.). Les presses agronomiques de Gembloux,
A.S.B.L : pp 41 5-453.
67. Spire D., 2001. INRA.
68. Te J., Melcher U., Howard A. et Verchot-Lubicz J., 2005.
Soilborne wheat mosaic virus (SB WMV) 19K protein belongs to a class of
cysteine rich proteins that suppress RNA silencing. Virology journal, 2:18.
69. Tepfer M., 2002. Risk assessment of virus-resistant
transgenic plants. Annu Rev Phytopathol, 40: 467-91.
70. Trapero-Casas A. et Jiminez-Diaz R.M., 1985. Fungal wilt and
root rot diseases of chickpea in southern Spain. Phytopathology, 75:
1146-1151.
71. Trottin-Caudal Y., grasselly D. et millot P., 1995.
Maîtrise de la protection phytosanitaire: tomate sous serre et abris. Ed
Ctifl, 81-84.
72. Vazquez Rovere C., Asurmendi S. et Hopp E., 2001.
Transgenic resistance in potato plants expressing potato leaf roll virus (PLRV)
replicase gene sequences is RNA mediated and suggests the involvement of Post
transcriptional gene silencing. Archives of Virology (in press).
73. Walters D., Walsh D., Newton A. et Lyon G., 2005. Induced
Resistance for Plant Disease Control: Maximizing the Efficacy of Resistance
Elicitors. Phytopathology, 95: 1368-1373.
74. Wendehenne D., Durner J. et Klessig D.F., 2004. Nitric
oxide: a new player in plant signaling and defence responses. Curr. Opin. Plant
Sci., 7: 449-455.
Annexe 1 :
s Courbes de régression des différents
produits
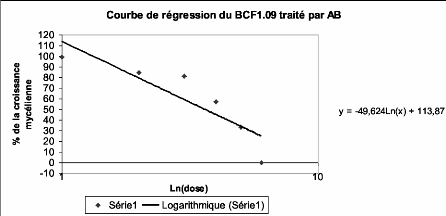
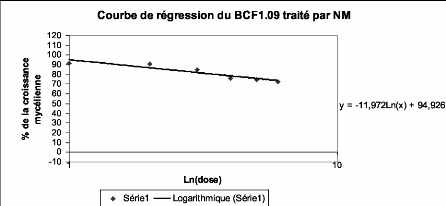
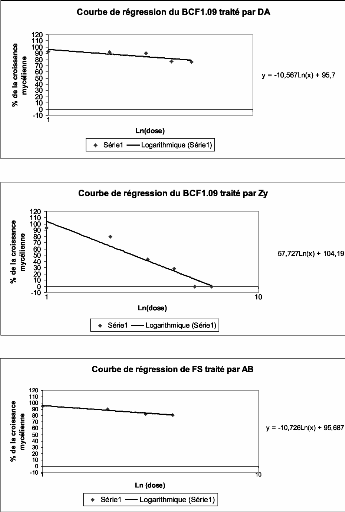
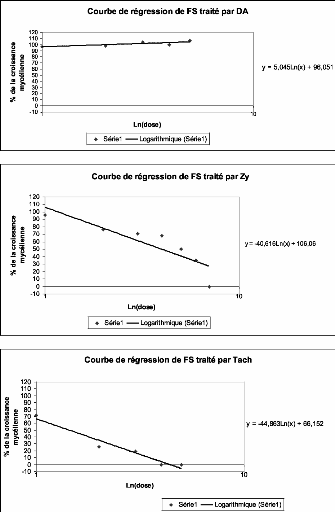
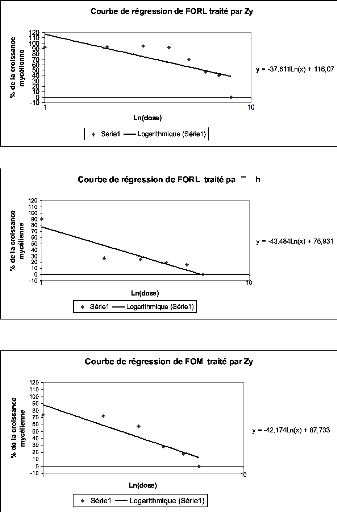
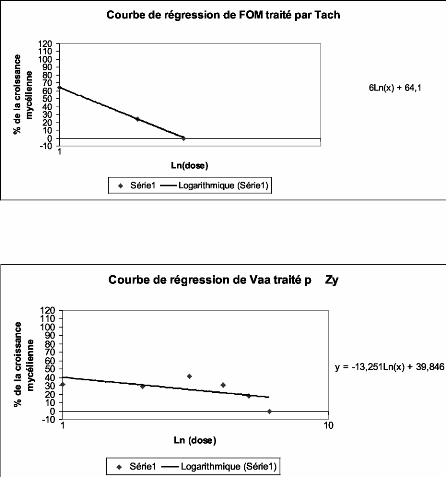
Annexe 2 :
· Préparation d'un milieu PDA (Potato
Dextrose Agar)
Pour préparer un litre de milieu de culture PDA, 200g
de pomme de terre ont été épulchés et bouillis sur
une plaque chauffante dans 500ml d'eau distillée jusqu'à avoir
une purée. Après filtration de cette purée, 20g de
saccharose et 10g d'agar ont été ajoutés. Ensuite, le
volume a été ajusté à un litre avec de l'eau
distillée. Le milieu a été stérilisé
à 120°C pendant 20min dans l'autoclave. Après
refroidissement, le milieu a été coulé dans des boites de
pétris stériles.
| 


