ANNEXE III
Spectrophotométrie d'absorption dans
l'ultraviolet et le visible
1. Principe :
La spectrométrie d'absorption moléculaire dans
le domaine ultraviolet (UV), de 185 à 380 nm environ, et visible (VIS),
de 380 à 800 nm environ, est une technique courante de contrôle et
d'analyse de composés chimiques. Elle s'applique à des
groupements d'atomes (ex : molécules, ions, polymères) qui
absorbent le rayonnement électromagnétique dans le domaine
UV-VIS.
L'absorption de la lumière UV-VIS par les
molécules se produit, comme pour les atomes, du fait de transitions
électroniques entre différents niveaux d'énergie. Un
électron à l'état fondamental absorbe des radiations d'une
énergie E suffisante pour l'élever à un niveau
d'énergie supérieur, l'état excité, (ce qui
détermine la longueur d'onde l, par la relation :
E = h c / l, oil « h » est la constante de Planck et
« c » la vitesse de la lumière). Le retour au plus bas niveau
d'énergie, l'état fondamental, se produit par perte
d'énergie sous forme de chaleur ou, occasionnellement, par
rémission de radiation (fluorescence ou phosphorescence).
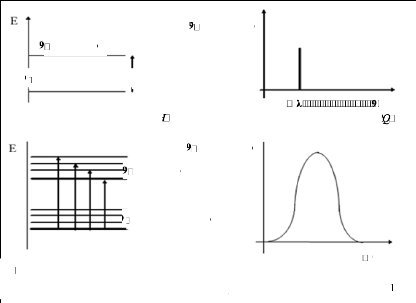
Absorbance Absorbance
tat fondamentale
état fondamentale / xcitation
excitation
/ EE
Figure (05) : Spectre d'une
seule
transition (Anonyme 12).
Figure (06) : Spectre d'absorptio
Figure (06) : Spectre
dabsortion UV-VIS.
UV-VIS(Anonyme 12).
Absorbance Absorbance
tat excité état excité
tat fondamentale état fondamentale
1 / E
/ E
iure (07) : Spectre de plusieurs
Figure (07) : Spectre de sieurs transitions
[45] transitions (Anonyme
12).
Figure (08) : Spectr résultant de
Figure (08) : Spectre
résulta
plusieurs transitions (Anonyme 12).
de plusieurs transitions [45]
tat excité état excité
S'il n'y avait qu'un seul (fig.05), le spectre d'absorption
UV-VIS (fig.06) n'aurait qu'une seule raie à la longueur d'onde
correspondant à l'énergie nécessaire à la
transition. Dans ce cas idéal, la spectrométrie UV-VIS serait un
outil immédiat d'analyse qualitative : la longueur d'onde exacte
d'absorption serait parfaitement caractéristique de la molécule,
Cependant, de nombreux autres niveaux d'énergie (dus à des
vibrations, des rotations et des transitions moléculaires) se
superposent aux niveaux d'énergie électroniques, et plusieurs
transitions sont possibles (fig.07). Le spectre résultant prend alors la
forme d'une bande large sans caractéristique très marquée
(fig.08) (Anonyme 12).
Ce spectre permet à la fois l'identification (analyse
qualitative), mais dans certaines limites seulement et l'estimation
(analyse quantitative) d'un composé.
Les chromophores qui peuvent être détectés
par des spectromètres UV-VIS comprennent toujours des liaisons doubles
entre atomes de carbone (C=C) ou des liaisons doubles ou triples entre le
carbone et certains autres atomes (C=O, CN notamment).Ils peuvent être
conjugués à d'autres groupes fonctionnels pour former des
complexes chromophores. Un exemple typique est le benzène
(Anonyme 12).
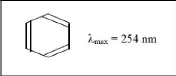
Figure (09) : molécule de
benzène (Anonyme 12).
Ainsi, la spectrométrie d'absorption moléculaire
UV-VIS permet d'étudier, à l'état gazeux, liquide ou
solide, des composés organiques principalement mais aussi des
composés inorganiques (Anonyme 12).
2. Analyse quantitative :
L'analyse quantitative par la spectrométrie UV-VIS est
très utilisée (beaucoup plus que l'analyse qualitative) car
l'absorption est plus ou moins importante selon le nombre de groupements
d'atomes placés sur le trajet de la lumière : des lois connues
relient cette absorption à ce nombre dans certaines conditions
opératoires. Ce sont les lois de LAMBERT et de BEER
(Anonyme 12).
· Loi de BEER- LAMBERT :
L'absorption de la lumière est directement proportionnelle
à la fois à la concentration du milieu absorbant et à
l'épaisseur de la cuve où se trouve le milieu.
Une combinaison de ces deux lois (la loi de BEER-LAMBERT) donne
la relation entre l'absorbance (A) et la transmittance (T) :
A = log (I0 / I) = log (100/ T) = å c x
Avec :
A = absorbance (sans unité).
I0= Intensité de la lumière incidente.
I = Intensité de la lumière transmise (I toujours
inférieure à I0).
T = Transmittance.
å coefficient d'absorption molaire ou d'extinction
(mol-1. dm3.cm-1).
c = concentration molaire (mol. dm-3).
x = longueur de la cuve (cm) ou trajet lumineux.
La relation entre transmittance et concentration n'est pas
linéaire (fig.10) mais la relation entre l'absorbance et la
concentration est linéaire (fig.11), ce qui est à la base de la
plupart des analyses quantitatives (Anonyme 12).
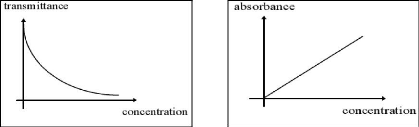
igure (10) : Relation entre
transmittance Figure (11) : Relation entre
l'absorbance.
et concentration (Anonyme 12). et
la concentration (Anonyme 12).
La simple relation linéaire entre l'absorbance et la
concentration et la facilité relative de mesure de la
lumière UV-VIS sont donc les raisons pour lesquelles la spectroscopie
UV-VIS est jà la base d'un grand nombre de méthodes d'analyse
quantitative.
N.B : A température ambiante, il
est donc hautement probable que toutes les molécules soient à
l'état électronique fondamental.
· Limites de la loi de
BEER-LAMBERT:
- Les mesures ne sont valables que dans une gamme de
concentrations très faible, et l'absorbance ne dépasse pas 3.
- Il est important de noter que å est une
fonction de la longueur d'onde et donc que la loi est seulement vraie en
lumière monochromatique, c'est une limite lié à
l'appareil (Anonyme 12).
3/Appareillage :
Les spectromètres classiques comprennent les
éléments suivants : (fig.12)
Une source, un porte-échantillons, un monochromateur, un
détecteur, un appareil de lecture (Anonyme 12).
Source Monochromateur Cellule Détecteur Processeur
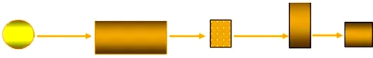
Figure (12) : Principaux constituants d'un
spectrophotomètre (Anonyme 12).
> La source :
Pour la plupart des spectrophotomètres UV-visible, on
utilise principalement deux types de lampes afin de couvrir la totalité
du spectre. Ainsi, pour la partie UV du spectre, on emploie des lampes au
deutérium ou parfois au xénon à haute pression. Les lampes
au deutérium émettent en effet un rayonnement dont les longueurs
d'onde sont comprises approximativement entre 180 et 400 nm, et ont une
durée de vie d'environ 1000 h, En ce qui concerne la partie
visible du spectre, les plus utilisees sont les lampes
halogène au quartz à filaments de tungstène dont le
rayonnement, continu, est compris entre 350 et 1300 nm.
> Monochromateurs et polychromateurs
:
La fonction du monochromateur est de selectionner une
longueur d'onde parmi le spectre du rayon incident. Les plus simples sont
composes de filtres ne laissant passer qu'une seule longueur d'onde; il est
possible d'en utiliser plusieurs afin d'obtenir differentes longueurs d'onde.
Les monochromateurs les plus utilises sont composes en general d'une fente
d'entree, d'un dispositif de dispersion comme un prisme ou un reseau, et d'une
fente de sortie. L'echantillon et le detecteur, places juste derrière le
monochromateur.
> Les détecteurs :
Il existe deux types principaux de detecteurs: le detecteur
unicanal et le detecteur multicanal. En fait, le premier convient à un
monochromateur alors que le second est utilise avec un polychromateur.
> Le recueil du signal (lecture)
:
Le detecteur est relie grâce à un convertisseur,
à un microprocesseur, qui recueille toute la serie de mesures
(Anonyme 12).
4/ Méthodologie :
Le blanc utilisé doit contenir la solution à
laquelle l'élément étudié a été
retiré.
Dans un premier temps, on cherche la longueur d'onde
d'absorption maximale de cet élément, en traçant son
spectre d'absorption (A en fonction de ë) : ë max est
determinee.
Ensuite, à ë max (pour n'effectuer
qu'une seule mesure tout en évitant au mieux les lumières
parasites), on trace la courbe d'étalonnage de l'élément.
Pour cela, on prépare environ 5 échantillons à des
concentrations connues et on mesure à chaque fois l'absorbance A. Parmi
ces echantillons, on prepare un echantillon qui donne A = 0 (solvant seul sans
l'élément étudié) et un autre qui donne A
= 100% (élément seul). Cette courbe
d'étalonnage permet de calculer le coefficient d'extinction å
défini précédemment. Alors, les concentrations inconnues
de l'élément peuvent être determinees, à ë
max en reportant sur la courbe les absorbances mesurees (Anonyme
12).
5/ Qualité du spectre :
La qualité du spectre obtenu par utilisation d'un
instrument est une fonction de la monochromaticite du rayon incident. Celle-ci
depend de:
> La largeur des fentes du monochromateur :
Lorsque la largeur des fentes diminue, la forme de la courbe spectrale se
modifie jusqu'à ce qu'une image plus ou moins nette apparaisse.
Cependant, pour des fentes très étroites, une faible
quantité d'énergie atteint le detecteur, et du bruit peut alterer
la qualite spectrale.
> la quantité de lumière parasite :
Le spectre peut egalement être modifie par le rayon émergeant du
monochromateur qui possède une lumière assez différente de
celle que l'on devrait obtenir theoriquement. On appelle cette lumière
la lumière parasite, due aux reflexions involontaires dispersives dans
le monochromateur. Si l'instrument est réglé à une
longueur d'onde correspondant à un maximum d'absorption connu
(ë max) pour un echantillon, la lumière
parasite sera en général moins absorbée max par
l'échantillon que celle à d'autres longueurs d'onde
(Anonyme 12).
6/ Exactitude et précision des
résultats :
L'exactitude détermine la façon dont s'approche
la valeur spectroscopique mesurée (A ou ë) de la vraie valeur. La
précision des résultats servant à obtenir la valeur
moyenne (qui correspond à la meilleure estimation du résultat
réel que les expériences ont trouvé) est donnée par
leur dispersion (Anonyme 12).
"Vrai" Valeur Valeur moyenne, A

Exactitude
Dispersion
A
Figure (13) : conceptions d'exactitude et de
dispersion (Anonyme 12).
On trouve la valeur moyenne A pour l'ensemble des
résultats A1, A2, ..., A n grâce à la formule :
(Anonyme 12).
A = A1 + A2 + ...A n / n
| 


