I.5.2.1. Première loi de Fick:
Considérons un élément (A)
dissout à l'intérieur d'une matrice cristalline. A basse
température le système est figé et l'impureté est
immobile. Par contre, Si la température est suffisamment
élevée, sous l'effet de l'agitation thermique, les atomes deA
sont mobiles et ils peuvent se déplacer à l'intérieur
de la matrice. Ils sont alors soumis au phénomène de diffusion :
une non-uniformité des variables thermodynamiques (une variation de la
concentration de (A), toutes choses égales par ailleurs, en
étant le cas le plus fréquent) entraîne un transport de
matière (un déplacement des atomes (A)) à
l'intérieur du solide. La diffusion est donc un processus non
réversible dont le "moteur" est le gradient de potentiel chimique et qui
a pour objectif d'uniformiser ce potentiel chimique. La description
phénoménologique générale de ce processus n'est
possible qu'à l'aide de la théorie de la thermodynamique des
processus irréversibles [30].
Cependant, dans le cas le plus simple d'une seule
espèce diffusante soumise uniquement à son gradient de
concentration, le phénomène se décrit très
simplement à l'aide de la première loi de Fick, qui stipule que
le flux d'impureté J (nombre d'atomes traversant l'unité
de surface par unité de temps) est proportionnel au gradient de
concentration C de l'impureté [30] :

j D C . (I.1)
Le signe "-" de l'équation précédente
traduit simplement le fait que la diffusion a lieu des zones à fortes
concentrations vers les zones à faibles concentrations, ce qui est
naturel pour pouvoir homogénéiser les concentrations.
Par définition, le coefficient de
proportionnalité D est le coefficient de diffusion. Le flux
étant généralement exprimé en atomes par
(cm-2s4) et les concentrations en nombre
d'atomes par centimètre cube (cm3), D
s'exprime alors en cm2s1.
D dépend fortement de la température;
quasi-nul à la température ambiante, ce coefficient est de
l'ordre de l'unité en micron carré par heure pour des
températures de l'ordre de 1100 °C.

17
Généralité et contexte
bibliographique.
C
t
I.5.2.2. Deuxième loi de Fick:
En régime non permanent, le flux de diffusion et la
concentration sont fonction du temps et de la position. Afin de pouvoir
déterminer le coefficient de diffusion, il est nécessaire de
prendre en compte uneéquation de conservation de la matière. Dans
le cas où les particules ne participeraient pas à une
réaction (réaction chimique, réaction entre les
différents types de
[30,31] :
En combinant les équations (I.1) et (I.2), on obtient la
deuxième loi de Fick:
Dans le cas de cristaux cubiques ou de systèmes isotropes,
le tenseur de diffusion se
réduit à un scalaire D
j DgradC
Si de plus la concentration ne varie que dans la
directionx, .3) se réduit à:
C
D
C
t x
x
.. . (I.4)
Si enfin, on peut supposer que le coefficient de diffusion est
indépendant de la concentration,
suivante :
Du point
second ordre. Pour la résoudre, il est
nécessaire de définir les conditions initiales et les conditions
aux limites [32]. Ces conditions sont généralement
imposées d'un point de vue expérimental afin de pouvoir
déterminer les valeurs des coefficients de diffusion par comparaison
entre les profils mesurés et ces lois simples. Nous donnerons en-dessous
des solutions pour deux cas pratiques [30-31].
Diffusion depuis une couche mince:
Il s'agit du cas pratique où l'espèce diffusante
est déposée à l'instant initial sous forme d'un film mince
à la surface (x = 0) d'un échantillon très
épais. S'il n'y a pas d'évaporation de l'impureté,
dès que la profondeur de pénétration est très
grande devant l'épaisseur du film initial le profil de concentration
suit une loi gaussienneà l'intérieur de l'échantillon :
C
0
j
t
grad
. (I.2)
2
C
.. . (I.5)
C
t
D
x
2
grad DgradC
.
. . . (I.3)
|
Généralité et contexte
bibliographique.
|
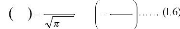
2
x
4 Dt
C x ,
t
Q
Dt
exp
Où Q est la quantité totale
d'impureté déposée (et donc dissoute dans le
matériau) :
0

Q
Cx
dx

Diffusion avec une concentration superficielle constante
:
Il s'agit du cas où une source extérieure
infinie permet de maintenirà la surface de l'échantillon une
concentration constanteC0 (constante par rapport au temps).
La solution fait alors appel à une fonction classique des
statistiques, la fonction erreur complémentaire:
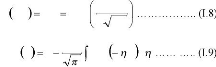
C x t C erfc
, 0
x
2 Dt
u
2 2
1 exp d .
0
erfc
u
Des tables donnent les valeurs de la fonction erreur
complémentaire. Sa variation en
x
fonction de u est donnée sur la figure I.11, en
échelle linéaire et semi-
2 Dt
logarithmique.
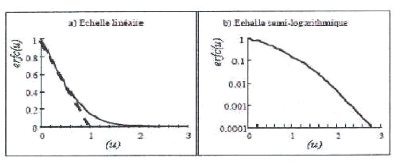
Figure I.11: Fonction erreur
complémentaire.

19
I.5.3. Expression du coefficient de diffusion en
fonction de la température :
. Elle contrôle la
concentration et la mobilité des défauts et par
ce biais la mobilité des atomes au sein du réseau. Dans un
cristal, chaque atome oscille autour de son site qui représente sa
position
amplifient et augmentent ainsi les
identique pour tout autre mécanisme), on peut montrer que
la fréquence de sauts atome
multipliée par la fréquence moyenne
x
Où N: est la fraction atomique de Boltzmann
[32].
N exp
kT
G f
Où f formation des lacunes (en eV), k la
constante de
Boltzmann et T la température (en Kelvin).
Pour sauter
caractéristique de la structure du cristal et de la nature
des proches voisins. Pour cela, il faut
fournir une certaine énergie enthalpie libre de migration
m fait
au La probabilité que
m nécessaire à franchir la barrière
est
donnée par:
kT
Gm
p exp
.... (I.12)
On peut ainsi exprimer la fréquence moyenne de saut
Et donc la fréquence de saut :
exp
kT
Gm
|
Généralité et contexte
bibliographique.
|
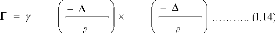
Gf
kT
Gm
kT
exp
exp
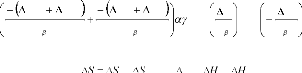
Le coefficient de diffusionD étant proportionnel
à la fréquence de saut longueur du saut [32], on
peutécrire :
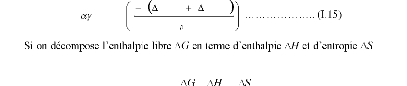
D exp
la relation thermodynamique :
Gm
Gf
kT
= T
suivant
on obtient :
D
Sm

k
S f
exp
S
k
. exp
kT
H
exp
Hm
kT
H f
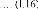
avec: f + m et H = f + m
On peut écrire, ainsi, le coefficient de
diffusionD, quel que soit le mécanisme de diffusion, de la
façon suivante :
D D0exp

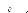
kT
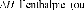
Où D0 est le coefficient préexponentiel
de diffusion (en m2.s-1),
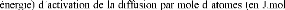
-1) et R la constante des gaz
parfaits (= 8.32 J.mol-1.K-1).
correspond
mécanismes de diffusion mis en jeu. On
remarqueégalement que le coefficient de diffusion augmente de
manière exponentielle lorsque que la température augmente.
I.5.4. Les divers types de diffusion:
réseau : diffusion de A dans A. Dans ce
cas les sauts sont complètement aléatoires car rien ne
|
Généralité et contexte
bibliographique.
|
atome marqué (par exemple un isotope) dilué dans le
solide pur : diffusion deA* dans A. Ce
traceur est discernable des atomes normaux du réseau. Le
coefficient sera modifié par un
facteur de corrélation et
aussi par un effet isotopique qui traduit la différence de masse
entre

en position
normale : diffusion deB en faible concentration
dansA.
On désigne par interdiffusion ou diffusion chimique, les
expériences dans lesquelles apparaissent de forts gradients chimiques :
diffusion après mise en contact de deux solides purs A et
B
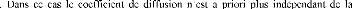
concentration [33].
|
Généralité sur les carbures des
métaux de transition.
|
Dans ce chapitre, nous donnerons uneétude bibliographique
sur les carbures des métaux de transition, et en cas particulier les
carbures de tungstène.
II.1. Carbures des métaux de
transition:
Les carbures sont des combinaisons de carbone avec un autre
élément ou plus, du système périodique, qui peut
appartenir aux groupes IA, IIA, IIIA et peutêtre aussi un métal de
transition du groupe IV, V, VI [34]. Leséléments
métalliques généralement forment des carbures et des
nitrures ; ils peuventêtre divisés en plusieurs types avec
différentes structures et caractéristiques physico-chimiques
[35]. Les carbures et les nitrures des métaux de transition sont des
composés contenant deux types d'atomes dont un type est un métal
de transition, comme le Ti, le W, etc et l'autre est du carbone ou azote. Pour
la brièveté, ils sont marqués comme métal, Me = Ti,
W..., et le non-métal, par Y = C, N, où Me et Y
36].
Les carbures des métaux de transition sont
groupés selon la position du métal de transition dans le tableau
périodique (tableau mondéliéev). Lorsque l'atome de
carbone s'insère dans le réseau, la structure de métal
varie (Tableau II.1).
|
Généralité sur les carbures des
métaux de transition.
|
Tableau II.1 : Les groupes des
carbures des m étaux de transition [37-39].
|
Noms
|
Synonymes
formules
|
Struct. Cristal.
Couleurs
|
Utilisations
|
|
Carbone
|
C
|
amorphe
noir
|
nucléaire
|
|
Carbure de bore
|
B4C
|
rhomboédrique
noir
|
mécanique, nucléaire
|
|
Carbure
|
HfC
|
/
|
carbure
|
|
Carbure de
Niobium
|
NbC
|
Cubique
|
/
|
|
Carbure de
silicium
|
SiC
|
hexagonale ou
cubique
incolore - noir
|
thermique, thermomécanique,
mécanique,
électrique,
électronique, nucléaire, chimique
et
militaire.
|
|
Carbure de
Tantale
|
TaC
|
cubique
noir
|
|
|
Carbure de
Tungstène
|
W2C
WC
|
hexagonale
hexagonale
noir
|
mécanique
|
|
Carbure de titane
|
TiC
|
Cubique
|
mécanique
|
|
Carbure de titane
|
Ti2C
|
Hexagonale
|
/
|
|
Carbure de
Vanadium
|
VC
|
Cubique
|
/
|
|
Carbure de
Vanadium
|
V2C
|
Hexagonale
|
/
|
|
Carbure de Zirconium
|
ZrC
|
Cubique
|
|
|
Graphite
|
C
|
hexagonale
noir
|
fibres réfractaires
|
|
Carbure de
molybdène
|
MoC
Mo2C
|
hexagonale
hexagonale
|
/
|
|
Généralité sur les carbures des
métaux de transition.
|
II.2. Propriétés des carbures des
métaux de transition:
Les carbures des métaux de transition ont une
combinaison unique des propriétés par exemple, un point de fusion
élevé, une haute stabilité chimique, une grande
dureté, une très bonne conductivité thermique et
électrique, et une bonne ésistance à la corrosion [40].
Mais ils sont très fragiles. Toutes ces propriétés
justifient leurs applications technologiques, soit comme matériaux
massifs ou comme des couches minces [41].
II.2.1. Propriétés structurale : a)-
La structure cristaiine :
La plupart des carbures des métaux de transition sont
des composants interstitiels où les atomes de carbone s'incorporent dans
le éseau du métal de transition. La géométrie des
sites interstitiels et la liaison entre le carbone et le métal sont des
caractéristiques nécessaires pour déterminer la structure
cristalline des carbures. La structure des carbures des métaux de
transition se détermine selon la règle de Hägg. Cette
règle est développée empiriquement les structures des
borures, des carbures, des halogénures, et des nitrures en métal
de transition [42].

Pour les composés des métaux de
transition (carbures, nitrur :
Si le rapport r=rX/rM (rX est le rayon
et
rM est le rayon
type B1(NaCl) ou hexagonale oit les atomes
de
atomique du m étal) est inférieur
à 0,59, la structure sera simple de
Règle Je Hägg
non métal occupent les sites
interstitiels octaédriques. C'est pourquoi ces
compos és sont connus par les composés
interstitiels.
Si r est supérieur à 0,59,
l'arrangement m étaiique est distordu pour accommoder les grands atomes
du non m étal et pour préserver l'interaction m
étalmétal. Ilen résulte la formation des structures
complexe.
Selon la règle de Hägg, si le rapport r est
inférieur à 0.59, les atomes de carbone s'insèrent dans
les positions interstitielles, sans provoquer de distorsions du éseau du
métal. Deux types des carbures interstitiels distinguent selon le type
de éseau cristallin des atomes de métal [43].
|
Généralité sur les carbures des
métaux de transition.
|
Dans le première type les carbures sont interstitiels
avec un réseau du métal à symétrie cubique à
faces centrées par exemple (TiC, ZrC, VC, HfC, TaC), dans ce cas et dans
les carbures e s'incorporent dans les sites interstitiels octaédrique ou
dans le centre du prisme trigonal. Par contre, dans le deuxième type les
carbures sont interstitiels avec un réseau du métal à
symétrie hexagonale compacte (par exemple : V2C, Ta2C, Mo2C, W2C), dans
le cas des carbures carbone occupent la moit des sites interstitiels
octaédriques disponibles.
Dans les deux types de carbures interstitiels, la coordinence du
carbone est de 6, età
comme carbone libre mélange au carbure.
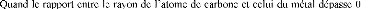
,59
deux autres types fondamentaux de structures se forment
[43-44].
a- Structure avec atomes de carbone isolés ayant une
coordinence de 8 et une symétrie hexagonale ou rhombique (MoC, WC,
Mn3C).
b-
symétrie hexagonale (Cr7C3, Mn7C3).
Généralement, on distingue trois genres de
structure des carbures des métaux de transition (figure II.1) selon le
type de réseau de métal:



La structure B1 (NaCl), où les sites
interstitiels octaédriques de l'élément
métallique,
de type (CFC), sont totalement occupés par les
atomes de carbone. Elle présente le
VC, NbC et TaC.
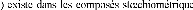
la structure L'3, où les atomes de carbone
occupent la moit des sites interstitiels octaédrique du
sous-réseau de l'élément métallique, de type
hexagonal compact (Hcp s de type M2C. par exemple V2C, Ta2C, Mo2C et W2C.
la structure WC, où les atomes de carbone occupent
les sites interstitiels du centre d'un prisme trigonal du sous réseau de
l'élément métallique, est hexagonal simple.
|
Généralité sur les carbures des
métaux de transition.
|
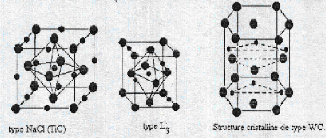
Figure II.1 : Trois genres de
structures des carbures des m étaux de transition.
La règle de Hägg introduit une
géométrie simple pour les structures formées, tant que la
structure des carbures se détermine par leurs propriétés
électroniques. La structure électronique a un effet
considérable sur les changements de la structure cristalline dans les
métaux et les carbures [42].

La progression en structure cristalline d épend du
nombre d'électrons de valence sp par atome (e/a)
:
GLl lliro1ic t'/ngcl-131c r(c1
ée est CC.
la structure formée est Hcp.
ée est CFC.
La caractéristique intéressante de la structure
des carbures des métaux de transition est que le réseau
adopté par le métal dans le carbure n'est jamais celui du
métal de base, c'est-àdire : si le métal a un
réseau Hcp, son carbure a le métal sur un réseau CFC, le
métal de base CFC occupe un réseau non-cubique dans son carbure,
et les métaux de base CC ont des réseaux CFC ou Hcp dans leurs
carbures. Ceci a été expliqué en utilisant la
théorie d'Engel-Brewer [42].
|
Généralité sur les carbures des
métaux de transition.
|
b)- Les liaisons cristallines :
Les composantes réfractaires et parmi elles les carbures
étant connus par la complexité de leurs structures
cristalline.
Il y a trois types [43-45].


La liaison ionique : on trouve ce type de
liaison dans les carbures des métaux alcalins, alcalino-

La liaison covalente : elle est
prépondérante dans les carbures SiC, B4C.
La liaison métallique : les carbures des
métaux de transition présent ce type de liaison.
Dans les carbures covalents, les liaisons sont très
localisées et directionnelles entre les atomes de carbone et ceux de
métal (Si ou B). Il en résulte une haute
réfractivité, une dureté extrême, une
stabilité chimique supérieure à celle de tous
résistance électrique peu élevée
[43,45].
Les carbures métalliques sont caractérisés
par des bondes électroniques délocalisées étendues
sur tous les réseaux
conséquent, quelques propriétés de ces
carbures, comme par exemple la conductivité électrique, sont
spécifiquement métalliques [42].
Tous les carbures sont caractérisés par leur grande
dureté et haut point de fusion, les petits pour les carbures ioniques.
Les coefficients de dilatation thermique augmentent en partant des carbur
ioniques [45].
II.2.2. Propriétés physiques et
mécaniques :
Les propriétés physiques et mécaniques
pour certains types des carbures des métaux de transition sont
données dans le tableau suivant (tableau II.2), tout en sachant que ces
propriétés sont très dépendantes de la technique
délaboration. Il existe un grand nombre des composés
possèdent une dureté élevée. Cependant, pour
réussir la conception d'un revêtement, il est nécessaire de
faire une bonne sélection des matériaux ainsi qu'une bonne
sélection de la technique délaboration.
|
Généralité sur les carbures des
métaux de transition.
|
Tableau II.2: Les
propriétés physiques et mécaniques des carbures des m
étaux de transition.
|
matériaux
|
Température
de
fusion
(°C)
|
Dureté
(Kg/mm2)
|
Module
d'Yong
(GPa)
|
Résistivité
électrique
|
Coeff.
moyen
de
dilatation
thermique
|
|
Ti
|
1660
|
55
|
120
|
42,7
|
9,3
|
|
TiC
|
3067
|
3000
|
470
|
50
|
7,4
|
|
TiN
|
2947
|
2000
|
--
|
25
|
9,4
|
|
Zr
|
1855
|
100
|
95
|
42,4
|
7,1
|
|
ZrC
|
3445
|
2800
|
400
|
42
|
6,7
|
|
ZrN
|
2982
|
1600
|
--
|
21
|
7,2
|
|
Hf
|
2223
|
85
|
138
|
32,1
|
5,8
|
|
HfC
|
3928
|
2500
|
352
|
--
|
6,6
|
|
HfN
|
--
|
1600
|
--
|
--
|
6,2
|
|
V
|
1917
|
55
|
130
|
20,1
|
10,0
|
|
VC
|
2830
|
2940
|
430
|
59
|
7,3
|
|
VN
|
2346
|
1520
|
--
|
85
|
9,2
|
|
V2N
|
--
|
1900
|
--
|
--
|
--
|
|
Nb
|
2477
|
80
|
101
|
14,4
|
8,0
|
|
NbC
|
3613
|
1950
|
580
|
19
|
6,6
|
|
NbN
|
2204
|
1420
|
--
|
58
|
10,1
|
|
Nb2N
|
--
|
1700
|
--
|
--
|
--
|
|
Ta
|
3017
|
110
|
186
|
13,1
|
7,0
|
|
TaC
|
3985
|
1700
|
560
|
15
|
6,3
|
|
Ta2C
|
--
|
1300
|
--
|
--
|
--
|
|
Ta2N
|
--
|
1200
|
--
|
--
|
--
|
|
TaN
|
--
|
--
|
--
|
--
|
5
|
|
Cr
|
1857
|
230
|
250
|
12,9
|
10,8
|
|
Cr3C2
|
1895
|
1300
|
390
|
75
|
10,3
|
|
Cr2N
|
1740
|
--
|
--
|
--
|
--
|
|
CrN
|
--
|
1100
|
--
|
64
|
2,3
|
|
Mo
|
2623
|
250
|
320
|
5,47
|
6,0
|
|
Mo2C
|
2520
|
1650
|
230
|
71
|
4,9//a ; 8,2//c
|
|
Mo2N
|
1950
|
1700
|
--
|
79
|
--
|
|
W
|
3422
|
360
|
407
|
5,39
|
4,45
|
|
WC
|
2776
|
2200 (0001)
|
720
|
22
|
5,0//a ; 4,2//c
|
|
|
1300 (1010)
|
--
|
--
|
|
|
WN
|
600
|
--
|
--
|
19,89
|
--
|
|
B4C
|
2450
|
2940
|
450
|
104
|
--
|
|
SiC
|
2300
|
2580
|
480
|
103
|
--
|
|
Si3N4
|
1900
|
1700
|
210
|
1016
|
--
|
|
C (diamant)
|
3800
|
7600
|
7600
|
1018
|
--
|
Les caractéristiques qu'on pourrait tirer du tableau II.2
ci-dessus sont les suivantes : [42, 45,46].
|
Généralité sur les carbures des
métaux de transition.
|
a) - La température de fusion:
Les températures de fusion des carbures et des
nitrures sont très élevées en comparaison avec les
métaux purs, elles sont parmi les plus hautes de tous les types de
matériaux, et elles sont semblables à celles des matériaux
céramiques.
Pour les métaux, le maximum des points de fusion est
observé entre les groupes V et VI, tandis que pour les carbures, il est
dans le groupe V et pour les nitrures dans le groupe IV.
b) - La dureté :
Dans le cas des carbures, la dureté représente
une de leurs proprétés les plus significatives. Les valeurs de la
dureté des carbures sont très élevées en
comparaison avec les nitrures, et les métaux purs, mais ces valeurs de
dureté varient en fonction du mode de préparation du carbure (la
température de préparation, la pression, l'épaisseur de
la couche et la technique de mesure utilisée
Généralement, les métaux les plus durs
ont une énergie de cohésion élevée, une courte
longueur de liaison et une forte liaison de valence. Les carbures des
métaux de transition ayant des liaisons de type ionique,
métallique et covalent. La liaison ionique et métallique
réduit la dureté du cristal.
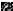
Dans les couches minces des carbures des métaux de
transition, le renforcement de la
finesse des grains est démontré par la relation de
Hall Petch [47]: H H0 Kd1/ 2
avec:
- H : est la dureté de polycristal.
- H0 : est la dureté
intrinsèque pour un monocristal.
- D : est la taille moyenne des
grains.
- K : est une constante de matériaux.
Mais ils ont remarqué que cette relation est valable pour
les couches monophasées dont la taille de grain est inférieure
à 20 nm.
c) - Le module de Young:
Le module de Young est une autre proprété
mécanique qui représente la rigidité du matériau,
ou bien sa résistance à la déformation
élastique.
Les valeurs de module de Young sont considérablement
grandes pour les carbures et les nitrures comparés à celles des
métaux purs, et elles sont similaires à celles des
matériaux céramiques.
|
Généralité sur les carbures des
métaux de transition.
|
d) - La résistivité électrique
:
Les matériaux peuvent être classifiés comme
conducteurs, semi-conducteurs ou isolants. Les conducteurs
caractérisés par une résistivité dans la gamme de
10-2 3 u
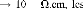
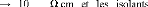
semi-conducteurs approximativement 106 11 u à peu
prés
1013 18u .
Les valeurs de la résistivité électrique
des carbures et des nitrures sont peuélevées que celles des
métaux purs, mais ils sont encore dans la classe de conducteurs. Par
contre, les matériaux céramiques ont des valeurs
extrêmement élevées, donc ils sont des isolants.
e) - La dilatation thermique:
Le coefficient de dilatation thermique (CDT) est une
caractéristique très importante dans l'élaboration des
couches minces. La différence entre les coefficients de dilatation
thermique des substrats et du film est l'origine des contraintes
résiduelles [10]. Les coefficients de dilatation thermique augmentent en
partant des carbures covalents, pui
ioniques [45].
La dilatation thermique linéaire peut être
définie en fonction de la température par l'équation
suivante [48] :
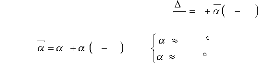
/ C
5 / C 2
10
5
10
0
1
avec : 1 T 25 /
0
1 T 25
l
l
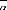
: Le coefficient moyen de dilatation thermique.
En plus de ces propriétés
précédentes, les carbures des métaux de transition sont
caractérisés également par:
f) - La
réfractérité :
Les carbures des métaux de transition des groupes IV
et IIV sont caractérisées par la
réfractérité, c'est-à-dire ils ont un haut point de
fusion (la température de décomposition (tableau II.2)) [49], en
plus ils ont une résistance appropriée aux déformations
mécaniques à une haute température. D'après la
théorie de Branski, la réfractérité des
métaux dépend de la configuration électronique des atomes
de ces métaux [43].
g) - L'adhérence :
L'adhérence de revêtement de carbure avec son
substrat s'exprime comme la force nécessaire pour rompre l'interface.
Plusieurs techniques s'utilisent pour déterminer cette
|
Généralité sur les carbures des
métaux de transition.
|
grandeur, parmi ces tests: le testà rayure (scratch
test). L'adhérence dépend de la température. Elle varie
avec la rugosité de la surface, la dureté du substrat et la
nature chimique de l'interface.
R.Halimi et al. [50] ont étudié
l'adhérence des films minces de carbure de titane en fonction de la
température, ils ont rapporté que l'adhérence augmente
avec la température de recuit jusqu'à 1000 °C et aucune
perte d'adhérence n'a été observée, même pour
une charge de 1000 g.
h) - Les contraintes résiduelles
:

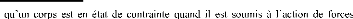
Notion de contraintes :
On dit
extérieures ou de façon plus générale
quand un de ses éléments exerce une force sur les
éléments voisins [51].
Pratiquement toutes les couches mincesélaborées
par PVD présentent des contraintes internes [52]. Ces contraintes
induites par les différentes étapes de dépôt, les
traitements thermiques et thermomécaniques (ou de diffusion) sont dites
contraintes résiduelles [53-54].
Les contraintes résiduelles sont des contraintes
statiques qui existent dans un système isolé soumis à
aucune force ni moment extérieur et qui se trouvent en équilibre
mécanique [55]. Comme les matériaux ne sont pas jamais
parfaitement continus et présentent
Les sources de contraintes peuvent provenir de
déformations aux échelles macro, micro ou submicroscopique.

Ordres de contraintes :
Une classification de contraintes en trois ordres a
été proposée il y a quelques années [51,55].
1- Les contraintes résiduelles du 1er ordre
sont homogènes sur plusieurs grains. Elles peuvent atteindre localement
des valeurs très importantes, mais elles sont nulles à
2- Les contraintes résiduelles du 2eme
ordre
rmations résultantes des désorientations
cristallines entre grains, le retour élastique de chaque grain
étant diffère de celui des autres grains.
|
Généralité sur les carbures des
métaux de transition.
|
3- Les contraintes résiduelles du 3eme ordre
sont homogènes sur les petits domaines de
deux solide (quelques distances interréticulaires). Ces
contraintes sont dues à
1-

2, et 3.
L'origine des contraintes
résiduelles on distingue trois origines de contraintes
dans le revêtement [56] :
résulte de la
Contraintes intrins èques : elles
résultent de la croissance du revêtement. Plusieurs facteurs
engendrent ce type de contrainte, comme le bombardement ionique lors de la
déposition de revêtement qui peut introduire des contraintes de
compression dans la couche superficielle où l'énergie des atomes
qui bombardent est plus grande lorsque la pression est faible. Les
impuretés du gaz introduisent aussi des contraintesélevées
dans les couches minces, la formation d'oxydes aux joints de grains introduits
aussi des contraints de compression. La coalescence des grains et les
transformations de phases influent également sur les contraintes
intrinsèques.
2- Contraintes thermiques : elles
résultent de la différence des coefficients de dilatation
(expansion) entre le dépôt et le substrat. Pendant la
déposition de revêtement, les contraintes intrinsèques
décroissent avec la température du substrat (figure II.2).
3- Contraintes externes : elles sont dues
aux déformations des revêtement/substrat.
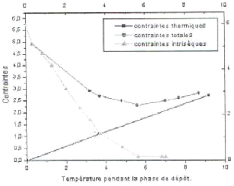
Figure II.2 : Contribution des
contraintes thermiques et intrins èques.
|
Généralité sur les carbures des
métaux de transition.
|
II.3. Préparation des carbures :
à deux seulement : la métallurgie des poudres et la
déposition des couches minces.
II.3.1. Métallurgie des poudres :
Le tableau II.3 résume les méthodes
utilisées en métallurgie des poudres pour préparer les
carbures polycristallins [2,43]. La réaction directe des deux
éléments (métal en poudre et carbone) se fait par fusion
ou frittage. La consolidation des carbures sous des formes utiles se fait par
frittage (puis traitement thermique) ou par compression chaud.
Tableau II.3 : Méthodes de
préparation de carbures.
|
Méthodes
|
Réactions
|
|
a)- Réaction directe des
éléments dans une atmosphère protectrice ou sous
vide.
|
M+C MH+C
|
2
|
b)- réaction
avec le carbone en excès dans une
atmosphère protectrice ou réductrice.
|
MO + C
|
|
c)- réaction du métal avec un gaz
organique
|
M + CxHy C + H2
M + CO 2
|
d)- métal en
présence
|
MCl4 +CxHy + H2
|
mHn)
|
e)- décomposition du métal carbonyle
en
|
M + H2
|
2, H2, H2O)
|
f)- électrolyse des sels
fondus
|
|
Na2O B2O3 + NaCO3 +LiF + MoO3
|
|
II.3.2. Déposition des couches minces:
Des couches minces de carbures peuventêtre obtenues par
dépôt direct des carbures sur
de carbures. Elle
consiste à déposer une couche de métal pur
sur des substrats en acier riche en carbone puis
carbone du substrat vers la couche superficielles du métal
et par la suit sa liaison avec les atomes métalliques [57].
|
Généralité sur les carbures des
métaux de transition.
|
La différence fondamentale entre le
procédé de déposition avec introductions de gaz
réactifs (N2, CH4 de l'adhérence des couches au substrat. En
effet, la faible adhérence du film à son substrat,
l'inhomogénéité de la composition et la présence de
gaz explosif (toxique) sont les principaux problèmes posés lors
de la déposition directe de carbure ou de nitrure de métaux de
transition par PVD ou CVD. Alors que dans le second procédé,
l'interface n'existe pratiquement pas, vu l'interdiffusion des
éléments du substrat dans le film. On obtient ainsi, une
quasi-continuité de la matière du substrat au revêtement et
une adhérence très forte des couches au substrat.
| 


