|
|
|
|
|
République Algérienne Démocratique et
Ministère de l'Enseignement Supérieur et de la Recherche
Université Mouloud Mammeri de Tizi
Faculté des Sciences Agronomiques et des Sciences
Département de Biochimie et de Microbiologie.
En vue d'obtention du diplôme d'études
supérieures
Option : biochimie.
Mesure de l'impact toxique du
paracétamol
thérapeutiques chez 11 alcooliques
adultes
dosage des taux de quelques marqueurs
hépatiques, et évaluation du danger
encouru intoxiqués par ce médicament.
Travail réalisé par :
Mlle. AISSAT Samira.
Encadreur:
Dr. MEKACHER L-R.
Pharmacien-assistant de toxicologie. Praticien de santé
publique CHUTO.
Promotion de Biochimie : 2009/
|
Populaire.
Scientifique.
Ouzou.
Biologiques.
en sciences biologiques
à doses
volontaires à travers le
moléculaires de lésions
par deux présumés
Co-encadreur: Mr. SMAIL
R.
Maitre assistant-chargé de cours. Enseignant UMMTO.
2010.
|
|
|

Ce fut une idée, qui n'aurait pu voir le jour et se
concrétiser sans la contribution et surtout la confiance de deux
personnes que je remercie énormément, je cite mon encadreur :
Dr MEKACHER L-R ; pharmacien-assistant en toxicologie, praticien
de
santé publique au CHUTO, ainsi que mon co-encadreur :
Mr SMAIL R ; maitre
assistant-chargé de cours en biochimie du
département de Biochimie et de
Microbiologie de notre faculté.
Mes remerciements s'adressent à : Mme AIGOUN
responsable du Laboratoire de Toxicologie du département de Pharmacie de
la Faculté de Médecine qui a si gentiment accepté de
m'accorder l'accès au laboratoire.
Je remercie également l'équipe médicale et
paramédicale du laboratoire Central de Biochimie du CHUTO dirigé
par le Dr SIFER, en particulier Mme HADJ KACI, qui m'a
facilité mon travail au sein du laboratoire.
Je tiens à remercier Mr REZOUG Belkacem sans qui je
n'aurais pu établir le contact avec les alcooliques qui ont
accepté, au nom de la science, de contribuer à
notre étude.
Je remercie tous les enseignants de la faculté des
sciences agronomiques et sciences biologiques avec une attention
particulière à Mlle TADJER D.
Je remercie tous ceux et toutes celles qui ont contribué
de prés ou de loin à la réalisation de ce travail.

À
la mémoire de mon
défunt
père,
ma mère et au reste
de la famille,
tous ceux
qui

Sommaire :
Introduction 5
1. Synthèse bibliographique 6
1.1- Définition du paracétamol 6
1.2- Origine 6
1.3- Historique 7
1.4- Caractéristiques du paracétamol 10
1.4.1- Caractéristiques structurales 10
1.4.2- Caractéristiques physico-chimiques 10
1.4.3- Galénique 10
1.4.4- Caractéristiques pharmacologiques 11
1.4.4.1- Caractéristiques pharmacocinétiques
11
1.4.4.1.1- Absorption 11
1.4.4.1.2- Distribution 12
1.4.4.1.3- Métabolisme 12
1.4.4.1.4- Elimination 14
1.4.4.2- Caractéristiques pharmacodynamiques 14
1.4.4.2.1- Doses actives 14
1.4.4.2.2- Mode d'action et cibles moléculaires 14
1.5- Indications thérapeutiques 17
1.6- Contre indications, effets indésirables et
interactions médicamenteuses 17
1.7- Toxicologie du paracétamol 18
1.7.1- Prévalence 18
1.7.2- Circonstances 18
1.7.3- Mécanisme d'action toxique 18
1.7.4- Formes cliniques 20
1.7.5- Symptomatologie 20
1.7.6- Facteurs de risque 21
1.7.6.1- Déplétion des réserves en
glutathion 21
1.7.6.2- Inducteurs du cytochrome P-450 22
1.7.6.3- Inhibiteurs de la glucoronyl transférases 22
1.7.6.4- Variabilités interindividuelles et
interethniques 22
1.7.7- Diagnostic 23
1.7.8- Traitement 24
1.7.8.1- Traitement évacuateur 24
1.7.8.2- Traitement antidotique 25
2. Matériels et méthodes 27
2.1- Matériels 27
2.1.1- Echantillons 27
2.1.2- Appareillage 27
2.1.3- Produits et réactifs 27
2.1.4- Autres 28
2.2- Méthodes 28
2.2.1- Echantillonnage 28
2.2.1.1- Evaluation du risque encouru par deux
présumés intoxiqués au paracétamol 28
2.2.1.2- Mesure de l'impact toxique de la prise de
paracétamol à doses thérapeutiques chez 11 alcooliques
volontaires adultes 28
2.2.2- Chromatographie sur couche mince des urines du patient
présumé intoxiqué au paracétamol admis au CNT
d'Alger 29
2.2.3- Dosage spectrophotométrique du paracétamol
dans le sang des patients
présumés intoxiqué au paracétamol
30
2.2.3.1- Principe 30
2.2.3.2- Mode opératoire 30
2.2.3.2.1-Préparation des solution « étalon
» de paracétamol 30
2.2.3.2.2- Préparation des échantillons 31
2.2.3.2.3- Préparation du mélange
réactionnel et mesure de l'absorbance 31
2.2.4- Détermination du bilan hépatique 31
2.2.5- Etude statistique 33
3. Résultats et discussion 34
3.1- Evaluation du risque encouru par les présumés
intoxiqués au paracétamol 34
3.1.1- Chromatographie sur couche mince des urines du patient
présumé intoxiqué au paracétamol admis au CNT
d'Alger 34
3.1.2- Dosage spectrophotométrique du paracétamol
dans le sang des patients présumés
intoxiqués au paracétamol 35
3.1.3- Conclusion 37
3.2-Mesure de l'impact toxique de la prise de paracétamol
à doses therapeutiques chez 11
alcooliques volontaires et adultes 38
Conclusion 44
Liste des figures :
- Figure 1 : Formule développée du
paracétamol 6
- Figure 2 : Schéma de la réaction
d'acylation du paraaminophénol en paracétamol 7
- Figure 3 : Schéma de la réaction
d'acylation de l'aniline en acétanilide 7
- Figure 4 : Formules développées
du naphtalène (a), de l'acétanilide (b) et de l'antipyrine (c)
8
- Figure 5 : Formules développées
de l'aniline (ou phénylamine) (a), de la phénacétine
(b) et du paracétamol (c) 9
- Figure 6 : Diagramme représentant les
différentes possibilités de métabolisation du
paracétamol 13
- Figure 7 : Voies de biosynthèse des
prostanoïdes 15
- Figure 8 : Action du paracétamol 16
- Figure 9 : diagramme représentant
l'importance relative qu'acquiert la voie oxydative
dans le métabolisme du paracétamol lors d'une
intoxication 19
- Figure 10 : Graphe montrant la relation
inverse entre la teneur en glutathion dans le
foie et le taux de liaison du NAPQI avec les protéines de
cet organe 22
- Figure 11 : Nomogramme de RUMACK-MATTHEWS
mettant en relation la concentration plasmatique du paracétamol, le
temps après l'ingestion et la gravité de l'intoxication 23
- Figure 12 : Formule
semi-développée du N-acétyl-L-cystéine 25
- Figure 13 : Diagramme représentant les
étapes de la biosynthèse du glutathion à partir
de la NAC 26
- Figure 14 : Photographie de l'ampoule à
décantation du mélange urine et éther
diéthylique en présence d'acide chlorhydrique 29
- Figure 15 : Équation des
réactions du paracétamol avec les ions nitrites et du 3-nitro
4-hydroxyacétanilide produit avec les ions hydroxydes 30
- Figure 16 : Photographie du doseur Beckmann
Coulter à système SYNCHRON CX-9
32
- Figure 17 : Chromatogramme de CCM sur gel de
silice des urines du patient admis au
CNT d' Alger pour intoxication au paracétamol 34
- Figure 18 : courbe d'étalonnage du
dosage spectrophotométrique du paracétamol dans
le sang des patients présumés intoxiqué par
ce medicament 36
- Figure 19 : Photographies montrant la
différence de coloration entre un mélange réactionnel
(milieu acide avec ions nitrites) contenant du paracétamol (b) et un
mélange ne contenant pas (a) 38
- Figure 20 : Histogrammes illustrant la
variation des paramètres mesurés en fonction
de la fonction ou pas de paracétamol chez 11 alcooliques
volontaires 41
Page 3
Liste des tableaux :
- Tableau I : spécification des
réactifs pour doseur Beckmann Coulter à système SYNCHRON
CX-9 32
- Tableau II : Résultats des absorbances
mesurées à une longueur d'onde ë=405 nm
35
- Tableau III : Taux des marqueurs
hépatiques dans le sang pour chacun des trois prélèvements
39
- Tableau VII : Résultats du calcul des
paramètres statistiques élémentaires et du test t
de STUDENT pour échantillons appariés N = 11 et ddl
= 10 42
Liste des abréviations :
- ALAT : Alanine amino transférase
- ASAT : Aspartate amino transférase
- CCM : Chromatographie sur couche mince
- CHU : Centre Hospitalo Universitaire
- CNT : Centre National de Toxicologie
- Cox : Cyclooxygénase - CYP : Cytochrome P
- D-BIL : Bilirubine directe - DE 50 : Dose efficace 50 - DL 50 :
Dose létale 50
- DO : Densité optique
- DT 50 : Dose toxique 50
- GGT : Gamma glutamyl transférase
- NAC : N acetyl cystéine
- NAPQI : N acetyl P benzo quinine imine
- PAL : phosphatase alcaline - T-BIL : bilirubine totale.
- UMMTO : Université Mouloud MAMMERI de Tizi Ouzou
Page 3
Résumé
Résumé :
L'éthanol est un inducteur des mono-oxygénases
à CYP-450, responsable de la transformation du paracétamol en
NAPQI, un métabolite hépatotoxique, plaçant ainsi les
alcooliques parmi les personnes à risque à l'intoxication au
paracétamol.
Afin de voir plus clair et d'avoir une idée plus
précise sur le seuil de l'expression de la toxicité de ce
médicament, nous avons choisi un petit groupe de 11 individus de sexe
masculin, tous volontaires, appartenant à la tranche d'âge [45-50]
ans, consommant quotidiennement de l'alcool, à fin de mesurer l'impact
hépatotoxique de la prise de paracétamol à dose
thérapeutique, soit 1g toutes les quatre heures, pendant 12 heures.
Etant donné que la cytolyse hépatique est l'un des
principaux et premiers signes de cette hépatotoxicité, nous
sommes partis du principe que les taux plasmatiques des transaminases
hépatiques ASAT et ALAT, devraient forcément augmenter sous
l'effet du paracétamol et ce d'autant plus, que le sujet est une
personne à risque.
Les résultats des dosages des taux plasmatiques de ces
marqueurs de cytolyse hépatique, obtenus, montrent une réelle et
considérable atteinte et suggèrent, d'une part, plus de prudence
dans la prescription du paracétamol, voire le bannissement de son
automédication, et d'autre part, l'utilisation du dosage des taux
plasmatiques de ASAT et ALAT pour l'évaluation du degré
d'intoxication par ce médicament, en complément de l'estimation
de la dose ingérée à travers la détermination de la
paracétamolémie.
Mots dlés : paracétamol,
intoxication, toxicité, dose, alcooliques, bilan hépatique.
Page 4
Introduction
Introduction :
Le paracétamol est la substance active d'une large
gamme de spécialités médicamenteuses telles que :
Doliprane, Efferalgan, Expandol, Paralgan, ...etc., et est
préconisé comme traitement symptomatique de la douleur et de la
Fièvre.
Sa disponibilité sans ordonnance en pharmacie, ainsi
que le peu ou l'absence d'effets indésirables qui lui sont
associés, font de lui le médicament le plus prescrit et le plus
consommé des antalgiques-antipyrétiques.
Pourtant, il lui est connu une hépatotoxicité,
notamment chez les personnes à risque tels que les alcooliques, les
personnes dénutries ou consommant une certaine catégorie de
médicaments dont la caractéristique est d'induire les
cyclo-oxygénases à cytochrome P-450,...etc..
Afin de voir plus clair et d'avoir une idée plus
précise sur le seuil de l'expression de la toxicité de ce
médicament, et étant donné que l'éthanol est un
inducteur des mono-oxygénases à CYP-450, responsable de la
transformation du paracétamol en NAPQI, ce métabolite
hépatotoxique, plaçant ainsi les alcooliques parmi les personnes
à risque d'intoxication au paracétamol, nous avons choisi un
petit groupe de 11 individus de sexe masculin, tous volontaires pour cette
étude, et appartenant à la tranche d'âge [45-50] ans,
consommant quotidiennement de l'alcool, à fin de mesurer l'impact
hépatotoxique de la prise de paracétamol à doses
thérapeutiques.
Profitant aussi de la survenue de deux cas
présumés intoxiqués au paracétamol, nous avons
cherché à évaluer le risque encouru par chacun d'eux en
procédant par les techniques et approche en usage dans nos Services
spécialisés.
Page 5
I/ Synthèse bibliographique :
1.1- Définition du paracétamol :
Le paracétamol, de formule brute << C8H9NO2
», est la dénomination commune internationale (DCI) de la substance
active de plusieurs spécialités pharmaceutiques de la classe des
antalgiques-antipyrétiques.
Son nom chimique systématique est <<
para-acétamido-phénol » (Figure 1). Il est néanmoins
désigné par plusieurs autres noms tels que : <<
N-(4-hydroxyphényl)-acétamide », <<
N-acétyl-para-aminophénol (en abrégé NAPAP ou
APAP), << acétylaminophénol », <<
phydroxyacétanilide », << 4'-hydroxy-acétanilide
», << acétaminophène » ou encore <<
N-paraacétyl-aminophénol ».
Quant à son nom commun << paracétamol »,
il est dérivé de la contraction de son nom chimique
systématique.

Figure 1 : Formule développée du
paracétamol.
1.2- Origine :
Le paracétamol est d'origine synthétique. Il
peut être obtenu par l'acylation (Figure 2) du para-amino-phénol
en solution dans l'acide éthanoïque (acide acétique), par
l'action de l'anhydride acétique à 100 °C (CLAYDEN et
al, 2003 ; MESPLEDE et SALUZZO, 2004).
Cette réaction d'acylation dépend du rapport des
concentrations des réactants : à concentrations
équivalentes en anhydride acétique et paraaminophénol, le
produit obtenu est exclusivement mono-acétylé,
c'est-à-dire du paracétamol pur. Mais en présence d'un
excès d'anhydride acétique, le produit obtenu est doublement
acétylé et ne correspond pas au paracétamol. Dans ce
dernier cas néanmoins, l'hydrolyse suffit pour la transformation du
composé doublement acétylé en composé
mono-acétylé, donc, en paracétamol.
Page 6
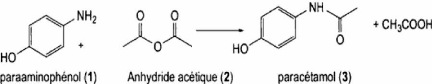
Figure 2 : Schéma de la réaction
d'acylation du
paraaminophénol en paracétamol.
Le paracétamol peut être aussi obtenu suivant une
autre voie comprenant d'abord une acylation de l'aniline (appelée aussi
phénylamine) au moyen de l'anhydride acétique (ou anhydride
éthanoïque) (Figure 3), suivie d'une hydroxylation de
l'acétanilide obtenu sous l'action de l'acide ascorbique (LE MAREC,
2005).
Aniline anhydride acétique acétanilide
Figure 3 : Schéma de la réaction
d'acylation de l'aniline en
acétanilide.
1.3- Historique :
Le paracétamol est une molécule qui comme
l'aspirine est plus que centenaire, mais qui malheureusement n'a à son
actif qu'une cinquantaine d'années d'activité
thérapeutique (LE MAREC, 2005).
Elle représente une découverte providentielle,
née d'une erreur de livraison de produit qui c'était produite en
1886, à l'université de Strasbourg, où les deux assistants
du professeur KUSSMAUL, ARNOLD CAHN et PAUL HEPP, qui réalisaient des
essais thérapeutiques
Page 7
avec du naphtalène (Figure 4a) sur les parasitoses
intestinales, reçurent de l'acétanilide (Figure 4b) à la
place du naphtalène et ne s'aperçurent de cette erreur
qu'après observation d'une baisse inhabituelle de température
chez leurs patients (LE MAREC, 2005 ; QUENEAU, 2006).

(a) (b) (c)
Figure 4 : Formules développées
du naphtalène (a), de l'acétanilide
(b) et de l'antipyrine (c)
(LE MAREC, 2005).
Ainsi ces deux auteurs (ARNOLD CAHN et PAUL HEPP)
découvrirent l'activité antipyrétique de
l'acétanilide appelé aussi phényl-acétamide, qui
est une amine aromatique de formule C8H9NO.
Ils s'empressèrent alors de publier leur
découverte et d'ouvrir leur propre fabrique pour concurrencer
l'analgésique mais aussi l'antipyrétique en vogue à
l'époque : « l'antipyrine » (Figure 4c), appelé aussi
« phénazone » ou encore « analgésine », le
premier médicament au monde entièrement synthétisé
(VIBES, 2001), et donnèrent au nouveau médicament le nom
d'antifébrine.
Mais étant donné que l'acétanilide est un
dérivé de l'aniline (matière première dans
l'industrie des colorants extraite à partir de l'huile de goudron de
houille, ou de l'indigo) (LE MAREC, 2005), les chercheurs
s'intéressèrent alors aux autres dérivés de
l'aniline notamment la phénacétine (Figure 5) pour laquelle on
découvrît des vertus antalgique et antipyrétique (LE MAREC,
2005 ; QUENEAU, 2006).
C'est ainsi aussi, selon LE MAREC (2005), que MORSE a
réussi, en 1888, à obtenir un autre dérivé portant
les mêmes propriétés analgésiques et
antipyrétiques que l'acétanilide : il s'agit du
para-acétamido-phénol communément appelé «
paracétamol ».
Page 8
Hélas ! en 1893, JOSEPH VON MERING, un médecin
allemand, comparant les propriétés antalgiques et
antipyrétiques du paracétamol et de la phénacétine
ainsi que leurs toxicités respectives, conclu que le paracétamol
est beaucoup plus toxique pour le rein des malades que la
phénacétine et donna la préférence à cette
dernière, qui va, aux cotés de l'aspirine, jeter de l'ombre sur
le paracétamol un demi-siècle durant (QUENEAU, 2005).

(a) (b) (c)
Figure 5 : Formules développées
de l'aniline (ou phénylamine) (a), de la
phénacétine
(b) et du paracétamol (c) (LE MAREC, 2005).
Cela a duré jusqu'en 1948, année où l'on
s'aperçût de l'importante néphrotoxicité de la
phénacétine chez des consommateurs chroniques (QUENEAU, 2005).
Par la suite, selon LE MAREC (2005) et QUENEAU (2006),
d'autres études toxicologiques furent concluantes, preuves à
l'appui, vis-à-vis des propriétés antalgique et
antipyrétique et montrèrent une bonne tolérance de
l'organisme au paracétamol.
Ainsi le docteur VON MERING avait commis une erreur et
celle-ci est aujourd'hui attribuée à une contamination du
paracétamol étudié par ce médecin, par une
espèce chimique douée d'une forte néphrotoxicité
(LE MAREC, 2005 ; QUENEAU, 2006).
Enfin en 1955, la Food and Drugs Administration (FDA) permit
la commercialisation, et pour la première fois, du paracétamol
aux États-Unis. À partir de ce moment, l'utilisation du
paracétamol connu un tel essor qu'il est considéré
aujourd'hui comme le plus populaire et le plus utilisé des antalgiques
et antipyrétiques (QUENEAU, 2006).
Page 9
1.4- Caractéristiques du paracétamol :
1.4.1- Caractéristiques structurales :
Le paracétamol est un dérivé
phénolique. Sa structure comporte donc un cycle benzénique
substitué par un groupement hydroxyle et un groupement acétamide
en position para (Figure 1).
Le paracétamol ne comporte pas de carbone
asymétrique et n'a pas de stéréo-isomères (CLAYDEN
et al, 2002).
1.4.2- Caractéristiques physico-chimiques :
Le paracétamol est un acide organique faible (pKa =
9,5) très liposoluble, qui se présente sous forme de poudre
cristalline, blanche, inodore et de saveur amère (ELLIS, 2002 ; SERRIE
et THUREL, 2002).
Le paracétamol est soluble dans l'eau froide et peut
atteindre la limite de 14,3g/l, alors que dans l'eau chaude, les 50g/l, et dans
l'éthanol, les 140g/l (ELLIS, 2002).
Sa masse molaire est de 151,17 g/mol.
1.4.3- Galénique :
Le paracétamol est commercialisé sous
différentes formes galéniques pour adulte, pour enfant ou pour
nourrisson :
pour l'adulte, le paracétamol se présente sous
forme de comprimés (sécables ou effervescents), gélules ou
poudre, dosés usuellement à 500mg (STORA, 2005) ; pour l'enfant
ou le nourrisson, le paracétamol est sous forme de sachets ou
suppositoires, dosés à 100 ou 500mg, ou encore de suspensions
buvables (STORA, 2005).
Le paracétamol existe aussi (pour adulte et enfant) sous
d'autres formes :
en comprimés orodispersibles (comprimés qui se
dissolvent sur la langue et ne nécessitant pas la prise d'eau) (STORA,
2005) ;
en solution injectable (voie intraveineuse) où le
paracétamol est sous forme d'une prodrogue « le
proparacétamol », hydrolysable en paracétamol dans le plasma
six minutes après son administration dans le rapport : 2g de
proparacétamol conduisant à 1g de paracétamol (REMY,
2004).
Compte tenu de l'extrême veinotoxicité du
proparacétamol, une nouvelle formulation galénique du
paracétamol injectable (IV), où le paracétamol n'est pas
sous forme de
Page 10
prodrogue, offrant une bien meilleure tolérance veineuse
existe aussi (perfalgan) (MOREAU et al, 1992 ; ANNEQUIN, 2002 ;
CAPDEVILA, 2004).
Le paracétamol est également
commercialisé sous forme d'associations avec d'autres
médicaments. Ces associations médicamenteuses ont pour but la
potentialisation de l'effet analgésiant. Selon FAURE (2010), le
paracétamol s'associe classiquement à :
des molécules de palier II comme la codéine
(Codoliprane), le dextropropoxyphène (Di-Antalvic) ou le tramadol
(Ixprim) ;
des molécules de pallier III comme l'opium (Lamaline) ;
des substances adjuvantes comme la caféine (Claradol
caféine) ou l'acide ascorbique (Doliprane vitamine C) ;
des vasoconstricteurs (pseudo-éphédrine) ou des
antihistaminiques pour la prise en charge des affections ORL (Actifed, Fervex,
Rhinofébral,...).
un autre antalgique non morphinique, notamment l'aspirine
(Afébryl et Véganine).
1.4.4- Caractéristiques pharmacologiques :
1.4.4.1- Caractéristiques
pharmacocinétiques :
1.4.4.1.1- Absorption :
Administré par voie orale, le paracétamol est
rapidement et presque totalement absorbé au niveau du tractus
gastro-intestinal par diffusion passive. L'absorption est beaucoup plus rapide
dans l'intestin grêle que dans l'estomac (RAINSFORD, 2004). Quoiqu'elle
soit un peu ralentie par l'alimentation, l'absorption permet l'obtention d'un
pic plasmatique au bout de 30 à 60 minutes après ingestion (BEGUE
et ASTRUC, 1999). Le paracétamol subit une biotransformation
hépatique dès le premier passage hépatique, quant à
sa biodisponibilité absolue, elle est satisfaisante et avoisine les 80%
(SERRIE et THUREL, 2002 ; ZETLAOUI et LENOBLE, 2004), voire les 90% pour les
formes effervescentes (GAUDY, 1999).
Lors d'une administration rectale, l'absorption du
paracétamol est aléatoire et son délai est plus long que
celui d'une prise orale, d'ailleurs le pic plasmatique n'est obtenu qu'au bout
de 2h (DE BROCA, 2005) avec une biodisponibilité réduite de 10
à 20% (SERRIE et THUREL, 2004).
Pour la voie injectable, l'administration du
paracétamol en intraveineuse permet certes son passage direct dans la
circulation, ce qui en fait d'ailleurs une voie privilégiée dans
les cas d'urgence, mais en termes d'efficacité, celle-ci ne
présente aucun avantage par rapport à la voie orale (ELLRODT,
2005).
Page 11
1.4.4.1.2- Distribution :
La distribution du paracétamol est rapide et uniforme :
il diffuse dans tous les milieux liquidiens (sang, liquide
céphalorachidien, salive, lait, liquide interstitiel) et tissus de
l'organisme (SERRIE et THUREL, 2004).
Sa liaison aux protéines plasmatiques est faible (15
à 20 %) (POUCHAIN et al, 1996) et son volume de distribution
varie de 0,9 à 1 l/kg (SERRIE et THUREL, 2004).
1.4.4.1.3- Métabolisme :
La demi-vie plasmatique du paracétamol est d'environ 2h
(VIALA et BOTTA, 2005 ; BOUCHER et COHEN, 2007 ; GAUDY, 2009). Elle est
très courte et témoigne ainsi d'une forte métabolisation
dont ce médicament fait l'objet au niveau de l'organisme.
Le métabolisme du paracétamol est
essentiellement hépatique en raison de la situation « carrefour
» du foie, du débit sanguin élevé et de la richesse
en enzymes diverses de cet organe. Il est aussi rénal, mais
accessoirement (ZETLAOUI et LENOBLE, 2004).
Dans le foie comme dans les reins, le paracétamol est
substrat d'enzymes microsomales (des transférases et des oxydases) qui
le conjuguent en dérivés très hydrosolubles donc
facilement excrétables (Figure 6).
Les transférases microsomales appartiennent à deux
sous classes différentes :
l'uridine di-phosphate glucuronyl transférase
(UDP-glucuronyl transférase) dont l'acide
uridine-5'-diphospho-á-D-glucuronique (en abrégé : UDPGA)
est le coenzyme, qui transforme le paracétamol en un
dérivé glucuroconjugué par transfert de groupement
glucuronate porté par le coenzyme (STERNER, 1999) ;
la sulfotransférase dont le coenzyme est le
3-phosphoadénosine-5'-phosphosulfate (en abrégé : PAPS),
qui transforme le paracétamol en un dérivé
sulfoconjugué par transfert de groupement sulfate inorganique
porté par le coenzyme (HACHULLA et FLIPO, 1999).
Les oxydases sont des mono-oxygénases à
cytochrome P450, essentiellement les cytochromes CYP2E1 et CYP3A4, qui
transforment le paracétamol en N-acétyl-pbenzoquinone-imine (en
abrégé : NAPQI) qui est ensuite conjugué au glutathion.
Page 12

Figure 6 : Diagramme représentant les
différentes possibilités
de métabolisation du
paracétamol (GAUDY, 2009).
De part l'importance de la glucuroconjugaison sur les autres
formes de conjugaison, environ 55% du paracétamol ingéré
subit une glucuroconjugaison. La sulfoconjugaison intervient quant à
elle, pour 35% environ, alors que l'oxydation pour seulement 7%.
Il est à signaler également l'existence d'une
variabilité individuelle et ethnique dans le métabolisme du
paracétamol. Celle-ci porte sur le pool hépatique de glutathion,
l'activité du CYP-450 et les phénotypes de glucoronidation et
suggère que certains sous groupes de la population seraient plus
vulnérables au paracétamol (SERAIFI et al, 2007).
Page 13
1.4.4.1.4- Elimination :
Comme le suggère sa demi-vie très courte (2
heures), le paracétamol est complètement éliminé
dans les 24 heures qui suivent son ingestion.
Il est éliminé exclusivement dans les urines sous
forme « inchangé » et sous forme de métabolites
(dérivés conjugués) en lesquels il est
transformé.
Son excrétion sous forme de dérivés
conjugués (dérivé glucuronate, dérivé
sulfate et NAPQI conjugué au glutathion) est la plus importante et
représente 97% du paracétamol ingéré. Les 3% qui
restent représentent la part qui revient à son excrétion
sous forme inchangée.
La forme inchangée du paracétamol est
filtrée au niveau glomérulaire, quant aux formes
conjuguées, elles sont rapidement excrétées au niveau
tubulaire (RANG et DALE, 2003).
Sous forme inchangée ou sous forme de métabolite,
l'excrétion du paracétamol est indépendante du pH et du
débit urinaires.
1.4.4.2- Caractéristiques pharmacodynamiques :
1.4.4.2.1- Doses actives :
L'action du paracétamol est dose dépendante mais
avec un effet thérapeutique plafond à 1g (STORA, 2005 ; GALLET et
DE MOULLIAC, 2009).
La dose efficace 50 (en abrégé : DE50) est de
45mg/kg/24h. Quant à la dose toxique 50 (en abrégé : DT50)
elle est de 150mg/kg/24h soit au total une dose d'environ 10g pour un adulte de
70kg (JONES et DARGAN, 2008). Elle est de l'ordre de 125mg/kg/24h pour les
adolescents. Paradoxalement, les enfants de moins de 10 ans tolèrent
mieux le paracétamol, toutefois leur DT50 est mal
déterminée (PERLMUTER et al, 2008). De plus le seuil de
toxicité est bien plus bas chez les sujets à risque comme c'est
le cas chez l'éthylique chronique adulte pour qui la DT50 est de
75mg/kg/24h (VINCENT, 2009).
La dose létale 50 (en abrégé : DL50) est de
l'ordre de 2,4g/kg ce qui fait de lui un produit à grande marge
thérapeutique.
1.4.4.2.2- Modes d'action et cibles moléculaires
:
L'action antalgique et antipyrétique du
paracétamol résulte de son inhibition de l'activité de la
cyclooxygénase-3 (en abrégé : cox-3) produite par le
cortex cérébral et qui y est responsable de la synthèse de
prostaglandines (Figure 7) notamment de PGE2, un médiateur central de la
douleur et de la fièvre, et de la cyclooxygénase-2b (en
abrégé : cox-
Page 14
2b) produite par la moelle épinière pour la
synthèse de prostaglandines médullaires en renforcement de la
perception douloureuse en cas d'inflammation (GUEUGNIAUD et DE LA COUSSAYE,
2000 ; PELLISSIER et VIEL, 2000 ; WARNER et MITCHELL, 2002 ; MONTAGNIER et
al, 2003 ; BERENBAUM, 2004 ; PINAUD et al, 2004 ; BEAULIEU,
2005 ; ROUSSEAU, 2007 ; REZENDE et al, 2008).
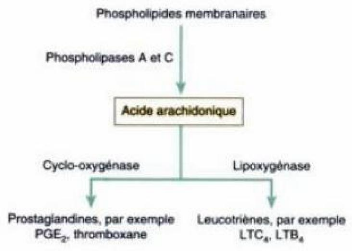
Figure 7 : Voies de biosynthèse des
prostanoïdes, d'après
POCOCK et RICHARDS (2004).
Théoriquement, le paracétamol pourrait inhiber
également les cyclooxygénases périphériques (Figure
8), notamment la cyclooxygénase-2 constitutive (en abrégé
: cox-2 constitutive) et aurait une action anti-inflammatoire, sauf que son
affinité pour celles-ci est faible et que ses capacités
d'inhibition sont réduites en présence de fortes concentrations
de peroxyde d'hydrogène (H2O2), condition totalement remplie lors du
processus inflammatoire (CASAMAJOR et DESCROIX, 2009).
Page 15
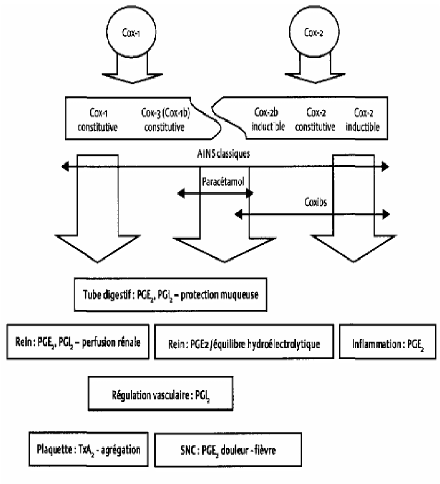
Figure 8 : action du paracétamol,
d'après WARNER et MITCHELL (2004).
Quant à la toxicité du paracétamol, elle
est exercée par l'un des métabolites en lesquels il est
transformé. Il s'agit en l'occurrence du NAPQI
(N-acétyl-p-benzoquinoneimine) formé par l'action des
mono-oxygénases à cytochrome P-450 sur le paracétamol.
Page 16
1.5- Indications thérapeutiques :
Le paracétamol est le traitement symptomatique
indiqué pour les affections douloureuses d'intensité
légère, et/ou fébriles (PINAUD et al, 2004).
Par ces deux actions pharmacologiques (antalgique et
antipyrétique), le paracétamol intègre plusieurs
traitements dans diverses disciplines médicales : pneumologie,
rhumatologie, gastro-entérologie, chirurgie,...etc..
En effet, les cliniciens et thérapeutes
préconisent le paracétamol dans des cas multiples et
variés tels que : céphalées, migraines, amygdalites,
angines, pharyngites, douleurs dentaires, douleurs postopératoires,
états grippaux, bronchites, affections pulmonaires, rhumatismes,
lombalgies, algies musculaires et tendineuses, ulcères, douleurs
utérines, gastrites,...etc. (PELISSIER et VIEL, 2000 ; GERAUD et FABRE,
2001).
1.6- Contre-indications, effets indésirables et
interactions médicamenteuses :
Les contextes où la prescription du paracétamol
est contre indiquée sont très rares. Il est cité dans la
littérature les cas d'hypersensibilité au paracétamol et
l'insuffisance hépatocellulaire sévère.
Néanmoins selon ARDID (2009), certaines études,
fortement controversées, suggèrent que le paracétamol
potentialiserait l'effet anticoagulant de la warfarine et pourrait ainsi
augmenter le risque d'hémorragie chez les patients recevant les deux
médicaments simultanément.
Quant aux effets indésirables pouvant
éventuellement accompagner un traitement au paracétamol, ils sont
également très rares et QUENEAU et OSTERMANN (2004) parlent de
dyspepsie, de manifestations cutanées de type rashes avec
érythèmes, d'urticaire et/ou de prurit, de bronchospasme,
d'anémie hémolytique, d'agranulocytose, de thrombopénie et
d'hépatotoxicité, notamment en terrain vulnérable
(hypersensibilité au paracétamol et insuffisance
hépatocellulaire) et en présence de facteurs de risque
(dénutrition, alcoolisme, certains médicaments,...etc.).
Selon PONS et PERRUSE-MENTHONNEX (2005), le paracétamol
est le seul antalgique totalement dénué d'effet
tératogène et foetotoxique ce qui fait de lui l'antalgique de
choix pour les femmes enceintes et allaitantes. Néanmoins, une
étude anglaise récente affirme que la fréquence de prise
du paracétamol en fin de grossesse pourrait être associée
au dédoublement du risque de wheezing (terme anglo-saxon
désignant le sifflement caractéristique du
rétrécissement des branches) chez le jeune enfant (SHAHEEN et
al, 2002).
Page 17
En outre, certains autres effets indésirables
attribuables non pas au paracétamol mais aux composants des excipients
qui lui sont associés sont également à prendre en
considération : c'est le cas par exemple de certains maux de tête
et de la survenue de certaines tumeurs que certains auteurs imputent à
la présence dans les formulations de paracétamol, d'aspartame, un
dipeptide, utilisé comme édulcorant (BRUNNER et al,
2006).
1.7- Toxicologie du paracétamol :
1.7.1- Prévalence :
L'incidence de l'intoxication au paracétamol au cours
des vingt dernières années est de 2 à 7% du total des
intoxications médicamenteuses en France au moment ou elle atteint un
taux de 48% au Royaume Uni (BRES et al, 2009).
En Algérie, le Centre Antipoison a enregistré,
en 2008, six cas d'intoxication au paracétamol parmi les 3021 cas
d'intoxications médicamenteuses (ANONYME, 2008), soit un taux d'environ
0,2%.
1.7.2- Circonstances :
L'intoxication au paracétamol est de plus en plus
fréquente, et pour cause l'autoprescription (automédication).
Dans ce contexte, elle est involontaire, la plus
fréquente, et due en général à des accidents
domestiques (enfants croyant aux bonbons) ou thérapeutiques (erreurs de
posologie et/ou de prescription).
Dans d'autres contextes, elle peut être volontaire et
servir la poursuite d'un but suicidaire ou d'un but criminel. Néanmoins
ces derniers contextes sont très rares du fait même de la
difficulté de réalisation de cette intoxication.
1.7.3- Mécanisme d'action toxique :
Le « N-acétyl-p-benzoquinone-imine »
(NAPQI) est un métabolite potentiellement toxique qui doit sa
toxicité à sa capacité de se lier de façon
covalente aux protéines hépatiques (LXR, ChREBP,...etc.)
d'où résulte une lyse hépatocytaire (ASFAR, 2010).
Il est le produit de la transformation du paracétamol
par les mono-oxygénases à cytochrome P-450 au niveau du foie.
A doses thérapeutiques, le NAPQI produit à raison
de 7% de la dose de paracétamol ingérée, est facilement
neutralisé par le biais de sa conjugaison au glutathion disponible au
Page 18
niveau du foie. Par conséquent, ses liaisons aux
protéines intracellulaires sont limitées et leurs
conséquences amorties.
A doses toxiques, les quantités de glutathion
disponibles ne sont plus suffisantes relativement aux quantités de NAPQI
produites du fait d'importantes quantités de paracétamol dans le
foie mais aussi du fait de l'induction des mono-oxygénases à
CYP-2E1 (Figure 9).

Figure 9 : diagramme représentant
l'importance relative qu'acquiert la voie oxydative dans
le
métabolisme du paracétamol lors d'une intoxication,
d'après SERAIFI et al (2007).
Il s'en suit donc une accumulation de ce métabolite au
niveau du foie et ses effets néfastes pour cet organe deviennent
proportionnellement perceptibles et de plus en plus importants.
Page 19
1.7.4-Formes ciniques :
La toxicité du paracétamol s'exprime en
général de manière aiguë, mais il arrive qu'elle
s'exprime à long terme ou de manière chronique (KUPFERSCMIDT,
2004 ; SERAIFI, 2007).
La toxicité aiguë du paracétamol
résulte de l'absorption d'une forte quantité en une seule prise
ou en plusieurs mais à intervalles entre les prises très
rapprochés (PELLISSIER et VIEL, 2000).
Dans la toxicité chronique, se manifestant de
manière tardive, la majorité des cas enregistrés sont le
plus souvent des personnes à risque (personnes alcooliques,
dénutries et/ou sous certains traitements médicamenteux) et ayant
consommé 5 à 6,5g de paracétamol par 24 heures et ce
durant une période atteignant 6 à 8 semaines (LANE et
al, 2002).
1.7.5- Symptomatologie :
L'intoxication aiguë au paracétamol se manifeste
par peu de signes cliniques durant les premières 24 heures suivant
l'ingestion d'une forte dose de paracétamol. Selon REICHL et al
(2004), CHAIB (2007) et LACROIX et al (2007), il s'agit de :
légers maux d'origine digestive : perte d'appétit,
nausées, vomissements, douleurs dans la partie supérieure de
l'abdomen ;
pâleur ;
sensation de malaise général ;
paracétamolémie élevée pouvant
donner une estimation du risque d'hépatotoxicité encouru par
référence au nomogramme de RUMACK-MATTHEW (voir le
diagnostic).
Néanmoins, passé un délai de 24 heures
après pareille ingestion, il s'en suit une amélioration de la
clinique observée (nausées, vomissements,...etc.), mais aussi les
premiers indices de lésion hépatique sont détectés
dans un bilan hépatique à travers :
l'élévation des taux des transaminases
(aspartate amino-transférase, en abrégé : ASAT, et alanine
amino-transférase, en abrégé : ALAT) : une
élévation de 200 à 500 fois les valeurs normales, trahit
lyse des cellules hépatiques.
une diminution des facteurs de coagulation ;
une augmentation du taux de prothrombine TP ;
une augmentation de la bilirubinémie.
Page 20
Après 48 heures, une hépatite cytolytique se
déclare cliniquement sous forme, notamment, d'ictère, d'acidose
métabolique, d'hypoglycémie, d'hémorragies internes au
niveau du foie et d'encéphalopathie hépatique.
Au-delà du 5ème jour, et en dehors de
toute prise en charge efficace, l'intoxication évolue et se traduit en
des convulsions, des défaillances cardiovasculaires et des
dépressions respiratoires, un coma et une mort certaine.
1.7.6- Facteurs de risque :
Les facteurs de risque incriminés sont au nombre de
quatre (CARLI et al, 2004 ;
REICHL et al, 2004 ; OSMANN et al, 2007 ;
SERAIFI et al, 2007 ; LEVY, 2009) : la
déplétion des réserves en glutathion ;
la consommation d'inducteurs des mono-oxygénases à
CYP-450 ;
la prise d'inhibiteurs des glucoronyl transférases ;
la variabilité interindividuelle et interethnique.
1.7.6.1- Déplétion des réserves en
glutathion :
La déplétion des réserves en glutathion est
en général due au jeûne prolongé ou à la
dénutrition.
Elle a pour conséquence l'abaissement du seuil de
toxicité. En effet, l'augmentation du taux de liaison du NAPQI aux
protéines hépatiques est directement liée à un
appauvrissement en glutathion (Figure 10).
Page 21
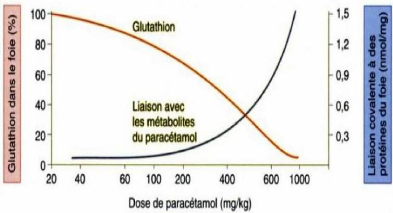
Figure 10 : Graphe montrant la relation
inverse entre la teneur en glutathion dans le foie et le
taux de liaison du
NAPQI avec les protéines de cet organe (REICHEL et al,
2004).
1.7.6.2- Inducteurs du cytochrome P-450 :
Les mono-oxygénases à CYP-450 sont des enzymes
inductibles. Plusieurs substances induisent leur synthèse. Il s'agit
notamment d'éthanol et de certains médicaments
(phénobarbital, phénytoïne, carbamazépine,
isoniazide, rifampicine,...etc.).
1.7.6.3- Inhibiteurs de la glucoronyltransférase
:
Les substances inhibitrices de la glucoronyltransférase
rapportées dans la littérature (OSMANN et al, 2007) sont
des médicaments tels que le triméthoprime-sulfaméthoxazole
et la zidovudine.
1.7.6.4- Variabilité interindividuelle et
interethnique :
La variabilité interindividuelle et interethnique porte
sur le pool hépatique en glutathion, l'activité du CYP-450 et les
phénotypes de glucoro-conjugaison et suggère que certains sous
groupes de la population seraient plus vulnérables au paracétamol
(SERAIFI et al, 2007).
Page 22
1.7.7- Diagnostic :
Le diagnostic de l'intoxication au paracétamol repose
avant tout sur les données anamnestiques (collectées par
interrogation du patient et/ou proches), l'examen clinique et un dosage de la
paracétamolémie.
Complémentairement, des examens biologiques (dosage des
transaminases) ne feront que confirmer l'intoxication (REICHL, 2004 ; LACROIX
et al, 2007 ; PERLMUTER et al, 2008 ; CNERM, 2009).
La paracétamolémie déterminée dans
les premières 24 heures suivant l'ingestion est judicieuse et permet une
évaluation du risque d'hépatotoxicité encouru grâce
au nomogramme de RUMACK-MATTHEW (Figure 11).
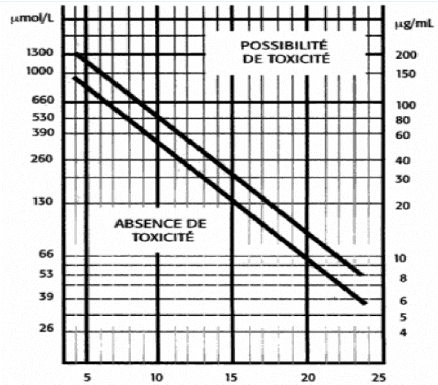
Figure 10 : Nomogramme de RUMACK-MATTHEWS
mettant en relation la concentration
plasmatique du paracétamol
(ordonnées), le temps en heures après l'ingestion (abscisses)
et
la gravité de l'intoxication (surface du graphe), d'après
LACROIX et al (2007).
Page 23
Le nomogramme de RUMACK-MATTHEW représente un graphique
donnant en abscisses le temps écoulé après ingestion d'une
dose inconnue de paracétamol et en ordonées la concentration
plasmatique en paracétamol, et partagé diagonalement par deux
doites parallèles en deux zones de risque de toxicité : la zone
supérieure où l'intoxication est possible et la zone
inférieure où le risque de toxicité est nul.
Par le point du graphique correspondant à la valeur de
la paracétamolémie mesurée, coincidée avec la
valeur présumée du temps écoulé après
l'ingestion du paracétamol, une droite parallèlle aux doites
partageant le graphique en deux zones de risque de toxicité, est
tracée et son point d'intersection avec l'axe des ordonnées donne
la dose de paracétamol présumée ingérée
(LACROIX et al, 2007)
Néanmoins il faut savoir que ce nomogramme est
ininterprétable et inutile avant la 4ème heure et au-delà
de la 24ème heure après ingestion, ainsi que lorsque
la dose est ingerée de façon fractionnée, et lorsqu'il
s'agit de personnes à risque (LACROIX et al, 2007).
1.7.8- Traitement :
Dans le domaine de l'intoxication médicamenteuse en
général, les thérapeutes procèdent selon le cas par
les quatre types de traitements suivant : le traitement évacuateur, le
traitement épurateur, le traitement symptomatique et/ou le traitement
antidotique.
Dans le cas de l'intoxication au paracétamol, il est
fait recours seulement aux traitements évacuateur et/ou antidotique.
Cependant, et lorsque le traitement antidotique s'avère inutile du fait
de la gravité de l'intoxication (dose et/ou temps d'exposition
extrêmement importants), la transplantation hépatique peut
également être envisagée (DROZ, 2008).
1.7.8.1- Traitement évacuateur :
L'évacuation peut s'effectuer par lavage gastrique
à l'eau en utilisant une sonde de gros calibre adapté à un
entonnoir, ou par l'administration de charbon activé dont le complexe
formé avec le médicament, est éliminé dans les
selles (LACROIX et al, 2007 ; JONES et DARGAN, 2008).
Dans l'intoxication au paracétamol cette
dernière procédure (emploi de charbon activé) est
habituellement utilisée : 1g/kg de poids corporel du patient est
administré par voie orale (JONES et DARGAN, 2008).
Toutefois, il faut savoir que, consistant à vider
l'estomac du médicament, ce traitement est inutile passé un
délai d'une heure après ingestion en raison de la vitesse
d'absorption
Page 24
élevée (30 à 60 minutes) du
paracétamol par la muqueuse gastro-intestinale (LACROIX et al,
2007).
1.7.8.2- Traitement antidotique :
Le traitement antidotique est un traitement efficace et repose
sur l'emploi d'un remède, appelé « antidote », capable
de neutraliser la substance toxique.
Dans le cas du paracétamol, l'antidote est
l'acétylcystéine (Figure 13), un agent mucolytique ayant des
vertus antidotique contre ce médicament (DROZ, 2008).

Figure 13 : formule
semi-développée du
N-acétyl-L-cystéine,
d'après TOOLANEY et al
(2007).
Le N-acétyl-L-cystéine (en abrégé
: NAC) est la forme acétylée de la cystéine. Il est
naturellement produit par le corps ou apporté par l'alimentation
(consommation d'ail, d'oignons, d'oeufs, de brocolis,... etc..
Son administration à un patient intoxiqué par le
paracétamol, permet d'apporter à son organisme la cystéine
nécessaire à la biosynthèse de glutathion (Figure 14) et
par là même, d'augmenter son pool de glutathion, et de le
prémunir contre l'hépatotoxicité.
Le NAC est efficace et son effet est certain lorsque son
administration s'est faite dans les 10 heures suivant l'ingestion du
paracétamol (VAUBOURDOLLE, 2007, LACROIX et al, 2007).
Page 25

Figure 14 : Diagramme représentant les
étapes de la biosynthèse du glutathion
à partir de la
NAC, d'après KENNON et HEARD (2008).
En absence de troubles de conscience et de vomissements,
l'administration du NAC se fait par voie orale, mais en présence de tels
troubles, elle se fait en intraveineuse pendant 20 heures et relayée
ensuite par la voie orale pendant au moins 52 heures (BEDRY et al,
2007).
Le protocole oral consiste en l'administration d'une dose de
charge de 140mg/kg suivie de doses d'entretien de 70mg/kg toutes les 4 heures
pendant 72 heures.
Dans le protocole intraveineux, le NAC est administré
en solution dans du glucose à 5%. La dose de charge est de 140 mg/kg en
une heure. Elle est suivie de 50 mg/kg en 4 heures, puis de 100 mg/kg en 15
heures, et enfin d'un relais per os (voie orale) de 70 mg/kg toutes les 4
heures pendant 52 heures.
Page 26
II/ Matériel et méthodes :
Notre travail a porté sur la mesure de l'impact toxique
de la prise de paracétamol à dose thérapeutique (1g toutes
les quatre heures pendant douze heures) chez 11 alcooliques volontaires adultes
et sur l'évaluation du risque encouru par deux intoxiqués au
paracétamol.
Pour cela, nous avons réalisé une partie de
notre expérimentation (analyses quantitatives et qualitatives du
paracétamol dans le sang et les urines) au niveau du Laboratoire de
Toxicologie du Département de Pharmacie de la Faculté de
Médecine de l'Université Mouloud MAMMERI de Tizi Ouzou, sous la
direction du Docteur MEKACHER L.R., chargé de cours au sein de cette
même faculté, et sous la co-direction de Monsieur SMAIL R.,
Maître-assistant chargé de cours au Département de
Biochimie-Microbiologie, de la Faculté des Sciences Biologiques et des
Sciences Agronomiques de la même université.
L'autre partie (détermination des bilans
hépatiques) nous l'avons réalisée au Laboratoire Central
de Biochimie du Centre Hospitalo-universitaire (CHU) NEDIR MOHAMED de
Tizi-Ouzou où le Docteur MEKACHER L.R., assure la fonction de praticien
de santé publique.
2.1- Matériel :
2.1.1- Échantillons :
Sang et urines humains.
2.1.2- Appareillage :
Balance de précision ; Doseur Beckmann Coulter à
système SYNCHRON CX-9 ; plaque chauffante ; spectrophotomètre UV-
visible ; centrifugeuse.
2.1.3- Produits et réactifs :
- Acides : acide chlorhydrique et acide
trichloracétique.
- Sels : chlorure ferrique, hydroxyde de sodium, nitrite
de sodium, sulfamate d'ammonium.
- Alcools et autres solvants organiques : acétone,
chloroforme, éthanol, éther diéthylique.
- Réactifs spécifiques : réactif
T-BIL, réactif D-BIL, réactif ASAT, réactif ALAT,
réactif PAL et réactif GGT.
Page 27
- Paracétamol : Prodafalgon 10g/l
(paracétamol injectable) ; Doliprane 1000mg (paracétamol en
comprimés).
2.1.4- Autres :
Verrerie usuelle de laboratoire, pipettes, plaques de gel de
silice pour CCM, épicrâniennes, gants, papier aluminium et autres
ustensiles.
2.2- Méthodes :
2.2.1- Echantillonnage :
2.2.1.1- Evaluation du risque encouru par deux
présumés intoxiqués au paracétamol :
Les échantillons de sang analysés en vue de
cette évaluation, proviennent de deux patients admis, l'un (un jeune
homme de 23 ans) au Centre National de Toxicologie (CNT) d'Alger, pour avoir
consommé, dans un but suicidaire, plus de 13g de paracétamol en 3
heures, l'autre (un homme de 50 ans, aux antécédents
psychotiques) au pavillon des urgences de médecine du Centre
Hospitalo-universitaire (CHU) NEDIR MOHAMED de Tizi-Ouzou, dans un état
comateux, pour avoir consommé par voie orale une grande quantité
de médicaments dont le paracétamol.
Pour le patient du CNT, un échantillon d'urines a
également été analysé.
2.2.1.2- Mesure de l'impact toxique de la prise de
paracétamol à dose
thérapeutique chez 11 alcooliques volontaires
adultes :
Les 11 personnes qui ont aimablement et volontairement
participé à cette étude sont de sexe masculin et
appartiennent tous à la tranche d'âge [45 - 50] ans. Ils sont tous
alcooliques en ce sens qu'il ne passe pas un jour sans qu'ils en consomment de
l'alcool.
Un prélèvement sanguin par jour à 8 heures
du matin et ce pendant trois jours, a été effectué
à jeun sur chacun de ces participants à cette étude.
Les deux premiers prélèvements étaient
effectués sans prise préalable de paracétamol par chacun
de ces volontaires alors que pour le troisième, une consommation
préalable de ce médicament a été organisée
et a commencé le deuxième jour à 8h30 du matin,
c'est-à-dire, juste après le deuxième
prélèvement, et a pris fin le même jour à 20h30. La
dose ingérée par chacun d'eux était de 1g toutes les 4
heures pendant 12 heures.
Les prélèvements sanguins sont
réalisés dans des tubes héparinés et
étiquetés aux noms des individus.
Page 28
Aussitôt après prélèvement, les tubes
de sang ainsi recueillis sont centrifugés et un bilan hépatique
est déterminé sur chacun des sérums obtenus.
2.2.2- Chromatographie sur couche mince des urines du
patient présumé intoxiqué au paracétamol admis au
CNT d'Alger :
La chromatographie sur couche mince a été
réalisée pour l'échantillon d'urines et avait pour but la
recherche de paracétamol.
Dans une ampoule à décantation, 20ml d'urines du
patient du CNT sont mélangés avec 1ml d'acide chlorhydrique 6N et
20ml d'éther diéthylique. Le mélange obtenu est
agité pendant 2 minutes et laissé ensuite au repos jusqu'à
complète séparation des deux phases : la phase organique
constituée par l'éther diéthylique et la phase aqueuse
constituée par l'eau des urines (Figure 14).
Figure 14 : Photographie de l'ampoule à
décantation du mélange urines et éther diéthylique
en présence d'acide chlorhydrique : la phase organique contenant le
paracétamol est en dessus.

La phase organique est récupérée dans une
soucoupe et laissée s'évaporer sur une plaque chauffante. Le
résidu sec obtenu est repris dans de l'éthanol. Une solution
alcoolique de paracétamol pur est préparée avec le
même éthanol pour servir d'étalon (ou témoin).
Un spot de chaque solution alcoolique ainsi obtenue est
déposé sur une plaque de gel de silice pour CCM. Cette
dernière est ensuite placée dans une cuve de chromatographie
contenant 9 volumes de chloroforme et 1 volume d'acétone.
Après développement, une révélation
au chlorure ferrique 0,4 M est effectuée.
Page 29
2.2.3- Dosage spectrophotométrique du
paracétamol dans le sang des patients présumés
intoxiqués au paracétamol :
Le dosage du paracétamol n'a porté que sur le
sang des deux patients admis pour intoxication médicamenteuse au CNT
d'Alger et au pavillon des urgences du CHU de TiziOuzou, respectivement.
Le but de ce dosage était l'évaluation du danger
encouru par ces personnes à travers une mesure de leurs
paracétamolémies.
2.2.3.1- Principe :
Ce dosage spectrophotométrique du paracétamol
repose sur la capacité qu'a le 3-nitro 4-hydroxyacétanilide,
produit par la réaction du paracétamol en milieu acide avec les
ions nitrites, de prendre une teinte jaune orangé en milieu alcalin
(Figure 15) et d'avoir un maximum d'absorption spécifique à 405
nm.
La paracétamolémie est déterminée par
référence à une courbe d'étalonnage obtenue
grâce à une gamme de solutions de paracétamol pur de
concentrations connues.

Figure 15 : Equations des réactions du
paracétamol avec les ions nitrites et du 3-
nitro
4-hydroxyacétanilide produit avec les ions hydroxydes.
2.2.3.2- Mode opératoire :
2.2.3.2.1- Préparation des solutions «
étalon » de paracétamol :
Des solutions « étalon » de
paracétamol de concentrations respectives de 0, 50, 100, 200 et 400mg/l,
sont préparées en dissolvant du paracétamol pur dans du
sérum blanc (sérum d'une personne n'ayant pas consommé de
paracétamol).
Page 30
2.2.3.2.2- Préparation des échantillons
:
Les échantillons de sang sont centrifugés pour
éliminer les cellules sanguines et le paracétamol est dosé
directement ensuite dans le sérum ainsi obtenu.
2.2.3.2.3- Préparation du mélange
réactionnel et mesure de l'absorbance : Ajouter 2ml d'acide
trichloracétique (100g/l) à 1ml de prise d'essai (sérum ou
solution « étalon ») puis mélanger et centrifuger
pendant 5 minutes (1er mélange).
Dans un autre tube, ajouter 1ml d'acide chlorhydrique (6N)
à deux 2ml de solution de nitrite de sodium (100g/l) et mélanger
(2ème mélange).
Ajouter 2ml du surnageant du premier mélange obtenu au
second mélange, agiter et laisser reposer pendants 2 à 3 minutes
à la température ambiante.
Ajouter 2ml de solution de sulfamate d'ammonium (150g/l) goutte
à goutte, pour éliminer l'excès d'acide nitreux.
Ajouter 2ml de solution d'hydroxyde de sodium (6M), agiter
rapidement pour éviter d'éventuelles bulles de gaz.
Mesurer l'absorbance à 405nm par rapport au blanc
préparé avec du sérum.
2.2.4- Détermination du bilan hépatique
:
Le bilan hépatique effectué consiste en le
dosage dans le sérum des principaux marqueurs moléculaires de
lésions hépatiques, que sont les transaminases (ASAT et ALAT),
les phosphatases alcalines (PAL), la gamma glutamyl transférase (GGT),
la bilirubine totale (T-BIL) et la bilirubine directe (D-BIL).
La quantification de tous ces paramètres a
été effectuée automatiquement en utilisant le doseur
Beckmann Coulter à système SYNCHRON CX-9 du Laboratoire Central
de Biochimie du CHU de Tizi-Ouzou (Figure 16).
Page 31
|
Figure 16 : Photographie du doseur Beckmann
Coulter à système SYNCHRON CX-9.
du Laboratoire Central de Biochimie du CHU de TiziOuzou.
|
|
Pour tous les paramètres, cet appareil mesure la variation
de l'absorbance par rapport à un blanc, à la suite d'une
réaction en présence d'un réactif spécifique
(Tableau I).
Les espèces chimiques produites lors de chaque
réaction, absorbent chacune à une longueur d'onde qui lui est
spécifique (Tableau I).
Les principes de dosage de ces paramètres sont
cités en annexe 1.
Tableau I : Spécification des
réactifs pour doseur Beckmann Coulter à système SYNCHRON
CX-9.
|
Réactif
|
Composition
|
ë
d'absorption
(nm)
|
|
ASAT
|
á- cétoglutarate, malate
Déshydrogénase, L-aspartate, NADH.
|
340
|
|
ALAT
|
á- cétoglutarate, lactate
déshydrogénase, L-alanine, Tampon tris, NADH.
|
340
|
|
PAL
|
p-Nitrophénylphosphate,
2-amino-2-méthyl-1-propanol.
|
410
|
|
GGT
|
ã-glutamyl-p-nitroaniline,
glycyl-glycine.
|
410
|
|
T-BIL
|
Benzoate de sodium, caféine, acide sulfanique, acide
chlorhydrique, nitrite de sodium, acétate de sodium.
|
520
|
|
D-BIL
|
Acide sulfanique, acide chlorhydrique, Nitrite de sodium.
|
560
|
Page 32
2.2.5- Étude statistique :
Pour la pondération des fluctuations des mesures
effectuées et la détermination de la signification des
résultats obtenus, notamment pour la mesure de l'impact toxique de la
prise de paracétamol à dose thérapeutique (1g toutes les
quatre heures pendant douze heures) chez 11 alcooliques volontaires adultes,
nous avons calculé les paramètres statistiques
élémentaires (moyennes, variances et écart-types) et
procédé au test de STUDENT aux risques 5 et 1 %, manuellement et
automatiquement en utilisant le logiciel STATISTICA.
Page 33
III/ Résultats et discussion :
3.1- Evaluation du risque encouru par les
présumés intoxiqués au paracétamol
3.1.1- CCM sur gel de silice :
Le chromatogramme de la CCM sur gel de silice effectuée
pour les urines du patient admis au CNT d'Alger, est donné en figure
18.
Nous pouvons y constater, que seulement sur le trajet des deux
spots initialement déposés sur la plaque de gel de silice, qu'il
y a apparition de tâches grisâtres, comme attendu, après
développement et révélation au chlorure ferrique 0,4M.
Témoin Echantillon

Sens de migration
Figure 18 : Chromatogramme de CCM sur gel de
silice des urines du patient admis au CNT d'Alger pour intoxication au
paracétamol.
Les tâches noirâtres correspondent au
paracétamol après réaction avec le chlorure ferrique
0,4M.
Ces tâches sont le produit de la réaction du
paracétamol avec le chlorure ferrique 0,4M. Elles se présentent
à la même hauteur sur la plaque et leurs Rf sont égaux
à 0,26.
Elles ont des intensités de la couleur différentes,
donc des concentrations en paracétamol différentes entre la
solution témoin et l'échantillon. Mais cela ne renseigne pas
Page 34
cependant sur la concentration du paracétamol dans les
urines et encore moins sur la dose ingérée ni sur le risque et le
danger encourus par le patient.
Néanmoins, ce résultat atteste ainsi de la
consommation du paracétamol par le patient et confirme les
données anamnestiques préalablement recueillies auprès des
patients euxmêmes ou auprès de leurs proches.
Pour l'évaluation du risque, un dosage du
paracétamol dans le sang est nécessaire.
3.1.2- Dosage spectrophotométrique du
paracétamol dans le sang des patients présumés
intoxiqués au paracétamol :
Le dosage spectrophotométrique du paracétamol a
été effectué et sur le sang du patient admis au CNT
d'Alger que sur le sang du patient admis au pavillon des urgences du CHU de
Tizi-Ouzou.
Nous désignerons par C1, la concentration en
paracétamol dans le sang du patient du CNT, et par C2, la concentration
en paracétamol dans le sang du patient du CHU de TiziOuzou.
Les valeurs des densités optiques mesurées
à 405 nm, correspondantes à chaque concentration en
paracétamol dans chaque prise d'essai (échantillons de sang et
solutions « étalon ») sont données dans le tableau II
ci-dessous :
Tableau II : Résultats des absorbances
mesurées à 405 nm.
|
Gamme étalon
|
Echantillons de sang
|
|
Concentration (mg/l)
|
0
|
50
|
100
|
200
|
400
|
C1
|
C2
|
|
Absorbance à 405 nm
|
0
|
0,0431
|
0,1249
|
0,2754
|
0,5049
|
0,7070
|
0,0089
|
La détermination des valeurs des concentrations en
paracétamol C1 et C2 dans les sérums des deux patients
présumés intoxiqués par ce médicament, est
réalisée graphiquement grâce au tracé obtenu en
mettant en abscisses, les concentrations connues des solutions «
étalon », et en ordonnées, les absorbances correspondantes
(Figure 18).
Les valeurs des absorbances mesurées pour chaque
échantillon de sérum des deux patients, sont portés sur
l'axe des ordonnées de ce graphique ci-dessus, et par projection sur la
droite et de celle-ci sur l'axe des abscisses, les concentrations C1 et C2 qui
leur correspondent sont lues directement sur l'axe des abscisses. Elles sont
égales à 554 mg/l pour C1 et à 10 mg/l pour C2, soit en
ìmol/l, 3665 et 66, respectivement.
Page 35
Par référence au nomogramme de RUMACK-MATTHEWS
(Figure 11), à 5 heures après ingestion, pour le patient du CNT
d'Alger et à 10 heures après ingestion, pour le patient du CHU de
Tizi-Ouzou, les doses en paracétamol ingérées par le
premier patient sont extrêmement élevées ce qui l'expose
à d'énormes risques et par conséquent il doit être
rapidement mis sous antidote, alors que pour le deuxième patient, les
doses ingérées ne sont pas toxiques voire qu'elles sont
même en deçà du seuil thérapeutique.
Néanmoins, le temps écoulé depuis l'ingestion du
paracétamol est très élevé eu égard à
la demi-vie très courte de ce médicament. En effet, quelque soit
la dose ingérée, le produit est pratiquement totalement
éliminé au bout de 7 fois sa demi-vie plasmatique. Ce qui n'est
pas le cas du NAPQI résultant de son catabolisme. Par conséquent
à ce stade de l'analyse, nous sommes dans l'incapacité d'infirmer
de façon catégorique la possible intoxication de ce patient par
du paracétamol, à moins que son coma à l'arrivée au
pavillon des urgences soit du réellement à l'un ou à tous
les autres médicaments qu'il avait pris concomitamment au
paracétamol.

0,8
0,7
0,6
0,5
0,4
0,3
0,2
0,1
50; 0,0471
100; 0,1279
400; 0,5079
200; 0,2754
0 0; 10; 0,0099
5
Figure 18 : Courbe d'étalonnage du
dosage spectrophotométrique du paracétamol
dans le sang des
patients présumés intoxiqués par ce médicament.
Page 36
3.1.3- Conclusion :
Au vu de tous ces résultats ci-dessus, nous concluons
que sur les deux présumés intoxiqués au
paracétamol, un seul (le patient du CNT d'Alger) l'est
véritablement, et coure un grand danger lié à la
présence dans son organisme d'importantes quantités de
paracétamol et de son métabolite toxique, en l'occurrence le
NAPQI, qui attaque le foie. Pour cela, il doit être rapidement mis sous
antidote.
Quant à l'autre (le patient du CHU de Tizi-Ouzou), les
résultats obtenus montrent qu'il n'a pas ingéré de fortes
doses de paracétamol. Néanmoins, lui aussi coure un danger dans
la mesure où le coma dans lequel il est tombé le retentit fort
bien. Ce danger n'est pas lié à son ingestion de
paracétamol mais à une autre cause dont d'autres
médicaments présumés ingérés concomitamment
à de petites doses de paracétamol.
Par ailleurs, nous constatons que le recours à la
chromatographie sur couche mince pour la recherche d'une présence de
paracétamol ou d'un tout autre produit dans l'organisme, est inutile
voire une perte de temps en regard de l'urgence de la situation.
En effet, la simple constatation de visu de la teinte jaune
orangé (Figure 19) du 3-nitro 4-hydroxyacétanilide, produit par
la réaction du paracétamol en milieu acide avec les ions
nitrites, lors du dosage de ce médicament, avant même la lecture
de l'absorbance au spectrophotomètre, suffit et permettrait un gain de
temps dans la mesure où, d'une pierre deux coups, le risque encouru est
évalué au travers de la paracétamolémie,
aussitôt la présence de paracétamol dans l'organisme
révélée.
Page 37

(a) (b)
Figure 19 : Photographies montrant la
différence de coloration entre un mélange
réactionnel
(milieu acide avec ions nitrites) contenant du paracétamol (b) et
un
mélange ne contenant pas (a).
3.2- Mesure de l'impact hépatotoxique de la
prise de paracétamol à dose thérapeutique chez 11
alcooliques volontaires adultes :
Etant donné que l'éthanol est un inducteur des
mono-oxygénases à CYP-450, responsable de la transformation du
paracétamol en NAPQI, ce métabolite hépatotoxique,
plaçant ainsi les alcooliques parmi les personnes à risque
d'intoxication au paracétamol, nous avons choisi un petit groupe de 11
individus de sexe masculin, appartenant à la tranche d'âge [45-50]
ans, consommant quotidiennement de l'alcool, à fin de mesurer l'impact
hépatotoxique de la prise de paracétamol à dose
thérapeutique, soit 1g toutes les quatre heures.
Etant donné aussi que la cytolyse hépatique est
l'un des principaux et premiers signes de cette hépatotoxicité,
nous sommes partis du principe que les taux plasmatiques des transaminases
hépatiques ASAT et ALAT, devraient forcément augmenter (DOROSZ,
2003) sous l'effet du paracétamol et ce d'autant plus, que le sujet est
une personne à risque.
Ainsi, notre mesure de cet impact hépatotoxique
est-elle réduite à la comparaison entre les taux plasmatiques de
ces transaminases avant et durant une consommation de paracétamol.
Page 38
Afin de juguler d'éventuelles fluctuations non
liées à la consommation de paracétamol, nous avons
dosé ces paramètres un premier puis un deuxième jour avant
cette consommation et comparé les résultats obtenus.
Les taux plasmatiques de la bilirubine totale, de la
bilirubine conjuguée (ou bilirubine directe), de la phosphatase alcaline
et de la gamma-glutamyl transférase, dont l'augmentation est
révélatrice d'une cholestase (DOROSZ, 2003), sont
également comparés.
Les résultats obtenus sont consignés dans le
tableau III ci-dessous. Les valeurs trouvées pour chacun des
paramètres mesurés se situent dans les fourchettes normales,
hormis de légères augmentations apparentes concernant les taux de
bilirubine conjuguée chez l'individu D, et les taux d'ASAT chez les
individus B, H et K, et ce avant et durant la consommation de
paracétamol, notamment pour la bilirubine conjuguée chez
l'individu D et pour l'ASAT chez l'individu K.
Néanmoins, notre but n'est pas de mettre en
évidence l'augmentation anormale des taux de ces marqueurs. Nous
recherchons plutôt s'il y a ou pas une augmentation significative des
taux sous l'effet de la consommation du paracétamol chez chaque
individu.
Or chez neuf individus sur onze pour les taux d'ASAT, huit
individus sur 11 pour les taux d'ALAT, et dix individus sur 11 pour les taux de
GGT, nous avons enregistré une augmentation apparente durant la
consommation de paracétamol (Figure 20).
Page 39
Tableau III : taux plasmatiques mesurés
pour les marqueurs moléculaires de l'hépatolyse et de la
cholestase, chez 11 alcooliques volontaires adultes, avant et durant une
consommation de 1g de paracétamol toutes les 4 heures.
|
Prélèvement
|
Individu
|
Valeurs
normales
(DOROSZ,
2003)
|
|
A
|
B
|
C
|
D
|
E
|
F
|
G
|
H
|
I
|
J
|
K
|
|
TBIL (mg/l)
|
I (1er jour)
|
4
|
6
|
3
|
8
|
4
|
4
|
8
|
6
|
6
|
6
|
9
|
= 10mg/l
|
|
II (2èmejour)
|
4
|
7
|
4
|
7
|
3
|
5
|
9
|
5
|
7
|
5
|
9
|
|
III(3èmejour)
|
5
|
6
|
3
|
7
|
3
|
5
|
8
|
6
|
7
|
6
|
8
|
|
DBIL (mg/l)
|
I (1er jour)
|
2
|
3
|
2
|
4
|
2
|
1
|
3
|
1
|
2
|
1
|
1
|
= 3mg/l
|
|
II (2èmejour)
|
2
|
3
|
3
|
4
|
2
|
1
|
3
|
1
|
2
|
1
|
1
|
|
III(3èmejour)
|
2
|
3
|
2
|
4
|
2
|
1
|
2
|
1
|
2
|
1
|
1
|
|
ASAT (UI/l)
|
I (1er jour)
|
25
|
28
|
22
|
25
|
23
|
25
|
22
|
26
|
27
|
26
|
31
|
= 30UI/l
|
|
II (2èmejour)
|
25
|
27
|
21
|
26
|
20
|
24
|
24
|
29
|
25
|
25
|
30
|
|
III(3èmejour)
|
25
|
31
|
25
|
28
|
21
|
29
|
23
|
33
|
29
|
29
|
34
|
|
ALAT (UI/l)
|
I (1er jour)
|
20
|
23
|
17
|
19
|
15
|
18
|
20
|
23
|
14
|
12
|
22
|
= 35UI/l
|
|
II (2èmejour)
|
22
|
24
|
16
|
19
|
14
|
18
|
19
|
22
|
12
|
15
|
21
|
|
III(3èmejour)
|
22
|
27
|
19
|
21
|
15
|
20
|
22
|
26
|
18
|
17
|
24
|
|
PAL (UI/l)
|
I (1er jour)
|
110
|
114
|
89
|
98
|
120
|
89
|
90
|
102
|
75
|
120
|
114
|
40-130
UI/l
|
|
II (2èmejour)
|
110
|
113
|
94
|
98
|
121
|
90
|
89
|
105
|
78
|
126
|
108
|
|
III(3èmejour)
|
110
|
116
|
99
|
95
|
120
|
90
|
94
|
100
|
70
|
125
|
117
|
|
GGT (UI/l)
|
I (1er jour)
|
21
|
19
|
18
|
23
|
19
|
21
|
21
|
22
|
30
|
19
|
30
|
= 35UI/l
|
|
II (2èmejour)
|
20
|
18
|
18
|
23
|
20
|
20
|
22
|
23
|
32
|
19
|
35
|
|
III(3èmejour)
|
24
|
22
|
20
|
25
|
21
|
22
|
23
|
20
|
31
|
20
|
33
|
Mais à fin de juger de la signification de ces
augmentations apparentes, nous avons calculé les paramètres
statistiques élémentaires (moyennes, variances et
écart-types) et procédé au test de STUDENT pour
échantillons appariés aux risques 5 et 1 %.
Les résultats auxquels nous sommes parvenus (Tableau
IV), indiquent qu'il n'existe aucune différence significative lorsqu'on
compare les taux de T-BIL, D-BIL, PAL, ASAT, ALAT et GGT mesurés un jour
avant la consommation de paracétamol à ceux mesurés deux
jours avant.
Aucune différence significative n'est
enregistrée également lorsqu'on compare les taux de T-BIL, D-BIL
et PAL mesurés un jour avant et ceux mesurés deux jours avant,
aux taux des mêmes paramètres mesurés durant la
consommation de 1 g de paracétamol toutes les 4 heures et ce durant
douze heures.
L'absence de différence significative lorsqu'on compare
le taux de GGT mesuré un jour avant la consommation de
paracétamol au taux mesuré durant le traitement, est
également signalée.
Page 40

En revanche, la comparaison des taux de ASAT et ALAT
mesurés un jour avant et ceux mesurés deux jours avant la mise
sous traitement au paracétamol, ainsi que le taux de GGT mesuré
deux jours avant, aux taux des mêmes marqueurs moléculaires
mesurés durant le traitement, montre une différence significative
aux risques á = 0,05 et á =
0,01.
Cela voudrait dire que la consommation de paracétamol
à dose thérapeutique seulement pendant douze heures par les
alcooliques, est suffisante pour engendrer une cytolyse hépatique.
Qu'est ce que ça serait si la durée était
prolongée et le foie déjà malade ? La cytolyse serait plus
étendue et le processus inflammatoire qu'elle ne manquerait de
déclencher alors se muerait en hépatite et entraînerait
à la longue une fibrose et/ou une cholestase voire une nécrose
hépatique.
Chez nos volontaires, si aucun signe de cholestase n'a
été décelé, c'est parce que leurs foies sont encore
en bon état comme l'attestent leurs bilans hépatiques normaux
(Tableau III) et que la durée du traitement au paracétamol subit,
n'est pas importante eu égard à la durée nécessaire
pour le développement d'une pareille pathologie.
Chez les non alcooliques, la consommation
régulière et assez prolongée de paracétamol pour
lutter volontiers contre la douleur liée à une migraine ou
à une arthrose par exemple, pourrait aussi entraîner une cytolyse
hépatique car aussi infime soit-elle la quantité de NAPQI
produite, une partie se fixe inévitablement sur les protéines
hépatiques. Et lorsque la régénération de celles-ci
n'arrive plus à combler le vide laissé du fait de la
fréquence de plus en plus raccourcie, des prises de ce
médicament, la cytolyse deviendrait effective voire s'étendrait
de plus en plus jusqu'à initiation du processus inflammatoire.
C'est dire, enfin, que l'automédication est à
bannir même s'il s'agit de paracétamol.
Tableau IV : Résultats du calcul des
paramètres statistiques élémentaires et du test t
de
STUDENT pour échantillons appariés N = 11 et ddl =
10.
Les différences significatives aux risques
á = 0,05 et á = 0,01 sont
signalées en rouge.
|
Moyenne
|
Ecart-type
|
N
|
Différence
des
Moyennes
|
Ecart-type
estimé
|
t
|
ddl
|
|
TBIL I
|
5,81818182
|
1,94000937
|
11
|
0,09090909
|
0,94387981
|
0,31943828
|
10
|
|
TBIL II
|
5,90909091
|
2,02259959
|
|
|
TBIL I
|
5,81818182
|
1,94000937
|
11
|
0
|
0,77459667
|
0
|
10
|
|
TBIL III
|
5,81818182
|
1,72152153
|
Page 42
|
|
TBIL II
|
5,90909091
|
2,02259959
|
11
|
0,09090909
|
0,83120941
|
0,36273813
|
10
|
|
TBIL III
|
5,81818182
|
1,72152153
|
|
|
DBIL I
|
2
|
1
|
11
|
0
|
|
|
10
|
|
DBIL II
|
2
|
1
|
|
|
DBIL I
|
2
|
1
|
11
|
0,09090909
|
0,30151134
|
1
|
10
|
|
DBIL III
|
1,90909091
|
0,94387981
|
|
|
DBIL II
|
2
|
1
|
11
|
0,09090909
|
0,30151134
|
1
|
10
|
|
DBIL III
|
1,90909091
|
0,94387981
|
|
|
ASAT I
|
25,4545455
|
2,65945996
|
11
|
0,36363636
|
1,7477258
|
0,69006556
|
10
|
|
ASAT II
|
25,0909091
|
2,98176275
|
|
|
ASAT I
|
25,4545455
|
2,65945996
|
11
|
2,45454545
|
2,29624199
|
3,54527369
|
10
|
|
ASAT III
|
27,9090909
|
4,06090003
|
|
|
ASAT II
|
25,0909091
|
2,98176275
|
11
|
2,81818182
|
1,99088834
|
4,69481463
|
10
|
|
ASAT III
|
27,9090909
|
4,06090003
|
|
|
ALAT I
|
18,4545455
|
3,67052139
|
11
|
0,09090909
|
1,51357494
|
0,19920477
|
10
|
|
ALAT II
|
18,3636364
|
3,77551923
|
|
|
ALAT I
|
18,4545455
|
3,67052139
|
11
|
2,54545455
|
1,36847626
|
6,16913709
|
10
|
|
ALAT III
|
21
|
3,71483512
|
|
|
ALAT II
|
18,3636364
|
3,77551923
|
11
|
2,63636364
|
1,5666989
|
5,5810526
|
10
|
|
ALAT III
|
21
|
3,71483512
|
|
|
PAL I
|
101,909091
|
14,9228318
|
11
|
1
|
3,28633535
|
1,00921678
|
10
|
|
PAL II
|
102,909091
|
14,5839264
|
|
|
PAL I
|
101,909091
|
14,9228318
|
11
|
1,36363636
|
4,1538591
|
1,08878757
|
10
|
|
PAL III
|
103,272727
|
16,1684316
|
|
|
PAL II
|
102,909091
|
14,5839264
|
11
|
0,36363636
|
4,88411153
|
0,2469324
|
10
|
|
PAL III
|
103,272727
|
16,1684316
|
|
|
GGT I
|
22
|
4,21900462
|
11
|
0,72727273
|
1,79392916
|
1,34458529
|
10
|
|
GGT II
|
22,7272727
|
5,64076075
|
|
|
GGT I
|
22
|
4,21900462
|
11
|
1,90909091
|
1,51357494
|
4,18330013
|
10
|
|
GGT III
|
23,9090909
|
4,39214174
|
|
|
GGT II
|
22,7272727
|
5,64076075
|
11
|
1,18181818
|
2,40075746
|
1,63267117
|
10
|
|
GGT III
|
23,9090909
|
4,39214174
|
Conclusion générale
Conclusion générale :
Au terme de notre travail, nous pouvons conclure que la
consommation de paracétamol à dose thérapeutique par les
alcooliques est suffisante pour engendrer une cytolyse hépatique voire
une initiation d'un processus inflammatoire à même de provoquer
à long terme, cholestase, fibrose et/ou nécrose.
Ce risque est également possible pour les non
alcooliques chez qui la consommation de paracétamol est
régulière et assez prolongée pour lutter volontiers contre
la douleur liée à une migraine ou à une arthrose par
exemple, car aussi infime soit-elle la quantité de NAPQI toxique
résultant du métabolisme du paracétamol, une partie se
fixe inévitablement sur les protéines hépatiques. Et
lorsque la régénération de celles-ci n'arrive plus
à combler le vide laissé du fait de la fréquence de plus
en plus raccourcie, des prises de ce médicament, la cytolyse deviendrait
effective et s'étendrait de plus en plus jusqu'à initiation du
processus inflammatoire.
Ainsi notre souhait est de voir bannie à jamais
l'automédication même s'il s'agit de paracétamol, ce
médicament pourtant réputé inoffensif.
De plus, devant une intoxication aiguë, nous recommandons
de ne plus recourir à la chromatographie sur couche mince pour la
recherche d'une présence de paracétamol ou d'un tout autre
produit d'ailleurs, dans l'organisme, sous peine d'une perte de temps
énorme en regard de l'urgence de telles situations.
En effet, une simple constatation de visu de la teinte jaune
orangé du 3-nitro 4-hydroxyacétanilide, produit par la
réaction du paracétamol en milieu acide avec les ions nitrites,
lors du dosage de ce médicament, avant même la lecture de
l'absorbance au spectrophotomètre, suffit et permettrait un gain de
temps dans la mesure où, d'une pierre deux coups, le risque encouru est
évalué au travers de la paracétamolémie,
aussitôt la présence de paracétamol dans l'organisme est
ainsi révélée.
Quant à l'évaluation du danger encouru par les
patients au travers de la paracétamolémie, nous recommandons
d'être prudents, notamment lorsque le temps écoulé depuis
l'ingestion présumée d'une dose importante de paracétamol,
est long. Si la littérature recommande que ce temps ne dépasse
pas les 24 heures (LACROIX et al, 2007), nos résultats
suggèrent, sous réserve d'être confirmés, une limite
bien en deçà. Pour palier à ce défaut, nous
recommandons de mesurer le cas échéant, les taux d'ASAT et ALAT,
ces marqueurs moléculaires de la cytolyse hépatique.
Page 44
Références bibliographiques :
ANNEQUIN, D. (2002). La douleur chez l'enfant.
Elsevier Masson. 1ére Ed. Paris.
ARDID, D. (2009). Usage et mésusage des
médicaments. Revue du rhumatisme. N° 76. 576- 579.
ASFAR, P. (2010). Réanimation
hépato-splanchnique. Elsevier Masson. 1ére Ed.
Paris.
BEAULIEU, P. (2005). Pharmacologie de la
douleur. Les presses de l'université de Montréal.
1ére Ed. Québec.
BEDRY, R., LLANAS, B., VINCENT, D., FAYON, M.
(2007). Guide pratique de toxicologie pédiatrique. Arnettes.
2ème Ed.
BEGUE, P et ASTRUC, J. (1999). Pathologie
infectieuse de l'enfant. Elsevier Masson. 2ème Ed., Paris.
BERENBAUM, F. (2004). La cox-3 existe-t-elle.
Revue de rhumatisme. Vol 71, N°12. 1095- 1097.
BOUCHER, Y ; COHEN, E. (2007). Urgences
dentaires et médicales : conduite à tenir- prévention chez
les personnes à risque. CDP- Wolters- Kluwer. 1ère Ed.
France.
BRES, M ; SEBBANE, M ; PEYRIERE, H ; JREIGE, R ;
RUBENOVITCH, J ; ELEDJAM, J-J. (2009). Devenir des intoxications au
paracétamol admises dans un service d'urgences. Journal Européen
des Urgences. Vol 22, N°S2.A207.
BRUNNER, L-S., SMELTZER, S., BARE, B., SUDDARTH, D-S.
(2006). Soins infirmiers en médecine et en chirurgie. De Boeck
Université. 2ème Ed. Bruxelles.
CALVINO, B. (2009). Paracétamol : ne pas
dépasser la dose prescrite. Pour la science. N°385.
CAPDEVILA, X. (2004). Analgésie
postopératoire. Elsevier Masson. 1ére Ed. Paris.
CARLI, P ; RIOUX, B ; TELION, C. (2004).
Urgences médico-chirurgicales de l'adulte. Arnettes.
2ème Ed. Paris.
CASAMAJOR, P., DESCROIX, V. (2009). La
prescription ciblée en odontologie. Wolters Kluwers.
2ème Ed., France.
CHAIB, A. (2007). Urgences, réanimation,
transfusion. Elsevier Masson. 1ére Ed. Paris.
CLAVERIE, I et HEDDE, H. (2008). Pharmacologie
générale-Toxicologie : concepts fondamentaux. Porphyre.
2ème Ed. Paris.
CLAYDEN, J; WAREN, S; GREEVES, N; WOTHERS, P.
(2003). Chimie organique. De Boeck. 2ème Ed.
Paris.
CNERM. (2009). Réanimation et urgences.
Elsevier Masson. 3ème Ed. Paris.
DE BROCA, A. (2005). Douleurs, soins palliatifs
et deuil. Elsevier Masson. 2ème Ed. Paris. DOROSZ Ph.
(2003). Guide pratique des médicaments. 23ème
Edition, Maloine, Paris. DROZ, J-P. (2008). 52 cas clinique
transversaux. Pradel. 1ère Ed. France.
ELLIS, F. (2002). Paracétamol - a
curriculum resource. Osborne. 1ére Ed., Londres.
ELLRODT, A. (2005). Urgences médicales. Estem.
5ème Ed. Paris.
FAURE, S. (2010). Analgésiques
antipyrétiques ; Actualités pharmaceutiques ; Vol49-N° 492 ;
45-48.
GALLET, J-P. DE MOULLIAC, J-V. (2009). Guide
pratique de la consultation en pédiatrie. Elsevier Masson.
9ème Ed., Paris.
GAUDY, J-F. (2009). Techniques
analgésiques cranio-cervico-faciales :
Odontostomatologie, médecine esthétique. Elsevier
Masson. 3ème Ed. Paris.
GERAUD, G et FABRE, N. (2001). Guide pratique
des migraines et céphalées. Elsevier Masson.
1ère Ed. Paris.
GUEUGNIAUD, P-Y ; DE LA COUSSAYE, J-E. (2000).
Modalités de la sédation et/ou de l'analgésie en
situation extrahospitalière: Conférence d'experts. Elsevier
Masson. 1ère Éd. Paris.
HACHULLA, E et FLIPO, R-M. (1999).
Corticothérapie en pratique de ville : Médecine interne et
rhumatologie. Estem. 1ére Ed. Paris.
JONES, A-L et DARGAN, P-I. (2008). Toxicologie
d'urgences. Elsevier Masson. 1ére Ed. Paris.
KUPFERSCMIDT, H. (2004). Traitement de
l'intoxication au paracétamol. Centre suisse d'informations
toxicologiques.
LA CROIX, J ; GAUTHIER, M ; GOUDREAULT, P. (2007).
Urgences et soins intensifs pédiatriques. Elsevier Masson.
2ème Ed. Paris.
LANE, J; MARTIN, G; BELSON, D; BROWN, K et SCHEETZ, A.
(2002). Chronic acetaminophen toxicity: a case report and review of
the literature. The journal of emergency médicine. Elsevier Masson. Vol
23, N° 3. 253-256.
LE MAREC, C. (2005). Histoire du
paracétamol. Le praticien en anesthésie-réanimation. Vol 9
- N°4, 321-328.
Page 2
LEVY, P. (2009).
Hépato-gastro-entérologie. Elsevier Masson.
1ére Ed. Paris.
MESPLEDE, J ; SALUZZO, C. (2004). Cent
manipulations en chimie organique et inorganique. Bréal.
1ère Ed. Paris.
MONTAGNIER, L., EYQUEM, A., ALOUF, J-E. (2003).
Traité de microbiologie clinique. Piccin. 3ème Ed.
Italie.
MOREAU, L., Le QUAY, J.C., GRANRY, N., BOISHARDY, A.,
DELHUMEAU. (1992). Pharmacocinétique du paracétamol dans
le liquide céphalo-rachidien chez le sujet âgé ; annales
françaises d'anesthésie et de réanimation, vol 11-
supplément 1, pp R88.
OSMAN, D ; BONNET, M-P ; BOUFERRACHE, K ; JOSSERAND, J.
(2007). Urgence- Réanimation- Anesthésie. Elsevier
Masson. 1ére Ed. Paris.
PELISSIER, J et VIEL, E. (2000). Douleur et
médecine physique et de réadaptation (Volume 38 de
Problèmes en médecine de rééducation). Elsevier
Masson. Paris.
PERLMUTER, L ; PERLMUTER, G ; PITARD, L. (2008).
Guide pratique de l'infirmière. Elsevier Masson.
2èmeEd. Paris.
PINAUD, M; VALLET, B; LAUDENBACH, V; KERBAUL, F.
(2004). Conférences d'actualisation: 46e Congrès
national d'anesthésie et de réanimation (La collection de la
SFAR). Elsevier Masson. Paris.
POCOCK, G et RICHARDS, C-D. (2004). Physiologie
humaine : les fondements de la médecine. Elsevier Masson.
1ère Ed. Paris.
PONS, J-C et PERROUSE-MENTHONNEX, K. (2005).
Comment soigner la femme enceinte. Elsevier Masson. 1ère Ed.
Paris.
POUCHAIN, D ; ATTALI, C ; DE BUTLER, J ; GAY, B ;
MOLINA, J ; OLOMBEL, P ; ROUY, J-L. (1996). Médecine
générale : concepts et pratiques. Elsevier Masson.
1ére Ed. Paris.
QUENEAU, P. (2006). Le paracétamol : deux
erreurs et un oubli pour une découverte providentielle. Douleurs. Vol 6
- N°6. 332-333.
QUENEAU, P., OSTERMANN G. (2004). Le
médecin, le malade et la douleur. Elsevier Masson.
3ème Ed., Paris.
RAINSFORD, K-D. (2004). Aspirin and related
drugs. CRC Press. 1ére Ed. New York.
RANG, H-P;
DALE, M. (2003). Pharmacology. Churchill Livingstone.
5ème Ed. USA.
REICHEL, F-X; PERRAUD, R; KRAHÉ, E. (2004).
Guide pratique de toxicologie. De Boeck University.
1ère Ed. Bruxelles.
REMY, C. (2004). la place du paracétamol
pour l'analgésie postopératoire. le praticien
anesthésie-réanimation. Elsevier Masson. 293-296.
REZENDE, R-M ; FRANÇA, D-S ; DE MENEZES, G-O ;
DOSREIS, WGP ; BAKHLE, Y-S et FRANCISCHI, J-N. (2008). Different
mechanisms underlie the analgesic actions of paracetamol and dipyrone in a rat
model of inflammatory pain. British journal of pharmacology. Vol 4, N°154.
760-768.
ROUSSEAU, M-A. (2007). Rhumatologie
Traumatologie Orthopédie. Elsevier Masson. 1ére Ed. Paris.
SERRIE, A et THUREL, C. (2002). La douleur en
pratique quotidienne : diagnostic et traitement. Arnette ;
2ème Ed., Paris.
SEIRAFI, M ; ITEN, A ; HADENGUE, A. (2007).
Paracétamol toxicité hépatique aux doses
thérapeutiques et populations à risque. Revue médicale
suisse. Vol 3, N°129.
SHAHEEN, S-O; NEWSON, R; SHERRIFF, U; HENDERSON, A;
HERON, J; BURNEY, P; GOLDING, J. (2002). Paracétamol use in
pregnancy and wheezing in early childhood. Thorax. Vol 57. 958-963.
STERNER, O. (1999). Chemistry, health and
environnement. Wiley VCH. 1ére Ed. Allemagne.
STORA, D. (2005). Pharmacologie: Cahier du
préparateur. Wolters Kluwers. 3ème Ed. Porphyre.
France.
TOOLANEY, G-H. (2007). New research on
methamphetamine abuse. Nova publishers. 1ére Ed. New York.
VAUBOURDOLLE, M. (2007). Toxicologie, sciences
mathématiques, physiques et chimiques. Wolters Kluwers.
3ème Ed. Paris.
VIALA, A ; BOTTA, A. (2005). Toxicologie. Tec
& Doc Lavoisier. 2ème Ed. Paris.
VIBES, J. (2001). Guide de la douleur : le
syndrome douloureux chronique. Estem ; 1ère Ed., Paris.
VINCENT, J-L. (2009). Le manuel de
réanimation, soins intensifs et médecine d'urgence. Springer.
3ème Ed. Paris.
WARNER, T-D et MITCHELL, J-A. (2002).
Cyclooxygénase-3 (COX-3): Filling in the gaps towards COX continuum.
PNAS. Vol. 99, N°21. 371-373.
ZETLAOUI, P et LENOBLE, M. (2004). Intoxications
aux urgences. Elsevier Masson. Paris.
Page 4
| 


