
UNIVERSITÉ DE
NGAOUNDÉRÉ
*********
ÉCOLE DES SCIENCES ET
DE
MÉDECINE
VÉTÉRINAIRE
*********
DÉPARTEMENT DE PHYSIOLOGIE
ET
BIOTECHNOLOGIES DE LA
REPRODUCTION
THE UNIVERSITY OF NGAOUNDERE
*********
SCHOOL OF
VETERINARY MEDICINE
AND SCIENCES
*********
DEPARTMENT OF
REPRODUCTIVE
PHYSIOLOGY AND
BIOTECHNOLOGY
ÉVALUATION DU POTENTIEL OVARIEN DES
ZÉBUS
POUR LA PRODUCTION IN VITRO
D'OVOCYTES
FÉCONDABLES DANS LE PLATEAU DE L'ADAMAOUA
MÉMOIRE PRESÉNTÉ EN VUE DE
L'OBTENTION DU DIPLÔME DE
DOCTEUR EN MÉDECINE
VÉTÉRINAIRE
Par
DAWAYE SOULEY MONGLO
Matricule :
07A010MV
Première promotion
Encadreur Superviseur
Dr KOUAMO Justin ZOLI PAGNAH André
Chargé de cours Professeur
Année
2014

FICHE DE CERTIFICATION DE L'ORIGINALITE DU
TRAVAIL
Je soussigné DAWAYE SOULEY MONGLO
atteste que le présent mémoire est le fruit de mes
propres travaux effectués à l'abattoir municipal de
Ngaoundéré et au laboratoire de l'IRAD-WAKWA, sous l'encadrement
du Dr KOUAMO Justin et la supervision du Pr ZOLI PAGNAH André.
Ce mémoire est authentique et n'a pas été
antérieurement présenté pour l'acquisition de quelque
grade universitaire que ce soit.
DAWAYE SOULEY MONGLO
Date
Visa de l'encadreur visa du superviseur
Date Date
Visa du Chef du département
Date
II
FICHE DE CERTIFICATION DES CORRECTIONS
APRES
SOUTENANCE
Le présent mémoire a été revu et
corrigé conformément aux observations
du jury.
Visa du superviseur
Date
Visa du président du
jury
Date
Visa du Chef du département
Date
III
DÉDICACE
À
BOUBA MONGLO
iv
REMERCIEMENTS
Au Directeur de l'Ecole des Sciences et de Médecine
Vétérinaire (ESMV), le
Professeur ZOLI PAGNAH André, qui n'a ménagé
aucun effort pour la réussite de notre
formation et pour avoir accepté de superviser ce
mémoire.
Au Docteur KOUAMO Justin qui a encadré ce travail. Il a
porté un intérêt particulier
et a suivi de près toutes les étapes de
réalisation de ce travail.
A tout le personnel enseignant et administratif de l'ESMV.
Au chef du centre de l'IRAD pour nous avoir accordé le
laboratoire.
Au Dr MANCHANG, Dr Germanus BAH du laboratoire de l'IRAD et au
personnel de
l'abattoir municipal de Ngaoundéré pour leur
soutien et leur collaboration.
A mon père MONGLO Silas, ma mère ASTA Elisabeth,
mon oncle
VONDOU MASSAYE Pierre et à tous mes frères et
soeurs. Que Dieu leur accorde longue vie.
A tous mes camarades de la première promotion.
V
TABLE DES MATIÈRES
Page
FICHE DE CERTIFICATION DE L'ORIGINALITE DU TRAVAIL i
FICHE DE CERTIFICATION DES CORRECTIONS APRES SOUTENANCE ii
DÉDICACE iii
REMERCIEMENTS iv
LISTE DES TABLEAUX xi
LISTE DES FIGURES xii
LISTE DES PHOTOS xiii
LISTE DES ABRÉVIATIONS xiv
RÉSUMÉ xv
ABSTRACT xvi
INTRODUCTION 1
CHAPITRE I : REVUE DE LA LITTÉRATURE 3
A. ANATOMIE ET PHYSIOLOGIE DE L'OVAIRE 3
I. Anatomie de l'ovaire 3
I.1. Morphologie 3
I.2. Topographie 4
I.3. Structure histologique 4
I.4. Irrigation et innervation 5
II. Physiologie de l'ovaire 5
II.1. Ovogenèse 5
vi
II.2. Cycle sexuel 6
II.2.1. Evénement cellulaire ovarien 6
II.2.1.1. Folliculogenèse 6
II.2.1.1.1. Aspects morphologiques du développement
folliculaire 7
II.2.1.1.2. Dynamique de la croissance folliculaire 10
II.2.1.1.3. Régulation de la croissance folliculaire 13
II.2.1.2. Atrésie folliculaire 13
II.2.1.3. Ovulation et maturation du complexe cumulus-ovocyte
14
II.2.1.3. 1. Ovulation 14
II.2.1.3.2. Maturation du complexe ovocyte-cumulus 14
II.2.1.4. Formation et évolution du corps jaune 16
II.2.2. Régulation hormonale de la fonction ovarienne
16
II.2.3. Évènements comportementaux 18
II.2.3.1. Saisonnalité 18
II.2.3.2. OEstrus 18
B. PRODUCTION IN VITRO D'EMBRYONS 19
I. Technique de collecte des ovocytes 19
I.1. Collecte des ovocytes à partir des ovaires
prélevés sur des animaux abattus (ex vivo) 19
I.1.1. Aspiration des ovocytes 19
I.1.2. Slicing des ovaires 19
I.1.3. Ponction des follicules 19
vii
I.1.4. Dissection des follicules 20
I.2. Collecte des ovocytes par ovum pick-up (in vivo)
20
II. Evaluation de la qualité des ovocytes 20
II.1. Evaluation des ovocytes sur la base du diamètre des
follicules 20
II.1. Evaluation sur la base des caractéristiques
morphologiques du cumulus oophorus 21
II. 2. Choix des ovocytes pour la maturation et la
fécondation in vitro 21
III. Maturation in vitro des ovocytes 22
IV. Fécondation in vitro des ovocytes 22
V. Culture des embryons 22
VI. Facteurs de variation de la population folliculaire, du
rendement et de la qualité ovocytaires
23
IV.1. Facteurs ovariens 23
IV.1. 1. Corps jaune 23
IV.1.2. Disposition des follicules dans le cortex ovarien 23
IV.1.3 Diamètre des follicules 24
IV.2. Facteurs non ovariens 24
IV.2.1. Race 24
IV.2.2. Age 25
IV.2.4. Note d'état corporel (NEC) 25
IV.2.4. Statut physiologique 26
V.3. Autres facteurs de variations du rendement et de la
qualité des ovocytes 27
VIII
V.3.1. Technique de collecte 27
V.3.2. Temps et température de transport. 27
CHAPITRE II : MATÉRIEL ET MÉTHODES 28
I. Site de l'étude 28
II. Animaux 28
III. Protocole expérimental 29
III.1. Identification de la race 29
III.2. Provenance des animaux 31
III.3. Poids des vaches 31
III.4. Note d'état corporel 31
III.5. Age 33
III.6. Statut physiologique 33
III.7. Prélèvement des ovaires 34
III.8. Détermination du poids et de la taille des
ovaires 34
III.9. Identification du corps jaune 35
III.10. Détermination de la population folliculaire
35
III. 11. Collecte et classification des ovocytes 36
IV. Analyses statistiques 36
CHAPITRE III : RÉSULTATS ET DISCUSSION 37
I. Résultats 37
I.1.
ix
Caractérisation des vaches abattues et des ovaires
37
I.1.1. Race 37
I.1.2. Age 37
I.1.3. NEC 38
I.1.4. Statut physiologique 38
I.1.5. Corps jaune 38
I.1.6. Poids des ovaires et des vaches 38
I.1.7. Taille des ovaires 40
I.2. Population folliculaire 42
I.3. Rendement en ovocyte 42
I.4. Qualité des ovocytes 43
I.5. Effet des facteurs ovariens sur la population
folliculaire, le rendement et la qualité des
ovocytes. 44
I.5.1. Localisation ovarienne 46
I.5.2. Corps jaune 46
I.5.3. Poids de l'ovaire 46
I.5.4. Taille de l'ovaire. 46
I.6. Variation de la population folliculaire, du rendement et
de la qualité des ovocytes en
fonction des facteurs non ovariens. 47
I.6.1. Race 49
I.6.2. Age 49
X
I.6.3. NEC 49
I.6.4. Statut physiologique 49
I.6.5. Stade de gravidité 50
II. Discussion 50
CONCLUSION 55
BIBLIOGRAPHIE 56
ANNEXE 64
xi
LISTE DES TABLEAUX
Page
Tableau I: Grille de notation de l'état corporel des
bovins 32
Tableau II: Méthode de détermination de l'âge
des bovins 33
Tableau III : Répartition des vaches en fonction de
l'âge 37
Tableau IV : Répartition des vaches en fonction du statut
physiologique 38
Tableau V : Variation du poids des ovaires et des vaches en
fonction de la race, de la NEC, de
l'âge, du statut physiologique et du corps jaune
39
Tableau VI : Variation de la taille des ovaires en fonction de la race,
de la NEC, de l'âge, du statut
physiologique et de la présence ou non du corps jaune .
41
Tableau VII: Variation du nombre des follicules en fonction des
facteurs ovariens 44
Tableau VIII : Variation du rendement et la qualité des
ovocytes en fonction des facteurs ovariens.
45
Tableau IX : Variation de la population folliculaire en fonction
des facteurs non ovariens 47
Tableau X : Variation du rendement et de la qualité des
ovocytes en fonction des facteurs non
ovariens 48
XII
LISTE DES FIGURES
Page
Figure 1: Structure histologique d'un ovaire 4
Figure 2 : Follicule primordial 7
Figure 3 : Follicules primaires 8
Figure 4 : Follicule secondaire 8
Figure 5 : Follicule tertiaire 9
Figure 6: Follicule mûr ou de De Graaf 10
Figure 7 : Vagues de croissances folliculaires chez la vache
11
Figure 8 : Notion de recrutement, sélection et dominance
d'un follicule chez la vache 12
Figure 9 : Enchaînement des rétroactions
réglant la fonction ovarienne 17
Figure 10: Distribution des vaches en fonction de la race 37
Figure 11 : Distribution des vaches en fonction de la NEC 38
Figure 12: Répartition du nombre des follicules en
fonction de leur diamètre 42
Figure 13 : Répartition des ovocytes en fonction de leur
qualité 44
XIII
LISTE DES PHOTOS
Photo n ° 1 : Ovaire d'une vache 3
Photo n ° 2 : Zébu Goudali 29
Photo n ° 3 : Zébu White Fulani 30
Photo n ° 4 : Zébu Red Fulani 30
Photo n ° 5 : Zébu Bokolo 31
Photo n ° 6 : Détermination du poids de l'ovaire
34
Photo n ° 7 : Détermination de la taille de
l'ovaire 34
Photo n ° 8 : Ovaire portant un corps jaune 35
Photo n ° 9 : Ovaire portant des follicules 35
Photo n ° 10 : Complexe Ovocyte-Cumulus 43
xiv
LISTE DES
ABRÉVIATIONS
AMPc : Adénosine 3':5'-Mono Phosphate
Cyclique
BCS : Body condition score
COC : Complexe Ovocyte Cumulus-oophorus.
DPBS : Dulbecco's Phosphate-Buffered
Saline.
ESMV : Ecole des Sciences et de
Médecine Vétérinaire.
FSH : Follicle-Stimulating Hormone.
FIV : Fécondation in vitro
G: gauge.
GnRH : Gonadotrophin-Releasing Hormone.
IGF-1 : Insuline Growth Factor 1
IRAD : Institut Agricole de recherché
pour le développement.
KD : Kilo Dalton.
LH : Luteinizing Hormone.
NaCl : Chlorure de sodium.
NEC : Note d'état corporel.
PIV : Production in vitro
d'embryon.
PTHO : Périmètre thoracique.
xv
RÉSUMÉ
Cette étude a été menée à
l'abattoir afin d'évaluer le potentiel ovarien de deux cent et une (201)
vaches locales dans la région de l'Adamaoua (Cameroun) pour la
production in vitro d'ovocytes fécondables. Quatre cent deux
(402) ovaires ont été prélevés puis
transportés au laboratoire dans une solution de NaCl à 9 %
endéans les deux heures qui suivaient l'abattage. Les follicules sur
chaque ovaire ont été comptés, leur diamètre (CD)
mesuré et classé en trois catégories: petits (CD < 3
mm), moyens (3 = CD = 8 mm) et gros (CD > 8 mm). Les ovocytes ont
été récoltés par le « slicing » de chaque
ovaire dans le Dubelcco's Phosphate Buffered-Saline, puis examinés sous
stéréoscope (10X) et classés en quatre groupes selon la
morphologie et l'expansion du complexe cumulus oophorus. L'effet des facteurs
ovariens (poids et taille des ovaires, position ovarienne et corps jaune) et
non ovariens (race, note d'état corporel, âge, état et
stade de gravidité) sur la population folliculaire, le rendement et la
qualité ovocytaires a été évalué. La
population folliculaire moyenne était de 16,75#177;0,83 par ovaire. La
population des petits, moyens et gros follicules étaient 8,39#177;0,60 ;
8,14#177;0,43 et 0,21#177;0,02 respectivement. Le rendement ovocytaire a
été de 10,97#177;0,57 par ovaire. Les ovocytes de qualités
I, II, III, IV étaient de 3,53#177;0,19 (32,21%) ; 2,72#177;0,15
(24,82%) ; 2,24#177;0,15 (20,44%) ; 2,47#177;0.20 (22,54%) respectivement.
L'index de la qualité ovocytaire était de 2,26. Les vaches
jeunes, présentant une note d'état corporel (NEC) = 3, non
gravides et portant de gros ovaires avaient un rendement plus
élevé en follicules et en ovocytes (P<0,05). Les ovocytes de
qualité I et II aptes à être maturés et
fécondés in vitro représentaient 57,15 %. Ces
résultats indiquent que les ovaires des zébus locaux
prélevés après abattage présentent une
potentialité moyenne pour la production in vitro d'embryons.
Mots clés : zébus, ovaires,
population folliculaire, qualité ovocytaire, embryon, Adamaoua.
xvi
ABSTRACT
An slaughterhouse study was conducted to evaluate the ovarian
potential of two hundred and one local zebu cattle from Ngaoundere, Adamawa
Region (Cameroon) for in vitro oocyte fertilization. The ovaries were
excised, submerged in normal saline solution (0.9%) and transported to the
laboratory for evaluation within 2 hours of collection. Follicles on each ovary
were counted, their diameters (CD) measured and grouped in 3 categories: small
(CD <3 mm), medium (3 = CD = 8 mm) and large (CD > 8 mm). Each ovary was
then sliced into a petri dish, the oocytes recovered in Dulbecco's phosphate
buffered saline, examined under a stereoscope (x 10) and graded into four
groups based on the morphology of cumulus oophorus cells and cytoplasmic
changes of the oocytes. The effects of both ovarian (ovarian localization,
corpus luteum, size and weight of ovary) and non-ovarian factors (breed, age,
BCS and pregnancy status of cow) on the follicular population and oocyte
recovery rate were determined. There was an average of 16.75 #177; 0.83
follicles per ovary. The number of small, medium and large follicles were 8.39
#177; 0.60, 8.14 #177; 0.43 and 0.21 #177; 0.02 respectively. Oocyte recovery
rate was 10.97 #177; 0.43 per ovary. Oocytes graded I, II, III and IV were 3.53
#177; 0.19 (32.21%), 2.72 #177; 0.15 (24.82%), 2.24 #177; 0.15 (20.44%) and
2.47 #177; 0.20 (22.54%) respectively. The oocyte quality index was 2.26.
Younger, non-pregnant cows with a body condition score (BCS) = 3 and large
ovaries presented higher number of follicles and oocytes (P < 0.05). Oocytes
acceptable quality (grade I and II) for in vitro maturation and
fertilization constituted 57.15% of the harvest. These results indicate that
ovaries of local Zebu harvested after slaughter have a moderate potential for
in vitro embryo production.
Keys words: zebus, ovaries, follicular
population, oocyte quality, embryo, adamawa.
1
INTRODUCTION
L'élevage bovin au Cameroun occupe une place importante
dans le système de production animale nationale. Avec environ 7 millions
de têtes, les bovins représentent 10 % du cheptel global des
animaux (MINEPIA, 2009). Les bovins élevés au Cameroun sont pour
la plupart les zébus (Bos indicus). Les taurins (Bos
taurus) représentent à peine 2% de la population bovine
totale et sont menacés d'extinction (Lhoste, 1991). A côté
de celles-ci, se trouvent également des races exotiques. Toutefois, la
productivité de ces races reste faible. Les problèmes
génétiques, zootechniques, sanitaires et de reproduction ont
été identifiés comme étant les facteurs
responsables de la faible productivité (Ebangi et al., 2011).
Les bovins locaux camerounais sont élevés selon un mode
traditionnel avec peu de programmes d'amélioration
génétique. L'insémination artificielle a été
introduite pour la première fois en Afrique en 1935 au Kenya, puis s'est
généralisée dans toute l'Afrique subsaharienne à la
faveur des différents projets d'amélioration (Kouamo et al.,
2009). Au Cameroun, elle est encore peu utilisée. Certains
éleveurs pratiquent l'insémination sur les races locales avec une
semence importée. Mais, cette technique est utilisée de
manière anarchique, ce qui entraîne la dispersion et la dilution
du génotype local (Bah et al., 2010). La production in
vitro d'embryon et le transfert d'embryon sont des techniques de
reproduction qui constituent une alternative à l'IA pour
l'amélioration génétique (Huang et Rosenwarks, 2012). En
effet, ils permettent la préservation du potentiel
génétique d'animaux sub-fertiles ou morts (Deuleuze et
al., 2009) par la création d'une banque de gènes (Seidel et
Seidel, 1989). Les ovaires prélevés sur des animaux après
abattage constituent la plus grande source d'ovocytes primaires obtenus
à moindre coût pour la production à grande échelle
d'embryons bovins suite à la maturation et à la
fécondation in vitro (Agrawal et al., 1995).
L'étape initiale et primordiale dans la fécondation in vitro
est la collecte et la sélection des ovocytes viables capables
d'être maturés et fécondés in vitro. A
notre connaissance, cette étude n'a jamais été
menée au Cameroun. C'est dans ce contexte qu'a été
réalisée cette étude avec pour objectif principal
l'évaluation du potentiel ovarien des zébus Akou, Bokolo, Djafoun
et Goudali pour la production in vitro d'ovocytes
fécondables.
Il s'agit de façon spécifique de :
- caractériser les vaches abattues ainsi que leurs ovaires
; - déterminer la population folliculaire ;
- déterminer le rendement et la qualité des
ovocytes ;
2
- évaluer les effets des facteurs ovariens et non ovariens
sur la population folliculaire, le rendement et la qualité des
ovocytes
CHAPITRE I : REVUE DE LA LITTÉRATURE A. ANATOMIE
ET PHYSIOLOGIE DE L'OVAIRE
L'ovaire est un organe qui a quatre fonctions principales
à savoir : la multiplication des cellules somatiques (cellules
folliculaires) entourant l'ovocyte, la multiplication des ovogonies et la
maturation des ovocytes, l'ovulation et la synthèse des hormones
stéroïdiennes et peptidiques contrôlant le fonctionnement
ovarien mais aussi celui de tous les organes qui interviennent dans la fonction
de reproduction de la femelle.
I. Anatomie de l'ovaire I.1. Morphologie
L'ovaire de la vache (photo n° 1) a la
forme d'une amande aplatie latéro-médialement (Cuq et Agba, 1975)
avec deux pôles inégaux ; elle peut souvent être
sub-ovoïde. La surface de l'ovaire est irrégulière, elle est
bosselée par des structures telles que les follicules à
différents stades de croissance et le corps jaune. Les dimensions de
l'ovaire des bovins rapportées dans la littérature chez Bos
indicus sont de 26 à 28 mm pour la longueur, 17 à 18 mm pour
la largeur et 13 à 14 mm pour l'épaisseur (Cuq et Agba, 1975). Le
poids moyen des ovaires est de 4,42 g pour le zébu Ankolé
(Natumyana et al., 2008) et de 10,2 g pour le taurin Swedish Red (
Rajoski, 1960).
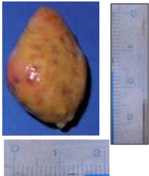
3
Photo n ° 1 : Ovaire d'une vache
I.2. 4
Topographie
Une fois formés, les ovaires sont assimilés
à des glandes. Ils sont situés dans la cavité abdominale
et sont maintenus à cet endroit par différentes structures : le
ligament ovarien, le ligament suspenseur qui les rattache à la paroi
pelvienne et le mésovarium qui les rattache au ligament large.
I.3. Structure histologique
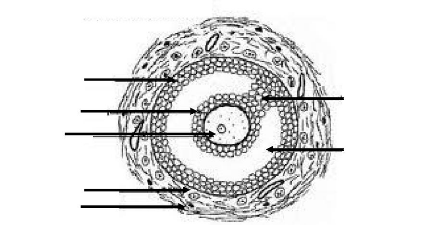
En coupe longitudinale (figure 1), on observe
trois parties distinctes de l'ovaire à savoir l'épithélium
germinatif qui est la couche externe, l'albuginée constituée de
tissus conjonctifs denses et le stroma qui se divise en deux parties : le
cortex (couche externe) et la médulla (couche interne). Le cortex est un
tissu de soutien formé de tissu conjonctif et de cellules du stroma ; il
contient les organites ovariens (follicules, corps jaune). Quant à la
médulla, encore appelée zone vasculaire, elle est composée
de tissu ovarien nutritionnel et de soutien (Marieb, 1999).
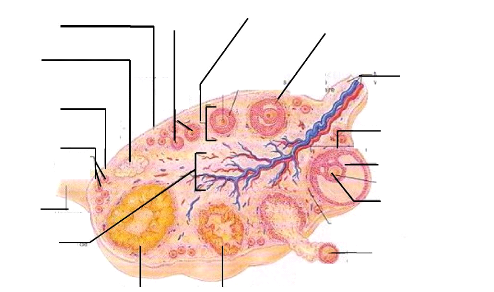
Cortex
Follicules primaires
Albuginée
Follicule secondaire
Corpus albican
Mésovarium et vaisseaux sanguins
Epithélium germinatif
Follicule mûr
Follicules primordiaux
Antrum
Ligament propre
Ovocyte
Medulla
Ovocyte expulsé
|
Corps jaune
|
Corps jaune en voie de développement
|
|
Figure 1: Structure histologique d'un ovaire
Source : Marieb, 1999. Anatomie et Physiologie humaines,
p. 1056.
5
I.4. Irrigation et innervation
Les ovaires sont irrigués par l'artère ovarique
issue de la partie caudale de l'aorte abdominale. La veine ovarique draine
l'ovaire du cortex vers la médulla. Elle se jette rapidement dans la
veine cave caudale pour la veine ovarique droite, et dans la veine
rénale pour la veine ovarique gauche. Les nerfs sont
représentés par de nombreux rameaux grêles,
anastomosés, constituant le plexus ovarique.
II. Physiologie de l'ovaire
Au sein de l'ovaire, deux processus de développement
étroitement imbriqués, l'ovogenèse et la
folliculogenèse, déterminent le nombre et la qualité des
ovocytes produits. Ces processus, initiés pendant la vie foetale, se
poursuivent pendant toute la vie de la femelle et sont étroitement
contrôlés à chacune de leurs étapes par de nombreux
facteurs hormonaux et environnementaux (Monniaux et al., 2009).
II.1. Ovogenèse
L'ovogenèse est la formation des cellules sexuelles
femelles, aussi appelées ovules (Marieb, 1999). Elle se déroule
dans les ovaires et débute durant la vie embryonnaire (Mauléon,
1961). Elle est d'autant plus complexe qu'elle s'imbrique dans un autre
processus de développement, la folliculogenèse, avec laquelle
elle entretient des liens étroits (Monniaux et al., 2009). Le
processus de l'ovogenèse se déroule en cinq phases et
s'échelonne sur plusieurs années.
La différentiation sexuelle embryonnaire est
établie vers la 6e semaine de la gestation chez la vache.
Durant cette période foetale, les cellules germinales primordiales
colonisent la crête génitale (phase 1). Elles donnent,
après différentiation, naissance aux ovogonies (phase 2) qui sont
des cellules diploides (Namdori et al., 2008). Ces ovogonies se
multiplient de façon mitotique dans les cordons ovigères
jusqu'à leur entrée en prophase méiotique qui marque
l'arrêt de leur accroissement numérique (Monniaux et al.,
2009). Cette multiplication s'étend du 60e au 170e
jour du développement embryonnaire et foetal (Erickson, 1966). Les
ovaires peuvent contenir alors jusqu'à 2 millions d'ovogonies (Hanzen
et al., 2000) durant la vie foetale. La phase mitotique
terminée, ces dernières entament le processus de méiose
qui s'interrompt au stade diplotène (dit aussi vésicule
germinale) de la prophase I et deviennent ainsi les ovocytes I (phase 3).
Chaque ovocyte s'entoure d'une couche de cellules somatiques, de cellules de la
granulosa et d'une lame basale pour former des follicules primordiaux (Drion
et al., 1996; Monniaux et al., 2009).
6
A la puberté qui intervient à l'âge de 3
à 4 ans chez les zébus (Messine et al., 2003), plusieurs
ovocytes I seront activés, un seul sera « choisi » pour
poursuivre la première division de la méiose I. Une fois la
première division méiotique terminée, l'ovocyte I donne
deux cellules haploïdes de volume très inégal. La plus
petite des cellules est appelée globule polaire I et la plus grosse, qui
contient tout le cytoplasme l'ovocyte II (phase 4). Cet ovocyte va commencer la
seconde division de la méiose mais ne la complétera pas. Elle
sera bloquée en métaphase II jusqu'à la libération
de l'oeuf mature (phase 5). C'est lors de la fécondation ou de
l'activation parthénogénétique de l'oeuf que la
méiose se termine. En cas de non fécondation, l'ovule
dégénère (Marieb, 1999).
II.2. Cycle sexuel
Un cycle sexuel est l'ensemble d'événements
biologiques précis intervenant à trois niveaux: cellulaire,
hormonal et comportemental. Il est caractérisé par la croissance
et la régression des follicules et du corps jaune (Sartori et Barros,
2011). Sa durée moyenne est de 22,1#177;1,5 jours chez la femelle
Zébu (Marichatou, 2010).
II.2.1. Evénement cellulaire ovarien
Au niveau cellulaire, il y a deux phases conduisant à
des formations ovariennes : une phase folliculaire correspondant à la
croissance des follicules et qui se termine par l'ovulation ou rupture du
follicule et une phase lutéale au cours de laquelle le corps jaune issu
de la rupture du follicule croit puis régresse (Stouffer, 2006).
II.2.1.1. Folliculogenèse
Le follicule est une structure en forme de sac, formée
par un amas de cellules mésodermiques, entourant une cellule ou un autre
ensemble de cellules. La folliculogenèse commence pendant le
développement foetal. En effet, les follicules antraux sont
observés dans les ovaires des foetus bovins très tôt
à 5 mois de gestation (Santos et al., 2013). C'est un processus
continu initié à partir de la réserve de follicules
primordiaux jusqu'à l'ovulation ou, cas le plus fréquent,
à la dégénérescence (ou atrésie) de plus de
99% des follicules en croissance (Driancourt et al., 2001; Monniaux
et al., 2009). L'initiation de la croissance folliculaire se
caractérise par l'augmentation du volume de l'ovocyte et l'entrée
en prolifération des cellules de la granulosa (Monniaux et al.,
2009. Cette phase ne concerne que 10 % du stock folliculaire qui est de 150 000
à 235 000 chez la vache (Hanzen et al., 2000). Elle est
caractérisée par des modifications qui concernent à la
fois le follicule et l'ovocyte qu'il renferme (Monniaux et al.,
2009).
7
II.2.1.1.1. Aspects morphologiques du
développement folliculaire
La folliculogenèse comprend les stades des follicules
primordial, primaire et secondaire, constituant les follicules
pré-antraux, puis les stades tertiaire et de De Graaf
représentant les follicules antraux (Hanzen et al., 2000;
Monniaux et al., 2009).
a) Follicule primordial
Le follicule primordial (figure 2),
centré par l'ovocyte I, est entouré de quelques cellules
folliculaires endothéliformes. Son diamètre moyen est de 40 um
(Hanzen et al., 2000). Habituellement localisé en
périphérie de l'ovaire, il représente le stade
folliculaire quiescent. L'ovocyte, de diamètre compris entre 20 et 35
um, se trouve bloqué au stade diplotène de la prophase I de la
première division de la méiose (Monniaux et al.,
2009).
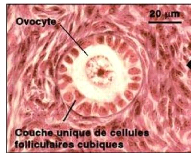
Figure 2 : Follicule primordial
Source :
http://mapageweb.umontreal.ca/cabanat/bio2460/Gametogenese.html
b) Follicule primaire
Il résulte de la transformation du follicule primordial
par augmentation du volume de l'ovocyte I, qui est entouré d'une couche
de cellules cubiques. Ces cellules synthétisent des
glycoprotéines qui formeront la zone pellucide. D'une épaisseur
d'environ 10 microns, elle est constituée à 95 % de trois
glycoprotéines, organisées en longs filaments
interconnectés, appelées ZP1, ZP2, ZP3. La taille du follicules
primaire atteint 60 à 80um et celle de l'ovocyte qu'ils contiennent 30
à 40 micromètres (Hanzen et al., 2000).
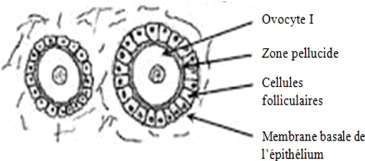
Figure 3 : Follicules primaires
Source :
http://mapageweb.umontreal.ca/cabanat/bio2460/Gametogenese.html
c) Follicule secondaire
Il est constitué d'un ovocyte volumineux,
enveloppé d'une zone pellucide complètement
différenciée. Celle-ci est entourée de plusieurs couches
de cellules cubiques formant la granulosa. La granulosa est limitée
à l'extérieur par la membrane de Slavjansky. L'ovocyte atteint
à ce stade son volume maximum. Le diamètre du follicule
secondaire est compris entre 200 et 400 um et celui de l'ovocyte est d'environ
60 um (Hanzen et al., 2000).
|
Ovocyte I
Zone pellucide Granulosa
Membrane de Slavjansky Thèque interne Thèque
externe
|
8
Figure 4 : Follicule secondaire
Source :
http://mapageweb.umontreal.ca/cabanat/bio2460/Gametogenese.html
d) 9
Follicule tertiaire
Il est appelé follicule cavitaire ou antral en raison
de l'apparition au sein des couches de cellules folliculaires de petites
cavités résultant de l'accumulation d'un transudat plasmatique et
de la sécrétion des cellules de la granulosa. Le follicule
atteint à ce moment la taille de 3 à 4 mm et l'ovocyte un
diamètre compris entre 100 et 130 um (Hanzen et al., 2000).
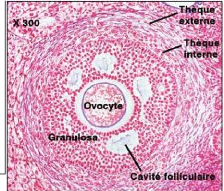
Figure 5 : Follicule tertiaire
Source :
http://mapageweb.umontreal.ca/cabanat/bio2460/Gametogenese.html
e) Follicule mûr ou follicule de De
Graaf
Il représente la phase terminale du
développement folliculaire. Cette phase ne concerne qu'un follicule sur
1000 entrés en croissance. Ce follicule ne peut être
observé que pendant le proestrus (Cuq et Agba, 1975). C'est au cours de
cette phase que les cavités finissent par confluer pour former l'antrum.
Le développement progressif de l'antrum entraîne la
séparation des cellules de la granulosa qui se différencient en
outre en corona radiata, couche cellulaire entourant directement l'ovocyte et
en cellules du cumulus oophorus. La taille du follicule mûr est de 10
à 12 mm chez le zébu (Sartorelli et al., 2005).
Zone granulosa
Cumulus oophorus
Corona radiata
Ovocyte
Antre et liquide folliculaires
Thèque interne Thèque externe
10
Figure 6: Follicule mûr ou de De
Graaf
Source :
http://mapageweb.umontreal.ca/cabanat/bio2460/Gametogenese.html
Tout au long du développement folliculaire, l'ovocyte
et les cellules de la granulosa qui l'entourent gardent un contact
étroit grâce à l'existence de prolongements cytoplasmiques
des cellules de la granulosa qui traversent la zone pellucide et viennent
s'apposer contre la membrane plasmique de l'ovocyte. La présence de
jonctions communicantes «gap junctions» à ces niveaux de
contact est responsable d'un véritable couplage métabolique entre
ces deux types cellulaires, permettant des échanges d'ions et de petites
molécules de poids moléculaire inférieur à 1 kD
(Monniaux et al., 2009).
II.2.1.1.2. Dynamique de la croissance
folliculaire
La population des follicules ovulatoires se renouvelle au
cours du cycle oestral par une succession de croissance ou de régression
folliculaires successives (Sartori et Barros, 2011 ; Ghinter et al.,
2014) appelées « vagues folliculaires ».
a) Vagues de croissance folliculaires
Une vague folliculaire correspond à la croissance
synchrone d'une cohorte de follicules, suivie de la sélection d'un ou de
plusieurs follicules qualifiés de follicules dominants et de leur
évolution vers l'ovulation, ou de leurs régressions successive
quand les conditions endocriniennes sont défavorables (phase
lutéale du cycle ou gestation) (Monniaux et al., 2009).
Chez la vache, le cycle comporte le plus souvent 2, voire 3
vagues apparaissant respectivement aux jours 2 et 11 ou aux jours 2, 9 et 16 du
cycle respectivement (figure 7). Au cours de chaque vague, on
assiste à l'émergence de plusieurs follicules de diamètre
supérieur ou égal à 4 mm, parmi lesquels apparaîtra
le follicule préovulatoire issu de la dernière vague (Ginther
et al., 2013).
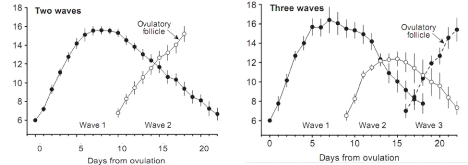
FollicleDiameter(mm)
11
Figure 7 : Vagues de croissances folliculaires chez la
vache
Source : Ginther et al. (2013)
Au cours de la période pré-pubertaire, la
croissance folliculaire se déroule sous la forme des vagues ; cependant,
tous les follicules sont anovulatoires à cause d'une insuffisance de
l'hormone LH (Savio et al., 1988). Des études ont
également montré l'émergence des vagues de croissance
folliculaire pendant la gestation mais sans phénomènes de
sélection ni de dominance (Ginther et al., 1989).
b) Notions et mécanismes de recrutement,
sélection et dominance
Chaque vague de croissance folliculaire comprend trois phases
: recrutement, sélection et dominance (figure 8).
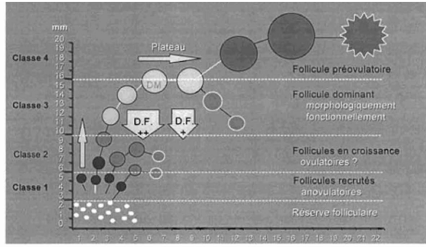
12
Figure 8 : Notion de recrutement, sélection et
dominance d'un follicule chez la vache
Source : Lucy et al.
(1992)
Lors de la première phase (recrutement), 2 à 3
follicules de diamètre compris entre 3 et 6 mm émergent d'un
groupe de follicules tertiaires et deviennent dépendante de l'hormone
FSH (Driancourt et al., 1991).
La sélection est l'émergence du ou (des)
follicule(s) ovulatoire(s) parmi les follicules recrutés. Ceux-ci
commencent à sécréter des oestrogènes et de
l'inhibine ; ces hormones exercent un rétrocontrôle négatif
sur l'hypophyse, abaissant ainsi la sécrétion de la FSH à
un niveau inférieur aux besoins folliculaires. A l'exception du ou (des)
follicule(s) sélectionné(s) capable(s) de se développer en
présence d'un faible taux de FSH, les autres follicules entrent en
atrésie (Driancourt et al., 1991).
Pendant la dernière phase, le follicule acquiert les
récepteurs de LH dans ses cellules de la granulosa et devient dominant
(Monniaux et al., 2009). La dominance est à la fois
morphologique et fonctionnelle. Elle est qualifiée de morphologique
parce qu'elle est exercée par le plus gros follicule présent sur
l'un ou l'autre ovaire. Elle est fonctionnelle parce que le follicule dominant
est le seul qui soit capable de provoquer la régression des follicules
en croissance et d'inhiber le recrutement de nouveaux follicules (Sirois et
Fortune, 1988) et d'ovuler dans un environnement hormonal approprié. Le
follicule dominant cohabite sur le même ovaire avec 2 à 4
follicules de diamètre compris entre 4 et 8 mm et environ 20 à 80
autres follicules de diamètre compris entre 1 et 3 mm. Cliniquement, la
présence sur les
13
ovaires de plus de 10 follicules de diamètre compris
entre 3 et 8 mm permet d'exclure celle d'un follicule fonctionnellement
dominant.
II.2.1.1.3. Régulation de la croissance
folliculaire
Chez les mammifères, il existe deux phases successives
dans la croissance des follicules : la folliculogenèse basale et la
folliculogenèse terminale (Monniaux et al., 2009).
a) Folliculogenèse basale ou phase gonadotrope
indépendante
Elle concerne le développement des follicules du stade
primordial au stade pré-antral. A ce stade, on note l'absence du
rôle essentiel des hormones gonadotropes. En effet, l'inhibition de la
libération de la FSH chez la vache n'empêche pas l'identification
des follicules de diamètre compris entre 6 et 7 mm (Webb et
al., 1994). La FSH agirait davantage sur la régulation des
capacités de synthèse et de la maturation des cellules de la
granulosa (Driancourt et al., 1991). Cette phase serait
contrôlée par de nombreux facteurs de croissance d'origine
ovocytaire et somatique, agissant essentiellement selon un mode paracrine de
régulation. C'est au cours de cette phase que s'effectue l'essentiel de
la croissance de l'ovocyte, à partir d'un diamètre initial de 20
à 30 microns, et que l'ovocyte acquiert la compétence
méiotique, c'est-à-dire la capacité à reprendre la
méiose (bloquée au stade diplotène) quand il est extrait
de son follicule (Monniaux et al., 2009).
b) Folliculogenèse terminale ou
gonadotrope-dépendante
Elle est strictement dépendante de la présence
de FSH et, pour les stades terminaux de maturation du follicule
pré-ovulatoire, de la présence de LH. Elle débute chez la
vache lorsque les follicules ont atteint un diamètre de 3 à 4 mm.
L'apparition de récepteurs de LH sur les cellules de granulosa est la
«signature» d'une maturité complète du follicule, qui
devient apte à ovuler. C'est au cours de cette phase que s'effectue la
sélection du ou des follicule(s) destiné(s) à ovuler,
grâce à un ensemble de mécanismes dont la finalité
biologique est de réguler le nombre d'ovulations caractéristique
de chaque espèce et de chaque race (Monniaux et al., 2009).
II.2.1.2. Atrésie folliculaire
Encore appelée involution folliculaire, elle constitue
le devenir de la majorité (99.9 %) des follicules présents dans
l'ovaire des mammifères. Elle joue donc indirectement un rôle
important dans la régulation du taux d'ovulation. Cytologiquement, elle
n'est identifiable que chez les follicules antraux par la mise en
évidence de pycnose (grains de chromatine
14
condensée) ou d'apoptose (corps apoptotiques) dans les
cellules de la granulosa des follicules à antrum ou par l'identification
de processus dégénératifs (opacification) au niveau de
l'ovocyte. Biochimiquement, elle s'accompagne d'une augmentation des
concentrations en enzymes lysosomales et en glycosaminoglycanes ainsi que d'une
diminution des concentrations en oestradiol (Monniaux et al.,
1999).
II.2.1.3. Ovulation et maturation du complexe
cumulus-ovocyte
II.2.1.3. 1. Ovulation
L'ovulation est un processus complexe au cours duquel sont
induites à la fois la reprise de la méiose de l'ovocyte,
l'expansion du cumulus, la rupture du pôle apical du follicule et la
restructuration tissulaire associée à la différenciation
cellulaire nécessaire à la formation du corps jaune. Seuls les
follicules qui expriment de nombreux récepteurs de LH à la
surface des cellules de la granulosa sont capables d'ovuler en réponse
au pic préovulatoire de LH (Monniaux et al., 2009). L'ovulation
se produit 27 heures après la décharge de la LH chez la vache
(Sartori et Barros, 2011).
II.2.1.3.2. Maturation du complexe ovocyte-cumulus
En réponse au pic préovulatoire de la LH,
l'ovocyte entre en phase de maturation. La reprise de la méiose
s'accompagne de modifications structurales et biochimiques au sein du
cytoplasme, et est associée à une différenciation des
cellules du cumulus. Au cours de la folliculogenèse, depuis la formation
du follicule primordial jusqu'à la phase de croissance finale du
follicule dominant, l'ovocyte est bloqué en prophase de la
première division méiotique. Ce blocage est maintenu
essentiellement par un niveau élevé d'AMPc (Adénosine
3':5'-Mono Phosphate Cyclique intra-ovocytaire (Norris et al., 2008).
Dans le follicule, ce facteur inhibiteur transite des cellules de la granulosa
au cumulus et à l'ovocyte par des jonctions communicantes.
La reprise de la méiose survient spontanément
in vitro lorsque le complexe cumulus-oophorus est sorti du follicule
et résulterait de l'arrêt de l'apport du facteur inhibiteur.
In vivo, le pic pré-ovulatoire bloque le passage d'AMPc entre
les cellules folliculaires et l'ovocyte permettant ainsi la maturation
nucléaire. La maturation du complexe ovocyte-cumulus peut être
évaluée à plusieurs niveaux.
a) 15
Maturation nucléaire
La rupture de la vésicule germinale (Germinal
Vesicle Break Down ou GVBD) est le premier signe visible de maturation.
Elle se produit dans les heures qui suivent le pic préovulatoire de LH
et elle commence par un plissement de l'enveloppe nucléaire. Les pores
nucléaires disparaissent puis l'enveloppe se fragmente avant
d'être dégradée (en 3 h chez la souris, 6 h chez les
bovins). Le nucléole disparaît rapidement au contact du
cytoplasme. Le fuseau se forme depuis les MTOCs (Microtubule Organizing
Center, équivalent du centrosome dans l'ovocyte) et ses tubules
s'ancrent sur les chromosomes qui se distribuent sur la plaque
métaphasique de la première division méiotique
(métaphase I). L'anaphase et la télophase sont rapides, les
chromosomes homologues se séparent et migrent aux pôles du fuseau,
dont l'un provoque une boursouflure de la membrane qui deviendra le premier
globule polaire. Après la télophase, les chromosomes de l'ovocyte
se répartissent rapidement sur une plaque métaphasique alors que
se forme le second fuseau méiotique (Terret et Wassmann, 2008). Le
globule polaire contenant la moitié du complément chromatinien
est expulsé dans l'espace périvitellin. C'est à ce stade
qu'intervient l'ovulation chez la plupart des mammifères.
b) Maturation cytoplasmique
Elle est caractérisée par la multiplication des
mitochondries, l'apparition d'un appareil de Golgi bien développé
et la migration des granules corticaux vers la périphérie de
l'ovocyte. Ces granules corticaux contiennent un ovopéroxidase qui, lors
de la fécondation, a pour effet d'empêcher la polyspermie
(Yoshida et al., 1993).
c) Maturation membranaire
Elle comprend l'ensemble des processus permettant la
reconnaissance spécifique de l'ovocyte par le spermatozoïde, mais
également l'expansion du complexe cumulus-oophorus. Le cumulus
expansé constitue un micro-environnement protecteur pour l'ovocyte et
assure la captation du complexe par le pavillon de la trompe suite à
l'ovulation (Tanghe et al., 2002).
Arrivé à ce stade de maturation
nucléaire, cytoplasmique et membranaire, l'ovocyte est susceptible
d'être fécondé s'il est mis en présence de
spermatozoïdes ayant eux-mêmes subi la capacitation et la
réaction acrosomiale.
16
II.2.1.4. Formation et évolution du corps
jaune
Le corps jaune se forme immédiatement après
l'ovulation : l'ovocyte est expulsé du follicule ovulatoire qui est
alors transformé en corps jaune. L'évolution du corps jaune peut
se découper en trois temps : une période de croissance de 4
à 5 jours pendant laquelle il est insensible à la prostaglandine
F2á ; une période de maintien d'activité de 8 à 10
jours et enfin, s'il n'y a pas eu fécondation, une période de
lutéolyse (environ à J17) d'abord brutale puis plus progressive
en 24 à 48 heures. Et en cas de gestation, le corps jaune cyclique est
transformé en corps jaune gestatif (Stouffer, 2006).
II.2.2. Régulation hormonale de la fonction
ovarienne
La maturation folliculaire et l'ovulation sont
contrôlées par le système hypothalamo-hypophysaire qui
intègre les informations de différents facteurs endogènes
(signaux hormonaux et nutritionnels) et exogènes (photopériode,
température, stress... ) (Monniaux et al., 2009). Il existe une
interaction globale entre les activités du système
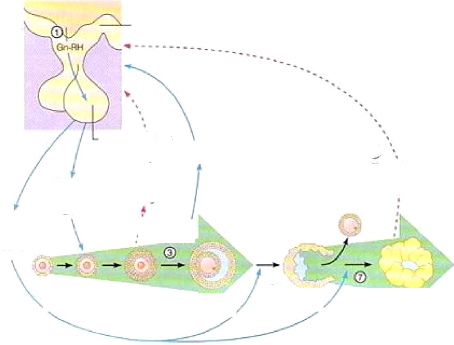
hypothalamo-hypophysaire et celles des ovaires (figure 9). Le contrôle de
l'activité endocrine de l'ovaire est basé sur un ensemble de
rétrocontrôle entre l'ovaire et le système
hypothalamo-hypophysaire qui fait intervenir des hormones (Marieb, 1999).
L'hypophyse et plus précisément
l'adénohypophyse secrète les gonadotropines, LH et FSH. La
sécrétion de ces hormones est sous le contrôle de la GnRH,
une neurohormone secrétée directement dans les capillaires
sanguins de la tige pituitaire. La GnRH synthétisé par les
neurones de l'hypothalamus stimule la synthèse et la
sécrétion de FSH et LH en se fixant sur les récepteurs
situés à la surface des cellules gonadotropes. La LH permet la
luteinisation des cellules du follicule et stimule le follicule à
produire les androgènes. La FSH stimule l'aromatisation des
androgènes en oestrogènes et stimule la croissance folliculaire.
Son action s'exerce plus sur les follicules antraux que sur les follicules
pré-antraux présents au sein de la même cohorte de
recrutement (Richards et al., 1987).
Les stéroïdes, en particulier l'oestradiol
d'origine ovarienne, inhibent la sécrétion pulsatile de la GnRH
par un rétrocontrôle négatif. Cependant en fin de la
croissance folliculaire terminale et au-delà d'une concentration seuil,
l'oestradiol exerce une action positive sur le système
hypothalamo-hypophysaire. Il provoque à la fois une augmentation des
pulses de la GnRH, puis une libération massive de ce dernier, et une
augmentation importante de la sensibilité hypophysaire. L'association de
ces effets conduit à une décharge massive de LH qui
déclenchera l'ovulation des follicules pré-ovulatoires
présents sur l'ovaire. Après l'ovulation, le corps jaune se
forme, croît et secrète la progestérone qui exerce une
rétroaction
17
négative sur l'axe hypothalamo-hypophysaire, ce qui
empêche toute libération massive des gonadotropines hypophysaires.
En fin de la phase lutéale et en absence d'embryon dans l'utérus,
les prostaglandines secrétées induisent la lutéolyse. La
régression du corps jaune lève l'action inhibitrice de la
progestérone et un nouveau cycle commence (Marieb, 1999).
Afflux de
FSH et LH
Hypothalamus
OEstrogènes
Adéno-hypophyse
Taux d'oestrogènes élevés
OEstrogènes et progestérone
FSH et LH
Légère
augmentation des
taux
d'estrogènes
Follicule en voie de Ovulation Corps jaune
développement Follicule mûr
Légende :
Activation
Inhibition
Figure 9 : Enchaînement des rétroactions
réglant la fonction ovarienne
Source : Marieb, 1999 (Anatomie et
Physiologie humaines) p. 1066.
Les différentes aires de l'hypothalamus qui gouvernent
le comportement sexuel et la sécrétion de la GnRH sont
également au carrefour de nombreux systèmes de contrôle de
l'homéostasie, tels que le contrôle du poids corporel, du
comportement alimentaire et de la thermogénèse. Elles sont donc
capables d'intégrer toute perturbation du bilan
énergétique au niveau périphérique et de
réagir en modifiant un ensemble de fonctions physiologiques et de
comportements.
18
II.2.3. Évènements comportementaux
II.2.3.1. Saisonnalité
La plupart des mammifères présentent des cycles
annuels de reproduction caractérisés par la succession d'une
période d'activité sexuelle plus ou moins longue appelée
saison sexuelle et d'une période de repos, résultant de la mise
en silence de la fonction gonadotrope, appelée anoestrus saisonnier. La
reproduction des bovins est considérée comme peu
saisonnière car des mises-bas sont observées durant toute
l'année. Cependant, un regroupement marqué des naissances est
noté pendant la saison des pluies. En effet, cette saison correspond
à la période où le pâturage est abondant, ce qui
optimise les performances de reproduction (Kouamo et al., 2009). Ce
saisonnement de reproduction traduit une adaptation de la fonction de
reproduction au milieu.
II.2.3.2. OEstrus
L'oestrus est le résultat de l'action de l'oestradiol
sur le système nerveux central et amenant jusqu'aux manifestations
psychiques des chaleurs. Durant 14 à 18 heures, la vache est en oestrus,
elle est anxieuse et sans repos, son appétit diminue (Sartori et Barros,
2011).
La connaissance de l'anatomie et de la physiologie de l'ovaire
demeure un des pré-requis pour l'application des biotechniques de
reproduction assistée telles que l'insémination artificielle, la
synchronisation des chaleurs, le transfert d'embryon et la production in
vitro d'embryons.
19
B. PRODUCTION IN VITRO D'EMBRYONS
La production in vitro d'embryons nécessite la
collecte préalable des complexes ovocytes cumulus-oophorus (COCs)
à partir des ovaires. La qualité des follicules et des ovocytes
collectés à partir de ces ovaires est un pré-requis pour
la maturation et la fécondation in vitro des ovocytes (Boni,
2012).
I. Technique de collecte des ovocytes
Les ovocytes peuvent être collectés soit sur des
ovaires d'animaux abattus, soit sur des animaux vivants.
I.1. Collecte des ovocytes à partir des ovaires
prélevés sur des animaux abattus (ex vivo)
Les ovocytes peuvent être récoltés
à moindre coût pour la production in vitro d'embryons
à grande échelle (Agrawal et al., 1995) à partir
d'ovaires des vaches de tout âge y compris les foetus collectés
après abattage (Natumanya et al., 2008). Plusieurs techniques
de collecte ont été développées.
I.1.1. Aspiration des ovocytes
Dans cette technique, les follicules visibles sur l'ovaire
sont aspirés à l'aide d'une aiguille 18G (Gauge) et d'un
système d'aspiration (#177; 1 bar) ou d'une pompe à vide (100-150
mm Hg) (Satrapa et al., 2010).
I.1.2. Slicing des ovaires
Selon cette technique, les ovaires sont placés dans une
boîte de pétri contenant 5 ml du Dubelcco Phosphate Buffered
Saline (DPBS). Des sections multiples sont faites sur la surface ovarienne
avec une lame de bistouri (Wang et al., 2007). Cette technique permet
de récupérer les ovocytes présents dans tous les
follicules quelle que soit leur localisation au niveau du cortex ovarien,
augmentant ainsi le rendement en ovocytes. Elle a pour inconvénient de
produire beaucoup de débris tissulaires, ce qui rend la recherche des
ovocytes difficile (Wani et al., 1999).
I.1.3. Ponction des follicules
Les ovaires, tenus par une pince, sont submergés dans
une solution physiologique (DPBS) contenue dans une boîte de
pétri, puis les follicules visibles sont ponctionnés par une
aiguille de 18-G et le fluide folliculaire est récupéré
(Wang et al., 2007).
20
I.1.4. Dissection des follicules
Les follicules antraux intacts ou partiels sont
disséqués et placés en maturation. Cette technique permet
d'exclure les follicules atrétiques et d'obtenir d'ovocytes de meilleure
qualité (Foudani et al., 1998).
I.2. Collecte des ovocytes par ovum pick-up (in
vivo)
Les ovocytes immatures peuvent aussi être
collectés par ponction des follicules ovariens visualisés sur
l'écran d'un échographe sur des vaches vivantes. Elle est
réalisée par voie transvaginale à l'aide d'un pistolet
muni d'une sonde à ultrasons et d'une aiguille rétractable
reliée à un système d'aspiration. C'est la technique de la
ponction échoguidée ou OPU (Ovum Pick Up). Elle a
l'avantage d'être utilisée sur des animaux de haute valeur
génétique, et peut être répétée deux
fois par semaine chez la même femelle pendant plusieurs mois
(jusqu'à cinq) sans affecter apparemment la fertilité
ultérieure des animaux. Son inconvénient réside dans le
fait qu'elle a des résultats incertains et le rendement en ovocyte est
faible.
II. Evaluation de la qualité des
ovocytes
La qualité des ovocytes est définie selon cinq
niveaux (Sirard et al., 2006) :
- aptitude à reprendre la méiose ;
- aptitude à se diviser après la fécondation
;
- aptitude à se développer jusqu'au stade
blastocyste;
- aptitude à induire une gestation jusqu'à son
terme ;
- aptitude à développer l'embryon à terme et
en bonne santé.
Une évaluation fonctionnelle est toutefois difficile
à déterminer au moment de la
collecte des ovocytes. Plusieurs stratégies ont
été employées dans l'optique de fournir une valeur
prédictive du potentiel des ovocytes collectés pour la production
in vitro d'embryons. Les méthodes non invasives comme le
diamètre folliculaire et la morphologie des COCs ont été
utilisées comme critères de sélection des ovocytes de
bonne qualité.
II.1. Evaluation des ovocytes sur la base du
diamètre des follicules
Le diamètre folliculaire a été largement
utilisé comme un paramètre de sélection des ovocytes. Des
études ont établi une relation entre la taille du follicule et la
compétence au développement de l'ovocyte. La ponction des
follicules antraux est utilisée chez la vache à partir des
follicules de diamètre compris entre 3 et 8 mm (Abraham et al.,
2012). En effet, les follicules en dessous de 3 mm de diamètre donnent
un faible pourcentage d'ovocytes aptes à
21
acquérir la compétence méiotique. De
même, la dégénérescence des ovocytes suite à
l'atrésie des follicules est plus fréquente dans les follicules
de diamètre inférieur à 3 mm et supérieure à
6 mm (Anguita et al., 2007).
II.1. Evaluation sur la base des caractéristiques
morphologiques du cumulus oophorus
Après collecte ex vivo ou in vivo,
les ovocytes peuvent être dénudés ; mais, ils sont
généralement entourés d'une quantité plus ou moins
abondante de cellules de la corona radiata et du cumulus oophorus. Les ovocytes
sont classés selon la morphologie des COCs c'est-à-dire le nombre
de couches de cellules du cumulus oophorus et l'aspect du cytoplasme
évalué sur la base de l'aspect des noyaux. Les ovocytes
présentant un cytoplasme homogène sont davantage associés
à des COCs compacts. Inversement, un cytoplasme d'aspect granuleux et
polarisé, correspondant à une distribution
irrégulière de gouttelettes lipidiques et d'organelles
intracellulaires, est davantage associé à des follicules
atrétiques et à des COCs expansés (Salomone et
al., 1999). Selon ces critères, les ovocytes sont classés en
quatre qualités (De Loose et al., 1989 ; Alves et al.,
2014).
- Qualité 1 (Q1) : Cumulus pluristratifié (plus
de trois couches) compacté et un cytoplasme homogène ;
- Qualité 2 (Q2) : Cumulus compacté à une
ou deux couches et un cytoplasme moins homogène ;
- Qualité 3 (Q3) : couche des cellules
irrégulières avec un peu du cumulus oophorus moins
compacté et un cytoplasme moins régulier avec des zones sombres
;
- Qualité 4 (Q4) : absence de cumulus oophorus ou
expansé, cytoplasme irrégulier avec des zones sombres.
Le critère de sélection basé sur la
morphologie des COCs est important pour la réussite de la maturation
in vitro.
II. 2. Choix des ovocytes pour la maturation et la
fécondation in vitro
Les ovocytes et le cumulus oophorus (cellules somatiques
entourant l'ovocyte) sont reliés par des jonctions communicantes
permettant l'inter-échange des molécules et nutriments entre ces
cellules (Norris et al., 2008). L'efficacité de la production
in vitro d'embryons (PIV) est influencée significativement par
la qualité des ovocytes. Les COCs utilisés pour la PIV sont les
COCs de qualité 1 et 2, c'est-à-dire entourés d'un cumulus
compact (composé de 3 à 4 couches de cellules couvrant la zone
pellucide) et ayant un cytoplasme homogène (Cetica et al.,
1999; Wang et al., 2007). De nombreuses études ont
22
montré que la compétence au développement
est proportionnelle à la qualité du complexe cumulus oophorus
ovocyte avec une différence des taux de développement
significatif entre les COCs des classes 1 et 2 acceptables d'une part et
d'autre part les COCs de classes 3 et 4 (Cetica et al., 1999).
III. Maturation in vitro des
ovocytes
L'objectif est d'obtenir la maturation nucléaire et
surtout cytoplasmique des ovocytes ayant déjà acquis la
compétence complète pour reprendre la méiose. Les cellules
des complexes cumulus oophorus ovocytes de qualité 1 et 2 sont mises en
maturation in vitro dans le milieu TCM 199 (Abraham et al.,
2012), milieu tamponné au bicarbonate, contenant des sels
minéraux, des sources de carbone et d'énergie (glucose,
glutamine) ainsi que des acides aminés et des vitamines. L'albumine
sérique bovine (BSA) ainsi que des liquides biologiques complexes
(sérum bovin foetal : 10 et sérum d'une femelle en oestrus : 10%)
et des antibiotiques (gentamycine (75ug/ml) (Satrapa et al., 2010)
sont souvent ajoutés à ce milieu dont l'effet empêche
l'adhésion des complexes cumulus ovocytes entre eux et au support de
culture.
IV. Fécondation in vitro des
ovocytes
La fécondation des ovocytes matures s'effectue avec
des spermatozoïdes qui ont subi au préalable la capacitation. Il
s'agit de l'entrée du spermatozoïde dans l'ovocyte permettant
l'incorporation du contenu nucléaire mâle dans le gamète
femelle. La fécondation in vitro est réalisée en
puits (20 à 30 ovocytes) ou en microgouttes (20 ul) en présence
de 106 spermatozoïdes par ml. L'incubation dure 18 à 24
heures dans une atmosphère modifiée contenant 5% de C02 à
38.8° C (Abraham et al., 2012).
V. Culture des embryons
La culture des embryons est une étape cruciale pour la
production d'embryons in vitro. Chez les mammifères
domestiques, c'est au stade blastocyste que l'embryon est transférable
dans l'utérus de la femelle receveuse. La culture jusqu'à ce
stade est donc indispensable. C'est également à ce stade que
l'embryon est apte à supporter la
congélation/décongélation. Les zygotes obtenus sont mis en
culture dans un milieu contenant tous les composés dont l'embryon a
besoin.
23
VI. Facteurs de variation de la population folliculaire,
du rendement et de la qualité ovocytaires
Les facteurs tels que la race, l'âge, le niveau
hormonal, le stade de reproduction et la nutrition ont été
cités antérieurement comme influençant la population
folliculaire et le rendement en ovocytes des différentes espèces
d'animaux domestiques.
IV.1. Facteurs ovariens IV.1. 1. Corps jaune
Plusieurs études ont montré l'effet du corps
jaune sur la population folliculaire. Les résultats sont parfois
controversés. La présence du corps jaune (Dominguez, 1995;
Natumanya et al., 2008) ou son diamètre (Hanzen et
al., 2000) n'affecte pas le développement des follicules ovariens
sur l'ovaire hétérolatéral ou ipsi-latéral. Par
contre, d'autres auteurs ont montré que l'activité folliculaire
serait plus grande sur l'ovaire porteur de corps jaune que sur l'ovaire
hétérolatéral chez la vache pendant le cycle oestral
(Driancourt et al., 1991) ; et pour d'autres encore, l'ovaire
hétérolatéral au corps jaune a plus de follicules ovariens
chez le dromadaire (Abdoon, 2001), chez la chèvre (Swchwarz et Wierzcho,
2010) et chez la brebis (Shabankareha et al., 2010). Lors de la
gestation cependant, le corps jaune exerce une influence négative sur la
croissance des follicules de diamètre supérieur à 7 mm sur
l'ovaire ipsi- latéral (Pierson et Ginther, 1987a).
Le rendement et la qualité des ovocytes ne sont pas
affectés par la présence du corps jaune sur l'ovaire des vaches
de races Bos Taurus (Dominguez, 1995) et Bos Indicus
(Natumanya et al., 2008). Mais, d'après Samad et Raza
(1999), Wani et al. (2000) et Abdoon (2001), les ovaires
possédant un corps jaune ont un rendement plus faible en ovocytes que
les ovaires sans corps jaune chez la bufflesse, la brebis et la femelle du
dromadaire.
IV.1.2. Disposition des follicules dans le cortex
ovarien
Une coupe d'ovaire permet de visualiser les follicules
ovariens qui se présentent depuis leur stade initial ou follicule
primordial jusqu'au stade de follicule mûr ou dominant, libérant
l'ovocyte. L'apparition de follicules en surface de l'ovaire semble
dépendre de la profondeur du cortex à laquelle ils sont
localisés. Les follicules se développent toujours dans la partie
corticale de l'ovaire avec une variabilité de distribution entre cette
zone (Derivaux et Ectors, 1989). Ainsi, si chez certaines races ces follicules
sont en majorité en localisation sub-superficielle et donc visibles en
surface à 1 mm de profondeur, chez d'autres comme c'est le
24
cas chez la bufflesse, ils sont distribués à
différents niveaux du cortex mais majoritairement en profondeur, par
conséquent non visibles en surface (Kumar et al., 1997).
IV.1.3 Diamètre des follicules
Le diamètre des follicules influence la qualité
des ovocytes. Des études ont montré une fréquence plus
élevée de la maturation in vitro des ovocytes
récoltés à partir des follicules de diamètre
supérieur à 3 mm qu'à partir de ceux
récoltés sur follicules de diamètre inférieur
à 2 mm. En effet, Les ovocytes provenant des follicules de
diamètre inférieure à 2 mm sont caractérisés
par une maturation cytoplasmique et moléculaire incomplète
(Sirard et al., 2006). La morphologie des COC's change durant la phase
de croissance et de régression des follicules ; les ovocytes
expansés ou nus sont plus observés dans les follicules
atrétiques (Salomone et al., 1999) tandis que, les ovocytes
ayant 3 à 4 couches des cellules du cumulus oophorus sont
observés dans les follicules antraux qui répondent à la
FSH (Blondin et Sirard, 1995). Les travaux de Laizeau (2003) et de Machatkova
et al. (2004) ont également montré que la
présence d'un follicule dominant affecte négativement le
rendement et la qualité en ovocyte.
IV.2. Facteurs non ovariens
IV.2.1. Race
La race est un facteur qui influence la population
folliculaire. En effet Selon Silva-Santos et al. (2011), le nombre des
follicules varie d'une race à une autre et entre les individus d'une
même race. Ainsi, Les travaux de Dominguez (1995) ont montré que
les races européennes ont plus de gros follicules que les zébus
ou produits de leur croisement. Par contre, le nombre de petits follicules ne
diffère pas au sein des groupes. Lucci et al. (2002) ont
révélé par exploration histologique que les zébus
ont une population folliculaire en particulier les follicules
pré-antraux, quantitativement similaire à celle observée
chez les taurins tropicaux. Cependant, des différences sont
observées au niveau des follicules antraux. Ghinter et al.
(1996) ont observé au début de chaque vague folliculaire, 24
petits follicules antraux (3-5 mm) chez la vache Bos taurus alors que
41,5 ont été observés pendant l'émergence des
premières vagues folliculaires du développement folliculaire chez
le zébu Nellore (Sartori et Barros, 2011). Le diamètre des gros
follicules diffère également entre les races ; il est plus petit
(10-12 mm) chez le zébu Nellore que chez la vache Holstein (16-20mm)
d'après Carvalho et al. (2008).
25
Les ovocytes issus des vaches à haut niveau
génétique donnent après maturation et fécondation
in vitro un taux plus élevé des blastocytes par rapport
à ceux prélevés sur des vaches à niveau
génétique moyen (Snijders et al., 2000). Anna et
al. (2013) n'ont pas observé de différence significative en
terme de rendement ovocytaire entre les races Katjang, croisé Boer et
métis chez l'espèce caprine.
IV.2.2. Age
Il ressort de nombreux travaux que l'âge influence de
façon significative la population folliculaire chez la vache. Le nombre
des follicules de diamètre compris entre 2 et 8 mm comptés chez
les vaches adultes âgées de plus de 9 ans est significativement
inférieur à celui des génisses (Lucyna et Zdzislaw, 1984;
Natumanya et al., 2008).
L'âge de la donneuse est un facteur significatif qui
influence la compétence au développement de l'ovocyte (Armstrong,
2001). Il a été démontré que le pourcentage des
oeufs qui arrivent au stade blastocyste est plus faible quand les ovocytes sont
issus des génisses par rapport à ceux issus des vaches
âgées (Armstrong, 2001).
Samad et Raza (1999), Wani et al. (1999) et Anna
et al. (2013) ont trouvé que l'âge n'affecte pas le
rendement et la qualité des ovocytes chez la bufflesse, la brebis et la
chèvre. Par contre la quantité des ovocytes et leur
qualité diminuent avec l'âge (Lucyna et Zdzislaw, 1984 ; Natumanya
et al., 2008) chez les bovins.
IV.2.4. Note d'état corporel (NEC)
La NEC traduit l'état nutritionnel et l'état
d'engraissement de l'animal à travers la quantité de graisses
accumulée sous la peau. Elle est utilisée dans la gestion du
troupeau afin de connaître son statut nutritionnel. Les facteurs
nutritionnels ont été étudiés chez les animaux afin
de déterminer leur effet sur la fertilité et les
paramètres de reproduction. Il ressort de ces études que les
vaches dont l'alimentation est pauvre présentent des follicules
dominants de petite taille et un régime riche en énergie augmente
la vitesse de croissance folliculaire (Armstrong, 2001). Les vaches ayant une
bonne NEC (3 à 5) ont plus de follicules en développement
comparés aux vaches ayant une NEC de 2 (Dominguez, 1995; Drion et
al., 1996; Natumanya et al., 2008).
Des études ont montré une relation entre la note
d'état corporel et la production des ovocytes. Ainsi, les
résultats de Dominguez (1995) ont montré qu'une NEC faible (<
à 2) influence négativement le rendement et la qualité des
ovocytes. En effet, la qualité des ovocytes dépend des conditions
nutritionnelles sous lesquelles le follicule a commencé son
développement, c'est-à-dire au moment de son recrutement dans la
vague folliculaire. La
26
durée de croissance d'un follicule à un
follicule pré-ovulatoire est entre 84 et 85 jours chez la vache Holstein
(Al-Katanani et al., 2002). Ainsi, les follicules qui entament leur
croissance sous des conditions nutritionnelles déficientes
hébergent des ovocytes inaptes à poursuivre un
développement normal lorsqu'ils sont fécondés in
vitro. Ainsi, la proportion des ovocytes de bonne qualité (I et II)
est proportionnelle à la NEC (Dominguez, 1995).
IV.2.4. Statut physiologique
Les deux études consacrées à la
cinétique de la croissance folliculaire pendant les premières
semaines de gravidité (Savio et al., 1988 ; Ginther et al.,
1989) ont identifié, comme pendant le cycle sexuel et malgré
la présence continue d'une imprégnation progestéronique,
des vagues de croissance folliculaire tous les 8 à 10 jours mais sans
phénomènes de sélection ni de dominance. L'une d'entre
elles a observé une réduction de la croissance folliculaire sur
l'ovaire ipsi-latéral au corps jaune 17 à 24 jours après
la fécondation (Savio et al., 1988 ). Certains estiment
l'embryon responsable de cet effet (Driancourt et al., 1991). Il
serait médié par la BPL (Bovine Placental Lactogen)
secrétée par les cellules binuclées trophoblastiques et
dont l'effet inhibiteur sur la croissance folliculaire préovulatoire a
été démontré (Lucy et al., 1992). Une
étude a confirmé la persistance des vagues de croissance
folliculaire entre le 4e et le 9e mois de
gravidité chez la vache. Cependant, la taille du follicule dominant
diminue au cours de cette période et le plus souvent aucun follicule de
diamètre supérieur à 6 mm n'est détecté sur
les ovaires au cours des trois dernières semaines de gestation (Ginther
et al., 1996).
Certains auteurs ont observé une augmentation du nombre
de follicules de diamètre compris entre 4 et 8 mm entre le 7e
et le 42e jour postpartum. Spicer et Echterkamp (1996) ont
montré que le nombre de follicules moyens (5 à 9 mm) et celui des
gros follicules (> à 10 mm) est plus élevé chez les
vaches non gravides que les gravides et ce nombre diminuait graduellement du
premier au troisième trimestre de gravidité.
Plusieurs travaux ont montré que la qualité des
ovocytes et le rendement en ovocytes dépendent du statut physiologique
de la femelle. Abdoon (2001) a montré que le nombre des ovocytes
ponctionnés chez la femelle du dromadaire gravide est significativement
inférieur à celui obtenu à partir de la femelle non
gravide. Un grand nombre ou pourcentage d'ovocytes nus (qualité non
sélectionnée pour la FIV) est obtenu à partir des ovaires
de la femelle du dromadaire en anoestrus ou en période de
gravidité. Le statut physiologique n'influence pas le rendement ni la
qualité des ovocytes chez les races européennes (Dominguez, 1995)
et le zébu Ankole (Natumanya et al., 2008).
27
V.3. Autres facteurs de variations du rendement et de la
qualité des ovocytes V.3.1. Technique de collecte
Le rendement en ovocytes varie selon la technique
utilisée: 5,8 ovocytes ont été collectés par ovaire
en utilisant l'aspiration directe des follicules apparents. Ce rendement passe
significativement à 9,6 ovocytes par la technique de slicing (Wang
et al., 2007).
V.3.2. Temps et température de transport.
La température à laquelle sont conservés
les ovaires pendant leur transport a également fait l'objet
d'étude. En effet, l'évaluation de la morphologie du cumulus
oophorus et l'apoptose des cellules de la granulosa montre que les ovaires ne
devraient pas être conservés plus de 3 heures entre 20 et
30°C afin d'éviter l'apoptose des cellules de la granulosa et les
modifications morphologiques du cumulus oophorus (Pedersen et al.,
2004).
28
CHAPITRE II : MATÉRIEL ET MÉTHODES
I. Site de l'étude
L'étude a été réalisée
pendant la période de novembre 2013 à juillet 2014 à
l'abattoir municipal de Ngaoundéré et au laboratoire de
physiologie et biotechnologie de la reproduction de l'IRAD-WAKWA dans la
Région de l'Adamaoua. Ngaoundéré est situé entre la
latitude 7° 19' 39 N et la longitude 13° 35' 4 E. Le climat est de
type soudano-sahélien et est caractérisé par une saison
sèche de novembre à mars et une saison de pluies d'avril à
octobre. La pluviométrie moyenne est de 1496,7 mm par an. La moyenne des
températures minimales enregistrées est de 15,2 ° C et celle
des températures maximales est de 29 ° C (station
météorologique de Ngaoundéré).
II. Animaux
Cette étude a porté sur 201 vaches qui
provenaient principalement du département de la Vina (Région de
l'Adamaoua) et du département du Mayo- Rey (Région du Nord).
Seules les vaches zébus ont été
considérées.
Dans les zones d'origine, les animaux sont
élevés de façon extensive. Ils paissent dans les
pâturages communautaires à l'exception des ranchs qui disposent
d'étendues plus ou moins délimitées et
clôturées. Bien que les éleveurs soient de plus en plus
sédentarisés, il existe encore des clans nomades (Mbororo
notamment) mais presque tous les éleveurs pratiquent la transhumance en
saison sèche, à la recherche d'eau et du fourrage pour leurs
animaux. A côté de cela, se trouvent également d'autres
systèmes notamment les systèmes semi-extensif et intensif
où on note l'intervention de l'homme dans l'amélioration des
performances de production et de reproduction à travers la
complémentation et la supplémentation de l'aliment, l'application
d'un programme de prophylaxie et la pratique des inséminations
artificielles. Les soins vétérinaires sont limités aux
campagnes de masse (vaccinations contre les épizooties, traitements
curatifs et préventifs contre les trypanosomoses, etc...).
29
III. Protocole expérimental III.1. Identification
de la race
La race a été identifiée sur les bases
des caractéristiques phénotypiques telles que décrites par
Lhoste (1969).
a) Zébu Goudali
Il s'agit d'un zébu de taille moyenne dont la bosse
est en général assez développée et tombante, la
tête assez longue et étroite et le profil légèrement
convexe. L'encolure est assez courte, le cornage court et plutôt fin. Le
fanon est assez développé. La conformation pour la viande est
assez satisfaisante grâce à un bon développement des masses
musculaires de l'arrière-main. Le squelette est en général
assez léger, la robe est le plus souvent tachetée de rouge; le
noir se rencontre rarement. La répartition du rouge est variable depuis
des types presque blancs avec seulement quelques mouchetures jusqu'à des
types uni-rouge ou brun.

Photo n ° 2 : Zébu Goudali
b) Zébus M'Bororos
Les zébus M'Bororos sont des animaux de grand format.
La tête est longue et le cornage, long et puissant, présente en
général une forme de lyre haute. L'encolure est longue et peu
musclée ; la croupe est peu charnue, la poitrine est étroite mais
profonde. Parmi ces groupes se distinguent trois races :
30
- zébu Akou ou white fulani
C'est un animal de grand format, de robe blanche parfois
mouchetée avec des muqueuses foncées. Le mufle, les oreilles et
les onglons sont en général noirs.

Photo n ° 3 : Zébu White Fulani -
zébus Djafoun ou Red fulani
La variété Djafoun est
caractérisée par une robe acajou uniforme et par des cornes en
forme de lyre implantées haut.

Photo n ° 4 : Zébu Red Fulani
31
c) Zébu Bokolo
C'est un animal de taille moyenne caractérisé
par une robe crème, une bosse peu développée et l'absence
des cornes.

Photo n ° 5 : Zébu Bokolo
III.2. Provenance des animaux
D'après les enquêtes menées auprès
des bouchers à l'abattoir, 61% des animaux étudiés
provenaient du département de la Vina et 39% du département du
Mayo Rey. Ces origines correspondent en réalité aux
marchés à bétail où les achats des animaux ont
été effectués ; les origines réelles des animaux
étaient difficiles à déterminer du fait qu'un même
animal peut transiter par plusieurs marchés à bétail.
III.3. Poids des vaches
Avant l'abattage, le périmètre thoracique (PTHO)
de chaque vache a été mesuré avec le mètre ruban.
Le poids a été calculé selon la formule : poids (kg) =
124,69 - 3,171 x PTHO + 0,0276 x PTHO2 (Njoya et al.,
1997).
III.4. Note d'état corporel
Chaque vache a été examinée avant
l'abattage pour déterminer sa note d'état corporel selon une
grille de notation allant de 0 à 5 d'après Vall et al.
(2003). La note d'état corporel globale a été
estimée pour chaque vache par :
- La note du flanc dont les repères anatomiques sont la
pointe de la hanche, les apophyses transverses et épineuses ;
32
- La note arrière dont les repères anatomiques
sont la base de la queue et la pointe des fesses, le ligament
sacro-tubéral, le détroit caudal et la ligne du dos.
C'est en fonction de la proéminence de ces
repères et de l'aspect saillant des os sous-jacents que l'on attribue
une note allant de 0 à 5. Le tableau I présente
les grilles d'évaluations de la NEC. Ces repères ont
été complétés par la palpation des amas graisseux
superficiels : les abords, le grasset, la côte.
Tableau I: Grille de notation de l'état corporel
des bovins
|
Note
|
état
|
Zone lombaire
|
Zone caudale
|
|
0
|
Cachectique
|
Apohyses épineuses et transverses visibles ;
vertèbres très visibles : la peau « rentre » sous les
apophyses.
|
Queue et pointes ischiales très saillantes ;
Détroit caudal très profond ;
Fesse pointue.
|
|
1
|
Très maigre
|
Apophyses transverses très saillantes ;
vertèbres visibles, couvertures musculaires limitées, la peau
« suit » les apophyses.
|
Queue très saillante, pointe de la
fesse saillante, détroit caudal
profond.
|
|
2
|
Maigre
|
Apophyses transverses visibles mais non proéminentes ;
ligne transverse concave.
|
Queue saillante, détroit caudal
creux, pointe de la fesse arrondie
|
|
3
|
Normal
|
Apophyses transverses discernables à la palpation ;
ligne transversale légèrement concave ; hanche arrondies et
lisses.
|
Queue saillante ; ligne queue
pointe de la fesse lisse ou
légèrement concave ; détroit
caudal
effacé.
|
|
4
|
Gras
|
Apophyses transverses invisibles mais hanches
perceptibles ; ligne transversale plate ou
légèrement convexe.
|
Queue entourée de graisse mais
proéminente ; détroit caudal
comblé.
|
|
5
|
Très gras
|
Apophyses transverses invisibles mais hanches
perceptibles ; ligne transversale convexe.
|
Queue enfouie, parfois entouré de bourrelets.
|
Source : Vall et al. (2003).
Les vaches ont été classées en 3
catégories selon Natumyana et al. (2008) : note 1-2 : maigre ;
note 3 : Moyenne ; note 4-5 : grasse.
33
III.5. Age
Après l'abattage, l'âge a été
déterminé par l'examen de la dentition ou des cornes.
Tableau II: Méthode de détermination de
l'âge des bovins
|
Dentition
|
Nombres des sillons/Cornes
|
Age de la vache
|
|
Dents de lait
|
Absent
|
< à 2 ans
|
|
Eruption des pinces
|
2 ans
|
|
Eruption des premières mitoyennes
|
1
|
3 ans
|
|
Eruption des deuxièmes mitoyennes
|
2
|
4 ans
|
|
Eruption des coins
|
3
|
5 ans
|
|
Rasement des incisives
|
4
|
6 ans
|
|
Nivellement des pinces
|
5
|
7 ans
|
|
Nivellement des premières mitoyennes
|
6
|
8 ans
|
|
Nivellement des deuxièmes mitoyennes
|
7
|
9 ans
|
|
Nivellement des coins
|
8
|
10 ans
|
|
Ecartement des dents
|
9
|
11 ans
|
|
10
|
12 ans
|
|
11
|
13 ans
|
|
12
|
14 ans
|
|
13
|
15 ans
|
Source : Fassi et al. (2006)
Pour la détermination de l'âge par les cornes, la
formule suivante a été utilisée : Age (en années) =
N + 2, avec N représentant le nombre des sillons et 2 une constante.
Les vaches ont été classées en groupes
d'âges : 3 = âge < 6 ans, 6 = âge < 10 ans et 10=
âge = 15 ans selon Lucyna et Zdzislaw (1984).
III.6. Statut physiologique
Après l'abattage et l'éviscération,
l'utérus a été examiné afin de déterminer
l'état physiologique de la vache. Si celle-ci est gravide, le foetus
était retiré par incision de l'utérus et son âge
approximatif déterminé à partir de la formule Y= X (X+2)
où X représente le nombre de mois de gestation, 2 une constante
et Y la longueur nuque-croupe en centimètres (Santos et al.,
2013). La longueur nuque-croupe était mesurée à
partir de l'éminence frontale jusqu'à la jonction
sacrée-coccygienne (ischium). Le stade de gravidité a
été ensuite classé en premier trimestre (1 à 90
jours), deuxième trimestre (91 à 180 jours) et troisième
trimestre (> à 180 jours).
34
III.7. Prélèvement des ovaires
Après identification et abattage de chaque vache, les
ovaires ont été prélevés par section du ligament
large à l'aide des ciseaux. Ensuite, l'ovaire droit est placé
dans un tube conique contenant un milieu isotonique (NaCl, 0.9%) avec la
pénicilline-streptomycine (0,5 mg/ml), et l'ovaire gauche dans un autre.
Après la collecte, les tubes contenant les ovaires ont été
mis dans un container isotherme à la température de 30-32°
C, puis transportés au laboratoire endéans les 2 heures qui
suivaient l'abattage. Les ovaires présentant des pathologies (kystes)
ont été exclus (Wang et al., 2007).
III.8. Détermination du poids et de la taille des
ovaires
Au laboratoire, les ovaires ont été
débarrassés de débris tissulaires (ligament large
attachés sur l'ovaire) et ont été pesés avec une
balance électronique de type Mettler PC 2000 (photo
n° 6) avec une précision de 0,01. En fonction de leur
poids, les ovaires ont été répartis en trois groupes :
petits (< à 3 g), moyens (3 à 5 g) et gros (> à 5
g).

Photo n ° 6 : Détermination du poids de
l'ovaire
La taille (longueur, largeur et épaisseur) de l'ovaire
a été mesurée à l'aide d'un calliper
électronique (Photo n° 7). En fonction de ce
facteur, les ovaires ont été répartis en deux groupes :
volume ovarien inférieur à 2,25x1,75x1,25 cm3 et
supérieur à 2,25x1,75x1,25 cm3 (Samad et Raza.,
1999).

Photo n ° 7 : Détermination de la taille de
l'ovaire
III.9. Identification du corps jaune
Le corps jaune (photo n° 8) est une
glande endocrine transitoire du fait de sa durée
éphémère. C'est une structure qui est formée
à partir du follicule qui a ovulé. Son identification sur
l'ovaire était basée sur sa forme et sa couleur. Le corps jaune
mature a une forme en « bouchon sphérique », et une couleur
grise.
Photo n ° 8 : Ovaire portant un corps
jaune
III.10. Détermination de la population
folliculaire
Pour chaque vache, les follicules visibles (photo
n° 9) à la surface de l'ovaire ont été
comptés. Le diamètre folliculaire a été
mesuré et les follicules ont été classés en 3
catégories : petits (CD < 3 mm), moyens (3 = CD = 8 mm) et gros (CD
> 8 mm) selon Duygu et al. (2013). Les ovaires ont
été ensuite rincés avec une solution physiologique de NaCl
à 0,9 % contenant de la pénicilline-streptomycine à la
dose de 0,5 mg/ml. Ils ont été gardés dans un bain marie
à une température de 30° C pendant toute la durée de
leur examen.
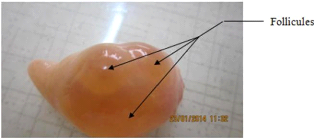
35
Photo n ° 9 : Ovaire portant des
follicules
III. 36
11. Collecte et classification des ovocytes
La technique de slicing (incision) des ovaires (Wang et
al., 2007) a été utilisée pour collecter les
ovocytes. Chaque ovaire a été placé dans une boîte
de pétri contenant 5 ml de la solution du DPBS. De petites incisions ont
été faites sur toute la surface de l'ovaire à l'aide d'une
lame de bistouri pour obtenir les ovocytes, l'ovaire étant maintenu avec
des pinces à dents de souris.
Une fois collectés et rincés dans une solution
de DPBS, les ovocytes ont été examinés et comptés
sous stéréoscope à l'objectif 10X (photo n° 10). Les
ovocytes ont été ensuite classés en 4 qualités en
tenant compte de l'homogénéité du cytoplasme et des
couches des cellules du cumulus oophorus selon De Loose et al. (1989)
et Alves et al. (2014).
- Qualité 1 : Cumulus compacté ayant plus de trois
couches à cytoplasme homogène ; - Qualité 2 : Cumulus
compacté à une ou deux couches et un cytoplasme homogène ;
- Qualité 3: Cumulus peu compacté à cytoplasme peu
régulier avec des zones sombres ; - Qualité 4 : Sans cumulus,
avec un cytoplasme irrégulier.
Pour évaluer la qualité globale des ovocytes,
un index a été calculé : [qualité Ix1+
qualité II x 2+qualité III x 3+qualité IVx4] / nombre
total des ovocytes (Duygu et al., 2013). Une valeur tendant vers 1
reflète une bonne qualité globale des ovocytes.
IV. Analyses statistiques
Les données ont été analysées avec
le logiciel Statistical Package for Social Sciences (SPSS), version 20. Le test
de Shapiro-Wilk a été utilisé pour le test de
normalité des observations ou valeurs. Les données des follicules
et ovocytes qui ne suivent pas une distribution normale ont été
transformées par le logarithme Népérien. L'analyse de la
variance (ANOVA) à un facteur a été effectuée pour
évaluer l'effet des facteurs ovariens et non ovariens sur la population
folliculaire, le rendement et la qualité ovocytaire. Les
différences entre moyennes ont été testées par le
test de Duncan's. Pour les données non normales, le test de
Krustal-Wallis a été utilisé pour la comparaison des
différentes moyennes. Toutes les données ont été
représentées sous la forme de moyenne #177; ESM (Erreur Standard
de la Moyenne) au seuil de 5 %.
37
CHAPITRE III : RÉSULTATS ET DISCUSSION I.
Résultats
I.1. Caractérisation des vaches abattues et des
ovaires I.1.1. Race
Sur les 201 vaches étudiées, 92 étaient de
race Goudali, 50 de race White Fulani (Akou), 31 de race Red Fulani (Djafoun)
et 20 de race Bokolo (figure 10).
effectifs relatifs
45%
40%
25%
20%
50%
35%
30%
15%
10%
0%
5%
28,86%
9,95%
15,42%
45,77%
Akou Bokolo Djafoun Goudali
race
Figure 10: Distribution des vaches en fonction de la
race
I.1.2. Age
L'âge des vaches abattues variait entre 3 et 15 ans. Avec
une moyenne de 6,80 #177; 0,15, la plupart des vaches avait un âge
compris entre 6 et 10 ans (tableau III).
Tableau III : Répartition des vaches en fonction
de l'âge
Groupe d'âges Effectif Pourcentage
3 - 6 ans 55 27,4
6 - 10 ans 108 53,7
10 - 15 ans 38 18,9
TOTAL 201 100
38
I.1.3. NEC
L'évaluation morphologique des vaches a montré
que la note d'état corporel des vaches abattues variait entre 1 et 5 ;
avec une moyenne de 2,67#177;0,06. Plus de la moitié (59,7 %) des vaches
avaient une NEC = 3 (figure 11).
effectifs relatifs
40,00%
20,00%
60,00%
0,00%
40,30%
46,27%
13,43%
Faible Moyenne élevée
Note d'état corporel
Figure 11 : Distribution des vaches en fonction de la NEC
I.1.4. Statut physiologique
Plus de la moitié (52,2%) des vaches étaient
gravides. Le tableau IV présente leur
répartition en fonction de leur statut physiologique et de la
gravidité.
Tableau IV : Répartition des vaches en fonction
du statut physiologique
|
Statut physiologique
|
Effectifs
|
Pourcentage
|
|
Non gravides
|
96
|
47,8
|
|
Gravides
|
105
|
52,2
|
|
? 1er trimestre
|
53
|
26,4
|
|
? 2e trimestre
|
32
|
15,9
|
|
? 3e trimestre
|
20
|
9,9
|
I.1.5. Corps jaune
Cent quarante vaches (69,7%) possédaient un corps jaune
sur l'un ou l'autre ovaire contre soixante une (30,3%) qui n'en
possédaient pas.
I.1.6. Poids des ovaires et des vaches
Le poids moyen de l'ovaire était de 4,60#177;1,82 g et
ceux de l'ovaire droit et gauche de 4,99#177;2,48g et 4,22#177;2,15 g
respectivement. Il est à noter que l'ovaire droit pèse plus que
l'ovaire gauche. Le poids moyen des vaches était de 382,08#177;70,73
Kg.
39
Le tableau V présente la variation du
poids des ovaires et des vaches en fonction de la race, de la NEC, de
l'âge, du statut physiologique et de la présence ou non du corps
jaune. Il ressort de ce tableau que les vaches gravides ont des ovaires plus
lourds (P < 0 ,05). De même, les ovaires porteurs de corps jaune sont
plus lourds (P < 0 ,05). La race et l'âge des vaches n'ont aucun effet
(P > 0 ,05) sur le poids des ovaires, alors que la note d'état
corporel a une influence significative. Les ovaires des vaches ayant une NEC =
3 sont plus lourds (p < 0,05). Bien que la race Goudali ait tendance
à avoir un poids plus élevé que les autres races, la
différence n'est pas significative (p > 0,05). Par contre, le poids
des vaches augmente de façon significative (p < 0,05) avec la note
d'état corporel, la présence du corps jaune et de l'état
gravidique.
Tableau V : Variation du poids des ovaires et des
vaches en fonction de la race, de la NEC, de l'âge, du
statut
physiologique et du corps jaune (moyenne #177; ESM)
|
Facteurs
|
|
N
|
Poids moyen ovaire droit
|
Poids moyen Ovaire gauche
|
Poids
Moyen ovaire
|
Poids
de l'animal
|
|
Akou
|
50
|
5,07#177;0,32a
|
4,20#177;0,26a
|
4,63#177;0,23a
|
348,27#177;7,97a
|
|
Bokolo
|
20
|
4,99#177;0,87a
|
3,41#177;0,36a
|
4,20#177;0,27a
|
354,90#177;12,76a
|
|
Race
|
Djafoun
|
31
|
4,62#177;0,58a
|
4,56#177;0,42a
|
4,59#177;0,42a
|
364,35#177;13,35a
|
|
Goudali
|
92
|
5,05#177;0,24a
|
4,28#177;0,23a
|
4,67#177;0,18a
|
373,72#177;6,70a
|
|
P-value
|
|
0,546
|
0,675
|
0,776
|
0,654
|
|
Faible
|
81
|
4,35#177;0,24a
|
3,78#177;0,22a
|
4,06#177;0,18a
|
339,05#177;5,51a
|
|
NEC
|
Moyenne
|
93
|
5,30#177;0,26b
|
4,45#177;0,24b
|
4,87#177;0,26a
|
366,07#177;6,88b
|
|
Elevée
|
27
|
5,82#177;0,55b
|
4,70#177;0,37b
|
5,26#177;0,31b
|
424,70#177;11,11c
|
|
P-value
|
|
0,007
|
0,027
|
0,002
|
0,000
|
|
3 - 6
|
55
|
4,79#177;0,28a
|
3,87#177;0,22a
|
4,33#177;0,19a
|
357,44#177;9,86a
|
|
Age
|
6 - 10
|
108
|
5,12#177;0,25a
|
4,28#177;0,21a
|
4,70#177;0,18a
|
372,32#177;5,43a
|
|
10 - 15
|
38
|
4,87#177;0,45a
|
4,52#177;0,42a
|
4,69#177;0,33a
|
373,81#177;10,65a
|
|
P-value
|
|
0,923
|
0,063
|
0,441
|
0,581
|
|
Statut
|
Non gestante
|
96
|
4,26#177;0,20a
|
3,54#177;0,18a
|
3,90#177;0,16a
|
339,09#177;5,83a
|
|
Gestante
|
105
|
5,65#177;0,26b
|
4,84#177;0,22b
|
5,24#177;0,17b
|
384,97#177;6,23b
|
|
physiologique
|
P-value
|
|
0,000
|
0,000
|
0,000
|
0,000
|
|
Absent
|
61
|
3,57#177;0,18a
|
3,22#177;0,16a
|
3,39#177;0,16a
|
333,29#177;7,60a
|
|
Corps jaune
|
Présent
|
140
|
5,60#177;0,22b
|
4,22#177;0,15b
|
5,12#177;0,15b
|
376,03#177;5,32b
|
|
P-value
|
|
0,000
|
0,009
|
0,000
|
0,000
|
a,b,c :les moyennes dans une colonne avec des exposants
différents sont significatives (P<0,05)
40
I.1.7. Taille des ovaires
Les dimensions moyennes de l'ovaire étaient de
2,78#177;0,55 cm pour la longueur, 1,90#177;0,42 cm pour la largeur et de
1,27#177;0,33 cm pour l'épaisseur.
Le tableau VI montre la variation de la
taille de l'ovaire en fonction de la race, de la NEC, de l'âge, du statut
physiologique et de la présence ou non du corps jaune.
Il ressort de ce tableau que : la longueur de l'ovaire
augmente significativement avec l'âge (p < 0,05) ; l'épaisseur
de l'ovaire est plus réduite (p < 0,05) chez les vaches maigres. Les
dimensions des ovaires augmentent avec l'état gravidique et la
présence du corps jaune (p < 0,05).
41
Tableau VI : Variation de la taille des ovaires en
fonction de la race, de la NEC, de l'âge, du statut physiologique et de
la présence ou non du corps jaune (moyenne#177;ESM).
|
FACTEURS
|
|
N
|
Longueur moyenne OG
|
Longueur moyenne OD
|
Longueur moyenne ovaire
|
Largeur Moyenne OG
|
Largeur
moyenne
OD
|
Largeur
moyenne
ovaire
|
Epaisseur
moyenne
OG
|
Epaisseur
moyenne
OD
|
Epaisseur
moyenne
Ovaire
|
|
Akou
|
58
|
2,67#177;0,54a
|
2,91#177;0,55a
|
2,79#177;0,06a
|
1,84#177;0,37a
|
1,97#177;0,39a
|
1,90#177;0,04a
|
1,21#177;0,27a
|
1,33#177;0,33a
|
1,27#177;0,03a
|
|
Bokolo
|
20
|
2,61#177;0,52a
|
2,74#177;0,37a
|
2,68#177;0,08a
|
1,75#177;0,44a
|
2,07#177;0,49a
|
1,91#177;0,05a
|
1,09#177;0,33a
|
1,34#177;0,35a
|
1,21#177;0,55a
|
|
Races
|
Djafoun
|
31
|
2,78#177;0,47a
|
2,86#177;0,58a
|
2,82#177;0,09a
|
1,95#177;0,45a
|
1,84#177;0,45a
|
1,89#177;0,06a
|
1,31#177;0,33a
|
1,26#177;0,41a
|
1,29#177;0,05a
|
|
Goudali
|
92
|
2,68#177;0,59a
|
2,86#177;0,55a
|
2,77#177;0,05a
|
1,82#177;0,42a
|
1,97#177;0,43a
|
1,90#177;0,03a
|
1,25#177;0,34a
|
1,35#177;0,52a
|
1,30#177;0,03a
|
|
p-value
|
|
0,716
|
0,681
|
0,767
|
0,354
|
0,274
|
0,998
|
0,100
|
0,797
|
0,565
|
|
Faible
|
81
|
2,60#177;0,51a
|
2,76#177;0,48a
|
2,68#177;0,05a
|
1,77#177;0,40a
|
1,84#177;0,40a
|
1,81#177;0,03a
|
1,15#177;0,29a
|
1,22#177;0,31a
|
1,18#177;0,02a
|
|
Moyenne
|
93
|
2,76#177;0,60a
|
2,93#177;0,60a
|
2,85#177;0,06a
|
1,88#177;0,42a
|
2,04#177;0,43a
|
1,96#177;0,03b
|
1,29#177;0,33b
|
1,40#177;0,52b
|
1,34#177;0,03b
|
|
NEC
|
Elevée
|
27
|
2,72#177;0,44a
|
2,93#177;0,43a
|
2,82#177;0,06a
|
1,89#177;0,40a
|
1,96#177;0,43a
|
1,97#177;0,04b
|
1,31#177;0,34b
|
1,42#177;0,42b
|
1,36#177;0,05b
|
|
p-value
|
|
0,129
|
0,094
|
0,066
|
0,175
|
0,055
|
0,052
|
0,007
|
0,014
|
0,002
|
|
3 - 6 ans
|
55
|
2,50#177;0,46a
|
2,67#177;0,46a
|
2,58#177;0,05a
|
1,77#177;0,33a
|
1,93#177;0,35a
|
1,85#177;0,03a
|
1,28#177;0,34a
|
1,32#177;0,30a
|
1,30#177;0,03a
|
|
Age
|
6 À 10 ans
|
108
|
2,75#177;0,55b
|
2,94#177;0,55b
|
2,84#177;0,05b
|
1,87#177;0,44a
|
1,99#177;0,34a
|
1,92#177;0,03a
|
1,23#177;0,30a
|
1,31#177;0,34a
|
1,27#177;0,02a
|
|
10 - 15 ans
|
38
|
2,81#177;0,60b
|
2,92#177;0,54b
|
2,86#177;0,08b
|
1,84#177;0,43a
|
1,93#177;0,53a
|
1,89#177;0,06a
|
1,19#177;0,35a
|
1,40#177;0,76a
|
1,29#177;0,07a
|
|
p-value
|
|
0,009
|
0,007
|
0,003
|
0,348
|
0,658
|
0,302
|
0,376
|
0,575
|
0,763
|
|
Statut
|
Non gestante
|
96
|
2,53#177;0,49a
|
2,70#177;0,47a
|
2,62#177;0,04a
|
1,70#177;0,37a
|
1,88#177;0,39a
|
1,79#177;0,03a
|
1,14#177;0,29a
|
1,22#177;0,30a
|
1,18#177;0,02a
|
|
physio-
|
Gestante
|
105
|
2,84#177;0,56b
|
3,01#177;0,56b
|
2,92#177;0,05b
|
1,96#177;0,41b
|
2,04#177;0,45b
|
2,00#177;0,03b
|
1,32#177;0,33b
|
1,42#177;0,52b
|
1,37#177;0,02b
|
|
logique
|
p-value
|
|
0,000
|
0,000
|
0,000
|
0,000
|
0,010
|
0,000
|
0,000
|
0,001
|
0,000
|
|
Absent
|
61
|
2,56#177;0,50a
|
2,64#177;0,43a
|
2,60#177;0,05a
|
1,66#177;0,29a
|
1,72#177;0,26a
|
1,69#177;0,03a
|
1,07#177;0,19a
|
1,11#177;0,19a
|
1,09#177;0,02a
|
|
Corps jaune
|
Présent
|
140
|
2,75#177;0,56b
|
2,96#177;0,55b
|
2,85#177;0,04b
|
1,92#177;0,43b
|
2,06#177;0,45b
|
1,99#177;0,02b
|
1,30#177;0,34b
|
1,43#177;0,48b
|
1,36#177;0,02b
|
|
p-value
|
|
0,024
|
0,000
|
0,001
|
0,000
|
0,000
|
0,000
|
0,000
|
0,000
|
0,000
|
a,b,c :les moyennes dans une colonne avec des exposants
différents sont significatives (P<0,05) OD : Ovaire Droit, OG :
Ovaire Gauche
I.2. 42
Population folliculaire
Sur un total de quatre cent deux (402) ovaires
récoltés, six milles sept quarante-sept (6747) follicules ont
été obtenus soit une moyenne de 16,75#177;0,83 par ovaire. Le
nombre de follicules de diamètre inférieur à 3 mm varie de
0 à 55 ; celui des follicules de diamètre compris entre 3-8 mm de
0 à 47 et de 0 à 2 pour les follicules de diamètre
supérieure à 8 mm. La figure 12
représente la répartition des follicules en fonction de
la taille.
1,25%
48,63%
50,12%
Follicules de diamètre < à 3 mm :
8,39#177;0,60
Follicules de diamètre compris entre 3 et 8mm :
8,14#177;0,43 Follicules de diamètre > à 8 mm :
0,21#177;0,02
Figure 12: Répartition du
nombre des follicules en fonction de leur diamètre
I.3. Rendement en ovocyte
Quatre mille quatre cent onze (4411) ovocytes de qualité
I, II, III et IV ont été récoltés des 402 ovaires,
soit un rendement moyen en ovocytes par ovaire de 10,97#177;0,43.
43
I.4. Qualité des ovocytes
Les ovocytes ont été classés en quatre
qualités : I, II, III et IV (photo n° 10).
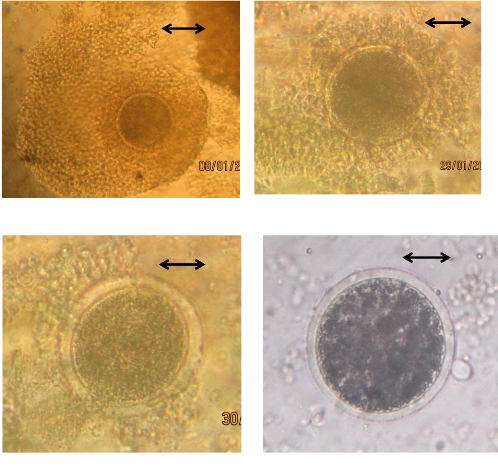
(C)
(D)
30 um
30 um
(B)
(A)
30 um
30 um
Photo n ° 10 : Complexe
Ovocyte-Cumulus
(A) : Cumulus compacté avec plus de 3 couches et
à cytoplasme homogène (COC-I) ;
(B) : Cumulus compacté avec une ou deux couches et un
cytoplasme homogène (COC-II) ;
(C) : Cumulus peu compacté à cytoplasme peu
régulier avec des zonez sombres (COC-III) ;
(D) : Cumulus dénudé ou absent, avec un
cytoplasme moins régulier (COC-IV).
La figure 13 présente la
répartition des ovocytes (moyenne #177;ESM) en fonction de leur
qualité. Les ovocytes jugés de bonne qualité pour la
maturation et la fécondation in vitro (qualité I et II)
représentent une moyenne de 6,27#177;0,32 par ovaire soit un pourcentage
de 57,15% (2515). L'index de la qualité ovocytaire (IQO) était de
2,26.
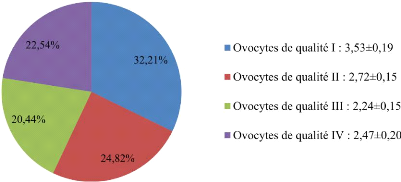
44
Figure 13 : Répartition des ovocytes en fonction
de leur qualité
I.5. Effet des facteurs ovariens sur la population
folliculaire, le rendement et la qualité des ovocytes.
Les tableaux VII et VIII présentent
l'effet de la localisation ovarienne, de la présence ou non du corps
jaune, du poids et de la taille de l'ovaire sur la population folliculaire, le
rendement et la qualité des ovocytes.
Tableau VII: Variation du nombre des follicules en
fonction des facteurs ovariens (moyenne #177; ESM)
|
Facteurs
|
|
N
|
Nombre des follicules/ovaire
|
Follicules
totaux/ovaire
|
|
Petits
(< 3mm)
|
Moyens (3-8 mm)
|
Gros
(> 8 mm)
|
|
|
Localisa-
|
Droit
|
201
|
8,24#177;0,62a
|
8,45#177;0,47a
|
0,25#177;0,04a
|
16,95#177;0,86a
|
|
tion
|
Gauche
|
201
|
8,55#177;0,64a
|
7,83#177;0,48a
|
0,18#177;0,03a
|
16,57#177;0,88a
|
|
ovarienne
|
p-value
|
|
|
|
|
0,756
|
|
Corps
|
Absent
|
260
|
8,99#177;0,57a
|
7,31#177;0,38a
|
0,23#177;0,03a
|
16,53#177;0,73a
|
|
jaune
|
Présent
|
142
|
7,31#177;0,70a
|
9,68#177;0,64b
|
0,18#177;0,03a
|
17.17#177;1,12a
|
|
P-value
|
|
|
|
|
0,623
|
|
Poids de
|
< 3
|
134
|
5,33#177;0,52a
|
5,74#177;0,49a
|
0,25#177;0,04a
|
11,32#177;0,79a
|
|
l'ovaire
|
3 - 5
|
134
|
7,55#177;0,65b
|
7,94#177;0,53b
|
0,24#177;0,04a
|
16,47#177;0,88b
|
|
(g)
|
>5
|
134
|
11,41#177;0,99c
|
10,75#177;0,63c
|
0,16#177;0,03a
|
22,49#177;1,26c
|
|
P-value
|
|
|
|
|
0,000
|
|
volume de
|
<2,25x1,75x1,25
|
142
|
5,07#177;0,40a
|
6,21#177;0,40a
|
0,29#177;0,05a
|
11,57#177;0,60a
|
|
l'ovaire
|
>2,25x1,75x1,25
|
174
|
10,81#177;0,79b
|
10,72#177;0,60b
|
0,18#177;0,03a
|
21,71#177;1,10b
|
|
(cm3)
|
P-value
|
|
|
|
|
0,000
|
a,b,c :les moyennes dans une colonne avec des exposants
différents sont significatifs
(P<0,05)
45
Tableau VIII : Variation du rendement et la
qualité des ovocytes en fonction des facteurs ovariens
(moyenne#177;ESM).
|
Facteurs
|
N
|
Rendement ovocytaire/ovaire
|
|
Qualité ovocytaire
|
|
Ovocytes cultivables
|
|
I
|
II
|
III
|
IV
|
I et II
(%)
|
|
Localisation
|
Droit
|
201
|
11,28#177;0,62a
|
3,55#177;0,22a
|
2,83#177;0,18a
|
2,30#177;0,17a
|
2,60#177;0,26a
|
6,38#177;0,36a (56,56)
|
|
ovarienne
|
Gauche
|
201
|
10,67#177;0,60a
|
3,52#177;0,21a
|
2,62#177;0,18a
|
2,17#177;0,17a
|
2,36#177;0,19a
|
6,13#177;0,35a (57,45)
|
|
p-value
|
|
0,756
|
|
|
|
|
0,631
|
|
Corps
|
Absent
|
260
|
11,51#177;0,53a
|
3,58#177;0,19a
|
2,86#177;0,16a
|
2,37#177;0,15a
|
2,70#177;0,21a
|
6,44#177;0,31a (55,95)
|
|
jaune
|
Présent
|
142
|
9,99#177;0,75a
|
3,45#177;0,28a
|
2,47#177;0,19a
|
2,08#177;0,19a
|
2,07#177;0,24a
|
5,92#177;0,43a (59,25)
|
|
P-value
|
|
0,095
|
|
|
|
|
0,330
|
|
Poids de
|
< 3
|
134
|
8,44#177;0,59a
|
2,66#177;0,22a
|
2,09#177;0,22a
|
1,78#177;0,18
|
1,90#177;0,21
|
4,75#177;0,35a (56,27)
|
|
l'ovaire
|
3 - 5
|
134
|
11,39#177;0,74b
|
3,51#177;0,24b
|
3,51#177;0,24b
|
2,29#177;0,20
|
2,59#177;0,33
|
6,50#177;0,44b (57,07)
|
|
(en g)
|
>5
|
134
|
13,09#177;0,84b
|
4,43#177;0,32b
|
4,43#177;0,32b
|
2,64#177;0,23
|
2,93#177;0,28
|
7,51#177;0,48b (57,37)
|
|
P-value
|
|
0,000
|
|
|
|
|
0,000
|
|
Volume de
|
<2,25x1,75x1,25
|
142
|
8,57#177;0,57a
|
2,65#177;1,93a
|
2,15#177;0,17a
|
1,68#177;0,17a
|
2,08#177;0,22a
|
4,80#177;0,33a (56,00)
|
|
l'ovaire (cm3)
|
>2,25x1,75x1,25
|
174
|
12,57#177;0,73b
|
4,14#177;0,26b
|
3,16#177;0,21b
|
2,58#177;0,19b
|
2,69#177;0,23a
|
7,30#177;0,42b (58,07)
|
|
P-value
|
|
0,000
|
|
|
|
|
0,000
|
a,b,c :les moyennes dans une colonne avec des exposants
différents sont significatifs (P<0,05).
46
I.5.1. Localisation ovarienne
La position gauche ou droite de l'ovaire n'a aucun effet
significatif (P > 0,05) sur la population folliculaire, le rendement et la
qualité des ovocytes. Toutefois, l'ovaire droit a tendance à
avoir plus de follicules et d'ovocytes que l'ovaire gauche.
I.5.2. Corps jaune
Le corps jaune n'a aucun effet significatif (P > 0,05) sur
le nombre de petits (diamètre < à 3 mm), gros (diamètre
> à 8 mm) et follicules totaux. Par contre, les ovaires porteurs de
corps jaunes ont plus (P < 0,05) de follicules moyens.
Les ovaires ne portant pas de corps jaune ont tendance
à avoir un rendement plus élevé en ovocytes totaux et en
ovocytes cultivables. Aucune différence significative n'est
observée en terme de qualité ovocytaire entre les ovaires ipsi et
contra-latéraux au corps jaune.
I.5.3. Poids de l'ovaire
Le poids de l'ovaire influence de façon significative
la population folliculaire totale, le rendement et la qualité
ovocytaire. Cependant, il n'a aucun effet significatif (P > 0,05) sur le
nombre moyen des gros follicules.
I.5.4. Taille de l'ovaire.
Il ressort du tableau VII que les ovaires
dont le volume est supérieur à 2,25x1,75x1,25 cm3 ont
plus (P < 0,05) de follicules totaux que ceux dont le volume est moindre.
Cependant le nombre des gros follicules ne diffère (P > 0,05) pas
entre ces deux groupes.
De même, le rendement en ovocytes totaux et en ovocytes
cultivables est plus élevé (P < 0,05) dans les ovaires ayant
un volume supérieure à 2,25x1,75x1,25 cm3
(tableau VIII).
47
I.6. Variation de la population folliculaire, du
rendement et de la qualité des ovocytes en fonction des facteurs non
ovariens.
Les tableaux IX et X présentent l'effet
de la race, de l'âge, de la NEC, du statut physiologique et du stade de
la gestation sur la population folliculaire, le rendement et la qualité
ovocytaire.
Tableau IX : Variation de la population folliculaire en
fonction des facteurs non ovariens (moyenne #177; ESM)
|
Facteurs
|
N
|
Nombre de follicules/ovaire
|
Follicules totaux
|
|
Petits
(< 3mm)
|
Moyens
(3-8mm)
|
Gros
(> 8mm)
|
/ovaire
|
|
Akou
|
58
|
9,60#177;1,20a
|
7,63#177;0,91a
|
0,19#177;0,03a
|
17,39#177;1,74a
|
|
Race
|
Bokolo
|
20
|
7,80#177;2,04a
|
8,00#177;1,26a
|
0,25#177;0,07a
|
16,02#177;2,45a
|
|
Djafoun
|
31
|
9,10#177;1,83a
|
8,22#177;1,03a
|
0,22#177;0,06a
|
17,47#177;2,42a
|
|
Goudali
|
92
|
7,53#177;0,76a
|
8,48#177;0,62a
|
0,20#177;0,04a
|
16,27#177;1,10a
|
|
P-value
|
|
|
|
|
0,170
|
|
3 -6 ans
|
55
|
8,52#177;1,08a
|
8,55#177;0,67a
|
0,34#177;0,05a
|
17,42#177;1,38a
|
|
Age
|
6 -10 ans
|
108
|
8,61#177;0,86a
|
9,14#177;0,59a
|
0,17#177;0,02b
|
17,76#177;1,13a
|
|
10 -15 ans
|
38
|
7,59#177;1,34a
|
4,74#177;1,06b
|
0,13#177;0,04b
|
12,46#177;2,16b
|
|
P-value
|
|
|
|
|
0,043
|
|
Faible
|
81
|
7,61#177;0,79a
|
6,68#177;0,63a
|
0,20#177;0,03a
|
14,48#177;1,14a
|
|
NEC
|
Moyenne
|
93
|
8,98#177;0,99a
|
9,78#177;0,68b
|
0,22#177;0,03a
|
18,99#177;1,35b
|
|
Elevée
|
27
|
8,74#177;1,71a
|
6,91#177;0,86a
|
0,18#177;0,05a
|
15,85#177;2,05a
|
|
P-value
|
|
|
|
|
0,038
|
|
Statut
|
Non gravide
|
96
|
9,23#177;0,79a
|
7,55#177;0,64a
|
0,29#177;0,03a
|
17,00#177;1,26a
|
|
physio-
|
Gravide
|
105
|
7,63#177;0,79a
|
8,69#177;0,59a
|
0,31#177;0,03a
|
16,52#177;1,11a
|
|
logique
|
P-value
|
|
|
|
|
0,781
|
|
1er trimestre
|
53
|
8,20#177;1,34a
|
9,60#177;0,93a
|
0,27#177;0,05a
|
18,08#177;1,82a
|
|
Stade de
|
2e trimestre
|
32
|
7,48#177;1,25a
|
8,50#177;0,88a
|
0,17#177;0,05b
|
16,12#177;1,69a
|
|
gravidité
|
3e trimestre
|
20
|
6,37#177;0,94a
|
6,60#177;1,15a
|
0,12#177;0,05c
|
13,05#177;1,74a
|
|
P-value
|
|
|
|
|
0,431
|
a,b,c :les moyennes dans une colonne avec des exposants
différents sont significatifs (P<0,05)
48
Tableau X : Variation du rendement et de la
qualité des ovocytes en fonction des facteurs non ovariens
(moyenne#177;ESM)
|
Facteurs
|
|
N
|
Rendement
ovocytaire
|
|
Qualité ovocytaire
|
|
Ovocytes cultivables
|
|
I
|
II
|
III
|
IV
|
I et II (%)
|
|
Akou
|
58
|
11,39#177;1,03a
|
3,63#177;0,28a
|
2,65#177;0,28a
|
2,42#177;0,58a
|
2,74#177;0,42a
|
6,27#177;0,60a (55,12)
|
|
Bokolo
|
20
|
11,07#177;1,93a
|
2,95#177;0,45a
|
3,27#177;0,63a
|
2,27#177;0,47a
|
2,42#177;0,69a
|
6,22#177;1,02a (56,21)
|
|
Race
|
Djafoun
|
31
|
10,79#177;1,82a
|
3,75#177;0,65a
|
2,55#177;0,40a
|
2,10#177;0,19a
|
2,21#177;0,53a
|
6,31#177;0,99a (58,41)
|
|
Goudali
|
92
|
10,75#177;0,76a
|
3,53#177;0,26a
|
2,70#177;0,22a
|
2,23#177;0,15a
|
2,41#177;0,26a
|
6,23#177;0,45a (58,00)
|
|
P-value
|
|
0,809
|
|
|
|
|
1,000
|
|
3 - 6
|
55
|
12,23#177;0,95a
|
3,77#177;0,28a
|
2,94#177;0,27a
|
2,60#177;0,32a
|
2,91#177;0,37a
|
6,72#177;0,49a (54,97)
|
|
Age (années)
|
6 - 10
|
108
|
11,64#177;0,79a
|
3,79#177;0,28a
|
2,98#177;0,22a
|
2,35#177;0,19a
|
2,52#177;0,28a
|
6,77#177;0,46a (58,18)
|
|
10 - 15
|
38
|
7,25#177;1,30b
|
2,46#177;0,49b
|
1,65#177;0,28b
|
1,41#177;0,26b
|
1,72#177;0,38b
|
4,12#177;0,75b (56,83)
|
|
P-value
|
|
0,006
|
|
|
|
|
0,006
|
|
Faible
|
81
|
9,59#177;0,82a
|
2,93#177;0,26a
|
2,44#177;0,25a
|
1,89#177;0,21a
|
2,31#177;0,34a
|
5,38#177;0,48a (56,08)
|
|
NEC
|
Moyenne
|
93
|
12,50#177;0,87b
|
4,34#177;0,31b
|
3,07#177;2,15a
|
2,49#177;0,23a
|
2,59#177;0,26a
|
7,42#177;0,49b (59,36)
|
|
Elevée
|
27
|
9,87#177;1,52a
|
2,55#177;0,41a
|
2,33#177;0,38a
|
2,41#177;0,43a
|
2,57#177;0,58a
|
4,89#177;0,75b (49,54)
|
|
P-value
|
|
0,034
|
|
|
|
|
0,003
|
|
Statut
|
Non gravide
|
96
|
12,05#177;0,85a
|
3,62#177;0,27a
|
2,98#177;0,24a
|
2,53#177;0,23a
|
2,90#177;0,32a
|
6,61#177;0,48 (54,88)
|
|
physiologique
|
Gravide
|
105
|
9,99#177;0,75b
|
3,46#177;0,28a
|
2,48#177;0,19a
|
1,97#177;0,18b
|
2,08#177;0,24a
|
5,93#177;0,44 (59,40)
|
|
P-value
|
|
0,023
|
|
|
|
|
0,298
|
|
Stade
|
1er trimestre
|
53
|
11,33#177;1,27a
|
3,87#177;0,45a
|
2,82#177;0,33a
|
2,23#177;0,29a
|
2,41#177;0,39a
|
5,26#177;0,72a (59,00)
|
|
de gravidité
|
2e trimestre
|
32
|
9,41#177;0,98a
|
3,47#177;0,42a
|
2,30#177;0,25a
|
1,92#177;0,29a
|
1,72#177;0,31a
|
5,76#177;0,59a (61,29)
|
|
3e trimestre
|
20
|
7,37#177;1,26a
|
2,35#177;0,46a
|
1,85#177;0,33a
|
1,37#177;0,30a
|
1,80#177;0,50a
|
4,20#177;0,76a (56,94)
|
|
P-value
|
|
0,016
|
|
|
|
|
1,430
|
a,b,c :les moyennes dans une colonne avec des exposants
différents sont significatifs (P<0,05)
49
I.6.1. Race
La race n'a aucun effet significatif sur la population
folliculaire totale (P > 0,05). Toutefois, les races Red Fulani et white
Fulani ont tendance à avoir plus de follicules que les races Goudali et
Bokolo.
Il n'existe aucune différence significative (P >
0,05) entre les races sur le rendement en ovocytes, la qualité et les
ovocytes cultivables (P > 0,05). Toutes les races étudiées
possèdent un pourcentage en ovocytes cultivables (I et II)
supérieur à 50 %.
I.6.2. Age
Les vaches âgées de plus de 10 ans ont moins de
gros et moyens follicules (P < 0,05). De même, le rendement en
ovocytes est plus élevé (P < 0,05) chez les vaches
âgées de moins de 10 ans. Les ovocytes cultivables
récoltés chez ces dernières représentent 61,13 %
des ovocytes totaux.
I.6.3. NEC
La note d'état corporel exerce un effet significatif
sur le nombre des follicules moyens et des follicules totaux. Les vaches ayant
une NEC moyenne ont plus (P < 0,05) de follicules moyens et de follicules
totaux que les vaches maigres et celles ayant une bonne NEC.
De même, les vaches ayant une NEC moyenne ont un
rendement en ovocyte plus élevé (P < 0,05) que les vaches
maigres et grasses. En ce qui concerne la qualité ovocytaire, les
ovocytes de qualité I et les ovocytes cultivables sont plus nombreux (P
< 0,05) chez les vaches ayant une NEC moyenne.
I.6.4. Statut physiologique
Le statut physiologique n'a aucun effet significatif (P >
0,05) sur la population folliculaire. Toutefois, les vaches non gravides ont
tendance à avoir plus des follicules totaux que les vaches gravides.
Le statut physiologique exerce un effet significatif sur le
rendement en ovocytes. Les vaches gravides ont moins (p < 0,05) d'ovocytes
totaux, comparées aux vaches non gravides. En termes de qualité
ovocytaire, les ovocytes de qualité III sont plus élevés
(p < 0,05) chez les vaches non gravides. Les ovocytes de qualité I et
II qui sont utilisés pour la maturation in vitro ne sont pas
influencés par le statut physiologique. Toutefois, les vaches non
gravides ont tendance à avoir plus d'ovocytes cultivables que les vaches
gravides.
50
I.6.5. Stade de gravidité
Les résultats montrent que l'âge de la gestation
n'a aucun effet significatif (p > 0,05) sur le nombre des follicules totaux.
Les vaches, au dernier trimestre de la gestation, ont tendance à avoir
moins de follicules que les vaches aux premier et deuxième trimestres.
Par contre, le stade de la gestation a un effet significatif sur le nombre de
gros follicules. Les vaches au dernier trimestre de la gestation ont moins (P
< 0,05) de gros follicules.
La gravidité influence le rendement en ovocytes. Les
vaches au premier trimestre ont plus (P < 0,05) d'ovocytes que les vaches au
dernier trimestre de gravidité. Cependant, il n'a aucun effet sur la
qualité globale des ovocytes et sur la qualité des ovocytes
cultivables.
II. Discussion
L'âge moyen des vaches abattues (6,80 #177; 0,15) est
similaire à celui observé par Bah et al. (2010). Selon
ces auteurs, 39 % des vaches abattues à Ngaoundéré
souffriraient des pathologies diverses qui, associées aux effets de la
saison sèche et de la rareté des pâturages y relative
auraient des répercussions sur les performances pondérales avec
pour conséquence une note d'état corporel faible. La
caractérisation des vaches indique que les zébus Mbororo (Akou et
Djafoun) et les zébus Bokolo associés constituent 50,24 % des
races. Ceci est dû au coût plus élevé du zébu
Goudali. D'où le choix des bouchers porté vers les zébus
Mbororo dont le prix est relativement plus bas.
Le poids moyen de l'ovaire des zébus
étudiés est comparable à celui du zébu
Ankolé (4,6#177;2,3 ; Natumanya et al., 2008), mais
inférieur à celui de la vache Frisonne (10-19 ; Pierson et
Ginther, 1987a) et de la vache Swedish Red (10,2 g ; Rajoski, 1960). Cette
différence de poids entre les ovaires des zébus et des taurins
peut être due à l'effet race. En effet le poids moyen des vaches
abattues était inférieur à celui de la vache frisonne,
soit 547793 kg (Laizeau, 2003). La différence de poids entre l'ovaire
droit et gauche a également été rapportée par
Rajoski (1960). En effet, les études de Pierson et Ghinter (1987a) et de
Ghinter et al. (2014) ont montré que les ovulations sont plus
fréquentes sur l'ovaire droit. Cette plus grande activité
physiologique de l'ovaire droit serait donc responsable de son poids plus
élevé. Par ailleurs, il a été
démontré que le statut nutritionnel, la présence du corps
jaune et celles des follicules influence la taille de l'ovaire (Pierson et
Ginther, 1987a) ; d'où la corrélation positive observée
entre la NEC, la présence du corps jaune, le statut physiologique et le
poids des ovaires. L'âge n'a aucun effet sur le poids des ovaires, ceci
s'expliquerait par le fait que toutes les vaches étudiées ont
atteint leur maturité sexuelle et que le poids des ovaires augmente
très peu après la puberté. Les dimensions de l'ovaire
étaient inférieures à
51
celles des races européennes (Rajoski, 1960).
La corrélation positive entre la note d'état corporel et
l'épaisseur de l'ovaire s'expliquerait par une sous-alimentation qui
influence négativement l'état général des animaux
et par conséquent le poids des ovaires. Dans cette étude, la
présence du corps jaune avait un effet positif sur les dimensions de
l'ovaire.
La population folliculaire moyenne est comparable à
celle obtenue par Carvalho et al. (2008) chez le Zébu Nellore.
Le nombre des follicules de taille comprise entre 3 et 8 mm est similaire
à celui du zébu Ankolé rapporté par Natumanya
et al. (2008). Par contre, Dominguez (1995) a observé des
valeurs plus élevées chez les races européennes. Ces
différences sont probablement liées à la race et/ ou
à l'environnement.
La présence du corps jaune n'a aucun effet sur la
population folliculaire ; ceci est également rapporté par
Natumanya et al. (2008). Par contre, Ghinter et al. (2014)
pensent que le corps jaune a une influence positive sur le nombre de follicules
ovariens si et seulement si un follicule dominant est également
présent sur l'ovaire porteur du corps jaune. Cet effet s'expliquerait
par les facteurs angiogéniques d'origine lutéale qui, en
augmentant l'apport sanguin, stimuleraient également la croissance
folliculaire au niveau de l'ovaire porteur du corps jaune. Ghinter et al.
(2014) ont également observé une grande activité
folliculaire sur l'ovaire droit portant un follicule dominant et/ou un corps
jaune. Ceci s'expliquerait par la densité des vaisseaux sanguins qui
favorisent un apport important de sang au niveau de l'ovaire droit ou alors par
la présence des follicules primordiaux plus nombreux sur cet ovaire. La
corrélation positive entre la taille de l'ovaire et la population
folliculaire a également été rapportée par Samad et
Raza (1999) et Wani et al. (1999) chez la bufflesse et la
chèvre respectivement.
La race n'a aucun effet sur la population folliculaire. Santos
et al. (2013) ont observé que la population folliculaire varie
entre les individus d'une même race et entre les races. Dominguez (1995)
a observé que les zébus ont moins de gros follicules, mais plus
de follicules totaux que les taurins (Sartori et Barros, 2011).
Dominguez (1995) et Alves et al. (2014) ont
observé le même effet de la NEC sur la population folliculaire. En
effet, il a été observé que la sous-alimentation inhibe le
mécanisme du rétrocontrôle exercé par l'oestradiol
sur la FSH. Par ailleurs, la folliculogenèse basale est essentiellement
contrôlée par les hormones de croissances telles que l'IGF-1
(Insuline Growth Factor-1). Lucy et al. (1992) ont montré que
lors d'un déficit énergétique, il y a un ralentissement de
la croissance folliculaire suite à une diminution des concentrations en
IGF-
52
1. Une situation alimentaire favorable s'accompagnant des
teneurs plasmatiques élevées en IGF-1 serait un stimulant de la
croissance folliculaire. De plus, il augmente la sensibilité des
cellules de la granulosa à la stimulation de la FSH (O'callaghan et
Boland, 1999). Ryan et al. (1994) ont trouvé qu'il existe une
corrélation entre les apports alimentaires suffisants et la
concentration en IGF-1 dans le sang et la NEC. Les animaux ayant une NEC
très élevée (4 et 5) ou faible (1 et 2) avaient des
faibles concentrations en IGF-1 ; d'où la diminution de la croissance
folliculaire.
L'âge influence significativement la population
folliculaire. Son effet a également été rapporté
par Lucyna et Zdzislaw (1984), et Fassi (2006). En effet, les travaux de
Armstrong (2001) ont montré que le nombre des follicules diminue avec
l'âge chez toutes les espèces. Ceci s'expliquerait par la
défaillance de l'axe hypothalamo-hypophysaire, la déficience des
hormones ovariennes et surtout l'apoptose des follicules, principales
responsable de l'épuisement de la réserve ovarienne.
La gestation n'influence pas significativement la population
folliculaire bien que Ginther et al. (1989) aient identifié des
vagues de croissance folliculaire tous les 8 à 10 jours sans toutefois
conduire à la sélection et à la dominance entre le
4e et le 9e mois de gestation. Par contre, une
réduction du nombre de gros follicules avec l'âge du foetus a
été rapportée par Dominguez (1995). De même, la
présence du corps jaune gestatif a un effet négatif sur la
croissance des follicules de diamètre supérieur à 7 mm
après le 22e jour de gestation (Pierson et Ginther, 1987b).
La différence observée sur le nombre de gros follicules
s'expliquerait par le fait que la sécrétion de la
progestérone durant la gestation inhibe la sécrétion des
gonadotropines hypophysaires (FSH et LH). En effet, la
folliculogénèse terminale est dépendante d'un taux
élevé des gonadotropines. En absence de ces hormones, les
follicules en croissance n'atteignent que les stades des follicules
préantraux.
La technique de slicing des ovaires permet de récolter
les ovocytes présents dans tous les follicules quelle que soit leur
localisation au niveau du cortex ovarien (Ward et al., 2000). Le
rendement ovocytaire, comparable à celui rapporté par Wang et
al. (2007) chez la vache Holstein, est néanmoins supérieur
à celui rapporté par Armstrong (2001), Natumanya et al.
(2008) et Abraham et al. (2012) soit 6,0#177;0,6 ; 4,05#177;0,77
et 3.33 #177; 1.03 mais inférieur aux 66 ovocytes rapportés par
Carolan et al. (1992). Ces variations pourraient être
liées à la technique d'incision qui produit beaucoup de
débris tissulaires (Wani et al., 2000). D'autres auteurs se
servent d'une lame à brin séparée de 1 mm pour inciser les
follicules et d'un passoir. Un nombre important d'ovocytes serait donc retenu
dans les ovaires sans être
53
récoltés, ou alors les ovocytes ont
été désintégrés par la lame de bistouri
durant l'incision des ovaires. Cette technique pourrait contribuer au faible
rendement obtenu dans cette étude. Des investigations futures seraient
également nécessaires pour évaluer, par des coupes
histologiques, la localisation des follicules dans l'ovaire des zébus.
L'index de la qualité ovocytaire obtenu est supérieur à 1.
Ceci indique que la qualité globale des ovocytes est moyenne. Le taux
d'ovocytes de qualité I et II à sélectionner pour la
maturation in vitro se situe dans l'intervalle de 30- 60 %
rapportés par Lucyna et Zdzislaw (1984) et Natumyana et al.
(2008)
Les résultats obtenus ont montré que la
quantité des ovocytes augmente avec le poids et la taille de l'ovaire.
Or, peu d'études ont montré l'effet de la taille et du poids de
l'ovaire sur la population folliculaire, le rendement et la qualité des
ovocytes chez les bovins. Mais on constate que ceux obtenus par Samad et Raza
(1999) chez la bufflesse et par Wani et al. (1999) chez la
chèvre sont contraires. Ceci pourrait être dû à
l'espèce. De même, Natumanya et al. (2008) montrent qu'il n'y a
aucune influence du corps jaune sur le rendement et la qualité des
ovocytes chez la vache Ankolé. Par contre, une corrélation
positive entre la présence du corps jaune, le rendement et la
qualité des ovocytes a été montrée chez la brebis
(Wani et al., 1999), la bufflesse (Samad et Raza, 1999) et le
dromadaire (Abdoon, 2001). Ces variations pourraient être dues à
l'espèce.
Cette étude n'a révélé aucune
influence de la race sur le rendement et la qualité des ovocytes. Ceci a
également été rapporté par Abraham et al. (2012)
chez les races Swedish Red et Swedish Holstein. Par contre, Dominguez (1995) et
Fassi (2006) ont noté que les vaches de races européennes
donnaient plus d'ovocytes que celles des races locales au Nord-Est du Mexique.
Par ailleurs, de nombreuses études ont montré que la
quantité et la qualité ovocytaire diminuaient avec l'âge
(Lucyna et Zdzislaw, 1984; Natumanya et al., 2008). Ce qui corrobore
nos résultats. En effet, notre étude montre que les jeunes
animaux constituent les meilleurs donneurs d'ovocytes de bonne qualité.
L'effet de la NEC et de la gestation sur le rendement et la qualité
ovoytaire a été également rapporté par Dominguez
(1995) et Natumanya et al. (2008). En effet, les changements
métaboliques et hormonaux n'affectent pas seulement la croissance
folliculaire mais aussi la croissance de l'ovocyte. Etant donné que la
folliculogenèse et l'ovogénèse sont deux processus
étroitement liés (Monniaux et al., 2009), la
qualité des ovocytes dépend des conditions nutritionnelles sous
lesquelles le follicule a commencé son développement
c'est-à-dire au moment de son recrutement. En effet,
54
l'absence d'ovulation pendant la gestation est la
conséquence de l'atrésie des ovocytes et ce n'est qu'entre le
30e et 100e jour post-partum que le nombre d'ovocytes
augmente linéairement chez la vache (Kendrick et al., 1999).
55
CONCLUSION
Les ovaires récoltés à la suite des
abattages constituent une importante source d'ovocytes. La population
folliculaire ovarienne ainsi que la qualité des ovocytes sont d'une
grande importance pour la production in vitro d'embryons. Dans cette
étude, il était question d'évaluer le potentiel ovarien
des zébus pour la productionn in vitro d'ovocytes
fécondables à partir des ovaires récoltés à
l'abattoir. Les vaches et les ovaires ont été
caractérisés, la population folliculaire, le rendement et la
qualité ovocytaire déterminés. L'effet des facteurs
ovariens et non ovariens sur la population folliculaire, le rendement et la
qualité ovocytaire a été évalué. Les
résultats montrent que l'âge, l'état corporel et
l'état de gravidité des vaches donneuses ainsi que le volume et
le poids des ovaires influencent la population folliculaire, le rendement et la
qualité ovocytaires. Les ovocytes cultivables (I et II)
récoltés représentent 57,15 %. Ce résultat indique
que les ovaires des zébus de races locales élevés au
Cameroun possèdent un potentiel moyen pour la production in vitro
d'embryon. Afin d'optimiser la réussite de la maturation et de la
fécondation in vitro des ovocytes, les études futures
doivent tenir compte de certains facteurs qui influencent le rendement et la
qualité des ovocytes à savoir : l'âge des vaches donneuses
(< 10 ans), la note d'état corporel (= 3), l'état de non
gravidité, le poids (> 3 g) et le volume (> 2,25x1,75x1,25
cm3) des ovaires. Ce travail constitue une phase préliminaire
de la 2e génération des biotechnologies de l'embryon.
Nos perspectives sont celles de :
- réaliser toutes les étapes de la production
in vitro d'embryon : la capacitation des spermatozoïdes ; la
fécondation des ovocytes maturés ; le développement des
oeufs jusqu'au stade blastocyste ;
- utiliser cette technique pour multiplier et préserver
les races camerounaises en voie d'extinctions telles que les taurins Namchi et
Kapsiki.
56
BIBLIOGRAPHIE
Abdoon, A.S.S. 2001. Factors affecting follicular population,
oocyte yield and quality in camels (camelus dromedarius) ovary with
special reference to maturation time in vitro. Anim. Reprod. Sci. 66,
71À79.
Abraham, M.C., Gustafsson H., Ruete, A. and Brandt, Y.C.,
2012. Breed influences on in vitro development of abattoir-derived bovine
oocytes. Acta Veterinaria Scandinavica 54, 1-6.
Agrawal, K.P., Sharma, T., Sexana, C. and Sharma, N. 1995.
Chronology of first meiotic events of caprine oocytes matured in vitro.
Indian J. Anim. Sci. 65, 285-288.
Al-Katanani, Y. M., Paula-Lopes, F.F. and Hansen, P.J. 2002.
Effect of season and exposure to heat stress on oocyte competence in holstein
cows. J. Dairy. Sci. 85, 390-396.
Alves, B.G., Alves, A.K., Lucio, A.C., Martins, C.M., Silva,
T.H. and Santos, R.M. 2014. Ovarian activity and oocyte quality associated with
the biochemical profil of serum and follicular fluid from girolando dairy cows
postpartum. Anim. Reprod. Sci.
http://.dx.doi.org/10.1016/j.anireprosci.2014.02.019.
Armstrong, D.T. 2001. Effect of maternal age on oocyte
developmental competence. Theriogenology 55, 1303-1322.
Anguita, B.,Vandaele, L., Mateusen, B., Maes, D. and Soom,
A.V. 2007. Developmental competence of bovine oocytes is not related to
apoptosis incidence in oocytes, cumulus cells and blastocysts.
Theriogenology 67, 537À549.
Anna, A.A., Hisham, M.N., Khadijah, W.E.W. and Abdullah, R.B.
2013. Comparative study on goat oocytes recovery methods and factors affectings
the quantity and quality of oocytes. Asian journal of animal and veterinary
advances. 8, 437-448.
Bah, G.S., Ebangui, A.L., Niba, E.S., Manchang, T.K., Messine,
O. et Achukwi, A.D. 2010. Reproductive status of cows slaughtered at the
Ngaoundere municipal slaughter house and factors responsible for potential
losses in herd productivity. Int. J. Biol. Chem. Sci. 4(4),
916-923.
Blondin, P. and Sirard, M.A. 1995. Oocyte and follicular
morphology as determining characteristics for developmental competence in
bovine oocytes. Mol. Reprod. Dev. 41, 54À62.
Boni, R. 2012. Origins and effects of oocyte quality in
cattle. Anim. Reprod. 9, 333-340.
57
Camargo, L.S.A., Viana, J.H.M., SÁ, W.F., Ferreira,
A.M. and Filho, V.R.V. 2005. Developmental competence of oocytes from
prepubertal bos indicus crossbred cattle. Anim. Reprod. Sci.
85, 53À59.
Carolan, C.P., Monaghan, A., Mehmood, M., Lonergan, P. and
Gordon, I. 1992. Slicing of bovine ovaries as a means of oocyte recovery.
J. Reprod. Fertil : 9-51.
Carvalho, J.B., Carvalho, N.A., Reis, E.L., Nichi, M., Souza,
A.H, and Baruselli, P.S. 2008. Effect of early luteolysis in progesterone-based
timed ai protocols in bos indicus, bos indicus x bos
taurus, and bos taurus heifers. Theriogenology 69:
167-175.
Cetica, P.D., Dalvit, G.C. and Beconi, M.T. 1999. Study of
evaluation criteria used for in vitro bovine oocyte selection and maturation.
Biocell. 23, 125-133.
Cuq, P. et Agba, K. C. 1975. Les organes génitaux de la
femelle zébu. Rev. Elev. Méd. Vét Pays trop. 28,
331-403.
De Loose, F., Vliet, P.V., Maurik, P.V. and Kruip, T.A.M.
1989. Morphology of immature bovine oocytes. Gamete Res. 24,
197À204.
Derivaux, J., and F. Ectors. 1989. Reproduction chez les
animaux domestiques. Academia, Edition et Diffusion, Louvain-la-Neuve
I, 57-506.
Deuleuze, S., Pointhier, J. et Hanzen, C. 2009. Reproduction
assistée dans l'espèce équine : Collecte,
évaluation, maturation et utilisations d'ovocytes équins.
Ann. Méd. Vét. 153, 22-30.
Diskin, M.G., Mackey, D.R., Roche, J.F. and Screenan, J.M.
2003. Effects of nutrition and metabolic status on circulating hormones and
ovarian follicle development in cattle. Anim. Reprod. Sci. 78,
345-370.
Dominguez, M.M. 1995. Effects of body condition, reproductive
status and breed on follicular population and oocyte quality in cows.
Theriogenology 43, 1405-1418.
Driancourt, M. A., Gougeon, A., Monniaux, D., Royère,
D. and Thibault, C. 2001. Folliculogenèse et ovulation Dans : la
reproduction chez les mammifères et l'homme. Eds Ellipses INRA,
316- 322.
Driancourt, M. A., A. Gougeon, and D. Royere. 1991. La
fonction ovarienne. Dans : la reproduction chez les mammifères et
l'homme. Thibault C., Levasseur MC. Eds Ellipses INRA, 273- 298.
Drion, P.V., Beckers, J.F., Ectors, F.J., Hanzen, C.,
Houstain, J.Y., Lonergan, P. 1996. Régulation de la croissance
folliculaire et lutéale : Folliculogénèse et
atrésie. Le point vétérinaire 28. Spécial
reproduction des ruminants, 881-891.
58
Duygu, B.A., Muhammed, K.B., Dogan, N. and Hander, G. 2013.
Effect of the stage of oestrus cycle on follicular population oocyte yield and
quality, and biochemical composition of serum and follicular fluid in Anatolian
water buffalo. Anim. Reprod. Sci. 137, 8-114.
Ebangi, A.L., Erasmus, G.J., Mbah, D.A., Tawah, C.L. and
Ndofor-Foleng, H.M. 2011. Evaluation of level of inheritance in the growth
traits in the Gudali and Wakwa beef cattle breeds of Adamawa, Cameroon.
Lives. Res. Rural Dev. 23, Article #139. Retrieved August 25, 2014,
from
http://www.lrrd.org/lrrd23/6/eban23139.htm
Erickson, B. H. 1966. Developmental and senescence of the
postnatal bovine ovary. J. Anim. Sci. 25, 800-805.
Fassi, F. A. 2006. Collecte et maturation des ovocytes bovins
: Effet de l'état nutritionnel sur le rendement et la qualité des
ovocytes. 163 p. Thèse de Doctorat d'Etat Es-Sciences Biologiques,
Institut Agronomique et Vétérinaire Hassan II, Rabat.
Foudani, A.A., Waddington, D., and Cambell, K.H.S. 1998.
Maintenance of bovine oocytes in meiotic arrest and subsequent development in
vitro: A comparative evaluation of antral follicle culture with other method.
Biol. Reprod. 59, 255-262.
Ginther, O.J., Bashir, S.T., Santos, V.G. and Beg, M.A. 2013.
Contralateral ovarian location between the future ovulatory follicle and extant
corpus luteum increases the length of the luteal phase and number of
follicular waves in heifers. Theriogenology 79, 1130-1138.
Ginther, O.J., Hoffman, M. M. 2014. Intraovarian effect of
dominant follicle and corpus luteum on number of follicles during a
follicular wave in heifers. Theriogenology 79, 1130-1138.
Ginther, O.J., Knopf, L. and Kastelic, J.P. 1989. Ovarian
follicular dynamics in heifers during early pregnancy. Biol. Reprod.
41, 247-254.
Ginther, O.J., Kot, K., Kulick, L.J., Martin, S. and Wiltbank,
M.C. 1996. Relationship between FSH and ovarian follicular waves during the
last six months of pregnancy in cattle. J. Reprod. fert. 108,
271-279.
Hanzen, C., Lourtie, O. and Drion, P.V. 2000. Le
développement folliculaire chez la vache aspects morphologiques et
cinétiques. Ann. Méd. Vét. 144, 223-235.
Huang, Y.J., and Rosenwarks, Z. 2012. In vitro fertilization
treatment and factors affecting fertility. Pract. Rest. Cl., Obst.
Cynatecol. 26, 777-788.
Kendrick, K.W., Bailey, T.L., Garst, A.S., Pryor, A.W.,
Ahmadzadeh, A., Akers, R.M., Eyestone, W.E., Pearson, R.E., Gwazdauskas, G.
1999. Effects of energy balance on
59
hormones, ovarian activity, and recovered oocytes in lactating
holstein cows, using transvaginal follicular aspiration. J. Dairy Sci.
82, 1731-1740.
Kouamo, J., Sow, A., Leye, A., Sawadogo, G.J., et Ouedraogo,
G.A. 2009. Amélioration des performances de production et de
reproduction des bovins par l'utilisation de l'insémination artificielle
en Afrique sub-saharienne et au Sénégal en particulier :
État des lieux et perspectives. Revue Africaine de Santé et de
Productions Animales : Vol .7 N03-4, : 139-148.
Kumar, A., Solanki, S.K., Tripathi, V.N. and Jain, G.C. 1997.
Oocyte retrieval and histological studies of follicular population in buffalo
ovaries. Anim. Reprod. Sci. 47, 189-195.
Laizeau, J.S. 2003. Facteurs de variation de la production
d'embryons chez la vache laitière de race montbéliarde. 183 P.
Thèse de doctorat vétérinaire. École nationale
vétérinaire d'Alfort. Créteil, France.
Lhoste, P. 1991. Cattle genetic resources of West Africa. In
Hickman, C.G., ed. Cattle genetic resources, Amsterdam, the Netherlands,
Elsevier Science Publishers, 73-89.
Lhoste, P. 1969. Les races bovines de l'Adamaoua. Institut
d'élevage et de médecine vétérinaire des pays
tropicaux, 19.
Lucci, C.M., Figueiredo, J.R. and Bao, S.N. 2002. Zebu
(Bos indicus) ovarian preantral follicles: Morphological
characterization and development of an efficient isolation method.
Theriogenology 57, 1467-1483.
Lucy, M.C., Savio, J.D., Badinga, L., De La Sota, R.L. and
Thatcher, W.W. 1992. Factors that affect ovarian follicular dynamics in cattle.
J. Anim. Sci. 70, 3615-3626.
Lucyna, K., and Zdzisaw,S. 1984. Number and quality of oocytes
in relation to age of cattle. Anim. Reprod. Sci. 7: 451-460.
Machatkova, M., Krausova, K., Jokesova, E. and Tomanek, M.
2004. Developmental competence of bovine oocytes: Effects of follicle size and
the phase of follicular wave on in vitro embryo production. Theriogenology
61, 329-335.
Marichatou, H., Tamboura, H. et Amadou T. 2010.
Synchronisation des chaleurs et insémination artificielle bovine.
Production animale en Afrique de l'Ouest. CIRDES. Recommandations
techniques. Fiche n° 9. 8P.
Marieb, N. E. 1999. Anatomie et physiologie humaine,
éditions du renouveau pédagogique inc. the benjamin/cumming
publishing company inc, 1-1204.
Mauleon, P. 1961. Déroulement de
l'ovogénèse comparé chez différents
mammifères domestiques. Proc. ivth int Congr. Anim. Reprod. 2,
348-354.
60
Messine, O. 2003. Certain aspects of the reproductive
performance of zebu cattle in Cameroon. PhD thesis, University of the Free
State, Bloemfontein, South Africa.
MINEPIA (Ministère de l'Elevage, des Pêches et
des Industries Animales). 2009. Schéma directeur pour le
développement des filières de l'élevage au Cameroun,
volume II: cartographie des filières, 82p.
Monniaux, D., Caraty, A., Dalbies-Tran, R., Dupont, J., Fabre,
S., Mermillod, P. et Monget, P. 2009. Développement folliculaire ovarien
et ovulation chez les mammifères. Inra Prod. Anim. 22,
59-76.
Monniaux, D., Mandon-Pepin, B. and Monget, P. 1999.
L'atrésie folliculaire, un gaspillage programmé.
Médecine/sciences 15, 157-166.
Namdori, R.M., Potireddy, S. and Latham, K.E. 2008. Oocyte
quality and maternal control of development. International Review of Cell
and Molecular Biology 268: 223-262.
Natumanya, R., Owiny, D. and Kugonza, R. 2008. The potential
of Ankole cattle abattoir ovaries for in vitro embryo production.
African journal of Animal and Biomedical Sciences 3(1), 1819-4214.
Njoya, A., Bouchel, D., Ngo Ntama, A.C. Moussa, C.
Martrenchar, A. et Leteneur, L. 1997. Systèmes d'élevage et
productivité des bovins en milieu paysan au Nord-Cameroun. World
Animal Review 89, 12-23.
Norris, R.P., Freudzon, M., Mehlmann, L.M., Cowan, A.E.,
Lampe, P.D. et Jaffe, L.A. 2008. Luteinizing hormone causes map
kinase-dependent phosphorylation and closure of connexion 43 gap junctions in
mouse ovarian follicles: One of two paths to meiotic resumption.
Development 135, 3229-3238.
O'callaghan, D., and Boland, M.P. 1999. Nutritionnal effects
on ovulation, embryo development and the establishment of pregnancy in
ruminants. Anim. Science. 68, 299314.
Pedersen, H. G., E. D. Watson, and E. E. Elfer. 2004. Effect
of ovary holding temperature and time on equine granulosa cell apoptosis,
oocyte chromatin configuration and cumulus morphology. Theriogenology
62, 468-480.
Pierson, R.A. and Ginther, O.J. 1987a. Follicular population
during the estrous cycle in heifers. Influence of right and left side and
intraovarian effect of the corpus luteum. Anim. Reprod. Sci. 14,
177-186.
Pierson, R. A. and Ginther, O.J. 1987b. Intraovarian effect of
the corpus luteum on ovarian follicles during early pregnancy in heifers.
Anim. Reprod. Sci.15, 53-60.
61
Rajakoski, E. 1960. The ovarian follicular system in sexually
mature heifers with special reference to seasonnal, cyclical and left-right
variations. acta endocrinol. 52, 1-68.
Richards, J. S., Janhseh, T., Hedin, L., Lifka, J., Ratoosh,
S., Durica, J.M. and Golding, N.B. 1987. Ovarian follicular development from
physiology to molecular biology. Recent Prog. Horm. Res. 43: 231-276.
Ryan, D.P., Spoon, R.A., Griffith, M.K. and Williams, G.L.
1994. Ovarian follicular recruitment, granulosa cell steroidogenic potential
and growth hormone/insuline-like growth factor-i relationships in suckled beef
cows consuming high lipid diets: Effect of graded differences in body condition
maintained during the puerperium. Domest. Anim. Endocrinol. 11:
161-174.
Salomone, D.F., Adams, G.P. and Mapletoft, R.J. 1999. Changes
in the cumulus-oocyte complexe of subordinate follicles relative to follicular
wave status in cattle. Theriogenology 52, 549-561.
Samad, H.A., and Raza, A. 1999. Factors affecting recovery of
buffalo follicular oocytes. Pakistan vet. J. 2, 19.
Santos, S.S.D., Feirirra, M.A.P., Pinto, J.A., Sampaio, R.V.,
Carvalho, A.C., Silva, T.V.G., Costa, N.N., Cordeiro, M.S., Miranda, M.S.,
Ribeiro, H.F.L. and Ohashi, O.M. 2013. Characterization of folliculogenesis and
the occurrence of apoptosis in the development of the bovine fetal ovary.
Theriogenology 79, 344-350.
Sartorelli, E.S., Carvalho, L.M., Bergfelt, D.R., Ginther,
O.J. and Barros, C.M. 2005. Morphological characterization of follicle
deviation in Nelore (Bos indicus) heifers and cows. Theriogenology
63, 2382-2394.
Sartori, R. and Barros, C.M. 2011. Reproductive cycles in
Bos indicus cattle. Anim. Reprod. Sci. 124, 244-250.
Satrapa, R.A., Nabhan, T., SILVA, C.F., Simões, R.A.L.,
Razza, E.M., Puelker, R.Z., Trinc, L.A. and Barros, C.M. 2010. Influence of
sire breed (Bos indicus versus Bos taurus) and interval from
slaughter to oocyte aspiration on heat stress tolerance of in vitro-produced
bovine embryos. Theriogenology 76, 1162-1167.
Savio, J.D., Keenan, L., Boland, M. P., and Roche, J. F. 1988.
Pattern of growth of dominant follicles during the oestrous cycle of heifers.
J. Reprod. Fertil. 83, 663-671.
Seidel, G.E. and Seidel, S.M. 1989. Analysis of application of
embryo transfer in developing countries. Theriogenology 31(1),
3-16.
Shabankareha, H. K., Habibizadb, J., Sarsaifia, K.,
Cheghamirzac, K. and Jasemi, V.K. 2010. The effect of the absence or presence
of a corpus luteum on the ovarian follicular
62
population and serum oestradiol concentrations during the
estrous cycle in sanjabi ewes. Small Ruminant Research 93, 180-185.
Silva-Santos, K. C., Santos, G.M.G., Siloto, L.S., Hertel,
M.F., Andrade, E.R., Rubin, M.I.B., Sturion, L., Melo-Sterza, F.A. and Seneda,
M.M. 2011. Estimate of the population of preantral follicles in the ovaries
of Bos taurus indicus and Bos taurus taurus cattle.
Theriogenology 76, 1051À1057.
Sirard, M.A., Richard, F., Blondin, P. and Robert, C. 2006.
Contribution of the oocyte to embryo quality. Theriogenology 65:
126À136.
Sirois, J. and Fortune, J. E. 1988. Ovarian follicular
dynamics during the oestrus cycle in heifer monitored by real-time
ultrasonography. Biology of reproduction 39: 308-317.
Snijders, S.E., Dillon, P. O'callaghan, D. and Boland, M. P.
2000. Effect of genetic merit, milk yield, body condition and lactat number on
in vitro oocyte development in dairy cows. Theriogenology 53(4),
981-990.
Spicer, L.J., and Echterkamp, S.E. 1996. Ovarian follicular
growth, function and turnover in cattle: A review. J. Anim. Sci. 62,
428-451.
Stouffer, L.R. 2006. Structure, function, and regulation of
the corpus luteum. Knobil and
Neill's Physiology of Reproduction, Third Edition edited by
Jimmy D. Neill, 475-526. Schwarz, T., and E. Wierzcho. 2010. The distribution
of corpus luteum and ovarian follicular
development in pregnant goats. Reproductive biology
10 n° 1, 53-66.
Tanghe S., Van Soom A., Nauwynck H., Coryn M. and De Kruif A.,
2002. Mini review: Functions of the cumulus oophorus during oocyte
maturation, ovulation, and fertilization. Mol. Reprod. Dev. 61,
414-424.
Terret, M.E. and Wassmann, K. 2008. Meiotic weakness: the
first division. Med. Sci. (Paris): 24, 197-203.
Vall., C., Abakar, O. et Dongmo Ngoutsop, A.L. 2002. Note
d'état corporel des zébus de trait dans les savanes d'Afrique
centrale. N'Djamena, Tchad, fiches techniques du Prasac n° 13, 4.
Wang, Z. G., Song-Dong, Y. and Zi-Rong, X. 2007. Effects of
collection methods on recovery efficiency, maturation rate and subsequent
embryonic developmental competence of oocytes in Holstein cow. Asian-Aust.
J. Anim. Sci. 20(4), 496 - 500.
Wani, N.A., Wani, G.M., Khana, M. Z. and Salahudinb, S. 2000.
Effect of oocyte harvesting techniques on in vitro maturation and in
vitro fertilization in sheep. Small Ruminant Research 36,
63À67.
63
Wani, N.A., Wani, G.M., Khana, M.Z. and Sidiqi, M.A. 1999.
Effect of different factors on the recovery rate of oocytes for in vitro
maturation and in vitro fertilization procedures in sheep.
Small Ruminant Research 34, 71À76.
Ward, F.A., Lonergana, P., Ennght, B.P. and Boland, M.P. 2000.
Factors affecting recovery and quality of oocytes for bovine embryo production
in vitro using ovum pick-up technology. Theriogenology
54, 433-446.
Webb, R., Gong, J.G. and Bamley, T.A. 1994. Role of growth
hormone and intrafollicular peptides in follicle development in cattle.
Theriogenology 41, 25-30.
Yoshida M., Cran D.G. et Pursel V.G. 1993. Confocal and
fluorescence microscopic study using lectins of the distribution of cortical
granules during the maturation and fertilization of pig oocytes. Mol.
Reprod. Dev. 36, 462-468.
WEBOGRAPHIE
http://mapageweb.umontreal.ca/cabanat/bio2460/Gametogenese.html
64
ANNEXE
SCHEMAS DES ZEBUS EN FONCTION DE LEUR NEC
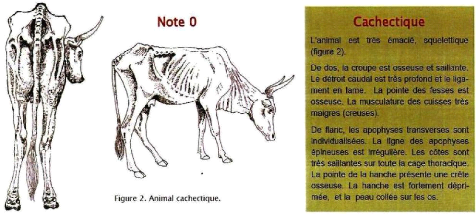
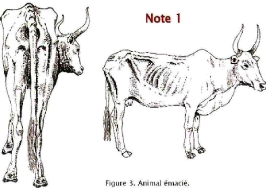
Note 1
Figure 3. Animal émacié.
65
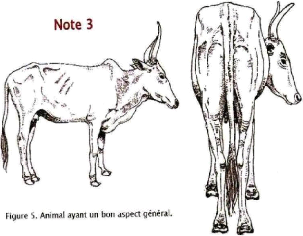
Figure 5. Animai ayant un bon aspect général.
|
Trop maigre
Animal trop maigre (figure 3)_
De dos, la croups est saillante. Le détroit caudal et
le ligament sont visibles, la pointe de la fesse est saillante et les cuisses
sont maigres_
De flanc, la ligne des apophyses transverses marque un angle
vif, La ligne des apophyses épineuses est marquée. les
côtes et les apophyses iliaques sont saillantes La hanche est très
marquée, sans muscles apparents.
|
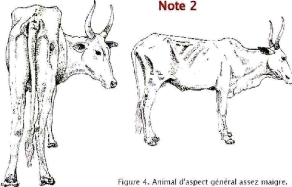
Note 2
Figure 4. Animal d'aspect général assez maigre.
Maigre
Animai d'aspect général assez maigre (figure
4).
De dos, la croupe est proéminente. Le détroit
caudal est naissant_ Le ligament est isolé et
légèrement couvert. Les pointes de la fesse sont
visibles_ Les musculatures de la cuisse sont fines.
De flanc, la ligne des apophyses transverses est saillante,
mais l'angle est non vif. La ligne des apophyses épineuses est peu
couverte. Les côtes sont apparentes a Var-riore de la cage thoracique.
Les apophyses iliaques sont apparentes avec un angle vit, Le creux de la hanche
est marqué, légèrement couvert.
|
Bon
Animal ayant un bon aspect général (figure 5).
De dos, la croupe est concave. Le détroit caudal est a
peine visible. Le ligament est; d'aspect épais et arrondi.
Les pointes de I$ fesse sont juste apparentes. La musculature des cuisses est
un peu rebondie_
De flanc, le ligne des apophyses transver ses est
marquée, l'angle n'est pas vif. La. ligne des apophyses épineuses
est perceptible. Les otites sont repérables. La pointe de le hanche est
visible. Le creux de la han-
loi
che est couvert de masse musculaire. '
|
66
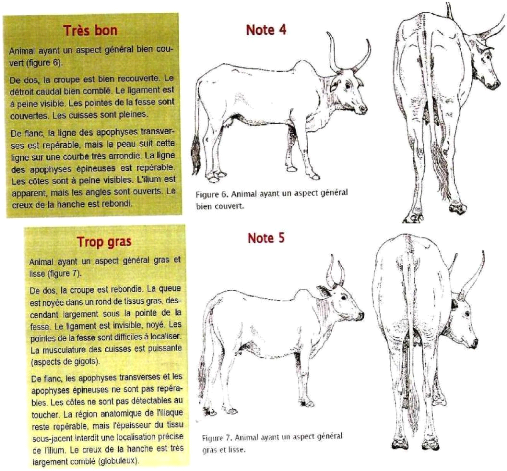
67



