CHAPITRE II : MATÉRIEL ET MÉTHODES
I. Site de l'étude
L'étude a été réalisée
pendant la période de novembre 2013 à juillet 2014 à
l'abattoir municipal de Ngaoundéré et au laboratoire de
physiologie et biotechnologie de la reproduction de l'IRAD-WAKWA dans la
Région de l'Adamaoua. Ngaoundéré est situé entre la
latitude 7° 19' 39 N et la longitude 13° 35' 4 E. Le climat est de
type soudano-sahélien et est caractérisé par une saison
sèche de novembre à mars et une saison de pluies d'avril à
octobre. La pluviométrie moyenne est de 1496,7 mm par an. La moyenne des
températures minimales enregistrées est de 15,2 ° C et celle
des températures maximales est de 29 ° C (station
météorologique de Ngaoundéré).
II. Animaux
Cette étude a porté sur 201 vaches qui
provenaient principalement du département de la Vina (Région de
l'Adamaoua) et du département du Mayo- Rey (Région du Nord).
Seules les vaches zébus ont été
considérées.
Dans les zones d'origine, les animaux sont
élevés de façon extensive. Ils paissent dans les
pâturages communautaires à l'exception des ranchs qui disposent
d'étendues plus ou moins délimitées et
clôturées. Bien que les éleveurs soient de plus en plus
sédentarisés, il existe encore des clans nomades (Mbororo
notamment) mais presque tous les éleveurs pratiquent la transhumance en
saison sèche, à la recherche d'eau et du fourrage pour leurs
animaux. A côté de cela, se trouvent également d'autres
systèmes notamment les systèmes semi-extensif et intensif
où on note l'intervention de l'homme dans l'amélioration des
performances de production et de reproduction à travers la
complémentation et la supplémentation de l'aliment, l'application
d'un programme de prophylaxie et la pratique des inséminations
artificielles. Les soins vétérinaires sont limités aux
campagnes de masse (vaccinations contre les épizooties, traitements
curatifs et préventifs contre les trypanosomoses, etc...).
29
III. Protocole expérimental III.1. Identification
de la race
La race a été identifiée sur les bases
des caractéristiques phénotypiques telles que décrites par
Lhoste (1969).
a) Zébu Goudali
Il s'agit d'un zébu de taille moyenne dont la bosse
est en général assez développée et tombante, la
tête assez longue et étroite et le profil légèrement
convexe. L'encolure est assez courte, le cornage court et plutôt fin. Le
fanon est assez développé. La conformation pour la viande est
assez satisfaisante grâce à un bon développement des masses
musculaires de l'arrière-main. Le squelette est en général
assez léger, la robe est le plus souvent tachetée de rouge; le
noir se rencontre rarement. La répartition du rouge est variable depuis
des types presque blancs avec seulement quelques mouchetures jusqu'à des
types uni-rouge ou brun.

Photo n ° 2 : Zébu Goudali
b) Zébus M'Bororos
Les zébus M'Bororos sont des animaux de grand format.
La tête est longue et le cornage, long et puissant, présente en
général une forme de lyre haute. L'encolure est longue et peu
musclée ; la croupe est peu charnue, la poitrine est étroite mais
profonde. Parmi ces groupes se distinguent trois races :
30
- zébu Akou ou white fulani
C'est un animal de grand format, de robe blanche parfois
mouchetée avec des muqueuses foncées. Le mufle, les oreilles et
les onglons sont en général noirs.

Photo n ° 3 : Zébu White Fulani -
zébus Djafoun ou Red fulani
La variété Djafoun est
caractérisée par une robe acajou uniforme et par des cornes en
forme de lyre implantées haut.

Photo n ° 4 : Zébu Red Fulani
31
c) Zébu Bokolo
C'est un animal de taille moyenne caractérisé
par une robe crème, une bosse peu développée et l'absence
des cornes.

Photo n ° 5 : Zébu Bokolo
III.2. Provenance des animaux
D'après les enquêtes menées auprès
des bouchers à l'abattoir, 61% des animaux étudiés
provenaient du département de la Vina et 39% du département du
Mayo Rey. Ces origines correspondent en réalité aux
marchés à bétail où les achats des animaux ont
été effectués ; les origines réelles des animaux
étaient difficiles à déterminer du fait qu'un même
animal peut transiter par plusieurs marchés à bétail.
III.3. Poids des vaches
Avant l'abattage, le périmètre thoracique (PTHO)
de chaque vache a été mesuré avec le mètre ruban.
Le poids a été calculé selon la formule : poids (kg) =
124,69 - 3,171 x PTHO + 0,0276 x PTHO2 (Njoya et al.,
1997).
III.4. Note d'état corporel
Chaque vache a été examinée avant
l'abattage pour déterminer sa note d'état corporel selon une
grille de notation allant de 0 à 5 d'après Vall et al.
(2003). La note d'état corporel globale a été
estimée pour chaque vache par :
- La note du flanc dont les repères anatomiques sont la
pointe de la hanche, les apophyses transverses et épineuses ;
32
- La note arrière dont les repères anatomiques
sont la base de la queue et la pointe des fesses, le ligament
sacro-tubéral, le détroit caudal et la ligne du dos.
C'est en fonction de la proéminence de ces
repères et de l'aspect saillant des os sous-jacents que l'on attribue
une note allant de 0 à 5. Le tableau I présente
les grilles d'évaluations de la NEC. Ces repères ont
été complétés par la palpation des amas graisseux
superficiels : les abords, le grasset, la côte.
Tableau I: Grille de notation de l'état corporel
des bovins
|
Note
|
état
|
Zone lombaire
|
Zone caudale
|
|
0
|
Cachectique
|
Apohyses épineuses et transverses visibles ;
vertèbres très visibles : la peau « rentre » sous les
apophyses.
|
Queue et pointes ischiales très saillantes ;
Détroit caudal très profond ;
Fesse pointue.
|
|
1
|
Très maigre
|
Apophyses transverses très saillantes ;
vertèbres visibles, couvertures musculaires limitées, la peau
« suit » les apophyses.
|
Queue très saillante, pointe de la
fesse saillante, détroit caudal
profond.
|
|
2
|
Maigre
|
Apophyses transverses visibles mais non proéminentes ;
ligne transverse concave.
|
Queue saillante, détroit caudal
creux, pointe de la fesse arrondie
|
|
3
|
Normal
|
Apophyses transverses discernables à la palpation ;
ligne transversale légèrement concave ; hanche arrondies et
lisses.
|
Queue saillante ; ligne queue
pointe de la fesse lisse ou
légèrement concave ; détroit
caudal
effacé.
|
|
4
|
Gras
|
Apophyses transverses invisibles mais hanches
perceptibles ; ligne transversale plate ou
légèrement convexe.
|
Queue entourée de graisse mais
proéminente ; détroit caudal
comblé.
|
|
5
|
Très gras
|
Apophyses transverses invisibles mais hanches
perceptibles ; ligne transversale convexe.
|
Queue enfouie, parfois entouré de bourrelets.
|
Source : Vall et al. (2003).
Les vaches ont été classées en 3
catégories selon Natumyana et al. (2008) : note 1-2 : maigre ;
note 3 : Moyenne ; note 4-5 : grasse.
33
III.5. Age
Après l'abattage, l'âge a été
déterminé par l'examen de la dentition ou des cornes.
Tableau II: Méthode de détermination de
l'âge des bovins
|
Dentition
|
Nombres des sillons/Cornes
|
Age de la vache
|
|
Dents de lait
|
Absent
|
< à 2 ans
|
|
Eruption des pinces
|
2 ans
|
|
Eruption des premières mitoyennes
|
1
|
3 ans
|
|
Eruption des deuxièmes mitoyennes
|
2
|
4 ans
|
|
Eruption des coins
|
3
|
5 ans
|
|
Rasement des incisives
|
4
|
6 ans
|
|
Nivellement des pinces
|
5
|
7 ans
|
|
Nivellement des premières mitoyennes
|
6
|
8 ans
|
|
Nivellement des deuxièmes mitoyennes
|
7
|
9 ans
|
|
Nivellement des coins
|
8
|
10 ans
|
|
Ecartement des dents
|
9
|
11 ans
|
|
10
|
12 ans
|
|
11
|
13 ans
|
|
12
|
14 ans
|
|
13
|
15 ans
|
Source : Fassi et al. (2006)
Pour la détermination de l'âge par les cornes, la
formule suivante a été utilisée : Age (en années) =
N + 2, avec N représentant le nombre des sillons et 2 une constante.
Les vaches ont été classées en groupes
d'âges : 3 = âge < 6 ans, 6 = âge < 10 ans et 10=
âge = 15 ans selon Lucyna et Zdzislaw (1984).
III.6. Statut physiologique
Après l'abattage et l'éviscération,
l'utérus a été examiné afin de déterminer
l'état physiologique de la vache. Si celle-ci est gravide, le foetus
était retiré par incision de l'utérus et son âge
approximatif déterminé à partir de la formule Y= X (X+2)
où X représente le nombre de mois de gestation, 2 une constante
et Y la longueur nuque-croupe en centimètres (Santos et al.,
2013). La longueur nuque-croupe était mesurée à
partir de l'éminence frontale jusqu'à la jonction
sacrée-coccygienne (ischium). Le stade de gravidité a
été ensuite classé en premier trimestre (1 à 90
jours), deuxième trimestre (91 à 180 jours) et troisième
trimestre (> à 180 jours).
34
III.7. Prélèvement des ovaires
Après identification et abattage de chaque vache, les
ovaires ont été prélevés par section du ligament
large à l'aide des ciseaux. Ensuite, l'ovaire droit est placé
dans un tube conique contenant un milieu isotonique (NaCl, 0.9%) avec la
pénicilline-streptomycine (0,5 mg/ml), et l'ovaire gauche dans un autre.
Après la collecte, les tubes contenant les ovaires ont été
mis dans un container isotherme à la température de 30-32°
C, puis transportés au laboratoire endéans les 2 heures qui
suivaient l'abattage. Les ovaires présentant des pathologies (kystes)
ont été exclus (Wang et al., 2007).
III.8. Détermination du poids et de la taille des
ovaires
Au laboratoire, les ovaires ont été
débarrassés de débris tissulaires (ligament large
attachés sur l'ovaire) et ont été pesés avec une
balance électronique de type Mettler PC 2000 (photo
n° 6) avec une précision de 0,01. En fonction de leur
poids, les ovaires ont été répartis en trois groupes :
petits (< à 3 g), moyens (3 à 5 g) et gros (> à 5
g).

Photo n ° 6 : Détermination du poids de
l'ovaire
La taille (longueur, largeur et épaisseur) de l'ovaire
a été mesurée à l'aide d'un calliper
électronique (Photo n° 7). En fonction de ce
facteur, les ovaires ont été répartis en deux groupes :
volume ovarien inférieur à 2,25x1,75x1,25 cm3 et
supérieur à 2,25x1,75x1,25 cm3 (Samad et Raza.,
1999).

Photo n ° 7 : Détermination de la taille de
l'ovaire
III.9. Identification du corps jaune
Le corps jaune (photo n° 8) est une
glande endocrine transitoire du fait de sa durée
éphémère. C'est une structure qui est formée
à partir du follicule qui a ovulé. Son identification sur
l'ovaire était basée sur sa forme et sa couleur. Le corps jaune
mature a une forme en « bouchon sphérique », et une couleur
grise.
Photo n ° 8 : Ovaire portant un corps
jaune
III.10. Détermination de la population
folliculaire
Pour chaque vache, les follicules visibles (photo
n° 9) à la surface de l'ovaire ont été
comptés. Le diamètre folliculaire a été
mesuré et les follicules ont été classés en 3
catégories : petits (CD < 3 mm), moyens (3 = CD = 8 mm) et gros (CD
> 8 mm) selon Duygu et al. (2013). Les ovaires ont
été ensuite rincés avec une solution physiologique de NaCl
à 0,9 % contenant de la pénicilline-streptomycine à la
dose de 0,5 mg/ml. Ils ont été gardés dans un bain marie
à une température de 30° C pendant toute la durée de
leur examen.
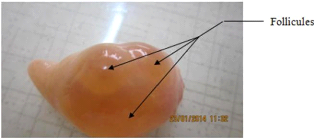
35
Photo n ° 9 : Ovaire portant des
follicules
III. 36
11. Collecte et classification des ovocytes
La technique de slicing (incision) des ovaires (Wang et
al., 2007) a été utilisée pour collecter les
ovocytes. Chaque ovaire a été placé dans une boîte
de pétri contenant 5 ml de la solution du DPBS. De petites incisions ont
été faites sur toute la surface de l'ovaire à l'aide d'une
lame de bistouri pour obtenir les ovocytes, l'ovaire étant maintenu avec
des pinces à dents de souris.
Une fois collectés et rincés dans une solution
de DPBS, les ovocytes ont été examinés et comptés
sous stéréoscope à l'objectif 10X (photo n° 10). Les
ovocytes ont été ensuite classés en 4 qualités en
tenant compte de l'homogénéité du cytoplasme et des
couches des cellules du cumulus oophorus selon De Loose et al. (1989)
et Alves et al. (2014).
- Qualité 1 : Cumulus compacté ayant plus de trois
couches à cytoplasme homogène ; - Qualité 2 : Cumulus
compacté à une ou deux couches et un cytoplasme homogène ;
- Qualité 3: Cumulus peu compacté à cytoplasme peu
régulier avec des zones sombres ; - Qualité 4 : Sans cumulus,
avec un cytoplasme irrégulier.
Pour évaluer la qualité globale des ovocytes,
un index a été calculé : [qualité Ix1+
qualité II x 2+qualité III x 3+qualité IVx4] / nombre
total des ovocytes (Duygu et al., 2013). Une valeur tendant vers 1
reflète une bonne qualité globale des ovocytes.
IV. Analyses statistiques
Les données ont été analysées avec
le logiciel Statistical Package for Social Sciences (SPSS), version 20. Le test
de Shapiro-Wilk a été utilisé pour le test de
normalité des observations ou valeurs. Les données des follicules
et ovocytes qui ne suivent pas une distribution normale ont été
transformées par le logarithme Népérien. L'analyse de la
variance (ANOVA) à un facteur a été effectuée pour
évaluer l'effet des facteurs ovariens et non ovariens sur la population
folliculaire, le rendement et la qualité ovocytaire. Les
différences entre moyennes ont été testées par le
test de Duncan's. Pour les données non normales, le test de
Krustal-Wallis a été utilisé pour la comparaison des
différentes moyennes. Toutes les données ont été
représentées sous la forme de moyenne #177; ESM (Erreur Standard
de la Moyenne) au seuil de 5 %.
37
CHAPITRE III : RÉSULTATS ET DISCUSSION I.
Résultats
I.1. Caractérisation des vaches abattues et des
ovaires I.1.1. Race
Sur les 201 vaches étudiées, 92 étaient de
race Goudali, 50 de race White Fulani (Akou), 31 de race Red Fulani (Djafoun)
et 20 de race Bokolo (figure 10).
effectifs relatifs
45%
40%
25%
20%
50%
35%
30%
15%
10%
0%
5%
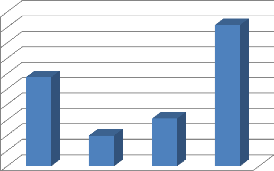
28,86%
9,95%
15,42%
45,77%
Akou Bokolo Djafoun Goudali
race
Figure 10: Distribution des vaches en fonction de la
race
I.1.2. Age
L'âge des vaches abattues variait entre 3 et 15 ans. Avec
une moyenne de 6,80 #177; 0,15, la plupart des vaches avait un âge
compris entre 6 et 10 ans (tableau III).
Tableau III : Répartition des vaches en fonction
de l'âge
Groupe d'âges Effectif Pourcentage
3 - 6 ans 55 27,4
6 - 10 ans 108 53,7
10 - 15 ans 38 18,9
TOTAL 201 100
38
I.1.3. NEC
L'évaluation morphologique des vaches a montré
que la note d'état corporel des vaches abattues variait entre 1 et 5 ;
avec une moyenne de 2,67#177;0,06. Plus de la moitié (59,7 %) des vaches
avaient une NEC = 3 (figure 11).
effectifs relatifs
40,00%
20,00%
60,00%
0,00%
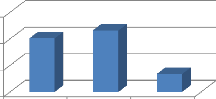
40,30%
46,27%
13,43%
Faible Moyenne élevée
Note d'état corporel
Figure 11 : Distribution des vaches en fonction de la NEC
I.1.4. Statut physiologique
Plus de la moitié (52,2%) des vaches étaient
gravides. Le tableau IV présente leur
répartition en fonction de leur statut physiologique et de la
gravidité.
Tableau IV : Répartition des vaches en fonction
du statut physiologique
|
Statut physiologique
|
Effectifs
|
Pourcentage
|
|
Non gravides
|
96
|
47,8
|
|
Gravides
|
105
|
52,2
|
|
? 1er trimestre
|
53
|
26,4
|
|
? 2e trimestre
|
32
|
15,9
|
|
? 3e trimestre
|
20
|
9,9
|
I.1.5. Corps jaune
Cent quarante vaches (69,7%) possédaient un corps jaune
sur l'un ou l'autre ovaire contre soixante une (30,3%) qui n'en
possédaient pas.
I.1.6. Poids des ovaires et des vaches
Le poids moyen de l'ovaire était de 4,60#177;1,82 g et
ceux de l'ovaire droit et gauche de 4,99#177;2,48g et 4,22#177;2,15 g
respectivement. Il est à noter que l'ovaire droit pèse plus que
l'ovaire gauche. Le poids moyen des vaches était de 382,08#177;70,73
Kg.
39
Le tableau V présente la variation du
poids des ovaires et des vaches en fonction de la race, de la NEC, de
l'âge, du statut physiologique et de la présence ou non du corps
jaune. Il ressort de ce tableau que les vaches gravides ont des ovaires plus
lourds (P < 0 ,05). De même, les ovaires porteurs de corps jaune sont
plus lourds (P < 0 ,05). La race et l'âge des vaches n'ont aucun effet
(P > 0 ,05) sur le poids des ovaires, alors que la note d'état
corporel a une influence significative. Les ovaires des vaches ayant une NEC =
3 sont plus lourds (p < 0,05). Bien que la race Goudali ait tendance
à avoir un poids plus élevé que les autres races, la
différence n'est pas significative (p > 0,05). Par contre, le poids
des vaches augmente de façon significative (p < 0,05) avec la note
d'état corporel, la présence du corps jaune et de l'état
gravidique.
Tableau V : Variation du poids des ovaires et des
vaches en fonction de la race, de la NEC, de l'âge, du
statut
physiologique et du corps jaune (moyenne #177; ESM)
|
Facteurs
|
|
N
|
Poids moyen ovaire droit
|
Poids moyen Ovaire gauche
|
Poids
Moyen ovaire
|
Poids
de l'animal
|
|
Akou
|
50
|
5,07#177;0,32a
|
4,20#177;0,26a
|
4,63#177;0,23a
|
348,27#177;7,97a
|
|
Bokolo
|
20
|
4,99#177;0,87a
|
3,41#177;0,36a
|
4,20#177;0,27a
|
354,90#177;12,76a
|
|
Race
|
Djafoun
|
31
|
4,62#177;0,58a
|
4,56#177;0,42a
|
4,59#177;0,42a
|
364,35#177;13,35a
|
|
Goudali
|
92
|
5,05#177;0,24a
|
4,28#177;0,23a
|
4,67#177;0,18a
|
373,72#177;6,70a
|
|
P-value
|
|
0,546
|
0,675
|
0,776
|
0,654
|
|
Faible
|
81
|
4,35#177;0,24a
|
3,78#177;0,22a
|
4,06#177;0,18a
|
339,05#177;5,51a
|
|
NEC
|
Moyenne
|
93
|
5,30#177;0,26b
|
4,45#177;0,24b
|
4,87#177;0,26a
|
366,07#177;6,88b
|
|
Elevée
|
27
|
5,82#177;0,55b
|
4,70#177;0,37b
|
5,26#177;0,31b
|
424,70#177;11,11c
|
|
P-value
|
|
0,007
|
0,027
|
0,002
|
0,000
|
|
3 - 6
|
55
|
4,79#177;0,28a
|
3,87#177;0,22a
|
4,33#177;0,19a
|
357,44#177;9,86a
|
|
Age
|
6 - 10
|
108
|
5,12#177;0,25a
|
4,28#177;0,21a
|
4,70#177;0,18a
|
372,32#177;5,43a
|
|
10 - 15
|
38
|
4,87#177;0,45a
|
4,52#177;0,42a
|
4,69#177;0,33a
|
373,81#177;10,65a
|
|
P-value
|
|
0,923
|
0,063
|
0,441
|
0,581
|
|
Statut
|
Non gestante
|
96
|
4,26#177;0,20a
|
3,54#177;0,18a
|
3,90#177;0,16a
|
339,09#177;5,83a
|
|
Gestante
|
105
|
5,65#177;0,26b
|
4,84#177;0,22b
|
5,24#177;0,17b
|
384,97#177;6,23b
|
|
physiologique
|
P-value
|
|
0,000
|
0,000
|
0,000
|
0,000
|
|
Absent
|
61
|
3,57#177;0,18a
|
3,22#177;0,16a
|
3,39#177;0,16a
|
333,29#177;7,60a
|
|
Corps jaune
|
Présent
|
140
|
5,60#177;0,22b
|
4,22#177;0,15b
|
5,12#177;0,15b
|
376,03#177;5,32b
|
|
P-value
|
|
0,000
|
0,009
|
0,000
|
0,000
|
a,b,c :les moyennes dans une colonne avec des exposants
différents sont significatives (P<0,05)
40
I.1.7. Taille des ovaires
Les dimensions moyennes de l'ovaire étaient de
2,78#177;0,55 cm pour la longueur, 1,90#177;0,42 cm pour la largeur et de
1,27#177;0,33 cm pour l'épaisseur.
Le tableau VI montre la variation de la
taille de l'ovaire en fonction de la race, de la NEC, de l'âge, du statut
physiologique et de la présence ou non du corps jaune.
Il ressort de ce tableau que : la longueur de l'ovaire
augmente significativement avec l'âge (p < 0,05) ; l'épaisseur
de l'ovaire est plus réduite (p < 0,05) chez les vaches maigres. Les
dimensions des ovaires augmentent avec l'état gravidique et la
présence du corps jaune (p < 0,05).
41
Tableau VI : Variation de la taille des ovaires en
fonction de la race, de la NEC, de l'âge, du statut physiologique et de
la présence ou non du corps jaune (moyenne#177;ESM).
|
FACTEURS
|
|
N
|
Longueur moyenne OG
|
Longueur moyenne OD
|
Longueur moyenne ovaire
|
Largeur Moyenne OG
|
Largeur
moyenne
OD
|
Largeur
moyenne
ovaire
|
Epaisseur
moyenne
OG
|
Epaisseur
moyenne
OD
|
Epaisseur
moyenne
Ovaire
|
|
Akou
|
58
|
2,67#177;0,54a
|
2,91#177;0,55a
|
2,79#177;0,06a
|
1,84#177;0,37a
|
1,97#177;0,39a
|
1,90#177;0,04a
|
1,21#177;0,27a
|
1,33#177;0,33a
|
1,27#177;0,03a
|
|
Bokolo
|
20
|
2,61#177;0,52a
|
2,74#177;0,37a
|
2,68#177;0,08a
|
1,75#177;0,44a
|
2,07#177;0,49a
|
1,91#177;0,05a
|
1,09#177;0,33a
|
1,34#177;0,35a
|
1,21#177;0,55a
|
|
Races
|
Djafoun
|
31
|
2,78#177;0,47a
|
2,86#177;0,58a
|
2,82#177;0,09a
|
1,95#177;0,45a
|
1,84#177;0,45a
|
1,89#177;0,06a
|
1,31#177;0,33a
|
1,26#177;0,41a
|
1,29#177;0,05a
|
|
Goudali
|
92
|
2,68#177;0,59a
|
2,86#177;0,55a
|
2,77#177;0,05a
|
1,82#177;0,42a
|
1,97#177;0,43a
|
1,90#177;0,03a
|
1,25#177;0,34a
|
1,35#177;0,52a
|
1,30#177;0,03a
|
|
p-value
|
|
0,716
|
0,681
|
0,767
|
0,354
|
0,274
|
0,998
|
0,100
|
0,797
|
0,565
|
|
Faible
|
81
|
2,60#177;0,51a
|
2,76#177;0,48a
|
2,68#177;0,05a
|
1,77#177;0,40a
|
1,84#177;0,40a
|
1,81#177;0,03a
|
1,15#177;0,29a
|
1,22#177;0,31a
|
1,18#177;0,02a
|
|
Moyenne
|
93
|
2,76#177;0,60a
|
2,93#177;0,60a
|
2,85#177;0,06a
|
1,88#177;0,42a
|
2,04#177;0,43a
|
1,96#177;0,03b
|
1,29#177;0,33b
|
1,40#177;0,52b
|
1,34#177;0,03b
|
|
NEC
|
Elevée
|
27
|
2,72#177;0,44a
|
2,93#177;0,43a
|
2,82#177;0,06a
|
1,89#177;0,40a
|
1,96#177;0,43a
|
1,97#177;0,04b
|
1,31#177;0,34b
|
1,42#177;0,42b
|
1,36#177;0,05b
|
|
p-value
|
|
0,129
|
0,094
|
0,066
|
0,175
|
0,055
|
0,052
|
0,007
|
0,014
|
0,002
|
|
3 - 6 ans
|
55
|
2,50#177;0,46a
|
2,67#177;0,46a
|
2,58#177;0,05a
|
1,77#177;0,33a
|
1,93#177;0,35a
|
1,85#177;0,03a
|
1,28#177;0,34a
|
1,32#177;0,30a
|
1,30#177;0,03a
|
|
Age
|
6 À 10 ans
|
108
|
2,75#177;0,55b
|
2,94#177;0,55b
|
2,84#177;0,05b
|
1,87#177;0,44a
|
1,99#177;0,34a
|
1,92#177;0,03a
|
1,23#177;0,30a
|
1,31#177;0,34a
|
1,27#177;0,02a
|
|
10 - 15 ans
|
38
|
2,81#177;0,60b
|
2,92#177;0,54b
|
2,86#177;0,08b
|
1,84#177;0,43a
|
1,93#177;0,53a
|
1,89#177;0,06a
|
1,19#177;0,35a
|
1,40#177;0,76a
|
1,29#177;0,07a
|
|
p-value
|
|
0,009
|
0,007
|
0,003
|
0,348
|
0,658
|
0,302
|
0,376
|
0,575
|
0,763
|
|
Statut
|
Non gestante
|
96
|
2,53#177;0,49a
|
2,70#177;0,47a
|
2,62#177;0,04a
|
1,70#177;0,37a
|
1,88#177;0,39a
|
1,79#177;0,03a
|
1,14#177;0,29a
|
1,22#177;0,30a
|
1,18#177;0,02a
|
|
physio-
|
Gestante
|
105
|
2,84#177;0,56b
|
3,01#177;0,56b
|
2,92#177;0,05b
|
1,96#177;0,41b
|
2,04#177;0,45b
|
2,00#177;0,03b
|
1,32#177;0,33b
|
1,42#177;0,52b
|
1,37#177;0,02b
|
|
logique
|
p-value
|
|
0,000
|
0,000
|
0,000
|
0,000
|
0,010
|
0,000
|
0,000
|
0,001
|
0,000
|
|
Absent
|
61
|
2,56#177;0,50a
|
2,64#177;0,43a
|
2,60#177;0,05a
|
1,66#177;0,29a
|
1,72#177;0,26a
|
1,69#177;0,03a
|
1,07#177;0,19a
|
1,11#177;0,19a
|
1,09#177;0,02a
|
|
Corps jaune
|
Présent
|
140
|
2,75#177;0,56b
|
2,96#177;0,55b
|
2,85#177;0,04b
|
1,92#177;0,43b
|
2,06#177;0,45b
|
1,99#177;0,02b
|
1,30#177;0,34b
|
1,43#177;0,48b
|
1,36#177;0,02b
|
|
p-value
|
|
0,024
|
0,000
|
0,001
|
0,000
|
0,000
|
0,000
|
0,000
|
0,000
|
0,000
|
a,b,c :les moyennes dans une colonne avec des exposants
différents sont significatives (P<0,05) OD : Ovaire Droit, OG :
Ovaire Gauche
I.2. 42
Population folliculaire
Sur un total de quatre cent deux (402) ovaires
récoltés, six milles sept quarante-sept (6747) follicules ont
été obtenus soit une moyenne de 16,75#177;0,83 par ovaire. Le
nombre de follicules de diamètre inférieur à 3 mm varie de
0 à 55 ; celui des follicules de diamètre compris entre 3-8 mm de
0 à 47 et de 0 à 2 pour les follicules de diamètre
supérieure à 8 mm. La figure 12
représente la répartition des follicules en fonction de
la taille.
1,25%
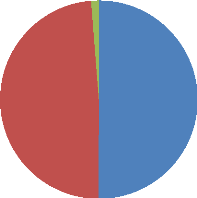
48,63%
50,12%
Follicules de diamètre < à 3 mm :
8,39#177;0,60
Follicules de diamètre compris entre 3 et 8mm :
8,14#177;0,43 Follicules de diamètre > à 8 mm :
0,21#177;0,02
Figure 12: Répartition du
nombre des follicules en fonction de leur diamètre
I.3. Rendement en ovocyte
Quatre mille quatre cent onze (4411) ovocytes de qualité
I, II, III et IV ont été récoltés des 402 ovaires,
soit un rendement moyen en ovocytes par ovaire de 10,97#177;0,43.
43
I.4. Qualité des ovocytes
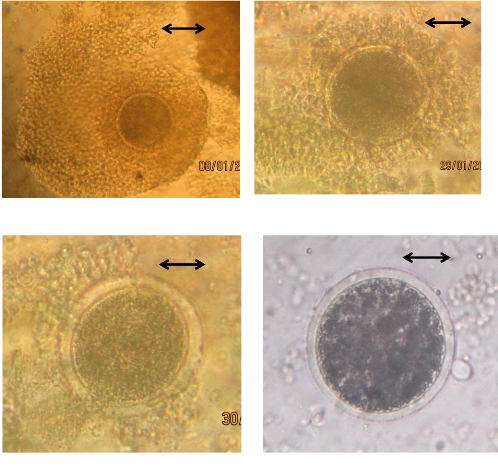
Les ovocytes ont été classés en quatre
qualités : I, II, III et IV (photo n° 10).
(C)
(D)
30 um
30 um
(B)
(A)
30 um
30 um
Photo n ° 10 : Complexe
Ovocyte-Cumulus
(A) : Cumulus compacté avec plus de 3 couches et
à cytoplasme homogène (COC-I) ;
(B) : Cumulus compacté avec une ou deux couches et un
cytoplasme homogène (COC-II) ;
(C) : Cumulus peu compacté à cytoplasme peu
régulier avec des zonez sombres (COC-III) ;
(D) : Cumulus dénudé ou absent, avec un
cytoplasme moins régulier (COC-IV).
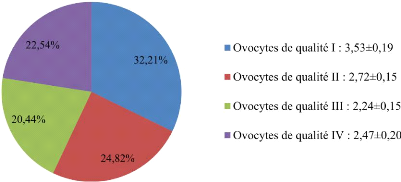
La figure 13 présente la
répartition des ovocytes (moyenne #177;ESM) en fonction de leur
qualité. Les ovocytes jugés de bonne qualité pour la
maturation et la fécondation in vitro (qualité I et II)
représentent une moyenne de 6,27#177;0,32 par ovaire soit un pourcentage
de 57,15% (2515). L'index de la qualité ovocytaire (IQO) était de
2,26.
44
Figure 13 : Répartition des ovocytes en fonction
de leur qualité
I.5. Effet des facteurs ovariens sur la population
folliculaire, le rendement et la qualité des ovocytes.
Les tableaux VII et VIII présentent
l'effet de la localisation ovarienne, de la présence ou non du corps
jaune, du poids et de la taille de l'ovaire sur la population folliculaire, le
rendement et la qualité des ovocytes.
Tableau VII: Variation du nombre des follicules en
fonction des facteurs ovariens (moyenne #177; ESM)
|
Facteurs
|
|
N
|
Nombre des follicules/ovaire
|
Follicules
totaux/ovaire
|
|
Petits
(< 3mm)
|
Moyens (3-8 mm)
|
Gros
(> 8 mm)
|
|
|
Localisa-
|
Droit
|
201
|
8,24#177;0,62a
|
8,45#177;0,47a
|
0,25#177;0,04a
|
16,95#177;0,86a
|
|
tion
|
Gauche
|
201
|
8,55#177;0,64a
|
7,83#177;0,48a
|
0,18#177;0,03a
|
16,57#177;0,88a
|
|
ovarienne
|
p-value
|
|
|
|
|
0,756
|
|
Corps
|
Absent
|
260
|
8,99#177;0,57a
|
7,31#177;0,38a
|
0,23#177;0,03a
|
16,53#177;0,73a
|
|
jaune
|
Présent
|
142
|
7,31#177;0,70a
|
9,68#177;0,64b
|
0,18#177;0,03a
|
17.17#177;1,12a
|
|
P-value
|
|
|
|
|
0,623
|
|
Poids de
|
< 3
|
134
|
5,33#177;0,52a
|
5,74#177;0,49a
|
0,25#177;0,04a
|
11,32#177;0,79a
|
|
l'ovaire
|
3 - 5
|
134
|
7,55#177;0,65b
|
7,94#177;0,53b
|
0,24#177;0,04a
|
16,47#177;0,88b
|
|
(g)
|
>5
|
134
|
11,41#177;0,99c
|
10,75#177;0,63c
|
0,16#177;0,03a
|
22,49#177;1,26c
|
|
P-value
|
|
|
|
|
0,000
|
|
volume de
|
<2,25x1,75x1,25
|
142
|
5,07#177;0,40a
|
6,21#177;0,40a
|
0,29#177;0,05a
|
11,57#177;0,60a
|
|
l'ovaire
|
>2,25x1,75x1,25
|
174
|
10,81#177;0,79b
|
10,72#177;0,60b
|
0,18#177;0,03a
|
21,71#177;1,10b
|
|
(cm3)
|
P-value
|
|
|
|
|
0,000
|
a,b,c :les moyennes dans une colonne avec des exposants
différents sont significatifs
(P<0,05)
45
Tableau VIII : Variation du rendement et la
qualité des ovocytes en fonction des facteurs ovariens
(moyenne#177;ESM).
|
Facteurs
|
N
|
Rendement ovocytaire/ovaire
|
|
Qualité ovocytaire
|
|
Ovocytes cultivables
|
|
I
|
II
|
III
|
IV
|
I et II
(%)
|
|
Localisation
|
Droit
|
201
|
11,28#177;0,62a
|
3,55#177;0,22a
|
2,83#177;0,18a
|
2,30#177;0,17a
|
2,60#177;0,26a
|
6,38#177;0,36a (56,56)
|
|
ovarienne
|
Gauche
|
201
|
10,67#177;0,60a
|
3,52#177;0,21a
|
2,62#177;0,18a
|
2,17#177;0,17a
|
2,36#177;0,19a
|
6,13#177;0,35a (57,45)
|
|
p-value
|
|
0,756
|
|
|
|
|
0,631
|
|
Corps
|
Absent
|
260
|
11,51#177;0,53a
|
3,58#177;0,19a
|
2,86#177;0,16a
|
2,37#177;0,15a
|
2,70#177;0,21a
|
6,44#177;0,31a (55,95)
|
|
jaune
|
Présent
|
142
|
9,99#177;0,75a
|
3,45#177;0,28a
|
2,47#177;0,19a
|
2,08#177;0,19a
|
2,07#177;0,24a
|
5,92#177;0,43a (59,25)
|
|
P-value
|
|
0,095
|
|
|
|
|
0,330
|
|
Poids de
|
< 3
|
134
|
8,44#177;0,59a
|
2,66#177;0,22a
|
2,09#177;0,22a
|
1,78#177;0,18
|
1,90#177;0,21
|
4,75#177;0,35a (56,27)
|
|
l'ovaire
|
3 - 5
|
134
|
11,39#177;0,74b
|
3,51#177;0,24b
|
3,51#177;0,24b
|
2,29#177;0,20
|
2,59#177;0,33
|
6,50#177;0,44b (57,07)
|
|
(en g)
|
>5
|
134
|
13,09#177;0,84b
|
4,43#177;0,32b
|
4,43#177;0,32b
|
2,64#177;0,23
|
2,93#177;0,28
|
7,51#177;0,48b (57,37)
|
|
P-value
|
|
0,000
|
|
|
|
|
0,000
|
|
Volume de
|
<2,25x1,75x1,25
|
142
|
8,57#177;0,57a
|
2,65#177;1,93a
|
2,15#177;0,17a
|
1,68#177;0,17a
|
2,08#177;0,22a
|
4,80#177;0,33a (56,00)
|
|
l'ovaire (cm3)
|
>2,25x1,75x1,25
|
174
|
12,57#177;0,73b
|
4,14#177;0,26b
|
3,16#177;0,21b
|
2,58#177;0,19b
|
2,69#177;0,23a
|
7,30#177;0,42b (58,07)
|
|
P-value
|
|
0,000
|
|
|
|
|
0,000
|
a,b,c :les moyennes dans une colonne avec des exposants
différents sont significatifs (P<0,05).
46
I.5.1. Localisation ovarienne
La position gauche ou droite de l'ovaire n'a aucun effet
significatif (P > 0,05) sur la population folliculaire, le rendement et la
qualité des ovocytes. Toutefois, l'ovaire droit a tendance à
avoir plus de follicules et d'ovocytes que l'ovaire gauche.
I.5.2. Corps jaune
Le corps jaune n'a aucun effet significatif (P > 0,05) sur
le nombre de petits (diamètre < à 3 mm), gros (diamètre
> à 8 mm) et follicules totaux. Par contre, les ovaires porteurs de
corps jaunes ont plus (P < 0,05) de follicules moyens.
Les ovaires ne portant pas de corps jaune ont tendance
à avoir un rendement plus élevé en ovocytes totaux et en
ovocytes cultivables. Aucune différence significative n'est
observée en terme de qualité ovocytaire entre les ovaires ipsi et
contra-latéraux au corps jaune.
I.5.3. Poids de l'ovaire
Le poids de l'ovaire influence de façon significative
la population folliculaire totale, le rendement et la qualité
ovocytaire. Cependant, il n'a aucun effet significatif (P > 0,05) sur le
nombre moyen des gros follicules.
I.5.4. Taille de l'ovaire.
Il ressort du tableau VII que les ovaires
dont le volume est supérieur à 2,25x1,75x1,25 cm3 ont
plus (P < 0,05) de follicules totaux que ceux dont le volume est moindre.
Cependant le nombre des gros follicules ne diffère (P > 0,05) pas
entre ces deux groupes.
De même, le rendement en ovocytes totaux et en ovocytes
cultivables est plus élevé (P < 0,05) dans les ovaires ayant
un volume supérieure à 2,25x1,75x1,25 cm3
(tableau VIII).
47
I.6. Variation de la population folliculaire, du
rendement et de la qualité des ovocytes en fonction des facteurs non
ovariens.
Les tableaux IX et X présentent l'effet
de la race, de l'âge, de la NEC, du statut physiologique et du stade de
la gestation sur la population folliculaire, le rendement et la qualité
ovocytaire.
Tableau IX : Variation de la population folliculaire en
fonction des facteurs non ovariens (moyenne #177; ESM)
|
Facteurs
|
N
|
Nombre de follicules/ovaire
|
Follicules totaux
|
|
Petits
(< 3mm)
|
Moyens
(3-8mm)
|
Gros
(> 8mm)
|
/ovaire
|
|
Akou
|
58
|
9,60#177;1,20a
|
7,63#177;0,91a
|
0,19#177;0,03a
|
17,39#177;1,74a
|
|
Race
|
Bokolo
|
20
|
7,80#177;2,04a
|
8,00#177;1,26a
|
0,25#177;0,07a
|
16,02#177;2,45a
|
|
Djafoun
|
31
|
9,10#177;1,83a
|
8,22#177;1,03a
|
0,22#177;0,06a
|
17,47#177;2,42a
|
|
Goudali
|
92
|
7,53#177;0,76a
|
8,48#177;0,62a
|
0,20#177;0,04a
|
16,27#177;1,10a
|
|
P-value
|
|
|
|
|
0,170
|
|
3 -6 ans
|
55
|
8,52#177;1,08a
|
8,55#177;0,67a
|
0,34#177;0,05a
|
17,42#177;1,38a
|
|
Age
|
6 -10 ans
|
108
|
8,61#177;0,86a
|
9,14#177;0,59a
|
0,17#177;0,02b
|
17,76#177;1,13a
|
|
10 -15 ans
|
38
|
7,59#177;1,34a
|
4,74#177;1,06b
|
0,13#177;0,04b
|
12,46#177;2,16b
|
|
P-value
|
|
|
|
|
0,043
|
|
Faible
|
81
|
7,61#177;0,79a
|
6,68#177;0,63a
|
0,20#177;0,03a
|
14,48#177;1,14a
|
|
NEC
|
Moyenne
|
93
|
8,98#177;0,99a
|
9,78#177;0,68b
|
0,22#177;0,03a
|
18,99#177;1,35b
|
|
Elevée
|
27
|
8,74#177;1,71a
|
6,91#177;0,86a
|
0,18#177;0,05a
|
15,85#177;2,05a
|
|
P-value
|
|
|
|
|
0,038
|
|
Statut
|
Non gravide
|
96
|
9,23#177;0,79a
|
7,55#177;0,64a
|
0,29#177;0,03a
|
17,00#177;1,26a
|
|
physio-
|
Gravide
|
105
|
7,63#177;0,79a
|
8,69#177;0,59a
|
0,31#177;0,03a
|
16,52#177;1,11a
|
|
logique
|
P-value
|
|
|
|
|
0,781
|
|
1er trimestre
|
53
|
8,20#177;1,34a
|
9,60#177;0,93a
|
0,27#177;0,05a
|
18,08#177;1,82a
|
|
Stade de
|
2e trimestre
|
32
|
7,48#177;1,25a
|
8,50#177;0,88a
|
0,17#177;0,05b
|
16,12#177;1,69a
|
|
gravidité
|
3e trimestre
|
20
|
6,37#177;0,94a
|
6,60#177;1,15a
|
0,12#177;0,05c
|
13,05#177;1,74a
|
|
P-value
|
|
|
|
|
0,431
|
a,b,c :les moyennes dans une colonne avec des exposants
différents sont significatifs (P<0,05)
48
Tableau X : Variation du rendement et de la
qualité des ovocytes en fonction des facteurs non ovariens
(moyenne#177;ESM)
|
Facteurs
|
|
N
|
Rendement
ovocytaire
|
|
Qualité ovocytaire
|
|
Ovocytes cultivables
|
|
I
|
II
|
III
|
IV
|
I et II (%)
|
|
Akou
|
58
|
11,39#177;1,03a
|
3,63#177;0,28a
|
2,65#177;0,28a
|
2,42#177;0,58a
|
2,74#177;0,42a
|
6,27#177;0,60a (55,12)
|
|
Bokolo
|
20
|
11,07#177;1,93a
|
2,95#177;0,45a
|
3,27#177;0,63a
|
2,27#177;0,47a
|
2,42#177;0,69a
|
6,22#177;1,02a (56,21)
|
|
Race
|
Djafoun
|
31
|
10,79#177;1,82a
|
3,75#177;0,65a
|
2,55#177;0,40a
|
2,10#177;0,19a
|
2,21#177;0,53a
|
6,31#177;0,99a (58,41)
|
|
Goudali
|
92
|
10,75#177;0,76a
|
3,53#177;0,26a
|
2,70#177;0,22a
|
2,23#177;0,15a
|
2,41#177;0,26a
|
6,23#177;0,45a (58,00)
|
|
P-value
|
|
0,809
|
|
|
|
|
1,000
|
|
3 - 6
|
55
|
12,23#177;0,95a
|
3,77#177;0,28a
|
2,94#177;0,27a
|
2,60#177;0,32a
|
2,91#177;0,37a
|
6,72#177;0,49a (54,97)
|
|
Age (années)
|
6 - 10
|
108
|
11,64#177;0,79a
|
3,79#177;0,28a
|
2,98#177;0,22a
|
2,35#177;0,19a
|
2,52#177;0,28a
|
6,77#177;0,46a (58,18)
|
|
10 - 15
|
38
|
7,25#177;1,30b
|
2,46#177;0,49b
|
1,65#177;0,28b
|
1,41#177;0,26b
|
1,72#177;0,38b
|
4,12#177;0,75b (56,83)
|
|
P-value
|
|
0,006
|
|
|
|
|
0,006
|
|
Faible
|
81
|
9,59#177;0,82a
|
2,93#177;0,26a
|
2,44#177;0,25a
|
1,89#177;0,21a
|
2,31#177;0,34a
|
5,38#177;0,48a (56,08)
|
|
NEC
|
Moyenne
|
93
|
12,50#177;0,87b
|
4,34#177;0,31b
|
3,07#177;2,15a
|
2,49#177;0,23a
|
2,59#177;0,26a
|
7,42#177;0,49b (59,36)
|
|
Elevée
|
27
|
9,87#177;1,52a
|
2,55#177;0,41a
|
2,33#177;0,38a
|
2,41#177;0,43a
|
2,57#177;0,58a
|
4,89#177;0,75b (49,54)
|
|
P-value
|
|
0,034
|
|
|
|
|
0,003
|
|
Statut
|
Non gravide
|
96
|
12,05#177;0,85a
|
3,62#177;0,27a
|
2,98#177;0,24a
|
2,53#177;0,23a
|
2,90#177;0,32a
|
6,61#177;0,48 (54,88)
|
|
physiologique
|
Gravide
|
105
|
9,99#177;0,75b
|
3,46#177;0,28a
|
2,48#177;0,19a
|
1,97#177;0,18b
|
2,08#177;0,24a
|
5,93#177;0,44 (59,40)
|
|
P-value
|
|
0,023
|
|
|
|
|
0,298
|
|
Stade
|
1er trimestre
|
53
|
11,33#177;1,27a
|
3,87#177;0,45a
|
2,82#177;0,33a
|
2,23#177;0,29a
|
2,41#177;0,39a
|
5,26#177;0,72a (59,00)
|
|
de gravidité
|
2e trimestre
|
32
|
9,41#177;0,98a
|
3,47#177;0,42a
|
2,30#177;0,25a
|
1,92#177;0,29a
|
1,72#177;0,31a
|
5,76#177;0,59a (61,29)
|
|
3e trimestre
|
20
|
7,37#177;1,26a
|
2,35#177;0,46a
|
1,85#177;0,33a
|
1,37#177;0,30a
|
1,80#177;0,50a
|
4,20#177;0,76a (56,94)
|
|
P-value
|
|
0,016
|
|
|
|
|
1,430
|
a,b,c :les moyennes dans une colonne avec des exposants
différents sont significatifs (P<0,05)
49
I.6.1. Race
La race n'a aucun effet significatif sur la population
folliculaire totale (P > 0,05). Toutefois, les races Red Fulani et white
Fulani ont tendance à avoir plus de follicules que les races Goudali et
Bokolo.
Il n'existe aucune différence significative (P >
0,05) entre les races sur le rendement en ovocytes, la qualité et les
ovocytes cultivables (P > 0,05). Toutes les races étudiées
possèdent un pourcentage en ovocytes cultivables (I et II)
supérieur à 50 %.
I.6.2. Age
Les vaches âgées de plus de 10 ans ont moins de
gros et moyens follicules (P < 0,05). De même, le rendement en
ovocytes est plus élevé (P < 0,05) chez les vaches
âgées de moins de 10 ans. Les ovocytes cultivables
récoltés chez ces dernières représentent 61,13 %
des ovocytes totaux.
I.6.3. NEC
La note d'état corporel exerce un effet significatif
sur le nombre des follicules moyens et des follicules totaux. Les vaches ayant
une NEC moyenne ont plus (P < 0,05) de follicules moyens et de follicules
totaux que les vaches maigres et celles ayant une bonne NEC.
De même, les vaches ayant une NEC moyenne ont un
rendement en ovocyte plus élevé (P < 0,05) que les vaches
maigres et grasses. En ce qui concerne la qualité ovocytaire, les
ovocytes de qualité I et les ovocytes cultivables sont plus nombreux (P
< 0,05) chez les vaches ayant une NEC moyenne.
I.6.4. Statut physiologique
Le statut physiologique n'a aucun effet significatif (P >
0,05) sur la population folliculaire. Toutefois, les vaches non gravides ont
tendance à avoir plus des follicules totaux que les vaches gravides.
Le statut physiologique exerce un effet significatif sur le
rendement en ovocytes. Les vaches gravides ont moins (p < 0,05) d'ovocytes
totaux, comparées aux vaches non gravides. En termes de qualité
ovocytaire, les ovocytes de qualité III sont plus élevés
(p < 0,05) chez les vaches non gravides. Les ovocytes de qualité I et
II qui sont utilisés pour la maturation in vitro ne sont pas
influencés par le statut physiologique. Toutefois, les vaches non
gravides ont tendance à avoir plus d'ovocytes cultivables que les vaches
gravides.
50
I.6.5. Stade de gravidité
Les résultats montrent que l'âge de la gestation
n'a aucun effet significatif (p > 0,05) sur le nombre des follicules totaux.
Les vaches, au dernier trimestre de la gestation, ont tendance à avoir
moins de follicules que les vaches aux premier et deuxième trimestres.
Par contre, le stade de la gestation a un effet significatif sur le nombre de
gros follicules. Les vaches au dernier trimestre de la gestation ont moins (P
< 0,05) de gros follicules.
La gravidité influence le rendement en ovocytes. Les
vaches au premier trimestre ont plus (P < 0,05) d'ovocytes que les vaches au
dernier trimestre de gravidité. Cependant, il n'a aucun effet sur la
qualité globale des ovocytes et sur la qualité des ovocytes
cultivables.
II. Discussion
L'âge moyen des vaches abattues (6,80 #177; 0,15) est
similaire à celui observé par Bah et al. (2010). Selon
ces auteurs, 39 % des vaches abattues à Ngaoundéré
souffriraient des pathologies diverses qui, associées aux effets de la
saison sèche et de la rareté des pâturages y relative
auraient des répercussions sur les performances pondérales avec
pour conséquence une note d'état corporel faible. La
caractérisation des vaches indique que les zébus Mbororo (Akou et
Djafoun) et les zébus Bokolo associés constituent 50,24 % des
races. Ceci est dû au coût plus élevé du zébu
Goudali. D'où le choix des bouchers porté vers les zébus
Mbororo dont le prix est relativement plus bas.
Le poids moyen de l'ovaire des zébus
étudiés est comparable à celui du zébu
Ankolé (4,6#177;2,3 ; Natumanya et al., 2008), mais
inférieur à celui de la vache Frisonne (10-19 ; Pierson et
Ginther, 1987a) et de la vache Swedish Red (10,2 g ; Rajoski, 1960). Cette
différence de poids entre les ovaires des zébus et des taurins
peut être due à l'effet race. En effet le poids moyen des vaches
abattues était inférieur à celui de la vache frisonne,
soit 547793 kg (Laizeau, 2003). La différence de poids entre l'ovaire
droit et gauche a également été rapportée par
Rajoski (1960). En effet, les études de Pierson et Ghinter (1987a) et de
Ghinter et al. (2014) ont montré que les ovulations sont plus
fréquentes sur l'ovaire droit. Cette plus grande activité
physiologique de l'ovaire droit serait donc responsable de son poids plus
élevé. Par ailleurs, il a été
démontré que le statut nutritionnel, la présence du corps
jaune et celles des follicules influence la taille de l'ovaire (Pierson et
Ginther, 1987a) ; d'où la corrélation positive observée
entre la NEC, la présence du corps jaune, le statut physiologique et le
poids des ovaires. L'âge n'a aucun effet sur le poids des ovaires, ceci
s'expliquerait par le fait que toutes les vaches étudiées ont
atteint leur maturité sexuelle et que le poids des ovaires augmente
très peu après la puberté. Les dimensions de l'ovaire
étaient inférieures à
51
celles des races européennes (Rajoski, 1960).
La corrélation positive entre la note d'état corporel et
l'épaisseur de l'ovaire s'expliquerait par une sous-alimentation qui
influence négativement l'état général des animaux
et par conséquent le poids des ovaires. Dans cette étude, la
présence du corps jaune avait un effet positif sur les dimensions de
l'ovaire.
La population folliculaire moyenne est comparable à
celle obtenue par Carvalho et al. (2008) chez le Zébu Nellore.
Le nombre des follicules de taille comprise entre 3 et 8 mm est similaire
à celui du zébu Ankolé rapporté par Natumanya
et al. (2008). Par contre, Dominguez (1995) a observé des
valeurs plus élevées chez les races européennes. Ces
différences sont probablement liées à la race et/ ou
à l'environnement.
La présence du corps jaune n'a aucun effet sur la
population folliculaire ; ceci est également rapporté par
Natumanya et al. (2008). Par contre, Ghinter et al. (2014)
pensent que le corps jaune a une influence positive sur le nombre de follicules
ovariens si et seulement si un follicule dominant est également
présent sur l'ovaire porteur du corps jaune. Cet effet s'expliquerait
par les facteurs angiogéniques d'origine lutéale qui, en
augmentant l'apport sanguin, stimuleraient également la croissance
folliculaire au niveau de l'ovaire porteur du corps jaune. Ghinter et al.
(2014) ont également observé une grande activité
folliculaire sur l'ovaire droit portant un follicule dominant et/ou un corps
jaune. Ceci s'expliquerait par la densité des vaisseaux sanguins qui
favorisent un apport important de sang au niveau de l'ovaire droit ou alors par
la présence des follicules primordiaux plus nombreux sur cet ovaire. La
corrélation positive entre la taille de l'ovaire et la population
folliculaire a également été rapportée par Samad et
Raza (1999) et Wani et al. (1999) chez la bufflesse et la
chèvre respectivement.
La race n'a aucun effet sur la population folliculaire. Santos
et al. (2013) ont observé que la population folliculaire varie
entre les individus d'une même race et entre les races. Dominguez (1995)
a observé que les zébus ont moins de gros follicules, mais plus
de follicules totaux que les taurins (Sartori et Barros, 2011).
Dominguez (1995) et Alves et al. (2014) ont
observé le même effet de la NEC sur la population folliculaire. En
effet, il a été observé que la sous-alimentation inhibe le
mécanisme du rétrocontrôle exercé par l'oestradiol
sur la FSH. Par ailleurs, la folliculogenèse basale est essentiellement
contrôlée par les hormones de croissances telles que l'IGF-1
(Insuline Growth Factor-1). Lucy et al. (1992) ont montré que
lors d'un déficit énergétique, il y a un ralentissement de
la croissance folliculaire suite à une diminution des concentrations en
IGF-
52
1. Une situation alimentaire favorable s'accompagnant des
teneurs plasmatiques élevées en IGF-1 serait un stimulant de la
croissance folliculaire. De plus, il augmente la sensibilité des
cellules de la granulosa à la stimulation de la FSH (O'callaghan et
Boland, 1999). Ryan et al. (1994) ont trouvé qu'il existe une
corrélation entre les apports alimentaires suffisants et la
concentration en IGF-1 dans le sang et la NEC. Les animaux ayant une NEC
très élevée (4 et 5) ou faible (1 et 2) avaient des
faibles concentrations en IGF-1 ; d'où la diminution de la croissance
folliculaire.
L'âge influence significativement la population
folliculaire. Son effet a également été rapporté
par Lucyna et Zdzislaw (1984), et Fassi (2006). En effet, les travaux de
Armstrong (2001) ont montré que le nombre des follicules diminue avec
l'âge chez toutes les espèces. Ceci s'expliquerait par la
défaillance de l'axe hypothalamo-hypophysaire, la déficience des
hormones ovariennes et surtout l'apoptose des follicules, principales
responsable de l'épuisement de la réserve ovarienne.
La gestation n'influence pas significativement la population
folliculaire bien que Ginther et al. (1989) aient identifié des
vagues de croissance folliculaire tous les 8 à 10 jours sans toutefois
conduire à la sélection et à la dominance entre le
4e et le 9e mois de gestation. Par contre, une
réduction du nombre de gros follicules avec l'âge du foetus a
été rapportée par Dominguez (1995). De même, la
présence du corps jaune gestatif a un effet négatif sur la
croissance des follicules de diamètre supérieur à 7 mm
après le 22e jour de gestation (Pierson et Ginther, 1987b).
La différence observée sur le nombre de gros follicules
s'expliquerait par le fait que la sécrétion de la
progestérone durant la gestation inhibe la sécrétion des
gonadotropines hypophysaires (FSH et LH). En effet, la
folliculogénèse terminale est dépendante d'un taux
élevé des gonadotropines. En absence de ces hormones, les
follicules en croissance n'atteignent que les stades des follicules
préantraux.
La technique de slicing des ovaires permet de récolter
les ovocytes présents dans tous les follicules quelle que soit leur
localisation au niveau du cortex ovarien (Ward et al., 2000). Le
rendement ovocytaire, comparable à celui rapporté par Wang et
al. (2007) chez la vache Holstein, est néanmoins supérieur
à celui rapporté par Armstrong (2001), Natumanya et al.
(2008) et Abraham et al. (2012) soit 6,0#177;0,6 ; 4,05#177;0,77
et 3.33 #177; 1.03 mais inférieur aux 66 ovocytes rapportés par
Carolan et al. (1992). Ces variations pourraient être
liées à la technique d'incision qui produit beaucoup de
débris tissulaires (Wani et al., 2000). D'autres auteurs se
servent d'une lame à brin séparée de 1 mm pour inciser les
follicules et d'un passoir. Un nombre important d'ovocytes serait donc retenu
dans les ovaires sans être
53
récoltés, ou alors les ovocytes ont
été désintégrés par la lame de bistouri
durant l'incision des ovaires. Cette technique pourrait contribuer au faible
rendement obtenu dans cette étude. Des investigations futures seraient
également nécessaires pour évaluer, par des coupes
histologiques, la localisation des follicules dans l'ovaire des zébus.
L'index de la qualité ovocytaire obtenu est supérieur à 1.
Ceci indique que la qualité globale des ovocytes est moyenne. Le taux
d'ovocytes de qualité I et II à sélectionner pour la
maturation in vitro se situe dans l'intervalle de 30- 60 %
rapportés par Lucyna et Zdzislaw (1984) et Natumyana et al.
(2008)
Les résultats obtenus ont montré que la
quantité des ovocytes augmente avec le poids et la taille de l'ovaire.
Or, peu d'études ont montré l'effet de la taille et du poids de
l'ovaire sur la population folliculaire, le rendement et la qualité des
ovocytes chez les bovins. Mais on constate que ceux obtenus par Samad et Raza
(1999) chez la bufflesse et par Wani et al. (1999) chez la
chèvre sont contraires. Ceci pourrait être dû à
l'espèce. De même, Natumanya et al. (2008) montrent qu'il n'y a
aucune influence du corps jaune sur le rendement et la qualité des
ovocytes chez la vache Ankolé. Par contre, une corrélation
positive entre la présence du corps jaune, le rendement et la
qualité des ovocytes a été montrée chez la brebis
(Wani et al., 1999), la bufflesse (Samad et Raza, 1999) et le
dromadaire (Abdoon, 2001). Ces variations pourraient être dues à
l'espèce.
Cette étude n'a révélé aucune
influence de la race sur le rendement et la qualité des ovocytes. Ceci a
également été rapporté par Abraham et al. (2012)
chez les races Swedish Red et Swedish Holstein. Par contre, Dominguez (1995) et
Fassi (2006) ont noté que les vaches de races européennes
donnaient plus d'ovocytes que celles des races locales au Nord-Est du Mexique.
Par ailleurs, de nombreuses études ont montré que la
quantité et la qualité ovocytaire diminuaient avec l'âge
(Lucyna et Zdzislaw, 1984; Natumanya et al., 2008). Ce qui corrobore
nos résultats. En effet, notre étude montre que les jeunes
animaux constituent les meilleurs donneurs d'ovocytes de bonne qualité.
L'effet de la NEC et de la gestation sur le rendement et la qualité
ovoytaire a été également rapporté par Dominguez
(1995) et Natumanya et al. (2008). En effet, les changements
métaboliques et hormonaux n'affectent pas seulement la croissance
folliculaire mais aussi la croissance de l'ovocyte. Etant donné que la
folliculogenèse et l'ovogénèse sont deux processus
étroitement liés (Monniaux et al., 2009), la
qualité des ovocytes dépend des conditions nutritionnelles sous
lesquelles le follicule a commencé son développement
c'est-à-dire au moment de son recrutement. En effet,
54
l'absence d'ovulation pendant la gestation est la
conséquence de l'atrésie des ovocytes et ce n'est qu'entre le
30e et 100e jour post-partum que le nombre d'ovocytes
augmente linéairement chez la vache (Kendrick et al., 1999).
55
|
|


