|
ÓäæÊÈ
äíÓÏäåãáá
ÉíäØæáÇ
ÉÓÑÏãáÇ
|
|
Ecole Nationale d'Ingénieurs de Tunis
|
Mémoire
Présenté à l'ENIT
Pour
l'obtention du
Diplôme de Mastère
en
Génie des Systèmes Industriels
:
Systèmes & Procédés
Semi-conducteurs
Par
Ihsèn BEN MBAREK
Ingénieur en
Electronique&Microélectronique de l'ENIT

Elaboration et Caractérisation Physique des
Couches Minces de TiO2 Déposées par Pulvérisation
Cathodique
Réalisé au Laboratoire de Photovoltaïque et
Matériaux Semi-conducteurs : LPMS-ENIT Soutenu le 04
avril 2009
Devant le Jury :
Président : M. Ridha BEN CHEIKH (Professeur à
l'ENIT)
Rapporteur : M. Mounir KANZARI (Professeur à l'IPEIT)
Co-encadreur : M. Mohamed ABAAB (Professeur à l'ENIT)
Encadreur : Mme Fatma CHAABOUNI (Maitre de Conférence
à l'ENIT)
Année : 2008 - 2009 Réf : MGSI
04/GI-09
enit@enit.rnu.tn
íäæÑÊßááÅÇ
쒄釂 - 71 872 729
ÓßÇáÇ - 71 874 700
ÊÇåáÇ ÓäæÊ 1002
ÑíÏáÈáÇ 37 È Õ
ÓäæÊÈ
äíÓÏäåãáá
ÉíäØæáÇ
ÉÓÑÏãáÇ Ecole Nationale
d'Ingénieurs de Tunis BP 37 le Belvédère 1002 Tunis
Tél: 71874700 - Fax: 71872729 - Email
enit@enit.rnu.tn
ÁÇÏåÅ
ãíÙÚøÊáÇ
øÞÍ øíáÚ
ãåá äã ìáÅ
ÉÒíÒÚáÇ
íÊÏáÇæ æ
ÒíÒÚáÇ
íÏáÇæ ìáÅ
|
ÈÇåã
|
íäÈÅ
|
æ ÍÌÇä
íÌæÒ
|
íÆÇÈÍ
ìáÅ
|
äíÏáÇ íÓ
íÎ ãå áÇÛ
ÉÕÇÎæ
ÉáÆÇÚáÇ ÏÇÑ
øáß ìáÅ
ÇÑÍ
íäãøáÚ äã
øáß ìáÅ
áÖÇáÇ
íÊÐÊÇÓ ìáÅ
ÁÇÞÏÕáÇæ
ÁÇøÈÍáÇ áß
ìáÅ
ä ÇÓÍÇ
áãÚáÇ
ÇÐå íÏå
Remerciements
Mes sincères et infinis remerciements s'adressent
à Mr Mohamed ABAAB et Mme Fatma CHAABOUNI mes encadreurs au sein du
Laboratoire de Photovoltaïque et Matériaux Semiconducteurs (LPMS)
de l'ENIT, pour leurs disponibilités, leurs encouragements et leurs
conseils qui m'ont été très précieux et l'effort
qu'ils ont fourni en faveur de la réussite de ce travail avec beaucoup
d'amabilité et de gentillesse.
Qu'ils trouvent ici l'expression de ma haute
gratitude.
J'adresse mes sentiments respectueux à Mr Bahri
REZIG et je tiens à lui exprimer ma profonde reconnaissance pour m'avoir
accueillie dans son laboratoire. La réalisation de cet ouvrage et le bon
déroulement de ce travail ont été aussi rendus possible
grâce à la collaboration d'un nombre de personnes du laboratoire
de recherche, tout particulièrement Mr Mohamed Maher LANDOLSI, le
technicien du laboratoire, qui ont accepté de partager avec moi leurs
connaissances, leurs expériences et leur savoir-faire.
J'espère que cet ouvrage rendra justice à la
qualité de leur apport.
Je tiens à exprimer mes remerciements à Mr
Hassan BOUZOUITA, Mr Mounir KANZARI, Mr Bechir ZOUEBI et Mr Jaouhar MOUIINE mes
enseignants à l'ENIT, pour leurs confiances en acceptant de me diriger
patiemment, pour les efforts méritoires qu'ils ont
déployés, leur soutien constant, leurs grandes expériences
et leurs qualités humaines m'ont été d'une grande
importance et m'ont permis de mener à bien ce travail. Je remercie aussi
Mr Rached GHARBI, Maitre de conférences de l'ESSTT, de son aimable aide
pour les mesures de caractérisation IV.
Qu'ils trouvent ici l'expression de ma profonde
reconnaissance.
Table des matières
Liste des figures iii
Liste des Tableaux iv
Liste des Abréviations
v
Introduction générale
1
1 Matériau TiO2 3
1.1 Introduction 4
1.2 Structure cristalline 4
1.2.1 Phase rutile 5
1.2.2 Phase anatase 6
1.2.3 Phase brookite 7
1.3 Propriétés électriques
8
1.3.1 Dopage et type de conductivité 8
1.3.2 Conductivité 9
1.3.3 Constante diélectrique 10
1.4 Propriétés optiques 10
1.5 Applications 12
1.5.1 Biocompatibilité du TiO2 12
1.5.2 Pigments et peintures 12
1.5.3 Activité photocatalytique 13
1.5.4 Super-hydrophilie (anti-buée) 15
1.5.5 Electronique et photovoltaïque 15
1.5.6 Eclairage des tunnels 16
1.5.7 Chauffage 16
1.5.8 Autres applications 17
1.6 Conclusion 18
2 Techniques de dépôt :
Pulvérisation cathodique 19
2.1 Introduction 20
2.2 Dépôt chimique en phase vapeur (CVD :
Chemical Vapor Deposition) 22
2.3 Evaporation thermique 24
2.4 Ablation laser (Pulsed Laser Deposition- PLD)
26
2.5 Epitaxie par jets moléculaires 27
2.6 Pulvérisation cathodique 27
2.6.1 Principe de la pulvérisation 28
2.6.2 Pulvérisation DC (Direct Current)
32
2.6.3 Pulvérisation RF (Radio-fréquence)
34
2.6.4 Pulvérisation triode 35
2.6.5 Pulvérisation réactif 36
2.6.6 Croissance cristalline 37
2.7 Conclusion 39
3 Elaboration et caractérisation des couches
minces de TiO2 40
ENIT 2007 i
3.1 Introduction 41
3.2 Elaboration des couches minces de TiO2 41
3.2.1 Préparation des substrats 41
3.2.2 Dispositif de pulvérisation 42
3.2.3 Etching 43
3.2.4 Pré-pulvérisation 43
3.2.5 Pulvérisation 44
3.3 Caractérisation structurale : Analyse par
Diffraction des Rayons X (DRX) 45
3.3.1 Principe de la méthode 45
3.3.2 Description de l'appareillage 46
3.3.3 Couches élaborées sur des substrats
de verre 49
3.3.4 Couches élaborées sur des substrats
de silicium 51
3.4 Caractérisation morphologique par Microscopie
à Force Atomique 54
3.4.1 Les modes de fonctionnement les plus courants
55
3.4.2 Dispositif utilisé 56
3.4.3 Couches de TiO2 élaborées sur des
substrats de verre 57
3.4.4 Couches de TiO2 élaborées sur des
substrats de silicium 59
3.5 Caractérisation optique des couches minces de
TiO2 62
3.5.1 Méthode de calcul des constantes optiques
62
3.5.2 Couches élaborées sur des substrats
de verre 65
3.5.3 Couches élaborées sur des substrats
de silicium 71
3.6 Caractérisation électrique
72
3.6.1 Spectroscopie d'impédance électrique
72
3.6.2 Type de conductivité 83
3.7 Conclusion 85
Conclusion générale 87
Bibliographie 89
Netographie 94
ENIT 2007 ii
Liste des figures
Fig. 1. 1 L'agencement des octaèdres des
variétés des oxydes de titane 5
Fig. 1. 2 Maille élémentaire de TiO2
rutile 5
Fig. 1. 3 Maille élémentaire de TiO2
anatase 7
Fig. 1. 4 Maille élémentaire de TiO2
pour la structure brookite 7
Fig. 1. 5 Tableau des impuretés
incorporées dans TiO2 10
Fig. 1. 6 Spectre de lumière (a) avec la zone
d'action du TiO2 (b) 10
Fig. 1. 7 Illustration d'applications concrètes
des propriétés de TiO2 14
Fig. 2. 1 Méthodes générales pour
déposer une couche mince 21
Fig. 2. 2 Schéma de principe de
dépôt CVD, réacteur à parois chaudes 23
Fig. 2. 3 Principe d'évaporation thermique
24
Fig. 2. 4 Schéma de principe de l'ablation
laser 26
Fig. 2. 5 Système de pulvérisation diode
28
Fig. 2. 6 Schéma des composants de la cathode
magnétron 29
Fig. 2. 7 Principe de la pulvérisation
cathodique diode 30
Fig. 2. 8 Décharge et zone de luminescence
négative (plasma) 31
Fig. 2. 9 Mécanisme d'arrachage des atomes
31
Fig. 2. 10 Schéma du créneau de
potentiel appliqué à la cible. 33
Fig. 2. 11 Principe de la pulvérisation
radiofréquence 34
Fig. 2. 12 Schéma d'un dispositif de
pulvérisation cathodique RF magnétron 35
Fig. 2. 13 Principe de fonctionnement de la
pulvérisation triode 36
Fig. 2. 14 Zones Structurales (Mochvan et Demchishin)
37
Fig. 2. 15 La morphologie d'une CM par le
modèle M-D et Thornton. 38
Fig. 3. 1 Bâti de pulvérisation
cathodique au Laboratoire : (a) enceinte, (b) cible, et (c) unité de
contrôle 43
Fig. 3. 2 Pulvérisation
préférentielle : cible d'éléments à
rendements différents 44
Fig. 3. 3 Schéma de DRX par une famille de
plans réticulaires : a1, a2, a3 46
Fig. 3. 4 Le diffractomètre « Philips
X'Pert 1 X-ray diffractometer » 47
Fig. 3. 5 Schéma de principe d'un
diffractomètre par Rayon X 47
Fig. 3. 6 Spectres de DRX des couches de TiO2/Verre
49
Fig. 3. 7 Plan réticulaire (110) et (210) et
maille de TiO2 rutile 50
Fig. 3. 8 Spectres de DRX des couches de TiO2/Si
51
Fig. 3. 9 AFM : (a) principe, (b) zone d'interaction
pointe-échantillon, (c) Image d'une pointe en Si3N4 54
Fig. 3. 10 Le microscope « Dimension 3100
Scanning Probe Microscope (SPM) » 56
Fig. 3. 11 Images AFM 2D des couches de TiO2/Verre
à TS : (a) ambiante, (b) 100, (c) 200 et (d) 300°C 57
Fig. 3. 12 Images AFM 3D des couches de TiO2/Verre
à TS (a) ambiante, (b) 100, (c) 200 et (d) 300°C 59
Fig. 3. 13 Images AFM 2D des couches de TiO2/Si
à TS : (a) ambiante, (b) 100, (c) 200 et (d) 300°C 60
Fig. 3. 14 Images AFM 3D des couches de TiO2/Si
à TS : (a) ambiante, (b) 100, (c) 200 et (d) 300°C
61
Fig. 3. 15 Spectrophotomètre Shimadzu UV 3100S.
62
Fig. 3. 16 Spectres de transmission en fonction de A
des couches de TiO2/Verre 65
Fig. 3. 17 Spectres d'absorption en fonction de A des
couches de TiO2/Verre 66
Fig. 3. 18 Spectre de réflexion en fonction de
A des couches de TiO2/Verre 67
Fig. 3. 19 Coefficient d'absorption en fonction de
l'énergie des couches deTiO2/verre 69
Fig. 3. 20 Gap optique des CMs de TiO2 à : (I)
différentes température, (a) TAmb, (b) 100, (c) 200 et (d)
300°C 70
Fig. 3. 21 Spectre de réflexion en fonction de
A des couches de TiO2/Si 71
Fig. 3. 22 Modèle des cellules
élémentaires ou modèle des briques ("Brick Layer Model").
73
Fig. 3. 23 Circuit équivalent du modèle
des briques (a) et sa représentation de Nyquist (b) 74
Fig. 3. 24 Circuit équivalent du modèle
simplifié (a) et sa représentation de Nyquist (b).
75
Fig. 3. 25 Modèle de circuits
équivalents et le spectre d'impédance correspondant
76
Fig. 3. 26 Modèle révisé de
spectre d'impédance avec les demi-cercles de recouvrement 78
Fig. 3. 27 Principe de modulation d'une CM
79
Fig. 3. 28 Montage de mesure des impédances et
modèle simplifié 79
Fig. 3. 29 Diagramme de Nyquist des CMs de TiO2/verre
à TS : (a) Ambiante, (b) 100, (c) 200 et (d) 300 °C
80
Fig. 3. 30 Spectre d'impédance d'une CM de
TiO2/Verre pour TS = 300 °C 80
Fig. 3. 31 Principe de la méthode de la pointe
chaude 83
ENIT 2007 iii
Liste des Tableaux
Tab. 1. 1 Propriétés physiques de TiO2
11
Tab. 3. 1 Identification des raies des spectres RX des
couches de TiO2/Verre 50
Tab. 3. 2 Taille des grains des couches de TiO2/Verre
50
Tab. 3. 3 Identification des raies des spectres RX des
couches de TiO2/Si 52
Tab. 3. 4 Taille des grains des couches de TiO2/Si
53
Tab. 3. 5 Rugosité moyenne obtenue par AFM des
couches minces de TiO2 élaborées sur substrats de verre
58
Tab. 3. 6 Rugosité moyenne obtenue par AFM des
couches de TiO2/Si 60
Tab. 3. 7 Epaisseurs et indice de réfraction
des couches de TiO2/Verre 68
Tab. 3. 8 Valeurs des transitions directes permises
des couches de TiO2/Verre 70
Tab. 3. 9 Calcul des propriétés
électriques des CMs de TiO2 pour différentes températures
de substrat 81
Tab. 3. 10 Types de conductivité des CMs de
TiO2 83
ENIT 2007 iv
ENIT 2007 V
Liste des Abréviations
A-------------------------------------------------------------------------------------
AFM : Atomic Force Microscope.
APCVD : Atmospheric Pressure Chemical Vapor Deposition. ASTM :
American Society for Testing and Materials.
C-------------------------------------------------------------------------------------
CM : Couche Mince.
CTP : Résistance à Coefficient de
Température Positif. CVD : Chemical Vapour Deposition.
D------------------------------------------------------------------------------------
DC : Direct Current.
DIBS : Dual Ion Beam Sputtering. DRX : Diffraction des Rayons X.
DSSC : Dye-Sensitized Solar Cells.
E------------------------------------------------------------------------------------EJT
: épitaxie par jets moléculaires.
H------------------------------------------------------------------------------------HP
VEE : Hewlett Packard Visual Engineering Environment.
I-------------------------------------------------------------------------------------
IBAD : Ion Beam Assisted Deposition.
IBS : Ion Beam Sputtering.
ICDD : International Centre for Diffraction Data.
ICSD : Inorganic Crystal Structures Database.
IR : Infrarouge (780 nm et 1 000 000 nm) : IR proche (de 0,78 pm
à 1,4 pm), IR moyen (de 1,4 à
3 pm), IR lointain : (de 3 pm à 1 000 pm).
J-------------------------------------------------------------------------------------
JCPDS : Joint Committee on Powder Diffraction Standards.
L-------------------------------------------------------------------------------------
LIR : IR lointain de 3 pm à 1 000 pm.
LISR : Large Integrating Sphere Attachment.
LPCVD : Low-Pressure Chemical Vapor Deposition.
LP-MOCVD : Low-Presssure Metal-Organic Chemical Vapor
Deposition.
M------------------------------------------------------------------------------------
MBE : Molecular Beam Epitaxy.
M-D : Movchan et Demchishin model. MIR : IR moyen de 1,4 à
3 pm.
MOCVD : Metal-Organic Chemical Vapour Deposition.
MOSFET : Metal Oxide Semiconductor Field Effect Transistor.
MOV : Matières Organiques Volatiles.
P------------------------------------------------------------------------------------
PDF : Powder Diffraction File.
PECVD : Plasma Enhanced Chemical Vapor Deposition.
PET : Polyester.
PID : Proportional-Integral-Derivative Controller.
PIR : IR proche de 0,78 pm à 1,4 pm.
PLD : Pulsed Laser Deposition.
PVD : Physical Vapor Deposition.
R------------------------------------------------------------------------------------
RF : Radio Frequency 13.56 MHz.
S-------------------------------------------------------------------------------------
Sccm : standard cubic centimeters per minute (soit un
centimètre cube par minute dans les
conditions suivantes : Température = 0°C, Pression =
101.325 kPa)
SFM: Scanning Force Microscope.
SIE : Spectroscopie d'Impédance Electrique.
SPM : Scanning Probe Microscope.
T-------------------------------------------------------------------------------------TCO
: Transparent Conducting Oxide.
U------------------------------------------------------------------------------------
UC : Unité de Contrôle.
ULVAC : The ULtimate in VACuum Technology.
UVCVD : Ultra-Violet Chemical Vapor Deposition.
UHV-MOCVD : Ultra-High Vacuum Metal-Organic Chemical Vapour
Deposition.
UV : Ultra-Violet.
UVA : Ultraviolet-A (400-315 nm).
UVB : Ultraviolet-B (315-280 nm).
UVC : Ultraviolet-C (280-10 nm).
UV extrêmes : Ultraviolets extrêmes (200-10 nm).
UV proches : (380-200 nm de longueur d'onde).
Y-------------------------------------------------------------------------------------YAG
: Yttrium Aluminium Garnet.
ENIT 2007 vi
Introduction générale
Introduction générale
Le dioxyde de titane représente un marché
mondial d'environ 4,5 millions de tonnes par an. C'est, en particulier, le
pigment blanc le plus utilisé en raison de son indice de
réfraction élevé. Le marché se divise en trois gros
secteurs qui sont les pigments de peinture de l'ordre de 60%, les charges de
plastique 20% et de papier 20%. A côté de ces tonnages très
importants, à faibles marges, il existe des applications à forte
valeur ajoutée dont le tonnage ne représente que quelques pour
cents. En effet, le dioxyde de titane est un matériau bon marché,
chimiquement stable et non toxique. Il est très largement utilisé
dans de nombreux domaines de haute technologie du fait de ses
propriétés remarquables. Grâce à son coefficient de
réfraction élevé, il est utilisé dans l'industrie
photovoltaïque ou comme pigment pour le papier glacé. Sa constante
diélectrique élevée en a fait un candidat potentiel pour
le remplacement de SiO2 dans les dispositifs MOSFET. En tant que
semi-conducteur de type n, sa conductivité est modifiée par
adsorption d'un gaz, ce qui en fait un capteur de gaz efficace. De plus, il
possède une activité photocatalytique reconnue, utilisée
pour les vitres autonettoyantes par exemple. Il présente
également une bonne résistance à la corrosion et une
biocompatibilité qui conduisent à l'utiliser comme
revêtement d'implants chirurgicaux. D'autres applications concernent les
domaines de l'électronique (batteries au lithium, systèmes
électrochromes...), de l'environnement (photocatalyse), de la catalyse,
des cosmétiques (filtre UV), de la pharmacie (additif) et de la
médecine (prothèses osseuses, destruction de cellules tumorales
et désinfection en raison de ses propriétés
bactéricides : TiO2/UV).
Durant ces quinze dernières années, les
thématiques associées aux problèmes de protection de
l'environnement, qui ont pour objectifs la purification de l'air, la
dépollution de l'eau et les matériaux autonettoyants à
travers la photocatalyse, ou la recherche de semi-conducteurs pour cellules
photovoltaïques font l'objet d'une grande activité de recherche
tant sur le plan fondamental qu'appliqué et suscitent un engouement
croissant auprès de la communauté scientifique. Comparativement
à d'autres semi-conducteurs, le TiO2 présente en effet une bonne
stabilité thermique et un prix de revient raisonnable. Huit
variétés allotropiques de dioxyde de titane, sont actuellement
répertoriées. Par contre, les propriétés
électrique, morphologique, structurale, et optique de TiO2 sont
instables et c'est un modeste semi-conducteur ou un médiocre isolant
selon le point de vue. Par exemple, pour de nombreuses applications, il serait
intéressant de le rendre soit plus isolant, soit plus conducteur.
La technique de dépôt utilisée pour
préparer nos couches minces de TiO2 est la pulvérisation
cathodique. Cette méthode complexe nécessite l'optimisation d'un
nombre
ENIT 2009 1
Introduction générale
important de paramètres tels que la pression totale
dans l'enceinte de pulvérisation, la pression partielle d'argon, la
température de substrat, la puissance appliquée à la cible
...
Le but de ce travail est, d'une part, d'élaborer et
d'étudier les propriétés électrique, morphologique,
structurale et optique des couches minces de TiO2 nano-cristallin
fabriquées par pulvérisation cathodique magnétron
vis-à-vis de la variation de température de substrat. D'autre
part, nous allons étudier l'influence du type de substrat sur les
propriétés des couches minces de dioxyde de titane. L'objectif de
cette étude consiste donc à comprendre les mécanismes
conduisant aux changements des propriétés physiques afin
d'établir des corrélations entre la microstructure des couches et
leurs propriétés électriques et optiques.
Dans ce cadre nous avons proposé comme substrats : le
verre qui a une structure cristalline amorphe, et le silicium monocristallin.
Le choix du substrat de silicium a été motivé par le
nombre important des applications de TiO2 faisant intervenir les
systèmes TiO2/Si, TiO2/SiO2 ou TiO2/SiO2/Si. De plus, dans l'industrie
électronique, en vue du remplacement de l'oxyde de silicium SiO2 par un
autre oxyde de plus forte constante diélectrique, l'étude de
l'interface entre un oxyde métallique et le silicium constitue depuis
quelques années un axe de recherche majeur. Ce mémoire se
décompose donc en trois grandes parties :
- la première représente une revue
bibliographique qui portera sur l'étude des propriétés
optique, structurale et électrique du dioxyde de titane et ses
applications.
- dans une seconde partie, nous nous intéresserons aux
différentes techniques CVD ou PVD habituellement utilisées pour
préparer les couches minces. Cette partie présente un panorama
non exhaustif des différentes techniques de dépôt. Nous
détaillerons en particulier les types de pulvérisation cathodique
en soulignant ses avantages. Nous allons rappeler aussi les modèles de
M-D et Thornton de croissance cristalline pour des couches d'oxyde
métallique pulvérisées en fonction de la
température de substrat et de la pression totale de l'enceinte.
- le choix des conditions opératoires pour
élaborer nos couches minces par pulvérisation cathodique
radiofréquence à effet magnétron, la préparation
ainsi que la caractérisation physique de ces couches feront l'objet de
la troisième partie. En effet, nous nous intéresserons dans cette
partie à la caractérisation optique par
spectrophotométrie, structurale par des analyses de diffraction des
Rayons X, morphologique par microscopie à force atomique (AFM) et
électrique par spectroscopie d'impédance électrique (SIE)
et par la méthode de pointe chaude. Le principe de fonctionnement de
chaque dispositif d'analyse sera bien détaillé.
Enfin, une conclusion générale permettra de
dégager l'essentiel de ce travail et de le mettre en perspective.
ENIT 2009 2
Matériau TiO2
1.1 Introduction 4
1.2 Structure cristalline 4
1.2.1 Phase rutile 5
1.2.2 Phase anatase 6
1.2.3 Phase brookite 7
1.3 Propriétés électriques
8
1.3.1 Dopage et type de conductivité
8
1.3.2 Conductivité 9
1.3.3 Constante diélectrique 10
1.4 Propriétés optiques 10
1.5 Applications 12
1.5.1 Biocompatibilité du TiO2 12
1.5.2 Pigments et peintures 12
1.5.3 Activité photocatalytique 13
1.5.4 Super-hydrophilie (anti-buée)
15
1.5.5 Electronique et photovoltaïque
15
1.5.6 Eclairage des tunnels 16
1.5.7 Chauffage 16
1.5.8 Autres applications 17
1.6 Conclusion 18
ENIT 2009 3
Chapitre 1 : Matériau TiO2
1.1 Introduction
Le titane (Ti) est le dixième élément le
plus abondant de la croute terrestre (0.63 %) [a] et par conséquent ses
oxydes, dont le TiO2, sont présents dans beaucoup de minéraux,
dont de nombreux silicates. Plus d'une cinquantaine de minéraux
possèdent ainsi des teneurs en TiO2 (matériau transparent / bleu
pâle) supérieures à 1 % dont l'ilménite et le
rutile. Malgré cette richesse naturelle, le TiO2, abondamment
employé comme pigment blanc dans les peintures, les cosmétiques
ou la papeterie, est synthétisé industriellement ce qui permet de
l'obtenir à des coûts très bas. Le TiO2 peut être
synthétisé comme un cristal simple, poudre, céramique et
couche mince. Cette dernière forme cristalline est celle adoptée
dans notre recherche.
1.2 Structure cristalline
Contrairement aux autres oxydes, l'oxyde de titane compte
plusieurs polymorphes. Jusqu'à présent, huit sont
répertoriés, à savoir : rutile, anatase, brookite, bronze
(TiO2-B) [1], columbite (TiO2-II, srilankite ou bien TiO2 type ?-PbO2) [2],
hollandite (TiO2-H) [3], ramsdellite (TiO2-R) [4] et baddeleyite (TiO2-III)
[5].
Les trois premiers étant les principaux. Le rutile est
l'espèce la plus commune, formée typiquement dans une large gamme
de pressions et de températures ; l'anatase est le polymorphe de basse
température tandis que la brookite est plus rare.
Néanmoins, dans des conditions de pression et de
température particulières, les cinq autres formes ont
été observées. En effet, la présence de
l'espèce (TiO2-B), qui a été en premier
synthétisée et caractérisée au laboratoire par L.
Brohan en 1980 [6] a été rapportée récemment dans
le minerai de perovskite [7], dans les Tektites (débris de roches
vitrifiés formés après impact de météorites
ou de comètes avec le sol terrestre) [8] et sous forme de lamelle
associée à l'anatase dans des veines hydrothermales [9]. Les
quatre autres variétés qui restent : la ramsdellite (TiO2-R), la
columbite (TiO2-II), la hollandite (TiO2-H) et la baddeleyite (TiO2-III) ont
été obtenues soit par des réactions topotactiques
(hollandite et ramsdellite) ou par traitement à haute température
de l'anatase ou du rutile (columbite et baddeleyite) [10, 11, 12, 13].
Par exemple, à haute pression, i.e. plus que 10 Gpa, la
structure baddeleyite apparaît [14]. Alors que le srilankite a
été accru par épitaxie atomique de couche à partir
de TiCl4 et H2O [15].
Dans toutes ces variétés, à l'exception
de la baddeleyite, le titane est trouvé en coordinence
octaédrique (octaèdres TiO2) (voir Fig.1.1). Les réseaux
tridimensionnels de chaque variété ne diffèrent que par le
mode d'agencement des octaèdres TiO6 qui peuvent être
reliés entre eux par
ENIT 2009 4
ENIT 2009 5
Chapitre 1 : Matériau TiO2
des arêtes et/ou des sommets. Pour le polymorphe
baddeleyite, le titane est trouvé en coordinence sept comme dans les
structures de l'oxyde ZrO2 [16].
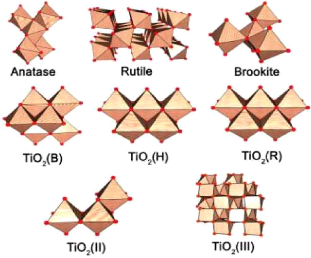
Fig. 1. 1 L'agencement des octaèdres des
variétés des oxydes de titane
Jusqu'à maintenant et selon nos connaissances,
seulement le rutile, l'anatase et le brookite ont été produit par
pulvérisation cathodique, processus utilisé pour préparer
nos échantillons.
1.2.1 Phase rutile
La forme utilisée dans les différents usages
industriels est presque toujours la forme rutile et par suite elle est la
structure la plus commune et la plus étudiée. C'est la forme la
plus dense de TiO2 (de 4,20 à 5,60), stable à des
températures supérieures à 850°C, ainsi qu'à
hautes pressions [25].
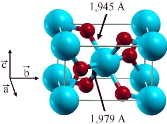
|
Fig. 1. 2 Maille élémentaire de TiO2
rutile
|
(Ti , O )
|
La maille élémentaire de la phase rutile est
quadratique (Fig.1.2). Les paramètres de maille mesurés par
diffraction de neutrons à 15 °K sont les suivants : a =
b = 4,587 Å, c = 2,954 Å, paramètre
interne x = 0,305 et c / a = 0,644 [22].
Chapitre 1 : Matériau TiO2
Enfin, la phase rutile est isolante avec une bande interdite de
3,02 eV [23,24].
Dans cette structure, chaque atome de titane est au centre
d'un octaèdre légèrement distordu d'atomes
d'oxygène avec quatre liaisons équatoriales Ti-O courtes (1,945
Å) et deux liaisons apicales plus longues (1,979 Å).
L'enchaînement de ces octaèdres se fait soit par des arrêtes
soit par des sommets. Les atomes d'oxygène sont, quant à eux,
tous liés à trois atomes de titane (deux liaisons courtes et une
liaison longue).
Le rutile peut exister à n'importe quelle
température au-dessous de 1800°C, le point auquel le dioxyde de
titane devient liquide.
1.2.2 Phase anatase
L'anatase est un état métastable qui revient
sous forme rutile si la température de croissance dépasse
400°C. En tant que matériau massif, l'anatase se transforme de
façon irréversible en rutile à une température
d'environ 820°C [17]. Toutefois, la température de transition lors
de la formation d'une couche mince est abaissée : entre 550°C et
650°C en LP-MOCVD [18, 19] et entre 650°C et 700°C dans des
conditions d'élaboration UHV-MOCVD [20].
La température de transformation peut être
modifiée en ajoutant des impuretés dans le TiO2. Par exemple, la
phase d'anatase disparaît complètement à la
température environ de 530°C, de 680°C, et de 830°C pour
des échantillons de poudre contenant le vanadium, le molybdène,
et le tungstène respectivement [21].
La structure de maille de la phase anatase (Fig.1.3) est plus
complexe que celle de la phase rutile (Fig.1.3). La maille
élémentaire est toujours quadratique. Les paramètres
cristallins mesurés par diffraction de neutrons à 15 °K sont
les suivants : a = b = 3,782 Å, c = 9,502
Å, paramètre interne z = 0,208, c / a =
2,512 [22] et densité de 3,82 à 3,97 gcm-3.
Les distances dans le cristal sont très
légèrement raccourcies par rapport à la phase rutile :
quatre liaisons quasi-équatoriales courtes (1,933 Å) et deux
liaisons apicales longues (1,978 Å) pour chaque atome de titane. Les
atomes d'oxygène sont trivalents avec deux liaisons courtes et une
liaison longue.
L'anatase est également un isolant avec une bande
interdite d'environ 3,23 eV [23,24].
ENIT 2009 6
ENIT 2009 7
Chapitre 1 : Matériau TiO2
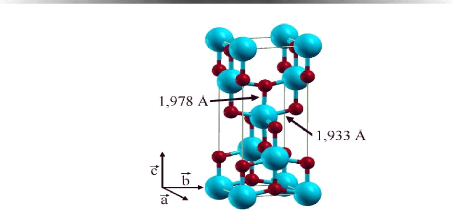
|
Fig. 1. 3 Maille élémentaire de TiO2
anatase
|
(Ti , O )
|
Cette structure consiste également en un arrangement
d'octaèdres distordus d'atomes d'oxygènes centrés sur des
atomes de titane.
Même si l'unité de base est la même dans
les deux phases (anatase et rutile), les plans cristallographiques sont
différents. Les différences entre ces plans cristallographiques
induisent le léger écart sur la valeur de la bande interdite :
3,23 eV (384 nm) pour l'anatase au lieu de 3,02 eV (411 nm), correspondant
à la lumière ultraviolette [26], pour le rutile. Il faut donc un
peu moins d'énergie pour créer des paires électron/trou
dans le rutile mais son rendement quantique est un peu moins bon, ce qui fait
de l'anatase la phase la plus active en photovoltaïque. En effet, il a
été montré que l'anatase était la forme la plus
active [27,28] sur le plan photocatalytique et par suite sur le plan
photovoltaïque.
1.2.3 Phase brookite
La structure brookite, qui est une forme instable et
difficilement isolable de TiO2, a été obtenue par la
méthode de sol-gel [1-2] (voir Fig.1.4).
Fig. 1. 4 Maille élémentaire de TiO2 pour
la structure brookite
Chapitre 1 : Matériau TiO2
Elle est orthorhombique (a=0.546 nm, b=0.918 nm, c=0.514 nm)
et principalement observée à hautes températures [29,
30].
Les couches minces de TiO2 avec les trois structures peuvent
être synthétisées, bien que, généralement,
seulement l'anatase et le rutile sont présents et pour lesquelles un
grand nombre de travaux, aussi bien expérimentaux que théoriques,
ont été menés.
1.3 Propriétés
électriques
Les facteurs principaux influant la conduction
électrique sont d'une part la concentration et le type
d'impuretés incorporés dans TiO2 et d'autre part la morphologie
des couches minces.
Les résultats montrent que suivant les impuretés
ou les gaz réactifs choisis, le dioxyde de titane peut être un bon
isolant avec une constante diélectrique élevée ou un
conducteur transparent raisonnable. La plage de conduction électrique
couverte par les échantillons produits par [31] s'étend de
10-10 S m-1 à 103 S m-1.
1.3.1 Dopage et type de conductivité
En choisissant des impuretés appropriées, le
dioxyde de titane peut être rendu isolant (TiO2:Ce) ou plus conducteur
avec une conduction électrique de type n (TiO2:Nb) ou de type
p (TiO2:Fe) [31].
Les lacunes d'oxygène se comportent comme donneurs
d'électrons, ainsi le TiO2-x est un semi-conducteur type N,
contrairement au semi-conducteur type P qui contient des électrons
accepteurs et dont les porteurs de charge sont les trous au lieu des
électrons [32]. Le TiO2-x sous-stoechiométrique est à la
fois un pauvre isolant et un modeste semi-conducteur. C'est pourquoi
différents essais ont été faits soit pour contrôler
la concentration de lacunes d'oxygène ou pour introduire des porteurs de
charge (dopage) à l'intérieur du TiO2 afin d'augmenter ou de
diminuer la conductivité électrique, tout dépend de
l'application.
En effet, le TiO2 est un semi-conducteur de type n en raison
de son déficit en oxygène qui résulte de l'existence de
lacunes anioniques ou de la présence d'atomes de titane en sites
interstitiels, sa conductivité dépend de sa non
stoechiométrie : plus il est déficitaire en oxygène, plus
il est conducteur. Sa conductivité est très faible, mais celle-ci
augmente avec le dopage par des cations : Mg2+, Nb5+, Ta5+, notamment avec ce
dernier pour lequel la conductivité de TiO2 augmente
considérablement.
ENIT 2009 8
Chapitre 1 : Matériau TiO2
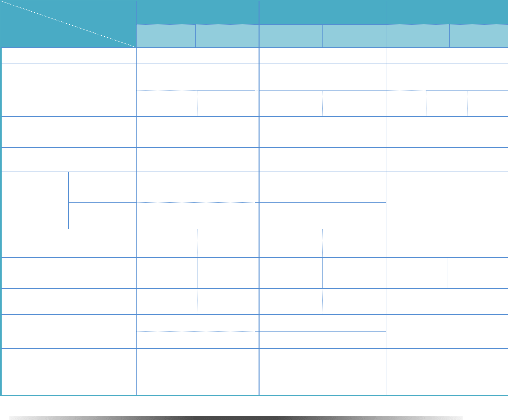
Presque la moitié des atomes de la table
périodique ont été incorporés dans le TiO2 [33, 34]
(voir tableau 1.5). Par exemple, quand des atomes de niobium ou de tantale sont
incorporés dans le TiO2, ils agissent comme donneurs d'électron
[35, 36], ayant pour résultat une augmentation de la conductivité
électrique. Le chrome, le manganèse, et le fer sont
rapportés comme accepteurs d'électron [36, 37, 38] augmentant ou
diminuant la conductivité TiO2 électrique selon le rapport de
leur concentration et de la concentration de lacune d'oxygène [39].
1.3.2 Conductivité
Il est aussi montré que les atomes incorporés
engendrent des défauts tels que des lacunes d'oxygène. Ces
défauts s'opposent à la variation de la conduction
électrique introduite par les impuretés. Soutenance
Ainsi, malgré des concentrations de dopants de l'ordre
du pour-cent, la variation de la conduction électrique est une
augmentation ou une diminution de trois ordres de grandeur par rapport au TiO2
non dopé. Alors que, les couches minces fabriquées avec de la
vapeur d'eau présentent une augmentation de conductivité
électrique de huit ordres de grandeur par rapport à des
échantillons préparés avec de l'oxygène dans des
conditions similaires.
L'importante augmentation de la conduction électrique
est due, selon Alain Bally [31], à l'injection dans les grains de TiO2
d'électrons provenant de liaisons non saturées d'atomes de titane
se trouvant à la surface des grains. C'est la taille nanométrique
des grains qui rend possible un dopage aussi important. Ceci peut être
expliqué du fait que les transitions d'oxydes métalliques sont
souvent non stoechiométriques, à la pression
proche-atmosphérique de l'oxygène, les vacances d'oxygène
est le défaut prédominant dans le TiO2 [40]. Le manque
d'oxygène introduit un excès d'électrons dans le
matériau résultant dans l'augmentation de la conductivité
électrique [40].
NB : Les couches minces de TiO2 ne sont pas
seulement modifiées du point de vue chimique et conductivité
électrique par les incorporations, mais chaque dopage est
accompagné par des changements de structure et de morphologie
importantes, comme la transformation de la structure anatase à la
structure rutile. Par exemple, l'introduction du silicium favorise la structure
anatase, alors que l'introduction de l'étain favorise la structure
rutile [41]. Les grands atomes comme le cérium peuvent casser le
réseau cristallin ce qui donne comme résultat un TiO2 amorphe
[42] (cf. Fig.1.5).
ENIT 2009 9
(b)
Chapitre 1 : Matériau TiO2
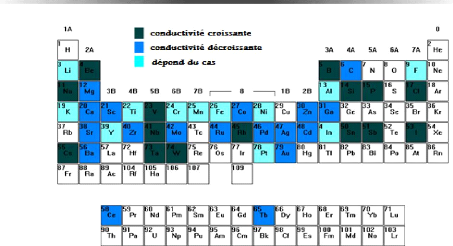
Fig. 1. 5 Tableau des impuretés
incorporées dans TiO2
1.3.3 Constante diélectrique
Le TiO2 isolant est intéressant grâce à sa
constante diélectrique élevée : 173 pour la structure
rutile et 48 pour la structure anatase [43]. Si la conductivité
électrique du TiO2 est suffisamment élevée, il peut
être utilisé comme un oxyde conducteur transparent (transparent
conducting oxide : TCO) comme l'oxyde d'indium-étain, le fluor
dopé avec l'oxyde d'étain ou l'oxyde de zinc [44].
1.4 Propriétés optiques
La lumière utilisable avec le TiO2 non dopé pour
les applications photovoltaïques, est limitée à des
longueurs d'ondes inférieures à 400 nm, c'est-à-dire dans
l'ultraviolet (UV) (Fig.1.6).
ENIT 2009 10
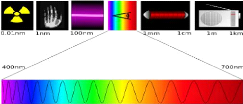

Fig. 1. 6 Spectre de lumière (a) avec la zone
d'action du TiO2 (b)
Chapitre 1 : Matériau TiO2
Des matériaux pouvant travailler dans le visible sont
plus souhaitables en termes d'utilisation de la lumière naturelle. En
effet, seulement 5% de la lumière solaire est utilisée dans le
cas de l'anatase [b]. Pour cette raison, le dopage de TiO2 anatase a
été étudié pour déplacer son gap dans le
visible.
Grâce au dopage, on peut translater la bande
d'absorption d'une couche mince et dans notre cas on peut exploiter le domaine
visible de la lumière pour des applications photovoltaïques ou
photocatalytiques.
Il a été montré que le dopage par
différents métaux de transition comme V, Cr, Mn, Fe et Ni, permet
un décalage vers le visible de la bande d'absorption du TiO2. Ce
décalage dépend de la quantité de dopant introduite.
L'efficacité dans le décalage varie comme suit :
V>Cr>Mn>Fe>Ni. Ceci permet d'utiliser la lumière solaire
plus efficacement et ce jusqu'à 20% à 30% de mieux [45,46].
Les propriétés structurales, optiques et
électriques de TiO2 sont présentées dans le tableau 1.1
[47].
Tab. 1. 1 Propriétés physiques de
TiO2
Phase
Rutile
Anatase
Brookite
Propriété
// à l'axe c
// à l'axe c
? à l'axe c
? à l'axe c
// à l'axe a/b // à l'axe c
|
Structure
|
Quadratique
|
Quadratique
|
Orthorhombique
|
|
Groupe d'espace
|
P42/mnm (136)
c = 2.954Å a=b=4,587 Å
|
I41/amd (141)
c = 9.502 Å a=b=3,782
Å
|
Pcab
a=5.46 Å b=9.18 Å c=5.14 Å
|
|
Le plan réticulaire le
plus
stable
|
(110)
|
(101)
|
|
|
Densité
|
4.25g/cm3
|
3.89g/cm3
|
4.12g/cm3
|
|
Prop élect
(non dopé)
|
Réactive
non réactive
|
Semi conducteur type N
Instable
(isolant/N--/P--)
|
Semi conducteur type N
Instable (isolant/N/P)
|
|
|
Constante diélectrique
statique å0
(MHz range)
|
173 89
|
48 31
|
78
|
|
Indice de réfraction pour
(ë = 600
nm)
|
2.89 2.6
|
2.5 2.55
|
2.57 2.69
|
|
Energie de gap à 10 K [eV]
|
3.051 3.035
|
3.46 3.42
|
3.14
|
|
Mobilité
électrique
[cm2/Vs]
|
Crystal : 0.1-10
Couche mince : 0.1
|
Crystal : 15-550
Couche mince : 0.1-4
|
|
|
Masse effective de
l'électron
|
9 -13me
10 - 30me
12 - 32me
|
~1me
|
|
ENIT 2009 11
Chapitre 1 : Matériau TiO2
1.5 Applications
Le dioxyde de titane, dont l'abondance relative
représente 0,44% [c] de l'écorce terrestre est bon marché,
biocompatible, chimiquement inerte, donc très stable et non toxique. On
peut l'utiliser soit sous forme de poudre dans l'eau (destruction de polluants,
pesticides, colorants) avec séparation et recyclage en fin de
traitement, soit sous forme déposée sur support (fibres de verre,
tissus, plaques). Grâce à ces propriétés, ce
matériau semble particulièrement attractif.
Ainsi, la recherche dans divers domaines est consacrée
à l'oxyde de titane sous diverses formes tel que cristal simple,
céramique et couche mince.
1.5.1 Biocompatibilité du TiO2
Le TiO2 présente également une bonne
résistance à la corrosion et une biocompatibilité qui
conduisent à l'utiliser comme revêtement d'implants chirurgicaux
[48]. Il constitue le principal revêtement des prothèses osseuses.
Il a été utilisé même dans le traitement du cancer
(destruction de cellules tumorales et désinfection en raison de ses
propriétés bactéricides : TiO2/UV). En fait, le titane est
utilisé avec succès comme matériel d'implant pour des
applications dentales, orthopédiques, ostéosynthèses et
son oxyde natal est généralement constitué du dioxyde de
titane. Il est utilisé aussi bien dans l'alimentaire et la pharmacie
(additif).
Le TiO2 a aussi un pouvoir dispersant très important
pour les pigments. Par exemple, avec de l'oxyde de titane, on disperse 60% de
TiO2 dans de l'huile de ricin. Cette propriété peut aussi bien
s'appliquer aux filtres UV physiques dans les produits solaires.
Il est donc abondamment utilisé dans le domaine des
cosmétiques : écrans solaires (utilisation de particules
très fines : de 15 à 50 nm), crèmes de soins, laits
corporels, produits capillaires, huiles pour le corps, huiles pour cheveux,
produits de maquillage, rouge à lèvres etc) [c]. La poudre de
TiO2 est aussi utilisée en dentifrice et savons.
1.5.2 Pigments et peintures
De point de vue application, les oxydes de titane se sont
imposés comme pigments blancs les plus performants et les plus
utilisés dans le monde. En effet, chimiquement inerte, résistant
à la lumière du soleil, non toxique et très opaque, le
dioxyde de titane pur possède un indice de réfraction très
haut (2.55 (anatase) et 2.7 (rutile) à 590 nm), et une dispersion
optique plus élevée que celle du diamant [c]. Ainsi, l'indice de
réfraction élevé, qui provoque la réflexion totale
de la lumière incidente, confère au blanc de titane un attrait
certain dans la réalisation de peintures.
ENIT 2009 12
Chapitre 1 : Matériau TiO2
Il a remplacé depuis 1920, les anciens pigments tels
que : le blanc de zinc (ZnO), le blanc de plomb ou céruse (2PbCO3,
Pb(OH)2), le lithopone (ZnS, BaS) trouvés principalement dans la
fabrication de la peinture et des matières plastiques [c].
Il représente aussi environ les trois quart de la
production mondiale de pigments minéraux synthétiques, devant les
oxydes de fer (pigments rouge, noir et jaune), le noir de carbone et le jaune
de chrome. Les pigments blancs sont aussi largement employés dans le
papier, les encres d'imprimerie, les cosmétiques et l'industrie du
textile [49]. La forme rutile est utilisée en tant que pigment blanc
dans les peintures bâtiment, les encres et spécialement dans les
matières plastiques.
Grâce à son coefficient de réfraction
élevé, il est utilisé comme pigment pour le papier
glacé ou pour la peinture à partir des poudres de TiO2,
remplaçant l'oxyde de plomb qui est toxique [25]. Il est
considéré comme le meilleur des pigments blancs.
Pour les papiers, le TiO2 est utilisé comme agent
opacifiant (charge représentant de 15 à 20 % de la masse du
papier) soit dans la masse soit dans le couchage du papier. Consommations dans
ce secteur, aux États-Unis, en 1992 : kaolin : 5 à 7 millions de
tonne, CaCO3 : 1,5 million de tonne, TiO2 : 250 000 tonne (1/4 de la
consommation nord américaine de TiO2) [c].
1.5.3 Activité photocatalytique
C'est surtout dans le domaine de l'environnement que l'oxyde
de titane a fait récemment une percée importante. En effet, il se
trouve que le TiO2 est un semi-conducteur à grande activité
photocatalytique, ayant une bonne stabilité thermique, qui est
chimiquement et biologiquement inerte, peu cher, facile à produire et
à utiliser. Son seul inconvénient est qu'il absorbe
principalement dans l'UV vu son gap ~3.2-3.0 eV et qu'il n'absorbe que 5%
seulement des radiations visibles [50]. Son activité photocatalytique
exceptionnelle lui permet : de dégrader efficacement la pollution
organique contenue dans l'eau (déminéralisation), de
dégrader les matières organiques volatiles (MOV),
d'éliminer efficacement les bactéries, les virus, les alcools,
les aérosols, les produits de nettoyage, les solvants de peinture, le CO
et même le fumée de tabac. Pour ces raisons, l'oxyde de titane
surtout sous sa variété anatase [51], a été
utilisé dans l'épuration des eaux usées (traitement d'eau
par oxydation des molécules organiques dissoutes) [52] ; la
désodorisation des foyers et des lieux de travail [53, 54]; dans
l'élaboration de surfaces autonettoyantes (exemple les vitres) [55, 56]
; dans la stérilisation dans les hôpitaux [57] ; dans le
traitement du cancer [58]. Enfin, Il a même été
reporté récemment la possibilité de l'incorporer dans du
textile à base de coton qui devient par conséquent autonettoyant
[59, 60].
ENIT 2009 13
ENIT 2009 14
Chapitre 1 : Matériau TiO2
En effet, il existe de nombreux exemples d'applications
environnementales de la photocatalyse qui sont déjà ou sont sur
le point d'être industrialisées. C'est au Japon que l'on trouve
une concrétisation de la plupart de ces applications. Quelques exemples
sont donnés avec les photos de la figure 1.7. Les champs d'application
vont du revêtement d'objet ou d'édifices en plein air (verres,
glaces, vitrage, éclairage, bétons,...) par une couche
submicronique (donc invisible) de TiO2 ce qui rend ces objets "auto-nettoyants"
[11].
Il existe depuis 2003 un dispositif qui permet de traiter des
gros volumes, si les gaz polluants sont solubles dans l'eau, ou encore un
système mis au point pour capter et détruire les odeurs par
photocatalyse, à l'aide d'un papier enrobé de TiO2.
Le TiO2 est aussi un catalyseur capable d'oxyder de
très nombreuses molécules organiques avec une excellente
sélectivité en CO2 grâce a son rendement quantique et aux
potentiels redox de ses bandes de valence et de conduction.
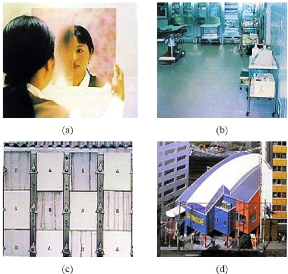
Fig. 1. 7 Illustration d'applications concrètes
des propriétés de TiO2
(a) anti-buée, (b) dalles stérilisantes,
(c) dalles autonettoyantes, (d) toile autonettoyante.
Cependant, un classement des photocatalyseurs peut être
fait en fonction de leur efficacité moyenne constatée. Loin
d'être absolu, ce classement reflète le meilleur compromis entre
un bon rendement quantique, de bonnes propriétés d'adsorption des
molécules organiques, et des potentiels redox adaptés à la
plus grande gamme de polluants possible. Ce classement fréquemment
cité par les photocatalystes [61, 62], place le TiO2, qui a
été le premier
Chapitre 1 : Matériau TiO2
photocatalyseur découvert, comme étant le plus
performant pour l'oxydation de nombreuses molécules [63, 64, 65] (le
classement est donné ci dessous).
TiO2(3,2) >> ZnO(3,3) >ZrO2(3,87) > CeO2 >>
SnO2(3,54) >CdS > MoO3>>WO3(2,76)>>V2O5 1.5.4
Super-hydrophilie (anti-buée)
Il existe aussi un phénomène appelé
"super-hydrophilie" qui a été mis en évidence sur le TiO2
[66, 67, 68]. Peu de matériaux ont un angle de contact inférieur
à 10 degrés, avec comme exception quelques matériaux
adsorbant l'eau et qui ont été activés par des
tensioactifs ou d'autres agents amphiphiles. Lorsque l'angle de contact devient
proche de zéro, la surface du matériau ne retient plus l'eau et
on parle de "super-hydrophilie". Cependant, ces surfaces ne conservent pas ce
caractère hydrophile très longtemps. Or quand la surface du TiO2
est exposée à un rayonnement UV, l'angle de contact avec l'eau
diminue graduellement. Après une exposition suffisamment longue à
la lumière, la surface devient "super-hydrophile". Ce caractère
particulier peut être obtenu pendant un ou deux jours. Ce type de
photocatalyseur est le seul connu possédant une propriété
super hydrophile semi permanente. Cette propriété est
utilisée pour réaliser des miroirs antibuée que l'on peut
utiliser par exemple dans des salles de bain [11] (cf. Fig.1.7 (a)).
1.5.5 Electronique et photovoltaïque
Le dioxyde de titane est très largement utilisé
dans de nombreux domaines de haute technologie du fait de ses
propriétés remarquables. Grâce à son coefficient de
réfraction élevé, il est utilisé dans l'industrie
photovoltaïque sous forme de couches mince [69].
Les cristaux simples transparents ou les couches minces ont un
indice de réfraction élevé qui rend le TiO2
approprié aux applications optiques [70, 71]. Des Multicouches
composées de TiO2 et de SiO2 sont conçues pour faire des
revêtements antireflets dans la totalité du domaine visible [72,
73].
Les électrodes en TiO2 sont utilisées dans les
composants électro-chromiques [74] et les cellules solaires
sensibilisées par des colorants (dye-sensitized solar cells DSSC) [75].
Les cellules solaires photovoltaïques en phase solide (Solid-state
photovoltaic solar cells) formées par une couche poreuse de TiO2
montrent des résultats prometteurs [76, 77].
En tant que semi-conducteur de type n, sa conductivité
est modifiée par adsorption d'un gaz, ce qui en fait un capteur de gaz
efficace [78]. Par exemple, les diodes de Pd-TiO2 sont utilisées
ENIT 2009 15
Chapitre 1 : Matériau TiO2
comme capteur de gaz pour l'hydrogène [79, 80], et le
TiO2 peut remplacer ZrO2 dans les sondes de lambda utilisées dans les
industries d'automobile [21].
Il est utilisé aussi comme une couverture des
électrodes de soudure à l'arc ou comme un agent de polissage doux
: pour automobiles
Il concerne aussi de nombreuses applications à
l'intérieur des bâtiments, s'appuyant sur l'utilisation
d'éclairage artificiel ayant une partie de leur spectre
d'émission dans l'UV. Typiquement, une lampe à fluorescence
émet un rayonnement UV de 0,4 uW.cm-2 et une lampe à
incandescence une puissance de 0,07 uW.m-2, d'après [81].
Ainsi, l'utilisation d'oxydes à haut indice de
réfraction tel que le dioxyde de titane (n=2.4 sur l'ensemble du spectre
visible) a permis la réalisation de micro-guides d'ondes aux
performances tout à fait remarquables.
Sa constante diélectrique élevée en a
fait un candidat potentiel pour le remplacement de SiO2 dans les dispositifs
MOSFET [82, 83].
1.5.6 Eclairage des tunnels
Le dioxyde de titane est incorporé dans le bitume de
routes situées sous des tunnels, il donne une chaussée claire
permettant un meilleur éclairage du tunnel. 130 tonnes de TiO2 ont
été employées pour 3 tunnels autoroutiers de contournement
de Genève [c].
En effet, l'indice de réfraction de la phase rutile du
TiO2 pour ? = 590 nm est : n = 2,70, tandis que celui de l'anatase vaut : 2,55
(à titre de comparaison : le diamant (2,45), le ZnS (2,38), le ZnO (2,2)
et le NaCl (1,54)) [c]. Le TiO2 présente pour le spectre de la
lumière visible un coefficient de diffusion élevé sans
zone d'absorption de telle sorte que 96 % de la lumière incidente est
réfléchie. Par conséquence, il est utilisé pour
l'éclairage dans les tunnels.
1.5.7 Chauffage
Il est aussi utilisé pour la fabrication du titanate de
baryum : céramique ayant les propriétés d'une thermistance
(résistance à coefficient de température positif, CTP),
utilisée comme élément chauffant de petits appareillages
électroménagers : cafetières électriques,
chauffe-biberons, plaques chauffantes. Sa résistance augmentant avec la
température, lorsque la température voulue est atteinte, la
résistance est suffisante pour empêcher le passage du courant
électrique et ainsi arrêter le chauffage, puis le
réguler.
ENIT 2009 16
Chapitre 1 : Matériau TiO2
1.5.8 Autres applications
En plus des applications potentielles précédentes,
les oxydes de titane sont aussi utilisés
dans :
- la détection de certains gaz tels : NO2 [41], H2 [84],
CO [85] ou d'humidité [86].
- la protection contre les UVA et UVB grâce à sa
forte absorption dans l'ultraviolet (TiO2 représente le principal
composant actif des crèmes solaires commercialisées) [87].
- la conversion et stockage de l'énergie solaire en
énergie électrique grâce à des batteries
photovoltaïques qui peuvent servir pour les voitures,
téléphones mobiles ou autres dispositifs portables [88] [89].
- La détection de faux en peinture peut être
réalisée en étudiant la nature des blancs. La
présence de TiO2 implique que le tableau a été peint
après 1920. La mise en évidence de la forme de TiO2
utilisée (anatase ou rutile) permet de donner des indications plus
précises : anatase avant 1953, surtout rutile après [c].
ENIT 2009 17
Chapitre 1 : Matériau TiO2
1.6 Conclusion
Le dioxyde de titane (TiO2) se présente sous
différentes formes cristallines : l'anatase, le rutile et la brookite,
le bronze (TiO2-B), le columbite (TiO2-II, srilankite ou bien TiO2 type
?-PbO2), le hollandite (TiO2-H), le ramsdellite (TiO2-R) et le baddeleyite
(TiO2-III), dont les plus courantes sont l'anatase, le rutile et la brookite
(très rare). Ce composé est un semi-conducteur de type n en
raison de son déficit en oxygène qui résulte de
l'existence de lacunes anioniques ou de la présence d'atomes de titane
en sites interstitiels, sa conductivité dépend de sa non
stoechiométrie : plus il est déficitaire en oxygène, plus
il est conducteur. Sa conductivité est très faible, mais celle-ci
augmente avec le dopage par des cations : Mg2+, Nb5+, Ta5+.
L'étude bibliographique relative au dioxyde de titane,
au niveau structural comme au niveau de ses propriétés, montre
qu'il présente un caractère fortement anisotrope. Ceci nous
permettra de comprendre le comportement de ce matériau face à un
chauffage de substrat ou en fonction de nature de substrat et d'analyser ainsi
les résultats qui seront obtenus.
Une diversité d'applications reflète
l'importance du matériau. A cause du grand potentiel de TiO2 dans les
applications et du manque d'une compréhension de base de ce
matériel, la recherche sur ce matériel est la plupart du temps
topique. Les applications sont essentiellement concentrées sur les
couches minces de TiO2. Les propriétés morphologiques et
structurales, et par suite les propriétés physiques, des couches
minces dépondent du processus de fabrication.
ENIT 2009 18
Techniques de dépôt :
Pulvérisation
cathodique
2.1 Introduction 20
2.2 Dépôt chimique en phase vapeur (CVD :
Chemical Vapor Deposition) 22
2.3 Evaporation thermique 24
2.4 Ablation laser (Pulsed Laser Deposition- PLD)
26
2.5 Epitaxie par jets moléculaires
27
2.6 Pulvérisation cathodique 27
2.6.1 Principe de la pulvérisation
28
2.6.2 Pulvérisation DC (Direct Current)
32
2.6.3 Pulvérisation RF (Radio-fréquence)
34
2.6.4 Pulvérisation triode 35
2.6.5 Pulvérisation réactif
36
2.6.6 Croissance cristalline 37
2.7 Conclusion 39
ENIT 2009 19
Chapitre 2 : Téchniques de dépôt :
La pulvérisation cathodique
2.1 Introduction
Par principe une couche mince d'un matériau
donné est un élément de ce matériau dont l'une des
dimensions, qu'on appelle l'épaisseur, a été fortement
réduite de telle sorte qu'elle s'exprime en nanomètres et que
cette faible distance entre les deux surfaces limites (cette quasi
bidimensionnalité) entraîne une perturbation de la majorité
des propriétés physiques [e].
La différence essentielle entre le matériau
à l'état massif et à l'état de couches minces est
en effet liée au fait que dans l'état massif on néglige
généralement avec raison le rôle des limites dans les
propriétés, tandis que dans une couche mince ce sont au contraire
les effets liés aux surfaces limites qui sont
prépondérants. Il est assez évident que plus
l'épaisseur sera faible et plus cet effet de bidimensionnalité
sera exacerbé, et qu'inversement lorsque l'épaisseur d'une couche
mince dépassera un certain seuil l'effet d'épaisseur deviendra
minime et le matériau retrouvera les propriétés bien
connues du matériau massif.
La seconde caractéristique essentielle d'une couche
mince est que, quelle que soit la procédure employée pour sa
fabrication, une couche mince est toujours solidaire d'un support sur lequel
elle est construite (même si, après coup, il arrive parfois que
l'on sépare la couche mince dudit support). En conséquence il
sera impératif de tenir compte de ce fait majeur dans la conception,
à savoir que le support influence très fortement les
propriétés structurales de la couche qui y est
déposée. Ainsi une couche mince d'un même matériau,
de même épaisseur pourra avoir des propriétés
physiques sensiblement différentes selon qu'elle sera
déposée sur un substrat isolant amorphe tel le verre, ou un
substrat monocristallin de silicium par exemple.
Les principales méthodologies de fabrication
utilisées par les fabricants de composants électroniques actifs
ou passifs font appel à des procédures physiques de
dépôt du matériau sur un substrat initialement
dépourvu de dépôt. La couche mince va donc croître en
épaisseur à partir de zéro. Il est à noter que bien
que l'on dispose de procédés de décapage permettant
d'araser angström par angström un matériau, on n'utilise
pratiquement jamais ce moyen pour obtenir une couche mince d'épaisseur
donnée.
Dans ce chapitre nous décrivons d'abord diverses
méthodes utilisées pour la fabrication de couches minces sous
vide. Nous présentons essentiellement les méthodes de PVD. Nous
décrivons ensuite plus particulièrement le principe de la
pulvérisation cathodique en soulignant ses avantages. La première
partie présente un panorama non exhaustif des différentes
techniques de dépôt existantes les plus courantes. Celles-ci
peuvent être classées en deux catégories :
ENIT 2009 20
ENIT 2009 21
Chapitre 2 : Téchniques de dépôt :
La pulvérisation cathodique
- Méthodes «chimiques» faisant appel à
une réaction chimique ou électrochimique localisée
à la surface du substrat. Ces méthodes font appels à
l'énergie de dissociation des molécules.
- Méthodes «physiques» dans lesquelles le
matériau solide à déposer est transformé en phase
vapeur puis se condense sur le substrat. L'énergie de sublimation est
mise en jeu dans ce type de méthodes.
Ces méthodes nécessitent l'obtention de vides
secondaires pour que les atomes évaporés ne subissent aucune
collision. Les principales méthodes utilisées pour fabriquer des
couches minces sous vide sont classées sur le schéma de la figure
2.1.
Méthodes
générales
pour
déposer une
couche mince
Processus
chimique
(CVD)
Processus
physique
(PVD)
CVD
Laser CVD
Plasma CVD
Pulvérisation Cathodique
Evaporation Thermique
Epitaxie à faisceau moléculaire
DC : Diode/Triode
RF : Diode/Triode
Evap. Thermique par effet Joule
L'ablation Laser
Implantations d'ions
Faisceau
d'électrons
Fig. 2. 1 Méthodes générales pour
déposer une couche mince
Chapitre 2 : Téchniques de dépôt :
La pulvérisation cathodique
NB : Les techniques de fabrication des
couches minces sont très nombreuses. Parmi ceux qui ne sont pas
présentées dans l'organigramme de la figure 2.1 : le plasmas de
décharges électriques, la pulvérisation ionique (IBS), la
pulvérisation ionique par double faisceaux d'ions (DIBS), le
dépôt en phase gazeuse activé par plasma (Plasma Enhanced
Chemical Vapor Deposition PECVD), le MOCVD, le CVD à pression
Atmosphérique (APCVD), le CVD à basse pression (LPCVD),
épitaxie en phase vapeur de semi-conducteurs composés,
dépôt par activation photochimique (UVCVD), dépôt en
bain chimique, dépôt par réaction électrochimique ou
électrodépôt, dépôt à partir d'une
solution : techniques sol-gel etc.
2.2 Dépôt chimique en phase vapeur (CVD :
Chemical Vapor Deposition)
Les différents précurseurs, des
organo-métalliques, sont évaporés puis
transférés par des gaz vecteurs jusqu'à la surface du
substrat chauffé pour former un dépôt solide. Les
composés volatils du matériau à déposer sont
éventuellement dilués dans un gaz porteur et introduits dans une
enceinte où sont placés les substrats. La couche est obtenu par
réaction chimique entre la phase vapeur et le substrat chauffé.
Dans certains cas, une élévation de température est
nécessaire pour maintenir la réaction chimique. Le CVD est un
domaine interdisciplinaire, il comprend un ensemble de réactions
chimiques, un processus thermodynamique et cinétique [90]. La
réaction chimique est au centre de ces disciplines: elle
détermine la nature, le type et les espèces présentes.
Il existe deux types de réacteurs : le réacteur
à paroi chaude et le réacteur à paroi froide. Dans le cas
du réacteur à paroi chaude, ce dernier est chauffé
directement, ce qui permet d'opérer à plus faible pression:
à peu près 75 m torr, pour lesquels des dépôts se
produisent bien sur les substrats, mais aussi sur les parois (technique LPCVD :
Low-Pressure Chemical Vapor Deposition [91]). Dans le cas du réacteur
à paroi froide, seul le substrat est chauffé, si bien que la
réaction n'est effective qu'au niveau du substrat chauffé; elle
se produit à pression atmosphérique. Le principe de cette
méthode de dépôt est présenté dans la figure
2.2, dans le cas de la paroi chaude.
La réaction chimique peut être activée
à l'aide d'un plasma. Cette méthode s'appelle "CVD plasma" ou
PECVD (Plasma Enhanced Chemical Vapor Deposition). Dans ce cas, il y a
création en plus de particules énergétiques. Avec la
méthode CVD, il est possible de déposer des matériaux
métalliques, diélectriques et composites [92].
ENIT 2009 22
Chapitre 2 : Téchniques de dépôt :
La pulvérisation cathodique
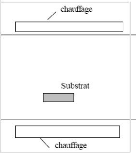
Fig. 2. 2 Schéma de principe de
dépôt CVD, réacteur à parois chaudes
Ce processus n'exige pas de vide poussé et permet
d'obtenir des vitesses de dépôt importantes. Il peut s'adapter
à des surfaces assez grandes et complexes mais les précurseurs
peuvent être chers, difficiles à fabriquer et dangereux à
manipuler.
La fabrication de couches minces métalliques grâce
à ces méthodes s'est particulièrement
développée ces dernières années.
Les avantages de ce procédé sont les suivants :
- facilité d'obtention d'un assez grand nombre
d'éléments ou de composés chimiques.
- bonne qualité des couches, un excellent recouvrement des
marches, et une bonne adaptabilité dans une chaîne de
production.
- possibilité de réaliser des dépôts
sélectifs, ce qui permet d'éliminer une étape de gravure
et de planarisation de la surface.
- grande vitesse de dépôt : peut atteindre 1000
à 10 000 angströms par minute.
- contrôle de la stoechiométrie, de la morphologie,
de la structure cristalline et de l'orientation de croissance qui peuvent
être ajustés par contrôle des paramètres de
dépôt.
- recouvrement uniforme de formes complexes et creuses.
- obtention à températures relativement basses de
composés réfractaires.
- permet des dépôts de haute pureté moyennant
une purification poussée des précurseurs.
- possibilité de modification de surface par bombardement
par des espèces de haute énergie (PACVD).
ENIT 2009 23
ENIT 2009 24
Chapitre 2 : Téchniques de dépôt :
La pulvérisation cathodique
Malgré ces avantages, le CVD a plusieurs
inconvénients :
- les couches sont peu denses, ils sont souvent
contaminés par des gaz très réactifs issus de la
réaction chimique (hydrogène, fluor, chlore...)
- tous les matériaux ne peuvent être
déposés par CVD
- le système de dépôt est une mise en oeuvre
relativement lourde.
- Le substrat doit être chauffé, même si la
température est généralement modérée (800
à 1000 °C), elle peut excéder les tolérances du
substrat (déformation, transition de phase, décarburation des
aciers, diffusion de dopants dans les composants électroniques). Une
voie de recherche active consiste à rechercher des précurseurs
qui réagissent à plus basse température.
- agressivité toxicité et/ou instabilité
à l'air des précurseurs d'où difficulté de
manipulation.
- même chose pour les produits de réaction qui
peuvent attaquer le substrat, provoquant porosité, mauvaise
adhérence et contamination du dépôt.
- essentiellement un procédé d'équilibre
: les phases métastables obtenues par des procédés comme
la pulvérisation ne peuvent généralement pas être
reproduit par la CVD.
- la désorption des gaz entraîne une
porosité.
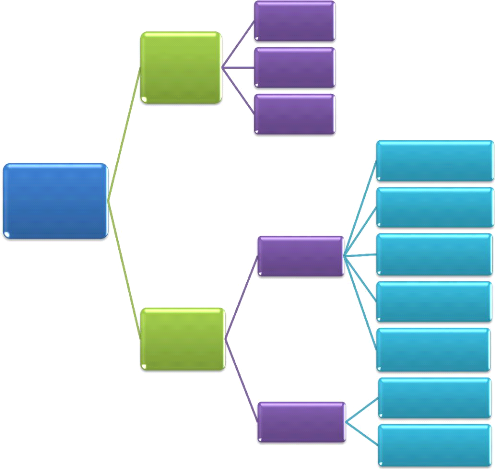
2.3 Evaporation thermique
Il existe plusieurs méthodes d'évaporation plus
ou moins complexes dont la plus simple est l'évaporation par effet Joule
(cf. fig. 2.3).
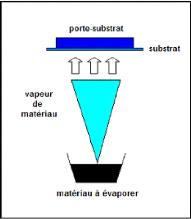
Fig. 2. 3 Principe d'évaporation
thermique
Chapitre 2 : Téchniques de dépôt :
La pulvérisation cathodique
Dans ce cas, le matériau à déposer (la
cible) est placé, sous vide, dans un creuset et chauffé
jusqu'à évaporation. ). Les atomes de la vapeur vont alors se
déposer sur un substrat placé en regard du creuset. Le processus
se fait sous un vide secondaire. On peut ajouter un gaz réactif qui
réagit avec la vapeur et change la composition chimique du
dépôt. La vitesse de dépôt dépend de la
température de la source, de la distance entre le creuset et le substrat
mais aussi du coefficient de collage des espèces évaporées
sur le substrat. Elle varie classiquement de 1 nanomètre par minute
à 10 micromètres par minute [90].
Les procédés de chauffe sont multiples :
résistif à l'aide d'un filament réfractaire, bombardement
électronique à l'aide d'un faisceau d'électrons intense et
énergétique, typiquement 5 à 10 KeV, induction ou par un
faisceau laser. Le premier sert à l'évaporation de
matériau facile à fondre et le deuxième sert à
l'évaporation de matériaux réfractaires.
Cependant, certains problèmes spécifiques
à l'évaporation existent : il est difficile de déposer des
matériaux très réfractaires ou à faible tension de
vapeur. Cette méthode ne permet pas de maîtriser facilement la
composition chimique dans le cas d'un alliage par suite d'un effet de
distillation du composant le plus volatil.
Les couches peuvent être aussi contaminées par
réaction avec le creuset, avec le filament et surtout par le
dégazage des parois induit par l'échauffement ou le bombardement
des électrons.
Dans le cas de l'évaporation par faisceau
d'électrons, les rayons X mous émis peuvent être à
l'origine de défauts cristallins [92]. L'évaporation reste
toutefois une méthode particulièrement appréciée
car elle conduit à l'élaboration de matériaux très
purs et d'autant plus purs que la pression pendant le dépôt est
faible.
La pression dans les systèmes d'évaporation
classiques demeure le plus souvent inférieure à 10-6
torr pendant le dépôt et elle est particulièrement basse
dans les systèmes d'épitaxie par jets moléculaires (EJT,
ou "MBE") [90, 92]. Cependant elle ne convient pas à la fabrication de
couches hors d'équilibre thermodynamique pour lesquelles nous devons
faire appel à une méthode utilisant un bombardement ionique.
Cependant, cette méthode simple à mettre en oeuvre et permettant
de grandes vitesses de dépôt, n'offre généralement
pas aux couches, une très bonne adhérence et il existe des
problèmes de stoechiométrie pour les matériaux
déposés à partir de source multiélément. Le
problème réside dans la faible énergie des atomes
évaporés lors de leur condensation sur le substrat [93].
Pour augmenter cette énergie et ainsi améliorer
la qualité du dépôt, des techniques d'évaporation
thermique assistée par faisceau d'ions (Ion Beam Assisted Deposition)
ont été mises
ENIT 2009 25
ENIT 2009 26
Chapitre 2 : Téchniques de dépôt :
La pulvérisation cathodique
en place. La technique de dépôt reste donc
l'évaporation de la cible à laquelle s'ajoute le bombardement par
le faisceau d'ions énergétiques sur la couche mince en cours de
croissance. Cet apport d'énergie facilite ainsi la formation de liaisons
chimiques entre la couche et le substrat d'où une meilleure
adhérence que lors d'une simple évaporation. Cela permet aussi
d'obtenir des couches minces avec une microstructure moins colonnaire,
améliorant ainsi les propriétés mécaniques,
optiques et électriques.
2.4 Ablation laser (Pulsed Laser Deposition- PLD)
Cette technique a été proposée par
l'équipe de Bell Core [94] et rapidement appliquée par d'autres
groupes. Il s'agit encore d'une évaporation sous vide, l'énergie
étant apportée par l'impact d'un faisceau laser de puissance
élevée, typiquement laser excimère ou laser YAG.
La figure 2.4 représente le principe de cette
méthode.
Fig. 2. 4 Schéma de principe de l'ablation
laser
La surface du matériau à évaporer est
ainsi éjectée sous l'impact d'un faisceau laser, il se forme
localement une "plume" de plasma et les particules éjectées hors
équilibre thermodynamique viennent se condenser sur le substrat. Des
lasers pulsés sont généralement utilisés pour
obtenir les densités lumineuses nécessaires.
Un des principaux avantages de l'ablation laser est de pouvoir
transférer la stoechiométrie entre la cible multicomposant et la
couche. Ceci est particulièrement important pour des matériaux
contenant des éléments volatils tels que le soufre.
Chapitre 2 : Téchniques de dépôt :
La pulvérisation cathodique
Cette méthode présente l'avantage de ne
nécessiter aucune source thermique polluante à l'intérieur
de l'enceinte, ce qui est un avantage très significatif pour les
dépôts effectués dans un environnement ultravide.
Un des plus gros inconvénients de l'ablation laser est
la production de micro particules provoquées par les impacts trop
brutaux sur la cible.
2.5 Epitaxie par jets moléculaires
L'épitaxie par jets moléculaires (ou MBE pour
Molecular Beam Epitaxy) est une technique consistant à envoyer un ou
plusieurs jets moléculaires vers un substrat préalablement choisi
pour réaliser une croissance épitaxiale. Elle permet de faire
croître des échantillons nanostructurés de plusieurs
cm2 à une vitesse d'environ une monocouche atomique par
seconde.
Cette technique est utile dans la fabrication optique (pour
des revêtements réfléchissants ou anti-reflet, par
exemple), l'électronique (couches d'isolants, de semi-conducteurs et de
conducteurs des circuits intégrés), l'emballage (feuilles de PET
recouvertes d'aluminium), et l'art contemporain.
2.6 Pulvérisation cathodique
La pulvérisation cathodique bénéficie
d'une très grande popularité en milieu industriel. Les
procédés de pulvérisation sont moins performants que le
procédé CVD au niveau du nombre de couches traitées
simultanément et de la vitesse de dépôt, mais
incontestablement, ils sont plus simples à mettre en oeuvre et ils
permettent le dépôt de n'importe quel matériau solide
à température ordinaire, surtout des matériaux difficiles
à évaporer.
Bien entendu, on ne peut pas pulvériser les solides
organiques peu stables à cause de l'augmentation de la
température, les matériaux très volatils pour des
problèmes de déficience conduisant à des couches non
stoechiométriques à cause du système de pompage et aussi
les polymères, qui possèdent de très longues chaînes
moléculaires. Les mêmes effets pour les deux derniers types de
matériaux sont observés dans le cas de la méthode
d'évaporation.
Par contre, la pulvérisation cathodique connaît
un grand succès dans le domaine de l'élaboration des
métaux et des diélectriques. Elle a donné lieu à de
nombreuses publications [90]. En pulvérisation cathodique nous
distinguons la pulvérisation simple et la pulvérisation
réactive. Dans la pulvérisation simple l'atmosphère de la
décharge est chimiquement neutre, c'est-à-dire que l'on produit
un vide de 10-6 torr. On injecte ensuite le gaz d'argon pur pour
créer le plasma.
ENIT 2009 27
Chapitre 2 : Téchniques de dépôt :
La pulvérisation cathodique
Dans le cas de la pulvérisation cathodique
réactive l'atmosphère du plasma est réactive,
c'est-à-dire que l'on introduit un certain pourcentage de gaz actif dans
l'argon, par exemple de l'oxygène O2 ou de l'azote N2. Dans chacun de
ces cas, la cible peut être constituée d'un élément
simple ou bien d'un composé. Il existe différents types de
systèmes de pulvérisation cathodique, suivant le mode de
création du plasma ou la nature de la cible (conductrice ou isolante) :
diode à courant continu, triode à courant continu, ou haute
fréquence.
Au cours de ce mémoire, les couches minces ont
été obtenues par pulvérisation cathodique magnétron
RF. Les différentes caractéristiques de cette technique sont
développées dans la suite, mais nous précisons tout
d'abord des notions de base de la pulvérisation.
2.6.1 Principe de la pulvérisation
La pulvérisation consiste à bombarder une cible
avec des particules énergétiques, en général des
ions argon, afin d'en éjecter les atomes (voir figure 2.5).
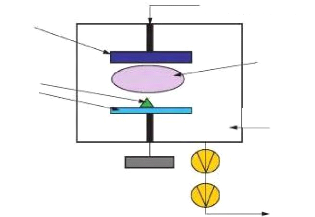
courant négatif (2 à 5kV)
cible
décharge
substrat anode
argon
système de pompage
Fig. 2. 5 Système de pulvérisation
diode
En regard de cette cible est placé un substrat, sur
lequel viennent se déposer les atomes pulvérisés pour
former une couche mince.
La source des ions est un plasma à décharge
luminescente, à l'intérieur d'une enceinte sous vide partiel,
où un champ électrique entre l'anode et la cathode vient ioniser
et accélérer les atomes d'argon.
ENIT 2009 28
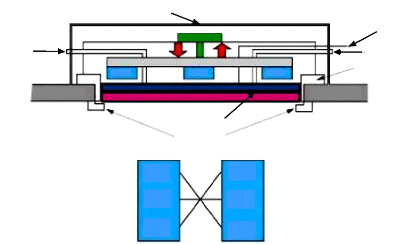
2.6.1.1 La cible (target)
ENIT 2009 29
Chapitre 2 : Téchniques de dépôt : La
pulvérisation cathodique
Dans une enceinte de dépôt, la cible
désigne le matériau à pulvériser ou à
évaporer et qui est transféré vers le substrat à
revêtir. La cible est collé sur un une port-cible en cuivre
galvanisé ou en graphite comme matières amagnétique et
résistibles à la corrosion due à la circulation de l'eau
désionisée de refroidissement (cf. Fig.2.6).
arrivée H2O
Côté atmosphère
Moteur
départ H2O
cadre isolant
Nord
Nord
Sud
capot de
protection alimentation
HT
bâti enceinte
Plaque de refroidissement
Cible
bâti enceinte
Côté vide feuille
graphite
Cadre anode
magnétron 1 magnétron 2
Nord
Cas de 2 magnétron face à face
Les champs magnétiques
se
referment
Nord
Sud
Nord
Sud
Sud
Fig. 2. 6 Schéma des composants de la cathode
magnétron
En effet, il faut prévoir le refroidissement de la
cathode, plus précisément la port-cible, car la dissipation
d'énergie résultant de l'impact des ions peut provoquer la fusion
de celle-ci.
2.6.1.2 Le plasma (ou bien luminescence
négative)
Le plasma est un gaz électriquement neutre, mais
conducteur et généré par excitation d'origine
électrique, magnétique ou thermique ; il constitue le
quatrième état de la matière et est formé d'un
ensemble de particules libres (électrons et espèces neutres :
atomes, molécules), d'ions et de photons (Fig.2.7). Cet ensemble
respecte globalement la neutralité de charges. Dans cet état
l'énergie apportée au gaz provoque une dissociation des atomes.
Lorsque l'apport d'énergie est global, il y a équilibre thermique
(températures supérieures à 10 000°C) on parle alors
de plasma chaud. Lorsque l'apport d'énergie est restreint aux
électrons (décharge), le milieu est hors équilibre
thermique on parle alors de plasma froid. Pour produire les particules
énergétiques qui pulvérisent la cible, un des moyens, est
donc de créer un plasma, c'est à dire d'initier et d'entretenir
une décharge électrique entre deux électrodes dans un gaz
d'argon à faible pression (de quelques mTorr).
ENIT 2009 30
Chapitre 2 : Téchniques de dépôt : La
pulvérisation cathodique
Les particules du plasma sont en mouvement sous l'action de
sources d'énergie électrique, les électrodes (la cathode
chargée négativement et l'anode chargée positivement).
C'est le principe de la pulvérisation cathodique diode (Fig.2.7).
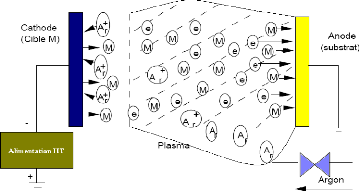
Fig. 2. 7 Principe de la pulvérisation
cathodique diode
Ces particules sont généralement les ions
d'argon Ar+ du plasma, accélérés dans le champ
électrique de la cible, portée à une tension
négative par rapport à celle du plasma. Les particules
pulvérisées sont en général électriquement
neutres. Elles sont diffusées dans toute l'enceinte. Un certain nombre
d'entre elles sont recueillies sur un support appelé substrat,
placé en face de la cible, et sur lequel elles forment une couche mince.
Donc le plasma, appelé aussi la décharge luminescente, est la
base de la pulvérisation cathodique.
2.6.1.3 La gaine ou obscur de Crookes
Etant donné la faible mobilité des ions par
rapport aux électrons, une grande partie du potentiel électrique
appliqué entre l'anode et la cathode est consommée dans l'espace
obscur de Crookes ou gaine de cathode au voisinage de la cathode.
L'épaisseur de celui-ci varie de 1 à 4 cm selon la pression et la
densité de courant. Par conséquent, un champ électrique
important règne dans cette région de telle sorte que les ions
allant du plasma vers la cathode s'y trouvent fortement
accélérés.
La figure 2.8 représente les phénomènes
qui se produisent dans le plasma et la gaine de cathode. Les ions argon qui
sont formés dans le plasma sont accélérés par le
champ électrique de l'espace sombre ou gaine de cathode et vont
bombarder la cible, éjectant des atomes superficiels et des
électrons secondaires. Ces électrons sont
accélérés à leur tour par le potentiel de la gaine
et pénètrent dans le plasma où ils entrent en collision
avec les atomes, les ionisant, et contribuant
ENIT 2009 31
Chapitre 2 : Téchniques de dépôt : La
pulvérisation cathodique
ainsi à entretenir la décharge. Le potentiel le
plus positif est appelé potentiel plasma Vp. Ce potentiel est toujours
négatif.
Luminescence négative
Ar
Ar
Courbe de décharge luminescente
Ar+
Gaine de cathode
Courbe de décharge électrique
Électrons secondaires
Ar
V cathode (<0)
V
Cible
Fig. 2. 8 Décharge et zone de luminescence
négative (plasma)
2.6.1.4 Fonctionnement
Cette technique fonctionne suivant un procédé
d'éjection de matériau à la surface d'un solide (cathode)
par le bombardement de particules ionisées et énergétiques
d'un gaz neutre (ions Ar+). Par simple choc élastique, les
ions transfèrent une partie de leur énergie à un ou
plusieurs atomes de la surface de la cible, rompent les liaisons et impriment
une quantité de mouvement aux atomes arrachés qui se condensent
ensuite sur le substrat (anode). L'arrachage des atomes de surface se produit
lorsque l'énergie transférée dépasse
l'énergie de liaison (voir Fig.2.9) [f].
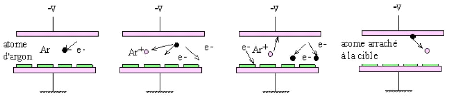
|
Choc d'un électron sur un atome d'argon
|
Ionisation de l'argon
avec production
d'un
électron
|
Bombardement de l'ion
argon sur la cible, choc
des
électrons sur des atomes
d'Ar,
neutralisation
d'électrons
|
Émission d'un atome de
la cible vers
les
substrats, neutralisation
de l'ion Ar+
|
Fig. 2. 9 Mécanisme d'arrachage des
atomes
Chapitre 2 : Téchniques de dépôt :
La pulvérisation cathodique
L'impact des ions sur la cathode produit deux effets. D'une
part, les atomes de la cible sont délogés et
éjectés vers le(s) substrat(s). D'autre part, l'impact
entraîne l'émission d'un petit nombre d'électrons dits
"primaires".
Dans le cas du bombardement d'une cible métallique par
des ions argon, un électron primaire pour environ dix ions est
arraché. Ces électrons, fortement accélérés
dans la zone obscure de la cathode, atteignent le plasma où ils entrent
en collision avec les atomes d'argon. Cette collision entraîne d'une
part, une émission d'électrons dits "secondaires" et d'autre
part, la formation d'ions argon nécessaires au maintien du plasma et
donc au bombardement de la cible. La condition requise pour maintenir une telle
charge d'espace, est que chaque électron primaire entraîne la
formation de suffisamment d'ions, qui à leur tour permettront
l'émission d'un nouvel électron primaire. Pour cela, la distance
anode/cathode doit être suffisamment grande par rapport au libre parcours
moyen des électrons. Les couches obtenus par pulvérisation
cathodique ont des compositions proches de celle de la cible, sont
adhérents et de bonne qualité.
2.6.2 Pulvérisation DC (Direct Current)
La source d'alimentation est une tension continue
négative. On utilise ce mode pour pulvériser des cibles
conductrices. La configuration la plus courante est celle de la cathode plane
magnétron.
2.6.6.1 Le magnétron
Le magnétron est un système de confinement
magnétique des électrons pour augmenter localement le taux
d'ionisation d'un gaz. Il constitue un perfectionnement de la cathode classique
et permet d'augmenter la densité ionique du plasma au voisinage de
celle-ci. En effet, un aimant annulaire, placé sous la cible, engendre
un champ magnétique parallèle à celle-ci. De ce fait les
électrons primaires et secondaires (émis par la cible sous
l'effet de l'impact des ions) ont des trajectoires qui s'enroulent autour des
lignes de champ. Une zone plus riche en électrons est ainsi
créée au voisinage de la cible, ce qui permet d'augmenter le taux
d'ionisation du gaz et le rendement de pulvérisation de la cible. Dans
le cas des cathodes magnétron, la vitesse de pulvérisation des
matériaux cibles est fortement augmentée.
2.6.6.2 Pulvérisation DC pulsé
L'inconvénient du DC continu en atmosphère
réactive est la formation, lors du dépôt, d'une couche
isolante sur la cible. L'accumulation de charges sur la cible entraîne la
formation de micro-arcs et de défauts dans la couche. Dans le cas de la
technique dite « DC pulsé », le procédé de
ENIT 2009 32
ENIT 2009 33
Chapitre 2 : Téchniques de dépôt :
La pulvérisation cathodique
dépôt est périodiquement interrompu en
appliquant une tension positive sur la cible. Cette dernière est alors
régulièrement déchargée par bombardement
électronique. La figure 2.10 représente l'impulsion de tension
appliquée à la cible. Le temps, ?, pendant lequel la tension est
positive est appelé Reverse time.
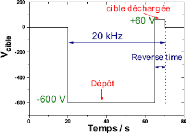
Fig. 2. 10 Schéma du créneau de potentiel
appliqué à la cible.
Cette technique permet de conserver des vitesses de
dépôt importantes contrairement aux techniques RF. Une
étude menée par L.B. Jonsson [95] a comparé les
propriétés de couches minces d'Al2O3 déposées,
à partir de la même cible d'aluminium, par pulvérisation en
DC pulsé ou en DC continu. Il s'avère que les vitesses de
dépôt sont les mêmes pour des fréquences
supérieures à 5-10 kHz.
2.6.6.3 Les limites du dispositif "diode"
Le système de pulvérisation cathodique DC diode
présente l'avantage d'être très simple à mettre en
oeuvre. Son inconvénient majeur est lié à la
nécessité d'utiliser une valeur élevée de la
pression (10-1 ou 10-2 torr) pour entretenir une
décharge stable. En effet aux pressions élevées, on
observe dans les couches déposées la présence en
quantité non négligeable d'impuretés, en provenance
principalement :
-- du gaz de bombardement, par exemple de l'argon occlus dans les
couches,
-- de l'atmosphère résiduelle ; par exemple de
la vapeur d'eau, de l'oxygène ou des molécules organiques, qui ne
peuvent être totalement éliminés du fait de la faible
dynamique de pompage dans la gamme de pression considérée.
La présence d'impuretés dans l'enceinte se fait
d'autant plus ressentir au niveau des couches, par suite du
phénomène de rétrodiffusion des particules
pulvérisées, que les vitesses de dépôt sont
relativement faibles : toujours inférieures à quelques
micromètres par heure. Cet ancien procédé est donc peu
performant.
ENIT 2009 34
Chapitre 2 : Téchniques de dépôt :
La pulvérisation cathodique
2.6.3 Pulvérisation RF (Radio-fréquence)
Le dispositif haute fréquence présente la
même structure que la pulvérisation diode DC, mais on remplace le
champ électrique continu par un champ électrique alternatif
à haute fréquence de l'ordre de 13.56 MHz (1 kV crête
à crête). On peut ainsi maintenir la décharge
jusqu'à une pression inférieure à 10-3 torr. Si
l'on ajoute un champ magnétique continu au champ électrique RF,
on peut maintenir une décharge stable jusqu'à quelques
10-4 torr. Ceci est un avantage considérable car le libre
parcours moyen des molécules gazeuses est d'environ 50 cm [90]. La
plupart des atomes éjectés de la cible ne rencontreront pas les
molécules du gaz résiduel.
L'avantage essentiel du procédé est de permettre
la pulvérisation de n'importe quel matériau, qu'il soit
conducteur ou isolant, car dans des systèmes à courant continu
les charges électriques des ions bombardant la cible s'accumulent
à sa surface. Elles y créent un champ électrique qui
repousse les ions du plasma, ce qui a pour effet de réduire
considérablement l'efficacité de la pulvérisation.
On peut envisager de travailler en courant alternatif pour
décharger la cathode, mais les ions restent suffisamment mobiles pour
atteindre les électrodes à chaque moitié de cycle, les
deux sont donc pulvérisés (substrat et cible) et le transport de
matière est nul. Pour éviter cela, on choisit d'utiliser un
plasma haut fréquence. Si on augmente la fréquence, les
électrons oscillant dans le champ HF acquièrent suffisamment
d'énergie pour provoquer une ionisation efficace et les ions, plus
lourds, restent immobiles dans le champ HF et ne provoquent pas la
répulvérisation du substrat. Les ions du fait de leur masse
restent peu mobiles et les électrons de masse négligeable suivent
les changements de polarité (voir Fig. 2.11).
Espace noir
Espace noir
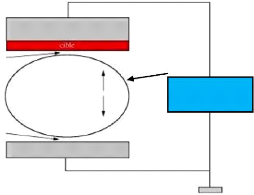
Contre électrode
électrode
cible
Déplacement des
électrons dans
le
nuage de plasma
Générateur RF
Fig. 2. 11 Principe de la pulvérisation
radiofréquence
ENIT 2009 35
Chapitre 2 : Téchniques de dépôt :
La pulvérisation cathodique
Tant que les électrons secondaires, formés lors
de la collision des ions Ar+ sur la cible isolante, ne peuvent
entretenir le plasma on utilise le mode RF de telle sorte qu'à la
fréquence considérée (13,56 MHz), les électrons
oscillent à grande fréquence par contre les ions sont
quasi-immobiles du fait de leur masse beaucoup plus élevée.
Les atomes sont ionisés par les chocs avec les
électrons oscillants ce qui réduit la dépendance de la
décharge vis à vis de l'émission d'électrons
secondaires. La cible isolante n'évacuant pas les charges, il s'ensuit
un excès limité de charges négatives créant ainsi
une tension négative d'autopolarisation attirant les ions positifs qui
vont ainsi pulvériser la cible.
Dans notre cas, on a utilisé le processus de
pulvérisation cathodique RF magnétron (voir Fig. 2.12).
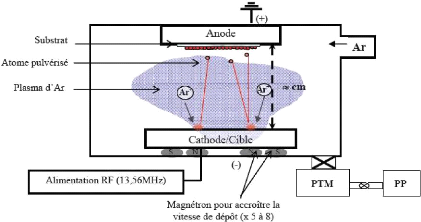
Fig. 2. 12 Schéma d'un dispositif de
pulvérisation cathodique RF magnétron
Dans le cas du système triode, on applique une tension
haute fréquence à la cible. On élimine de cette
manière, d'une alternance à l'autre, les charges qui ont tendance
à s'y accumuler.
2.6.4 Pulvérisation triode
Dans les procédés diode DC ou haute
fréquence, le plasma est produit au moyen d'une décharge à
cathode froide. Ce procédé de production des ions exige
l'utilisation de tensions relativement élevées ce qui est un
inconvénient dans certains cas. De plus il n'y a pas assez
d'électrons pour ioniser le plasma.
Dans le système de pulvérisation cathodique DC
triode, présenté dans la figure 2.13, on produit la
décharge au moyen d'électrons émis à partir d'une
cathode chaude et accélérés dans un champ
électrique crée par une anode qui est un cylindre porté
à un potentiel d'environ +150 volts.
ENIT 2009 36
Chapitre 2 : Téchniques de dépôt :
La pulvérisation cathodique
Ces électrons provoquent l'ionisation d'une faible
fraction des particules du gaz, un sur dix mille, se trouvant entre ces deux
électrodes.
La cathode est un filament de tungstène chauffé
par effet Joule à une température de l'ordre de 2500 °C
[90]. Dans le système triode, la décharge peut être
entretenue à une pression plus faible que dans le montage DC diode : de
l'ordre de 10-3 à 10-4 torr, ce qui est un
avantage du point de vue de la contamination des couches par le gaz
utilisé pour former le plasma.
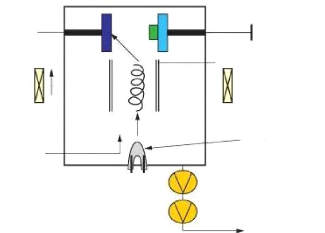
Bobine
Ar
H
Bobine
Cible
Substrat
Ar+
Anode
e-
Cathode thermoionique W
Argon
Système de pompage
Fig. 2. 13 Principe de fonctionnement de la
pulvérisation triode
De plus, ce système présente une très
grande souplesse d'utilisation : la cible, indépendante du plasma, est
bombardée à des énergies faibles, ce qui n'est pas le cas
dans le système diode.
2.6.5 Pulvérisation réactif
Procédés dans lesquels une ou plusieurs des
espèces du revêtement est (sont) gazeuse(s). Par exemple,
pulvérisation de Al dans O2 pour former Al2O3, Ti pour former TiO2, Ti
ou Nb dans N2 pour former TiNx ou NbNx,
dépôts de diamant à partir de CH4.
Parmi les avantages de cette technique :
- des composés complexes peuvent être
formés à partir de cibles métalliques faciles à
fabriquer
- on peut réaliser des gradients de concentration.
- La réaction peut se produire sur la cathode et le
matériau formé est ensuite éjecté, ou la
réaction peut se produire sur le substrat (on est alors proche de la
CVD)
ENIT 2009 37
Chapitre 2 : Téchniques de dépôt :
La pulvérisation cathodique
2.6.6 Croissance cristalline
L'élaboration d'une couche par pulvérisation
cathodique se déroule suivant trois étapes successives. Chaque
étape est préférentiellement influencée par
certains paramètres de dépôt. La première
considère le déplacement des atomes de la cible au substrat.
Cette étape est essentiellement influencée par la pression totale
dans le gaz de pulvérisation et la puissance du magnétron. Les
deux étapes suivantes consistent en l'incorporation des atomes sur le
substrat ou dans la couche et à leur diffusion dans la couche
jusqu'à leur position d'équilibre. Ces deux étapes sont
influencées par l'énergie des atomes incidents et la
température du substrat. Une fois qu'une couche continue est
formée, l'évolution suit son cours jusqu'à la structure
finale suivant le modèle de Movchan et Demchishin (voir Fig.2.14). Ce
modèle, schématisant la relation entre température de
dépôt et microstructure des couches, se divise en trois zones
[90].
Dans la zone I, à basse température, la
mobilité des atomes déposés est réduite et la
structure se forme à partir de la géométrie de surface.
Une structure colonnaire composée de nanocristallites se forme à
partir des nucléis créés sur des défauts. Les
colonnes coniques n'ont que peu de liaisons entre elles.
Dans la zone II, lorsque la température du substrat
augmente, la mobilité des particules adsorbées augmente et la
morphologie structurale se transforme et correspond à la zone T : les
cristallites grossissent et les grains sont de plus en plus serrés pour
former des colonnes de grains (zone II).
La taille des colonnes croît avec la température
et finalement si on augmente encore la température, on arrive à
une recristallisation du composé (zone III).
T1 Température T2
Zone I Zone II Zone III
Métal < 0.3 TM 0.3-0.45 TM > 0.45 TM
Oxyde < 0.26 TM 0.26-0.45 TM > 0.45 TM
Fig. 2. 14 Zones Structurales (Mochvan et
Demchishin)
avec TM (melting temperature) représente la
température de fusion du matériau de la couche : métal ou
oxyde.
Chapitre 2 : Téchniques de dépôt :
La pulvérisation cathodique
Le modèle de Thornton (Fig. 2.15) [96] rajoute au
modèle précédent l'influence de la pression totale. Pour
une pression de travail élevée, la probabilité de chocs
accrue impose aux particules de parvenir au niveau du substrat avec une
énergie réduite limitant leur diffusion, le dépôt
est alors plus poreux.
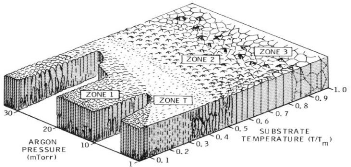
Fig. 2. 15 La morphologie d'une CM par le modèle
M-D et Thornton.
La microstructure est contrôlé par la
température homologue T/TM (en K et non pas en °C).
Avec : T = température du substrat
TM = température de fusion (melting temperature) Zone I :
Croissance nodulaire ou colonnaire (structure poreuse) Zone T : Croissance
nanofibreuse (structure de transition) Zone II : Croissance microcristalline
orientée ou épitaxiale Zone III : Croissance isotrope (structure
recristallisée des grains)
ENIT 2009 38
Chapitre 2 : Téchniques de dépôt :
La pulvérisation cathodique
2.7 Conclusion
Le dépôt en phase vapeur physique (PVD)
présente beaucoup d'avantages par rapport au dépôt en phase
vapeur chimique. Parmi les points forts de la PVD :
- facilité de contrôle de processus qui est
extrêmement versatile, non polluant et permet le dépôt d'une
grande variété de matériaux inorganiques (métaux,
alliages, composés ou un mélange de telles espèces) ainsi
que de certains matériaux inorganiques.
- Possibilité de dépôt sur des substrats
aux formes complexes (non-plans) à des vitesses de dépôt
importantes.
- Très haute pureté et densité des
dépôts, excellente liaison au substrat et bon état de la
surface finie qui évite un traitement ultérieur.
Les grands avantages de la pulvérisation sont
l'obtention d'une qualité optique et morphologique souvent
supérieure à celle des couches obtenus par simple
évaporation ainsi qu'un meilleur transfert de la stoechiométrie,
ainsi, possibilité de faire varier la température du substrat
dans de très larges limites depuis des températures
négatives jusqu'à de très hautes températures. Par
contre, les vitesses de déposition sont plus faibles de l'ordre de la
dizaine de nm/min car le caractère isolant des cibles impose de
travailler avec des puissances réduites
Une des applications les plus fréquentes de cette
méthode est la réalisation de structures multicouches
isolant-conducteur avec des machines équipées de plusieurs cibles
haute fréquence. Ces machines sont utilisées pour la
réalisation de condensateurs en couches minces. Les vitesses de
dépôt obtenues grâce à ce procédé sont
directement proportionnelles à la puissance appliquée sur la
cible ; le courant ionique est lui aussi directement proportionnel à la
puissance dissipée dans la cible.
ENIT 2009 39
|
Chapitre 3 : Elaboration et caractérisation des couches
de TiO2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Elaboration et caractérisation des
couches minces de TiO2
3.1 Introduction 41
3.2 Elaboration des couches minces de TiO2
41
3.2.1 Préparation des substrats 41
3.2.2 Dispositif de pulvérisation
42
3.2.3 Etching 43
3.2.4 Pré-pulvérisation 43
3.2.5 Pulvérisation 44
3.3 Caractérisation structurale : Analyse par
Diffraction des Rayons X (DRX) 45
3.3.1 Principe de la méthode 45
3.3.2 Description de l'appareillage 46
3.3.3 Couches élaborées sur des
substrats de verre 49
3.3.4 Couches élaborées sur des
substrats de silicium 51
3.4 Caractérisation morphologique par
Microscopie à Force Atomique 54
3.4.1 Les modes de fonctionnement les plus courants
55
3.4.2 Dispositif utilisé 56
3.4.3 Couches de TiO2 élaborées sur des
substrats de verre 57
3.4.4 Couches de TiO2 élaborées sur des
substrats de silicium 59
3.5 Caractérisation optique des couches minces
de TiO2 62
3.5.1 Méthode de calcul des constantes optiques
62
3.5.2 Couches élaborées sur des
substrats de verre 65
3.5.3 Couches élaborées sur des
substrats de silicium 71
3.6 Caractérisation électrique
72
3.6.1 Spectroscopie d'impédance
électrique 72
3.6.2 Type de conductivité 83
3.7 Conclusion 85
ENIT 2009 40
|
Chapitre 3 : Elaboration et caractérisation des couches
de TiO2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.1 Introduction
Dans ce chapitre, nous présentons d'abord une
description de la technique de fabrication des couches minces de dioxyde de
titane par pulvérisation cathodique RF magnétron et une
description de chaque technique expérimentale d'analyse utilisée
pour l'étude des propriétés structurale, morphologique,
optique et électrique des couches. Par suite nous exposons les
résultats de caractérisation des différentes couches
élaborées. Nous avons fait varier la température de
croissance en utilisant des substrats en silicium et d'autres en verre et
étudié son effet sur les couches de dioxyde de titane.
3.2 Elaboration des couches minces de TiO2
Les couches de dioxyde de titane ont été
élaborées, au Laboratoire de Photovoltaïque et
Matériaux Semi-conducteurs (LPMS) de l'ENIT, par pulvérisation
cathodique RF magnétron. Une série de quatre manipulations a
été faite en variant la température des substrats de la
température ambiante jusqu'à 300 °C. Une étape
préliminaire à l'élaboration des couches minces est la
préparation des substrats.
3.2.1 Préparation des substrats
Le fait de nettoyer les substrats avant chaque
dépôt permet d'améliorer l'adhérence entre la couche
à déposée et son support. Cependant, l'obtention d'une
bonne adhérence ne dépend pas uniquement de cette étape.
En effet, d'autres facteurs entrent en jeu, comme les contraintes thermiques,
mécaniques ou chimiques. La phase du nettoyage ex situ a pour but
d'éliminer toutes les particules solides (grains de poussière ou
d'abrasif) se trouvant en surface. Pour cela il est nécessaire
d'utiliser un solvant (alcool) qui dissout les contaminants sans attaquer le
substrat.
La phase de préparation des substrats consiste à
couper en petits morceaux les « wafers » de silicium et les lames de
verre et à marquer la face arrière de chaque morceau par une
croix à l'aide d'un stylo diamant. Ces substrats vont être, par la
suite, nettoyés chimiquement selon le processus suivant :
1. Lavage à l'aide d'un détergent.
2. Rinçage avec l'eau désionisée.
3. Rinçage avec l'acétone.
4. Rinçage avec l'eau régale (2/3 HNO3; 1/3 HCl)
pendant 15 min.
5. Un deuxième rinçage avec l'eau
désionisée.
6. Rinçage avec l'acétone.
7. Passage aux ultrasons pendant 15 min.
ENIT 2009 41

Trois cibles
Porte-substrat tournant
(b) (c)
(a)
Vers pompe 2aire
Bouteilles
d'azote et d'oxygène
Compteur temps de dépôt
UC de températ. des subs. Régulateur (PID)
Unité de contrôle (UC) de la cathode RF
Bouteille d'argon
UCs des cathodes DC
Choix du mode : etching/sputtering
Contrôle de la pompe
d'eau de refroidissement
Alimentation : RF et générale
Pression du vide 2aire et 1aire
ENIT 2009 42
Chapitre 3 : Elaboration et caractérisation des
couches de TiO2
8. Rinçage avec l'acétone.
9. Séchage dans une étuve à 120 °C
pendant 15 min.
10. Essuyage délicat avec un papier Josef.
Mais un tel nettoyage n'est pas suffisant pour obtenir une
surface correcte. Les impuretés de surface restantes sont
éliminées grâce à un nettoyage in situ appelé
« etching » par le bâti de
pulvérisation décrit ci-après. Le principe
de nettoyage physique sera décrit au paragraphe 3.2.3.
3.2.2 Dispositif de pulvérisation
Le dispositif utilisé est une enceinte de
pulvérisation cathodique à radiofréquence (13,56 MHz) High
rate sputtering system ULVAC Model SH-350E-D06 (voir Fig. 3.1 (a)).
|
Chapitre 3 : Elaboration et caractérisation des couches
de TiO2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Fig. 3. 1 Bâti de pulvérisation cathodique
au Laboratoire : (a) enceinte, (b) cible, et (c) unité de
contrôle
Ce bâti fonctionne avec le procédé
magnétron, des aimants permanents sont positionnés sous la cible
de manière à ce que les lignes de champ soient orientées
pour former une boucle au dessus de la cible (cf. Fig.3.1 (b)).
L'enceinte de dépôt dispose de trois porte-cibles,
de diamètre de 10 cm qui permettent de réaliser in situ des
dépôts multicouches (Fig.3.1 (b)) et un porte-substrat tournant,
pour favoriser un flux de matière homogène, pouvant contenir plus
que 36 substrats (Fig.3.1 (a)).
Les paramètres de croissance peuvent être
commandés et controlés par l'unité de contrôle (cf.
Fig. 3.1 (c)).
3.2.3 Etching
Après l'établissement du vide secondaire dans la
chambre, un nettoyage physique ou « etching » des substrats pendant
15 mn sous une puissance de 200W est faite dans l'objectif d'enlever des
impuretés éventuelles existantes sur la surface du substrat. En
effet, les impuretés de surface restantes sont éliminées
grâce à un nettoyage in situ par amorçage d'une
décharge électrique entre la cathode et l'enceinte mise à
la masse.
3.2.4 Pré-pulvérisation
Une pré-pulvérisation d'une durée de 5
minutes est effectuée avant chaque nouvelle pulvérisation afin de
décaper la surface de la cible.
La pulvérisation d'une cible formée
d'espèces avec des rendements de pulvérisation différents
conduit à une phase vapeur plus riche de l'un des constituants. Il en
découle donc un appauvrissement de la cible en cet
élément.
La composition d'équilibre ne sera obtenue qu'au bout
d'un certain temps (temps de pré-pulvérisation allongée
à 30-45 min lors de la première utilisation de la cible) lorsque
la composition superficielle des espèces sera telle que le rendement de
pulvérisation combiné à la constitution des espèces
par unité de surface aura atteint un équilibre.
La figure 3.2 décrit le phénomène de
pulvérisation préférentielle dans le cas d'une cible
formée d'éléments à rendements différents de
pulvérisation [97].
ENIT 2009 43
|
Chapitre 3 : Elaboration et caractérisation des couches
de TiO2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Fig. 3. 2 Pulvérisation
préférentielle : cible d'éléments à
rendements différents
3.2.5 Pulvérisation
La dernière étape de l'élaboration des
échantillons est la pulvérisation. Cette technique de
déposition met en jeu de nombreux paramètres qui interviennent
sur les caractéristiques des couches. Les paramètres les plus
déterminants pour notre étude et dépendant essentiellement
du bâti utilisé sont :
V' la puissance de déposition : 200 Watt.
V' la pression dans l'enceinte : 5 10-5 Pa.
V' la distance cible-substrat (fixe) : 65 mm.
V' le temps de dépôt : 4 heures.
V' la rotation des substrats : 15 tr/mn.
V' le choix du gaz réactif : sans gaz réactif.
V' température des substrats : qui est la variable
(TAmbiante, 100, 200 et 300 °C).
V' nombre de cibles : une seule cible de TiO2 de pureté
99.999 %.
V' type de la cathode (DC ou RF) : RF.
V' pression de dépôt : 0.6 Pa.
V' flux d'argon correspondant à la pression de
dépôt : 2.8 sccm.
Les échantillons sont enfin soigneusement
retirés de la chambre, numérotés et seront
caractérisés par une série de mesures (structurale,
optique, morphologique et électrique)
ENIT 2009 44
|
Chapitre 3 : Elaboration et caractérisation des couches
de TiO2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.3 Caractérisation structurale : Analyse par
Diffraction des Rayons X (DRX)
La diffraction de rayons X est une méthode
universellement utilisée pour déterminer la structure
cristallographique des couches minces. C'est la technique de base de la
caractérisation de la nature de l'empilement atomique, distance, angles
dans la maille et phases minérales micro et poly-cristallines des
matériaux. En effet, cette méthode ne s'applique qu'à des
milieux cristallins (roches, cristaux, minéraux, pigments, argiles,
etc.) présentant les caractéristiques de l'état
cristallin, c'est-à-dire un arrangement périodique,
ordonné et dans des plans réticulaires tridimensionnels des
atomes constitutifs. Les atomes s'organisent donc en plans réticulaires
plus ou moins denses qui sont désignés par leurs
coordonnées (h, k, l) dans un système de repérage de
l'espace. La méthode permet ainsi clairement de distinguer les produits
amorphes (verres ...) des produits cristallisés.
3.3.1 Principe de la méthode
L'état cristallin est caractérisé par la
répartition tripériodique dans l'espace d'un motif atomique.
Cette répartition ordonnée constitue des plans parallèles
et équidistants que l'on nomme plans réticulaires (h,k,l). Les
distances interréticulaires sont de l'ordre de 0.15 Å- 15 Å
et dépendent de la disposition et du diamètre des atomes dans le
réseau cristallin. Elles sont constantes, caractéristiques du
cristal et peuvent être calculées grâce à la
diffraction de rayons X.
Les corps cristallins peuvent être, donc,
considérés comme des assemblages de plans réticulaires
plus ou moins denses. Les plans contiennent les atomes : certains plans
contiennent bien plus d'atomes que d'autres en fonction de la formule chimique
du minéral. Ces plans réticulaires sont séparés par
des distances caractéristiques (d) selon la nature du cristal ou du
minéral considéré. Trois ou quatre distances
réticulaires bien choisies permettent une reconstitution du
réseau cristallin du minéral.
Avec un rayonnement de longueur d'onde suffisamment petit, on
peut obtenir des diffractions par les plans réticulaires (de la
même manière que les rayons lumineux sont diffractés par
les petites fentes d'un réseau en optique). Cette réfraction est
d'autant plus intense que le plan est « dense » c'est-à-dire
riche en atomes.
La théorie a été élaborée
par W.L. Bragg et G.Wulff : on l'appelle théorie de
Wulff-Bragg. Un faisceau de rayons X monochromatiques et
parallèles de longueur d'onde ? qui frappe un cristal est
diffracté dans une direction donnée par chacune des familles des
plans réticulaires à chaque fois que la condition ou loi de
Bragg est réalisée :
ENIT 2009 45
ENIT 2009 46
Chapitre 3 : Elaboration et caractérisation des couches de
TiO2
n? = 2d sinO (1)
n? : ordre de la diffraction,
n : nombre entier,
? : longueur d'onde du faisceau de rayons X,
d : distance de deux plans réticulaires,
O : angle d'incidence des rayons X.
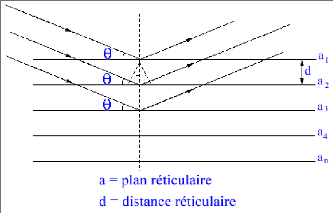
Rayon X
O
A
O
B
C
Rayon X
Fig. 3. 3 Schéma de DRX par une famille de plans
réticulaires : a1, a2, a3
La différence de marche entre deux plans
consécutifs est ici égale à
? = AB+BC (2)
or AB+BC = 2 OB sin O (3)
Comme OB est la distance interréticulaire d et que
AB+BC doit être égale à un nombre entier de longueur d'onde
?, en posant n = nombre entier, on retrouve la formule de Bragg (1).
Pour que la diffraction se produise, il faut que les ondes
diffractées par les différents plans soient en phase, c'est
à dire que la différence de marche (Fig. 3.3) des rayons
rencontrant ces plans soit égale à un nombre entier. Dans ce cas,
l'angle suivant lequel le faisceau de rayons X est
dévié est égal à l'angle d'incidence O et est
caractéristique de la distance interplanaire ou interréticulaire
d. Si l'on connaît la longueur d'onde ? du faisceau de
rayons X, on peut mesurer à partir de l'angle O
l'équidistance d et ainsi identifier la nature du
cristal.
3.3.2 Description de l'appareillage
L'appareil utilisé est un diffractomètre «
Philips X'Pert 1 X-ray diffractometer » équipé d'un
goniomètre à géométrie BRAGG-BRENTANO (cf. Fig.
3.4). Dans cette configuration, la
Chapitre 3 : Elaboration et caractérisation des
couches de TiO2
profondeur de pénétration de la source des
rayons X est beaucoup plus grande que l'épaisseur de nos
échantillons. Ainsi, l'échantillon est sondé sur toute son
épaisseur [g].

Fig. 3. 4 Le diffractomètre « Philips
X'Pert 1 X-ray diffractometer »
Les rayons X ont été produits à partir
d'une source de radiation CuKá, ayant une longueur d'onde de 1.5418
Å, avec une tension d'accélération de 40 kV et un courant
de 30 mA. Le pilotage de l'appareil est assuré par un micro-ordinateur
[g].
Le matériau est bombardé par un faisceau
monochromatique de rayons X parallèles de longueur d'onde connue (cf.
Fig. 3.5), produit grâce à une anticathode de cuivre (Energie du
rayonnement : 8047 eV ; longueur d'onde : 1.5418 Å).
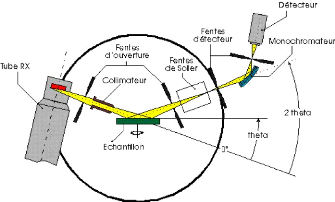
ENIT 2009 47
Fig. 3. 5 Schéma de principe d'un
diffractomètre par Rayon X
|
Chapitre 3 : Elaboration et caractérisation des couches
de TiO2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Le rayonnement émis est défini par un
système de fentes situées avant et après
l'échantillon. Ce dernier est fixé sur une lame de verre qui
tourne d'un mouvement uniforme autour d'un axe situé dans son plan
(cercle goniométrique), permettant ainsi d'augmenter le nombre
d'orientations possibles des plans réticulaires. Les particules
étant orientées au hasard, il y aura toujours une famille de
plans donnants lieux à la diffraction, de telle sorte que l'on obtiendra
simultanément tous les faisceaux susceptibles de diffracter : ces
faisceaux forment des cônes de demi-angle au sommet 2 0.
Un détecteur ou compteur (Geiger-Müller ou
compteur à scintillation) mesure l'intensité du rayonnement X
diffracté dans certaines directions. Il tourne autour du même axe
mais à une vitesse double de celle de l'échantillon. Pour un
angle d'incidence 0, l'angle mesuré par le déplacement du
compteur sera donc 2 0. Un diaphragme à couteau permet d'éliminer
l'effet parasite du faisceau incident dans les petits angles (2 0 <
10°). L'enregistrement réalisé est la courbe de
l'intensité des rayons X diffractés en fonction des angles de
diffraction.
Lorsque les plans réticulaires (hkl) de
l'échantillon se trouvent sous une incidence 0 vérifiant la loi
de Bragg, il y a diffraction sous un angle 20 par rapport au faisceau incident.
Chaque diagramme de diffraction est défini par des positions angulaires
20hkl et par des intensités diffractées Ihkl
caractéristiques des espèces cristallines et des phases
présentes dans l'échantillon. L'ensemble du rayonnement
diffracté est enregistré à l'aide d'un détecteur
associé à une unité d'acquisition placée
derrière l'échantillon.
L'identification des raies obtenues sur les spectres se fait
par comparaison manuelle ou bien informatique avec celles des fichiers de
références. La base de données la plus complète
à l'heure actuelle est la « Powder Diffraction File » (PDF) de
l'ICDD (Inorganic Crystal Structures Database : ex-JCPDS : Joint committee on
powder diffraction standards, ex- comité E4 de l'ASTM), avec plus de 150
000 fiches (dont cependant de nombreuses redondances) [h].
L =
Les tailles des grains sont évaluées à
partir de la largeur à mi-hauteur f3 (mesurée en 20) des pics de
diffraction à l'aide de la formule de Debye Scherrer [103]
:
âcosè
où L désigne la taille des grains en Å, f3
la largeur à mi-hauteur du pic exprimé en radians, ë est la
longueur d'onde du faisceau (ë=1.5418 Å) et 0 la position du pic de
diffraction considéré.
ENIT 2009 48
ENIT 2009 49
Chapitre 3 : Elaboration et caractérisation des
couches de TiO2
3.3.3 Couches élaborées sur des substrats de
verre
Cette partie sera consacrée à l'étude de
la caractérisation structurale des couches minces de TiO2
déposées sur des substrats de verre à différentes
températures (TAmb, 100, 200 et 300 °C). La figure 3.6
montre les spectres de diffraction des rayons X des couches
déposées sur des substrats de verre chauffés.
100
TAmb
Rutile R(110)
Rutile R(210)
300°C
200°C
100°C
0
7 14 21 28 35 42 49 56
1200
1100
1000
900
800
700
600
500
400
300
200
Angle de Bragg 2?
(°)
Fig. 3. 6 Spectres de DRX des couches de
TiO2/Verre
D'après la figure 3.6, on constate en premier lieu que
le dépôt sur des substrats chauffés favorise la
cristallisation de ces couches par rapport au dépôt sur des
substrats non chauffés. En effet, à la température
ambiante (Ts = 20 °C), l'analyse des spectres révèle
l'absence des pics, les couches élaborées sur des substrats de
verre non chauffés sont donc amorphes tout comme la structure
cristalline du verre.
Lorsque la température augmente, on remarque
l'apparition d'un pic au voisinage de l'angle de diffraction 2? = 27 indiquant
une cristallisation des couches.
Par comparaison avec les fichiers de références
du PDF et de l'ICSD (Inorganic Crystal Structures Database), on a
identifié les phases correspondantes aux raies obtenues sur les
spectres. Le tableau 3.1 résume les
intensités et les angles de Bragg correspondants aux spectres de
diffraction des rayons X expérimentaux des couches de TiO2/Verre pour
différentes températures de substrat synthétisées
au laboratoire.
ENIT 2009 50
Chapitre 3 : Elaboration et caractérisation des couches de
TiO2
Tab. 3. 1 Identification des raies des spectres RX des
couches de TiO2/Verre

20 (°)
théorique
20 (°)
N° pic expérimental
I/Imax(%) Matériau Phase Forme cristalline
hkl
théorique
1
2
Tétragonal
110
210
27.29
27.492
100
TiO2
Rutile
43.61 44.136 6 TiO2 Rutile Tétragonal
L'élévation de la température (100, 200
et 300°C) pendant les 4h de dépôt favorise l'apparition d'un
pic principal R(110) de la phase rutile de TiO2 pour toutes les couches dont
l'intensité présente un maximum pour la température de
croissance de 200°C.
Pour une température de substrat supérieure
où égale à 200 °C, on remarque l'apparition d'un
deuxième pic R(210) moins intense que celui du pic R(110) correspondant
à la phase la plus stable [47] et la plus dense (cf. Fig. 3.7).
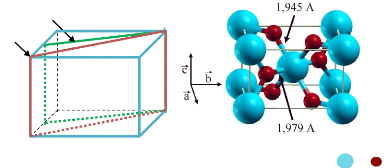
Fig. 3. 7 Plan réticulaire (110) et (210) et
maille de TiO2 rutile
(Ti , O )
(210) (110) 1/2
En effet, les plans qui diffractent sont aussi bien des plans
normaux (hk0) que des plans inclinés ou parallèles ((h0l), (0kl)
et (hkl)) par rapport à la base (a,b) (cf. Fig. 3.7). En second
lieu, on remarque l'absence totale de la phase anatase du TiO2 contrairement
aux couches de TiO2 déposées sur des substrats de silicium (voir
3.4.4). C'est la phase rutile qui est prédominante. Donc la nature du
substrat peut favoriser une phase plutôt qu'une autre.
Pour le calcul de la taille de grains, on utilise la formule
(4) de la loi de Debye-Scherrer applicable pour les couches
cristallisées. Le tableau suivant regroupe les valeurs calculées
des tailles des grains des couches en question.
Tab. 3. 2 Taille des grains des couches de
TiO2/Verre
|
Température du substrat (Ts en
°C)
|
100
|
200
|
300
|
|
Taille des grains (nm)
|
12.8
|
17.5
|
10.1
|
ENIT 2009 51
Chapitre 3 : Elaboration et caractérisation des
couches de TiO2
D'après le spectre de diffraction (Fig 3.6), on
remarque que le pic principal qui représente la phase rutile R (110) de
TiO2 est plus intense et plus fin pour les couches déposées
à 200 °C que celui des couches déposées sur des
substrats chauffées à 100 ainsi qu'à 300 °C.
Effectivement, les grains de la phase rutile d'orientation
cristalline (110) ont la plus grande taille à 200°C d'après
le tableau 3.2. En effet, d'après le diagramme de Movchan et Demchishin
(figure 2.14) nous savons que lors de la réalisation de couches, plus la
température est importante, plus les grains sont gros.
Par contre, pour les couches déposées à
300 °C, on remarque que la taille des grains diminue. Ceci est dû
à l'apparition d'une deuxième orientation cristalline suivant le
plan (210) favorisant une couche polycristalline.
3.3.4 Couches élaborées sur des substrats de
silicium
La figure 3.8 représente les spectres de diffraction
des rayons X des différentes couches minces de TiO2
déposées sur des substrats de silicium type P et d'orientation
(100) à température ambiante, 100, 200 et 300 °C.
21 28 35 42 49 56
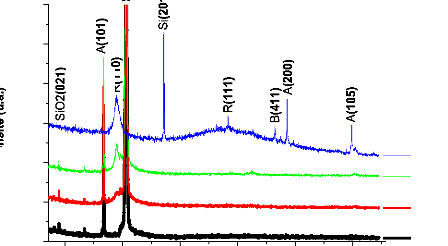
021)
3000
2500
2000
1500
1000
500
0
(
201)
200°C
TAmb
300°C
100°C
Angle de Bragg 2?
(°)
Fig. 3. 8 Spectres de DRX des couches de
TiO2/Si
Chapitre 3 : Elaboration et caractérisation des
couches de TiO2
Par comparaison avec les fichiers de références
du PDF de l'ICSD, on a identifié les phases correspondantes aux raies
obtenues sur les spectres. Les intensités et
les angles de Bragg correspondants aux spectres de diffraction des rayons X
expérimentaux des couches de TiO2/Si, pour différentes
températures de substrat, synthétisées au laboratoire sont
regroupés dans le tableau 3.3.
Tab. 3. 3 Identification des raies des spectres RX des
couches de TiO2/Si
|
20 (°) 20 (°) I/Imax(%) Forme
N° pic théorique Matériau Phase
cristalline Hkl
expérimental théorique
|

20.26 20.526 1.3 SiO2 Coesite Monoclinique
Anatase
100
25.686
25.69
Tétragonal
TiO2
27.29 27.492 100 TiO2 Rutile Tétragonal
-
Si
100
28.443
28.42
Cubique
33.01 33.178 100 Si
40.82
Rutile
17.1
41.322
TiO2
- Tétragonal
Tétragonal
46.539 46.303 1.4 TiO2 Brookite Tétragonal
48.01
Anatase
21.4
48.791
TiO2
Tétragonal
55.87 55.944 13.2 TiO2 Anatase Tétragonal
1
3
4
5
6
7
8
9
10
100
101
110
111
201
111
411
200
105
Lorsque la température de substrat augmente (<300
°C), on retrouve le même pic dominant de silicium Si (111) de
structure cubique qui diminue progressivement avec la température
jusqu'à se transformer en Si (201) de structure tétragonale (pour
Ts=300°C) identique à celle du TiO2 avec toujours la dominance de
la phase de Silicium.
L'analyse des spectres des différentes couches montre
que la phase anatase de TiO2 est dominante pour les faibles températures
de substrat (<300°C) et que l'orientation est
préférentielle suivant le plan A(101) le plus stable [47].
De plus, on constate que l'intensité du pic principal
A(101) diminue légèrement en fonction de la température du
substrat (pour T = 200°C) puis s'annule brusquement pour les couches
déposées à 300°C.
ENIT 2009 52
ENIT 2009 53
Chapitre 3 : Elaboration et caractérisation des
couches de TiO2
On remarque aussi la présence d'une phase secondaire
rutile R(110), plus stable que l'anatase, qui apparait dès la
température 100°C. L'intensité de ce pic secondaire augmente
avec la température de croissance indiquant une amélioration de
la cristallinité des couches.
A 300°C, on remarque l'apparition de phase secondaire de
rutile associée au plan réticulaire (111), de brookite B(411) et
d'anatase associées aux plans réticulaires (105) et (200). A
cette température, les couches sont cristallisées, mais ne
possèdent pas d'orientation préférentielle. Nous
remarquons ici que le fait de chauffer les substrats à
température supérieure à 200 °C entraîne une
désorientation des couches qui ne présentent plus l'orientation
préférentielle A(101). Cela est en accord avec la
littérature [110].
Notons aussi que la phase secondaire du SiO2 associée
au plan réticulaire (021) n'existe qu'à basse
température.
La taille des grains a été calculée
à partir de la loi de Debye et Scherrer (4) applicable seulement dans le
cas de phase unique ou dominante. La phase anatase A(101) dans notre cas est la
phase dominante pour les températures : ambiante, 100 et 200 °C.
Les valeurs sont regroupées dans le tableau suivant.
Tab. 3. 4 Taille des grains des couches de
TiO2/Si
|
Température du substrat (Ts en
°C)
|
TAmb
|
100
|
200
|
|
Taille des grains (nm)
|
16
|
15.5
|
14.9
|
La taille des grains d'anatase A(101) est de l'ordre de 15 nm.
Ces valeurs sont légèrement plus grandes que celles obtenues pour
les couches élaborées sur des substrats de verre vu que la maille
élémentaire de la phase anatase (a = b = 3,782
Å, c = 9,502 Å [22]) est plus grande que celle de la phase
rutile (a = b = 4,587 Å, c = 2,954 Å
[22]).
De plus, le rutile est la forme la plus dense du TiO2 (de
densité 4,20 à 5,60 gcm-3 par rapport à
l'anatase de 3,82 à 3,97) ce qui donne des grains plus denses, et par
suite plus petits et compacte, de rutile que ceux de l'anatase.
Chapitre 3 : Elaboration et caractérisation des
couches de TiO2
3.4 Caractérisation morphologique par Microscopie
à Force Atomique
Le principe des microscopies à champ proche est, dans
son concept général, très simple. Il consiste à
balayer la surface de l'échantillon avec une pointe dont
l'extrémité est de dimension atomique tout en mesurant les forces
d'interaction entre cette pointe et la surface. A force d'interaction maintenue
constante par exemple (hauteur variable), il est possible de retrouver la
topographie de l'échantillon. La figure 3.9 (a) et (b) montre le
schéma de principe de l'AFM.
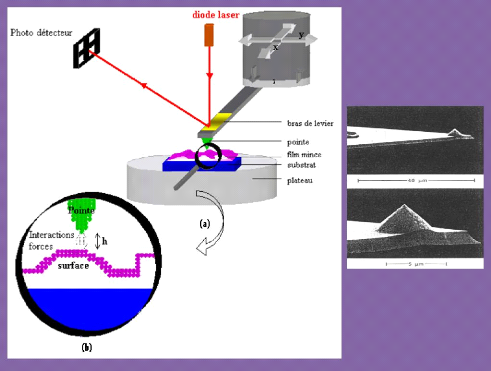
(c)
Fig. 3. 9 AFM : (a) principe, (b) zone d'interaction
pointe-échantillon, (c) Image d'une pointe en Si3N4
L'échantillon est fixé sur un dispositif
composé de céramiques piézoélectriques permettant
des déplacements dans les trois directions de l'espace XYZ avec une
précision de l'ordre du dixième d'angström. La sonde de
l'AFM est une pointe ultra-fine (Fig 3.9 (c)), idéalement de dimension
atomique, intégrée à l'extrémité d'un
micro-levier flexible (cantilever) et sensible à des forces plus faibles
que les forces interatomiques. Ces interactions peuvent être des forces
de Van der Waals, des forces électrostatiques, des forces
magnétiques ou encore des forces de répulsion ionique. Les
déflections du micro-levier, résultant des variations de force
entre la pointe et
ENIT 2009 54
|
Chapitre 3 : Elaboration et caractérisation des couches
de TiO2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
l'échantillon lors du balayage, sont mesurées le
plus souvent par une détection optique. Un faisceau laser est
focalisé sur le micro-levier puis réfléchi sur une
photodiode coupée en deux ou quatre quadrants. Le signal
différentiel donne la déformation du levier et donc la force
d'interaction, connaissant la constante de raideur du micro-levier.
Dans le mode de fonctionnement standard (en mode contact), la
force est maintenue constante durant le balayage (XY) à l'aide d'une
boucle de régulation qui ajuste la position Z de l'échantillon.
La force mesurée Fm est comparée à une force de
référence Fc. Un correcteur électronique permet
d'annuler l'erreur ÄF=Fm-Fc, en modifiant la position Z de
l'échantillon pour maintenir la force d'interaction
désirée. La mesure de la position de l'échantillon selon
l'altitude Z en fonction des coordonnés XY permet de reconstituer la
topographie de la surface étudiée.
3.4.1 Les modes de fonctionnement les plus courants
Il existe en fait trois modes d'utilisation de l'AFM : le mode
contact, le mode non-contact, et enfin le mode contact intermittent.
? Le mode contact consiste à utiliser les forces
répulsives : la pointe appuie sur la surface, elle est donc
repoussée du fait du principe de Pauli, et le levier est
dévié. La rétroaction s'effectue sur la mesure de la
direction de la déviation.
? Le mode contact intermittent dit "tapping", est, de loin, le
plus utilisé, consiste à faire vibrer le levier à sa
fréquence propre de résonance (typiquement de l'ordre de la
centaine de kHz), avec une certaine amplitude. Quand la pointe interagit avec
la surface (essentiellement de façon répulsive), l'amplitude
décroît (parce que la fréquence de résonance
change). La rétroaction se fait alors sur l'amplitude d'oscillation du
levier.
? Le mode non-contact utilise, lui, les forces attractives.
Difficile à gérer, il est très peu utilisé en
pratique, parce que ces forces sont faibles, et nécessitent un
environnement à faible bruit. Par ailleurs, la couche d'adsorbats (toute
surface à l'air ambiant est recouverte d'une couche de l'ordre du nm
d'épaisseur d'eau et de divers polluants) vient largement affecter les
mesures - le vide est plus que conseillé pour obtenir une
résolution suffisante en pratique. La rétroaction s'effectue soit
sur la déviation, mais bien évidemment il s'agit d'une
déviation du levier qui va dans l'autre sens que dans le cas du mode
contact, soit sur l'amplitude des oscillations.
ENIT 2009 55
ENIT 2009 56
Chapitre 3 : Elaboration et caractérisation des
couches de TiO2
3.4.2 Dispositif utilisé
L'AFM utilisé est le microscope "Dimension 3100
Scanning Probe Microscope (SPM)" conçu par la société
"Veeco Metrology Group". Une photo de cet AFM est montrée en figure
3.10. Nous avons utilisé principalement ce microscope en mode contact
pour obtenir des images topographiques de la surface de nos couches minces
nanostructurées ainsi que pour déterminer les
caractéristiques de surface de chaque couche.

Fig. 3. 10 Le microscope « Dimension 3100 Scanning
Probe Microscope (SPM) »
Le « Dimension 3100 » est un microscope à
balayage de sonde qui utilise des normes et des modes d'imageries de SPM
(Scanning Probe Microscopy ou encore microscope à balayage de sonde)
avancés pour mesurer les caractéristiques de surface pour des
plaquettes semi-conductrices, les masques lithographiques, des supports
magnétiques, CD / DVD, des biomatériaux, de l'optique, et
d'autres échantillons jusqu'à 200 mm de diamètre [j]. Le
suivi précis du laser et la capacité de modifier les techniques
de balayage sans outils garantissent la flexibilité et la
facilité d'emploi.
Le système est piloté par le contrôleur
`'NanoScope 3D» qui peut balayer de la taille maximale de balayage
jusqu'à quelques nanomètres avec une résolution de 16 bits
sur toutes les formes d'onde de balayage et sur chacun des axes [j].
Le « Dimension 3100 » est offert avec le «
Dimension DAFMLN low noise head » qui représente un système
d'isolation de la chambre afin de minimiser le bruit. Le scanner est construit
de matériaux rigides et de basse-vibrations qui garantissent un faible
bruit tout en offrant une fiabilité supérieure.
Chapitre 3 : Elaboration et caractérisation des
couches de TiO2
3.4.3 Couches de TiO2 élaborées sur des
substrats de verre
La figure 3.11 montre les images AFM réelles et leurs
négatifs bidimensionnels (1um x 1um) donnés par l'analyse AFM des
couches de TiO2 déposées sur des substrats de verre
chauffés à température ambiante, 100, 200 et 300 °C
d'épaisseurs variant de 114 à 183 nm. Elle rend compte de la
croissance des cristallites lors de l'échauffement des substrats. Bien
que la croissance granulaire ait lieu, elle reste modeste du fait de la
température de substrat relativement faible.

Négatif Image réelle Négatif Image
réelle

(a) (b)
Négatif Image réelle Négatif Image
réelle
(c) (d)
Fig. 3. 11 Images AFM 2D des couches de TiO2/Verre
à TS : (a) ambiante, (b) 100, (c) 200 et (d)
300°C
En effet, la figure 3.11 (a) montre une
surface lisse qui présente une grande porosité des couches
à substrats non chauffés et absence presque totale des grains, ce
qui confirme le caractère amorphe de ces couches montré par
diffraction des rayons X. Ceci est dû au fait qu'à basse
température, la mobilité des atomes déposés est
réduite et la structure se forme à partir de la
géométrie de surface du substrat et par suite la couche est
fortement influencée par la structure cristalline du substrat
amorphe.
La couche est donc assez poreuse, ce qui explique une grande
rugosité mesurée par AFM de la couche déposée
à température ambiante (voir tab 3.5). Le signe (-) devant la
valeur de la rugosité des couches à substrats non chauffés
indique que cette valeur est la différence entre la surface moyenne et
la profondeur d'un pore de la couche ce qui donne une différence
négative.
ENIT 2009 57
ENIT 2009 58
Chapitre 3 : Elaboration et caractérisation des
couches de TiO2
En effet, une structure colonnaire composée de
nanocristallites se forme à partir des nucléis
créés sur des défauts. Les colonnes coniques n'ont que peu
de liaisons entre elles. C'est une croissance nodulaire (structure poreuse)
conformément au modèle M-D et Thornton décrit dans la
partie bibliographique (voir paragr. 2.6.6).
Tandis que, la figure 3.11 (b) montre une structure de
transition correspondante à un début de cristallisation à
100 °C qui représente la température de transition au rutile
pour ces couches.
Par contre, la figure 3.11 (c) montre que les couches sont
cristallisées d'une manière quasi-isotropique. C'est plutôt
une tendance à avoir une couche monocristalline.
L'image AFM montrée en figure 3.11 (d) dévoile
de larges cristallites plates et d'autres plus petites, ce qui n'était
pas aussi visibles pour des températures de substrats inférieures
à 200 °C. C'est une phase de recristallisation des couches de TiO2
pour avoir des couches polycristallines.
Ces observations sont en bon accord avec les résultats
de l'analyse quantitative menée par diffraction des rayons X.
D'autre part, la rugosité augmente progressivement
à partir de la température de transition (100 °C). Les
rugosités moyennes (rms pour root mean square roughness) des
différents échantillons sont regroupées dans le tableau
3.5.
Tab. 3. 5 Rugosité moyenne obtenue par AFM des
couches minces de TiO2 élaborées sur substrats de
verre
|
Température de substrat
|
Ambiante (20°C)
|
100°C
|
200°C
|
300 °C
|
|
Rrms (nm)
|
(-)22.3
|
5.8
|
7.6
|
19.8
|
La rugosité rms des couches augmente avec la
température de dépôt, passant de 5.8 nm à 100°C
à environ 19.8 nm à 300°C. Cette augmentation de la
rugosité est liée à la structure colonnaire qui est plus
prononcée à haute température qu'à basse
température.
Une image tridimensionnelle (1um x 1um) de l'état de
surface des couches donne une idée plus claire sur la rugosité
des surfaces ainsi que la dispersion des cristallites (voir figure 3.12).
Pour les couches déposées à des
températures supérieures à 100 °C, des grains
pratiquement de même taille (de l'ordre de 43 nm) apparaissent. Ces
grains correspondent à l'agglomération de plusieurs petits grains
(de taille de l'ordre de 15 nm) constituant des cristallites.
Chapitre 3 : Elaboration et caractérisation des couches de
TiO2
(c) (d)

(a)
(b)
Fig. 3. 12 Images AFM 3D des couches de TiO2/Verre
à TS (a) ambiante, (b) 100, (c) 200 et (d) 300°C
En effet, la mobilité des particules adsorbées
augmente avec la température et la morphologie structurale se transforme
de telle sorte que les cristallites grossissent et les grains sont de plus en
plus serrés pour former des colonnes de grains ou cristallites.
3.4.4 Couches de TiO2 élaborées sur des
substrats de silicium
La figure 3.13 montre les images réelles et leurs
négatifs donnés par l'analyse AFM des couches de TiO2
déposées sur des substrats de silicium chauffés à
température ambiante, 100, 200 et 300 °C.
ENIT 2009 59
ENIT 2009 60
Chapitre 3 : Elaboration et caractérisation des
couches de TiO2

Négatif Image réelle Négatif Image
réelle
(a) (b)
Négatif Image réelle Négatif Image
réelle
(c) (d)
Fig. 3. 13 Images AFM 2D des couches de TiO2/Si
à TS : (a) ambiante, (b) 100, (c) 200 et (d)
300°C
Ces images AFM montrent que les couches se cristallisent mieux
lorsqu'on augmente la température de croissance. Cette cristallisation
est accompagnée par une diminution de la rugosité de surface
(voir Tab. 3.6). Ceci peut être expliqué par le fait que la maille
élémentaire de la phase anatase est plus grande que celle de la
phase rutile (la taille de la maille élémentaire du rutile est
pratiquement la moitié par rapport à celle de l'anatase) et que
le rutile est plus dense que l'anatase (paragr. 1.2) ce qui implique que les
grains de la phase rutile devraient être plus petits et plus denses.
Tab. 3. 6 Rugosité moyenne obtenue par AFM des
couches de TiO2/Si
|
Echantillon : TiO2/Si
|
Ts =19°C
|
Ts =100°C
|
Ts =200°C
|
Ts =300 °C
|
|
Rrms (nm)
|
(-)15.4
|
11.7
|
10.3
|
5.2
|
Or à partir de 100 °C, il y a apparition de la
phase rutile, qui devient plus intense à 300 °C d'après les
analyses DRXs. Le réseau cristallin devrait avoir un état
cristallin de plus en plus dense et une surface de moins en moins rugueuse.
Chapitre 3 : Elaboration et caractérisation des
couches de TiO2
Une image tridimensionnelle de l'état de surface des
couches donne une idée plus claire sur la rugosité des surfaces
ainsi que la dispersion des cristallites (voir Fig. 3.14).
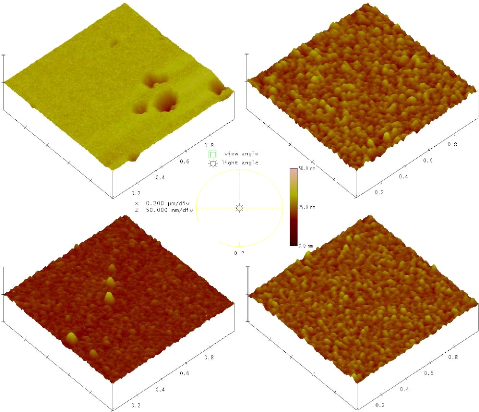
(a)
(b)
(c) (d)
Fig. 3. 14 Images AFM 3D des couches de TiO2/Si
à TS : (a) ambiante, (b) 100, (c) 200 et (d) 300°C
On remarque que les cristallites se transforment
légèrement en colonnes de grains en augmentant la
température de substrat du fait que la mobilité des particules
adsorbées augmente aussi avec la température.
Pour les couches déposées sur des substrats de
verre, on remarque que la rugosité est une fonction décroissante
de la température, tandis que, pour les couches déposées
sur des substrats de silicium, plus la température est
élevée, plus la couche est rugueuse.
ENIT 2009 61
ENIT 2009 62
Chapitre 3 : Elaboration et caractérisation des
couches de TiO2
3.5 Caractérisation optique des couches minces de
TiO2
Les propriétés optiques des couches
réalisées par pulvérisation cathodique dépendent en
particulier de la composition chimique et de la cristallinité. Les
constantes optiques sont déterminées à l'aide des spectres
de transmission et de réflexion de la lumière par la couche.
Les mesures de transmission et de réflexion ont
été faites au moyen d'un spectrophotomètre Shimadzu UV
3100S équipé d'une sphère intégrante LISR 3200
(Fig.3.15).
Le spectrophotomètre dispose d'un monochromateur à
double faisceau et a une énergie suffisante pour faire plusieurs types
de mesures dans un large domaine de longueur d'onde 220 nm (UV) à 3200
nm (PIR).

Fig. 3. 15 Spectrophotomètre Shimadzu UV
3100S.
3.5.1 Méthode de calcul des constantes
optiques
Les constantes optiques sont déterminées en
fonction de la nature des couches étudiées, absorbantes ou
transparentes et de son comportement dans la gamme de longueur d'onde
étudiée. Les interférences sont souvent utilisées
pour déterminer les constantes optiques telles que l'indice de
réfraction nc, l'épaisseur de la couche d, ainsi que
le coefficient d'absorption á des matériaux en couches minces.
La couche doit avoir une grande
homogénéité et des faces planes et parallèles.
Heavens [98] a proposé un modèle de calcul des
paramètres optiques à partir des franges d'interférences
obtenues sur les spectres expérimentaux de transmission T(?) et de
réflexion R(?).
|
Chapitre 3 : Elaboration et caractérisation des couches
de TiO2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.5.1.1 Détermination de l'indice de
réfraction nc
Pour la détermination de l'indice de réfraction
nc et de l'épaisseur d, on va travailler dans la
région de faible absorption.
Dans la gamme spectrale dite de faible absorption, le spectre
de transmission optique T(?) d'une couche mince est marqué par des
oscillations interférentielles, la réflexion à l'interface
couche substrat n'est pas négligeable, l'expression de R dépendra
de l'indice de réfraction du substrat [99].
Dans le cas d'une incidence normale et à condition que
l'indice de la couche nc soit supérieur à celui du
substrat ns, l'expression de l'indice de réfraction
nc d'une couche mince faiblement absorbante sur un substrat
transparent est donnée par [100] :
(6)
Où Rmax est le taux de réflexion correspondant
à un maximum dans une région de faible dispersion
c'est-à-dire dn/dë 0 et ns
étant l'indice de réfraction des substrats de verre
(ns= 1.52)
4nc d?p?1
?(p?1)?2
3.5.1.2 Détermination de l'épaisseur de la
couche d
En restant toujours dans les mêmes conditions que
précédemment et après avoir déterminé
l'indice de réfraction, l'épaisseur de la couche d est
déterminée par la position des extremums d'interférences
par la relation
(7)
p étant l'ordre d'interférence associé
à la longueur d'onde X qui correspond à un extremum pour les
spectres de transmission ou de réflexion. En effet, pour la
réflexion, les maxima correspondent à des valeurs impaires de p
alors que les minima correspondent à des valeurs pairs, inversement pour
la transmission.
A faible dispersion (dn/dë 0) et pour
deux extremums d'interférences successifs et d'après (7), on a
:
(8)
Avec etles longueurs d'ondes correspondantes à deux
extremums successifs. D'où, on peut déduire de (8) que :
ENIT 2009 63
Chapitre 3 : Elaboration et caractérisation des
couches de TiO2
(10)
(9) et
3.5.1.3 Détermination du gap optique de la
couche
1 (1 ? R )
? ? Ln [ ]
d T
Pour une couche fortement absorbante, les oscillations
interférentielles dues aux réflexions multiples dans la couche
disparaissent, la réflexion à la surface couche substrat est
négligeable.
Les expressions de la réflexion , de la transmission , et
de l'indice de réfraction
sont données par [101]
:
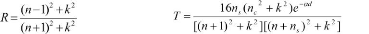
(11) (12)
(13)
ou encore
d étant l'épaisseur de la couche, l'indice des
substrats de verre et k le
( h E q v _ gopt
)
coefficient d'extinction
Dans la zone de forte absorption dite aussi d'absorption
fondamentale (c'est-à-dire que ad
> 0.1 ou bien a > 104 cm-'), le
coefficient d'absorption et le coefficient d'extinction k en
absence
d'oscillation sont donnés par [102] :
ENIT 2009 64
Dans la région de forte absorption (a > 104
cm-'), impliquant les transitions optiques entre la bande de
valence et celle de conduction, a est régi par la relation de Tauc
[102] :
a(co)=fl hv
(16)
- J3 est une constante qui dépend de la probabilité
de transition.
- y est la fréquence de l'onde (Hz). Pour toute onde, on
peut écrire y = c/X où X est la
longueur d'onde (en mètre m) et c est la vitesse
de la lumière.
- h est la constante de Planck.
- w=2ity est la fréquence angulaire du photon incident.
- Egopt est le gap optique.
- q un nombre qui caractérise le processus de
transition.
q vaut : 1/2 pour les transitions directes permises.
ENIT 2009 65
Chapitre 3 : Elaboration et caractérisation des
couches de TiO2
3/2 pour les transitions directes interdites. 2 pour les
transitions indirectes permises.
pour les transitions indirectes interdites.
En général pour le dioxyde de titane q est
égal à 1/2, ce qui correspond à des transitions directes
permises. D'où, nous allons considérer que les transitions
directes permises.
3.5.2 Couches élaborées sur des substrats
de verre 3.5.2.1 Spectres de transmission, d'absorption et de réflexion
? Spectres de transmission
La Figure 3.16 montre le spectre de transmission des couches
minces de dioxyde de titane déposées sur des substrats de verre
à température ambiante, 100, 200 et 300 °C pour le domaine
spectral variant de 300 nm (UVB) jusqu'à 1800 nm (PIR).
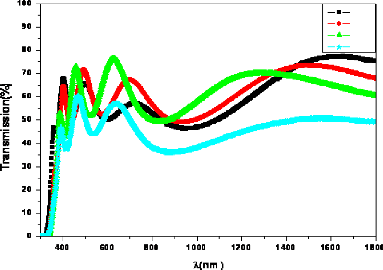
Amb 100°C 200°C 300°C
Fig. 3. 16 Spectres de transmission en fonction de A
des couches de TiO2/Verre
Sur ce spectre, on observe deux régions bien distinctes
:
- Une région où l'absorption devient de plus en
plus grande (cf. Fig 3.16), ce qui se traduit par un amortissement progressif
des franges d'interférences et une forte décroissance de la
transmission.
ENIT 2009 66
Chapitre 3 : Elaboration et caractérisation des
couches de TiO2
- Une région présentant des franges
d'interférences où les extrema gardent des valeurs sensiblement
constantes (région de transparence) dont l'exploitation nous permet de
déterminer à la fois l'indice de réfraction de la couche
et son épaisseur.
La présence des oscillations d'interférences
indiquent une bonne homogénéité des couches
élaborées.
En augmentant la température jusqu'à 200
°C, la transmission des couches augmente ensuite elle diminue pour une
température de 300 °C.
A 200 °C, les couches présentent la meilleure
homogénéité ce qui est en accord avec les résultats
données par les analyses de diffraction des rayons X. En effet, la
couche la plus cristallisée a été observé à
cette température comme indiqué par les analyses structurales. Le
maximum de transmission (77%) est obtenu aussi à température de
substrat de 200 °C. Ces couches sont transparentes dans tout le domaine
visible et infrarouge et on peut les classer comme couches non absorbantes. Ces
couches sont intéressantes comme étant couches antireflet.
? Spectres d'absorption
La figure 3.17 montre l'effet de l'échauffement des
substrats sur l'absorption des couches.
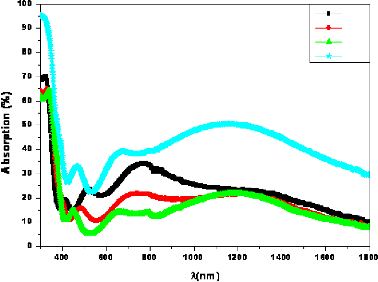
Amb
100°C
200°C
300°C
Fig. 3. 17 Spectres d'absorption en fonction de A des
couches de TiO2/Verre
ENIT 2009 67
Chapitre 3 : Elaboration et caractérisation des
couches de TiO2
On note dans la zone de forte absorption une
amélioration du front d'absorption accompagnée d'un petit
décalage vers le visible en particulier pour les hautes
températures de substrat (200 et 300°C). Mais la zone de
photoactivité des couches de TiO2 reste toujours l'ultra-violet proche
visible (UVB et UVC et une partie du bleu de visible) conformément
à la bibliographie (pragr. 1.4).
? Spectres de réflexion
Les spectres de réflexion schématisés
à la figure 3.18 présentent des oscillations
caractéristiques du phénomène d'interférence
indiquant une homogénéité des couches.
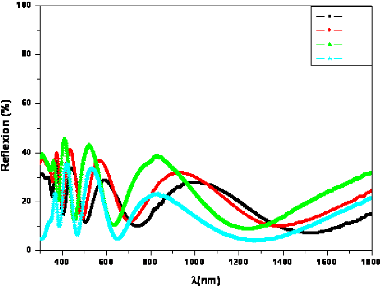
Amb 100°C 200°C 300°C
Fig. 3. 18 Spectre de réflexion en fonction de A
des couches de TiO2/Verre
Ces spectres montrent également une augmentation des
taux de réflexion sauf pour la température de substrat de
300°C. On remarque que les couches deviennent très absorbantes et
moins réfléchissantes.
Ces dernières couches combinent deux
propriétés importantes pour la fabrication des couches doubles
fonctions dans le domaine photovoltaïque : d'une part, elles
représentent un revêtement antireflet qui résiste à
la corrosion et joue au même temps le rôle d'une couche protectrice
pour les cellules solaires et d'autre part elles représentent le
semi-conducteur type N côté soleil de la jonction P-N des cellules
solaires.
ENIT 2009 68
Chapitre 3 : Elaboration et caractérisation des
couches de TiO2
Cette jonction peut être améliorée par un
dopage adéquat afin d'avoir un semi-conducteur fortement dopé
N+. On propose comme dopant le niobium ou le vanadium. Nous avons
montré dans le premier chapitre que par analogie avec les
activités photocathalytiques, le dopage par ces matériaux
translate la zone de photoactivité du TiO2 vers le domaine visible et a
un effet plus important que celui de la température du substrat.
3.5.2.2 Épaisseurs et indices de
réfraction
A partir des spectres de réflexion et dans la zone de
faible absorption de 400 à 1800 nm, nous avons déterminé
les épaisseurs et les indices de réfraction moyens des
différentes couches élaborées sur des substrats de verre
en utilisant les équations (6), (9) et (10) (cf. Tab. 3.7).
Tab. 3. 7 Epaisseurs et indice de réfraction des
couches de TiO2/Verre
|
Température du substrat Ta
|
100
|
200
|
300
|
|
nc
|
2.3
|
2.5
|
2.7
|
2.3
|
|
d (nm)
|
183
|
151
|
114
|
152
|
Notons que le minimum d'épaisseur a été
obtenu pour la couche déposée à substrat chauffé
à 200°C et qu'à cette température on note un maximum
d'indice de réfraction. Plus la couche est cristallisée et dense,
plus elle est réfractaire et par suite d'indice de réfraction est
plus élevé [j] (par exemple le verre (amorphe de n = 1.5), vide
(de densité nulle et n = 1), air (de faible densité), le diamant
(cristallisé et dense (3.52 gcm-3) de n=2.45).
Or, d'après les analyses de DRX, lorsque la
température augmente, les couches deviennent de plus en plus
cristallisées suivant une orientation préférentielle
jusqu'à 200 °C.
Au-delà de cette température, l'apparition d'une
autre orientation cristalline augmente les défauts cristallins et le
désordre dans la structure de la couche pour tendre vers une structure
polycristalline. De ce fait, l'indice de réfraction va évidemment
décroit. L'épaisseur de la couche varie en sens opposé par
rapport à l'indice de réfraction selon l'équation (10).
3.5.2.3 Coefficients d'absorption
Les coefficients d'absorption sont évalués
à partir des mesures de la transmission et de la réflexion
optiques des couches minces dans le domaine spectral 300-400 nm, en appliquant
la relation (14) (voir Fig.3.19).
ENIT 2009 69
Chapitre 3 : Elaboration et caractérisation des couches de
TiO2
h? (eV)
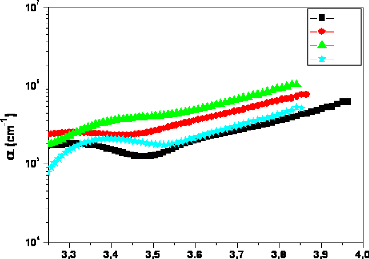
Amb 100°C 200°C 300°C
Fig. 3. 19 Coefficient d'absorption en fonction de
l'énergie des couches deTiO2/verre
On remarque que les valeurs des coefficients d'absorption des
couches sont assez élevées et avoisinent la valeur de
105 cm-1 dans le domaine du proche-visible (3.2 eV). On
constate aussi que le coefficient d'absorption est maximal pour la couche
déposée à 200 °C.
3.5.2.4 Transitions optiques
Dans la région de forte absorption (a ? 104
cm-1), impliquant les transitions optiques entre la bande de valence
et celle de conduction, a est régi par la relation de Tauc (16). En
général pour le dioxyde de titane q est égal à 1/2,
ce qui correspond à des transitions directes permises.
Le gap optique pour les différentes couches peut
être obtenu en traçant
(hõá)2=f(hõ) au voisinage du seuil d'absorption
pour les différentes couches élaborées, comme
montré sur la figure 3.20, où hõ est l'énergie de
photon.
La linéarité obtenue pour q=1/2 confirme que les
transitions sont de nature directes permises.
ENIT 2009 70
Chapitre 3 : Elaboration et caractérisation des
couches de TiO2
(a) (b)
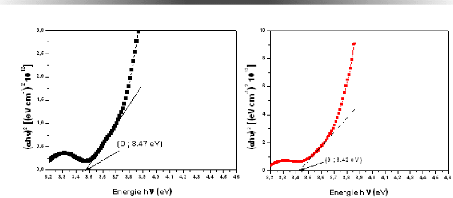
Ts=Amb
Ts=100°C
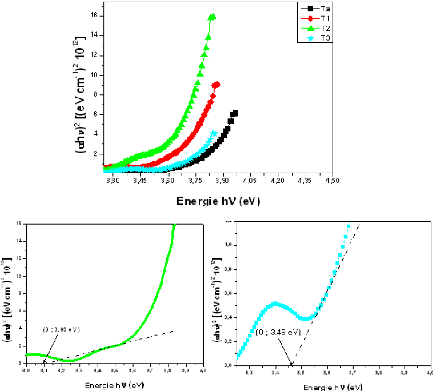
Ts=200°C
(I)
Ts=300°C
(c) (d)
Fig. 3. 20 Gap optique des CMs de TiO2 à : (I)
différentes température, (a) TAmb, (b) 100, (c) 200 et (d)
300°C
Par extrapolation de la partie linéaire des courbes on
obtient la valeur du gap optique. Les valeurs obtenues sont données dans
le tableau 3.8.
Tab. 3. 8 Valeurs des transitions directes permises des
couches de TiO2/Verre
|
Température du substrat
|
Ta
|
100
|
200
|
300
|
|
Eg
|
3.47
|
3.42
|
3.09
|
3.46
|
ENIT 2009 71
Chapitre 3 : Elaboration et caractérisation des
couches de TiO2
A température de croissance inférieure ou
égale à 200 °C, on remarque que le gap optique
décroit en fonction de l'augmentation de température.
En effet, le gap optique correspondant à la
température de croissance ambiante est l'énergie de transition
optique directe et permise d'une couche amorphe qui doit être importante.
Tandis que, à 100 et 200 °C, c'est-à-dire à la
température de transition et de cristallisation, le gap diminue.
A 300 °C, l'apparition d'une deuxième orientation
cristallographique dans la couche suivant un plan moins dense, selon les
résultats de DRX, perturbe le réseau cristallin. Les
différences entre ces plans cristallographiques induisent cette
augmentation sur la valeur de la bande interdite (voir paragr. 1.2.2).
3.5.3 Couches élaborées sur des
substrats de silicium
Le silicium est un matériau opaque, d'indice de
réfraction de l'ordre de 3.5 (ns > nc) et absorbant, par suite on ne
peut pas utiliser le modèle de Heavens [98] pour le calcul des
paramètres optiques. D'où, on ne peut exploiter que la courbe de
réflexion. La figure 3.21 présente le spectre de
réflexion des couches de TiO2 élaborées sur des substrats
de silicium à température ambiante, 100, 200 et 300°C et
d'un échantillon de substrat de silicium.
100
40
20
80
60
0
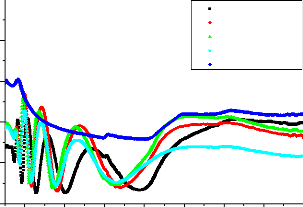
TiO2/Si à Tamb TiO2/Si à
100°C TiO2/Si à 200°C TiO2/Si à
300°C Substrat Si
400 600 800 1000 1200 1400 1600
1800
? (nm)
Fig. 3. 21 Spectre de réflexion en fonction de A
des couches de TiO2/Si
D'une part, on remarque que le spectre de réflexion du
substrat de silicium montre l'absence quasi-totale
d'homogénéité. D'autre part, on remarque que le silicium
présente un taux de réflexion important dans tout le domaine
spectral et surtout dans le domaine visible et UV
|
Chapitre 3 : Elaboration et caractérisation des couches
de TiO2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
proche-visible. Par contre, la présence d'une couche de
TiO2 sur un substrat de silicium montre une bonne
homogénéité de ces couches et diminue le taux de
réflexion.
La diminution du taux de réflexion augmente
l'absorption du silicium ce qui permet d'utiliser le dioxyde de titane comme
couche antireflet pour les panneaux photovoltaïque en silicium. On
remarque aussi que les couches à substrat non chauffé sont moins
réfléchissantes que celles déposées sur des
substrats chauffés.
3.6 Caractérisation électrique
Les performances électriques dépendent en
majeure partie de la microstructure des cellules. Les grains et les joints de
grains ne se comportent pas de façon identique vis-à-vis de la
conduction. Le comportement des grains peut être assimilé à
celui d'un monocristal alors que celui des joints de grains s'en éloigne
significativement, à cause de leurs nombreux défauts
intrinsèques et de l'éventuelle précipitation d'une phase
isolante.
3.6.1 Spectroscopie d'impédance
électrique
L'impédance d'un matériau diélectrique
peut être généralement divisée en une composante
capacitive et une composante résistive. Dans ce modèle RC
parallèle, la partie résistive rend compte des
phénomènes de conduction dans le matériau et la partie
capacitive, de sa polarisabilité. L'étude des
propriétés électriques d'un matériau polycristallin
nécessite la prise en considération de la contribution des joints
de grains. En effet, ces derniers ont souvent des comportements
électriques différents de ceux du grain. Le comportement
électrique au niveau des défauts de structure tels que les joints
de grains est généralement modélisé par
différents circuits RC successifs et peut être
étudié en courant alternatif. L'étude du comportement
électrique des joints et des grains est réalisée par
spectroscopie d'impédance. Cette technique, largement utilisée
dans le domaine de l'électrochimie, a été adaptée
à l'étude des solides par J.E.Bauerle [104].
3.6.1.1 Principe
La spectroscopie d'impédance est une technique de
caractérisation qui permet de séparer la contribution de chaque
constituant microstructural : grains, joints de grains et porosité. Elle
s'appuie sur la différence de capacité électrique qui
existe entre ces éléments ; donc en mesurant l'impédance
d'un matériau sur une certaine plage de fréquence ; les
différents phénomènes seront ainsi mis en
évidence.
ENIT 2009 72
|
Chapitre 3 : Elaboration et caractérisation des couches
de TiO2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Un matériau polycristallin peut ainsi être
modélisé par un ensemble de cellules dites
élémentaires correspondant aux grains, séparées par
une "phase" intergranulaire possédant une conductivité
différente (Fig.3.22). Dans la plupart des cas, ces zones
intergranulaires sont moins conductrices que les grains.
La modélisation des spectres d'impédance par
circuit équivalent permet, dans le cas idéal, de distinguer trois
contributions : aux basses fréquences, la réponse de l'interface
électrode-matériau, aux moyennes fréquences celle des
joints de grains et aux hautes fréquences celles du grain proprement
dit.
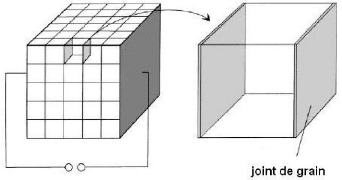
Fig. 3. 22 Modèle des cellules
élémentaires ou modèle des briques ("Brick Layer
Model").
Le circuit équivalent d'un tel modèle est
constitué de deux circuits RC en série, R1C1 pour les grains et
R2C2 pour les joints de grains (fig. 3.23 (a)). L'équation d'un tel
modèle est représentée par la formule (17) où Z
représente l'impédance.
2??1
??(??) = ??1 2??12 + ??2 2??12 +
????2 2??2
2??22 - ?? ( ????1 2??12) (17)
1+ ??2??1 1+ ??2??2
1+ ??2??1 1+ ??2??1
??(0) = ??1 + ??2 ???? lim ??(??) = 0 (18)
???8
avec w la fréquence de signal angulaire (w=2ðf)
En représentation cartésienne dans le plan
complexe, cette expression correspond à deux demi-cercles qui donnent
accès par une résolution graphique aux résistances R1 et
R2 et aux capacités C1 et C2 (Fig.3.23 (b)).
ENIT 2009 73
ENIT 2009 74
Chapitre 3 : Elaboration et caractérisation des
couches de TiO2
Ces deux demi-cercles à basse et haute fréquence
correspondent respectivement aux phénomènes qui se produisent aux
joints de grains et aux phénomènes intragranulaires. Les
résistances sont déterminées à l'aide des
intersections des demi-cercles avec l'axe des abscisses comme montré sur
la figure 3.23 (b) et les capacités à l'aide du maximum
d'amplitude de Tm Z (aux fréquences f01 et f02) atteint pour
ù0RC=1. Les capacités C1 et C2, qui rendent compte des
défauts de structure, sont inversement proportionnelles à
l'épaisseur des grains et des joints de grains.
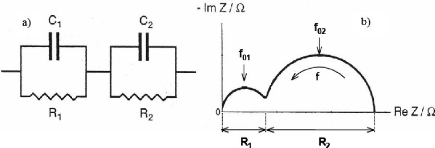
Fig. 3. 23 Circuit équivalent du modèle
des briques (a) et sa représentation de Nyquist (b)
Cette technique permet donc de séparer et de
déterminer les résistances et capacités
équivalentes des diverses contributions du matériau. Tl suffit
que les fréquences de relaxation de chacun de ces circuits soient
suffisamment différentes pour obtenir un ou plusieurs demi-cercles
correspondant à chacune des contributions.
Les valeurs des résistances R1 et R2
déterminées par spectroscopie d'impédance dépendent
de plusieurs facteurs tels que la composition chimique, le volume et la
structure respective des grains et de leurs joints. Ainsi, une
résistance R2 élevée peut être la conséquence
de plusieurs facteurs:
? Un réarrangement cationique [105] ou une
amorphisation au niveau des zones intergranulaires,
? Un volume total de joints important. Par ailleurs, lorsque
la taille des grains est très petite, on note aussi l'apparition d'un
phénomène de dispersion des charges au niveau des joints, qui
contribue à augmenter R2.
? Les défauts de structure tels que les lacunes, les
dislocations [106] et les pores dont la présence est fréquente au
niveau des joints.
Chapitre 3 : Elaboration et caractérisation des
couches de TiO2
Mais il existe des limites au modèle des cellules
élémentaires puisque dans un matériau polycristallin
quelconque la forme des grains n'est pas cubique, les joints n'ont pas tous des
comportements électriques équivalents et il peut exister des
contacts de section variable entre des grains voisins. Dans ce dernier cas, R2
dépend à la fois de la section et du nombre de contacts entre les
grains [107]. L'étude du comportement électrique des joints devra
donc être complétée par des analyses en microscopie et il
faudra tenir compte de ces paramètres dans l'interprétation du
diagramme de Nyquist.
Pour les composés dont les grains sont très
conducteurs, on néglige généralement l'effet capacitif et
le déplacement des porteurs de charge à l'intérieur des
grains est considéré comme purement résistif. Le
modèle adopté est alors plus simple (fig. 3.24 (a)) et
l'équation d'un tel système devient :
??(??) = ??1 +
(19)
1+ ??2??2 2??22 - ?? 1+
??2??1 2??12
??2 ????2
2??2
??(0) = ??1 + ??2 ???? lim ??(??) = ??1 (20)
???8
En représentation cartésienne dans le plan
complexe, cette expression correspond à un demi-cercle de
diamètre R2 centré sur l'axe des réels à (R1+R /2)
(fig. 3.24(b)).
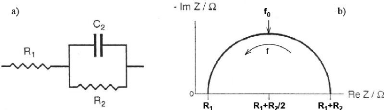
ENIT 2009 75
Fig. 3. 24 Circuit équivalent du modèle
simplifié (a) et sa représentation de Nyquist (b).
Le comportement électrique de différentes
couches a été étudié par spectroscopie
d'impédance. Suivant la compacité du matériau, la
précision de l'appareil de mesure, la taille des grains et la
conductivité des oxydes, le comportement électrique des grains et
des joints correspond au modèle présenté par la figure
3.23 (a) ou la figure 3.24 (a). Dans tous les cas, l'application du
modèle des cellules élémentaires aux oxydes est
cohérente.
En tenant compte de la réponse de l'interface
électrode-matériau, chacun des phénomènes se
produisant dans les grains, joints de grains et électrodes se
modélise par un circuit RC parallèle
ENIT 2009 76
Chapitre 3 : Elaboration et caractérisation des
couches de TiO2
de pulsation caractéristique ?? qui lui est propre et le
spectre d'impédance d'un matériau présente, donc,
généralement trois demi-cercles ou arcs de cercle (voir figure
3.25) :
- aux basses fréquences (10-2 à 10 Hz)
correspond l'arc associé aux phénomènes se produisant aux
électrodes (dans notre cas la gamme fréquentielle est comprise
entre 5 Hz et 13 MHz),
- aux fréquences moyennes (10 à 105 Hz)
correspond la réponse des joints de grains, - aux hautes
fréquences (>105 Hz) correspond la réponse des
grains.
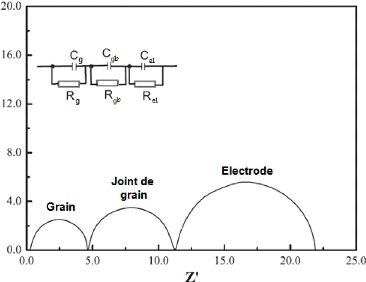
Fig. 3. 25 Modèle de circuits équivalents
et le spectre d'impédance correspondant
Des modèles de circuits électriques
équivalents ont été employés
précédemment pour simuler la réponse et pour fournir la
compréhension du système polycristallin et composé.
Bauerle [108] a proposé un modèle du système simple,
montré dans la figure 3.25. Les spectres d'impédance sont
analysés en se basant sur le modèle physique largement
répandu des grains et des joints de grain connectés en
série avec un modèle de circuit équivalent. Dans ce
circuit, les éléments de RC parallèles, correspondent aux
grains (g), aux joints de grain (gb) et à l'électrode (el) sont
arrangés en série. Les parties réelles et imaginaires
d'impédance obtenues pour ce circuit équivalent idéal sont
:
|
Chapitre 3 : Elaboration et caractérisation des couches
de TiO2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
?? ??gb
??
Re(Z) = Z' =
1+(??/???? ) + 1+(??/??gb) +
1+(??/??????) ???? (21)
|
Im (Z) = Z?=
|
??g(??/???? )
+
1+(??/????
)
|
??gb(??/??gb) +
1+(??/??gb)
|
??????(?? ??????
/ ) (22)
1+(??/??????)
|
Les résistances totale équivalentes des grains
(Rg), des joints de grain (Rgb) et des électrodes (Rel) peuvent
être déterminées à partir des intersections des arcs
des demi-cercles correspondants avec l'axe des réelles.
· co= 1 / RiCi est la fréquence angulaire ou
encore la pulsation de l'élément i ; qui correspond à la
valeur maximale de chaque arc.
· Rg, Rgb et Rel représentent la
longueur du segment de l'axe réel intersecté par les demi-cercles
correspondants, tandis que Cg, Cgb et Cel sont déterminés en
substituant la valeur de résistance dans les Eqs. (21) et (22).
· La résistance totale Rt de l'échantillon
est déterminée à partir de l'intersection de l'arc de
très basse fréquence avec l'axe des réelles, auquel la
pulsation co -* 0 ; et elle est décrite comme Rt = Rg + Rgb +
Rel. Dans notre système, la résistance Rel d'interface
d'électrode-échantillon (c'est à dire laque
d'argent-échantillon) peut être négligée à
cause de l'absence du demi-cercle à très basse
fréquence.
Les spectres d'impédance peuvent
présentés deux demi-cercles à recouvrement partiel. Le
demi-cercle de basse fréquence est attribué aux effets de joint
de grain, alors que l'arc de haute fréquence est attribué au
grain (Fig. 3.26). Pour un spectre typique d'impédance de deux
demi-cercles à recouvrement partiel, un modèle modifié de
Cole-Cole [109] peut être exprimé par :
Z* (??) = ??0 +
??1- ??0
??????
+
??2- ??1 (23)
1+(
g)-ag
1+(??????gb)-agb
Avec Z* est le conjugué de Z (Z* = Re (Z) - Im (Z))
ôg et ôgb sont les temps de relaxation moyens des grains et des
joints de grain respectivement alors que ág et ágb sont les
paramètres qui représentent la déviation de la forme des
demi-cercles idéale du spectre d'impédance selon le model de
Debye pour les grains et les joints de grain.
ENIT 2009 77
ENIT 2009 78
Chapitre 3 : Elaboration et caractérisation des
couches de TiO2
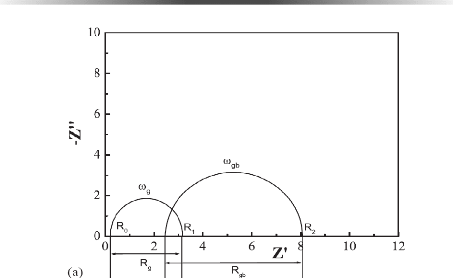
Fig. 3. 26 Modèle révisé de
spectre d'impédance avec les demi-cercles de recouvrement
3.6.1.2 Résultats et discussion
Les mesures ont été faites à l'aide d'un
analyseur d'impédance HP4192 piloté par le logiciel HP VEE
(Hewlett Packard Visual Engineering Environment) et de gamme
fréquentielle comprise entre 5 Hz et 13 MHz, d'amplitude d'excitation du
signal perturbateur entre 5 mV et 1.1 V et de tension de polarisation
crête à crête de 70 V. Nous avons choisi la spectroscopie
d'impédance pour la détermination des propriétés
électriques des couches élaborées pour sa
faisabilité en tant que technique de contrôle non destructif
applicable aux couches minces.
Cette technique consiste à travailler avec une tension
sinusoïdale U de fréquence f (la pulsation w vérifie : w
=2ðf telle que U=U0 exp (jwt) (cf. Fig. 3.27). Cette tension produit un
courant sinusoïdal dans le matériau qui subit cependant un
déphasage ? variable : I=I0exp j (wt+?). L'impédance est alors
définie comme le rapport T/U : Z(w)=Z0 exp(-j?), Z est un nombre
complexe composé d'une partie réelle Re (Z) et d'une partie
imaginaire Tm (Z) :
Z(w) = Re (Z) + j Im (Z).
Nous utiliserons la représentation cartésienne
de Z dans le plan complexe aussi appelée représentation de
Nyquist comme explicité dans le paragraphe précédent.
Chapitre 3 : Elaboration et caractérisation des
couches de TiO2
Nous avons mesuré l'impédance (module et phase)
de nos couches minces de TiO2 déposées sur des substrats de verre
chauffés pour une gamme de fréquences comprises entre 5 Hz et 13
MHz.

Sorties ou réponses :
y(t)
Système inconnu de fonction de transfert H =
Y(t)/U(t) (une CM)
Entrées ou excitation : U(t)=Umax
sin(wt)
Action Mesure
Perturbations v(t)
Fig. 3. 27 Principe de modulation d'une CM
Le montage utilisé comprend une cellule à 2
bornes dont les électrodes sont constituées de deux fils de
cuivres très fins fixés à l'aide de la laque d'argent aux
extrémités de l'échantillon à mesurer (cf. Fig.
3.28). La laque d'argent est utilisée pour collecter les charges en
surface des échantillons.
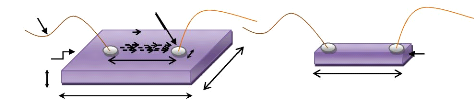
e = 2 mm S = d*e
CM de TiO2
20 mm
l = 10 mm
l
R = (?*l) / S
d (nm)
15 mm
Laque d'argent
Fil de cuivre
E
Fig. 3. 28 Montage de mesure des impédances et
modèle simplifié
Les échantillons ont des épaisseurs variant de
114 à 183 nm et de dimension de (15x20) mm2. Ces mesures
permettent de mettre en évidence l'influence des zones intergranulaires
dans la conduction au sein des couches minces de dioxyde de titane.
Les spectres d'impédance des couches de TiO2 sur des
substrats de verre chauffés à différentes
température sont étudiés dans cette expérience
(voir Fig. 3.29 et 3.30). Nous constatons que les spectres montrent deux
demi-cercles à recouvrement partiel pour tous les échantillons
sauf celui à substrat chauffé à 300 °C qui
présente deux demi-cercles sans recouvrement.
ENIT 2009 79
ENIT 2009 80
Chapitre 3 : Elaboration et caractérisation des
couches de TiO2
Les intersections des demi-cercles avec l'axe des abscisses
permettent aussi d'accéder à la résistivité des
grains ñg aux basses fréquences et à celle des
joints de grain ñgb aux hautes fréquences.
Les lieux de Nyquist des différents spectres
d'impédance sont montrés dans les figures 3.29
et 3.30.
Re(Z) (106 ?)
-Im(Z) (105 ?)
TAmb 100°C 200°C 300°C
Fig. 3. 29 Diagramme de Nyquist des CMs de TiO2/verre
à TS : (a) Ambiante, (b) 100, (c) 200 et (d) 300
°C
Re(Z) (103 ?)
-I m(Z) (103 ?)
300°C
Fig. 3. 30 Spectre d'impédance d'une CM de
TiO2/Verre pour TS = 300 °C
ENIT 2009 81
Chapitre 3 : Elaboration et caractérisation des
couches de TiO2
Le tableau 3.9 ci-dessous représente les
résultats de calcul des propriétés électrique des
couches de dioxyde de titane pour différentes températures de
substrat avec :
ü R0, Rg, Rgb et RT représentent, respectivement,
la résistance de contact, des grains, des joints de grain et totale (ou
aussi à courant continu) des échantillons
étudiés.
ü ?0, ?g, ?gb et ?T représentent,
respectivement, la résistivité de contact, des grains, des joints
de grain et totale (ou aussi à courant continu) des échantillons
étudiés.
ü fg, fgb, Cg? Cgb??g et ?gb sont,
respectivement, les fréquences de relaxation, les capacités et
temps de réponse des grains et des joints de grain.
Tab. 3. 9 Calcul des propriétés
électriques des CMs de TiO2 pour différentes températures
de substrat
|
Ts = 20 °C
|
Ts = 100 °C
|
Ts = 200 °C
|
Ts = 300 °C
|
|
R0 (k?)
|
12.64
|
29.53
|
49.87
|
0.82
|
|
Rg (M?)
|
3.32
|
2.50
|
0.55
|
0.01
|
|
Rgb (M?)
|
1.81
|
3.24
|
3.09
|
0.11
|
|
?0 (10-4 ?.cm)
|
46.26
|
89.18
|
113.70
|
2.49
|
|
?g (10-2 ?.cm)
|
121.5
|
75.5
|
12.5
|
0.3
|
|
?gb (10-2 ?.cm)
|
66.2
|
97.8
|
70.5
|
3.3
|
|
fg = fHF (MHz)
|
1
|
1.3
|
5.6
|
5.6
|
|
Cg (pF)
|
0.1
|
0.09
|
0.09
|
7.17
|
|
fgb = fBF (Hz)
|
158.11
|
99.76
|
88.91
|
3971.64
|
|
Cgb (pF)
|
310.98
|
436.30
|
922.44
|
709.05
|
|
?g (ns)
|
174.75
|
127.47
|
28.08
|
28.35
|
|
?gb (ms)
|
1.00
|
1.60
|
1.79
|
0.04
|
|
RT (M?)
|
4.16
|
5.25
|
3.55
|
0.11
|
|
?T (10-2 ?.cm)
|
152
|
159
|
81
|
3.3
|
On remarque que la résistivité des grains
décroît avec la température, par contre, la
résistivité des joints de grain devient de plus en plus
prédominante par rapport à celle des grains en augmentant la
température des substrats. En effet, les résistivités de
grain s'affaiblie alors que celles des zones intergranulaires s'approchent des
résistivités totales qui représentent aussi la
résistivité à courant continu.
Cette technique de mesure nous permet donc de confirmer que
les grains gouvernent majoritairement la conduction au sein des couches minces
de dioxyde de titane à substrat chauffé à des
températures supérieures ou égales à 200 °C.
Pour un dépôt à 300 °C, la couche est bien moins
résistive vu qu'elle est moins poreuse. Par conséquent, elle est
plus conductrice. De ce fait
|
Chapitre 3 : Elaboration et caractérisation des couches
de TiO2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
l'impédance du système étudié
formé par la couche, la laque d'argent ou le contact et
l'électrode est plus faible.
Nous constatons aussi que l'effet capacitif des grains,
représenté par le demi-cercle des hautes fréquences, est
devenu de plus en plus négligeable en augmentant la température
de croissance.
Afin de confirmer l'évolution de la
résistivité des couches avec leurs porosités, nous avons
déterminé les différentes valeurs de la
résistivité totale ?T, qui représente aussi la
résistivité mesurée à courant continu, pour chaque
échantillon. La résistivité des couches
décroît en suivant la décroissance de la porosité
des couches en fonction de la température de substrat montrée par
les analyses AFM.
La spectroscopie d'impédance complexe permet, donc, de
confirmer que les zones granulaires gouvernent majoritairement la conduction au
sein des couches minces de dioxyde de titane à haute température
de substrat. En fait, Plus un dépôt est poreux, plus la section
entre les grains est grande, ce qui conduit à des
résistivités ?i plus grandes, c'est le cas des couches
déposées à température ambiante et 100 °C. La
résistivité des films augmente donc, pareillement à la
résistivité des zones intergranulaires, en fonction de la
porosité de la couche.
Par ailleurs, on remarque l'existence d'un petit arc inductif
à moyenne fréquence pour les températures ambiante, 100 et
200 °C qui s'affaibli jusqu'à sa disparition à Ts
= 300 °C. Cette inductance peut être considérée comme
une inductance parasite qui indique l'instabilité des couches et de
leurs porosités. En effet, un système électrique (dans
notre cas le système est formé par la couche mince, la laque
d'argent et l'électrode de cuivre) caractérisé par son
réponse harmonique (fréquentielle) ne peut être stable que
si sa fonction de transfert est à partie imaginaire négative. La
stabilité se traduit dans le lieu de Nyquist par le demi-plan
(-Im(Z)).
Concernant les temps de relaxation ou temps de réponse,
on remarque que, à la température ambiante, 100 et 200 °C,
les grains ont une réponse de moins en moins rapide et que les joints
des grains sont de plus en plus très rapide. Tandis que, à 300
°C, les grains et les joints des grains ont un temps de réponse
très rapide et de même ordre de grandeur.
ENIT 2009 82
ENIT 2009 83
Chapitre 3 : Elaboration et caractérisation des
couches de TiO2
3.6.2 Type de conductivité
Dans cette partie nous étudierons le comportement
électrique des couches minces de TiO2 déposées sur des
substrats de verre et de silicium à différentes
température de substrat : température ambiante, 100, 200 et
300°C.
3.6.2.1 Principe
La détermination du type de conductivité des
échantillons (N, P ou intrinsèque) dans le laboratoire se fait
par la méthode de la pointe chaude ou bien « hot point probe».
C'est une méthode facile, rapide et efficace. Elle se base sur l'effet
thermoélectrique appelé aussi l'effet Seebeck. En effet, si un
matériau est soumis à un gradient de température, un
potentiel électrique se manifeste entre la région froide et la
région chaude. Le signe de ce potentiel est relié au signe des
porteurs de charges et l'amplitude est proportionnelle à la
différence de température. Expérimentalement, nous avons
utilisé un galvanomètre relié aux deux pointes, l'une
chauffée et l'autre non chauffée, et un étalon couche de
silicium de type N comme référence. Si le sens de
déviation du « spot » est le même que celui de la couche
référence alors notre semi-conducteur est de type N et dans le
cas contraire il est de type P sinon la couche est intrinsèque (voir
Fig. 3.31).
Pointe froide
Pointe chaude
Couche mince
type P
Galvanomètre
Spot
Couche référence Si (N)
Substrat (Si (P) ou Verre)
Fig. 3. 31 Principe de la méthode de la pointe
chaude
3.6.2.2 Résultats et discussion
Le tableau 3.10 rassemble le type de
conductivité des couches élaborées sur des substrats de
verre et de silicium pour différentes température de
croissance.
Tab. 3. 10 Types de conductivité des CMs de
TiO2
Chapitre 3 : Elaboration et caractérisation des couches de
TiO2
|
Température du
substrat
|
Substrat en Si (p)
|
Substrat en verre (I)
|
|
Phase(s) de TiO2
|
Type
|
Phase(s) de TiO2
|
Type
|
|
Tamb
|
Anatase
|
P
|
Amorphe
|
N-- (I)
|
|
100°C
|
Anatase>>Rutile
|
P+
|
Rutile
|
N- (I)
|
|
200°C
|
Anatase > Rutile
|
N++
|
Rutile
|
N
|
|
300°C
|
Anatase Rutile
|
N++
|
Rutile
|
N++
|
Les couches de TiO2 déposées sur des substrats
de verre à température ambiante et à 100°C sont
très résistives et presque intrinsèques par compensation.
On remarque que la conductivité est une fonction croissante de la
température de substrats, et par suite la résistivité des
couches est une fonction décroissante de la température de
substrat ce qui est en accord avec les résultats de la spectroscopie
d'impédance, tout en gardant le même type de conductivité
(N) c'est-à-dire que les électrons sont les porteurs
majoritaires. L'unique phase présente dans ces couches qui est le rutile
a gardé sa stabilité en type de conductivité.
Concernant les couches déposées sur des
substrats de silicium, la conductivité est, non seulement croissante en
augmentant la température des substrats, mais elle a changé son
type pour être fortement conductrice de type N++ à
300°C. On remarque que dès l'apparition de la phase rutile, les
couches changent de type de conductivité. Conformément à
la littérature, la phase rutile est généralement de
conductivité de type N alors que la phase anatase est souvent de type
P.
En effet, la diffraction des Rayons X a montré la
présence d'une seule phase à température ambiante et
100°C pour les couches déposées sur des substrats de
silicium mais les porteurs majoritaires dans ces couches sont les trous
contrairement aux couches déposées sur du verre. La
conductivité dépend fortement du type de substrat.
On remarque aussi qu'à basse température
(ambiante et 100 °C), le type de conductivité des couches de TiO2
est celui du substrat. Par exemple, pour les couches déposées sur
des substrats de verre le TiO2 demeure compensé. Alors que pour celles
déposées sur des substrats de silicium type P, les couches
conservent le même type de conduction.
ENIT 2009 84
|
Chapitre 3 : Elaboration et caractérisation des couches
de TiO2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.7 Conclusion
La croissance cristalline des couches de TiO2 est une fonction
de la structure cristalline et de substrat et les propriétés
physiques dépondent très fortement de la température de
croissance. Un bon accord entre les résultats expérimentaux et la
théorie est observé. Ceci prouve que les modèles
proposés sont appropriés. La principale conclusion, que nous
pouvons tirer de cette étude, est que :
A basse température de croissance (TAmb) :
· Les couches minces de TiO2/verre sont amorphes tandis
que les couches de TiO2/Si(p) sont monocristallisées selon la phase
anatase et présentent un pic très intense de Si(111).
· Selon la bibliographie, l'anatase est
généralement de type P alors que le rutile est de type N. Ceci
est en bon accord avec les résultats donnés par la méthode
de pointe chaude.
· Plus un dépôt est poreux, plus la section
entre les grains est grande, ce qui conduit à des
résistivités plus grandes. Cette porosité rend la couche
très résistive, d'aspect capacitif important et de temps de
réponse très lent que ce soit pour les grains ou bien pour les
joints des grains. Les grains sont plus résistifs que les joints des
grains.
A moyenne température (100 et 200 °C) :
· Les analyses de DRX montrent que le verre (I) favorise
la phase Rutile (N-I) qui est la plus stable, alors que, le silicium
monocristallin Si(100) type P favorise la phase Anatase type P. Les couches se
cristallise suivant une orientation préférentielle la plus stable
(R(110) pour le verre et A(101) pour le silicium).
· Les images d'AFM confirment cette cristallisation qui
présentent une structure granulaire d'une manière
quasi-isotropique et qui a la tendance d'avoir une couche monocristalline.
· Les couches cristallisent en phase rutile à
partir d'une température de substrats de 100°C pour les couches
déposées sur du verre et de 200 °C pour celles
déposées sur du silicium. Cela permet d'éliminer la
nécessité d'un recuit post-dépôt engendrant des
fissures à la surface. Selon la bibliographie, les températures
de transition (recuit) sont de l'ordre de 800°C, pour le rutile, et de
500, pour l'anatase.
· D'après les analyses optique et
électrique, les couches déposées sur du verre sont de plus
en plus transparentes, conductrices, réfractrice, minces,
anti-réfléchissantes et absorbantes.
· La conductivité augmente avec la
température de substrat mais elle reste toujours faible et les couches
sont plus ou moins résistives pour les couches déposées
sur du verre. Elle est assuré
ENIT 2009 85
|
Chapitre 3 : Elaboration et caractérisation des couches
de TiO2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
principalement par les grains mais les joints des grains
restent résistifs et possèdent un effet capacitif non
négligeable.
? Les réponses harmoniques présentent une
inductance parasite qui indique une instabilité.
A haute température (300°C) :
? Les couches sont cristallisées mais ne
possèdent pas une orientation préférentielle tout en
suivant le modèle théorique de Thornton. Ceci se traduit par
l'apparition de larges cristallites plates et d'autres plus petites dans les
images AFMs montrant une recristallisation des couches. Cela augmente le
désordre dans le réseau et le rend moins dense et polycristallin.
Par suite, les couches deviennent plus épaisses, moins absorbantes et
moins réfractrices.
? La SIE montre que l'effet capacitif des grains est devenu de
plus en plus négligeable et que la résistivité des couches
décroît en suivant la décroissance de la porosité
des couches. La SIE permet aussi de confirmer que les zones granulaires
gouvernent majoritairement la conduction au sein des couches minces de dioxyde
de titane à haute température de substrat.
? La disparition du petit arc inductif à moyenne
fréquence indique que les couches sont électriquement stables.
Tandis que, les grains et les joints des grains ont des temps de réponse
très rapide et de même ordre de grandeur (40 et 30 ns).
Les mesures des impédances complexes par spectroscopie
d'impédance nous ont permis de mieux connaître la microstructure
des couches de dioxyde de titane et de les modéliser.
Les propriétés optiques, morphologiques,
structurales, et électriques dépendent fortement de la
température de substrat et toutes ces propriétés sont en
bon accord entre elles.
ENIT 2009 86
Conclusion générale
Conclusion générale
Cette étude a pour objectif principal la
synthèse et la caractérisation des couches minces de dioxyde de
titane sur des substrats de verre et de silicium obtenues par
pulvérisation cathodique RF magnétron à différentes
températures de substrat.
Différentes techniques d'analyse ont été
mises en oeuvre pour caractériser les couches minces de TiO2. Elles sont
essentiellement divisées en quatre catégories. Les analyses
optiques comprenant des mesures de transmission et de réflexion ont
fourni des informations sur les états électroniques des couches.
L'analyse de la structure et de la morphologie des couches ont
été réalisées par diffraction des rayons X et par
microscopie à force atomique. Finalement, les propriétés
électriques en mode continu ou alternatif ont été
mesurées à l'aide de la spectroscopie d'impédance et la
méthode de « hot point probe ».
Les analyses optiques ont montré que la
température de substrat peut translater la zone de photoactivité
du dioxyde de titane de l'Ultra Violet vers le proche visible. En effet, pour
les couches à substrat de verre, l'énergie de gap optique varie
en fonction de la température de 3.47 à 3.09 eV alors que
l'indice de réfraction varie de 2.3 à 2.7. D'après ces
analyses, le calcul des épaisseurs des couches déposées
sur des substrats de verre montre que ces couches ont des épaisseurs
variant entre 183 et 114 nm. Alors que pour les couches déposées
sur de substrats de silicium, l'étude optique montre que le TiO2 est un
matériau anti-réfléchissant pour les panneaux de silicium.
En effet, le silicium est très réfléchissant dans les
domaines UV et visible ce qui influence le rendement des cellules
photovoltaïques.
Les études structurale par diffraction des Rayons X
(DRX) et morphologique par microscopie à force atomique (AFM) ont
montré que les couches de TiO2 élaborées par
pulvérisation cathodique RF magnétron sur des substrats de verre
et de silicium ont une structure qui dépend fortement de la structure
cristalline du substrat à basse température. Cette structure
s'améliore avec la température pour être plus compacte,
stable, cristallisée et moins poreuse suivant le modèle de
Thornton de croissance cristalline relatif aux couches élaborées
par pulvérisation cathodique. Les couches déposées
à température ambiante présentent une grande
rugosité due à la porosité des couches.
ENIT 2009 87
Conclusion générale
Le dépôt sur des substrats chauffés
paraît favoriser la structure tétragonale des substrats de
silicium et diminuer la porosité des couches vu que le pic du silicium
devient de moins en moins intense du fait que les couches deviennent de plus en
plus compactes, cristallisées. On a aussi remarqué une
amélioration de la stabilité des couches déposées
sur du silicium qui se traduit par la transformation de la structure anatase
à la structure rutile.
Les couches minces de TiO2 ne sont pas seulement
modifiées du point de vue optique, structural mais chaque augmentation
de température est accompagnée par des changements de morphologie
importants. Les couches sont poreuses à basse température et
suivent une croissance nodulaire. En augmentant la température, la
structure devient colonnaire.
Les résultats menés par spectroscopie
d'impédance montrent que suivant la température, le dioxyde de
titane peut être un bon isolant ou un conducteur transparent raisonnable.
Ils permettent la modélisation électrique des couches et la
compréhension du comportement des grains et des joints de grain. La
spectroscopie d'impédance complexe permet de confirmer que les zones
granulaires gouvernent majoritairement la conduction au sein des couches minces
de dioxyde de titane à haute température de substrat. Plus un
dépôt est poreux, plus la section entre les grains est grande, ce
qui conduit à des résistivités plus grandes. La
résistivité des couches diminue donc, pareillement à la
résistivité des zones granulaires, en fonction de la diminution
de la porosité de la couche qui est une conséquence de
l'augmentation de la température.
D'après les mesures de type de conductivité on
constate que, conformément à la littérature, la phase
rutile est généralement de conductivité de type N alors
que la phase anatase est souvent de type P.
Ce travail représente une introduction à un
sujet de recherche dédié à améliorer les
propriétés optiques et électriques des couches de TiO2
pour des applications photovoltaïques. Dans ce cadre, on propose
d'étudier l'effet du dopage (le niobium) et/ou du recuit tout en variant
la température de substrat jusqu'à la disparition complète
de la phase anatase des couches déposées sur du verre.
ENIT 2009 88
Bibliographie
Bibliographie
[1] M. Zukalová et al. Progress in Solid State
Chemistry. 33 (2005), 253-261.
[2] Yu Jing-Xin et al. Chinese Phys. B. 18
(2009), 269-274.
[3] O. Carp, C. L. Huisman et A. Reller. Progress in Solid
State Chemistry. 32 (2004), 33-177.
[4] A. Kuhn, R. Amandi et F. García-Alvarado. J. Power
Sources. 92 (2001), 221-227.
[5] J.Tang et Endo. J. Am. Ceram. Soc. 76
(1993), 796.
[6] R. Marchand, L. Brohan et M. Tournoux. Mat. Res. Bull.
15 (1980), 1129-1133.
[7] J. F. Banfield et D. R. Veblen. American Mineralogist.
77 (1992), 545-557.
[8] J. J. Mazer et al. Nature. 357 (1992),
573-576.
[9] J. F. Banfield, D. R. Veblen, et D. J. Smith. American
Mineralogist. 76 (1991), 343-353.
[10] P. Y. Simons et F. Dachille. Acta Crystallographica.
23 (1967), 334-335.
[11] M. Lartoche et al. J. Solid State Chemistry. 81
(1989), 78-82.
[12] N. A. Dubrovinskaia et al. Phys. Rev. Lett. 87
(2001), 275501.
[13] L. Kavan et al. J. Am. Chem. Soc. 118
(1996), 6716-6723.
[14] J. Staun Olsen, L. Gerwald, and J. Z. Jiang. J. Phys.
and Chem. of Solids 60 (1999), 229.
[15] J. Aarik et al. J. Crystal Growth 169
(1996), 496.
[16] J. D. McCullough et K. N. Trueblood, Acta Cryst.
12 (1959), 507-511.
[17] R. J. G. Clark, The chemistry of titanium and vanadium.
Elsevier, New York. (1968).
[18] P. Babelon, « Obtention de couches minces à
base de titane par les techniques sol-gel et
MOCVD ». Th. doct, Univ. de Bourgogne, (1997).
[19] F. Fabreguette. « Caractérisation de couches
minces et de multicouches nanométriques à
base d'oxynitrure de titane élaborées par
LP-MOCVD ». Th. doct, Univ. de Bourgogne, (2000).
[20] C. J. Taylor et al, J. Am. Chem. Soc., 121
(1999), 5220-5229.
[21] J. Bilbao: « Cours du brevet fédéral
d'électromecanicien », (1999).
[22] J. Muscat, V. Swamy et N. M. Harrison. Phys. Rev. B.
65 (2002), 224112.
ENIT 2009 89
Bibliographie
[23] C. Sarantopoulos. « Photocatalyseurs à base de
TiO2 préparés par infiltration chimique en phase vapeur (CVI) sur
supports microfibreux ». Th. doct, Inst. Nat. Polytech de Toulouse (2007),
10-11.
[24] L. Kavan et al, J. Am. Chem. Soc. 118
(1996), 6716-6723.
[25] A. BREVET, « Les premiers instants de la croissance de
films minces d'oxydes métalliques par MOCVD : caractérisation
physico-chimique de l'interface film/substrat ». Th. doct.
Université de Bourgogne (2006), 11.
[26] K. Rajeshwar, Jornal of Applied Electrochemistry.
25 (1996), 1067.
[27] K. M. Schindler, M. Kunst, Jornal of Physical Chemistry.
94 (1990), 8222.
[28] Y.H. Hsien et al, Applied Catalysis. 31
(2001), 241.
[29] P. Babelon, « Obtention de couches minces à
base de titane par les techniques sol-gel et MOCVD ». Th. doct.,
Université de Bourgogne, (1997).
[30] F. Fabreguette, « Caractérisation de couches
minces et de multicouches nanométriques à base d'oxynitrure de
titane élaborées par LP-MOCVD ». Th. doct. Université
de Bourgogne, (2000).
[31] A. Bally, « Electronic properties of nano-crystalline
titanium dioxide thin films », Th. doct. Ecol. Poly. Federale de Lausanne
2094 (1999).
[32] S. M. Sze, « Physics of semiconductor devices »,
Wiley Interscience, New York (1981).
[33] G. H. Johnson, Journal of The American Ceramic Society.
36 (1953), 97.
[34] C. H. Lee et C. W. Ching, Materials Chemistry and Physics.
47 (1997), 193.
[35] E.C. Akubuiro et X.E. Verykios, Journal of Physics and
Chemistry of Solids. 50 (1989), 17.
[36] A.Bernasik et al, Applied Surface Science. 65/66
(1993), 240.
[37] N. G. Eror, Journal of Solid State Chemistry. 38
(1981), 281.
[38] S. Fujitsu and T. Hamada, Journal of The American Ceramic
Society. 77 (1994), 3281.
[39] J.L. Carpentier, A. Lebrun, et F. Perdu, J. of Phy. and
Chem. of Solids. 50 (1989), 145.
[40] P. Kofstad, « Nonstoichiometry, diffussion, and
electrical conductivity in binary metal oxides », Wiley Interscience, New
York (1972).
[41] S.Vemury et S.E.Pratsinis, Journal of The American Ceramic
Society. 78 (1995), 2984.
[42] K. Prasad et al, Japanese Journal of Applied Physics. A.
36 (1997), 5696.
[43] A. Eucken et A. Büchner, Zeitschrift für
physikalische Chemie. B. 27 (1935), 321.
[44] H. L. Hartnagel et al, « Semiconducting transparent
thin films », Institute of Physics Publishing, Bristol (1995).
ENIT 2009 90
Bibliographie
[45] M.Anpo. In Green Chemistry, P.Tundo and P.Anastas
(Eds.), Oxford University Press,1 (2000).
[46] L. Zang et al, Visible-light detoxification, PubMed.
11931119 (2000) 379-84.
[47] S. Springer, « Free carriers in nanocrystalline
titanium dioxide thin films », th. doct. Eco. Poly. Federale de Lausanne,
n° 2934 (2004), 13.
[48] M. P. Casaletto et al, « Surface studies of in vitro
biocompatibility of titanium oxide coatings ». Appl. Surf. Science.
172, (2001) 167-177.
[49] Y. Zhang et al, Catalysis Today. 68
(2001), 89-95.
[50] Y. Li et T.H. Lim, Journal of solid state chemistry.
177 (2004), 1372-1381.
[51] N. Negishi et T. Takeuchi, Journal of Sol-Gel. Sci.
Technol. 22 (2001), 23.
[52] A. Fujishima, T. N. Rao et D. A. Tryk . Journal of
Photochem. Photobiol. 1 (2000), 1-21.
[53] I. Sopyan, M. et al, Journal of Electroanal. Chem.
415 (1996), 183.
[54] A. Fujishima et al, Nature. 353 (1997),
737.
[55] N. Negishi et al, Chemistry Letters. (1995), 841.
[56] K. Sunada et al, Environ. Sci. Technol. 32
(1998), 726-728.
[57] H. Sakai et al, Chemistry Letters. (1995) 185-186.
[58] K. Qi et al, Journal of Materials Chemistry. 16
(2006), 4567-4574.
[59] M. Beblow. Nature. 429 (2004), 620.
[60] D.F. Ollis, H. Al-Ekabi, Photocatalytic purification and
treatment of water and air, Elsevier Amsterdam. (1993).
[61] L.B. Reuthergarth et M. Iangphasuk, Chemosphere, 35
(1997), 585.
[62] K. Tanaka, M.F.V. Capule et T. Hisanaga, Chem. Phys. Lett.
187 (1991), 73.
[63] X.Y. Deng, Y.H. Yue et Z. Gao, Applied Catalysis B :
Environmental. 32 (2001), 181.
[64] G.R. Bamwenda et al, Applied Catalysis A : General.
205 (2001), 117.
[65]A. Fujishima, K. Hashimoto et T. Watanabe, TiO
Photocatalysis, fundamentals and applications ; BKC, Inc.: Tokyo. (2001),
176.
[66] M. Kaneko, I. Okura, Photocatalysis - Science and
Technology; Kodansha and Springer: Tokyo and New York, (2002).
[67] R. Wang, K. Hashimoto et A. Fujishima, Advanced Materials.
2 (1998), 135.
[68] B. S. Richards et al, « Potential cost reduction of
buried-contact solar cells through the use of titanium dioxide thin films
». Sol. Energy, 76 (2004), 269-276.
ENIT 2009 91
Bibliographie
[69] P. Serp, P. Kalck, et R. Feurer, « Chemical Vapor
Deposition Methods for the Controlled Preparation of Supported Catalytic
Materials ». Chem. Rev.. 102 (2002), 3085-3128.
[70] R. R. Willey: « Practical design and production of
optical thin films », Marcel Dekker, New York (1996).
[71] S. Lee, B. Hun Park, and S.-G. Oh, Journal of the Korean
Physical Society. 31 (1997), 352.
[72] X. Orignac et al, Journal of Sol-Gel Science and
Technology. 8 (1997), 243.
[73] R. E. Hummel, and K. H. Guenther: « Handbook of
optical properties ; Thin films for optical coatings », CRC. 1
(1995).
[74] P. Bonhôte et al, Journal of Chemical Society,
Chemical Communication (1996), 1163.
[75] M. Gratzel et K. Kalyanasundaram, Current Science.
66 (1994), 706.
[76] S. Siebentritt et al, 14 European Photovoltaic Solar Energy
Conference, Barcelona, Spain 30 june-4 July (1997), 1823.
[77] K. Tennakone et al, Journal of Physics D: Applied Physics.
31 (1998), 2326.
[78] M. Schiavello, « Heterogeneous Photocatalysis »,
John Wiley & Sons, New York (1997).
[79] A. Mandelis et C. Christofides, « Physics, chemistry
and technology of solid state gas sensor devices », John Wiley & Sons,
New York (1993).
[80] N. Yamamoto, S. Tonomura, et H. Tsubomura, Journal of the
Electrochemical Society. 129 (1982), 444.
[81] A. Hocini et al, Microelectronics journal. 39
(2008), 99-102
[82] R.Paily et al, Applied Surface Science. 187
(2002), 297-304.
[83] F. Fabreguette et al, Applied Surface Science.
175-176 (2001), 685-690.
[84] R. Zanoni et al, Sensors and Actuators B 24-25
(1995), 886.
[85] R. Fromknecht et al, Nuclear Instruments and Methods in
Physics Research B 120 (1996), 252.
[86] F. Bregani et al, Sensors and actuators B 31
(1996), 25.
[87] E. Traversa et al, Sensors and actuators B 31
(1996), 59.
[88] K. Hatta et al, Journal of Crystal Growth 163
(1996), 279.
[89] M. Stromme et al, Journal of Applied Physics 79
(1996), 3749.
[90] J.L. Vosen et W. Kern, « Thin film processes »,
Ed. Academic press 1978.
[91] D. Bouchier, th. doct., Université Paris-Sud
d'Orsay, (1985), 122.
[92] C. Manasterski, Thèse « La pulvérisation
cathodique industrielle », (2007), 69-75.
ENIT 2009 92
Bibliographie
[93] A. Richard, A. M. Durand, « La pratique du vide et des
dépôts de couches minces », In Fine Paris, 1995.
[94] D. Dijkkamp, Y. H. Min-Lee et W. L. Mc, Appl. Phys.
Lett.51 (1987), 619.
[95] L.B. Jonsson et al. Thin Solid Films. 365
(2000),43-48.
[96] J.A. Thornton, Journal of Vacuum Science and Technology,
11(4) (1974), 666-670.
[97] M.L. ANNE, « Guides d'ondes en verres de
chalcogénures pour la détection infrarouge d'espèces
(bio)chimiques ». Th. doct. en chimie, Université de Rennes 1,
(2007), 44.
[98] O.S.Heavens, « Optical properties of thin solid
films », Butterworths, London (1950)
[99] J.E.Hall and W.F.Ferguson, Journal of the Optical
Society of America. 45 (1955 ), 714.
[100] S.K.Balh et al, Journal of Applied Physics. 140
(12) (1996).
[101] G.Levéque, Thèse d'état,
Monpelier-France (1979).
[102] T. S. Moss, « Optical properties of semiconductors
», Butterworths, Sci. Pub. Ltd. London
(1961).
[103] E. M. Bachari, G. Baud et S. Ben Amor, Thin Solid Film.
348 (1999) 165172
[104] J. E. Bauerle, Journal of Physics and Chemistry of
Solids. 30 (1969),2657.
[105] H-F. Cheng, Journal of Applied Physics. 56(6)
(1984), 1831.
[106] N. Ponpandian et A. Narayanasamy, Journal of Applied
Physics. 92 (5) (2002), 2770.
[107] J. Fleig et J. Maier, Journal of the european ceramic
society. 19 (1999), 693.
[108] J.E. Bauerle, Journal of Physics and Chemistry of
Solids. 30 (1969), 2657.
[109] M.H. Abdullah et A.N. Yusoff, Journal of Materials
Science. 32 (1997), 5817.
[110] YUANYUAN ZHANG et al. Journal of crystal growth.
300 (2007), 551-554
ENIT 2009 93
ENIT 2009 94
Bibliographie
Netographie
[a]
http://fr.wikipedia.org/wiki/Titane
[b]
http://apiscopo.free.fr/premier%20chapitre.htm
[c]
http://www.sfc.fr/Donnees/mine/tio2/textio2.htm
[d]
http://www.sophim.com/htmlfr/fcerester.html
[e]
http://pagesperso-orange.fr/michel.hubin/physique/couche/chap_cm0.htm
[f]
http://pagesperso-orange.fr/michel.hubin/physique/couche/chap_pc1.htm
[g]
http://www.mechlab.utwente.nl/physicalanalysis/mechanical/Philips%20X%27Pert%20120X-ray%20Diffractometer.whlink/
[h]
http://fr.wikipedia.org/wiki/Diffractom%C3%A9trie
de rayons X
[i]
http://www.veeco.com/Products/metrology
and instrumentation/AFM SPM/Dimension 3100/
[j]
http://fred.elie.free.fr/refraction_et_densite.htm



