|
COUT DIRECT DE LA PRISE EN CHARGE DU LYMPHOME DE BURKITT ET DU
NEPHROBLASTOME DE L'ENFANT AU CHU-TOKOIN
INTRODUCTION
Dans les pays développés, le taux de
guérison des cancers de l'enfant est passé en 30 ans
d'environ 25 % à près de 75 %, toutes tumeurs et
leucémies comprises. Dans les pays en développement, les
résultats sont beaucoup moins bons. En Afrique, les statistiques sont
rares et fragmentaires. L'incidence globale des maladies malignes de l'enfant y
serait du même ordre que dans les pays développés, et en
2000, elle aurait été de 35 000 nouveaux cas chez
l'enfant de moins de 15 ans. Le double est attendu en 2025. [1]
En Octobre 2000, le Groupe Franco-Africain d'Oncologie
Pédiatrique (GFAOP) s'est constitué; avec pour objectif principal
de redresser la situation défavorable en Afrique. [2]
Malgré cette initiative, force est de constater que les
cancers de l'enfant en général, le Lymphome de Burkitt et le
Néphroblastome de l'enfant en particulier constituent encore un
réel problème socio-économique et pronostic dans les pays
africains dont le Togo. Les faits suivants justifient cette situation :
Avant tout la grande pauvreté des populations et des
systèmes de santé, l'insuffisance dramatique des infrastructures,
les prix élevés et la disponibilité aléatoire des
médicaments. S'y ajoutent l'éducation sanitaire des populations
qui est insuffisante, et la formation pratique à l'oncologie
pédiatrique des soignants et de nombreux médecins, qui est peu
développée. Facteurs aggravants majeurs : l'insuffisance, ou
l'absence complète le plus souvent de toute couverture sociale, et une
idée, encore très répandue en Afrique :
« le traitement des cancers en général, des enfants en
particulier, n'est pas une priorité de santé
publique ». [1]
Le programme thérapeutique du GFAOP au Togo s'applique
à deux tumeurs : le néphroblastome et le lymphome de
Burkitt, qui ont en commun un excellent pronostic avec des taux de
guérison dépassant 90 %, tous cas confondus, dans les pays
développés. [1]
Plusieurs études ont permis d'étudier les aspects
épidémiologiques cliniques évolutifs et
thérapeutiques de ces cancers en Afrique [3, 4, 5,6-9, 10, 11, 12-15,
16, 17, 18], mais peu d'études ont porté sur les aspects
médico-économiques de leur prise en charge. Et pourtant ces
cancers posent bien souvent en Afrique un problème
socio-économique. [5, 6, 7, 8, 9, 10, 19]
Ce problème ne devrait pas être laissé
pour compte puisqu'il détermine en partie le pronostic.
Par ailleurs, Le contrôle des dépenses de
santé est devenu un des axes principaux des politiques de santé.
[20]
Les études sur les coûts sont des outils
indispensables pour déterminer l'impact économique d'une maladie
car elles permettent d'assigner les ressources humaines et matérielles
nécessaires pour la prévention, le diagnostic, le traitement et
le suivi des patients. [21]
Connaître le coût de la prise en charge du
Lymphome de Burkitt et du Néphroblastome de l'enfant au Togo est une
chose essentielle pour orienter les décideurs sur les stratégies
à mettre en oeuvre afin d'améliorer le pronostic de ces
affections. Il était donc judicieux de mener cette étude afin de
documenter la littérature médicale sur les aspects
médico-économiques relatifs à la prise en charge du
lymphome de Burkitt et du néphroblastome de l'enfant au CHU-Tokoin de
Lomé et proposer des solutions à même de minimiser le
coût direct de leur prise en charge en vue de répondre à la
demande avec efficience.
Les objectifs assignés à ce travail étaient
les suivants :
Objectif général :
Evaluer le coût direct moyen de la prise en charge d'un
Lymphome de Burkitt d'une part et du Néphroblastome de l'enfant d'autre
part au CHU-Tokoin de Lomé
Objectifs spécifiques :
- Déterminer la fréquence hospitalière du
Lymphome de Burkitt et du Néphroblastome de l'enfant au CHU-Tokoin de
Lomé selon l'âge, le sexe, la localisation de la tumeur et le
stade.
- Déterminer le taux de rémission complète
pour chacun de ces deux cancers
- Evaluer le coût direct moyen des différentes
lignes de dépense : à savoir celui de l'hospitalisation, des
examens complémentaires, des antimitotiques, des traitements adjuvants
et de la Chirurgie.
- Déterminer la part respective de chacune de ces lignes
de dépense dans le coût direct moyen global de la prise en charge
de chacun des cancers
- Evaluer le coût direct de la prise en charge selon le
stade.
Pour atteindre ces objectifs, nous ferons quelques rappels
dans le chapitre généralités, nous décrirons
ensuite notre méthodologie. Nous présenterons nos
résultats que nous discuterons. Enfin, nous dirons un mot de conclusion
et ferons des Suggestions.
PREMIERE
PARTIE
![]()
GENERALITES
1. LE LYMPHOME DE BURKITT
Définition
Le lymphome de Burkitt (LB) est un cancer appartenant au groupe
des lymphomes malins non Hodgkiniens (LMNH) caractérisé par la
prolifération monoclonale lymphoblastique de cellules B
particulières appelées cellules de Burkitt. [10]
C'est la première hémopathie maligne de l'enfant
africain. [6,3]
Historique
Le lymphome de Burkitt a été décrit pour
la première fois en 1958 par Denis
BURKITT, chirurgien anglais travaillant en Ouganda. Celui-ci
constata la survenue très fréquente de tumeurs de la
mâchoire chez l'enfant africain. [16]
En 1964, Epstein et Barr isolent au sein de cellules tumorales
issues de lymphome de Burkitt un nouveau virus appartenant à la famille
des Herpes viridae, auquel ils donneront leur nom. Un lien étroit est
établi entre ce virus et le lymphome de Burkitt de l'enfant africain.
[22]
En 1969, l'OMS définit le lymphome de Burkitt comme une
entité anatomo- pathologique à part entière
caractérisée par un type prédominant de cellules
tumorales. Selon ces critères morphologiques, des cas de lymphomes de
Burkitt sont
diagnostiqués aux Etats-Unis et en Europe. [23] Ces
tumeurs présentent cependant des différences par rapport aux
lymphomes de Burkitt africains au plan clinique et
épidémiologique. [24]
Par la suite, la connaissance du lymphome de Burkitt a
été renforcée par les
données de l'immunologie, de la
cytogénétique et de la biologie moléculaire.
Au début des années 80,
l'épidémiologie du lymphome de Burkitt dans les
pays occidentaux est modifiée par l'émergence de
l'infection par le VIH. On constate
une augmentation de la fréquence de ces lymphomes au sein
de la population
infectée par le VIH qui constitue une nouvelle source
d'étude pour ce lymphome. [25, 26, 27]
Des progrès thérapeutiques importants ont
été enregistrés améliorant nettement la survie des
patients, permettant de noter sa chimiosensibilité. Malgré ces
progrès thérapeutiques, il n'y a pour l'instant aucun protocole
thérapeutique universellement admis; ce qui explique les
variétés de protocoles utilisés par la plupart des
auteurs. [15, 12,7, 13,14]
Epidémiologie
1.3.1. Incidence
L'incidence du LB varie considérablement selon les
régions du globe : 36,1 cas par million d'enfants en Ouganda, 18 par
million au Nigeria, 1,7 par million à Bamako, 0,5 par million en
Angleterre. [28]C'est la première tumeur maligne de l'enfant en Afrique
sub-saharienne: Elle y représente en effet 30 à 60% des cancers
de l'enfant. [3, 29]
1.3.2. Le virus d'Epstein-Barr (EBV)
L'EBV est un virus ubiquitaire qui infecte la
quasi-totalité de la population adulte mondiale et qui se transmet
principalement par la salive. Dans les zones tropicales, l'EBV se transmet de
la mère au nourrisson. Ainsi, près de 100% des enfants de 5 ans
sont infectés en Afrique tropicale. Dans les pays occidentaux, la
transmission survient souvent durant l'adolescence et peut alors se manifester
cliniquement par une mononucléose infectieuse (MNI). L'EBV est
associé à la quasi-totalité des lymphomes de Burkitt
endémiques. [22]
1.3.3.Les trois formes du Lymphome de
Burkitt[24]
1.3.3.1. La forme endémique
C'est la forme décrite par Burkitt. C'est classiquement
une tumeur des maxillaires atteignant les jeunes enfants africains.
- Son incidence est élevée : 5 à 10
cas/ 100 000 habitants pendant les 15 premières années de la
vie.
- La distribution géographique en Afrique Noire
coïncide avec l'endémie palustre (à l'ouest : 10°
latitude nord, 15° latitude sud, et à l'est : 5° latitude
nord, 20° latitude sud), avec des facteurs climatiques bien
définis : température >16°C, altitude <1500 m,
pluviométrie annuelle supérieure à 50 cm. Une incidence
identique au LB endémique a été retrouvée en
Papouasie Nouvelle-Guinée. A Madagascar, le LB existe dans les
régions d'endémie palustre.
- Les études sérologiques des cas africains ont
montré la coexistence d'une infection antérieure par l'EBV. [22]
- Il a été mis en évidence au niveau des
cellules du LB endémique une aberration chromosomique avec la
présence du réarrangement du proto-oncogène c-myc, soit au
sein de la translocation t (8;14), soit au sein de translocations variantes.
[30]
1.3.3.2. La forme sporadique
Elle domine chez les enfants en Occident, mais s'observe aussi
chez les jeunes adultes. [24] L'infection à EBV n'a été
mise en évidence que dans 20% des cas. L'aberration chromosomique
est constante.
1.3.3.3. Le LB lié à
l'infection par le VIH
Cette forme se manifeste tôt dans la progression vers le
sida. L'intégration du génome de l'EBV est forte. L'aberration
chromosomique est constante. Le LB lié au sida a été
rapporté en Occident surtout chez des homosexuels. [25, 26, 27]
Des cas ont été rapportés en Afrique
chez des hétérosexuels. En pratique, la prévalence du LB
est faible dans le cadre du sida.
La pathogénie de ces trois formes de LB peut
ainsi être résumée :
- infection initiale par l'EBV,
- conditions climatiques particulières avec
endémie palustre,
- aberration chromosomique.
Les 2 premiers événements ne sont constamment
trouvés qu'en Afrique.
1.4. Diagnostic positif
1.4.1.Le Lymphome de Burkitt endémique
1.4.1.1.Les Circonstances du diagnostic
Ø Il s'agit le plus souvent d'un enfant amené
par ses parents pour tumeur
maxillo-faciale. La localisation maxillo-faciale
représente en effet 40 à 100% des formes de début selon
les séries africaines. [6, 9, 10,11, 19, 31, 32, 33]
Cette tumeur intéresse le plus souvent le maxillaire
supérieur. La tumeur peut débuter par une douleur et/ou
mobilité dentaire suivie de la chute des dents ou une tumeur gingivale.
En quelque semaine, il se développe une tumeur monstrueuse qui
déforme le visage.
Une atteinte orbitaire peut être retrouvée,
auquel cas elle est soit isolée, ou alors consécutive à
une atteinte maxillaire. [10]
On observe : un chémosis qui est une infiltration
oedémateuse de la paupière suivi d'une exophtalmie et d'une
tumeur qui se développe en quelques semaines et déforme le
visage.
Ø Les tumeurs abdominales : elles représentent
la deuxième localisation
tumorale après la localisation maxillo-faciale et
s'observent dans plus de 30% des cas. [11, 34, 35]
Les organes souvent atteints dans les localisations
abdomino-pelviennes sont : la rate, les ganglions
rétropéritonéaux, les ovaires, les reins, le foie, les
anses intestinales.
L'atteinte abdominale semble souvent associée à
d'autres localisations, en particulier faciales. [10, 11, 36]
Ø Les autres circonstances de découverte
sont :
Les localisations neurologiques. Elles sont
exceptionnellement une forme
de début en raison du fait que l'envahissement
neuro-méningé est une complication évolutive de la maladie
de Burkitt.
L'atteinte ostéomédullaire s'observe
également en cours d'évolution. [10 ,11]
L'atteinte ganglionnaire périphérique est rare (4%
des cas).
D'autres localisations ont été décrites: os
longs, testicules, thyroïde, thymus, glandes salivaires, peau, seins,
séreuses (plèvre). [10, 11]
1.4.1.2.Les signes paracliniques
1.4.1.2.1.Radiographie du massif maxillo-facial
[35]
- Lésions précoces : Petits foyers
ostéolytiquesau niveau des maxillaires
- Lésions tardives :
. Ostéolyse étendue avec déplacement et
chute des dents
. Envahissement des cavités nasales, sinusales et
orbites
. Fracture pathologique de l'os mandibulaire
1.4.1.2.2.Examens cyto-histologiques
Ø La cytologie
L'examen cytologique permet de poser le diagnostic de lymphome
de Burkitt lorsqu'on découvre des lymphoblastes à cytoplasme
réduit, hyperbasophile et vacuolé sur une lame après
ponction d'une zone tumorale. [10]Ces cellules néoplasiques sont
monomorphes de taille moyenne avec 15 à 20ì de diamètre et
de forme arrondie. Le noyau est volumineux, rond, de forme
régulière. La chromatine est fine, réticulée avec
présence de 2 à 4 nucléoles bien visibles (figure 1).
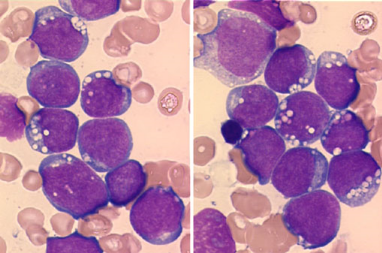
Figure 1 : La cellule de
Burkitt [37]
L'histologie
L'examen anatomo-pathologique permet la confirmation histologique
du diagnostic. L'examen porte sur les prélèvements biopsiques de
la tumeur. La découverte de l'aspect classique de «ciel
étoilé» sur la lame permet de poser le diagnostic de maladie
de Burkitt (figure 2). Le ciel étant représenté par les
cellules tumorales et les étoiles constituées par les histiocytes
qui séparent de place en place les cellules tumorales. [10]
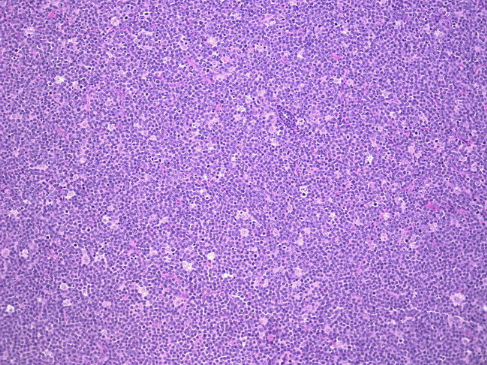
Figure 2 : Aspect caractéristique de « Ciel
étoilé » du Lymphome de Burkitt [38]
http://fr.wikipedia.org/wiki/Fichier:Burkitt_lymphoma,_H&E.jpg1.4.1.2.3.Etude
immunologique
Dans la maladie de Burkitt, on recherche des anticorps
dirigés contre certaines protéines de l'EBV. L'examen
immunologique est positif et montre toujours des anticorps anti-VCA (Virus
Capside Antigen) de type IgG à des taux anormalement
élevés, quelques fois on note la présence d'anticorps
anti-EBNA (Epstein Barr NuclearAntigen).
1.4.1.2.4.Etude cytogénétique
Dans la quasi-totalité des cas de lymphome de Burkitt,
on observe une translocation d'un fragment du bras long du chromosome
8.
- Dans 75% des cas, il s'agit d'une translocation
réciproque avec le bras
long du chromosome 14 notée t (8 ;14) ;
- dans 16% des cas, il existe une translocation
réciproque avec le
chromosome 22 notée t (8 ; 22) ;
- et dans les 9% restant, la translocation se fait avec un
fragment du bras
court du chromosome 22.[39]Le chromosome 8 porte
l'oncogène C-myc. Le rôle exact du produit du gène C-myc
dans la regulation de la croissance cellulaire n'est pas connu. Quelque soit la
translocation, on observe dans les cellules de Burkitt une importante
activation de la transcription de l'oncogène C-myc.[40, 41]
L'activation de cet oncogène n'est que l'une des
étapes de la transformation lymphomateuse qui necessite l'activation
d'autres oncogènes en particulier l'oncogène B-lym.
1.4.2.La forme sporadique
La présentation clinique est presque toujours
abdominale [42,43]. Elle est souvent neuro-méningée, plus
rarement ORL, très rarement maxillaire. L'extension est d'emblée
importante. [44, 45, 46]
1.4.3. Le lymphome de Burkitt lié au sida
Les localisations médullaires et
neuro-méningée prédominent.[47, 48] Il y a une atteinte
multiviscérale d'emblée.
1.5. Bilan d'extension et
préthérapeutique
1.5.1. Bilan d'extension
Le bilan d'extension de la maladie comporte :
- un examen clinique exhaustif : il recherche l'existence de
signes généraux (amaigrissement, fièvre au long cours,
sueurs nocturnes profuses), des signes et symptômes attribuables à
une atteinte ganglionnaire ou extra-ganglionnaire : abdomino-pelvienne,
thoracique ostéo-médullaire ou neurologique.
Les examens paracliniques suivants complètent le
bilan clinique:
- La radiographie du thorax à la recherche de localisation
pulmonaire pleurale ou médiastinale
- L'échographie et/ou un scanner abdominal à la
recherche d'adénopathies abdominales et de localisations
viscérales abdominales
- L'étude cytologique du LCR à la recherche de
localisation neuroméningée
- Le myélogramme ou une biopsie
ostéo-médullaire à la recherche d'un
envahissement médullaire.
Au terme de ce bilan, la maladie de Burkitt est stadifié
selon la classification anatomique de Murphy ainsi qu'il suit:
-Stade I :
atteinte d'un groupe ganglionnaire unique, ou une tumeur unique
extra-lymphatique à l'exclusion du médiastin et de l'abdomen.
-Stade II :
- atteinte de deux ou plusieurs groupes ganglionnaires
d'un seul côté du diaphragme. Une ou deux tumeurs
extralymphatiques avec ou sans envahissement ganglionnaire régional,
d'un seul côté du diaphragme.
- ou une tumeur digestive primitive localisée
sans ou avec seulement l'atteinte du premier relais ganglionnaire
mésentérique et complètement
réséquée.
-Stade III :
- atteintes tumorales de part et d'autre du
diaphragme,
- ou toute tumeur primitive intrathoracique,
- ou toute tumeur abdominale étendue,
- ou tumeur para-spinale.
-Stade IV : Envahissement de la moelle osseuse et/ou
du système nerveux central
1.5.2. Bilan préthérapeutique
comporte :
- La sérologie VIH est systématique
- L'hémogramme,
- La Recherche des troubles métaboliques :
(hyperkaliémie, hypocalcémie,
hyperphosphorémie, hyperuricémie, acidose
lactique) pouvant traduire un
syndrome de lyse tumorale,
- La créatininémie et l'urémie
- Le dosage de transaminases
- Le Groupage sanguin
- L'examen parasitologique des Selles
1.6. Traitement
Le traitement du lymphome de Burkitt repose essentiellement sur
la chimiothérapie. Dès la fin des années 60, des
études ont montré que le lymphome de Burkitt peut être
guéri par la chimiothérapie seule.[15,49, 50, 51]
La chirurgie d'exérèse est vite apparue comme
insuffisante compte-tenu, d'une part de l'importance de la dissémination
tumorale dans la plupart des cas, et d'autre part du taux fréquent de
rechutes même en cas d'exérèse tumorale complète si
une chimiothérapie complémentaire n'était pas
réalisée.[19]
Plus tard, des essais concernant la radiothérapie ont
été effectués, s'avérant décevants et peu
concluants.
La chimiothérapie est basée sur la
différence de sensibilité entre les cellules cancéreuses
et les cellules normales, elle induit des remissions parfois spectaculaires
avec regression de la tumeur et une nette amélioration de l'état
général.
ü La stratégie de traitement repose sur
l'utilisation de polychimiothérapies
intensives et de durée brève.
Dans les pays développés, elle est basée
sur les protocoles LMB (Lymphome Malin B, un protocole français de
traitement des lymphomes B), protocoles en constante évolution. Il
s'agit de protocoles de polychimiothérapie de type CHOP
(cyclophosphamide, adriamycine, vincristine, prednisone) ou ACVBP (adriamycine,
cyclophosphamide, vindésine, bléomycine, prednisine). Ces
protocoles difficiles à mettre en oeuvre en Afrique subsaharienne sont
responsables de périodes d'aplasie médullaire et justifient que
les malades soient hospitalisés dans des services
spécialisés d'oncologie encore rares en Afrique.
Aussi, le protocole de base du LB en Afrique est le protocole
GFA 2005 dit « Cyclo-Burkitt » qui consiste en une
injection intraveineuse de 1,2g/m2 de cyclophosphamide
(ENDOXAN®) associée à une injection intrarachidienne de 15
mg de méthotrexate (METHOTREXATE®) et de 15 mg d'hydrocortisone. En
cas d'échec, un traitement de sauvetage est instauré.
Le protocole de sauvetage est réalisé comme
l'indique le tableau I ci-après.
Tableau I : protocole de sauvetage du Lymphome de
Burkitt
|
COPM
|
2 cycles espacés de 21 jours
|
|
Médicaments
|
Dose et voie d'administration
|
Jour
|
|
Vincristine
Cyclophosphamide
Méthotrexate HD
Acide folinique
Prednisone
Méthotrexate
+ Hydrocortisone
|
2 mg/m² en IV
|
J1
|
|
500 mg/m² en 2 injections IV
|
J2 à J4
|
|
3 g/m² en perfusion
|
J1
|
|
15 mg/m²/6H per os
|
J2 à J5
|
|
60 mg/m² en 2 prises PO ou IV
|
J1 à J7
|
|
MTX :15 mg et HC :15mg en intrarachidien
|
J1 et J6
|
|
CYM
|
2 cycles espacés de 21 jours
|
|
Médicaments
|
Dose et voie d'administration
|
Jour
|
|
Méthotrexate HD
Ledertrexate
+ Hydrocortisone
Acide folinique
Cytarabine
Cytarabine +
Hydrocortisone
|
3 g/m² en perfusion
|
J1
|
|
LTX: 15 mg et HC : 15mg
en intrarachidien
|
J2
|
|
15 mg/m²/6H per os
|
J2 à J5
|
|
100 mg/m²/j en 2 injections SC
|
J2 à J6
|
|
Cytarabine : 30 mg et HC : 15mg
en intrarachidien
|
J7
|
|
COPADM
|
1 cycle
|
|
Médicaments
|
Dose et voie d'administration
|
Jour
|
|
Vincristine
Cyclophosphamide
Adriblastine
Méthotrexate HD
Acide folinique
Prednisone
Méthotrexate+
Hydrocortisone
|
2 mg/m² en IV
|
J1
|
|
1 g/m² en 2 injections IV
|
J2 à J4
|
|
60 mg/m² en IV
|
J2
|
|
3 g/m² en perfusion
|
J1
|
|
15 mg/m²/6H per os
|
J2 à J5
|
|
60 mg/m² en 2 prises PO ou IV
|
J1 à J7
|
|
MTX :15 mg et HC :15mg en intrarachidien
|
J1 et J6
|
|
SEQUENCE
|
1 cycle
|
|
Médicaments
|
Dose et voie d'administration
|
Jour
|
|
Vincristine
Cyclophosphamide
Méthotrexate HD
Acide folinique
Prednisone
Méthotrexate+ Hydrocortisone
|
2 mg/m² en IV
|
J1
|
|
500 mg/m² en 2 injections IV
|
J1 et J2
|
|
3 g/m² en perfusion
|
J1
|
|
15 mg/m²/6H per os
|
J2 à J4
|
|
60 mg/m² en 2 prises PO ou IV
|
J1 à J7
|
|
MTX : 15 mg et HC :15mg en intrarachidien
|
J2
|
ü Les traitements adjuvants comportent entre
autres:
-L'hyperhydratation alcaline au Sérum
bicarbonaté et au glucosé isotoniques
-Les antiémétiques : Primpéran* ou
Zophren*
-Les hypouricémiants : L'allopurinol notamment.
-L'acide folinique (Lederfoline*)
-les antalgiques : Le paracétamol notamment
- les antihelminthiques tels que l'albendazole et le
mébendazole.
En pratique :
- aux stades I et II : 3 cycles de
« Cyclo-Burkitt »
- si rémission complète : arrêt du
traitement et surveillance
- si mauvaise réponse : protocole de sauvetage
- au stade III: 3 cycles de
« Cyclo-Burkitt »
- bonne réponse : 3 cycles supplémentaires
à 15 jours d'intervalle
- mauvaise réponse : protocole de sauvetage
- au stade IV : protocole de sauvetage d'emblée
1.7. Evolution-pronostic et Suivi
Constamment mortel sans traitement, le LB a vu son pronostic
transformé au cours des dernières années. Les taux de
rémission sont de 90% pour le stade I, de 75% pour le stade II, de 70%
pour les stades III et IV chez l'enfant sous polychimiothérapie ;
avec un taux de survie à 90% dans les stades III et IV médullaire
et 70% de survie dans les stades IV avec atteinte du système nerveux
central. [52]
Le Suivi des patients est indispensable. IL permet en
effet d'apprécier l'efficacité du traitement sur les mensurations
de la tumeur et la tolérance du patient d'une part ; de rechercher
et prendre en charge les complications du traitement d'autre part.
Les principales complications à rechercher et
prendre en charge sont :
o En premier lieu, le syndrome de lyse tumorale : c'est
l'association
hyperkaliémie, hyperuricémie,
hyperphosphatémie avec hypocalcémie et augmentation du taux de
LDH dû à l'afflux massif de constituants intracellulaires,
incluant les purines, le potassium et le phosphore, provenant des cellules
tumorales moribondes dans la circulation sanguine, dépassant la
capacité d'excrétion des reins.
Les risques majeurs en sont : la précipitation de
cristaux (urates, phosphates de calcium), l'insuffisance rénale
aiguë, la lithiase urinaire, les troubles de la conduction et arrêt
cardiaque.
Le traitement doit être instauré dans la mesure
du possible préventivement. IL comporte : hyperhydratation
alcaline, hypouricémiant, hypokaliémiant et épuration
rénale au besoin.
La surveillance comporte : Kaliémie,
Phosphorémie, Calcémie, Uricémie, urémie,
créatininémie et LDH sanguin.
o Les autres sont d'ordre :
-digestif : Nausées, vomissements, constipation,
diarrhées, mucites
-dermatologique : alopécie,
-hématologiques : neutropénie, anémie,
thrombopénie,
-hépatique : toxicité hépatique,
- rénale, cardiaque
- infectieuses.
Elles justifient une surveillance clinique basée
sur l'examen général et physique de tous les appareils et d'un
bilan biologique comportant au moins: l'hémogramme, la biologie
rénale, hépatique, l'ionogramme sanguin, la phosphorémie
la calcémie le taux de LDH sanguin. Elle se fera à chaque cure.
Le suivi ultérieur permettra de rechercher une éventuelle
rechute.
2. LE NEPHROBLASTOME DE L'ENFANT
2.1. Définition
Le néphroblastome encore appelé tumeur de Wilms est
une tumeur embryonnaire rénale développée à partir
du blastème du métanéphros qui, normalement sous
l'induction de bourgeon né sur le canal
métanéphrétique, se différencie en tubule et
glomérule. Lorsque cette différenciation ne se fait pas, la
prolifération blastémateuse aboutit à la formation d'une
tumeur constituée de cellules jeunes indifférenciées.
[53]
2.2. Epidémiologie et génétique
La Fréquence du néphroblastome varie de 5
à 26,4% des affections malignes de l'enfant dans la littérature.
[54, 55, 56, 57, 58]
Son incidence est de 1 à 2 cas par an par millions
d'habitants.
Age : C'est une tumeur de la première
enfance survenant le plus souvent entre 1 et 5 ans avec un pic de
fréquence à trois ans et demi.[59]
Sexe : Il atteint aussi souvent le garçon que la
fille.[54, 58, 60]
Facteurs de risque et
étiopathogéniques : [59, 61,62, 63, 64]
² Certaines malformations congénitales sont
associées à un risque accru de survenue d'un
néphroblastome :
- L'aniridie (absence congénitale d'iris)
- Hémihypertrophie corporelle.
- Anomalies génito-urinaires (rein en fer à cheval,
duplicité urétérale)
- Le syndrome de Wiedemann-Beckwith
² Cependant, la plupart des néphroblastomes
surviennent "de novo" chez des enfants dénués
d'antécédents.
² Les anomalies génétiques :
Les taux les plus élevés observés en Afrique
Noire [65, 66] et dans la population Noire des Etats-Unis, la localisation
bilatérale chez 5 à 10% des enfants atteints [67]la
découverte récente du premier gène suppresseur de la
tumeur de Wilms, le WT1, localisé au niveau du chromosome 11p13 [68] et
du second le WT2 au niveau du chromosome 11p15 [69] qui contrôlent la
différenciation du rein au stade embryonnaire et dont des anomalies
pourraient déterminer le développement de la tumeur
suggèrent au néphroblastome une origine plutôt
génétique qu'environnementale.[70, 71, 72, 73]
2.3. Anatomie pathologique
² Macroscopie : Le néphroblastome est une tumeur
volumineuse dont le poids peut dépasser 1000g. Elle est
polylobée, entourée de pseudokyste. Il existe des formes
kystiques (Cystadénome rénal).
² Microscopie :Il s'agit d'une tumeur embryonnaire dont
l'histologie très hétérogène est
caractérisée dans sa forme typique dite triphasique par 3
composantes :[59]
- Une plage de cellules blastémateuses
très indifférenciées
- Une différenciation épithéliale
plus ou moins avancée avec des structures
plus ou moins parfaites de pseudoglomérules
- Un tissu conjonctif tumoral fibroblastique avec une
composante osseuse
cartilagineuse.
Par ailleurs, certains néphroblastomes ne comportent que
un ou deux de ces éléments (formes uni ou biphasiques). [53]
2.4. Diagnostic positif
2.4.1.Circonstance de découverte [57, 63, 74,
75, 76]
² La découverte fortuite (en règle par
parents) ou systématique (par le médecin) d'une masse abdominale
est le mode de révélation habituel (80 %). Il s'agit d'une masse
qui présente classiquement les caractéristiques
suivantes :
- indolore, ferme, lisse.
- volumineuse à développement
antérieur, dans l'hypochondre
- rapidement évolutive
- fragile et devant être examiner avec
précaution car pouvant se rompre
- isolée, chez un enfant en bon état
général.
² La tumeur peut être découverte à
l'occasion de d'autres manifestations cliniques :
- Douleurs abdominales, troubles digestifs :
constipation notamment
- Hématurie, parfois dysurie
- Syndrome abdominal aigu en rapport avec une hémorragie
intra-tumorale
importante ou une rupture intra-péritonéale
- Altération de l'état général
- Anémie
- Fièvre modérée prolongée
- Hypertension artérielle
- Métastases révélatrices : plus
souvent pulmonaires, parfois multiples, et
rarement hépatique, osseuse, cérébrale ou
péritonéale.
2.4.2.Examen clinique complet
² L'examen général : précise
état général qui est en général bon,
l'état nutritionnel, la TA, la taille, le périmètre
ombilical.
² L'examen de l'abdomen note :
-Le plus souvent une tumeur unilatérale et parfois
bilatérale du flanc décrivant une
voussure pouvant dépasser la ligne médiane, ferme
ou dure, classiquement
indolore. Elle est souvent polylobée et volumineuse
dépassant parfois la fosse
iliaque donnant un contact lombaire. [57, 77,
78]
-Une hépatomégalie d'allure tumorale est
possible.
² L'examen des aires ganglionnaires et des autres appareils
recherche des adénopathies superficielles et des métastases
viscérales d'une part et de malformations associées :
aniridie, hémihypertrophie corporelle, malformation urogénitale,
ou macroglossie d'autre part.[64, 77, 63]
2.4.3. Examens paracliniques
2.4.3.1. Biologie[77
Il n'existe pas de signe biologique permettant de porter le
diagnostic de néphroblastome.
² Le dosage des métabolites urinaires des
catécholamines, normal, est systématique pour le diagnostic
différentiel avec le neuroblastome.
² Les autres examens biologiques sont essentiellement
à visée pré-thérapeutique :
- La NFS est souvent normale
- La biologie rénale : urémie et
créatininémie à la recherche d'une insuffisance
rénale
- La biologie hépatique
- Dosage de marqueurs tumoraux : Alpha foeto-proteine en
général normal
2.4.3.2.Imagerie
L'imagerie médicale est d'un apport précieux dans
le diagnostic correct d'une tumeur solide du rein notamment du
néphroblastome. [53, 77]
² L'Echographie abdominale
- Montre une masse tumorale intra rénale, déformant
les contours du rein,
pleine, solide (hyperéchogène), souvent
hétérogène présentant des plages
hypoéchogènes en rapport avec des remaniements
nécrotiques.
- Toute la région abdominale est analysée à
la recherche de ganglions, d'anomalies de l'autre rein, du foie et des
vaisseaux.
² Radiologie de l'abdomen sans préparation (ASP) et
urographie intra-veineuse (UIV)
· Le cliché d'abdomen sans préparation montre
une volumineuse masse opaque qui refoule les clartés intestinales.
· Après opacification on note :
- Une absence d'opacification dans l'enceinte de la
formation tumorale
- Que la tumeur est retro-péritonéale,
car l'urogramme montre l'atteinte
grossière d'un rein dont les cavités
excrétrices sont déplacées et
déformées ;
- Que la tumeur est intra-rénale, car les cavités
excrétrices sont étirées et laminées par la
tumeur
- Dans les formes évoluées, on note un rein
« muet » ou avec excrétion
faible ou retardée
² La tomodensitométrie abdominale
Le scanner, non indispensable au diagnostic confirme les
données de l'échographie en montrant la tumeur
intra-rénale hétérogène. Il confirme la
localisation et l'aspect de la masse rénale et identifie les
éventuelles métastases au foie, les extensions de la tumeur dans
les vaisseaux du rein. Il permet d'éliminer une autre cause de masse
rénale.
² Artériographie : elle n'est pas indispensable
au diagnostic. Elle est
indiquée en cas de rein muet.
2.5.Bilan d'extension [57, 63, 79]
Le néphroblastome au moment du diagnostic est rarement
associé à des métastases. Les métastases
lorsqu'elles existent sont soit pulmonaires (90 %), hépatiques,
abdominales extra-hépatiques, ganglionnaires, osseuses ou
cérébrales. Leur association est possible. Le bilan d'extension
suivant doit être réalisé :
- La radiographie pulmonaire : recherche une opacité
arrondie isolée ou des opacités macronodulaires multiples
réalisant une image en « lâcher de
ballon ».
- Le scanner thoracique n'est pas de routine. Il complète
la radiographie thoracique en cas de besoin.
- Le scanner abdominal : permet d'évaluer l'extension
abdominale en complément de l'échographie abdominale.
- La radiographie du rachis évalue l'extension
rachidienne
- L a scintigraphie osseuse au Technétium 99 est
réalisée en cas de douleur osseuse
2.6. Evolution-Pronostic
² Evolution :
Elle est fonction du développement local et de l'extension
à distance en règle par voie hématogène via le
pédicule rénal, la veine cave inférieure et la circulation
pulmonaire. On assiste à une extension péritonéale,
vasculaire, pulmonaire, hépatique, ganglionnaire, osseuse et
cérébrale. [57, 63, 74,79,80]
² Facteurs pronostic : [58,59, 79, 80, 81, 82]
Ce sont l'âge, le stade d'extension (macroscopique et
histologique) et le type histologique de la tumeur. Les deux derniers facteurs
ne sont donc réunis qu'après l'intervention chirurgicale et
permettent de définir le traitement post-opératoire. Ils
permettent d'adapter l'intensité du traitement au risque
évolutif.
· L'âge : Les formes diagnostiquées
avant l'âge d'un an seraient de bon pronostic. la toxicité de la
chimiothérapie serait la principale cause de mortalité avant
l'âge de 1 an.
· Le stade d'extension tumorale : Il est
défini par les comptes-rendus chirurgical et anatomo-pathologique selon
la classification de la Société Internationale d'Oncologie
Pédiatrique (SIOP).
- Stade I : tumeur limitée au rein, en capsulée,
d'exérèse complète.
- Stade II : tumeur franchissant la capsule rénale mais
dont l'exérèse a été totale.
- Stade III : exérèse incomplète ou tumeur
rompue (par traumatisme biopsie) ou ganglions du hile rénal envahis
- Stade IV : existence de métastases.
- Stade V : néphroblastome
bilatéral.
· La classification histologique
La classification histologique complète la classification
opératoire et permet de définir le traitement qui va suivre la
chirurgie. La chimiothérapie première ne gènepas l'examen
histologique.
On retrouve trois groupes de formes histologiques
différentes: à bas, intermédiaire ou haut risque.
Selon ces formes histologiques, l'attitude thérapeutique
sera différente. Plus le risque est important, plus l'arsenal
thérapeutique utilisé le sera aussi.
2.7. Prise en charge thérapeutique [59, 82, 83, 84,
85, 86]
Le néphroblastome a une très grande
sensibilité à la radiothérapie et à la
chimiothérapie. Les protocoles de traitements sont nombreux. Les plus
courants dans les pays européens sont les protocoles SIOP. Le protocole
adopté en Afrique sub-saharienne et en particulier dans les
unités pilotes du GFAOP est un protocole simplifié du protocole
SIOP 2001. Il comporte trois temps :
2.7.1.Le traitement
pré-opératoire
Le traitement du néphroblastome commence par une
chimiothérapie initiale dite préopératoire. Elle
dépend des cas et suppose un diagnostic radiologique ferme
² Dans les formes localisées, elle
associe entraitement de 4 semaines:
· La vincristine (Oncovin®) : elle est
employée à la dose hebdomadaire de 1,5 mg/m2 en séries de
2, 4 ou 8 injections selon la phase de protocole.
· et l'actinomycine D (Cosmegen®) va été
le premier utilisé avec succès. On l'emploie actuellement
à la dose de 45 ug/m² et par injection, en cures de 3 ou 5 jours.
Cette dose est adaptée au poids et à l'âge.
² Dans lesFormes métastatiques,
traitement de 6 semaines de :
· Vincristine : 1,5 mg/m²
· Actinomycine D : 45 ug/m²
· Doxorubicine (adriamycine ou Adriblastine®) :
elle a amélioré la survie
sans récidive des stades II à IV. Sa
toxicité cardiaque préoccupante, cumulative et à
retardement, accrue par l'irradiation médiastinale, conduit à
réserver son emploi aux formes les plus graves. La dose usuelle est de
50 mg/m2 toutes les 3 ou 4 semaines.
Ces traitements facilitent l'opération en diminuant
notablement la taille de la tumeur.
Toutes ces drogues, différemment associées, ont
des toxicités immédiates variables, mais dans l'ensemble
tolérables. Vomissements et alopéciesont constants, les
neutropéniessouvent courtes, et les traitements ambulatoires en
règle possibles.
2.7.2.La chirurgie
La chirurgie constitue la seconde étape de la
démarche thérapeutique.
Elle est effectuée 8 à 10 jours après la fin
de la chimiothérapie pré-opératoire et consiste en une
néphrectomie totale du rein tumoral.
La voie d'abord est médiane large ou sous costale
longitudinale ou lombotomie : on procède à une ligature
première du pédicule vasculaire, ligature
urétérale, néphrectomie totale puis exploration soigneuse
de la cavité péritonéale et du rein controlatéral,
et curage des ganglions du hile et des ganglions régionaux suspects. La
pièce d'exérèse est acheminé au laboratoire
d'anatomie pathologique pour examen.
2.7.3. Chimiothérapie
post-opératoire
Elle dépend, pour sa composition et sa durée :
- de l'âge du patient ;
- du stade de la tumeur ;
- de sa variété établie à l'examen
microscopique.
Elle associe : Actinomycine D, Vincristine et
Doxorubicine.
2.7.4. Radiothérapie post
opératoire
Le néphroblastome est une tumeur très sensible
à la radiothérapie, à des doses relativement faibles.
La radiothérapie post-opératoire ne peut être
envisagée que si on dispose d'un appareil très précis et
de Radiothérapeutes experts dans la radiothérapie de l'enfant.
Ainsi,
² Si la radiothérapie est disponible :
Irradiation à petite dose du lit tumoral, en fonction des
constatations faites et du risque de résidu tumoral (stade III).
² Si la radiothérapie n'est pas disponible :
On n'en fait pas. Il n'est pas certain qu'une augmentation de la
chimiothérapie postopératoire puisse compenser ce manque.
2.8. Guérison et suivi
Quatre vingt dix pour cent des néphroblastomes peuvent
maintenant être guéris sans séquelles, grâce
notamment à la pratique de la chimiothérapie première. [
83]
Ceci recouvre des réalités quelque peu différentes selon
les stades favorables (100 % de guérison) et les stades à haut
risque (63 % de guérison).
Le suivi des enfants est effectué tous les trimestres
pendant les deux premières années, essentiellement à la
recherche de métastases. Il comporte un examen clinique complet, un
bilan biologique rénal, hépatique et un hémogramme. Une
radiographie pulmonaire et une échographie abdominale sont ré
alisées tous les six mois pendant les 4 premières années
puis tous les ans. [63]
Le suivi les années suivantes, a pour objectif la
recherche de séquelles éventuelles telles : une insuffisance
rénale (surtout lors d'une néphrectomie partielle et/ou d'une
irradiation du rein controlatéral, et d'utilisation de sels de platines)
ou une insuffisance cardiaque.
3. DEFINITION DES CONCEPTS DE COUTS
3.1. Le Coût
Le coût d'un bien ou service
correspond à l'accumulation des charges nécessaires à la
production et la distribution de celui-ci. Pour l'économiste, Il se
rapporte au sacrifice que l'on consent quand on affecte une ressource à
une consommation donnée. [87]
3.2. Le Coût des soins de Santé
Dans le domaine de la santé, on distingue deux
catégories des coûts : D'une part, les coûts
monétaires et d'autre part, les coûts non monétaires.
Le coût monétaire des soins de santé
correspond à l'accumulation des dépenses monétaires
effectuées, premièrement par les individus pour les soins de leur
santé et deuxièmement par les ménages et la
société pour les soins de santé respectivement de leurs
membres et de sa population. [88]
3.3. Le coût direct des soins
Le coût direct est l'ensemble des charges qui, étant
propres à un produit ou à une activité, peuvent lui
être affectées directement sans discussion ni arbitraire, ou qui
peuvent lui être rattachées sans ambiguïté. [89]
Dans le domaine de la santé, les coûts directs sont
des coûts primordiaux qu'un malade est tenu de supporter, tout frais lié directement à
l'administration des soins. [90] Il s'agit notamment des coûts relatifs
aux éléments suivants :
- La consultation : dépenses effectuées
par le malade avant d'accéder au cabinet de
son médecin ;
- Les examens paracliniques : c'est l `ensemble des
frais des examens
complémentaires afin soit de confirmer le diagnostic
posé, évaluer le
retentissement ou l'extension de l'affection, ou à
visée préthérapeutique ;
- Les médicaments : Le malade dépense
aussi dans l'achat des médicaments
prescrits par le médecin après le
diagnostic ;
- Les transports : ceci englobe les frais
occasionnés après le déplacement du
malade du lieu d'habitation vers l'hôpital ;
- L'hospitalisation : les frais du séjour
hospitalier
- Les autres frais tels que le frais de restauration, de
lessive, de toilette, de
vaisselle lors que celui-ci est hospitalier.
3.4. Les coûts indirects
Ils désignent tous les coûts qu'il n'est pas
possible ou dont il est peu pratique d'affecter directement à un
produit, à un service, à une opération ou à un
centre de coûts. [91]
Ils correspondent dans le domaine de la santé à
tous les frais non directement liés à l'administration des soins,
le manque à gagner induit par la maladie. [92]
3.5. Le coût total des soins
Il Correspond à la somme des coûts directs et
indirects des soins payés.
3.6. Le coût moyen des soins
C'est le coût total des soins rapporté au nombre de
patients.
.
DEUXIEME CHAPITRE_______________
![]()
2. METHODOLOGIE
2.1. CADRE D'ETUDE
Notre étude s'est déroulée dans le
service de pédiatrie du centre hospitalier universitaire de Lomé
Tokoin (CHU-Tokoin), en particulier dans l'unité d'infectiologie et
d'onco-hématologie.
Le CHU-Tokoin est un hôpital de référence
de niveau national. Il est situé dans le district sanitaire N° 5 de
Lomé.
2.1.1. Le service de pédiatrie du
CHU-Tokoin
2.1.1.1 Les infrastructures du service de
pédiatrie
Le service de pédiatrie du CHU-Tokoin est un service
ayant une capacité d'accueil de 93 lits et berceaux. Il
comprend :
² deux salles de consultation ;
² une salle de soins externes ;
² une unité de prise en charge des
prématurés située dans un bâtiment du service de
gynécologie et obstétrique ;
² dix pavillons d'hospitalisation dont deux pavillons de
réanimation et un pavillon d'oncologie dénommé
« P1 ».
² une unité de réhydratation par voie
orale, centre intégré de soins aux enfants (URO-CISE) abritant
l'antenne de vaccination ;
² une laiterie ;
² une section de jeux à l'hôpital ;
² un bloc administratif.
2.1.1.2. Le Personnel du service de
pédiatrie
Le service est dirigé par un professeur titulaire de
pédiatrie et subdivisé en 4 unités de soins dont chacune
est sous la responsabilité d'un professeur ou d'un assistant chef de
clinique. Le pavillon d'oncologie pédiatrique est sous la
responsabilité du professeur GBADOE, chef de l'unité
d'infectiologie et d'onco-hématologie.
Le personnel soignant est composé de 8
pédiatres dont 5 professeurs titulaires, 3 assistants chef de
clinique ; des médecins en formation au diplôme
d'études spécialisées de pédiatrie, en nombre
variable; des internes titulaires et stagiaires, en nombre variable
aussi ; 2 surveillants ; 3 assistants médicaux ; 15
infirmières et infirmiers ; 1 technicien supérieur en
orthophonie ; 1 technicien supérieur kinésithérapie,
1 technicien supérieur anesthésie réanimation ; 15
gardes-malades ; 2 secrétaires ; 1 nutritionniste ; 1
archiviste et 1 manoeuvre.
2.1.1.3. Les Activités menées au
sein du service de pédiatrie
Le service de pédiatrie du CHU-Tokoin est le service de
référence en matière de santé de l'enfant au Togo.
On y mène des activités hospitalières notamment : les
consultations pédiatriques générales, les soins
pédiatriques spécialisés, les hospitalisations, les gardes
et les vaccinations. Le service accueille les enfants de 0 à 15 ans
venus de Lomé et de ses environs ainsi que de l'intérieur du
pays. Le nombre d'admission en consultation est estimé à 9000 par
an (soit 24 à 25 admissions en moyenne par jour) dont le tiers est
hospitalisé.
Des activités d'enseignement sont également
menées dans le service, dont l'enseignement de la pédiatrie aux
étudiants de la Faculté Mixte de Médecine et de Pharmacie,
aux étudiants de l'Ecole des Assistants Médicaux, aux
étudiants des écoles paramédicales (Ecole Nationale des
Auxiliaires Médicaux, Ecole des Sages-femmes) et aux médecins
inscrits au DES de pédiatrie. Enfin, de nombreuses activités de
recherche y sont aussi réalisées.
2.1.2. L'unité d'infectiologie et
d'onco-hématologie du service de pédiatrie du CHU-Tokoin et la
prise en charge des patients atteints de cancers
2.1.2.1. Description de l'unité
d'infectiologie et d'onco-hématologie
-Infrastructures : L'unité
d'infectiologie et d'onco-hématologie dispose de deux pavillons
d'hospitalisation dénommés P1 et P2 respectivement et d'un
magasin de stockage des produits.
-Personnel : Le personnel est
composé d'un professeur titulaire de pédiatrie, chef de
l'unité ; de deux médecins en DES de pédiatrie, des
internes en nombre variable et d'infirmiers en service dans le service.
-Activités : l'unité
s'occupe de la prise en charge et du suivi des enfants atteints de maladies
infectieuses, d'hémopathies dont la drépanocytose et de
cancers.
2.1.2.2. La section
« oncologie » de l'unité d'infectiologie et
d'onco-hématologie du service de pédiatrie du CHU-Tokoin
i)-Infrastructures : Le pavillon
d'hospitalisation P1 accueille les enfants atteints de cancers. C'est une salle
commune avec promiscuité des patients, non climatisée ni
ventilée, vétuste comportant : 7 lits et matelas, 1
sanitaire hors usage et une salle de garde pour le personnel soignant.
ii)-Ressources
humaines : avec à sa tête un professeur titulaire de
pédiatrie (le professeur GBADOE), l'équipe soignante est
constituée outre ce dernier d'un médecin en cours de formation au
diplôme d'Etudes Spécialisées de pédiatrie, d'un
interne stagiaire et d'un infirmier du pavillon P10 venant s'occuper des soins
du P1 ainsi que des cures de chimiothérapie et de la surveillance.
iii)-Ressources
matérielles :
Le matériel de soins est composé de :
protecteurs stériles jetables ; gants stériles ;
lunettes ; haricots ; robinets à 3 voies ; bocal pour la
diurèse ; fiches de température ; fiches
spéciales de surveillance clinique et paraclinique; fiches
d'observation, bulletins d'analyse et ordonnanciers avec en en-tête
l'inscription « Prise en charge VICTOiR ».
iv)-Fonctionnement de la section
« Oncologie » et PEC des enfants atteints de
cancers
Au début des activités de la section
« oncologie », la prise en charge des enfants atteints de
lymphome de Burkitt se faisait par le protocole « VACM » et
les frais inhérents à cette prise en charge (examens
complémentaires, antimitotiques, solutés, complications...)
étaient assurés par les parents jusqu'à l'implication
effective de l'association « VICTOiR » en Avril 2006.
? Aide de l'association
« VICTOiR » : Elle a dès lors
consisté en la fourniture d'antimitotiques pour les
chimiothérapies ainsi que certains médicaments destinés
à la gestion des effets secondaires, des poches de culot globulaire et
concentrés plaquettaires pour les transfusions, et en l'obtention
après des négociations avec le service social de la
gratuité des examens paracliniques et de l'hospitalisation.
? Apport du GFAOP : Depuis Juillet
2008 date à laquelle l'unité a reçu un premier lot de
médicaments antimitotiques du GFAOP à la suite d'un plaidoyer
fait par le chef de l'unité auprès du GFAOP, les
médicaments antimitotiques sont fournis par le GFAOP. Cette fourniture
est devenue constante depuis l'adhésion de l'unité au GFAOP en
Mars 2009.
? Les frais de transport, de consultations,
d'alimentation durant l'hospitalisation et de médicaments divers tels
que : les antipaludéens, les antifongiques, les antiviraux et ceux
destinés aux traitements symptomatiques sont à la charge des
parents.
? Prise en charge d'un enfant atteint de cancer
(procédures depuis l'admission jusqu'au traitement)
1-Ouverture d'une chemise en carton avec le nom de l'enfant
malade.
2-Signature par les parents de l'enfant du contrat les liant
à « VICTOiR ».
3-Rédaction du dossier (observation) médical de
l'enfant après examen clinique.
4-Remplissage de la fiche d'observation propre de
l'équipe d'oncologie.
5-Prise d'une Photographie de l'enfant avant le traitement
(une autre est prise à la fin du traitement).
6-Bilan clinique : Taille, Poids, Pouls, Tension
artérielle, examen des différents appareils, localisation et
mensurations des tumeurs accessibles.
7-Démarches munies des bulletins d'analyses à
en-têtes « VICTOiR » aux affaires sociales :
· bilan biologique : cytologie tumorale et/ou
biopsie, sérologie HIV, hépatites, groupage sanguin, recherche de
parasites, ECBU, NFS, LCR, Urémie, Créatininémie, dosage
sanguin d'acide urique, LDH, ionogramme sanguin calcémie
phosphorémie et PH urinaire.
· bilan radiologique : échographie
abdominale, radiographie du thorax...
Notes : -La biopsie en vue de l'examen
anatomo-pathologique se fait soit par un médecin stomatologue ou
oto-rhino-laryngologue et la pièce est acheminée dans le service
d'anatomie pathologique avec le bulletin spécifique. Le double carbone
où figurent le nom, l'âge de l'enfant, la date du
prélèvement est gardé et mis dans la chemise de
l'enfant.
-La ponction cytologique se fait par un
médecin hématologue.
-Tous les résultats sont gardés
dans la chemise de l'enfant
8-Stadage.
9-la décision de commencer les cures de
chimiothérapie chez l'enfant est prise par l'équipe d'oncologie,
un mail est envoyé sur le site de « VICTOiR » pour
en informer l'association.
10-Prise en charge médicamenteuse
Tous les médicaments dont l'enfant aura besoin tout au
long des cures, doivent être prescrits sur les ordonnanciers de
« VICTOiR ».
Le double carbone est alors accompagné de la facture
des médicaments achetés et mis dans la chemise de l'enfant ;
ceux pris dans le stock octroyé par le GFAOP ou
« VICTOiR » sont notés.
11-Surveillance clinique et paraclinique
2.1.2.3. Protocole de traitement du lymphome de
Burkitt dans l'unité : le protocole
« cyclo-Burkitt »
i)-stade I, II : 3 injections de
cyclophosphamide 1,2 g/m2 à 8 jours d'intervalle
etassociée à une injection intrarachidienne de 15 mg de
méthotrexate et de 15 mg d'hydrocortisone.
* si rémission complète : arrêt
du traitement et surveillance
* si mauvaise réponse : protocole de
sauvetage (tableaux I et II)
ii)-stade III: 3 cycles de
« Cyclo-Burkitt » et,
*Si bonne réponse : 3 cycles
supplémentaires à 15 jours d'intervalle
*Si mauvaise réponse : protocole de
sauvetage
iii)-stade IV : protocole de sauvetage
d'emblée
2.1.2.4. Protocole de traitement du
néphroblastome dans l'unité
i)-Chimiothérapie
préopératoire
-Formes localisées (stades I, II et
III) : Actinomycine D : 45 ìg/Kg en IV à S1,
S3 + Vincristine : 1,5 mg/m2 en IV à S1, S2, S3 et
S4.
- Formes métastatiques (stades
IV) :Actinimycine D : 45 ìg/Kg en bolus IV à
S1, S3, S5 + Vincristine : 1,5 mg/m2 en IV de S1 à S6 +
Adriblastine : 50mg/m2 en perfusion pendant 6h.
ii)-Chirurgie
iii)-Chimiothérapie
post-opératoire :
- Stade I: Actinomycine D: 45 ìg/Kg en
bolus IV à S2, S7 + Vincristine: 1,5mg/m2
à S1, S2, S3, S4, S6, S7, S8 et S9
- Stade II, III:Actinomycine D: 45
ìg/Kg à S2, S4, S6, S8, S11, S14, S17,S20, S23, S26.+
Vincristine: 1,5mg/m2 de S1 à S8, S11, S12, S14, S15, S17,
S18, S20, S21, S23, S24, S26 et S27 + Adriblastine: 50mg/m2 à
S2, S6, S11, S17, S23
- Stade IV: Chimiothérapie
première à 3 drogues pendant 6 semaines, chirurgie, si
métastasectomie complète et enfin chimiothérapie à
3 drogues comme les stades III.
2.2. PATIENTS ET METHODE D'ETUDE
2.2.1. Patients
Notre étude a porté sur les dossiers d'enfants
d'âge inférieur ou égal à 15 ans,
hospitalisés dans le pavillon d'oncologie du service de pédiatrie
du CHU-Tokoin soit pour lymphome de Burkitt, soit pour néphroblastome
pendant la période d'étude.
2.2.1.1. Critères d'inclusion
Pour être inclus dans notre étude, le dossier des
patients devait rassembler les critères suivants:
- Preuve histologique et/ou cytologique du diagnostic de
lymphome de Burkitt ou de néphroblastome ;
- Examens paracliniques initiaux et de suivi
honorés avec preuves des dépenses
effectuées à l'appui ;
- Ordonnances prescrites et honorées avec preuves
des dépenses effectuées ;
- Et traitement bien observé
2.2.1.2.Critères de non
inclusion
N'ont pas été inclus dans notre
étude :
- Les cas de lymphome de Burkitt ou néphroblastome
diagnostiqués chez les patients âgés de plus de 15
ans ;
- Les cas suspects de lymphome de Burkitt ou de
néphroblastome mais sans confirmation anatomo-pathologique du
diagnostic ;
- Les dossiers de patients n'ayant pas honoré les
bilans paracliniques demandés et/ ou les traitements prescrits.
2.2.2. Méthode
2.2.2.1. Type et période
d'étude
Il s'agit d'une série de cas d'enfants atteints de
lymphome de Burkitt ou de néphroblastome hospitalisés dans le
pavillon d'oncologie du service de pédiatrie du CHU-Tokoin du
1er Juin 2008 au 31 Juillet 2010 (soit une période de 26
mois).
2.2.2.2. Collecte des données
Deux fiches d'enquête ontété
élaborées en vue de la collecte des données
nécessaires à la réalisation de ce travail: l'une portant
sur le lymphome de Burkitt et l'autre sur le néphroblastome. Chacune de
ces fiches d'enquête prenait en compte tous les paramètres
médico-économiques inhérents à la prise en charge
de l'affection cible. (Cf. Annexe 2)
Le recueil des informations a été fait à
partir des dossiers médicaux d'hospitalisation et de suivi des patients
et les sources de valorisation des coûts (reçus d'examens
biologiques et d'imagerie, tickets-factures de pharmacie). Les données
manquantes ont été obtenues grâce aux entretiens tenus avec
les parents en charge des patients.
La rémission complète a été
affirmée par la disparition du syndrome tumoral.
2.2.2.3.Variables étudiées
-Variables sociodémographiques : âge, sexe,
provenance, responsable de la PEC de l'enfant.
-Variables cliniques, paracliniques et thérapeutiques
liées à l'hospitalisation et au suivi : mode et motif
d'admission, délai d'évolution avant la première
consultation, état général, siège et stade du
cancer, examens complémentaires réalisés, traitements
reçus, et le mode de sortie des patients.
-Variables économiques : frais de transport, frais
de consultations, frais d'alimentation durant le séjour hospitalier,
frais de séjour hospitaliers, frais des actes et examens paracliniques
et les frais pharmaceutiques au cours de l'hospitalisation et du suivi.
2.2.2.4.Calcul des coûts
i)- Coûts unitaires et sources de
valorisation
Les antimitotiques et certains antibiotiques ont
été pourvus par le GFAOP. De ce fait, le coût des
antimitotiques et celui de ces antibiotiques a été estimé
à partir du prix de vente en officine au Togo et en cas de besoin
à l'aide du dictionnaire Vidal 2007.
Les sources utilisées pour la valorisation des
différentes lignes de dépense sont rapportées dans le
tableau III.
Tableau III: Source de valorisation par
ligne de dépense
|
Source de valorisation
|
|
Transport
Tarifs de transport public
Hospitalisation
Reçu des frais d'hospitalisation
Consultation
Reçu des frais de l'acte
Examens biologiques Reçu
des frais de l'examen biologique
Examens radiologiques Reçu
des frais de l'examen d'imagerie
Antimitotiques Dictionnaire
Vidal 2007/Prix en officine
Médicaments divers
Ticket-facture de pharmacie
Acte Chirurgical
Reçu des frais de l'acte
|
ii)- Coûts directs de la prise en
charge
² Le coût direct global individualisé de la
prise en charge durant l'hospitalisation correspondait à l'ensemble des
dépenses dévolues:
- au transport de l'enfant malade et son accompagnant du
domicile à l'hôpital, et au retour à domicile;
- aux différentes consultations effectuées dans
le cadre de la PEC initiale du malade. La consultation en pédiatrie
générale coûte en moyenne 1200 F CFA. Dans les services
spécialisés, la consultation est de : 2700 F CFA ;
- aux actes et examens complémentaires
réalisés pendant l'hospitalisation;
- aux médicaments et aux «consommables» tels
que : gants, perfuseurs et seringues, bande et cathéter veineux,
utilisés à chacune des étapes de la prise en
charge ;
- au séjour hospitalier : 2000 FCFA la journée
en salle commune dans le pavillon d'oncologie pédiatrique ;
- et à l'alimentation au cours de
l'hospitalisation.
² Le coût direct global individualisé de la
prise en charge après la sortie de l'hôpital correspondait
à la somme du coût direct global de la prise en charge durant
l'hospitalisation et de celui du suivi.
² Le coût moyen des différentes lignes de
dépense a en outre été évalué par la moyenne
des dépenses effectuées par l'ensemble des patients qui avaient
la variable exprimée.
Les coûts ont été calculés et
exprimés en moyenne #177; écart type et en franc CFA.
2.2.2.5. Analyse des données
- La saisie et l'analyse des donneés ont
été réalisées par le logiciel Epi-info version
6.0.4.
- Les textes et tableaux ont été faits par
Microsoft-Office WORD 2007.
1. LYMPHOME DE BURKITT
1.1. Données générales
Au cours de notre période d'étude, 9
590 patients âgés de 0 à 15 ans ont
été hospitalisés dans le service de pédiatrie du
CHU-Tokoin. Parmi ceux-ci, 35 patients présentaient
une affection maligne soit une fréquence de 0,36% des
hospitalisations en pédiatrie. 8 cas de lymphome de
Burkitt ont été recensées durant cette période ce
qui correspond à une fréquence de 0,08% des
hospitalisations et 22,8% des cancers de l'enfant. Six
(6) patients soit 75% des patients atteints de lymphome de Burkitt
durant notre période d'étude répondaient à nos
critères d'inclusion et ont été retenus pour notre
étude.
1.2. Données sociodémographiques
1.2.1. L'âge
L'âge moyen de nos patients était de 7,5
#177;2,7 ans avec des extrêmes de 3 et
11 ans.
Quatre patients avaient un âge compris entre 6 et 10ans
comme le montre la figure1.
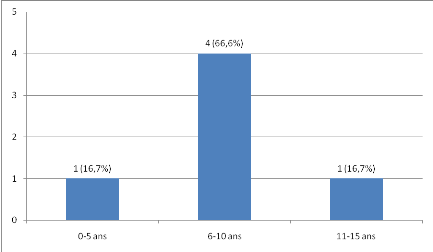
Figure 1 : Répartition des patients atteints
de lymphome de Burkitt selon l'âge
1.2.2. Répartition des patients selon le
sexe
Il existait une prédominance masculine avec une sex-ratio
de 5. (Figure 1)
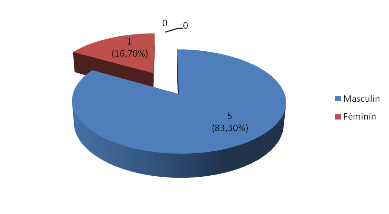
Figure 1: Répartition des patients selon le
sexe
1.2.3. Provenance
Deux patients (soit 33,3%) sont venus de la région
centrale du Togo comme le montre la figure 2.
Aucun patient n'est venu de Lomé commune ainsi que de la
région des savanes.
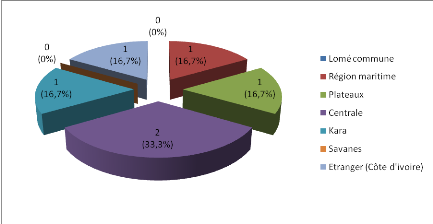
Figure 2 : Répartition des patients selon la
provenance
1.2.4 Prise en charge
Les frais de transport, de consultation, d'alimentation et de
médicaments divers essentiellement composés
d'antipaludéens, antifongiques, antiviraux et de traitements
symptomatiques ont été à la charge des parents dans tous
les cas comme le montre le tableau .
Tableau : Répartition des patients atteints
de lymphome de Burkitt selon la personne responsable de la PEC
financière et par poste de dépense
|
GFAOP
n (%)
|
VICTOIR
n (%)
|
Mercy Ships
n (%)
|
Parents
n (%)
|
|
Transport
|
-
|
-
|
-
|
6 (100)
|
|
consultation
|
-
|
-
|
-
|
6 (100)
|
|
Examens paracliniques
|
-
|
6 (100)
|
2 (33,3)
|
1 (16,7)
|
|
Antimitotiques
|
6 (100)
|
1 (16,7)
|
-
|
-
|
|
Antibiotiques
|
5 (83,3)
|
2 (33,3)
|
-
|
-
|
|
Produits sanguins
|
-
|
6 (100)
|
-
|
-
|
|
Solutés et consommables
|
-
|
6 (100)
|
-
|
2 (33,3)
|
|
Antiémétiques
|
-
|
5 (83,3)
|
-
|
1 (16,7)
|
|
Autres médicaments
|
-
|
-
|
-
|
6 (100)
|
|
Alimentation
|
-
|
-
|
-
|
6 (100)
|
|
Hospitalisation
|
-
|
6 (100)
|
-
|
-
|
1.3. Aspects cliniques
1.3.1. Motif de consultation
La tuméfaction maxillo-faciale a constituée le
motif de consultation le plus fréquent avec 83,3%. Elle
était suivie par les douleurs et mobilités dentaires dans deux
cas (soit 33,3%) comme le montre le tableau II.
Tableau II : Répartition des patients selon
le motif de consultation
|
Effectif (n=6)
|
Pourcentage (%)
|
|
Tuméfaction maxillo-faciale
|
5
|
83,3
|
|
Tuméfaction latérocervicale
|
1
|
16,7
|
|
Douleurs et mobilité dentaires
|
2
|
33,3
|
|
Dyspnée
|
1
|
16,7
|
1.3.2. Délai d'évolution avant la
consultation
Le délai moyen d'évolution avant la consultation
était de 4,3#177; 4 mois avec des extrêmes de 7
semaines et 12 mois.
Les patients au stade 3 ont en moyenne consulté plus
tardivement avec un délai moyen d'évolution avant la consultation
de 5,4#177; 4,6 mois comme le montre le tableau III.
Tableau III : Délai moyen d'évolution
avant la consultation par stade
|
Délai moyen d'évolution
(Mois)
|
Ecart type
(Mois)
|
|
Stade 1
|
2
|
1,4
|
|
Stade 2
|
-
|
-
|
|
Stade 3
|
5,4
|
4,6
|
|
Stade 4
|
-
|
-
|
1.3.3. Etat général
Trois patients (soit 50%) avaient un bon état
général à l'entrée comme le montre la figure 3.
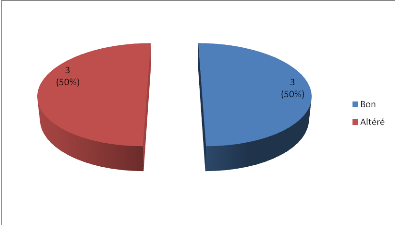
Figure 3 : Répartition des
patients selon l'état général
Les trois patients (50%) avec un état
général altéré à l'entrée
étaient au stade 3 de la classification de Murphy du lymphome de Burkitt
comme le montre le tableau IV.
Tableau IV : Répartition des patients en
fonction de l'état général et du stade
|
Stade 1
|
Stade 2
|
Stade 3
|
Stade 4
|
|
Bon
|
2 (33,3)
|
-
|
1 (16,7)
|
-
|
|
Altéré
|
-
|
-
|
3 (50)
|
-
|
|
Total
|
2 (33,3)
|
-
|
4 (66,7)
|
-
|
1.3.4. Etat nutritionnel
Deux patients (soit 33,3%) dans notre série étaient
malnutris. Un avait une malnutrition aigue sévère et un autre une
malnutrition aigue modérée.
1.3.5. Topographie de la tumeur
La localisation maxillo-faciale prédominait avec une
fréquence de 83,3% comme le montre le tableau V.
Tableau V : Répartition des patients selon la
localisation de la tumeur
|
Effectif
n=6
|
Pourcentage
%
|
|
Maxillo-faciale
|
5
|
83,3
|
|
Ganglion périphérique
|
2
|
33,3
|
|
Abdominale
|
4
|
66,6
|
|
Thoracique
|
1
|
16,7
|
La localisation tumorale par malade est rapportée dans le
tableau ci-après.
Tableau : Localisation tumorale par
patient
|
Age (an)
|
Sexe
|
localisations
|
|
Cas1
|
9
|
F
|
Maxillaires droits+Oculaire droite+ Abdominale
|
|
Cas 2
|
7
|
M
|
Maxillaire supérieur gauche+ Abdominale + thoracique
cardiaque+ ganglionnaire inguinale gauche
|
|
Cas 3
|
8
|
M
|
Ganglionnaire cervicale droite+ Abdominale
|
|
Cas 4
|
3
|
M
|
Mandibulaire gauche
|
|
Cas 5
|
7
|
M
|
Maxillaire supérieur droit
|
|
Cas 6
|
11
|
M
|
Maxillaire supérieur gauche+ Abdominale
|
1.3.6. Stade du lymphome de Burkitt selon la
classification de Murphy
La plupart de nos patients (66,7%)
étaient au stade 3 de la classification de Murphy. (Tableau VI)
Tableau VI : Répartition des patients selon
le stade
|
Effectif
|
Pourcentage %
|
|
Stade 1
|
2
|
33,3
|
|
Stade 2
|
-
|
-
|
|
Stade 3
|
4
|
66,7
|
|
Stade 4
|
-
|
-
|
|
Total
|
6
|
100
|
1.4. Coût de la prise en charge
1.4.1. Coûts spécifiques
1.3.1.1. Transport
Le coût moyen du transport aller-retour dans la
série était de 40 583, 3#177; 60 314,5
FCFA avec des extrêmes de 2 500 et
160 000 FCFA.
1.3.1.2. Frais de séjour hospitalier
² Durée d'hospitalisation
La durée moyenne d'hospitalisation dans notre série
était de 163,5#177; 46,1 jours avec des extrêmes de 119 et 223
jours.
² Frais de séjour hospitalier
Les frais d'hospitalisation variaient de 238 000
à 446 000 FCFA avec une moyenne de
326 666,7#177; 91 788,7 FCFA.
Le tableau VII rapporte les Frais de séjour moyen par
stade.
Tableau VII : Frais de séjour moyen par
stade.
|
Frais de séjour moyen (FCFA)
|
Ecart type (FCFA)
|
|
Stade 1
|
251 000
|
18 384,8
|
|
Stade 2
|
-
|
-
|
|
Stade 3
Stade 4
|
364 500
-
|
90 574,1
-
|
1.3.1.3. Frais de Consultation
Les frais de la consultation initiale étaient de
3 166,7#177; 1 179,3 FCFA avec des extrêmes de
1200 et 3900 FCFA.
1.3.1.4. Coût du bilan initial
Le coût du bilan initial variait de 108
160 à 126 860 FCFA avec une moyenne de
114 026,7 #177; 6 742,8 FCFA.
Le tableau VIII rapporte le coût moyen du bilan initial en
fonction du stade du lymphome de Burkitt.
Tableau VIII : coût moyen du bilan initial par
stade.
|
Coût moyen du bilan initial (FCFA)
|
Ecart type
(FCFA)
|
|
Stade 1
|
111 685
|
3 005,2
|
|
Stade 2
|
-
|
-
|
|
Stade 3
Stade 4
|
115 197,5
-
|
8 202,6
-
|
1.3.1.5. Coût des médicaments
antimitotiques
Le coût moyen des antimitotiques était de
739 054,2#177; 120 119 FCFA avec des extrêmes
de 588 825 et 950 680 FCFA.
Le coût moyen des antimitotiques par stade est
rapporté dans le tableau IX.
Tableau IX : Coût moyen des antimitotiques par
stade.
|
Coût moyen des antimitotiques (FCFA)
|
Ecart type (FCFA)
|
|
Stade 1
|
662 917,5
|
104 782,6
|
|
Stade 2
|
-
|
-
|
|
Stade 3
|
777 122,5
|
120 793,3
|
|
Stade 4
|
-
|
-
|
1.3.1.6. Coût des traitements adjuvants
Le coût moyen des traitements adjuvants était de
267 657,5 #177; 54 977,4 FCFA avec des extrêmes de
212 545 et 367 645 FCFA.
Le coût moyen des traitements adjuvants par stade est
rapporté dans le tableau X
Tableau X : Coût moyen des traitements
adjuvants par stade
|
Coût moyen (FCFA)
|
Ecart-type (FCFA)
|
|
Stade 1
|
224 137,5
|
16 394,3
|
|
Stade 2
|
-
|
-
|
|
Stade 3
|
289 417,5
|
55 262,4
|
|
Stade 4
|
-
|
-
|
1.3.1.7. Coût du traitement des
complications
Le coût moyen du traitement des complications était
de 343 431,7 #177; 305 428,4 FCFA avec des
extrêmes de 49 950 et 637 030
FCFA.
Le coût moyen des antibiotiques représentait 74,8%
(256 761,7 FCFA) du coût moyen du traitement des complications
(Tableau X). Le coût des divers (42 253,3 FCFA soit 5,7%)
était essentiellement composé du coût
d'antipaludéens, d'antifongiques ou d'antiviraux.
Tableau X : coût moyen des principaux groupes
thérapeutiques et part respective dans la structure du coût moyen
du traitement des complications
|
Coût moyen (FCFA)
|
Pourcentage (%)
|
|
Antibiotiques
|
256 761,7
|
74,8
|
|
Produits sanguins
|
44 416,7
|
12,9
|
|
Divers
|
42 253,3
|
12,3
|
|
Total
|
343 431,7
|
100
|
Le coût moyen du traitement des complications pour les
patients au stade 3 était de 479 022,5 #177; 286 248,1
FCFA avec des extrêmes de 49 950 et
637 030 FCFA comme le montre le tableau XI.
Tableau XI : Coût moyen du traitement des
complications par stade
|
Coût moyen (FCFA)
|
Ecart type (FCFA)
|
|
Stade 1
|
72 250
|
0
|
|
Stade 2
|
-
|
-
|
|
Stade 3
|
479 022,5
|
286 248,1
|
|
Stade 4
|
-
|
-
|
1.3.1.8. Coût du bilan paraclinique de surveillance
per-cures
La surveillance paraclinique des patients au cours des cures de
chimiothérapie anticancéreuse a coûté entre
341 740 et 590 350 FCFA. Son
coût moyen était de 431 871,7 #177; 100 296,9
FCFA.
Le tableau XII rapporte le coût moyen du bilan paraclinique
de surveillance per-cures de chimiothérapie par stade.
Tableau XII : Coût moyen du bilan paraclinique
de surveillance per-cures par stade
|
Coût moyen (FCFA)
|
Ecart type (FCFA)
|
|
Stade 1
|
380 415
|
31 925,9
|
|
Stade 2
|
-
|
-
|
|
Stade 3
|
457 600
|
117 380,7
|
|
Stade 4
|
-
|
-
|
1.3.1.9. Alimentation durant le séjour
hospitalier
Le coût moyen de l'alimentation durant le séjour
hospitalier était de 267 833,3 #177; 110 855,1
FCFA avec des extrêmes de 107 100 et
436 000 FCFA.
1.4.2. Coûts directs globaux
1.3.1.10. Coût direct global moyen de la prise en
charge à la sortie de l'hôpital et part respective des
différentes lignes de dépense dans sa structure
² coût direct global moyen de la prise en charge du
lymphome de Burkitt à la sortie de l'hôpital
Le coût direct global moyen de la prise en charge (PEC) du
lymphome de Burkitt à la sortie de l'hôpital était de
2 534 291 #177; 703 922,5 FCFA et des
extrêmes de 1 747 170 et 3 504 795 FCFA.
Le tableau XIII rapporte le coût direct global moyen de la
prise en charge du lymphome de Burkitt à la sortie de l'hôpital
par stade.
Tableau XIII : Coût direct global moyen de la
prise en charge du lymphome de Burkitt à la sortie de l'hôpital en
fonction du stade
|
CDGMS* (FCFA)
|
Ecart type (FCFA)
|
|
Stade 1
|
1 902 855
|
220 171,8
|
|
Stade 2
|
-
|
-
|
|
Stade 3
|
2 850 010
|
641 072,6
|
*CDGMS= Coût direct global moyen de la prise en charge
à la sortie de l'hôpital.
² Part respective des différentes lignes de
dépense dans la structure du CDGMS
Le coût des médicaments antimitotiques a
représenté 29,16% du Coût direct global moyen de la
prise en charge du lymphome de Burkitt à la sortie de
l'hôpital.
La figure 4 montre la part de chaque ligne de dépense dans
la structure du Coût direct global moyen de la prise en charge du
Lymphome de Burkitt à la sortie de l'hôpital.
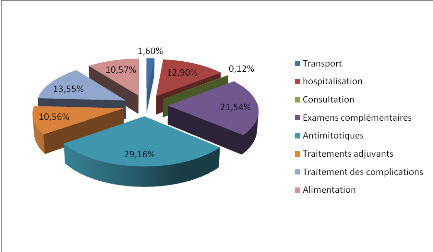
Figure 5 : Part respective de chaque ligne de dépense
dans la structure du coût direct global moyen de la prise en charge du
lymphome de Burkitt à la sortie de l'hôpital
1.3.1.11. Coût direct global moyen de la PEC
après l'exéat
Le coût direct global moyen de la PEC du lymphome de
Burkitt après l'exéat est rapporté dans le tableau
XIII.
Tableau XIV: Coût du suivi et coût direct
global moyen de la prise en charge du lymphome de Burkitt à 1mois, 12
mois et 24 mois post-exéat.
|
Coût du suivi
(FCFA)
|
Coût direct global moyen de la PEC (FCFA)
|
|
A 1 Mois post-exéat
|
68 525#177; 38 502
|
2 850 192,5 #177; 1 061 158,7
|
|
A 12 Mois post-exéat
|
62 010
|
2 815 765
|
|
A 24 Mois post-exéat
|
101 560
|
2 855 315
|
2. LE NEPHROBLASTOME
2.1. Données générales
Parmi les 9 590 patients hospitalisés
dans le service de pédiatrie du CHU-Tokoin durant notre période
d'étude, 7 cas de néphroblastome ont
été recensés soit une fréquence de
0,07% des hospitalisations et 20% des cancers
de l'enfant. Ces Sept (7) patients répondaient à nos
critères d'inclusion et ont de ce fait été retenus pour
notre étude.
2.2. Données sociodémographiques
2.2.1. Age
La moyenne d'âge de nos patients au moment du diagnostic
était de 4,7#177; 3,1 ans avec des extrêmes de
7 mois et 9 ans. Plus de la moitié de nos patients
(quatre patients soit 57,1%) avaient un âge compris entre 0 et 4 ans
comme le montre la figure 6.
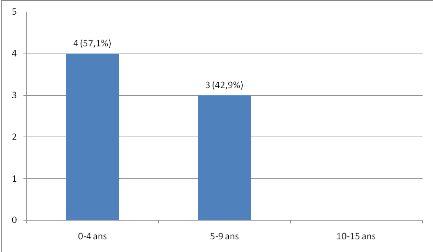
Figure 6 : Répartition des patients atteints
de néphroblastome selon l'âge
2.2.2. Répartition des patients selon le
sexe
Nous avons noté une prédominance masculine avec une
sex-ratio de 2,5. (Figure 5)
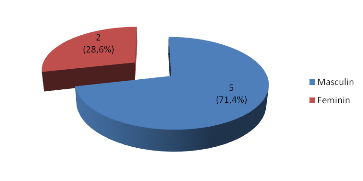
Figure 7: Répartition des patients selon le
sexe
2.2.3. Provenance
Cinq patients (soit 71,4%) venaient de la région maritime
du Togo. Deux patients (soit 28,6%) venaient de Lomé commune.
2.2.4. Prise en charge
Les frais de transport, de consultation, d'alimentation et de
médicaments divers essentiellement composés
d'antipaludéens, et de traitements symptomatiques divers ont
été à la charge des parents dans tous les cas comme le
montre le tableau .
Tableau : Répartition des patients atteints
de néphroblastome selon la personne responsable de la PEC
financière et par poste de dépense
|
GFAOP
n (%)
|
VICTOIR
n (%)
|
Parents
n (%)
|
|
Transport
|
-
|
-
|
7 (100)
|
|
consultation
|
-
|
-
|
7 (100)
|
|
Examens paracliniques
|
-
|
7(100)
|
2 (28,6)
|
|
Antimitotiques
|
7 (100)
|
-
|
-
|
|
Antibiotiques
|
6 (85,7)
|
3 (42,8)
|
4 (57,1)
|
|
Produits sanguins
|
-
|
7 (100)
|
2 (28,6)
|
|
Solutés et consommables
|
-
|
7 (100)
|
3 (42,8)
|
|
Antiémétiques
|
-
|
7 (100)
|
1 (16,7)
|
|
Autres médicaments
|
-
|
-
|
7 (100)
|
|
Chirurgie
|
-
|
6 (85,7)
|
1 (16,7)
|
|
Alimentation
|
-
|
-
|
7 (100)
|
|
Hospitalisation
|
-
|
7 (100)
|
1 (16,7)
|
2.3. Aspects cliniques
2.3.1. Motif de consultation
La distension abdominale était le motif de consultation le
plus fréquent. Elle était retrouvée chez cinq
patients (soit 71,4% des cas), suivie par la masse abdominale
découverte par les parents chez quatre patients (soit 57,1%) comme le
montre le tableau XV.
Tableau XV : Répartition des patients selon
le motif de consultation
|
Effectif (n=7)
|
Pourcentage (%)
|
|
Masse abdominale
|
4
|
57,1
|
|
Distension abdominale
|
5
|
71,4
|
|
Douleur abdominale
|
3
|
42,8
|
2.3.2. Délai d'évolution de la tumeur
avant la consultation
Le délai moyen d'évolution de la tumeur avant la
première consultation était de 3,18#177; 3,09
mois avec des extrêmes de 1 semaine et
8 mois.
2.3.3. Etat général
Quatre patients (soit 57,1%) avaient un état
général altéré au moment du diagnostic comme la
montre la figure 6.
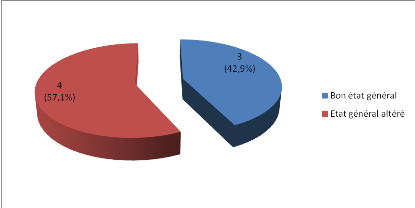 Figure 8 : Répartition des patients selon
l'état général au moment du diagnostic Figure 8 : Répartition des patients selon
l'état général au moment du diagnostic
L'état général au moment du diagnostic
était altéré chez tous les patients avec un
néphroblastome à un stade avancé (stade 3 ou 4) comme le
montre le tableau XVI.
Tableau XVI : Répartition des patients en
fonction de l'état général et selon le stade au moment du
diagnostic
|
Stade 1
|
Stade 2
|
Stade 3
|
Stade 4
|
|
n (%)
|
n (%)
|
n (%)
|
n (%)
|
|
Bon
|
-
|
3 (42,8)
|
-
|
-
|
|
Altéré
|
-
|
1 (14,3)
|
1 (14,3)
|
2 (28,6)
|
|
Total
|
-
|
4 (57,1)
|
1 (14,3)
|
2 (28,6)
|
2.3.4. Forme clinique évolutive du
néphroblastome
La plupart de nos patients (71,4%) avait une forme clinique
localisée comme le montre le tableau XVII.
Tableau XVII : Répartition des patients selon
la forme clinique évolutive du néphroblastome
|
Effectif
|
Pourcentage (%)
|
|
Forme localisée
|
5
|
71,4
|
|
Forme métastatique
|
2
|
28,6
|
|
Total
|
7
|
100
|
2.3.5. Localisation de la tumeur
La localisation rénale unilatérale droite
prédominait dans notre série avec une fréquence 71,4%. Il
n'y a pas eu de néphroblastome bilatéral.
Les métastases étaient hépatique dans un cas
et pleurale dans un autre comme le montre le tableau XVIII.
Tableau XVIII : Répartition des patients
selon la localisation tumorale
|
Effectif
|
Pourcentage (%)
|
|
Tumeur rénale gauche localisée
|
2
|
28,6
|
|
Tumeur rénale droite localisée
|
3
|
42,8
|
|
Tumeur rénale droite + métastase
hépatique
|
1
|
14,3
|
|
Tumeur rénale droite +métastase pleurale droite
|
1
|
14,3
|
|
Total
|
7
|
100
|
2.4. Aspects thérapeutiques
2.4.1. Chimiothérapie
préopératoire
Tous les sept patients (100%) ont bénéficié
d'une chimiothérapie préopératoire.
En moyenne 5#177;0,7cures à actinomycine D et Vincristine
pour les formes localisées (71,4%) et 6 cures à Actinomycine D,
Vincristine et Doxorubicine pour les formes métastatiques.
2.4.2. Néphrectomie
Six patients (85,7%) ont bénéficié d'une
néphrectomie totale homolatérale à la lésion
tumorale. Plus de la moitié des patients (Quatre patients soit 66,6% des
patients opérés) avaient un néphroblastome au stade 2
comme le montre le tableau XIX.
Le patient non opéré avait une forme clinique
métastatique ce qui équivaut à un néphroblastome
stade 4 opératoire.
Tableau XIX : Répartition des patients
opérés selon le stade chirurgical du
néphroblastome
|
Effectif
|
Pourcentage (%)
|
|
Stade 1
|
-
|
-
|
|
Stade 2
|
4
|
66,6
|
|
Stade 3
|
1
|
16,7
|
|
Stade 4
|
1
|
16,7
|
|
total
|
6
|
100
|
2.4.3. Chimiothérapie post
opératoire
Cinq patients dans notre série (71,4%) ont reçu une
chimiothérapie postopératoire. Les deux autres patients sont
décédés : l'un avant la chirurgie et l'autre juste
après la chirurgie.
La chimiothérapie a consisté dans tous les cas en
20 cures sur une durée de 27 semaines dans tous les cas.
2.5. Coûts de la prise en charge
2.5.1. Coûts spécifiques
2.4.1.1. Transport
Les frais de transport aller et retour entre le domicile et
l'hôpital ont varié entre 500 et 4 000 FCFA avec une moyenne de
2 542,9#177; 1 236,7FCFA.
2.4.1.2. Consultation
Les frais dévolus à la consultation initiale
variaient de 1200 à 6 200 FCFA avec une moyenne de
2 871,4#177; 1 670 FCFA.
2.4.1.3. Coût du bilan paraclinique initial
Le bilan paraclinique initial a coûté en moyenne
83 422,9#177; 30 040,7 FCFA avec des extrêmes de
59 110 et 143 160 FCFA.
Le coût moyen du bilan paraclinique initial a
été rapporté dans le tableau XX ci-après.
Tableau XX : Coût moyen du bilan paraclinique
initial par stade
|
CMBI* (FCFA)
|
Ecart type
|
|
Stade 1
|
-
|
-
|
|
Stade 2
|
77 845
|
17 875,7
|
|
Stade 3
|
70 310
|
0
|
|
Stade 4
|
101 135
|
59 432,3
|
*CMBI : Coût moyen du bilan paraclinique initial
2.4.1.4. Coût des antimitotiques pour la
chimiothérapie préopératoire
Les médicaments antimitotiques pour la
chimiothérapie préopératoire ont coûté en
moyenne 150 228,6#177; 71 249 FCFA avec des
extrêmes de 83 840 et 281 880
FCFA.
Les antimitotiques pour la chimiothérapie
préopératoire ont coûté en moyenne
239 025#177; 60 606,1 FCFA dans les formes
métastatiques comme le montre le tableau XXI.
Tableau XXI : Coût moyen des antimitotiques
pour la chimiothérapie préopératoire par forme
évolutive de néphroblastome
|
Coût moyen (FCFA)
|
|
Forme localisée
|
114 710#177; 34 307,2
|
|
Forme métastatique
|
239 025#177; 60 606,1
|
2.4.1.5. Coût des traitements adjuvants pour la
chimiothérapie préopératoire
Le coût moyen des traitements adjuvants pour la
chimiothérapie préopératoire dans notre série
était de 117 655,7 #177; 30 907.6 FCFA avec des
extrêmes de 64 795 et 147 455
FCFA.
Le coût moyen des traitements adjuvants pour la
chimiothérapie préopératoire selon la forme clinique
évolutive a été rapporté dans le tableau XXI
Tableau XXII : Coût moyen des traitements
adjuvants pour la chimiothérapie préopératoire selon la
forme évolutive de néphroblastome
|
Coût moyen (FCFA)
|
Ecart type (FCFA)
|
|
Forme localisée
|
114 618
|
35 572,8
|
|
Forme métastatique
|
125 250
|
22 549,6
|
2.4.1.6. Coût du traitement des complications de la
chimiothérapie préopératoire
Le traitement des complications de la chimiothérapie
préopératoire a coûté de 19 500 à
260 600 FCFA. Le coût moyen était de 128 424,2
#177; 93 691,1 FCFA.
Le traitement des complications de la chimiothérapie
préopératoire a coûté 238 817,5#177;
30 805,1 FCFA dans les formes métastatiques comme le
montre le tableau XXII.
Tableau XXIII : Coût moyen du traitement des
complications de la chimiothérapie préopératoire selon la
forme clinique évolutive
|
Coût moyen (FCFA)
|
|
Forme localisée
|
73 227,7#177; 46 119,7
|
|
Forme métastatique
|
238 817,5#177; 30 805,1
|
2.4.1.7. Coût du bilan paraclinique de surveillance
per-cures de chimiothérapie préopératoire
Le coût moyen du bilan paraclinique de surveillance
per-cures de chimiothérapie préopératoire était de
281 132,9#177; 56 292,5 FCFA avec des
extrêmes de 221 060 et 380 060
FCFA.
Le coût moyen du bilan paraclinique de surveillance
per-cures de chimiothérapie préopératoire était de
307 455 #177; 9 270,2 FCFA dans la forme
métastatique comme le montre le tableau XXIV.
Tableau XXIV : Coût moyen du bilan
paraclinique de surveillance per-cures de chimiothérapie
préopératoire selon la forme évolutive de
néphroblastome
|
Coût moyen (FCFA)
|
Ecart type (FCFA)
|
|
Forme localisée
|
270 604
|
65 167,3
|
|
Forme métastatique
|
307 455
|
9 270,2
|
2.4.1.8. Coût de la prise en charge
chirurgicale
Le coût moyen de la prise en charge chirurgicale
était de 205 860#177; 53 106.5 FCFA avec des
extrêmes de 165 360 et 311 425
FCFA.
2.4.1.9. Coût des antimitotiques pour la
chimiothérapie postopératoire
Cinq patients ont bénéficié d'une
chimiothérapie postopératoire. Quatre au stade 2
opératoire et un au stade 3.
Le coût moyen des médicaments antimitotiques pour la
chimiothérapie post opératoire était de
595 728,3#177; 149 217,5 FCFA ; avec des
extrêmes de 461 345 et 756 310
FCFA.
2.4.1.10. Coût des traitements adjuvants pour la
chimiothérapie postopératoire
Les traitements adjuvants pour la chimiothérapie
postopératoire ont coûté en moyenne
369 398, 3#177; 46 486.4 FCFA avec des
extrêmes de 320 255 et 412 670
FCFA
2.4.1.11. Coût du traitement des complications de
la chimiothérapie postopératoire
Le coût du traitement des complications de la
chimiothérapie postopératoire a varié entre
219 000 et 511 610 FCFA avec une
moyenne de 331 415#177; 157 641,2 FCFA.
Le coût moyen du traitement des complications pour le stade
2 était de 365 305#177; 206 906,5 FCFA. Le traitement des
complications pour le patient au stade 3 a coûté 263 635
FCFA.
2.4.1.12. Coût du bilan paraclinique de
surveillance per-cures de chimiothérapie
postopératoire
Le coût moyen du bilan paraclinique de surveillance
per-cures de chimiothérapie postopératoire était de
985 053,3 #177; 62 501 FCFA avec des extrêmes
de 919 600 et 1 044 110
FCFA.
2.4.1.13. Coût de l'alimentation pendant le
séjour hospitalier
Le coût moyen de l'alimentation durant le séjour
hospitalier était de 256 525#177; 171 561 FCFA
avec des extrêmes de 85 000 et 481 600
FCFA.
2.4.1.14. Frais du séjour hospitalier
La durée moyenne du séjour hospitalier était
de 221,2#177; 143,9 jours avec des extrêmes de 63 et 344
jours.
Le coût moyen du séjour hospitalier était de
442 400#177; 287 879,8 FCFA avec des extrêmes
de 126 000 et 688 000 FCFA.
2.5.3. Coût globaux
2.4.1.15. Coût direct de la prise en charge du
néphroblastome à l'exéat
Le coût direct global moyen de la prise en charge du
néphroblastome à l'exéat était de
4 091 486,7#177; 390 352,9 FCFA avec des
extrêmes de 3 640 755 et
4 319 330 FCFA.
Le coût direct global moyen de la prise en charge des
patients au stade 2 était de 3 980 042,5 #177;
479 825 FCFA.
Le coût direct global de la prise en charge du patient au
stade 3 était de 4 313 375 FCFA.
Les deux patients avec un néphroblastome au stade 4
opératoire (forme métastatique) étaient
décédés en cours d'hospitalisation.
2.4.1.16. Part de chacune les lignes de dépense
dans la structure du coût direct global moyen de la prise en charge du
néphroblastome
Figure 9 : Part respective des différentes
lignes de dépenses dans la structure du coût direct global moyen
de la prise en charge du néphroblastome à
l'exéat.
Le coût des examens paracliniques a occupé le
premier rang avec une proportion de 32,92% du coût direct global moyen de
la prise en charge du néphroblastome à l'exéat (CDGME). Il
était suivi par le coût des antimitotiques (17,10%) et celui
de l'hospitalisation (16,05%). Le coût du transport aller et retour
domicile-hôpital-domicile représentait 0,06% du CDGME et celui des
frais de consultation, 0,03%. Quant au coût des traitements adjuvants et
celui du traitement des complications, ils ont représenté
respectivement : 11,29% et 9,71% du CDGME. Enfin, le coût de la
chirurgie et celui de l'alimentation ont représenté
respectivement 5,33% et 7,51% du CDGME.
2.4.1.17. Coût direct de la prise en charge du
néphroblastome après l'exéat
Le coût direct global moyen de la prise en charge du
néphroblastome à 3mois, 6 mois et 9mois est rapporté dans
le tableau XXIV ci-après.
Tableau XXV : Coût direct global moyen de la
prise en charge du néphroblastome à 3, 6 et 9 mois
post-exéat
|
Coût moyen (FCFA)
|
Ecart type (FCFA)
|
|
A 3 mois
|
4 142 955
|
397 311,4
|
|
A 6 mois
|
4 171 038,3
|
420 225,7
|
|
A 9 mois
|
4 185 319,1
|
354 025
|
DISCUSSION
1. Limites et biais de l'étude
Il s'est agi d'une étude rétrospective
(1er Juin 2008 au 31 Décembre 2009) et prospective
(1er Janvier au 31 Juillet 2010) portant sur les enfants
hospitalisés soit pour LB ou pour NB entre le 1er Juin 2008
et le 31 Juillet 2010 dans l'unité d'oncologie pédiatrique du CHU
Tokoin de Lomé.
L'objectif général de notre étude
était d'évaluer le coût direct moyen de la prise en charge
du lymphome de Burkitt d'une part et du néphroblastome de l'enfant
d'autre part au CHU Tokoin de Lomé. L'interprétation rigoureuse
de nos résultats exige d'en discuter la qualité et la
validité.
- En premier lieu, la petite taille de notre échantillon
limite quelque peu la qualité de nos résultats. Celle-ci est
justifiable d'une part par la rareté des affections faisant l'objet de
ce travail, et d'autre part à la non inclusion de certains
cancéreux qui ne remplissaient pas pleinement nos critères
d'inclusion.
- L'irrégularité des patients aux visites de
contrôle a contribué à biaiser l'évaluation des
coûts directs globaux de prise en charge après la sortie de
l'hôpital.
- La mémoire faisant souvent défaut,
l'évaluation exacte du coût de l'alimentation et du transport
était quelque fois difficile.
Par ailleurs, le manque de littérature sur le sujet nous
a limités dans la comparaison de nos résultats.
3. Lymphome de Burkitt
3.1. Fréquence
Ce travail ne prétend pas être exhaustif. La
fréquence du LB est certainement plus élevée dans notre
milieu que ce qui a été observé. En effet, certains
malades ne sont probablement pas amenés en consultation faute de moyens
ou d'informations.
3.2. Données sociodémographiques
1.1.1. L'âge
L'âge moyen de nos patients était de 7,5 #177;2,7ans
avec des extrêmes de 3 et 11 ans.
SEGBENA et al (1997), TOGO et al (2008) et RAFARAMINO et al
(2001) avaient trouvé le même résultat au Togo, Mali et
Madagascar respectivement. La moyenne d'âge dans chacune de leur
série était également de 7,5 ans.
Cet âge moyen se situe bien dans la marge de 4 à 10
ans rapportée dans la littérature
(BERTRAND, 1981 ; DP BURKITT, 1961 ; D CANTALOUBE,
1990 ; A LE GUYADER, 1985)
La conjonction des facteurs de risque de LB endémique
autour de cet âge tels que : les stimulations immunitaires multiples
et répétées d'origine infectieuse sur organisme
immunologiquement immature et malnutrition pourrait justifier ce fait.
1.1.2. Le sexe
Dans notre série, il existait une prédominance
masculine avec une sex-ratio de 5.
La prédominance masculine est constante dans la
littérature : SEGBENA et al (1997) au Togo, TOGO et al (2008) au
Mali et RAFARAMINO et al (2001) à Madagascar ont trouvé une
sex-ratio de 1,5 ; 2,4 et 2 respectivement.
Aucune explication probante n'y a été
trouvée.
1.1.3. La provenance
Nos patients étaient repartis sur la quasi-totalité
du territoire togolais : un patient (16.7%) venait en effet de la
région maritime, un autre de la région des plateaux, deux (33,3%)
de la région centrale et un de la Kara.
Par ailleurs, un patient venait de la côte d'ivoire.
SEGBENA et al avait trouvé 66,4% des patients venant du
sud du Togo en 1997.
Ce constat pourrait se justifier par le fait que l'unité
d'oncologie pédiatrique du CHU-Tokoin est la seule unité de PEC
des cancers de l'enfant au Togo. Les cas suspects de LB identifiés dans
les structures sanitaires de niveau inférieur sur toute l'étendue
du territoire y sont de plus en plus référés.
1.1.4. Prise en charge
Les frais inhérents à la prise en charge des
patients étaient supportés dans tous les cas par un parent (le
père dans tous les cas), l'association VICTOIR et le GFAOP.
L'association Mercy Ships a contribué à la PEC de deux
patients.
La PEC du lymphome de Burkitt est en partie supportée par
le GFAOP dans ses unités pilotes (UP) depuis sa mise sur pied en 2000.
Ceci étant imputable à son ferme engagement dans la fourniture
des médicaments antimitotiques, certains antibiotiques et
médicaments divers.
Les travaux réalisés dans d'autres UP en font
cas : dans la série de TOGO et al au Mali en 2008 par exemple, les
médicaments avaient tous été pourvus par le GFAOP. Les
examens complémentaires étaient à la charge des parents.
Notre UP bénéficie également du soutien du
GFAOP pour les médicaments antimitotiques et certains antibiotiques. Les
examens complémentaires, les produits sanguins et l'hospitalisation sont
supportés par l'association VICTOIR.
Les autres frais sont à la charge des parents.
L'association Mercy Ships participe quelque fois à la
réalisation des examens complémentaires. Ces faits justifient nos
observations.
3.3. Aspects cliniques
1.1.5. Motif de consultation et délai
d'évolution avant l'admission
Les patients ont le plus souvent été amenés
en consultation dans notre série pour tuméfaction maxillo-faciale
avec une fréquence de 83,3%.
La tuméfaction maxillo-faciale constitue le premier motif
de consultation dans la quasi-totalité des séries africaines
(D.P. BURKITT, 1983 ; G.E. CREZOIT, 1994 A. LE GUYADER, 1985 ;
SEGBENA, 1997 ; Rafaramino, 2001) à l'instar de SEGBENA et Al. qui
a trouvé une fréquence de 96,4% au Togo en 1997
Le délai moyen d'évolution avant la consultation
dans notre série était de 4,3 mois. Ce délai est proche de
celui de SEGBENA et Al. qui avaient retrouvé un délai moyen de 3
mois.
Ce long délai avant la consultation dans notre
série pourrait se justifier par le manque d'information des populations
sur la maladie, le manque de moyens financiers et le recours aux
tradipraticiens en premier lieu dont seul l'échec motive les parents
à amener les enfants à l'hôpital ultérieurement.
1.1.6. Etat général
Trois patients (soit 50%) avaient un état
général altéré dans notre série.
Ceci pourrait se justifier par le fait que les patients sont
amenés tardivement en consultation ; à un moment où
la maladie a déjà un retentissement sur l'état
général.
TOGO et Al. avaient retrouvé 66,7% de patients ayant un
état général altéré. Ce qui est proche de
nos observations.
NDIAYE et Al en Côte d'ivoire avaient par contre
trouvé 15% de patients avec un état général
altéré. Ce taux inférieur à celui que nous avons
trouvé dans notre série peut se justifier par le fait que dans
leur série, le délai diagnostic avait été
bref : en moins d'un mois dans 50% des cas.
1.1.7. Etat nutritionnel
Deux patients soit 33,3% de nos patients étaient
malnutris.
Ce résultat est proche de celui de TOGO et Al au Mali qui
avaient trouvé 33,7% de patients malnutris.
DOUMBE et Al. au Cameroun avaient trouvé près du
double avec un taux de malnutri de l'ordre de 64%.
Cette observation est le reflet du bas niveau
socioéconomique dont sont issus certains de ces enfants.
1.1.8. Localisation de la tumeur
La localisation maxillo-faciale occupait le premier rang dans
notre série avec une fréquence de 83,3% des cas. Le maxillaire
supérieur était le plus touché (80% des cas). Elle
était suivie par la localisation abdominale et l'atteinte ganglionnaire
périphérique avec une fréquence de 33% chacune.
La localisation préférentielle de la tumeur aux
maxillaires est la règle dans le LB endémique. Notre série
ne s'est pas dérobée à cette règle. Elle est
constante dans la littérature.
SEGBENA et al. Au Togo avait trouvé 100% d'atteinte
maxillo-faciale suivie des localisations abdomino-pelvienne et ganglionnaires
périphériques avec fréquence de 25% dans leur
série.
DOUMBE et al. Au Cameroun avaient trouvé une
fréquence de 74% pour les localisations maxillo-faciales suivies des
formes abdominales avec 18%.
Cette localisation maxillo-faciale préférencielle
n'a pas trouvé d'explication probante.
1.1.9. Stade tumoral selon Murphy
La plupart de nos patients (66,7%) étaient au stade 3 de
la classification de Murphy au moment du diagnostic.
Cette fréquence est supérieure à celle de
DOUMBE et al. au Cameroun en 1997 qui avaient trouvé une
prédominance des stades cliniques avancés avec 47% de stades 3 et
25% de stades 4.TOGO et al au Mali en 2008 ont obtenu 87,5% de stade 3 et 12,5%
de stade 4 dans leur série.
RAFARAMINO et al (2001) à Madagascar avaient par contre
trouvé une prédominance des stades précoces avec 60% de
stades 1 (45%) et stades 2 (15%). Cela peut se justifier par le fait que le
bilan d'extension complet n'avait été fait que chez 27,5% des
patients de leur série. Les autres patients ne l'ayant pas fait en
entier faute de moyens financiers ce qui pourrait avoir biaisé la
stadification de la tumeur chez certains patients dans leur série.
Les observations de notre série pourraient se justifier
par le fait que les patients sont encore amenés en consultation avec un
certains retard. Cela étant d'autant plus marqué pour ceux qui
vivent loin de la ville de Lomé qui abrite la seule unité
d'oncologie pédiatrique du pays.
3.4. Coût de la prise en charge
Dans cette partie de notre travail, nous avons
été limités en matière de littérature
comparative. Il n'existe en effet quasiment pas de données de la
littérature sur le coût de la prise en charge du lymphome de
Burkitt.
1.1.10. Coûts spécifiques
1.1.10.1. Frais de transport
Le coût moyen du transport aller-retour dans notre
série était estimé à 40 583, 3#177;
60 314,5 FCFA.
Ce coût est vraisemblablement sous-estimé dans la
mesure où il ne prend pas en
compte les frais de déplacements quotidiens des
accompagnants pendant toute la durée de l'hospitalisation. L'estimation
de ces frais a en effet été difficile; la mémoire ayant
assez souvent fait défaut.
1.1.10.2. Frais du séjour hospitalier
L'évolution du lymphome de Burkitt dans notre série
a été émaillée de nombreuses complications,
dominées par les épisodes infectieux.
Ceci a eu comme conséquence une hospitalisation
prolongée, avec une durée moyenne de séjour de 163,5#177;
46,1 jours.
Les frais moyens du séjour hospitalier s'élevait
à 326 666,7#177; 91 788,7 FCFA.
Soit 11,7 fois le SMIG au Togo qui est de 28 000 FCFA. Ces
frais étaient très élevés pour le Togolais
moyen.
Les frais de séjour hospitalier ont
représenté 13,12 % du coût direct moyen global de la PEC du
lymphome de Burkitt à la sortie de l'hôpital et viennent au
troisième rang après le coût des antimitotiques et celui
des examens complémentaires.
1.1.10.3. Frais de consultation
Les frais de la consultation initiale étaient de
3 166,7#177; 1 179,3 FCFA avec des extrêmes de 1 200 et 3 900
FCFA.
Aucun de nos patients n'avait été admis
d'emblée en consultation pédiatrique générale dont
le prix est de 1200 FCFA. L'unique patient chez lequel les frais de
consultation s'élevaient à 1200 FCFA avait préalablement
consulté gratuitement à l'infirmerie de l'association Mercy
ships.
Les parents ont donc dépensé en moyenne 1 966,7
FCFA de plus que s'ils avaient d'emblée amené leur enfant en
consultation pédiatrique générale sans compter les
dépenses engagés chez les tradipraticiens dont les parents se
refusent assez souvent de mentionner. D'où l'intérêt de la
sensibilisation des populations sur la conduite à tenir en cas
d'affection de l'enfant suspecte de lymphome de Burkitt.
1.1.10.4. Coût des examens
complémentaires
Dans la prise en charge du lymphome de Burkitt, le coût des
explorations effectuées, tant pour le diagnostic que pour la
surveillance du traitement s'élevait à 545 898,4 FCFA. Ce
coût a représenté 22,67% du coût direct global moyen
de la PEC à l'exéat, venant de ce fait au deuxième rang
après le coût des antimitotiques.
Il a été dominé par le coût du bilan
biologique de surveillance.
Ce coût était très élevé pour
le togolais moyen. Il représentait en effet 19,5 fois le SMIG au Togo.
La réalisation effective de ces examens a été rendu
possible grâce a l'appui financier de l'association VICTOIR qui y a
contribué dans tous les cas.
Ce coût est quelque peu sous-estimé dans la
mesure où les examens complémentaires de surveillance n'ont pas
été demandés dans le respect strict de l'art
médical ; le souci économique nous ayant incité
à ne demander des explorations que lorsqu'elles s'avéraient
vraiment nécessaires.
La mise en oeuvre d'une politique visant à
réduire les frais d'examens complémentaires à visée
diagnostique et de surveillance pour les enfants atteints de lymphome de
Burkitt serait une meilleure alternative pour renforcer l'appui de
l'association VICTOIR.
1.1.10.5. Coût des médicaments
antimitotiques
Avec une proportion de 30,81 % du coût direct global moyen
de la PEC du lymphome de Burkitt, le coût estimé des
médicaments antimitotiques a occupé le premier rang dans la prise
en charge du lymphome de Burkitt de notre série.
Ces médicaments antimitotiques ont été
pourvus par le GFAOP.
Les prix élevés, la disponibilité
aléatoire [Lemerle J. et Al., 2003 ] et les ruptures de la fourniture
de ces médicaments quelques fois observées sont autant de faits
qui justifieraient d'un appui des politiques et d'autres partenaires
sociaux.
1.1.10.6. Coût des traitements
adjuvants
Le coût moyen des traitements adjuvants était de
267 657,5 #177; 54 977,4 FCFA.
Ce coût occupait le quatrième rang dans la structure
du coût direct moyen de la PEC du lymphome de Burkitt à la sortie
de l'hôpital.
Ce coût également élevé pour le
togolais moyen, a été couvert dans la plupart des cas par
l'association VICTOIR et comportait essentiellement : les
antiémétiques, les antifoliniques, les hypouricémiants et
les solutés d'hydratation.
Les parents y ont contribué quelques fois. Le GFAOP a
quelques fois pourvu les antifoliniques.
1.1.10.7. Coût du traitement des
complications
Nous avons rapporté un coût moyen du traitement des
complications de 319 348,3 FCFA. Celui-ci était dominé par
le coût des antibiotiques qui a représenté 80,4% suivi de
celui des produits sanguins avec 13%.
Tous nos patients ont bénéficié du protocole
de sauvetage Burkitt qui est un protocole plus lourd et de ce fait tributaire
d'une toxicité beaucoup plus importante. Les complications infectieuses
et hématologiques étaient les complications majeures ce qui
justifie nos observations.
1.1.10.8. Coût de l'alimentation durant le
séjour hospitalier
Le coût moyen de l'alimentation durant le séjour
hospitalier était de 267 833,3 FCFA #177; 110 855,1 FCFA pour
une durée d'hospitalisation moyenne de 163,5#177;46,1 jours : ce
qui correspond en moyenne à un coût journalier de 1 638,1
FCFA.
Ce coût moyen était quelque peu élevé
pour certains parents qui avaient souvent recours à de bonnes
volontés pour les appuyer dans la couverture des frais d'alimentation.
Ceci est le reflet du bas niveau économique des familles dont sont issus
ces enfants. Le fait que les aliments aient le plus souvent été
acheté déjà cuits chez des revendeuses pourrait avoir
contribué à élevé ce coût moyen dans la
mesure où les aliments préparés au foyer coûte
beaucoup moins chère que lorsqu'ils l'ont déjà au moment
de leur achat.
1.1.11. Coût globaux
1.1.11.1. Coût direct global de la PEC du lymphome
de Burkitt à l'exéat
Le coût direct global moyen de la prise en charge du
lymphome de Burkitt à l'exéat était de
2 508 241,7 #177; 730 258 FCFA pour un séjour moyen de
163,5#177;46,1 jours
Le coût direct est très élevé pour
une famille togolaise de niveau moyen puisqu'il est 89,6 fois plus
élevé que le SMIG.
Et pourtant ce coût direct calculé est quelque peu
sous-estimé dans la mesure où il ne prend pas en compte des
coûts non médicaux comme les frais de déplacements
quotidiens de l'accompagnant pendant toute la durée de
l'hospitalisation.
Ce coût élévé fait des familles
d'enfant atteint de lymphome de Burkitt au Togo des personnes
financièrement ruinées du fait des dépenses
engagées dans la PEC de leur enfant et de l'insuffisance de leurs
revenus malgré l'appui des partenaires sociaux.
L'aide des politiques et des partenaires sociaux reste leur seul
espoir en absence d'un système de sécurité sociale
efficace.
1.1.11.2. Coût direct global de la PEC du lymphome
de Burkitt après l'exéat
Coût direct global moyen de la PEC du lymphome de Burkitt
après l'exéat était de :
2 811 367,5#177; FCFA à 1mois post-exéat, 2
813 065#177; FCFA à 12 mois post-exéat et 2
852 615#177; FCFA à 24 mois post-exéat.
Ces coûts sont sous-estimés dans la mesure où
les consultations de suivi ne se sont pas tenues dans tous les cas aux dates
convenues. De plus le souci économique a conduit à ne
réaliser les examens complémentaires de suivi que lorsqu'ils
étaient vraiment nécessaires.
4. Néphroblastome
4.1. Fréquence
Ce travail ne prétend pas être exhaustif. La
fréquence du NB est certainement plus élevée dans notre
milieu que ce qui a été observé. En effet, certains
malades ne sont probablement pas amenés en consultation faute de moyens
ou d'informations.
4.2. Données sociodémographiques
1.1.12. Age
L'âge moyen de nos patients au moment du diagnostic
était de 4,7#177; 3,1 ans.
Plus de la moitié de nos patients (quatre patients soit
57,1%) avaient un âge compris entre 0 et 4 ans.
La tranche d'âge de 0 à 4 ans était
également la tranche d'âge la plus fréquente dans la
série de Akhiwu W. O. et al en 2009 au Nigéria avec 61,1% des
cas.
L'âge moyen de nos patients est légèrement
supérieur à celui de FRANCESCA et Al. en 2002 en Italie qui
avaient trouvé un âge moyen de 3,65 ans.
LANDOLSI et Al. en 2002 en Tunisie avaient trouvé un
âge moyen de 3,75 ans.
Néphroblastome est une pathologie atteignant surtout
l'enfant en âge préscolaire
1.1.13. Sexe
Nous avons relevé une prédominance masculine dans
notre série avec une sex-ratio de 2,5.
FRANCESCA et Al avaient également trouvé une
prédominance masculine avec une sex-ratio de 1,16. Il en est de
même pour TOUHEM S. et Al qui avaient trouvé une sex-ratio de 1,44
en 2007 en Algérie.
En revanche, CHEN B F. et Al, AUDRYG. et Al avaient trouvé
une prédominance féminine avec une sex-ratio de 0,92 et 0,77
respectivement en Taiwan et en France.
Les résultats divergent selon les études et de ce
fait, nous ne pouvons pas affirmer que le néphroblastome est plus
fréquent chez le garçon que chez la fille.
Le néphroblastome atteindrait aussi souvent le
garçon que la fille. [AGUEHOUNDE C. et al1994 ; PARKIN D.M et
al 1998;Peko J. F. et al 2004 ]
1.1.14. Prise en charge
Tous nos patients (100%) étaient pris en charge par un
parent, l'association VICTOIR et le GFAOP. Ceci étant justifiable par
les mêmes raisons que celles avancées pour le LB : à
savoir que La PEC du néphroblastome de l'enfant est en partie
supportée par le GFAOP dans ses unités pilotes (UP) depuis sa
mise sur pied en 2000.
Notre UP bénéficie également de l'appui du
GFAOP pour les médicaments antimitotiques et certains antibiotiques. Les
examens complémentaires, les produits sanguins et l'hospitalisation sont
supportés par l'association VICTOIR.
Les autres frais sont à la charge des parents. Ces faits
justifient nos observations.
4.3. Aspect cliniques
1.1.15. Motif de consultation
La distension abdominale, retrouvée chez cinq
patients (soit 71,4% des cas), était le motif de consultation le
plus fréquent dans notre série. Elle était suivie par la
masse abdominale découverte par les parents chez quatre patients (soit
57,1%).
La distension abdominale était également le motif
de consultation le plus fréquent dans la série de LANDOLSI et Al.
qui avaient trouvé une fréquence de 68%.
La masse abdominale était par contre le premier motif de
consultation dans la série de KA A. S. et Al au Sénégal
avec une fréquence de 81%.
Le NB étant une tumeur abdominale maligne rapidement
évolutive, la masse et la distension abdominale sont les symptômes
par lesquels il est précocement manifeste.
1.1.16. Délai d'évolution avant la
consultation
Le délai moyen d'évolution de la tumeur avant la
première consultation dans notre série était de 3,18#177;
3,09 mois avec des extrêmes de 1semaine et 8 mois.
Ce délai moyen est inférieur à celui de
TOUHEM S. et Al en Algérie qui avaient trouvé un délai
moyen d'évolution avant la première consultation de l'ordre de 5
mois avec des extrêmes de 1 et 30 mois.
KA A. S. et Al au Sénégal avaient trouvé un
délai moyen de 2 mois.
1.1.17. Etat général
La plupart de nos patients (soit 57,1%) avaient un état
général altéré au moment du diagnostic.
La fréquence de l'altération de l'état
général dans notre série est supérieure à
celle de KA A.S. et Al qui avaient trouvé une altération de
l'état général dans 33% des cas en 2003 au
Sénégal.
Cela pourrait se justifier par le fait que les patients ont
été amenés en consultation dans notre série plus
tardivement que dans la leur.
1.1.18. Localisation de la tumeur
Tous nos patients (100%) avaient une néphroblastome
unilatéral. La localisation rénale droite prédominait dans
notre série avec une fréquence 71,4% des cas.
Nos résultats sont proches de ceux de TOUHEM S. et Al en
Algérie qui avaient trouvé 98 % de localisation
unilatérale dans leur série. L'atteinte rénale droite
prédominait légèrement dans leur série avec une
fréquence de 54 % des cas.
SOW et Al au Cameroun avaient trouvé une
légère prédominance rénale droite avec une
fréquence de 52% des cas.
SANGKHATHAT S.et Al en Thaïlande avaient par contre
trouvé une légère prédominance de l'atteinte
rénale gauche avec une fréquence de 50% de localisation
rénale gauche isolée contre 44,1% d'atteinte rénale droite
isolée et 5,9% de localisation bilatérale.
4.4.Aspects thérapeutiques
1.1.19. Protocole thérapeutique
Tous les patients (100%) de notre série ont
été traités selon un protocole simplifié du
protocole SIOP 2001 tel que recommandé par le GFAOP qu'il ait
été complet ou non.
Les protocoles SIOP sont les plus utilisés dans la
littérature :les patients de la série de FRANCESCA et Al en
Italie avaient été traités selon les protocoles SIOP-6,
SIOP-9, et SIOP-93-01. Ces protocoles préconisent tous une
chimiothérapie préopératoire et diffèrent quelque
peu par la nature des antimitotiques utilisés et la durée de la
chimiothérapie préopératoire.
KA A.S. et Al en 2003 au Sénégal avaient
traité tous les patients (100%) atteints de néphroblastome dans
leur série selon le protocole SIOP-93-01.
90% des patients de la série de TOUHEM S. et Al.en
Algérie avaient été traité selon le protocole
SIOP-93.
Notre unité d'oncologie pédiatrie est une
unité pilote du GFAOP : Voila ce qui justifie l'usage du protocole
simplifié du protocole SIOP 2001recommandé par le GFAOP pour le
traitement des patients de notre série. Il comporte l'avantage
d'être efficace et surtout moins toxique que les lourds protocoles
utilisés dans les pays du Nord.
1.1.20. Chimiothérapie
préopératoire
Tous nos patients (100%) ont bénéficié d'une
chimiothérapie préopératoire.
Ce taux est supérieur à celui de TOUHEM S. et Al.en
Algérie qui avaient trouvé 90% ainsi qu'à celui de
FRANCESCA et Al en Algérie qui avaient trouvé 80% des patients
ayant reçu une chimiothérapie préopératoire. Cela
pourrait se justifier parle fait que dans la série de FRANCESCA et Al,
certains patients (7,5%) avaient été référés
dans leur centre après une chirurgie première, chez d'autres
(4,3%), ils existaient un doute diagnostic au regard des aspects cliniques et
radiologiques obtenus après le bilan initial et enfin quelques uns
(4,3%) présentaient un abdomen aigue et le reste était
âgé de moins de 6 mois. Dans notre série par contre, le
diagnostic radiologique était très évocateur dans tous les
cas, la prise en charge thérapeutique avait été
initiée dans tous les cas par l'unité et les antimitotiques
étaient disponibles.
1.1.21. Chirurgie
Six patients (soit 85,7% des patients de notre série) ont
bénéficié d'une néphrectomie totale
homolatérale à la lésion tumorale.
Tous les patients (100%) de la série de FRANCESCA et Al en
Italie avaient été opérés. Le geste ayant
consisté en une néphrectomie totale ou partielle.
TOUHEM S. et Al. en Algérie avaient trouvé 95 % de
patient ayant subi une néphrectomie totale unilatérale. 4% des
patients de leur série avaient subi une néphrectomie totale et
partielle (bilatérale).
Ces taux élevés sont justifiables par le fait que
le traitement chirurgical est univoque dans la prise en charge
thérapeutique du néphroblastome. Dans notre série un
patient n'a pas subi de néphrectomie ceci étant dû au fait
que celui-ci est décédé avant la date prévue
à cet effet. D'autres raisons évoquées dans la
littérature : les perdus de vue, et le refus des parents [KA A.S.
et Al.]
1.1.22. Chimiothérapie et radiothérapie
postopératoires
Quatre patients (soit 57,1%) ont reçu une
chimiothérapie postopératoire. Aucun n'a reçu de
radiothérapie.
Ce taux est supérieur à celui de la série de
FRANCESCA et Al. en Italie dans laquelle 26,8% des patients avaient reçu
une chimiothérapie postopératoire et la radiothérapie. Il
est inférieur à celui de la série de TOUHEM S. et Al en
Algérie dans laquelle 90% des patients avaient reçu une
chimiothérapie postopératoire. 92% de leurs patients avaient
reçu une radiothérapie postopératoire.
Nos observations pourraient se justifier par le fait que les deux
patients décédés de notre série l'ont
été avant la chimiothérapie postopératoire qui est
systématique dans le protocole utilisé dans l'unité. Un
patient n'avait pas entamé le traitement postopératoire à
la fin de la collecte des données.
Pour ce qui est de la radiothérapie postopératoire,
aucun n'en a reçu dans notre série parce que les prestations de
service en matière de radiothérapie ne sont pas encore
disponibles dans le pays.
1.1.23. Stade opératoire
Quatre patients parmi les opérés (soit 66,6% des
patients opérés) avaient un néphroblastome au stade 2. Un
patient (16,7% des opérés) était rendu au stade 3 et un
autre (16,7%) au stade 4.
La prédominance des stades précoces (stades 1 et 2)
est quasi-constante dans la littérature : FRANCESCA et Al avaient
trouvé une fréquence de 74,2% pour les stades 1 et 2. KA A.S. et
Al, TOUHEM S. et Al, LANDOLSI et Al, en avaient trouvé une
fréquence de 61,9% ; 57% ; 54,8% respectivement.
Ce constat pourrait se justifier par le fait que le NB
étant une tumeur maligne rapidement évolutive, la masse et la
distension abdominale par laquelle elle est précocement manifeste est en
général notée tôt par un parent notamment lorsqu'il
donne le bain ou habille l'enfant.
4.5. Coût de la prise en charge
1.1.24. Coût spécifiques
1.1.24.1. Frais de transport
Les frais de transport moyens s'élevaient à de
2 542,9#177; 1 236,7 FCFA.
Ce coût est également sous-estimé puisqu'ici
non plus, il ne prend pas en
compte les frais de déplacements quotidiens des
accompagnants pendant toute la durée de l'hospitalisation. La
mémoire ayant assez souvent contribué à réduire la
qualité de ce résultat.
1.1.24.2. Frais de consultation
Les frais dévolus à la consultation initiale
s'élevaient en moyenne à 2 871,4#177; 1 670 FCFA.
Aucun de nos patients n'a là encore d'emblée
été admis en consultation pédiatrique
générale au CHU-Tokoin.
Ces frais ne sont pas un reflet juste de la réalité
puisque les dépenses engagés pour la consultation de
tradipraticiens et praticiens divers de médecine non conventionnelle n'a
pas été prise en compte.
La sensibilisation des populations reste le meilleur recours pour
limiter ces dépenses.
1.1.24.3. Coût des examens paracliniques
réalisés au cours de l'hospitalisation
Le coût des examens paracliniques réalisés
à visée diagnostic, préthérapeutique et la
surveillance du traitement s'élevait à 1 349 609,1 FCFA. Ce
coût a représenté 32,92% du coût direct global moyen
de la PEC à l'exéat, venant de ce fait au premier rang dans la
structure du coût direct global moyen de la PEC du néphroblastome
à l'exéat.
Ce coût était très élevé pour
le togolais moyen Il représentait en effet 48,2 fois le SMIG au Togo. La
réalisation de ces examens a été également rendue
possible grâce a l'appui financier de l'association VICTOIR qui y a
contribué dans tous les cas.
Le souci économique a conduit à ne demander des
explorations que lorsqu'elles s'avéraient vraiment nécessaires ce
qui pourrait avoir contribué à sous-estimer ce coût.
1.1.24.4. Coût des antimitotiques
Les médicaments antimitotiques pour la
chimiothérapie préopératoire ont coûté en
moyenne 150 228,6#177; 71 249 FCFA.
Le coût moyen des médicaments antimitotiques pour la
chimiothérapie post opératoire était de
595 728,3#177; 149 217,5 FCFA
Le coût total des antimitotiques représentait 17,
10% du coût direct global moyen de la prise en charge du
néphroblastome à l'exéat et occupait de ce fait le second
rang après le coût des examens complémentaires.
Les antimitotiques pour la chimiothérapie
postopératoire ont couté près de 4 fois plus chères
que pour la chimiothérapie préopératoire. Ceci est
justifiable par le fait que la chimiothérapie postopératoire
utilise 3 drogues anticancéreuses contre 2 pour la chimiothérapie
préopératoire. Par ailleurs, la chimiothérapie
postopératoire comporte 20 cures contre 5 à 6 cures pour la pour
la chimiothérapie préopératoire.
N'eut été l'appui matériel du GFAOP ces
médicaments seraient une lourde charge financière pour les
parents de ces enfants puisque le coût total des médicaments
antimitotiques représente 26,6 fois le SMIG au Togo. Un appui
supplémentaire des politiques et d'autres partenaires sociaux ne serait
pas de trop dans la mesure où il permettrait de prévenir les
ruptures éventuelles de la fourniture de ces antimitotiques et de donner
la chance à beaucoup d'autres enfants atteints de néphroblastome
de bénéficier du traitement.
1.1.24.5. Coût des traitements adjuvants
Le coût moyen des traitements adjuvants pour la
chimiothérapie préopératoire dans notre série
était de 117 655,7 #177; 30 907,6 FCFA
Les traitements adjuvants pour la chimiothérapie
postopératoire ont coûté en moyenne
369 398, 3#177; 46 486.4 FCFA
La différence entre le coût moyen des traitements
adjuvants pour la chimiothérapie préopératoire et la
chimiothérapie postopératoire est justifiable par les faits
précédemment énoncés ; à savoir :
la quantité plus importante de médicaments antimitotiques
utilisées au cours de la chimiothérapie postopératoire par
rapport à la chimiothérapie préopératoire.
Ce coût également élevé, a
été couvert dans la plupart des cas par l'association VICTOIR et
comportait essentiellement : les antiémétiques, les
antifoliniques, les hypouricémiants et les solutés d'hydratation.
Les parents y ont contribué quelques fois.
1.1.24.6. Coût du traitement des complications
Le traitement des complications de la chimiothérapie
préopératoire a coûté en moyenne 110 077,8
FCFA
Le coût moyen du traitement des complications de la
chimiothérapie postopératoire a était de 331 415#177;
157 641,2 FCFA.
La chimiothérapie post opératoire a
été tributaire d'un plus grand nombre de complications
ajouté à une morbidité post opératoire
dominé par les infections bactériennes. Ces faits justifient la
différence observée entre le coût du traitement des
complications des chimiothérapies préopératoire et
postopératoire.
1.1.24.7. Coût de la prise en charge chirurgicale
Le coût moyen de la prise en charge chirurgicale
était de 205 860#177; 53 106.5 FCFA avec des extrêmes de
165 360 et 311 425 FCFA.
La chirurgie a été également coûteuse.
Son coût prenait en compte les dépenses
dévolues à la visite pré-anesthésique, aux
médicaments et consommables pour l'anesthésie, au matériel
chirurgical, à l'acte chirurgical et à la réanimation
postopératoire. Ces frais divers étaient couverts dans la plupart
des cas par l'association VICTOIR.
Une politique de réduction des prix des médicaments
ainsi que celui de l'acte chirurgical pourrait contribuer à
réduire ce coût.
1.1.24.8. Coût de l'alimentation pendant le
séjour hospitalier
Le coût moyen de l'alimentation durant le séjour
hospitalier était de 256 525#177; 171 561 FCFA pour une
durée moyenne du séjour hospitalier de 221,2#177; 143,9 jours.
1.1.24.9. Frais du séjour hospitalier
Le coût moyen du séjour hospitalier était de
442 400#177; 287 879,8 FCFA avec des extrêmes de 126 000
et 688 000 FCFA.
Il occupait le troisième rang avec 16,05% du coût
direct global moyen de la prise en charge du néphroblastome à
l'exéat après celui des examens complémentaires et celui
des antimitotiques.
Ce coût moyen est assurément sous-estimé dans
la mesure ou la durée minimale d'hospitalisation pour
néphroblastome au CHU-Tokoin devrait être de 224 Jours
correspondant au minimum de 5 semaines de chimiothérapie
préopératoire et 27 semaines de chimiothérapie
postopératoire ceci sans compter la durée minimale requise pour
la prise en charge chirurgicale. Le coût que nous avons rapporté
est relatif à une durée moyenne d'hospitalisation
inférieure. Ceci pourrait se justifier par le fait que deux patients de
notre série sont décédés avant la
chimiothérapie postopératoire ce qui a contribué à
sousestimé la durée moyenne d'hospitalisation et de ce fait les
frais de séjour moyens.
1.1.25. Coût globaux
1.1.25.1. Coût direct de la prise en charge du
néphroblastome à l'exéat
Le coût direct global moyen de la prise en charge du
néphroblastome à l'exéat était de
4 088 586,6 FCFA avec des extrêmes de 3 635 755 et
4 316 630 FCFA pour une durée moyenne de séjour
hospitalier de 221,2 #177; 143,9 jours.
Le coût direct est très élevé pour une
famille togolaise de niveau moyen puisqu'il est 146 fois plus
élevé que le SMIG au Togo.
Ce coût direct est tout de même sous-estimé
dans la mesure où il ne prend pas en compte des coûts non
médicaux comme les frais de déplacements quotidiens de
l'accompagnant pendant toute la durée de l'hospitalisation.
Dans ces conditions, l'appui des politiques et des partenaires
sociaux, la mise en place d'un système de sécurité sociale
efficace, de réduction des prix des médicaments et des chambres
d'hospitalisation comme mesure d'accompagnement institutionnel sont autant de
stratégies pouvant permettre de réduire le coût direct de
la PEC du lymphome de Burkitt.
1.1.25.2. Coût direct de la prise en charge du
néphroblastome après l'exéat
Coût direct de la prise en charge du néphroblastome
après l'exéat était de 4 140 055 FCFA à 3 mois
post-exéat, 4 168 138,3 FCFA à 6 mois post-exéat
et 4 182 419,1 FCFA à 9mois post-exéat.
Ces coûts sont également sous-estimés dans la
mesure où les consultations de suivi ne se sont pas tenues dans tous les
cas aux dates convenues. De plus le souci économique a conduit à
ne réaliser les examens complémentaires de suivi que lorsqu'ils
étaient vraiment nécessaires.
CONCLUSION
Les cancers ne sont pas exceptionnels chez l'enfant. Le lymphome
de Burkitt et le néphroblastome sont les plus fréquents en
Afrique en général et au Togo en particulier.
L'objectif principal de notre étude était
d'évaluer le coût direct moyen de la prise en charge d'un
Lymphome de Burkitt d'une part et du Néphroblastome de l'enfant d'autre
part au CHU-Tokoin de Lomé en général et de
déterminer la part respective de chaque ligne de dépense dans le
structure de chacun de ces coûts en particulier.
Notre but était de documenter la littérature
médicale sur les aspects médico-économiques relatifs
à ces cancers au CHU-Tokoin de Lomé et proposer des solutions
à même de minimiser le coût direct de leur prise en charge
en vue de répondre à la demande avec efficience.
De notre étude, il découle que :
-Le coût direct global moyen de la prise en charge du
Lymphome de Burkitt au CHU-Tokoin de Lomé est très
élevé par rapport au niveau de vie du Togolais moyen. Il se
chiffrait à 2 508 241,7 FCFA à la sortie de
l'hôpital dans notre série pour une durée moyenne de
séjour hospitalier de 163,5 #177; 46,1 jours. Il était
de : 2 811 367,5 FCFA à 1mois post-exéat, 2
813 065 FCFA à 12 mois post-exéat et 2 852 615 FCFA
à 24 mois post-exéat.
Les antimitotiques, les examens complémentaires et
l'hospitalisation étaient les lignes de dépense les plus
coûteuses. Leur coût représentait respectivement 30,81%,
22,67% et 13,12% du Coût direct global moyen de la prise en charge
à la sortie de l'hôpital.
-Le coût direct global moyen de la prise en charge du
néphroblastome est encore plus élevé. Il se chiffrait
à 4 088 586,6 FCFA à la sortie de l'hôpital dans
notre série pour une durée moyenne de séjour hospitalier
de 221,2 #177;143,9 jours. Il était de 4 140 055 FCFA à 3
mois post-exéat, 4 168 138,3 FCFA à 6 mois
post-exéat et 4 182 419,1 FCFA à 9mois post-exéat.
Le coût des examens paracliniques a occupé le
premier rang avec une proportion de 32,92% du coût direct global moyen de
la prise en charge du néphroblastome à l'exéat. Il
était suivi par le coût des antimitotiques (17,10%) et celui
de l'hospitalisation (16,05%)
-La prise en charge financière des patients de notre
série était assurée dans tous les cas (100%) par un
parent, l'association VICTOIR et le GFAOP. Chacun d'eux ayant en partie
supporté les frais divers inhérents à la prise en charge
des patients.
La question qui se pose à l'évidence est de
savoir si une prise en charge aussi onéreuse donne lieu à des
résultats satisfaisants. A cet effet, Il faut noter que le taux de
rémission complète dans notre série était de 100%
pour le lymphome de Burkitt et de 71,4% pour le néphroblastome. Les deux
patients décédés présentaient un
néphroblastome au stade 4 au moment du diagnostic. Le suivi de ces
enfants permettra d'affirmer les cas de guérison.
Dès lors, La réduction de ces coûts pourra
être obtenue par le développement de stratégies visant
à réduire les principales lignes de dépense telles
que : la l'adoption d'une politique de baisse du coût des
médicaments et autres consommables rentrant dans le traitement de ces
affections, la réduction des durées d'hospitalisation en jouant
sur les délais d'exécution des actes et examens
complémentaires, en promouvant des alternatives à
l'hospitalisation comme des centres de séjour prolongé à
coût réduit ou l'hospitalisation à domicile, la
réduction des frais des examens complémentaires.
Ce travail a permis de constater la cherté du
traitement du lymphome de Burkitt et du néphroblastome de l'enfant au
Togo. L'appui logistique et financier apporté par le GFAOP d'une part et
l'association VICTOIR d'autre part dans la prise en charge de ces affections au
Togo est louable. Cependant, des efforts énormes restent à
consentir afin d'améliorer de façon optimale le pronostic de ces
affections au Togo.
SUGGESTIONS
Au terme de notre étude, nous faisons les suggestions
suivantes :
v A l'endroit des autorités politiques et
administratives :
-Faire du traitement des cancers en
général, et des enfants en particulier, une priorité de
santé publique.
- Favoriser le développement de l'assurance maladie et
des mutuelles de santé au Togo.
- réduire les frais d'examens complémentaires
à visée diagnostique et de suivi pour les enfants atteints
de lymphome de Burkitt ou de néphroblastome.
- Promouvoir la gratuité des médicaments
antimitotiques afin d'appuyer l'action du GFAOP au Togo.
-Equiper l'unité d'oncologie pédiatrique du
CHU-Tokoin et créer une unité de radiothérapie afin
d'optimiser la qualité de la prise en charge des enfants atteints de
cancer.
-Améliorer la couverture sanitaire en promouvant la
formation pratique de médecins pédiatres et du personnel
paramédical en oncologie pédiatrique pour une
décentralisation des structures médicales
spécialisées dans la PEC des affections malignes de l'enfant au
Togo.
-Promouvoir l'éducation sanitaire des populations.
v A l'endroit du personnel soignant :
-Sensibiliser les populations sur la conduite à tenir
en cas de maladie, sur les problèmes liées à la prise en
charge tardive des maladies malignes de l'enfant et les conséquences de
l'automédication.
-Savoir reconnaitre les limites de ses compétences et
passer le témoin à temps
- Prendre de plus en plus en compte la notion du coût
des soins de santé dans ses prestations.
- Réduire la durée d'hospitalisation des enfants
atteints de lymphome de Burkitt ou de néphroblastome afin de diminuer
les frais d'hospitalisation dans la mesure du possible.
v A l'endroit de la population:
-Consulter précocement un personnel soignant en cas
d'affection maligne suspecte de l'enfant.
-Renoncer à l'automédication.
-Inclure le volet santé dans le budget familial et
mieux souscrire à une assurance maladie.
v Aux partenaires sociaux :
-Approvisionner régulièrement l'unité
d'oncologie pédiatrique du CHU-Tokoin en drogues antimitotiques.
-Créer d'autres unités pilotes sur le territoire
togolais
-Etendre la couverture des frais inhérents à la PEC
REFERENCES
1. Lemerle J, Msefer-Alaoui F, Harif M, et Al. Peut-on
traiter les cancers des enfants en Afrique ? L`action du Groupe
franco-africain d`oncologie pédiatrique.
Médecine
thérapeutique / Pédiatrie. Volume 6, Numéro 3, 192-7, Mai
2003, Revue : Oncologie pédiatrique.
2. Lemerle J., Barsaoui S., Harif M. et Al. Le traitement des
cancers de
l'enfant en afrique : travaux du groupe franco-africain
d'oncologie pédiatrique - Med Trop, 2007, 67, 497-504.
3. Bernard J. La tumeur de Burkitt. Méd. Afr. Noire,
1981, 28 (6) : 399-401.
4. Debrie J-C, Salgas P, Verdalle P, Conessa CI, Tomasi M,
Charpentier P. Les localisations maxillo-faciales du lymphome de BURKITT en
Afrique. A propos de Sept cas. Les Cahiers d'ORL. 1991 ; XXVI (3) :
116-27.
5. Togo B., Keita M., MedefoDai, Traore F., Sidibe T. Le
lymphome de Burkitt à localisation maxillo-faciale en milieu
pédiatrique au CHU Gabriel Touré, Bamako, Mali : à propos
de 24 cas - Med Trop, 2008, 68, 600-602.
6. Adjogble K.S. Contribution à l'étude clinique
de la maladie de Burkitt au Togo. A propos de 16 observations dans le service
de Pédiatrie au C.H.U. de Lomé. ThèseMéd.
Lomé, 1980, n°10.
7. Burkitt D. P., O'connor. Malignant lymphoma in Africa
children. Cancer, 1961, 14 (2) : 258 p.
8. Cantaloube D., Bellavoir A., Rives J.M., Pasturel A.
Stomatologie Tropicale : lymphome de Burkitt Africain, pian, noma,
lèpre. Encycl. Med. Chir. (Paris), Stomatologie 22050T10, 2-1990,
14p.
9. Gadegbeku S., Koutouan A. et Coll. La maladie de Burkitt
en Côte d'Ivoire en 1988. Rev. Sto. Chir. Max. Fac. 1988, 87, (4) :
201-211.
10. Segbena AY, Kueviakue M, Vovor A, Tataganagbi K, Assimadi
K Napokoura GA, Kpodzro K. Le lymphome de BURKITT au Togo. Aspects
épidémiologique, clinique thérapeutique et
évolutif. Médecine d'Afrique noire 1997 ; 44 (3) :
141-5.
11. Rafaramino F., Maminirina RAM., Razafindrabe JAB.,
Raharijoana L., Randriamampandry A., Rakotobe P. Le lymphome de Burkitt de
l'enfant à Madagascar. Formes anatomo-cliniques , aspects
thérapeutiques et évolutifs. Bull Soc PathExot 2001, 94,
389-393.
12. Ben Ayed, Boussen H., Jaafoura et Coll. Le lymphome de
Burkitt à propos de 7 cas en Tunisie. Tunisie Médicale, 1984, 62
: 73 - 77.
13. N'kruma F.K., Olweny C.L.M. Clinical feature of Burkitt's
lymphoma. The African experience. LARC Scientific publications, Lyon, 1985 (60)
: 87 - 95.
14. Olweny C.L.M., Katongole-M'bidde, Otih D., Lwanga S.K.,
Magrah I.J., And Ziegler J.L. Long term experience with Burkitt's lymphoma in
Uganda. Int. J. Cancer, 1980, 26: 261 - 266.
15. Koffi K.G., Bosson N.M., Aka-Adjo M.A., Diop S., N'dhatz
E., Ahmedou O., Sanogo I., Sangare A. Résultat du traitement du lymphome
de Burkitt africain. Expérience du service d'hématologie clinique
du CHU de Yopougon. Médecine d'Afrique noire 1997 ; 44 (12) :
635-9.
16. Burkitt DP. A sarcoma involving the jaws in African
children. Br J Surg 1958; 46:218-23
17. Doumbé P, Mbakop A, EssombaMboumi MT, Obama MT,
Kago I, Gonsu J et al. Lymphome de Burkitt chez l'enfant au Cameroun :
aspects descriptifs et anatomocliniquesBull Cancer 1997 ; 84 :
379-83
18. Crezoit G.E., Aka G. et Coll. Troubles
neuro-végétatifs au cours du lymphome de Burkitt. Rev. COSA-CMF,
Abidjan, 1994, 1, (2) 06 : 10-13
19. Le Guyader A., Kebe-Memel E.N., Battesti S. La maladie de
Burkitt. A propos des formes apparemment chirurgicales.Chirurgie, 1985, 111 (8)
: 715-732.
20. Martinez - Vila E. The coast of Stroke. Cerebrovascular
diseases 2004; 17: 124-129.
21. Tall H. Coût du traitement et des examens
complémentaires des accidents vasculaires cérébraux.
Thèse de doctorat en Pharmacie 2005, Université de Lomé,
62 p.
22. Bellan C, Lazzi S, De Falco G, Nyongo A, Giordano A,
Leoncini L. Burkitt's lymphoma: new insights into molecular pathogenesis. J
ClinPathol2003; 56 : 188-92.
23. World Health organization. Histopathological definition of
Burkitt's tumor. Bull WHO 1969;40:601-607
24. Blum KA, Lozanski G, Byrd JC. Adult Burkitt leukemia and
lymphoma. Blood 2004 ; 104 : 3009-20
25. Doll DC, List AF. Burkitt's lymphoma in a homosexual.
Lancet 1982;1(8279):1026-7
26. Ziegler JL, Drew WL, Miner RC, Mintz L, Rosenbaum E,
Gershow J, Lennette ET, Greenspan J, Shillitoe E, Beckstead J, Casavant C,
Yamamoto K. Outbreak of Burkitt's-likelymphoma in homosexualmen.Lancet
1982;2(8299):631-3
27. Levine AM, Meyer PR, Begandy MK, Parker JW, Taylor CR,
Irwin L, Lukes RJ. Development of B-cell lymphoma in homosexual men. Clinical
and immunologie findings. Ann Intem Med 1984;100(1):7-13
28. MagrathIT.Malignant non-Hodgkin's lymphomas in children.
In: Pizzo PA, Poplack DG. Principles and Practice of Pediatric Oncology (4th
ed). Lippincott Williams andWilkinsed, Philadelphia, 2002, pp 661-705.
29. Brousse N., Solal-Celigny P., Scoazek J.Y. Les lymphomes
malins non hodgkiniens. Laboratoires Roger Bellon, Paris 1986, 9, 457 p.
30. Dave SS, Fu K , Wright GW, Lam LT, Kluin P, Boerma EJ et
al. Molecular diagnosis of Burkitt's lymphoma. N Engl J Med 2006; 354:
2431-42.
31. Devine M. Lymphome de Burkitt. Ed. Tech. Encycl. Med.
Chir. (Paris), Hématologique, clinique et thérapeutique à
propos de 242 cas.ThèseMéd, Lomé, 1989, n°10.
32. Burkitt D.P., O'connor. The discovery of Burkitt's
Lymphoma. Cancer, 1983, 51 (10): 1777-1786.
33. Mouden J.C., Durand J.P., Garrigue G.P. Le lymphome de
Burkitt au Cameroun. Considérations anatomo-cliniques et
épidémiologiques sur 66 cas recensés de 1980 à
1986. Bull. Soc. Pathol. Exot., 1988, 81 (1) : 15-23.
34. Borowski B & Patte C. A propos d'un lymphome de
Burkitt à localisation buccale et ORL chez l'enfant. Inform dent, 1992,
74, 433-436.
35. Lelo T, MalengaMp, Ndoma K &Bielelie E. Le lymphome de
Burkitt à localisation maxillo-faciale. Aspects radiographiques.
MédAfr Noire, 1992, 39, 12.
36. Sow M, Nkégoum B, Essame JL, Garoua O, Nzokou A.
Aspects épidémiologiques et histopathologiques des tumeurs
urogénitales au Cameroun. ProgUrol 2006 ; 16: 36-9.
37. Flandrin G. Atlas of Genetics and Cytogenetics in Oncology
and Haematology
Consulté le 27 Août 2010
Disponible à l'URL:
http://www.atlasgeneticsoncology.org/Anomalies/Images/FlandrinBurkitt.jpg
38. Anonyme. Burkitt'sLymphoma.
Consulté le 27 Août 2010
Disponible à l'URL :
http://www.webpathology.com/image.asp?case=389&n=13
39. Bernheim A, Berger R, Lenoir G. Cytogenetic studies on
African Burkitt's lymphoma cell lines: t(8;14), t(2;8) and t(8;22)
translocations. Cancer Genet Cytogenet 1981;3(4):307-15
40. Dalla-Favera R, Bregni M, Erikson J, Patterson D, Gallo
RC,Croce CM. Human c-myc one gene is located on the region of chromosome 8 that
is translocated in Burkitt lymphoma cells. ProcNatlAcadSei
USA1982;79(24):7824-7
41. Lombardi L, Newcomb EW, Dalla-Favera R. Pathogenesis of
Burkitt lymphoma: expression of an activated c-myc oncogene causes the
tumorigenic conversion ofEBV-infected human B
lymphoblasts.Cell1987;49(2):161-70
42. Junquera Gutierrez LM, Albetos Castro JM, Alonso Vaquero
D, Vicente Rodriguez JC. & Lopez Arranz JS. Lymphome de Burkitt
américain de localisation mandibulaire. RevStomatolChirMaxillofac, 1994,
95, 355-358.
43. Sulé JC, Manlan K, Fagniez PL, Ricard D'agay MF
& Reyes F. Lymphomes de Burkitt abdominaux : A propos de trois cas.
Gastroenterol Clin Biol, 1990, 4, 455-463.
44. Arseneau JC, Canellos GP, Banks PM, Berard CW, Gralnick
HR, Devita VT. American Burkitt's lymphoma: a clinicopathologic study of 30
cases. I. Clinical factor relating to prolonged survival. Am J Med 1975; 58:
314-21.
45. Levine PH, Cho BR, Connelly RR, et al.The American Burkitt
lymphoma registry: a progress report. Ann Intern Med 1975; 83: 31-6.
46. Stiller CA, Parkin DM. International variations in the
incidence of childhood lymphomas. PaedPerinatalEpidemiol 1990 ; 4 : 303-24.
47. Raphael MM, Audouin J, Tulliez M, Michiels JF, Berger F,
D'agay MF, Gaulard P, Merlio JP, Marelle L, Gisselbrecht C, Bryon PA, Diebold J
for the French Study Group for HIV-Associatedtumors. Anatomie and histologie
distribution of 448 cases of AIDS-related non Hodgkin's lymphomas. Blood 1993
;82(10 Suppl 1) :386a
48. Raphael M, Gentilhomme 0, Tulliez M, Byron PA, Diebold J.
Histopathologic features of high-grade non-Hodgkin's lymphomas In
acquiredimmunodeficiency syndrome. The French Study Group of Pathology for
Human Immunodeficiency Virus-Associated Tumors. Arch PatholLab Med
1991;115(1):15-20
49. Magrath I, Adde M, Shad A, Venzon D, seibel N, Gootenberg
J, Neely J, Arndt C, Nieder M, Jaffe E, Wittes RA, Horak ID. Adults and
children with small non-cleaved-celllymphoma have a similar excellent outcome
when treated with the same chemotherapy regimen. J Clin
OncoI1996;14(3):925-34
50. Magrath IT. African Burkitt's lymphoma. History, biology,
clinical features, and treatment.Am J PediatrHematol OncoI1991;13(2):222-46
51. Patte C, Michon J, Bouffet E, Leverger G, Robert A,
Bertrand Y, Munzer M, Thyss A, Perel Y, Lejars O. High survival rate of
childhood B-cell lymphoma and leukemia (ALL) as result of the LMB 89 Protocol
of the SFOP : Abstract ASCO, Annual Meeting, Mai 1992.
52. Frappaz D, Bouffet E, Philip T. Le lymphome de Burkitt. In
Gorin NC, Philip T,
Symann M. Manuel Pratique d'hémato- cancérologie
et de chimiothérapie Paris,
Frison-Roche ed, 1996, pp 550-7.
53. Haouas N., Sahraoui W., Sridi K. Néphroblastome de
l'adulte.Prog. Urol., 2005, 15, 326-328
54. Peko J. F., Moyen G. & Gombe-Mbalawa C. Les tumeurs
solides malignes de l'enfant à Brazzaville: aspects
épidémiologique et anatomo-pathologique. Bull Soc PatholExot,
2004, 97, 2, 117-118
55. Akhiwu W. O., Igbe A. P., Aligbe J. U., Eze G. I., Akang
E. E. U. Malignant Childhood Solid Tumours in Benin City, Nigeria. West African
Journal of Medicine Vol. 28, No. 4 July-August 2009
56. Rakotomahefa M.; Randriatahina P.; Ratsimbazafy A;
RaobijaonaH. Aspects epidemiocliniques des cancers dans le service de
pediatrieHJRBefelatanana de janvier 2007 au mai 2009
57. KA A.S., IMBERT P., MOREIRA C., NIANG A., BAUJAT G., SEYE
M.N., GUYON P. Epidémiologie et pronostic des affections malignes de
l'enfant à Dakar, Sénégal. Med Trop2003; 63 : 521-526
58. AGUEHOUNDE C., SILVA-ANOMA S., ROUX C. Le
néphroblastome au centre hospitalier d'Abidjan : a propos de 60
cas. Journal
d'urologie 1994, vol. 100, no4, pp. 196-199
59. SCHLEIERMACHER G et BRISSE H. Le
néphroblastome.
Oncologie, Vol
8, Number 6, July 2006 , pp. 555-562 (8)
60. PARKIN DM & SOHIER R. International Incidence of
children's cancer, Vol II. IARC SciPubln° 144, Lyon, France,
1998.
61. MILLER R.W., FRAUMENI J.F. JR., MANNING M.D.Association of
Wilms's tumor with aniridia, hemihypertrophy and other congenital
abnormalities. N Engl J Med 270: 922-927, 1964.
62. JADRESIC L., LEAKE J., GODRON I., DILLON M.J.,GRANT D.B.,
PRITCHARD J., RIDSON R.A., BARRATT T.M. - Clinicopathologic review of twelve
children with nephropathy, Wilms tumor, and genital abnormalities (Drash
syndrome). J Pediatr117: 717-725, 1990.
63. Sangkhathat S. Chotsampancharaen T., Kayasut K.,
Patrapinyokul S., Chiengkriwate P., Kitichet R., Maipang M. Outcomes of
Pediatric Nephroblastoma in Southern Thailand. Asian Pacific J Cancer Prev
2008, 9, 643-647
64. NEWSHAM I., CAVENEE W. Tumors and developmental anomalies
associated with Wilms' tumor. Med PediatrOncol21: 199-204, 1993.
65. MUKIIBI JM, BANDA L, LIOMBA NG et Coll- Spectrum of
childhood cancers in Malawi 1985-1993. East Afr Med J 1995 ; 72 : 25-29.
66. AKANG EE - Tumors of childhood in Ibadan, Nigeria
(1973-1990). PediatrPathol Lab Med 1996; 16: 791-800.
67. COPPES M.J., HABER D.A., GRUNDY P.E. - Genetic events in
the development of Wilms' tumor. N Engl J Med 331: 586-590, 1994.
68. CALL M.K., GLASER T., ITO C.Y., HABER D.A., ROSE E.A.,
KRAL A., YEGER H., LEWIS W.H., JONES C., HOUSMAN D.E. - Isolation and
characterization of a zinc finger polypeptide gene at the human chromosome 11
Wilms' tumor locus. Cell 60: 509-520, 1990.
69. GRUNDY P., COPPES M. - An averview of the clinical and
molecular genetics of Wilms' tumor. Med PediatrOncol1996; 27: 394-397.
70. BIRCH JM. L'épidémiologie du cancer chez
l'enfant. Ann Nestle 1990; 48 : 113-125.
71. STILLER CA, PARKIN DM . Geographic and ethnic variations
in thevincidence of childhood cancer. Br Med Bull 1996 ; 52 : 682-703.
72. MILLER RW. Frequency and environnemental epidemiology of
childhood cancer in principles and practice of pediatric oncology. JB Lippincot
Company ed, Philadelphia, 1988, 1129 p.
73. BRICHARD B. Tumeur de Wilms : apport de la biologie
moléculaire dans la compréhension de la genèse de cette
tumeur. Louvain med. 118: 253-260, 1999.
74. Hameury F., Dussart S., Dijoud F., Thiesse P., Leclair
M.D., Gauthier F., Mouriquand P.D.E. and Bergeron C. .Cancérologie,
hématologie, immunologie - Extension vasculaire du néphroblastome
: expérience du SIOP 93-2001, France.
Archives de
Pédiatrie
Volume
15, Issue 5, June2008, P. 944-945
75. BE-FONG CHEN et Al 2004 = Chen BF., Tzen CY., Liang
DC., Liu HC., Huang YW., Fan CC.Immunohistochemical Expression of Wilms'Tumor 1
Protein in Nephroblastoma. J Chin Med Assoc 2004; 67: 506-510
76. SOW M., MBAKOP A., OBAMA MT., TEDJOUA E., ABONDO A. Les
tumeurs du rein en milieu africain. Incidence et aspects anatomo-cliniques. A
propos de 123 cas observés à l'Hôpital Central et au C.H.U.
de Yaoundé (Cameroun).ProgUrol 1994 ; 4 : 214-218
77. OUATTARA O., GOULI J.C., ODEHOURI-KOUDOU T.H., YAO
K.J.B., SAMBA T., DIETH A.G., KOUAME D.B., DICK R.K. Aspects diagnostiques des
tumeurs abdominales malignes de l'enfant. J AfrChir Digest 2009; 9 (2): 913
- 917
78. Landolsi A., Ben Fatma L., Kallel K., Gharbi O., Zakhama
A., Golli M., Mosbah F., Kraiem C., Nouri A., Ganouni A. and S. Ben Ahmed.
Étude anatomoclinique et pronostique des néphroblastomes dans le
centre tunisien.
Annales
d'Urologie
Volume
37, Issue 4, 1 August 2003, Pages 164-169
79. Mrad. K., Driss M., Abbes I., Charfi L., Sassi S., Oubiche
F., Barsaoui S. and Ben Romdhane K. Le néphroblastomerhabdomyomateux :
quelle signification histo-pronostique ?
Annales de
Pathologie
Vol
24, Suppl 1, Nov 2004, p148
80.
MEKKI M. ;
LANDOLSI A.;
BELGHITH M.;
KRICHENE I.;
CHELLY S.;
ZAKHAMA A.;
JOUINI R.;
GOLLI M.;
GAHBICHE M.
;
NOURI A.Tumeurs
rénales malignes avant l'âge d'un an. Expérience d'un
service de chirurgie pédiatrique nord africain.
Annales
d'urologie
2003, vol. 37, no5, pp. 239-243
81. AUDRYG. et Al 2008= G. Audry, M. Peycelon, A. Charieg, M.
Larroquet, L. Boccon-Gibod, C. Patte, J. Landman-Parker, G. Schleiermacher, C.
Bergeron, H. DucouLepointe and P.G. Helardot. Chirurgie des
néphroblastomes associés à de la
néphroblastomatose(23 patients). Archives de pédiatrie
2008 ,15, 888-SFCP-004.
82. S. Touhem, M. Abbane, M. Salah Bali,
A. Djemaa. Prise en charge du néphroblastome (à propos de
42 cas). Expérience du service de radiothérapie oncologie du
centre hospitalier universitaire Benbadis de Constantine. Cancer /
Radiothérapie 2009,vol 13, numéro 6-7
page 658 (octobre 2009)
83.
LEMERLE J. ;
TOURNADE M.
F.;
PEIN F.Le
néphroblastome, modèle des cancers chimiosensibles de l'enfant.
Expansion scientifique, Paris, FRANCE
1999, vol. 75, no7-8, pp. 233-239
84. Camassei F. D., Arancia G., Cianfriglia M., Bosman C.,
Francalanci P., Ravà L., Jenkner A., Donfrancesco A., and
BoldriniR.Nephroblastoma : Multidrug-Resistance P-Glycoprotein Expression in
Tumor Cells and Intratumoral Capillary Endothelial Cells. Am J ClinPathol
2002;117:484-490
85. Groupe franco-africain d'oncologie pédiatrique.
Rapport d'activité 2007-2008. 15p ????
86. FELGENHAUER J.L., BARCE J.M., BENSON R.L., NAN B., OLSON
J.M., BRESLOW N.E. : No Excess of early onset cancer in family members of wilms
tumor patients. Cancer, 2001 ; 92 : 6.
87. Munyanga M, Kuzondisa. « Evaluation
des projets », annexe du module : Méthodes
d'évaluation économique des programmes de santé, ESP,
2004-2005, p61
88. Mvudi M, Bongo B. « Notion de base en
économie», annexe du module, ESP, 2004-2005, p2
89. Launois R. Typologie des coûts en
comptabilité analytique. In : Ateliers de la transparence :
comparaison des coûts des thérapeutiques dans le dossier de la
transparence. Travaux de l'Atelier n° 6. Paris : Snip, 1995.
90. Lututala M, Alfred Coffi. « les coûts
annexes des soins d'hospitalisation des malades dans le réseau
BDOM-KINSHASA », Avril 2004, p74
91. Louis Ménard et coll., Dictionnaire de la
comptabilité et de la gestion financière, Toronto,
L'Institut Canadien des Comptables Agréés, 1994.
92. Launois R. Un coût, des coûts, quels
coûts ? Journal d'Économie Médicale 1999 ; 17 :
77-82.
| 


