
Université des Sciences et Techniques de Masuku
(USTM)
~~~~~~~~~~~
~~~~~~~~~~~
Institut National Supérieur
d'Agronomie
et de Biotechnologies
(INSAB)
~~~~~~~~~~~
Département Phytotechnologie
~~~~~~~~~~~~~~~~~~
THEME
CINETIQUE DE LA RICHESSE TIF. LA CANNE A SUCRE
(Saccharum officinarum L.)
EN FONCT~~~ V U DELJ%I DE ~~~~~~~~~~
Stage effectué du 23 A !"# au 3$ Oct%&!e 2$'2
SUCAF Gabon
Présenté et Soutenu par :
M. Eric RAIVIRE
our l'obtention du Diplôme d'Ingénieur Agronome
O(t"%) : Production Végétale
D"!"gé (a! *
Dr. Paul ONDO
OVONO
Enseignant chercheur à l'INSAB
Maître
assistant CAMES
E)cad!eu!+*
M. Juslin OBIANG ASSEKO Ingénieur
Agronome
Année Académique :
2011- 2012
Déclaration sur l'honneur
Par la présente, je soussigné M. Eric RAIVIRE,
certifie avoir rédigé ce mémoire de fin de cycle
intitulé : « Cinétique de la richesse de la canne à
sucre, en fonction du délai de maturation ».
Seul et sans aucune aide interdite, je ne me suis basé
sur aucune autre source que celles citées dans le manuscrit. Ce
mémoire n'a ni dans sa forme actuelle, ni dans sa forme proche,
été soumis à une autre institution.
Franceville, le ...../...../20I3
M. Eric RAIVIRE
Dédicace
A.
Ma mère Altesse Marie MBOUMBA qui très tôt
m'a inculqué la valeur de l'effort.
« La culture de la terre est une science, et la nature ne
se révèle qu'à ceux qui s'appliquent à la
connaitre, elle garde pour les autres ses voiles et ses mystères
»
Charles Saint-Foi
(Livres des Peuples et des Rois)
« La théorie, c'est quand on sait tout et que rien
ne fonctionne. La pratique, c'est quand tout fonctionne et que personne ne sait
pourquoi. Ici, nous avons réuni théorie et pratique : Rien ne
fonctionne... et personne ne sais Pourquoi !»
Albert Einstein
Remerciements
C'est avec beaucoup de reconnaissance et une émotion
certaine que je rédige ces quelques lignes. Elles marquent le point
final de ce mémoire, mais également l'aboutissement de cinq
années d'acquisition de savoirs, de collaborations, de
découvertes et d'amitiés créées ou
renforcées au sein de l'INSAB, et de SUCAF Gabon. Je ne saurai citer
toutes les personnes, dirigeants, encadreurs, collègues, conseillers,
amis ou membres de ma famille qui, de près ou de loin, ont permis la
réalisation de ce travail et le bon déroulement de cette
étude. Ces remerciements vous sont adressés à tous, et
tout particulièrement :
M. Gérard MALAVAL, Directeur
Général Adjoint SUCAF Gabon qui m'a fait l'honneur de vivre cette
belle expérience auprès des professionnels de la filière
canne à sucre au Gabon en marquant favorablement son accord à ma
venue au sein de l'entreprise.
M. Luc HOLSTEYN, Directeur du
département culture SUCAF Gabon, de m'avoir permis de réaliser ce
travail au sein de son département;
M. Jean Baptiste ABOGHE MBA, Directeur
Adjoint du Département culture, Chef de Service Agronomique pour, ses
conseils d'ainé et la confiance accordée;
M. Nicholas Aimé SABELA, Chef de
Service culture pour ses avis, ses propositions intéressantes;
M. Juslin OBIANG ASSEKO, Chef de Service
Agronomique adjoint, pour les multiples échanges enrichissants, la
rigueur professionnelle, la lucidité, l'optimisme, son
irréprochable disponibilité. Merci pour le partage des
connaissances et de l'expérience professionnelle;
M. Paul ONDO OVONO, Docteur en Sciences
agronomiques, enseignant chercheur au département phytotechnologie de
l'INSAB, pour l'encadrement scientifique, le regard critique sur l'approche de
la thématique, d'avoir lu, corriger les incohérences et
défauts lors de la rédaction de ce mémoire qu'il sache le
plaisir grandissant que j'ai eu dans notre relation de travail;
Mlle Flavie LARBRE, Consultante SUCAF Gabon,
qui très tôt s'est montrée disponible, m'a donnée
des avis éclairés m'ayant permis d'avoir une lisibilité
d'ensemble sur les questions que je devais aborder;
M. Léandre MOUAYA, pour nos
échanges entre « collègues Ingénieurs »;
Aux Directeurs et Chefs de service des
différents départements, SUCAF Gabon pour la promptitude
dont ils ont fait montre dans les explications et la présentation
générale de leurs services respectifs;

Aux Chefs de sections, MM. Hervé
BENNI, Michel HOUNDAKOULA pour leurs conseils pratiques sur les
opérations de suivi maturité;
Au personnel permanent et saisonnier, du
service agronomique pour leurs implications lors des analyses, qu'ils sachent
le plaisir que j'ai eu à échanger avec eux.
Pr. Alain SOUZA, Professeur en pharmacologie,
Directeur Général de l'INSAB pour son coaching personnel et ses
conseils d'ainé;
Dr. Maurice OGNALAGA, enseignant chercheur
à l'INSAB pour sa participation active dans la réalisation de ce
travail;
Corps administratif et enseignant de l'USTM,
et de l'INSAB pour la transmission du bien le mieux partagé « la
connaissance »;
Mme Georgette MOUBIDAGHA, secrétaire
du service agronomique SUCAF Gabon pour ses encouragements et ses conseils
pendant les moments de doutes et d'inquiétudes;
Mme Pierrette MBOU pour sa
disponibilité;
Mes Parents, sans qui tout cela n'aurait pas
été possible, pour leur inestimable soutien dans
l'accomplissement de mes études, pour leurs encouragements dans tous mes
choix, pour m'avoir transmis leur volonté et leur détermination,
leur respect d'autrui, leur humilité, et leur goût de la vie,
indispensables à cette aventure. Avec tout mon amour.
Ma très chère et adorable fiancée
Mlle claire NTSINTOU NDOUMBA pour son amour, sa tendresse
et son affection sans cesse manifesté. Par ces quelques lignes
reçois toute l'admiration, la fierté de ton « lapin
».
Tous les Amis, d'ici et d'ailleurs, qui m'ont
suivi et supporté tout au long de ce travail, pour leur soutien
permanent et leur amitié, qu'ils en soient vivement remerciés, et
tout particulièrement, M. Denis ASSEY, Mlle Vanessa
Benedicta, MEDJELE SATOKA, MM. Brice MOUITY, Ruffin MOUKAGNI et le bureau
d'étude U'dix avec tous ses agronomes.
Avant propos
La dynamique de production agricole dans laquelle nombre de
pays sont engagés notamment le Gabon impose la mise en place de
politiques pragmatiques et cohérentes fondées sur les
thématiques de formation, recherche, développement. Ce model
conceptuel de l'agriculture moderne implique qu'en amont la formation de la
ressource humaine soit assurée, tant en personnel d'encadrement
qu'exécutant et en aval, que des axes de recherches soient
élaborés avec pour finalité, permettre le
développement socio économique.
C'est pour répondre à cette « double »
exigence que l'Institut National Supérieur d'Agronomie et de
Biotechnologies envoie en stage thématique ses étudiants dans
différentes structures agricoles dans l'optique de compléter les
enseignements théoriques proposés dans l'offre de formation par
un apprentissage pratique sur le terrain, et participer à la
résolution de problématiques de
recherche-développements.
Le présent mémoire, que nous soumettons à
la critique scientifique sanctionne la fin d'une enrichissante « aventure
scientifique et humaine » qui s'est déroulée six mois durant
au complexe agro industriel de SUCAF Gabon sur la thématique de
« la cinétique de la richesse de la canne à sucre en
fonction du délai de maturation ».
Ce document restitue les résultats obtenus au cours de
cette étude, tout comme, il fait des suggestions à l'entreprise
SUCAF Gabon, relativement à la durée du suivi de la maturation,
la période optimale de la richesse des variétés
Co997 et NCo376 ainsi que le délai de
maturation auquel cette richesse est obtenue.
Table des matières
Déclaration sur l'honneur ..i
Remerciements . iii
Avant propos v
Table des matières vi
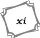
Liste des abréviations .x
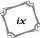
Liste des Figures xi
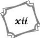
Liste des tableaux xii
Liste des annexes xiii
Résumé xiv
Abstract xvi
Introduction 1
Chapitre I. REVUE BIBLIOGRAPHIQUE
I. Eléments de généralités
sur la canne à sucre . 4
I.1. Taxonomie, description et cycle de production 4
I.1.1. Taxonomie et description 4
I.1.2. Physiologie et développement ..5
I.1.3. Qualités agronomiques de la canne à sucre
5
I.2. Ecologie .7
I.2.1. Climat ...7
I.2.2. Conditions édaphiques . 8
I.3. Plantation de la canne à sucre
.9
I.4. Récolte de la canne à sucre
10

I.5. Bio agresseurs de la canne à sucre
11
I.5.1. Les maladies 11
I.5.2. Moyen de lutte 11
I.5.3. Ravageurs ..12
I.6. Production du matériel
végétal . .14
I.6.1. Obtention des variétés en station 14
I.6.2. La sélection variétale 15
II. La phase de maturation et de surmaturation
16
II.1. Définition 16
II.2. Type de maturation .16
II.2.1. Maturation naturelle ..17
II.2.2. Maturation forcée 17
II.2.3. Classification des maturateurs 17
II.2.3.1. Les défoliants 18
II.2.3.2. Les Déshydratants .18
II.2.3.3. Les régulateurs de croissance 18
II.2.3.4. Les enzymes inhibiteurs 19
II.3. Les principaux maturateurs et leur composition
chimique 19
II.3.1. L'Ethephon 19
II.3.2. Le Glyphosate 19
II.3.3. Le Fusilade 21
II.3.4. Hydrazide maleique 22
II.3.5. Imazapyr 22

II.3.6. Paraquat 22
II.3.7. Autres maturateurs 22
II.4. Conditions d'épandage de maturateurs
23
II.5. Effets néfastes de la maturation :
Risque environnemental 24
II.6. Alternatives à l'usage des murisseurs de
la canne à sucre 26
II.7. Surmaturation de la canne à sucre
27
III. La richesse en sucre. 27
III.1. Définition 27
III.2. Le saccharose 28
III.2.1. Propriétés physiques du saccharose
28
III.2.2. Propriétés chimiques du saccharose
29
III.3. Composition du jus de canne à sucre
29
III.4. Eléments d'évaluation de la
richesse en sucre 30
III.4.1. Le Brix 30
III.4.2. Le Pol 30
III.4.3. La pureté 31
III.4.4. Le Rendement Hugo Simplifié 31
III.5. Evolution de la Richesse en sucre au cours du
cycle de production 31
III.5.1. La phase de croissance 31
III.5.2. La phase de maturation 32
Chapitre II. MATERIEL ET METHODES
I. Matériel 33
I.1. Le matériel végétal 33

I.1.1. Caractéristiques du matériel
végétal étudié 33
I.2. Le matériel technique 34
II. Méthodologie 35
II.1. Localisation géographique des parcelles
expérimentales 35
II.2. Dispositif expérimental ou l'essai 35
II.3. Protocole expérimental 36
II.3.1 Epandage du maturateur 36
II.3.2. Suivi de la cinétique de la richesse 36
II.3.3. Echantillonnage des cannes dans les parcelles 36
II.3.4. Extraction, filtrage et réception du jus 37
II.3.5. Analyse du jus 38
III. Analyse statistique des résultats
38
Chapitre III. RESULTATS
III.1. En début campagne, plot à maturation
naturelle 39
III.1.1. Evolution du Brix (PB) 39
III.1.2. Evolution de la Pureté (PB) 39
III.1.3. Evolution du rendement Hugot RHS (PB) 39
III.2. Plot à maturation forcée
.42
III.2.1. Evolution du Brix (PT) 42
III.2.2. Evolution de la Pureté (PT) 42
III.2.3. Evolution du rendement Hugot RHS (PT) 42
III.3. Evolution richesse moyenne RHS (PT) 44
III.3.1. Secteur Ouelle .44
III.3.2.Analyse de variance pour la richesse secteur Ouelle
44
III.2.3. Comparaison de richesse à 35 et 47 jours
secteur Ouelle 44
III.4. Evolution de la richesse moyenne RHS (PT)
...46
III.4.1. Secteur Bangouvou .46
III.4.2. Analyse de variance pour la richesse secteur
Bangouvou .46
III.4.3. Comparaison richesse à 35 et 42 jours secteur
Bangouvou 47
III.5. Période milieu campagne, plot à
maturation naturelle ..48
III.5.1. Evolution du Brix 48
III.5.2. Evolution de la Purete 48
III.5.3. Evolution du rendement Hugot RHS (PB) 48
III.6. Période milieu campagne, plot à
maturation forcée ..51
III.6.1. Evolution du Brix 51
III.6.2. Evolution de la Pureté 51
III.6.3. Evolution du rendement Hugot RHS (PB) 51
III.7. Evolution de la richesse moyenne RHS (PT)
53
III.7.1. Secteur Mvengue 53
III.7.2. Analyse de variance pour la richesse secteur Mvengue
.53
III.7.3. Comparaison de la richesse 35 et 42 jours secteur
Mvengue ..54
III.8. Evolution de la richesse moyenne RHS (PT)
55
III.8.1. Secteur Ouelle* 55
III.8.2. Analyse de variance pour la richesse secteur Ouelle
..55
III.8.3. Comparaison de richesse 35 et 39 jours secteur Ouelle
56
III.9. Gain de richesse 57
|
III.10. Corrélation entre gain de richesse et
délai
|
59
|
|
III.10.1. Début campagne
|
59
|
|
III.10.1.1. Secteur Ouelle...
|
59
|
|
III.10.1.2. Secteur Bangouvou
|
60
|
|
III.10.2. Milieu campagne
|
61
|
|
III.10.2.1. Secteur Mvengue
|
61
|
|
III.10.2.2. Setcteur Ouelle
|
..62
|
|
Chapitre IV. DISCUSSION
IV.1. Analyse globale des résultats
|
..63
|
IV.2. Délais de maturation et optimum de richesse
|
..65
|
IV.3. Gain de richesse
|
|
.65
|
|
|
Conclusion
|
67
|
|
Bibliographie
|
70
|
|
Lexique
|
78
|
Liste des abréviations
ANOVA : Analyse de la Nouvelle Variance ;
BGV : Bangouvou ;
B46.364 : Variété provenant de la
station de recherche de la Barbade, sélectionnée en 1946
identifiant 364 ;
B66.23 : Variété provenant de la
station de recherche de la Barbade, sélectionnée en 1966,
identifiant 23 ;
C.M : Carré Moyen ;
Co997 : Variété provenant de la
station de recherche basée à Coimbatore (Inde), identifiant 997
;
I.C.U.M.S.A : International Commission for Uniform Methods
of Sugar Analysis ;
I.N.S.E.E : Institut National de la Statistique
et des Etudes Economiques ;
I.U.P.A.C : International Union of Pure and Applied
Chemistry ;
MSIRI : Mauritius Sugar Industry Research
Institute ;
NCo310 : Variété provenant de la
station du Natal (Afrique du Sud) avec des graines de Coimbatore (Inde),
identifiant 310 ;
NCo376 : Variété provenant de la
station du Natal (Afrique du Sud) avec des graines de Coimbatore (Inde),
identifiant 376.
OU : Ouelle ;
OU* : Ensemble des parcelles testes
concernées par l'étude en période de milieu campagne ;
R.H.S : Rendement Hugo Simplifié ;
R01, R02, R03...Rn : 1ère
repousse, 2ème repousse, 3ème
repousse,...nème repousse ;
SCE : Somme des Carrés des Ecarts ;
SARIS Congo : Société Agricole et
de Raffinage Industriel du Sucre du Congo ;
S.A.S.A : South African Sugar Association;
SO.SU.CAM : Société
Sucrière du Cameroun ;
SO.SU.HO : Société sucrière
du Haut Ogooué ;
S.S.A.T : Swaziland Sugar Association Technical
Services;
SUCAF Gabon : Sucrerie d'Afrique-Gabon ;
TC : Tonne canne ;
TC/ha : Tonne canne par hectare ;
TS/ha : Tonnage sucre par hectare ;
VG : M'vengue
°Z : Unité désignant la
déviation du plan de polarisation du saccharose vers la gauche
(Lévogyre)
Liste des figures
Figure 1. Reprise des bourgeons
latéraux dus au phénomène de surmaturation 25
Figure 2. Structure d'une molécule de
saccharose 26
Figure 3. Schéma du dispositif
expérimental 33
Figure 4. Evolution de la richesse moyenne
secteur Ouelle début campagne 41
Figure 5. Evolution de la richesse moyenne
secteur Bangouvou début campagne 43
Figure 6. Evolution de la richesse moyenne
secteur Mvengue milieu campagne 50
Figure 7. Evolution de la richesse moyenne
secteur Ouelle* milieu campagne 52
Figure 8. Corrélation : Gain de
richesse et délai de maturation secteur Ouelle 3 56
Figure 9. Corrélation : Gain de
richesse et délai de maturation secetur Bangouvou 57
Figure 10. Corrélation : Gain de
richesse et délai de maturation secteur Mvengue 58
Figure 11. Corrélation : Gain de
richesse et délai de maturation secteur Ouelle* 59

Liste des tableaux
|
Tableau 1. Exigences climatiques de la canne
à sucre
|
8
|
|
Tableau 2. Exigences édaphiques de la
canne à sucre
|
.8
|
|
Tableau 3. Comparaison des différents
cycles d'exploitation de la canne vierge
|
9
|
|
Tableau 4. Composition de 100g de jus de canne
|
27
|
|
Tableau 5. Caractéristiques agro
morphologiques des variétés étudiées
|
..31
|
|
Tableau 6. Caractéristiques et
utilisation du matériel d'étude
|
32
|
Tableau 7. Période début Campagne,
plot à maturation naturelle : Paramètres de richesse....38
Tableau 8. Période début Campagne, plot à
maturation forcée : paramètres de richesse.......40
Tableau 9. Analyse de variance pour la richesse
secteur Ouelle (3) 42
Tableau 10. Test de comparaison de Dunnett :
richesse à 35 et 47 jours Ouelle (3) .43
Tableau 11. Analyse de variance pour la richesse
Bangouvou 44
Tableau 12. Test de comparaison de Dunnett :
richesse à 35 et 42 jours Bangouvou 44
Tableau 13. Période milieu campagne, plot
à maturation naturelle : Paramètres de richesse 46
Tableau 14. Période milieu campagne, plot
à maturation forcée : Paramètres de richesse 48
Tableau 15. Analyse de variance pour la richesse
Mvengue 51
Tableau 16. Test de comparaison de Dunnett
richesse à 35 et 42 jours Mvengue 51
Tableau 17. Analyse de variance pour la richesse
Ouelle* 53
Tableau 18. Test de comparaison de Dunnett
richesse à 35 et 42 jours Ouelle* 53
Tableau 19. Gain de richesse par secteur 54
Liste des annexes
Annexe 1a. Caractéristiques anatomique et
morphologiques de la canne à sucre
Annexe 1b. Caractéristiques anatomique
et morphologiques de la canne à sucre
Annexe 2. Physiologie et développement
de la canne à sucre
Annexe 3. Principales maladies de la canne
à sucre
Annexe 4. Principaux ravageurs de la canne
à sucre
Annexe 5. Table de correction du Pol
Annexe 6. Formulaire
Annexe 7. Programme de maturation des parcelles
Annexe 8a. Dispersion de la moyenne de
richesse entre l'optimum et le témoin : secteur OU
Annexe 8b. Dispersion de la moyenne de
richesse entre l'optimum et le témoin : secteur BGV
Annexe 8c. Dispersion de la moyenne de
richesse entre l'optimum et le témoin : secteur VG
Annexe 8d. Dispersion de la moyenne de
richesse entre l'optimum et le témoin : secteur OU*

Résumé
La culture intensive de la canne à sucre au Gabon a
débuté en 1976, d'abord avec la SO.SU.HO, puis avec SUCAF Gabon
depuis 1999.
En trente cinq ans (35), en dépit de nombreux efforts,
la production reste en deçà des objectifs, pour cause, des
facteurs endogènes tels que l'application des délais de
maturation qui restent faibles 35 jours comparativement à ceux d'autres
sucreries, environ 42 à 49 jours à SOSUCAM.
C'est dans le souci d'une recherche de perspectives visant
l'amélioration du niveau actuel de production, et de mieux gérer
le suivi de l'itinéraire technique de la culture que SUCAF Gabon propose
d'étudier la cinétique de la richesse de la canne en fonction du
délai de maturation.
L'objectif principal, est d'évaluer l'effet d'une
augmentation du délai de maturation sur la richesse des
variétés Co997 et NCo376. Aussi,
déterminer la période pour laquelle la richesse atteint son
optimum, de sorte à mieux prédire les dates de récoltes
des parcelles.
Pour réaliser l'étude, douze (12) parcelles sont
concernés, dont six (6) par période de campagne (Début et
Milieu). Ces variétés sont répétées 3 fois
correspondant aux parcelles des différents secteurs. Dans chaque
parcelle, on applique le traitement (T) constitué de Fusilade
super® à la dose de 0,3L/ha, et on suit hebdomadairement
l'évolution de la richesse au-delà de 35 jours.
Au terme de l'étude, les résultats ci après
ont été obtenus : En début campagne :
Dans le secteur Ouelle, l'augmentation du délai de
maturation n'a pas eu un effet significatif sur la richesse
p-value>á. Par ailleurs, le gain de richesse est de 0,47 point et
l'optimum de richesse est atteint à 47 jours.
Dans le secteur Bangouvou, l'augmentation du délai de
maturation a eu un effet significatif sur la richesse p-value<á. Le
gain de richesse est de 0,76 point et l'optimum de richesse est atteint
à 42 jours.
En milieu campagne :

Dans le secteur Ouelle*, il n'y a pas eu un effet significatif
d'une augmentation du délai de maturation sur la richesse
p-value>á. Le gain de richesse obtenu est négatif -0,6 point,
tandis que l'optimum de richesse n'est pas fixé, mais se situe
au-delà de 39 jours.
Dans le secteur Mvengue, il n'y a pas eu un effet significatif
d'une augmentation du délai de maturation sur la richesse
p-value>á. Le gain de richesse est de 0,4 point et l'optimum de
richesse est atteint à 42 jours.
398 mots
Mots clés: Canne à sucre
-Délai de maturation - Richesse « Saccharose » (6
mots)

Abstract
Intensive culture of the sugarcane in Gabon has begun in 1976,
initially with SO.SU.HO, then with SUCAF Gabon since 1999.
In thirty five years (35), in spite of many progresses, the
production remains weak compared to objectives, due of the endogenous factors
such as the application of the times of ripening which remain weak 35 days
comparatively to those of other sugar refineries, approximately 42 to 49 days
to SO.SU.CAM.
In order to seek prospects aiming at the improvement for the
current level of production, and to better manage the follow-up of the farming
technique route that SUCAF Gabon proposes to studied the kinetics of the
richness of the cane according to the time of maturation.
The principal objective is to evaluate the effect of an
increase in the duration of ripening on the richness of the varieties
Co997 and NCo376 Also, to determine the period
for which the richness reaches its optimum, of kind to better predicting the
dates of harvests of the plots.
To make this study, twelve (12) plots are concerned, including
six (6) per period of harvest's season (Beginning and Medium) at a rate of
three (3) per variety. These varieties are repeated 3 times corresponding to
the pieces of the various sectors. In each plots, one applies treatment
(T) made up of Fusilade super ® to the amount of 0.3
L/ha, and one weekly follows the evolution of the richness beyond 35 days.
At the end of the study, these results were obtained:
In beginning harvest's period:
In the Ouelle sector, the increase in the duration of ripening
have not a significant effect on the richness p-value>á. In addition,
the profit of richness is 0.47 point and the optimum of richness is reached at
42 days.
In the Bangouvou sector, the increase in the duration of
ripening have a significant effect on the richness p-value <á. The
profit of richness is 0.76 point and the optimum of richness is reached at 42
days.
In medium harvest's period:
In the Ouelle* sector, there is not a significant effect of an
increase in the duration of ripening on the richness p-value>á. Any
time, the profit of richness obtained is negative -0.6 point, while the optimum
of richness is not fixed, but is beyond 39 days.
In the sector Mvengue, there is not a significant effect of an
increase in the duration of ripening on the richness. p-value>á.
However the profit of richness is 0.4 point and the optimum of richness is
reached at 42 days.
398 words
Key words: Sugarcane - Duration of
ripening - Richness «Sucrose» (6 words)
Introduction
La canne à sucre Saccharum officinarum L.
(Poacées), est une plante pluriannuelle aux usages multiples. Elle
est principalement cultivée pour sa tige dont on extrait le sucre
cristallisable: le saccharose (FAUCONNIER, 1991). Avec une production annuelle
supérieure à 130 millions de tonnes (FAO, 2002), la canne
à sucre est la première plante cultivée au monde. Ce
positionnement sur le marché international se justifie par le fait d'un
accroissement des besoins de consommation en sucre, et le développement
de l'industrie du bio éthanol comme alternative aux énergies
fossiles « pollueuses » de l'environnement. Au cours de la
dernière décennie 2000-2010, la production mondiale de sucre est
passée de 133,4 à 173 millions tonnes avec près de la
moitié réalisée par les trois principaux producteurs que
sont le Brésil, l'Inde et l'Union Européenne. (F.A.O, 2010). Dans
cette dynamique de production, le continent africain n'est pas en reste, sa
contribution est de l'ordre de 10,5 million de tonne par an, soit 8% de la
production mondiale, tandis que la production de l'ensemble des pays de
l'Afrique Centrale avoisine les 200.000 tonnes dont 25.000 tonnes en moyenne
pour le Gabon (F.A.O, 2010). Pour autant, la production de sucre provenant de
la canne à sucre reste à améliorer afin de répondre
aux exigences et enjeux du moment. Depuis le XIXème
siècle, des cultures comme la betterave sucrière Beta
Vulgaris (Chénopodiacées) sont expérimentées
en raison de leur aptitude à produire le saccharose en vu de
suppléer l'actuelle production de canne à sucre. (Ky et
al, 1997). Cependant la production de saccharose provenant de
l'exploitation industrielle de la betterave reste encore marginale puisqu'elle
ne représente que le quart de la production mondiale de sucre
(I.N.S.E.E, 2002).
Pour arriver à soutenir voire augmenter la production
actuelle de sucre de canne de façon durable dans ce contexte de
monoculture intensive, des efforts sont à fournir, notamment, user d'une
technicité parfaite tout au long du cycle de production avec un point
d'honneur sur la phase de maturation.
Van DELLEWIJN (1952) définit simplement la maturation
comme étant une « accumulation de sucre dans la tige ». Pour
SOOPRAMIEN (2000), la maturation correspond à une phase de
synthèse, d'accumulation de saccharose et de l'utilisation des
ressources carbonées. Selon le S.S.A.T (2003) la phase de maturation de
la canne est un processus physiologique au cours duquel, la plante accumule le
sucre cristallisable (saccharose) dans la tige, et corrélativement
réduit sa croissance végétative. Elle s'accompagne d'une
élévation de

la pureté et de la fibre ainsi que d'une
réduction sensible du glucose (sucre non cristallisable), de l'eau et de
l'acidité du jus.
En matière de recherche et développement, c'est
dans la première moitié du XXème siècle,
que de nombreuses publications ont été consacrées à
la compréhension de la maturation et l'utilisation de maturateurs
chimiques sur la canne à sucre aux Etat Unis (Floride en 1920) (GILBERT,
2002), et en Australie avec les travaux de SKINNER (1956). En Afrique, et plus
précisément en Afrique du Sud, les premières publications
sur la maturation et les maturateurs de la canne à sucre voient le jour
par Harry ROSTRON en 1973 cité par (MORGAN, 2003). Actuellement, de
nombreux travaux sont effectués dans l'optique de mieux contrôler
les paramètres de ce processus et relever les effets induits qu'il
pourrait avoir tant sur la reprise des repousses, que sur le rendement des
parcelles maturées que l'impact environnemental. Des recherches ont pu
mettre en évidence l'influence des facteurs abiotiques tels que le
climat sur le déroulement du processus de maturation. En effet, les
températures basses, un niveau de précipitation faible, la
sècheresse et un fort ensoleillement occasionnent une augmentation de la
richesse en saccharose, alors que le contraire est observé lorsque les
conditions climatiques sont plus favorables à la croissance
végétative (GLOVER, 1972; ALEXANDER, 1973; LEGENDRE, 1975; BIANG
NZIE, 1993).
Au Gabon, les études portant sur les aspects de la
maturation de la canne à sucre sont encore au stade expérimental,
sinon mal connus. Cette insuffisance en termes de production scientifique
implique une nécessité pour l'entreprise SUCAF Gabon d'actualiser
et renforcer qualitativement ses méthodes de production en se conformant
aux standards appliqués dans d'autres sucreries avec in fine
l'objectif d'améliorer la production actuelle de sucre.
En terme de durée, la période de maturation
varie selon le climat, la région, et la variété. En
général, elle s'étend de 8 à 22 mois (LACOSTE,
2004). A SUCAF Gabon, le délai théorique de maturation est
observé en fonction des variétés exploitées. Il est
de 42 jours pour la B46.364, et de 35 jours pour les
variétés comme la NCo376, Co997 (PEME, 2004). Comparativement aux
délais considérés à SOSUCAM 35 à 49 jours en
fonction de la saison (OBIANG, 2010), ou 35-70 jours en Afrique du Sud
(S.A.S.A, 1998), les délais pratiqués à SUCAF Gabon
semblent faibles.
Subséquemment à ce constat, l'entreprise propose
une augmentation de la durée du suivi de la maturité, dans
l'optique de relever son incidence sur l'évolution de la richesse en
saccharose

C'est dans ce contexte que l'étude portant sur la
« cinétique de la richesse en saccharose en fonction du
délai de maturation » est menée. L'objectif de
l'étude étant à terme de:
Evaluer l'effet que pourrait avoir un rallongement du
délai théorique de maturation, de sorte à cerner avec
précision l'intervalle de temps pour lequel l'optimum de richesse serait
atteint pour chacune des variétés étudiées;
Permettre à l'entreprise SUCAF Gabon de revoir son
programme de maturation en coupant des parcelles qui sont à leur optimum
de richesse.
Pour aborder cette thématique, nous présenterons
successivement les points théoriques qui définissent chaque
chapitre. D'abord nous dresserons au chapitre I une synthèse
bibliographique afin de repositionner la problématique par rapport aux
projets de recherches actuels. Le chapitre II présentera le
matériel utilisé, la méthodologie adoptée et
l'outil statistique qui ont permis la réalisation de l'étude. Les
chapitres III et IV sont consacrés à la présentation des
résultats, ainsi qu'à la discussion de ces derniers, alors que le
dernier point de l'étude s'attache à la présentation des
limites et des perspectives suggérées par l'étude.
I. Eléments de généralités
sur la canne à sucre I.1. Taxonomie, description et cycle de production
I.1.1. Taxonomie et description
Le genre Saccharum comprend plusieurs espèces
dont la classification s'est faite sur la base du type d'organes (rachis
duveteux ou glabres) et de leur fonctionnement (ordre d'ouverture des
épillets). Le fonctionnement des épillets est un critère
de choix dans la classification. Ainsi, la classification suivante est
considérée pour la canne à sucre (FAUCONNIER, 1991) :
Règne : Végétal
Embranchement : Angiosperme
Classe : Monocotylédones Ordre :
Scitaminales Sous- ordre : Graminées
Famille : Poacées
Sous-famille : Cannacées Tribu :
Saccharidées Genre : Saccharum
Espèce : Officinarum.
La canne à sucre constitue l'une des plus importantes
cultures des régions tropicales. Elle couvre près de 19 millions
d'hectares cultivés dans 97 pays. Son aire de dispersion se situe entre
latitude 37 °N et 30°S, limité par le
climat et l'altitude (FAUCONNIER et al, 1970 ; CHAMPOISEAU, 2006).
Originaire de la Nouvelle Guinée (Westphal et
al, 1985), la canne à sucre atteint 2 à 5 m de hauteur
pour un diamètre de 2 à 6 cm à maturité (Van
DILLEWIJN, 1960). Elle ne se ramifie pas au-dessus du sol mais les yeux
souterrains donnent naissance à d'autres tiges. Une touffe de canne peut
comporter 10 à 15 tiges. Chacune de ses tiges se compose d'une
succession de noeuds plus ligneux, où sont implantés les yeux et
d'entre noeuds (HUBERT, 1968).
La tige de canne est constituée d'une série de
phytomères qui prennent naissance au niveau du méristème
végétatif apical au sommet de la tige.

Un phytomère est constitué d'un entre-noeud et
d'un noeud qui porte la gaine prolongée par le limbe foliaire.
L'intérieur de la tige est constitué d'une masse importante de
tissus de stockages (essentiellement pour le saccharose) formée de
cellules du parenchyme entre lesquelles se trouvent les faisceaux vasculaires
du phloème et du xylème (SOOPRAMIENS, 2000).
Les feuilles de canne à sucre ont ordinairement une
phyllotaxie alterne. Elles sont insérées sur les noeuds et sont
composées de deux parties, la gaine et le limbe foliaire
séparés par une articulation comprenant l'ochréa, la
ligule et les auricules. La gaine, de forme tubulaire, est la
partie basse de la feuille qui s'enroule autour de l'entre-noeud (Van
DILLEWIJN, 1960).
Une coupe transversale du limbe foliaire révèle
des épidermes supérieurs et inférieurs entre lesquels se
trouvent des cellules fibreuses, des cellules du parenchyme ou du
mésophylle et de larges faisceaux vasculaires (SOOPRAMIEN, 2000). Les
faisceaux du phloème et du xylème de la gaine foliaire
communiquent avec les faisceaux correspondants de la tige au niveau du noeud
lorsque les feuilles sont encore jeunes (BLACKBURN, 1984).
Le système racinaire se développe à
partir de la primordia racinaire lorsqu'une partie de la tige de canne à
sucre, appelée bouture, est plantée dans les conditions
favorables (terrain meuble et approvisionnement en eau suffisant). Dans les
premiers mois suivant la plantation de la bouture, deux types de racines se
développent successivement et portent des rôles distincts :
Les racines de bouture tout d'abord, minces et
ramifiées, qui prennent en charge l'alimentation hydrique et
minérale des premières tiges ;
Les racines de tige se développent ensuite, plus
épaisses et peu ramifiées, elles prendront le relais de
l'alimentation de la future plante (SOOPRAMIEN, 2000).
Ensuite à l'état mature, nous distinguons trois
types de racines :
Les racines superficielles qui assurent l'alimentation
hydrique et minérale de la plante;
Les racines de soutien qui assurent la fixation de la plante
et l'absorption d'eau ;
Les racines "cordon", peu nombreuses et profondes dans le sol,
qui jouent un rôle de protection contre la sécheresse (BLACKBURN,
1984)
L'inflorescence de la canne à sucre (aigrette ou
flèche) est une panicule rose argenté portant des fleurs
hermaphrodites donnant des caryopses de très petite taille (Van
DILLEWIJN, 1960). Les graines fertiles, encore appelées
«fuzz», sont exclusivement utilisées en création
variétale et non comme méthode de multiplication en industriel
(FELDMANN et al, 1997).

Les annexes 1a et 1b illustrent de façon
schématique les différents « organes » de la canne
à sucre.
I.1.2. Physiologie et développement
Le cycle de production de la canne peut s'étaler sur 12
à 24 mois. Le cycle de la culture comprend la canne plantée
(vierge) et les repousses, qui va de la plantation à la plantation
suivante et peut être très long (plus de 15 ans). La plantation a
lieu, en moyenne tous les 7 à 10 ans, et s'étale de
décembre à juin. SUCAF Gabon utilise des repousses pendant une
durée moyenne de 10 ans après que le rendement ait baissé
en dessous de 60 T/ha.
Après la germination, les trois étapes
importantes du développement de la canne à sucre sont le tallage,
la croissance de la tige et la maturation.
Le tallage intervient après la germination
(1 à 3 mois après que les racines aient pu
correctement se former). Le nombre de talles maximal lors de la culture ou le
nombre de talles au moment de la récolte dépendent de nombreux
facteurs tels que la variété de la canne à sucre,
l'humidité et la température du sol, la quantité d'azote
disponible, l'ensoleillement et l'incidence des ravageurs ou de certaines
maladies, tel que le charbon « Ustilago scitaminea »
(SOOPRAMIEN, 2000).
La croissance de la tige consiste en une phase de
multiplication, de différentiation et d'élongation cellulaire qui
intervient durant une période déterminée dépendante
de facteurs environnementaux. C'est une phase de très forte croissance
végétative et d'activité photosynthétique au cours
de laquelle la canne à sucre assimile les éléments
nutritifs (azote, phosphore, potassium et autres sels minéraux). Les
matières organiques non utilisées par la plante (<40%) seront
stockées sous forme de saccharose (SOOPRAMIEN, 2000).
D'un point de vue physiologique, la canne à sucre
possède une activité photosynthétique de type C4,
particulièrement efficace pour la fixation du CO2 et qui peut être
affecté par la présence de maladies (ALEXANDER, 1973).
La maturation correspond à une phase de synthèse
et d'accumulation de saccharose importante, à hauteur de 65-70% et de
l'utilisation des ressources carbonées. La variété de
canne à sucre, mais aussi les conditions environnementales, l'irrigation
ou l'utilisation de produits chimiques peuvent influencer la maturation.
L'annexe 2 présente les différentes phases importantes qui
composent le cycle de production de la canne à sucre.
I.1.3. Qualités agronomiques de la canne à
sucre
Des récentes études ont montrés que la
biomasse résiduelle produite dans un champ de canne est comprise entre 7
et 20 T de matière sèche par hectare (MS/ha) (KEE KWONG et
al,

1987; ROBERTSON et al, 2000 ; DE OLIVEIRA et
al, 2002). Même si la quantité de résidus de
récolte déposée varie chaque année, on
considère pourtant que 2 à 18 % sont toujours présents au
bout d'un an (KLOK et al, 2003). CHEONG et al (2003)
observent une érosion de l'ordre de 10.8 t/ha annuellement sous sol nu.
Avec la protection de la paille (constituée par les résidus de
récolte) disposée dans le champ de canne à sucre, un
entreligne sur deux, l'érosion annuelle est largement réduite,
passant à 1.8 t/ha. Avec le paillis complet, l'érosion annuelle
n'est plus que de 1 t/ha. Le paillis réduit l'impact direct des gouttes
de pluie sur le sol, ralentit l'eau de ruissellement, agit comme un filtre qui
retient les particules de sol en suspension dans l'eau (CHEONG et al,
2003), améliore l'infiltration et de ce fait diminue l'érosion
(BRAUNACK et al, 2001).
Une étude montre que la culture de la canne à
sucre réduit les pertes de sol de 90 à 98% par rapport à
un sol nu et ce sur cinq types de sol différents (MSIRI, 2005).
En termes de gestion durable des parcelles, il y a donc lieu
d'intégrer la dimension « éco-fertilité » que
peut procurer la culture de la canne à sucre. Lorsqu'elle est
cultivée dans de bonnes conditions, la canne à sucre maintient et
améliore à long terme le stock de matière organique du sol
(SAINT MACARY et al, 2002), bien que ces résidus puissent
être des obstacles aux opérations de travail du sol lors de la
plantation, et constitué des niches potentielles pour les ennemis de la
culture (JAGLALE, 2003).
I.2. Ecologie
I.2.1. Climat
A l'instar d'autres cultures, la canne à sucre est
influencée par l'environnement, notamment le facteur climat. Elle a
besoin d'eau, de chaleur et d'humidité pour ses exigences de
levée et de croissance. Les précipitations, tout comme les
conditions de température au-delà des extrêmes peuvent
affecter les rendements. De part sa situation géographique, le climat de
SUCAF Gabon est de type équatorial, chaud et humide,
caractérisé par quatre saisons
Une petite saison des pluies, mi septembre -mi décembre
;
Une petite saison sèche, mi décembre- mi mars ;
Une grande saison des pluies, mi mars-mi juin ;
Une grande saison sèche, mi juin- mi septembre. (PEME,
2004)

Le tableau 1 présente la moyenne des données
climatiques favorables à la culture de la canne en comparaison avec ceux
rencontrées à SUCAF Gabon.
Tableau 1. Exigences climatiques de la canne
à sucre
Types Données favorables Données SUCAF
Gabon
|
Températures (T°)
|
26-33°C (croissance),
15°C-18°C
(maturation)
0°C (Température létale)
|
25° - 30°C
|
|
Précipitations
|
1000-2000mm/an (croissance)
Saison sèche
marquée 4 à 5 mois
(maturation)
|
2125 mm/an
|
Hygrométrie (HR) =80% 80 -90 %
Insolation >1200 h/an 1369 h/an
Evapotranspiration > 1000 mm/an 1226.6 mm/an
Source : Rapport annuel
d'activité. Service agronomique SUCAF Gabon 2011 et HUBERT (1968)
Il ressort du tableau 1 que le site de SUCAF Gabon
répond aux exigences climatiques que requiert la culture de la canne.
Que ce soit en termes de températures, de précipitations, ou
d'évapotranspiration. Ces données sont quasiment au dessus des
moyennes recommandées, ce qui suppose un climat favorable.
I.2.2. Conditions édaphiques
Outre le climat qui a une influence sur le rendement de la
canne à sucre, on note également l'effet des conditions
édaphiques. Le tableau 2 présente les données relatives au
sol à SUCAF Gabon en comparaison avec les exigences de la culture.

Tableau 2. Exigences édaphiques de la
canne à sucre
Type Données favorables Données SUCAF
Gabon
|
pH
|
5,5-8
(demande une légère alcalinité)
|
4,-5
(Sol Ferralitique)
|
|
Texture
|
Sablo-Argileuse Sableuse Argileuse
|
Argilo sableuse
|
|
Structure
|
Meuble et profond #177; Elevée
|
#177; Compacte -
|
|
C.E.C
|
|
C/N
|
|
Assez élevé 325 m
|
|
Altitude
|
= 500 m
|
Source : Rapport annuel
d'activité. Service agronomique SUCAF Gabon 2011 et HUBERT (1968)
D'après le tableau 2, nous observons que les conditions
édaphiques sont moyennes par rapport aux besoins de la culture. Le sol
de SUCAF Gabon est moyennement acide, alors que la culture sollicite une
légère alcalinité (PEME, 2004). A ce titre, les
amendements calciques apportés par le service culture en moyenne 2 T/ha
de chaux restent faibles. Une moyenne de 4 à 5T/ha serait souhaitable
pour augmenter le pH d'une unité (DUPONT et KALALA, 2004).
I.3. Plantation de la canne à sucre
La plantation de la canne à sucre se fait par
bouturage, en principe au début ou à la fin de la saison des
pluies. A SUCAF Gabon, la plantation s'effectue entre
octobre-décembre/janvier pour les PC (Petites Cultures : canne de 12
mois) et mars-avril/mai pour les GC (Grandes culture : cannes de 15 à 17
mois) (PEME, 2004). Le tableau 3 présente une comparaison des
différents cycles d'exploitation de la canne vierge.

Tableau 3. Comparaison des différents
cycles d'exploitation de la canne vierge
|
Canne vierge de grande culture
|
|
|
P
|
|
|
|
|
|
|
|
|
|
|
|
R
|
|
|
|
|
|
Canne vierge de petite
culture
|
|
|
|
|
|
|
|
P
|
|
|
|
|
|
|
|
|
|
|
|
R
|
|
|
|
|
|
Campagne sucrière
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Mois
|
J
|
F
|
M
|
A
|
M
|
J
|
J
|
A
|
S
|
O
|
N
|
D
|
J
|
F
|
M
|
A
|
M
|
J
|
J
|
A
|
S
|
O
|
N
|
D
|
|
Année culturale
|
Année (n)
|
Année (n+I)
|
P = plantation R = récolte
Source : Département culture, Service
culture SUCAF Gabon 2012
La plantation consiste à sectionner les tiges des
cannes en morceaux en ayant soin de laisser sur chacun d'eux au moins un noeud
pour la reprise dans un premier temps, puis, de les planter en terre dans un
second temps après avoir été trempé au
préalable dans une solution « Organo-mercurique » (Agallol
à 1%) (PEME, 2004). Lors de la récolte, qu'elle soit manuelle ou
mécanisée, le rhizome ainsi qu'un morceau de tige faisant
apparaître au moins un noeud sont laissés en terre, comme lors de
la plantation. Cette opération permet, du fait de la rusticité de
la plante, de faciliter sa reprise spontanée. En général
les sucriers ont recours à cette méthode et laissent les cannes
repousser quatre ou cinq années consécutives (au moins 8 ans
à SUCAF Gabon) (PEME, 2004), ce qui permet de conserver des rendements
intéressants sans trop appauvrir le sol. En outre, le fait de ne pas
avoir à replanter de nouvelles boutures chaque année procure un
gain financier et une économie de temps importants.
I.4. Récolte de la canne à sucre
C'est la période où les tiges de canne sont
coupées, pour être envoyé au broyage afin d'extraire du
sucre à l'usine. La récolte est conditionnée par le
contrôle des paramètres technologiques de maturation notamment le
Brix et la pureté qui doivent atteindre des valeurs recherchées
respectivement 19 à 22 pour le Brix et 90 à 95 °Z
pour la pureté et un Rendement Hugo Simplifié moyen de 12
(BESSEGUE, 2011).
La récolte se fait en « vert » ou en «
brûlée » (MVEH, 2011), pour ce dernier cas le brulis est fait
en « veille coupe». Bien que la coupe en « brûlée
» présente de nombreux avantages lors la récolte,
préférentiellement, la coupe en « verte » reste la plus
utilisée.
En terme de rendement, grâce aux progrès de la
recherche, les rendements mondiaux de la canne à sucre ont
augmenté à un rythme annuel de 0,6% entre 1961 et 2005 passant
ainsi d'un

rendement de 50 tonnes par hectare en 1961 à 65 tonnes
en 2005. Parmi les principaux pays producteurs de canne à sucre, le
Brésil et l'Inde affichent un rendement croissant sur la période
(rythme annuel de croissance = 1,2% pour le Brésil et 0,9% pour l'Inde)
qui leur permet d'atteindre les niveaux de rendement respectifs à
l'hectare de 73 tonnes par hectare pour le Brésil et 62 tonnes par
hectare pour l'Inde en 2005 (FAUCONNIER, 1991).
A SUCAF Gabon, les rendements des parcelles déterminent
la fréquence de replantation. Ces rendement doivent être
impérativement = 60 t/ha pour maintenir la production
des repousses (BESSEGUE, 2011).
I.5. Bio agresseurs de la canne à sucre
I.5.1. Les maladies
La canne à sucre est une pluriannuelle plantée
sur de grandes surfaces en système de monoculture. Cette
caractéristique la rend particulièrement exposée aux
ravageurs ainsi qu'à de nombreuses maladies (CHAMPOISEAU, 2006).
L'utilisation des boutures lors des plantations facilite
considérablement la propagation des agents pathogènes, impliquant
la mise en place de schémas de pépinières, le
développement de techniques d'assainissement du matériel
végétal ainsi que des règles phytosanitaires strictes pour
l'échange du matériel végétal telles que des
quarantaines (FELDMANN et al, 1994; ROTT et al, 1997).
Par ailleurs, les procédés de lutte font
essentiellement appel à l'utilisation de variétés
résistantes qui peuvent jouer le rôle d'inoculum pour des
variétés sensibles, sans toutefois présenter de
symptômes (FAUCONNIER, 1991). En 2000, près de 60 maladies
d'origines bactériennes, virales, fongiques ou encore provoquées
par des phytoplasmes étaient recensées sur la canne à
sucre (ROTT et al, 2000). Dans certains cas (variétés
sensibles, évolution de l'agent pathogène, conditions
environnementales particulières,...), ces maladies peuvent provoquer des
dommages très importants et avoir des conséquences
économiques graves à l'échelle d'une parcelle, d'une aire
de culture, voire d'un pays.
A SUCAF Gabon, il existe principalement cinq (5) maladies qui
provoquent des dégâts et doivent potentiellement faire l'objet de
thématiques de recherches et intégrer dans le schéma
d'assainissement et de sélection variétale. Il s'agit de trois
(3) maladies fongiques (le charbon « Ustilago scitaminea »,
la morve rouge « Colletotrichum falcatum » et Pokka boeng,
« Fusarium monilliforme » d'une maladie virale impliquant le
« Yellow leaf virus

(YLV) » responsable du syndrome de la feuille jaune et
une bactériose vasculaire (l'échaudure des feuilles causée
par Xanthomonas albilineans).
L'annexe 4 présente la liste des différentes
maladies de la canne, leur degré de gravité et les pertes
occasionnées.
I.5.2. Moyens de lutte
Les pratiques culturales de la canne à sucre rendent
cette culture particulièrement sensible à de nombreuses maladies
(CHAMPOISEAU, 2006), notamment du fait de quelques spécificités
:
Les épidémies sont facilitées dans un
contexte de monoculture sur de grandes surfaces agricoles ;
la propagation des agents pathogènes est
facilitée par la multiplication végétative par bouturage
et la sélection variétale est longue et difficile, notamment
à cause du caractère pluriannuel de la culture. Les
méthodes de lutte contre l'échaudure des feuilles sont
essentiellement préventives car aucun moyen de lutte chimique n'est
utilisé à l'heure actuelle.
La sélection variétale représente le
moyen de lutte le plus efficace et le plus répandu pour lutter contre
les principales maladies de la canne à sucre. Il permet l'obtention de
nouvelles variétés de canne à sucre par croisements
d'espèces présentant des qualités agronomiques
particulières ou une résistance naturelle à une maladie.
L'espèce S. spontaneaum, résistante à
l'échaudure des feuilles, a été utilisée dans de
nombreux schémas de sélection variétale. La
création variétale est un processus relativement long (10-12 ans
en moyenne) qui nécessite la mise en place de schémas de
sélection complexes. Pour être efficace dans la lutte contre les
maladies à long terme, la sélection doit être
accompagnée de mesures prophylactiques telles que :
i) l'élimination du matériel végétal
infecté ;
ii) le nettoyage et la désinfection des outils de coupe
en pépinières ;
iii) Des contrôles sanitaires et la production de
matériel végétal assaini.
Les contrôles sanitaires stricts ont été
mis en place pour l'échange et la distribution de matériel
végétal (boutures) d'un pays à l'autre, voire même
à l'intérieur d'un même pays. C'est par exemple le
rôle de la quarantaine internationale du CIRAD à Montpellier.
Celle-ci, au cours de deux cycles de quarantaine d'une durée de un an
chacun, a pour objectif de tester, assainir et finalement certifier le bon
état

phytosanitaire du matériel végétal
à l'égard des principaux organismes pathogènes de la canne
à sucre (ROTT, 1995) ;
L'assainissement du matériel végétal fait
appel aux techniques récentes de culture in vitro mais aussi
aux techniques plus classiques de thermothérapie des boutures ;
La culture in vitro permet la production et la
multiplication de matériel végétal assaini en laboratoire
à partir de différents tissus de plantes, tels que les
méristèmes apicaux ou les bourgeons latéraux (FELDMANN
et al, 1994). Les vitro plants ainsi produits seront utilisés
pour la mise en place des schémas de pépinières, mais
aussi dans différents essais expérimentaux, notamment de
phytopathologie ;
La thermothérapie des boutures est une méthode
basée sur la destruction des bactéries dans les boutures
grâce à la chaleur, sans dommage pour les tissus
végétaux. Elle est surtout efficace contre les maladies
bactériennes et fongiques. Elle consiste en un trempage des boutures
préalablement immergées dans de l'eau à 25°C pendant
48 heures, suivi d'un bain d'eau chauffée à 50°C pendant une
durée 3 heures (ROTT, 1995). Ce procédé n'est cependant
pas toujours compatible avec la taille des surfaces agricoles à planter,
de même, certaines variétés ne résistent pas au choc
thermique, c'est le cas de la R570 récemment introduite
à SUCAF Gabon où la reprise des bouture est parfois difficile,
occasionnant ainsi de nombreux vides.
I.5.3. Ravageurs
En général, les ennemis sont spécifiques
de certaines zones géographiques que les maladies. En 1953, une liste
mondiale d'ennemis de la canne comprenait 1168 espèces, dont 462
coléoptères, 333 hémiptères, 265
lépidoptères (FAUCONNIER, 1991). Pour le cas spécifique de
SUCAF Gabon, nous retenons essentiellement deux (2) dont : les borers
principaux ennemis de la canne. On estime les pertes totales à 10% de la
récolte mondiale. Ils sont très nombreux, plus graves en climats
peu favorables à la maturation et s'attaquent aux entrenoeuds de la
tige:
Diatraea spp ;
Chilo spp ;
Eldana saccharina; ce sont les plus fréquents et
les plus graves.
L'annexe 4 présente la liste des principaux ravageurs
de la canne, leur degré de gravité et les pertes
occasionnées.

I.6. Production du matériel
végétal
C'est au cours du siècle dernier (1888) qu'on a
découvert que la graine de canne à sucre pouvait germer et donner
de nouvelles plantes. Les premiers croisements dirigés se sont faits
entre S. officinarum seuls. Puis au début du
XXème siècle, en Inde et à Java, les S.
spontaneum, hybridés aux S. officinarum, ont permis de
rendre résistant les cannes cultivées. Depuis, les croisements
interspécifiques sont devenus plus complexes.
Présentement, deux tendances existent: l'ouverture vers
les genres voisins (Miscanthus sp, Erianthus sp, Narenga sp, Sorghum
sp) et le retour aux sources (collectes botaniques en Nouvelle
Guinée) (FAUCONNIER, 1991). Malgré certains espoirs, la culture
in vitro n'a pas encore permis d'obtenir de façon stable des
sujets nouveaux (FELDMANN et al, 1994).
I.6.1. Obtention de variétés (clones) en
station
La création variétale coûte cher car il
lui faut des moyens suffisants, de bons spécialistes et du temps pour
obtenir des variétés meilleures que celles qui pourraient
être importées de pays voisins ou même lointains. On
constate en effet que les variétés excellentes en un lieu sont
souvent bonnes ailleurs. Les remarquables POJ 28-78 (Java), Co290
(Sud de l'Inde), B43.62 (Barbade), NCo310
ou NCo376 (Inde - Afrique du Sud) ont été
utilisées dans le monde entier tant comme variétés en
culture que comme géniteurs (FAUCONNIER, 1991). On constate aussi que
des variétés jugées moyennes peuvent donner de très
beaux résultats sur des petites parcelles bien soignées.
Par ailleurs, plus les conditions écologiques et
économiques d'une zone de culture de cannes sont particulières et
spécifiques, et plus il y a de chances de pouvoir créer pour
elles, par hybridation raisonnée et sélection bien faite, des
variétés satisfaisantes. Ainsi, les fines, droites,
hâtives, riches et précoces variétés de Louisiane
conviennent bien à une zone très originale qui gèle tous
les ans et utilise des coupeuses-andaineuses sur des terres lourdes et
humides.
Les croisements variétaux se décident en
station, en fonction des besoins:
«dégénérescence» progressive des
variétés, faiblesse des repousses, manque de richesse en sucre,
sensibilité jugée excessive aux maladies endémiques ou
apparition de nouveaux fléaux, besoin de s'adapter à des
conditions locales (écologiques et économiques)
particulières, etc.

Les parents à hybrider sont mis en serre
contrôlée dans des «lanternes». Les nombreuses graines
(fuzz) sont semées en casiers, bien arrosées et nourries. Les
plantules (seedlings) sont repiquées à 1 ou 2 mois (10 à
15 cm de haut) en groupes (bunch) ou individuellement, puis installées
en planches (3-4 mois), seuls les sujets vigoureux étant retenus
à chaque opération. Ces seedlings doivent ensuite être
triés (sélection).
On peut aussi obtenir des variétés en les
faisant venir d'ailleurs (en général par importation de
boutures). Pour éviter les maladies fréquentes et graves, on
place ces variétés en quarantaine et sous contrôle le temps
voulu et on les multiplie ensuite pour les introduire dans les derniers stades
de la sélection ou les utiliser comme géniteurs. Elles sont aussi
distribuées aux usiniers dont certains déposent des demandes
d'importation à l'organisme chargé de la quarantaine.
I.6.2. La sélection variétale
Il faut 7 à 12 ans pour sélectionner une ou
quelques variétés à partir des 50.000 à 2.000.000
de graines semées chaque année par station de sélection.
On comprend que ces stations, souvent propriété des producteurs,
les réservent à leurs membres ou à leur pays, ce qui
diminue l'offre de variétés dites «libres» (FAUCONNIER,
1991). Les principaux critères de sélection sont:
vigueur végétative (grosse production à
l'hectare en vierge et surtout en repousse); bonne richesse en sucre des cannes
et pureté élevée (à tonnages égaux de sucre
par hectare, on préférera la variété la plus
riche);
qualités de précocité (permettant
d'avancer avec profit le début de la campagne sucrière) ou de
tardivité (permettant d'allonger la campagne) et donc
intérêt d'une longue PMI (période de maturation
industrielle); ceci explique que l'adaptation aux cycles de culture
(utilisés ou prévisibles) soit à introduire assez
tôt dans le processus de sélection;
résistance suffisante à toutes les maladies
graves du pays et tolérance éventuelle à certains ennemis
(borers, nématodes, rats, etc.) ou à certaines conditions (danger
de gels ou de cyclones, sécheresse, salure, sols particuliers, etc.);
facilité et bon marché de la culture ; selon les
conditions du lieu, on attribuera beaucoup d'importance à certains des
caractères suivants: bonne levée à la plantation,
couverture rapide du terrain, feuilles vertes non coupantes et à gaines
glabres, feuilles

sèches se détachant naturellement ou
aisément, tiges de bon diamètre, floraison la plus faible
possible (sauf pour les variétés précoces en cycle
annuel), cannes droites ou ne se couchant pas malgré de forts tonnages,
tolérance à de médiocres conditions de culture et à
des erreurs de calendriers, etc. (FAUCONNIER, 1991).
II. La phase de maturation et de
surmaturation
Cette partie examine l'état actuel des connaissances
concernant l'utilisation des maturateurs de la canne à sucre. Elle
fournit certaines définitions, concepts et terminologies.
II.1. Définition
FERNANDES (1982) a défini la maturation de la canne
à sucre comme étant le processus physiologique qui implique la
synthèse des sucres et leur translocation dans la tige. Selon CASTRO
(1999), la maturation est un des aspects les plus importants pour la production
de canne à sucre. Elle permet la synthèse et le stockage du
sucrose, qui dépend de l'énergie, des caractéristiques
variétales. Alors qu'ALEXANDER (1973) définit de façon
simple la maturation comme étant l'inverse de la
croissance de la plante. D'autres
auteurs comme DEUBER (1988),
définissent la maturation de la canne à sucre suivant deux (2)
dimensions: botanique et physiologique.
Botaniquement, la canne à sucre est mûre
après la production des fleurs et la formation des graines.
Physiologiquement, la maturation est atteinte quand les tiges
accèdent à leur stockage potentiel de saccharose, c'es à
dire le point où le maximum de sucre est accumulé. La
durée de cette accumulation de sucre est d'un à deux (2) mois.
Le processus de maturation de la canne est une étape
qui doit être bien maitrisé en ce qu'il permet une meilleure
gestion de cette opération culturale, permet de réaliser du
profit, et réduire les pertes de sucre récupérables au
cours de leur stockage (CAPUTO, 2006).
II.2. Type de maturation
Il existe deux types de maturations dans la culture de la
canne à sucre. Une maturation dite « naturelle » qui ne fait
pas intervenir de traitement maturateurs sur les parcelles. La canne à
sucre dans ces conditions arrive à maturité suivant son cycle
normal et une maturation dite « forcée ou artificielle» qui
nécessite l'emploie de maturateurs. L'avantage de

ces traitements maturateurs est qu'ils permettent à la
canne à sucre d'avoir une maturité homogène malgré
l'âge de la parcelle (BESSEGUE, 2011)
II.2.1. Maturation naturelle et accumulation de
saccharose
Les exploitants agricoles appliquent des maturateurs à
la canne à sucre de sorte que le pourcentage de saccharose soit en
augmentation au-dessus de ce qui serait réalisé dans des
conditions normales.
Les travaux récents de INMAN-BAMBER et al
(2002) suggèrent que la maturation de la canne pourrait être
définie par deux phases :
La première phase est associée à la
teneur en saccharose (sur une base de poids sec de tige) de l'augmentation
basique d'entre-noeuds.
La deuxième phase est associée aux entre-noeuds
basiques étant entièrement mûris. Les entre-noeuds basiques
atteignent la teneur maximum en sucrose autour de 0,55g/g de matière
sèche dans la variété NCo376 quand le poids sec
de tige totale a approché 150g. Ces données ont été
obtenues à partir d'une expérience sur le terrain conduite en
1988 en Afrique du Sud. Le travail rapporté par MUCHOW et al
(1997) suggère que l'accumulation de saccharose dans la canne
à sucre est un phénomène continu directement lié
à la croissance de tige, un processus qui est déclenché
par de basses températures, un déficit en eau. La maturation
normale de la canne à sucre est directement associée à la
dessiccation des tiges.
II.2.2. Maturation artificielle et accumulation de
saccharose
Selon les résultats d'une étude menée par
des chercheurs hawaïens, rapportée par (SU et al, 1992),
une application des maturateurs tels que le Glyphosate avait pour
réponse physiologique de la canne la cessation de la croissance du
méristème apical et une augmentation de la quantité de
saccharose au bout d'une durée de cinq (5) jours seulement. Le processus
de stockage du saccharose dans les tiges s'effectue au moyen d'un gradient de
concentration. L'énergie requise pour ce processus est fourni par la
respiration. En outre, il est établi que le contenu accru de saccharose
est accompagné d'un cycle continu de dégradation et de
synthèse pendant l'accumulation de sucrose dans les tissus de
réserves (VORSTER et BOTHA, 1999; ROHWER et BOTHA, 2001).
II.2.3. Classification des maturateurs
Les maturateurs de la canne à sucre sont classés
par catégorie, en fonction de l'organe ciblé, la nature de
l'effet sur la plante.

Globalement, on distingue quatre catégories de
maturateurs (VLITOS et LAWRIE, 1965): Défoliants;
Déshydratants;
Régulateur de croissance de plantes ;
Inhibiteur d'enzyme.
Seuls l'Ethrel, le Glyphosate et le Fusilade sont largement
répandus pour leur utilisation sur la canne à sucre comme
murisseurs, notamment en Afrique du Sud (DONALDSON, 1999), au Swaziland
(ROSTRON, 1996), aux Etat Unis dans l'Etat de Floride (DUSKY et al,
1986), à Hawaï (BARTOLOMEW et SILVA, 2001), en îles Maurice
(SOOPAYA et NAYAMUTH, 2001) et Guyane (EASTWOOD et DAVIS, 1998).
II.2.3.1. Les défoliants
Ils agissent au contact des feuilles de la plantes dont elles
causent la sénescence puis la chute au bout de quelques jours. Ce mode
d'action est typique des maturateurs tels que l'Ethrel.
II.2.3.2. Les déshydratants
Ces composés causent le séchage rapide de la plante
(ARVIER, 1965).
II.2.3.3. Les Régulateurs de croissance de
plantes
Les régulateurs de croissance de plantes sont des
substances synthétiques qui ont des actions antagonistes ou synergiques
connus : cas des hormones (auxines, gibbérellines, cytokinines,
retardateurs, inhibiteurs et éthylène) et qui favorisent,
empêchent, ou modifient les processus physiologiques et morphologiques
d'un phénomène.
Les inhibiteurs de croissance pour leur part sont des
substances qui ont la capacité d'empêcher la croissance des
méristèmes apicaux ou secondaires
Le groupe des régulateurs de croissance inclut des
composés qui affectent le processus de croissance réglé
par des hormones en particulier l'auxine. Le régulateur le plus
généralement utilisé est l'herbicide 2,4-D (VLITOS et
LAWRIE, 1965).
Les produits commerciaux comme «
l'Ethrel®» produisent de l'éthylène. Lorsque
cet éthylène est incorporé dans les tissus de la canne
à sucre, il cause la maturation bien que le mécanisme par lequel
ce phénomène s'effectue soit à l'heure actuelle mal
connu.

II.2.3.4. Les enzymes inhibiteurs
Les activités herbicides de certains maturateurs tels
que le Glyphosate et le Fusilade sont parfois associées à
certaines enzymes qui agissent en synergie ou en antagonistes dans la
réalisation du processus de maturation. Ces enzymes sont
classifiées en fonction de leur solubilité, l'emplacement
cellulaire et leur optimum de pH. (SU et al, 1992).
Pour le cas spécifique des invertases, elles sont
impliquées dans la diminution du stockage de saccharose dans les entre
noeuds de la canne à sucre qui se traduit par la synthèse du
glucose et du fructose (LINGLE, 1997).
C12H22011 + H20 + (Forte présence des invertases) =
C6H1206 + C6H1206
( Saccharose) (Glucose)
(Fructose)
Cette assertion est confirmée par ZHU et al
(1997) et SUZUKI (1983) qui attribuent l'augmentation de la concentration
du saccharose dans les cellules des entre-noeuds de canne à sucre avec
une diminution d'activité acide soluble d'invertase (S.A.I) pendant la
phase de maturation.
Les conditions environnementales peuvent
considérablement influencer l'activité des invertases. TERAUCHI
et al (2000) ont rapporté que l'activité acide soluble
d'invertase (S.A.I) diminue en conditions froides. De même, les facteurs
physiologiques comme les régulateurs de croissance de plantes favorisent
des changements distincts et significatifs de l'activité enzymatique des
invertases acides et neutres (LEITE et al, 2009 ; SIQUEIRA, 2009).
Outre les invertases acides solubles, l'activité des
invertases neutres (Ni) et la quantité de saccharose dans les
entre-noeuds mûrs sont étroitement liés. ROSE et BOTHA
(2000) ont trouvé une corrélation significative entre le contenu
de saccharose et le niveau d'invertases neutres (Ni). Elles agissent donc en
synergies dans la réalisation du processus de maturation.
II.3. Les maturateurs de la canne et leur composition
chimique
II.3.1. L'Ethephon
L'Ethéphon (2-Chloro-éthyl-acide phosphorique),
est un produit chimique à base d'éthylène lequel est un
régulateur de croissance de plantes avec les propriétés
systémiques. Fortement soluble dans l'eau, il est stable à un pH
< 3,5. Il est sensible au rayonnement ultraviolet et est jusqu'à 75
°C stable.

L'éthéphon pénètre les tissus
végétaux et est progressivement transféré vers les
cellules, où il se décompose alors en éthylène
(YANG, 1969), affectant le processus de croissance tout en bloquant la
floraison (TOMLIN, 1994).
Mais le principal avantage observé avec l'utilisation
de l'Ethéphon comme maturateur est qu'il n'endommage pas la germination
des prochains rejetons de canne à sucre. Dans certains cas, un effet
bénéfique est observé, avec le tallage accru au
début de la germination après coupure. SILVA et al
(2007), ont observé un effet stimulant sur l'apparition du tallage
jusqu'à six mois bien que les réponses aient dépendu de la
variété.
II.3.2. Le Glyphosate
Le glyphosate (Phosphonométhyl de N-glycine) est
actuellement un des herbicides les plus utilisé en agriculture, en
raison de l'action efficace qu'il exerce sur les mauvaises herbes et sa basse
toxicité.
Le mécanisme d'action du Glyphosate®
est tout à fait unique. C'est le seul herbicide capable d'empêcher
spécifiquement la synthèse des enzymes
5-Enol-pyruvyl-shikimate-3-phosphate (EPSPS), ce qui catalyse la condensation
du pyruvate shikamate d'acide et de phosphate, de ce fait empêchant la
synthèse de trois acides aminés essentiels : tryptophane,
phénylalanine et tyrosine (ZABLOTOWICZ et REDDY, 2004).
Le Glyphosate est considéré comme un herbicide
systémique, non-sélectif et de large-spectre. Son absorption est
facilitée par des groupes de protéines de transport de phosphate
qui sont présents dans la membrane de la plante.
En outre, le Glyphosate est jugé comme un des meilleurs
maturateurs de la canne à sucre en ce qu'il accélère la
maturation (DALLEY et JUNIOR de RICHARD, 2010) et en raison de deux principales
raisons:
Il empêche la croissance de canne à sucre en
inhibant ou en causant la « mort » du méristème apical,
ou il empêche la synthèse de l'acide indol acétique (IAA).
L'inhibition de l'élongation de tige peut également être
connexe à la capacité d'auxine de favoriser la synthèse
d'éthylène en augmentant l'activité de l'accumulateur
(synthèse d'acide 1-amino-cyclo-propane-1-carboxylic) (LIANG et
al, 1992). L'augmentation de l'éthylène peut stimuler le
processus de sénescence et la germination des bourgeons latéraux,
et l'équilibre hormonal entre IAA et éthylène peut
également mener à l'inhibition de la tige élongation.
Il cause l'effort en canne à sucre en empêchant
la synthèse des acides aminés essentiels

et protéines. EPSPS est codé au noyau et
exécute son rôle dans le chloroplaste, catalyse l'attache des
composés shikimate-3-phosphate et phospho-énol-pyruvate pour
produire enol-pyruvyl-shikimate-3-phosphate et le phosphate inorganique.
Comme maturateur, la dose effective du Glyphosate change
considérablement selon les régions. Généralement on
applique entre 144 à 864 g/ha. Au Brésil, la dose se situe entre
144 et 240 g/ha, alors qu'elle est de 0,75L/ha à SUCAF Gabon (PEME,
2004).
MILLHOLLON et LEGENDRE (1996) ont montré qu'une
application du Glyphosate pendant une durée de trois (3) années
consécutives réduisait le rendement de la canne de 4%, mais
accroissait le rendement en sucre de 7%.
Pour des variétés distinctes de canne à
sucre, différentes réponses au Glyphosate comme maturateur ont
été rapportées concernant le rendement, l'humidité
des tiges, le Brix, le Pol et la pureté qui sont des paramètres
technologiques importants dans le suivi de la maturité des parcelles de
canne à sucre.
Bien que le Glyphosate existe sous diverses formulations, lors
qu'il est appliqué, on note une augmentation de saccharose dans les
tiges de canne à sucre. (VILLEGAS et al, 1993; BENNETT et
MONTES, 2003; VIATOR et al, 2003).
Nonobstant ses multiples effets positifs sur l'accumulation de
saccharose et le rendement de sucre extractible, le Glyphosate présente
quelques effets indésirables :
Le premier est le taux élevé de bourgeons sur
des tiges après l'application, laquelle baisse la qualité de
matière première ;
Le second est l'effet néfaste sur le rejeton de
germination ensuite la moisson des secteurs traités, avec une
réduction de talles par mètre. Ce qui dans le temps entraine une
productivité plus faible des parcelles (LEITE et CRUSCIOL, 2008). C'est
pour cette raison que le Glyphosate est prioritairement utilisé dans des
parcelles qui sont à replanter dans les deux ou trois ans qui suivent
l'épandage.
Cependant, il y a également des signaux selon lesquels
le Glyphosate ne cause aucun effet néfastes en termes de qualité
et de productivité, cette perspective reste à explorer (VIANA et
al, 2008).
II.3.3. Le Fusilade
Actuellement, nombreux sont les produits employés comme
maturateurs de la canne à sucre. Entre autre, on peut citer le Fusilade
(Fluazifop-p-butylique). Le Fusilade est un herbicide systémique
utilisé préférentiellement pour les graminées. Il
occasionne la « mort »
des méristèmes apicaux de la plante, favorisant
ainsi la maturation (DONALDSON et VAN STADEN, 1995). C'est l'un des maturateurs
avec le Glyphosate utilisé pour la maturation des parcelles à
SUCAF Gabon. Ces deux maturateurs sont homologués en zone CEMAC par la
commission sous régionale d'homologation des produits phytosanitaires et
appareils de traitements dont le Secrétariat permanent est basé
au Cameroun.
En termes de posologie, la dose d'application du Fusilade est
de 0,13 à 0,35 L/ha (WATSON et STEFANO, 1986) et la parcelle devra
être moissonnée dans les quatre (4) à six (6) semaines qui
suivent l'épandage.
II.3.4. Hydrazide maléique
De formule 1,2-dihydro-3,6-pyridazinedione c'est un inhibiteur
de croissance de plantes qui est considéré comme un agent de
maturation pour la canne à sucre. Ce régulateur de croissance
cause une perte de dominance apicale principalement chez les
monocotylédones. CASTRO et al (1985) ont vérifié
que l'application de l'Hydrazine maléique® favorise
l'accumulation du saccharose, couplée d'une réduction de
croissance de la canne à sucre.
II.3.5. Imazapyr
Il s'agit d'un herbicide systémique non-sélectif
qui est absorbé par les racines. Il est rapidement
transféré dans le xylème et le phloème au niveau
des régions méristèmatiques où il s'accumule.
Son effet diminue le développement et la croissance de
la canne à sucre. Le principe est tel que, lorsqu'il est
appliqué, les hydrates de carbone synthétisés pendant la
photosynthèse ne soient pas utilisés pour le processus de
croissance, mais s'accumulent dans la tige au cour de la phase de maturation
(LAVANHOLI et al, 2002).
II.3.6. Paraquat
Ce produit est un inhibiteur du photosystème I. Il peut
ou ne pas affecter la qualité des tiges industrielles. Son effet est
lié à la dose quand il est employé comme
déshydratant.
Selon CHRISTOFFOLETTI et al (1993), l'utilisation du
Paraquat a amélioré la qualité de la brûlure des
champs de canne et a rapporté la matière première avec peu
d'impuretés pour utilisation industrielle.
II.3.7. Autres maturateurs
Bien que leur utilisation soit minime, il existe d'autres
maturateurs de la canne. Entre

autre on peut citer le groupe des :
Sulfometuron-méthyliques
La dose de produit recommandée pour
accélérer la maturation de la canne à sucre est de 15 g/ha
à 20 g/ha. Après application, la parcelle traitée peut
être moissonnée au bout de 25 à 45 jours.
SYLVA et al (2007) ; LEITE et al (2010) ont
montré que l'application des produits à base de
Sulfometuron-méthylique n'ont à l'heure actuelle aucun effet
dommageables sur le rendement de la canne.
Trinexapac-éthyle
Les composés à base de Trinexapac-éthyle
appartiennent au groupe chimique de cyclo-hexanedione. Ils induisent
également une accumulation de saccharose dans les tiges au moment de la
maturation de la canne à sucre.
Ce régulateur de croissance empêche la
synthèse des formes actives de l'acide gibbérellique, une hormone
impliquée dans la division et la croissance des cellules, ce qui
mène à une diminution de l'accumulation de saccharose (NAKAYAMA
et al, 1990; RADEMACHER, 2000).
La dose recommandée pour favoriser le mûrissement
est de 200 et 300 g/ha et la parcelle traitée doit être
récolté entre 35 et 55 jours après épandage du
maturateur.
II.4. Conditions d'épandage de
maturateurs
Le traitement maturateur dans le cadre de la maturation
forcée de la canne à sucre est aérien, ce qui suppose la
prise en compte de certaines conditions qui garantissent le bon
déroulement de cette opération culturale qui n'est pas sans
danger. Entre autre :
Révision de l'avion avant tout déplacement
(s'assurer de son état fonctionnel), vérifier le dispositif
d'épandage du maturateur (microaires), et veiller à ce que la
cuve de stockage du produit soit à vide avant de la remplir ;
Utilisation des maturateurs homologués et d'un avion
habilité à voler, régulièrement
contrôlé par les autorités en charge de l'aviation civile
;
Respect de la dose d'application du maturateur, en tenant
compte des spécifications mentionnées sur l'étiquette au
risque de brûler prématurément la canne. De même, une
attention doit être portée sur les consignes données par
les pictogrammes;

Le personnel de soutien au sol (mélangeurs, chargeurs
et porte-fanion pour orienter le pilote) doit être convenablement
formé pour s'assurer que l'opération est sécurisé
et sans danger ;
Informer les populations environnantes sur le déroulement
de l'opération;
Bonne gestion du planning de maturation des parcelles de
sortes qu'il n'y ait pas de personnes dans les parcelles pendant
l'opération ;
Conscience professionnelle de la part du pilote ;
Conscience et compréhension des considérations
environnementales locales (faire attention aux points d'eaux,
végétation particulière, cultures avoisinantes non
traitées) ;
Procédures d'urgences en cas d'accidents.
II.5. Effets néfastes de la maturation : risque
environnemental
Les questions environnementales sont aujourd'hui au coeur du
débat sociétal. Cette prise de conscience se décline en
diverses formules : développement durable, biodiversité, gestion
des déchets, énergies renouvelables, principe de
précaution etc...
En agriculture, notamment dans la filière canne
à sucre, l'utilisation des pesticides, même comme maturateurs
(pulvérisation U.B.V : Ultra Bas Volume) implique des risques directs
pour la santé humaine et les écosystèmes environnants. Les
risques sur la santé humaine sont plus élevés dans les
climats chauds que dans les conditions climatiques tempérées. Ce
constat est dû au fait que sous températures
élevées, la circulation du sang dans la peau et les veines
s'intensifie et par conséquent les pesticides sont alors absorbés
plus rapidement puis transportés vers les organes vitaux du corps.
Sur le plan environnemental, l'épandage des maturateurs
présente des risques du fait qu'à l'arrosage, une grande partie
du produit n'atteint pas forcement la canne, mais est dispersée par le
vent. Ainsi, des points d'eau peuvent être contaminés et des
écosystèmes affectés avec la perspectives de
présenter un danger pour les populations dans le temps. Ce qui fait que
cette opération est de moins en moins utilisée notamment dans des
départements français comme la Martinique depuis 1995 où
elle est interdite (JORF, 1996.). De façon plus spécifique, les
dangers ci après peuvent être relevé :

Une pollution de l'eau.
Des particules du maturateur peuvent se retrouver dans l'eau
par ruissellement, notamment les eaux de surfaces (Ruisseaux, marres,
étangs...) où l'eau stagne et se pollue rapidement. Raison pour
laquelle dans certains pays, l'irrigation de la canne à sucre est
proscrite 4 mois après plantation (JORF, 1996.). De plus, les
résidus de maturateurs ( 5%) peuvent se retrouver dans
le sol, et affecter les nappes phréatiques dans le temps (PROSI, 1997)
même si certains herbicides à base d'hormone du type 2, 4-D
utilisés depuis près de 40 ans en cannerais sont facilement
dissipés par l'action des microorganismes au bout d'une semaine
seulement. (FAO, 1994),
Destruction des insectes utiles.
Certains insectes sont utiles à l'homme. Le cas le plus
probant est perçu avec les abeilles qui produisent du miel et permettent
la pollinisation anémophile de certaines plantes, ce qui contribue
à la bonne récolte des productions paysannes environnantes. Or un
épandage surtout lorsqu'elles sont en activités notamment en
milieu de journée peut affecter leur éthologie. Il en est de
même du comportement de certains insectes utiles aussi appelés
`'ennemis naturels» des insectes nuisibles.
Résistance.
Un épandage de maturateur lorsqu'il est
répété même à une fréquence de l'ordre
de l'année peut rendre un organisme nuisible résistant (moins
sensible) à l'action des pesticides utilisés. Ainsi, des
traitements à base de Round up ou de Fusilade sur les mauvaises herbes
peut s'avérer dans le temps difficile bien que cette perspective reste
à explorer. De plus des risques de phyto-toxicités sur la canne
sont à envisagées, d'où la nécessité de
faire un bon usage de ces maturateurs (BERKE, 1984).
Persistance.
Les pesticides de façon générale à
moins d'être de molécules allèlochimiques persistent et ne
se transforment que très lentement en substances moins dangereuses.
Ainsi, les substances qui se dégradent difficilement, s'accumulent dans
le sol pour se retrouver, avec le risque de relever l'acidité du sol,
surtout pour des pesticides de la catégorie des organochlorés. Il
est toujours préférable d'utiliser un pesticide facilement
dégradable.

II.6. Alternatives à l'usage des maturateurs de la
canne à sucre
Bien que l'usage des maturateurs soit encore important dans
l'industrie cannière, il n'en demeure pas moins que des travaux sont en
cours en vue de proposer des alternatives durables à ces maturateurs
compte tenu de leurs effets sur l'environnement. En exemple, on peut citer les
travaux de (CLEMENTS, 1980), qui suggèrent un suivi de la maturation
à partir du control de l'humidité des graines. En effet, cette
méthode suppose la conduite de l'assèchement des cannes d'au
moins 24 mois pour mieux les faire mûrir. Elle a donné des
résultats positifs dans l'archipel d'Hawaii (U.S.A). Elle consiste en
une irrigation qui n'est faite que pour maintenir l'humidité des gaines
(échantillonnées chaque semaine) au plus proche d'une droite
Humidité-Temps représentant l'idéal d'un abaissement
continu de cette humidité de 83% à 73 % en 7 mois. A cette
humidité, des analyses classiques du suivi maturation peuvent être
faite, et attester d'une bonne maturation de la canne entre 12-15%.
II.7. Surmaturation de la canne à
sucre
Après la phase de maturation, il peut y avoir une
inversion des sucres qui provoque la
diminution du Brix, du RHS et une chute de la pureté.
C'est ce qu'on appelle la surmaturation. Les cannes mûres
récoltées dans les champs ont un délai limite
d'utilisation au delà duquel, la richesse en sucre baisse. Cette
altération de la richesse, couplée à une perte de
propriétés organoleptiques de la canne est appelée «
phase de surmaturation ». Elle est due à plusieurs facteurs :
Le redémarrage de la croissance, du fait de conditions
favorables (élévation des températures, retour des
pluies). Les bourgeons latéraux aériens ou souterrains de la tige
repartent en végétation en utilisant le saccharose
accumulé. Cela entraîne la baisse du saccharose et la baisse de
pureté du jus dans la tige ;
La verse : les tiges s'enracinent et la croissance
redémarre en utilisant le saccharose accumulé. Certaines
variétés, plus sensibles à la verse, sont plus enclines au
phénomène de surmaturation ;
La floraison : lorsque la plante fleurit, sa croissance
s'arrête et aucune feuille n'est produite. Les feuilles en place se
dessèchent et la plante ne produit plus assez d'énergie pour
assurer ses fonctions vitales. Elle va donc utiliser le saccharose
accumulé dans ses tiges pour assurer sa survie. Les
variétés qui fleurissent beaucoup sont donc plus sensibles
à la surmaturation c'est le cas de la Co997 à SUCAF
Gabon.

Ainsi, on considère comme délais limites
jusqu'au broyage, 48 h pour une canne entière coupée en
«vert», 24 h pour une canne entière coupée «
brûlée » et 12 h pour une canne tronçonnée afin
de retarder au mieux le déroulement de ce processus physiologique.
(FAUCONNIER, 1991). Une des méthodes envisagées pour
contrôler, et minimiser l'impact de la surmaturation de la canne serait
de l'entreposer à basse température au niveau de la cour à
canne (FAUCONNIER, 1991). La figure 1 présente le
phénomène de surmaturation qui se traduit par une reprise des
bourgeons latéraux.

Figure 1. Reprise des bourgeons
latéraux due au phénomène de surmaturation
III. La richesse en sucre III.1.
Définition
On appelle richesse en sucre, le taux (%) de saccharose dans
les tiges de la canne à sucre. Elle varie selon les climats, les mois,
les variétés, la catégorie ou âge des cannes et les
conditions de la culture. Plus en détail, cette richesse varie aussi
d'une touffe à l'autre et d'une canne à l'autre. Une canne pas
encore mûre est plus riche au pied qu'au milieu et une canne trop
mûre peut être plus riche en haut (en éliminant le bout
blanc) qu'en bas (FAUCONNIER, 1991). La richesse en sucre est
contrôlée par une mission importante des services agronomiques des
sucreries : le suivi de la maturation. C'est au cours du suivi de la maturation
que l'on observe le comportement de la courbe de richesse.
La courbe de maturation quant à elle définit le
niveau atteint tout le long d'une campagne par la richesse de l'ensemble des
cannes traitées. Cette courbe doit être la plus longue et la plus
haute possible. La meilleure maturation (optimum de richesse) se situe
généralement aux 3/5 ou aux 2/3 de la campagne. Plus la courbe
s'aplatit plus on a tendance à allonger la campagne. A la limite, cette
courbe est « presque » plate et la campagne devient « presque
»

permanente: cas du Pérou, de la Colombie, des
Hawaii, de l'Uganda, du Kenya et qui pourrait être celui du
Maroc (FAUCONNIER, 1991). La modification durable d'un des nombreux
facteurs en cause entraîne un équilibre
différent. Ainsi, la mise en culture d'une variété
très précoce ou l'utilisation de produits maturisants permet
d'avancer le début de la campagne. De même, le passage d'une
période d'expansion à une période de stabilisation de la
production (due à des prix moins intéressants) oblige à
resserrer la campagne à sa partie la plus profitable
(FAUCONNIER, 1991).
Le facteur richesse permet de classer les
variétés en précoces (début
campagne), moyennes (mi-campagne) et tardives (fin
campagne), selon l'époque où elles donnent leur meilleure
richesse ou plutôt des richesses proches de leurs potentialités
dans le lieu considéré.
III.2. Le saccharose
On entend par sucre, le sucre cristallisable ou
saccharose de formule chimique : C12H22O11. Le saccharose est
un disaccharide à 12 carbones composé d'une seule unité de
glucose et de fructose (monosaccharides), qui sont reliés par une
liaison glycosidique á(1?2)â et
de masse molaire 342,3g/mol.
Les figures 2a, 2b et 2c présentent la
structure d'une molécule de saccharose.
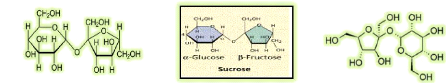
(b) (c)
(a)
Figure 2. Structure d'une molécule de saccharose
(a et b) : Projection de HAWORTH, (c) : Projection
polygonale
III.2.1. Propriétés physiques du
saccharose.

La molécule de saccharose caramélise
à 160 ° C. Sa masse volumique est de 1,5879
g·cm-3. Une solution de saccharose
réfracte la lumière suivant un angle proportionnel à sa
concentration en sucre. Cette propriété est mise
à profit pour le dosage en sucre du jus de
canne dans les refractomètres. Le saccharose dévie
à droite le plan de polarisation de la lumière
III.2.2. Propriétés chimiques du
saccharose.
On oppose le saccharose aux sucres réducteurs qui
décolorent la liqueur de Fehling. Sous l'action d'une diastase, la
saccharase ou invertase, le saccharose s'inverti en deux (2) sucres
réducteurs non cristallisables : Le glucose (C6H12O6) qui
dévie le plan de polarisation de la lumière à droite
(dextrose) et le fructose (C6H12O6) qui dévie le plan de
polarisation de la lumière à gauche (lévulose).
Cette réaction de dégradation de la
quantité de saccharose est accélérée par la
chaleur. C'est cette réaction qui se produit lorsque les cannes sont
laissées trop longtemps sur le sol après avoir été
coupées sans être broyées à l'usine.
III.3. Composition du jus de canne à
sucre
La partie du végétal qui intéresse
l'industrie sucrière est la tige de canne mûre, saine,
fraîchement coupée, exempte de racines et de terre,
débarrassée de ses feuilles et du « bout blanc ». En
effet, c'est de cette tige qu'on extrait le jus qui se compose de plusieurs
éléments dont l'eau, les sucres réducteurs, la fibre, et
autres impuretés. Le tableau 4 présente les différentes
composantes de 100g de jus de canne analysé.
Tableau 4. Composition de 100g de jus de
canne.
Composantes Proportion (%) Détails
Eau 74,50 ----
Cendre 0,50 SiO2, K2O, Na2O et autres
Fibres 10,00 Cellulose, lignine et autres.
Sucres réducteurs 14,00 Saccharose, glucose et
fructose.
Composés azotés 0,40 Acides aminés et
autres.
----
Corps gras et cire 0,20
----
Pectine (Gomme) 0,20
----
Acides libres et combinés 0,20
Source : (SPENCER et MEADE, 1948)
Du tableau 4, il ressort que le jus de canne se compose
majoritairement d'eau 75%, de sucre réducteurs principalement le
saccharose 14%, de fibre 10% et
d'impuretés 1%.

III.4. Eléments d'évaluation de la richesse
en sucre
Une analyse du jus de canne à sucre permet de
déterminer le niveau de richesse à partir du calcul de certains
paramètres comme le Brix, le Pol, la Pureté et le Rendement Hugo
Simplifié (RHS). Les méthodes de calcul de ces données
sont mentionnées dans l'annexe 6.
III.4.1. Le Brix
L'unité Brix utilisé communément dans
l'industrie sucrière pendant des décennies est destinée
à représenter la teneur en matière sèche, % m/m. On
continue aussi à utiliser le terme Brix à la fois dans
l'industrie sucrière et chez les utilisateurs de mélasse,
même si l'ICUMSA a recommandé d'abandonner son usage (ARTAS,
1992).
Remarque :
Selon la terminologie officielle de l'IUPAC adoptée par
la Société française de Chimie (S.F.C), le Brix
désigne le titre massique en matière sèche exprimé
en %.
Le principe de détermination du Brix implique
l'utilisation d'un réfractomètre qui prend en compte l'indice de
réfraction de l'eau par rapport à l'air qui est de1,330 à
20°C. Si l'on dissout une substance dans l'eau, du saccharose par exemple,
l'indice de réfraction augmente. L'indice de réfraction varie
dans le même sens que la concentration de la
réfractométrique est utilisée couramment dans l'industrie
sucrière pour doser directement des solutions de saccharose. Le
réfractomètre est alors directement gradué en
concentration de saccharose (saccharimètre).
La température intervient légèrement sur
la valeur de l'indice de réfraction. Pour un travail de grande
précision (déterminations d'indices à 0,0005 près)
on doit utiliser un réfractomètre équipé d'un
thermostat, en raison de sa très grande facilité d'emploi (ARTAS,
1992)
III.4.2. Le Pol
Le Pol d'une solution sucrée selon l'ARTAS (1992) est
lié à la rotation optique résultante du saccharose et
autres substances optiquement actives, principalement le glucose. Une solution
sucrée doit être clarifiée avant que son Pol puisse
être déterminé par un polarimètre. L'acétate
de plomb basique sec est l'agent clarificateur le plus communément
utilisé.

Remarque :
La quantité d'acétate de plomb utilisé
doit être minimale. Tout excès risque de précipiter une
partie du fructose entrainant une augmentation de la dextro-rotation donc une
forte polarisation et affectant aussi la polarisation de saccharose.
L'utilisation d'une table de correction permet de
déterminer la valeur exacte du Pol, à partir duquel on calcul la
Pureté et le Rendement Hugot Simplifié (Richesse). L'annexe 5,
présente la table des facteurs à partir de laquelle on fait une
correction du Pol.
III.4.3. La pureté
La pureté du jus de canne est un paramètre qui
détermine la proportion de saccharose par pourcentage de Brix. Elle
s'évalue en termes de pourcentage. La méthode de calcul de la
pureté est donnée dans l'annexe 6.
III.4.4. Le Rendement Hugot Simplifié
Plusieurs paramètres peuvent être
considérés pour estimer le niveau de richesse des tiges de canne.
Dans des sucreries comme SARIS Congo, la richesse est estimée par la
détermination du Brix, alors qu'à SOSUCAM, ou SUCAF Gabon, c'est
le Rendement Hugo Simplifié qui est considéré (BERKE,
1984). Ce paramètre indique la quantité apparente de saccharose
des tiges, à partir d'un rapport entre la différence de
pureté et une constante (Cte=30) sur le Brix (HUGOT, 1970).
L'annexe 6 explicite la méthode de calcul du Rendement Hugot
Simplifié.
III.5. Evolution de la Richesse en sucre au cours du
cycle de production III.5.1. La phase de croissance
L'accumulation du saccharose dans les tiges qui a
commencé dès le début de la croissance (3 mois),
s'accélère en fin de croissance (8,5-9 mois) sous l'action
combinée d'un froid relatif, de l'écart élevé des
températures nocturnes et diurnes, du manque d'eau et d'azote (Anonyme,
2002)

III.5.2. La phase de maturation
La maturation technologique consiste en l'accumulation du
saccharose dans toutes les tiges, en même temps que la baisse de la
teneur en eau, de la teneur en glucose et de l'acidité du jus. Elle
commence en général lorsque la croissance diminue, à
partir de mai -juin (début de la saison fraîche) ce qui correspond
au 8ème et 9ème mois après
plantation. Cette maturation technologique reste à son meilleur niveau
pendant une durée qui dépend de la variété et des
conditions du milieu. Elle dure en général 2 à 3 mois.
Elle est estimée au champ par des mesures de Brix, allant de 18 en juin
jusqu'à 22 en octobre (cela correspond à une richesse de 12
à 15 %).

I. Matériels
I.1. Le matériel végétal
Le matériel végétal, support de notre
étude est constitué des repousses des variétés
NCo376 et Co997. Pour les repousses de la variété
NCo376, les Parcelles (OU 3A, OU 3B, OU 3C, VG 1, VG 2, VG 3) ont
été considéré avec des catégories
respectives (R09, R10, R09, R04, R02, R04). Les repousses de la
variété Co997 ont été planté dans
les parcelles (OU 1, OU 2A, OU 2B, BGV 3, BGV 4/6A, BGV 4/6B) avec des
catégories respectives (R02, R03, R03, R05, R04, R04). L'annexe 7
présente les différentes variétés
étudiées, la dose de maturateur appliquée, la date de
maturation de chacune des parcelles.
I.1.1. Caractéristiques du matériel
végétal étudié
Le choix des variétés étudiées
repose sur la recherche de certains critères agronomiques, dont la
performance de production (TC/ha) et (TS/ha). Le tableau 5 présente les
principales caractéristiques des variétés
Co997 et NCo376 choisis pour notre
étude.
Tableau 5. Caractéristiques agro
morphologiques des variétés étudiées
Variété Caractéristiques
Jj Elle occupe 0,98% de la superficie utile ;
Jj Bonne canne de fin de campagne ;
Jj Floraison précoce, nécessite donc un suivi de
maturité rigoureux ;
Jj Tiges droites de couleurs vertes ;
Jj Entrenoeuds moyen 15 cm ;
Jj Diamètre moyen 27 mm recouvert de cire ;
Jj Bonne qualité agronomiques (Fort tallage, richesse
élevée, fort tonnage canne (TC/ha)
même en repousse, Bonne qualité de jus);
Jj RHSz12-14
Co997
Jj Elle occupe z33% de la superficie utile ;
Jj Canne fine à très fort tonnage (TC/ha) ;
Jj Bonnes qualités agronomiques (très fort tallage,
très forte richesse, bonne qualité de
jus) ;
Jj Du fait de sa finesse, elle présente tout de même
un taux de perte en champ élevé,
puisque des tronçons de cannes sont fréquemment
évacués avec la paille pendant la
coupe ;
Jj TC/h moyenz72,5 ;
Jj TS/h moyenz8,10 ;
Jj RHS moyenz11-12
NCo376
Source : (BESSEGUE, 2011)

I.2. Le matériel technique
En vu de déterminer les paramètres
technologiques de la richesse du jus de canne analysé des produits et
appareils ont été utilisé. De façon
générale, les appareils suivants ont été
employés : Un Moulin artisanal, un Polarimètre, un
Refractomètre, un Avion diffuseur de maturateur.
De même, les produits ci après ont
été employés : Le Fusilade Super®,
l'acétate de plomb basique, papiers filtres.
Le tableau 6 présente la liste du matériel
employé, leurs caractéristiques, ainsi que leur utilisation
respective.
Tableau 6. Caractéristiques et
utilisations du matériel d'étude employé.
Désignation Caractéristiques
Utilisation
|
Polarimètre
|
Type :
SCHIMDT+HAENSCH
|
Détermination du Pol.
La mesure du Pol renseigne sur la quantité
de
saccharose contenu dans le jus analysé.
|
|
Refractomètre
|
Type :
RFM 32
|
Détermination du Brix.
La mesure du
Brix renseigne sur la quantité
de saccharose + impuretés
contenus dans
les jus analysé.
|
|
Moulin à 2 cylindres
|
---
|
Extraire par broyage le jus de canne pour
analyses
|
|
Avion
|
Type :
ULM (Moteur Ultra Léger) J300,
Vitesse
linéaire 120Km/H, équipé de 5 microaires.
|
Epandage du maturateur.
L'épandage
se fait à partir de microaires à
une hauteur de 5 à 10
m au dessus de la
cime de la canne.
|
|
Fusilade® Super
|
m.a:
Fluazifop-p- butyl
|
Dose: 0,3 L/ha.
Herbicide de contact utilisé comme agent
maturisant
de la canne
|
|
Acétate de plomb basique
|
Type :
MERCK SCHUCHARDT (Germany).
Réf :
31.530.383
|
Agent Coagulant, et décanteur des
impuretés,
afin d'obtenir le jus torréfié.
|
|
Papier Filtre
|
Type :
Techniques plisse
(France).
Réf : 159 1P00025.
Dimension
: 185mm. Qté : 100
|
Permet d'obtenir le jus torréfié qui servira
à
déterminer la mesure du Pol.
|

Outre l'appareillage et produits dont les
caractéristiques et l'usage ont été
présenté, nous avons également utilisé dans le
cadre de cette étude le logiciel Excel avec la base de
donnée SUCAF Gn-Suivi maturité qui à
permis la saisie hebdomadaire des données du suivi
maturité et de tracer les courbes de tendances de richesse pour chaque
secteur.
II. Méthodologie
II.1. Localisation géographique des parcelles
expérimentales
L'étude est menée dans les plantations
industrielles de SUCAF Gabon qui couvrent une superficie utile de
4.700 ha. Le site est localisé géographiquement dans le
département de la Mpassa (Province du Haut
Ogooué) à cheval sur l'axe routier Franceville-Moanda
à 1°40'1°48' Latitude Sud et 13°19'
-13°21' Longitude Est, à une altitude moyenne
de 325 m
(IBOUILI, 2004).
II.2.
Dispositif expérimental ou l'essai
Les essais sont effectués dans les plantations
industrielles de SUCAF Gabon. Le dispositif expérimental est un
dispositif d'essai en couple avec trois
répétitions à l'image de celui
décrit par BIANG NZIE et al ( 1993)
à SOSUCAM. Un couple est constitué d'une sous
parcelle témoin, témoin bâché (TB)
et d'une sous parcelle traitée (PT) qui contient le témoin
maturé (TM).
Le (TB) permet d'évaluer le gain de richesse
obtenue entre la maturation forcée et naturelle après
épandage du maturateur. La figure 3 montre la
disposition du dispositif expérimental
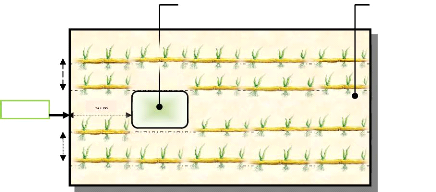
Plot bâché (PB) ou (Témoin
Bâché)
Plot traité (PT)
Ligne I
Ligne (n)
Entrée
54
Ligne (n+I)
I,5 m
Ligne (n+2)
Figure 3. Schéma du dispositif
expérimental (Essai en couple)

Les traitements maturateurs sont effectués en
début de campagne pour les parcelles (BGV 3, 4/6A, 4/6B)
variété Co997, (OU 3A, 3B et 3C) variété
NCo376 et en milieu campagne pour les parcelles (OU 1, 2A, 2B)
variété Co997, (VG 1, 2 et 3) variété
NCo376. Chaque traitement maturateur est réalisé 20
jours avant la date prévisionnel de maturation en vue d'avoir des
délais de maturation beaucoup plus longs et suivre au delà de 35
jours le comportement de la courbe de richesse des variétés
(Co997 et NCo376) dans les conditions agro
écologiques de SUCAF Gabon. Pour ce faire, le maturateur utilisé
est le Fusilade® Super, m.a : Fluazifop-p-butyl, à la
dose de 0,3 L/ha.
II.3. Protocole expérimental II.3.1. Epandage du
maturateur
L'épandage du Fusilade sur les parcelles se fait par
avion ULM J300 (Moteur Ultra Léger) à une vitesse linéaire
d'environ 120 km/h à partir des microaires. L'avion est
équipé de 5 microaires qui diffusent le produit sur une bande
moyenne de 10 à 15 m de large. La concentration volumique épandue
est de 0,3 l/ha de bouillie à une hauteur de 5 à 10 m entre
l'appareil et la cime des feuilles.
II.3.2. Suivi de la cinétique de la richesse en
saccharose II.3.3. Echantillonnage des cannes dans les parcelles
Afin d'évaluer l'efficacité du traitement, et
l'incidence d'un rallongement des délais de maturation sur le
comportement de la courbe de richesse, des échantillons de cannes sont
prélevés dans les parcelles suivant une fréquence de 7
jours : soit à 0 jour (point zéro), 7, 14, 21, 28, 35, 42, 49, 56
jours.
Les échantillons sont prélevés selon la
méthode d'échantillonnage suivante :
On compte le nombre de ligne de la parcelle,
On fait un insigne sur les cannes situées sur la ligne
correspondant à la moitié des lignes de la parcelle ;
L'échantillonneur rentre à 50 m à
l'intérieur de la parcelle et prélève un
échantillon de 5 tiges de cannes. S'il s'agit du (TB : Témoin
bâché) ou du (TM : Témoin maturé) la taille de
l'échantillon est ramenée à 10 tiges en prenant soin de
les épailler, les couper

à 5cm au raz du sol et enlever les
feuilles du sommet en faisant ressortir les bouts blancs.
L'échantillon est ensuite étiqueté
après être lié en paquet. Chaque étiquette porte les
mentions : numéro de l'échantillon, nom de la parcelle, et de la
variété.
Les échantillons sont ramassés et
transportés vers la cour à canne du service agronomique pour
broyage, extraction et filtrage du jus. La figure 3 (voir page 33)
présente de façon schématique les lieux de
prélèvement des échantillons.
II.3.4. Extraction, filtrage et réception du
jus
A l'arrivée des échantillons des parcelles, les
cannes sont sectionnées en trois tronçons (Sommet-Milieu-Base)
proportionnels. Cette distinction permet d'analyser le jus du sommet, du milieu
et de la base et conclure sur la répartition du stockage de sucre le
long de la tige. Par la suite, les tronçons sont broyés dans un
moulin, le jus recueilli dans des sceaux selon qu'il provient du sommet, du
milieu ou de la base est versé dans des flacons de 200 ml pour
être filtré.
Le jus servant à la détermination du Brix est
transvasé dans des flacons de 50 ml, alors que le jus servant à
déterminer le Pol est filtré. La procédure de filtrage du
jus consiste à prendre:
200 ml de jus. Pour le jus du milieu, après avoir
prélève le jus du sommet et de la base, mélanger les jus
provenant des trois fractions avant de prélever le jus du milieu ou jus
mélangé;
Ajouter 2 g d'acétate de plomb pour séparer le jus
torréfié et les impuretés; Homogénéiser
pendant 15 à 20 secondes ;
Laisser décanter 10 secondes;
Verser le contenu dans les papiers filtres préalablement
placés dans les entonnoirs; Recueillir le jus dans les flacons de 100 ml
toujours en prenant soin de distinguer le jus du sommet, du milieu et de la
base;
Analyser au laboratoire.

Remarque:
Outre la méthode classique d'extraction et d'analyse du
jus à partir d'un moulin, il en existe d'autres, notamment celle dite
« Analyse à la presse », dont le broyage se fait au moyen
d'une presse, et la détermination de la richesse tient compte du poids
du « gâteau ».
II.3.5. Analyse du jus
L'analyse du jus au laboratoire permet de déterminer
les paramètres technologiques de la richesse de la canne à savoir
: le Brix, le Pol, la Pureté, et le Rendement Hugo Simplifié
(RHS).
Ainsi on fait passer au réfractomètre le jus
brute (Sommet-Mélange-Base) contenu dans les flacons de 50 ml, et par
lecture on détermine le Brix.
Le jus torréfié ou jus acétate de plomb
(Sommet-Mélange-Base) passe par le polarimètre afin de
déterminer le Pol par lecture direct.
Les lectures du Pol et du Brix permettent de calculer la
Pureté et le Rendement Hugo Simplifié (RHS) à partir des
méthodes de calculs présentés à l'annexe 6.
Le RHS est l'indicateur de richesse de la canne
considéré à SUCAF Gabon. Pour chaque parcelle on
déterminera le Brix, la Pureté, le RHS du (PB) pour les plots
à maturation naturelles et pour les plots traités avec le
maturateur.
III. Analyse statistique des résultats
La saisie, le traitement hebdomadaire des données et le
suivi des parcelles est fait sous Excel avec la base de donnée
SUCAF Gn-Suivi maturité. L'interprétation et le
traitement statistique des résultats est fait avec le logiciel
XL-Stat. Une analyse de variance (ANOVA) à un facteur a
été utilisée pour déterminer la signification des
traitements au seuil de 5%. Le test de DUNNETT a permis de comparer les
traitements.
Pour ce qui est de la corrélation entre le gain de
richesse et l'augmentation du délai du suivi maturité le logiciel
XL-Stat a été utilisé. Le test de la
corrélation est le Student t-test qui a permis d'établir la
liaison entre les deux variables.

III.1. Période début campagne: plot
à maturation naturelle
III.1.1. Evolution du Brix
Dans le but d'estimer la richesse apparente du jus de canne
des secteurs Ouelle et Bangouvou, puis établir une corrélation
avec le degré d'impuretés contenu dans ce jus, des mesures de
Brix ont été effectué hebdomadairement dans les plots
à maturation naturelle (PB). Les résultats des mesures du
paramètre Brix en début campagne pour l'ensemble de parcelles
considérées sont présentés au tableau 7.
Au vue du tableau 7, il ressort que le Brix (PB) augmente
à mesure que le délai de maturation augmente suivant une
fréquence de 7 jours dans les deux secteurs concernés. En effet,
il passe de 16,46 à 19,7 dans le secteur Ouelle avec une moyenne de
18,01#177;1,44, et de 17,6 à 19,5 dans le secteur Bangouvou avec une
moyenne de 18,94#177;0,90 comme précisé au tableau 7.
III.1.2. Evolution de la Pureté
Outre l'analyse hebdomadaire du Brix, nous avons
déterminé le degré de pureté du jus des parcelles
à maturation naturelles (PB). L'ensemble des résultats issus de
la mesure de ce paramètre en début campagne est
présenté au tableau 7. Ces résultats concernent, la
pureté des parcelles du secteur Ouelle et Bangouvou.
Pour ce qui est du paramètre Pureté (PB),
d'après le tableau 7, son évolution fluctue en « dents de
scies », prenant successivement des valeurs élevées et
basses. Toutefois, la moyenne de pureté dans le secteur Ouelle est de
88,99#177;1,87, alors qu'elle est de 87,65#177;2,87 dans le secteur
Bangouvou.
III.1.3. Evolution du Rendement Hugot
Simplifié
Le rendement Hugot Simplifié RHS (PB) est
déterminé dans les plots à maturation naturelle des
secteurs Ouelle et Bangouvou en début campagne. Les résultats de
la mesure de ce paramètre sont consignés au tableau 7.
De même, l'analyse du tableau 7 concernant le
paramètre RHS (PB) nous montre qu'il augmente dans le secteur Ouelle, et
prend les valeurs 9,76 à 11,76 entre le point 0, et la dernière
analyse, avec une moyenne de 10,63#177;0,76.

Dans le secteur Bangouvou, nous constatons également
que le RHS (PB) augmente de 2,5 points, passant de 8,9 à 11,4, avec une
moyenne de 10,9#177;0,89.

Tableau 7. Période début campagne
: Paramètres technologiques de maturation pour plot à maturation
naturelle (PB)
Secteur Mesure T0 T1 T2 T3 T4 T5 T6 T7 T8 Moyenne Ecart type
|
Brix
|
16,46
|
15,9
|
17,5
|
17,2
|
18,63
|
19,13
|
19,53
|
19,7
|
-
|
18,01
|
#177;1,44
|
|
OU
|
Pureté
|
88,06
|
92,26
|
88,93
|
89,5
|
85,76
|
89,96
|
87,93
|
89,5
|
-
|
88,99
|
#177;1,87
|
|
RHS (PB)
|
9,76
|
9,86
|
10,3
|
10,2
|
10,4
|
11,46
|
11,3
|
11,73
|
-
|
10,63
|
#177;0,76
|
|
Brix
|
17,6
|
17,86
|
18,63
|
18,33
|
19,03
|
19,43
|
20,13
|
19,96
|
19,5
|
18,94
|
#177;0,90
|
|
BGV
|
Pureté
|
80,63
|
89,1
|
86,43
|
89,43
|
89,36
|
89,86
|
88,53
|
86,9
|
88,6
|
87,65
|
#177;2,87
|
|
RHS (PB)
|
8,9
|
10,56
|
10,4
|
10,8
|
11,3
|
11,6
|
11,8
|
11,36
|
11,4
|
10,90
|
#177;0,89
|
|
Avec :
T0 : Analyse Point zéro ; T7 : Analyse à 49
jours pour OU T1 : Analyse à 7 jours ; T8= Analyse à 52 jours
pour BGV
|
|
|
Fréquence entre analyses = 7 jours
|
|
|

III.2. Période début campagne: plots
à maturation forcée
III.2.1. Evolution du Brix (PT)
Le paramètre Brix (PT) des plots à maturation
forcée à été mesuré hebdomadairement en
début campagne dans les secteurs Ouelle et Bangouvou. Le tableau 8,
présente les données enregistrées pour ce paramètre
dans les deux secteurs étudiés. L'analyse globale du tableau 8
nous montre que le Brix (PT) augmente dans les deux secteurs
considérés en début campagne. En effet, le Brix (PT) dans
le secteur Ouelle passe de 16,1 au point 0, à 20,43 au bout de 47 jours
avec une valeur moyenne de 18,47#177;1,96, tandis qu'il augmente de 2,7 points
entre 0 et 52 jours dans le secteur Bangouvou, avec une moyenne de
19,77#177;1,23.
III.2.2. Evolution de la pureté (PT)
Ce paramètre a été mesuré dans les
deux secteurs considérés en début campagne dans les plots
à maturation forcée. Les résultats de la mesure de la
pureté (PT) sont présentés dans le tableau 8.
Pour ce qui est de la pureté, elle est instable dans
les deux secteurs en prenant des valeurs hautes et basses successivement. Toute
fois, la pureté moyenne par secteur est de 89,4#177;2,33 à
Ouelle, et 88,24#177;2,71 dans le secteur Bangouvou.
III.2.3. Evolution du rendement Hugot Simplifié
RHS (PT)
Le tableau 8 présente l'ensemble des valeurs
enregistrées pour ce paramètre dans les secteurs Ouelle et
Bangouvou en début campagne.
Le rendement Hugot Simplifié RHS (PT) pour sa part
augmente dans l'ensemble des deux secteurs. Il passe de 9,08 au point 0
à 12,42 au bout de 47 jours, avec une valeur moyenne de 11#177;1,13 dans
le secteur Ouelle, Dans le même temps on enregistre les valeurs 9,53 au
point 0 et 12,05 à 52 jours dans le secteur Bangouvou, avec une richesse
moyenne de 11,57#177;1,20.

Tableau 8. Période début campagne
: Paramètres technologiques de maturation, plot à maturation
artificiel (PT)
Secteur Mesure T0 T1 T2 T3 T4 T5 T6 T7 T8 Moyenne Ecart type
|
Brix
|
16,1
|
15,86
|
17,16
|
17,96
|
19,4
|
20,33
|
20,53
|
20,43
|
-
|
18,47
|
#177;1,96
|
|
OU
|
Pureté
|
85,5
|
92,07
|
90,16
|
91,7
|
86,83
|
88,36
|
89,8
|
90,76
|
-
|
89,40
|
#177;2,33
|
|
RHS (PT)
|
9,08
|
9,85
|
10,34
|
10,89
|
11,02
|
12,01
|
12,34
|
12,42
|
-
|
11,00
|
#177;1,13
|
|
Brix
|
17,9
|
18,23
|
18,36
|
19,6
|
20,23
|
21,06
|
21,36
|
20,6
|
20,6
|
19,77
|
#177;1,23
|
|
BGV
|
Pureté
|
83,16
|
85,53
|
88,6
|
87,16
|
91
|
87,7
|
92,9
|
89,73
|
88,4
|
88,24
|
#177;2,71
|
|
RHS (PT)
|
9,53
|
10,20
|
10,75
|
10,96
|
12,35
|
12,49
|
13,45
|
12,39
|
12,05
|
11,57
|
#177;1,20
|
|
Avec :
T0 : Analyse Point zéro ; T7 : Analyse à 49 jours
pour OU T1 : Analyse à 7 jours; T8= Analyse à 52 jours pour
BGV
|
|
|
Fréquence entre analyses = 7 jours
|
|

III.3. Evolution de la Richesse moyenne RHS (PT) en
début campagne III.3.1. Secteur Ouelle
La figure 4 présente l'évolution de la
richesse moyenne des trois parcelles testées dans le secteur
Ouelle en début campagne.
Campagne 2012.Suivi maturité parcelles
tests :
Courbe de richesse secteur Ouelle: à T= 47
j
1 2 3 4 5 6 7 8 9 10 11 12
Semaine d'analyse
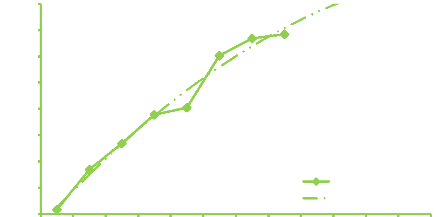
Richesse moyenne
12,5
11,5
10,5
9,5
13
12
11
10
9
RHS PT OU 3A, B et C Tendance OU 3A, 3B et 3C
Figure 4. Evolution de la richesse moyenne des parcelles
tests : Secteur Ouelle en début campagne
Le rallongement du délai de maturation de 35
à 47 jours pour l'ensemble des parcelles tests à permis d'obtenir
une augmentation richesse de 0,47 points. L'optimum de
richesse n'est pas clairement fixé d'après la
courbe de richesse présentée à la figure
4, mais semble se préciser autour de 47 jours.
III.3.2. Analyse statistique de la richesse dans le secteur
Ouelle en début campagne
|
Les résultats de l'analyse de la variance pour
la richesse des parcelles du secteur Ouelle fonction du délai de
maturation en début campagne sont mentionnés dans le tableau
9.
|
en
|
La statistique de test utilisé est le test de
DUNNETT pour valider l'hypothèse nulle H0 : Il n'y a pas
d'effet significatif de l'augmentation du délai de maturation
sur la richesse.

La variable explicative (X) pour cette ANOVA est le
délai de maturation, tandis que la variable réponse (Y) est le
RHS (PT) obtenu.
Tableau 9. Analyse de variance (ANOVA) pour la
richesse secteur Ouelle
|
Source
|
DDL
|
Somme des carrés
|
Moyenne des carrés
|
F
|
p-value
|
|
Modèle Erreur
Total corrigé
|
1
|
0,167
|
0,167
|
6,250
|
0,067
|
|
4
|
0,107
|
0,027
|
|
|
|
5
|
0,273
|
|
|
|
L'interprétation du tableau 9 indique qu'il n'y a pas
un effet significatif de l'augmentation du délai de maturation sur la
richesse dans le secteur Ouelle. En effet, la valeur de la probabilité
calculée p-value est supérieure au seuil de signification
fixé à 5% (p-value>0.05). Ainsi, nous pouvons affirmer que les
différences observées entre les résultats des richesses en
fonction du délai de maturation (Figure 5) ne sont que des tendances.
III.3.3 Comparaison de richesse à 35 et 47 jours
secteur Ouelle
Le tableau 10 présente les résultats obtenus du
test de comparaison avec un témoin de Dunnett. Ce test confronte la
signification des richesses obtenues à 35 et à 47 jours dans le
secteur Ouelle.
Tableau 10. Test de comparaison de DUNNETT
entre la richesse à 35 et 47 jours secteur Ouelle.
|
Contraste Différence Différence
|
Valeur
|
Pr > Diff Significatif
|
standardisée critique
Optimum vs Témoin
0,333 2,500 2,776 0,067 Non
Le tableau 10 à travers le test de comparaison avec un
témoin de DUNNETT nous confirme qu'il n'y a pas d'effets significatifs
d'une augmentation du délai de maturation sur la richesse. Cela suppose
donc que les valeurs de richesses obtenues à l'optimum et à 35
jours ne sont pas significativement différentes.

L'annexe 8a, présente les boites à
moustache, qui définissent la dispersion des
moyennes du témoin à 35 jours et l'optimum à 47
jours. Nous constatons bien que les écarts types des
moyennes des richesses obtenues à 35 et 47 jours se chevauchent, par
conséquent, les différences de richesses
à ces deux analyses ne sont pas significatives.
III.4. Evolution de la Richesse moyenne RHS
(PT)
en
III.4.1. Secteur Bangouvou
La figure 5 présente l'évolution de la
richesse moyenne dans le secteur Bangouvou
début campagne.
Campagne 2012. Suivi maturité parcelles
tests :
Courbe de richesse secteur BGV 3, BGV 4/6A et
BGV 4/6B à T= 52 j
|
1 2 3
|
4 5 6 7 8 9 10
Semaine d'analyse
|
11 12 13
|
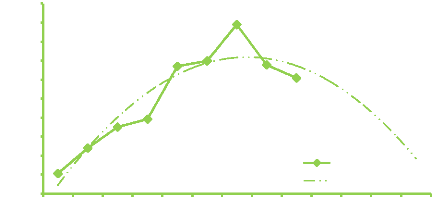
Richesse moyenne
14,00
13,50
13,00
12,50
12,00
11,50
11,00
10,50
10,00
9,50
9,00
RHS PT BGV 3, 4/BA, 4/6B Tendance BGV
Figure 5. Evolution de la richesse
moyenne : Secteur Bangouvou en début campagne
jours avec une
à 42
.
angouvou
D'après la figure 5 , le secteur BGV
présente un optimum de richesse valeur >13,5,
au-delà, nous notons une baisse de richesse
: début
III.4.2. Analyse statistique de la richesse dans le
secteur B
campagne

Les résultats de l'analyse de la variance pour
la richesse du secteur Bangouvou en fonction u délai de
maturation en début campagne sont mentionnés dans le
tableau 11. La statistique de test utilisée est le test de
comparaison Dunnett pour valider l'hypothèse
nulle H0 : Il n'y a pas d'effet significatif de l'augmentation
du dél ai de maturation sur la richesse.
Tableau 11. Analyse de variance (ANOVA) pour la
richesse secteur Bangouvou
|
Source DDL
|
Somme des carrés
|
Moyenne des carrés
|
F
|
p-value
|
|
Modèle Erreur
Total corrigé
|
1
|
1,402
|
1,402
|
24,029
|
0,008
|
|
4
|
0,233
|
0,058
|
|
|
|
5
|
1,635
|
|
|
|
Au regard des résultats présentés au
tableau 11, nous constatons qu'il y a un effet significatif d'une augmentation
du délai de maturation sur la richesse dans le secteur Bangouvou. Ce
constat est justifié par la valeur de la probabilité
calculée p-value qui est inférieur au seuil de signification
fixé à 5% (p-value<0.05). En conséquence, nous pouvons
affirmer que les différences observées entre les résultats
des richesses en fonction du délai de maturation (Figure 7) sont
significatives.
III.4.3. Comparaison de richesse à 35 et 42 jours
secteur Bangouvou
Le tableau 12 récapitule les résultats obtenus
du test de comparaison avec un témoin (DUNNETT). Ce test confronte la
signification des richesses obtenues à 35 et 42 jours dans le secteur
Bangouvou.
Tableau 12. Test de comparaison de DUNNETT
entre la richesse à 35 et 42 jours secteur Bangouvou.
Contraste Différence Différence Valeur
standardisée critique
|
Pr > Diff
|
Significatif
|
|
Optimum vs Témoin
|
0,967 4,902 2,776 0,008 Oui
|
|
|
Le tableau 12 à travers le test de comparaison de
DUNNETT nous confirme qu'il y a un effet significatif d'une augmentation du
délai de maturation sur la richesse. Cela suppose donc que les valeurs
de richesses obtenues à l'optimum et à 35 jours sont
significativement différentes.
L'annexe 8b, montre les boites à moustache, qui
définissent la dispersion des moyennes du témoin à 35
jours et l'optimum à 42 jours. Nous constatons que les écarts
types des

moyennes des richesses obtenues à 35 et 42 jours ne se
chevauchent pas, par conséquent, les différences de richesses
à ces deux analyses sont significatives.
III.5 Période milieu campagne, plot à
maturation naturelle III.5.1. Evolution du Brix
Pour la période de milieu de campagne, les secteurs
Mvengue et Ouelle* sont concernés par notre étude, notamment les
parcelles tests VG 1, VG 2, VG3 et OU 1, 2A et 2B qui servent de
répétition. Les valeurs du paramètre Brix (PB) ont
été relevées chaque semaine et répertoriées
dans le tableau 13.
Du tableau 13, nous retenons que le Brix (PB) augmente dans
les deux secteurs étudiés. Il croît de 16,3 au point 0
à 20,26 à 49 jours dans le secteur Mvengue avec une moyenne par
secteur de 17,88#177;1,77.
Dans le secteur Ouelle*, il prend les valeurs 17,56 au point 0
à 21,01 à 39 jours, avec une moyenne de 19,32#177;1,29.
III.5.2. Evolution de la pureté
Le paramètre pureté des parcelles à
maturation naturelles a été déterminé pour les
secteurs VG et OU* à partir des mesures du Brix et du Pol. Les valeurs
enregistrées pour ce paramètre sont mentionnées dans le
tableau 13.
D'après le tableau 13, nous remarquons également
que la Pureté n'est pas stable. Elle prend alternativement des valeurs
hautes et basses, mais est comprise entre 88,6-93,5 dans le secteur (VG) avec
une valeur moyenne de 91,26#177;1,82.
Parallèlement, la pureté fluctue dans le secteur
(OU*) où elle est comprise entre 83,6 et 89,7, avec une valeur moyenne
de 87,17#177;2,29.
III.5.3. Evolution du Rendement Hugot
Simplifié
Le rendement Hugot à été
déterminé en milieu campagne dans les secteurs Mvengue et
Ouelle*. L'ensemble des résultats observé pour ce
paramètre est résumé dans le tableau 13. Pour ce qui est
du paramètre RHS (PB), il augmente dans le secteur (VG), et prend les
valeurs 10,4 au point 0 et 11,86 à la dernière analyse, soit une
moyenne de 10,93#177;0,99. Aussi, le

RHS (PB) augmente de 2,59 points entre la première et
la dernière analyse dans le secteur (OU*), avec une valeur moyenne de
11,04#177;0,98.

Tableau 13. Période milieu campagne :
Paramètres technologiques de maturation, plot à maturation
naturelle (PB)
Secteur Mesure T0 T1 T2 T3 T4 T5 T6 T7 T8 Moyenne Ecart type
|
Brix
|
16,3
|
16,03
|
15,9
|
18,5
|
17,2
|
18,76
|
20,06
|
20,26 -
|
17,88
|
#177;1,77
|
|
VG
|
Pureté
|
93,73
|
88,7
|
92,16
|
91,16
|
92,73
|
91,96
|
91,03
|
88,6 -
|
91,26
|
#177;1,82
|
|
RIS (PB)
|
10,4
|
9,4
|
9,88
|
11,33
|
10,76
|
11,63
|
12,2
|
11,86 -
|
10,93
|
#177;0,99
|
|
Brix
|
17,56
|
17,83
|
19,0
|
19,36
|
20,13
|
20,36
|
21,01
|
- -
|
19,32
|
#177;1,29
|
|
OU*
|
Pureté
|
83,6
|
86,11
|
85,1
|
88,1
|
88,16
|
89,4
|
89,73
|
- -
|
87,17
|
#177;2,29
|
|
RIS (PB)
|
9,76
|
10,0
|
10,46
|
11,23
|
11,7
|
11,76
|
12,35
|
- -
|
11,04
|
#177;0,98
|
|
Avec :
T0 : Analyse Point zéro ; T7 : Analyse à 49 jours
pour VG T0 : Point zéro ; T6= Analyse à 39 jours pour OU
|
|
|
Fréquence entre analyses = 7 jours
|
|
|

III.6. Période milieu campagne, plot à
maturation forcée
III.6.1. Evolution du Brix
Le tableau 14, dresse l'ensemble des valeurs observées
pour le paramètre Brix (PT) dans les secteurs Ouelle* et Mvengue en
milieu campagne. Pour ce qui est du paramètre Brix (PT) : Dans le
secteur Ouelle*, il augmente de 4,2 points entre la première et la
dernière analyse (soit 39 jours après maturation) avec une
moyenne de 19,65#177;1,66.
Dans le secteur Mvengue également, le Brix augmente de
3,96 points avec une moyenne de 18,12#177;1,66 au terme de 49 jours.
III.6.2. Evolution de la pureté
Le résumé des données enregistrées
pour le suivi de la Pureté (PT) en milieu campagne dans les secteurs
Ouelle* et Mvengue est présenté au tableau 14.
Le paramètre Pureté (PT), pour sa part fluctue
dans les deux secteurs, cependant, on note une valeur de 91,17#177;1,76 pour le
secteur Mvengue, alors qu'elle n'est que de 88,25#177;1,99 dans le secteur
Ouelle*.
III.6.3. Evolution du rendement Hugot
Le paramètre rendement Hugot Simplifié est
déterminé hebdomadairement dans les secteurs Ouelle* et Mvengue
en milieu de campagne. L'ensemble des résultats est consigné dans
le tableau 14.
S'agissant du Rendement Hugot Simplifié, il augmente
dans les deux secteurs. Il passe de 9,51 à 12,16 à Mvengue avec
une moyenne de 11,09#177;1,26, tandis qu'il enregistre les valeurs 9,71 au
point zéro et 12,76 à 39 jour dans le secteur Ouelle* avec une
moyenne de 11,51#177;1,23.

Tableau 14. Période milieu campagne :
Paramètres technologiques de maturation, plot à maturation
artificielle (PT)
Secteur Mesure T0 T1 T2 T3 T4 T5 T6 T7 T8 Moyenne Ecart type
|
Brix
|
16
|
16,1
|
17,16
|
18,5
|
17,96
|
18,76
|
20,53
|
19,96 -
|
18,12
|
#177;1,66
|
|
VG
|
Pureté
|
89,7
|
89,1
|
90,93
|
89,56
|
93,0
|
93,63
|
92,86
|
90,56 -
|
91,17
|
#177;1,76
|
|
RIS (PT)
|
9,51
|
9,52
|
10,29
|
10,99
|
11,32
|
11,97
|
12,94
|
12,16 -
|
11,09
|
#177;1,26
|
|
Brix
|
17,2
|
17,56
|
19,4
|
20,4
|
20,8
|
21,03
|
21,14
|
- -
|
19,65
|
#177;1,66
|
|
OU*
|
Pureté
|
85,86
|
88,66
|
86,86
|
86,0
|
89,96
|
90,66
|
89,72
|
- -
|
88,25
|
#177;1,99
|
|
RIS (PT)
|
9,71
|
10,31
|
11,06
|
11,47
|
12,49
|
12,79
|
12,76
|
- -
|
11,51
|
#177;1,23
|
|
Avec :
T0 : Analyse Point zéro ; T7 : Analyse à 49 jours
pour VG T0 : Point zéro ; T6= Analyse à 39 jours pour OU
|
|
|
Fréquence entre analyses = 7 jours
|
|

III.7. Evolution de la Richesse moyenne RHS (PT) III.7.1.
Secteur Mvengue
La figure 6 présente l'évolution de la richesse
moyenne dans le secteur Mvengue en milieu campagne.
Campagne 2012. Suivi maturité parcelles tests
:
Courbe de richesse des parcelles VG 1, VG 2 et VG 3 à T =
42j
1 2 3 4 5 6 7 8 9 10 11
Semaine d'analyse
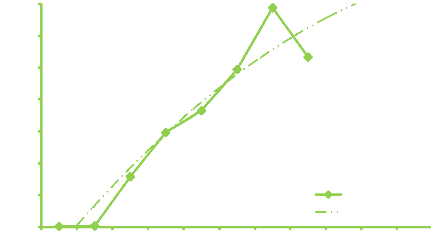
RHS PT VG 1, 2 et 3 Tendance Secteur VG
Richesse moyenne
12,5
11,5
10,5
9,5
13
12
11
10
Figure 6. Evolution de la richesse moyenne des
parcelles tests : Secteur M'vengue en milieu campagne
De la première à l'analyse 7, nous remarquons une
augmentation de richesse dans le secteur VG. En effet, elle passe de 9,5
à la 1ère et 2ème analyse à
13 à la 7ème analyse. Aussi, nous
enregistrons une baisse de la richesse après la 7ème
analyse.
L'optimum de richesse dans ce secteur est donc atteint à
42 jours ce qui correspond à la 7ème analyse comme
présenté à la figure 6.
III.7.2. Analyse statistique de la richesse secteur Mvengue
en milieu de campagne
Les résultats de l'analyse de la variance pour la richesse
du secteur Mvengue en fonction du délai de maturation en milieu campagne
sont mentionnés dans le tableau 15.
La statistique de test utilisé est le test de DUNNETT pour
valider l'hypothèse nulle H0 : Il n'y a pas d'effet significatif du
délai de maturation sur la richesse obtenue à 35 et 42 jours.

Tableau 15. Analyse de variance (ANOVA) pour la
richesse secteur Mvengue
|
Source DDL
|
Somme des carrés
|
Moyenne des carrés
|
F
|
p-value
|
|
Modèle Erreur
Total corrigé
|
1
|
1,602
|
1,602
|
4,348
|
0,105
|
|
4
|
1,473
|
0,368
|
|
|
|
5
|
3,075
|
|
|
|
Au regard des résultats présentés au
tableau 15, on peut conclure qu'il n'y a pas un effet significatif d'une
augmentation du délai de maturation sur la richesse dans le secteur
Mvengue. Ce constat est justifié par la valeur de la probabilité
calculée p-value qui est supérieur au seuil de signification
fixé à 5% (p-value>0.05).
En conséquence, nous pouvons affirmer que les
différences observées entre les résultats des richesses en
fonction de la durée du traitement maturateur (Figure 6) ne sont pas
significatives.
III.7.3. Comparaison de la richesse à 35 et 42
jours secteur Mvengue
Le tableau 16 présente les résultats obtenus du
test de comparaison avec un témoin (DUNNETT). Ce test confronte la
signification des richesses obtenues à 35 et 42 jours dans le secteur
Mvengue.
Tableau 16. Test de comparaison de DUNNETT
entre la richesse à 35 et 42 jours secteur Mvengue.
Contraste Différence Différence Valeur critique Pr
> Diff Significatif
standardisée
|
Optimum vs Témoin
|
|
1,033 2,085 2,776 0,105 Non
|
|
|
|
Le tableau 16 à travers le test de comparaison de
DUNNETT, nous confirme qu'il n'y a pas un effet significatif d'une augmentation
du délai de maturation sur la richesse dans le secteur Mvengue. Cela
suppose donc que les valeurs de richesses obtenues à l'optimum (42) et
au témoin (35) jours ne sont pas significativement
différentes.

L'annexe 8c, montre les boites à moustache, qui
définissent la dispersion des moyennes du témoin à 35
jours et l'optimum à 42 jours. Nous remarquons que les écarts
types des moyennes des richesses obtenues à 35 et 42 jours se
chevauchent, par conséquent, les différences de richesses
à ces deux périodes ne peuvent être significatives.
III.8. Evolution de la richesse moyenne RHS
(PT)
III.8.1. Secteur Ouelle*
La figure 7 présente l'évolution de la richesse
moyenne dans le secteur Ouelle* en milieu de campagne.
Campagne 2012. Suivi maturité parcelles tests
:
Courbe de richesse secteur Ouelle à T= 39 j
1 2 3 4 5 6 7 8 9
Semaine d'analyse
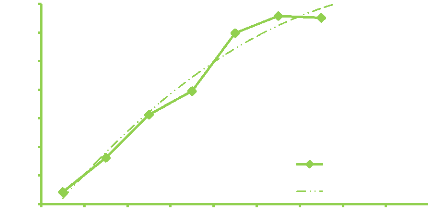
Richesse moyenne
12,5
11,5
10,5
9,5
13
12
11
10
Tendance OU1, 2, 3
RHS PT OU 1, 2A et 2B
Figure 7. Evolution de la richesse moyenne des
parcelles tests : Secteur Ouelle* en milieu campagne
La figure 7 indique que la richesse dans le secteur Ouelle*
est croissante. En effet, elle passe 9,7 au point zéro à
12,7 à 35 jours. Au-delà de cette date, la
richesse semble baissé, alors que la courbe de tendance montre bien
qu'elle est pourrait encore augmenter. Cela se justifie par le fait qu'elle ait
été récoltée trop tôt. Son optimum de
richesse pourrait donc se situer au delà de 39 jours (Fig. 7).
III.8.2. Analyse statistique de la richesse secteur
Ouelle* en milieu de campagne
Les résultats de l'analyse de la variance pour la
richesse du secteur Ouelle* en fonction du délai de maturation en milieu
campagne sont mentionnés dans le tableau 17.

La statistique de test utilisé est le test de
comparaison avec un témoin (DUNNETT) pour valider l'hypothèse
nulle H0 : Il n'y a pas d'effet significatif d'une augmentation du délai
de maturation sur la richesse secteur Ouelle*.
Tableau 17. Analyse de variance (ANOVA) pour la
richesse secteur Ouelle*
|
Source DDL
|
Somme des carrés
|
Moyenne des carrés
|
F
|
p-value
|
|
Modèle Erreur
Total corrigé
|
1
|
0,002
|
0,002
|
0,250
|
0,643
|
|
4
|
0,027
|
0,007
|
|
|
|
5
|
0,028
|
|
|
|
Au regard des résultats présentés au
tableau 17, on peut conclure qu'il n'y a pas un effet significatif d'une
augmentation du délai de maturation sur la richesse dans le secteur
Ouelle*. Ce constat est justifié par la valeur de la probabilité
calculée p-value qui est supérieur au seuil de signification
fixé à 5% (p-value>0.05).
En conséquence, nous pouvons affirmer que les
différences observées entre les résultats des richesses en
fonction de la durée du suivi (Figure 10) ne sont pas significatives.
III.8.3. Comparaison de la richesse à 35 et 39
jours secteur Ouelle
Le tableau 18 présente les résultats obtenus du
test avec un témoin (DUNNETT). Ce test confronte la signification des
richesses obtenues à 35 et 39 jours dans le secteur Ouelle.
Tableau 18. Test de comparaison avec un
témoin (DUNNETT) entre la richesse à 35 et 39 jours secteur
Ouelle*.
Contraste Différence Différence
Valeur
standardisée critique
Pr > Diff Significatif
|
Témoin vs Optimum
|
|
0,033 0,500 2,776 0,643 Non
|
|
|
|
Le tableau 18 à travers les tests de comparaisons de
DUNNETT, nous confirme qu'il n'y a pas un effet significatif d'une augmentation
du délai de maturation sur la richesse dans le secteur Ouelle*. Cela
suppose donc que les valeurs de richesses obtenues à l'optimum (39) et
au témoin (35) jours ne sont pas significativement
différentes.

L'annexe 8d, montre les boites à moustache, qui
définissent la dispersion des moyennes du témoin à 35
jours et l'optimum à 39 jours. Nous remarquons que les écarts
types des moyennes des richesses obtenues à 35 et 39 jours se
chevauchent, par conséquent, les différences de richesses
à ces deux périodes ne peuvent être significatives.
III.9. Gain de richesse
Le tableau 19 résume les gains obtenus aux
témoins (35) jours dans chaque secteur ainsi que les gains
enregistrés aux optima respectifs.
La différence de gain obtenu à l'optimum et au
témoin renseigne sur le gain de richesse correspond au rallongement du
délai de maturation.

Tableau 19. Gain de richesse (RHS) par
secteur
Témoin Optima
(35 jours) (39, 42 ou 47 jours)
|
Secteur OU (3)
Secteur BGV
Secteur VG
Secteur OU*
|
PT
|
PB
|
PT
|
PB
|
Gain richesse (Témoin)
|
Gain richesse (Optimum)
|
?G=Gain (délai)
|
|
12,03
|
11,46
|
12,34
|
11,3
|
0,57
|
1,04
|
0,47
|
|
12,49
|
11,6
|
13,45
|
11,8
|
0,89
|
1,65
|
0,76
|
|
11,97
|
11,63
|
12,94
|
12,2
|
0,34
|
0,74
|
0,4
|
|
12,79
|
11,76
|
12,76
|
12,35
|
1,03
|
0,41
|
-0,62
|

L'analyse du tableau 19, montre que le rallongement du
délai de maturation dans le secteur Ouelle en début campagne a
permis un gain de richesse de 0,47 point. Dans le secteur Bangouvou par contre,
le gain semble beaucoup plus importants, soit 0,76 points.
En milieu de campagne, le secteur Mvengue a enregistré
un gain de richesse de 0,4 points lorsqu'on rallonge le délai de 35
à 42 jours, alors que le gain semble négatif dans le secteur
Ouelle* soit 0,62 point de perdu, qui pourrait être imputable à
une récolte « précoce » des parcelles de ce secteur.
III.10. Corrélation entre gain de richesse et
délai du suivi maturité
III.10.1. Début campagne III.10.1.1. Secteur
Ouelle.
La figure 8 présente les résultats de l'analyse
de la corrélation entre le gain de richesse et le délai du suivi
maturité dans le secteur Ouelle en début campagne.
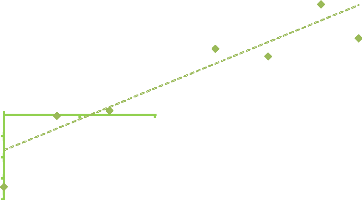
Période: Début campagne
Corrélation: Gain de richessse et délais,
sécteur OU (3)
y = 0,0291x - 0,3338 R2 = 0,7813
0 10 20 30 40 50
Délai
|
Gain
|
|
Tendance Gain OU (3)
|
|
Gain de richesse
|
1,2
1 0,8 0,6 0,4 0,2
0 -0,2 -0,4 -0,6 -0,8
|
Figure 8. Corrélation entre le gain de
richesse et délai de maturation secteur OU
Les résultats présentés à la
figure 8 montrent qu'il existe une corrélation significative forte entre
le gain de richesse et le délai du suivi de la maturité dans le
secteur Ouelle en début campagne. Cette corrélation se traduit
par le coefficient de corrélation r=0,88 qui est compris entre
(0,8<r<1).

Par ailleurs, le coefficient de détermination
(R2=0,781) nous révèle que 78,1% de l'augmentation du
gain de saccharose est dû à l'augmentation du délai du
suivi de la maturité.
Suivant l'équation de régression linéaire
du gain de richesse en fonction du délai du suivi maturité, nous
constatons que le coefficient directeur est positif, ce qui permet de conclure
que le gain de richesse augmente proportionnellement au délai du suivi
de la maturité.
III.10.1.2. Secteur Bangouvou
La figure 9 présente les résultats de l'analyse
de la corrélation entre le gain de richesse et le délai du suivi
maturité dans le secteur Bangouvou.
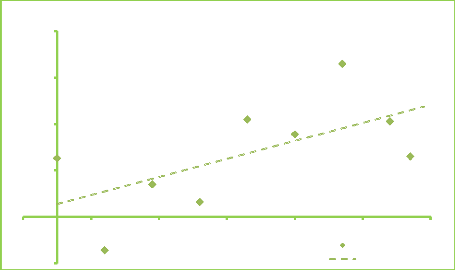
Gain
1
Délais
Série1
Tendance Gain BGV
Période: Début campagne
Corrélation: Gain de richesse et délais,
sécteur BGV
1,5
y = 0,0195x + 0,1358 R2 = 0,382
0,5
0
-5 5 15 25 35 45 55
2
-0,5
Figure 9. Corrélation entre le gain de
richesse et délai de maturation secteur Bangouvou
Les résultats présentés à la figure 9
indiquent qu'il n'existe pas une corrélation entre le gain de richesse
et le délai du suivi de la maturité dans le secteur Bangouvou en
début campagne. Ce résultat est justifié par le
coefficient de corrélation r<0,7 est compris.
Cependant le coefficient de détermination
(R2=0,382) nous révèle que 38,2% de l'augmentation du
gain de saccharose est dû proportionnellement à l'augmentation du
délai du suivi de la maturité.

Toutefois, suivant l'équation de régression
linéaire du gain de richesse en fonction du délai du suivi
maturité, nous constatons que le coefficient directeur est positif, ce
qui laisse penser que le gain de richesse augmente proportionnellement au
délai du suivi de la maturité.
III.10.2. Milieu campagne III.10.2.1. Secteur
Mvengue
La figure 10 présente les résultats de l'analyse
de la corrélation entre le gain de richesse et le délai du suivi
maturité dans le secteur Mvengue en milieu de campagne.
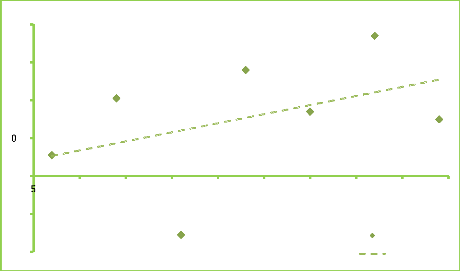
-0,2
Délai
Période: Milieu campagne
Corrélation: Gain de richesse et délai secteu VG
0,8
y = 0,0096x + 0,0386 R2 = 0,1849
0,6
10 15 20 25 30 35 40 45 50
Série1
Tendance Gain VG
-0,4
0,4
,2
Gain de richesse
0
Figure 10. Corrélation entre le gain de
richesse et délai de maturation secteur Mvengue
Les résultats présentés à la figure
10 indiquent qu'il n'existe pas de corrélation entre le gain de richesse
et le délai du suivi de la maturité dans le secteur Mvengue en
milieu campagne. Cela se justifie par le coefficient de corrélation
r<0,7.
Par ailleurs, le coefficient de détermination
(R2=0,184) nous révèle que seulement 18,4% de
l'augmentation du gain de saccharose est du proportionnellement à
l'augmentation du délai du suivi de la maturité.
Suivant l'équation de régression linéaire
du gain de richesse en fonction du délai du suivi maturité, nous
constatons que le coefficient directeur est positif, ce qui laisse supposer que
le gain de richesse augmente proportionnellement au délai du suivi de la
maturité.
III.10.2.2. Secteur Ouelle*
La figure 11 présente les résultats de l'analyse
de la corrélation entre le gain de richesse et le délai du suivi
maturité dans le secteur Ouelle* en milieu de campagne.

Période: Milieu campagne
Corrélation : Gain de richesse et délai secteur
Ouelle*
y = 0,0166x + 0,1296 R2 = 0,46
0 5 10 15 20 25 30 35 40
Délai Gain
Tendance OU (1,2A,2B)
|
Gain de richesse
|
1,2 1 0,8 0,6 0,4 0,2 0
|
-0,2
Figure 11. Corrélation entre le gain de
richesse et délai de maturation secteur Ouelle*
Les résultats présentés à la figure
11 indiquent qu'il n'y a pas une corrélation entre le gain de richesse
et le délai du suivi de la maturité dans le secteur Ouelle* en
milieu campagne. En effet, le coefficient de corrélation r<0,7
De même, l'analyse du coefficient de détermination
(R2=0,46) nous révèle que 46% de l'augmentation du
gain de saccharose est du proportionnellement à l'augmentation du
délai du suivi de la maturité.
En considérant l'équation de régression
linéaire du gain de richesse en fonction du délai de maturation,
nous constatons que le coefficient directeur est positif, ce suppose le gain de
richesse augmente proportionnellement au délai du suivi de la
maturité

IV.1. Analyse globale des résultats
La thématique de recherche que nous avons abordé
au cours de cette étude s'inscrit dans une problématique de
recherche développement. Elle est axée sur le suivi de
l'évolution de la courbe de richesse des variétés
Co997 et NCo376 lorsqu'on augmente le
délai de maturation.
Le contrôle régulier de la richesse s'est fait
par mesure des paramètres technologiques de richesse (Brix,
Pureté, RIFTS) à intervalle de 7 jours dans les parcelles tests,
au-delà des délais habituels de suivi de la maturation à
SUCAF Gabon.
Le Brix
Au vue des résultats de début, et milieu
campagne présentés aux tableaux 7, 8, 11, et 12, nous constatons
que le Brix évolue de manière croissante dans les plots à
maturation naturelles et artificiels. L'optimum moyen de Brix est obtenu
à la sixième semaine, soit 42 jours après maturation dans
les secteurs considérés.
Cependant on note globalement que le Brix des plots à
maturation artificiel (Brix PT) augmente beaucoup plus vite que celui des plots
à maturation naturelles (Brix PB). Ce constat corrobore avec les
observations de (DUSKY et al, 1991 ; BIANG NZIE et al, 1993)
sur le comportement de ce paramètre suivant les deux modes de
maturation.
Les raisons qui peuvent expliquer cette évolution sont
multiples. L'augmentation de l'âge des cannes testées au cours de
la maturation peut en être l'une des causes selon (MARGARITA, 1976). En
effet, au cours du processus de maturation en début campagne,
l'âge est passée de 10 à 11 mois dans le secteur Ouelle,
9,7 à 11,6 mois à Bangouvou, tandis qu'en milieu campagne les
secteurs Mvengue et Ouelle* ont enregistré des augmentations
d'âges respectives de 9,7 à 11,3 et 9,7 à 11.
La pureté
L'analyse globale du paramètre pureté dans
chacun des secteurs étudié révèle d'après
les tableaux 7, 8, 11 et 12 qu'en en début campagne, dans le secteur
Ouelle, la pureté est de 89,4#177;2,33 et 88,2#177;2,71 à
Bangouvou, tandis qu'à Mvengue et Ouelle* en milieu de campagne, elle
est respectivement égale à 91,17#177;1,76 et 88,25#177;1,99.

Ce paramètre demeure instable dans l'ensemble des
secteurs, même si nous pouvons remarquer qu'elle est plus
élevée dans les plots à maturation artificielle que dans
les plots à maturation naturelle comme relevé par BESSEGUE
(2011).
Plusieurs raisons peuvent expliquer la variabilité de
la purété suivant les semaines d'analyses, entre autre : la
présence d'impuretés dans le jus, en dépit du fait qu'il
ait été filtré. De même, la qualité des
filtres utilisés, la mauvaise pesée de l'acétate et
quelques défauts au cours de la manipulation sont autant de raisons qui
ont rendus difficile la stabilité des lectures faites au
polarimètre.
Toute fois, les valeurs moyennes de pureté
enregistrées dans l'ensemble des secteurs semblent élevées
par rapport à celles obtenues par ROSTRON (1975) 77
à 85,9%.
Le Rendement Hugot Simplifié
En début campagne, secteur Ouelle (3), et en milieu
campagne secteurs Mvengue, Ouelle* l'analyse de la variance (tableaux 9, 15 et
17) montre qu'il n'y a pas un effet significatif en ce qui concerne
l'augmentation du délai de maturation sur la richesse (p-value>0,05).
A l'opposé, le secteur Bangouvou (tableau 11) présente un effet
significatif d'une augmentation du délai de maturation sur la richesse,
p-value inférieur au seuil de signification (p-value<0.05).
Ces résultats nous indiquent que la richesse des
parcelles des secteurs Ouelle (3), Mvengue et Ouelle* récoltées
au délai théorique de (35 jours) est proche de l'optimum.
Cependant la richesse des parcelles du secteur Bangouvou récolté
au délai théorique de (35 jours) est significativement
différente de l'optimum.
Ainsi nous pouvons affirmer dans les deux cas que l'entreprise
perd du sucre, puisqu'elle récolte des parcelles qui ne sont pas
à leur optimum de richesse.
En termes d'explications pouvant justifier l'effet
significatif du délai de maturation sur la richesse, nous avons le
rôle des conditions climatiques de la période d'étude (Juin
à Août) qui semblent des plus favorables.
En effet, la saison sèche aidant, la température
moyenne au cours de cette période est propice à une bonne
maturation 25,9°C en moyenne, l'ensoleillement augmente de 55,9 à
100,1 heures, avec un niveau de précipitation qui baisse de 22,3
à 6,5 mm. Dans ces conditions, une augmentation du suivi de la
maturation ne pourrait que donner des valeurs
plus raisonnables du comportement de la courbe de richesse.
Cette hypothèse semble confirmer les conclusions de (BIANG NZIE et
al, 1993, DUSKY et al, 1999, LEGENDRE, 1975 puis 1988 et
ROSTRON, 1986) sur l'effet positif des facteurs climatiques sur la maturation
de la canne.
Par ailleurs, selon l'étude menée par BESSEGUE
(2011) cité par (ANONYME, 2011), il semblerait que la
variété Co997 présente une meilleure richesse
lorsqu'on augmente le délai de maturation, ce qui explique entre autre
l'effet significatif enregistré dans les parcelles du secteur Bangouvou
qui abritent cette variété.
IV.2. Délais de maturation et optimum de
richesse
Globalement, selon la figure 4, la richesse dans le secteur
Ouelle en début campagne augmente de 0 à 47 jours. Dans les
secteurs Bangouvou et Mvengue, elle augmente de 0 à 42 jours.
Au-delà de 47 jours, dans Ouelle (3), et 42 jours dans les secteurs
Bangouvou et Mvengue, la richesse baisse, ce qui fixe l'optimum de richesse
à ces valeurs (47 jours pour Ouelle (3), 42 jours pour Mvengue et
Bangouvou).
Pour ce qui est de l'optimum de richesse dans le secteur
Ouelle* en milieu campagne (Figure 7), il se situerait au-delà de 39
jours.
Au vu de ces résultats qui semblent confirmer ceux
obtenus lors du test sur les délais maturateurs entrepris en 2011
(ANONYME, 2011 ; BESSEGUE, 2011), nous pouvons affirmer que l'optimum de
richesse dans les conditions climatiques de SUCAF Gabon est atteint à 42
et 47 jour pour les variétés Co997 et
NCo376.
En considérant le Fusilade® comme
maturateur, les délais actuels de SUCAF Gabon (35 jours) sont faibles
comparativement à la Guyane 42 jours (EASTWOOD et al, 1977) et
le Cameroun (OBIANG, 2012) qui présentent des délais similaires
à ceux obtenus par notre étude.
Par ailleurs, lorsqu'on compare, les durées du suivi
maturation proposées à l'issu de notre étude, (42 et 47
jour), ce délai, demeure très faible puis qu'il ne
représente que la moitié du délai considéré
en Afrique du sud 35 à 70 jours (SASA, 1998), 70 à 84 jours
(ROSTRON, 1985 et 1989) ou en Australie 84 jours (MORGAN,
2003).

IV.3. Gain de richesse
D'après le tableau 19, en début campagne dans
les secteurs Ouelle et Bangouvou, nous avons obtenu des gains de richesses
respectifs de 0,47 et 0,76 point. En milieu de campagne, dans le secteur
Mvengue nous avons enregistré un gain de 0,4 points alors qu'à
Ouelle*, nous avons noté une perte de richesse de 0,62 points en raison
d'une récolte trop précoce dans ce secteur.
Dans l'ensemble, les résultats en termes de gain de
richesse semblent similaires à ceux obtenus par BESSEGUE (2011).

Conclusion
L'application de maturateurs comme méthode
d'amélioration de la richesse de la canne à sucre tient une place
prépondérante dans l'industrie de la canne à sucre. Au
cours de notre étude portant sur la cinétique de la richesse de
la canne à sucre en fonction du délai de maturation, nous avons
envisagé une augmentation du délai de maturation de 12 parcelles
tests, soit 6 par variété et par période de campagne, afin
de relever l'incidence de cette observation sur la courbe de richesse des
variétés Co997 et NCo376.
L'objectif de cette étude était d'estimer
l'intervalle de temps pour lequel l'optimum richesse des variétés
Co997 et NCo376 est atteint et dans le
même temps actualiser le programme de maturation de l'entreprise de
façon à récolter des parcelles au maximum de leur
richesse.
Les résultats obtenus au terme de l'étude
confirment de façon globale que les délais de maturation
actuellement appliqués (35 jours) pour les variétés
Co997 et NCo376 sont faibles. En effet, pour
chacune de ces variétés, l'optimum de richesse est atteint autour
de 42 jours après épandage de maturateur.
En considérant les deux périodes de campagne
(début et milieu), les résultats suivants ont été
obtenus:
Dans le secteur Ouelle (variété
NCo376) en début campagne, l'ANOVA montre qu'il n'y a pas un
effet significatif d'une augmentation du délai de maturation sur la
richesse avec une p-value=0,067. Toutefois, nous constatons un gain de richesse
de 0,47 points et l'optimum est fixé autour de 47 jours.
Dans le secteur Bangouvou (Variété
Co997) en début campagne, l'ANOVA montre qu'il y a un effet
significatif d'une augmentation du délai de maturation sur la richesse
au seuil de probabilité 5% à p-value=0,008. De plus, on note un
gain de richesse de 0,76 point et l'optimum est obtenu à 42 jours
Dans le secteur Mvengue (variété
NCo376) en milieu campagne, l'ANOVA montre qu'il n'y a pas un effet
significatif d'une augmentation du délai de maturation sur la richesse,
au seuil de signification de 5% à p-value = 0,105. Cependant, un gain de
richesse de 0,4 point est obtenu et l'optimum est fixé à 42
jours.

Dans le secteur Ouelle* (variété
Co997) en milieu de campagne, l'ANOVA montre qu'il n'y a pas un
effet significatif d'une augmentation du délai de maturation sur la
richesse avec une p-value=0,643. Par ailleurs, on obtient une baisse de
richesse de 0,4 point, alors que l'optimum de richesse se situe au-delà
de 39 jours.
De ce qui précède, les recommandations suivantes
ont été faites à savoir:
Un rallongement du délai de maturation peut être
intéressant et préconisé, pour les variétés
Co997 et NCo376 qui présentent leurs
optima de richesse autour de 42 jours ;
Tester d'autres maturateurs (Ethrel, Verdict, Polado ...), en
vue de diversifier et trouver le maturateur le mieux adapter à nos
conditions agro écologiques. De même, des associations de
maturateurs peuvent être envisagé afin d'évaluer leur
efficacité et observer l'effet sur la richesse ;
Envisager une étude portant sur les aspects de
persistance, de rémanence, de phyto-toxicité de l'épandage
de ces maturateurs sur le sol, les repousses ;
Tester l'effet de l'épandage de maturateur sur la
croissance des repousses des différentes variétés de canne
;
L'appareillage doit être revisité, bien
étalonner afin d'avoir des chiffres plus raisonnable et proches de la
réalité : Cas du polarimètre qui est un indicateur
essentiel de richesse, permet ainsi d'estimer le gain ou la perte de sucre ;
Poursuivre l'étude avec d'autres variétés
industrielles notamment la B46.364, B66.23, afin d'actualiser également
leur délai de maturation, et déterminer l'intervalle de temps
pour lequel leurs optima de richesse sont atteints ;
Mesurer l'effet que pourrait avoir une maturation
précoce de certaines parcelles, et estimer la quantité de sucre
perdue imputable à cette mauvaise pratique culturale ;
Ajuster la commande de maturateur avec une marge de 10%, afin
d'anticiper sur toute rupture de stock, ce qui pourrait compromettre le
déroulement normal de cette opération culturale comme cela a
été le cas des parcelles tests de la variété
B46.364 initialement prévu dans le cadre de cette
étude en fin campagne ;
En matière de procédure, outre le rendement
Hugot, le contrôle et le suivi de la maturité des parcelles peut
être envisagé en tenant compte des valeurs du Brix comme c'est
le

cas à Saris Congo, ou en contrôlant
l'humidité des graines. Pour ce qui est du Brix, il constitue un
excellent indicateur du degré de maturité, il peut être
directement mesuré au champ avec un appareil facile d'emploi, le
réfractomètre à main.
Le délai de maturation est faible dans la plupart des
pays quand on utilise le Glyphosate comme maturateur. Il est de 28 jours en
Guyane, 21 à 35 jours au Etats-Unis. Il serait intéressant pour
l'entreprise de connaitre la durée pour laquelle on devrait suivre la
maturité des parcelles muris avec le Glyphosate, ainsi, elle optimisera
les récoltes avec des richesses beaucoup plus importantes.
Eventuellement, une étude portant sur une augmentation
des doses de Fusilade® ou Round up® à
appliquer aux parcelles peut être proposée en fonction des
périodes de campagne et comparer l'effet sur le rendement, le
comportement physio-morphologique de la canne

Bibliographie
ANONYME., 2002. Mémento de l'agronome.
Ministère de la coopération et du développement. Nouvelle
édition Jouve, 11, bd de Sébastopol, 75.001 Paris,
République française. 1694 pages.
ANONYME., 2011. Rapport annuel de campagne,
Département culture/Service agronomique. SUCAF Gabon. 113 pages.
ALEXANDER., A.G, 1973. Sugarcane physiology.
Elsevier Scientific Publishing Company, New-York, U. S., 752 p.
ARTAS., 1992. Révisé en (2011).
Mesure du Pol des produits lourds. Laboratoire des sucreries africaines. eRcane
®. pp 12-13.
ARVIER A.C., 1965. The harvest application of
desiccants to sugar cane foliage in «Proceeding of Queensland society of
Sugar cane Technologist».32th conference, Cairns. Australia 28
April - 4 May 1970. pp 123-132.
BARTOLOMEW D.P et SILVA J.A., 2001. Agronomy
in Hawaii. College tropical agriculture and human resources, University of
Hawaii at Manoa.
BENETT P.G et MONTES G., 2003. Effect of
glyphosate formulation on sugarcane ripening. Sugar Journal, Vol. 66,
No.1. p22.
BERKE J.P., 1984. Essais maturateurs :
Résultats et interprétation. SOMEDIAA, Cameroun. 121p.
BESSEGUE C., 2011. Cinétique de la
richesse de la canne à sucre en fonction du délai de maturation.
Mémoire de fin de cycle. USTM/INSAB. 60 p.
BIANG NZIE E. et KAPSEU C., 1993. Influence
du glyphosate et des précipitations sur la maturation de la canne
à sucre. Cahiers agricultures (2) : 111-115.
BLACKBURN F., 1984. Sugarcane. Tropical
Agriculture. Longman Group, Harlow, U. K., 414 p.
BRAUNACK M., AINSLIE H., 2001. Trash blanket
and soil physical properties: Mackay experience, Proceedings of the Australian
Society of Sugar Cane Technologists, 23rd, Mackay, Queensland, 1-4
May 2001, p.154-160.
CAPUTO M.M., 2006. Indução da
maturação por produtos químicos e sua
conseqüência na qualidade tecnológica de diferentes
genótipos de cana-de-açúcar. Dissertation (Master in
Science in Crop Production). Escola Superior de Agricultura «Luiz de
Queiroz», Universidade de São Paulo (Brazil).

CASTRO P., 1999. Maturadores químicos em
cana-de-açúcar, Proceedings of SECAPI 1999 4th Semana da
Cana-de-açúcar de Piracicaba; Piracicaba, São Paulo,
Brazil. pp12-16. CASTRO P.R.C., APPEZATO B., CONCALVES M.B., 1985.
Ação de hidrazida maleica e etefon no crescimento da
cana-de-açúcar. Anais da E. S. A. «Luiz de
Queiroz», Vol. 42, No.2, (April 1985), pp. 391-399.
CHAMPOISEAU P., 2006. Xanthomonas
albineans, l'agent causal de l'échaudure des feuilles de canne
à sucre: Caractérisation et variabilité des bases
génétiques du pouvoir pathogène en Guadeloupe et dans le
monde. Thèse de Doctorat, Université des Antilles et de Guyane.
200 p.
CHEONG L.R., AH KOON P.D., NG KEE KWONG K.F.,
2003. Effets de la pluviométrie et des pratiques culturales sur
le ruissellement et l'érosion dans la canne à sucre à
Maurice, Revue Agricole et Sucrière de l'Ile Maurice, vol 82. p. 72-77.
CHRSTOFFOLETTI P.J., SACOMANO J., SOFFNER R., CATTANEO S.,
1993. Avaliação do uso de Paraquat como dessecante na
cultura da cana-de-açúcar em condições de
précolheita. Revista de Agricultura, Vol. 68, No. 3, pp
271-286.
CLEMENTS H., 1980. Sugarcane crop logging and
crop control.
DALLEY C.D et RICHARD JUNIOR E.P., 2010.
Herbicides as ripeners for sugarcane. Weed Science. Vol.58,
No.3, pp. 329-333.
DEUBER R., 1988. Maturação da
cana-de-açúcar na região sudeste do Brasil, Proceedings of
4th Seminário de Tecnologia COPERSUCAR 1988. Piracicaba, São
Paulo, Brazil. pp33-40. DE OLIVEIRA., YANAI G.M., LEITE N.H., DE SOUZAB
D.B., COLLETA FILHO A., MACHADO H.D., NUNESSA L.R., 2002.
Decomposition and release of nutrients from sugarcane trash in two
agricultural environments in Brazil, Proceedings of the Australian Society of
Sugar Cane Technologists, 24th, Cairns, Queensland, 29 April-2 May
2002. Pp 290-296.
DONALDSON R.A et VAN STADEN J., 1995. Some
effects of the ripener Fusilade Super and drought stress on stalk components
and leaf emergence of sugarcane. Proc. S. Afr. Sugar Technol. Assoc. 69:
41-45.
DONALDSON R.A., 1999. Sugarcane ripening in
South Africa review of last decade. In proceeding of the International Society
of Sugarcane Technologists'. XXIII congress, New Delhi, India, 22-23 February
1999. pp 8-12.
DUPONT G et KALALA T., 2004. Le point sur une
technique culturale : La Régénération. Rapport de mission,
SUCAF Gabon. 66 pages.

DUSKY J.A et ALVAREZ J., 1986. Optimal
harvesting tie after ripener application in sugarcane. September/October 1986.
pp 1-3.
DUSKY J.A., RAINBOLT C.R., GILBERT R.A., 1991.
Sugarcane ripeners in Florida. Florida sugarcane handbook, an
electronic publication of the Agronomy department. p2. EASTWOOD et
DAVIS HB., 1997. Chemical ripening in Guyana-prosgress and prospects
sugarcane. N°3 pp 4-17.
EASTWOOD et DAVIS HB., 1998. Chemical ripening
in Guyane. Part 2. Succeful commercial implementation. International Sugar
Journal. Vol. 100. Issue N°1190E. pp 89-95. F.A.O., 2002.
Fond des Nations Unies pour l'Alimentation et l'Agriculture.
Perspectives de l'alimentation, N°6 juin 2002. p10.
F.A.O., 2010. Fond des Nations Unies pour
l'Alimentation et l'Agriculture. Perspectives d l'alimentation, N°3-juin
2010. p10.
FAUCONNIER R et BASSEREAU., 1970. La canne
à sucre. Techniques agricoles et productions tropicales. Maisonneuve et
Larose, Paris, France, 468 p.
FAUCONNIER R., 1991. La canne à sucre.
Techniques agricoles et productions tropicales Maisonneuve et Larose. Paris.
165p.
FELDMANN P., SAPOTILLE J., GREDOIRE P., ROTT P., 1994.
Micro propagation of sugarcane. In Vitro Culture of Tropical
Plants. C. Teisson, ed. La Librairie du Cirad, Montpellier, France. p15-17.
FELDMANN P., D'HONTE A., GUIDERDONI E., GRIVET L., et
GLASZMANN J.C., 1997. La canne à sucre : L'Amélioration
des Plantes Tropicales. A. Charrier, M. Jacquot, S. Hamon et D. Nicolas, eds.
CIRAD et ORSTOM, Montpellier, France. P. 197-215. FERNANDES AC., 1982.
Refratômetro de campo. Boletim Técnico Coopersucar,
Vol.19, pp.5-12.
GILBERT R.A., BENNET A.C., DUSKY J.A., LENTINI R.S.,
2002. Sugarcane ripeners in Florida. Document SS-AGR-215, Agronomy
department. Institute of Food and Agricultural Science. University of
Florida.
GLOVER J., 1972. Practical and theoretical
assessments of sugarcane yield potential in Natal Proceedings of 46th
South African Sugarcane Technologists Association, pp.138-141.
HUBERT P., 1968. Recueil des fiches techniques d'agriculture
spéciale. Tome 2.
HUGOT E., 1970. La sucrerie de canne,
2ème ed. Paris. Dunod
IBOUILI L.S., 2004. Etude monographie de la
Sucrerie d'Afrique-Gabon (SUCAF Gabon). Franceville. 41p.

INMAN-BAMBER., MUCHOW R.C., ROBERTSON M.J., 2002.
Dry matter partitionning of sugar cane in Australia and South Africa.
Field crop research. Vol 76. pp 7184.
INSEE., 2002. Canne à sucre, état
des lieux. Dossier Economie de la Réunion 12p. JAGLALE V., 2003.
Estimation des résidus de récolte de la canne à
sucre, CIRAD-CA, Pôle Canne à Sucre, ISA Lille, 33 p.
JORF., 1996. Décret du 5 novembre 1996
relatif à l'appellation d'origine contrôlée «
Martinique ». Journ. Off. de la République. Française, 8
nov. 1996, pp. 16360 - 16362. JULIEN M.H.R., IRVINE J.E., BENDA G.T.,
1989. Sugarcane anatomy, morphology and physiology. Diseases of
Sugarcane: Major Diseases. C. Ricaud, B. T. Egan, A. G. Gillaspie et C. G.
Hughes, eds. Elsevier Publishers B. V., Amsterdam, Netherlands. p. 1-20
KEE KWONG N.G., DEVILLE J., 1987. Residual
fertilizer nitrogen as influenced by timing and nitrogen forms in a silty clay
soil under sugarcane in Mauritius, Martinus Nijhoff publisher, The Netherlands,
Fertilizer Research, 14, p. 219-226.
KLOK J.A., KINGSTON G., HURNEY A.P., 2003.
What is the impact of green cane trash blankets in wet and tropical
environments? Proceedings of the Australian Society of Sugar Cane
Technologists, 25th Townsville, Queensland, 6-9 May 2003.
KY., 1997. La betterave, plante miracle ;
Edition la vague verte, Woignarue. p205. LACOSTE E., 2004.
Sucre et pays en développement: Implications des accords
préférentiels et d'une ouverture des marches. Cyclope Paris. 72
p.
LAVANHOLI M.G.D.P., CASAGRONDE A.A., OLIVEIRA L.A.F.,
FERNANDES G.A., 2002. Aplicação de etefon e imazapyr em
cana-de-açúcar em diferentes épocas e sua influência
no florescimento, acidez do coldo e teores de açúcares nos colmos
- variedade SP70-1143. STAB. Açúcar, Álcool e
Subprodutos, Vol.20, No. 5, pp. 42-45,
LEGENDRE B.L., 1975. Ripening of sugarcane:
effects of sunlight, temperature, and rainfall. Crop Sci. 15: 349-352.
LEGENDRE B.L et FINGER C.L., 1988. Response
of sugarcane varieties to the chemical ripener glyphosate. Sugar J. (51):
16-19
LEITE G.H.P et CRUSCIOL C.A.C., 2008.
Reguladores vegetais no desenvolvimento e produtividade da
cana-de-açúcar. Pesquisa Agropecuária Brasileira,
Vol.43, N°8. pp995-1001.
LEITE G.H.P., CRUSCIOL C.A.C., LIMA G.P., SILVA M.A.,
2009. Reguladores vegetais e atividade de invertases em
cana-de-açúcar em meio de safra. Ciência Rural,
Vol.39, No.3. pp 718-725.

LIANG X., STEFFEN A., KELLER J.A., SHEN N.F., 1992.
The 1-aminociclopropane- 1-carboxilate synthase genmne family of
Arabidopsis thaliana. Proceedings of the National Academy of Science of the
United States of America. Vol.89, No.22, pp11046-11050. LINGLE S.E.,
1997. Seasonal internode development and sugar metabolism in
sugarcane. Crop Science, Vol.37, No. 4, pp 1222-1227.
MARGARITA B et VALDEZ R.E., 1976. Effect of
stage of maturity on nutritive value of sugarcane. Pp 115-118.
MILLHOLLON R.W et LEGENDRE B.L., 1996. Sugarcane
yield as affected by annual glyphosate ripener treatments. Proc. Am. Soc. Sugar
Cane Technol. 16: 7-16.
MORGAN T., 2003. Effect of ripeners on early
season sugar production in sugar cane. Thesis, James Cook University. 121 p.
MSIRI (Mauritius Sugar Industry Research Institute).,
2004. Annual Report 2005. MUCHOW R.C., ROBERTSON M.J., WOOD
A.W., KEATING B.A., 1997. Assessing limits to sugar cane yield. In
« proceeding of Australia Society of Sugar cane Technologist's »
CAIRNS. Queensland. 22 April to 2 May 2002. pp 221-228
MVEH M., 2011. Etude comparative des rendements
de la canne à sucre en fonction du mode de coupe. Mémoire de fin
de cycle. USTM/INSAB. 60 p.
NAKAYAMA K., KAMYAI Y., KOBAYASHI M., ABE M., et SAKURAI
A., 1990. Effects of a plant-growth regulator, prohexadione, on the
biosynthesis of gibberellins in cell-free systems derived from immature seeds.
Plant Cell Physiol. 31: 1183-1190.
OBIANG A.J., 2010. « Effet des
résidus de récolte sur les rendements de la canne à sucre
à SUCAF-Gabon» Mémoire de fin de cycle. Université de
Sciences et Techniques de Masuku/INSAB. 79 pages
OBIANG A.J., 2010. Rapport de mission à
SOSUCAM Cameroun (Pegas). SUCAF Gabon, 16 p.
PEME H., 2004. Etude des aspects de la
maturation de la canne à sucre à SUCAF Gabon. Mémoire de
fin de cycle. Institut Polytechnique Rural de Formation et de Recherche
Appliquée de Katibougou/Mali. 48 p.
PROSI., 1997. La recherche sucrière et la
protection de l'environnement : la problématique des produits
agrochimiques. PROSI Magazine, n°340. Environnement. Maurice.
RADEMACHER W., 2000. Growth retardants: Effect of gibberellin
biosynthesis and other metabolic pathways. Annu. Rev. Plant Physiol. Plant Mol.
Biol. 51: 501-531.

ROBERSTON F.A., 2000. Trash
management-consequences for soil carbon and nitrogen, Proceedings of the
Australian Society of Sugar Cane Technologists, 22nd, Bundaberg, Queensland,
2-5 May 2000, pp225-229.
ROHWER J.M et BOTHA F.C., 2001. Analysis of
sucrose accumulation in the sugar cane culm on the basis of in vitro kinetic
data. Biochemical Journal, Vol.358, No. 2, (September 2001),
pp437-445.
ROSE S, et Botha F.C., 2000. Distribution
patterns of neutral invertase and sugar content in sugarcane internodal
tissues. Plant Physiology and Biochemistry, Vol.38, No.11, (November
2000), pp.819-824.
ROSTRON H., 1985. Chemical ripening of
sugarcane with Fusilade super. Proc. South African Sugarcane Technol. (59) 168
- 175.
ROSTRON H., BARNES JP., JENKINS D.A., MARSH C.M.,
PARKE R.I., VAN COLLER., 1986. Recent sugarcane ripening experiment
with Fusilade. Proc Int Soc. Sug. Technol. (19): 252-252.
ROSTRON H., 1996. Chemical ripening in
sugarcane in Swaziland, In «Sugarcane: Research towards effiscient and
sustainable production sugar 2000» Symposium-Towards a sweeter future.
CSIRO Division of tropical crop and pastures, Brisbane, 19 - 23 August 1996. Pp
172175.
ROTT P., 1995. L'échaudure des
feuilles de la canne à sucre. Agriculture et développement (6):
49 - 55.
ROTT P., BOUSQUET J.F., MULLER M., CHATENET M., 1997.
Resistance to leaf scald disease is associated with limited
colonization of sugarcane and wild relatives by Xanthomonas
albilineans. Phytopathology 87: 1202-1213.
ROTT P., BAILLEY R.A., COMSTOCK J.C., CROFT B.J.,
SAUMTALLY A.S., 2000. A guide to sugarcane diseases. CIRAD and ISSCT,
Montpellier, France, 339p.
SKINNER J.C., 1956. The effect of maleic
hydrazide on the sucrose content of sugar cane. Technical communications.
N° 1, 1956. Bureau of sugar experiment. Station of Brisbane. Australia.
SPENCER E.F et MEADE G.P., 1948. In Cane
sugar Handbook. 8th eds., 2nd impression august 1948.
(John Wiley and sons: N.Y). p 20.
SOOPAYA R et NAYAMUTH A.R., 2001. Chemical
ripening to improve cane quality in drought-stricken areas. Sugar cane
international. July 2001. pp 9-14.
SOOPRAMIEN G., 2000. Sugarcane morphology,
anatomy and physiology. p13-20 in: A Guide to Sugarcane Diseases.
Saumtally, eds. CIRAD and ISSCT, Montpellier, France.

S.A.S.A., 1998. Experiment station
Information Street. 12. Ripening; 12.3. Registered chemicals for ripening
sugarcane; Fusilade super. SASA. Private Bag XO2 Mount Edgecombe. 4300. Kwazulu
Natal.
S.S.A.T., 2003. Chemical ripening-why and
how. S.S.A.T (1): n° 24 pp 1 - 4.
SAINT MACARY H., CHABALIER P.F., GENERMONT S., MORVAN
T., PAILLAT J.M., PAYET N., 2002. Gestion de l'azote en culture de
canne à sucre : pratiques actuelles, puits potentiels et risques de
pollution, Rencontres internationales pluridisciplinaires. Perspectives de
développement de la canne en milieu insulaire, Stella Matutina, Ile de
La Réunion, 10p.
SIQUEIRA G.F., 2009. Eficácia da
mistura de glifosato a outros maturadores na cana-de-açúcar
(Saccharum spp.). Dissertation (Master in Science in
Agriculture). Faculdade de Ciências Agronômicas, Universidade
Estadual Paulista, Botucatu.
SU LY., CRUZ A.D., MOORE P.H., MARETZEKI., 1992.
The relationship of glyphosate treatment to sugar metabolism in sugar
cane: New physiological insight. Journal of plant physiology. Vol 4: pp
168-173.
SUZUKI J., 1983. Biossíntese e
acúmulo de sacarose em cana-de-açúcar (Saccharum spp.):
Influência do íon Potássio durante diferentes
estádios de crescimento em solução nutritiva. Thesis (PhD
in Soil and Plant Nutrition). Escola Superior de Agricultura «Luiz de
Queiroz», Universidade de São Paulo, Piracicaba.
TERAUCHI T., MATSUOKA M., KOBAYASHI M., NAKANO H.,
2000. Activity of sucrose phosphate synthase in relation to sucrose
concentration in sugarcane internodes. Japanese Journal of Tropical
Agriculture, Vol.44, N°3, pp.141-151.
TOMLIN C., 1994. The pesticide manual. (10th.
Edition), Blackwell Scientific Publications, Cambridge.
VAN DILLEWINJ C., 1952. Botany of sugarcane.
Waltham: The chronic Botanica. 371p VIANA R.S ., SILVA P.H., MUTTON
M.A., MUTTON M.J.R., GUIMARAES E.R., BENTO M., 2008. Efeito da
aplicação de maturadores químicos na cultura da
cana-de-açúcar (Saccharum spp.) variedade SP81-3250.
Acta Scientiarum Agronomy. Vol.30, No.1, pp. 6571,
VIATOR B.J., VIATOR C., JACKSON W., WAGNES PACK H.,
RICHARD JUNIOR E.P., 2003. Evaluation of potassium-based ripeners as
an alternative to glyphosate and the effects of 2, 4-D on herbicidal cane
ripening. Sugar Journal, Vol.66, No.1, pp. 21.
VILLEGAS F.T., TORRES J.S.A., 1993. Efecto
del Roundup usado como madurante en la producción de caña
d'azúcar. International Sugar Journal, Vol.95, No.1130, pp. 59
- 64.

VLITOS et LAWRIE., 1965. Chemical ripening in
sugar cane. A rewiew of field studies carried out in Trinidad over a five years
period. In proceeding of international Society of Sugar cane Technologist. XII
congress, San Juan (Puerto Rico) 28th March - 10 April 1965. Pp 429
- 445.
VORSTER D.J et BOTHA F.C., 1999. Sugarcane
internodal invertase and tissue maturity. Journal of Plant Physiology, Vol.155,
No.4/5, (April 1999), pp.470 - 476.
WATSON E.C. et DESTEFANO R.P., 1986. The use
of fluazifop-butyl and sethoxydim as sugarcane ripeners. Proc. Am. Soc. Sugar
Cane Technol. 6:56 -58.
YANG S.F., 1969. Ethylene evolution from
2-chloroethylphosphonic acid. Plant Physiol. 44: 1203-1204.
ZABLOTOWICZ R.M et REDDY K.N., 2004. Impact
of glyphosate on the Bradyrzobium japonicum symbiosis with glyphosate-resistant
transgenic soybean: a minirevew. Journal of Environmental Quality, Vol.33,
No.3, (May 2004), pp. 825 - 831.
ZHU Y.J., KOMOR E., MOORE P.H., 1997. Sucrose
accumulation in the sugarcane stem is regulated by the difference between the
activities of soluble acid invertase and sucrose phosphate synthase. Plant
Physiology, Vol.115, No.2, (October 1997), pp.609 - 616.

Lexique
Baba : Expression désignant les jeunes
repousses de canne susceptibles de ne pas arriver à maturité, ou
d'avoir un rendement négligeable ;
Bagasse : Résidus fibreux de canne
obtenus après passage aux moulins et servant de combustibles aux
chaudières;
Biocarburant : Les biocarburants sont des
carburants d'origine biologique, soit des alcools et dérivés
(produit à partir du sucre ou de l'amidon), soit des huiles et
dérivés (produits à partir des oléagineux ) de plus
en plus suggérés comme alternatives aux énergies fossiles
;
Bout blanc : Partie terminale de la tige de
canne, tendre, aqueuse et moins riche en sucre. Bouture :
Morceau d'une plante destiné à être
replanté pour produire une nouvelle plante Identique. Une bouture de
canne à sucre doit avoir entre 2 et 3 yeux.
Brix : Pourcentage apparent de matière
sèche (Saccharose + impuretés) contenus dans 100g de jus ;
Cachalots : Nom donnée aux engins
transportant la canne à sucre du champ à l'usine.
Campagne : Période de récolte et d'usinage de la
canne. Elle dure en moyenne 120 jours.
Canne vierge : Canne nouvellement
plantée et qui n'a pas encore été coupée par
opposition aux repousses ;
Catégorie : Nombre d'année
d'utilisation de la repousse, à l'exception de la catégorie R01
qui correspond à une canne vierge (nouvellement plantée)
Coupe en brûlée : Mode de
récolte des parcelles dont les cannes ont été
préalablement brulées ;
Coupe en vert : Mode de récolte dont
les cannes sont récoltées telles quelles, sans être
brûlées au préalable ;
Ecosystème : Ensemble formé par
la communauté des êtres vivants (biocénose) et son
environnement géologique, pédologique et atmosphérique
(biotope). Les différents éléments de
l'écosystème développent un réseau
d'interdépendance favorisant le maintien de la vie ;

Ecumes : Résidus de la filtration des jus
après décantation ;
Ethologie : Etude du comportement des animaux
dans leur milieu naturel ; Gâteau : Tourteau de fibre
recueilli après extraction du jus par la presse ;
Invertases : Catégorie d'enzymes qui
catalysent l'hydrolyse du saccharose en glucose et fructose ;
L'Ochréa, la ligule, l'auricule :
Constituants de l'articulation, faisant jonction entre la gaine de la
feuille et le noeud de la tige ;
Mélasse : Résidu liquide
après extraction du sucre du jus de la canne. La mélasse est
encore très sucrée, noirâtre et visqueuse. Elle contient
encore une faible quantité de sucre, de la vitamine B6 et des
minéraux (calcium, magnésium, potassium et fer) ;
Noeud : Se dit du point d'insertion d'une
feuille ou d'un rameau sur la tige principale. Phytomère
: Portion de bouture ayant l'aptitude d'être multiplier pouvant
donner de nouvelles tiges après tallage ;
Phytoplasmes : Types de bactéries sans
paroi, dépourvu de forme spécifique (pleimorphes) qui se
multiplient exclusivement dans les tubes criblés du phloème.
Plante C4 : Groupe de végétaux
effectuant avant les réactions du cycle de Calvin une pré
réaction (réaction de Hatch et Slack) qui consiste à la
fixation du CO2 sur un acide organique
à 3 carbones souvent le (Phospho-énol pyruvate)
et le transforment ensuite en acide organique
à 4 carbones généralement (l'oxalo
acétate ou acide malique). A l'opposé des plantes C3 qui
réalisent directement la photosynthèse à partir du cycle
de Calvin. Chez les plantes CAM communes des zones de désert, elles
ferment leurs stomates durant les heures les plus chaudes de la journée.
Ces plantes fixent le CO2 la nuit, l'accumulent sous forme de malate, et le
mobilise le jour où il subit une décarboxylation. C'est le CO2
issu de cette décarboxylation qui va être utilisé lors de
la photosynthèse ;
Point zéro : Expression
désignant la première analyse des échantillons de canne
d'une parcelle dont on veut suivre la maturité ;
Primordia racinaire : La première racine
produite par la plante ; Plot : Anglicisme désignant un
bloc, une parcelle ;

Pol : unité désignant la
quantité de saccharose contenu dans le jus ; Pureté
: Rapport entre la quantité de saccharose (Pol
corrigé) et le Brix ;
Recouvrage : Opération culturale
consistant à replanter les vides après passage de la planteuse
;
Régénération : Ensemble
d'opérations culturales (chaulage, sous-solage, griffage et buttage)
utilisé dans le but de rallonger la durée de vie d'une parcelle
;
R570 : Variété de canne
à sucre originaire de la Réunion, n°570. Cette
variété est récemment passée en industrielle
à SUCAF Gabon ;
Suivi de la maturité :
Opération culturale qui vise à contrôler
hebdomadairement l'évolution de la richesse des parcelles. Elle consiste
à prélever des échantillons représentatifs de canne
dans les parcelles, extraire et analyse le jus recueilli afin de
déterminer les paramètres technologiques de richesse (Brix,
Pureté, RHS) ;
Veille coupe : Expression désignant le
jour précédant la récolte d'une parcelle.

Annexes

I
Annexe la. Caractéristiques
anatomique et morphologiques de la canne à sucre
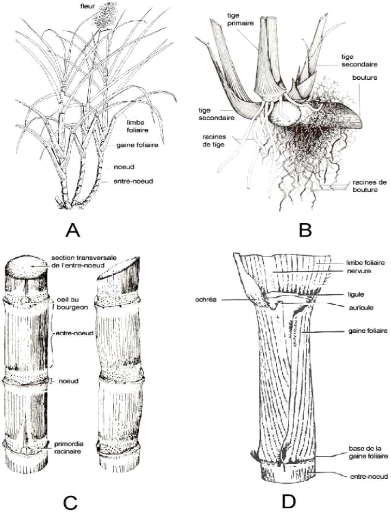
A, aspect général d'une touffe de canne. B,
bouture de canne germée illustrant le
développement des
racines de tige et de bouture. C, portion d'une tige de canne montrant
les
détails d'un noeud et d'un entre-noeud. D, portion d'une feuille de
canne montrant les
différentes parties qui la composent (JULIEN
et al, I989; S..PRAMIEN, 2000).

Annexes
Annexe lb. Caractéristiques anatomique et
morphologiques de la canne à sucre
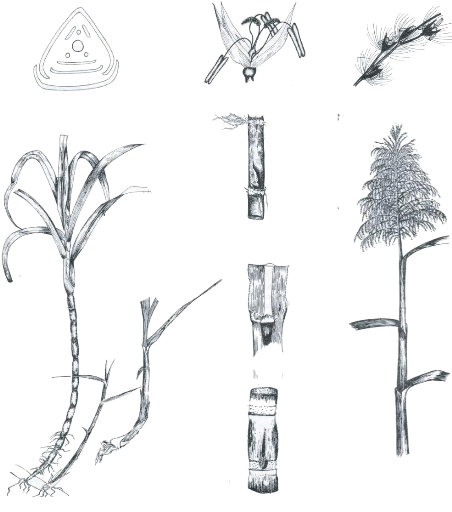
(F)
(E)
(G)
(H)
(C)
(D)
(A)
(B)

11
A.- Tige se développant à partir de
bourgeon végétatif; B.- Portion d'un
entre-noeud
montrant un bourgeon végétatif;
C.- «Semence» végétative et bourgeon
«germe»; D.-
Insertion de la feuille sur la tige, limbe, ligule,
gaine et bourgeon du noeud, E.-
Inflorescence; F.- Portion
de l'inflorescence sétes; G.- Épillet; H.-
Diagramme floral.
(JULIEN et al, I989)

Annexes

III
Annexe 2. Physiologie et
développement de la canne à sucre
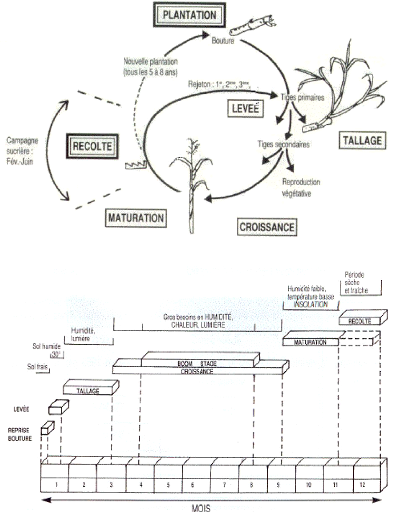
Source : FAUC.NNIER, 199I.

Annexes
Annexe 3 : Principales maladies de
la canne à sucre
MALADIES (et agent causal)
CONSEQUENCES
SYMPTOMES BOTANIQUES
AGRO-TECHNOLOGIQUES
|
CHARB.N
Ustilago scitaminea
|
q Fouet sommital noir, libérant des spores.
q Aspect rabougri et herbacé des tiges infectées :
Tiges longues et fines.
|
q Diminution du nombre de tiges usinables.
q Chute rendement en repousses
|
|
q
R.UILLE
Puccinia melanocephala
q Retard de végétation.
q Baisse de production chez clone sensible.
Apparition de lésions sur les feuilles ayant l'aspect de
petites taches oranges, pouvant occuper toute la surface du limbe.
q
C
H A
M
P
I G
N
O N S
P.KKAH B.ENG
Fusarium moniliforme ou F. subglutinans : formes
conidiennes
q Impact économique peu important, excepté sur
variétés sensibles.
Sur cannes de 6 à 8 mois : apparition de zones
chlorotiques blanches à la base des feuilles.
q Sur cannes plus âgées : distorsion et
déformation des jeunes feuilles.
q
M.RVE R.UGE
Glomerella tucumanensis
q Perte en saccharose.
q Mauvaise germination.
Lésions rouges allongées sur la nervure
centrale.
q Coloration rouge du tissu des entre-noeuds de tige
observée en coupe longitudinale.
q
RING SP.T
Différents champignons, dont Leptosphaeria
sacchari
Lésions abondantes formant des tâches vert
foncé ou marron, ovales, avec une étroite bordure jaune sur le
limbe des feuilles âgées.
q q Pas d'importance économique.
Bordure devenant irrégulière avec l'accroissement
des lésions, formant de larges plages rougeâtres.
q
ECHAUDURE DES FEUILLES
Xanthomonas albilineans
q Diminution des tiges usinables.
q Risque de perte du champ.
Fines lignes sur feuilles et blanchiment du feuillage (sur jeunes
cannes de moins de 6 mois).
q
B A
C
T E
R I E
S
Départ de demoiselles et dessèchement du
feuillage (cannes proches de la maturité).
q
MALADIE DU
RAB.UGRISSEMENT
DES REP.USSES
ou
RAT..N STUNTING DISEASE (RSD)
Clavibacter xyli
q Diminution du rendement agricole, pouvant s'aggraver au fil
des repousses.
q Richesse en sucre non affectée.
Rabougrissement des tiges en taille et en diamètre.
q Amplification par stress hydrique etIou nutritionnel, ainsi
que par un nombre croissant de repousses.
q Symptômes absents lorsque les conditions de culture
sont satisfaisantes.
V I
R U
S
YELL.W LEAF
SYNDR.ME (YLS)
Sugarcaneyellow Leaf Virus :
scYLV
Sugarcane
Yellow
Phytoplasme : scYP
q Jaunissement de la nervure centrale des jeunes feuilles, qui
peut s'étendre à l'ensemble du limbe.
q Nécrose de l'extrémité vers la base.
q Diminution possible du sucre extractible sur
variété très sensible.
STRIES
CHL.R.TIQUES
Agent suspecté : virus
q Stries jaunes sur feuilles, se nécrosant à un
stade avancé.
q Risque de mortalité de souches.

IV
Source : MB.LIDI-BAR.N et al, 200I ;
D'après : MARTIN et al, I96I ; HUGHES et al, I964 ;
R.TT et al, 2000

Annexes
Annexe 4. Principaux ravageurs de la
canne à sucre
Gravité CONSEQUENCES
RAVAGEURS DEGATS CAUSES
AGRO-TECHNOLOGIQUES
|
++
|
B.RERS
(CHENILLES F.REUSES)
Diatraea saccharalis :
le plus répandu en
Martinique
Diatraea centrella
ou Eodiatraea centrella
|
q Mort de la cime par destruction du bourgeon terminal, pouvant
conduire à la mort de la tige pour les très jeunes cannes.
q Présence de galeries à l'intérieur des
tiges, repérables par les trous d'évacuations des débris
vers l'extérieur.
q Perforations et galeries : porte d'entrée à
différents germes.
|
q Perte de tonnage.
q Perte en saccharose.
|
|
CHENILLES
PHYLL.PHAGES
+ Laphygma frugiperda
CIRPHIS L.REYU Mocis puncturalis
|
q Jeunes feuilles de canne rongées, sauf la nervure
centrale
|
q Dégâts souvent très localisés.
q Pas d'importance économique particulière
|
|
FULG.RIDE
(INSECTE PIQUEUR SUCCEUR)
+ Saccharosydne saccharivora

Conduisant à la
FUMAGINE
q q Perte de tonnage possible, en cas de recouvrement total des
jeunes cannes par la fumagine.
q Généralement, régression fumagine au fil
de la croissance, sans incidence sur tonnage.
Production de miellat par les nymphes et les adultes du
fulgoride.
q Sur ce miellat, développement de champignon
(Capnodiium spp.), sous forme d'épaisses croûtes ayant
l'aspect de moisissure noire sur les feuilles
= la fumagine.
q Couleur rouge jaunâtre à la surface des
feuilles.

V
Source : Guide variétal CTCS
(MBOLIDI-BARON et al, 2001) . D'après : ROSEMAIN ., 1982 ;
FRETAY, 1986 ; ETIENNE,
1996 .

Annexes

VI
Annexe 5. Table de correction du
Pol
Facteur permettant le calcul du Pol % à partir de la
lecture saccharimétrique et du Brix.
(Polarimètre de poids
normal=26g)
Pour obtenir le Pol gramme% gramme, multiplier la lecture du
saccharimètre obtenue
après clarification à
l'acétate de plomb par le facteur correspondant au Brix
corrigé
(ramener à la même température que celle
de la lecture du Pol)
|
Brix
|
Facteur
|
Brix
|
Facteur
|
Brix
|
Facteur
|
Brix
|
Facteur
|
|
0,1
|
0.26063
|
4,0
|
0.25671
|
8,0
|
0.25270
|
12,0
|
0.24871
|
|
0,2
|
0.26053
|
0,1
|
0.25661
|
0,1
|
0.25260
|
0,1
|
0.24861
|
|
0,3
|
0.26043
|
0,2
|
0.25651
|
0,2
|
0.25250
|
0,2
|
0.24851
|
|
0,4
|
0.26033
|
0,3
|
0.25641
|
0,3
|
0.25240
|
0,3
|
0.24841
|
|
0,5
|
0.26023
|
0,4
|
0.25631
|
0,4
|
0.25230
|
0,4
|
0.24831
|
|
0,6
|
0.26013
|
0,5
|
0.25621
|
0,5
|
0.25220
|
0,5
|
0.24821
|
|
0,7
|
0.26003
|
0,6
|
0.25612
|
0,6
|
0.25210
|
0,6
|
0.24811
|
|
0,8
|
0.25993
|
0,7
|
0.25601
|
0,7
|
0.25200
|
0,7
|
0.24801
|
|
0,9
|
0.25982
|
0,8
|
0.25591
|
0,8
|
0.25190
|
0,8
|
0.24791
|
|
1,0
|
0.25972
|
0,9
|
0.25581
|
0,9
|
0.25180
|
0,9
|
0.24781
|
|
0,1
|
0.25962
|
5,0
|
0.25571
|
9,0
|
0.25170
|
13,0
|
0.24771
|
|
0,2
|
0.25952
|
0,1
|
0.25561
|
0,1
|
0.25160
|
0,1
|
0.24761
|
|
0,3
|
0.25942
|
0,2
|
0.25551
|
0,2
|
0.25150
|
0,2
|
0.24751
|
|
0,4
|
0.25932
|
0,3
|
0.25541
|
0,3
|
0.25140
|
0,3
|
0.24741
|
|
0,5
|
0.25922
|
0,4
|
0.25531
|
0,4
|
0.25130
|
0,4
|
0.24731
|
|
0,6
|
0.25912
|
0,5
|
0.25521
|
0,5
|
0.25120
|
0,5
|
0.24721
|
|
0,7
|
0.25902
|
0,6
|
0.25510
|
0,6
|
0.25110
|
0,6
|
0.24711
|
|
0,8
|
0.25892
|
0,7
|
0.25500
|
0,7
|
0.25100
|
0,7
|
0.24701
|
|
0,9
|
0.25882
|
0,8
|
0.25490
|
0,8
|
0.25090
|
0,8
|
0.24691
|
|
2,0
|
0.25872
|
0,9
|
0.25480
|
0,9
|
0.25080
|
0,9
|
0.24681
|
|
0,1
|
0.25862
|
6,0
|
0.25470
|
10,0
|
0.25070
|
14,0
|
0.24671
|
|
0,2
|
0.25852
|
0,1
|
0.25460
|
0,1
|
0.25060
|
0,1
|
0.24661
|
|
0,3
|
0.25842
|
0,2
|
0.25450
|
0,2
|
0.25050
|
0,2
|
0.24652
|
|
0,4
|
0.25832
|
0,3
|
0.25440
|
0,3
|
0.25040
|
0,3
|
0.24642
|
|
0,5
|
0.25822
|
0,4
|
0.25430
|
0,4
|
0.25030
|
0,4
|
0.24632
|
|
0,6
|
0.25812
|
0,5
|
0.25420
|
0,5
|
0.25020
|
0,5
|
0.24622
|
|
0,7
|
0.25802
|
0,6
|
0.25410
|
0,6
|
0.25010
|
0,6
|
0.24612
|
|
0,8
|
0.25792
|
0,7
|
0.25400
|
0,7
|
0.25000
|
0,7
|
0.24602
|
|
0,9
|
0.25781
|
0,8
|
0.25390
|
0,8
|
0.24990
|
0,8
|
0.24592
|
|
3,0
|
0.25771
|
0,9
|
0.25380
|
0,9
|
0.24980
|
0,9
|
0.24582
|
|
0,1
|
0.25761
|
7,0
|
0.25370
|
11,0
|
0.24970
|
15,0
|
0.24572
|
|
0,2
|
0.25751
|
0,1
|
0.25360
|
0,1
|
0.24960
|
0,1
|
0.24562
|
|
0,3
|
0.25741
|
0,2
|
0.25350
|
0,2
|
0.24950
|
0,2
|
0.24552
|
|
0,4
|
0.25731
|
0,3
|
0.25340
|
0,3
|
0.24940
|
0,3
|
0.24542
|
|
0,5
|
0.25721
|
0,4
|
0.25330
|
0,4
|
0.24930
|
0,4
|
0.24532
|
|
0,6
|
0.25711
|
0,5
|
0.25320
|
0,5
|
0.24920
|
0,5
|
0.24522
|
|
0,7
|
0.25701
|
0,6
|
0.25310
|
0,6
|
0.24910
|
0,6
|
0.24512
|


VII
|
|
|
|
|
|
|
Annexes
|
|
0,8
|
0.25691
|
0,7
|
0.25300
|
0,7
|
0.24901
|
0,7
|
0.24502
|
|
0,9
|
0.25681
|
0,8
|
0.25290
|
0,8
|
0.24891
|
0,8
|
0.24493
|
|
16,0
|
0.24473
|
0,9
|
0.25280
|
0,9
|
0.24881
|
0,9
|
0.24483
|
|
0,1
|
0.24463
|
20,0
|
0.24076
|
24,0
|
0.23682
|
28,0
|
0.23288
|
|
0,2
|
0.24453
|
0,1
|
0.24066
|
0,1
|
0.23672
|
0,1
|
0.23279
|
|
0,3
|
0.24443
|
0,2
|
0.24056
|
0,2
|
0.23662
|
0,2
|
0.23269
|
|
0,4
|
0.24433
|
0,3
|
0.24046
|
0,3
|
0.23652
|
0,3
|
0.23259
|
|
0,5
|
0.24423
|
0,4
|
0.24036
|
0,4
|
0.23642
|
0,4
|
0.23249
|
|
0,6
|
0.24413
|
0,5
|
0.24026
|
0,5
|
0.23632
|
0,5
|
0.23239
|
|
0,7
|
0.24403
|
0,6
|
0.24017
|
0,6
|
0.23622
|
0,6
|
0.23230
|
|
0,8
|
0.24393
|
0,7
|
0.24007
|
0,7
|
0.23613
|
0,7
|
0.23220
|
|
0,9
|
0.24383
|
0,8
|
0.23997
|
0,8
|
0.23603
|
0,8
|
0.23210
|
|
17,0
|
0.24373
|
0,9
|
0.23987
|
0,9
|
0.23593
|
0,9
|
0.23200
|
|
0,1
|
0.24363
|
21,0
|
0.23977
|
25,0
|
0.23583
|
29,0
|
0.23190
|
|
0,2
|
0.24353
|
0,1
|
0.23967
|
0,1
|
0.23573
|
0,1
|
0.23181
|
|
0,3
|
0.24343
|
0,2
|
0.23957
|
0,2
|
0.23563
|
0,2
|
0.23171
|
|
0,4
|
0.24333
|
0,3
|
0.23947
|
0,3
|
0.2 3553
|
0,3
|
0.23161
|
|
0,5
|
0.24324
|
0,4
|
0.23938
|
0,4
|
0.23544
|
0,4
|
0.23151
|
|
0,6
|
0.24314
|
0,5
|
0.23928
|
0,5
|
0.23534
|
0,5
|
0.23141
|
|
0,7
|
0.24304
|
0,6
|
0.23918
|
0,6
|
0.23524
|
0,6
|
0.23132
|
|
0,8
|
0.24294
|
0,7
|
0.23908
|
0,7
|
0.23514
|
0,7
|
0.23122
|
|
0,9
|
0.24284
|
0,8
|
0.23898
|
0,8
|
0.23504
|
0,8
|
0.23112
|
|
18,0
|
0.24274
|
0,9
|
0.23888
|
0,9
|
0.23495
|
0,9
|
0.23102
|
|
0,1
|
0.24264
|
22,0
|
0.23878
|
26,0
|
0.23485
|
30,0
|
0.23093
|
|
0,2
|
0.24254
|
0,1
|
0.23868
|
0,1
|
0.23475
|
|
|
|
0,3
|
0.24244
|
0,2
|
0.23859
|
0,2
|
0.23465
|
|
|
|
0,4
|
0.24234
|
0,3
|
0.23849
|
0,3
|
0.23455
|
|
|
|
0,5
|
0.24224
|
0,4
|
0.23839
|
0,4
|
0.23445
|
|
|
|
0,6
|
0.24215
|
0,5
|
0.23829
|
0,5
|
0.23436
|
|
|
|
0,7
|
0.24205
|
0,6
|
0.23819
|
0,6
|
0.23426
|
|
|
|
0,8
|
0.24195
|
0,7
|
0.23809
|
0,7
|
0.23416
|
|
|
|
0,9
|
0.24185
|
0,8
|
0.23799
|
0,8
|
0.23406
|
|
|
|
19,0
|
0.24175
|
0,9
|
0.23789
|
0,9
|
0.23396
|
|
|
|
0,1
|
0.24165
|
23,0
|
0.23780
|
27,0
|
0.23387
|
|
|
|
0,2
|
0.24155
|
0,1
|
0.23770
|
0,1
|
0.23377
|
|
|
|
0,3
|
0.24145
|
0,2
|
0.23760
|
0,2
|
0.23367
|
|
|
|
0,4
|
0.24135
|
0,3
|
0.23750
|
0,3
|
0.23357
|
|
|
|
0,5
|
0.24125
|
0,4
|
0.23740
|
0,4
|
0.23347
|
|
|
|
0,6
|
0.24116
|
0,5
|
0.23730
|
0,5
|
0.23337
|
|
|
|
0,7
|
0.24106
|
0,6
|
0.23720
|
0,6
|
0.23327
|
|
|
|
0,8
|
0.24096
|
0,7
|
0.23711
|
0,7
|
0.23317
|
|
|
|
0,9
|
0.24086
|
0,8
|
0.23701
|
0,8
|
0.23307
|
|
|
|
|
0,9
|
0.23691
|
0,9
|
0.23298
|
|
|
Source : Livret ARTAS., (1992).
Révisé en 2011. Mesure du Pol des produits lourds. Laboratoire
des sucreries
africaines. eRcane ®. Pp 12-13


Rendement en canne (TCIha)= TC récoltéISuperficie
totale de la parcelle
Tonnage en sucre (T.S)= Tonnage en canne x
RHSI100
Rendement en sucre (TS Iha)= Tonnage SucreISuperficie totale de la
parcelle
VIII
Annexes
Annexe 6. Formulaire
1. Facteur de correction du Pol (Artas.,
I992)
4.

26
Facteur =
100 x N (Masse volumique à
20°C)
Avec N, calculer suivant l'équation de :
N,=
0,9972+3,8472.10-3.B+1,43.10-5B2-3,59.10-8.B3+2,76
.10-9.B4-4,12.10-II.B5+2,12.10-I 3B6
1. Brix.
dant
Brix =~laBrix (Lu) xdo6
3 . Pol
4. Pureté (P)
Pureté = 1IBrix x [I00 x Pol (corrigé)]
Pol (corrigé) = Pol (Lu au polarimètre) x Facteur
de correction donné par la table de correction du Pol
Rendement Hugo Simplifié (RHS)
5.

RHS = [(Pureté -30)1 x BrixI100
Ecart Brix (Base--Sommet)
6.

Ecart Brix (B -- S) = Brix (Base) -- Brix (sommet)
Ecart RHS (Base--Sommet)
7.

Ecart RHS (B -- S) = RHS (Base) -- RHS (Sommet)
Tonnage canne (TCIha), Tonnage Sucre (TS), Rendement
sucre (TSIha)

Ix
Annexes
Annexe 7. Programme de maturation
des parcelles
Début Campagne
|
Variétés
|
Parcelle
|
N°
|
Aire maturée
(ha)
|
Type de
Maturateur
|
Dose
(LIha)
|
Cat
|
Date de
maturation
|
|
NC0376
|
.U
|
3A
|
5,76
|
Fusilade®
|
0,3
|
R09
|
06I06II2
|
|
.U
|
3B
|
5,75
|
Fusilade®
|
0,3
|
RI0
|
06I06II2
|
|
.U
|
3C
|
3,03
|
Fusilade®
|
0,3
|
R09
|
06I06II2
|
|
C0997
|
BGV
|
3
|
5,50
|
Fusilade®
|
0,3
|
R05
|
08I06II2
|
|
BGV
|
4I6A
|
6,46
|
Fusilade®
|
0,3
|
R04
|
08I06II2
|
|
BGV
|
4I6B
|
7,28
|
Fusilade®
|
0,3
|
R04
|
08I06II2
|
|
|
|
Milieu Campagne
|
|
|
|
|
Variétés
|
Parcelle
|
N°
|
Aire maturée
(ha)
|
Type de
Maturateur
|
Dose
(LIha)
|
Cat
|
Date de
maturation
|
|
NC0376
|
VG
|
1
|
4,5
|
Fusilade®
|
0,3
|
R04
|
III06II2
|
|
VG
|
2
|
4,63
|
Fusilade®
|
0,3
|
R02
|
III06II2
|
|
VG
|
3
|
5,54
|
Fusilade®
|
0,3
|
R04
|
III06II2
|
|
C0997
|
.U
|
1
|
6,30
|
Fusilade®
|
0,3
|
R0I
|
02I07II2
|
|
.U
|
2A
|
4,33
|
Fusilade®
|
0,3
|
R03
|
02I07II2
|
|
.U
|
2B
|
6,I9
|
Fusilade®
|
0,3
|
R03
|
02I07II2
|
Source : Département cultureIService
agronomique 20I2


X
Annexes
Dispersionn de la moyenne de richesse entre l'optimum
(42)jours et le témoin
(35) jours, secteur OU 3 (ABC)
RHS PT
12,8
12,6
12,4
12,2
11,8
11,6
11,4
11,2
13
12
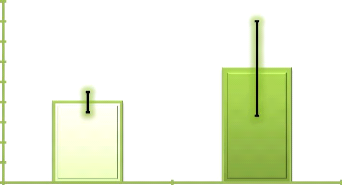
12,0
12,4
Temoin Optimum
Traitements
Annexe 8a. Dispersion de moyenne de richesse entre
l'optimum et le témoin secteur .U
Annexe 8b. Dispersion de
moyenne de richesse entre l'optimum et le témoin secteur BGV
Dispersion de la moyenne de richesse entre l'optimum
(42) jours et le témoin (35)
jours, secteur Bangouvou
Temoin Optimum
Traitements
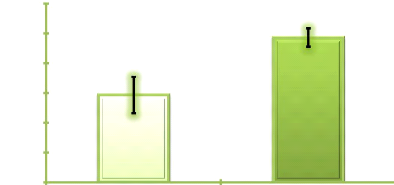
RHS PT
13,5
12,5
11,5
14
13
12
11
12,4
13,4


XI
Annexes
Dispersion de la moyenne de richesse entre l'optimum
(42) jours et le témoin
(35) jours, secteur VG
Temoin Optimum
Traitements
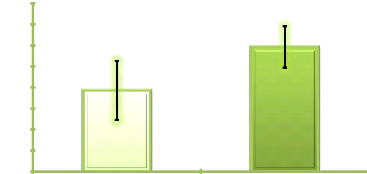
RHS PT
13,5
12,5
11,5
10,5
14
13
12
11
10
11,9
12,9
Annexe 8c. Dispersion de moyenne de richesse entre
l'optimum et le témoin secteur VG
Annexe 8d. Dispersion de
moyenne de riche sse entre l'optimum et le témoin
secteur .U*
Dispersion de la moyenne de richesse
entre l'optimum (39) jours et le temoin (35) jours
Secteur OU* en milieu
campagne
RHS PT
12,95
12,85
12,75
12,65
12,9
12,8
12,7
12,6

12,8
12,7
Temoin Optimum
Traitements




