|

DEDICACES
Ce travail est dédié à :
A mon père BAHOUHOULA MOYO Maurice qui nous a
quittés très tôt et qui ne cessait de nous parler de
l'école, sa mémoire est restée à jamais
gravée dans nos coeurs.
A ma mère NGOMBO MBODO Monique, pour toutes les
souffrances qu'elle a endurée depuis ma naissance, tu m'as
encouragé à persévérer dans les études,
trouve ici toute ma profonde reconnaissance.
Mes oncles KADI Hervé et BAHOUHOULA MOYO Thomas pour
vos multiples sacrifices, je vous serai reconnaissant.
Mon fils MBODO Hesbon Guéyazi, que ce travail demeure
une source d'inspiration, de motivation permanente au cours de ta vie et
suscite en toi le goût de l'effort.
Mes frères et soeurs, je resterai reconnaissant durant
toute ma vie pour votre soutien multiforme pendant toute ma carrière
scolaire et universitaire. Ce travail est le fruit de votre sacrifice.
Mon grand père KADI Norbert et ma grand-mère
TOULOUKOULOU Cécile. Ce travail réalisé dans des
conditions sociales difficiles ne pouvait pas aboutir sans votre soutien moral
et spirituel.
Mes regrettés membres frères et soeurs et
membres de la famille qu'ils trouvent ici à titre posthume, le
témoignage de ma reconnaissance.
Monsieur MAHOUNGOU Yves Bernard pour son soutien multiforme,
je ne vous oublierai jamais.
Mes frères LOUBOTA Misère, KONDI Théonas
et les autres qui m'ont toujours encouragés dans des bonnes
initiatives.
Tous ceux dont j'ai oublié et qui m'ont apporté
aide et assistance, qu'ils reconnaissent à partir de ce travail ma
profonde gratitude. Je ne saurai oublier MAHOUNGOU Alain Jiresse qui a
assuré la saisie informatique de ce document.
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
|
|
REMERCIEMENTS
Au terme de ce travail qui marque la fin de notre cycle
d'Ingénieur à l'Ecole Nationale Supérieure d'Agronomie et
de Foresterie (ENSAF), nous remercions tous ceux qui ont permis de mener
à bien ce travail de recherche. Notamment à :
Monsieur MBETE Pierre, Directeur du bureau de stages à
(ENSAF) pour m'avoir établi la demande de mise en stage au Parc National
de Conkouati Douli (PNCD). Qu'il trouve là l'expression de ma profonde
reconnaissance
Mes vifs remerciements à Messieurs DENGUI Jean Claude
et NIAMATELE Basile respectivement conservateur en chef et adjoint du Parc
National de Conkouati Douli (PNCD), pour m'avoir reçu et autorisé
à effectuer mon stage de fin de formation en vue de l'obtention du
Diplôme Ingénieur des Travaux de Développement Rural
(DITDR), option : Technique Forestières au sain de leur
structure(Parc).
Ma reconnaissance va également à toute
l'équipe administrative de l'ENSAF, notamment au Professeur Parisse,
Directeur et au Professeur BOUKOULOU Henri, secrétaire académique
de l'ENSAF.
Aux différents départements, notamment au
Professeur MOUTSAMBOTE Jean-Marie, chef de département des Techniques
Forestières pour ses sages conseils durant notre parcourt à
l'ENSAF.
A Monsieur le Président et aux membres du jury, recevez
mes remerciements anticipés.
Au chef de volet recherche, ses assistants et les travailleurs
du volet notamment aux chefs des sites sur la plage, ainsi qu'aux permanents et
journaliers du Parc.
A tous mes collègues de promotion en particulier
MOUKINI Christian, MOUKANI Renna, ZADOUAKA Natalie, MATOUMONA Destin, MALONDA
Sabin, BOUANGUI Albert, BOUEYA Brunel et BALOUMBOU Grace. Qu'ils trouvent ici
l'expression de ma grande reconnaissance pour tous les moments de dur labeur
que nous avions passés ensemble à l'ENSAF.
A tous mes amis KOUNGA Wesinsley, NZAOU Clavert, KONDI
Wilmard, MOUANDA Blosco, Médih Brice, KIABELO Blaise, BAKALA Boris,
BAMBA Kelly Waf, PEPE Elyon Nikaise. Qu'ils trouvent ici la
considération et le respect que j'ai pour eux.
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
II
|
SIGLES ET ACRONYMES
C.c : Caretta caretta
C.m : Chelonia mydas
D.c : Dermochelys Coriacea
CITES : Convention sur le Commerce
International des Espèces Sauvages de
Faunes et de Flore Menacées d'extinction/Convention On
International Trade in
Endengered Species.
ECOFAC : Ecosystème Forestier
d'Afrique Centrale
ENSAF : Ecole Nationale Supérieure
d'Agronomie et de Foresterie
E.i : Eretmochelys Imbricata
L.o : Lepidochelys olivacea
LAB : Lutte Anti-Braconnage
MDDEFE : Ministère du
Développement Durable de l'Economie Forestière et de
l'Environnement.
ONG : Organisation Non Gouvernementale.
PNCD : Parc National de Conkouati Douli.
PNNN: Parc National de Nouabale Ndoki.
PROGECAP : Projet de Gestion et de
Conservation des Aires Protégées.
PROTOMAC : Protection des Tortues Marines
d'Afrique Centrale.
UICN : Union Internationale pour la
Conservation de la Nature.
WCS : Wildlife Conservation Society.
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
III
|
LISTE DES FIGURES ET TABLEAUX
Figure 1 : Présentation du milieu
d'étude 4
Figure 2 : Tortue luth sur la plage de Kondi
12
Figure 3 : Tortue verte sur la plage de Vandji
13
Figure 4 : Tortue imbriquée Niandji
14
Figure 5 : Tortue olivâtre sur la plage de
Niandji 15
Figure 6 : Prédation du petit par les
machoirons 18
Figure 7 : Abattage d'une femelle 19
Figure 8 : Localisation des sites de ponte des tortues
marines 22
Figure 9 : Nombre de tortues par site durant la
période d'étude 26
Figure 10 : Répartition des pêcheurs
selon les classes d'âges 26
Figure 11 : Répartition des pêcheurs
selon le niveau d'instruction 27
Figure 12 : Répartition des pêcheurs
selon la situation matrimoniale 27
Figure 13 : Répartition des captures selon les
espèces 28
Figure 14 : Répartition des captures
accidentelles des tortues par site 29
Figure 15 : Nombre de tortues olivâtres par moi
et par site 30
Figure 16 : Nombre de Tortues luths par mois et par
site 30
Tableau 1 : Période d'incubation des
espèces 17
Tableau 2 : Nombre d'individus matures et immatures
par espèces 29
Tableau 3 : Longueur de la courbe carapace
31
Tableau 4 : Largeur courbe carapace 31
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
IV
|
DEDICACES i
REMERCIEMENTS ii
SIGLES ET ACRONYMES iii
LISTES DE FIGURES ET TABLEAUX iv
ITRODUCTION 1
1. Contexte général 1
2. Objectifs de l'étude 1
3. Importance de l'étude 2
CHAPITRE I : PRESENTATION DU MILIEU D'ETUDE 3
1.1. Historique 3
1.2. Milieu physique 3
1.2.1. Situation géographique 3
1.2.2. Climat 4
1.2.3. Relief 5
1.2.4. Géologie 5
1.2.5. Sols 5
1.2.6. Hydrographie 5
1.3. Milieu biologique 6
1.3.1. Flore 6
1.3.1.1. Végétation littorale 6
1.3.1.2. Forêts denses 6
1.3.1.3. Mangroves 7
1.3.1.4. Savanes 7
1.3.2. Faune 7
1.3.2.1. Mammifères 7
1.3.2.2. Reptiles 7
1.3.2.3. Poissons 8
1.4. Milieu humain 8
1.4.1. Démographie et ethnie 8
1.4.2. Activités génératrices de revenus
8
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
V
|
CHAPITRE II : BIOLOGIE ET ECOLOGIE DES TORTUES, LE PROTOCOLE
DE NIDIFICATION, LES MENACES
ET MESURES DE PROTECTION 9
2.1. Biologie et écologie des tortues 9
2.1.1. Systématique 9
2.1.2. Caractères généraux des tortues
marines 10
2.1.2.1. Caractères morphologiques 10
2.1.2.2. Les organes 10
2.1.2.3. Les sens 10
2.1.2.4. Le dimorphisme sexuel 10
2.1.3. Particularités des tortues marines 11
2.1.4. Caractéristiques des tortues marines 11
2.1.4.1. Tortue luth 11
2.1.4.2. Tortue verte 12
2.1.4.3. Tortue imbriquée 13
2.1.4.4. Tortue olivâtre 14
2.2. Protocole de nidification 15
2.2.1. Acensions sur la plage 15
2.2.2. Balayage de l'aire de ponte 16
2.2.3. Creusement du nid 16
2.2.4. Ponte des oeufs 16
2.2.5. Comblement du nid 16
2.2.6. Brouillage de l'aire de ponte 16
2.2.7. Retour à la mer 16
2.3. Menaces 17
2.3.1. Menaces naturelles 17
2.3.2. Menaces liées aux activités humaines
19
2.3.2.1. Menaces directes 19
2.3.2.3. Menaces indirectes 20
2.4. Mesure de protection 20
2.5. Peines relatives au braconnage 21
CHAPITRE III : MATERIELS ET METHODE DE COLLECTE DE DONNEES
22
3.1. Localisation des sites de pontes 22
3.2. Matériels 22
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
VI
|
3.2.1. Matériel de terrain 22
3.2.2. Matériel biologique 23
3.2.3. Matériel technique 23
3.3. Méthode de collecte des données 23
3.3.1. Entretien avec les acteurs impliqués dans la
gestion du Parc 23
3.3.2. Entretien avec les pêcheurs 24
3.3.3. Observation et identification des tortues 24
3.4. Patrouilles 24
3.5. Identification 24
3.6. Marquage 25
3.7. Traitement des données 25
CHAPITRE IV : PRESENTATION DES RESULTATS 26
4.1. Nombre de tortues au cours de la saison de ponte 26
4.2. Population des acteurs de pêche 26
4.2.1. Répartition des pêcheurs selon les classes
d'âge 26
4.2.2. Répartition des pêcheurs selon le niveau
d'instruction 27
4.2.3. Répartition des pêcheurs selon la
situation matrimoniale 27
4.3. Capture accidentelle des tortues par espèce 28
4.4. Capture accidentelle des tortues par site 28
4.5. Captures des individus matures et immatures par
espèce 29
4.6. Détermination de la saison et le pic de ponte par
espèce 29
4.6.1. Période de ponte de la tortue olivâtre
30
4.6.2. Période de ponte de la Tortue luth 30
4.7. Mensuration des tortues 31
CHAPITRE V : DISCUSSION 32
5.1. Nombre des tortues par site 32
5.1.1. Site de Niandji 32
5.1.2. Site de Vandji 32
5.1.3. Site de Paris 32
5.1.4. Site de Kondi 32
5.1.5. Site de Bondi 33
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
VII
|
|
5.1.6. Site de Longo-Bondi
|
33
|
|
5.2. Saison et le pic de ponte
|
33
|
|
5.3. Population des acteurs de pêche
|
33
|
|
5.4. Capture des tortues marines
|
34
|
|
CONCLUSION
|
35
|
|
ANNEXES
|
37
|
|
Annexe 1 : Calendrier du déroulement du stage
|
37
|
|
Annexe 2 : Quelques espèces de faune rencontrées
dans le Parc
|
38
|
|
Annexe 3 : Photos des menaces
|
....39
|
|
BIBLIOGRAPHIE
|
40
|
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
VIII
|
INTRODUCTION
1. Contexte général
L'environnement de toute l'humanité est victime de
menaces de toute sorte y compris l'Afrique Centrale. Sa protection est
l'affaire de tous et il est nécessaire de commencer à
l'éducation des plus jeunes et à sensibiliser la population
riveraine. Puisqu'il s'agit de l'environnement marin, le choix de notre travail
porte sur : «l'Etude des Populations des Tortues Marines sur le
littoral du Parc National de Conkouati Douli», animaux marins
particulièrement faciles à approcher et à observer, en
grand danger de disparition. Il existe sept espèces des tortues marines
au monde, rassemblées en deux grandes familles. Le Parc National de
Conkouati Douli (PNCD) est géré en partenariat entre le
Ministère de l'Economie Forestière qui exerce la tutelle
légale et Wildlife Conservation Society (WCS) qui finance les
activités dans le Parc par un protocole d'accord signé le
30/01/2008. L'analyse de la problématique liée à
la conservation des tortues du littoral de Conkouati, retient plusieurs menaces
qui peuvent être énumérées ainsi qu'elles suivent ;
le braconnage des oeufs sur les plages et des femelles en mer, la destruction
des habitats marins et de ponte, la prédation, la pollution des eaux par
les déchets ménagers et chimiques, la mortalité induite
par les captures accidentelles liées à l'activité de la
pêche.
Avant, les tortues marines étaient
considérées comme des «sirènes», des
génies de la mer porteurs d'esprit maléfiques, qu'il ne fallait
pas déranger. Bien que certaines personnes consomment ponctuellement de
la chaire de la tortue marine, celle-ci était formellement interdite
chez les femmes enceintes (Dembe, 2011).
2. Objectifs de l'étude
Cette étude avait deux objectifs les objectifs globaux
et les spécifiques. Pour les objectifs globaux, ils consistent à
:
· Contribuer à la pérennité de ces
espèces sur le littoral de Conkouati tout en vulgarisant les notions de
Conservation et/ou de Développement auprès de la population de la
zone de Conkouati ;
· Développer un programme de sensibilisation en
impliquant les populations locales à la gestion concertée et
durable des tortues marines ;
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
1
|
|
· Marquer les tortues marines afin d'estimer le rythme
de ponte pendant une même saison ou d'une saison à l'autre, en
fonction des espèces rencontrées.
Les objectifs spécifiques, visent l'acquisition des
données de base sur la ponte de ces espèces marines
(espèces présentes, nombre de nids, lieu de ponte, taux de
prédation des oeufs, chronologie de la ponte) et de proposer des mesures
de conservation en intégrant la participation des populations
riveraines.
3. Importance de l'étude
Sur l'importance de cette étude, elle ressortira les
réalités des menaces des tortues dans les différents sites
de ponte du littoral. Elle vise à contribuer à la mise en place
d'un programme de suivi de ces espèces. Le suivi à court, moyen
et long terme des activités de l'étude des tortues marines et
l'analyse de son incidence sur les populations locales pourront permettre de
trouver les mesures qui garantiraient une exploitation durable de la ressource
faunique marine dans le Parc. Ce travail fournira les connaissances
nécessaires qui pourront enrichir la littérature sur les
caractéristiques spécifiques de chaque espèce, les menaces
et mesures de protection. Cette étude est aussi utile pour
l'administration en charge de la faune et des aires protégées,
car elle permettra à cette dernière d'avoir des informations sur
le mode d'accès des populations du Parc à la ressource faunique,
le degré de l'application de la loi et de redéfinir le cas
échéant une politique permettant de concilier l'exploitation de
la faune et sa conservation dans le Parc à travers le renforcement et
l'organisation des brigades de la lutte anti-braconnage (LAB).
Au delà de l'introduction, ce présent travail
est reparti en cinq chapitres : La présentation du milieu d'étude
; la biologie et écologie des tortues, protocole de nidification, les
menaces et mesures de protection ; les matériels et les méthodes
de collecte des données ; la présentation des résultats et
la discussion puis une conclusion.
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
2
|
CHAPITRE I : PRESENTATION DU MILIEU D'ETUDE
Le Parc de Conkouati est localisé dans le
département du Kouilou, à cheval sur les districts de Nzambi et
de Madingo-Kayes à 180 km de la ville de Pointe- Noire. Le Parc comprend
une partie continentale et une partie marine.
1.1. Historique
En mai 1980, il est créée une réserve de
faune dénommée Réserve de Faune de Conkouati par
arrêté 4432/MEF/DEFRN/BC 17-01 du 25 Mai 1980, sur une superficie
de 300000ha. De 1994 à 1999, sa gestion est assurée par l'UICN
(Union Internationale pour la Conservation de la Nature) en partenariat avec le
PROGECAP-Congo (Projet de Gestion et de Conservation des Aires
Protégées), financée jusqu'à juin 1999 par la
Banque Mondiale. Le 14 du mois d'août 1999 par décret
présidentiel n°99-136 bis, cette réserve passe du statut de
Réserve à celui du Parc. Il est dénommé Parc
National de Conkouati Douli et couvre une superficie de 504.950ha.
1.2. Milieu physique
Le Parc est sous la double influence de deux parties la partie
continentale (composée d'une végétation de forêts et
de savanes) et la partie marine (constituée des lacs et lagunes, des
cours d'eau et un littoral bordé de mangrove). Le littoral dont la
monotonie est brisée par quelques échancrures des estuaires et
des lagunes, part de la rive gauche de l'embouchure du fleuve Noumbi
jusqu'à la lagune de Mikoundji sur la rive gauche.
1.2.1. Situation géographique
Plus de 25% de la superficie du Parc est située dans la
partie marine soit une superficie de 126237,5ha. Il est limité:
Au nord-ouest du village Cotovindou, suivant la
frontière entre le Congo et le Gabon jusqu'au point d'intersection avec
la route nationale n°5 Ndindi-Gabon-Nzambi.
A l'ouest par le point d'intersection avec la route nationale
n°5 Ndindi-Gabon-Nzambi.
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
3
|
Au sud de la limite de douze mille marins suivant une ligne
droite orientée vers l'est traversant les permis pétroliers
marins IV, marin XII et marin IIA.
A l'est du carrefour de Tchizalamou par la route
Tchizalamou-Youbi plus à l'ouest entre les deux villages (figure 1).
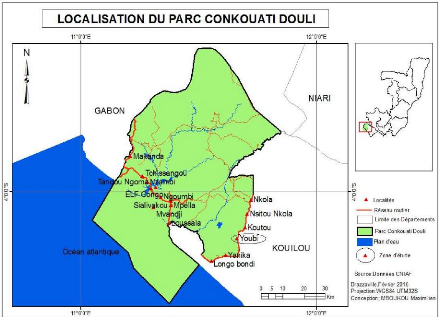
Figure 1 : Présentation du milieu
d'étude (Source : CINIAF, Février 2015) 1.2.2.
Climat
Conkouati a un climat équatorial de transition
présentant une pluviométrie variant entre 1200 et 1700mm d'eau
par an. La saison des pluies s'étend du mois d'octobre au mois de mai
avec un maximum de pluies en novembre et mars. Elle est entrecoupée par
une petite saison sèche entre décembre et février. La
saison sèche par contre s'installe de juin à août, les
températures moyennes annuelles varient entre 24 et 26°C.
L'amplitude thermique étant de 4 à 5°C, les
températures sont plus basses entre juillet et août
c'est-à-dire pendant la saison sèche (Poundza et Samba-Kimbata,
1990).
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
4
|
1.2.3. Relief
Le relief de Conkouati n'est pas homogène sur son
ensemble, il présente deux grands ensembles. Le bassin
sédimentaire côtier est caractérisé par un mince
cordon littoral suivi d'une zone des plateaux et des collines. La transition
entre le littoral et les plateaux est formée d'un important talus
dépassant en moyenne 50m d'altitude, au centre de cette transition se
trouve une vaste dépression qui s'étend jusqu'à la lagune
Mbanio au Gabon. La chaîne montagneuse du Mayombe s'étend de
l'Angola au Gabon et présente un relief de type appalachien. La zone de
Conkouati présente un relief assez modéré avec des
altitudes de 300 à 600m, les points culminants de cette zone sont les
Monts Koubala, Mavende et Moguindou, (Hecketsweiler et Ikonga 1991).
1.2.4. Géologie
D'après les sources de (Vicat et Gioan 1989), la
géologie présente deux grands ensembles distincts. Le bassin
sédimentaire côtier formé de terrains
crétacés (secondaires) masqués par des formations
superficielles d'âge allant de la fin du tertiaire au début
quaternaire. Tandis que la chaîne du Mayombe est constituée de
terrains métamorphiques mêlés d'intrusions de roches
éruptives.
1.2.5. Sols
Du point de vue pédologique, le territoire du Kouilou
est varié. La plaine côtière et les massifs forestiers
littoraux sont caractérisés par : des sols podzoliques qui sont
pauvres en minerais avec une forte acidité, le PH varie entre 3,9 et 4,5
et ne présentent aucun intérêt sur le plan agronomique ; et
des sols hydromorphes à texture sableuse, qui sont les lacs et lagunes
(Nzila, 1999).
1.2.6. Hydrographie
Le réseau hydrographique de Conkouati est très
développé et la plupart des cours d'eau naissent dans la partie
est du Parc, avec plusieurs systèmes lacustres (le lac Tchibinda, lac
Tchivoka). Deux grandes rivières sont rencontrées la Ngongo et la
Noumbi. La Ngongo et ses affluents (la Mouissa, la Niambi et la Louvandzi)
alimentent la lagune de Conkouati. Cette la plus grande du Congo couvre 2400ha
de
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
5
|
superficie et se jette dans l'océan. La Noumbi avec ses
affluents comme (Loubanguila et la Loukongui) se jette également dans
l'océan (Doumenge 1992).
1.3. Milieu biotique
La végétation aquatique des lacs et lagunes est
composé de Vossia cuspidata et de Crinum natans. On
note également plusieurs lagunes dont celle de Conkouati où vit
une population des Lamantin d'Afrique (Trichechus senegalensis) et
enfin un important réseau de lacs, rivières et
marécages.
1.3.1. Flore
On estime que dans le sud du Congo, la flore compte 2500
à 3000 phanérogames, avec 1800 espèces fréquentes.
L'herbier national du Congo comptait en 1948, 4397 espèces taxons, le
nombre potentiel étant estimé à au moins 600. Les
inventaires floristiques ont inventoriés 1207 espèces reparties
en 12 familles, 40 Ptéridophytes reparties en 16 familles. Le couvert
végétal de la zone d'étude est constitué de la
végétation littorale, les forêts denses, les mangroves et
les savanes (Moutsamboté, 1997).
1.3.1.1. Végétation littorale
Le front de plages est constitué des groupements
herbacés plus ou moins rampants essentiellement composés des
Aternanthera maritima, Canevalia rosea, ceux-ci sont suivis
des fourrés littoraux bas constitués de groupements à
Dalbergia escataphyllum et Manilkara lacera.
1.3.1.2. Forêts denses
L'existence d'une forêt dense exige trois facteurs la
lumière, l'humidité et la température. La forêt sub
tropicale existe sous forme de galeries et d'îlots de forêts et
ensuite en vastes étendues vers le nord. Sur les plateaux, ces
forêts montrent des affinités nettement littorales alors que les
collines sont en transition vers les forêts du Mayombe. La forêt du
Mayombe, a des dominances différentes selon la constitution
géologique, sa position sur les versants de la montagne. Ces versants
sont peuplés par les légumineuses notamment les Maranthaceae,
Zingiberaceae à dominance des Cesalpiniaceae. Dans les
vallées par contre on trouve des forêts à Mitragyna
stipulosa et Symphonia globulifera (Moutsamboté,
1997).
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
6
|
1.3.1.3. Mangroves
La mangrove est une formation végétale littorale
peuplée essentiellement des palétuviers qui envahissent les
dépôts vaseux des estuaires. Elles se développent autour
des lagunes de Conkouati et des autres petites lagunes et sur le cours
inférieur de la rivière Noumbi. Cette mangrove est à
dominance de Rhisophora racemosa (Palétuvier). Dans ce rideau
de palétuvier prospèrent des animaux qui se reproduisent sans
être inquiétés par l'homme sinon il y aura d'autres
prédateurs.
1.3.1.4. Savanes
Les savanes de la partie sud-ouest sont dominées par
Ctenium newtonii, Elyonurus brazzae et Pobeguinea arrecta.
Les bas fonds sont composés des espèces dominantes comme
Pteridium aquilinum. Tandis que celles de Cotovindou dans le nord-est
sont constituées des mêmes espèces par contre on note ici
la présence du Panicum phragmitoide et Hypparrhenia
diplandra.
1.3.2. Faune
Plus que la flore, la faune du Congo est actuellement fort
méconnue. Cependant, les études réalisées au sud de
la réserve (Parc) par (Mambou, 1991; Diakana, 1991;
Mamonékéné, 1991) et (Villier, 1980 ; Descarpentries,
1980) ont contribué à l'amélioration des connaissances sur
la faune du Congo.
1.3.2.1. Mammifères
Le Parc regroupe en son sein les mammifères terrestres
et arboricoles et les mammifères marins. Parmi les mammifères
terrestres et arboricole rencontrées, neuf espèces
menacées dans le monde, six espèces dans l'annexe I de la CITES,
dix huit dans l'annexe II, ont été recensées. La
présence des espèces rares et ou protégées a
été signalée. Pour les mammifères marins, on note
la présence du grand dauphin et de la baleine à bosse, en plus de
celle probable d'autres baleinoptères qui font d'ailleurs l'objet d'une
étude dans le Parc.
1.3.2.2. Reptiles
Il y a 41 espèces de reptiles inventoriés dans
la réserve (Parc). Parmi ces reptiles, on compte cinq espèces de
Tortues marines. Il faut cependant souligner que toutes les
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
7
|
espèces de Tortues rencontrées sur le littoral
de Conkouati sont menacées d'extinction, même à
l'échelle mondiale. Toutes ces espèces sont inscrites en annexe I
et II de la CTES.
1.3.2.3. Poissons
Les différentes espèces de poissons
rencontrée à Conkouati, sont recensées dans deux
écosystèmes à savoir l'écosystème
laguno-lacustre et l'écosystème marin. Dans
l'écosystème laguno-lacustre, plus de 50 espèces de
poissons sont connues de la population riveraine. En mer on n'a pas un nombre
exact des espèces de poissons présentes, selon Fontana (1981).
1.4. Milieu humain
1.4.1. Démographie et ethnie
Le département du Kouilou, situé au sud-est du
pays avec une superficie de 13690 km2 et 783 332 habitants
(recensement 2001) soit une densité de 57 habitants/km2,
couvre la façade maritime du Congo. Le département est
dominé par deux principales ethnies ; les Vili à l'ouest et les
Yombé à l'Est et une minorité des Loumbous. D'après
les traductions orales de Nguinguiri (1995), les Vili et les Yombé comme
les autres groupes Kongo, seraient originaires de «Kongo Dia Totila»
ancien Royaume Kongo, situé dans l'actuel Angola.
1.4.2. Activités génératrices de
revenus
La pêche reste la principale activité dans la
zone et plus de 95% de la population vivent de cette activité. Les
hommes pratiquent la pêche et les femmes commercialisent les produits de
pêche, le plus souvent fumés ou encore transformés en
poissons salés. Ces produits sont vendus à Pointe-Noire. En mer
comme dans la lagune de Conkouati et de Mikoundji, la pêche est
pratiquée par pirogue à l'aide des filets maillants. La
pêche est saisonnière, en mer et dans les eaux douces la
pêche est plus rentable en saison de pluies tandis que dans la lagune et
les lacs, elle est rentable en saison sèche. Les dégâts
causés par la chasse sur la faune ne sont pas significatifs. On estime
que par année, une famille peut gagner en moyenne environ 800000 FCFA
avec la pêche (UICN, 1995).
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
8
|
CHAPITRE II : BIOLOGIE ET ECOLOGIE DES TORTUES, LE
PROTOCOLE DE NIDIFICATION, LES MENACES ET MESURES DE PROTECTION.
3.1. Biologie et écologie des tortues
2.1.1. Systématique
Les chéloniens sont regroupés en grandes deux
familles, la famille de Cheloniidae et celle de Dermochelyidae. La famille des
Cheloniidae regroupe toutes les tortues à écailles. Tandis que
celle des Dermochelyidae est composée d'une seule espèce, la
Tortue luth. C'est à partir du sous ordre des cryptodires que sont
apparues les tortues marines actuelles. Sept espèces de tortues peuplent
les eaux marines du monde, la Tortue verte (Chelonia mydas), la Tortue
olivâtre (Lepidochelys olivacea), la Tortue caouanne
(Caretta caretta), la Tortue à dos plat (Natator
depressue), la Tortue de kemp (Lepidochelys kempii) et la Tortue
imbriquée (Eretmochelys imbricata) et la Tortue luth
(Dermochelys coriacea).
D'après (Leschi et al. 2007), le groupe des
Chéloniens appartient au :
Règne : Animal
Embranchement : Chorodatas
Sous-embranchement : Vertébrés
Classe : Reptiles
Sous-classe : Anapsides
Ordre : Testudines (Chéloniens)
Sous-ordre : Pleurodires et cryptodires.
A l'exception de la Tortue à dos plat dont l'aire de
répartition se limite dans l'océan (Atlantique, Indien,
Pacifique) et la Tortue de kemp dont l'aire de répartition serait
limitée au Nord de l'Afrique, toutes les autres espèces sont
susceptibles d'être rencontrées sur le littoral congolais.
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
9
|
2.1.2. Caractères généraux des
tortues marines
2.1.2.1. Caractères morphologiques
Les tortues ont de différentes caractéristiques
morphologiques particulières, comme par exemple une peau sèche et
écailleuse. La profonde modification de leur système osseux a
abouti à la réalisation d'une boîte osseuse appelée
carapace (Billes, 2004). Chez les tortues marines, à l'exception de la
Tortue luth, la boîte osseuse de la carapace est recouverte de plaques
écailleuses. La carapace est constituée d'une partie
supérieure la dossière, reliée par une partie
inférieure le plastron, par l'intermédiaire d'un pont osseux
joignant les deux parties de chaque côté du corps de l'animal. La
carapace protège l'animal contre les agressions extérieures.
2.1.2.2. Les organes
A l'exception du Trionyx, les tortues sont dépourvues
de dents. Elles n'ont pas d'oreilles externes mais des oreilles moyennes et
internes qui ne leurs permettent pas de discerner les sons à des
fréquences basses. Le coeur aplati, est composé de deux
oreillettes et d'un ventricule. Les poumons sont de grande taille et solidement
attachés à la dossière et elles ont une paire de rein. Le
cloaque est le seul orifice excréteur chez les tortues servant à
la fois à l'élimination des déchets et à la
reproduction. Chez la femelle, il sert à la réception des oeufs
au moment de la ponte et chez le mâle, il est le pénis,
extériorisé lors de l'accouplement pour transférer les
spermes directement dans les voies génitales femelles.
2.1.2.3. Les sens
Les tortues marines discernent bien les couleurs (orange
à rouge) dans l'eau, plutôt hors de l'eau elles voient mal les
objets éloignés. Leur odorat est faible. L'oreille de la Tortues
verte, ne perçoit entre 60 et 1000 Hz. Chez la Tortue luth la gamme
d'audition est plus courte et ne va que de 300 à 500 Hz (Bonin,
2006).
2.1.2.4. Le dimorphisme sexuel
Le dimorphisme est l'un des moyens qui permettent de
distinguer les mâles des femelles. Les espèces mâles sont
plus grandes que les espèces femelles chez les espèces de grande
taille, par contre chez les espèces de petite taille les mâles
sont plus petits que les femelles. Chez les Tortues à écailles,
mâle est plus petit que la
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
10
|
femelle tandis que chez la Tortue luth le mâle et la
femelle ont presque la même taille. La queue est plus longue chez le
mâle que chez la femelle, ce qui permet de les différencier. Le
mâle a un plastron légèrement creux et la femelle a un
plastron plat. Chez les Cheloniidae, les mâles ont des griffes qui les
permettent de se tenir sur la dossière de a femelle.
2.1.3. Particularités des tortues marines
La boîte osseuse formant la carapace et le pont osseux
se résume à des simples espaces de tissu fibreux entre le
plastron et la dossière. Les doigts des membres antérieurs sont
solidaires les uns des autres donnant ainsi aux membres l'aspect d'une lame
flexible appelée rame. Les membres postérieurs ont une
transformation moins marquée, mais rigidifiés en une seule
palette servant à la fois à la propulsion, à la
stabilité et au guidage (Billes, 2004). La tête est peu mobile, le
cou est absent et la tête est semblable au nez d'avion.
2.1.4. Caractéristiques des tortues marines
Le monde marin est peuplé par sept espèces de
tortues. Cependant, seules cinq d'entre elles fréquentent les
côtes congolaises. Les Tortues luths et Tortues olivâtres sont les
espèces les plus représentatives au Congo. Elles viennent dans
ces eaux pour se reproduire et s'alimenter. Les tortues vertes
fréquentent essentiellement les côtes congolaises que pour
s'alimenter. Quelques spécimens ont été observés
pendant leur ponte. Les Tortues imbriquées viennent également se
nourrir le long du littoral mais les pontes sont extrêmement rares. Quant
à la tortue caouanne, elle est rarement rencontrée pendant les
patrouilles sur la plage.
2. 1.4.1. Tortue luth (Dermochelys coriacea)
Elle occupe tous les Océans du monde (océan
Atlantique, Indien, Pacifique) et les mers (la mer Rouge,
Méditerranée) (Bonin, 2006). La Tortue luth se reconnue
facilement par sa grande taille, ces griffes et l'absence d'écailles sur
sa dossière. La dossière est recouverte d'une peau noir
bleutée teintée de taches blanchâtres, lisse lui donnant
l'aspect du cuir et par la présence de cinq carènes
longitudinales sur la dossière terminée par un long éperon
pointu. La tête est particulière par la présence d'une
tache frontale rose. C'est une espèce à croissance rapide. C'est
la seule espèce de la famille des Dermochelyidae. Son
régime alimentaire est composé
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
11
|
d'invertébrés pélagiques, de
préférence les méduses et accidentellement les
crustacés, les jeunes poissons, les mollusques et les algues. L'adulte
pèse 950kg pour une longueur carapace de 180cm, la maturité
sexuelle est estimée entre 13 et 14ans, elle peut pondre en moyenne 120
oeufs ayant un diamètre de 7mm, (figure 2).

Figure 2 : Tortue luth sur la plage de Kondi
(Source : MBODO BAHOUHOULA Igore, 2014)
2.1.4.2. Tortue verte (Chelonia mydas)
Elle est largement répandue dans les mers et
Océans du monde et dans les eaux dont la température
dépasse 20°C. Elle a une dossière presque ronde souvent
bombée en avant et plate vers l'arrière. Sa dossière est
de couleur de brunâtre à grisâtre et son plastron est de
couleur brun jaunâtre. Chaque patte a une griffe. Elle a une petite
tête et un museau arrondi (Billes, 2004). La Tortue verte est la plus
grande de toutes les tortues à écailles, avec 80 à 130cm
de longueur carapace pour un poids de 140 à 160 kg, les plus grands
individus peuvent atteindre jusqu'à 230kg. C'est la seule herbivore de
toutes les tortues marines. Sa croissance est très retardée, elle
croît en moyenne 0,4 à 9cm/an et la maturité reproductive
est atteinte entre 30 et 50ans. La capacité de ponte est de 120 à
150 oeufs ayant 5cm de diamètre, (figure 3).
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
12
|

Figure 3 : Tortue verte sur la plage de
Vandji (Source : MBODO BAHOUHOULA Igore, 2014)
2.1.4.3. Tortue imbriquée (Eretmochelys
imbricata)
Son aire de répartition est vaste, elle se rencontre
dans la plupart des régions tropicales, subtropicales et même
tempérées et dans tous les océans. Sa carapace est assez
allongée et présente une dossière brune orange et le
plastron est blanc jaunâtre. On la reconnaît par les plaques
imbriquées des écailles de la dossière, chacune de ces
écailles se superposent comme les tuiles d'un toit (Bonin et al, 2006).
La petite tête longue est munie d'un museau dont la partie
supérieure est terminée par un bec en forme de crochet. On note
la présence de deux paires de griffes portées sur ses pattes,
recouvertes de grosses écailles de couleur brun rougeâtre. Elle
est omnivore et sa croissance est de 20cm/an pour les individus immatures et la
maturité sexuelle est atteinte autour de 3 à 4 ans. Elle mesure
90 cm de la longueur de carapace pour un poids de 80kg (figure 4).
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
13
|

Figure 4 : Tortue imbriquée sur la
plage de Niandji (Source : MBODO BAHHOUHOULA Igore, 2014)
2.1.4.4. Tortue olivâtre (Lepidochelys
olivacea)
La Tortue olivâtre se rencontre dans tous les
Océans. La dossière est olivâtre à brunâtre.
Le plastron et le dessus des membres sont jaunes clair. La tête est
petite, gris jaunâtre, munie d'un bec non denticulé. Elle a deux
griffes à chaque patte. Elle pèse 35 à 50kg, pour une
longueur carapace de 65 à 70cm. Son régime alimentaire est
opportuniste (Fretey, 2001), à tendance carnivore (crustacés,
mollusques, poissons) et même des végétaux. Elle pond en
moyenne 110 oeufs par couvée qui mesure environ 4cm de diamètre.
Pas de preuve de l'âge de maturité sexuelle, sauf chez la Tortue
de kemp où l'âge de maturité sexuelle est estimé
entre 7 et 9 ans (figure 5).
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
14
|

Figure 5 : Tortue olivâtre sur la plage
de Niandji (Source: MBOUMBA Richard, 2014) 2.2. Protocole de
nidification
Après l'accouplement, la femelle choisit le lieu
où elle creusera son nid de ponte. La forme du nid dépend de
l'espèce. Chez les Cheloniidae, il est de forme cylindrique
avec une profondeur moyenne de 30 à 40cm et un diamètre de 10
à 20cm. Par contre chez les Dermochelyidae, le nid a la forme
d'empreinte (pied) d'éléphant. Il est composé de trois
principales parties ; la cuvette, le puits de ponte et la chambre d'incubation.
La nidification ne peut être rendue possible que grâce à un
protocole, il est réalisé en suivant la chronologie des
étapes suivantes : l'ascension sur la plage, le balayage de l'aire de
ponte, le creusement du nid, la ponte des oeufs, le comblement du nid, le
brouillage de l'aire de ponte et le retour à la mer.
2.2.1. Ascension sur la plage
La femelle arrive sur la plage et cherche l'endroit pour
implanter son nid. Cet endroit doit être sur une zone sableuse où
il n'y aura pas de nuisance. Au moment où elle commence son ascension,
elle est très sensible aux dérangements et aux objets
gênant sa progression.
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
15
|
2.2.2. Balayage de l'aire de ponte
Celui-ci intervient après que la femelle ait
trouvée la place d'implanter son nid. Elle enlève tout ce qui
peut l'entraver au balayage de son aire de ponte, à cette phase elle se
sert surtout de ses rames.
2.2.3. Creusement du nid
A ce sujet, elle se sert de ses pattes postérieures.
Chaque membre assure un mouvement du sable et un membre écarté
sert d'appui, tandis que l'autre est crispé sur le sable afin
d'éviter son accumulation pour tomber à nouveau dans le trou.
2.2.4. Ponte des oeufs
Observer la ponte des tortues marines ou assister à
l'éclosion de leurs oeufs est un spectacle aussi rare qu'inoubliable.
Entre septembre et avril, les différentes espèces de tortues
marines se succèdent sur les plages de Conkouati. Elles viennent de nuit
creuser un nid et mettre leurs oeufs à l'abri. Au cours d'une ronde
nocturne avec des équipes de suivi, on peut observer la ponte, marquer
et mesurer les tortues venant pondre. Par la suite on peut aussi faire le
transfert des oeufs vers un nid creusé par l'homme bien à l'abri
des prédateurs et autres dangers (crabes, chiens).
2.2.5. Comblement du nid
Le comblement du nid de ponte se fait à l'aide de
palettes, en réalisant un mouvement alterné. La femelle racle le
sable accumulé autour d'elle pour couvrir ses oeufs et ensuite tasser le
sable en se servant de ses palettes et de son plastron. Elle peut se servir
aussi de son poids.
2.2.6. Brouillage de l'aire de ponte
Il est caractéristique de plusieurs tours sur le nid
afin de le dissimuler celui-ci du regard des prédateurs et des
braconniers. Seules les équipes de patrouilles habilitées aux
suivis peuvent déceler l'endroit où se trouve le nid.
2.2.7. Retour à la mer
Après avoir brouillé l'aire de ponte elle doit
retourner dans la mer pour attendre la prochaine saison de ponte.
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
16
|
Après le retour à la mer, les oeufs vont suivre
leur évolution et il va s'ensuivre l'incubation, l'éclosion et
l'émergence.
· L'incubation ; c'est le processus du
développement de l'embryon dans l'oeuf. Chez les chéloniens, la
période d'incubation varie en fonction de l'espèce et de la
température ambiante du nid ; plus elle est élevée plus le
développement sera rapide. La durée d'incubation et la
température en fonction de l'espèce sont résumées
dans le tableau ci-après.
Espèces
|
Durée d'incubation (jours)
|
Température (°C)
|
Tortue Luth (D.c)
|
58-72 jours
|
29,50°C
|
Tortue olivâtre (L.o)
|
49-62 jours
|
29,13°C
|
Tortue verte (C.m)
|
47-80 jours
|
28,26°C
|
Tortue imbriquée (E.i)
|
52-74 jours
|
29,32°C
|
Tortue caouanne (C.c)
|
49-67 jours
|
28,76°C
|
|
Tableau 1 : Période d'incubation des
espèces (Source : Miller et Limpsus, 1980)
· L'éclosion ; le nouveau
né coupe la membrane de l'oeuf avec la dent de l'éclosion puis
écarte la coque de l'oeuf avec les rames.
· L'émergence ; après une
période d'incubation, les premiers oeufs éclosent et les
minuscules tortues se ruent instinctivement vers la mer pour y trouver une
relative sécurité dans leur élément naturel.
L'émergence peut être observée la nuit ou pendant les jours
nuageux, frais ou pluvieux.
2.3. Menaces
Les tortues marines sont des animaux en voie de disparition,
c'est-à-dire qu'il ne reste que très peu dans le monde, des
nombreuses menaces pèsent sur elles tout au long de leur vie et elles
mettent très longtemps à devenir adultes. Ces menaces sont les
menaces naturelles et les menaces liées aux activités
humaines.
2.3.1. Menaces naturelles
Elles sont telles que les eaux d'infiltration, l'érosion,
la prédation et la végétation.
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
17
|
|
· Les eaux d'infiltration. Par leur
action, elles affectent le bon déroulement de l'incubation. Sur
certaines plages, notamment lorsqu'elles sont bordées par les
marécages, des espaces lagunaires, ou soumises à des pluies
torrentielles journalière, les eaux d'infiltration peuvent
entraîner le pourrissement de la majorité des oeufs d'une ponte
(Billes, 2004).
· L'érosion. Les plages bordant
les océans sont victimes d'érosion. Régulièrement,
il arrive qu'on rencontre à la surface du sable des oeufs dont les nids
ont été détruits par l'océan en particulier lors
des fortes marées lorsque les vagues découvrent les nids (Dembe,
2011).
· La prédation. Les tortues
marines sont victimes des prédateurs naturels à tous les stades
de leur développement. Lors de l'émergence, les petits peuvent
être la proie de certains mammifères, oiseaux et les crabes si la
sortie est diurne. En mer ils sont la proie de plusieurs poissons : bars,
petits requins, machoirons, ainsi que quelques oiseaux marins (figure 6).

Figure 6 : Prédation des petits par
le machoiron (Source : MBODO BAHOUHOULA Igore, 2014)
· La végétation. La
végétation rampante garnissant souvent le haut de la plage
représente une menace pour les oeufs. Les racines des plantes rampantes
envahissent les nids et percent les oeufs. Par la suite, ces plantes peuvent
constituer une menace mortelle pour les juvéniles lors de
l'émergence (Billes, 2004).
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
18
|
|
2.3.2. Menaces liées aux activités
humaines
La plus grande menace qui pèse sur les tortues marines
est liée aux menaces directes et indirectes.
2.3.2.1. Menaces directes
Au cours de leur vie, les femelles sont victimes de plusieurs
menaces, notamment celles liées à l'action directe de l'homme, la
présence des animaux domestiques sur les plages par exemple les porcs et
les chiens et la collecte des oeufs. On note aussi les hameçons de
pêche et les filets.
Les hameçons de pêche. Ils sont
une menace très grave pour les tortues. Elles peuvent mordre et mourir
épuisées, elles peuvent être pêchées
intentionnellement ou mourir lentement, en mer, à cause des lignes qui
les scient l'intestin.
Les filets. Les adultes ou les petits qui
restent attrapés meurent souvent noyés, contrairement aux
hameçons avec lesquels elles peuvent continuer à vivre. Les
pertes dues aux filets et à la pêche peuvent avoir, à
l'immédiat, un impact très grave sur la population des tortues.
Les femelles nidifiant sur plages sont abattues, cet abattage est lié
à l'activité de l'homme sur ces dernières (Figure 7).
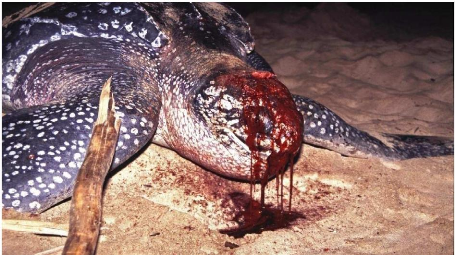
Figure 7 : Abattage d'une femelle (Source :
MBODO BAHOUHOULA Igore, 2014)
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
19
|
|
2.3.2.2. Menaces indirectes
Les activités de l'homme peuvent avoir des
conséquences multiples sur la survie de ces espèces, qui peuvent
être résumées autour de la lumière, les billes de
bois et la pollution des eaux.
La lumière et les billes de bois. Ils
sont par contre un grand danger pour les femelles qui viennent pondre. La
lumière peut désorienter les femelles et les empêche de
revenir sur la plage. Les billes de bois agissent comme des barrières
qui bloquent leurs mouvements sur la plage.
La pollution des eaux. Elle est le pire mal
de la mer et elle est pour les tortues comme pour tous les organismes marins un
assassin silencieux. Le pétrole tout comme les ordures altèrent
le milieu, changent les conditions de vie dans la mer et ils empêchent
à beaucoup d'animaux de dérouler leurs cycles vitaux
régulièrement comme manger et se reproduire.
2.4. Mesures de protection
Les zones d'alimentation et de ponte des tortues marines
doivent être classées comme aires protégées (Protat,
2010). Afin d'amener un changement de mentalité des habitants des plages
sur les mortalités des tortues marines, il est nécessaire
d'accroitre l'apprentissage du public et la participation communautaire dans la
conservation.
Dans l'état actuel des connaissances, il est urgent de
mettre en place soit par les instances de pouvoir local, soit par l'Etat
(Ministère de l'Economie Forestière), un plan
d'aménagement visant à la mise en place d'une véritable
politique de la conservation des tortues marines menacées de
disparition. Cette politique ne doit pas s'appliquer seulement sur une portion
limitée du littoral mais sur tout son ensemble. Dans le PNCD trois
actions jugées prioritaires sont à envisager à savoir :
· La sensibilisation et l'éducation des populations
locales ;
· La mise en place d'un système de suivi et de
collecte des données statistiques de la pêche maritime artisanale
et industrielle sur les tortues marines ;
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
20
|
|
· La formulation et la prise des arrêtés
ministériels sur la loi n°015/88 du 17/09/1988 réglementant
la pêche maritime en République du Congo, se rapportant à
la protection des tortues adultes, nouveau-nés et de leurs oeufs.
2.5. Peines relatives au braconnage
En application de la loi n°37-2008 du 28 novembre 2008
sur la gestion durable de la faune et des aires protégées, les
peines prévues pour les individus ayant posé un acte non
autorisé ou acte de braconnage ainsi que les personnes acquérant
le produit frauduleux sont consignées dans les articles 112 et 113 de
ladite loi.
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
21
|
|
CHAPITRE III: MATERIELS ET METHOD E DE COLLECTE DES
DONNEES
3.1. Localisation des sites de ponte
Dans le PNCD plus précisément sur son
littoral, le suivi de ponte des tortues se fait naturellement dans six (6)
sites du nord au sud du Parc. Ces sites sont tels que le site
de Niandji, Vandji, Paris, Kondi, Bondi et le site de
Longo-Bondi (figure 8).
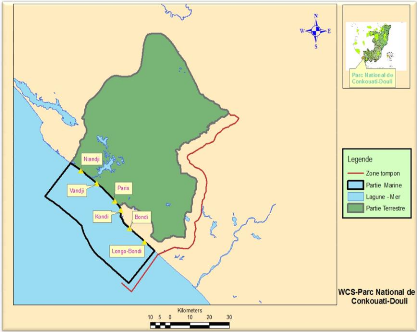
Figure 8 : Localisation des sites de ponte des tortues
marines (Source : WCS)
3.2. Matériels
Pour la réalisation de cette étude nous
avons utilisés trois types de
matériel
|
: le
|
|
e
matériel de terrain, le matériel biologique
et le matériel technique.
3.2.1. Matériel de terrain
Le matériel cité ci-dessous a
été utilisé pour la réalisation de cette
étude sur l
terrain : un mètre ruban de 2,5 m
pour
|
la biométrie ; une torche à
pile
|
; les bagues de
|
|
Rapport de fin de formation
(2013-2014) présenté par MBODO
BAHOUHOULA Igore.
|
22
|
|
marque RENATURA ou KUDU ; une pince; un appareil photo de
marque Canon A3000 ; un GPS de marque Canon ; un bloc note ; des fiches
d'identification.
3.2.2. Matériel biologique
Il était constitué essentiellement des cinq
espèces de tortues rencontrées dans les différents sites.
Il s'agit de la : Tortue luth (Dermochelys coriacea) ; Tortue verte
(Chelonia mydas) ; Tortue olivâtre (Lepidochelys
olivacea) ; Tortue caouanne (Caretta caretta) et la Tortue
imbriquée (Eretmochelys imbricata).
3.2.3. Matériel technique
Ce matériel était constitué des
clés d'identification des tortues; les mémoires et publications
sur les tortues matines d'autres chercheurs pour se servir comme repère
; l'internet et un ordinateur de marque DELL.
3.3. Méthode de collecte des données
Pour mener à bien cette étude, nous avons
consultés sur le sujet les documents rencontrés sur les lieux qui
ont donnés lieu à la collecte des informations secondaires. Il
s'agit particulièrement des :
· Documents prélevés au MDDEFE notamment
la loi 16-2000 du 16 novembre 2000 portant code forestier de la
République du Congo, l'arrêté n°6075 du 9 avril 2009
déterminant les espèces animales intégralement et
partiellement protégées et le décret n°99-136 bis du
14 août 1999, portant création du Parc National de Conkouati Douli
;
· Documents disponibles sur les tortues marines, en
particulier les manuels pratiques sur les tortues marines, les clés
d'identification et les publications sur la protection de ces
espèces.
3.3.1. Entretien avec les acteurs impliqués dans la
gestion du Parc
Des enquêtes ont été organisées
avec les principaux acteurs travaillant pour le compte du Parc. Il s'agit en
particulier des responsables du Parc (Coordonnateur chef de site et le chef de
volet recherche) et les journaliers.
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
23
|
3.3.2. Entretien avec les pêcheurs
Ils sont la source principale d'informations concrètes
sur le terrain concernant les tortues prises accidentellement dans les filets
et les hameçons de pêche. Les entretiens pour la plupart, se sont
déroulés grâce à des rencontres très
tôt le matin sur la plage.
3.3.3. Observations et indentification des tortues
Les tortues marines présentent des
caractéristiques propres pour chaque espèce, ces
différences caractéristiques, citées dans le chapitre
précédent nous ont permis de les nuancer. Les pêcheurs
identifient chaque espèce de tortues en donnant le nom vernaculaire,
puis on utilise les clés d'identification pour donner le nom
scientifique. Au cours de notre étude nous avons rencontrés
quatre espèces de tortues sur les cinq que compte le littoral congolais,
avec une absence totale de la Tortue Caouanne.
3.4. Patrouilles
Elles s'effectuent de préférence la nuit avec un
maximum de trois personnes par équipe. On ne doit pas s'approcher de la
tortue lors du creusement de son nid. Il ne faut pas également
être bruyant lors des patouilles, cela risque d'empêcher la
montée des espèces nidifiant et même constituer un danger
pour l'équipe dans la mesure où les braconniers vous
surprennent.
3.5. Identification
Elle commence par les traces laissées sur le sable par
les tortues et la nature da la carapace. Les traces sont parmi les
critères d'identification les plus importants. Les tortues laissent sur
le sable des profondes empreintes qui permettent d'identifier l'espèce.
La Tortue luth et la tortue olivâtre avancent les quatre pattes en
même temps, la trace est dite symétrique ou de type
simultané. Les tortues vertes, imbriquée et caouanne avancent
seulement deux pattes en même temps. La trace est dite asymétrique
ou de type alterné.
La nature de la carapace est différente pour chaque
espèce des deux familles des Chéloniens. A partir de ces
familles, on distingue deux types de carapace, la
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
24
|
carapace lisse (sans écailles) chez la tortue luth et
la carapace à écailles présente chez les Chelonidae.
3.6. Marquage
Il a pour objectif d'obtenir les informations concernant la
reproduction, le déplacement (l'habitat) et la croissance. Chez la
Tortue olivâtre, deux marques externes sont placées lors de la
ponte sur les nageoires antérieures qui produisent un minimum de
mouvements. Tandis que chez la Tortue luth, les marques sont posées sur
les nageoires postérieures lors de la ponte.
3.7. Traitement des données
Les données sont traitées en utilisant le
logiciel Excel après collecte des données sur le terrain, afin
d'identifier les espèces, de connaître le nombre de tortues
rencontrées au cours de cette saison de ponte et par site, la capture
accidentelle des tortues par espèce et par site, la saison et le pic de
ponte et de faire les mensurations des espèces.
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
25
|
CHAPITRE IV : PRESENTATION DES RESULTATS
4.1. Nombre de tortues au cours de la saison de
ponte
Au cours de cette saison de ponte allant de novembre
à mars,
effectif total de 1198 tortues sur
Niandji, 175 à Vandji, 190 tortues
tortues à Longo-Bondi (Figure
9).
on a pu rencontrer un
le littoral de Conkouati dont 404 tortues au
à Paris, 146 tortues à Kondi,
166
à Bondi et 117
site de
Nombre de tortes
450
|
404
|
|
400
|
|
|
|
|
|
350
|
|
|
|
|
300
|
|
|
|
|
250
|
|
|
|
|
200
|
|
|
190
175 166
|
|
|
|
|
|
146
|
|
150
|
|
|
|
|
|
|
|
|
|
|
117
|
|
|
100
|
|
|
|
|
|
|
|
|
|
|
|
|
50
|
|
|
|
|
|
|
|
|
|
|
|
|
0
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Niandji Vandji Paris Kondi Bondi L-Bondi
|
Sites
Figure 9 : Nombre de tortues par site
durant la période d'étude
4.2. Population des acteurs de pêche
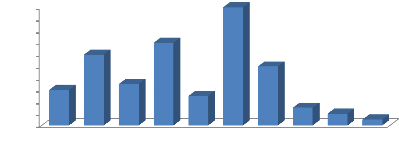
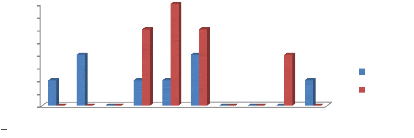
4.2.1. Répartition des pêcheurs selon les
classes d'âge
ans ans ans ans ans ans ans ans ans ans
Nombre des pêcheurs
intérrogés
20
18
16
14
12
10
4
8
0
6
2
15-20
6
20-25
12
25-30
7
30-35
14
35-40
5
40-45
20
45-50
10
50-55
3
55-60
2
60-65
1
Classe d'âge des pêcheurs
|
Rapport de fin de formation
(2013-2014) présenté par MBODO
BAHOUHOULA Igore.
|
26
|
Figure 10 : Répartition des pêcheurs selon
les classes d'âge
Cette figure 10 ci-dessus montre que la tranche
d'âge des pêcheurs les plus actifs est celle de la classe
40-45 (25%), puis viennent celles de 30- 35 (17,5%),
20-25 (15%) et celle de 45- 50 (12,5%).
4.2.2. Répartition des pêcheurs selon le
niveau d'instruction
Classe des pêcheurs
4
3,5
3
2,5
2
1,5
Nombre des pêcheurs par niveau
1
0,5
0
15-20 ans
60-65
60-65
55-60
45-50
35-40 ans
ans
ans
ans
ans
30-35 ans
25-30 ans
20-25 ans
Primaire Secondaire
40-45 ans
Figure 11 : Répartition des
pêcheurs selon le niveau d'instruction
Le niveau d'instruction le plus important est celui
des pêcheurs du secondaire (collège) avec 60% et 40% au primaire.
Dans la zone d'étude, il n'y a pas que des pêcheurs du primaire et
du secondaire mais il y a aussi des pêcheurs qui n'ont pas
été à l'école qui ont aussi l'objet de notre
interrogation.
4.2.3. Répartition des pêcheurs selon la
situation matrimoniale
Classe d'âge des pêcheurs
ans
ans
ans
ans
ans
ans
ans
ans
ans
ans
Célibataires Mariés
Pêcheurs célibataires et
mariés
0,5
3,5
2,5
1,5
4
0
3
2
1
15-20
20-25
25-30
30-35
35-40
40-45
45-50
55-60
60-65
60-65
Rapport de fin de formation
(2013-2014) présenté par MBODO
BAHOUHOULA Igore.
Figure 12 : Répartition des pêcheurs selon
la situation matrimoniale
Les jeunes âgés de 18 à 35 ans de la
zone d'étude sont majoritairement célibataires et vivent sous le
toit de leurs parents et cette figure 12 montre que parmi les
pêcheurs interrogés, les mariés représentent 60%
contre 40% des célibataires.
4.3. Captures accidentelles des tortues par
espèces
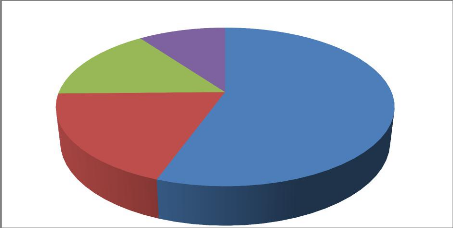
Tortue imbriquée;
19,50%
Tortue olivâtre;
15,50%
Tortue luth;
10,00%
Tortue Verte;
55,00%
Figure 13 : Répartition des
captures selon les espèces
La figure 13 ci-dessus montre que 55,00% des tortues
capturées et relâchées sont des Tortues vertes (
Chelonia mydas) . Les pourcentages des autres espèces
sont tels que 19,50% des Tortues imbriquées ( Eretmochelys
imbricata), 15,50% des Tortues olivâtres (
Lepidochelys olivacea) puis viennent les Tortues luths
(Dermochelys coriacea ) avec 10,00%.
4.4. Captures accidentelles des tortues par site
La répartition des captures selon les sites ou
plages est représentée dans la figure 14
ci-après.
Les résultats de cette figure montrent que
Niandji est le site (plage) où les tortues sont plus
pêchées avec 65,40% de capture suivi de Paris avec un pourcentage
de capture de 10,50%.
|
Rapport de fin de formation
(2013-2014) présenté par MBODO
BAHOUHOULA Igore.
|
28
|
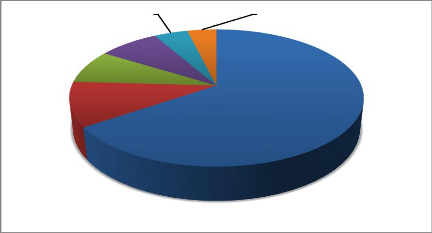
Bondi; 7,90%
Paris; 10,50%
Vandji; 8%
Kondi; 4,40% Longo-Bondi;
3,80%
Niandji; 65,40%
Figure 14: Répartition des captures acc
identelles des tortues par site
4.5. Capture des individus matures et i mmatures par
espèce
Les effectifs des individus des espèces de
tortues marines capturés sont représ
entés
|
dans le tableau ci-après. Il
|
montre que les Tortues olivâtres soit (100%) et
une moitié
|
espèces sont
(50%) des Tortues luths capturées sont des
individus matures, ces rarement observées au stade immature ou
juvénile su . Tandis que les Tortues vertes
soit 61,60% ca et les Tortues imbriquées
61,60% capturées accidentellement sont des
individus immatures.
|
Espèces
|
Individus
|
|
Matures
|
Immatures
|
Indéterminés
|
|
Tortues olivâtres
|
160
|
0
|
0
|
|
Tortues Imbriquées
|
1
|
47
|
77
|
|
Tortues luths
|
35
|
35
|
0
|
|
Tortues vertes
|
2
|
46
|
77
|
|
Tableau 2 : Nombre d'individus
|
matures et immatures par espèce
|
4.6-Détermination de la sa
|
ison et le pic de ponte par espèces
|
La saison de ponte des tortues marines en Afrique
Centrale est déterminée entre les mois d'octobre et d'avril
d'après (UICN) et du programme Kudu. Au Congo, cet
|
Rapport de fin de formation
(2013-2014) présenté par MBODO
BAHOUHOULA Igore.
|
29
|
intervalle de temps correspond à la période des
pluies au Congo. Nous avions considérés la tortue olivâtre
et la Tortue luth la saison et le pic de ponte.
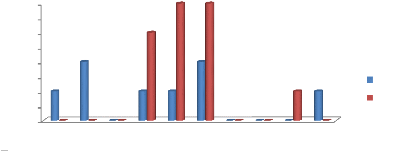
4.6.1-Période de ponte de la Tortue
olivâtre
Cette figure ci après montre que la ponte de la tortue
olivâtre ne commence pas en novembre, car la ponte pouvait pas commencer
par un pic en novembre avec un maximum de 226 et décroitre
jusqu'à s'effacer en mars. On se rend compte que la tortue
olivâtre commence sa avant novembre.
|
250
200
|
|
226
|
|
|
|
|
|
|
|
160
|
|
|
|
150
|
|
|
|
|
|
|
|
|
100
|
|
|
|
|
|
|
|
|
|
|
|
|
55
|
|
|
|
50
|
|
|
|
|
|
20
|
|
|
|
|
|
|
|
|
0
|
|
0
|
|
|
|
|
|
|
|
|
|
|
|
Nov. Déc. Janv.
|
Fév.
|
Mars
|
|
Mois
|
|
|
Nombre de tortues
Figure 15 : Nombre de tortues olivâtres par mois et
par site 4.6.2-Période de ponte de la Tortue luth
350
300
250
200
150
100
50
0
Nov. Déc. Janv. Fév. Mars
Figure 16: Nombre de Tortues luths par mois et
par site
Après lecture de la figure 16 ci-dessus, on admet que
la Tortue luth commence sa ponte en novembre. En ce mois un effectif de 90
tortues avant d'atteindre un
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
30
|
maximum (pic) en janvier avec 291 tortues pour enfin
arrêter sa ponte en mars avec 22 tortues. Donc la saison de ponte de la
tortue luth commence en novembre.
4.7. Mensuration des tortues
Elle a pour objectif de mesurer la taille corporelle
potentielle de la reproduction, la taille minimale à la maturité
sexuelle, le suivi de la taille des femelles reproductrices pour un site de
ponte et la croissance. Pour les mensurations, nous nous sommes
référés aux tortues baguées consignées dans
le tableau 2.
|
Espèces
|
Moyenne
|
Maximale
|
Minimale
|
Nombre
|
|
D.c
|
148 cm
|
200 cm
|
103 cm
|
212
|
|
L.o
|
72,3 cm
|
91 cm
|
66 cm
|
170
|
|
C.m
|
90,3 cm
|
99 cm
|
82 cm
|
3
|
Tableau n° 3: Longueur de la courbe
carapace
|
Espèces
|
Moyenne
|
Maximale
|
Minimale
|
Nombre
|
|
D.c
|
107,2 cm
|
151 cm
|
72 cm
|
212
|
|
L.o
|
71 cm
|
89 cm
|
64 cm
|
170
|
|
C.m
|
79,3 cm
|
89 cm
|
74 cm
|
3
|
Tableau n° 4: Largeur de la courbe
carapace
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
31
|
CHAPITRE V : DISCUTION
5.1. Nombre des tortues par site
La saison et pic de ponte ont été
déterminés par les études menées par la PROTOMAC
(Protection des Tortues Marines l'Afrique Centrale) sur une décennie.
5.1.1. Site de Niandji
Le site de Niandji a reçu 404 tortues, avec 277 Tortues
luths, 126 Tortues olivâtres et 1 Tortue verte, ceci suite à la
distance qui le sépare des villages environnants. La pêche est
moins pratiquée et le milieu est encore vierge. Le nombre croissant des
Tortues luths (277) dans ce site est justifié comme le souligne (Fretey
2001) que le niveau élevé de ponte des Tortues luths dans les
littoraux congolais et gabonais est fonction de la virginité de la zone.
Ce résultat coïncide bien avec ceux obtenus par Kissambou
(2011).
5.1.2. Site de Vandji
La plage de ce site est visitée par 177 tortues, dans
cet effectif il y on a 123 Tortues luths et 52 Tortues olivâtres. On a
constaté que le site n'est pas fréquenté par les
espèces de tortues comme avant, on dira que la cause est le fait que le
site soit entouré de plusieurs campements de pêche. Le village
Vandji est le lieu d'achat des poissons et poissons salés sur tout le
littoral du Parc.
5.1.3. Site de Paris
On compte 104 Tortues olivâtres, 78 Tortues luths et 8
Tortues vertes soit un total de 190 tortues. Selon la géologie, sa plage
est rocheuse. Le fait qu'il présente une plage plutôt rocheuse,
cette roche place ce site en deuxième plan en ce qui concerne les
effectifs après Niandji.
5.1.4. Site de Kondi
L'effectif le plus faible de tous les sites est observé
à Paris. Le nombre total de tortues dans ce site est de 148 avec, 82
Tortues olivâtres, 63 Tortues luths et 1 Tortue verte. La cause de ce
fait est présence de la route nationale n°5 (RN°5). Cette
route a un caractère persuasif aux personnes prises par le désir
du braconnage.
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
32
|
5.1.5. Site de Bondi
Le site de Bondi a accueilli 89 Tortues luths, 69 Tortues
olivâtres, 5 Tortues vertes et 3 Tortues imbriquées soit un total
de 166 tortues. La présence de quatre espèces de tortues est le
résultat de la présence d'une bande de tortues imbriquées
qui peuvent se déplacer saisonnièrement d'un site à un
autre. Ces résultats coïncident avec ceux obtenus par Kissambou
(2011).
5.1.6. Site de Longo-Bondi
Longo-Bondi, bien que, présentant une bande sableuse
d'une longueur de 10km comme c'est le cas pour Paris et Bondi, il a l'effectif
le plus faible avec 117 tortues, pour 86 Tortues luths, 28 Tortues
olivâtres et 3 Tortues vertes. La cause de ce faible effectif
résulte de la présence de nombreux campements de pêche
autour de ce site.
5.2. Saison et le pic de ponte
La saison de ponte de Lepidochelys olivacea est plus
précoce que celle des autres avec une durée brève. Elle
débute normalement en juillet et la son pic est probable observé
en novembre, car le figure 14 montre bien ce pic en mois de novembre par
rapport au nombre d'espèces par mois.
Celle de Dermochelys coriacea couvre environ huit
mois, soit une de juillet à mars. Le début de la ponte est en
juillet et son pic de ponte est atteint en janvier. Sa saison de ponte
s'arrêt en mars. Le suivi de ponte de cette espèce, accuse un
retard de quatre mois car à Conkouati les suivis de ponte commencent en
novembre, c'est pourquoi on compte directement 90 tortues en novembre qui
traduit son pic de ponte. La Tortue Caouanne, la Tortue imbriquée et la
Tortue verte leurs résultats ne sont représentatifs, cela ne nous
a pas permis de les comparer.
5.3. Population des acteurs de pêche
Pour l'âge, la fréquence la plus importante est
celle des pêcheurs dont l'âge est compris entre 40 et 45 ans
(figure 10). La faible présence des jeunes de 35 à 45 ans est le
fait que, de nos jours, les personnes de cette tranche d'âge ne peuvent
satisfaire leurs besoins en trouvant facilement un emploi, l'essor
économique pouvait permettre à ces jeunes de trouver des emplois.
Ceux de moins de 30 ans espèrent encore trouver des emplois dans des
chantiers d'exploitation pétrolière et autres.
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
33
|
Concernant le niveau d'instruction, les résultats ont
révélés que 60% des pêcheurs ont le niveau
secondaire (figure 11). A partir de ces résultats, on peut en effet,
dire que les problèmes de conservation et de la protection de la
biodiversité ont des exigences qui nécessitent un niveau
intellectuel acceptable, il est donc évident d'intéresser des
tels pêcheurs pour la vulgarisation des programmes de protection de la
biodiversité en général et des tortues marines en
particulier.
L'analyse des données sur la situation matrimoniale des
pêcheurs, montre que 60% sont des chefs de ménages (graphique 12).
La pêche est l'unique source de revenus des familles. Il serait
impérieux si l'Etat crée des aires marines
protégées à la Baie de Loango comme sur le littoral de
Conkouati pour la pérennité des cinq espèces de tortues et
des certaines espèces de poissons présentes.
5.4. Captures des tortues marines
Il y a 100% de tortues olivâtres et une moitié
soit 50% des Tortues luths prises dans les filets sont des individus matures,
si on parle en termes d'âge (tableau 2). Ces individus de tortues
olivâtres sont capturées à l'âge mature parce
qu'à l'âge immature elles ne se déplacent pas. Elles se
font prendre au moment de l'ascension sur la plage lors de la ponte.
Les proportions des Tortues vertes et des Tortues
imbriquées matures capturées sont faibles. Ceux-ci sont en
conformité avec les résultats obtenus par Protat (2010). En
majorité les Tortues imbriquées capturées sont des
individus immatures.
Pour les sites ou plages, Niandji reste le site le plus
fréquenté par les tortues marines (figure 9). La présence
élevée de ces espèces explique l'importance biologique de
la zone. Comme le soutient Fretey (2001) que le niveau élevé de
ponte des tortues dans littoraux congolais et gabonais est fonction de la
virginité de la zone.
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
34
|
CONCLUSION
Au terme de cette étude qui avait pour objectif global
de contribuer à la pérennité des espèces de tortues
marines sur le littoral de Conkouati en particulier et de toutes les
espèces animales dans le Parc en général à travers
un meilleur développement du programme de sensibilisation en impliquant
les populations locales, il ressort que les menaces qui pèsent sur la
population des tortues marines sur le littoral congolais sont d'origine directe
(liées aux activités de l'homme) et indirecte (menaces
naturelles). Il ressort que cinq espèces de tortues sont
présentes dans les eaux du littoral congolais avec une forte dominance
des Tortues olivâtres et Tortues luths. La ponte de la Tortue verte a
été également vérifiée sur les plages de
Conkouati. La période de ponte est presque la même pour toutes les
espèces, elle s'étend d'octobre à avril. La distribution
spatiale de ces deux espèces est relativement homogène sur les
plages de Conkouati, avec une légère dominance des Tortues luths
dans le site de Niandji. La cause mortalité des tortues dans
l'océan peut être attribuée soit aux pêcheurs
(chalutiers chinois) qui pratiquent illégalement la pêche dans les
mangroves et dans les zones de reproduction de la partie marine, soit aux
exploitants pétroliers qui polluent les eaux marines. La pollution des
milieux aquatiques liée aux activités d'extraction
pétrolière en mer constitue également une menace pour ces
espèces.
Dans l'optique de l'élaboration et de la mise en place
d'un plan de pérennisation visant à mettre sur pied des mesures
de gestion durable des ressources forestières en général,
de la faune sauvage et de la faune marine en particulier, le gouvernement doit
en collaboration avec les gestionnaires des aires protégées,
veiller à l'application de la loi congolaise n°37-2008 du 28
novembre 2008 sur la gestion de la faune sauvage et des aires
protégées et il serait importance de protéger les
populations de tortues marines dans le Parc de Conkouati car les menaces qui
pèsent sur ne sont plus à démontrer et des poissons d'une
part et d'autre part la faune en général. Les organisations non
gouvernementales (ONG) oeuvrant dans le secteur de la conservation au Congo
doivent, assurer la création des unités de production pouvant de
ce fait détourner l'attention des populations sur les ressources
fauniques et recruter les jeunes de la zone de conservation et leur apprendre
les métiers forestiers en leur intégrant dans la gestion des
ressources forestières. Elles doivent également créer des
unités de lutte anti braconnage dans la
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
35
|
zone de conservation et intéresser les populations
locales exerçant dans le secteur de pêche et de la chasse dans la
gestion de la biodiversité. Le Ministère en charge de la faune et
de la biodiversité, doit revoir le processus de recrutement des
écogardes dans les aires protégées pour assurer une
gestion efficace de la faune sauvage, afin d'éviter un rendement faible
et une érosion continue des ressources fauniques et renforcer les
brigades de LAB dans les zones de conservation. Il doit aussi procéder
à l'éducation environnementale dans tous les villages
situés à l'intérieur et/ou en périphérie du
Parc et promouvoir la recherche dans toutes les aires protégées
du Congo en général et en particulier dans le Parc de Conkouati
afin d'avoir un fichier national de toutes les espèces de faune et de la
flore.
La protection des espèces animales est l'affaire de la
communauté internationale. Au Congo en ce qui concerne les tortues
marines, leur préservation est l'oeuvre du Parc de Conkouati et
l'association RENATURA Congo, une Association de la Biodiversité
basée à la baie de Loango. Ces espèces bien que
protégées par diverses conventions internationales et nationales,
subissent plusieurs menaces. Parmi laquelle figure la pêche artisanale
qui est l'une des principales causes du déclin de bon nombre des tortues
marines.
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
36
|
ANNEXES
Annexe 1 : Calendrier du déroulement du
stage
|
Dates
|
Activités menées
|
Bute
|
Localité
|
Responsables impliqués
|
|
18/11/2013
|
Obtention de la
note mise en
stage
|
Pour être
accueilli au site de stage
|
Ministère de
l'Economie Forestière
|
Directeur du
cabinet du
Ministre de
l'Economie Forestière
|
|
6/12/2013
|
Voyage
|
|
Brazzaville -
Pointe Noire
|
|
|
16/12/2013
|
Rencontre avec les
responsables du Parc
|
Prise de contact
|
Direction
Départementale
de l'Economie
Forestière du
Kouilou à Pointe Noire
|
DENGUI Jean
Claude conservateur et NIAMATELE Basile conservateur adjoint
|
|
21/12/2013
|
Voyage
|
|
Pointe Noire -
Conkouati
|
|
|
6/01/2014
|
Rencontre avec les
responsables de la recherche
|
Proposition du
thème de travail
|
Base vie du Parc
|
BITSINDOU
Abdon et ses
assistants
|
|
7/01/2014
|
Entretien avec
les conservateurs et le chef de a recherche
|
Connaître
manipuler le
GPS pour
naviguer dans la forêt
|
Base vie du Parc
|
Le
conservateur, conservateur
adjoint le chef
de volet
recherche.
|
|
8/01/2014
|
Rencontre avec le chef de volet recherche
|
Savoir collecter
les données sur le terrain
|
Base vie du Parc
|
BITSINDOU Abdon chef de volet recherche
|
|
11/01/2014
|
Mission de
terrain au bord
de la plage
|
Identification des espèces en utilisant les clés
d'identification
|
Base vie pour
Niandji et Vandji
|
BOUMBA Richard
assistant de
recherche
|
|
10/02/2014
|
Mission de
terrain au bord
de la plage
|
Marquage des
tortues te suivi
des nids
|
Base vie pour
Paris et Kondi
|
BOUMBA Richard
assistant de
recherche
|
|
2/03/2014
|
Mission de
terrain au bord
de la plage
|
Nombre de nids
|
Base vie pour
Bondi et Longo-Bondi
|
|
|
22/03/2014
|
Mission de
terrain au bord
de la plage
|
Quantification des nids
|
Dans tous les
sites
|
|
|
20/04/2014
|
Fin du stage et voyage
|
|
Conkouati Pointe Noire
|
|
|
10/05/2014
|
Voyage
|
|
Pointe Noire -
Brazzaville
|
|
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
37
|
Annexe 2 : Quelques espèces de faune
rencontrées dans le Parc
Dans les Parc on trouve les espèces rencontrées
dans les autres Parcs du pays, mais on y trouve aussi cinq espèces de
tortues qui sont une particularité pour ce Parc semi marin.
|
Noms scientifiques
|
Noms communs
|
Ordres
|
Familles
|
|
Loxodonta africana cyclotis
|
Eléphant de forêt
|
Proboscidiens
|
Elephantidae
|
|
Gorilla gorilla
|
Gorille de pleine
|
Primates
|
Pongidae
|
|
Pan panicus
|
Chimpanzé à face noire
|
Primates
|
Pongidae
|
|
Tragelaphus spekei
|
Sitatunga
|
Artiodactyles
|
Bovidae
|
|
Cyncerus caffer
caffer
|
Buffle de forêt
|
Artiodactyles
|
Bovidae
|
|
Papio sphinx
|
Mandrill
|
Primates
|
Cercopitecidae
|
|
Tragelaphus scriptus
|
Guib harnaché
|
Artiodactyles
|
Bovidae
|
|
Crocodilus cataphractus
|
Crocodile à long
museau
|
Crocodiliens
|
Crocoliidae
|
|
Trichechus senegalensis
|
Lamantin
|
Siréniens
|
Trichechidae
|
|
Dermochelys coriacea
|
Tortue luth
|
Chéloniens
|
Dermochelydae
|
|
Chelonia mydas
|
Tortue verte
|
Chéloniens
|
Chelonidae
|
|
Eretmochelys imbricata
|
Tortue imbriquée
|
Chéloniens
|
Chelonidae
|
|
Lepidochelys olivacea
|
Tortue olivâtre
|
Chéloniens
|
Chelonidae
|
|
Careta careta
|
Tortue caouanne
|
Chéloniens
|
Chelonidae
|
|
Sousa teuzii
|
Dauphin à bosse
|
Cétacés
|
Delphinidae
|
|
Megaptera novaeangliae
|
Baleine à bosse
|
Cétacés
|
Balaenopteridae
|
|
Cephalophus dorsalis
|
Céphalophe à
bande dorsale
noire
|
Artiodactyles
|
Bovidae
|
|
Manis gigantea
|
Pangolin géant
|
Pholidotes
|
Manidae
|
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
38
|
Annexe 3 : Photos des menaces
|
Rapport de fin de formation
(2013-2014) présenté par MBODO
BAHOUHOULA Igore.
|
39
|

Capture par pêche artisanale Menaces
directes de l'homme
Menace par les grumes Prédation par le
machoiron
Pollution des eaux Menace par la
végétation
BIBLIOGRAPHIE
1. BILLES A. (2004). Sur les traces de
tortues marines d'Afrique Centrale, ECOFAC/Programme, Kudu, Libreville, Gabon ;
64p.
2. DEMBE H. (2011). Etude comparative des
engins et techniques de pêche de poissons utilisés dans la Baie de
Loango et leurs incidences concomitantes sur les captures des Tortues Marines,
103p.
3. DOUMENGE Ch. (1992). La réserve de
faune de Conkouati Congo : le secteur sud-ouest, UICN, Programme de
conservation des forêts, 231p.
4. FONTANA, A., (1981) Milieu marin et
ressource halieutique de la République Populaire du Congo,
édition ORSTOM, Paris pp 219-221.
5. FRETEY J. (1980). Les pontes de la Tortue
luth, Dermochelys coriacea en Guyane française, Rev. Ecol.
(Terre Vie) 34 : 649-650.
6. FRETEY J. 1981.Tortues marines de Guyane.
Edition du Léopard d'or, imprimerie reluire.
7. FRETEY J. (2001). Biogeography and
Conservation of Marine Turtles of the Atlantic Coast of Africa/
Biogéographie et Conservation des tortues marines de la côte
atlantique de l'Afrique, UNEP/CMS Bonn, Allemagne ; 429p.
8. GIRESS P. (1908). Carte sédiment
logique du plateau Continental du Congo. Notice explicative n°85, ORSTOM,
République Populaire du Congo : 28p.
9. HECKETSWEILER Ph. (1990). La conservation
des écosystèmes forestiers du Congo, UICN, programme pour les
forêts tropicales, 187p.
10. HECKETSWEILER Ph. et MOKOKO
IKONGA J. (1991). La réserve de faune de Conkouati (Congo) le
secteur sud-est, UICN, programme de conservation des forêts, Gland,
Suisse 323p.
11. JAMET R. et RIEFFEL J. M. 1976.
Notice explicative n°65. Carte pédologique du Congo
à 1/200000. Feuille Pointe Noire et feuille Loubomo. ORSTOM, Paris
167P.
12. KELLE L, GRATIOT, NOLIBOS I, THERESE J,
WONGSOPAWIRO R. et THOISY B.D, 2007.Monitoring of
nesting leatherback turtles (Dermochelys coriacea):
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
40
|
Contribution of remote seasing for real-time assessment of
beach coverage in French Guiana-Chelonian.
13. Patrick KISSAMBOU L. (2011). Ecologie
des Tortues Marines sur le littoral du Parc National de Conkouati Douli,
63p.
14. LANYON J.M, LIMPSUS C.J et MARSH H. (1989).
Dugongs and turtles: grazers in the sea grass system. Biology of Sea
grass: A treatise on the biology of seagresses with special reference to the
Australian region. AWD Larkum, McComb and SA Shepherd (Eds). Elsevier:
Amsterdam, New-York, 34-610.
15. MEFDDE, loi 16-2000 du 16 novembre 2000
portant code forestier de la République du Congo.
16. MEFDDE, loi n°37-2008 du 28
novembre 2008 sur la gestion durable de la faune et des aires
protégées.
17. MILLER J.D, LIMPSUS C.J. Incubation
period and sexual differentiation in the green turtle Chelonia mydas, L. In.:
CB. Banks. AA Martin (Eds) Proceeding of the Melbourne Herpetological
Symposium. Zoology Board of Victoria, Parkville: 66-73.
18. MOUTSAMBOTE J.M. 1997. Etude de
différents types de végétations de la réserve de
faune de Conkouati : secteur ouest. Centre d'Etude sur les Ressources
Végétales (CERVE).
19. NGOKAKA C., MAMONEKENE V., KINOUANI MATSIONA G.
S. (2009). La pêche maritime artisanale congolaise et son
rôle dans l'insertion des jeunes désoeuvrés : Cas de la
base Agip à Pointe-Noire. Annale de l'Université Marien Ngouabi,
10 (1) : 64-74.
20. NGUINGUIRI, J. C., (1995). Des
pêcheurs face au développement : acteurs stratégiques et
trajectoires des pêcheries vili du Congo. Thèse de doctorat en
anthropologie spéciale et ethnologie. Marseille Ecole des Hautes Etudes
en sciences sociales.
21. NZILA, J. D., (2010). Influence des
propriétés physico-chimiques des sols sur le développement
des Eucalyptus dans la région de Pointe-Noire (Congo). Rapport
scientifique UR2PI.
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
41
|
22. POUNZA, SAMBA-KIMBATA, (1990).
Aperçu sur le climat de l'Afrique
Centrale atlantique. In
«Paysage quaternaire de l'Afrique Centrale». Lanfranchi R. et
Schwartz D (eds).
23. PROTAT., E. (2010). Projet de
création d'une aire protégée dans la baie de Loango
(Congo). RENATURA Congo 2010. 35p.
24. SCHNEIDER. W., (1992). Guide de terrain des
ressources marines
commerciales du Golfe de Guinée. FAO; Rome
268p.
25. SCHULZ J. P. (1975). Sea turtles nesting
in Suriname. Nader. Commas. Intern. Natuurbes, Sticht. Natuurbeh. 23: 1-143.
26. SCHULZ J.P. (1975). Sea turtles nesting
in Suriname. Zoologische Verhan delingen 143: 1-143. Warm turtle from Cold
Water.
27. VICAT J. P. et GIOAN P.
(1989). La chaîne précambrienne du Mayombe en
République Populaire du Congo: géologie,
métallogénie, perspective de développement. Rev.des
Connaissances sur le Mayombe, UNESCO-PNUD : 17-45.
|
Rapport de fin de formation (2013-2014)
présenté par MBODO BAHOUHOULA Igore.
|
42
|
| 


