1.3. LES MINERAUX ARGILEUX :
Les argiles sont des entités minéralogiques
caractérisées par un comportement particulier avec l'eau, qui se
traduit souvent par des phénomènes de gonflement, de
dispersion
CHAPITRE 1 RECHERCHES BIBLIOGRAPHIQUES

7
et d'hydratation. Ce sont des silicates d'alumines
hydratés, qui ont des structures phylliteuses particulières et se
distinguent par leur nature chimique.
La structure phylliteuse de l'argile est le résultat de
la superposition de couches tétraédriques de silice et de couches
structurales octaédriques d'hydroxydes d'aluminium ou de
magnésium. Dans une couche tétraédrique (SiO2), l'ion
silicium Si4+ est placé au centre d'un tétraèdre
entouré de quatre atomes d'oxygène. Dans une couche
octaédrique d'hydroxyde d'aluminium Al2(OH) 6 ou de magnésium
Mg3(OH) 6, le cation (Al3+ où Mg2+) est
entouré d'un octaèdre d'ions hydroxydes OH- (figure
1.1 et 1.2).
Dans le cas où le cation de la couche
octaédrique est l'aluminium, deux tiers des sites octaédriques
sont occupés par des ions Al3+ et la couche
octaédrique est dite gibbsite alors que, dans le cas où l'on est
en présence de cations Si4+, tous les sites
octaédriques sont occupés et la couche octaédrique est
dite brucite.
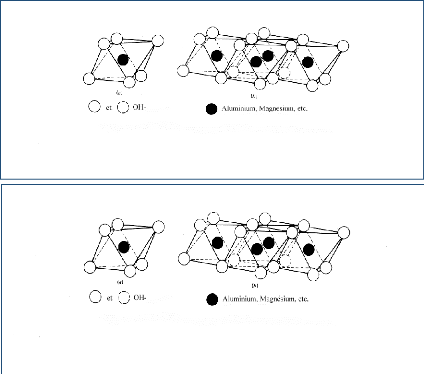
Figure 1.1 : Structure d'une couche
tétraédrique.
Figure 1.2 : Structure d'une couche octaédrique.
Figure (1.1) et (1.2) Les deux structures
élémentaires des feuillets d'argile.
La jonction entre une couche tétraédrique et une
couche octaédrique se fait par
DDVVV
substitution de certains groupements OH- par des ions
d'oxygène O2-, ce qui donne à la particule
CHAPITRE 1 RECHERCHES BIBLIOGRAPHIQUES

8
d'argile une charge négative. Il s'ensuit des
propriétés adsorbants de l'argile, favorisant la fixation de
cations et de molécules polaires afin d'assurer la neutralité
électrique du minéral.
Certaines argiles, pour lesquelles les liaisons interfeuillets
sont très faibles, ont la propriété de fixer des
molécules d'eau entre deux feuillets voisins. Ces argiles sont dites
gonflantes. Le potentiel de gonflement d'une argile dépend de la texture
et de la structure de minéraux qui la constituent.
1.3.1. Le groupe de la kaolinite :
Argiles dioctaédriques de type 1 / 1 (ou TO)
typique :
Le représentant le plus important de ce groupe de
minéraux est de loin la kaolinite. Elle est aussi l'exemple typique
d'une argile non gonflante. Les minéraux de cette famille sont
composés par l'alternance de couches tétraédriques et de
couches octaédriques (figure 1.3a). Les deux tiers des atomes du plan
commun entre la structure octaédrique et la structure
tétraédrique sont des atomes d'oxygène, qui assurent la
jonction entre les deux couches. Le tiers restant est composé d'ions
hydroxyles.
Suivant la nature du cation de la structure
octaédrique, on distingue deux sous-groupes dans cette famille de
minéraux argileux :
? le groupe de la serpentine, où la couche
octaédrique est de type « brucite »
? le groupe de la kaolinite, où la couche
octaédrique est de type « gibbsite ».
Les liaisons entre les différentes couches sont
relativement rigides et sont principalement assurées par les forces de
Van der Waals et les liaisons hydrogènes.
Outre les deux groupes précédents, cette famille
de minéraux contient le groupe des halloysites, qui existent sous deux
formes : une forme déshydratée ressemblant à la structure
de la kaolinite et une forme hydratée, où une couche de
molécules d'eau s'intercale entre deux feuillets de type
kaolinitique.
L'épaisseur d'une couche de kaolinite est de 7,2
A°, tandis qu'une couche d'halloysite hydratée a une
épaisseur de 10,1 A°. Des feuillets d'halloysite
d'épaisseurs intermédiaires peuvent exister, correspondant
à des structures partiellement hydratées.
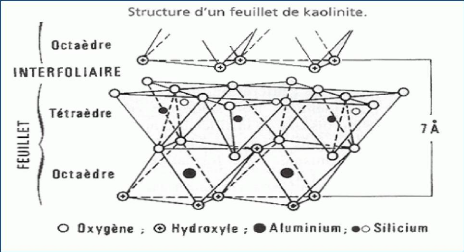
CHAPITRE 1 RECHERCHES BIBLIOGRAPHIQUES

9
Figure (1.3a) : Structure d'un feuillet de kaolinite.

Figure (1.3b) : Cristaux des particules de kaolinite vus au
microscope électronique.
Des substitutions de cations de silicium de la couche
tétraédrique ou de cations d'aluminium de la couche
octaédrique peuvent se produire sans changer l'arrangement des
minéraux de cette famille. Cependant, de telles substitutions sont
susceptibles de générer un déficit de charge et donc de
charger négativement la couche de kaolinite. Ce déficit de
charges est comblé par l'attraction d'autres cations et l'on parle alors
de capacité d'échange en cations (CEC) du minéral, souvent
donnée en milliéquivalents par cent grammes du minéral
(sec). On donne dans le tableau 1.2 quelques valeurs de CEC pour
différents minéraux argileux:
CHAPITRE 1 RECHERCHES BIBLIOGRAPHIQUES

10
|
Minéraux
|
CEC
|
|
Kaolinite
|
3-15meq/100g
|
|
Halloysite
|
5-40meq/100g
|
|
Montmorillonite
|
80-150meq/100g
|
Tableau 1.2 : Capacité d'échange de cations (CEC)
de quelques minéraux.
| 


