|
RépublIquE AlGéRIENNE DéMOCRAtIquE
Et POpulAIRE
MINISTERE DE L'ENSEIGNEMENT SUPERIEUR ET DE LA
RECHERCHE SCIENTIFIQUE
Université d'Oran

Département de Pharmacie
Mémoire pour l'obtention du titre de Docteur
en Pharmacie
LES NANOMEDICAMENTS
UNE APPROCHE INTELLIGENTE POUR LE TRAITEMENT DU CANCER
?
Présenté par :
BENYETTOU Imene
Encadreur
Dr N. BELBOUCHE Faculté de Médecine
d'Oran
Co-Encadreur
Dr H. KALAI Faculté de Médecine d'Oran
Dr N. MOUSSAOUI Président Faculté de
Médecine d'Oran
Dr C. ZAOUI Dr F. BOUDIA
Composition du Jury
Examinateur Examinateur
Faculté de Médecine d'Oran Faculté de
Médecine d'Oran
Année Universitaire
2012/2013
HASSANI Amina
Ala mémoire de notre cher camarade
Hamdi Azzedine...
À la mémoire de mes grands-parents. À
ma très chère NENNA, mes parents, frères ainsi que toute
ma famille. À tous mes amis, HIALASI y compris. À mon
pays.
Imene BENYETTOU
À la mémoire de mes grands-parents. À
mes parents, mes frères ainsi que toute ma grande famille. À tous
mes amis. À mon pays l'Algérie.
Amino HASSANI
Remerciements
Nous remercions « DIEU » pour nous avoir
guidé et aidé à terminer ce mémoire.
Qu'il nous soit permis d'exprimer notre profonde
reconnaissance à notre encadreur Dr N BELBOUCHE , maitre-assistant en
pharmacologie et chef du département de pharmacie qui a bien voulu nous
confier ce thème de mémoire passionnant .
Que notre co-encadreur Dr KALAI Hocine, docteur en
biophysique veuille bien trouver ici l'expression de notre profonde gratitude
pour le vif intérêt qu'il a montré à notre travail
et le soutien qu'il n'a cessé de nous prodiguer.
Nous remercions très vivement Dr N .MOUSSAOUI
docteur en pharmacie galénique de nous avoir aidé par ces
conseils et documents et de nous faire l'honneur d'accepter la
présidence de ce jury.
Nos sincères remercîments vont
également à Dr ZAOUI pour sa gentillesse et d' avoir bien voulu
être membre de ce jury.
Nous témoignons nos sincères gratitudes
à Dr BOUDIA maitre assistante en pharmacologie pour l'honneur qu'elle
nous fait de siéger dans ce jury.
Nous adressons au Pr Patrick COUVREUR nos
remercîments les plus vifs, pour l'aide précieuse qu'il nous a
apporté et de sa modestie.
Nous tenons à remercier tout
particulièrement Dr Ahmad Amin HASSANI pharmacien
généraliste de nous avoir proposé ce thème
fascinant, nous souhaiterons également remercier Ilies et Ayoub
BENYETTOU, Hadjer LARDJAM et Lila AHMAD BLAHA ainsi que tous ceux qui ont
contribué par leur aide, leur gentillesse et leur soutien à
l'achèvement de ce modeste travail.
TABLE DES MATIERES
INTRODUCTION GENERALE
1. Introduction 1
2. Historique 3
CHAPITRE I : Nanotechnologie et
Nanomedecine
1. Nanotechnologie 4
2. Nanomédecine 4
3. Nanovecteurs 5
3.1.Propriétés fondamentales des
Nanovecteurs 6
3.2.Les différents types de Nanovecteurs
7
3.2.1.Liposome 7
3.2.1.1.Synthèse 8
3.2.1.2.Inclusion du principe actif 9
3.2.1.3.Relargage des principes actifs 9
3.2.2.Micelles 10
3.2.3.Nanoparticules polymériques 11
3.2.3.1.Synthèse et inclusion du principe actif
par Nanoprécipitation 11
3.2.3.2.Synthèse par polymérisation du
monomère 12
3.2.3.3.Synthèse par émulsion dans l'eau
12
3.2.3.4.Inclusion du principe actif par dialyse
12
3.2.4.Dendrimères 13
3.2.4.1.La structure tridimensionnelle 13
3.2.4.2.Synthèse 14
3.2.4.3.Inclusion du principe actif 14
3.2.5.Nanoparticules Hybrides 15
3.2.5.1.Nanoparticules magnétiques 15
3.2.5.2.Nanoparticules d'or 15
3.2.5.3.Quantum dots 15
3.3.Evolution des Nanovecteurs au cours du temps
17
3.3.1.Nanovecteurs de première
génération 17
3.3.2.Nanovecteurs de deuxième
génération 17
3.3.3.Nanovecteurs de troisième
génération 17
3.3.4.Nanovecteurs de génération
ultérieure 18
CHAPITRE II: Nanomédicament et Cancer
1. La cancérogenèse 19
2. Les chimiothérapies classiques et leurs
principales toxicités 20
3. Mécanismes de résistance aux
anticancéreux 21
3.1. Mécanismes non cellulaires de la
résistance 21
3.2. Mécanismes cellulaires de la
résistance 21
4. Le traitement du cancer par les
nanomédicaments 22
5. Stratégies de ciblage 23
5.1. Le ciblage passif 23
5.2. Le ciblage Actif 24
6. Pharmacocinétique 26
6.1. Absorption 26
6.2. Distribution « voie intraveineuse »
27
6.2.1. Le système vasculaire 27
6.2.2. Le système lymphatique 29
6.3. La métabolisation 30
6.4. L'élimination 30
7. Pharmacodynamie 30
7.1. Les franchissements des membranes cellulaires
30
7.1.1. Le franchissement complet de la membrane
30
7.1.2. Le franchissement partiel de la membrane à
l'aide de vésicules 31
7.1.3. Facteurs favorisant le franchissement
32
7.2. Les cheminements intracellulaires 32
7.2.1. Le hyaloplasme 32
7.2.2. Le trafic vésiculaire 33
CHAPITRE III: Nanomédicament et Cancer "ESSAIS
PRECLINIQUES"
1. Méthodologie de sélection
36
2. Les études précliniques prouvant les
propriétés de la couronne 38
2.1. La Furtivité 39
2.2. Le ciblage 41
2.3. Le ciblage des cancers du cerveau à
travers la barrière hémato encéphalique.
47
2.4. Le ciblage à travers la membrane
cellulaire 53
3. Les études précliniques prouvant les
caractères du Coeur 54
3.1. Réduire la résistance au
anticancéreux 55
3.2. Association de plusieurs PA 58
3.3. L'utilisation de matériaux «
intelligents » et sensibles à un stimulus physique ou chimique
60
3.3.1 Les NV PH sensibles 60
3.3.2 Les NV Thermosensibles 62
3.3.3 Le ciblage magnétique par les
Nanovecteurs 63
4 Nanothéragnostique 65
5 Le concept de squalénisation
71
6 Discussion 75
CHAPITRE IV : Nanomédicament et Cancer "ESSAIS
CLINIQUES"
1. Les Anthracyclines liposomales 79
1.1. DOXIL 79
1.2. MYOCET 81
1.3. DaunoXome 83
1.4. ThermoDox 84
2. Nanovecteurs à base de Taxanes 85
3. Nanovecteurs à base d'Alkaloides 85
3.1. Vincristine liposomale (OncoTCS,Marqibo)
85
CHAPITRE V: Toxicologie et Règlementation
1. Toxicologie 87
2. Règlementation de la nanomédecine
89
CONCLUSION ET PERSPECTIVES
1. Future et perspectives 90
2. Conclusion 91
05
LISTE DES FIGURES
Figure 1 : Gamme de tailles des
différents types de Nanovecteurs comparées à celles des
principales structures chimiques et biologiques
Figure 2 : la structure des Nanovecteurs
06
Figure 3 : La structure du liposome
07
Figure 4 : Représentation des
différents systèmes liposomaux 07
Figure 5 : Préparation des liposomes
par la méthode de BANGHAM 08
Figure 6 : Structure de la micelle inverse
(a) et directe(b) 10
Figure 7 : Structures des nanosphères
(A) et des nanocapsules (B) 11
Figure 8 : Préparation des
nanoparticules par Nanoprécipitation 11
Figure 9 : Préparation des
nanoparticules par émulsion dans l'eau 12
Figure 10 : La structure du dendrimere
13
Figure 11 : Représentation schématique des
nanoparticules d'or, d'oxyde de fer et des Quantum dots 15
Figure 12 : Les différentes
générations de nanoparticules 18
Figure 13 : Nanoparticule multifonctionnelle
18
|
Figure 14 : Représentation
schématique des mécanismes de ciblage actifs et passifs des NV
dans la tumeur
|
24
|
Figure 15 : Les principales voies de
franchissement des NV à travers la membrane Cellulaire
31
Figure 16 : Le cheminement intra cellulaire
des NV 33
Figure 17 : Architecture des nanotechnologies
utilisées pour la vectorisation des médicaments
34
Figure 18 : Schéma
représentatif des deux parties constituant le NV 35
Figure 19 : Le nombre des publications sur
les nanomédicaments entre 1940 et 2010 36
Figure 20 : Le diagramme des étapes de
sélection des études incluses dans le mémoire
37
Figure 21 : Schéma
représentatif des principales propriétés de la couronne de
NV 38
Figure 22 : Histological analysis of neoplastic
masses excised from immunodeficient mice bearing 40 human
anaplastic thyroid xenograft tumors
|
Figure 23
|
:
|
In vivo antitumoral effects of GEMZAR® and L- GEM
in immunodeficient mice bearing human anaplastic thyroid xenograft tumors
|
40
|
|
Figure 24
|
:
|
Specific interaction of mAb-NPs in SKOV-3 and Daudi cells
|
41
|
|
Figure 25
|
:
|
(a) MCF-7 and (b) C6 cancer cell viability of DOX in free form or
formulated NP
|
42
|
|
Figure 26
|
:
|
Confocal laser scanning microscopy of C6 cancer cells incubated
with DOX
|
42
|
|
Figure 27
|
:
|
In vitro cytotoxicity results using different cancer
cell lines
|
43
|
|
Figure 28
|
:
|
In vitro viability of (A) MCF-7 and (B) C6 cells after
24 h (A1, B1) or 48 h
|
44
|
|
|
(A2, B2) treatment of paclitaxel NP and Taxol®
|
|
|
Figure 29
|
:
|
Antitumor efficacies in vivo (A) and body weight changes
(B)
|
45
|
|
Figure 30
|
:
|
The photo-targeted nanoparticle concept
|
46
|
|
Figure 31
|
:
|
Kaplan-Meier survival curves of CD1 nude/nude mice treated with
different liposomal
|
47
|
|
|
HPR formulations
|
|
|
Figure 32
|
:
|
In vivo fluorescent images of U87 tumor bearing mice of
orthotopic model given physiological saline
|
48
|
|
Figure 33
|
:
|
Anti-tumor efficacy of various DOX formulations evaluated by
relative tumor volume
|
48
|
|
Figure 34
|
:
|
Antiproliferative curve of various DOX formulations against C6
|
49
|
|
Figure 35
|
:
|
Percentage of survival (Kaplan-Meier plot) of rats with
intracranially transplanted glioma C6 after iv injection of DOX
|
49
|
|
Figure 36
|
:
|
In vitro cytotoxicity against C6 cells after 60 h of
incubation
|
50
|
|
Figure 37
|
:
|
In vivo effects of DOX solution and DOX-polymer
conjugates after iv administration on the survival of brain tumor-bearing ICR
mice
|
50
|
|
Figure 38
|
:
|
Extensive distribution of fluorescent liposomes in CNS
|
51
|
|
Figure 39
|
:
|
3D reconstruction of primate gadoteridol (GDL) infusion
|
51
|
|
Figure 40
|
:
|
Micrographs of the cortex region of SV 129 mice 15 min after
injection of Apo
|
52
|
|
|
Emodified nanoparticles
|
|
|
Figure 41
|
:
|
Inhibition of rat 101/8 glioblastoma growth in rats after
treatment with doxorubicin-loaded PBCA nanoparticles
|
52
|
|
Figure 42
|
:
|
NGF concentrations in murine brain after i.v. injection of
different NGF preparations
|
52
|
|
Figure 43
|
:
|
(C) Internalization of free doxorubicin (F-DOX) and PEG-PE
encapsulating doxorubicin (M-DOX) in A549 cells over a period of 30 min
|
53
|
|
Figure 44
|
:
|
Schéma représentatif de principales
propriétés du coeur des NV
|
54
|
|
Figure 45
|
:
|
Sensitivity of DOX R MCF7 to doxorubicin (DOX), polymer (NP),
mixture of doxorubicin and polymer (NP+DOX) and doxorubicin-loaded
nanoparticles (NP DOX)
|
55
|
|
Figure 46
Figure 47 Figure 48 Figure 49
|
:
:
:
:
|
Résultat des tests menés in vivo sur des
souris transgéniques porteuses d'un hépatocarcinome
multirésistant
The in vivo anticancer activity of nanosilver
Histological examination of (A) the injection site (muscle), and
(B) the spleens
Bioassay of the nanocell with a GFP-positive melanoma-endothelial
cell three-dimensional co-culture system
|
56
57
57
58
|
|
Figure 50
|
:
|
Polymer drug conjugates for combination chemotherapy
|
59
|
|
Figure 51
|
:
|
(a) In vitro pH-dependent cytotoxicity
of DOX-loaded PHSM
|
60
|
|
Figure 52
|
:
|
The cellular uptake and retention of [D] NP
|
61
|
|
Figure 53
|
:
|
Viability of HeLa cells incubated with PTX-PCIAE-FA and Tarvexol
for
|
62
|
|
|
24 h at temperature of 37 and 40 ?C
|
|
|
Figure 54
|
:
|
(A)In vivo fluorescence images of MGH-U1 tumor bearing
mice without treatment and after intravenous injection of LMNC-Cy5 SHMNC-Cy5
|
63
|
|
Figure 55
|
:
|
Cell viability assay for PLC-PRF-5 cancer cells treated during 48
h for different concentrations of gemcitabine
|
64
|
|
Figure 56
|
:
|
(a) T2-weighted fast-spin echo images at the level of the LNCaP
tumor on the right side of the mouse
|
66
|
|
Figure 57
|
:
|
Représentation schématique de la méthode
appliquée par l'équipe d'Arias en 2009
|
66
|
|
Figure 58
|
:
|
Examples of T2-weighted images of the tumors obtained at 2
h-postinjection of
|
67
|
|
|
USPIO/SQgem NPs
|
|
|
Figure 59
|
:
|
In vivo imaging of Cy5.5-labeled CNPs in SCC7
tumor-bearing mice
|
68
|
|
Figure 60
|
:
|
(a) (1, 2) Selected MR images of PAV nanoemulsion and CTRL
nanoemulsion injected mice
|
69
|
|
Figure 61
|
:
|
(a) (1) Photoacoustic tomography imaging
before and after intradermal injection of porphysomes;(2) fluorescence imaging
after i.v. injection of porphysomes
|
70
|
|
Figure 62
|
:
|
La squalénisation de la gemcitabine
|
71
|
|
Figure 63
|
:
|
Résultats des tests sur la leucémie murine
|
72
|
|
Figure 64
|
:
|
Résultats des traitements par la gemcitabine libre ou
squalénisée sur le volume tumoral
|
73
|
|
Figure 65
|
:
|
SQ-Gem improves inhibition of tumor growth and increased
survival
|
74
|
|
Figure 66
|
:
|
Représentation schématique des différentes
voies d'activation du complément...
|
88
|
LISTE DES TABLEAUX
|
Tableau I
|
:
|
Les principales familles d'anticancéreux classiques et
leurs toxicités
|
20
|
|
Tableau II
|
:
|
Les publications des essais précliniques
sélectionnées dans le mémoire
|
75
|
|
Tableau III
|
:
|
Les nanomédicaments pour le traitement du cancer
approuvés par la FDA
|
85
|
|
Tableau IV
|
:
|
Exemples de nanomédicaments en essais cliniques
|
86
|
|
Tableau V
|
:
|
Exemples de formulations à base de plantes
|
90
|
LISTE DES ABREVIATIONS
ASGP-R ADN BHE CLSM CLTX CMC DCMC DLT DMNB
DMT
DOPE
:
:
Récepteur ASialo GlycoProtéine Acide
désoxyribonucléique
: Barrière Hémato
Encéphalique (BBB pour « Blood Brain Barrier »en anglais)
: Microscopie Confocale à balayage
Laser
: Chlorotoxine
: Concentration Micellaire Critique
: Acide Désoxycholique
carboxyméthylchitosane
: Toxicité Limitant la Dose majeure
: 4,5-diméthoxy-2-nitrobenzyl
: Dose Maximale Tolérée
: 1,2-dioléoyl-sn-glycéro-3
phosphoéthanolamine
DOTAP :
1,2-dioléoyl-3-triméthylammonium-propane DOX :
doxorubicine
DPPC EMA EPP EPR FDA GDL GEM GM1 GUV HPLC
HPR IR IV
: dipalmitoylphosphatidylcholine
: European Medicines Agency
: Erythro dysesthésies plantaire
: Enhanced Permeation and Retention
: Food and Drug Administration (en USA)
: Gadotéridol
: Gemcitabine
: Monosialoganglioside
: Vésicules géantes
: chromatographie en phase liquide de haute
performance (High Pressure Liquid
Chromatography en anglais)
: Fenretinide de rétinoïde
synthétique
: infrarouge
: Intraveineuse
LUV
: vésicules unilamellaires de grande
taille
L-GEM : Gemcitabine liposomale
mAb MAC MDR MIR MLV MSPC NB NIH NIR NIRF NM
: anticorps monoclonaux
: complexe d'attaque membranaire
: multidrugresistance
: Imagerie par résonance
magnétique en temps réel
: vésicules multilamellaires
: monostearoylphosphatidylcholine
: Neuroblastome
: National Institutes of Health
: proche infrarouge
: Neer Infra Red fluorescence
: nanomédicament
nm : Nanometre
NP NS NT NV PA
: nanoparticule
: solution saline normale
: nanotechnologie
: nanovecteur
: principe actif
PAMAM : Dendrimeres poly amido amine
pégylé
|
PEG
|
: polyéthylènes glycols
|
PEG-PE :
polyéthylèneglycol-phosphatidyléthanolamine
PEGPLA : Acide polylactique
PEPPG : poly éthylène-poly
propylène glycols
PHCA : poly(alkylcyanoacrylate)
PLGA : poly (lactide-coglycolide)
(«Poly(Lactic-co-Gglycolic Acid» en anglais)
PM
: poids moléculaire
POD
RES
RFA
: PEGylés et conjugué au
diorthoester
: système
réticulo-endothélial (« Reticulo Endothelial System »
en anglais)
: Radio frequency ablation
UV : Ultraviolet
RGD : Arg-Gly-Asp
SPR SUV TAT
SERS : surface-enhanced Raman diffusion
: résonance plasmonique de surface
: vésicules unilamellaires de petites
tailles
: transactivation activateur
Tc : Temperature de transition de phase

INTRODUCTION GENERALE

1
1. Introduction
« Il y a une impression grandissante dans la
communauté scientifique et technique : nous sommes en train d'entrer
dans un nouvel âge d'or (...). Nous sommes sur le point d'être
capables de construire des choses qui fonctionnent sur la plus petite
échelle possible, atome par atome (...). Le siècle dernier nous a
permis d'étudier le fonctionnement de la nanomachine biologique à
un niveau de détail incroyable, les prochaines décennies vont
nous permettre d'apprendre à modifier et adapter cette machinerie pour
prolonger la qualité et la durée de vie ».
Richard E. Smalley, prix Nobel de chimie en 1996,
témoigna ainsi devant le Congrès américain en 1999 de
l'émergence d'une nouvelle discipline scientifique : les
nanotechnologies.
Les nanotechnologies représentent aujourd'hui un axe
majeur de développement traduisant à la fois fascination et
espoirs dans divers domaines (électronique, agriculture, énergie
solaire...), deux des domaines les plus passionnants et prometteurs pour
l'avancement sont la santé et la médecine. C'est ce qu'on appelle
La nanomédecine, qui est un domaine de
recherche en croissance rapide et récent tout en réunissant des
ingénieurs, des physiciens, des biologistes, chimistes,
mathématiciens, des médecins et pharmaciens, cherchant des
solutions pour la plupart des défis actuels « cancer, maladies
cardio-vasculaires et neurodégénératives, infectieuses
« résistance aux antibiotiques »ainsi que d'autres maladies.
En formulant des nanoparticules à des fins prophylactiques, de
diagnostics et thérapeutiques.
La capacité à manipuler la matière
à une échelle supramoléculaire rend possible la
création de nouvelles classes thérapeutiques ayant des
propriétés novatrices. En augmentant l'index thérapeutique
des médicaments et en modifiant leur distribution. Cela permet de
réduire les doses administrées, limiter les effets secondaires et
cibler le médicament vers un organe cible ou une tumeur. C'est une
révolution dans le domaine pharmaceutique. Le chapitre 1 de ce
mémoire va nous initier au monde nanométrique ainsi que
l'application des nanotechnologies dans le domaine pharmaceutique (les
nanomédicaments, leurs types et leur synthèse).
Actuellement, le domaine le plus actif de la recherche et du
développement des nanoparticules est le traitement du cancer car il
reste l'une des maladies les plus meurtrières dans le monde, et le
nombre de nouveaux cas augmente chaque année (35000
nouveaux cas/an, 20000 décès /an en
Algérie), en dépit des progrès rapides dans les
procédures de diagnostics et les traitements, le taux de survie globale
ne s'est pas amélioré considérablement au cours des 30
dernières années.
INTRODUCTION GENERALE

2
Il est nécessaire, par conséquent, de
développer de nouvelles approches pour la détection
précise du cancer et des thérapies ciblées en fonction des
marqueurs spécifiques du cancer, ce qui pourrait conduire à la
médecine personnalisée. Ainsi le chapitre 2 se rapportera sur les
propriétés pharmacologiques des nanomédicaments dans la
thérapie du cancer.
Notre objectif majeur dans cette étude est de
répondre à une question précise :
Si les nanotechnologies se révèlent
théoriquement efficace pour combattre le cancer, ont-elles fait leurs
preuves sur le terrain ? Si c'est le cas, par quel mécanisme
?
Dans Ce mémoire nous avons l'ambition de montrer que
les concepts de la physico- chimie dans le développement de nouveaux
matériaux ,de la biopharmacie et la pharmacologie pour améliorer
l'index thérapeutiques des anticancéreux ainsi qu' une meilleure
connaissance des cibles biologiques permettent d'imaginer des systèmes
submicroniques d'administration dotés de nombreuses fonctions et
propriétés, bref de développer des nanotechnologies «
intelligentes » qui peuvent, en effet, contribuer à diversifier
notre arsenal thérapeutique dans le traitement du cancer.
Ainsi dans le chapitre 3, le but de notre travail a
été de chercher à visualiser l'actualité des
dernières études et publications concernant l'application des
nanomédicaments pour le traitement du cancer, nous essayerons de retirer
le voile de ces technologies nouvelles ,de les explorer et les comprendre, un
nombre d'études précliniques récentes ont
été récoltées et analysées.
Le Chapitre 4 concernera les nanomédicaments
commercialisés ou en phase clinique ainsi qu'une analyse toxicologique
et réglementaire sera effectuée.
INTRODUCTION GENERALE

3
2. Historique
Au XXème siècle, la communauté
scientifique commença à découvrir le monde atomique et
à décrire ces lois par la physique quantique, cependant fabriquer
un médicament à cette échelle qui s'acheminerai de
manière spécifique vers un site d'action n'était qu'une
imagination qui a inspiré la science-fiction à cette
époque, et pourtant à l'origine c'était un rêve tant
désiré par de nombreux scientifiques parmi eux Paul
Ehrlich médecin allemand, un des fondateurs de la
chimiothérapie, qui évoqua le magic
bullet mais aussi Richard Feynman qui
en 1959 a dit lors d'une conférence « there's plenty of
room at the bottom» défiant ainsi ces
collègues d'utiliser des particules supramoléculaires pour
fabriquer une large gamme de produits.
Dix ans plus tard « 1970 », le français
Jean-Marie Lehn (Prix Nobel 1987 de Chimie) a
réalisé des travaux qui ont permis de définir un nouveau
domaine de la chimie, la « chimie supramoléculaire
». Il a construit des édifices de taille
nanométrique en utilisant des espèces chimiques qui
s'autoassemblent pour donner des édifices plus complexes. C'est le
principe du BOTTOM-UP. Ensuite, les premières
expérimentations de vectorisation des médicaments sont
réalisées par Peter Paul Speiser et
Patrick Couvreur. Ils utilisent les
liposomes comme vecteurs pour le transport de médicaments.
Ce n'est qu'en 1974 qu'a été créé
le terme « nanotechnologie » par Le
professeur Japonais NorioTaniguchi pour faire
référence à une technologie qui aurait pour but de
concevoir, fabriquer et utiliser des structures d'une dimension de l'ordre du
nanomètre, peu de temps après le physicien Donald
Eigler, parvient à déplacer un à un
35 atomes de xénon et à dessiner les
initiales d'IBM sur une surface de nickel grâce à
l'invention du microscope à effet tunnel « 1983
» pour manipuler des atomes tout en fournissant des images en trois
dimensions avec une très haute résolution.
Ainsi les chercheurs ont pu fabriquer des biopuces permettant
de réaliser des analyses sur une surface de quelques cm2 et
en quelques heures de la même façon que les puces
électroniques sont fabriquées ,en 1999,
l'américain Carlo Montemagno a
réalisé un nano moteur en s'inspirant du moteur
ATPase, deux ans après, l'équipe de
Christian Joachim est parvenue à construire
une brouette moléculaire capable de
transporter des atomes que l'on peut manipuler avec la pointe d'un microscope
à effet tunnel ils ont réussi à assembler des atomes
pièce par pièce pour fabriquer cette
nanomachine.
Dès lors, plusieurs nanomédicaments ont
été fabriqué par autoassemblage à fin de traiter
divers maladies servers, aujourd'hui ils représentent l'un des plus
grand marchés de l'industrie pharmaceutique [44].

CHAPITRE I :
NANOTECHNOLOGIE
ET NANOMEDECINE
« Là où la nature cesse de produire
ses
ET NANOMEDECINE
propres espèces, l'homme, en se servant des choses
naturelles, en accord avec cette nature même, cmmence à
créer une infinité
[Tap e contenu encré n encad est u
d'espèces. »
Léonard de Vinci
Chapitre I Nanotechnologie Et
Nanomedecine

4
La possibilité d'explorer, de manipuler et de
modifier la matière et le vivant à l'échelle
des
nanomondes « 10-9m
», ne constitue pas une nouveauté, nous le faisons depuis
longtemps car l'ADN (Acide désoxyribonucléique), dont la largeur
est de quelques nanomètres(nm) , est manipulée de manière
extrêmement fine depuis plus de 40 ans par des techniques totalement
indépendantes des nanotechnologies, et toute une série de
médicaments ou de marqueurs biologiques sont fabriqués depuis
longtemps par la chimie, et influent sur le vivant à cette
échelle. En d'autres termes ce n'est pas le fait de manipuler la
matière et le vivant à cette échelle qui constitue une
révolution, alors quelle est la définition des nanotechnologies ?
[1]
1. Nanotechnologie
D'origine grecque, le préfix «nano» est
dérivé du terme «Nanos » qui signifie «nain».
Les nanotechnologies(NT) peuvent être définies comme l'ensemble
des études et des procédés de fabrication et de
manipulation de structures, de dispositifs et de systèmes
matériels à l'échelle du nm. Les nanotechnologies se
définissent aussi comme la préparation, la
caractérisation, la manipulation et le contrôle d'atomes ou de
petits groupes d'atomes ou de molécules en vue de construire de nouveaux
matériaux dotés de nouvelles propriétés dans
plusieurs domaines mais récemment elle vient d'offrir des potentiels de
développements dans le domaine médical notamment pharmaceutique
c'est LA NANOMEDECINE [2].
2. Nanomédecine
C'est l'application des nanotechnologies à la
médecine .Il couvre le processus de diagnostic, de traitement et de
prévention des maladies et lésions traumatiques, à
soulager la douleur, préserver et améliorer la santé
humaine, en utilisant la connaissance moléculaire du corps humain c'est
une révolution de la pratique future de la médecine. La
majorité des travaux dans le domaine peuvent être classés
dans l'un des domaines suivants :
? Systèmes de vectorisation de principe actif (PA)
notamment des gènes « nanomédicaments ». ? La
régénération tissulaire active.
? Biocapteurs, biopuces et nouvelles techniques d'imagerie pour
des fins de diagnostic [3].
Chapitre I Nanotechnologie Et
Nanomedecine

5
Parmi ces domaines c'est les « nanomédicaments
»(NM) qui présentent un fort développement et une
accélération exponentielle dans la recherche pharmaceutique.
3. Nanovecteurs
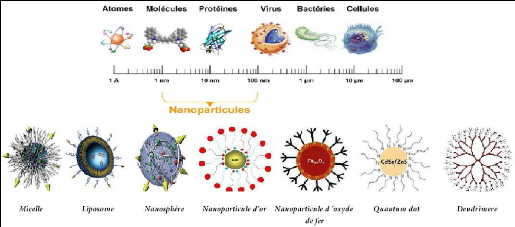
Figure 1: Gamme de tailles des différents
types de Nanovecteurs comparées à celles des principales
structures chimiques et biologiques [56].
Les systèmes vivants sont construits à partir de
matériaux moléculaires ou des nanostructures telles que des
acides nucléiques ADN et ARN (50-100nm) et des protéines. Ils
peuvent être produits à partir des processus d'auto-assemblage ou
auto-organisation dans le système vivant ou par synthèse
chimique. Alors que tous les matériaux internalisés par les
cellules sont plus petites que 100 nm.
Le domaine des nanomatériaux est semblable à
celui des structures biologiques, La NT se réfère à la
manipulation et /ou ingénierie des nano-objets à l'échelle
des molécules, et apporte au moins deux principales
caractéristiques attrayantes pour les techniques existantes.
? Une dimension généralement mais pas
exclusivement entre1 -100nm afin qu'ils puissent franchir les barrières
biologiques dont la barrière hémato-encéphalique (BITE),
les parois des vaisseaux ou de la membrane cellulaire, Ils peuvent donc
interagir avec un large panel d'entités biologiques.
Les nano-objets présentent des propriétés
physiques (électrique, magnétique, optique, mécanique) ou
chimique (Point de fusion) et peuvent s'étendre sur différentes
formes (nanosphères, nanotubes, nano-barreaux, nanofils) et
matériaux (la silice, de l'or, des semi-conducteurs, oxydes de fer, des
lipides ou à base de polymère), de sorte qu'ils peuvent
être creux, poreux ou solide [3].
Par nanomédicament, on entend la conception
d'un « véhicule » ou « vecteur » de
taille
nanométrique capable d'amener une
molécule active sur une cible thérapeutique donnée : un
gène, une protéine, une cellule, un tissu ou un
organe.

6
Chapitre I Nanotechnologie Et
Nanomedecine
|
De façon schématique, les nanovecteurs (NV) sont
composées de deux «parties», de l'intérieur à
l'extérieur :
· Le coeur.
· La couronne.
Et doivent avoir des propriétés
spécifiques
|
|
|
Figure 2: la structure des Nanovecteurs
[16].
|
|
3.1.Propriétés fondamentales des
Nanovecteurs
L'échelle nanométrique permet d'exploiter des
propriétés physiques différentes de celles
observées à l'échelle microscopique telles qu'un rapport
surface/volume important, cependant Il y a quelques exigences biologiques
essentielles pour les NV à remplir:
· Etre non toxique et traçable.
· Etre biodégradables.
· Etre sélectifs pour être efficace dans le
ciblage spécifique des cellules cibles.
· Une taille entre 1-100nm.
· Une grande stabilité dans les milieux
physiologiques.
· Libération et activation contrôlée du
PA.
· «Furtivité» et la capacité
à éviter la réponse immunitaire.
· Capacité d'attachement au PA.
· Etre soit soluble ou colloïdale en milieu aqueux
pour une efficacité accrue.
· Avoir une longue demi-vie dans la circulation et un
faible taux d'agrégation [3].
Chapitre I Nanotechnologie Et
Nanomedecine
3.2. Les
différents types de Nanovecteurs
3.2.1. Liposome

Les liposomes (découverts en 1965 par Bangham112) sont
des NP colloïdales dont la structure est fermée et
constituée d'une ou plusieurs bicouche(s) de phospholipides, avec une
phase aqueuse au coeur. Ils peuvent être classés en quatre
catégories, selon leur taille et leur structure :

7
Figure 3: La structure du liposome
[55].
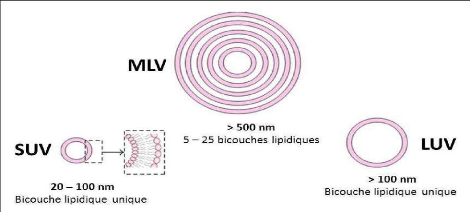
Figure 4: Représentation des
différents systèmes liposomaux [10].
? Les liposomes multilamellaires (MLV), (500 nm -5000nm)
constituées de plusieurs bicouches concentriques.
? Les liposomes unilamellaires de petites tailles (SUV),
(100nm) sont formés d'une simple bicouche.
? Les liposomes unilamellaires de grande taille (LUV), (200 nm -
800 nm).
? Les liposomes géants (GUV), supérieure à
1000 nm.
Chapitre I Nanotechnologie Et
Nanomedecine

8
? Le facteur f
C'est la fraction hydrophile dans le phospholipide. Ce facteur a
une grande influence sur la forme
géométrique de l'assemblage :
? Une trop forte fraction hydrophile (f > 50%) donne lieu
à la formation préférentielle de micelles
sphériques.
? Une fraction hydrophile comprise entre 40% et 50% forme des
micelles cylindriques (forme tubulaire).
? Les liposomes sont formés uniquement pour des fractions
hydrophiles comprises entre 25% et 40%.
? Le poids moléculaire
? Le PM du lipide n'influe pas sur la structuration en liposome
tant que le facteur f est compris entre 25% et 40%. Néanmoins, les
lipides de poids moléculaire très élevé ne forment
pas des liposomes.
? Il influe uniquement sur l'épaisseur de la membrane du
corps du liposome.
.
3.2.1.1. Synthèse
Les liposomes peuvent être préparés par
plusieurs méthodes :
? Hydratation d'un film mince «
méthode de BANGHAM »
Consiste à évaporer une solution organique de
lipide puis remettre le résidu en suspension dans un solvant aqueux,
à une température supérieure à la
température de transition de phase du lipide ce qui conduit à la
formation de (MLV) 1-5 ìm.
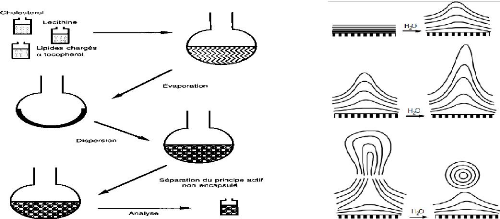
Figure 5: Préparation des liposomes par
la méthode de BANGHAM [57].
Chapitre I Nanotechnologie Et
Nanomedecine

9
? Emploie d'un Co-solvant.
Consiste à additionner une solution organique de lipide
dans une solution aqueuse sous forte agitation et
éliminer le solvant par évaporation, pour donner
une émulsion ou une dispersion de liposomes.
? Sonication ou extrusion des MLV.
Elle est appliquée à travers une membrane en
polycarbonate, à une température supérieure à la
température de transition de phase des lipides à
fin d'obtenir des SUV.
? Congélation/décongélation des MLV.
Consiste à fragiliser la membrane des MLV pour qu'elles se
recombinent en liposomes LUV.
3.2.1.2. Inclusion du principe actif
? De façon passive
Par incorporation directe du PA hydrophobe dans une solution
de lipides lors de la formation des liposomes avec une efficacité
d'inclusion de 5 à 15%.
Par hydratation de film mince « un solvant de
réhydratation contient le PA hydrophile qui est encapsule lors de la
formation des liposomes. Le taux d'inclusion est faible mais peut être
amélioré lors de la formation de SUV par extrusion, en utilisant
comme solvant d'extrusion une solution aqueuse de PA ». ? De façon
active
Par addition d'une solution organique de PA hydrophobe dans
une solution aqueuse de liposomes, suivie d'une dialyse pour éliminer le
solvant et le PA.
Inclusion par gradient de pH utilisée dans le cas d'un
PA hydrophile faiblement basique et consiste à créer un gradient
de pH entre l'intérieur et l'extérieur de la diffusion qui
continuera de l'extérieur à l'intérieur jusqu'à
inclusion de la totalité du PA ou jusqu'à la disparition du
gradient de pH. Des taux d'inclusion importants peuvent être atteints.
3.2.1.3. Relargage des principes actifs
Le relargage de PA hydrophiles est gouverne par la structure du
liposome, et en particulier par
? L'épaisseur de la membrane, qui dépend du PM du
lipide.
? La perméation de l'eau à travers la membrane
qui dépend de la mobilité des chaines hydrophobes. Les liposomes
auront des temps de relargage courts pour réduire la mobilité,
des molécules de cholestérol sont ajoutées à la
solution de phospholipide [5].
Les liposomes sont des véhicules de principes actifs
importants principalement dans la prise en charge de molécules
hydrophiles. La fonctionnalisation par des PEG et des ligands de ciblage permet
à ces objets d'atteindre les tissus tumoraux et de libérer les
médicaments sur la cible thérapeutique [5].
Chapitre I Nanotechnologie Et
Nanomedecine
Figure 6: Structure de la micelle
inverse (a) et directe(b) [2].
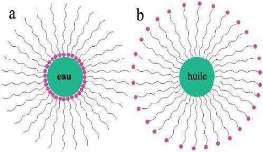
3.2.2. Micelles
La première utilisation de micelles polymères
pour le traitement du cancer était en début des années
1980 par Ringsdorf et ses collègues.
Ces particules sphériques sont de taille
nanométrique (10-100 nm) formé à partir de
l'auto-assemblage des amphiphile biocompatible des copolymères à
blocs dans les milieux aqueux à partir d'une concentration donnée
appelée
concentration micellaire critique (CMC).

10
Cette CMC dépend de la nature de la molécule
amphiphile et des conditions expérimentales [4].
L'architecture coeur-couronne est importante pour les
médicaments pour des fins de vectorisation, parce que le noyau
hydrophobe peut agir comme un réservoir de médicaments insolubles
dans l'eau, tandis que l'enveloppe extérieure protège la micelle
de la libération rapide du PA (Fig8).
Bien que plusieurs aspects fonctionnels des blocs constitutifs
ont été explorées (température ou pH sensibles),
les critères les plus importants sont la biocompatibilité et /ou
biodégradabilité.
Globalement, il existe deux types de micelles :
? Les micelles à coeur hydrophobe dispersibles dans un
solvant aqueux.
? Les micelles à coeur hydrophile dispersibles dans un
solvant apolaire [4].
Les micelles de polymères permettent l'utilisation
in vivo de médicaments déjà existants par
ailleurs jugé trop hydrophobe ou toxiques, sans avoir à manipuler
le produit chimique ou la structure de l'agent. De plus, l'encapsulation du
médicament dans le noyau de polymère et la CMC très faible
(typiquement de l'ordre de 10-610-7M), permet la
stabilité du médicament en entravant la dégradation
enzymatique et l'inactivation [6].
Chapitre I Nanotechnologie Et Nanomedecine
3.2.3. Nanoparticules polymériques
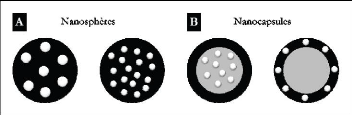
Figure 7: Structures des nanosphères
(A) et des nanocapsules (B) [5].
Ces NP peuvent être définies comme des
systèmes colloïdaux submicroniques. Suivant le type de
polymères et le mode de préparation, les nanoparticules peuvent
être séparées en deux catégories:
? Les nanosphères : particules solides
colloïdales de type matriciel dans lesquelles les PA peuvent être
encapsulés, dissous ou liés chimiquement. Ces particules ont
généralement des tailles supérieures à celles des
micelles de polymères avec un diamètre compris entre 100 nm et
200nm.
? Les nanocapsules : systèmes
colloïdaux et vésiculaires dans lesquelles le PA est confiné
dans le coeur liquide de la particule. Ce coeur est entouré d'une
membrane monocouche de polymère dont le diamètre est
généralement compris entre 100 nm et 300 nm.
Il existe plusieurs méthodes de synthèse et de
préparation des NP, le choix de la méthode dépend de la
nature et du PM du PA et du polymère utilisés, ainsi que le type
de NP qu'on veut obtenir:
3.2.3.1. Synthèse et inclusion du principe actif par
Nanoprécipitation
Le polymère et le PA sont solubilisés dans un
solvant organique miscible a l'eau et additionnés rapidement à
une solution aqueuse en présence ou non de tensio-actif sous très
forte agitation, Lors de l'addition dans la phase aqueuse, le solvant organique
diffuse immédiatement et conduit à la précipitation du
polymère et à la formation de la nanosphères Le solvant
organique est ensuite évaporé pour conduire à une
suspension aqueuse de NP.
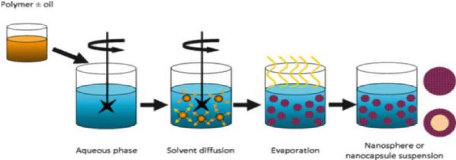

11
Figure 8: Préparation des nanoparticules
par Nanoprécipitation [58].
Chapitre I Nanotechnologie Et Nanomedecine

12
3.2.3.2. Synthèse par polymérisation du
monomère
En émulsion dans l'eau, en présence ou non de
surfactant, ou par ouverture de cycle du monomère en milieu organique
puis redispersion en phase aqueuse par Sonication.
3.2.3.3. Synthèse par émulsion dans l'eau
Une solution huileuse de polymère, en présence ou
non de tensio-actif, sous faible agitation, est émulsifiée dans l'
eau.la nanocapsule est formée par
l'agrégation du polymère à la surface de la goutte
d'huile.
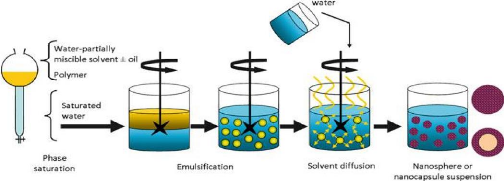
Figure 9: Préparation des nanoparticules
par émulsion dans l'eau [58].
3.2.3.4. Inclusion du principe actif par dialyse
Le polymère et le PA sont solubilises dans un solvant
organique miscible à l'eau puis dialysés contre de l'eau pure.
Cette opération est effectuée dans le but d'éliminer
l'excès de PA et le solvant, et aboutit à une suspension, dans
l'eau, de nanoparticules de polymère ayant intégré le PA
inclus.

13
Chapitre I Nanotechnologie Et
Nanomedecine
3.2.4. Dendrimères
Le mot dendrimère provient du mot grec « dendron
» arbre ou branche et « meros» partie Les dendrimères
sont composées de multiples monomères (dendrons) ramifiés
qui sont connectés radialement à un coeur central
multifonctionnel, ils peuvent être divisés en trois régions
spécifiques : le coeur, l'intérieur (Composé de branches
dendritiques connectées au coeur) et la périphérie
fonctionnalisable [4].
|
|
|
Figure 10: La structure du dendrimere.
|
Le nombre de points de branchements entre le coeur et la
périphérie définit la génération du
dendrimère ainsi, les dendrimères de générations
élevées auront un nombre important de groupements fonctionnels en
périphérie [3].
3.2.4.1. La structure tridimensionnelle
Dépend de la génération, cette structure
particulière permet d'inclure physiquement des molécules
hydrophobes, dans le coeur du dendrimere, ou de façon covalente,
à la périphérie :
? La génération du Dendrimère influe sur
la solubilité par un changement conformationnel et un changement de sa
perméabilité.
? La taille a un effet important sur le taux d'inclusion de
molécules hydrophobes. Le dendrimère améliore à la
fois l'absorption (diffusion ou osmose) et la rétention du PA dans les
cellules cancéreuses. Les augmentations d'encapsulation avec
génération de dendrimère peuvent être utiles pour
piéger les médicaments avec une dose thérapeutique
relativement élevée.
? La plurivalence : c'est utiliser les nombreuses fonctions de
surface du dendrimere pour l'accroche covalente de PA, de molécules
hydrophiles ou de ligands de ciblage. Cette méthode est
particulièrement utile elle permet d'accrocher plusieurs copies
créant ainsi une interaction beaucoup plus forte avec les
récepteurs présents à la surface d'une cellule
[7].Cette propriété a largement trouvé
son application dans la prévention de l'adhésion des cellules
tumorales et des métastases in vitro, ce qui est très
approprié pour le traitement du cancer [3].
Chapitre I Nanotechnologie Et Nanomedecine

14
3.2.4.2. Synthèse
? Approche divergente
Consiste à Construire le dendrimere à partir du
coeur en multipliant le nombre de fonctions réactives à chaque
nouvelle génération, utilisée industriellement, a le
désavantage d'augmenter le nombre de réactions à effectuer
et d'accroitre le nombre de réactions parasites à chaque nouvelle
génération. Le dendrimere obtenu a une faible
polydispersité.
? Approche convergente
Consiste à construire le dendrimere à partir de
la périphérie et à attacher les différents dendrons
sur un coeur pour conduire au dendrimere désiré. L'avantage c'est
de minimiser les étapes de synthèse, et conduit à des
dendrimeres homogènes et monodispersés.
3.2.4.3. Inclusion du principe actif
Le PA est lié :
· De façon covalente à la
périphérie du dendrimère.
· Par des interactions ioniques, hydrophobes, ou par des
liaisons hydrogène.
Les dendrimeres présentent de nombreux avantages pour une
utilisation en tant que vecteurs:
· Biodistribution et de pharmacocinétiques
contrôlées par la structure et le nombre de
générations.
· Une forte homogénéité structurale et
chimique.
· De nombreux groupements fonctionnalisables en surface,
permettant l'accroche de PA, ligands,...
· Une dégradation contrôlée par
l'utilisation de monomères biodégradables.
· Fonctions aisément accessibles en surface,
porosité de ces nanomolécules, flexibilité des branches
internes, accessibilité au coeur [7].
Néanmoins, malgré ces avantages, les
problèmes liés à la synthèse des dendrimeres
(synthèse multi-étapes couteuse et contrôle de la
qualité du produit final) ralentissent le passage du laboratoire aux
applications cliniques [5].
Chapitre I Nanotechnologie Et Nanomedecine

15
3.2.5. Nanoparticules Hybrides
Ce sont le plus souvent des particules ayant un coeur
métallique recouvert par une couche de molécules qui peuvent
être de nature hydrophile ou hydrophobe. Ces molécules sont des
agents de recouvrement qui permettent de contrôler le caractère
hydrophile ou lipophile des objets finaux. Ils peuvent être de nature
tensio-active ou non [4].
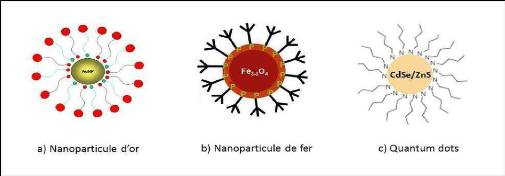
Figure 11: Représentation
schématique des nanoparticules d'or, d'oxyde de fer et des Quantum dots
[10].
3.2.5.1. Nanoparticules magnétiques
Composées des oxydes de fer, de métaux purs
(Fe, Co), ou bien des alliages (CoPt3, FePt).Les procédés de
synthèse sont aujourd'hui nombreux et peuvent-être classés
en quatre catégories : Co-précipitation-décomposition
thermique- microémulsion-et synthèse en milieu aqueux.
3.2.5.2. Nanoparticules d'or
Elles sont obtenues le plus souvent par réduction de
HAuCl4 par divers agents réducteurs comme le citrate de sodium. Cette
méthode a connu plusieurs modifications qui ont permis
d'améliorer les tailles moyennes (9 et 120 nm). Elles peuvent être
recouvertes par de nombreux ligands notamment des thiols. La méthode de
Shiffrin-Brust permet la synthèse de NP d'or et l'introduction de thiols
fonctionnels simultanément.
3.2.5.3. Quantum dots
Sont des semi-conducteurs, Ils sont fabriqués à
partir de cadmium, de sélénium, de tellure, d'indium, d'arsenic
et de soufre.
Chapitre I Nanotechnologie Et
Nanomedecine

16
? Propriétés
Pour les NP le rapport surface/volume est très grand.
Ainsi pour une NP constituée d'environ 1000 atomes et de diamètre
d'environ (2-3 nm), la moitié des atomes sont en surface. Les
propriétés électroniques (conductivité,
magnétisme, plasmon...) changent radicalement. En fonction de la taille.
Les propriétés ne sont plus celle du métal à
l'état massif, mais ne sont pas encore celle d'un atome ou d'une petite
molécule [8].
Les particules sphériques possèdent des
propriétés uniques atomes / molécules, la lumière
incidente sur un métal noble de NP peut être absorbée ou
diffusée (Mie 1908) [9].
Dans le cas des métaux à électrons
libres, les mouvements collectifs des électrons à la surface des
NP dominent celles à l'intérieur. Photons de longueurs d'onde
(UV), optiques, le proche infrarouge (NIR) et infrarouge (IR) peuvent se
coupler avec ces oscillations de surface d'électrons, d'être
absorbé, en fonction de la composition du métal, la taille, la
forme, et de l'environnement diélectrique.
Le Confinement et l'absorption de photons résulte d'un
très intense champ électrique locale sur les particules de
surface, connu sous le nom résonance plasmonique de surface (SPR).ce qui
crée des effets :
? Optiques: avec un potentiel d'applications
biomédicales et l'amélioration de
l'électromagnétique dite surface-enhanced Raman diffusion (SERS)
effect (Huang et al, 2007, Qian et al 2008). il permet d'augmenter la
sensibilité et la détection non invasive dans les tumeurs
[9].
? Photothermiques: Lorsque la lumière
est absorbée, son énergie se dissipe à travers des
vibrations dans le réseau atomique et peut générer de la
chaleur suffisante pour perforer les membranes cellulaires, de faciliter la
fusion de l'ADN double brin, et susciter des réponses cellulaires
à l'hyperthermie (Bert et al. 2002; Huang et al. 2007). c'est la
Thermothérapie.
? De la même manière, des nanoparticules d'or
peuvent également améliorer l'effet local des rayonnements
ionisants « 200% pour les potentiels de l'effet thérapeutique
».c'est la Radiothérapie [9].
? Se base sur des molécules (photo sensibilisateurs)
qui, suite à l'absorption d'un rayonnement lumineux, produisent de
l'oxygène singulet ou des radicaux libres c'est la
Thérapie photodynamique.
Chapitre I Nanotechnologie Et Nanomedecine

17
3.3. Evolution des Nanovecteurs au cours du temps
3.3.1. Nanovecteurs de première
génération
Les NV de première génération sont des
particules nanométriques qui ont une structure coeur/couronne et dont
cette dernière est peu ou pas travaillée. Elle est
constituée de molécules tensioactives qui n'apportent pas de
propriétés de ciblage et/ou de furtivité vis-à-vis
de l'hôte. Ces nanoparticules (NP) présentent des temps de
circulation sanguine très faible. Une famille de protéines
plasmatiques, les opsonines, présentent la propriété de se
lier à la surface de ces particules. Le « complexe » ainsi
formé est reconnu par les macrophages qui les internalisent par
endocytose. Cela se traduit au niveau de l'organisme par une accumulation des
constituants de ces NV au niveau du foie, de la rate ou de la moelle. De ce
fait, ces NV ont un intérêt thérapeutique uniquement sur
ces organes cibles [4].
3.3.2. Nanovecteurs de deuxième
génération
Dans le but de réduire les interactions NV-opsonines,
l'interface des NV doit comporter des groupements chimiques qui limitent la
fixation des opsonines. Ceci est réalisé en utilisant des
polymères non naturels comme les polyéthylènes glycols
« PEG » ou les poly éthylène-poly propylène
glycols PEPPG ; ou des polymères naturels comme des polysaccharides. On
dit alors que les NV de deuxième génération sont furtifs
vis-à-vis des systèmes de reconnaissance de l'hôte. Le
temps de circulation plasmatique est augmenté de façon
significative. Le caractère immunogène des NV peut être
déterminé, entre autre, quantitativement par mesure de
l'activation du complément. De plus la présence de PEG semble
améliorer la biocompatibilité des NV. L'ensemble de ces facteurs
aboutissent à un relargage plus long du PA [4].
3.3.3. Nanovecteurs de troisième
génération
Une partie de la couronne des NV de deuxième
génération peut comporter des ligands spécifiques d'un
organe, d'une population cellulaire ou d'un organite donné. On parle
alors de ciblage actif. Plusieurs stratégies ont été
utilisées avec succès :
? Greffage d'un anticorps spécifique d'une cible
donnée (récepteurs cellulaires) par voie covalente
(réversible ou non). On parle alors d'immunnanoparticules.
? Greffage de séquence peptidique visant des
récepteurs particuliers.
? Greffage d'oses pour le ciblage de cellules ayant des
récepteurs de sucre spécifiques comme les cellules
hépatiques ou certaines cellules cancéreuses.
? Greffage d'acide folique pour le ciblage des cellules
surexprimant le récepteur à l'acide folique
[4].

18
Chapitre I Nanotechnologie Et
Nanomedecine
Il est important de souligner que la façon dont le
ligand est présenté influe sur l'activité biologique des
NP. En effet, la densité de ligand à la surface a un rôle
important sur la reconnaissance et la fixation sur le récepteur. De
plus, cela détermine les paramètres physico-chimiques des NV. Les
NV de troisième génération représentent ainsi un
début de solutions thérapeutiques.
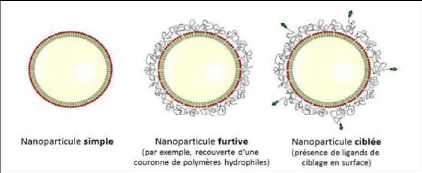
Figure 12 : Les différentes
générations de nanoparticules [10].
3.3.4. Nanovecteurs de génération
ultérieure
Le concept des nanoparticules multifonctionnelles
décrit par Mauro Ferrari [56] regroupe toutes les
considérations évoquées précédemment. Ce
principe est illustré à la figure 4.
Les NV doivent pouvoir transporter le PA vers une cible
précise mais on doit pouvoir aussi suivre le cheminement de ces vecteurs
à l'intérieur de l'hôte. Les NV doivent comporter des
systèmes de traçage qui peuvent être optiques
(fluorescence), radioactifs ou physiques (agent de contraste pour l'IRM). On
construit alors des NV multifonctionnels. Cependant, l'analyse fine de leur
comportement vis-à-vis de l'hôte est rendue plus complexe et plus
coûteuse à cause du nombre important de paramètres mis en
jeu [4].
|
|
|
|

CHAPITRE II :
NANOMEDICAMENT
ET CANCER
Chapitre II Nanomédicament Et
Cancer

19
Le cancer existe depuis la nuit des temps, d'ailleurs
les premières traces écrites datent depuis l'époque des
Egyptiens. Malheureusement , cette maladie représente aujourd'hui la
première cause de mortalité mondiale et pourtant il existe des
molécules efficaces actives sur les cellules cancéreuses,
cependant, les résultats cliniques n'ont pas été
satisfaisant car le taux de survie globale n'a pas été
significativement amélioré , il est donc logique de
déduire qu' au lieu de chercher une nouvelle molécule
anticancéreuse ,on change la stratégie de procédure de
livraison de la molécule ancienne reconnu comme étant
déjà efficace. Cette stratégie de livraison ne peut se
faire que si on arrive à mieux comprendre le mécanisme
pathologique de la maladie.
1. La cancérogenèse
Au cours du processus tumoral, la cancérogenèse
induit une prolifération cellulaire programmée qui conduit au
développement d'une masse tumorale, ce processus est :
? Lié à l'accumulation d'anomalies du
génome (génotype). elles sont le plus souvent acquises au cours
de la genèse tumorale.
? D'origine héréditaire (prédispositions
familiales).
Les clones tumoraux peuvent perdre ou conserver, certaines
caractéristiques morphologiques et fonctionnelles des cellules
originelles, ou en acquérir de nouvelles (= phénotype).
Ces modifications vont s'inscrire à la fois dans le
noyau, dans le cytoplasme et sur la membrane des cellules pathologiques.
Lorsque la tumeur atteint une taille de (1 à 2 mm) de
diamètre, elle induit la construction d'un système d'apport
sanguin appelé angiogenèse. Cette étape est capitale dans
la transition d'une tumeur de stade bénin à un stade malin
capable d'envahir et de métastaser les autres organes, induisant la
formation de capillaires se développant autour et au sein de la masse
tumorale. Ces neovaisseaux qui alimentent la tumeur peuvent également
fusionner avec le système vasculaire sain.
Chapitre II Nanomédicament Et
Cancer

20
? Le débit sanguin est souvent irrégulier, avec
la formation d'un nombre important de fenestrations et de canaux au niveau des
neovaisseaux.
? Une pression hydrique élevée. Due au drainage
lymphatique défaillant [10].
? L'Hypoxie qui rend l'environnement acide, cette hypoxie
tumorale est associée à la résistance à la
chimiothérapie, l'immunothérapie et la radiothérapie
[11].
Les traitements les plus utilisés sont la
chimiothérapie, la radiothérapie ou encore la chirurgie, mais ces
traitements peuvent entraîner des conséquences néfastes
pour le reste de l'organisme.
2. Les chimiothérapies classiques et leurs
principales toxicités Tableau I: Les principales familles
d'anticancéreux classiques et leurs toxicités [13].
Classes
|
DCI
|
Toxicités
|
Sels de Platine
Forment des ponts entre les deux chaînes d'ADN et
empêchent son ouverture lors de la réplication
|
Cisplatine (CDDP, Cisplatyl) Carboplatine (Paraplatine
Oxaliplatine (LOHP, Eloxatine)
|
Rénale
Thrombopénie
Neuropathies périphériques
|
Antracyclines
Inhibition des enzymes charges de réguler la structure
dans l'espace de l'ADN formation de radicaux libres
|
Daunorubicine (Cérubicine)
Doxorubicine
(Adriblastine)
Epirubicine (Farmorubicine)
|
Cardiaque
|
Alkylants
Attaquent directement l'ADN forme des radicaux libres
(alkyles)
|
Cyclophosphamide (Endoxan) Ifosfamide (Holoxan) Dacarbazine
(Déticène témozolomide( Témodal)
|
Toxicité neurologique Encéphalopathie
somnolence Maladie veino-occlusive Thrombopénie
|
Anti-Métabolites
Interfèrent avec la synthèse de l'ADN (Phase S du
cycle cellulaire), Ils se Substituent à des acides aminés ou
à des nucléotides)
|
Cytarabine (Aracytine) Gemcitabine (Gemzar) 5-FluoroUracile (
5-FU) Xeloda (Capécitabine Méthotrexate
|
Syndrome cérébelleux, mucites Syndrome pseudo
grippal
Radio sensibilisation mucites ++
Cardiaque
Rénale,mucites +++, hépatique
|
Poison du Fuseau
Empêchent la formation du fuseau chromatique qui permet la
séparation des chromosomes au cours de la mitose
|
Vincristine (Oncovin) Vindésine (Eldisine) Vinblastine (
Velbe) Vinorelbine (Nalvelbine)
|
Neuropathies périphériques
Constipationocclusions Veinotoxique
arthralgies, myalgies
|
Taxanes
Bloquent la division cellulaire en désorganisant le
fuseau microtubules
|
Paclitaxel( Taxol) Docetaxel (Taxotére)
|
Réaction Allergique
Sd de rétention hydrique
|
Les modificateurs de l'ADN
Formation de radicaux libres qui altèrent l'ADN
|
Bléomycine
Etoposide (Vp-16, vépéside) Irinotécan
(CPT-11, campto)
|
Fibrose pulmonaire Syndrome cholinergique
Diarrhées
|
|
Chapitre II Nanomédicament Et
Cancer

21
Chapitre II Nanomédicament Et
Cancer

22
L'échec de la chimiothérapie dans le traitement
du cancer résulte souvent de la résistance de celui-ci aux agents
antinéoplasiques. Cette résistance peut être naturelle ou
acquise.
3. Mécanismes de résistance aux
anticancéreux
Dans la majorité des cas, la résistance se
manifeste vis-à-vis de plusieurs classes d'anticancéreux de
structures chimiques et de modes d'action différents (Gottesman, 2002 ;
Longleyet al, 2005). Cette résistance pléïotropique est
souvent désignée par le terme MDR (multi drug resistance), elle
serait responsable de l'échec thérapeutique chez plus de 90% des
patients présentant des cancers métastatiques (Longley et al,
2005).
3.1. Mécanismes non cellulaires de la
résistance
Causé par :
· L'augmentation de la pression interstitielle.
· Présence des régions en hypoxie.
3.2. Mécanismes cellulaires de la
résistance
Cette résistance peut survenir à différents
niveaux :
· Augmentation de l'efflux du
médicament par la pompe Pgp.
· Diminution de l'expression ou de l'activité de ces
transporteurs (Gottesman, 2002 ; Longley et al,
2005) Diminution de l'influx du
médicament.
· Inactivation de l'agent thérapeutique :
par des transformations enzymatiques (Takebe et al. 2001).
· Séquestration vésiculaire du
médicament : En réduisant la concentration du
cytotoxique en contact avec sa cible sans affecter sa concentration cellulaire
globale (Dalton et al. 1999 ; Lehnert, 1996).
· Altérations de la cible du cytotoxique
: quantitative ou qualitative.
· Réparation des dommages de
l'ADN.
· Incapacité des cellules traitées
à entrer en apoptose [12].
4. Le traitement du cancer par les
nanomédicaments
La chimiothérapie classique présente certaines
caractéristiques physicochimiques inappropriées, un index
thérapeutique étroit et si la résistance au cytotoxique
est acquise, la chimiothérapie est rendu inefficace
[13].
Une meilleure compréhension des principes
moléculaires du cancer a abouti à l'élaboration de
nouvelles classes chimio-thérapeutiques. Ce sont Des traitements
moléculaires ciblés comme l'Hormonothérapie
ou l'Immunothérapie qui visent
à cibler directement la cellule cancéreuse en inhibant ces
récepteurs souvent surexprimés, par conséquent
améliorer l'équilibre entre l'efficacité et la
toxicité, cependant leur pharmacocinétique et leur distribution
tissulaire est souvent loin d'être optimale. En raison de leur faible
poids moléculaire, ce qui rend leur élimination rapide et une
accumulation minime dans les cellules tumorales.
Afin d'éviter ces inconvénients, les NT vont
jouer un rôle important car ils vont associer chimiothérapie
classique et traitement moléculaire ciblé en agissant au moins
à deux niveaux:
? En conférant de nouvelles propriétés au
PA (stabilité accrue, la pharmacocinétique modifiée, une
toxicité réduite...).
? En ciblant directement la tumeur.
La première stratégie fournit un moyen de
revisiter et sélectionner de nouvelles entités
moléculaires qui ont échoué dans le processus de
développement en raison des mauvaises propriétés
pharmacologiques (~40%).L'objectif est donc d'augmenter l'index
thérapeutique des médicaments connus.
Le ciblage des Nm est pertinent dans le cas des
médicaments dont l'intérêt clinique est limitée par
leur toxicité sur les organes vitaux (coeur, reins, moelle osseuse...)
.Il est en effet estimé que sur 100.000 molécules
administrées par voie iv, seulement1 à 10 peuvent
réellement atteindre leur cible, ainsi il peut fournir de nouvelles
options de livraison pour des médicaments existants qui sont sur le
point d'être retiré du marché.
4. Chapitre II Nanomédicament Et Cancer

23
Stratégies de ciblage
5.1. Le ciblage passif
L'augmentation de la perméabilité des vaisseaux
sanguins et la baisse du drainage lymphatique aboutissent à une
accumulation passive des NP au sein de la masse tumorale. Ce ciblage dit passif
est appelé effet EPR (Enhanced Permeation and
Retention).
La durée élevée de circulation sanguine
des NP est mise à profit pour augmenter leur probabilité de
passer par les fenestrations de l'endothélium tumoral et s'accumuler au
sein de la tumeur.
Les NV peuvent s'accumuler dans ces espaces (400 nm à
600 nm) et concentrer 10 à 100 fois plus de PA dans la cellule par cet
effet que par l'administration du PA seul [5].
En résumé, quatre facteurs expliquent
l'accumulation d'une nanoparticule dans une tumeur, qui est basée sur
l'effet EPR :
(1) La vie plasmatique élevée du nano
système.
(2) La perméabilité des vaisseaux.
(3) La taille nanométrique (typiquement 5 - 200 nm).
(4) Le faible drainage lymphatique au sein de la tumeur
[10].
Le Ciblage passif par effet EPR a été le mieux
observé dans de petites tumeurs bien vascularisées. Par contre il
est diminué dans les tumeurs mal vascularisées comme celle du
côlon et du pancréas [14] et parfois au sein de
sites primaires et secondaires « métastatiques » d'un
même cancer [11], Cette limitation a
énormément motivé les chercheurs pour réaliser des
efforts afin d'atteindre un ciblage actif à travers les interactions
ligand-récepteur.
Chapitre II Nanomédicament Et
Cancer
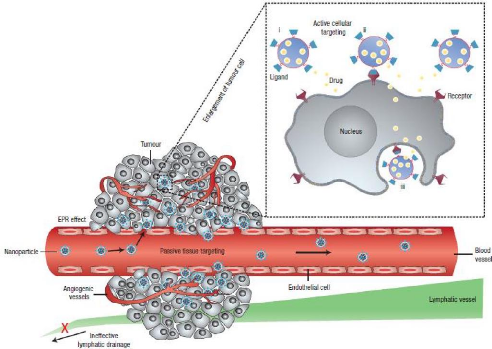

24
Figure14:Représentation
schématique des mécanismes de ciblage actifs et passifs des NV
dans la tumeur [13].
5.2. Le ciblage Actif
Le concept de thérapie ciblée est apparu dans
les années 1970 avec le développement d'anticorps (Schrama et al,
2006.), Alors que l'application de NP ciblées est apparue plus tard en
utilisant des immunoliposomes (Heath et al, 1980 ; Leserman et al, 1980). Les
progrès de la protéomique et de la bioinformatique du cancer ont
permis au développement de thérapies ciblées
[11].
La vectorisation active repose sur le couplage d'un NV avec un
ligand capable de reconnaitre de façon spécifique des
antigènes ou des récepteurs surexprimés à la
surface des cellules cibles (cellules tumorales, endothéliales ou
sanguines). Ce type de vectorisation s'appuie sur:
? Les interactions lectine-hydrate de carbone.
? Ligand-récepteur ou anticorps-antigène
[5].
Chapitre II Nanomédicament Et
Cancer

25
Parce que le poids moléculaire des anticorps est
relativement important (~ 150KDa), leur conjugaison se traduit souvent par un
mauvais contrôle de taille et réduit la capacité de
furtivité. Ces lacunes ont conduit à l'émergence d'autres
ligands de ciblage. Ces ligands comprennent :
? Des fragments Fab.
? Les facteurs de croissance.
? Les éléments nutritifs dont les récepteurs
sont surexprimés dans les cellules cancéreuses.
La petite dimension physique de ces alternatives permet une
meilleure efficacité de ciblage multivalent une plus grande
stabilité, une plus grande pureté, la simplicité de
synthèse, et la non immunogénicité sans compromettre le
temps de circulation des particules [14].
Il existe deux approches communes de médiation de ciblage
par le récepteur :
+ Cibler le microenvironnement de la tumeur, y compris
l'extracellulaire, les récepteurs de la matrice ou sur la surface des
cellules endothéliales tumorales des vaisseaux sanguins .ce qui est
généralement le plus efficace pour l'acheminement de l'induction
immunitaire ou des molécules de l'antiangiogenèse.
+ Cibler les surfaces des cellules tumorales. (Alexis et
al).par des récepteurs pour la délivrance intracellulaire
d'agents cytotoxiques ou signal de la voie inhibitrice
[11].
Ces vecteurs allient donc les caractéristiques suivantes :
+ Particules de taille inferieure a 200 nm.
+ Surface hydrophile (PEG, polysaccharides) pour induire la
furtivité.
+ Ligand a la surface du NV capable de reconnaitre de
façon spécifique des antigènes ou des récepteurs
surexprimés à la surface de cellules cibles.
+ Ligands d'imagerie in vivo pour suivre la distribution du
vecteur [5].
Chapitre II Nanomédicament Et Cancer

26
6. Pharmacocinétique
Le profil pharmacologique est étudié à
savoir le devenir in vivo de la molécule après administration, la
mettant en contact avec le milieu vivant. Les paramètres à
évaluer sont la pharmacocinétique, la biodistribution et la
capacité à passer les barrières biologiques ainsi que la
toxicité.
6.1. Absorption
L'absorption est le procédé par lequel la NP
passe de son site d'administration vers le plasma sanguin. Elle varie
principalement suivant la voie d'administration et les différentes
barrières qu'elle doit franchir :
· Voie orale (premier passage hépatique, enzymes
gastriques).
· Pulmonaire (passage à travers les
alvéoles).
· Intraveineuse(IV).
· Nasale.
· Dermique (diffusion à travers la barrière
cutanée).
· Oculaire (évacuation lacrymale).
· Intravaginale (muqueuse).
· Intra tumorale (acidité).
La biodisponibilité de la nanoparticule est de 100 %
uniquement pour la voie IV. Cette voie est donc souvent adoptée lors de
la première phase d'étude de molécules
thérapeutiques chez l'animal [10].
Chapitre II Nanomédicament Et
Cancer

27
6.2. Distribution « voie intraveineuse »
La distribution correspond à l'arrivée des NP
dans les différents tissus ; les plus étudiés sont le
système vasculaire, le système lymphatique, puis, de
manière générale les autres tissus
[15].
6.2.1. Le système vasculaire
En général, les médicaments
anticancéreux classiques sont éliminées du sang dans les
quelques heures qui suivent l'administration. Pour prolonger la demi-vie
plasmatique, les NV ont été proposées pour transporter et
délivrer ces médicaments. Les premiers essais ont
été accueillis avec succès marginal, car la taille des NV
affecte significativement leur rendement en délivrance in
vivo.
Cependant ils ne peuvent pas s'échapper de
l'absorption par le système réticulo-endothélial (RES)
« monocytes et les macrophages » qui est due au
phénomène d'opsonisation ce qui va conduire à augmenter
leur clairance plasmatique [14].
6.2.1.1. L'opsonisation
La raison principale de l'élimination hépatique
des NV est leur marquage par des protéines plasmatiques (les opsonines)
selon des interactions non spécifiques (Vonarbourg et al.2006).
Parmi les opsonines il y a :
? Le système du complément qui
est le premier élément du système immunitaire à
s'activer « voie alterne qui s'active spontanément par simple
fixation de la protéine C3. Cette activation aboutit à une
augmentation de la reconnaissance des NV par le RES et à la formation de
complexe d'attaque membranaire (MAC) ».
? Des immunoglobulines (IgG et IgM).
? La fibronectine.
? L'albumine et des Apo
lipoprotéines.
Ce qui rend les NV plus visibles et détectable par le
RES, surtout les macrophages résidents du foie (les cellules de Kupffer)
(Muller-Eberhard1988) « qui ont des récepteurs spécifiques
aux opsonines ».capable de déstabiliser certains NV. Elle permet
également de recruter des cellules phagocytaires par activation de
phénomènes inflammatoires suite à la libération
d'anaphylatoxines (Vonarbourg et al. 2006) [15].
Chapitre II Nanomédicament Et Cancer

28
6.2.1.2. Notion de furtivité
Le développement de la furtivité était
une percée majeure dans la prolongation de la durée de
circulation tout en minimisant l'absorption cellulaire non spécifique et
la captation par le système RES, de nombreuses études ont
été réalisées pour tester différentes
stratégies visant à limiter ce phénomène :
? On peut citer l'incorporation de Monosialoganglioside GM1
à la surface des NV. Cette stratégie vise à rendre les
biomimétique en imitation de Globules Rouge (Allen et al, 1987 ; Gabizon
et al, 1988).
? De nos jours la stratégie la plus répandue
reste cependant l'utilisation de chaîne de PEG [15]. qui
est un polymère hydrophile synthétique et
biodégradable« 2000 à 5000pm » structuré en
forme de BROSSE. Le revêtement de PEG forme une couche d'hydratation qui
retarde stériquement les reconnaissances RES par inhibition des
interactions hydrophobes électrostatiques avec les protéines
plasma [15].
Les ligands de ciblage sont souvent greffes sur les
extrémités des chaines de polymères présentes
à la surface des NP, afin que le ligand soit présent
au-delà la de la couronne de PEG. Il risquerait sinon d'être
masqué ou incorporé dans la couche de polymère, ce qui
rendrait sa présence inutile [10].
6.2.1.3. Franchissement des barrières
? Barrière endothéliale
Il existe trois types d'endothélium vasculaire : le
continu (sans pore), le fenestré ayant des pores entre (50 et 70 nm) et
les sinusoïdes ayant des pores de (0,1 à 3ìm). Les
fenestrés sont présents dans les reins et l'intestin grêle,
alors que les capillaires sinusoïdes sont retrouvées dans le foie,
la rate, les os et certaines glandes endocrines. La taille du NV est donc une
des raisons de son élimination par le foie plutôt que par les
reins [15].
Chapitre II Nanomédicament Et
Cancer

29
? Barriere Hémato
Encéphalique
Deux stratégies non invasives ont été
élaborées:
? La première consiste à augmenter la diffusion
passive d'un PA en le rendant plus hydrophobe. Cette méthode peut
améliorer de façon importante le franchissement de cette
barrière, mais n'est possible que pour peu de molécules (Sampath
et al. 2003).
? La deuxième stratégie consiste à
augmenter le transport du PA au travers des cellules. Cette augmentation peut
se faire :
? En favorisant un transport
aspécifique, comme rendre plus cationique une protéine
(Abbott et al. 2006, Hardebo et al 1985).
? Ou bien, elle peut se faire en
stimulant une entrée spécifique, comme celle de
la transferrine. Cette stratégie a déjà
démontré son efficacité in vitro et in vivo en utilisant
des NV (ciblage du récepteur de la transferrine) (Huwyler et al.
1996)[15].
6.2.2. Le système lymphatique
Les vaisseaux lymphatiques se trouvent dans l'ensemble du
corps à l'exception du cartilage de la cornée, du cristallin et
du système nerveux central. La nature même de la morphologie de
l'endothélium (avec de grands espaces) et la fragilité de
l'attachement des jonctions intracellulaires permet l'entrée des NP dans
la circulation lymphatique.
Le fluide lymphatique est filtré à travers les
noeuds lymphatiques en lien avec les macrophages qui phagocytent les agents
étrangers.
Les poumons et le tractus gastro-intestinal peuvent
être des sites d'accumulation des NP, surtout s'ils sont la voie
d'administration. Les reins, importants organes excréteurs, peuvent
accumuler des doses importantes de NP, surtout si celles-ci sont hydrophiles et
de petite taille. L'accumulation dans le coeur est généralement
étudiée à cause de son importance physiologique. Le muscle
est peu regardé car c'est un organe de très faible accumulation
bien qu'il représente 43 % du poids du corps chez la souris. La peau et
les os sont en général regroupes sous le terme de carcasse
[10].
Chapitre II Nanomédicament Et Cancer

30
6.3. La métabolisation
Certaines NP sont métabolisées dans les
lysosomes des macrophages du RES après avoir été
internalisées, d'autres subissent une hydrolyse dans l'environnement
aqueux. De nombreuses NP, notamment métalliques, ne sont pas
métabolisées par l'organisme et s'accumulent dans le corps, ce
qui favorise leur toxicité [10].
6.4. L'élimination
Suivant la composition des NP, l'excrétion peut se
faire sous forme modifiée (métabolites) ou sous forme
inchangée. Le foie et les reins sont les principaux organes responsables
de l'excrétion.
Concernant l'élimination rénale, surtout
retrouvée pour les NP de petite taille (< 5 nm) ou hydrophiles),
elles passent dans les urines suite à leur filtration
glomérulaire.
En dehors de sa fonction métabolique, le foie est
également une voie majeure d'excrétion pour les NP, notamment si
elles sont à base de lipides. L'excrétion se fait à
travers les hépatocytes via la voie de production de bile.
D'autres voies d'excrétion existent comme les poumons, le
lait ou la sueur.
7. Pharmacodynamie
« Accès au site d'action moléculaire
»
7.1. Les franchissements des membranes cellulaires
Lorsqu'un PA veut atteindre son site d'action
moléculaire, il aura au moins une membrane cellulaire à franchir,
Les PA vont avoir des capacités diverses pour franchir ce type de
barrière et le recours aux NV est une des nouvelles stratégies
permettant de faciliter ce franchissement (Akita et al. 2009)
[15].
7.1.1. Le franchissement complet de la membrane
Ce franchissement peut être direct par diffusion
à travers la bicouche de phospholipide, sinon il nécessite
l'utilisation de protéines membranaires, des facteurs de
déstabilisation des membranes, comme les lipides cationiques, par
diffusion passive ou active [15].
Chapitre II Nanomédicament Et Cancer

31
7.1.2. Le franchissement partiel de la membrane à
l'aide de vésicules
Ce type de franchissement ne permet pas aux PA d'accéder
directement au cytosol.
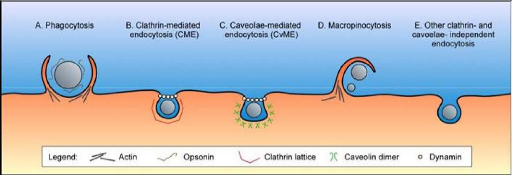
Figure 15: les principales voies de
franchissement des NV à travers la membrane cellulaire
[59].
Cependant il peut permettre à certains
d'accéder à leur site d'action. Les PA transportés peuvent
être alors beaucoup plus volumineux et ne sont donc pas
nécessairement libérés rapidement de leurs NV. En effet
ces vésicules peuvent fusionner ou mâturer pour délivrer
leur contenu dans différents compartiments cellulaires
[15].
? Phagocytose: concerne des particules de
tailles +/- importantes recouvertes d'opsonines.
? Macropynocytose: ressemble au
mécanisme de phagocytose cependant concerne des particules de petite
taille.
Ces deux mécanismes utilisent des protéines
d'actine pour réaliser l'exvagination de la membrane cellulaire.
? Endocytose :
? Mediée par la clathrine: c'est la voie la plus
utilisée par les NV. ? Médiée par les
cavéolés.
? Autres mécanismes d'endocytose indépendants.
Chapitre II Nanomédicament Et Cancer

32
7.1.3. Facteurs favorisant le franchissement
? Utilisation de molécules favorisant la
traversée:
+ Les molécules agissant directement sur la membrane.
+ Les molécules activant des mécanismes
cellulaires de franchissement.
+ Les molécules ayant un effet sur le milieu contenu dans
l'enceinte (éponges à protons).
? Utilisation de facteurs extérieurs physiques:
+ Une exposition à un champ électrique. +
Utilisation d'ultrasons.
+ Utilisation d'un champ magnétique
[15].
7.2. Les cheminements intracellulaires
7.2.1. Le hyaloplasme
Le PA ou le NV devra se mouvoir jusqu'à son site
d'action moléculaire, qu'il soit dans le hyaloplasme ou dans un organite
(ex : noyau). Or ce cheminement est freiné par le hyaloplasme,
c'est-à-dire le cytosol et le cytosquelette. des NV pouvant être
conçus pour améliorer le cheminement intracellulaire des PA
encore encapsulés dans les NV (Akita et al. 2009). Il est même
envisageable d'utiliser le cytosquelette pour véhiculer les PA dans la
cellule, comme certains ARNs qui utilisent le cytosquelette pour se
déplacer dans les oligodendrocytes (Ainger et al.1993)
[15].
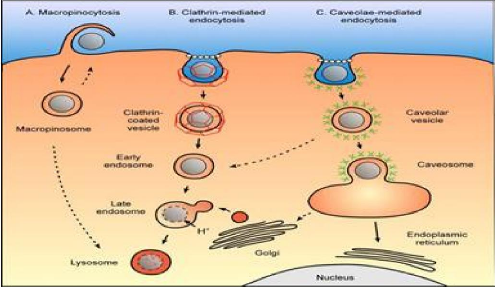
Chapitre II Nanomédicament Et
Cancer

33
Figure 16: le cheminement intra cellulaire des
NV [59].
7.2.2. Le trafic vésiculaire
Les vésicules intracellulaires se déplacent
grâce au cytosquelette. En conséquence les PA ou les NV contenus
dans ces vésicules vont cheminer de manière active dans le
hyaloplasme, cependant leur itinéraire sera alors dépendant de
ces vésicules et de leurs centres d'aiguillage. Ces itinéraires
et les paramètres les influençant peuvent être
différents selon le type de cellule et son activité.
La majorité des stratégies
développées, l'ont été pour éviter
l'orientation vers les lysosomes qui entraînent
généralement la dégradation des PA et des NV, pour
modifier l'itinéraire il faut :
? Connaître la destination naturelle de la
vésicule et donc le choix de la voie d'endocytose empruntée pour
entrer dans la cellule.
? La destination souhaitée « l'orientation
déterminée dans les centres d'aiguillages »
[15].

CHAPITRE III :
NANOMEDICAMENT
ET CANCER
ESSAIS PRECLINIQUES
Chapitre III Essais
Précliniques

34
Il est possible de construire des nanotechnologies
« intelligentes », car nous disposons aujourd'hui d'une grande
variété de matériaux et de biomatériaux qui peuvent
être mis en oeuvre suivant des procédés astucieux. Il est
ainsi possible de préparer des NV de morphologie très
variée : liposomes, nanoparticules à base de polymères
systèmes matriciels (nanosphères) ou réservoirs
(nanocapsules), micelles, NP d'oxyde de fer, dendrimères, ...etc.
(Fig17) [16].
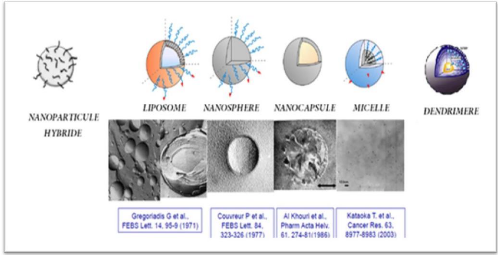
Figure 17: Architecture des nanotechnologies
utilisées pour la vectorisation des médicaments
[16].
Tous ces NV sont constitués de deux composants
principaux :
Un « coeur » et une « couronne »
qu'il est possible d'équiper de fonctionnalités adaptées
à l'objectif thérapeutique.

35
Chapitre III Essais
Précliniques
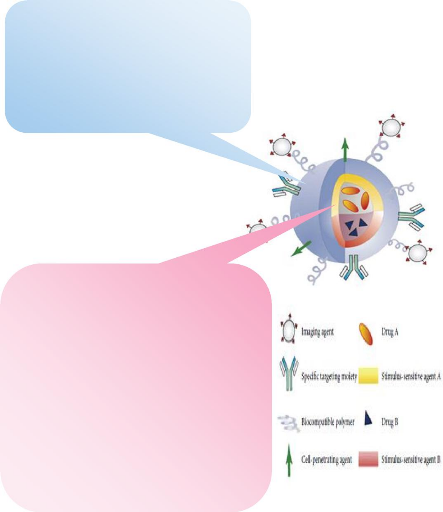
La « couronne »:
· La furtivité :
consiste à équiper la couronne de polymères hydrophiles et
flexibles comme les polyéthylènes glycols « PEGylation
»afin d'obtenir un effet de répulsion stérique.
· Le ciblage : grâce
à des ligands capables de reconnaître des récepteurs
spécifiques afin de pouvoir délivrer les médicaments
qu'ils transportent à l'intérieur de la cellule cible.
Le « coeur »:
· Le « coeur » des NV permet d'encapsuler des
molécules biologiquement actives pour les rendre «Invisibles»
vis- à-vis des mécanismes de résistance.
· permet aussi l'encapsulation de molécules
fragiles« Bio
mimétiques », comme l'ADN « qui ne serons
pas élucidé dans ce mémoire ».
· Il est aussi possible d'associer, au sein d'un
même NV, deux ou plusieurs molécules agissant sur des cibles
différentes mais complémentaires d'une même pathologie.
· L'utilisation de matériaux «
intelligents » et sensibles à un stimulus physique ou chimique
permet de contrôler la libération du PA dans le temps et dans
l'espace.
Figure 18: Schéma représentatif
des deux parties constituant le NV.

36
Chapitre III Essais
Précliniques
1. Méthodologie de sélection
Une recherche d'articles publiés au cours de la
période 2000-2013 et seulement quelques articles des années 90
ont étaient retenus ayant était pertinent et importants,
concernant les études précliniques cette recherche a
été effectuée sur un certain nombre de bases de
données. Ainsi ont été plus particulièrement
consultées : Science direct- Springer link - Annual reviews
-Hindawi publishing corporation - National cancer institute -RSC publishing -
Pubmed -BMJ Journals -Drug and therapeutics bulltin -Springer
ref. En utilisant les mots clés suivant :
Nanomedicine cancer drug delivery system state of the art.
Ces derniers ont été associés à
chacun de ces caractères : resistance- squalen -stealthness
temperature,magnetic,PH stimuli responsive -blood brain barriere -clinical
trial- combination.
|
L'augmentation du nombre de brevets et de publications s'est
considérablement accélérée depuis 2000 (Fig.19), au
départ on obtenus près de 117550 publications, alors on a pris un
échantillon de 588 études « complètes et non
répétées »aléatoirement puisque l'analyse est
manuelle et la durée de recherche est très courte.
On a divisé le travail en 4 étapes celle-ci
étant la première, chaque étape avait ces critères
d'exclusions (thérapie génique, imagerie,...) et d'inclusion,
aboutissant ainsi au nombre final inclus dans cette étude N=28, Les
détails sont représenté dans la figure20.
|
|
|
Figure 19: Le nombre des publications sur les
nanomédicaments entre1940 et 2010.
|
Concernant les données des essais cliniques ainsi que
les Nm approuvés et ayant eu une autorisation de mise sur le
marché, nous avons taché à ce que les bases de
données soit officiels :
? USA : en utilisant la page officielle
du FDA (Food and Drug Administration).
? Europe : en utilisant la page
officielle EMA (European Medicines Agency).
L'autorisation de mise sur le marché des NM contre le
cancer en Algérie n'a pu être confirmé ni infirmée
à cause d'un manque d'informations dans le domaine et de sources
officiels.
Chapitre III Essais
Précliniques
Échantillonnage
Identification
Criblage
Inclusion
Figure 20: Le diagramme des étapes de
sélection des études incluses dans le mémoire.
nanocristaux, nanotubes de carbone,
nanorobots)
N=128
Etudes systématiques N=20
Etudes anciennes « avant
N=37
synthèse et préparation
Absence de preuves
matériels visuels(coupes
histologiques
-
volume tumoral-
observations
Autres (fullerenes,
microscopiques )
Imagerie N=45
N=42
2000 »
N=11
N=117551
Science direct N=4148
Springer link
N=873
Annual reviews N=220
Hindawi publishing corporation
N=10
National cancer institute N=29
RSC publishing N=369
Pubmed
N=124
BMJ Journals N=109000
Drug and therapeuticsbulltin
N=2745
Springer ref N=33
N=226
Squalene N=8
Resistance aux cancers N=13
Furtivité N=21
Association de plusieurs
principes
actifs N=4
bHE/BC N=34
stimuli responsive
? température N=6
? PH N=17
? Champs magnétique N=1
Essais cliniques N=87
Ciblage actif N=23
N=28
Études incluses
N=588 études
N=174
analysant le volume tumorale
et le taux de survivants
N=98
Essais cliniques non pris-
en considération dans les
dossiers AMM des NM
commercialisé choisis
numériques scientifiquement
Thérapie génique N=23
quantifiables (courbes
Etudes générales
N=156
Absence de données
graphes tableaux)
N=10
37
Chapitre III Essais
Précliniques

38
2. Les études précliniques prouvant les
propriétés de la couronne
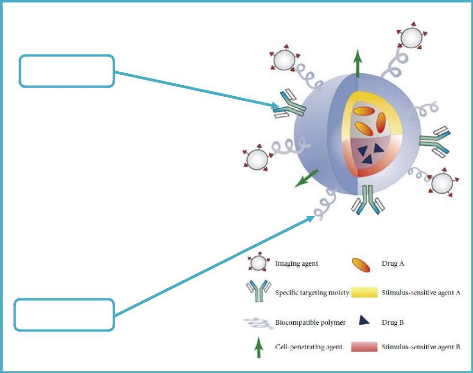
La furtivité
Le ciblage
Figure 21: Schéma représentatif
des principales propriétés de la couronne de NV.
Chapitre III Essais Précliniques

39
2.1. La Furtivité
Afin d'éviter l'opsonisaton des NV par les macrophages
« cellules de kupffer » dans le foie et la rate on peut
équiper ces NV de polymères hydrophiles et flexibles comme les
PEG, on parle alors de « PEGylation »qui, par un effet de
répulsion stérique, et vont empêcher l'adsorption des
protéines plasmatiques à la surface des NV
[16].
Dès le début des années 1990, les
équipes de Dimitri Papahajopoulos (Université de San Francisco,
USA) et d'Alberto Gabizon (Hadassah Medical Center, Jérusalem) ont
montré que des liposomes PEGylés, chargés en doxorubicine
(DOX), avaient une efficacité remarquable dans le traitement de tumeurs
expérimentales solides. Cette découverte a abouti à la
mise sur le marché du Doxil [16].
Ainsi l'équipe de Donatella Paolino en Italie a
amélioré l'activité antitumorale in vitro de la
Gemcitabine (GEM), agent anticancéreux rapidement désaminé
au métabolite inactif, en la piégeant dans des LUL
pégylés. Récemment (2010), ils ont étudié
l'efficacité in vivo de la formulation L-GEM Gemcitabine
liposomale (5 mg /kg) par rapport au produit commercial antitumorale
Gemzar® (50 mg /kg) sur un modèle de xénogreffe du cancer de
la thyroïde anaplasique [17].
? Liposomes unilamellaires PEGylés
chargé en Gemcitabine vs GEMZAR® in vivo [17].
L'enquête pharmacocinétique du médicament
démontre que les liposomes favorisaient l'accumulation du PA à
l'intérieur de la tumeur et ils augmentaient sa demi-vie plasmatique. En
outre, aucun signe de toxicité sanguine n'a été
observé.
L'analyse histologique des masses tumorales provenant
d'animaux soumis à divers traitements ne montrait aucune
différence significative dans l'organisation du tissu tumoral,
démontrant ainsi qu'aucune variation dans le profil pharmacodynamique de
la drogue n'a eu lieu après son encapsulation dans des liposomes
pégylés.
Après 4 semaines de traitement, le volume des tumeurs
chez les souris traitées avec L-GEM (5 mg /kg) et Gemzar® (50 mg
/kg) a été comparable (0,9cm3), tandis que celle des souris
traitées avec une solution saline était plus élevé
(2,3 cm3). Le traitement de Gemzar® (5 mg /kg) à la même dose
de médicament L-GEM n'a donné aucun effet anticancéreux
efficace et aucune différence significative par rapport au groupe
témoin (Figs. 23B et 22).
Chapitre III Essais
Précliniques
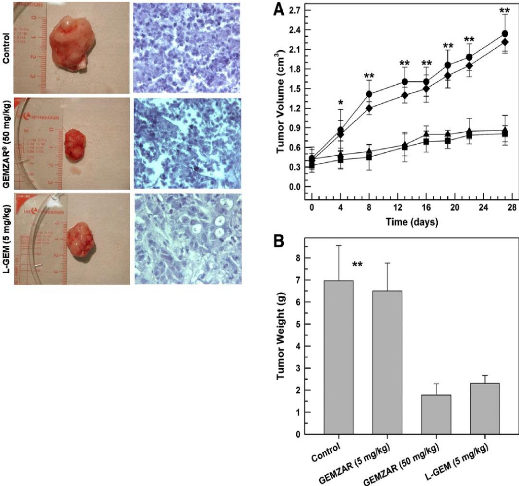
Figure 22: Histological analysis of
neoplastic masses excised from immunodeficient NODSCID mice bearing human
anaplastic thyroid xenograft tumors following their scarification at the end of
the experiments. Sections with a thickness of 7-10 pm were sliced and stained
with the eosin B/hematoxylin method. The photos of the analyzed tumor masses
were reported close to the respective histological slices. Animals were treated
with saline (control group), GEMZAR® (50 mg/kg) and L-GEM (5 mg/kg).

40
Figure 23: In vivo antitumoral
effects of GEMZAR® (5 mg/kg and 50 mg/kg) and L-GEM (5 mg/kg) in
immunodeficient NOD-SCID mice bearing human anaplastic thyroid xenograft
tumors. Animals were treated i.v. (200 pl) every three days for four weeks.
Variation of tumor volume (panel A) as a function of both type and duration of
treatment. Symbols: , control group (treatment with saline); + (5 mg/kg) and ?
(50 mg/kg), treatments with GEMZAR®; , treatment with L-GEM. The blank
group (treatment with unloaded liposomes) showed similar values to those
resulting in the control group (data not reported). At the end of
experimentation, animals were sacrificed and the tumor masses were excised and
weighed (panel B). No significan difference was observed between control and
blank groups. Results are the mean of three different experiments#177;standard
deviation. Statistical analysis was performed by one-way ANOVA: *Pb0.05;
**Pb0.001.
Chapitre III Essais
Précliniques
2.2. Le ciblage
Si les nano vecteurs « furtifs » permettent
l'extravasation sélective au niveau tumoral, ils nécessitent
néanmoins, dans certains cas, d'être équipés de
ligands capables de reconnaître des récepteurs spécifiques
afin de pouvoir délivrer les médicaments qu'ils transportent
à l'intérieur de la cellule cible. À titre d'exemple,
citons [16] :
? Des Ligands de cellules tumorales
différentielles ciblés par des anticorps anti HER2 (Herceptin
®) et anti-CD20 (Mabthera ®) couplé à des
NP.
University of Geneva, University of Lausanne
Switzerland 2007 [18].
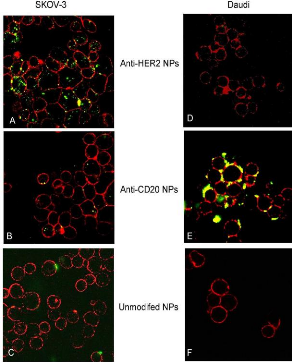
Dans cette étude ,295 anticorps monoclonaux (mAb)
anti-HER2 et 557 anti-CD20, respectivement, ont été couplé
de manière covalente avec des NP (250 nm). L'interaction
spécifique entre des cellules tumorales et mAb-NP a été
déterminée par microscopie confocale en utilisant deux
lignées cellulaires: SKOV-3 cellules
cancéreuses ovariennes humaines
(surexprimant HER2)
et Daudi les cellules de lymphomes surexprimant (CD20). Les résultats
ont montré le ciblage sélectif de mAb-NP aux cellules tumorales
surexprimant l'antigène spécifique. Les (anti-HER2 NP)
étaient internalisé efficacement. En outre, on a montré
une localisation cellulaire différente des NP en fonction du type
d'interaction anticorps antigène impliqué (Fig24).

41
Figure 24: Specific interaction of mAb-NPs in
SKOV-3 and Daudi cells studied by confocal laser scanning microscopy (objectif:
63×). Cell membranes were stained in red with Concanavalin A
AlexaFluor® 594 conjugate, whereas NPs were stained in green with DiO. The
cells were incubated with 1mg/ml mAb labeled NPs or non-conjugated NPs at 37 ?C
for 6 h. (A and D) Anti-HER2 NPs; (B and E) anti-CD20 NPs; (C and F) unmodified
NPs. Note: In (A) the clear distinction of red membranes and green
anti-HER2 NPs, since the latter are internalized and therefore dissociated from
the cell membrane, while in (E) the binding of anti-CD20 NPs to the cell
membrane leads to the superposition of green and red fluorescence and
appearance in yellow.
Chapitre III Essais
Précliniques
? Des NP de poly (lactide-co-glycolide)
décoré de Folate-vitamine E (TPGS) pour la
livraison ciblée de Doxorubicine. National
University of Singapore 2007 [19].
Figure 25: (a) MCF-7 and (b) C6 cancer cell
viability of DOX in free form or formulated in the 0% , 20%,33% and 50%
TPGS-FOL NPs (n 1/4 6).
Dans cette étude, des NP conjugué à la
DOX et le poly (lactide-coglycolide) et vitamine E TPGS (DOX-PLGA-TPGS)
conjugué ont été synthétisé par
l'équipe de Z. Zhang pour cibler des tumeurs riches ayant comme
récepteur surexprimé le folate. Les NP (350nm) ont montré
un effet significatif in vitro sur les MCF-7 (les cellules du cancer du sein)
et (des cellules tumorales du cerveauC6), ce qui a entraîné une
cytotoxicité supérieure et une meilleure absorption cellulaire en
comparaison avec la DOX libre. Les résultats impliquent que les NP
décorés en folate (TPGS-FOL et DOX-PLGATPGS) pourraient avoir un
grand potentiel pour l'utilisation des chimiothérapies
ciblées (Fig25).
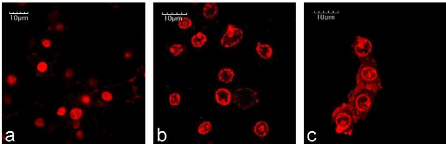

42
Figure 26: Confocal laser scanning microscopy
(CLSM) of C6 cancer cells incubated with DOX (a) in free form, or formulated
(b) in the NPs of noTPGS-FOL component in the blend matrix (i.e., the 0%
TPGS-FOL NPs) or (c) in the 50% TPGS-FOL NPs for 3 h at 37 1C.
Chapitre III Essais
Précliniques

43
? Cytotoxicité accrue des PEG-liposomes
chargés en Doxorubicine et modifiés
par des anticorps monoclonaux 2C5 in vitro.
Northeastern University USA 2007 [20].
L'équipe d'A. Elbayoumi a lié des Liposomes
pegylé chargé en Doxorubicine (Doxil) avec l'anticorps monoclonal
2C5 nucléosome spécifique (mAb 2C5) pour la reconnaissance d'une
large variété de cellules tumorales par les nucléosomes
liés à la surface des cellules. Ils ont démontré
une augmentation de la liaison in vitro et l'intériorisation
par plusieurs lignées de cellules cancéreuses (murine LLC, 4T1, 6
et humaines BT-20, MCF-7 et PC3), par cytométrie en flux (FACS) et la
microscopie confocale. En conséquence, L'internalisation
spécifique de l'anticorps monoclonal 2C5-Doxil TM dans le cytosol, ainsi
que la localisation nucléaire de la charge de médicament,
à l'intérieur des cellules cancéreuses a donné une
cytotoxicité nettement plus élevé, y compris celles
résistantes à la DOX (Fig27).
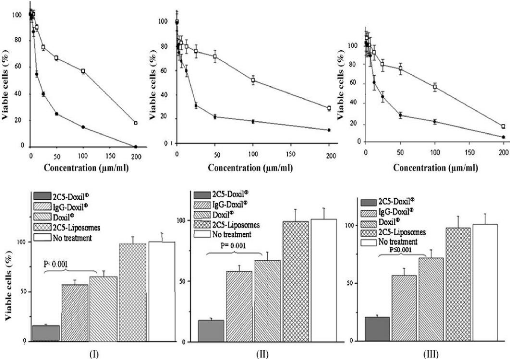
Figure 27: In vitro cytotoxicity
results using different cancer cell lines. Upper panels -cytoxic effect of
different concentrations of IgG-DoxilTM () and mAb 2C5-DoxilTM () on cancer
cells; lower panels - cytotoxicity of various preparations at the fixed
concentration of IgG-DoxilTM and 2C5-DoxilTM (as 100ug/ml free doxorubicin) and
same concentration of 2C5-liposomes (as lipid). 4T1 murine cell line, I; murine
6 cell line, II; and human PC3 cell line, III.
Chapitre III Essais
Précliniques

44
? Administration ciblée de Paclitaxel en utilisant
des NP de poly (lactide)
décorées de folate vitaminE (TPGS).
Feng National University of Singapore 2008 [21].
L'équipe de J. Pan a synthétisé des NP de
copolymères pour la chimiothérapie ciblée avec le
Paclitaxel conjugué au folate pour le ciblage. L'efficacité
d'encapsulation de médicaments et la libération du
médicament in vitro ont été mesurées par
une chromatographie en phase liquide de haute performance (HPLC).la formulation
NP a un grand avantage par rapport au PA libre à atteindre un meilleur
effet thérapeutique, qui a augmenté de 8,68% pour les
MCF-7cellules, le ciblage par les folates peut favoriser
considérablement la délivrance du médicament dans les
cellules cancéreuses correspondantes et renforcer ainsi son effet
thérapeutique (Fig28).
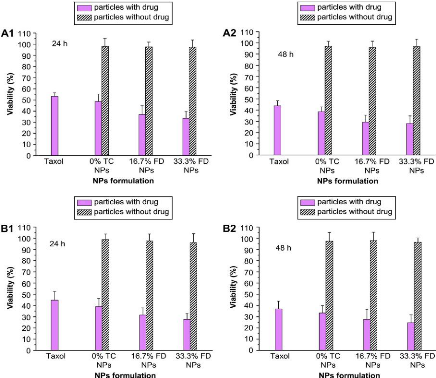
Figure 28: In vitro viability of (A)
MCF-7 and (B) C6 cells after 24 h (A1, B1) or 48 h (A2, B2) treatment of
paclitaxel formulated in the 0% TC NPs, 16.7% FD NPs,33.3% FD NPs or in its
current clinical dosage form Taxol® at the
same 25 mg/ml drug concentration at 37 °C (n 1/4 6).
Chapitre III Essais
Précliniques
? L'Efficacité de micelles
chargées de Doxorubicine ciblé par des
galactopeptides
contre les hépatomes. Chinese Academy of
Sciences 2013 [22].
Des micelles de Polymères portant un groupe galactosyl
sont utilisées par l'équipe de J Ding pour l'administration
ciblée de DOX aux cellules d'hépatome (HepG2 et SMMC7721) avec
récepteur asialoglycoprotéine (ASGP-R) qui sera comparé
avec des NP pégylées et DOX libre:
? In vitro, la libération de DOX s'est
accélérée grâce à la reconnaissance entre le
ligand galactose et les cellules ASGP-R de HepG2, l'endocytose des NP a
été considérablement favorisé, ce qui a
été démontré par microscopie confocale et la
cytométrie en flux.
? In vivo, en utilisant un HepG2 modèle de
xénogreffe de souris nude .Le volume de la tumeur et le poids corporel
ont été contrôlée sur une période de
traitement de 11 jours, les NP galactosylées étaient les plus
efficaces pour supprimer la croissance de la tumeur par rapport à la DOX
libre et NP pégylées. L'efficacité antitumorale
inférieure des NP pégylées était probablement
attribuée à sa mauvaise absorption cellulaire par les cellules
HepG2, indiquant la
nécessité d'introduire le ligand de ciblage
(Fig29).
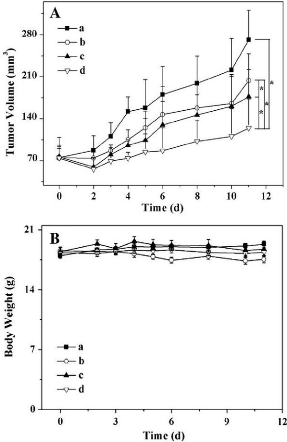

45
Figure 29: Antitumor efficacies in vivo
(A) and body weight changes (B) of HepG2 human hepatoma xenografted female
BALB/c nude mice treated with PBS (a), free DOX (b), and nanomedicines from
PMLG7-b-PLGA22 (c) and PGLG7-b-PLGA22 (d). Each formulation was administered on
days 0, 3, 6 and 9 by tail-vein injection with a dosage of2.0 mg DOX per kg
body weight for injection of free DOX and nanomedicines. Data were presented as
mean#177;standard deviation (n=6) (*pb0.001).
Chapitre III Essais
Précliniques

46
La principale difficulté d'application du ciblage actif
réside dans la relative rareté de ligands spécifiques,
Afin de contourner cette limitation, l'équipe de Kohane propose une
nouvelle idée innovante et assez pertinente en sortant du principe
générale du ciblage par contradiction [16].
? Le ciblage des NP par la lumière. MIT &
Harvard Medical School 2010 [23].
Les auteurs de cette publication ont pu recouvrir les
nanoparticules non pas par des molécules ciblant spécifiquement
un type de cellules mais au contraire par des peptides qui permettent
l'accrochage des nanoparticules sur un grand nombre de types dans un premier
temps et à inhiber l'interaction de ce peptide, puis à le rendre
actif seulement dans la zone à traiter.
Cette stratégie a été validée in
vitro en fonctionnalisant des nanoparticules commerciales par le peptide (des
acides aminés : GGGGYIGSR Alors que YIGSR est connu pour interagir avec
les intégrines ß 1 présentes sur la quasi-totalité
des types cellulaires, le greffage du4,5-diméthoxy-2-nitrobenzyl (DMNB)
sur ce peptide inactive sa capacité à adhérer sur
l'intégrine Ainsi l'illumination de cellules en présence des
particules couvertes par le peptide inactif favorise l'accrochage des
nanoparticules sur les cellules en raison du départ du groupement
inhibiteur DMNB induit par les photons UV .
L'équipe de Kohane a donc réussi à
développer une stratégie permettant un ciblage actif et
spécifique commandé par la lumière. En raison de son
caractère universel cette preuve de concept obtenue par des
expériences in vitro mérite d'être validée
in vivo. Ainsi pour Atteindre un tel objectif nécessite
l'utilisation de fibres optiques pour acheminer la lumière dans la zone
à traiter (Fig30).
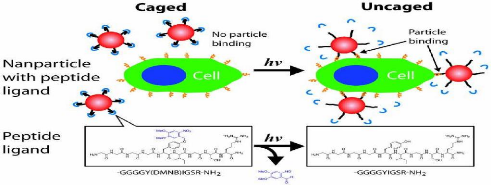
Figure 30: The photo-targeted nanoparticle
concept. A non-specific ligand on the surface of the nanoparticles is caged,
rendering it non-functional. Upon illumination, the caging group is released,
the ligand is activated and the nanoparticle can bind to the illuminated
tissue. The lower portion of the figure shows the chemistry of the targeting
moiety as it relates to the events schematized above. The GGGGYIGSR-NH2 peptide
is caged on tyrosine with a 4, 5-dimethoxy-2-nitrobenzyl group (DMNB, Blue).
After illumination the caging group is released and the targeter becomes
active.
Chapitre III Essais
Précliniques
2.3. Le ciblage des cancers du cerveau à travers la
barrière hémato encéphalique.
Grace au ciblage on a pu parvenir à traverser la BHE
pour le traitement des cancers du cerveau .Le Neuroblastome (NB) est la tumeur
solide extra-crânienne la plus fréquente chez l'enfant. Dans les
stades avancés de la maladie, le pronostic est médiocre et les
traitements ont une efficacité limitée cependant, les NM peuvent
apporter une solution à cet échec thérapeutique
[16].
? Fenretinide Immunoliposomal: un nouveau
médicament anti-tumorale du neuroblastome humain.
L. Raffaghello Children's Hospital Italy&
University of South California USA 2003 [24].
Le fenretinide de rétinoïde synthétique
(HPR) induit une apoptose dans NB et des lignées cellulaires de
mélanome. On a signalé dans une potentialisation in vitro des
effets cytotoxiques sur les cellules de mélanome lorsque le PA est
incorporé dans des immunoliposomes GD2 ciblées
(anti-GD2-SIL-HPR).
In vitro, anti-GD2-SIL-HPR a présenté
une sélectivité accrue et l'efficacité dans l'inhibition
de la prolifération cellulaire du NB par l'induction de l'apoptose en
comparaison avec le PA libre.
In vivo, dans un modèle métastatique de
NB l'anti-
GD2-SIL-HPR inhibe complètement
le
développement de métastases macroscopiques et
microscopiques par rapport aux témoins. Cependant, l'effet antitumorale
similaire, mais nettement moins puissant a été observé
également chez les souris traitées avec immunoliposomes anti-GD2
sans HPR (anti-GD2-SIL-vierge) ou des anti-GD2 mAb seul. En outre, les
résultats démontrent clairement que, même si anti-GD2 mAba
eu un effet anti tumoral fort dans ce modèle in vivo, 100% de
curabilité a été obtenu seulement après un
traitement par anti-GD2-SIL-HPR (Fig31).
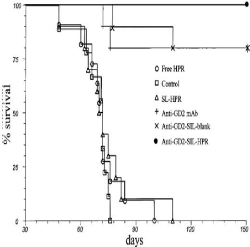

47
Figure 31: Kaplan-Meier survival curves of
CD1 nude/nude mice treated with different liposomal HPR formulations. The
animals (n 1/4 10 animals/group) were injected i.v. with 3 £ 106 HTLA-
230/mouse, and treated after 4 h with different HPR formulations for 5 days.
Treatments: control, HEPES Buffer pH 7.4 (); free HPR, 15 mg/Kg/total dose ();
SL-HPR, 15 mg/Kg/total dose(?);anti-GD2 mAb, 2 mg mAb/Kg/total dose mAb ( + );
anti-GD2-SIL-blank, 2 mg mAb/Kg/total dose ( X ); anti-GD2-SIL-HPR, 15 mg
HPR/Kg/total dose and 2 mg mAb/Kg/total dose (). The experiment has been
repeated three times with similar results.
Chapitre III Essais
Précliniques
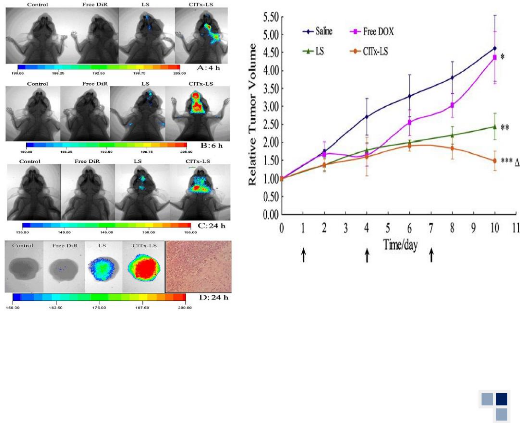
Figure 33: Anti-tumor efficacy of various DOX
formulations evaluated by relative tumor volume. Nude mice bearing U87 armpit
tumor were given physiological saline, free DOX, DOX-loaded LS and DOX-loaded
ClTx-LS of 5 mg/kg DOX via tail vein every 3 days for 3 times, respectively.
Each dose was indicated by a bold arrow. Relative tumor volume=tumor
volume/primary tumor volume. Data represented as mean#177;SD (n=6). *PN0.5,
**Pb0.005, ***Pb0.001 vs saline; ÄPb0.005 vs LS.
48
Figure 32: In vivo fluorescent
images of U87 tumor bearing mice of orthotopic model given physiological
saline, free DiR, DiR-loaded LS, and DiR-loaded ClTx-LS via tail vein, 4 h (A),
6 h (B) and 24 h (C) after administration, respectively, and ex vivo
fluorescent image of brains (D) after 24 h. Rightmost figure: H&E
stained excised brains of the mice after in vivo imaging, exhibiting
the infiltrative growth pattern of glioma cells.
? Ciblage des Canaux de chlorure des gliomes du
cerveau par des Liposomes chargés en doxorubicine modifiés par la
chlorotoxin.
Peking University, ChinaY. Xiang 2011 [25].
Le chlorotoxine(CLTX), est un peptide dérivé de
scorpion, et qui présente une spécificité
élevée aux gliomes, était fixé au liposomes100 nm
chargé de DOX CLTX (DOX) afin de cibler le gliome
cérébral. ? In vitro la distribution uniforme, l'haute
efficacité d'encapsulation et la capacité de charge
adéquate des sondes fluorescentes et médicament
anticancéreux a été démontré
quantitativement par le spectro-photo-fluoromètre et la
cytométrie en flux et qualitativement par la microscopie confocale ainsi
CLTX facilite l'absorption et la cytotoxicité des liposomes pour les
trois lignées cellulaires de gliome et une endothéliale
(Fig32).
? Chez les souris BALB /c portant des xénogreffes de
tumeur U87.Les liposomes CLTX modifié montré plus d'accumulation
dans les tumeurs intracrâniennes, une inhibition de la croissance
tumorale élevée et une toxicité inférieur du sang
(Fig33).
Chapitre III Essais
Précliniques
? Liposomes chargés de Doxorubicine
modifiés par la Lactoferrine pour le traitement
des gliomes. Sichuan University chinaH. Chen
2011[26].
Dans cette étude, des liposomes procationique
chargé de la DOX et modifiés par la lactoferrine (DOX-LF-PCL) ont
été développé, l'effet thérapeutique pour le
gliome a été évaluée.
? In vitro, Le profil d'absorption de diverses
formulations DOX par le cerveau « cellules endothéliales BCEC et
des cellules de gliomeC6 » ont été étudiés par
le microscope confocal à balayage et cytométrie de flux
(Fig34).
? In vivo, Un modèle de tumeur
intracrânien chez le rat a été utilisé. Cinq groupes
de rats porteurs d'un gliome (n total = 50) ont été soumis
à trois cycles de 2,5 mg / kg de DOX dans différentes
formulations ou une solution saline normale (NS) et analysées
(Fig35).
Les résultats ont montré que, par rapport
à la solution DOX, les liposomes chargés de DOX (DOX-Lips),
DOX-PCLs et DOX-LF-PCLs ont montré une amélioration des
performances de l'efficacité d'absorption dans BCEC et des cellules
C6.
DOX-LF-PCLs pourrait considérablement prolonger le temps
de survie.
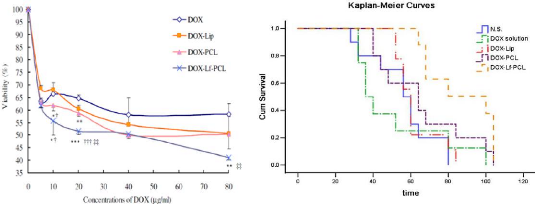

49
Figure 34: Antiproliferative curve of various
DOX formulations against C6 (n = 3, /P < 0.05, /P <
0.01, /P < 0.001 versus the DOX solution treatment; _P <
0.05, ___ P < 0.001 versus the conventional liposome treatment; __P <
0.01 versus the PCLs treatment, respectively).
Figure 35: Percentage of survival
(Kaplan-Meier plot) of rats with intracranially transplanted glioma C6 after
intravenous injection of 2.5 mg/kg DOX each on days 3, 6 and 12 using one of
the DOX preparations.
Chapitre III Essais
Précliniques

50
? Doxorubicine encapsulé par des
Dendrimeres PEGylés et conjugués avec RGD contre
le gliome, in vitro et in vivo.
Fudan University, China L. Zhangis2011 [27].
Arg-Gly-Asp (RGD) se sont des peptides ayant été
identifiés pour une forte affinité avec l'intégrine atb3
(molécule d'adhésion particulièrement connu pour son
rôle dans la progression du cancer et est
surexprimé dans les mélanomes, glioblastome, des
ovaires, du sein et de la prostate) dans cette étude on l'a
conjugué avec des Dendrimeres poly amido amine pégylé
(PAMAM) encapsulant la (DOX). (RGD-PPCD).
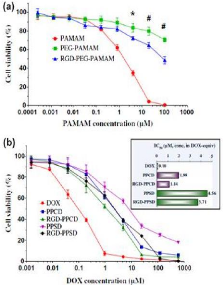
Figure 36: In vitro cytotoxicity
against C6 cells after 60 h of incubation. (a) PAMAM dendrimer and the modified
PAMAM conjugates, /P < 0.05; #P < 0.01, as compared with PEG-PAMAM at the
same concentration; (b) DOX, PPCD, RGD-PPCD, PPSD, and RGD-PPSD conjugates
(insert: IC50 values of free DOX and the DOX-polymer conjugates after 60 h of
incubation). Data were expressed as mean #177; standard deviation (n = 3).
? In vitro, la (RGD-PPCD) améliorait la
cytotoxicité à la suite de l'absorption cellulaire accrue du RGD
conjugués modifié par cellules C6 (Fig36).
? In vivo, l'activité antitumorale et la
biodistribution ont été étudiés dans un
modèle murin orthotopique de gliome C6 .En comparaison avec une solution
DOX libre, tous les conjugué ont prolongé la demi-vie et une plus
grande accumulation dans la tumeur au cerveau que dans tissu normal. RGD-PPCD a
été 2 fois plus accumulé dans la tumeur, il
présentait les durées de survie plus longue parmi tous les
groupes de traitement (Fig37).
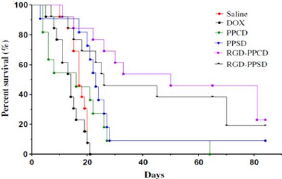
Figure 37: In vivo effects of DOX
solution and DOX-polymer conjugates after intravenous administration at a dose
of 7.5 mg DOX-equiv /kg on the survival of brain tumor-bearing ICR mice.
Saline, DOX, RGD-PPCD, and RGD-PPSD: n = 13; PPCD and PPSD: n = 11. (For
interpretation of the references to color in this figure legend, the reader is
referred to the web version of this article).
Chapitre III Essais
Précliniques
· Des dispositifs Supramoléculaires pour
améliorer le traitement des maladies
cérébrales. University `Magna
Græcia' of Catanzaro Italie Donatella Paolino 2011 [28].
Il a été montré que les liposomes
cationiques, du 1,2-dioléoyl-3-triméthylammonium-propane
(DOTAP),le 1,2-dioléoyl-sn-glycéro-3
phosphoéthanolamine(DOPE), sensible au pH , PEGylés
conjugué au diorthoester (POD)lipides, FITC-dextran-lysine, sont
rapidement accumulés dans les cellules du cerveau après la
perfusion .La répartition spatiale des liposomes dans le cerveau a
été étudiée en utilisant des liposomes
fluorescents. Les résultats obtenus en utilisant un scanner fluorescent
et la microscopie confocale à balayage laser (CLSM) ont montré
que :
· Les liposomes peuvent diffuser dans les
différents compartiments de matière grise, CLSM a souligné
le fait que les liposomes revêtus de macromolécules de dextran
diffusée dans une plus grande zone du cerveau par rapport aux liposomes
non revêtus.
· Les liposomes chargés positivement ont
été retenues au niveau du site de perfusion à
l'égard de ceux neutres ou négativement chargé (Fig38).
Une autre technique utilisée pour évaluer la
répartition des liposomes dans le parenchyme cérébral en
utilisant l'Imagerie par résonance magnétique en temps
réel (MIR).pour quantifier la répartition du volume
cérébral de NP. Gadotéridol (GDL), un complexe de
molécules de gadolinium utilisé comme un agent de contraste, est
encapsulé dans des liposomes comprenant des phospholipides neutres, du
cholestérol et PEGylé. Dans les expériences in
vivo, la répartition des liposomes GDL-chargés dans le tissu
cérébral de rat est immédiatement obtenue (Fig39).
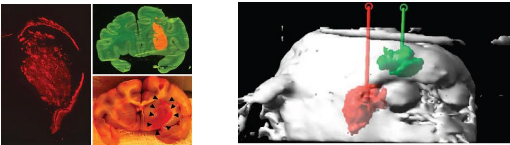

51
Figure 38: Extensive distribution of
fluorescent liposomes in CNS. (a) Almost complete coverage of rodent striatum
by a 20-2l liposome infusion; (b) distribution visualized by UV light in
primate putamen after 66-2l infusion; (c) view of liposome distribution in
putamen immediately after infusion procedure.
Figure 39: 3D reconstruction of primate
gadoteridol (GDL) infusion. 3D reconstruction of Vd demonstrates the
relationship between GDL infusion and brain structures, and also allows
volumetric measurements. Future applications are likely to use this feature for
planning purposes of distribution in vivo.

52
Chapitre III Essais
Précliniques
? Le transport de Doxorubicine à travers la
barrière hémato-encéphalique par des NP.
Goethe-University Germany& Nanosystem Ltd
Russia 2012 [29].
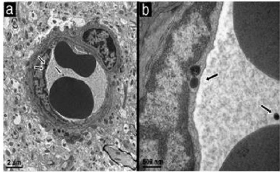
Figure 40: Micrographs of the cortex region
of SV 129 mice 15 min after injection of Apo Emodified nanoparticles. The
nanoparticles (dark spheres indicated by arrows) were seen inside the
endothelium cells (a and b). (a) shows a cross section of a blood vessel in the
cortex region with two nanoparticles in the endothelium cell and one
nanoparticle still in the lumen of the vessel. (b) shows a higher magnification
of the same micrograph.
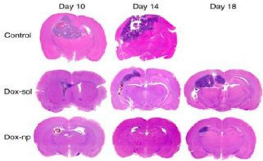
La livraison de médicaments, qui ne sont
généralement pas capables de traverser la BITE, dans le cerveau a
été confirmée par les études de biodistribution et
des dosages pharmacologiques
chez les rongeurs(Fig40).
En outre, la présence de
NP dans le parenchyme cérébral a été
visualisée par microscopie électronique. Les NP polymères
biodégradables chargées en DOX et injectés par voie IV,
ont été utilisés avec succès afin d'inhiber
significativement le
glioblastome expérimentale (Fig41).
Ces
données, ainsi que la possibilité d'utiliser des NP pour la
livraison de protéines et d'autres macromolécules à
travers la BITE, suggèrent que cette technologie est très
prometteuse pour le traitement non invasif des maladies du système
nerveux central (Fig42).
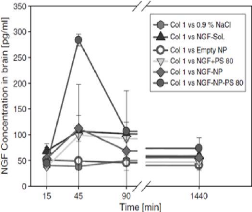
Figure 41: Inhibition of rat 101/8
glioblastoma growth in rats after treatment with doxorubicin-loaded PBCA
nanoparticles. The 101/8 glioblastoma was implanted into the brain hemisphere
of Wistar rats. Untreated animals (Control) and animals treated by intravenous
injections of doxorubicin (3×1.5 mg/kg on days 2, 5, and 8) in form of a
solution (DOX-sol) or bound to polysorbate 80-coated PBCA nanoparticles
(DOX-NP+ PS 80) were sacrificed at the indicated time points. The
haematoxylin-eosin staining of representative brains is displayed. Note the
decreased tumor size in the DOX-sol and especially the DOX-NP+PS 80 group.
Figure 42: NGF concentrations in murine brain
after i.v. injection of different NGF preparations: Col. 1: 0,9% NaCl solution
(i.v.), Col. 2: NGF (5 jig/mouse, i.v.). Col. 3: PBCA NP (9 mg/mouse, i.v.),
Col. 4: NGF (5 jig/mouse mixed with 1% PS 80 solution,i.v.), Col. 5: NGF (5
jig/mouse, absorbed on PBCA nanoparticles, i.v.), Col. 6: NGF(5 jig/mouse,
absorbed on PBCA nanoparticles coated with PS 80, i.v.).
Chapitre III Essais Précliniques

53
2.4. Le ciblage à travers la membrane cellulaire
Il est nécessaires d'accroître notre
compréhension de la façon dont ces particules sont prises en
charge et transportés au sein des cellules, et dans quelle mesure ils
sont métabolisés et sécrétés. Cette
enquête fournit de nouvelles connaissances sur le mécanisme de
livraison intracellulaire [16].
? La livraison des médicaments aux membranes
cellulaires par encapsulation dans des
micelles PEGylés. Chinese Academy of
SciencesChina J. Wang 2012 [30].
Les auteurs ont testé des micelles de
polyéthylèneglycol-phosphatidyléthanolamine (PEG-PE)
à l'aide d'une série de techniques de fluorescence. Ils ont
démontré que :
? Les copolymères de micelles PEG-PE
transféraient à travers la membrane de la cellule en raison de
leurs propriétés amphiphiles, et sont ensuite internalisés
par endocytose non spécifique et distribués dans le
réticulum endoplasmique et l'appareil de Golgi, mais pas au noyau,
lysosome ou mitochondries et sans affecter l'ATP et la viabilité
cellulaire.
? La Distribution subcellulaire de PEG-PE pourrait
dépendre en grande partie de PE pour la perméabilité de la
membrane cellulaire (Fig43).
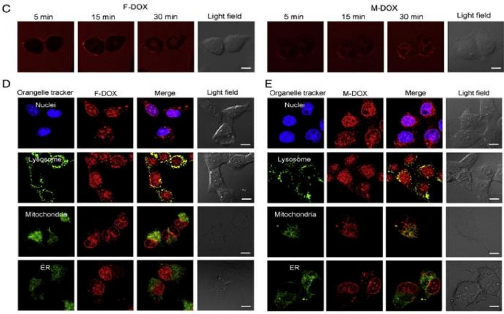
Figure43: (C) Internalization of free
doxorubicin (F-DOX) and PEG-PE encapsulating doxorubicin (M-DOX) in A549 cells
over a period of 30 min. Cells were incubated with 20 pM F-DOX or M-DOX. (D, E)
Intracellular locations of F-DOX and M-DOX in A549 cells. Cells were stained
with organelle trackers after incubation with 20 pM F-DOX or M-DOX for 2 h.
Scale bar=10 pm.
Chapitre III Essais
Précliniques

54
3. Les études précliniques prouvant les
caractères du Coeur
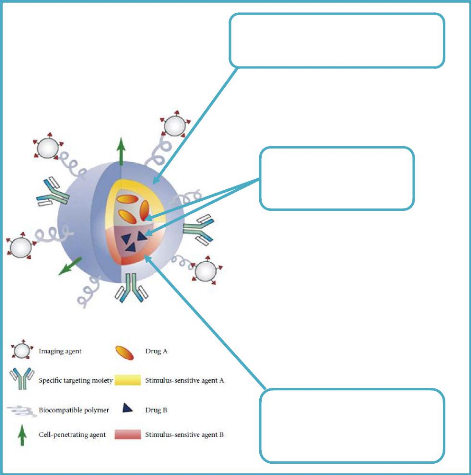
Rendre les anticancéreux « invisibles
»
vis- à-vis des mécanismes de
résistance
Association de plusieurs principes actifs.
L'utilisation de matériaux
« Intelligents » et sensibles à un
stimulus physique ou chimique.
Figure 44: Schéma représentatif
de principales propriétés du coeur des NV.
Chapitre III Essais Précliniques

55
3.1. Réduire la résistance aux
anticancéreux
? Des NP chargés de Doxorubicine pour
contourner la résistance des cellules tumorales.
Univ Paris-Sud, CNRS France & univ Catholique de
Louvain, Belgique : 1990 [31].
Les auteurs de cette publication P. couvreur et al
ont évalué l'effet de la DOX encapsulée par
des nanoparticules NP .Ils ont comparé la cytotoxicité de la
DOX-libre (free-DOX), DOX-encapsulé par des NP (NP-DOX) (300nm) et des
nanoparticules sans DOX (NP), avec une souche de culture cellulaire sensitive
(MCF7) et résistante (DOX R MCFT) du cancer du sein humain
évaluée après 6h d'incubation à des concentrations
de DOX appropriées :
? Les Cellules(MCF7) étaient plus sensitives à
la DOX-libre que les Cellules de (DOX R MCF7) soit 150 fois plus.
? Les NP sans médicament étaient relativement
non-toxique pour les deux lignées cellulaires du cancer du sein (90% de
survie).
? Aucune différence significative n'a été
observée dans le taux de survie des(MCF7) traitées avec
(free-DOX) ou (NP-DOX).
? En revanche, pour (DOX R MCFT), la concentration requise de
DOX laissant 50% de cellules viables a été diminué de 130
fois lors de (NP-DOX) ont été utilisés à la place
de libre-DOX.
Ces résultats indiquent que les NP ont fourni un
support efficace pour introduire des doses cytotoxiques de la DOX à
l'intérieur des cellules de cancer humain résistant DOX R MCF7
(Fig45).
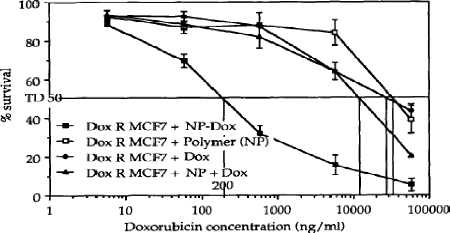
Figure 45: Sensitivity of DOX R MCF7 to
doxorubicin (DOX), polymer (NP), mixture of doxorubicin and polymer (NP+DOX)
and doxorubicin-loaded nanoparticles (NP-DOX).
Chapitre III Essais
Précliniques

56
? Augmentation de la sensibilité des cellules de
carcinome hépatocellulaire vis à vie de la Doxorubicine par
encapsulation dans des NP in vitro et in vivo.
INSERM, Lyon France(2005) [32].
L'équipe de Barraud a montré l'efficacité
de cette approche dans un hépatocarcinome humain ayant une
résistance multidrogue MDR. Lorsque ces cellules cancéreuses ont
été incubées avec des concentration croissantes de DOX
seule, pratiquement aucune activité anticancéreuse n'a
été observée ; alors que vectorisée par le
poly(alkylcyanoacrylate) (PHCA-DOX), la molécule a
présenté une cytotoxicité vis-à-vis des cellules
cancéreuses.
Des tests ont également été menés
in vivo sur un hépatocarcinome multirésistant chez la
souris transgénique. Les mesures ont montré que seules les NP de
PHCA chargées en DOX conduisent à une apoptose des cellules
cancéreuses, alors que l'introduction de DOX sous forme libre conduit
à un niveau d'apoptose faible, similaire à celui observé
lors de l'administration de NP sans DOX ou lors de l'administration d'un
placebo sous forme d'une solution aqueuse de glucose à 5 % ! (Fig46).
Figure 46: Résultat des tests
menés in vivo sur des souris transgéniques porteuses
d'un hépatocarcinome multirésistant [55].
Chapitre III Essais
Précliniques
? Des NP d'argent conjugués au TAT pour lutter
contre la multirésistance du cancer.
Jinhua Liu Zhengzhou University & Chinese Academy
of Sciences & Fudan University chine2012 [33].
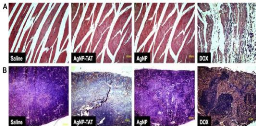
Figure 48: Histological examination of (A)
the injection site (muscle), and (B) the spleens. No histological change was
found in the injection site in the AgNP and AgNP-TAT treated groups, but
myocyte death and inflammatory cell infiltration occurred in the DOX group.
Moreover, spleen damage (e.g. sinus congestion and dilation) was also observed
in the DOX-treated animals.
Le mélanome malin est l'un des cancers de la peau les
plus agressives avec un potentiel métastatique actif et une haute
résistance aux cytotoxiques aucune chimiothérapie efficace n'est
cliniquement disponible pour l'instant.
Ils ont appliqué une stratégie performante en
utilisant des NP d'argent lié au TAT (Transactivation Activateur)
(AgNP-TAT) comme anticancéreux, TAT est un peptide connu pour sa
capacité à traverser les membranes. Les deux tests in vitro
et in vivo ont révélé le succès de
AgNP-TAT dans la lutte contre le MDR des tumeurs et un bénéfice
potentiel clinique.
? L'inhibition de la prolifération de diverses
lignées cellulaires tumorales par AgNP-TAT se produit au fil d'une heure
pour atteindre un taux d'inhibition>50%.
? Alors qu'il a fallu 7 h pour la DOX pour atteindre seulement
un taux d'inhibition <40% .ce qui démontre un autre avantage de
AgNP-TATdans d'apparition rapide de l'effet pharmacologique contre les cellules
tumorales (Fig47).
In vivo, cellules de mélanome B16
résistantes ont été transplantées dans des souris
nue , la taille des tumeurs a montré une inhibition efficace de la
croissance tumorale par AgNP-TAT, et il n'ya aucune différence
statistique entre AgNP-TAT et DOX ,aucun changement histologique a
été trouvé dans le
site d'injection dans le AgNP et animaux traités
AgNP-tat, mais la mort des myocytes et l'infiltration de cellules
inflammatoires s'est produite dans le groupe DOX, et les dégâts de
la rate a également été observée(Fig48).
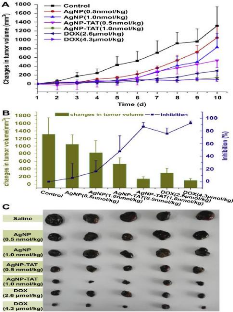

57
Figure 47: The in vivo anticancer
activity of nanosilver; A) The change of tumor volume over the treatment
regimen, B) The tumor weight measured at the experimental endpoint and the
calculated inhibition rate of tumor growth, C) The individual size of
tumors.
Chapitre III Essais Précliniques

58
3.2. Association de plusieurs PA
Il est aussi possible d'associer, au sein d'un même NV,
deux ou plusieurs molécules agissant sur des cibles différentes
mais complémentaires d'une même pathologie
[16].
? Les NV chargés de DOXORUBICINE-COMBRESTATINE:
l'effet sur des cellules GFP-mélanome endothélial.
Sengupta S. et al, Nature, 568-572 (2005)
[34].
C'est ce qui a été montré par
l'équipe de Sengupta S. du MIT qui a conçu un nano
médicament composé d'un agent antiangiogénique (la
combrestatine) et la Doxorubicine. Cette association permet d'agir à la
fois sur l'endothélium vasculaire tumoral et sur les cellules
cancéreuses elles- mêmes. La programmation de la libération
de ces deux molécules dans le temps aboutit à un traitement
beaucoup plus efficace que l'administration des deux anticancéreux sous
la forme d'un simple mélange physique. En effet, la combrestatine,
libérée en premier lieu, permet la perméabilisation de la
barrière endothéliale tumorale, ouvrant ainsi la voie au passage
facilité de la Doxorubicine, libérée dans un
deuxième temps. Celle- ci pourra alors agir plus efficacement sur les
cellules tumorales (Fig49).
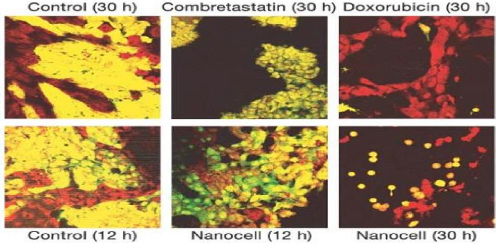
Figure 49: Bioassay of the nanocell with a
GFP-positive melanoma-endothelial cell three-dimensional co-culture system.
Micrographs showing the effect of treatments on melanoma (yellow) or
endothelium (red).
Chapitre III Essais
Précliniques

59
? Polymères thérapeutiques, perspectives
concernant le 21ème siècle, La fin du
commencement. Ruth Duncan. Polymer Therapeutics Lab
spain 2013 [35].
Ils ont décrit une combinaison conjuguée,
copolymère à base de doxorubicine et aminoglutéthimide qui
bloque la fabrication des androgènes mineurs et oestrogènes par
la corticosurrénale contre le cancer du sein et de la prostate. Cette
combinaison conçu a fin de combiner l'hormonothérapie et la
chimiothérapie dans l'espoir d'une amélioration du traitement
pour le cancer du sein métastatique résistant. Le conjugué
affichait nettement une amélioration de l'activité in vitro
dans les cellules MCF-7 par rapport au PA libres, le mécanisme
d'action accrue est apparu principalement en raison de la cinétique de
libération du médicament dans la même cellule en même
temps (Fig50).
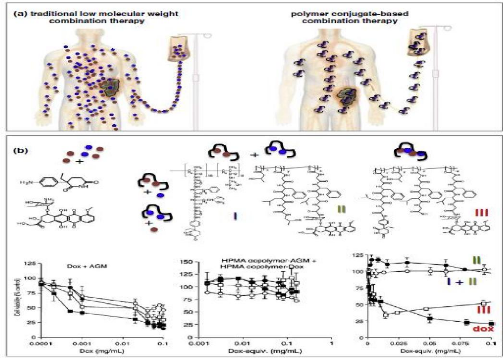
Figure 50: Polymer drug conjugates for
combination chemotherapy. Panel (a) shows schematically the advantage of
infusion of anticancer polymer conjugates carrying combination therapy compared
to traditional low molecular weight combination chemotherapy (after [x]). Panel
(b) shows the cytotoxicity the HPMA copolymer-DOX-AGM conjugate in MCF-7ca
cells compared to the controls DOX, HPMA copolymer-DOX+HPMA copolymer-AGM, and
HPMA copolymer-DOX alone. As further controls the cytotoxicity of DOX+AGMand
HPMA copolymer-DOX+HPMA copolymer-AGM in MCF-7 and MCF-7ca cells incubated in
the presence and absence of oestradiol are shown; MCF-7 plus oestradiol; ,
MCF-7 without oestradiol;
l , MCF-7ca plus oestradiol; , MCF-7ca without oestradiol.
Chapitre III Essais Précliniques

60
3.3. L'utilisation de matériaux « intelligents
» et sensibles à un stimulus physique ou chimique
3.3.1 Les NV PH sensibles :
Les poly mères ou lipides pH- sensibles sont capables
d'induire le relargage du médicament dans des compartiments biologiques
caractérisés par une chute de pH, comme les tumeurs au niveau
tissulaire ou les endolysosomes au niveau cellulaire. L'emploi de lipides ayant
une transition de température un peu supérieure à la
température du corps (40°C) permet, par ailleurs, la
délivrance ciblée dans une zone de l'organisme soumise à
une hyperthermie localisée [16].
? Des nanosystèmes Stimuli-sensibles: livraison de
médicaments.
Han Chang Kang2008 [36]. Dans cette
étude, La cytotoxicité in vitro de DOX chargé
dans des Micelles pégylées PH sensitives PHSM contre des cellules
tumorales MCF-7 (adéno carcinome mammaire humain) après une
incubation de 48h a été investiguée :
Les Micelles à pH 6,8 ont montré une
cytotoxicité DOX-dose-dépendante similaire à DOX libre
Cependant, PHSM DOX ont montré une inhibition puissante de la croissance
de la tumeur (MCF-7) par rapport à d'autres contrôles
non-pH-sensibles (PLLA-b-PEG micelles, libre DOX, et saline) à la
même dose de DOX. L'inhibition de la croissance de la tumeur de PHSM a
été maintenue pendant environ 6 semaines (Fig51).
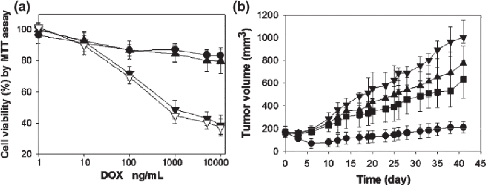
Figure51: (a) In vitro
pH-dependent cytotoxicity of DOX-loaded PHSM (containing 25 wt%
PLLb-PEG; pH 7.4(), 7.0( ), and 6.8( ) and free DOX(6.8 ) after 48-h
incubation (b) Tumor growth inhibition after treatment with
PHSM (), PLLA-b-PEG micelles ( ), free DOX( ), and saline(? ) in MCF-7
tumor-bearing BALB/c nude mice. Two i.v. injections of 10 mg/kg DOX
equivalent dose were made on days 0 and 3. Values are the mean #177; the
standard deviation (S.D.) (n = 5).
Chapitre III Essais
Précliniques

61
? NP sensibles au pH, dérivés du
chitosane en tant que supports de Doxorubicine pour une activité
antitumorale efficace in vitro.
Shenyang Pharmaceutical University chineYun-Huan
Jin2012 [37]. Des NP chargés en DOX sensible au pH
à base d'acide désoxycholique amphiphile modifié
carboxyméthylchitosane (DCMC) ([D] NP) ont été
préparé avec succès. Le [D] NP a permis la
libération accélérée du médicament dans un
environnement acide dont le pH est comparable à celui dans des endosomes
/ lysosomes.
? Contrairement au libre-DOX, [D] NP améliore
l'absorption cellulaire et la rétention dans les cellules
résistantes, ce qui a considérablement amélioré la
cytotoxicité DOX contre les cellules MCF-7/Adr (lignée cellulaire
de carcinome du sein humain résistant).
? Les images fluorescentes de la Fig. présentent la
comparaison de la distribution intracellulaire de DOX après avoir
incubé DOX libre et [D] NP avec MCF-7 et les cellules MCF-7/Adr. Les
Résultats d'efficacité antitumorale ont montré que [D] NP
pourrait tuer efficacement à la fois les souches sensibles et
résistant des cellules MCF-7dose-et temps-dépendante.
L'absorption cellulaire accrue et une plus grande rétention de [D] NP
dans les cellules résistantes aux médicaments, contribue à
une efficacité supérieure de [D] NP par rapport à la DOX
libre (Fig52).
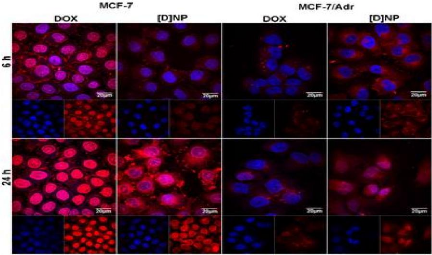
Figure 52: The cellular uptake and retention
of [D] NP. (a) Confocal microscopy images of MCF-7 and MCF-7/Adr cells
incubated with free DOX and [D] NP (DOX concentration: 10 uM) at 37 ?C for 6 h
or 24 h. Cells were fixed and then treated with Hoechst 33342 for nuclei
staining. Red: fluorescence of DOX. Blue: fluorescence of Hoechst. Pink: the
merged fluorescence of blue and red, produced by the co-localization of Hoechst
and DOX. The scale bars correspond to 20 um.
Chapitre III Essais Précliniques

62
3.3.2 Les NV Thermosensibles
? Micelles thermosensibles décorés de
folate à base de copolymères à blocs amphiphiles pour la
libération intracellulaire efficace des médicaments
anticancéreux.
Shahid Beheshti University Iran Seyed Jamal
Tabatabaei Rezaeia 2012 [38].
En résumé, un nouveau type de micelles (91nm)
thermosensibles décorés par le folate ont été
développés pour la livraison d'anticancéreux hydrophobes
par libération contrôlée par la température
induite.
In vitro les études de libération ont
démontré que le système de délivrance du Paclitaxel
(tarvexol)(PTX-PCIAE-FA) est relativement stable dans les conditions
physiologiques mais sensibles à des températures
supérieures à39,5qui déclencherait la libération
des médicaments encapsulés.
Les études de cytotoxicité ont montré que
le PTX transportés par ces micelles était plus
élevé que par le PTX libre. Ila également
été évalué à des températures
supérieures à 39,5, les résultats ont
démontré que l'absorption cellulaire et la cytotoxicité
des micellesPTX-chargés augmente en évidence. Ces
résultats indiquent que ces micelles thermosensibles peuvent offrir un
support très prometteur pour améliorer la prestation du
Paclitaxel (Fig53).
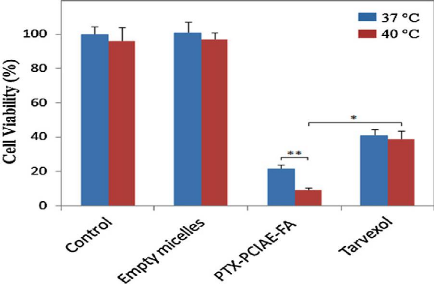
Figure 53: Viability of HeLa cells incubated
with PTX-PCIAE-FA and Tarvexol for 24 h at temperature of 37 and 40 ?C (*p <
0.01 and **p < 0.05).
Chapitre III Essais Précliniques
3.3 .3 Le ciblage magnétique par les
Nanovecteurs
? Des NV chargés de Doxorubicine pour le
traitement du cancer basé sur le ciblage magnétique.
Mu-Yi Hua Chang Gung University of Taiwan2011
[39].
En résumé, la DOX a été
encapsulé par des NP magnétiques (SHMNCs) constitué d'un
noyau magnétique Fe3O4et enveloppé de [N-(1-onebutyric acide)]
aniline, qui ont une capacité de charge élevée de
médicament (27.1%) de la DOX.
? Les NV ont étaient efficace à des
concentrations suffisantes pour induire une cytotoxicité dans les
cellules cancéreuses MGH-U1 et ont surmonté la résistance
au médicament, ce qui entraîne l'augmentation de la concentration
intracellulaire de DOX de 23% par rapport au libre-DOX.
? SHMNC-DOX pourrait facilement être ciblée et
concentrée sur des sites spécifiques en appliquant un champ
magnétique inférieur.
? La Livraison magnétique de SHMNC-DOX était une
thérapie prometteuse qui pourrait fournir un traitement plus efficace de
tumeurs en utilisant des doses thérapeutiques plus faibles avec
potentiellement moins d'effets secondaires.
Les images de fluorescence des NP répartis dans les
différents organes n'ont montré aucune accumulation dans le
coeur, ce système pourrait réduire la cardiotoxicité
provoquée par DOX (Fig54).
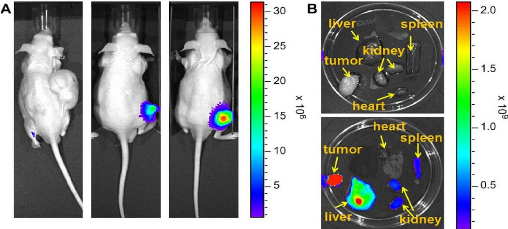

63
Figure 54: (A) In vivo fluorescence
images of MGH-U1 tumor bearing mice without treatment (i.e. control, left) and
after intravenous injection of LMNC-Cy5 (middle), SHMNC-Cy5(right) with 18 h of
MT application. (B) The representative fluorescence images of different organs
which were gotten from control mouse (top) and SHMNC-Cy5 treatment mouse
(bottom).
Chapitre III Essais
Précliniques

64
? Des NP magnétiques fonctionnalisées pour
l'administration de la Gemcitabin contre les tumeurs in
vitro.
University of Granada Spain
2013[40].
Dans ce travail, J.L. Viota décrit un nouveau
modèle de NP composites comprenant un noyau de magnétite,
revêtu de couches successives de haut poids moléculaire, le poly
(acrylique l'acide) et de chitosane, et une dernière couche d'acide
folique. La possibilité d'utiliser ces nanostructures
auto-assemblées pour l'encapsulation de GEM est explorée.
L'adsorption de l'acide folique, qui vise à
accroître le passage de la membrane cellulaire, est suivie par des
mesures d'absorption optique, qui ont également été
employées.
In vitro La microscopie confocale prouve que les NP
sont capables de libérer la gemcitabine dans des cellules de tumeur du
foie, du côlon et du sein. Il est également montré que,
après 2h, plus du médicament est délivré à
l'intérieur du noyau des cellules cancéreuses (Fig55).
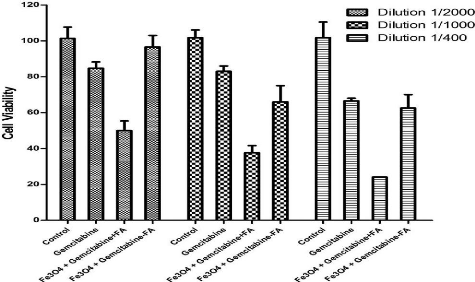
Figure 55: Cell viability assay for PLC-PRF-5
cancer cells treated during 48 h for different concentrations of gemcitabine,
and gemcitabine adsorbed onto nanoparticles composites
with(«Fe3O4+Gemcitabine+FA») and without
(«Fe3O4+Gemcitabine-FA») folic acid. Results are indicated for three
dilutions (v/v) of the 5×10-4 Gemcitabine solution and of the nanoparticle
suspensions with the same drug concentration.
Chapitre III Essais
Précliniques

65
4 Nanothéragnostique
Beaucoup d'efforts ont été faits pour
améliorer le traitement traditionnel du cancer par le
développement de Nanotheranostic, ils combinent le diagnostic non
invasif simultané et le traitement de maladies avec la
possibilité de suivre la libération du médicament en temps
réel et la distribution, ainsi prévoir et valider
l'efficacité de la thérapie.
Grâce à ces caractéristiques
extrêmement attrayant. L'étape suivante est la tentative pour
effectuer une véritable médecine personnalisée qui mesure
le traitement à chaque patient, en tenant compte de la
variabilité individuelle. L'application clinique de nanotheranostics
permettrait l'évaluation précoce de la maladie, Ce concept permet
d'élaborer des protocoles thérapeutiques personnalisés
pour atteindre le bénéfice maximal avec un profil de
sécurité élevé [16].
? Les Nanotheranostics pour une médecine
personnalisée
Univ Paris-Sud France S. Mura, P. Couvreur 2012
[41].
Des NP d'oxyde de fer thermiquement superparamagnétique
chargé en DOX (DOX @ TCL-SPION) ont été modifié par
la conjugaison de surface avec l'antigène spécifique de(PSMA)
pour la reconnaissance spécifique des cellules cancéreuses de la
prostate sur-exprimant le PSMA (DOX @ Apt-hybr-TCL-SPION).
L'Imagerie et propriétés thérapeutiques
ont été évaluées in vivo dans un
modèle murin de cancer de la prostate LNCaP humain.
? Après 2 h, un assombrissement important a
été observée dans la zone e la tumeur avec une
amélioration du signal de 53% dans la région
d'intérêt avec une forte accumulation.
? L'activité thérapeutique a été
évaluée par l'évaluation de la vitesse de croissance de la
tumeur dans les groupes traités avec DOX @ Apt-hybr-TCL-SPION par
rapport au libre-DOX, 5% de glucose, Apthybr-TCL-SPION ou brouillés DOX
@ scrApt-hybr-TCL-SPION comme groupe témoin. DOX@ Apt-hybr-TCL-SPION
montrait une inhibition supérieure de la croissance de la tumeur et,
à la fin du traitement, le volume de la tumeur était environ 54%
de ceux des groupes témoins (Fig 56.B). La réduction du volume de
la tumeur a été validé également par IRM
enregistrés à la fin de le traitement, ce qui confirme clairement
la possibilité d'un non-invasive suivi longitudinal de
l'efficacité de la thérapie (Fig56).

66
Chapitre III Essais
Précliniques
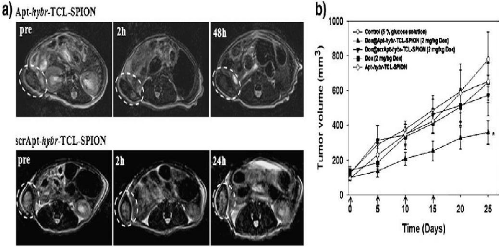
Figure 56: (a) T2-weighted fast-spin echo
images at the level of the LNCaP tumor on the right side of the mouse taken at
0, 2, 24, and 48 h after injection of Apt-hybr-TCL-SPIONs
orscrApt-hybr-TCL-SPIONs. The dashed circle indicates the xenografted tumor
region. (b) Antitumor activity of DOX@Apt-hybr-TCL-SPIONs in the LNCaP
xenograft animal model (*Pb0.05, n=6).
|
Un autre exemple intéressant, a été
proposé récemment (2009) par Arias et al. Dans cette
construction, des nanoparticules magnétiques ultrafines d'oxyde de fer,
qui répondent à un champ magnétique extra corporel. (D'une
taille de quelques nano mètres) ont été
piégées dans une nanomatrice (270nm) constituée d'un
lipide naturel (le squalène) couplé à la Gemcitabine USPIO
/ SQgem IP (Fig57).
|
|
Figure 57: Représentation
schématique de la méthode appliquée par l'équipe de
Arias et al., Submitted, 2009.
Ces nano constructions sont injectées par voie iv
pendant qu'un aimant est placé au niveau de la tumeur. L'inhibition de
la croissance tumorale est spectaculaire et peut être suivie par imagerie
en résonance magnétique nucléaire (RMN).
L'efficacité de cette approche a été
démontrée in vivo sur un modèle de tumeur solide
(leucémie murine L1210).
? Après injection IV de USPIO / SQgem IP, une
accumulation au site de la tumeur a été visualisés par
IRM.
? Après l'administration d'USPIO sans SQgem et
application du champ magnétique, une mise en valeur inférieure du
contraste de l'image a été observée.
Chapitre III Essais
Précliniques
En outre, les NP USPIO / SQgem magnétiquement
guidé conduit à une activité anticancéreuse
significativement plus élevé par rapport aux groupes
témoins, offrant ainsi à nouveau la preuve que la visualisation
simultanée de la tumeur et de traitement sont possibles. Les mêmes
auteurs ont déjà obtenu des résultats prometteurs en
élargissant cette stratégie à d'autres agents de contraste
(Gd3 +) et d'autres anticancéreux (paclitaxel, la Doxorubicine et
cisplatine) confirmant ainsi la polyvalence de cette nanoplatform (Fig58).
Des Micelles polymériques pour le suivi in vivo
par imagerie par résonance magnétique et l'administration de
médicaments ont été proposées par Blanco et al.
PEGPLA (Acide polylactique) micelles chargées avec la Doxorubicine et
SPIO NP ont été fonctionnalisé avec le cRGD de ligand de
ciblage (cRGDDOX- SPIO micelles). L'efficacité de cette nanoconstruction
comme agents théranostic a été évaluée
in vivo utilisant un modèle orthotopic H1299 de carcinome du
poumon à petites cellules.
? Après injection i.v. de cRGD-DOXSPIO
micelles permettant d'observer un
assombrissement
significatif dans la zone tumorale qui ont confirmé l'accumulation des
micelles dans ce tissu.
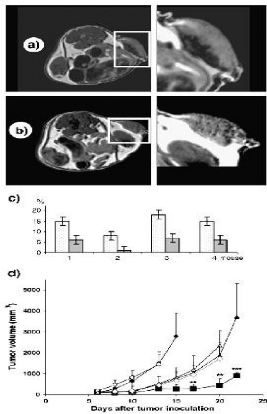

67
Figure 58: Examples of T2-weighted images of
the tumors obtained at 2 h-postinjection of USPIO/SQgem NPs (a) in the absence
of an external magnetic field and (b) guided by an external magnetic field (c)
Percentage of the hypo-intensity tissues with T2b36 ms (white column), and with
T2b20 ms (gray column). Mouse 2 was injected with nanocomposites without
exposition to magnetic field. Mice 1, 3, and 4 were injected with USPIO/SQgem
NPs with 2 h exposure to 1.1 T magnetic field. (d) In vivo anticancer
activity of USPIO/SQgem NPs (with extracorporeal magnetic field) (5 mg/kg
equivalent of gemcitabine) compared with placebo-treated group (drug unloaded
USPIO/squalene nanocomposites), USPIO/SQgem NPs (no extracorporeal magnetic
field applied), with SQgem NPs and with gemcitabine free in L1210 subcutaneous
tumor bearing mice.Untreated (.), placebo USPIO/squalene NPs (), gemcitabine
(0), SQgem NPs (A), USPIO/SQgem composite NPs (no extracorporeal magnetic
field) (A), USPIO/SQgem composite NPs (with extracorporeal magnetic field) (.).
Statistical analysis was performed using Student's t-test to compare the
statistical significance of USPIO/SQgem composite NPs independently with
gemcitabine and SQgem NPs. Data with **pb0.05and ***pb0.001 were considered as
significant and very significant, respectively.
Chapitre III Essais
Précliniques

68
Le colorant NIR Cy5.5 a été utilisé par
Kim et al pour étiqueter le Paclitaxel à base de chitosane NP
(PXT-CNPS). Imagerie et l'évaluation de l'efficacité
thérapeutique a été effectuée sur des souris
porteuses SCC7 murine les tumeurs de carcinome épidermoïde.
En NIR fluorescence images in vivo (NIRF) a
montré des tumeurs bien délimitées en raison de
l'accumulation des NP dans ce domaine. L'intensité du signal de
fluorescence a été corrélée à la
concentration des NP administrés et à la fréquence des
injections, par rapport à la teinture libre, NIRF images ont
montré
? Une augmentation rapide de la taille des tumeurs chez les
souris témoins tandis qu'une inhibition progressive de la croissance
tumorale a été observée chez les souris traitées.
montrant ainsi clairement une amélioration de l'activité
thérapeutique du médicament (Fig59).
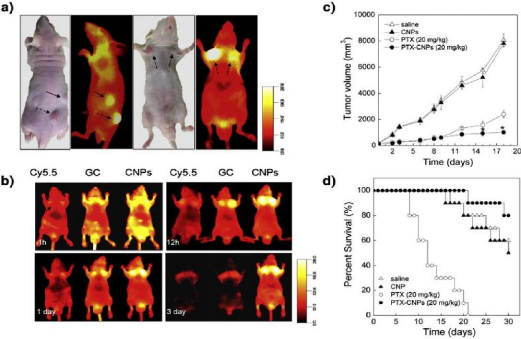
Figure 59: In vivo imaging of
Cy5.5-labeled CNPs in SCC7 tumor-bearing mice. (a) The early-stage tumor models
were generated by injecting subcutaneously SCC7 cells into the pectoral and
dorsal sides of C3H-HeJ nude mice. After eight days, different size of tumors
had grown to 2.6#177;0.3 mm (solid arrow) and 6.2#177;0.5 mm (dotted arrow).
NIRF images were recorded 1-day post-injection of 3.3 ìmol of
Cy5.5-labeled CNPs (5 mg/kg), (b) Time-dependent tumor targeting specificity of
free Cy5.5, Cy5.5-labeled GC polymers, and Cy5.5- labeled CNPs, all with
equimolar amounts of Cy5.5 (0.16 ìmol), in SCC7 tumor-bearing mice.
Comparative therapeutic efficacy studies of PTX-CNPs: (c) tumor size; (d)
survival curves.
Chapitre III Essais
Précliniques

69
L'Imagerie de tissus et d'organes profonds peut être
atteinte en utilisant également NIR quantum dots. Ces nanocristaux
semi-conducteurs sont extrêmement intéressants comme agents
d'imagerie fluorescente haute et sensibles, en raison de leur grand spectre
d'excitation et la possibilité de moduler l'émission, en fonction
de la taille des NV et la composition chimique.
Nurunnabi et al Ont combiné l'Herceptin, un anticorps
monoclonal IgG qui cible les récepteurs du facteur de croissance
épidermique surexprimé dans les cellules de cancer du sein et de
la prostate à la surface et les points quantiques dans le noyau de ces
micelles. Le potentiel du NIR QD-micelles chargées de réduire la
croissance tumorale a été étudiée sur des souris
HER-2 positif MDA-MB-231 portant cancer du sein humain. Plus
précisément adressée à ces cellules, les micelles
QD-chargés ont réussi à bloquer la fonction de HER2
surexprimé, donc provoquant une inhibition significative de la
croissance tumorale 77,3% par rapport à la solution saline (Fig60).
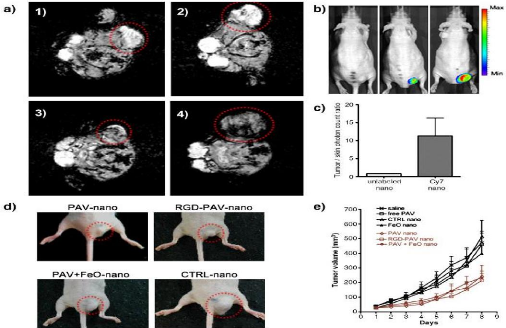
Figure 60: (a) (1, 2) Selected MR images of
PAV nanoemulsion and CTRL nanoemulsion injected mice; (3, 4) MR images of PAV
FeO nanoemulsion and FeO nanoemulsion injected mice. Red circles indicate the
tumors. In (1) and (2), tumors appeared bright compared to surrounding muscle
tissue. In (3) and (4), tumor areas appeared hypointense, indicative of FeO
accumulation. (b) In vivo NIRF images of mouse injected with unlabeled
nanoemulsions (left) and mice (two different sized tumors) injected with Cy7
nanoemulsion (middleand right) at the end of the study. (c) tumor/skin photon
ratio at the same time point. Therapeutic effect of nanoemulsions: (d)
photographs of typical tumors of mice injected with PAV nanoemulsion, RGD-PAV
nanoemulsion, PAVþFeO nanoemulsion, and CTRL nanoemulsion; (e) tumor
growth profiles.
Chapitre III Essais
Précliniques

70
La combinaison de l'imagerie photo-acoustique et optique
« photothermique », Une autre approche novatrice qui a
été récemment proposé par Lovell et al.
Dans cette étude, des porphysomes ont été
préparés, ils sont des vésicules sphériques
formée par l'assemblage d'auto conjugués
porphyrine-phospholipides.
? Porphysomes montrent une forte absorption de la
lumière et de fluorescence NIR.
? En outre, porphysomes irradiés convertissent
l'énergie laser en chaleur donc être attractif non seulement pour
la formation d'image, mais aussi pour les traitements photothermique.
La preuve du concept a été faite in vivo
après administration intradermique à des rats :
? Lorsqu'elle est injectée par voie iv chez des souris
porteuses de cellules tumorales, le signal a affiché une fluorescence
élevée dans la tumeur, mais pas immédiatement
? L'efficacité thérapeutique des porphysomes a
été démontrée chez la souris irradiée par un
laser 658 nm 24 h après l'injection. La température
contrôlée atteint 60 O C dans des tumeurs traitées par tout
porphysomes.
? Il n'était que de 40 O C pour les souris
témoins
En conséquence, les tumeurs ont été
complètement détruites, alors qu'aucune inhibition de la tumeur
n'a
été observée pour les souris témoins
(Fig61).
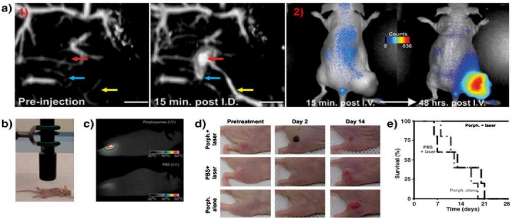
Figure 61: (a) (1) Photoacoustic tomography
imaging before and after intradermal injection of porphysomes; (2) fluorescence
imaging after i.v. injection of porphysomes in a KB xenograft-bearing mouse.
(b) Photothermal therapy set-up showing laser and tumor-bearing mouse; (c)
representative thermal response in KB tumor-bearing mice injected intravenously
24 h before with 42 mg/kg porphysomes or PBS; (d) photographs showing
therapeutic response to photothermal therapy using porphysomes; (e) survival
plot of tumorbearingmice treated with the indicated conditions.
Chapitre III Essais
Précliniques
5 Le concept de squalénisation
En dépit de ces progrès considérables et
du nombre important de publications dans le domaine des Nm, d'importants
verrous technologiques demeurent, parmi lesquels il convient de citer :
? Le faible pouvoir d'encapsulation des systèmes NP, qui
ne dépasse généralement pas 5 %.
? La libération rapide du médicament
encapsulé (burst release), correspondant au relarguage, en quelques
minutes, de la fraction de médicament simplement adsorbée
à la surface du NV.
? La difficulté d'obtenir des matériaux
synthétiques peu toxiques, biodégradables, n'induisant pas de
thésaurismoses cellulaires ou tissulaires, et non immunogènes.
Tout ceci explique le nombre encore faible de NM ayant abouti
à une mise sur le marché. Il est donc nécessaire de
proposer de nouvelles idées et de nouveaux concepts.
L'équipe du Pr Patrick Couvreur a proposé le
concept de squalenisation à fin de parvenir à augmenter le taux
de charge des NM de (1% à 50%) et à pouvoir encapsuler le maximum
du PA sans qu'il y est adsorption à la surface et causer des
toxicités, cette méthode consiste à faire réagir la
gemcitabine avec l'acide squalénique un lipide présent en grande
quantité dans l'huile du foie des requins, précurseur du
cholestérol, il existe aussi chez les humains. Lorsqu'on les met dans
l'eau, elles s'auto-organisent en colonnes parallèles, où la
partie gemcitabine est orientée vers l'intérieur. La « coque
» extérieure est constituée par les chaînes de
squalène (Fig62) [16].
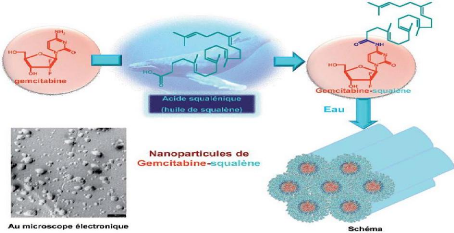

71
Figure 62: La squalénisation de la
gemcitabine : on fait réagir l'anticancéreux gemcitabine avec
l'acide squalénique et l'on obtient des molécules de gemcitabine
squalène. Lorsqu'on les met dans l'eau, elles se mettent à
s'autoorganiser en colonnes parallèles, où la partie principe
actif (gemcitabine) est orientée vers l'intérieur. La «
coque » extérieure est constituée par les chaînes de
squalène. L'ensemble de ces nanoparticules de 100 à 150 nm de
diamètre est observable par microscopie électronique
[55].
Chapitre III Essais
Précliniques

72
? L'efficacité de la Gemcitabine encapsulée
par des nanoparticules à base de squalène in vitro et
in vivo.
Reddy L H (2007-2009) [42].
L'activité de ces NM a été testée
sur un modèle relativement agressif de tumeur expérimentale la
leucémie de murine L-1210, les cellules cancéreuses ont
été injectées par voie IV aux souris, puis elles ont
été traitées par la même voie.
? Les souris non traitées meurent au bout de vingt
jours, cette leucémie est très agressive, les cellules
cancéreuses vont induire des métastases.
? Au contraire, pour les souris traitées par la GEM
libre à la dose de 100 mg/kg qui est la dose maximale
tolérée, le médicament a une activité (survie
prolongée de 50 %). mais ne sont pas guéries (après 45
jours aucun survivant).
? Il est bien évident que les particules de
squalène injectées seules n'ont aucun effet.
? En revanche, les particules de gemcitabine-squalène
injectées à une dose 5 fois moindre que la GEM libre conduisent
à 75 % de survivants à long terme (Fig63).
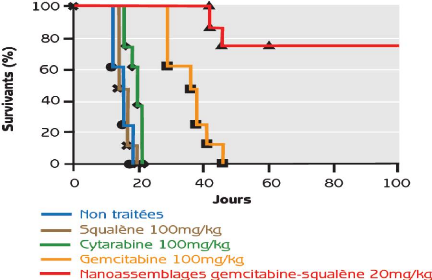
Figure 63 : Résultats des tests sur la
leucémie murine [55].

73
Chapitre III Essais
Précliniques
Ensuite il fallait s'assurer que la technologie de
squalénisation fonctionnait sur des tumeurs localisées. Pour
cela, les cellules cancéreuses ont été injectées
par voie sous cutanée et l'évolution des tumeurs a
été suivie.
? Pour les souris non traitées, le volume tumoral
croît de manière très rapide.
? Pour les souris traitées à la GEM, la tumeur est
résistante à ce médicament.
? Inversement, les souris traitées par voie IV par les NP
de GEM- squalène subissent dans un premier
temps une diminution de la masse tumorale, et après dix
jours, la tumeur disparaît (Fig64) [55].
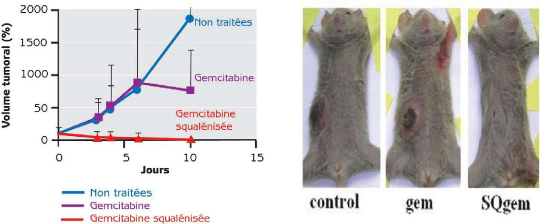
Figure64: Résultats des traitements par
la gemcitabine libre ou squalénisée sur le volume tumoral
[55].
Chapitre III Essais
Précliniques

74
? Les NM à base de Squalénoyle
Gemcitabine surmontent la faible efficacité du traitement par la
Gemcitabine dans le cancer du pancréas.
Univ Louis Pasteur-Strasbourg& univ Paris-Sud,
UMR CNRS France & univ Freiburg, GermanyS. Réjiba 2011 [43].
Le but était d'étudier l'efficacité antitumorale
de la Gemcitabine-squalène (SQ-Gem) NP sur les modèles
d'adénocarcinome pancréatique chimiorésistances et
chimiosensible.
? La viabilité cellulaire a montré que SQ-Gem NP
affichait des effets antiprolifératifs et cytotoxiques supérieur,
en particulier dans Panc1cellules tumorales chimiorésistances.
? In vivo, par rapport à Gem native, SQ-Gem NP
a diminué de manière significative la croissance de la tumeur, a
empêché l'invasion des cellules tumorales, et a prolongé la
durée de survie des souris porteuses de tumeurs pancréatiques
(Fig65).
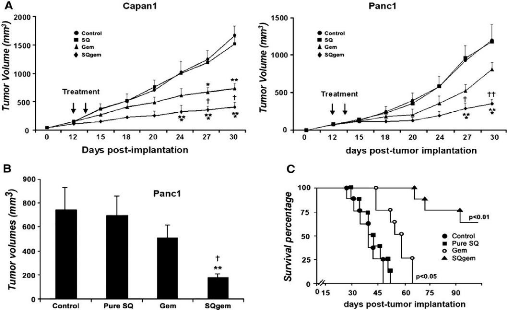
Figure 65: SQ-Gem improves inhibition of
tumor growth and increased survival. (A) Mice (n = 8) bearing subcutaneous
tumors were treated twice with Gem or SQ-Gem (20 mg/kg). After 1 month,
statistical analysis of tumor volumes showed superior antitumor efficacy of
SQ-Gem compared to untreated or SQ-treated mice (***P b 0.001) and to Gem
(†P b 0.05, ††P b 0.001). (B) The same experiment was performed
on Panc1 orthotopic tumor model (n = 14). Tumors were significantly reduced by
SQ-Gem treatment (**P b 0.01 vs. untreated mice and †P b 0.05 vs.
Gem-treated mice). (C) Kaplan-Meier survival curves of orthotopic Panc1
tumor-bearing mice showed significant enhanced median survival after SQ-Gem
treatment (vs. Gem-treated mice, *P b 0.5 and vs. Control mice, ***P b
0.001).
Chapitre III Essais
Précliniques

Ciblage intracellulaire
Doxorubicine Micelle PEG In vitro
J. Wang et al.2012
75
6 Discussion
Nos recherches ont été consacré au
principales caractéristiques des NM en se basant sur chacune des parties
« coeur-couronne » , l'association de plusieurs
caractéristiques à la fois, visant à la création
d'une nouvelle spécialité qu'est le Théragnostique mais
aussi de nouvelles solutions proposées à fin de surmonter
quelques verrous technologiques ont été
développés.
Nous avons pu récolter 28 études
précliniques récentes , les résultats de chaque
étude étaient prometteurs prouvant ainsi leur large
efficacités par rapport à l'administration d'un PA libre
et confirmant que cette nouvelle conception de médicaments peut
très bien être appliquée ,car elle procure au PA des
propriétés nouvelles et uniques
sans pour autant affecter le mécanisme d'action propre au
médicament, ainsi il en résulte une diminution de toxicité
ce qui va augmenter l'index thérapeutique.
Tableau II : Les publications des essais
précliniques sélectionnées dans le mémoire.

PA Encapsulé
Ligand Conjugué
Type de NV Type d'essai Cancer
étudié
Auteur / Année De Publication
La furtivité
In vivo
D Paolino et al 2010
Liposome
Gemcitabine
Cancer de la thyroide

Principales caractéristiques de la
couronne
|
Liposome
|
|
|
|
A Gabizon et al 1990
|
Doxorubicine
|
Le ciblage
|
|
Anti Her2/anti CD20
|
NP
|
In vitro
|
Cancer de l'ovaire lymphome
|
A Cirstoiu-Hapca et Al 2007
|
|
Doxorubicine
|
folate
|
NP
|
In vitro
|
Cancer du sein Cancer du cerveau
|
Z. Zhang et al 2007
|
|
Doxorubicine
|
2C5
|
Liposome PEG
|
In vitro
|
Differents types
|
T A.Elbayoumi et al 2007
|
|
Paclitaxel
|
folate
|
NP
|
In vitro
|
Cancer du sein
|
J. Pan et al 2008
|
|
Doxorubicine
|
galactopeptide
|
Micelle
|
In vitro/in vivo
|
hépatome
|
J. Ding et al 2013
|
|
peptide
|
NP
|
In vitro
|
Cellules saines
|
Dvir et al. 2010
|
|
Ciblage des tumeurs cérébrales
|
|
Fretinide
|
GD2
|
Liposome
|
In vitro/in vivo
|
neuroblastome
|
LRaffaghello et al2003
|
|
Doxorubicine
|
chlorotoxine
|
Liposome
|
In vitro/in vivo
|
gliome
|
Y. Xiang et al.2011
|
|
Doxorubicine
|
lactoferrine
|
Liposome
|
In vitro/in vivo
|
gliome
|
H. Chen et al 2011
|
|
Doxorubicine
|
Peptide RGD
|
Dendrimers PEG
|
In vitro/in vivo
|
gliome
|
L. Zhang et al 2011
|
|
Lipide PODX FTC
|
LiposomePEG Cationique
|
|
|
D Paolino et al 2011
|
|
Doxorubicine
|
|
NP
|
in vivo
|
|
S.Wohlfart et al 2012
|
Principales caractéristiques du
Coeur
|
Doxorubicine+ Combrestatine
|
|
NP
|
In vitro
|
Mélanome endothélial
|
S Sengupta et al 2005
|
|
Doxorubicine+ Aminogluthé timide
|
|
|
In vitro
|
Cancer du sein métastasique résistant
|
R. Duncan et al 2013
|
|
Doxorubicine
|
|
NP d'oxyde
|
in vivo
|
Cancer de la vessie
|
M.-Y. Hua et al.2011
|
|
|
De fer
|
|
|
|
|
Gemcitabine
|
folate
|
NP d'oxyde
de fer
|
In vitro
|
Cancer du foie,colon, Sein
|
J.L. Viota et al.2013
|
|
Doxorubicine Doxorubicine
|
|
NP NP
|
In vitro
In vitro/in vivo
|
Cancer du sein résistant
Carcinome hépatocellulaire
|
P Couvreur et al 1990
|
|
Barrauda et al 2005
|
|
TAT
|
NP d'argent
|
In vitro/in vivo
|
Mélanome malin
|
J. Liu et al 2012
|
Doxorubicine
Doxorubicine
Paclitaxel
folate
Réduction de la résistance au
anticancéreux
NP
Micelle PEG In vitro
Micelle
Association de plusieurs PA
Les NP stimuli responsives
Ciblage magnétique
In vitro
Thermo sensitives
In vitro
PH sensitives
Cellules tumorales HELA
Cancer du sein
Cancer du sein
H.C. Kang et al.2008
Y.-H. Jin et al.2012
S.J.T. Rezaei et al 2012

76
Chapitre III Essais
Précliniques
|
NANOTHERAGNOSTIQUE
|
|
Doxorubicine
|
PSMA
|
NP d'oxyde De fer
|
in vivo
|
Cancer du prostate
|
S. Mura, P. Couvreur
2012
|
|
Gemcitabine
|
|
NP d'oxyde De fer
|
in vivo
|
leucémie
|
S. Mura, P. Couvreur 2012
|
|
Doxorubicine
|
|
Micelle+ NP d'oxyde de fer
|
in vivo
|
Carcinome du poumon
|
S. Mura, P. Couvreur 2012
|
|
Anti Her2
|
Micelle+ Quantum dot
|
in vivo
|
Cancer du sein
|
S. Mura, P. Couvreur 2012
|
|
|
porphysome
|
in vivo
|
Tumeur
|
S. Mura, P. Couvreur 2012
|
|
SQUALENISATION
|
|
Gemcitabine
|
|
NP
|
in vivo
|
leucémie
|
L.H.Reddy, P. Couvreur 2009
|
|
Gemcitabine
|
|
NP
|
In vitro/in vivo
|
Cancer du pancréas
|
S. Réjiba et al 2011
|
D'après les résultats obtenus, nous avons pu
constater que l'application de NP à des fins thérapeutiques ou
Théragnostique contre le cancer est réalisable sur un large
éventail et sans limite, l'utilisation de différents types de NP
« liposomes, dendrimeres, micelles, quantum dot,... » Pour encapsuler
différentes molécules anticancéreuse ont étaient
étudiés avec succès comprenant la Doxorubicine,
Gemcitabine, Paclitaxel mais aussi l'efficacité a pu être
testée sur divers types de cancer que ce soit in vitro ou
in vivo, ainsi le ciblage actif par différents ligands
conjugués tous cela nous invite à déduire que la
diversité et la multiplicité des NP ne laisse aucun doute
d'excepter leurs large application dans le proche avenir.
Chapitre III Essais
Précliniques

77
Nous avons pu étudier deux publications traitant le
caractère de furtivité par des liposomes
chargeant la DOX ou la gemcitabine sur un cancer de thyroïde anaplasique
La furtivité des NP procuré par la fixation de chaine de PEG
à leur surface a pu diminuer la captation par le RES et ainsi augmenter
la demi vie du principe actif , ce phénomène se base sur des
interactions BIOPHYSIQUES des surfaces pegylées par des
mécanismes complexes dépendant du PM des chaines PEG (2000) , la
charge électrique ZETA et de la densité de fixation (nbr
molec/nm2).quand la densité augmente l'espace entre les
chaines pegylés diminue on passe alors de la forme « champignon
» à la forme « brosse » tout en diminuant
l'accecibilité au protéines plasmatiques augmentant ainsi leurs
toxicité vis à vie des cellules cancéreuses.
Après l'allongement de la demi vie du PA, on peut
ajouter des ligands à la surface, on a pu traiter
plusieurs études utilisant divers ligands « anti CD20-anti
Her2-2c5-folates- galactopeptides,... » La présence d'un ligand
augmente l'accumulation des NP à la surface des cellules tumorales ainsi
il peut accroitre leur diffusion dans l'interstisium tumoral où divers
pressions oncotiques et interstitiels sont présentes cela peut
être obtenu par la rapidité de l'internalisation cellulaire du
ligand conjugué au NP ce qui génère un gradient de
diffusion.
Ce mécanisme peut très bien faciliter le
transport des anticancéreux à travers divers barrières
biologiques ainsi la barrière hémato encéphalique mais
aussi la barrière cellulaire.
Car Comme il est important pour les PA d'atteindre le site
d'une tumeur, il est tout aussi important d'atteindre leur site
d'action intracellulaire. Ainsi La résistance
aux médicaments qui entrave l'efficacité des agents
chimio thérapeutiques conventionnels pourraient être
surmontées.
? Certains chercheurs supposent qu'après l'endocytose
des nanoparticules la localisation lysosomale du médicament
protège contre l'action de la P-glycoprotéine. En effet, Guise et
al, ont démontré que les NP ont été clairement
localisées dans les lysosomes qui entourent le noyau. À cet
égard, les NP doté de la capacité à s'accumuler
dans les cellules cancéreuses évitent l'expulsion par pompes
à efflux qui va se traduire par une plus grande concentration
intracellulaire et donc une meilleure efficacité.
? Cependant d'autres chercheurs supposent que la
dégradation lysosomale abouti à la libération du
médicament dans le cytoplasm proximal à la membrane cellulaire ce
qui rend le médicament
disponible pour la P-gp efflux pour cela le PA doit
échapper de la dégradation lysosomale.
Chapitre III Essais
Précliniques

78
De nombreuses stratégies ont évolué, une
stratégie populaire est de modifier les NP avec du RPC (peptides de
pénétration cellulaire) qui permettent l'entrée dans la
cellule tout en évitant la dégradation lysosomale. Le
Revêtement de surface des NP avec des peptides TAT permettra à ces
particules d'échapper à la voie lysosomale, autres
méthodes pour échapper à la voie endosomale est d'utiliser
des NP sensibles au pH. Le pH intra-tumoral déstabilise
le liposome, les obligeant à fusionner avec la membrane des endosomes et
libérer ensuite le PA dans le cytoplasme.
Cependant il existe plusieurs points à souligner :
? L'association de plusieurs PA à la fois est une bonne
démarche à fin de déstabiliser les cellules tumorales.
? Dans certain cas la seule conjugaison des NP à des
ligands peut améliorer significativement les résultats
thérapeutiques sans pour autant les charger par des PA
anticancéreux.
? Cette fois ci Les NP ne doivent pas forcement être
encapsulé par un anti cancéreux ni conjugués à un
ligand pour être efficace car on a pu voir que les porphysomes sont non
seulement efficace contre les tumeurs par le biais d'un mécanisme
physique photothermique mais aussi ils nous ont permis de suivre
l'évolution des tumeurs par imagerie.
? L'imagination des chercheurs est à ces extrêmes
car ils ont pu formuler des NP à l'intérieur de NP pour avoir un
résultat maximal de guérison c'est ce qu'on a pu voir dans les
études de ciblage magnétique ainsi que dans le domaine
Théragnostique.

CHAPITRE IV :
NANOMEDICAMENT
ET CANCER
ESSAIS CLINIQUES ET
SUR LE MARCHE
Chapitre IV Essais Cliniques

79
1. Les Anthracyclines liposomales
Il existe plusieurs technologies de nanoparticules basées
sur l'encapsulation liposomale d'Anthracyclines,
qui sont connus pour être des agents cytotoxiques puissants
de différents types de cancers. Trois des technologies les plus connus
et commercialisés sont Doxil (également commercialisé au
Canada et en Europe, Caelyx), Myocet (en Amérique du Nord et en Europe),
et DAUNOXOME [46].
1.1. DOXIL
Doxil a été initialement approuvé par la FDA
en1995 en tant que traitement pour le sarcome de Kaposi associé au SIDA.
Il est considéré comme le premier "nanodrug" approuvé et a
realisé un succès depuis son introduction sur le marché
[46].
? Structure
Composé de liposomes furtifs constitués d'une seule
membrane de bicouche lipidique composée de la phosphatidylcholine de
soja hydrogénée (HSPC) et de cholestérol encapsulée
avec de la doxorubicine. 80-90 nm [47].
? Mécanisme d'action
Doxil reposent sur un mécanisme de ciblage passif afin de
s'accumuler dans des sites tumoraux [47].
? Pharmacocinétique
Le volume de la distribution du Doxil est
légèrement plus grand que le volume de plasma lui-même, ce
qui indique qu'il existe une très faible absorption des liposomes par
les tissus sains [47].
? Métabolisme
Doxorubicinol, le principal métabolite de la
doxorubicine, a été détecté à des niveaux
très bas (0,8 à 26,2 ng / mL) dans le plasma des patients ayant
reçu 10 ou 20 mg/m2 [47].
? Excrétion
La clairance plasmatique de DOXIL était lente, avec une
valeur de clairance moyenne de 0,041 L/h/m2 à une dose de 20 mg/m2. Ceci
est en contraste avec la doxorubicine, qui affiche une valeur de clairance
plasmatique allant de 24 à 35 L/h/m2 [47].
Chapitre IV Essais Cliniques

80
Par conséquent, de nombreuses études ont
montré que l'efficacité de Doxil est sensiblement plus
élevé que celui de la doxorubicine libre, probablement en raison
du mécanisme de ciblage liposomale discuté
ci-dessus. Cependant, il n'existe toujours pas de consensus
sur le mécanisme de livraison de doxorubicine lui-même. Barenholz
traite de deux mécanismes, mais conclut que le mécanisme le plus
probable pour la livraison de doxorubicine est qu'un effondrement du gradient
de sulfate d'ammonium dans les résultats de fluide interstitiel
tumorales dans la libération de la doxorubicine à
l'extérieur des cellules tumorales, ce
mécanisme manque encore des preuves cliniques
concluantes [47].
? Bénéfice/ Risque
Les effets secondaires sont moins graves, que le
médicament libre. En particulier, Doxil montre une diminution drastique
de la cardiotoxicité de la doxorubicine. Des études de Phase I-II
avec Doxil ont révélé que la cardiotoxicité chez
les patients atteints de tumeurs solides est négligeable. La dose
maximale tolérée (DMT) de Doxil, telle que définie lors
des essais de phase II, était de 50 mg/m2 toutes les quatre semaines.
Les deux effets secondaires les plus graves de Doxil sont la mucite et la
palmaire érythro dysesthésies plantaire (EPP). PPE, qui est un
effet toxique unique de Doxil (non observé avec la doxorubicine libre)
et est en grande partie attribuable au temps de circulation longue des
vésicules et une tendance de la furtivité des liposomes à
s'accumuler dans la peau [47].
? Indication
À partir de 2012, les indications pour Doxil incluent
le traitement de deuxième ligne du sarcome de Kaposi associé au
SIDA(1995), le cancer ovarien récurrent(1998), le cancer
métastatique du sein(2003), et le myélome multiple en association
avec Bortezomib (2007)
Très récemment février 2013
La Food and Drug Administration américaine a
approuvé la première version générique du
médicament Doxil [47].
Chapitre IV Essais Cliniques

81
1.2. MYOCET
Myocet n'a pas encore été approuvé pour
une utilisation aux États-Unis (essais cliniques Phase III comme
traitement de première ligne pour cancer du sein métastatique
HER2 positif est en cours), mais il est commercialisé au Canada et en
Europe en association avec le cyclophosphamide en traitement de première
ligne du cancer du sein métastatique [46].
? Structure
Le liposome Myocet est composé d'une membrane à
double couche de la phosphatidylcholine d'oeuf et de cholestérol.
Chargé de doxorubicine à l'aide d'un processus de chargement
actif entraîné par un gradient de pH, la principale
différence entre Myocet et Doxil c'est qu'il manque la
fonctionnalisation de PEG sur la surface des particules
[48].
? Mécanisme d'action
Contrairement au Doxil, Myocet a été
observé pour sa libération assez rapide de doxorubicine. Dans les
24heures, 90% de sa teneur en doxorubicine est libéré in vivo. La
vitesse de libération accrue par rapport à Doxil est
principalement attribuable à l'absence de revêtement de
PEG [48].
? Pharmacocinétique
Sans PEGylation, le temps de circulation est beaucoup plus
court que celle observée pour Doxil(2,5 heures), Les avantages de la
formulation sont principalement liés à la diminution de la
toxicité dose-limitante par rapport à Doxil, ce qui a
réduit significativement l'incidence de la mucite. Cependant, Myocet a
encore un temps de circulation assez long pour assurer le ciblage passif
efficace des sites tumoraux [48].
? Métabolisme
Les concentrations maximales de doxorubicinol apparaissent
dans le plasma plus tardivement avec Myocet qu'avec la doxorubicine
conventionnelle [48].
? Élimination
La clairance de la doxorubicine totale a été de
5,1 #177; 4,8 l/h et le volume de distribution à l'état stable
(Vd) a été de 56,6 #177; 61,5 l alors que pour la doxorubicine
conventionnelle, la clairance et le Vd ont été respectivement de
46,7 #177; 9,6 l/h et de1 451 #177; 258 l.
Chapitre IV Essais Cliniques

82
La doxorubicine est connue pour être éliminée
en grande partie par le foie. Il a été montré qu'une
réduction posologique de Myocet est appropriée chez les patients
avec une fonction hépatique altérée Il a été
démontré que les substances inhibitrices de la
glycoprotéine P (P-gP) modifient la
biodisponibilité de la doxorubicine et du doxorubicinol
[48].
? Bénéfice/ Risque
Dans un rapport particulier en tête-à-tête
entre la phase III doxorubicine et Myocet pour le traitement du cancer du sein
métastatique, les taux de réponse et la survie sans progression
étaient identiques pour les deux traitements. Toutefois, l'incidence de
la toxicité cardiaque liée était inférieure
à Myocet. La toxicité limitant la dose majeure (DLT) de Myocet a
été montrée pour être une leucopénie ou une
neutropénie [48].
Chapitre IV Essais Cliniques

83
1.3. DaunoXome
Contrairement aux deux précédentes technologies,
DAUNOXOME est une encapsulation lipidique d'une autre anthracycline, la
daunorubicine. DAUNOXOME a été initialement
développé en utilisant la daunorubicine à la place de la
doxorubicine en raison de sastabilité aqueuse accrue et sa
cytotoxicité accrue pour certains types de tumeurs solides
[46].
? Structure
Le liposome DAUNOXOME se compose d'une membrane à
double couche de la distéaroyl-phosphatidylcholine et du
cholestérol chargé de sel de citrate de la daunorubicine 50 nm,
ce qui démontre la grande stabilité et une fuite minime de la
daunorubicine piégé [49].
? Mécanisme d'action
Comme les nanotechnologies à base de doxorubicine
discutés précédemment, DAUNOXOME s'appuie également
sur un mécanisme de ciblage passif des sites tumoraux
[49].
? Pharmacocinétique
DAUNOXOME a un petit volume permanent de distribution de 6,4
L, en se limitant au volume de fluide vasculaire, et la clairance de 17 ml /
min.
La demi-vie apparente de DAUNOXOME est de 4,4 heures beaucoup
plus courtes que celle de la daunorubicine, bien que les données
précliniques de biodistribution chez des animaux suggèrent que
DAUNOXOME traverse la barrière hémato-encéphalique, on
ignore si DAUNOXOME traverse la barrière
hémato-encéphalique chez les humains [49].
? Métabolisme
Le daunorubicinol, le principal métabolite actif de la
daunorubicine, a été détecté à des niveaux
faibles dans le plasma après administration intraveineuse de DAUNOXOME
[49].
? Indications
DAUNOXOME est approuvé aux Etats-Unis en tant que
traitement de première ligne pour les patients atteints du sarcome de
Kaposi associé au VIH. Il y a aussi de nombreux essais cliniques actifs
et / ou de recrutement qui tentent de prouver l'efficacité clinique sur
différentes formes de leucémies [49].
Chapitre IV Essais Cliniques

84
1.4. ThermoDox
Bien que n'étant pas actuellement approuvé dans
les marchés, ThermoDox est très similaire à Doxil et
Myocet, tel que discuté ci-dessus [46].
? Structure
Il est composé de la doxorubicine encapsulée
dans le noyau interne de la bicouche aqueuse des liposomes 100nm. Le liposome
ThermoDox est composé de dipalmitoylphosphatidylcholine (DPPC),
monostearoyl-phosphatidylcholine (MSPC), et DSPE-MPEG-2000. DPPC, qui a une
température de gélification de liquide-cristallin de transition
de phase (Tc) de 41,5 ° C, la membrane induit une instabilité dans
le liposome ThermoDox à des températures autour de Tc
[46].
? Mécanisme d'action
La propriété qui fait ThermoDox unique et qui a
suscité tellement l'attention, c'est que le chauffage des liposomes
à des températures = 39,5 ° C, ils libèrent leurs
charges de la doxorubicine en quelques secondes. Cette propriété
permet à la doxorubicine d'être livrées en rafale à
un site de la tumeur sans toxicité systémique associée
observée avec l'administration du médicament libre lui-même
[46].
? Bénéfice/ Risque
actuellement un essai clinique de phase III est en cours pour
ThermoDox en conjonction avec RFA(Radio frequency ablation)pour le traitement
du carcinome hépatocellulaire inopérable les résultats de
l'essai clinique HEAT sont attendus dans le courant de 2013.
En outre, le National Institute of Health (NIH) a
désigné l'étude comme un essai de priorité pour le
cancer du foie. La US-FDA, l'agence européenne des médicaments
(EMA) et les organismes de réglementations chinoises,
Sud-Coréennes et taiwanaises ont tous confirmé que l'étude
HEAT fournit une base acceptable pour la présentation d'une demande
d'autorisation de commercialisation .ThermoDox est également à
l'étude pour diverses formes de cancer du sein et métastases
osseuses [46].

85
Chapitre IV Essais Cliniques
3. Nanovecteurs à base de Taxanes
2.1. Genexol-PM
C'est une micelle à base de polymère
chargé en paclitaxel PEGylé (20 -50 nm) qui est
complètement soluble en milieu aqueux. Dans un essai clinique de phase
I, la dose tolérée maximale était de 390 mg/m2 Les
toxicités limitant la dose étaient la neuropathie, myalgies, et
la neutropénie. Il a de bons taux de réponse, actuellement,
Genexol-PM est approuvé pour le traitement du cancer du sein et du
poumon en Corée [45].
4. Nanovecteurs à base d'Alkaloides
3.1. Vincristine liposomale (OncoTCS,Marqibo)
C'est une vésicule de 120 nm. Il a été
développé pour prolonger la demi-vie plasmatique de la
vincristine. Un essai clinique de phase II en monothérapie sur des
patients atteints de chimiorésistance du lymphome non-hodgkinien a
démontré une activité significative avec des taux de
réponse global de 41%. Un essai clinique utilisant de la vincristine
liposomale dans le cadre d'une chimiothérapie de combinaison pour
lymphome à cellules B agressif, 17/23 patients ont eu une réponse
complète au traitement [45]. Le 9 août 2012 La
FDA a approuvé Marqibo pour traiter des patients adultes atteint d'un
type rare de leucémie, la leucémie aiguë lymphoblastique
(LAL) à chromosome Philadelphie négatif (Ph-)
[47].
Tableau III : Les nanomédicaments pour le
traitement du cancer approuvés par la FDA [46].
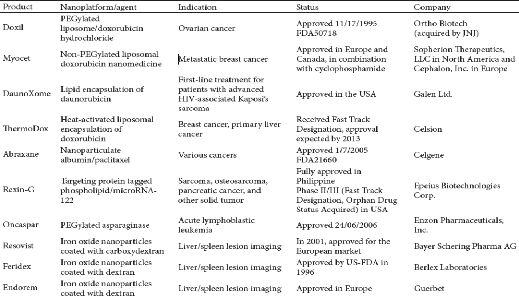
Chapitre IV Essais Cliniques

86
Tableau IV : Exemples de nanomédicaments
en essais cliniques [45].
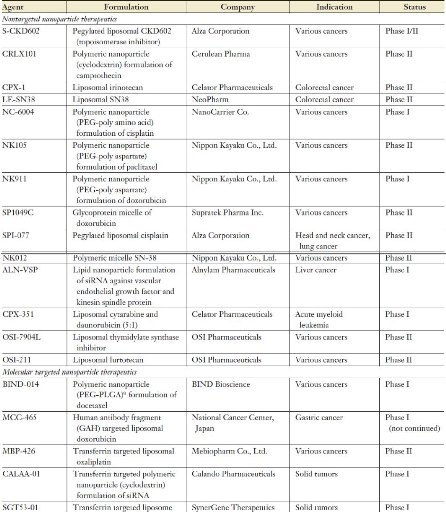

CHAPITRE V :
TOXICOLOGIE ET
REGLEMENTATION
L'homme et sa sécurité doivent constituer la
première préoccupation de toute aventure technologique.
Albert Einstein
Chapitre V Toxicologie Et Règlementation

87
1. Toxicologie
Malgré L'amélioration significative de l'index
thérapeutique ainsi que la diminution des effets secondaires
apportés par les NV aux anticancéreux, le magic bullet
imaginé par PAUL EHRLISH n'est toujours pas
réalisable , les Nm ne peuvent être considérés comme
un miracle pour la guérison contre le cancer ,afin de mieux
évaluer les éventuelles risques pour les malades, la
nécessité d'une meilleure connaissance des conséquences
potentiellement néfastes des nanomedicaments est à
vérifier cela exige la mise en place de nouveaux critères de
contrôles toxicologiques, qui consiste à:
? Rechercher les phénomènes d'agrégation
susceptibles d'entrainer des phénomènes thromboemboliques
à l'administration : Vu que la taille des NV est considérablement
petite il n y a pas de risque d'embolie ou de thrombose cependant dans certains
cas certaines particules vont interagir avec des protéines plasmatiques
peuvent s'aggreger entre elles et former des thrombus.
? Thesaurismose : C'est l'accumulation des matériaux
biodégradable à l'intérieur des cellules pour cela il faut
vérifier l'excrétion biliaire et rénal du produit avec un
bilan métabolique .
? Surveiller tous les processus liés à la capture
par le RES :
? On a remarqué une diminution d'index de phagocytose
qui est dose dépendant mais surtout REVERSIBLE après QUELQUES
HEURS cela est due à une diminution du taux d'opsonines plasmatiques et
pas à une toxicité des cellules de kuppfer.
? Etude de la fonction hepatocytaire : on a constaté
une diminution REVERSIBLE de glucose et une augmentation de l'alfa
glycoproteine acide bi-enteinné qui est l'indice d'un processus
inflammatoire hépatique réversible mais pas une insuffisance
hépatique, ce processus peut être éliminé par la
pegylation.
On conclue qu'il existe une absence d'insuffisance
hepatocytaire, une absence de dommages hepatocytaires irréversibles une
absence de peroxydation de lipide mais on doit noter qu'il existe un processus
inflammatoire réversible.
Chapitre V Toxicologie Et
Règlementation

88
L'activation du complément : on a constaté
l'apparition de certaines manifestation après l'administration du NV
chez quelques patients c'est due au phénomène CARPA « C
Activated Related Pseudo-Allergy » caractérisé par :
· L'hypo/hypertension, le mal de tête, l'apparition
de nausées, de la fièvre
· Apparaît dès la première
administration
· Imprévisible et non détectable par les
tests d'allergie classiques
· Peut être fatal mais RARE
· TOUS les nanomédicaments semblent présenter
des réactions pseudo-allergiques de type CARPA(Fig66).
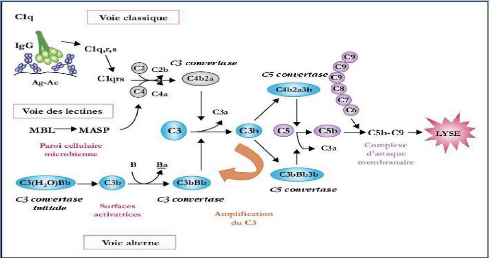
Figure66 : représentation
schématique des différentes voies d'activation du
complément. C'est du à l'activation du complément par la
voie alterne et production de C3a-C5a ce qui va induire une libération
de cytokines proinflammatoires qui vont agir au niveau de l'endothélium
vasculaire pulmonaire Procédures à faire :
· Interrogation du patient et de ces
antécédents allergiques
· Prémédication aux corticoïdes
· Injection lente ou perfusion des NV
· Tests d'activation du complément sur le
sérum du patient
· Nécessité de développer des tests
prédictifs
· Il est extrêmement important d'informer et de
former les cliniciens à ce type de médication
[50].
Chapitre V Toxicologie Et Règlementation

89
2. Règlementation de la nanomédecine
Le contexte historique de la réglementation des
médicaments et le débat actuel sur la nécessité
d'une "nanomédecine" règlementée a été
récemment revu, différents pays et territoires ont des cadres
législatifs spécifiques, il ya eu un effort important
d'élaborer des procédures qui sont commune à tous via les
directives de la Conférence internationale sur l'harmonisation (ICH).
L'International Standard Organisation et ses comités
nationaux ainsi que d'autres organisations travaillent fébrilement sur
la définition et l'Unification des termes et des méthodes des
nanomedecines. Toutefois, en raison de leur approche méthodique, il peut
prendre plusieurs années avant que les normes rattrapent la recherche.
Pour des raisons réglementaires, il existe plusieurs complications
supplémentaires. L'un d'eux est que le rapport classique
d'efficacité doit être remplacé par une (Composition +
Structure + Architecture /Fonction). Les essais cliniques exigerait au
nanomedecines d'être fabriqués conformément aux bonnes
pratiques de laboratoire et / ou bonnes pratiques de fabrication, la Food and
Drug US d'administration a conclu en Juillet 2007, qu'elle n'a pas besoin
d'élaborer une nouvelle réglementation pour les nanotechnologies
à l'heure actuelle et qu'aucun nouvel étiquetage était
nécessaire [51].

CONCLUSION ET
PERSPECTIVES
CONCLUSION ET PERSPECTIVES

90
1. Future et perspectives
Le développement et la recherche du secteur des
nanomédicaments pour le traitement du cancer est en expansion rapide,
l'amélioration des connaissances à l'échelle atomique a
abouti à une meilleure compréhension du monde des nano ainsi une
meilleure maitrise des éléments à cet échelle.
De ce fait de nouvelles plates-formes sont en cours
d'élaboration parmi celles :
? De nouvelles formulations à base de plantes comme des
nanoparticules polymériques, des nanocapsules, des liposomes,
phytosomes, nanoémulsions,transférosomes et ethosomes a
été rapporté en utilisant des extraits bioactifs des
plantes mais aussi des huiles essentiels sont en voie de
développement[52].
Tableau V : Exemples de formulations à
base de plantes.
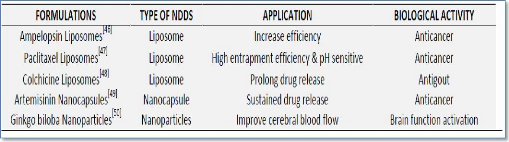
En s'inspirant de la nature pour la conception des NV, les
chercheurs se dirigent vers deux pôles distincts mais parallèles
:
? Le premier concerne les nanoparticules d'origine
naturelle qui ont suscité un intérêt
croissant en nanomedecine en raison de leurs biocompatibilité unique ,
biodégradabilité ainsi que leur immunogenécité ,des
études sont porté sur les organismes supérieurs , un
champignons carnivore était récemment découvert au Japon
pour la production de Nanoparticules et qui a donné des résultats
prometteurs dans l' immunochimiothérapie du cancer
[53].
? Le deuxième concerne la mise en évidence des
nanorobots et pompes auto-alimentées. ce sont
les PHARMACYTES commandés à distance,
Un système idéal de délivrance de médicaments
capables de les transporter précisément, et cibler à
destination cellulaires et intracellulaires spécifiques, ils auront de
nombreuses applications comme l'initiation de l'apoptose dans les cellules
cancéreuses et le contrôle direct du processus de la signalisation
cellulaire. Dans un rapport, des nanomachines alimenté chimiquement ont
été modélisés en utilisant le glucose comme
carburant pour naviguer dans la circulation sanguine [54].
CONCLUSION ET PERSPECTIVES

91
2. Conclusion
L
'homme rêve depuis toujours de pénétrer
dans le corps humain pour l'explorer, comme l'illustre si bien le roman d'Isaac
Asimov «Fantastic Voyage »paru en 1966, décrivant les
aventures d'un vaisseau sous-marin qui est miniaturise pour aller s'immiscer
dans les profondeurs du corps humain. Ainsi Les leçons tirées du
passé, et les limites des premières chimiothérapies, ont
permis de comprendre qu'il fallait proposer de nouvelles stratégies plus
ciblées, basées sur des médicaments dirigés
spécifiquement contre les altérations moléculaires
responsables des cancers, et administrer spécifiquement au site tumoral
plutôt que de manière généralisée.
Actuellement, Des nano systèmes d'administration, de
transport et de vectorisation des médicaments ont, en effet, pu
être conçus grâce aux recherches menées à
l'interface de la physique, de la chimie et de la biologie. La chimie des
polymères et des lipides ainsi que la chimie de conjugaison ont permis
le développement de nouveaux (bio)matériaux biocompatibles et
fonctionnalisés, la physico- chimie a contribué à
découvrir de nouvelles architectures supramoléculaires
organisées, la pharmacotechnie et la bio pharmacie ont apporté la
maîtrise des procédés d'encapsulation ainsi que les
concepts pharmacocinétiques et de biodistribution, tandis que la
biologie cellulaire et moléculaire a contribué, quant à
elle, à identifier ou à mieux connaître les cibles
biologiques et à proposer ainsi de nouvelles pistes pour la conception
de nanovecteurs plus spécifiques. Ce mémoire a fait le point sur
les principales avancées réalisées pour la vectorisation
de molécules biologiquement actives. Quoi qu'il en soit, les
avancées réalisées dans le domaine ont déjà
dépassé le stade de la curiosité du laboratoire de
recherche, puisque des nanomédicaments sont aujourd'hui à la
disposition des patients pour le traitement de cancers, ou pour le diagnostic,
tandis que d'autres sont au stade d'études cliniques de phase I, II ou
III. Nous avons pu déduire ainsi l'efficacité des nanomedicaments
en les comparants à des principes actifs libres et en leurs
conférant de nouvelles propriétés ce qui a abouti à
une amélioration significative de la biodistribution, le temps de demi
vie et à une diminution de la toxicité aboutissant ainsi à
une augmentation de l'index thérapeutique.
REFERENCES
[1] J-C Ameisen, C Burlet, M Canto-Sperber, P Cossart ,
CDeschamps, H Gaumont-Prat, A Grimfeld,
J-A Lepesant, M Loizeau, J-L
Lorrain,J Montagut,C de Rouffignac . (2007) Questions éthiques
posées par les nanosciences, les nanotechnologies et la santé
p19.
[2] D WIDED (2010) Nanoparticules d'or et d'argent
déposées sur oxyde de cérium synthétisées
sous
irradiation. Mémoire de magister en physique option rayonnenmnt
et applications Université MENTORI Canstantine Algérie p90.
[3] M Poúar (2010) Nanomedicine: a way of targeting and
detection of cancer cells Université de
Ljubljana p14.
[4] PERRIER. (2009)Modifications de nanocapsules lipidiques
par des procédés post-formulation.
Elaboration de vecteurs
multifonctionnels de médicaments. Thèse de doctorat
Spécialité : Neurosciences.Ecole Doctorale Nantes-Angers-Le Mans
p191.
[5] J Ogier(2008) Evaluation de Nanobagues comme Vecteurs de
Delivrance de Medicaments thèse de
doctorat Université de
Paris Sud U.F.R. Scientifique d'Orsay p261.
[6] E Blanco, C W. Kessinger, B D. Sumer, J Gao (2009)
Experimental Biology and Medicine--
Blanco.234:123-131.
[7] M HAYDER. (2011)Utilisation d'un Dendrimère
Phosphoré comme une Nouvelle Approche
Thérapeutique de la
Polyarthrite Rhumatoïde. Thèse de doctorat de l'université
de Toulouse p202.
[8] K RAHME. (2008) Stabilisation de nanoparticules dans
l'eau par des copolymères a blocs .Thèse
de doctorat de
l'université de Toulouse p246.
[9] Erik C. Dreaden, M A. El-Sayed, I H. El-Sayed.
Nanotechnology and Nanostructures Applied to
Head and Neck Cancer.
Nanomedicine and Cancer 20:373-395.
[10] J MERIAN(2012) Developpement et caracterisation in vivo
de nanoparticules lipidiques
biocompatibles au moyen des techniques
d'imagerie de fluorescence et nucleaire these de doctorat de
l'université Paris Descartes p297.
[11] F Alexis, E M. Pridgen, R Langer, OC. Farokhzad. (2010)
Nanoparticle Technologies for Cancer
Therapy .Drug Delivery, Handbook of
Experimental Pharmacology 197:55-86.
[12] V EL KHOURY(2006) étude de modifications
epigenetiques correlées à l'expression du gène
MDR1 et
à la texture nucleaire dans les cellules de carcinome pulmonaire H69
sensibles et résistantes à la chimiothérapie. thèse
de doctorat, université de Reims Champagne-Ardenne p253.
[13] D Peer, Jeffrey M. Karp,S Hong, O C. Farokhzad,R
Margalit, R Langer(2007) Nanocarriers as an
emerging platform forcancer
therapy nature nanotechnology 2 :751-760.
[14] C Ming, J Hu , L Zhang (2009)Therapeutic Nanoparticles
to Combat Cancer Drug Resistance
Current Drug Metabolism 10:836-841.
[15] A PAILLARD(2009) Franchissement de barrières
biologiques, mécanisme d'action et devenir
subcellulaire de
nanovecteurs d'agents anticancéreux pour la thérapie des gliomes.
Thèse de doctorat, université d'Angers p299.
[16] P Couvreur (2010) Les nanotechnologies peuvent-elles
contribuer à traiter des maladies sévères ?
Chaire
d'Innovation Technologique Liliane Bettencourt 2009-2010. P43.
[17] D Paolino, D Cosco, L Racanicchi, E Trapasso, C Celia ,M
Iannone, E Puxeddu, G Costante, S
Filetti,D Russo , M Fresta (2010)
Gemcitabine-loaded PEGylated unilamellar liposomes vs GEMZAR®:
Biodistribution,pharmacokinetic features and in vivo antitumor activity.
Journal of Controlled Release 144: 144-150.
[18] C Hapca, L. Nobs , F. Buchegger, R. Gurny, F. Delie.
(2007) Differential tumor cell targeting of
anti-HER2 (Herceptin®)
andanti-CD20 (Mabthera®) coupled nanoparticles .International Journal of
Pharmaceutics 331:190-196.
[19] Z Zhanga, S H Leeb, S S Feng. (2007) Folate-decorated
poly (lactide-co-glycolide)-vitamin E
TPGSnanoparticles for targeted drug
delivery .Biomaterials 28:1889-1899.
[20] T A. Elbayoumi, V P. Torchilin. (2007) Enhanced
cytotoxicity of monoclonal anticancer
antibody2C5-modified
doxorubicin-loaded PEGylated liposomesagainst various tumor cell lines.european
journal of pharmaceutical sciences 3 2:159-168.
[21] J Pan, S S Feng. (2008) Targeted delivery of paclitaxel
using folate-decorated poly (lactide)
evitamin E TPGS nanoparticles
Biomaterials 29:2663-2672.
[22] J Ding , C Xiao , Y Li , Y Cheng , N Wang , C He ,X
Zhuang, X Zhu , X Chen . (2013) Efficacious
hepatoma-targeted nanomedicine
self-assembled from galactopeptide and doxorubicin driven by two-stage physical
interactions. Journal of Controlled Release xxx xxx-xxx.
[23] T. Dvir, M.R. Banghart, B.P. Timko, R. Langer, D.S. Kohane
(2010) Le ciblage de nanoparticules
par la lumière Nanoletters(1),
250.
[24] L. Raffaghello, G. Pagnan, F. Pastorino, E. Cosimo, C.
Brignole, D. Marimpietri,E. Bogenmann, M.
Ponzoni, P.G. Montaldo(2003) .
Immunoliposomal fenretinide: a novel antitumoral drug for human neuroblastoma
.Cancer Letters 197:151-155.
[25] Y Xiang, L Liang, X Wang, J Wang, X Zhang, Q Zhang.
(2011) Chloride channel-mediated brain
glioma targeting of
chlorotoxin-modifieddoxorubicine-loaded liposomes. Journal of Controlled
Release 152 402-410.
[26] H Chen, Y Qin, Q Zhang, W Jiang, L Tang, J Liu, Q He.
(2011) Lactoferrin modified doxorubicin-
loaded procationic liposomes for
the treatment of gliomas.European Journal of Pharmaceutical Sciences
44:164-173.
[27] L Zhang, S Zhu, L Qiana, Y Pei, Y Qiub, Y Jiang. (2011)
RGD-modified PEG-PAMAM-DOX
conjugates: In vitro and in vivo studies for
glioma .European Journal of Pharmaceutics and Biopharmaceutics 79:232-240.
[28] D Paolino, D Cosco, R Molinaro,C Celia, M Fresta.(
2011)Supramolecular devices to improve the
treatment of brain diseases .Drug
Discovery Today 16: 7/8 .
[29] S Wohlfarta, S Gelperinab, J Kreuter. (2012) Transport
of drugs across the blood-brain barrier by
nanoparticles. Journal of
Controlled Release 161:264-273.
[30] J Wang , Y Wang , W Liang. (2012) Delivery of drugs to
cell membranes by encapsulation in PEG-
PE micelles .Journal of Controlled
Release 160: 637-651.
[31] P. Couvreur , L. Roblot,Treupe F, M.F. Poupon , F.
Brasseur (1990) NANOPARTICLES AS
CARRIERS FOR ANTICANCER DRUGSAdvanced Drug
Delivery Reviews 5:209-230.
[32] Barraud L, Merle P, Soma E, Lefrançois L,
GuerretS,Chevallier M., DubernetC,Couvreur P., Trépo
C., Vitvitski
L.(2005). Increase of doxorubicin sensitivity by doxorubicin loading into
nanoparticles for hepatocellular carcinoma cells in vitro and in
vivo. J. Hepathology, 42: 736-743.
[33] J Liu , Y Zhao , Q Guoa, Z Wang , H Wang , Y Yang ,Y
Huang.(2012) TAT-modified nanosilver
for combating multidrug-resistant
cancer Biomaterials 33 :6155-6161.
[34] S Sengupta, D Eavarone, I Capila, G Zhao, N Watson, T
Kiziltepe,R Sasisekharan. (2005)Temporal
targeting of tumour cells and
neovasculature with a nanoscale delivery system .nature 436.
[35] R Duncan, M J. Vicent (2013) Polymer
therapeutics-prospects for 21st century: The end of the
beginning.Advanced
Drug Delivery Reviews 65:60-70.
[36] H C Kang, E S Lee, K Na, Y H Bae(2008) Stimuli-Sensitive
Nanosystems: For Drugand Gene
Delivery Multifunctional .Pharmaceutical
Nanocarriers 162-199.
[37] Y-H Jin , H-Y Hua, M-X Qiaoa, J Zhua, J-W Qia, C-J Hua,
Q Zhangb,D-W Chena(2012) pH-
sensitive chitosan-derived nanoparticles as
doxorubicin carriers for effective anti-tumor activity: preparation and in
vitro evaluation Colloids and Surfaces . Biointerfaces 94: 184- 191.
[38] S J Tabatabaei Rezaeia, M R Nabida, H Niknejadb, A A
Entezamic (2012)Folate-decorated
thermoresponsive micelles based on
star-shaped amphiphilicblock copolymers for efficient intracellular release of
anticancer drugs International Journal of Pharmaceutics 437 :70- 79.
[39] M-Y Huaa, H-W Yang , H-L Liu , R-Y Tsai , S-T Pang , K-L
Chuang ,Y-S Chang , T-L Hwang , Y-
H Chang , H-C Chuang , C-K Chuang
(2011)Superhigh-magnetization nanocarrier as a doxorubicin delivery platformfor
magnetic targeting therapy .Biomaterials 32 :8999-9010.
[40] J.L. Viota, A. Carazo , J.A. Munoz-Gameza, K. Rudzkab,
R. Gómez-Sotomayor b, A. Ruiz-
Extremeraa,c,J. Salmeróna,c,
A.V. Delgado , (2013) Functionalized magnetic nanoparticles as vehicles for the
delivery of the antitumor drug gemcitabine to tumor cells. Physicochemical in
vitro evaluation .Materials Science and Engineering C 33 :1183-1192.
[41] S Mura, P Couvreur. (2012) Nanotheranostics for
personalized medicine Advanced Drug Delivery
Reviews 64: 1394-1416.
[42] a/H Reddy L., Khoury H., Paci A., Deroussent A.,
Ferreira H., Dubernet C., Declèves X., Besnard
M., Chacun H.,
Lepêtre-Mouelhi S., Desmaële D.,Rousseau B., Laugier C.,
CintratJ.-C., Vassal G., Couvreur P.(2007). Squalenoylation favorably modifies
the in vivo pharmacokinetics and biodistribution of gemcitabinein mice.J.
Control. Rel. 124 :20-27.
b/Reddy L.H., Renoir J.M., Marsaud V., Lepêtre-Mouelhi
S.,Desmaële D., Couvreur P.(2009).Anticancer Efficacity of Squalenoyl
Gemcitabine Nanomedicine on 60 Human Tumor Cell Panel and on Experimental
Tumor. Molecular Pharmaceutics, 6 : 1526-1535.
[43] S Réjiba, L. Harivardhan Reddy,, C Bigand,C
Parmentier, P Couvreur, A Hajri, (2011) Squalenoyl
gemcitabine nanomedicine
overcomes the low efficacy of gemcitabine therapy in pancreatic cancer .nanomed
journal 7 :841-849.
[44]
www.cnrs.fr.
[45] Andrew Z. Wang, R Langer,Omid C. Farokhzad. (2012)
Nanoparticle Delivery of Cancer Drugs
Annu. Rev. Med. 63:185-98.
[46] R Wang, P S. Billone, W M. Mullett. (2013) Nanomedicine
in Action: An Overview of Cancer
Nanomedicine on the Market and in Clinical
Trials .Journal of Nanomaterials ID 629681, p 12.
[47]
www.accessdata.fda.gov/scripts/cder/drugsatfda/index.cfm.
[48]
www.ema.europa.eu.
[49]
www.drugs.com.
[50] P Couvreur (2010) Les nanomedicaments .Innovation
technologique Liliane Bettencourt 927-942.
[51] R Duncan,R Gaspar . (2011)Nanomedicine under the
Microscope .Mol. Pharmaceutics XXXX,
XXX, 000-000.
[52] R.R. Bhagwat, I.S. Vaidhya. (2013) Novel drug delivery
systems: an overview Internatienal Journal
of Pharmaceutical Sciences and
Research, 4(3): 970-982.
[53] M Zhang (2013) Fungus-based nanoparticles: inspiration
from nature for cancer therapy.
Nanomedicine 8(3):313-316.
[54] R A. Freitas Jr. (2006) Pharmacytes: An Ideal Vehicle
for Targeted Drug Delivery. Journal of
Nanoscience and Nanotechnology 6:
2769-2775.
[55] P Couvreur (2010) Les nanomédicaments : une
approche intelligente pour le traitement des maladies
sévères
La chimie et la santé EDP Sciences, isbn : 978-2-7598-0488-7, p. 105.
[56] M Goutayer (2008) Nano-émulsions pour la
vectorisation d'agents thérapeutiques ou diagnostiques ;
étude
de la biodistribution par imagerie de fluorescence in vivo. Thèse de
doctorat de l'université Pierre et Marie Curie p241.
[57] P. Couvreur, 2009-2010.Nanomedicaments: materiaux et
methodes de preparation. Chaire
d'Innovation Technologique.
[58] E Fattal, H Hillaireau, S Mura, J Nicolas, N Tsapis
(2012)Targeted Delivery Using Biodegradable
Polymeric Nanoparticles Drug
Delivery, Advances in Delivery Science and Technology 10:255288.
[59] H Hillaireau, P Couvreur (2009) Nanocarriers' entry into
the cell: relevance to drug delivery
Cellular and Molecular Life
Sciences66:2873-2896.
Résumé
Les stratégies thérapeutiques actuelles
appliquées contre diverses maladies, notamment le cancer souffrent de
sévères limitations qui se terminent souvent par un échec
du traitement. La base d'une telle défaillance est multifactorielle
incluant une biodistribution non spécifique, l'insolubilité dans
l'eau, l'hydrophilie ou une masse moléculaire trop importante pour
franchir les barrières biologiques, et un index thérapeutique
étroit ce qui crée des effets toxiques importants et
entraîne parfois l'abandon du traitement en dépit de son
efficacité. Les nanomédicaments visent à contourner ces
obstacles pour rendre les traitements plus spécifiques, tout en
augmentant leur index thérapeutique, leur défi est double , d'une
part, grâce à leur taille « 10-9m» et leurs
caractéristiques de surface , ils doivent transporter le principe actif
et augmenter sa durée de vie, c'est le concept de
VECTORISATION, et d'une autre part , ils doivent être
capables de le livrer spécifiquement aux cellules cancéreuses
c'est le concept de CIBLAGE , en se basant sur des
mécanismes de ciblage passif, ou des mécanismes de ciblage actif
en utilisant des ligands dirigés contre certains récepteurs
surexprimés à la surface des cellules tumorales. Un
troisième défi peu s'imposer en associant la thérapie au
diagnostic c'est le concept du THERAGNOSTIC. La
résistance aux médicaments pourrait aussi être
surmontée. Dans ce mémoire, nous avons pu mettre en
évidence des propriétés propres aux nanomédicaments
ainsi que leurs avantages par des essais cliniques et précliniques mais
aussi une analyse des nanomédicaments approuvés a
été effectuée.
Mots clefs : cancer, index
thérapeutique, nanomédicaments, vectorisation, ciblage,
theragnostic, chimiothérapeutique.
Abstract
Current therapeutic strategies used against various diseases,
including cancer suffer from severe limitations that often end in failure of
treatment. The basis of such a failure is multifactorial including nonspecific
biodistribution, insolubility in water, hydrophilicity or too high molecular
weight to cross biological barriers, and a narrow therapeutic index which
creates significant toxicity and sometimes leads to discontinuation of
treatment in spite of its effectiveness. Nanodrugs designed to overcome these
obstacles to make them more specific treatments, while increasing their
therapeutic index, their challenge is twofold, on the one hand, thanks to their
size "10 -9m" and their surface characteristics, they must carry the
drug and increase its life this is the concept of
VECTORIZATION, and on the other hand, they must be able to
deliver it specifically to cancer cells this is the concept of
TARGETING, based on Passive targeting mechanisms or actif
mechanisms using targeting ligands directed against overexpressed receptors in
certain tumor cell surface. A third challenge might be imposed by combining
therapy and diagnosis this is the concept of THERAGNOSTIC.
Drug resistance could be overcome. In this paper it has been shown the
master-specific properties of nanodrug delivery systems and their advantages in
clinical and preclinical trials, but also an analysis of nanodrugs already
approved was made .
Keywords: cancer, therapeutic index, nanodrugs,
vectorization, targeting ligands, theragnostic, chemotherapy.

Mots clefs : cancer, index thérapeutique,
nanomédicaments, vectorisation, ciblage, theragnostic,
chimiothérapeutique.
Keywords: cancer, therapeutic index, nanodrugs, vectorization,
targeting ligands, theragnostic, chemotherapy.
Les stratégies thérapeutiques actuelles
appliquées contre diverses maladies, notamment le cancer souffrent de
sévères limitations qui se terminent souvent par un échec
du traitement. La base d'une telle défaillance est multifactorielle
incluant une biodistribution non spécifique, l'insolubilité dans
l'eau, l'hydrophilie ou une masse moléculaire trop importante pour
franchir les barrières biologiques, et un index thérapeutique
étroit ce qui crée des effets toxiques importants et
entraîne parfois l'abandon du traitement en dépit de son
efficacité. Les nanomédicaments visent à contourner ces
obstacles pour rendre les traitements plus spécifiques, tout en
augmentant leur index thérapeutique, leur défi est double , d'une
part, grâce à leur taille « 10-9m» et leurs
caractéristiques de surface , ils doivent transporter le principe actif
et augmenter sa durée de vie, c'est le concept de
VECTORISATION, et d'une autre part , ils doivent être
capable de le livrer spécifiquement aux cellules cancéreuses
c'est le concept de CIBLAGE , en se basant sur des
mécanismes de ciblage passifs, ou des mécanismes de ciblage
actifs en utilisant des ligands dirigés contre certains
récepteurs surexprimés à la surface des cellules
tumorales. Un troisième défi peu s'imposer en associant la
thérapie au diagnostic c'est le concept du
THERAGNOSTIC. La résistance aux médicaments
pourrait aussi être surmontée. Dans ce mémoire, nous avons
pu mettre en évidence des propriétés propres aux
nanomédicaments ainsi que leurs avantages par des essais cliniques et
précliniques mais aussi une analyse des nanomédicaments
approuvés a été effectuée.
Current therapeutic strategies used against various diseases,
including cancer suffer from severe limitations that often end in failure of
treatment. The basis of such a failure is multifactorial including nonspecific
biodistribution, insolubility in water, hydrophilicity or too high molecular
weight to cross biological barriers, and a narrow therapeutic index which
creates significant toxicity and sometimes leads to discontinuation of
treatment in spite of its effectiveness. Nanodrugs designed to overcome these
obstacles to make them more specific treatments, while increasing their
therapeutic index, their challenge is twofold, on the one hand, thanks to their
size "10 -9m" and their surface characteristics, they must carry the
drug and increase its life this is the concept of
VECTORIZATION, and on the other hand, they must be able to
deliver it specifically to cancer cells this is the concept of
TARGETING, based on Passive targeting mechanisms or actif
mechanisms using targeting ligands directed against overexpressed receptors in
certain tumor cell surface. A third challenge might be imposed by combining
therapy and diagnosis this is the concept of THERAGNOSTIC.
Drug resistance could be overcome. In this paper it has been shown the
master-specific properties of nanodrug delivery systems and their advantages in
clinical and preclinical trials, but also an analysis of nanodrugs already
approved was made .
FACULTE DE MEDECINE D'ORAN DEPARTEMENT DE
PHARMACIE
| 


