3.2 Critères de sélection des
participants
? Critères d'inclusion : sont à
considérer pour cette étude les éléments suivants,
les points d'eau (sources, forages, pompes et puits) de la localité
où les populations viennent s'abreuver, tout individu de ladite
localité faisant valoir de façon volontaire, son approbation
à participer à notre étude.
? Critères d'exclusion : sont exclus de cette
étude, les points d'eau dont l'accès est refusé au grand
public, toute personne vivant dans la localité mais qui ne consomme pas
les eaux de la localité, toute personne d'âge inférieure
à 18ans, toute personne faisant valoir son droit de retrait de
participation à notre étude qu'importe le moment avant
divulgation des résultats et toute personne dont on aurait eu à
perdre ses données.
3.3 Modalités de recrutement
Pour cette étude, nous effectuons des descentes en
journée au niveau des points d'eau d'intérêt de la
localité et nous soumettions le questionnaire à tout individu
inclut précédemment qui sera présent lors de notre
échantillonnage sur les sites et tout individu de la localité
rencontré dans leur domicile pendant nos descentes sur le terrain. Au
final nous avons obtenus 53 questionnaires remplis par 53 participants de la
localité.
Mémoire rédigé par TCHAMDA TAYO
Laurel Kévine, TMS Page 20
ÉVALUATION BACTÉRIOLOGIQUE DES EAUX DE
CONSOMMATION DES
POPULATIONS DE NGOA-ÉKÉLÉ À
YAOUNDÉ
4. PROCEDURE DE COLLECTE DES ECHANTILLONS
a. TECHNIQUE DE PRELEVEMENT GLOBALE
Condition de prélèvement
: Le prélèvement des points d'eau étaient
conditionné par leur appartenance à notre aire
géographique de recherche, soutenue par une approbation de collecte
orale donnée par les propriétaires / utilisateurs. À cela
s'ajoute l'absence de variations climatiques pouvant biaiser notre analyse.
Conditionnement : Les
échantillons d'eau étaient conservés dans des bouteilles
en plastique propres et transparentes pouvant contenir 1,5 L d'eau.
Modalités de transport : Les
échantillons étaient transportés à l'aide d'une
glacière à température comprise entre 2 et 4°C pour
moins de 8heures.
Délai d'analyse : Le
délai d'analyse était de 8heures.
Critères d'éligibilité des
échantillons : Les échantillons se devaient
d'être bien étiquetés et les volumes pouvant couvrir la
réalisation de l'analyse se devait d'être respectés (au
moins 1,5 L par échantillon d'un site de prélèvement).
b. PRELEVEMENT PROPREMENT DIT AU NIVEAU DES
SOURCES
Matériel : Solution hydro alcoolique,
récipient d'eau, marqueur, papier, stylo, glacière contenant des
glaçons
Après s'être nettoyé les mains, le
récipient est tenu de telle sorte que l'eau de source puisse
s'écouler dans ce dernier jusqu'à ce qu'il soit rempli. Par la
suite, ce récipient est fermé hermétiquement et
étiqueté pour être rangé dans une glacière.
La figure ci-après représente notre premier point
d'échantillonnage de la localité.
Mémoire rédigé par TCHAMDA TAYO
Laurel Kévine, TMS Page 21
ÉVALUATION BACTÉRIOLOGIQUE DES EAUX DE
CONSOMMATION DES
POPULATIONS DE NGOA-ÉKÉLÉ À
YAOUNDÉ

Figure 1 : Source du CETIC de
Ngoa-ékélé
c. PRELEVEMENT PROPREMENT DIT AU NIVEAU DES
PUITS
Matériel : savon, solution de
décontamination, une éponge, récipient d'eau, marqueur,
papier, stylo, glacière contenant des glaçons
Après avoir décontaminé le saut qui sert
à recueillir l'eau au niveau du site ainsi que nos mains, l'eau est
recueillie dans le puits à l'aide de ce saut et par la suite, elle est
transvasée dans notre récipient que nous fermions
hermétiquement. Pour clore, l'étiquetage de l'échantillon
est effectué et il est rangé dans la glacière. Les figures
ci-après représentent nos points d'échantillonnage
complémentaires à la source.

Figure 2 : Puits 1
Mémoire rédigé par TCHAMDA TAYO
Laurel Kévine, TMS Page 22
ÉVALUATION BACTÉRIOLOGIQUE DES EAUX DE
CONSOMMATION DES
POPULATIONS DE NGOA-ÉKÉLÉ À
YAOUNDÉ

Figure 3 : Puits 2
Figure 4 : Puits 3

Figure 5 : Puits 4
Figure 6 : Puits 5
Mémoire rédigé par TCHAMDA TAYO
Laurel Kévine, TMS Page 23
ÉVALUATION BACTÉRIOLOGIQUE DES EAUX DE
CONSOMMATION DES
POPULATIONS DE NGOA-ÉKÉLÉ À
YAOUNDÉ
5. PROCEDURE D'ANALYSE DES ECHANTILLONS
a. PRESENTATION DU MATERIEL ET CONSOMMABLES, DES REACTIFS
ET DES EQUIPEMENTS UTLISÉS POUR L'ANALYSE
Pour l'analyse de nos échantillons, nous avons eu
recours à l'usage du matériel, consommables, réactifs et
équipements consignés dans ce tableau.
Tableau 4 : Présentation du matériel,
consommables, réactifs et équipements pour
l'analyse
|
Matériel et consommables
|
Réactifs
|
Équipements
|
|
Stylo
|
Eau distillée
|
Distillateur
|
|
Papier format
|
Milieux EMB, BEA, Eau
|
Autoclave
|
|
Marqueur permanant
|
peptonnée, Sélénite,
|
Incubateur
|
|
Burette graduée
|
Hektoen, Kliger
|
Réfrigérateur
|
|
Ballon à fond plat
|
Violet de gentiane
|
Balance
|
|
Boites de pétri
|
Lugol
|
Vacupum
|
|
Tube en verre de culture
|
Alcool-acétone
|
Microscope
|
|
Membranes filtrantes
|
Fuschine
|
Ordinateur
|
|
Échantillon d'eau
|
Huile à immersion
|
Minuteur
|
|
Pince
|
Disques d'oxydase
|
|
|
Bec bunsen
|
Péroxyde d'hydrogène
|
|
|
Gaz
|
Galérie miniaturisée API 20E
|
|
|
Anse
|
Huile de paraffine
|
|
|
Pipette pasteur
|
Chlorure ferrique
|
|
|
Lame porte-objet
|
VP1-VP2
|
|
|
Papier absorbant
|
Réactif de KOVACK'S
|
|
|
Tubes à hémolyse
|
Solution de décontamination
|
|
|
Conteneurs de déchets
|
|
|
Mémoire rédigé par TCHAMDA TAYO
Laurel Kévine, TMS Page 24
ÉVALUATION BACTÉRIOLOGIQUE DES EAUX DE
CONSOMMATION DES
POPULATIONS DE NGOA-ÉKÉLÉ À
YAOUNDÉ
b. MÉTHODE D'ANALYSE DES ÉCHANTILLONS : LA
FILTRATION SUR
MEMBRANE
C'est la technique de concentration la plus utilisée au
laboratoire pour ce qui est de l'analyse des eaux. Le plus
généralement, on procède à une filtration sur
membranes en esters de cellulose, de porosité 0,22 ìm ou 0,45
ìm, susceptibles de retenir les bactéries. Après
filtration de l'eau à étudier, la membrane est
déposée sur un milieu gélosé approprié. Ceci
permet aux colonies de coliformes de se développer
préférentiellement au cours d'une incubation de 18 à 24
heures, et sous un aspect suffisamment caractéristique pour autoriser un
diagnostic présomptif. Celui-ci peut d'ailleurs être
confirmé par des repiquages judicieux. Son domaine d'application
privilégiée est les eaux claires ne contenant pas de
matières en suspension susceptibles de colmater : eaux d'alimentation,
de surface et de baignade claires. (L'analyse de l'eau - 10e éd. -
Jean Rodier,Bernard Legube,Nicole Merlet, s. d.)
? Description du dispositif de filtrage
Le dispositif dans son ensemble comporte les
éléments suivants : Un entonnoir-réservoir cylindrique ou
conique, en acier inoxydable ou plastique à usage unique, de taille
variable généralement de 50 à 500 mL, gradué. Ce
réservoir est destiné à être appliqué
exactement sur la surface plane, cylindrique, du support métallique lui
servant de base. Un support métallique formant une sorte de cuvette
conique dont le bord supérieur reçoit une plaque poreuse
(généralement de 50 mm de diamètre) destinée
à supporter une membrane filtrante de même diamètre. La
partie inférieure de la cuvette est prolongée par un tube creux,
muni d'un robinet, permettant le passage d'une aspiration par trompe à
vide et l'évacuation du liquide filtré. Un dispositif
d'assemblage des deux pièces précédentes, variable selon
le modèle d'appareil (collier de serrage, pince amovible, clip, etc.)
permet de solidariser réservoir et support et d'assurer
l'étanchéité, en évitant toute fuite du liquide
contenu dans le réservoir. Un matériel de liaison supportant
l'ensemble de cet appareil de filtration et le reliant à un dispositif
d'obtention du vide. Dans sa version la plus simple, représentée
sur le schéma, il consiste en une fiole à vide en verre, de
capacité suffisante pour éviter des vidanges trop
fréquentes de l'eau filtrée (5 litres par exemple), reliée
à une trompe à eau ou une pompe à vide par
l'intermédiaire d'un flacon de garde, muni d'un manomètre. Dans
des dispositifs plus complexes, la fiole à vide est remplacée par
une rampe supportant plusieurs appareils de filtration. La face
supérieure du support métallique et la plaque poreuse au contact
avec la
Mémoire rédigé par TCHAMDA TAYO
Laurel Kévine, TMS Page 25
ÉVALUATION BACTÉRIOLOGIQUE DES EAUX DE
CONSOMMATION DES
POPULATIONS DE NGOA-ÉKÉLÉ À
YAOUNDÉ
face supérieure de la membrane sont
généralement stérilisées à la flamme. Le
réservoir peut être stérilisé de la même
façon. Directement au contact des eaux analysées, son flambage
doit être particulièrement soigné ; le refroidissement est
alors relativement long, d'où l'avantage des entonnoirs à usage
unique. Les membranes filtrantes utilisées sont
généralement constituées par des esters de cellulose ; le
diamètre des pores est généralement de 0,45 ìm
(parfois de 0,22 ìm). Un quadrillage en surface facilite les
dénombrements bactériens.
? Technique de la filtration sur membrane
Flamber la face supérieure (plaque poreuse) de
l'appareil. Fermer le robinet du support et mettre en marche la pompe à
vide. Prélever une membrane stérile en la saisissant par son bord
extérieur, avec une pince flambée et refroidie ; la
déposer sur la plaque poreuse. L'entonnoir-réservoir
flambé et refroidi est placé au-dessus de la membrane. Installer
le dispositif de fixation (dans certains modèles d'appareils, ce
dispositif, toujours prévu, est inutile, l'adhérence du
réservoir sur la membrane étant suffisante). Agiter soigneusement
le flacon d'eau à analyser et verser l'eau, stérilement, dans le
réservoir jusqu'au repère (50 ou 100 mL selon l'appareil et selon
le type d'analyse pratiquée). Ouvrir le robinet du support suffisamment
pour laisser l'eau s'écouler lentement sous l'action du vide. Si le
contenu du réservoir correspond à la prise d'essai
nécessaire, rincer avec de l'eau stérile (40 à 50 mL)
dès la filtration terminée. Sinon, fermer le robinet à ce
moment-là, remplir à nouveau le réservoir avec de l'eau
à analyser, et rincer lorsque tout l'échantillon a
été filtré. Dès que la membrane paraît
sèche, fermer le robinet, enlever le dispositif de fixation et, avec la
pince à creuset, le réservoir. Prélever la membrane avec
une pince flambée en la saisissant par son extrême bord, et
l'introduire sur le milieu de culture choisi ou lui faire subir le traitement
selon la méthode utilisée parmi celles qui seront décrites
ultérieurement. Lorsque le volume d'échantillon à filtrer
est important, et que la teneur en matières en suspension n'est pas
négligeable, la membrane peut être colmatée avant
l'utilisation complète de la prise d'essai nécessaire à
analyser. Plusieurs membranes devront donc être successivement
utilisées. Remarques - Un matériel permettant de filtrer au lieu
même de prélèvement l'échantillon à
étudier est commercialisé. La membrane peut alors être
placée sur un milieu de transport et transférée
après retour au laboratoire sur un second milieu constituant le milieu
d'inoculation définitif. - La membrane peut également être
immédiatement placée sur le milieu définitif et
aussitôt incubée dans les conditions particulières pour
sélectionner les catégories de germes que l'on veut
étudier. Utiliser pour cela, des incubateurs pouvant fonctionner dans un
véhicule.
Mémoire rédigé par TCHAMDA TAYO
Laurel Kévine, TMS Page 26
ÉVALUATION BACTÉRIOLOGIQUE DES EAUX DE
CONSOMMATION DES
POPULATIONS DE NGOA-ÉKÉLÉ À
YAOUNDÉ
? Dénombrement sur membrane filtrante
La membrane après la filtration peut être
déposée sur la surface d'une gélose. Les bactéries
retenues à la surface sont nourries à travers la membrane par les
pores de celle-ci. Dans le cas des eaux d'alimentation ou des eaux de surface
de bonne qualité, il n'y a généralement aucune
difficulté à filtrer 100 mL. La sensibilité est donc, dans
ce cas, 100 fois supérieure à celle obtenue normalement par
incorporation en gélose, 20 fois à celle-ci lorsque l'inoculum
peut exceptionnellement être porté à 5 mL. Pour de telles
eaux, des volumes plus importants peuvent souvent être filtrés.
Les avantages de cette méthode sont : absence de choc thermique,
différenciation plus aisée des colonies, possibilité de
repiquage. En outre, la filtration permet de séparer les
bactéries du milieu analysé, donc des éventuels
inhibiteurs contenus dans ce milieu. Néanmoins, il n'est pas possible,
sur la surface des membranes (généralement de 50 mm de
diamètre), de dénombrer valablement plus de 80 à 100
colonies car, au-delà, les phénomènes de confluence et
surtout de compétitions sont considérés comme importants.
Il convient donc dans ce cas d'effectuer des dilutions. De plus, la
présence abondante de matières insolubles dans
l'échantillon filtré (fin dépôt minéral,
plancton, etc.) peut colmater les pores, faire obstacle au passage des
nutriments et donner ainsi des résultats erronés par
défaut. Le support utilisé pour la membrane peut être soit
une gélose pour isolement, le plus souvent sélective en vue de la
mise en évidence de germes ou de groupes de germes
déterminés ; soit un tampon absorbant imprégné de
solution nutritive. Le dépôt de la membrane sur la gélose
ou le tampon absorbant doit être fait avec le plus grand soin, sans
permettre à des bulles d'air de séparer en quelque point que ce
soit la membrane de son support. Pour cela, saisir la membrane par une pince
à son extrême bord, la mettre en contact par
l'extrémité opposée avec le support nutritif ; puis la
dérouler, en quelque sorte, sur celui-ci, ce qui assure progressivement
le contact. L'expression des résultats se fait sous forme d'un nombre
d'unités formant colonies (UFC).
ÉVALUATION BACTÉRIOLOGIQUE DES EAUX DE
CONSOMMATION DES
POPULATIONS DE NGOA-ÉKÉLÉ À
YAOUNDÉ
c. ALGORITHMES DE RECHERCHE DES COLIFORMES, DES
ENTEROCOQUES ET DES SALMONELLES
? CAS DES COLIFORMES
Mise en culture de la
membrane filtre de
notre
échantillon dans
milieu EMB à 37°C
pour 24h
En cas de croissance de
colonies, description et
Gram de controle
présentant des Bacilles
Gram-
Réalisation test de
catalase et test
d'oxydase,
obtention
catalase+ et oxydase-
|
Réalisation inoculum pour identification sur
galérie miniaturisée API 20E suiite à une incubation de
24h à
37°C
|
|
Après lecture de la
galérie, attribution du nom de l'espèce au moyen du
logiciel
APIDENT version 2.0
|
Figure 7 : Algorithme de recherche des
coliformes
? CAS DES ENTEROCOQUES
Mise en culture de la
membrane filtre de
notre
échantillon
dans le milieu BEA à
37°C pendant 24h
En cas de croissance,
on note le virage du
milieu au noir
et le
Gram présente des
cocci Gram+ en
chenette
Réalisation du test de
catalase,
obtention
catalase-
Entérocoques spp
Figure 8 : Algorithme de recherche des
entérocoques
Mémoire rédigé par TCHAMDA TAYO
Laurel Kévine, TMS Page 27
ÉVALUATION BACTÉRIOLOGIQUE DES EAUX DE
CONSOMMATION DES
POPULATIONS DE NGOA-ÉKÉLÉ À
YAOUNDÉ
? CAS DES SALMONELLES
Mise en culture de la
membrane filtre de
notre
échantillon dans le milieu
eau peptonnée pour
le
préanrichissement à 37°C
pendant 24h
|
Mise en culture de 1mL
du bouillon du pré-
enrichissement dans le
milieu Sélénite pour
l'enrichissement à
37)c
pour 24h
|
Mise en cuture du
bouillon d'enrichissement
dans le
milieu Hektoen
par la méthode des
quadrans, isolement
de
colonies à 37°C après
24h
Identification des
salmonelles par mise en
culture de
l'inoculum à
l'aide du milieu Kliger à
37°C pour
24h
|
Dégagement gazeux, fermentation du glucose au niveau du
culot, non fermentation du lactose au niveau de la pente et
production de H2S Salmonella Spp
|
|
Figure 9 : Algorithme de recherche des
salmonelles
d. MODE OPÉRATOIRE DE L'ANALYSE
BACTÉRIOLOGIQUE DES ÉCHANTLLONS
? 1er jour
Lorsque les échantillons parviennent au laboratoire, la
prise du pH, la description de la couleur et de la turbidité sont
réalisées. Par la suite, la filtration des échantillons
(eaux) est réalisée grâce au dispositif de pompe
prévu à cet effet. Chaque échantillon est filtré
individuellement selon les proportions indiquées en fonction du germe
qu'on souhaite isolé dans un milieu. Ainsi, 100ml d'eau sont
filtrés autour de la flamme en ayant au préalable aseptisé
tous les entonnoirs à la flamme et la membrane filtrante est
déposée dans le milieu EMB pour le dénombrement des
coliformes en particulier Escherichia coui. Il en est de même
pour la membrane suivante qui est mise dans le milieu BEA pour le
dénombrement des entérocoques. Les boites sont
étiquetées et mise à l'étuve à 37 °C
pour 24h. Puis, 1000ml d'eau sont filtrés pour la recherche des
salmonelles et la membrane est introduite à l'aide de la pince dans un
tube pour culture contenant de l'eau peptonnée. Le tube est mis à
l'étude à 37°C pour 24h. La figure ci-après
présente le dispositif de filtration employée pour nos
échantillons dans l'environnement de travail.
Mémoire rédigé par TCHAMDA TAYO
Laurel Kévine, TMS Page 28
ÉVALUATION BACTÉRIOLOGIQUE DES EAUX DE
CONSOMMATION DES
POPULATIONS DE NGOA-ÉKÉLÉ À
YAOUNDÉ

Figure 10 : Dispositif de filtration de l'eau dans
l'environnement d'analyse
? 2ème jour
Les milieux de culture sont sortis de l'étuve
après 24h d'incubation. La description des colonies avec
dénombrement par UFC pour 100ml est réalisée pour chaque
milieu de chaque échantillon filtré et renseignée sur la
fiche de paillasse. Sur EMB, les colonies sont roses d'aspect visqueux, de
taille égale à 5um et d'autres sont rouges de plus petite taille
en fonction de chaque échantillon. Sur BEA, les colonies sont de
très petite taille, d'aspect noir et transparente pour certaine en
fonction de l'échantillon d'eau filtré. Dans le tube de culture,
l'on observe le milieu qui est devenu trouble tirant vers le blanc pour
certains échantillons. De ce bouillon, 1ml est prélevé et
introduit dans un tube de culture contenant du milieu sélénite et
remis à l'étuve pour 24h à 37°C. Les figures
ci-après présentent les aspects de ces différentes
croissances en fonction des milieux.
Mémoire rédigé par TCHAMDA TAYO
Laurel Kévine, TMS Page 29
ÉVALUATION BACTÉRIOLOGIQUE DES EAUX DE
CONSOMMATION DES
POPULATIONS DE NGOA-ÉKÉLÉ À
YAOUNDÉ

Mémoire rédigé par TCHAMDA TAYO
Laurel Kévine, TMS Page 30
Figure 11 : Aspect des colonies sur EMB
Figure 12 : Aspect des colonies sur BEA

Figure 13 : Aspect des eaux peptonnées
après incubation à 37°C pour 24h
Par la suite, des frottis sont réalisés sur lame
porte-objet à l'aide de colonies isolées prises individuellement
sur dans chaque milieu, additionnées à de l'eau distillée
stérile. Ces frottis sont colorés au Gram. La lecture
microscopique est effectuée après séchage des lames. Les
lames des colonies roses et rouges sur EMB présentes des bacilles Gram-,
celle des colonies noires et transparentes prises sur BEA présentes des
cocci à Gram+. Les figures ci-après illustrent les lames suite
à la coloration de Gram.
Mémoire rédigé par TCHAMDA TAYO
Laurel Kévine, TMS Page 31
ÉVALUATION BACTÉRIOLOGIQUE DES EAUX DE
CONSOMMATION DES
POPULATIONS DE NGOA-ÉKÉLÉ À
YAOUNDÉ
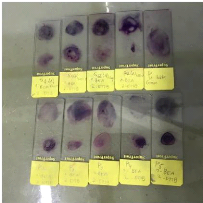
Figure 14 : Image lames porte-Objet après
coloration de GRAM
En continuité, des tests de catalase et d'oxydase sont
réalisés pour une colonie isolée de chaque
échantillon pour chacun des milieux utilisés. Les
bactéries possédant une chaîne respiratoire complète
sont dotées d'un cytochrome oxydase. La mise en évidence de cette
oxydase est effectuée en présence d'une solution aqueuse à
1% de chlorhydrate de diméthylparaphénylène diamine qui
forme un complexe violet au contact de cette enzyme. Les colonies sont
prélevées à l'aide d'une pipette Pasteur. Placer un disque
d'oxydase sur une lame propre et stérile. À l'aide d'une pipette
Pasteur (il est strictement interdit d'utilisé l'anse de platine pour ne
pas fausser le résultat) une goutte de suspension bactérienne
pure est déposée sur " un disque oxydase", celui-ci contient de
l'oxalate de diméthyl paraphénylène diamine. Les
bactéries oxydase-positives donnent rapidement une coloration violette
foncée ; dans le cas contraire, il n'y a pas de coloration.
Certaines bactéries ont la faculté de
dégrader le peroxyde d'hydrogène (H2O2). En présence d'une
bactérie productrice de catalase, on observe à partir d'H2O2 une
libération d'oxygène gazeux selon la réaction : H2O2 donne
H2O + 1/2O. La méthode consiste à prélever une colonie du
germe à étudier (ex. les staphylocoques pour les Gram + et les
entérobactéries pour les Gram -) sur l'extrémité
d'une anse de platine que l'on plonge ensuite dans une goutte d'eau
oxygénée (à l'aide d'une pipette Pasteur). Le
dégagement de bulles gazeuses signe la présence de
l'enzyme.(Denis et al., 2012)
ÉVALUATION BACTÉRIOLOGIQUE DES EAUX DE
CONSOMMATION DES
POPULATIONS DE NGOA-ÉKÉLÉ À
YAOUNDÉ
Les tests de catalase effectués sur les colonies roses
et rouges sur EMB sont tous positifs et ceux d'oxydase négatifs. Les
tests de catalase effectués sur les colonies noires et transparentes de
BEA sont tous négatifs et oxydase positifs. Les figures suivantes
illustrent des résultats de catalase et d'oxydase de certains
échantillons.

Mémoire rédigé par TCHAMDA TAYO
Laurel Kévine, TMS Page 32
Figure 15 : Résultat catalase positif et oxydase
négatif
Figure 16 : Test oxydase négatif
Pour clore cette journée, des suspensions
bactériennes sont réalisées à l'aide de l'eau
distillée stérile et de colonie isolée prise
individuellement dans chaque milieu EMB de chaque échantillon à
l'aide d'une anse, autour de la flamme. Suivant le principe d'utilisation de la
mini galerie APÏ 20E, après l'avoir
étiqueté, la suspension est prélevée à
l'aide d'une micropipette et mise dans les 20 puits constituant la mini galerie
de façon à remplir jusqu'au bas inférieur de l'orifice
d'ouverture, les puits des caractères biochimiques ONPG, TDA, IND, GLU,
MAN, INO, SOR, RHA, SAC, MEL, AMY et ARA uniquement à l'aide de cette
suspension sans bulle d'air. De façon à remplir totalement
l'orifice des puits des caractères biochimiques CIT, VP, et GEL
uniquement à l'aide de la suspension. De façon à remplir
jusqu'au bas inférieur de l'orifice d'ouverture des puits des
caractères biochimiques ADH, LDC, ODC, H2S et URE à l'aide de
cette suspension à laquelle on rajoutera de l'huile de paraffine
jusqu'au niveau du haut supérieur de l'orifice d'ouverture de ces puits
afin de créer l'anaérobiose. Les galeries sont ainsi
constituées pour chaque colonie sur EMB de chaque échantillon et
mises à l'incubateur à 37°C pour 24h. La figure
ci-après illustre la mini galerie remplie avant son incubation.
Mémoire rédigé par TCHAMDA TAYO
Laurel Kévine, TMS Page 33
ÉVALUATION BACTÉRIOLOGIQUE DES EAUX DE
CONSOMMATION DES
POPULATIONS DE NGOA-ÉKÉLÉ À
YAOUNDÉ
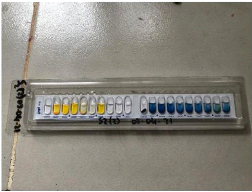
Figure 17 : Image de d'une micro gallérie API
20E après ensemencement
? 3ème jour
Les milieux en tube incubés sont sortis après
24h et à l'aide d'une anse, des ensemencements par la technique des
cadrans sont réalisés dans des géloses Hektoen pour chaque
échantillon à l'aide des bouillons sélénite
obtenus. Ces géloses sont étiquetées et mises à
l'incubateur pour 24h à 37°C. Les mini galeries sont sorties
également après 24h et la lecture est lancée. Pour chaque
galerie, une lecture avant révélation est réalisée
et au moins trois caractères se doivent d'être positifs pour que
la révélation puisse être effectuée, sinon
ré-incubation de la galerie à 37°C pour 24h. La
révélation est faite pour les caractères biochimiques TDA,
IND et VP respectivement à l'aide des réactifs suivants :
chlorure ferrique, VP1-VP2 et réactif de Kovack's. La réaction
dure 10min pour la TDA, 5min pour IND et VP puis, puis la lecture est
réalisée. Cette lecture est basée sur le virement de
couleur ou pas observable au niveau du puits de chaque caractère. Les
résultats de lecture sont exprimés en positif ou négatif
pour chaque caractère, et consignés dans le calepin du kit API
20E puis, présentés au final après
séparation des caractères en groupe de 3 et 2, en un des groupes
de chiffre qui constitue le nombre qui permet d'identifier
spécifiquement le germe isolé lors de la culture. Cette
identification a été réalisé à l'aide du
logiciel APIDENT version 2.0 sur un ordinateur de marque DELL. Certaines
souches n'ont pas été identifiables. Les figures ci-après
illustrent l'aspect des milieux sélénites après
incubation, une galerie après incubation et un résultat
d'identification fournie par le logiciel APIDENT.

Mémoire rédigé par TCHAMDA TAYO
Laurel Kévine, TMS Page 34
ÉVALUATION BACTÉRIOLOGIQUE DES EAUX DE
CONSOMMATION DES POPULATIONS DE NGOA-ÉKÉLÉ À
YAOUNDÉ
Figure 18 : Aspect de quelques milieux
Sélénite après incubation durant 24h à
37°C
Figure 19 : Aspect d'une micro gallérie API 20E
après incubation durant 24h à 37°C
Figure 20 : Résultat d'identification des
entérobactéries avec le logiciel APIDENT
ÉVALUATION BACTÉRIOLOGIQUE DES EAUX DE
CONSOMMATION DES
POPULATIONS DE NGOA-ÉKÉLÉ À
YAOUNDÉ
? 4ème jour
Les géloses Hektoen sont sorties après 24h et
des suspensions sont de nouveau réalisées à l'aide des
colonies isolées sur ce milieu pour chaque échantillon. Par le
suite à l'aide de suspension des différentes colonies
isolées sur Hektoen en fonction des échantillons, des
ensemencements sont réalisés sur milieu Kliger, milieu solide
coulé en pente pour l'identification des germes en partant du
suppositoire qu'il s'agisse des salmonelles. À l'aide d'une anse, la
suspension d'un échantillon unique est prélevée et une
piqure centrale dans le culot de la pente est réalisée puis, au
niveau de la pente, des stries longitudinales sont effectuées en sortant
du tube. Les tubes sont étiquetés, fermés de moitié
et mis à l'incubateur pour 24h à 37°C. Les figures ci -
après illustrent le milieu Kliger après ensemencement et l'aspect
des colonies sur milieu Hektoen après 24h d'incubation à
37°C.
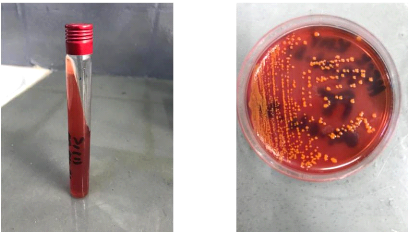
Mémoire rédigé par TCHAMDA TAYO
Laurel Kévine, TMS Page 35
Figure 21 : Milieu kliger avant incubation
Figure 22 : Colonies sur gélose
Hektoen
? 5ème jour
Les milieux sont sortis après 24h et la description de
chacun est effectuée et consignée dans la fiche de paillasse.
Principe de la production d'H2S, la mise en évidence de la production
d'H2S se fait grâce à la présence de thiosulfate de sodium
et de citrate ferrique (fer III). En effet, chez une souche dite H2S +: Le
thiosulfate est réduit en anaérobiose en H2S. L'H2S ainsi
formé se combine au citrate de fer présent pour former un
précipité de sulfure de fer noir. Principe de la lecture de la
fermentation des glucides, le milieu de Kligler
ÉVALUATION BACTÉRIOLOGIQUE DES EAUX DE
CONSOMMATION DES
POPULATIONS DE NGOA-ÉKÉLÉ À
YAOUNDÉ
contient 2 glucides: glucose et lactose (10 fois plus de
lactose que de glucose). Les entérobactéries utilisent d'abord le
glucose et ensuite, éventuellement le lactose. La production de gaz se
traduit par l'apparition de bulles au niveau du culot, ou encore par la
formation d'une poche qui décolle complètement le milieu du fond
du tube. (Denis et al., 2012)
La production de gaz est visible de par la fragmentation de la
gélose initialement stable en un bloc lors de l'ensemencement. Certains
culots de pente sont à présents jaunes, c'est la marque de
l'utilisation du glucose par les bactéries tandis que d'autres reste
oranges. Certaines pentes prennent la couleur jaune qui marque l'utilisation du
lactose par les bactéries pendant que d'autres demeurent de couleur
orange. Aucune production de H2S n'a été observable pour les
échantillons testés, du fait de l'absence de points noirs dans le
milieu. L'identification des germes isolés pour tous les
échantillons testés n'aura permis de détecter des
salmonelles dans les échantillons. Les figues ci-après illustrent
les milieux Kliger après incubation lorsqu'il y'a utilisation de lactose
et glucose par la bactérie.

Mémoire rédigé par TCHAMDA TAYO
Laurel Kévine, TMS Page 36
Figure 23 : Images après incubation des milieux
Kliger à 37°C durant 24h
Mémoire rédigé par TCHAMDA TAYO
Laurel Kévine, TMS Page 37
ÉVALUATION BACTÉRIOLOGIQUE DES EAUX DE
CONSOMMATION DES
POPULATIONS DE NGOA-ÉKÉLÉ À
YAOUNDÉ
e. ASSURANCE QUALITE POUR L'ANALYSE DE NOS
ECHANTILLONS
Lors de la préparation des milieux de culture
employés pour les analyses, les milieux autoclavables ont bien
été autoclavés et leurs coulages se sont faits dans les
boites de pétri et dans les tubes de culture autour de la flamme. Suite
aux préparations des milieux, des tests de stérilité, de
fertilité et de spécificité ont été
réalisés pour chaque milieu avant utilisation et leur
conservation s'est faite entre 2 et 8°C au réfrigérateur
pendant deux semaines.
Lors du processus d'analyse, toutes les manipulations
effectuées ces jours ont été effectuées dans le
respect des principes d'asepsie indiqués pour ces dernières, ce
sont : la décontamination de la surface de travail avant et après
chaque manipulation, la stérilisation avant passage de chaque
échantillon des accessoires du Vacupum pour la filtration et la
réalisation de celle-ci autour de la flamme, la stérilisation des
tubes où ont été réalisées les suspensions,
le travail permanent autour de la flamme pour ne citer que ceux-là. Les
algorithmes d'identification des gerles établies ont scrupuleusement
été suivis.
f. GESTION DES DECHETS
Au sorti de notre manipulation, tous les déchets non
infectieux ont été rassemblés dans des poubelles pour
déchets non infectieux, tous les milieux de culture coulés dans
les boites de pétri et en tubes utilisés ont été
autoclavés et détruits selon le protocole prévu à
cet effet et tous les déchets infectieux ont été
rassemblés dans des poubelles pour déchets infectieux. Toute la
verrerie utilisée a été décontaminée et
recyclée.
g. LIMITES DE L'ANALYSE ET ALTERNATIVES
PROPOSEES
L'analyse de nos échantillons a pris forme dès
la base sur la méthode de la filtration sur membrane avec
dénombrement après incorporation de la membrane en milieu solide
et isolement des salmonelles après usage de la membrane filtre en milieu
liquide. Cependant, cette méthode ne permet d'isoler que certains germes
(coliformes, entérocoques, salmonelles) tout en excluant la
possibilité d'en isoler d'autres. Il serait approprié de
concilier d'autres méthodes d'analyse pour s'assurer à plus
grande échelle d'isoler la quasi-totalité des germes à
Mémoire rédigé par TCHAMDA TAYO
Laurel Kévine, TMS Page 38
ÉVALUATION BACTÉRIOLOGIQUE DES EAUX DE
CONSOMMATION DES
POPULATIONS DE NGOA-ÉKÉLÉ À
YAOUNDÉ
rechercher dans les eaux de boisson, ce sont : la
méthode par incorporation en milieu liquide pour l'isolement des
bactéries sulfito-réductrices, la méthode utilisant le NPP
Pour l'isolement de Vibrio cholerae et bien d'autres.
6. FORMALITÉS ADMINISTRATIVES ET
CONSIDÉRATION ÉTHIQUES
Pour mener à bien ce travail, nous avons eu à
remplir diverses formalités d'ordre administratif et à tenir
compte de certaines considérations éthiques. Elles sont entre
autre : la demande d'une clairance éthique au sein du sein du
Comité Institutionnel d'Éthique de la Recherche pour la
Santé Humain de l'UCAC, une demande d'autorisation de collecte
adressée au Sous-préfet de l'arrondissement de Yaoundé 3
et une auprès du chef de quartier, une autorisation de mise en stage au
sein du laboratoire de l'ESS-UCAC et, la mise à disposition de notice
d'information appuyée par une fiche de consentement
éclairé pour les participants ayant répondus à
notre questionnaire.
7. TRAITEMENT DES DONNEES ET PRESENTATION DES
RESULTATS
Les données obtenues après analyse et
enquêtes au travers du questionnaire ont été
traitées à l'aide des logiciels Windows, Excel, CSPro et SPSS.
Pour ensuite permettre de présenter nos résultats sous forme de
tableau, de représentation graphique et en base de fichiers pour
conservation des données recueillies.
8. DIFFICULTES RENCONTREES
Les difficultés rencontrées durant cette
collecte ont été présentes à plusieurs niveaux,
déjà au niveau de l'obtention d'autorisations administratives de
collecte pour effectuer la collecte d'échantillon et pour la
réalisation des enquêtes auprès des populations de la
localité de Ngoa-Ékélé, puis lors de l'achat et
rassemblement du matériel du fait de la rareté de
ÉVALUATION BACTÉRIOLOGIQUE DES EAUX DE
CONSOMMATION DES
POPULATIONS DE NGOA-ÉKÉLÉ À
YAOUNDÉ
certains produits. Aussi, quelques difficultés au
départ en rapport à l'utilisation du dispositif de pompe, en
rapport à l'analyse en elle-même. La plus grande difficulté
s'est portée sur l'analyse statistique des résultats de nos
analyses.
9. LIMITES DE L'ETUDE
Comme limites de notre étude, il est à noter
qu'elle offre des résultats qui ne donnent pas une connaissance globale
sur la qualité bactériologique des eaux de consommation de la
ville de Yaoundé et encore moins du Cameroun, du fait qu'elle ne
concerne qu'une petite portion de la ville en elle-même. À cela
s'ajoute le fait que la recherche, de par les ressources disponibles n'a pu
rendre possible l'isolement de toutes les bactéries impliquées
dans les survenues maladies d'origine hydrique qui ne cessent d'être des
problèmes de santé publique et qui constituent des
références qualité pour les eaux. Aussi nous n'avons pu
analyser les eaux des points différents des sources et puits de la
localité mentionnés dans ce travail, notamment les forages,
pompes et rivières du fait qu'il a été impossible de les
répertorier.
Mémoire rédigé par TCHAMDA TAYO
Laurel Kévine, TMS Page 39
Mémoire rédigé par TCHAMDA TAYO
Laurel Kévine, TMS Page 40
ÉVALUATION BACTÉRIOLOGIQUE DES EAUX DE
CONSOMMATION DES
POPULATIONS DE NGOA-ÉKÉLÉ À
YAOUNDÉ
| 


