1.3. INTERACTIONS SOLUTE -- EAU
L'eau est omniprésente sur Terre, et sans elle, la vie
serait semble-t-il impossible. Il n'est pas difficile de constater que l'eau
est partout : (1) elle constitue un milieu de vie pour bons nombres de
végétaux et d'animaux à travers les océans, les
mers, les rivières,... qui recouvrent 70% du globe terrestre ; (2) elle
est également la principale substance constitutive des cellules
vivantes. A titre d'exemple, notre sang est composé à 83% d'eau
et la teneur en eau de notre corps avoisine les 65% en masse.
L'eau est si familière qu'elle est souvent vue comme un
liquide « typique ». En réalité, l'eau n'a rien de
typique: déjà en étant la seule substance naturelle
à exister sous ses trois états: liquide, solide (la glace) et gaz
(la vapeur d'eau). L'eau présente un nombre important de
propriétés singulières, dites propriétés
anomales, qui sont fortement corrélées à l'existence
même de la vie. Certaines de ses propriétés comme sa grande
capacité thermique, son importante conductivité thermique et sa
présence en grande quantité dans les cellules contribueraient
à la régulation thermique et éviteraient les fluctuations
locales de température dans les organismes. Parmi les autres
propriétés anomales notables12,*, notons que l'eau
présente des points de fusion (0°C) et d'ébullition
(+100°C) anormalement élevés en comparaison à
d'autres solvants comme le benzène ou l'éthanol par exemple
(C6H6: TF = 5,5°C, TEb = 80,1°C ; C2H6O: TF = -
114,3°C, TEb = 78,4°C 13), et qu'elle présente, ce
qui est tout à fait unique, une forte expansion volumique lors de sa
cristallisation (environ 9% à pression
atmosphérique14).
Les propriétés physico-chimiques des liquides
sont directement liées à leurs propriétés
structurales, et plus particulièrement à la capacité plus
ou moins importante des molécules à former des liaisons
hydrogène entre-elles. La faible dimensionnalité des
molécules d'eau et leur grande aptitude à se lier entre elles par
l'intermédiaire de très nombreuses liaisons hydrogène sont
à l'origine même de ses propriétés
singulières.
* Selon les critères utilisés et la
définition apportée au terme d'anomalie, le nombre de
propriétés anomales de l'eau peut atteindre le chiffre
impressionnant de 41.
1.3.1. L'eau et son réseau
tétraédrique
La molécule d'eau H2O est une molécule qui
possède un important moment dipolaire lié à la
présence de liaisons O-H fortement polarisées. Lorsqu'il est
lié à un hétéroatome fortement
électronégatif comme l'oxygène, l'atome d'hydrogène
présente une déficience électronique suffisante pour lui
permettre d'accepter partiellement un doublet. En d'autres termes, la
polarisation des liaisons O-H fait apparaître une charge négative
partielle (-) sur l'atome d'oxygène et une charge positive partielle (+)
sur chacun des atomes d'hydrogène. Les moments électriques
d'ordre supérieur (quadripolaire, octupolaire, ....) sont non
négligeables ce qui explique l'inhomogénéité du
champ électrique autour de la molécule. A ces importantes
propriétés de polarité s'ajoute le fait que les atomes
d'hydrogène avec leur faible rayon atomique peuvent s'approcher
étroitement des atomes d'oxygène, ce qui génère des
forces d'attraction relativement fortes. C'est ce que l'on appellera un pont
hydrogène ou une liaison hydrogène (Figure 4).
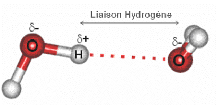
Figure 4 : Représentation d'une liaison hydrogène
entre deux molécules d'eau.
En phase condensée, chaque molécule d'eau va
former deux liaisons hydrogène avec ses propres atomes
d'hydrogène, plus deux liaisons hydrogène supplémentaires
mettant en jeu cette fois-ci les atomes d'hydrogène des molécules
d'eau voisines (Figure 5). Dans le premier cas, l'atome d'oxygène est
dit donneur, dans le deuxième il est dit accepteur. Les liaisons
hydrogène sont très sensibles aux transferts de charges d'un
donneur vers un accepteur dans une séquence qui produit un effet
appelé « coopérativité ».15,16
Là où d'autres liquides comme les alcools forment des
chaînes de liaisons hydrogène à cause de leur unique
groupement hydroxyle, l'eau forme des agrégats
tétraédriques, témoignant d'une plus grande
coopérativité. Dans la phase solide, l'arrangement
tétraédrique des molécules, qui s'étend à
longue distance, va constituer la forme cristalline. A température
ambiante, l'eau liquide présente une structure fortement
organisée, dont l'arrangement « moyen » est très voisin
de la structure tétraédrique de la glace hexagonale.
L'énergie des liaisons hydrogène est suffisamment faible (E ~
25kJ/mol de l'ordre de l'agitation thermique) pour que le réseau
tridimensionnel soit dynamique c'est-à-dire pour que les liaisons
hydrogène se fassent et se défassent en permanence.
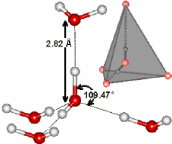
Figure 5 : Arrangement tétraédrique des
molécules d'eau dans la glace hexagonale.
Comme nous venons de le voir, l'eau présente des
particularités structurales tout à fait uniques. Mais
l'étude de la structure de l'eau « pure » ne peut-être
qu'une étude préliminaire, qui servira de base à la
compréhension de systèmes aqueux plus complexes.
| 


