1.4. LE ROLE DES SUCRES DANS LES PHENOMENES
BIOPROTECTEURS
Les membranes constitutives des cellules sont des
édifices biologiques extrêmement sensibles aux variations de
composition de leurs liquides cellulaires et notamment à la
présence de solutés compatibles. Si ces liquides étaient
composés exclusivement d'eau, les couches phospholipidiques risqueraient
de fusionner lors de très fortes déshydratations ou pourraient
être soumises à de très fortes pressions internes
liées à la cristallisation de l'eau. Les dommages
engendrés par de tels stress sont irréversibles voire fatals pour
la cellule. La présence de certains solutés dans ces solutions
permet de stabiliser les membranes en gardant intact l'espace intermembranaire,
mais également en évitant la formation de glace intracellulaire.
Le rôle de certains sucres comme le tréhalose ou le glucose dans
la conservation des structures biologiques chez les organismes anhydrobiotiques
est maintenant reconnu de manière unanime. En revanche, les
mécanismes moléculaires à l'origine de ces
phénomènes de bioprotection sont encore débattus et
différentes théories ont été évoquées
selon le niveau de déshydratation cellulaire considéré :
l'effet déstructurant24,27,28,29,30,31 et l'exclusion
préférentielle4,50
pour des pertes en eau modérées ; la substitution
de l'eau d'hydratation51 et la vitrification11 dans le
cas de très importantes pertes en eau.
1.4.1. Cas d'une déshydratation
modérée :
1.4.1.1. L'effet déstructurant
Les hydrates de carbone ont une architecture chimique
très spécifique qui mêle étroitement des groupements
polaires et apolaires, des liaisons hydrogène inter- et
intramoléculaire, et de très nombreux groupements hydroxyles, qui
leur confèrent un fort caractère hydrophile. Les sucres
présentent donc naturellement une grande affinité avec l'eau
comme en témoigne leur très grande solubilité. Les
perturbations générées par la présence des sucres,
même en très faible quantité, résultent: (i) de
contraintes stériques imposées par les sucres25, et
(ii) de leur aptitude à former des liaisons hydrogène plus
nombreuses et plus stables avec l'eau, que les molécules d'eau
entre-elles.26 Des études de mélanges binaire
eau-sucre ont mis en évidence l'effet déstructurant que peuvent
avoir les hydrates de carbone sur l'arrangement tétraédrique
de l'eau.24,27,28,29,30,31 Autrement dit, la présence
des sucres dans l'eau génère de nombreuses
cassures dans le réseau de liaisons hydrogène de l'eau, et
l'arrangement tétraédrique du solvant va ainsi perdre de sa
coopérativité. Il est bien évident que cette tendance va
s'accentuer avec l'augmentation en concentration du soluté. (Figure 6)
Simultanément, le nombre de liaisons hydogène va augmenter avec
la teneur en sucre par l'intermédiaire de leurs groupements
hydroxyles.
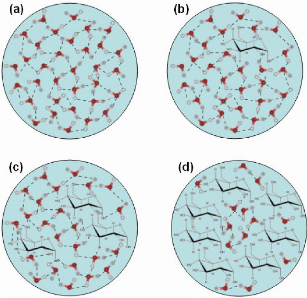
Figure 6: Schéma descriptif de l'effet d'un
soluté compatible (ici, le D-glucose) sur la structure de l'eau. (a) Cas
de l'eau «pure ». Les molécules d'eau forment de très
nombreuses liaisons hydrogène entre-elles et s'organisent en
réseau tétraédrique. Les schémas (b), (c) et (d)
présentent l'évolution de la structure de l'eau en fonction de la
concentration en D-glucose. Le D-glucose forme de très nombreuses
liaisons hydrogène avec les molécules d'eau, brisant ainsi la
structure tétraédrique de l'eau. Plus le ratio sucre/eau est
important, plus la taille des agrégats de molécules d'eau est
réduite et plus le volume d'eau susceptible de pouvoir cristalliser
diminue.
Si l'on regarde en détail, l'évolution des
interactions en fonction de la concentration, on remarque que les interactions
par formation de liaisons hydrogène entre molécules de solvant
sont majoritaires en milieu fortement dilué. Avec l'accroissement du
nombre de molécules de soluté dans le mélange, s'ensuit un
état intermédiaire qui mêle à la fois des
interactions eau-eau et sucre-eau. Enfin, lorsque la proportion en sucre est
nettement majoritaire, on peut observer un net appauvrissement du nombre de
liaisons hydrogène entre molécules d'eau au profit de nouvelles
et très nombreuses liaisons hydrogène inter-sucres et eau-sucre.
Pour des concentrations Cs supérieures à
60% en masse (seuil de percolation), un
phénomène d'encapsulation des agrégats d'eau dans une
matrice d'hydrates de carbone est observé lié à la
présence écrasante des molécules de sucre dans le
mélange (Figure 6). Donc, pour des solutions concentrées, le
volume des agrégats d'eau n'est plus suffisant pour permettre la
formation de centres de nucléation.32,* Une étude
récente, qui démontre que le tréhalose est beaucoup plus
efficace que le sucrose pour réduire la vitesse de
cristallisation33, vient corroborer cette hypothèse. La
déstructuration du réseau tétraédrique de l'eau par
les molécules de soluté conduit donc à la réduction
de la quantité d'eau susceptible de pouvoir cristalliser (Figure 6).
Mais tous les sucres ne présentent pas la même efficacité
et certains comme le glucose, le tréhalose, le sucrose ou le mannose se
voient être d'excellents briseurs de
structure.34,35,36,37,38,39,40
Comme nous venons de le voir, les molécules de sucre
ont donc plutôt tendance à déstructurer le réseau
tétraédrique de l'eau. Mais ceci est une vue simplifiée
des choses, et si d'un côté les sucres
«déstructurent» l'eau, dans le même temps, ils peuvent
la stabiliser ou la déstabiliser suivant le bilan final de liaisons
hydrogène, et suivant le sucre utilisé. Des simulations de
dynamique moléculaire49,41 réalisées sur des
solutions de D-glucose, D-mannose, D-fructose et sucrose ont pu montré
l'évolution des interactions agissant au sein même du
mélange selon la concentration en sucre (Cs).
(1) Cas dilué (Cs>> 20 molécules
d'eau par molécule de sucre)
Les sucres, très largement minoritaires,
s'insèrent dans la matrice d'eau. Des liaisons hydrogène se
brisent inévitablement par effet stérique. Selon le
positionnement des groupements hydroxyles du sucre considéré,
celui-ci s'insèrera de manière plus ou moins aisée dans le
réseau aqueux. Si la topologie du sucre est adaptée à
l'environnement aqueux, sans trop le déstabiliser, alors les
interactions soluté-solvant seront plus fortes, plus étendues et
incluront un nombre croissant de sphères d'hydratation. Des
résultats de simulations moléculaires ont ainsi montré la
compatibilité du D-glucose avec l'arrangement tétraédrique
de l'eau.42,43,44,45 Le D-glucopyranose présente toutes les
caractéristiques pour que sa sphère d'hydratation perturbe le
moins possible son environnement. De ce fait, les sucres s'insèrent
préférentiellement dans les agrégats d'eau, ce qui conduit
à une solution « stable» présentant de fortes
interactions. Des résultats comparables ont été
trouvés pour d'autres hydrates de carbone comme les
pentoses-D-xylopyranose et-D-arabinopyranose,30,46 ou comme le
disaccharidetréhalose.47,48 Dans le cas contraire,
c-à-d si la topologie des groupements hydroxyles ne s'ajuste pas avec
son environnement, alors les agrégats de molécules d'eau doivent
se réorganiser de manière plus importante afin de retrouver le
bon écartement entre l'atome d'oxygène de l'eau et les -OH des
sucres.
* La probabilité de nucléation est directement
reliée au volume de l'échantillon, au sous-refroidissement et
à la viscosité du liquide. Autrement dit le volume de
l'échantillon doit être supérieur à un volume
critique pour espérer observer la formation d'un centre de
nucléation.32
En résumé, l'insertion des molécules
d'hydrate de carbone dépend de la topologie des sucres, par le nombre de
groupements hydroxyle disponibles (plus important chez les disaccharides que
chez les monosaccharides) et par l'orientation de ces groupements hydroxyle,
qui permettront la formation de nouvelles liaisons. Ces deux derniers points
expliquent en partie pourquoi des isomères n'ont pas le même effet
sur la protection membranaire.
(2) Cas intermédiaire (Cs ~ 20
molécules d'eau par molécule de sucre)
Une étude par spectrométrie
infrarouge27 réalisée sur des solutions de D-glucose,
D-fructose et sucrose a permis de mettre en évidence un changement dans
les interactions aux alentours des 30% en masse. A l'apparition des
premières interactions sucre-sucre (~ 30%), les molécules de
soluté ne peuvent plus s'insérer dans le réseau aqueux
sans le déstabiliser. En d'autres termes, les agrégats de sucres
étant plus gros et plus rigides que ces mêmes molécules
seules, leur insertion dans l'environnement hydrique ne peut plus se faire sans
perturbation. Par conséquent, des ruptures majeures dans la
structuration en liaisons hydrogène du réseau commencent à
apparaître, ce qui conduit à la multiplication des petits
agrégats d'eau, agrégats qui font diminuer la
coopérativité et la stabilité de
l'ensemble.27
(3) Cas relativement concentré (Cs < 20
molécules d'eau par molécule de sucre)
Pour des concentrations relativement élevées,
au-delà de 30% en masse, les interactions sucre-sucre deviennent
importantes, et deux sous-réseaux imbriqués l'un dans l'autre
coexistent: un premier formé par les molécules de solvant et un
deuxième formé par les molécules de sucre. Avec
l'augmentation en concentration, la structure aqueuse devient chaotique,
c'est-à-dire que l'on ne trouve plus de grands domaines d'eau sans
défauts et de nombreux agrégats isolés sont
désormais répertoriés. La cristallisation de la solution
devient donc impossible.49
| 


