II.3. L'équation d'état fondamentale
choisie pour NH3-H2O
Parmi les modèles citées
précédemment on a choisi celui de MICHEL FEIDT
[33] qui combine la méthode de l'énergie libre de Gibbs
pour les propriétés thermiques et des équations qui
calculent le point de bulle et le point de rosée du mélange.
Cette méthode combine les avantages des deux et évite le besoin
de faire des itérations afin d'avoir les conditions d'équilibre
de phases. Les corrélations proposées couvrent des conditions
d'équilibre de phases à des pressions et des températures
élevées.
Le domaine de validité pour les relations qui suit est
:
· Pour les températures (k) :
230<T<600 ;
· Pour les pression (bar) :
0.2<P<110.
Ce domaine se trouve sous les points critiques de toutes les
composantes, de sorte que la détermination de l'équation
d'état pour le mélange, ne prend pas en considération les
particularités référents au domaine d'état
critique. L'équation d'état ne décrit pas l'état
dans laquelle la solution se trouve dans l'état d'agrégation
solide [33].
II.3.1. L'enthalpie libre
L'équation fondamentale de l'enthalpie libre de Gibbs est
donnée sous une forme intégrale (Ziegler et Trepp
[26], Ibrahim et Klein [27], Xu et Yogi
Goswami [28]) :
Cp
G H TS Cp dT V dP T dT
= - + ? + ? - ?
0 0 T
T P T
T P T
0 0 0
(II.13)
Cette équation est valable pour la phase gazeuse, ainsi
que liquide.
II.3.1.1. Phase liquide
Le comportement de l'état liquide du point de vue
thermique est décrit par les corrélations suivantes (Ziegler et
Trepp [26]), où le volume liquide est fonction de la
pression et de la température et CpL molaire du
liquide de la température :
(II.14) (II.15)
V = a + a P + a T + a
T
L 2
1 2 3 4
Cp = b + b T + b T
L 2
1 2 3
donc :
T P T L
Cp
G H TS Cp dT V dP T dT
L L L L L
(II.16)
= - + ? + ? - ?
0 0 T
T P T
0 0 0
Le développement de l'équation (II.16) avec
l'aide des équations (II.14) et (II.15) donne la forme réduite
:
B B ? ?
T
G H T S B T T T T T T B T B T T T
L L L 2 2 2 3 3 3
,0 ,0 1 ,0 ,0 ,0 1 2 ,0
( ) ( ) ( ) ln ( )
r
r r r r r r r r r r r
= - + - + - + - - - -
r r r
2 3 ? ?
? ?
T r ,0
B A
- - + + + - + -
3 2 2
T T T A A T A T P P P P
( ) ( )( ) ( )
2 2 2 2
r r r r r r r r r
,0 1 3 4 ,0 ,0
2 2
|
(II.17)
|
|
Les grandeurs adimensionnelles d'état sont :
· La température réduite : T r
|
T
= ;
T B
|
|
·
G
RTB ;
L'enthalpie libre molaire réduite : G r
· La pression réduite : P r
|
P
= ;
P B
|
·
H
RT B
;
L'enthalpie molaire réduite : H r
S
· L'entropie molaire réduite : r
S = ;
R
· Le volume molaire réduit : B
.
V =
r RT B
VP
Les indices utilisés sont :
· r : pour la grandeur réduite ;
· B : pour la grandeur de référence ;
· L : la phase liquide ;
· g : la phase gazeuse ;
· 0 : l'état de référence.
Les grandeurs de références sont
[33] :
TB=100k ;
PB=10bar et
R=8.3143kj/kmole.k.
II.3.1.2. La phase vapeur
Dans la phase vapeur (Ziegler et Trepp [26])
donne les corrélations qui interviennent :
g RT c cc
2 3
V c

4
= + + + +
P T T T
1 3 11 11
P2
(II.18)
P?? ?
2V
Cp d d T d T T dP
g = + + - ? ?
2 ? (II.19)
1 2 32
T
0 ? ? ?
Et :
T P T g
Cp
G H TS Cp dT V dP T dT
g g g g g
= - + ? + ? - ?
0 0 T
(II.20)
T P T
0 0 0
Après le développement on trouve :
D D ? ?
T
G H T S D T T T T T T DT
g g g
= - + - + - + - -
2 2 2 3 3 3 r
r r r r r r r r r r r
,0 ,0 1 ,0 ,0 ,0 1
( ) ( ) ( ) ln
2 3 ? ?
? ?
T r ,0
D P
? ?
- - - - + + -
D T T T T T T T C P P
3 2 2
2 ,0
r r r r r r r
( ) ( ) ln ( )
r
,0 1 ,0
r r
2 ? ?
? ?
P r ,0
?
r ?
?
? ?
P P P T P
?
r r
P P T
(II.2 1)
,0 ,0 ,0 11
2 3 3 4 3 11
4 3 12
r r r r r
+ - + + - ,0
C C +
? ?
T T T T T
? 11 12
? ?
r r r r r
,0 ,0 ? ,0 ,0
T r
C P P P T
3 3 3
?
+ - +

4 ,0 ,0
r r r r
12 11
11 11 12
3 ? ? T T T
r r r
,0 ,0
II.3.2. Propriétés
thermodynamiques
L'enthalpie, l'entropie et le volume molaires sont liés
à l'enthalpie libre de Gibbs [33] :
2 ( )
? ? ?
G T
= - ? ? ? ?? (II.22)
r r
H RT T
B r T r P r
? ? ?
G
S R
= - ? ?
r(II.23)
? ? ?
T r P r
RT G
? ? ?
B r
V = ? ? (II.24)
PP
B r T
? ? ?
r
Après le développement des équations on
trouve :
II.3.2.1. Pour la phase liquide
H RT
L = B
? B B
( ) ( ) ( ) ( )( )
T T T T T T P P A A T
2 3 2
3 3
r r r r r r r r r
- + - + - + - -
,0 ,0 ,0 ,0 1 4
2 3
2 2
H B
L
? r ,0 1
+
A P P
2 2 2
( )
r r
- ,0
2
? ? ? ?
? ? ? ?
S R S B B T T T T A A T P P
L L T r B
= ? + + - + - - + -
3 2 2
,0 1 2 ,0 ,0 3 4 ,0
ln ( ) ( ) ( 2 )( ) ?
r r (II.26)
r ? ? r r r r r
? ? ? ?
? T 2
r ,0 ?
(II.27)
(II.28)
S D D T T T T C
g T r D
? + + - + - +
ln ( ) ( ) 3
3 2 2
r ,0 1 2 ,0 ,0 2 4
? ? r r r r
? T 2 ? T
r r
? ?
P P ?
r r ,0
? - Tr + ?
4 ?
,0 ,0 ? ?
?
?
? ? ? ? ? ? ?
P P P P P
3 3
11
,0 ,0
11 ln
3 - + - -
r r
r r r
C C
? ? ? ? ? ? ?
12 12 4 12 12
? ? ? ? ? ? ?
T T T T P
3
r r r r r
,0 ,0 ,0
? ? ?
? ?
?
(II.29)
S R
g =
2
? 2 3 4
V C
g B
RT C C P T
C r r
= ? ? + + + +
P T T T
1 3 11 11 P
B r r r r
V A A P A T A T
L B
RT 2
= ? ?
? + + + ?
1 2 3 4
r r r
P B
II.3.2.2. Pour la phase vapeur
?
) ?
? D D
H D T T T T T T C P P
g + - + - + - + -
( ) ( ) ( ) (
2 2 2 3 3 3
? r r r r r r r r r
,0 1 ,0 ,0 ,0 1 ,0
2 3
H RT
g = ? ? ? ? ? ? ?
?
B P P P P P P
3 3
? + - + - + -
,0 ,0 ,0
4 12 4
C C C
r r
r r r r
2 ? ? ? ? ? ? ?
3 3 11 11 4 11 11
3
? ? ? ? ? ? ?
T T T T T T
r r r r r r
,0 ,0 ,0 ?
Mélange
|
E1
|
-41.733398
|
E2
|
0.02414
|
E3
|
6.702285
|
E4
|
-0.01 1475
|
E5
|
63.608967
|
E6
|
-62.490768
|
E7
|
1.761064
|
E8
|
0.008626
|
E9
|
0.387983
|
E10
|
0.004772
|
E11
|
-4.648107
|
E12
|
0.836376
|
E13
|
-3.553627
|
E14
|
0.000904
|
E15
|
24.361723
|
E16
|
-20.736547
|
|
|
Ammoniac
|
Eau
|
A1
|
3.971423.10-2
|
2.748796.10-2
|
A2
|
-1.790557.10-5
|
-1.016665.10-5
|
A3
|
-1.308905.10-2
|
-4.452025.10-3
|
A4
|
3.752836.10-3
|
8.389246.10-4
|
B1
|
1.634519.101
|
1.214557.101
|
B2
|
-6.508119
|
-1.898065
|
B3
|
1.448937
|
2.911966.10-1
|
C1
|
-1.049377.10-2
|
2.136131.10-2
|
C2
|
-8.288224
|
-3.169291.101
|
C3
|
-6.647257.102
|
-4.634611.104
|
C4
|
-3.045352.10 3
|
0
|
D1
|
3.673647
|
4.019170
|
D2
|
9.989629.10-2
|
-5.175550.10-2
|
D3
|
3.617622.10-2
|
1.951939.10-2
|
L
Hr ,0
|
4.878573
|
21.821141
|
g
Hr ,0
|
26.468879
|
60.965058
|
L
Sr ,0
|
1.644773
|
5.733498
|
g
Sr ,0
|
8.339026
|
13.453430
|
Tr,0
|
3.2252
|
5.0705
|
Pr,0
|
2
|
3
|
|
Tableau II.2. Les coefficients pour les
équations (II.13.17.21.22.23.24.25.26) et (II.32.33.34)
[33].
II.4. Mélange ammoniac-eau II.4.1. Mélange
liquide [33]
Selon l'analyse donnée par Ziegler et Trepp
[26], la fonction de Gibbs d'un mélange liquide de
l'ammoniac-eau est donnée par la relation idéale de
mélange de solution plus l'énergie d'excès de Gibbs
GE. Cette énergie, dont la relation est
proposée par Xu et Yogi Goswami [28], est
limitée à trois facteurs, tient compte de la déviation du
comportement idéal de solution (la solution liquide ne se comporte pas
comme une solution idéale).
Gr = x - x ? F +
F x - + F x -
E ( ) ( ) ( )2
1 1 2 2 1 3 2 1 ?? (II.31)
?
E E
5
Avec : F E E P E E P T
1 1 2 r ( 3 4 r ) r 2
= + + + ++ 6 (II.32)
T T
r r
E E
11 12
F E E P E E P T
2 7 8 9 10
= + + + + +
r ( r ) r 2
T T
r r
|
(II.33)
|
|
E E
15 16
F E E P
3 13 14 r 2
= + + + (II.34)
T T
r r
Les coefficients Ei (i=1 ....16), pour les
équations (II.32.33.34) sont indiqués dans le tableau (II.2).
L'enthalpie, l'entropie et le volume d'excès sont données
par [33] :
? ? ?
( )
H RT T
E = - B r
2
G T
E
r r
(II.35)
? ?
? ? T
? ? ?
P r x
,
r
? ? ?
G E
S R
E r
= - ? ? (II.36)
? ? ?
T r P r , x
V E B r
= ?
RT G
? ? ?
E
? (II.37)
P P
B r T
? ? ?
r , x
Après le développement on trouve :
?
?
E (1 ) ?
H RT x x
= - ?
B
?
? ?
2 3
E E ? 2 3
E E E E P x E E P
5 6 11 12
1 2
+ + + + - + + +
2 7 8
(2 1)
r ? r 2
T T
r r ? T T
r r
E E ?
2 ? 2 3
+ - ? + + +
x E E P T T
15 16
(2 1) 13 14 2
r ?
? r r ?
?
?
? ?
? ? (II.38)
?
?
? ?
S Rx x
E = -
(1
|
? E E ? ? ?
E E
2
5 6
2
? - - + + + - - - + +
11 12
E E P x E E P
3 4 r 2 3 9 10
(2 1) ? ? ?
r 2 3
? ? ?
T T T T
r r r r ?
) (II.39)
? ?
? 2 15 16
? ?
E E
2
+ - ? + ? ?
(2 1)
x
? ? ? ?
T T
2 3
? r r ?
|
|
E B
RT 2
V x x E E T x E E T x
= - + + - + + - ?
(1 ) (2 1)( ) (2 1) 14
? E (II.40)
? 2 4 8 10
r r ?
P B
Donc, l'enthalpie, l'entropie et le volume molaire du
mélange liquide NH3-H2O deviennent :
H m = xH NH + - x H H O +
H E L L L
(1 )
3 2
|
(II.41)
|
|
S m = xS NH + - x S H O +
S + S L L L E
(1 )
3 2
|
ml
|
(II.42)
|
|
V m = xV NH + - x V H O +
V L L L
(1 )
3 2
|
E
|
(II.43)
|
|
Avec : [ ln( ) (1 )ln(1 ) ]
S = - R x x + - x - x
(II.44)
ml
II.4.2. L'enthalpie, l'entropie et le volume massique de
la solution liquide
La concentration massique est le rapport entre la masse de
l'ammoniac et celle de la solution :
Où : est la masse d'ammoniac de la solution ;
mNH3
m H2 O : est la masse d'eau.
Entre la concentration massique î et celle
molaire x existe la relation approchée :
M H O î
2
x ~ (II.46)
NH 3
M+î
La masse molaire à une solution de concentration molaire
x est :
M = - x M H O + xM N H (II.47)
L (1 )
2 3
Il en résulte donc les expressions pour l'enthalpie,
l'entropie et le volume massique de la solution liquide :
H L
h L m
=
m L
M
|
(II.48)
|
|
S L
s L m
=
m L
M
VL
v L m
m L
=
M
|
(II.49) (II.50)
|
|
II.4.3. Mélange vapeur
La solution dans la phase vapeur à été
considérée comme étant une solution idéale. Cette
hypothèse est basée sur l'absence de l'énergie
d'excès de Gibbs GE. L'enthalpie, l'entropie et le
volume molaires du mélange vapeur de NH3-H2O sont
calculés par :
H m = yH NH + - y H g H
g g (1 ) (II.51)
O
3 2
S m = yS NH + - y S H O +
S mg (II.52)
g g g
(1 )
3 2
V m = yV NH + - y V H O
(II.53)
g g g
(1 )
3 2
Où : [ ln( ) (1 )ln(1 ) ]
S = - R y y + - y - y
(II.54)
mg
II.4.2. L'enthalpie, l'entropie et le volume massique du
mélange vapeur Ont pour expressions :
Hg
h g m
= (II.55)
m g
M
S g
s g m
=
m g
M
|
(II.56)
|
|
V g
v g m
= (II.57)
m g
M
Où Mg est la masse molaire de la
solution dans la phase vapeur.
M = - y M H O + yM N H (II.58)
g (1 )
2 3
II.5. Conditions de saturation
II.5.1. Point de bulle
Le point de bulle est calculé à partir de la
corrélation proposée par EL-Sayed et Tribus
[34] :
i
7 10
? ? ? ? ? ? ? ? ? ?
? ? (II.59)
,
= - ? + ( ) ln
i c m
P
T T
eb c m i ij
C x
C
, ? ? ? ? ? ? ?
i j
= 1 1
? ? ? ? ? ? ?
? ?
P
= ?
4
Avec : 2 (II.60)
T T a x
c m c i
= -? )
H O i
(
,
i=1
? ?
8
( )
b x i
? ?
i
?
P c m P c =
H O
2 1
i
= e ? ?
,
|
(II.61)
|
|
Où Tc,m : est la température critique
du mélange NH3-H2O ;
Pc,m : est la pression
critique du mélange NH3-H2O.
II.5.1. Point de rosée
Le point de rosée est calculé à partir de
la corrélation proposée par EL-Sayed et Tribus
[34] :
i
6 4
? ? ? ?
? ? ? ? ?
,
[ ]
, ? ? ? ?
ln(1.0001 ) ln
j c m
P ?
T T
d c m i ij
= - ? + -
? ? (II.62)
d A x ? ? ?
i j
= 1 1
? ? ? ?
? ?
? ? ?
P
= ?
Les équations (II.59.60.61.62) la pression en [psi] et la
température en [°F].
Les coefficients pour les équations (II.59.60.61.62) sont
indiqués dans le tableau (II.3) [33].
i
|
ai
|
bi
|
Ci
|
di
|
1
|
205.0009
|
0.368105523897
|
153.634521459
|
153.17055346
|
2
|
280.930556
|
- 3.6679548875
|
- 13.0305543892
|
- 11.7705687461
|
3
|
-317.0130009
|
46.6000470809
|
- 1.14845282991
|
- 1.78126355957
|
4
|
263.194444
|
-262.921061996
|
0.550358094447
|
0.647385455059
|
5
|
|
732.99536936
|
- 0.0753450148427
|
-0.0719950751898
|
6
|
|
- 1076.0613489
|
0.0048111668267
|
0.00285423950706
|
7
|
|
797.948078048
|
-0.000120433757177
|
|
8
|
|
- 235.903904222
|
|
|
|
Aij
|
j
|
1
|
2
|
3
|
4
|
i
|
|
|
194.793913463
|
74.236124188
|
9.84103819552
|
0.436843852745
|
2
|
- 74.3508283362
|
-33.2941879809
|
-4.78866918581
|
-0.225416733476
|
3
|
13.0175447367
|
6.1586564117
|
0.789740337141
|
0.03215 10834958
|
4
|
-0.90857587517
|
-0.356752691147
|
0.0238067275502
|
0.00495593933952
|
5
|
-0.00071863574153
|
-0.0251026383533
|
-0.0191664613304
|
-0.0017014253867
|
6
|
0.00195441702983
|
0.00280533349937
|
0.0013899436563
|
0.000116422611616
|
|
C ji
|
i
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
j
|
|
|
-462.460321366
|
421.443122208
|
-248.783804168
|
126.965580728
|
-33.5343446156
|
3.97454953787
|
-0.170806170177
|
2
|
23739.9986309
|
- 14560.354925
|
4807.07241098
|
- 2090.45270574
|
601.878586689
|
- 77.026846469
|
3.48182859299
|
3
|
- 194504.35292
|
53051.4495633
|
13565.1003309
|
1993.17101166
|
-3064.82070658
|
541.19105807
|
- 27.7957587743
|
4
|
639383.528867
|
382763.793582
|
- 466407.780832
|
100706.510396
|
71.7954752052
|
- 1696.60270972
|
113.762064546
|
5
|
- 523748.057636
|
- 3.58358986875E+6
|
2.82708344764E+6
|
- 687388.808612
|
5 1780.666659
|
1713.45942707
|
- 258.750496922
|
6
|
-2.32827147551E+6
|
1.22432653815E+7
|
-8.46971515799E+6
|
2.13241246959E+6
|
-209714.899856
|
4019.01019872
|
311.002585218
|
7
|
7.5624I853499E+6
|
-2.23079700156E+7
|
1.4459588896E+7
|
-3.69919965914E+6
|
405011. 985355
|
- 14844.7928004
|
- 123.917993454
|
8
|
- 9.66829589504E+6
|
2.28966568499E+7
|
-1.42810875331E+7
|
3.68836522546E+6
|
-428310.461566
|
19481.0094551
|
- 123.480627492
|
9
|
5.92208187086E+6
|
- 1.24833248091E+7
|
7.59640359678E+6
|
- 1.97512239296E+6
|
238153.698326
|
-12107.0794501
|
154.375042114
|
10
|
- 1.43240552125E+6
|
2.81331171633E+6
|
- 1.68400264482E+6
|
440201.446068
|
- 54497.0973336
|
2966.92804386
|
-48.5083828701
|
|
Tableau II.3. Les coefficients pour les
équations (II.59.60.61.62) [33].
II.6. Propriétés de transport de la
solution NH3-H2O [35] II.6.1. Densité de la solution liquide
Une relation semi-empirique du calcul de la densité de la
solution liquide à la saturation est la suivante :
2
= - + - + - + +
( 0.00695 1 .304 57.675 ) (0.00547 1 .0625 48.75 50)
(II.63)
T T T T T T
3 2 3 3 2
ñ î î
(0.00128 0.264 14.1 305) 8.3310 0.0206 0.817 990
T T T T T T
3 2
- + + + - + +
î - 5 3 2
Cette relation fournie les valeurs de la densité
exprimées en (Kg.m-3), le domaine de précision
satisfait pour les calculs techniques est :
· Pour les températures : 0< T < 100
[°C] ;
· Pour les concentrations : 3
0.1 < î < 0.5 ? ? kg / m
? ? .
On peut calculer la concentration massique de la solution
NH3-H2O sur la base de la connaissance des densités et des
températures :
5.5965 8.1301 2.5260 0.029266 1.099910 0.047472
+ - + - -
v v T T
2 - 4 2
vT
î = -
kg et T
? ?
|
[ ]
° C
|
(II.64)
|
|
+ + - ? ?
0.017601 1.698410 60501310 /
v T vT v T v m
2 4 2 5 2 2 3
- -
Dans le domaine de validité de l'équation
(II.63), l'erreur moyenne dans le calcul de la concentration est de 0.0012,
mais celle maximale est de 0.004.
Dans la figure (II.1) on représente le diagramme des
variations de la densité de la solution NH3-H2O en fonction de
la concentration et la température.
Figure II.1. La densité de la
solution NH3-H2O liquide.
|
|
|
II.6.2. La viscosité dynamique de la solution
liquide
Pour la viscosité dynamique de la solution liquide, il
est proposé la relation :
ln( ) ln( ) 3 (1 )ln ln( ) (1 ) ln( )
u î u î î u î u
= + - ? + ? + -
L 2 3 L
C C
L
? ?
NH 1 2
NH
3 H O
3 2
+ - ? + ?
3 (1 ) ln ln( )
î î u
2
? ?
C C
L
3 4
H O
2
|
(II.65)
|
|
Les constantes de cette relation ont pour valeurs :
C = 1.6582 C = 7.1638 C = 1.3575
C 4 = 3.6066.
1 2 3
La viscosité dynamique de l'eau liquide est :
u - ?
6 1731
L 5
= ?? - +
10 exp 6.278 5.61610 T
H O
2 T
|
2 ??
?
|
(II.66)
|
|
La viscosité dynamique de l'ammoniac liquide est :
10 exp 0.3180 5.983910
L 5
= T
NH
- ?
6 2214
? ? - +
T
2 ??
?
(II.67)
Dans les relations (II.66) et (II.67), T[k],
u[Pas.s].
La figure (II.2) présente la variation de
viscosité dynamique en fonction de la concentration massique. Le domaine
de validité de l'équation (II.65) est :
· Pour les concentrations : 0.3 < î
<0.9 ;
· Pour les températures : 10< T< 60
°C.
Dans ce domaine, l'erreur moyenne fournie par l'équation
(II.65) est de 6%, alors que celle maximale est de 12%.
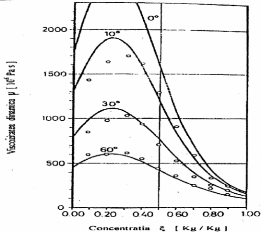
Figure II.2. La viscosité dynamique de
la solution NH3-H2O liquide.
II.6.3. La viscosité dynamique de la solution
gazeuse
La solution gazeuse est considérée comme
étant une solution idéale, donc la viscosité de la
solution gazeuse est :
u = - î u H O + îu
NH (II.68)
g g g
(1 )
2 3
Avec :
u H O - T T
g = - + - - 2
31.89 41.4510 8.27210
2 6
2
|
(II.69)
|
|
g 6 2
9.372 38.9910 44.0510 -
Et : u NH - T
= - + -
2 T(II.70)
3
La relations (II.69), pour la vapeur d'eau est valable pour
l'interval de température : 0 °C <T<1 000 °C, et la
relation (II.70) est valable pour l'interval de : -200 °C <T<
1200 °C, ainsi que les valeurs calculées résultes en
micropois. La température est exprimée en k.
II.6.4. La conductivité thermique de la solution
gazeuse
Pour la solution gazeuse composée de la vapeur d'eau
et de l'ammoniac en phase gazeuse, on peut accepter l'hypothèse d'une
solution idéale composée d'un gaz parfait. Dans ces conditions,
la conductivité thermique de la solution gazeuse a l'expression :
ë = - î ë H O +
îë NH (II.71)
g g g
(1 )
2 3
Où ë H O et ë N H
représentent la conductivité thermique de l'eau en état
vapeur et la conductivité
g g
2 2
thermique d'ammoniac gazeuse, respectivement.
g = - + - 8 3
17.53 2.4210 4.310 21.7310
2 4 2 -
ë H O - T - T T
2
|
(II.72)
|
|
Cette relation est valable pour l'intervalle de : 0
°C<T<800 °C.
ë NH - T - T
g = + + -
091 12.8710 2.9310 8.6810
2 4 2
3
|
-
|
8 3
T
|
(II.73)
|
|
Cette relation est valable pour l'intervalle de : 0
°C< T< 1400 °C. Les valeurs calculées pour les deux
équations (II.72.73) résultes en (microcal/s.cm.k). La
température est exprimée en k.
II.6.5. La conductivité thermique de la solution
liquide
Pour la solution liquide, on peut accepter l'hypothèse
d'une solution idéale. Dans ces conditions la conductivité
thermique de la solution liquide a pour expression :
ë = - î ë H O +
îë NH (II.74)
L L L
(1 )
2 3
Avec :
ë H O - T - T
L = - + - 2
0.4743 5.79310 7.22210
3 6
2
|
(II.75)
|
|
La relation (II.75) est valable pour l'intervalle de : 273
k<T<373 k.
ë T T
L -
= - -
-
1.06094741 1.576510 1.228510
3 6
NH 3
|
2
|
(II.76)
|
|
La relation (II.76) est valable pour l'intervalle de : -77
°C<T<100 °C. ë en (w/m.k).
La figure (II.3), représente la variation de la
conductivité thermique de la solution NH3- H2O liquide en
fonction de la concentration et de la température.
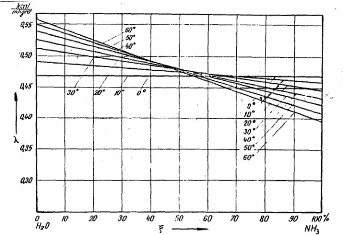
Figure II.3. La conductivité thermique
de la solution NH3-H2O liquide.
II.6.6. La chaleur spécifique isobare pour la
solution gazeuse
En adaptant l'hypothèse de la solution idéale
dans la phase gazeuse, composée à son tour d'un gaz parfait, en
peut supposer les relations suivantes pour le calcul de la chaleur
spécifique isobare de la solution gazeuse :
Cp= - î Cp H O + î Cp N H g g
g
(1 )
2 3
La chaleur spécifique isobare pour la vapeur d'eau est
donnée par :
Cp H O T T T
g - 10 3
= + + -
1.79 0.1 110 0.5910 2.0010
- -
3 6 2
2
|
(II.77)
(II.78)
|
|
Cette relation est valable pour l'intervalle de : 10
°C<T<115 °C.
La chaleur spécifique isobare pour l'ammoniac vapeur est
donnée par :
CpNH T T T
g = + + - 3
1.604 1.410 10 6.9610
- - -
3 6 2 10
3
|
(II.79)
|
|
Cette relation est valable pour l'intervalle de : -50
°C<T<50 °C. Les valeurs calculées résultes
en (kj/kg.k), la température est exprimé en k.
II.6.7. La chaleur spécifique isobare pour la
solution liquide La chaleur spécifique isobare de la solution
liquide est donnée par la relation :
L = + + ?
4.186 1 (0.118 0.00208 )
? î T
2
Cp (II.80)
? ?
Où bien on peut le calculée à partir de la
relation :
Cp = - î Cp H O + î Cp NH L L
L
(1 )
2 3
|
(II.8 1)
|
|
Les relations de calcul pour les chaleurs spécifiques
isobares de l'ammoniac et l'eau liquide sont :
L -
= - + - +
6 2
CpNH 9 3
8.049678 0.1301846 464.227410 575.9936 10
T T T
-
3
|
(II.82)
|
|
La relation (II.82) valable pour le domaine : -77.4
°C<T<100 °C.
L 2.8217826 11.8254510 35.04100610
36.00378610 - 9 3
= + - +
- 3 - 6 2
Cp H O T T T
2
(II.83)
Cette relation est valable pour l'intervalle de : 0
°C< T<350 °C. Les valeurs calculées résultes
en (kj/kg.k), la température est exprimé en k.
La figure (II.4), présente la variation de la solution
NH3-H2O liquide en fonction de la concentration et la
température.
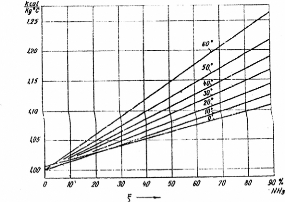
Figure II.4. La chaleur spécifique
isobare de la solution NH3-H2O liquide.
Conclusion
Le mélange ammoniac-eau a été le couple
binaire principal dans les machines frigorifiques à absorption pour
plusieurs années. Beaucoup d'études ont été faites
sur l'équilibre vapeur-liquide et sur les propriétés
thermodynamiques et de transport de ce mélange, y compris des
données P-T-x-y et des propriétés thermiques.
Aussi, une description du modèle
développé, est présentée ; une équation
d'état pour la phase vapeur et une équation décrivant la
non idéalité de la phase liquide. Ces équations
permettront la résolution du problème de l'équilibre
liquide-vapeur, quasiment nécessaire pour le calcul du cycle.
Cependant les écarts à l'idéalité
sont généralement beaucoup plus marqués en phase liquide,
en raison de sa densité, qu'en phase vapeur, et par conséquent il
est d'usage d'adopter l'hypothèse d'un équilibre entre une phase
vapeur assimilée à un mélange de gaz parfait et une phase
liquide non idéale, ce qui permet de simplifier aussi les calculs
mathématiques.
| 


