|
Evaluation des méthodes d'estimation de la pression de
vapeur pour la modélisation des aérosols
organiques
secondaires
KOMKOUA MBIENDA Armand Joël
11 avril 2011
Dédicaces
A la mémoire de papa MBIENDA Jean,
à maman TCHOUANWOU Louise,
qui ont toujours été là pour moi, et qui
m'ont donné un magnifique modèle de labeur et de
persévérance. J'espère qu'ils trouveront dans ce travail
toute ma reconnaissance et tout mon amour.
Je leur dédie ce mémoire.
Remerciements
Je tiens tout d'abord à remercier le Professeur
TCHAWOUA Clément, qui malgré ses multiples occupations s'est
montré disponible pour diriger ce travail jusqu'à la fin.
Je remercie également le Professeur MKANKAM KAMGA
François, chef du Laboratoire de Modélisation Environnemental et
de Physique de l'Atmosphère (LAMEPA) pour sa rigueur, la qualité
de ses enseignements et les conditions de travail adéquates dont nous
avons bénéficiées.
J'exprime ma profonde reconnaissance à tous les
enseignents du LAMEPA : Pr. NZEUKOU, Pr. MONKAM, Dr. MBIAKE, Dr. NKEGNE, Dr.
LENOUO pour toute la formation dont ils nous ont offerte.
Je tiens à remercier les membres du jury pour l'honneur
qu'ils me font en acceptant de participer à ce jury.
Ma gratitude va aussi à l'endroit du Professeur OWONO
OWONO Luc Calvin et au Dr. MBOUNGA Jean Marie, tous deux enseignants à
l'Ecole Normale Supérieure de l'Université de Yaoundé I
pour la qualité de leur enseignement et les conseils qui resterons
toujours gravés dans notre mémoire.
Mes remerciements vont au Dr. Marie CAMREDON du Laboratoire
Interuniversitaire des Systèmes Atmosphériques (LISA) de
l'Université de Paris 12 et Paris 7 pour sa collaboration qui nous a
permis d'avoir certains articles et nous a motivé pour contruire la base
de données utilisée dans notre mémoire.
Je remercie Dr. VONDOU Débertini et Dr. Djiotang Lucie
du LAMEPA pour leur disponibilité et les efforts consentis à
notre égard.
Je remercie nos aînés du LAMEPA : POKAM Wilfried,
NGUENANG Guy, YEPDO Zephirin, TANESSONG Roméo, TCHAKOUTIO Alain, MOUDI
Pascal pour leur disponibilité et conseil.
Ma reconnaissance va aussi à mes camarades FOUELEFACK,
BABALE, TAKONG, SONFAFK, KAÏSSASSOU, EMBOLO, NONO, AMOUGOU, MOTIO, ZEBAZE,
PENKA, CHAMANI, NKOA, pour leur précieuse collaboration.
Je n'oublie pas bien sûr les innombrables personnes qui
m'ont soutenu, encouragé ou qui, tout simplement, m'ont offert leur
amitié durant ces années travail.
Le meilleur est pour la fin. A ma famille, j'ai choisi parmi
tout les mots de la Terre et même de l'univers, les plus scincères
et ceux que mon coeur préfère pour vous dire simplement merci.
Dédicace i
Remerciements ii
Liste des figures vi
Liste des tableaux vii
Table des abréviations viii
Résumé ix
Abstract x
Introduction Générale 1
1 Généralités 3
1.1 Eléments de base sur les aérosols 3
1.1.1 Définition 3
1.1.2 Les sources des aérosols 3
1.1.3 La composition chimique 4
1.1.4 Les puits d'aérosols 4
1.2 Oxydation des COV dans la troposphère 5
1.2.1 Mécanisme d'oxydation des COV 5
1.2.2 Les étapes d'oxydation des COV 6
1.3 Thermodynamique des aérosols 7
1.3.1 Rappels fondamentaux sur la thermodynamique 7
1.3.2 Les potentiels chimiques 9
1.3.3 Potentiels chimiques de solutions 10
1.4 Représentation de l'équilibre gaz/particules
10
1.4.1 Théorie de l'équilibre gaz/particules 10
1.4.2 Equilibre thermodynamique phase gazeuse-phase particulaire
. . . . 11
2 Données et méthodes utilisées 14
2.1 La relation structure-propriété 14
2.1.1 Principe de base des techniques de contribution de groupe
14
2.1.2 Hiérachie des groupes 15
2.1.3 Techniques de contribution de groupes employées dans
le cadre de
notre travail 16
2.2 Description des méthodes d'estimation de la pression
de vapeur 17
2.2.1 Définition de la pression de vapeur 17
2.2.2 Méthode de Lee et Kesler (LK) 18
2.2.3 Méthodes basées sur l'équation de
Clausius-Clapeyron 18
2.3 Présentation des données 22
2.3.1 Données expérimentales 22
2.3.2 Données d'estimation 22
3 Résultats et analyses 25
3.1 Evaluation des propriétés de corps purs 25
3.1.1 Température d'ébullition 25
3.1.2 Température critique 26
3.1.3 Pression critique 28
3.2 Evaluation des méthodes d'estimation de la pression de
vapeur 29
3.2.1 Méthode de LK 30
3.2.2 Méthode de mM 32
3.2.3 Méthode de MY 34
Conclusion Générale et Perspectives 37
Bibliographie 38
Table des figures
1.1 Principaux mécanismes impliqués dans
l'oxydation troposphérique des COV 5
1.2 Principales étapes de l'oxydation des COV dans la
troposphère 7
3.1 Estimation de la température d'ébullition par
la technique de Joback . . . . 26
3.2 Estimation de la température critique par la technique
de Joback 27
3.3 Estimation de la température critique par la technique
de Lydersen 28
3.4 Estimation de la pression critique par la technique de Joback
29
3.5 Estimation de la pression critique par la technique de
Lydersen 30
3.6 Estimation de la pression vapeur par la méthode de LK
31
3.7 Boîte à moustache de la différence entre
valeur estimée par LK et valeur
expérimentale 32
3.8 Estimation de la pression vapeur par la méthode de mM
33
3.9 Boîte à moustache de la différence entre
valeur estimée par mM et valeur
expérimentale 33
3.10 Estimation de la pression vapeur par la méthode de MY
34
3.11 Boîte à moustache de la différence entre
valeur estimée par MY et valeur
expérimentale 35
3.12 Droites de correlation des différentes
méthodes 35
Liste des tableaux
|
2.1
|
Contributions de groupe de Joback
|
23
|
|
2.2
|
Contributions de groupe de Lydersen
|
24
|
|
3.1
|
EAM pour différentes familles de composés et pour
chaque méthode
|
31
|
|
3.2
|
ESM pour différentes familles de composés et pour
chaque méthode
|
32
|
Table des abréviations
COV: Composés Organiques Volatils COSV : Composés
Organiques Semi-Volatils AOS : Aérosols Organiques Secondaires PTS
:Particule Totale en Suspansion
CSA :Chambre de Simulation de l'Atmosphère NLH : Nombre de
Liaison Hydrogène
INST : Institut Nationale des Standards et de la Technologie
ESM : Erreur Systématique Moyenne EAM : Erreur Absolue
Moyenne ppb : particules par milliard
Résumé
Les aérosols organiques secondaires (AOS) font partir
des particules atmosphériques dont l' impact climatique et
environnemental n'est plus à démontrer. Ils sont formés
à partir des composés organiques volatils (COV) par un processus
de partitionnement gaz/particule. Ainsi, on a recours à des constantes
d'équilibres entre phase gazeuse et particulaire appelées
coefficient de partition pour décrire l'équilibre thermodynamique
des composés organiques. L'un des paramètres important controlant
ce processus est la pression de vapeur. A cet effet, compte tenu de la myriade
des précursseurs des AOS et des données très
limitées, l'usage de la relation structure-propriété est
dans la plus part des cas nécessaire pour connaître ce
paramètre. La technique de Joback s'est avérée la plus
apropriée pour estimer la température d'ébullition. Pour
estimer la température et pression critiques, la technique de Lydersen a
fourni les résultats les plus convainquants. Nous avons utilisé
la méthode de Lee et Kesler, la méthode de l'équation
modifiée de Mackay, et la méthode de Myrdal et Yalkowsky pour
l'estimation de la pressions de vapeur. A partir d'un ensemble de 267
composés précursseurs des AOS, nous avons obtenu des
résultats qui montrent d'une manière générale que
la méthode de Myrdal et Yalkowsky est la plus appropriée pour
l'estimation de la pression de vapeur en vue de la modélisation des
aérosols organiques secondaires.
Mots clés : Aérosols organiques secondaires;
Partitionnement gaz/particule; Relation structure-propriété;
Pression de vapeur
Abstract
Secondary organic aerosols (SOA) are atmospheric particles
whose climate and environment impact is well established. They are formed from
volatile organic compounds (VOCs) through a process of gas/particle
partitioning . Thus, it makes use of equilibrium constants between gas phase
and particle called partition coefficient to describe the thermodynamic
equilibrium of organic compounds. One of the important parameters controlling
this process is the vapor pressure. To this end, given the myriad of SOA
precurssors and data very limited, the use of structure-property relationship
is in most cases necessary to know this parameter. Joback technic proved to be
the most appropriate of estimating the boiling temperature. To estimate the
critical temperature and pressure, the Lydersen technic provided the most
convincing results. We used the method of Lee and Kesler, the method of the
modified equation of Mackay and the Myrdal and Yalkowsky method for estimating
the vapor pressure. From a set of 267 compounds precurssors of SOA, we obtained
results which show generally that the Myrdal and Yalkowsky method is most
appropriate for estimating the vapor pressure in light of the modeling of
secondary organic aerosols.
Keywords : Secondary organic aerosols; Gaz/particle partitioning;
Structure-property relationship; Vapor pressure
L'atmosphère est un système complexe qui agit
comme un véritable mélangeur d'espèces chimiques. Sa
compréhension est crutiale pour mieux réagir face aux menaces que
constitue la pollution atmosphérique contre notre environnement. Ainsi,
l'atmosphère fluide en perpetuel mouvement brasse aussi bien les
espèces vitales que les espèces dangereuses pour les êtres
vivants. La pollution atmosphérique d'origine anthropique trouve l'une
de ses démonstrations scientifiques en décembre 1930 en Belgique
(dans la vallée de Meuse) lorsqu'un nuage de poussière causa la
mort de 65 personnes (Firket 1931). La même enquête conclut que si
les mêmes conditions étaient réunies à Londre, plus
de 3000 personnes pouraient trouver la mort. C'est exactement ce qui se
produisit dans cette ville en décembre 1952 où l'épisode
de
|
smog de Londre ½fit plus de 3000 morts (Wilkins 1954).
|
Au cours du XXieme siècle, et
à l'aube du XXIieme siècle la croissance des
activités industrielles et humaines n'a cessé d'augmenter la
charge atmosphérique en polluants gazeux et particulaires dont la
dangérosité n'est plus à démontrer. C'est
précisement sur ces émissions anthropiques que les études
actuelles tandent à montrer qu'une limitation du nombre de particules et
de précurseurs de particules pourrait s'avérer plus rapidement
efficace qu'une réduction des émissions de gaz à effet de
serre, du fait du temps de résidence plus faible des particules (Hansen
et al. 2000; Jacobson 2002). A cet effet, les aérosols
atmosphériques font partis des variétés d'espèces
qui contribuent à mieux définir l'etat de l'atmosphère.
L'impact des aérosols, très divers, touche alors
différents domaines : climat et physico-chimie de l'atmosphère,
écosystème et sol, santé en liaison avec de nombreuses
activités humaines (Guillaume 2006) . Ils ont une concentration pouvant
variée de 107 à 108 particules par
cm3 et des diamètres allant jusqu'à
100um (Danier 2003). Notre connaissance des aérosols
atmosphériques et des processus chimiques et physiques auxquels ils
participent est encore très incomplète, contrairement à la
phase gazeuse (Tombette 2007). En effet, la phase particulaire est bien plus
complexe car elle nécessite une description de son état (liquide
ou solide), de son mélange (externe, interne), de sa composition
chimique (organiques et inorganiques), de sa granulométrie (nombre,
masse et taille) et de sa géométrie (sphérique ou
autre).
Selon leur taille, les aérosols peuvent être
regroupés en trois catégories : Les gros aérosols
(diamètre > 2500nm) qui sont essentielement d'origine naturelle, les
aérosols fins (diamètre compris entre 50 et 2500nm) et les
aérosols ultrafins (diamètre < 50nm) (Tombette 2007). Cette
dernière catégorie resulte généralement des
processus physico-chimiques engageant certains gaz atmosphériques qui
peuvent être d'origine anthropique ou naturelle. On les appelle les
aérosols secondaires. Une part importante de ces aérosols
secondaires sont les aérosols organiques secondaires (AOS). Les
espèces organiques pouvant mener à la formation des AOS sont
issues d'une myriade de composés organiques volatils (COV). Les
processus de formation des AOS peuvent suivre des schémas
physico-chimiques complexes, dont beaucoup restent encore inconnus. La
formation des AOS insitu est surtout mal comprise, les composants des
AOS ayant été étudiés principalement dans des
expériences en chambre confinée (chambre de simulation de
l'atmosphère CSA) (Griffin et al. 1999; Odum et al. 1997). C'est ainsi
dans ce contexte fort intéressant et multidimensionnel que se situe
notre travail basé sur l 'evaluation des methodes d'estimation de la
préssion de vapeur pour la modélisation des aérosols
organiques secondaires. L'objectif visé est de mener une étude
détaillée et comparative de trois méthodes d'estimation de
la pression de vapeur pour la modélisation des AOS. Pour mieux mener
à bout notre travail, nous l'avons structuré en trois
chapitres.
Le premier chapitre traite des
généralités. Plus explicitement, il présente
quelques notions essentielles sur les aérosols et explicite infine
quelques élements fondamentaux qui permettent de comprendre le
principe de formation des AOS. Le deuxième chapitre quant à lui
se focalise sur les données et explicite clairement les méthodes
utilisées. Enfin le chapitre trois est consacré aux
résultats et quelques analyses. Le memoire se termine par un conclusion
générale et les perspectives.
Ce chapitre présente des
généralités sur les aérosols en
général et les aérosols organiques secondaires en
particulier. Avant d'atteindre le processus de la modélisation du
partitionnement gaz-particules, nous présentons la thermodynamique des
aérosols qui nous permet directement d'expliciter le processus
d'oxydation des composés organiques volatils dans la
troposphère.
1.1 Eléments de base sur les aérosols
1.1.1 Définition
Les aérosols sont les particules solides ou liquides
qui ont une vitesse de chute négligeable dans l'air calme (
vitesse<25cm/min) (Kummer 2004). De nombreux modes de classification des
aérosols existent. On distingue les aérosols suivant leur
composition chimique (aérosols organiques et inorganiques), suivant leur
lieu privilégié de formation (aérosols urbains,
ruraux,troposphériques ou stratosphériques), suivant leur
processus de formation (aérosols primaires ou secondaires), de leur
origine (anthropique ou naturelle) (Debry 2004). Notons qu' il y a une
disproportion entre les émissions naturelles (94Z) et les
émissions anthropiques (6Z) (Crumeryolle 2008).
1.1.2 Les sources des aérosols
Les aérosols ont de nombreuses sourses qui varient
souvent rapidement dans le temps et l'espace. On distingue les sources des
aérosols primaires des aérosols secondaires. Comme sources
primaires, on peut citer principalement l'érosion de poussière
sous l'action du vent, la formation d'aérosols marins
libérés par l'éclatement à la surface d'un
océan de bulles d'air formées lors du déferlement des
vagues (Albriet 2007), les éruptions volcaniques ou encore les diverses
activités de la planète. Les aérosols d'origine
anthropique proviennent
principalement du trafic routier et aérien, et des
différentes activités industrielles. Cependant, on pourrait y
ajouter également tous les processus de combustion tels que les feux de
bois ou encore la fumée de cigarette. L'émission des
composés organiques volatils (COV) d'origine anthropique est une source
d'aérosols secondaires. En effet, ces COV peuvent être
oxydés dans l'atmosphère pour donner naissance à des
composés dont la pression de vapeur saturante est suffisamment faible
pour former les aérosols organiques secondaires par des processus de
transformation gaz/particule.
1.1.3 La composition chimique
On distingue principalement les aérosols inorganiques
et les aérosols organiques. Parmi les principales espèces
inorganiques simulées dans les modèles d'aérosols, on peut
citer les sulfates, les nitrates, les chlorates, l'ammoniaque et le sodium. Les
espèces organiques quant à elle sont moins bien connues (Albriet
2007). C'est pour cette raison que des espèces dites modèles sont
généralement utilisées pour simuler la phase organique.
Dans notre travail,nous utitliserons les espèces telles que les
hydrocarbures, les alcools, les acides carboxiliques, les aldéhydes, les
cétones,les esters et les eters. Enfin, des espèces inertes
telles que les poussières minérales ou le carbone
élémentaire ont une importance non négligeable.
1.1.4 Les puits d'aérosols
Une fois en suspension dans l'atmosphère, les
aérosols troposphériques ont une durée de vie
limitée avant d'être déposés ou transformés.
La durée de vie moyenne des aérosols varie de quelques jours
à quelques semaines (Albriet 2007). Cependant, cette durée est
évidemment très variable en fonction de la taille de
l'aérosol et aussi de son environnement. On distingue principalement
deux phénomènes de dépôt :
- Le dépôt sec qui dépend principalement
de la rugosité du sol qui caractérise sa capacité à
capter les particules en suspension;
- Le lessivage humide des particules qui sont drainées
par les gouttelettes de pluie jusqu'à la surface du sol.
Les aérosols secondaires représentent la
catégorie d'aérosols qui ne sont pas directement émis dans
l'atmosphère. Ils sont produits à partir des espèces en
phase gazeuse par l'intermediaire des réactions chimiques (Danier 2003).
Parmi les espèces gazeuses, se trouvent les composés organiques
volatils (COV) qui, à partir du processus d'oxydation permettent la
formation des aérosols organiques secondaires (AOS).
1.2 Oxydation des COV dans la troposphère
Les réactions chimiques dans l'atmosphère se
déroulent principalement dans la troposphère (Camredon 2007). Le
terme de "capacité oxydante de la troposphère" est
communément utilisé en référence à la
vitesse des mécanismes d'oxydation.
1.2.1 Mécanisme d'oxydation des COV
Les COV regroupent une très grande diversité
d'espèces. Les COV d'origine primaire sont principalement des
hydrocarbures. A l'échelle globale, environ 90Zdes hydrocarbures
émis dans la troposphère provient de sources naturelles
(Müller 1992; Brasseur et al. 1999) . A l'échelle locale, les COV
d'origine anthropique peuvent être majoritaires à proximité
des zones urbaines. Ils ont un temps de vie très variable allant de
quelques heures pour les espèces les plus réactives, à
plusieurs années pour des espèces comme le méthane
(Atkinson 2000). Les concentrations de COV non méthaniques varient de
quelques ppbC en milieu éloigné de sources intenses
d'émissions à plusieurs centaines de ppbC en milieu urbain
(Firlayson et Pitts 2000; Seinfeld et Pandis 2006). La représentation
des mécanismes majeurs impliqués dans le processus de formation
des COV est schematisée ci-dessous : L'oxydation
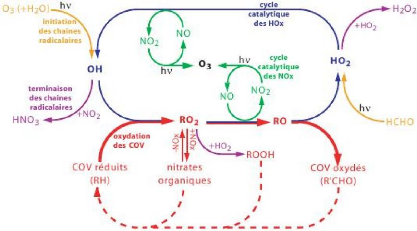
Figure 1.1 Principaux mécanismes impliqués dans
l'oxydation troposphérique des COV (d'après Camredon et Aumont,
2007a)
des COV passe par une chaîne radicalaire complexe
imbriquée dans le cycle catalytique des
HOX (OH, HO2 et RO2 ) et des
NOx. Cette oxydation est progressive. Elle implique une
multitude de composés organiques intermédiaires (Aumont et al.
2005). Les COV sont principalement consommés par réaction avec le
radical OH, menant à la formation d'un radical péroxyle
(RO2). Ce radical évolue, principalement par réaction
avec NO, vers un radical alkoxyle (RO). Cette réaction est
concurrencée par la formation d'une espèce stable selon les
réactions RO2 + NO (formation de nitrates
RONO2) ou RO2 + HO2 (formation
d'hydropéroxydes ROOH). Les radicaux alkoxyles (RO) vont réagir
avec O2 pour former des composés stables carbonylés. Les
espèces stables réagissent à leur tour avec le radial OH
pour former un composé à nouveau oxydé et ainsi de suite
jusqu'à l'oxydation totale du carbone en CO2. Ces processus
d'oxydation gazeuse mènent donc à la formation de COV d'origine
secondaire, portant des fonctions oxygénées et azotées.
La nature des groupes fonctionnels progressivement
ajoutés au squelette carboné de la molécule primaire lors
de l'oxydation est extrêmement variable ( on a par exemple les alcools,
aldéhydes, cétones, nitrates, hydropéroxydes, acides
carboxyliques). Elle dépend des conditions environnementales
considérées, notamment de la température (Atkinson 2000).
L' oxydation des COV s'effectue en plusieurs étapes dont il est
important de reléver.
1.2.2 Les étapes d'oxydation des COV
L'oxydation des COV s'éffectue de manière
progressive. Les étapes de cette oxydation peuvent être
décrites par un nombre limité de réactions
répétées de nombreuses fois jusqu'à l'oxydation
complète du composé parent. D'une manière globale, ces
étapes peuvent être résumées par la figure suivante
:
- l'initiation de la chaîne radicalaire organique par
les réactions avec OH, NO3 , O3 ou par rupture d'une
liaison après absorption d'un photon. Cette première étape
conduit généralement à la formation d'un radical
péroxyle RO2.
- les réactions des radicaux péroxyles avec NO,
NO2 , NO3 , HO2 ou avec d'autres RO2. Ces
réactions conduisent soit à la formation d'un composé
organique secondaire stable, soit à la formation d'un radical alkoxy
(RO).
les réactions des radicaux alkoxy avec O2, par
décomposition unimoléculaire (rupture
d'une liaison C-C) ou par isomérisation. Ces
transformations conduisent soit à la for-
mation d'un COV secondaire stable, soit à la formation
d'un radical RO.
Une fois le processus d'oxydation terminé, la
transformation gaz-particule s'impose. A cet effet, la thermodynamique des
aérosols est un outils incontournable pour une bonne
compréhension du processus de partitionnement gaz-particule pour la
modélisation des aérosols secondaires en général et
des aérosols organiques secondaires (AOS) en particulier.
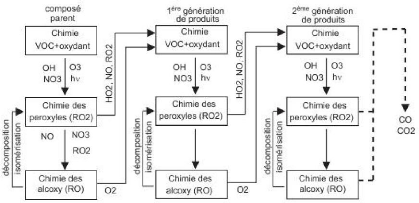
Figure 1.2 - Principales étapes de l'oxydation des COV
dans la troposphère [d'après Aumont et al., 2005].
1.3 Thermodynamique des aérosols
1.3.1 Rappels fondamentaux sur la
thermodynamique a) L'énergie interne
Soit une petite parcelle d'air. En considérant qu'elle
constitue un système fermé (pas d'échange de masse avec
l'extérieur), le premier principe de la thermodynamique donne:
dU = dQ + dW (1.1)
où dU est la variation d'énergie interne, dQ est
la quantité infinitésimale de chaleur absorbée par le
système et dW = --PdV est la quantité
infinitésimanle de travail effectué avec P la pression du
système et dV sa variation infinitésimale de volume.
D'après la seconde loi de la thermodynamique, la
chaleur ajoutée a un système pendant un processus
réversible (c'est-à-dire un processus par lequel le
système passe infiniment lentement d'un état d'équilibre
au suivant) est donnée par:
dQ = TdS (1.2)
où T est la température exprimée en Kelvin
et dS la variation infinitésimale d'entropie (qui qualifie le niveau de
désordre du système).
Finalement pour un système fermé :
dU = TdS - PdV (1.3)
Pour un système ouvert, l'énergie interne
dépend, en plus de S et V, du nombre de moles des espèces qui
composent le système, ns :
|
OU
dU = OU aS )VnsdS +
(OV )S,nsdV + E
s
|
( OU
ons )SV"nj dns (1.4)
|
Nous avons d'autre part les définitions thermodynamiques
de la température, de la pression et du potentiel chimique de
l'espèce Xs :
OU
T = (OU )V n P =
-( )S n us = ( OU )
(1.5)
OS , 8 OV , 8 ons S,V,n3
La variation de l'énergie interne peut alors
s'écrire :
|
?
dU = TdS - PdV +
s
|
usdns (1.6)
|
Une différence de température a tendance
à provoquer un transfert de chaleur d'un corps a un autre, une
différence de pression a tendance à entrainer une mise en
mouvement alors qu'une différence de potentiel chimique a tendance
à activer des réactions chimiques ou un transfert de masse entre
phases.
b) L'énergie libre de Gibbs
L'énergie libre de Gibbs est définie par :
G = U + PV - TS (1.7)
En prenant la differentielle de part et d'autre de
l'égalité, on a :
dG = dU + PdV + V dP - TdS -
SdT (1.8)
en utilisant la relation (1-6) on obtient finalement :
|
dG = -SdT + V dP +E
|
usdns (1.9)
|
s
On peut alors proposer une autre définition du potentiel
chimique d'une espèce Xs par rapport à
l'énergie libre de Gibbs :
OG
us = on)T,Pnj
(1.10)
c) Les conditions d'un équilibre chimique
Le second principe de la thermodynamique nous dit que
l'entropie d'un système adiabatique (dQ = 0) augmente pour un processus
irréversible et reste constante pour un processus réversible : dS
> 0
Pour un système a température et pression
constantes, on peut montrer que ce principe équivaut à : dG
0. La condition d'équilibre s'écrit
dG = 0 (1.11)
La détermination de la composition chimique d'un
équilibre nécessite la connaissance des potentiels chimiques de
toutes les espèces comme fonction des concentrations, température
et pression.
1.3.2 Les potentiels chimiques
a) Cas d'un
gaz parfait seul
Pour un gaz parfait seul, on a (Albriet 2007) :
u(T, P ) = u°(T,
1atm) + RT ln( P
1atm) (1.12)
donc (?u
?P )T = RT P . Or
d'après les relation (1-7) et en exploitant la relation (1-10), on
obtient
(
?G ?P )T = V et G =
nus. On retrouve alors l'équation
générale des gaz parfaits : PV = nRT
On peut caractériser la déviation par rapport au
comportement d'un gaz idéal grâce au facteur C tel que : C
= P V
nRT . Pour l'air sec et la vapeur d'eau avec des
températures et des pressions correspondant aux valeurs
atmophériques, on a : 0, 998 < C < 1. Ce qui
fait que considérer l'air sec et la vapeur d'eau comme des gaz parfaits
mène à faire une erreur inférieure a 0.2Z(Seinfeld et
Pandis 1998).
b) Cas d'un melange de gaz parfaits
Dans ce cas, le potentiel chimique s'écrit :
us = u°
s(T) + RT ln P + RT ln
ys (1.13)
où, ys représente la
fraction molaire du composante Xs et P est la
pression totale. La pression partielle du composant Xs se
définit par : Ps = ysp. En
utilisant cette définition, la relation (1-13) donne finalement une
éxpression analogue à (1-12) :
us = u°
s(T) + RT ln Ps
(1.14)
En procédant de la même manière que dans le
cas d'un gaz parfait seul, cette dernière expréssion est
équivalente à : PsV =
nsRT.
L'atmosphère peut être ainsi considérer comme
comme un mélange idéal de gaz parfaits avec une erreur
négligeable.
1.3.3 Potentiels chimiques de solutions
Les aérosols atmosphériques sont, à des
humidités relatives élevées, des solutions aqueuses.
-
Solution idéale : Rappelons d'abord qu'une solution est dite
idéale si les interactions
entre les molécules d'une même espèce sont
identiques aux interactions mutuelles entre
les molécules d'espèces différentes. Ainsi,
le potentiel chimique de chaque espèce est
une fonction linéaire du logarithme de sa fraction molaire
aqueuse xs :
us = u°
s(T, P) + RT lnxs
(1.15)
Une solution devient idéale lorsqu'elle devient de plus en
plus diluée dans un composant (le solvant).
- Solution non-idéale : les aérosols
atmosphériques sont souvent des solutions aqueuses concentrées
qui dévient significativement de l'idéalité. Cette
déviation est habituellement décrite en introduisant le
coefficient d'activité 'ys.
us = u°
s(T, P) + RT
ln'ysxs (1.16)
L'activité d'un composant est définie par
as = ysxs, la relation (1-16) dévient
simplement :
us = u°
s(T,P) + RT lnas
(1.17)
Ces notions de thermodynamique permettent de mieux
définir l'équilibre gaz-particules qui est d'une importance
capitale dans la modélisation de la formation des AOS (Henrigan et al.
2009).
1.4 Représentation de l'équilibre
gaz/particules
La relation gaz-particule définissant l'oxydation des COV
est un processus intégral de formation des AOS. D'où la
nécessité d'investiguer de manière singuliaire sur cet
équilibre.
1.4.1 Théorie de l'équilibre
gaz/particules
Considérons une portion d'air à une
température T et à une pression P. Chaque composé
organique semi-volatil COSVi(composés provenant de l'oxydation
des COV) est présent à une pression partielle Pi en
phase gazeuse. Ce COSVi est présent en phase particulaire
à
une fraction molaire xi . On suppose que
l'équilibre gaz/particules est atteint pour chaque COSVi .
D'après la relation (1-11), l'équilibre se traduit par
l'égalité des potentiels chimiques de l'espèce i (ui
) dans chacune des deux phases:
uGi (T, Pi) = uA i
(T, xi) (1.18)
Compte tenu des conditions atmosphériques de pression
et de température, la phase gazeuse peut être
considérée comme idéale. Ainsi, le potentiel chimique de
l'espèce COSVi dans la phase gazeuse s'exprime selon (Levine
2002) :
uG i (T, Pi) = u0 i (T,
P0) + RT lnPi/P0 (1.19)
où u0 i est le potentiel chimique
standard, c'est à dire à l'état de
référence, et P0 la pression de
référence (P0 = 1bar). Les COSVi
présents en phase particulaire sont sous une forme liquide. Ainsi,
en exploitant la relation (1-16) pour un COSVi donné, le
potentiel chimique dans la phase particulaire s'exprime par:
uA i (T, xi) = u0 i (T, P
vap
i ) + RT ln ixi (1.20)
où u0 i est le potentiel chimique
standard de l'espèce i pure ( sous une pression égale à sa
pression de vapeur Pvap
i ) et ?i le coefficient d'activité
du composé i dans la phase aérosol (rappelons que le coefficient
d'activité est un facteur de correction qui tient compte du comportement
non idéal du solvant).
En appliquant l'équation (1-17) au composé pur i,
on a :
u0 i (T, Pvap
i ) = uG i (T, Pvap
i ) (1.21)
Ainsi, d'après (1-19) et (1-21), en tenant compte de
(1-18), nous obtenons une relation générale :
Pi = ?ixiP vap (1.22)
i
Cette relation relie ainsi la pression partielle
d'équilibre d'un composé i en phase gazeuse
Pi
au-dessus d'un mélange d'espèces en phase condensée
à sa fraction molaire en phase
condensée xi connaissant Pvap
i et '-yi. Elle est généralement
connue sur le nom de loi de
Raoult.
1.4.2 Equilibre thermodynamique phase gazeuse-phase
particulaire
La condensation des AOS en phase particulaire se fait par
adsorption/absorption sur la surface ou au sein de la particule. Le processus
de condensation est la combinaison de deux processus : l'adsorption (captation
de gaz à la surface de l'aréosol) et l'absorption (captation
de gaz dans l'aréosol).
Une fois le gaz en contact avec la particule, la dissolution
du gaz dans la phase liquide de la particule joue un rôle important dans
la formation des AOS (Pun et al. 2003) : pour décrire cet aspet, il
faudrait prendre en compte les interactions entre les espèces
organiques, mais aussi avec les autres espèces présentes dans la
particule.
Pour décrire l'équilibre thermodynamique des
composés organiques, on a recours à des constantes
d'équilibre entre phases gazeuse et particulaire des différentes
espèces organiques : ces coefficients sont nommés coefficients de
partition (Guillaume 2006).
Pour un composé organique condensable i parmi
N (par unité se surface cm-2)
composés condensables dans l'aréosol, les concentrations en
équilibre thermodynamique en phase gazeuse (Ai) et en phase
particulaire (Fi) sont liées par le coefficient
Kp,i tel que (Pankow 1994) :
Fi/TSP
Kp,i = (1.23)
Ai
Kp,i en
m3ug-1 , Fi et
Ai en ng.m3. TSP (en
u.gm-3) la concentration massique totale des
composés organiques présentes dans l'aréosol.
Si la partion est supposée comme étant un simple
processus physique d'absoption, ce coefficient s'exprime par (Pankow 1987) :
K = NatspT exp[(Qi --
Qv)/ RT]
1vap (1.24)
600Pi
avec :
atsp : la surface spécifique du solide
(m2g-1)
T : la température (K)
Q1 : l' enthalpie de désorption du SOAi
(KJmol-1) Qv : l'enthalpie
de vaporisation (KJmol-1)
R : la constante universelle des gaz parfaits
(KJmol-1K-1)
Pi vap est la pression de vapeur saturante du composé i
(torr)
Si la pression Pi du composé i s'exprime en torr
(1torr = 1mmHg =
7610atm), la loi des gaz parfaits
s'écrit :
V
ni
(mol.m-3) = 760RT
(1.25)
la concentration dans la phase gazeuse s'exprime en
mol.m-3 et R = 8,
2.10-5m3.atm.mol-1K-1
La relation entre Ai et n;V peut simplement
s'écrire :
Ai(ng.m-3) =
ni V Mi.109 (1.26)
où Mi est la masse molaire du composé i
(g.mol-1). En combinant les expréssions
(1-25) et (1-26) en tenant compte de (1-22), on a :
xi?iPvap
Ai = 760RT Mi.109
i (1.27)
Pour un volume de 1m3 d'air,, la fraction
molaire est donnéee par :
ni,
xi, = (1.28)
ntot
?iPvapp760RT Mi.1099
i (1.29)
avec niN le nombre de mole du composée i
absorbéee dans les 1m-3 de volume d'airr et
ntot le nombre total de mole de tous les composéss
organiques pésents.. En utilisant (1-27), (1-28) dévientt :
ni,
Ai, =
ntot
Nous avons dans 1m3 de volume d'airr un
nombre de mole niN tel que :
Fit
ni, = (1.30)
Mi.1096
De la totalité des particules en suspension, f
représente la fraction massique de la matière organique qui est
absorbée. Cette définitionn de f permet d'écriree
:
ntot =
fATT SPP
(1.31)
M.106
oùu M est la masse molaire moyenne dans la phase
particulaire (en g.mol-1l et
M.106 en ug.mol-1).. A partir
des équationss (1-30) et (1-31), on obtient :
ni,
ntot
FiMM
(1.32)
fTSPMi.103
Nous pouvons réécriree l'expréssionn (1-29)
en tenant compte de (1-32) := =FiMAiPvap1066
(1.33)
fTSP760RTT
Quand le processus de partitionnement est dominée par
l'absortion,, la constante de partition Kp,i, du composée
organique i est directement déduitee de (1-33)
:f760RT
Kp,i = (1.34) zPi vapP
106
En somme, dans un processus de partitionnement gaz/particule, les
phénomèness d'absorp-
tionn et d'adsorptionn se produisent. On
déduitt ainsi de ce qui précèdee de façonss fort
simple
l'expréssionn du coefficient de partition àa partir des
relations (1-24) et (1-34) :Ki = =
11(760RTTffNatspT Texp[(Qi ,--
--Qv))//RT]](1.35))p,'Pivap
PMMi106 616000
Ce coefficient comporte un paramètree très&
important (la pression de vapeur) dont l'estimationn nécessite un
certain nombre de données et la maïtrisee de quelques
méthodes y afférantes. C'estt en fait cela qui fera l'objett du
chapitre suivant.
Chapitre 2
Données et méthodes utilisées
De nos jours, très peu de données
caractérisant le partitionnement total gaz-particule pour la
modélisation des AOS sont disponibles, car les espèces
intervenant dans ce processus sont pléthoriques. Nous présentons
dans ce chapitre tout d'abord le principe de base de la relation
structure/propriété, en suite une description des méthodes
employées sera faite. Nous terminerons par une présentation des
données expérimenrtales et d'estimation utilisées.
2.1 La relation structure-propriété
Les techniques de structure/propriété relient la
propriété P d'une molécule à des
descripteurs structuraux et/ou physicochimiques selon :
P =
f(X1,X2,X3,...,Xn)
(2.1)
avec X, le descripteur structural (type de liaisons,
type de groupements...) ou physicochimique (température
d'ébullition, pression critique...). Ces fonctions f peuvent
par exemple être construites sur la base de lois fondamentales ou
corrélées aux propriétés physico-chimiques des
molécules. Parmi l'ensemble des techniques de relation
structure/propriété, les tehniques de contribution de groupes
sont les plus simples à mettre en oeuvre (Camredon 2007).
2.1.1 Principe de base des techniques de contribution de
groupe
On rassemble sous le terme de "techniques de contribution de
groupe ½l'ensemble des techniques prédictives permettant
d'évaluer une propriété quelconque en sommant des
contributions relatives à des fragments de molécules. Elles
permettent un calcul rapide et simple de différentes grandeurs
thermodynamiques de substances pures ou de mélanges. Depuis, plusieurs
auteurs ont cherché à mettre en place des techniques
prédictives, celles-ci étant le plus souvent appliquées au
calcul des propriétés thermodynamiques en phase gazeuse (ce
qui
correspond bien au context de notre travail). C'est en effet
en 1932, que Parks et Huffmann ont démontré que certaines
fonctions thermodynamiques de composés organiques pouvaient être
raisonnablement calculées à partir de paramètres
liés aux structures moléculaires (Parks et Huffmann 1932).
2.1.2 Hiérachie des groupes
Benson et Buss (1955) ont montré qu'il était
possible d'établir un système hiérarchique en ce qui
concerne les lois d'additivité permettant d'évaluer certaines
propriétés moléculaires.
a) Groupe d'ordre 0 : contribution atomique
Le découpage en groupes d'ordre 0 correspond à
la prise en compte de chacun des atomes présents dans une
molécule donnée. Ainsi, chaque atome constitue un groupe du
composé étudié. Tout élément appartenant au
tableau de Mendeleïev peut donc être un groupe d'ordre 0. La
propriété recherchée concernant le composé
étudié est ainsi considérée comme étant une
somme de contributions atomiques.
b) Groupe d'ordre 1 : contribution des liaisons entre atomes
La molécule est, dans ce cas, découpée
en différents éléments ne dépendant
aucunément de leur environnement. En effet, si un même groupe est
présent dans une molécule ou dans une autre, sa valeur de
contribution reste identique quelque soit le groupe ou l'atome auquel il est
lié. Par exemple, si dans une molécule, le groupe --CH3
est lié au groupe --CH2--, sa contribution est la
même que si ce groupe est lié au groupe -OH. Les interactions
à longue distance n'influent donc aucunement dans ce cas. En effet,
l'estimation des températures normales d'ébullition a souvent
été remise en cause (Danier 2003). De plus, l'évaluation
de la température critique des composés par ces méthodes
requiert la détermination expérimentale des températures
normales d'ébullition. Or, celles-ci ne sont pas toujours disponibles
dans la littérature. Par ailleurs, la représentation des
structures moléculaires par des groupes d'ordre 1 est, dans certains
cas, tellement simplifiée que les isomères ne peuvent être
distingués.
c) Groupe d'ordre 2 : contribution des groupements
fonctionnels
Un groupe est constitué d'un atome central de valence
strictement supérieure à 1, et de l'ensemble des liaisons qu'il
forme avec ses voisins. Un groupe peut s'écrire de la manière
suivante (Salomon 2006) :
X --
(A)i(B)j(C)k(D)l
(2.2)
où X représente l'atome central auquel sont
liés i atome A, j atome B, k atome C et l atome
D. On peut
prendre pour exemple l'atome de carbone, C. Si ce dernier est un atome
central,
il peut former plusieurs groupes, tels que C -
(C)(H)3, C - (CO)(H)3, C
- (N)(H)3. Dans les techniques de contribution de
groupes de deuxième ordre, l'environnement complet de chaque atome
central est pris en compte, contrairement aux techniques utilisant des groupes
de premier ordre.
Les techniques de contribution de groupe nous permettent dans
notre travail d'estimer les propriétés critiques,
propriétés fondamentales voir nécessaires pour
l'estimation de la pression de vapeur. De mémoire, le point critique
d'un corps pur est le point d'une courbe reliant la pression, la
température et le volume telle que la transition de phase entre
l'état liquide et l'état gazeux est impossible.
2.1.3 Techniques de contribution de groupes
employées dans le cadre de notre travail
a) Technique de Lydersen
La technique de Lydersen est l'une des techniques de
contribution de groupe la plus célèbre pour l'estimation des
propriétés critiques (Bruce et al. 2001), à savoir la
température critique Tc, la pression critique
Pc. Ces propriétés sont ainsi
calculées par (Nannoolal 2006) :
Tc =
Tb
0, 567 + (2.3)
i Niti - ( i Niti)2
M
Pc = (0, 34 - (2.4)
i Nipi)2
- Tc et Pc s'expriment
respectivement en bar et en kelvin;
- ti et pi sont les contributions de groupes
pour la détermination, respectivement, de Tc et
Pc ;
- Ni est le nombre de groupe de type i dans la
molécule;
- M est la masse molaire de la molécule;
- Tb est la température d'ébullition
nécessaire à l'évaluation des températures
critiques et peut être une valeur expérimentale ou bien une valeur
calculée.
b) Technique de Joback
Joback et Reid ont ré-évalué les
contributions de groupes de premier ordre établies par Lydersen et a
ajouté plusieurs groupes fonctionnels. De nouvelles valeurs de
contributions de groupes ont ainsi été déterminées.
Les relations suivantes ont alors été proposées (Joback et
Reid 1987) :
|
Tc =
|
Tb
0, 584 + 0, 965 (2.5)
i Niti - ( i Niti)2
|
1
Pc = (0,113 + 0, 0032m
- > (2.6)
N p )2
m est le nombre d'atomes dans la molécule.
La relation établie par Joback permettant de calculer la
température d'ébullition est :
Ces notions de structure-propriété nous permettent
directement de mener une description des méthodes d'estimation de la
pression de vapeur.
2.2 Description des méthodes d'estimation de la
pression de vapeur
Dans notre travail nous avons utilisé trois
méthodes d'estimation de la pression de vapeur.
2.2.1 Définition de la pression de vapeur
Considérons un récipient renfermant un liquide
exposé à l'atmosphère. Les molécules
présentes dans le liquide sont en mouvement incessant. Les
molécules en surface vont s'évaporer dans l'atmosphère et
le liquide voit alors son volume diminuer. Lorsque le récipient est
fermé, les molécules de gaz rebondissent sur les parois. Le
système est un système dynamique où des molécules
liquides en surface s'évaporent pour devenir gazeuses et des
molécules gazeuses condensent pour devenir liquide. La transformation
liquide/vapeur d'une espèce A peut s'écrire :
A(g) =#177; A(l) (2.8)
A l'équilibre, les vitesses des deux processus pour
chacune des espèces présentes dans le système sont
égales et le système est stationnaire (Camredon 2007). Le gaz
exerce alors sur le liquide une pression appelée pression de vapeur. La
pression de vapeur est aussi la pression partielle du composé en phase
gazeuse. Si le liquide n'est composé que de l'espèce A,
la pression de vapeur est appelée pression de vapeur saturante
(Pvap). La pression de vapeur saturante d'un composé
représente donc la pression partielle à laquelle ce
composé est en équilibre avec sa phase condensée (liquide
ou solide) pure.
Cet équilibre de phases s'établit à toute
température. Une augmentation de la température entraîne
une augmentation de l'agitation des molécules liquides en surface, et
implique donc un déplacement de l'équilibre dans le sens
A(l) vers A(g) (transformation
endothermique). Afin de restaurer l'état d'équilibre, la vitesse
de la transformation A(g) vers A(l) doit
augmenter. Cette vitesse est proportionnelle à la pression partielle du
constituant dans
la phase gazeuse. Le maintien de l'équilibre implique
donc, avec l'élévation de la température, une augmentation
de la pression de vapeur. Diverses méthodes ont été
proposées pour l'estimation de Pvap.
2.2.2 Méthode de Lee et Kesler (LK)
Dans cette approche, la pression de vapeur reduite P
vap
r (P vap r=
Pvap/Pc) est une fonction de la température
reduite Tr (Tr =
T/Tr). La variarion de Pr vap s'exprime
ainsi par (Reid et al. 1986) :
lnPr vap =
f0(Tr) +
wf1(Tr) (2.9)
w est le facteur acentrique de Pitzer qui rend compte
de la non sphéricité des molécules.
f0(Tr) et
f1(Tr) représentent les fonctions de
Pitzer qui sont les polynômes en Tr (Barley et
McFiggans 2010) :
6, 09648
f0(Tr) = 5,
92714 - - 1, 28862lnTr + 0,
169347lnT 6 (2.10)
r
Tr
f1(Tr) = 15,2518
- 15, 6875 -13,
4721lnTr + 0, 43577lnT 6
(2.11)
r
Tr
w est calculé en fonction de Tb et des
propriétés critiques par la relation (Barley et McFiggans 2010)
:
|
a et 9 s'exprime respectivement par
:
a = -lnPc - 5, 92714 +
15,
? 15, 2518
= -
|
a
w =
?
6, 09648
1, 28862ln0
|
- 0,169347?6
43577?6
|
(2.12)
(2.13)
(2.14)
|
|
? -
6875
13, 4721ln0 0,
+
|
|
? -
|
avec B = Tb/Tc
Dans cette méthode, la connaissance de Tb,
Pc, et Tc est nécessaire. Nous avons
estimé ces paramètres en utilisant les techniques de Joback et
Lydersen décrites plus haut.
2.2.3 Méthodes basées sur l'équation
de Clausius-Clapeyron
Plusieurs méthodes d'estimation de la pression de vapeur
sont basées sur l'équation de Clausius-Clapeyron dont il est
important de rappeler.
a) Forme élargie de l'équation de
Clapeyron
Considérons un mélange de deux phases a
et 9 d'une substance. La phase a est en
équilibre avec la phase 9 à tout point de la
ligne de séparation.
Soit la transition a --> ?. La variation de
l'énergie libre de Gibbs à tout point de la ligne de
séparation est exprimée par la relation (1-11). Ainsi, nous
pouvons écrire :
AH
AS = (2.15)
rappelons que cette dernière relation n'est valable que
lors du changement de phase. Cherchons la pente de la ligne de
séparation des phases
((aaT
P)AG). En utilisant la relation cyclique d'Euler, pour les
trois varibles P, T, AG, on a :
aP )T
or, à partir des relations (1-3) et (1-8), on a dG
= -SdT + V dP ou encore :
( OT )AG =
oP
(
aAG)
aT )P (2.16)
d/G = -ASdT + AV dP
(2.17)
En considérant cette dernière relation (2-17),
à pression et à température constante respectivement, on a
:
A
(aOT G)P =
-AS (2.18)
et
OAOP
G )T = -AV (2.19)
En utilisant ces deux dernières relations, (2-16) devient
:
(OP AS
OT )AG = AV (2.20)
cette dernière équation est connue sous le nom
d'équation de Clapeyron. Sachant que nous sommes à
l'équilibre de phase (caractérisé par (2-15)),
l'équation de Clapeyron donne simplement :
AH
dP = T AVdT (2.21)
Pour intégrer l'équation (2-21), on doit
connaitre comment OH et AV varient avec la
température. Cette équation est vraie quelque soit le type de
transition de phase. Ce pendant, pour les transitions solide-gaz et liquide-gaz
particulièrement, on peut faire l'approximation suivante (Salzman 2004)
:
AV = Vgaz - Vliq Vgaz (2.22)
La connaissance de la chaleur massique à pression
constante (CP) est nécessaire lorsqu'on considère la
température comme dépendant de la variation d'enthalpie
AH. A pression constante donc, on écrit : AH =
CpAT. En intégrant de T à
Tb, on obtient :
T
AH(T) = AH (Tb) +
.11,6 ACpdT (2.23)
Une approximation du second ordre permet de considérer
ACp comme une constante (Salzman 2004). Ainsi, la relation
(2-23) s'écrit simplement :
AH(T) = AH(Tb) -
ACpTb + ACpT (2.24)
Par ailleur, (2-21) peut encore s'écrire en utilisant
(2-23), (2-16)et la loi des gaz parfaits appliquée à une mole
:
dP AH(Tb) -
TbACp dT AC dT
(T2 ) + Rp T (2.25)
En intégrant cette dernière relation de T
à Tb, on obtient la forme étandue de l'équation
de Clausius-Clapeyron :
|
lnPvap = ASb(Tb -
T) +
RT
|
AC b Tb T Tb
p ( ln T ) (2.26)
R T
|
ASb et ACpb sont
respectivement appelés entropie de vaporisation et la chaleur massique
de la transformation gaz-liquide à la tempétrature
d'ébullition. A cet effet, les méthodes basées sur
l'équation de Clausius-Clapeyron s'attèlent à la
détermination de ces deux paramètres.
b) Méthode de l'équation modifiée
de Mackay (mM)
L'hypothèse simplificatrice de cette méthode est de
considérer le rapport ACpb/ASb
comme une constante (Schwarzenbasch et al. 2003) :
= -0,8 (2.27)
ACpb
ASb
L' entropie de vaporisation à la tempétrature
d'ébullition est évalué par l'expréssion de
Kistiakowsky qui prends en compte les interactions de type Van Der Walls :
ASb(Tb) = Kf(36, 6
+ 8, 31lnTb) (2.28)
Kf est un facteur introduit par Fishtine dans
l'expréssion de Kistiakowsky originelle. Ce facteur qui porte son nom
est un facteur empirique qui corrige beaucoup d'interactions polaires. Ses
différentes valeurs sont :
- Kf = 1 pour les composés apolaires ou
monoplaires ;
- Kf = 1, 04 pour les composés ayant un
caractère bipolaire faible (ester, cétone) ;
- Kf = 1, 1 pour les amines primaires;
- Kf = 1, 3 pour les alcools aliphatiques.
Ainsi, en exploitant les relations (2-27) et (2-28), on obtient
l'expréssion permettant d' évaluer la pression de vapeur par la
méthode mM :
lnP vap = Kf(4, 4 +
lnTb)[1, 8Tb -- T
T -- 0, 8lnTb
(2.29)
T
La température d'ébullition est estimée par
la technique de Joback.
c) Méthode de Myrdal et Yalkowsky (MY)
Cette méthode utise l'expréssion empirique de
1Sb établi par Myrdal et Yalkowsky 1997 :
?Sb = 86 + 0, 4r + 1421.HBN
(2.30)
r et HBN sont respectivement appelés
torsional bond et hydrogene bond number. Ces
paramètres permettent de mieux caractériser la structure
moléculaire.
Dans cette méthode, certaines contributions de groupes
telles que les hydropéroxydes ne sont pas disponible. La contribution de
ces groupes est prise en compte dans l'expréssion de HBN.
Ainsi, nous utilisons la relation suivante (Camredon et Aumont 2006) :
,1 OH + CO(OH) + OOH
+ 0, 33/NH2
HBN = (2.31)
M
où OH COOH OOH et NH2 sont
respectivement le nombre de groupement alcool, acide carboxilique et amine
primaire présant dans la molécule. M es la masse
molaire. Le paramètre r caractérisant la structure
moléculaire s'exprime par (Vidal 1997) :
>
? = (SP 3 + 0, 5.SP2 +
0, 5.RING) -- 1 (2.32)
avec :
SP3 le nombre d'atome non terminal lié à
quatre autres atomes;
- SP2 le nombre d'atome ayant établi deux
liaisons avec deux atomes différents et une double liaison avec un
troisième atome;
RING est le nombre de cycle indépandant
présent dans la molécule
SP3 et SP2 revèlent simplement la notion
d'hybridation des orbitales atomiques. ? = 0 si la valeur
trouvée par calcul est négative.
La chaleur massique de la transformation gaz-liquide à la
tempétrature d'ébullition est, dans la méthode de MY
calculée par (Vidal 1997) :
LCpb = --(90 + 2, 5r)
(2.33)
En substituant LCpb et
1Sb dans (2-26) par leur expression donnée par
(2-30) et (2-33), on trouve la relation suivante :
lnP vap = --(21, 2 + 0,
3r + 177HBN)(Tb -- T
T ) + (10, 8 + 0,
25r)lnTb (2.34)
T
Pour cette méthode, la pression de vapeur est alors une
fonction de la température d' ébullition Tb et des
paramètres liés à la structure moléculaire.
Les méthodes explicitées ci-dessus ne vont
retrouver leur véritable lettre de noblesse qu'en fonction d'une base de
données dont il est important de présenter.
2.3 Présentation des données
Les données utilisées dans notre travail se
regroupent en deux catégories : les données expérimentales
et les données d'estimation.
2.3.1 Données expérimentales
Nous avons utilisé les pressions de vapeur
expérimentales comprises entre 10-8 et
1atm, et mesurées pour les températures comprises entre
270 et 320K. Ces valeurs expérimentales proviennent de Boulik
et al. (1984), Lide (1997), Yams (1994), Myrdal et Yalkowsky (1997), Asher et
al. (2002) et du site internet de l'institut nationale des standards et de la
technologie (NIST). Très peu de données sont disponibles pour les
presions de vapeur inférieures à
10-6atm, c'est à dire dans le domaine de
formation des AOS (Camredon et Aumont 2006). Les molécules
étudiées comportant entre autre les fonctions alcool,
aldéhyde, cétone, acide carboxylique, ester, et ether ont
été identifiées dans la troposphère par des
études insitu et des expériences dans les chambres de
simulation de l'atmosphère (CSA).
Les propiétes des corps purs, à savoir la
température d'ébullition (Tb), la température
critique (Tc), et la pression critique
(Tc) dont la nécessité n'est plus à
démontrer pour le calcul des données d'estimation, proviennent du
site intrnet du NIST.
2.3.2 Données d'estimation
L'obtention des données d'estimation pour un ensemble de
270 molécules d'interêt pour la formation des AOS s'est faite en
plusieures étapes :
obtention de la formule semi-développée de chaque
molécule:
- identification et dénombrement des différents
groupes d'ordre 1 et 2 présents dans chaque molécules;
identification et dénombrement des atomes non terminaux
hybridés SP3 et SP2 dans chaque molécule;
- dénombrement des atomes présents dans chaque
molécule;
- dénombrement des chaînes cycliques
indépandantes dans chaque molécule; - calcul des masses molaires
moléculaires;
- calcul des propriétés des corps purs par les
techniques de structuture/propriété étudiées plus
haut.
- calcul des pressions de vapeur par les différentes
méthodes.
Les tableaux (2-1) et (2-2) présentent respectivement les
contributions de groupe de Joback et Lydersen utilisées dans le cadre de
notre étude :
Table 2.1 -
Contributions de groupe de Joback (Bruce et al. 2001)
|
Propriété
|
tbi
|
tci
|
pci
|
|
Unité
|
K
|
K
|
bar
|
|
Goupe i
|
|
|
CH3(1)
|
23.58
|
0.0141
|
-0.0012
|
|
CH2(2)
|
22.88
|
0.0189
|
0.0000
|
|
CH (3)
|
21.74
|
0.0164
|
0.0020
|
|
C (4)
|
18.25
|
0.0067
|
0.0043
|
|
= CH2 (1)
|
18.18
|
0.0113
|
-0.0028
|
|
= CH (2)
|
24.96
|
0.0129
|
-0.0006
|
|
= C (3)
|
24.14
|
0.0117
|
0.0011
|
|
= C = (2)
|
26.15
|
0.0026
|
0.0028
|
|
CH2(ss) (2)
|
27.15
|
0.0100
|
0.0025
|
|
CH(ss) (3)
|
21.78
|
0.0122
|
0.0004
|
|
C(ss) (4)
|
21.32
|
0.0042
|
0.0061
|
|
OH (1)
|
92.88
|
0.0741
|
0.0112
|
|
ACOH (1)
|
76.34
|
0.0240
|
0.0184
|
|
O (2)
|
22.42
|
0.0168
|
0.0015
|
|
O(ss) (2)
|
31.22
|
0.0098
|
0.0048
|
|
C = O (2)
|
76.75
|
0.0380
|
0.0031
|
|
C = O(ss) (2)
|
94.97
|
0.0284
|
0.0028
|
|
CH = O (1)
|
72.20
|
0.0379
|
0.0030
|
|
COOH (1)
|
169.09
|
0.0791
|
0.0077
|
|
COO (2)
|
81.10
|
0.0481
|
0.0005
|
Table 2.2 -
Contributions de groupe de Lydersen (Nannoolal 2006)
|
Propriété
|
tbi
|
tci
|
pci
|
|
Unité
|
K
|
K
|
bar
|
|
Goupe i
|
|
|
CH3(1)
|
0.020
|
0.227
|
55.0
|
|
CH2(2)
|
0.020
|
0.227
|
55.0
|
|
CH (3)
|
0.012
|
0.210
|
51.0
|
|
C (4)
|
0
|
0.210
|
41.0
|
|
= CH2 (1)
|
0.018
|
0.198
|
45.0
|
|
= CH (2)
|
0.018
|
0.198
|
45.0
|
|
= C (3)
|
0
|
0.198
|
36.0
|
|
= C = (2)
|
0
|
0.198
|
36.0
|
|
CH2(ss) (2)
|
0.013
|
0.184
|
44.5
|
|
CH(ss) (3)
|
0.012
|
0.192
|
46.0
|
|
C(ss) (4)
|
-0.007
|
0.154
|
31.0
|
|
OH (1)
|
0.082
|
0.060
|
18.0
|
|
ACOH (1)
|
0.031
|
-0.020
|
3.0
|
|
O (2)
|
0.021
|
0.160
|
20.0
|
|
O(ss) (2)
|
0.014
|
0.120
|
8.0
|
|
C = O (2)
|
0.040
|
0.290
|
60.0
|
|
C = O(ss) (2)
|
0.033
|
0.200
|
50.0
|
|
CH = O (1)
|
0.048
|
0.330
|
73.0
|
|
COOH (1)
|
0.085
|
0.400
|
80.0
|
|
COO (2)
|
0.047
|
0.470
|
80.0
|
Chapitre 3
Résultats et analyses
Dans ce chapitre, nous présenterons les
différents resultats obtenus. Primo, nous évaluérons les
propriétés critiques qui nous permettrons secundo
d'évaluer les différentes méthodes d'estimation de la
pression de vapeur. L'usage des outils statistiques nous permettrons
d'évaluer la pécision de chaque méthode.
3.1 Evaluation des propriétés de corps
purs
La fiabilité des techniques et méthodes est mise
en évidence sous la base de l' erreur systématique moyenne (ESM)
et de l'erreur absolue moyenne (EAM). Elles sont définies ainsi qu'il
suit :
1 >ESM = n i ((vt)i
- (ve)i ) (3.1)
1 >
EAM = |(vt)i -
(ve)i| (3.2)
n
où (vt)i et (ve)i sont
respectivement la valeur estimée et la valeur expérimentale du
composé i.
3.1.1 Température d'ébullition
Pour estimer cette propriété, nous avons
utilisé la technique de Joback (paragaphe 2- 1-3). Les groupes
additionnels on été ajoutés pour prendre en
considération les molécules comportant les groupements
ONO2, C(O)OONO2 et OOH:
- pour le groupement ONO2, le site internet du NIST (
www.webbook.nist.gov/chemistry)
permet d'avoir tONO2 = 112, 10K ;
b
pour le groupement C(O)OONO2, on
obtient tC(O)OONO2 = 157, 42K
(Bruckmann et
b
Willner 1983) :
- on décompose le groupement hydroperoxyde en deux groupes
figurant dans la table de Joback. Ainsi, on peut écrire tOOH
b = t O
b + tOH
b .
La figure (3-1) présente la température
d'ébullition estimée par la Joback (TJob
b ) en fonction
des valeurs expérimentales pour un ensemble de 253
composés.
TbJob(K)
450
400
700
650
600
550
500
350
300
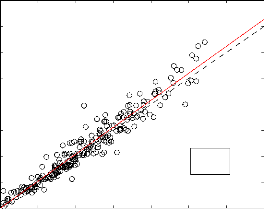
y = 1.039*x - 11.47
N=253 R2=0,96
300 350 400 450 500 550 600 650
Tbexp(K)
Figure 3.1 - Estimation de la température
d'ébullition par la technique de Joback. Les droites en trait continu et
trait intérrumpu représentent respectivement la droite de
regréssion et la pémière bissectrice
L'erreur absolue moyenne (EAM) pour l'estimation de Tb
est 12,65 K. Cette valeur est en accord avec 12,1 K trouvée par
Camredon et al. (2006) pour un ensemble de 252 composés. Comme le montre
la figure (3-1), il y a une bonne correlation entre les données
estimées de Tb et les données expérimentales, car
le coefficient de correlation est R2 = 0, 96. L'
ESM = 4, 46 montre que la technique de Joback est bien
adaptée pour l' estimation de Tb.
3.1.2 Température critique
Nous avons testé deux techniques d'estimation de la
température critiqueTc ( les techniques de Joback et
de Lydersen) afin de choisir celle présentant les resultats meilleurs.
Pour être utile dans la modélisation des AOS, une prise en compte
des groupes ONO2, C(O)OONO2 et OOH
est nécessaire. Ainsi, la contribution de ces différents
groupes est définie ainsi qu'il suit :
- tONO2 = t_O_
c + tNO2
c c
- tC(O)OONO2 =
tC(O)O + tONO2 c c c
- tOOH
c = t_O_
c + tOH
c
900
850
800
750
700
600
550
500
450
400
y = 0.866*x + 73.8
N=138
R2=0,93
400 500 600 700 800 900
Tcexp(K)
Figure 3.2 - Estimation de la température critique
par la technique de Joback. Les droites en trait continu et trait
intérrumpu représentent respectivement la droite de
regréssion et la pémière bissectrice
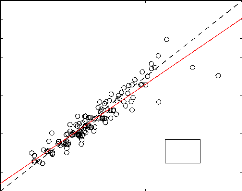
Les figures ci-dessus représentent pour un ensemble de 138
composés l'estimation de Tc par les techniques de
Joback et Lydersen respectivement. La ligne en trait continu représente
la droite de régression et celle en traits interrumpus représente
la première bissectrice. L'estimation faite avec la technique de Joback
présente une EAM de 17,65 K, qui est sensiblement égale à
la valeur de 17,6 K trouvée par Camredon et al. (2006) pour un ensemble
de 139 composés. En effet, la figure (3-2) montre que pour des
températures très élevées, la tenhnique de Joback
devient moins précise. Cela se justifie par une forte dispersion des
points pour des températures élevées. A partir de la
technique de Lydersen pour l'estimation de Tc, on obtient
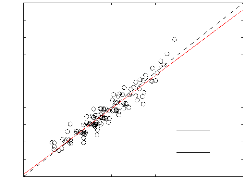
une EAM de 21,71 K. La figure (3-3) montre une correlation satisfaisante
(R2 = 0, 95) entre les données
expérimentales et celles obtenues par la technique Lydersen. De ce fait,
la technique de Lydersen est plus fiable que celle de Joback pour les
composés suceptibles de former les AOS (possédant une
température d'ébullition élevée).
TcLyd(K)
900
850
800
650
600
550
500
450
400
750
700
y = 0.949*x + 26.7
N=138 R2=0,95
400 500 600 700 800 900
Tcexp(K)
Figure 3.3 - Estimation de la température critique
par la technique de Lydersen. Les droites en trait continu et trait
intérrumpu représentent respectivement la droite de
regréssion et la pémière bissectrice
3.1.3 Pression critique
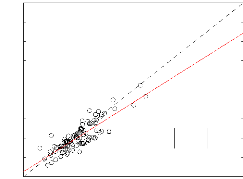
Pour évaluer la contribution des groupes ONO2,
C(O)OONO2 et OOH, nous avons
procédé de la même manière que dans le cas de
l'estimation de la température critique. Nous avons utilisé les
techniques de Joback et de Lydersen pour évaluer Pc.
Les figures suivantes ont été obtenu pour un ensemble de 117
composés.
PcJob(bar)
100
90
80
60
50
40
30
20
70
10
y = 0.798*x + 4.6
N=117 R2=0,85
10 20 30 40 50 60 70 80 90 100
Pcexp(bar)
Figure 3.4 - Estimation de la pression critique par la
technique de Joback. Les droites en trait continu et trait intérrumpu
représentent respectivement la droite de regréssion et la
pémière bissectrice
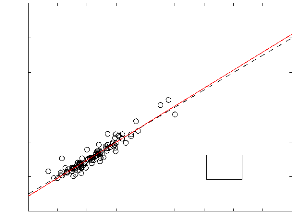
Les EAM obtenues à partir des techniques de Joback et
de Lydersen sont respectivement 3,22 atm et 1,87 atm. Cette dernière
valeur est en quasiment en accord avec la valeur de 1,66 atm trouvée par
Camredon et al. (2006) en utilisant la méthode d' Ambrose (pour
un ensemble de 119 composés). Cella montre en fait que la technique de
Lydersen est plus fiable. De plus, cette technique montre une bonne correlation
entre les données expérimentales et d'estimation.
Au vu de ce qui précède, nous utiliserons la
technique de Joback pour le calcul de la température d'ébullition
et la technique de Lydersen pour le calcul de la température critique et
de la pression critique.
3.2 Evaluation des méthodes d'estimation de la
pression de vapeur
Les pressions de vapeur correspondant aux 267 composés
étudiés ont été estimé à la
température de 298 °K. L'échelle logarythmique
utilisée ici permet d'espacer les valeurs proches en vu d'un bonne
interprétation. Nous allons évalué la fiabilité de
chaque méthode sur la base de l' EAM et de l' ESM calculés
à partir du logarythme de la pression de vapeur. Les tableaux (2-1) et
(2-2) montrent l'EAM et l'ESM pour chaque méthode et pour chaque
PcLyder(bar)
120
100
40
80
60
20
0
y = 1.038*x - 1.634
N=117 R2=0,95
10 20 30 40 50 60 70 80 90 100
Pcexp(bar)
Figure 3.5 - Estimation de la pression critique par la
technique de Lydersen. Les droites en trait continu et trait intérrumpu
représentent respectivement la droite de regréssion et la
pémière bissectrice
famille de composés prises dans les 267
échantillons étudiés.
3.2.1 Méthode de LK
Les figures suivantes présentent respectivement
Pvap estimée par la méthode de LK en fonction
de Pvap expérimentale et la boîte à
moustache de la différence entre valeur estimée et valeur
expérimentale.
Sur cette dernière figure, les différents domaines
de la pression de vapeur sont : - domaine 1 : Pvap <
10-5atm;
domaine 2 : 10-5 < Pvap
< 10-3atm;
- domaine 3; 10-3 < Pvap
< 10-1atm;
- domaine 4; 10-1 < Pvap
< 1atm.
Ces domaines de Pvap sont identiques
à ceux des figures (3-9) et (3-11). A partir de la figure (3-6), il en
ressort clairement que la méthode LK permet d'obtenir les resultats
fiables avec un coefficient de correlation R2 = 0,
96. La figure (3-7) montre que l'écart entre la valeur
estimée et la valeur expérimentale L\log(P
vap) augmente lorsque la pression de vapeur diminue. Les
érreurs les plus significatives obtenues (tableau (3-1)) concernent les
alcools (EAM = 0,611
Table 3.1 -
EAM pour différentes familles de composés et
pour chaque méthode
|
EAMLK
|
EAMmM
|
EAMMY
|
|
Hydrocarbure
|
0,129
|
0,142
|
0,123
|
|
Alcool
|
0,611
|
0,640
|
0,429
|
|
Aldéhyde et cétone
|
0,217
|
0,298
|
0,243
|
|
Acide carboxylique
|
0,253
|
0,563
|
0,270
|
|
Ester
|
0,232
|
0,151
|
0,174
|
|
composé bifonctionnel
|
0,537
|
0,407
|
0,426
|
|
composé trifonctionnel
|
0,588
|
0,547
|
0,513
|
|
Ester
|
0,196
|
0,224
|
0,162
|
|
Nitrate
|
0,170
|
0,070
|
0,069
|
IogPvap.L&K(atm)
-10
-2
-4
-6
-8
2
0
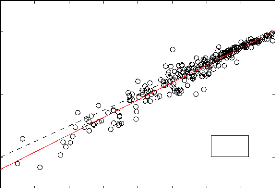
y = 1.11*x + 0.0882
N=267 R2=0,96
-8 -7 -6 -5 -4 -3 -2 -1 0
logPvap.Exp(atm)
Figure 3.6 Estimation de la pression vapeur par la
méthode de LK. Les droites en trait continu et trait intérrumpu
représentent respectivement la droite de regréssion et la
pémière bissectrice
et ESM = -0,499) et les composés bi- et trifonctionnels.
D'une manière générale, l'EAM et L'ESM pour l'ensemble des
composés étudiés sont respectivement 0,347 et -0,172.
Table 3.2 -
ESM pour différentes familles de composés et
pour chaque méthode
|
EAMLK
|
EAMmM
|
EAMMY
|
|
Hydrocarbure
|
0,046
|
0,052
|
0,001
|
|
Alcool
|
-0,499
|
-0,550
|
-0,287
|
|
Aldéhyde et cétone
|
0,087
|
0,237
|
0,117
|
|
Acide carboxylique
|
-0,079
|
0,563
|
0,059
|
|
Ester
|
-0,171
|
-0,014
|
-0,064
|
|
composé bifonctionnel
|
-0,298
|
0,231
|
0,243
|
|
composé trifonctionnel
|
-0,376
|
-0,118
|
0,025
|
|
Ester
|
-0,196
|
-0,077
|
-0,138
|
|
Nitrate
|
-0,170
|
0,040
|
0,024
|
|
logPvaPLK -- logPvaPexp
|
2
1.5
1
0.5
0 -0.5 -1 -1.5
|
|
N=20
|
|
N=54
|
|
|
N=154
|
N=49
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 2 3 4
Domaines de Pvapexp
Figure 3.7 - Boîte à moustache de la
différence entre valeur estimée par LK et valeur
expérimentale
3.2.2 Méthode de mM
Pour cette methode, nous avons obtenu les graphes suivants
représentant respectivement la correlation et les differentes
boîtes à moustaches.
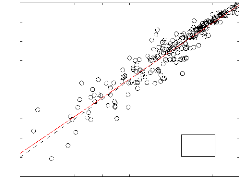
IogPvap.mM(atm)
-1
-2
-3
-4
-5
-6
-7
-8
-9
0
y = 0.963*x - 0.101
N=267 R2=0,95
-8 -7 -6 -5 -4 -3 -2 -1 0
logPvap.Exp(atm)
Figure 3.8 - Estimation de la pression vapeur par la
méthode de mM. Les droites en trait continu et trait intérrumpu
représentent respectivement la droite de regréssion et la
pémière bissectrice
|
logPvaPmM -- logPvaPexp
|
1.5
1
0.5
0
-0.5
-1
-1.5
|
|
N=20
|
|
N=54
|
|
N=143
|
|
N=49
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 2 3 4
Domaines de Pvapexp
Figure 3.9 Boîte à moustache de la
différence entre valeur estimée par mM et valeur
expérimentale
Le coefficient de correlation obtenu par cette méthode
est R2 = 0, 95. La figure (3-8)
montre une dispersion des points assez apréciable
autour de la droite d'ajustement linéaire. La figure (3-9) montre que
L\log(P vaP) augmente lorsque la pression de
vapeur diminue et présente une moyenne presque nulle pour les pressions
comprise entre 10--3 et
10--1atm. l'EAM pour l'ensemble des 267
composés est 0,356.
3.2.3 Méthode de MY
La méthode de MY se distingue des autres
méthodes par la prise en compte des interactions entre les
molécules. A partir de sa fiche technique détaillée au
chapitre 2, nous avons obtenue des resultats présentés
ci-dessous. Comme le montre la figure (3-10), il y a une bonne correlation avec
les données expérimentales (R2 =,
0, 96). L'erreur la plus significative ici concerne les
composés trifonctionnels (EAM = 0,513). La boite à moustache
ci-dessus montre que pour chaque famille de composés, l'erreur de biais
se situe légèrement au tour de la valeur zero. Pour l'ensemble de
tous les composés, on obtient une ESM de -0,0117 et une EAM de 0,290.
IogPvap.M&Y(atm)
-1
-2
-3
-4
-5
-6
-7
-8
0
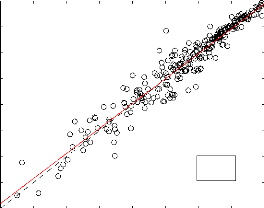
y = 0.964*x - 0.0974
N=267 R2=0,96
-8 -7 -6 -5 -4 -3 -2 -1 0
logPvap.Exp(atm)
Figure 3.10 - Estimation de la pression vapeur par la
méthode de MY. Les droites en trait continu et trait intérrumpu
représentent respectivement la droite de regréssion et la
pémière bissectrice
|
log PvaPMY -- logPvaPexp
|
2
1.5
1
0.5
0 -0.5 -1 -1.5
|
|
N=20
|
|
N=54
|
|
N=143
|
N=49
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 2 3 4
Domaines de Pvapexp
Figure 3.11 - Boîte à moustache de la
différence entre valeur estimée par MY et valeur
expérimentale
-8 -7 -6 -5 -4 -3 -2 -1 0
Figure 3.12 Droites de correlation des différentes
méthodes. Les droites en verte, rouge et bleue représentent
respectivement les droites de correlation des méthodes de LK, mM et
MY
A partir de la figure (3-12) et au vu de ce qui
précède, il en ressort de manière fort simple que la
méthode de mM est la moins précise des trois méthodes
étudiées. La méthode de MY s'avère la plus
précise. En effet, son coefficient de correlation se situe parmi les
plus élevés et présente les erreurs les moins
élevées, surtout en ce qui conserne les composés
d'interêt pour la formation des AOS (P vaP <
10-5atm).
Conclusion Générale et Perspectives
Au cours de notre mémoire basé sur
l'évaluation des méthodes d'estimation de la pression de vapeur
pour la modélisation des aérosols organiques secondaires, nous
avons montré que la connaissance de la pression de vapeur des
composés organiques volatils est un élement fondamantal
permettant de modéliser la formation des AOS. Trois méthodes
fondées sur la relation structure/propriété et construites
uniquement sur des considérations physiques et chimiques
déterministes ont été étudiées : la
méthode de Lee et Kesler (LK), la méthode de l'équation
modifiée de Mackay (mM) et la méthode de Myrdal et Yalkowsky.
Nous avons engagé une étude visant à évaluer la
fiabilité de ces méthodes pour l'estimation des pressions de
vapeur de composés d'intérêt pour la formation des AOS.
Nous avons compilé une base de données incluant les pressions de
vapeur d'environ 267 composés d'intérêt pour la formation
des AOS. Les molécules sélectionnées renferment des
hydrocarbures et des composés mono- et poly-fonctionnels, incluant les
principales fonctions organiques produites lors de l'oxydation gazeuse des COV
(alcool, carbonyl, hydroperoxyde, nitrate, peroxy acyl nitrate, ester et
ether). Cependant, très peu de données sont disponibles pour des
Pvap inférieures à
10-6atm. La précision des méthodes
d'estimation ne peut donc pas être évaluée pour de
très faibles valeurs de Pvap et une extrapolation de
ces méthodes est donc nécessaire.
En observant d'une manière particulière l'erreur
systématique moyenne et l'erreur absolue moyenne, en tenant compte des
différentes boîtes à moustaches, il en ressort clairement
que la méthode de mM est la moins fiable. Les deux autres
méthodes présentent des résultats semblables. A cet effet,
en observant de manière singulière les différentes erreurs
pour chaque famille de composés, nous pouvons affirmer sans grand risque
de nous tromper que la méthode de MY est la plus précise.
D' autres méthodes telles que la méthode UNIFAC
sont aussi utilisées pour la détermination de la pression de
vapeur. Des études ultérieures pourrons permettre
l'évaluation de la précision de ces méthodes en vue d'une
modélisation plus précise des AOS. Ainsi, nous pourrons mieux
étudier l'impact des aérosols organiques sur le climat et la
physico-chimie de l'atmosphère dans les milieux urbains comme Douala et
Yaoundé, où ils peuvent atteindre 90Zde la masse particulaire
totale.
Bibliographie
Albriet, B., 2007 : Modélisation numérique
des aérosols à échelle locale. Ph. D. thesis, Ecole
nationale des ponts et chaussées.
Asher, W.E., J.F. Pankow, G.B. Erdakos, and J.H. Seinfeld,
2002 : Estimation the vapour pressure of multifonctional oxygen-contening
organic compounds using group contribution methods. Atmospheric
Environment, 36, 1483-1498.
Atkinson, R., 2000 : Atmospheric chemistry of VOCs and NOx.
Atmosheric Environment, 34, 2061-2101.
Aumont, B., S. Szopa, and S. Madronich, 2005 : Modeling the
evolution of organic carbon during its gas-phase tropospheric oxidation :
developpment of and explicite model based on a self genereting approach.
Atmospheric Chemestry and Physics Discussion, 5, 703-754.
Barley, H.M., and G. McFiggans, 2010 : The critical assessment
of vapour pressure estimation methods for use in modelling the formation of
atmospheric organic aerosol. Atmosheric Chemistry and Physic, 10,
746-767.
Benson, S.W., and J.H. Buss, 1955 : Additional rules for the
estimation of molecular properties. Thermodynamic properties. J. Chem.
Phys., 29, 546.
Boulik, T., V. Freid, and E. Hala, 1984 : The vapour pressure
of pure substances. Elsevier, Amsterdam.
Brasseur, G., J.J. Orlando, and G.S. Tymdall, 1999 :
Atmospheric and global change. Oxford University.
Bruce, E., M. John, Prausnitz, and J. P., 2001 : The
properties of gases and liquids, fifth ed. Mc Graw-Hill.
Bruckmann, P.W., and H. Willner, 1983 : Infrared spectroscopic
study of peroxyacetyl nitrate (PAN) and its decomposition products.
Environmental Science and Technology, 17, 352-357.
Camredon, M., 2007 : Dévelloppement d'un
modèle déterministe pour la formation des aérosols
organiques secondaires : Application à la sensibilité du
système AOS/COV/NOx. Ph. D. thesis, Université de de Paris
VII -Val de Marne.
Camredon, M., and B. Aumont, 2006 : Assessment of vapour
pressure estimetion methods for secondary organic aerosol modelling.
Atmospheric Environment, 40, 2105- 2116.
Crumeryolle, S., 2008 : Impact des systèmes
convectifs sur les propriétés hydroscopiques des aérosols
: Analyse de deux cas d'étude durant la campagne AMMA. Ph. D.
thesis, Université de Toulouse III.
Danier, A.l., 2003 : Modeling the formation of atmospheric
aerosol from gazeous organic precursor. Ph. D. thesis, School of natural
ressources. Queensland University of technology.
Debry, E., 2004 : Modélisation et simulation de la
dynamique des aérosols atmosphériques. Ph. D. thesis, Ecole
nationale des ponts et chaussées.
Firket, M., 1931 : The cause of the symtoms in the Meuse Valley
during the fog of December. Bull Acad Roy Med Belg, 11, 683-741.
Firlayson, B.J., and N.J. Pitts, 2000 : Cmemistry of upper
and lower atmosphere. Academic press, San Diego.
Griffin, R.J., D.R. Crocker III, R.C. Flagan, and J.H.
Seinfeild, 1999 : Organic aerosol formation from the oxydation of biogenic
hydrocarbons. J. Geophys. Res., 104(D3), 3555-3568.
Guillaume, B., 2006 : Les aérosols : Emission,
formation d'aérosols organics secondaires,
transport longue
distance. Ph. D. thesis, Université de Toulouse III -
Paulsabatier.
Hansen, J., Satomki, R. R., L. A., and O. V., 2000 : Warming in
the twenty first century : an alternative scenario. Proc. Natl. Acad.
Sci., 97, 9875-9880.
Henrigan, C.J., M.H. Bergin, A. Russell, A. G.and Nenes, and
R.J. Weber, 2009 : Gaz/particle partitioning water soluble organic aerosol in
Atlanta . Atmos. Chem. Phys., 9, 3613-3628.
Jacobson, M.Z., 2002 : Control of fossil-fuel particulate
black carbon plus organic matter, possibly the most effective method of slowing
global warming. J. Geophys. Res. 107., (D19) 4410, doi : 10.1029/2001 JD
0013, 76, 9875-9880.
Joback, K.J., and R.C. Reid, 1987 : Estimation of pure component
properties from group contribution. Chem. Eng. Comm., 57, 233.
Kummer, J., 2004 : Caractérisation des aérosols
atmosphériques : aspet quatitatif,qualitatif et évolution des
risques environnement et santé. Ecole de santé publique -IGEAT
ULB.
Levine, 2002 : Physical chemestry. McGraw -Hill, New
York.
Lide, D.R., 1997 : Hanbook of Chemistry and Physics, 86
ed.
Müller, J.F., 1992 : Geographycal distribution of and
seasonal variation of surface emission and deposition velocities of atmospheric
trace gases. Journal of Geophysical re-
seach, 97, 3787-3804.
Myrdal, P.B., and S.H. Yalkowsky, 1997 : Estimating pure
component vapor pressure of complex organic molecules. Industrial and
Engineering Chemistry Reseach, 36, 2494-2499.
Nannoolal, Y., 2006 : Development and critical evaluation
of group contribution methods for the estimation of critical properties, liquid
vapour pressure and liquid viscosity of organic compounds. Ph. D. thesis,
University of Kwazulu Natal.
Odum, J.R., T.P.W. Jungcamp, R.J. Griffin, H.T.L. Forstner,
and J.H. Seinfeild, 1997 : Aromatcs reformulated gasoline and atmospheric
organic aerosol formation . Environ. Sci. Technol, 31, 1890-1897.
Pankow, J.F., 1987 : Rewiew and comparative analysis of the
theory of partitioning between the gaz and aerosol particulate phases in the
atmosphere. Atmospheric Environment, 22, 2275-2283.
Pankow, J.F., 1994 : An absorbtion model of gaz/particle
partitioning involved in the formation of secondary organic aerosol.
Atmospheric Environment, 28, 189-193.
Parks, P.S., and H.M. Huffmann, 1932 : Free energies of some
organic compounds. American chemical society, monograph 60. The chemical
catalog Co. Inc., New York.
Pun, B.K., C. Seigneur, J.H. Seinfeld, R.J. Griffin, and S.N.
Pandis, 2003 : Uncertainties in modeling secondary aerosols : Tree-dimensional
modeling studies in Nashville/Tennesse. Envron. Sci. Technol, 37,
3647-3661.
Reid, R.C., J.M. Prausnitz, and B.E. Poling, 1986 : The
properties of gases and liquids, fouth ed. Mc Graw-Hill, New York.
Salomon, A., 2006 : Dévelloppement d'une
méthode prédictive de calcul des hanthalpies de formation en
phase solide des molécules organiques. Application aux matériaux
énergétiques. Ph. D. thesis, Ecole des mines de Paris.
Salzman, W.R., 2004 : Physical chemestry. University of Arizona,
Tucson, Arizona-85721.
Schwarzenbasch, R.P., P.M. Gschwend, and D.M. Imboden, 2003 :
Environmental organic chemistry, secon ed. Wiley, New York.
Seinfeld, J., and S. Pandis, 1998 : Amospheric chemestry and
physics : From a pollution to climate change. John Wiler and Sons.
Seinfeld, J.H., and S.N. Pandis, 2006 : Atmospheric cemestry and
physics. Wiley New YorK.
Tombette, M., 2007 : Modélisation aérosols
et de leurs propriétés optiques sur l'Europe et l'île de
France : Validation, sensibilité et assimilation des
données. Ph. D. thesis, Ecole nationale des ponts et
chaussées.
Vidal, J., 1997 : Thermodynamique : Application au genie
chimique et à l'industrie du pétrolière. Technip,
Paris.
Wilkins, E.T., 1954 : . Journal ofthe royal sanitary
institute, 74, 1-21.
Yams, C.L., 1994 : Hanbook of vapour pressure, vols. 2and
3. Guef publishing compagny, Houston.
| 


