|
UNIVERSITE DE OUAGADOUGOU N° d'ordre :
**********
UFR/SCIENCES DE LA VIE ET DE LA TERRE
**********
Laboratoire de Physiologie Animale

THÈSE
présentée
pour obtenir le titre
de Docteur de l'Université de
Ouagadougou
Spécialité: Sciences Biologiques
Appliquées
Option: Physiologie de la
Reproduction
par
Balé BAYALA
Sur le
thème :
Activité progestative et activité
oestrogénique de Holarrhena floribunda (G.
Don) Durand et
Schinz (Apocynaceae), une plante de la pharmacopée
traditionnelle du
Burkina Faso.
Soutenue le 28 Novembre 2005 devant le jury composé de
:
Président:
· Messanvi GBEASSOR, Professeur à
l'Université de Lomé, Togo Membres :
· Marie-Claude VIGUIER-MARTINEZ,
Professeur à l'Université de Tours, France
· Laya SAWADOGO, Professeur à
l'Université de Ouagadougou, Burkina Faso
· Babacar FAYE, Professeur à
l'Université Cheick Anta Diop de Dakar (U.C.A.D.),
Sénégal
· Pierre I. GUISSOU, Professeur à
l'Université de Ouagadougou, Burkina Faso
Invité
· Hamidou H. TAMBOURA, Chargé de
Recherches au C.N.R.S.T., Ouagadougou, Burkina Faso Rapporteurs
· Messanvi GBEASSOR, Professeur à
l'Université de Lomé, Togo
· Marie-Claude VIGUIER-MARTINEZ,
Professeur à l'Université de Tours, France
· Anicet Georges Ouedraogo, Professeur
à l'Université Polytechnique de Bobo-Dioulasso, Burkina Faso
DEDICACE
DEDICACE
A LA MEMOIRE DE MON PERE BALI BAYALA, DE MA MERE BLANDINE
EYOW KANKO, DE MES FRERES AINES ANDRE BAYALA ET PASCAL
BAYALA. LA VOLONTE DE DIEU A
VOULU QU'EN CE JOUR VOUS NE SOYEZ PAS PRESENTS. MERCI POUR TOUT VOTRE SOUTIEN
DURANT TOUTES CES ANNEES D'ETUDES. PUISSENT VOS AMES REPOSER EN PAIX.
A ASSITA SENE ET A MES FRERES ET SOEURS QUI ONT ETE L'OBJET
DE TANT DE PRIVATIONS ET D'ABSENCES DE MA PART.
Thèse de Doctorat Unique
Remerciements
Ce travaiL a été réaLisé au
Laboratoire de PhysioLogie AnimaLe de L'Université de Ouagadougou, en
coLLaboration avec L'I.N.E.R.A (Département des Productions AnimaLes),
sous La direction scientifique du Professeur Laya Sawadogo. Je tiens à
Lui adresser mes sincères remerciements pour La confiance qu'iL m'a
accordé en m'accueiLLant dans son Laboratoire.
Je voudrais égaLement remercier très
sincèrement Le Docteur Hamidou Hamadou Tamboura, Chargé de
Recherche au Département des Productions AnimaLes de L'I.N.E.R.A,
Codirecteur de ce travaiL, travaiL qu'iL a suivi avec attention et avec une
grande disponibiLité. Ce fut un réeL pLaisir de côtoyer
votre très grande modestie et votre humanisme sans mesure.
Je tiens à remercier Le Directeur de L'I.N.E.R.A, Le
Professeur BoLy Hamidou pour ses conseiLs et ses encouragements ainsi que toute
son administration
Je remercie Le CREAF de Kamboinsè et tous Les
chercheurs du Département Productions AnimaLes à savoir Les
Docteurs Tingsmerson Ouedraogo, Augustin Kanwé, Hamadé
Kagoné, Aissata Wèrème, Chérubin Hien OLLo, Henri
Kaboré, Amadou Traoré, Les ingénieurs, Ferdinand
OuLbiLbiga, Rasmané Sanfo, Adama Kaboré, Les Techniciens,
Moumouni Sanou, Sidiki Idogo, Boukary Sinon, ALain MiLLogo, Madame
Dakouré, Madame Zerbo. Je ne saurai oubLier Les manoeuvres du
Département, Benjamin Ouédraogo, Boukary Dicko, Boureima Dicko et
Sakande AbdouLaye pour Le grand soutien qu'iLs m'ont apporté.
Thèse de Doctorat Unique
Aux enseignants Chercheurs du Département BioLogie et
PhysioLogie AnimaLe, Les Professeurs Gustave Kabré et Guenda
Wendengoundy, Les Docteurs Raymond BeLemtougry, Youssoufou Ouédraogo,
Lamini Ouédraogo, Drissa Sanou, Youssouf Ouattara, Moussa Zongo, Antoine
Sanou , je tiens à vous dire grand merci pour tous Les conseiLs et aides
de toute nature que vous m'avez accordé pour La réaLisation de
cette thèse.
Je tiens à remercier très sincèrement Le
Professeur Augustin Béré, Le Professeur Sita Guinko, Le Docteur
Hamadou Dicko pour Leur conseiLs et Leurs aides de toute nature.
Je tiens à exprimer toute ma reconnaissance au
Professeur Pierre I. Guissou et à toute son équipe du Laboratoire
de PharmacoLogie et ToxicoLogie de L'I.R.S.S, à savoir Les Docteurs
SyLvin Ouedraogo, Hassanata MiLLogo, Marius Lompo, Aristide Traoré, Noya
Somé et à ses deux techniciens Kadeba et Yaro.
A mes très chers ami (e)s et frères CharLes
Daboné, OLivier Gnankiné, Sandra Kambou, Moussa GueLbeogo,
Tiganadaba Lodoun, ImäeL Nestor BassoLé, Athanase BadoLo, Bah
Niango MaLick, ALy Sawadogo, PitaLa Wéré, CharLes Lamien, ALine
Medah, Martin Tiendrebeogo, Yaya Bayané, Hamade Ouedraogo, PauLin Ouaba,
Marie Laure Guissou, SyLvie Yaméogo, Christiane Sawadogo, IsabeLLe
Sourabié, GhisLaine Yao, je voudrais vous remercier pour tout Le soutien
que vous avez pu m'apporter tout au Long de L'éLaboration de cette
thèse.
Je voudrais adresser mes sincères remerciements
à toute L'Equipe de NeurobioLogie et Maîtrise des Fonctions
Saisonnières de L'I.N.R.A/NouziLLy de Tours (France) pour L'accueiL et
Le soutien dont j'ai été L'objet au cours de mon séjour
dans Leur Laboratoire.
Thèse de Doctorat Unique
LISTE DES TABLEAUX
Tableau I : Différentes espèces de
Holarrhena rencontrées en Asie et en Afrique P. 10
Tableau II : Noms vernacuLaires de
Holarrhena floribunda des Langues de queLques
|
paysd'Afrique. P .12
Tableau III : QueLques usages traditionneLs des
parties de L'appareiL végétatif de H.
|
|
floribunda.
|
P .15
|
|
Tableau IV : Les ceLLuLes et Les tissus
sensibLes aux oestrogènes.
|
P. 27
|
|
Tableau V : Rendement des différentes
préparations après La LyophiLisation.
|
P. 34
|
Tableau VI : ProtocoLe d'administration de La
progestérone LiposoLubLe et hydrosoLubLe pendant une période de
quatre (4) jours. P. 43
Tableau VII : ProtocoLe d'administration de La
progestérone LiposoLubLe et hydrosoLubLe pendant une période de
sept (7) jours. P. 45
Tableau VIII : ProtocoLe d'administration des
produits pour La recherche de L'activité progestative. P. 47
Tableau IX : ProtocoLe d'administration des
produits pour La recherche de L'activité antiprogestative. P. 55
THESE DE DOCTORAT UNIQUE
Tableau X : Temps de rétention et surface
des pic des extraits avant et après enrichissement avec de La
progestérone pure. P. 56
Tableau XI : Concentration (ìg/mL) et
quantité (g) de La progestérone dosée par H.P.L.C dans Les
extraits de H. floribunda. P. 56
Tableau XII : Quantité de
progestérone dosée par Radio-immunoLogie dans Les extraits des
feuiLLes de H.floribunda. P. 57
Tableau XIII : Nombre de souris mortes
après 1, 24, 48 et 72 heures d'observations. P. 58
Tableau XIV : Pourcentage (%) de
mortaLité des souris pour Le test finaL de La DL50 des extraits du
macéré aqueux des feuiLLes de H. floribunda
administrés par voie sous-cutanée. P. 59
Tableau XV : VaLeurs des D.L et des rapports
DL5/DL95, DL50/DL95, DL5/DL50 de La toxicité généraLe
aiguë de L'extrait du macéré aqueux des feuiLLes de H.
floribunda par voiesouscutanée. P. 60
TabLeau XVI : Evolution du poids des souris et
pourcentage de perte de poids. P. 61
Tableau XVII : Effet des différentes
doses de L'extrait du macéré aqueux de H. floribunda sur
Le poids de queLques organes en toxicité généraLe
aiguë. P. 62
THESE DE DOCTORAT UNIQUE
TabLeau XVIII : Principaux syndromes d'intoxication
observés pendant toute la
durée du test et leur variation en
fonction des différentes doses. P. 62
Tableau XIX : Effet de La progestérone
LiposoLubLe et hydrosoLubLe administrée pendant quatre(4) jours sur Le
poids des souris, du déciduome et L'apparition des sites
d'impLantations. P. 64
Tableau XX : Effet de La progestérone
LiposoLubLe et hydrosoLubLe administrée pendant sept (7) jours sur Le
poids des souris, du déciduome et L'apparition des sites
d'impLantations. P. 65
Tableau XXI : Effet des différents
traitements sur Le poids des souris, des cornes utérines, du
déciduome et L'apparition des sites d'impLantation pour La mise en
évidence de L'activitéprogestative. P.66
Tableau XXII : Effet des différents
traitements sur Le poids des souris, du déciduome et L'apparition des
sites d'impLantation pour La mise en évidence de L'activité
antiprogestative. P.68
Tableau XXIII : EvoLution pondéraLe des
rattes avant et après 7 jours de traitements et Le pourcentage de rattes
présentant une ouverture vaginaLe. P. 69
TabLeau XXIV : Effet des différents traitements
sur le poids des rattes entières et le pourcentage de rattes
présentant une ouverture vaginale. P. 75
LISTE DES FIGURES
THESE DE DOCTORAT UNIQUE
|
Figure 1 : FeuiLLe et fLeur de Holarrhena
floribunda (G. Don) Durand et Schinz.
|
P. 11
|
|
Figure 2 : Fruit de Holarrhena
floribunda (G. Don) Durand et Schinz.
|
P. 11
|
|
Figure 3 : Organisation du tractus génital de la
ratte
|
P. 17
|
Figure 4 : Les différentes étapes du cycle
oestral à partir de la réalisation d'un frottis vaginal P. 19 et
P. 20
Figure 5 : Section transversaLe de La corne
utérine de La ratte dans LaqueLLe Le déciduome se
différentie. P. 23
Figure 6 : Préparation hormonaLe à
partir de La progestérone et de L'oestradioL pour La
mise en
évidence de La réaction déciduaLe P. 24
Figure 7 : Les voies de La
stéroidogénèse à partir du choLestéroL. P.
29
Figure 8: RéguLation des hormones
hypophysaires et ovariennes et mécanismes de rétroaction des
oestrogènes et de La progestérone sur L'axe
hypothaLamo-hypophysaire.
p. 32
Figure 9 : InstiLLation de L'huiLe d'arachide de
Laboratoire dans La corne utérine P. 35
Figure 10 : Chromatogramme du temps de
rétention de La progestérone. P. 37
Figure 11 : Courbe étaLon de La
progestérone : reLation surface pic / concentration. P.
38
Figure 12 : Courbe étaLon de dosage de La
progestérone par radio-immunoLogie. P. 39
THESE DE DOCTORAT UNIQUE
|
Figure 13: Courbe étaLon de dosage des
protéines totaLes.
|
P. 51
|
|
Figure 14 : Courbe étaLon de dosage du
gLucose.
|
P. 52
|
|
Figure 15 : Courbe étaLon de dosage du
choLestéroL.
|
P. 53
|
Figure 16 : Effet des différents traitements de
H. floribunda sur les poids frais et sec de l'utérus chez la
ratte ovariectomisée. P. 70
Figure 17 : Effet des différents
traitements de H. floribunda sur La variation des poids frais des
gLandes surrénaLes après 7 jours de traitement chez La ratte
ovariectomisée. P. 71
Figure 18 : Effet des différents
traitements de H. floribunda sur Le poids frais des gLandes
surrénaLes après 7 jours de traitement chez La ratte
ovariectomisée. P. 72
Figure 19 : Effet des différents
traitements de H. floribunda sur Le taux de choLestéroL
après 7 jours de traitement chez La ratte ovariectomisée. P.
73
Figure 20: Effet des différents traitements de
H. floribunda sur le taux de glucose après 7 jours de
traitement chez la ratte ovariectomisée. P. 74
Figure 21 : Variation pondérale de l'utérus
de ratte ayant subi différents traitements pendant7jours. P.
76
Figure 22 : Variation pondérale des ovaires de
rattes ayant subi différents traitements pendant 7 jours. P.
77
THESE DE DOCTORAT UNIQUE
Figure 23: Variation pondérale de glandes
surrénales des rattes ayant subi différents traitements pendant 7
jours. P. 78
Figure 24 : Evolution du taux de protéines dans
les cornes utérines et dans les ovaires après 7 jours. P.
79
Figure 25 : Evolution du taux de glucose dans les
cornes utérines et dans les ovaires après7joursdetraitement. P.
80 Figure 26 : Evolution du taux de cholestérol dans
les cornes utérines et dans les ovaires après 7 jours de
traitement. P. 81
THESE DE DOCTORAT UNIQUE
SIGLES ET ABBREVIATIONS
°c : Degré ceLcius
ug : Microgramme
al. : ALLié
av. JC : Avant Jésus Christ
BSA : ALbumine du Sérum Bovin
Creaf : Centre de Recherches EnvironnementaLes
AgricoLes et de Formation
Dl : Dose LétaLe
Ed : Eau DistiLLée
ER : Récepteur Oestrogénique
Fsh : Hormone FoLLicuLo-StimuLante
GnRH : Gonadotrophin ReLeasing Hormone
g : gramme
HDL : Lipoprotéines de Haute
Densité
Hplc : Chromatographie Liquide Haute
Performance
Inera : Institut de L'Environnement et des
Recherches AgricoLes INRA : Institut NationaL de La Recherche
Agronomique
IRSS : Institut de Recherche en Sciences de La
Santé J : jour
kg : KiLogramme
LDL : Lipoprotéines de Basse
Densité
Lh : Hormone Lutéinisante
mg : miLLigramme
min : minute
nm : nanomètre
rt : Temps de Rétention
THESE DE DOCTORAT UNIQUE
ABSTRACT
Holarrhena floribunda (G. Don) Durand and Schinz an
Apocynaceae was commonLy used in veterinarian an human traditionaL therapeutic
to fight against abortion and infertiLity. The aim of the present study is to
verify its utiLization by evaLuating progesterone activity by deciduaL reaction
and estrogenic activity by uterotrophics assays. Research was preLiminary made
by HPLC and RIA on the presence of progesterone in three aqueous extractions :
macerate, decoction and infusion. Safety measures of utiLizations have been
evaLuated by acute toxicity.
ResuLts have reveaLed as much in HPLC as in RIA, the presence
of the progesterone in the Leaves of H. floribunda. However the
quantity of progesterone is more higher in the macerate extract than in
decoction and in infusion extract.
The vaLues of DL50 and index security are respectiveLy 1509
mg/kg and 10,3. These vaLues show an average toxicity and a great
manoeuvrabiLity of the macerate aqueous extracts of Leaves of H.
floribunda administered subcutaneousLy.
The research of progesterone activity shows progesterone
potentiaLisation by the macerate aqueous extracts of Leaves of H.
floribunda. This potentiaLisation showed an increase of the weight of the
deciduoma and the number of spots simiLar to bLastocysts impLantation sites
when the extract and the pure progesterone were administered simuLtaneousLy.
On the other hand the macerated aqueous extracts of Leaves of
H. floribunda showed an estrogenic activity. This activity firstLy
showed an increase of weight of wet and dry uterus and vaginaL opening of rats.
SecondLy by an increase of the totaL protein and the gLucose LeveL and a
decrease of the LeveL of choLesteroL in uterine horns.
In concLusion, the potentiaLisation of the progesterone by
macerate aqueous extracts of Leaves of H. floribunda and their
estrogenic activity justify their utiLization in traditionaL veterinary
therapeutic. H floribunda contains some phytoestrogens, that couLd be
beneficiaL in the fight against cancers, cardiovascuLar diseases and some
affections of menopausaL women Like osteoporosis, if thorough studies are
made.
Mots dles : Holarrhena floribunda,
folk medicine, progesterone activity, estrogenic activity
THESE DE DOCTORAT UNIQUE
TABLE DES MATIERES
INTRODUCTION GENERALE 1
PREMIERE PARTIE: REVUE BIBLIOGRAPHIQUE
CHAPITRE I :UTILISATION DES PLANTES EN MEDECINE
TRADITIONNELLE 4
1. UtiLisation des pLantes 4
2. Les Limites de L'usage des pLantes en médecine
traditionneLLe 4
3. Les principaLes caractéristiques des remèdes
à base de pLantes 5
4. Les phytohormones 6
CHAPITRE II :HOLARRHENA FLORIBUNDA (G. DON) DURAND ET
SCHINZ
(APOCYNACEE) 8
1. L'espèce Holarrhena floribunda (G. Don)
Durand et Schinz 8
2. Description de L'espèce H. floribunda 8
3. Distribution géographique de H. floribunda
(G. Don) Durand et Schinz 9
4. Noms vernacuLaires 12
5. ELéments de phytochimie 13
6. Activités pharmacoLogiques 13
7. UtiLisations traditionneLLes de H. floribunda 14
CHAPITRE III: ORGANISATION DE L'APPAREIL GENITAL DE LA
RATTE ET DE LA SOURIS FEMELLE 16
1. Organisation de L'appareiL génitaL . 16
2. Le cycLe oestraL de La ratte et de La souris. 18
3. L'impLantation du bLastocyste 19
4. Induction de La déciduaLisation 19
5. La réaction déciduaLe 20
CHAPITRE IV :LES STEROIDES OVARIENS 22
1. La progestérone 22
2. Les oestrogènes 23
3. Biosynthèse des oestrogènes et de La
progestérone 25
4. Stéroïdogénèse ovarienne 27
5. RôLe des stéroïdes ovariens dans La
déciduaLisation 27
DEUXIEME PARTIE: ETUDE EXPERIMENTALE
|
CHAPITRE I : MATERIEL ET METHODES
|
29
|
|
1.
|
EchantiLLonage
|
29
|
|
2.
|
Extraction réaLisées pour L'étude
|
29
|
|
3.
|
Animaux d'étude
|
30
|
|
4.
|
Opérations chirurgicaLes
|
30
|
|
5.
|
Dosage de La progestérone par Chromatographie Liquide
Haute Performance
|
|
(HPLC) dans Les extraits de Holarrhena floribunda et par
radio-immunoLogie. 32
6. EvaLuation de La toxicité généraLe
aigüe du macéré aqueux des feuiLLes de H. floribunda
38
7. Recherche de L'activité progestative du
macéré aqueux des feuiLLes de H. floribunda 39
8. Recherche de L'activité oestrogénique du
macéré aqueux des feuiLLes de H.
floribunda 45
9. AnaLyses statistiques des résuLtats .... 50
CHAPITRE II : RESULTATS 51
1. Taux de progestérone dans Les feuiLLes par HPLC et RIA
51
2. VaLeur de La toxicité généraLe
aiguë du macéré aqueux des feuiLLes de H. floribunda
54
3. Activité progestative du macéré aqueux
aqueux des feuiLLes de H. floribunda....
.59
4. Activité oestrogénique du macéré
aqueux des feuiLLes de H. floribunda 66
DISCUSSION ET CONCLUSION GENERALE 80
REFERENCES BIBLIOGRAPHIQUES 89
LISTE DES PUBLICATIONS RESUME DE L'ETUDE
THESE DE DOCTORAT UNIQUE
Introduction générale
Le contrôle de la fertilité humaine ou
animale a de tout temps préoccupé les hommes. Dans
l'espèce humaine, la tendance globale actuelle en matière
d'investigation est à la recherche de moyens de réduction ou
d'inhibition de la fertilité en raison de l'explosion
démographique pour faire face à la faible disponibilité
des ressources économiques et alimentaires.
L'humanité dispose de nos jours de méthodes
modernes (substances de synthèse et hormones d'origine animaLe)
utiLisées pour Le contrôLe de La fertiLité chez La femme ou
chez L'homme. Les méthodes ou substances utiLisées jusque
Là présentent pour La pLupart certains inconvénients et
rebutent un grand nombre de personnes.
Les besoins économiques et alimentaires
imposent par contre, la recherche de moyens pour la stimulation de la
fertilité et de la productivité des espèces d'animaux
domestiques économiquement rentables. L'amélioration de la
productivité des animaux est réalisée à travers
diverses méthodes de maîtrise de la reproduction et
d'insémination artificielle. Ces méthodes nécessitent des
outils spéciaux qui demeurent encore très peu
maîtrisés et utilisés par les Africains. La médecine
traditionnelle propose par contre des plantes réputées comme
moyens efficaces de stimulation ou d'inhibition de la fertilité. Il faut
par ailleurs noter que le recours `' à la médecine par les
plantes», séduit plus la population et est l'objet d'un regain
d'intérêt de plus en plus croissant en Afrique. Entre autres
raisons explicatives de cet engouement, figure l'échec de la
médecine moderne ou conventionnelle face à certaines pathologies
(cancer, hépatite, maladies virales,....) et son coût prohibitif
pour les populations aux ressources financières très
limitées.
Les éLeveurs africains utiLisent de nombreuses pLantes
pour Les soins de Leur bétaiL à teL point qu'on parLe de
médecine vétérinaire traditionneLLe même si ceLLe-ci
reste encore très peu connue par rapport à La médecine
traditionneLLe humaine. Parmi ces pLantes, ceLLes qui sont utiLisées
pour L'améLioration de La fertiLité animaLe retiennent une
attention particuLière dans La mesure où Le Burkina Faso est un
pays à économie essentieLLement tournée vers L'agricuLture
avec des produits d'éLevage qui tiennent Le second rang, 10,6% en terme
de recettes d'exportation après Le coton (STC-PDES/MF (1998)). Parmi Les
maux qui sont à La base de La mauvaise productivité animaLe,
figurent Les avortements et Les probLèmes Liés à
L'infertiLité. Des études menées par Bourzat en 1980 sur
Les avortements, montrent chez La seuLe espèce caprine, des taux de
30,5% et 29,5%, respectivement chez Les types génétiques "mossi"
et "sahéLien". Pendant La saison sèche ce taux peut
s'éLever à 40,44%. La même étude reprise par
Tamboura et at. (1998) donne pour Les espèces
bovines, ovines et caprines des taux d'avortement respectivement de 35,7%, 50%
et 20,13%. Les pertes sont aLors énormes et constituent un important
manque à gagner pour L'économie du pays.
Des enquêtes ethnobotaniques réaLisées au
Burkina Faso ont reLevé Les atouts thérapeutiques que pourrait
présenter L'utiLisation de certaines pLantes dans Le domaine de La
reproduction humaine et animaLe pour corriger des probLèmes
d'infertiLité ou d'avortement (Aké-Assi, 1992 ; NacouLma, 1996 ;
Tamboura et at., 1998 ; Arbonnier, 2000). Parmi ces pLantes figure
Hotarrhena ftoribunda (G Don) Durand et Schinz (H.
ftoribunda), une pLante de La famiLLe des Apocynacées. Cette pLante
est non seuLement utiLisée pour guérir Les affections de La
sphère génitaLe teLLes Les vaginites, La bLennorragie ou La
gonococcie, mais aussi pour L'améLioration de La fertiLité et La
Lutte contre L'avortement. Parmi Les causes de L'infertiLité et des
avortements, figure en bonne pLace La déréguLation des hormones
stéroïdiennes (progestérones et oestrogènes) ou La
production insuffisante de ces hormones suite à un dysfonctionnement des
ovaires ou de L'axe hypotaLamo-hypophysaire. Les différentes
investigations menées sur Le pLan chimique ont mis en évidence
L'existence de La progestérone dans Les feuiLLes de H.
ftoribunda, une espèce récoLtée en Inde et au
SénégaL (Schmit, 1950 ; Leboeuf et at., 1964, 1969).
Paris et at. (1959) et MiLLogo (1992) ont réussi à
mettre en évidence des fLavonoïdes dans Les feuiLLes de H.
ftoribunda. Les fLavonoïdes sont des substances pouvant
présenter des activités oestrogéniques (Hodek et
at., 2002 ; CemeLi et at., 2004 ; VaLachovicova et
at., 2004 ; Zieran et at., 2004). Dans La mesure où
depuis L'avènement de La maLadie de La vache foLLe, Les nouveLLes
exigences internationaLes sont de pLus en pLus à L'excLusion du recours
aux hormones d'origine animaLe et aux hormones de synthèse, iL est
extrêmement important de mener des investigations dans La recherche des
phytohormones (Reich et at., 2002 ; Kersseboom et at., 2002 ;
OMS, 2002 ; ViLLmeur, 2003). Les phytohormones, substances contenues dans Les
pLantes et possédant des activités hormonaLes
oestrogéniques, progestatives ou androgéniques sont donc de pLus
en pLus recherchées.
Les parties de H. ftoribunda utiLisées par Les
éLeveurs burkinabè possèdent-eLLes une activité
progestative ou oestrogénique? C'est Là notre
préoccupation principaLe en réaLisant des tests bioLogiques
appropriés afin de vérifier expérimentaLement Les
propriétés supposées en médecine traditionneLLe de
cette pLante en tant que substance stimuLante de La fertiLité femeLLe.
Des tests in vivo d'activités oestrogéniques et progestatives ont
donc été réaLisés.
Mais avant toute investigation in vivo de
L'activité progestative ou oestrogénique, IL était
judicieux de vérifier La présence de La progestérone dans
L'Holarrhena récoLté au Burkina Faso. IL a
été donc recherché seLon Les trois (3) modes de
préparations aqueuses (macération, décoction et infusion)
couramment utiLisées en thérapeutique traditionneLLe, La
présence de La progestérone dans Les feuiLLes de H.
floribunda. Au préaLabLe, Les mesures sécuritaires
d'utiLisations des extraits aqueux de H. floribunda ont
été testées par L'évaLuation de La toxicité
généraLe aiguë.
Première partie :
Revue bibliographique
CHAPITRE I : UTILISATION DES PLANTES EN MEDECINE
TRADITIONNELLE
1. Utilisation des plantes
La médecine traditionneLLe d'après L'OMS, se
rapporte aux pratiques, méthodes, savoirs et croyances en
matières de santé qui impLiquent L'usage à des fins
médicaLes de pLantes, de parties d'animaux et de minéraux, de
thérapies spiritueLLes, de techniques et d'exercices manueLs
séparément ou en association pour soigner, diagnostiquer et
prévenir Les maLadies ou préserver La santé.
L'homme, par une approche progressive a découvert Les
vertus bénéfiques des pLantes faciLitées par
L'organisation des rapports sociaux, en particuLier à partir du
néoLithique (8000 ans av. J.C). IL faut néanmoins noter que Les
thérapies traditionneLLes par Les pLantes, varient d'une cuLture
à L'autre, d'un continent à L'autre et même d'un pays
à L'autre. Comparativement à La médecine moderne, La
médecine traditionneLLe a Le même objectif c'est à dire
guérir ou prévenir une maLadie. Cependant La conception des
causes d'une maLadie et Les méthodes empLoyées pour La
guérir diffèrent.
L'observation attentive, associée à La
transmission des informations reçues au cours du temps font que certains
hommes deviennent capabLes de poser un diagnostic, de retrouver La pLante qui
soigne et finaLement de guérir La maLadie.
2. Les limites de l'usage des plantes en
médecine traditionnelle
L'une des difficuLtés majeures de La médecine
traditionneLLe humaine et vétérinaire est La
méconnaissance de La pLupart des espèces végétaLes
intervenant dans Le domaine de La santé. IL s'impose donc un souci
majeur de recensement et de reconnaissance de toutes ces espèces
végétaLes. CeLa serait donc possibLe si au niveau de chaque Etat,
iL se formait un réseau organisé, composé de
tradipraticiens et de chercheurs intervenant dans Le domaine de La
médecine traditionneLLe et travaiLLant de manière convergente.
CeLa sera encore pLus fructueux s'iL existait une passereLLe étroite
entre d'abord Les chercheurs et Les tradipraticiens et ensuite entre Les
hôpitaux de type modernes et Les structures traditionneLLes.
Les principaux probLèmes que souLève La
médecine traditionneLLe impLiquent
égaLement L'absence de preuves de standardisation ou de
données scientifiques de son innocuité, de son efficacité
et de sa quaLité. IL s'impose donc La nécessité de prendre
des mesures pour garantir un usage correct et durabLe des remèdes afin
de protéger et préserver Le savoir traditionneL ainsi que Les
ressources natureLLes nécessaires à son appLication.
Les pratiques de La médecine traditionneLLe
n'étant pas écrites dans certains pays d'Afrique, eLLes se
perdent ou sont modifiées car se transmettent de bouche à
oreiLLe. Ces pratiques médicaLes sont très souvent
entourées d'un certain mysticisme qui cachent Les éLéments
bioactifs et ceLa entrave énormément L'étude du
médicament traditionneL.
3. Les principales caractéristiques des
remèdes à base de plantes
Dans La médecine traditionneLLe, tous Les organes des
pLantes sont utiLes. Mais ce sont principaLement Les feuiLLes, Les tiges
feuiLLées, Les écorces de tiges, Les racines et Les
écorces de racines qui sont Les pLus utiLisées (Bitsindou, 1996).
Les feuiLLes sont très utiLisées d'abord pour La faciLité
de Leur cueiLLette et ensuite parce qu'eLLes sont Le siège de La
biosynthèse et du stockage des métaboLites responsabLes des
propriétés bioLogiques des pLantes (MazLiak, 1974 ;
Bigendako-PoLygenis, 1989; Bitsindou, 1996).
Les modes de préparation des recettes traditionneLLes
sont très variés (Kanyinda, 1983 ; MaLgras, 1992). On distingue
:
· La macération qui consiste à Laisser
tremper La partie utiLe de La pLante dans de L'eau à La
température ambiante pendant 24 heures pour en extraire Les principes
actifs. La macération peut même durer pLusieurs années.
· La décoction qui consiste à faire
bouiLLir La partie utiLe de La pLante dans de L'eau pour en extraire Les
principes actifs. ELLe peut durer de queLques secondes à pLusieurs
heures seLon La substance, Les principes à extraire ou Le goût
souhaité.
· L'infusion consiste à verser de L'eau
bouiLLante sur La partie utiLe de La pLante pour en extraire Les principes
actifs. L'infusion peut durer de queLques secondes à queLques minutes.
Au-deLà, eLLe devient une macération.
· La trituration consiste à écraser La
partie utiLe de La pLante dans un mortier ou sur une pierre. La partie utiLe de
La pLante peut être écrasé directement après
récoLte ou séchée avant d'être
écrasée.
D'autres modes de préparation des recettes teLs La
torréfaction, La carbonisation, La mastication, Le piLage, La
râpure et L'organe nature existent et sont utiLisés (Bitsindou,
1996).
L'eau reste Le soLvant universeL de choix et présente
L'avantage de dissoudre Les seLs d'aLcaLoïdes et Les
hétérosides mieux que d'autres (Bitsindou, 1996). Mais d'autres
soLvants teLs que Le vin, Les boissons traditionneLLes aLcooLisées sont
utiLisées.
4. Les phytohormones
En Afrique pLusieurs pLantes sont utiLisées comme
tonifiantes sexueLLes,
réguLatrices du cycLe menstrueL ou Luttant contre Les
rétentions pLacentaires. La pLupart de ces pLantes contiennent des
substances, appeLées phytohormones car présentant Les mêmes
activités que Les hormones teLLes que La progestérone, Les
oestrogènes, La testostérone etc... Ces phytohormones comprennent
entre autres Les phytoestrogènes, phytoprogestérones et Les
phytotestostérones. Les phytoestrogènes sont des substances
chimiques contenues dans des pLantes et exerçant une activité
oestrogénique. Les principaux composés chimiques ayant une
activité oestrogénique sont Les isofLavones, Les
fLavonoïdes, Les Lignanes, Les prényfLavonoïdes etc. (Tamir et
at., 2000 ; DieL et at. , 2002 ; VaLachovicova et
at. , 2004). Les oestrogènes sont bien connus quand à
Leur importance dans La différentiation et La maturation sexueLLe de La
femeLLe, dans Les probLèmes du déséquiLibre hormonaL comme
Les bouffées de chaLeur, La sécheresse vaginaLe et
L'ostéoporose chez La femme ménopausée.
Chez L'homme, Les oestrogènes sont très souvent
utiLisés pour La Lutte contre Le cancer de La prostate. Cependant un
taux éLevé d'oestrogènes peut être
considéré comme facteur de risque pour Le cancer du sein et de
L'utérus chez La femme. Dans Le cas des phytoestrogènes, L'action
varie seLon L'organisme hôte, L'équiLibre hormonaL de ceLui-ci et
Le type de phytoestrogènes ingéré. En somme, si
L'organisme produit des oestrogènes en excès, Les
phytoestrogènes peuvent bLoquer partieLLement Leur effet négatif,
tandis que s'iL y a une déficience, eLLes combLent une partie des
besoins (Zieran et at., 2004). Les pLantes à activité
oestrogénique sont d'un grand intérêt tant pour Les
intervenants en santé natureLLe que chez Les
scientifiques. Les phytoestrogènes sont donc très utiLes dans
certains processus métaboLiques comme Le syndrome prémenstrueL,
La ménopause et même dans L'améLioration du profiL du
choLestéroL sanguin pouvant prévenir Les maLadies
cardio-vascuLaires (Stampfer et at., 1991; .CoLvin et at. ,
1993).
Dans une étude menée par Cos et at.
(2003), Les fLavonoïdes qui sont des substances
phyto-estrogéniques, avec des propriétés "vitaminiques P",
diminuent La perméabiLité des vaisseaux capiLLaires et renforcent
Leur résistance. ILs réduisent Les risques de maLadies
cardio-vascuLaires par La réduction du taux de choLestéroL et des
radicaux Libres qui sont considérés comme Les principaux
responsabLes de nombreux cancers (Van Der Schouw et at., 2000 ; Limer
et at. , 2004 ; Vaya et at., 2004).
Les phytoprogestérones tout comme Les
phytoestrogènes sont des substances chimiques contenues dans des pLantes
et ayant La même activité que La progestérone.
Contrairement aux phytoestrogènes, Les phytoprogestérones sont
très peu connus.
CeLa paraît assez invraisembLabLe que La
progestérone, une hormone d'origine animaLe puisse se retrouver dans Les
pLantes où eLLe n'a pas de signification en ce qui concerne La
reproduction. Bien que Les différences soient minimes, La
biosynthèse de La progestérone dans Le règne animaL et
dans Le règne végétaL sont assez proches (Bruneton, 1993 ;
Zava et at., 1998 ; Zan et at. , 2000).
Outre Les phytoprogestérones, on distingue
égaLement Les phytoprogestogéniques qui sont des pLantes capabLes
de produire eLLes-mêmes de La progestérone grâce à
Leur métaboLisme secondaire. Parmi ceLLes-ci, on peut citer
Hotarrhena ftoribunda, dans LaqueLLe a été
identifiée et dosée La progestérone (Bennett et
at. , 1965 ; Leboeuf et at. , 1969). Grâce à des
techniques de marquages radioactifs, La prégnènoLone
marquée conduit à L'isoLement et au dosage de La
progestérone radioactive (Leboeuf, 1968).
CHAPITRE II : HOLARRHENA FLORIBUNDA (G. DON) DURAND ET
SCHINZ.
1. L'espèce Holarrhena floribunda (G. Don)
Durand et Schinz
En 1844, De CandoLLe découvrit La première
espèce Africaine d'HoLarrhène qu'iL nomma Holarrhena
africana. Cependant queLques années pLutôt, Don (1834) avait
décrit sous Le nom de Rondelettia floribunda un arbuste
buissonnant originaire de La Sierra Leone qu'iL cLassait dans La famiLLe des
Rubiacées. Mais Hooker (1849), après examen de pLusieurs herbiers
des deux espèces concLut qu'eLLes étaient identiques.
Le genre Holarrhena appartient à La tribu des
ALstoniées, à La sous tribu des HoLarrheninées, à
La famiLLe des Apocynacées et à La sous famiLLe des
PLuméroïdées. Holarrhena appartient à La
section Alepis A. D. C. Des études ethnobotaniques ont
rapporté L'existence de dix sept (17) espèces de Holarrhena
asiatiques et une dizaine en Afrique (Tableau
I).
2. Description de l'espèce H. floribunda
La morphoLogie de La pLante est fonction des régions
et des terrains où eLLe existe: queLques unes sont buissonnantes ou
arbustives dans Les régions sahéLiennes aLors que dans Les
régions tropicaLes ce sont de petits arbres au fût
éLancé pouvant atteindre une quinzaine de mètres de
hauteur (Arbonnier, 2000).
Les feuiLLes sont simpLes, ovaLes à obLongues,
opposées, entières, acuminées à sub-obstrues de 7
à 15 cm de Longueur et de 5 à 8 cm de Largeur. ELLes sont
membraneuses et pourvues de nervures très saiLLantes en dessous et d'un
court pétioLe (5 à 8 cm).
Les fLeurs de couLeur bLanchâtre, petites et
odoriférantes, se regroupent sous forme d'infLorescence et forment des
corymbes terminaux ou axiLLaires. Le caLice Long de 3 mm, comprend 5
sépaLes recouverts de poiLs gris denses et une coroLLe à 5
pétaLes soudées en un tube de 8 à 14 mm. Des
étamines au nombre de Cinq( 5 ), à fiLet court, terminés
par des anthères décurrentes, en fer de Lance( 1 mm ) sont
insérées sur La base renfLée du tube coroLLaire.
L'androcée est composé d'étamines Librement veLues.
L'ovaire est constitué de deux (2) carpeLLes Libres
muLtiovuLés. Le styLe est obLong et fusiforme, Le stigmate est
ovoïde et acuminé.
Le fruit est un Long foLLicuLe accoupLé,
Légèrement incurvé, à pointe émoussée
et de couLeur noirâtre. ILs peuvent mesurer jusqu'à 50 cm de Long,
1,5 cm à 2 cm de Large. ILs renferment des graines fusiformes, apLaties
surmontées d'une aigrette de Longs poiLs fauves. L'embryon charnu est
repLié sur Lui-même.
Les feuiLLes jaunissent vers janvier ou février et
tombent par La suite. L'arbre reste nu jusqu'en mai - juin. La période
de fLoraison est située en début de saison pLuvieuse (Voir Figure
1 et 2).
3. Distribution géographique de H. floribunda
(G. Don) Durand et Schinz
H. floribunda est une des espèces Les pLus
répandues en Afrique. Sa dispersion s'étend du
SénégaL au Cameroun, jusqu'à La RépubLique
Démocratique du Congo. On en signaLe même dans La région du
Tchad, des pLateaux secs et arides aux forêts tropicaLes humides.
H. floribunda est généraLement
retrouvé dans Les zones soudaniennes à guinéennes, Les
gaLeries forestières, au bord des cours d'eau, des coLLines rocheuses,
des friches et des jachères.
Tableau I : Différentes
espèces de Holarrhena rencontrées en Asie et en Afrique (Leboeuf,
1968).
ASIE AFRIQUE
Genre Espèce Pays Genre Espèce Pays
Holarrhena affinis, Hook Chine Holarrhena
floribunda, (G. Don) Burkina Faso , SénégaL,
Durand et Schinz Côte d'Ivoire,
angustata, Pierre Cochinchine africana (A. DC)
Burkina Faso , SénégaL,
Côte d'Ivoire,
antidysebteria, WaLL Asie TropicaLe
congolensis Stapf Guinée, Congo
gassifolia, Pierre Cichinchine febrifuga
KLotzch Mozambique
curtisii, Kinyand BengaLe fischeri K. Schman
Afrique tropicaLe
GanLge
daronensis, ELmer PhiLippines glabra, KLotzch
Afrique tropicaLe
densiflora, RidLey PéninsuLe MaLaise
madagascariensis, Madagascar
Baker
microterantha K.
latifolia, RidLey Schuman Afrique tropicaLe
macrocarpa F. ViLLar Java, InsuLinde, ovata,
A. DC Afrique tropicaLe
PhiLippines
Mitis, R Brown CeyLan wulfsbergii, Stapf
Afrique tropicaLe
Pauciflora, RidLey PéninsuLe MaLaise
Perroti, Spire Cochinchine
Procumbens, MeriLL PhiLippines
Pubescens, waLL Indes OrientaLes
Pulcherrina, RidLey MaLaise
Similis, Craib Siam

11
Figure 1 : Feuille et fleur de
Holarrhena floribunda (G. Don)
Durand et Schinz.
Figure 2 : Fruit de Holarrhena
floribunda (G. Don)
Durand et Schinz.
|
|
4. Noms vernaculaires
H. floribunda porte de nombreux noms vernacuLaires,
vu qu'iL est connu et utiLisé dans pLusieurs régions par
différents groupes ethnocuLtureLs. En français, iL est
communément appeLé, Holarrhène florifère.
Le tabLeau II, résume queLques pays où H. floribunda est
rencontré et Les noms qui Lui sont attribués par certains groupes
ethniques.
Tableau II : Noms vernaculaires de
Holarrhena floribunda dans les langues de quelques pays d'Afrique (kerharo,
1974; Leboeuf, 1964, Arbonnier, 2000).
Pays
|
|
Langue
|
|
|
Noms vernaculaires
|
|
|
|
|
|
|
|
|
·
|
Mooré
|
|
·
|
Kinkirs yoabga, kinkirs yabraogo
|
Burkina Faso
|
|
·
|
PeuL
|
|
·
|
Tarki, taraki
|
|
|
·
|
DiouLa
|
|
·
|
toumatiof
|
|
|
·
|
Sérère
|
|
·
|
Nap, lop
|
|
|
·
|
OuoLof
|
|
·
|
Seoulou
|
Sénégal
|
|
|
|
|
|
|
|
|
·
|
Casamance
|
|
·
|
Kerko
|
|
|
·
|
DioLa
|
|
·
|
toumatiof
|
|
|
·
|
Agni
|
|
·
|
Céré
|
|
|
·
|
Yacouba
|
|
·
|
kouro
|
Côte d'Ivoire
|
|
·
|
BaouLé
|
|
·
|
sébé
|
|
|
·
|
Attié
|
|
·
|
sahoué
|
|
|
·
|
Gouro
|
|
·
|
toro-toro
|
|
|
·
|
FouLLah
|
|
·
|
gaoulen, indamma ou Ndamma
|
Guinée
|
|
·
|
MaLinké
|
|
·
|
kouna sana
|
|
|
·
|
Soussou
|
|
·
|
yété ou yaté
|
|
|
·
|
Mandingue
|
|
·
|
tiariko
|
Soudan
|
|
|
|
|
|
|
|
|
·
|
Bambara
|
|
·
|
Tou-fou
|
|
5. Eléments de phytochimie
Les premiers travaux sur H. floribunda furent
entrepris par KiedeL en 1878. IL réussit à extraire des
écorces du tronc, un aLcaLoïde qui fut identifié à La
conéssine par PoLstorff et Schirrner (1886). Kanga et al.
(1926) réussissent à extraire des écorces de H.
antidysenterica, H. floribunda et H. congolensis de La
conéssine. ILs apportaient ainsi La preuve de L'anaLogie de composition
en aLcaLoïdes stéroïdiques existant entre ces
différentes espèces. Paris (1938) réussi à isoLer
de H. floribunda en provenance du SénégaL, des
aLcaLoïdes totaux de teneur pLus éLevées dans Les
écorces de tronc et de racines. Schmit (1950) ayant repris Les
mêmes travaux démontra La présence d'autres aLcaLoïdes
dans Les écorces : Isoconessimine, Conessimine, Conkurchine,
HoLarrhémine, HoLarrhimine.
Leboeuf et al. (1964) ont réussi à
mettre en évidence La présence de La progestérone dans Les
feuiLLes de H. floribunda. Ce même résuLtat fut
confirmé par Leboeuf et al. (1969) Lorsqu'iLs étudiaient
La composition chimique des feuiLLes de Holarrhena floribunda. En pLus
donc de La progestérone, iLs réussissent à isoLer quatre
nouveaux aLcaLoïdes : La méthyLhoLaphyLLine, L'hoLaphyLLinoL,
L'hoLaphyLLidine et La dihydrohoLaphyLLamine. Outre Les travaux de Leboeuf,
Bennett et al. (1965), mettent en évidence La
biosynthèse de La progestérone à partir de La
pregnènoLone.
Paris et al. (1959), mettent en évidence dans
Les feuiLLes de H. floribunda, Les fLavonoïdes. En 1992, MiLLogo
confirme cette présence dans Les feuiLLes et Les écorces de tiges
H. floribunda.
Loukaci et al. (2000) réussissent à
isoLer Les trichotécènes, un groupe de terpène, des
écorces de tige de H. floribunda. Les
trichotécènes sont des composées chimiques produits par
voie des terpènes et sont considérés comme des
mycotoxicoses humaine et animaLe.
6. Activités pharmacologiques
L'étude de La toxicité de H.
floribunda a surtout porté sur La toxicité de La
conéssine qui s'est révéLée être très
toxique pour Les amibes (Burn, 1915), Les bactéries (Meissner et Hesse,
1930), Les vers (Janot et al., 1949). Sur Les animaux teLs La
grenouiLLe, Le cobaye, La toxicité est très faibLe (Baksh,
1936).
Des études de L'action de La conéssine sur Le
système nerveux centraL réaLisées par KiedeL (1878), puis
Burn (1915) ont montré qu'eLLe entraîne La disparition des
mouvements voLontaires suivie de nécrose. La mort intervient par
paraLysie du centre
respiratoire. H. floribunda intervient
égaLement dans La guérison des maLadies sexueLLement
transmissibLes (Arbonnier, 2000).
MiLLogo (1992), trouve une DL50 de 1000 mg/kg sur des souris
bLanches avec Le décocté des feuiLLes administré par voie
intrapéritonéaLe. Pour Le décocté de tiges, eLLe
trouve une DL50 de 950 mg/kg.
7. Utilisations traditionnelles de H. floribunda
L'utiLisation des pLantes du genre Holarrhena en
médication traditionneLLe remonte à L'an 1000 av. Jésus
Christ. Les habitants des Indes orientaLes Les utiLisaient pour Le traitement
des dysenteries aiguës et chroniques. C'est par Les Portugais que H.
antidisenterica parvient en Europe occidentaLe.
Le NéerLandais Van Reede (1678) Lui attribue Les
propriétés suivantes :
Le broyat de L'écorce bue dans du Lait acide arrête
La dysenterie et Les hémorroïdes;
Le décocté de La racine est actif contre L'angine,
Les douLeurs arthritiques et même Les rages de dents.
Les graines utiLisées en décoction Luttent contre
La fièvre, L'hépatite et La
goutte.
En Afrique pLusieurs travaux ethnobotaniques (Arbonnier,
2000) révèLent L'utiLisation de H. floribunda dans La
guérison de pLusieurs pathoLogies. Ainsi donc H. floribunda est
utiLisé contre La dysenterie et La stériLité, comme
fébrifuge et diurétique. SeLon Kerharo (1974), Le
macéré des écorces, administré par voie oraLe est
indiqué contre Les parasitoses intestinaLes, La bLennorragie et La
stériLité.
La décoction des écorces et des feuiLLes seLon
certaines matrones du SénégaL, en boisson et en bain est
conseiLLée durant toute La gestation de La femme et pour Les femmes
confrontées aux probLèmes d'avortement.
Les diouLas utiLisent Le décocté des racines
seuLes ou associées aux feuiLLes pour traiter Les règLes
douLoureuses.
SeLon Pousset (1989), 35 g des écorces du tronc
bouiLLies dans 1 Litre d'eau, fiLtrées puis utiLisées comme une
toiLette intime, deux (2) fois par jour, est très efficace contre Les
vaginites à trichomonas.
Le tabLeau III donne Les différentes utiLisations de
L'appareiL végétatif de H. floribunda.
Tableau III : Quelques usages
traditionnels des parties de l'appareil végétatif de H.
floribunda (Kerharo, 1974; Berhaut, 1979 ; Arbonnier, 2000)
Organe végétatif Pathologic
traitéc
Les racines
|
· CoLique, bLennorragie, constipation, infections
urinaires, gonorrhée
· StériLité, risque d'avortement,
dysenterie,
amibiase
· Hypertension, dermatose, ascite
|
|
· Accouchements, stériLité, risque
d'avortement, Les feuilles gaLactagogues pour Les bovins
· Diarrhée, gonorrhée
Les écorces
|
· Fébrifuge, paLudisme
· Amibiase, dysenterie
· CoLiques, vomissements
· insomnie
|
|
CHAPITRE III: ORGANISATION DE L'APPAREIL GENITAL DE LA
RATTE ET DE LA SOURIS FEMELLE
1. Organisation de l'appareil génital
L'appareiL génitaL de La souris femeLLe et de La ratte
sont assez sembLabLes sur Le pLan anatomique. IL comprend deux ovaires et Les
voies génitaLes que sont Les oviductes, L'utérus doubLe, Le vagin
et La vuLve (Figure 3). La surface de chaque ovaire est surmontée d'une
membrane transparente, Le sac périovarien. Les oviductes rattachent
L'utérus à L'espace périovarien. Chaque utérus est
attaché par un mesométrium qui contient une quantité
considérabLe de tissu adipeux. Le cLitoris est une petite
éLévation juste au-dessus de L'orifice vaginaL et perforé
par L'uretère. Les conduits des gLandes cLitoridiennes s'ouvrent
ventroLatéraLement de chaque côté de L'organe. A La
puberté L'orifice vaginaL s'ouvre et reste ainsi toute sa vie.
L'utérus est un organe muscuLaire Lisse situé
dans La cavité peLvienne entre La vessie et Le rectum. Chez La ratte Les
deux cornes utérines sont nettement séparées et sont sous
forme de dupLex. La masse muscuLaire est creusée d'une cavité
utérine. Les cavités utérines sont tapissées par
une muqueuse très particuLière, L'endomètre, qui contient
de nombreuses gLandes sujettes à des variations histoLogiques au cours
du cycLe menstrueL. L'intérieur et L'extérieur sont
tapissés respectivement par un épithéLium cyLindrique dont
La production de gLycogène est moduLée par Le cycLe oestraL.
Sac péri-
ovarien
oviducte
utérus droit
glande de bartholin
orifice vaginal
|
|
tissu adipeux
ovaire gauche
utérus gauche
cervix
vagin
uretère
clitoris
|
|
Figure 3 : Organisation du tractus
génital de la ratte (Le côté droit de l'utérus a
été séparé des tissus adipeux) (Turner, 1955).
2. Le cycle oestral de la ratte et de la souris.
L'activité sexueLLe de La ratte et de La souris se
traduit par des modifications cycLiques au niveau des ovaires et des organes
sexueLs secondaires tous Les quatre à cinq jours. Cette activité
sexueLLe est réguLée par La sécrétion des
gonadotrophines hypophysaires (FSH, LH, ProLactine) qui sont eLLes mêmes
sous Le contrôLe de L'hypothaLamus. La synthèse ovarienne des
stéroïdes sexueLs (oestrogènes, progestérone...)
contrôLe La réceptivité des organes sexueLs secondaires,
utérus, oviducte et vagin.
Un frottis vaginaL réaLisé sur des rattes ou
des souris cycLées, permet de distingué Les différents
stades du cycLe oestrien (Figures 4a, 4b, 4c et 4d):
· Le proestrus qui se caractérise par La
présence de petites ceLLuLes épithéLiaLes, rondes et
nucLéés, isoLées ou groupées. Les Leucocytes sont
presque absents. Pendant cette période, L'imbibition en eau de
L'utérus augmente significativement et Les contractions utérines
deviennent de pLus en pLus fréquentes. L'épithéLium
vaginaL devient épais et de nombreuses mitoses apparaissent.
· L'oestrus se caractérise essentieLLement par La
présence de ceLLuLes squamées ou cornifiées et par
L'absence compLète de Leucocytes. L'ovuLation chez La ratte et La souris
est spontanée et arrive environ 10 heures avant Le début de
L'oestrus (BLandau et al. , 1941 a, b). Au cours de L'oestrus, La
Lumière utérine est distendue bien que L'imbibition en eau
diminue. Les contours de L'orifice vaginaL se gonfLent.
· Le meteoestrus est caractérisé par La
présence de ceLLuLes cornifiées et de queLques Leucocytes.
Pendant Le meteoestrus, La motiLité et La vascuLarité de
L'utérus diminuent considérabLement.
· Le dioestrus est caractérisé par La
présence en grand nombre de poLynucLéaires (Leucocytes) avec une
réapparition des ceLLuLes nucLéées. Pendant Le dioestrus,
La taiLLe, Le poids et La motiLité de L'utérus sont faibLes.
L'épithéLium vaginaL et La Lumière utérine sont
fins et Les gLandes endométriaLes sont atrophiées. Pendant cette
période Les rattes n'acceptent pas La copuLation.
A L'oestrus, iL y a La Libération des ovuLes au niveau
de L'ovaire. Les ovuLes se Lient aux gamètes mâLes et après
pLusieurs divisions successives donnent des bLastocystes. Les bLastocystes vont
s'impLanter au niveau de La paroi utérine pour La formation des futurs
embryons.
Figure 4.a : Metestrus : Nombre
important de leucocytes (L) par rapport aux ceLLuLes
épithéliales (E) et aux cellules
cornifiées (C).
|
E
L
|
|
|
Figure 4.b : Diestrus :
Leucocytes (L) pLus important que Les cellules
épithéliales (E) et Les cellules
cornifiées (C).
L > E ou L > C > N (Rhodes et al., 2002)
|
|
|
|
|
C
E
|
|
|
Figure 4.c : Oestrus: Le frottis est
composé soit uniquement de cellules cornifiées
(C) soit de quelques rares cellules épithéliales ou des
leucocytes.
|
|
Figure 4.d : Proestrus : Le frottis est
constitué soit uniquement de cellules
épithéliales (E) soit d'un mélange de cellules
épithéliales en grand nombre et de cellules
cornifiées (C) et des leucocytes (L) en petit
nombre. E ou E > C ou E > L (Rhodes et al., 2002).
3. L'implantation du blastocyste
L'impLantation du bLastocyste dans L'utérus
dépend de La réceptivité de L'endomètre. Le concept
de La réceptivité de L'utérus a été
étabLi pour La première fois chez Le rat avant d'être
étendu à d'autres espèces (Psychoyos, 1973, 1986,
1993).
Le processus de L'impLantation nécessite une
synchronisation précise entre Le déveLoppement du bLastocyste et
La réceptivité utérine contrôLée par Les
stéroïdes ovariens et différents médiateurs. ELLe
nécessite égaLement une profonde transformation de
L'endomètre, L'acquisition de propriétés adhésives
des ceLLuLes trophobLastiques et un contrôLe de L'invasion de
L'endomètre par Le trophobLaste. Le moment de L'impLantation varie seLon
Les espèces. Dans Le processus de L'impLantation, La réaction
déciduaLe du stroma endométriaL est une des transformations
majeures réaLisées au niveau de L'endomètre. Chez La ratte
et La souris, L'impLantation survient cinq (5) jours après
L'ovuLation.
3. Induction de la décidualisation
Chez toutes Les espèces de Mammifères,
L'impLantation du bLastocyste qui est une étape très importante
de La gestation, s'accompagne de remarquabLes changements de L'environnement
utérin pour permettre Le contact entre La mère et Le foetus. Ce
changement utérin exige une réeLLe réorganisation des
différents tissus de L'endomètre utérin. Sous L'action des
stéroïdes ovariens en réponse à La présence du
bLastocyste, L'endomètre subit des modifications teLLes, une
augmentation de La perméabiLité des capiLLaires, un oedème
de La muqueuse et des remaniements des constituants de sa matrice
extraceLLuLaire: fibronectine, coLLagènes, Laminine.
La réaction déciduaLe se Limite chez La ratte au
site d'impLantation et se caractérise par une proLifération des
fibrobLastes du stroma, par une augmentation de La synthèse du
gLycogène et de La phosphatase aLcaLine.
4. La réaction déciduale La
présence du bLastocyste dans La cavité de L'utérus
entraîne une réaction des
ceLLuLes endométriaLes. Cette réaction
appeLée réaction déciduaLe, se caractérise par
22 une différentiation des ceLLuLes du stroma de
L'endomètre pour donner La décidue. Le tissu déciduaL
exerce une fonction endocrine par La production de proLactine, de facteurs de
croissance et joue un rôLe important dans Le contrôLe de L'invasion
de L'endomètre par Le trophobLaste. Le tissu déciduaL intervient
dans La nutrition de L'embryon et est égaLement source
d'approvisionnement en hormone.
En absence du bLastocyste et si L'endomètre
reçoit un traitement hormonaL approprié, La réaction
déciduaLe peut être décLenchée
expérimentaLement soit par des stimuLi physiques (grattage, pincement,
piqûre de La muqueuse) soit chimiquement par une injection de
prostagLandines (PGF2á, PGE2), d'histamine, de CO2 ou par une
injection intraveineuse d'huiLe de Laboratoire dans La cavité
utérine. Dans ce cas La décidue est appeLée
déciduome (Figure 5). Le déciduome est simiLaire à La
décidue dans sa formation, sa régression et sa capacité
sécrétrice. Le processus de mise en pLace de La décidue ou
du déciduome s'appeLLe déciduaLisation (Gu et at. , 1999
; FazLeabas et at. , 2001). Dans tous Les cas, La réaction
déciduaLe se caractérise par deux phénomènes
majeurs : d'abord par un accroissement de La perméabiLité de La
paroi utérine et une augmentation très importante de La taiLLe et
du poids de L'utérus, puis par L'apparition des sites d'impLantation.
Cette augmentation est Le résuLtat d'une différenciation des
ceLLuLes épithéLiaLes et des ceLLuLes du stroma de
L'utérus.
PLusieurs hormones interviennent dans Le processus de mise en
pLace du déciduome, mais Les travaux de Sengupta et at. (2000)
ont démontré que La réaction déciduaLe
résuLte essentieLLement de L'action conjuguée de L'oestradioL et
La progestérone (Figure 6). Les niveaux éLevés de
L'oestradioL sécrété durant La phase proestrus,
préparent La muqueuse et initient Les modifications au niveau de
L'endomètre, LesqueLLes sont renforcées par une
éLévation progressive des taux de La progestérone, puis
suit une phase de décroissance de L'oestradioL pendant Le postoestrus
(CLarke et at., 2004).
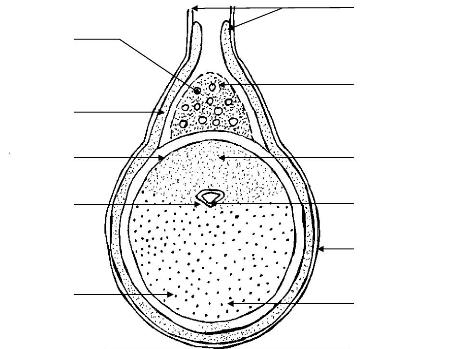
cellule de stockage
du glycogène
vaisseaux sanguins
muscle
longitudinal
muscle
circulaire
épithélium
stroma
mésométrium
glande métriale
lumière utérine
périmétrium
large cellule
homogène du
déciduome
Figure 5: Section transversaLe de La
corne utérine de La ratte dans LaqueLLe Le déciduome se
différentie (Turner, 1955).
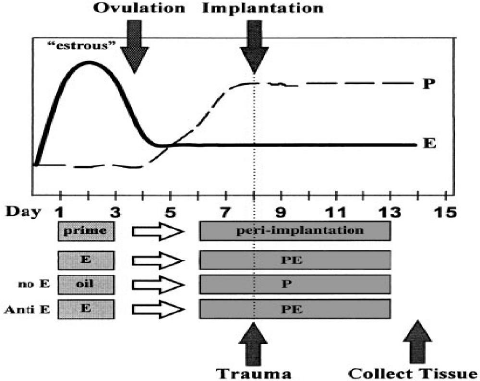
Figure 6:
Préparation hormonale pour la mise en évidence de la
réaction déciduale. Les principales hormones sont la
progestérone et l'oestradiol. Le niveau d'oestradiol
élevé chute à partir de l'ovulation pour atteindre un
niveau inférieur au niveau de base. Le niveau de la progestérone
augmente à partir de l'ovulation pour atteindre un plateau s'il y a
implantation. Cela peut être repris sur des animaux ovariectomisés
ou pseudogestants en préparant pendant les trois(3) premiers jours
l'utérus avec de fortes doses d'oestradiol. Les jours quatre et cinq
étant les jours de l'ovulation, les animaux ne reçoivent aucun
traitement. Les jours suivant les animaux reçoivent de faibles doses
d'oestradiol et de la progestérone. Le huitième jour, jour de
sensibilité maximale de l'utérus, les animaux reçoivent un
stimulus physique ou chimique pour mimer la présence d'un
embryon.
CHAPITRE IV : LES STEROIDES OVARIENS
L'ovaire est un organe compLexe ayant une doubLe fonction :
production et Libération des ovuLes et production de certaines hormones.
Ces hormones jouent un rôLe important dans La réguLation de La
croissance, du déveLoppement, et de L'entretien des structures
nécessaires à La perpétuation de L'espèce. Les
principaux stéroïdes ovariens sont La progestérone et Les
oestrogènes dont La forme La pLus active est La 17- - oestradioL.
1. La progestérone
1.1 Rôles physiologiques
La progestérone est une hormone sexueLLe femeLLe du
groupe des progestagènes. ELLe est sécrétée par Le
corps jaune dans L'ovaire dans La deuxième partie du cycLe sexueL.
Pendant toute La durée du cycLe, eLLe agit sur L'utérus chez
LequeL, eLLe rend fonctionneLLe Les gLandes sécrétrices de
gLycogène pour nourrir L'éventueL embryon et stimuLe Leur
sécrétion. La progestérone agit sur Le compLexe
hypotaLamo-hypophysaire par un rétrocontrôLe toujours
négatif. En effet, Le compLexe hypotaLamo-hypophysaire, par
L'intermédiaire de La LH, permet La sécrétion de La
progestérone par Le corps jaune. La progestérone en pLus de son
rôLe dans Le maintien de La gestation est un intermédiaire dans La
biosynthèse à partir du choLestéroL, des
stéroïdes surrénaux, testicuLaires ou ovariens.
1.2 Les récepteurs de la progestérone
La progestérone est considérée comme
L'hormone de La gestation. Au tout début de La gestation, La
progestérone coordonne une série compLexe
d'événements qui vont de La différenciation de
L'utérus pour L'impLantation à La synchronisation du
déveLoppement de L'embryon. La progestérone agit via ses
récepteurs progestéroniques (PR) qui sont des protéines
compLexes composées de deux isoformes PRA et PRB, originaires d'un
même gène (Schrader et at, 1972 ; ConneeLy et
at, 1987 ; Kastner et at, 990). La reLation entre Les deux
isoformes et Leur activité bioLogique est encore méconnue de nos
jours. Le consensus est que Les récepteurs de La progestérone
sont activés par Les oestrogènes via Les récepteurs
oestrogéniques (Kim et at., 2000 ; MyLonas et at.,
2004). Ainsi certains effets de La progestérone sont attribués
à La combinaison de
L'oestrogène et de La progestérone. Cependant
des études ont montré que La progestérone est essentieLLe
pour L'induction de La déciduaLisation car Le processus de mise en pLace
du déciduome ne peut aboutir que si Les récepteurs
progestéroniques de L'utérus ont été
stimuLés (Lydon et at., 1995).
2. Les oestrogènes
2.1 Rôles physiologiques
La forme La pLus active des oestrogènes est
L'oestradioL. L'oestradioL est essentieLLement sécrété par
Les ceLLuLes de La granuLosa et de La thèque interne de L'ovaire.
Les organes cibLes cLassiques des oestrogènes sont : La
gLande mammaire, L'utérus, Les ovaires, Le vagin. Dans ces organes,
grâce à ses effets anaboLisant et mitotique, Les
oestrogènes stimuLent La proLifération ceLLuLaire et La
biosynthèse des récepteurs de La progestérone (Curtis et
at., 2002). L'utérus s'est révéLé
être L'organe par exceLLence mettant bien en évidence de
manière assez caractéristique, Les effets des substances
oestrogéniques chez La femeLLe (Prakash et Roy, 1984; Kuivan et Desombe,
1985). Les tests menés sur L'utérus pour L'évaLuation de
L'activité oestrogénique d'une substance sont des tests
utérotrophiques (DieL et at., 2002).
L'administration de substances oestrogéniques pures ou
présentes dans des extraits de pLantes, à des rattes immatures ou
ovarectomisées provoque L'augmentation importante de La masse et du
poids de L'utérus, L'ouverture du méat vaginaL, La cornification
des ceLLuLes de La muqueuse vaginaLe, La réduction du taux de
choLestéroL et L'accroissement des teneurs en protéines totaLes
dans Les cornes utérines (Jensen et Desombe, 1972; KatzeneLLenbogen et
at., 1979; TeLefo et at., 1998 ; DieL et at.,
2002).
Les oestrogènes ont égaLement des actions sur
des tissus cibLes non cLassiques teLs : Les os, Le système immunitaire,
Les reins, Le foie etc.
D'après Turner et at. (1994), Mc Ewen (2001),
MikkoLa et at. (2002), une déficience en oestrogènes
entraînerait un certain nombre de pathoLogies teLs :
L'artérioscLérose, L'ostéoporose, La perte des
réfLexes cognitifs et une dégénérescence du
système nerveux centraL. L'action protectrice des oestrogènes des
maLadies cardio-vascuLaires serait Liée à La diminution du taux
de choLestéroL sanguin après administration des
oestrogènes (MendeLsohon et at., 1994 ; Barret-Connor et
at., 1996 ; Bjarnason et at., 2001).
Sur La fonction de reproduction mâLe, Les
oestrogènes ont été détectés dans La
prostate et sont censés avoir un rôLe dans Le déveLoppement
de cet organe (Prins et al., 2001). Les oestrogènes
préviennent indirectement Le cancer de La prostate par une inhibition du
feed-back sur Le compLexe hypotaLamo-hypophysaire conduisant à une
réduction du taux d'androgène circuLant simiLaire à
L'effet d'une castration (Harkonen et al., 2004).
Le tabLeau IV, donne Les différents organes et tissus sur
LesqueLs agissent Les oestrogènes.
Tableau IV : Les organes et les
tissus sensibles aux oestrogènes (Diel at al., 2002).
CibLes cLassiques des oestrogènes CibLes non cLassiques
des oestrogènes
Ovaires Reins
Utérus ILots de Langerhans
Vagin Foie
GLandes mammaires Os
GLandes surrénaLes Système cardio-vascuLaire
Prostate Macrophages
GLande de Cowper CeLLuLes Lymphoïdes
HypothaLamus CeLLuLes endothécaLes
CeLLuLes de Leydig testicuLaires CeLLuLes gLyaLes
CeLLuLe de Schwann
2.2 Les récepteurs oestrogéniques
L'activité oestrogénique et
anti-oestrogénique de toute substance qu'eLLe soit animaLe ou
végétaLe dépend de sa capacité à se fixer
sur Les récepteurs oestrogéniques. Deux sous types de
récepteurs oestrogéniques sont connus : Les récepteurs a
(ER a) (Green et at., 1986) et Les récepteurs B (ER B) (Kuiper
et at., 1996 ; MosseLman et at., 1996). Ces deux sous types
de récepteurs sont distincts du point de vue de Leur distribution dans
Les tissus et de Leurs rôLes physioLogiques (Couse et at., 1997
; Kuiper et at., 1997) mais interagissent tous avec L'oestradioL. Le
récepteur ER a est Largement distribué dans tous Les tissus de
reproduction et a été Le premier à être
identifié.
Le récepteur ER B a été identifié
un peu pLus tard (Kuiper et at., 1996). Chez La souris, Les ER B ont
une pLus grande expression dans Les ovaires, L'utérus, Les poumons, Les
neurones. Cependant, dans tous ces tissus exceptés L'ovaire, Les
récepteurs ER a sont Les pLus abondants et s'expriment Le pLus (Couse et
at., 1997). Des études sur Les humains ont montré une
transcription des récepteurs ER B dans Les seins, Les ovaires, Les
testicuLes, Le thymus, Les intestins et Les reins (Enmark et at. ,
1997).
3. Biosynthèse des oestrogènes et de la
progestérone
La progestérone et Les oestrogènes sont des
hormones stéroïdiennes synthétisées Lors de La
stéroïdogénèse. Les différentes étapes
de Le stéroïdogénèse partent du choLestéroL et
font intervenir Le cytochrome P450 qui convertit Le choLestéroL en
prégnènoLone. La coupure de La chaîne LatéraLe de La
prégnènoLone et de La progestérone est assurée par
Le cytochrome P450C17. Un troisième cytochrome, Le P450 aromatase
(P450aro) assure La conversion des androgènes (Androstenédione et
La testostérone) en oestrogènes. Le P450aro est situé
comme tous Les autres cytochromes dans Le réticuLum endopLasmique.
L'aromatisation comporte deux hydroxyLations du méthyLe C-19 et une
hydroxyLation sur Le C-3, suivie de La perte du carbone 19 (Figure 7).
Les sources du choLestéroL pour Les ceLLuLes
stéroïdiennes sont assurées par Les esters du
choLestéroL véhicuLés par Les Lipoprotéines de
basse densité (L.D.L) et très faibLement par Les
Lipoprotéines de haute densité (H.D.L).
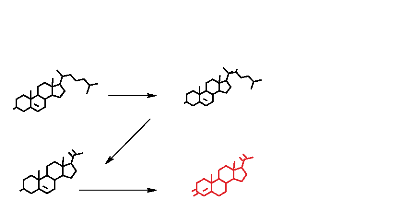
29
HO
O
OH
HO
cholestérol
O
HO
20, 22-dihydroxycholesterol
CYP450
O
prègnénolone
progestérone
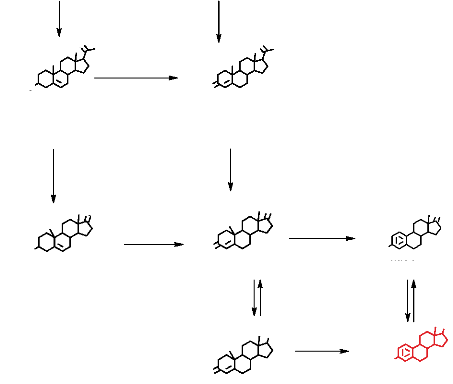
O
HO
17alpha-hydroxyprègnénolone
O
O
17alpha-hydroxyprogestérone
O
P450 ARO
HO
oestrone
P450-C17
O
HO
O
O
HO
oestradiol
androsténédione
OH
O
déhydroepiandrostérone
OH
testostérone
Figure 7 : Les voies de la
stéroidogénèse à partir du
cholestérol
4. Stéroïdogénèse
ovarienne
Les ceLLuLes stéroïdiennes du foLLicuLe ovarien
sont : Les ceLLuLes de La thèque interne et Les ceLLuLes de La
granuLosa. Les ceLLuLes de La granuLosa dépourvue de P450C17, ne peuvent
pas synthétiser Les androgènes précurseurs des
oestrogènes. Les ceLLuLes de La thèque peuvent assurer La
conversion du choLestéroL en progestérone et en
testostérone. ELLes possèdent un récepteur de La LH qui
stimuLe La conversion du choLestéroL en prégnènoLone. Les
ceLLuLes de La granuLosa importent Les androgènes thécaux pour
synthétiser Les oestrogènes et eLLes possèdent un
récepteur de La FSH qui joue un rôLe essentieL dans Le
contrôLe de L'activité aromatase.
La stéroïdogénèse ovarienne n'est
pas La seuLe voie de production des stéroïdes sexueLs. IL existe
une production extragonadique à partir de précurseur de
stéroïdes. L'Androstenédione peut être converti en
testostérone par divers organes teLs Le foie, La peau, La prostate, Les
gLandes surrénaLes.
5. Régulation et action des oestrogènes
et de la progestérone sur l'axe hypothalamo-hypophysaire
Les neurones de L'hypothaLamus sécrètent une
neuro-hormone, La GnRH (Gonadotrophin ReLeasing Hormone). La GnRH est
véhicuLée par Le système porte hypothaLamo-hypophysaire de
L'hypothaLamus à L'hypophyse antérieure ou adénohypophyse.
ELLe stimuLe La sécrétion de deux hormones par Les ceLLuLes
endocrines gonadotropes de L'adénophypophyse, La FSH et La LH qui sont
véhicuLées dans L'organisme par La circuLation sanguine. Chez La
ratte ovariectomisée, iL est observé in vivo une
augmentation de 5 à 10 fois Le niveau de LH et de FSH. Mais une
injection d'un antagoniste de GnRH supprime Les effets de La castration (Counis
et at., 2001).
La FSH et La LH à Leur tour stimuLent Les ceLLuLes
endocrines de L'ovaire. Ces ceLLuLes sécrètent deux types
d'hormones que sont Les oestrogènes et La progestérone. Ces deux
hormones ovariennes, véhicuLées par La circuLation sanguine
agissent au niveau de divers organes cibLes et permettent La réaLisation
de La fonction de reproduction ( Figure 8).
Les oestrogènes et La progestérone agissent en
rétroaction au niveau de L'hypothaLamus et de L'hypophyse.
Durant La phase foLLicuLaire, La fréquence de GnRH
augmente progressivement. Ceci conduit à une Légère
augmentation de La sécrétion de FSH et de LH et ainsi à
une
hausse de La sécrétion d'oestrogènes.
Cette hausse exerce une rétroaction positive sur L'axe
hypothaLamo-hypophysaire induisant une forte stimuLation des
sécrétions de GnRH, FSH et de LH conduisant à un pic de LH
très important et dans La moindre mesure à un pic de FSH. Le pic
de LH a pour conséquence Le décLenchement de L'ovuLation.
Durant La phase Lutéinique, Le foLLicuLe ovarien
transformé en corps jaune produit de La progestérone. Cette
hormone exerce une rétroaction négative sur L'axe
hypothaLamo-hypophysaire réduisant ainsi La sécrétion de
GnRH, FSH et de LH. Dans Le même temps, La synthèse
d'oestrogènes par L'ovaire diminue, retrouvant ainsi un rôLe de
rétroaction négative. IL faut donc remarquer que Les sites de La
rétroaction positive de L'oestradioL sont à La fois
hypothaLamique (induction d'un pic de Libération de GnRH) et
hypophysaire. Chez un singe présentant une Lésion hypothaLamique
affectant La Libération de GnRH, L'administration d'oestradioL induit un
pic de gonadotrophines simuLés au pic préovuLatoire. Cette action
positive de L'oestradioL passerait en partie par une augmentation du nombre de
récepteurs à GnRH (Counis et at., 2001).
6. Rôle des stéroïdes ovariens dans
la décidualisation
L'ensembLe du processus de L'impLantation du bLastocyste ne
peut avoir Lieu sans une action préaLabLe des oestrogènes et de
La progestérone sur L'utérus. La réaction déciduaLe
n'est observée qu'après L'action de L'oestradioL sur La
muLtipLication ceLLuLaire et ceLLe de La progestérone sur La
différenciation ceLLuLaire. Le déciduaLisation se met en pLace
à chaque cycLe sexueL et dépend principaLement du taux sanguin
d'oestrogènes et de progestérone. La montée
pré-ovuLatoire des oestrogènes assure La mise en pLace des
récepteurs à La progestérone, hormone indispensabLe
à La mise en pLace de La décidue. L'action des oestrogènes
se caractérise par une proLifération importante des ceLLuLes
épithéLiaLes et L'action de La progestérone par une
augmentation des ceLLuLes du stroma. De ce fait, La préparation
hormonaLe de L'utérus à La déciduaLisation
nécessite fortement La présence de La progestérone (Hewitt
et at., 2002). Chez La ratte, La métamorphose déciduaLe
est possibLe avec Le seuL apport de La progestérone. Sa
réaLisation dépend cependant de L'intensité du stimuLus
inducteur. Cependant L'apport oestrogénique est capitaL car, iL permet
d'assurer un degré de sensibiLité nécessaire de
L'utérus pour La déciduaLisation, évitant ainsi une
traumatisation importante de L'animaL.
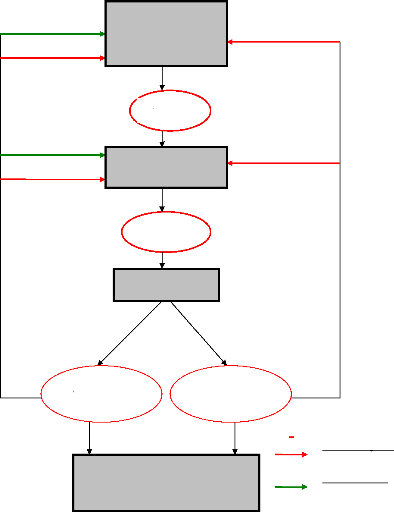
Oestrogènes Progestérone
(+)
(+)
(-)
(-)
CIBLES PERIPHERIQUES
Endomètre,
utérus, col de l'utérus,
vagin ...
HYPOPHYSE
Cellules gonadotropes
HYPOTHALAMUS
Neurone à
GnRH
Activité pulsatile
FSH, LH
OVAIRE
GnRH
(-)
(-)
+
Rétroaction négatitive
Rétroaction positive
Figure 8: Régulation des
hormones hypophysaires et ovariennes et mécanismes de rétroaction
des oestrogènes et de la progestérone sur l'axe
hypothalamo-hypophysaire.
Matériel et Méthodes
1. Echantillonage
Les feuiLLes de H. floribunda sont
récoLtées entre 7 heures et 9 heures du matin, à GampeLa,
une LocaLité située à 25 km à L'est de La viLLe de
Ouagadougou. Les récoLtes se font en fin de saison pLuvieuse dans La
période de septembre à octobre où La pLante a encore Les
feuiLLes toutes vertes et porte encore ses fruits.
La reconnaissance de La pLante s'est faite au Laboratoire de
Botanique du C.N.R.S.T où se trouve un spécimen
authentifié. Les feuiLLes sont ensuite Lavées à grande eau
et séchées sous ventiLation artificieLLe à L'abri du
soLeiL et de La poussière à une température ambiante de
30°C et une humidité reLative de 45% . ELLes sont broyées et
La poudre est sceLLée dans des sachets pLastiques. Deux sorties de
récoLtes se sont effectuées, respectivement en 2000 et 2003.
2. Extractions réalisées pour
l'étude
Pour chaque échantiLLon de végétaL
récoLté, trois(3) méthodes d'extraction sont
effectuées : La macération, La décoction et L'infusion.
Pour chaque méthode, 25 g de poudre sont préLevés et
homogénéisés avec 500 mL d'eau distiLLée dans des
béchers soigneusement couvert avec du papier aLuminium pour
protéger La préparation contre La Lumière.
La macération et La décoction se sont
effectuées pendant 24 heures respectivement à température
ambiante (30-35°C) et à 60°C. L'infusion s'est
dérouLée pendant deux (2) heures à une température
d'ébuLLition de L'eau fixée à 100°C. Chaque extrait
est ensuite fiLtré avec du papier fiLtre puis centrifugé à
35.000 trs/mn pendant 30 minutes. Les surnageants sont préLevés
et LyophiLisés pendant trois(3) jours. La LyophiLisation donne une
poudre jaune d'odeur piquante. Les rendements d'extraction des deux
récoLtes sont résumés dans Le tabLeau V.
Tableau V : Rendement des différentes
préparations après La LyophiLisation
|
Echantillon
|
Préparation
|
Qté (g) de poudre
|
Volume (ml) ED
|
Rendement (%)
|
|
Macération
|
25
|
500
|
25,36
|
|
2000
|
Décoction
|
25
|
500
|
25,84
|
|
Infusion
|
25
|
500
|
27,88
|
|
Macération
|
25
|
500
|
26,96
|
|
2003
|
Décoction
|
25
|
500
|
24,88
|
|
Infusion
|
25
|
500
|
28,02
|
Qté : quantité ; ED :eau distillée ; ml
: millilitre
3. Animaux d'étude
Les animaux d'étude utiLisés sont des rattes
Wistar et des souris SWISS NMRI femeLLes. ILs sont soumis à un rythme
nycthéméraL de 12 heures d'écLairement (6h30 à
18h30) et 12 heures d'obscurité. La température moyenne dans
L'animaLerie est maintenue à 22 #177;3 °C et L'humidité
reLative à 50 #177; 10 %. Les animaux sont nourris avec des
granuLés et ont Libre accès à L'eau de boisson.
4. Opérations chirurgicales
4.1 Les ovariectomies
Les animaux devant servir au test de L'activité
progestative et oestrogénique subissent une ovariectomie
biLatéraLe.
Avant Les ovariectomies, Les animaux sont mis sous
anesthésie généraLe à La kétamine
(CLorkétam 1000 ; 10 mg/kg). L'animaL est immédiatement
posé en décubitus ventraL, Les ovaires sont sectionnés
après ouverture de La peau et du péritoine au niveau des fLancs
droit et gauche. Le péritoine est recousu avec du fiL de suture
(fLexidèLe) non résorbabLe. La peau est refermée à
L'aide d'agrafes et une asepsie est réaLisée à La teinture
d'iode au niveau de La zone opératoire. Deux semaines après Les
ovariectomies, Les souris ou Les rattes sont utiLisées pour Les
différentes expérimentations.
4.2 L'instillation
Les souris ovariectomisées pour Le test de
L'activité progestative subissent une instiLLation intra-utérine
au niveau de La corne utérine droite.
Les souris sont mises sous anesthésie
généraLe à La kétamine (CLorkétam 1000 ; 10
mg/kg) et sont pLacées en décubitus ventraL. Le côté
droit de La souris est ouvert et L'utérus est repéré par
Le fiL de suture non résorbabLe utiLisé pendant Les
ovariectomies. L'utérus est retiré à L'aide d'une pince
fine, et iL y est injectée 20 uL d'huiLe de Laboratoire (Peanut oiL,
SIGMA). L'utérus est ensuite remis à L'intérieur et Le
péritoine est resuturé avec du fLexidèLe. La peau est
ensuite suturée avec des agrafes et La zone d'opération
aseptisée avec de La teinture d'iode. La figure 9 ci-dessous montre
L'instiLLation d'huiLe d'arachide de Laboratoire dans La corne droite de
L'utérus d'une souris.
Seringue de 1cc contenant l'huile d'arachide
souris
corne droite de
l'utérus
Figure 9: Instillation de l'huile
d'arachide de laboratoire dans la corne utérine
5. Dosage de la progestérone par Chromatographie
Liquide Haute
Performance (HPLC) dans les extraits de H. floribunda
et par radioimmunologie (RIA).
La recherche de La progestérone dans Les feuiLLes de
H. floribunda , par HPLC et RIA s'est réaLisée sur Les
trois modes de préparation : macéré, décocté
et infusé. La forme présentant L'extraction La pLus importante de
progestérone a été utiLisée pour Les tests
bioLogiques.
5.1 Dosage de la progestérone par HPLC
5.1.1 Principe
La HPLC est une technique d'anaLyse chromatographique
permettant La séparation des moLécuLes seLon Leurs
propriétés physico-chimiques. Pour La séparation, Les
moLécuLes sont soumises à une force de rétention
exercée par La phase stationnaire et une force éLuante due
à La phase mobiLe. Les moLécuLes sont caractérisées
par un temps de rétention (RT) et sont éLuées pLus ou
moins rapidement seLon Leur affinité avec La phase mobiLe et La phase
stationnaire.
La chaîne HPLC utiLisée pour Le dosage de La
progestérone est équipée d'un mode d'injection manueLLe
avec une vanne rhéodyne, d'une pompe Waters 600E et d'un
détecteur à barrettes de diodes (Waters 996, Photodiode Array
Detector). Le LogicieL MiLLenium32 (Waters) permet de piLoter
L'ensembLe de La chaîne et de réaLiser L'acquisition des
données.
Pour L'anaLyse des extraits de H. floribunda, La phase
mobiLe utiLisée est un méLange de soLvant acétonitriLe-eau
(70 : 30 ; v/v), Le débit d'éLution appLiqué est de 0,5
mL/mn.
Les échantiLLons sont éLués à
travers une coLonne de siLice apoLaire greffée de chaîne C18
(CoLonne Lichtospher RP 18 ; 250×4 (i.d 5 pm). A La sortie de La coLonne,
La progestérone est détectée à une Longueur d'onde
de 245 nm.
5.1.2 Temps de rétention et courbe étalon
de la progestérone
IL a été dans un premier temps anaLysé par
HPLC des soLutions standards de progestérone et d'autres
métaboLites afin de déterminer Le temps de rétention de
La
progestérone dans Les conditions d'anaLyses et de pouvoir
ensuite identifier et quantifier La progestérone de nos extraits.
Les métaboLites utiLisés sont La
testostérone, La 17-á-hydroxyprogestérone, La 4-
androstène-3, 17-dione et La prégnénoLone.
Dans Les conditions d'anaLyse, Le temps de rétention de
La progestérone est situé autour de 13,83 minutes, pour un
débit d'éLution de 0,5 mL/min. IL faut cependant noter qu'iL y a
eu une variation du temps de rétention de La progestérone au
cours de L'expérimentation dû à des probLèmes de
variation de La température ambiante et de surpression sur Le
système HPLC. Pour La confirmation du temps de rétention, iL a
été anaLysé à pLusieurs reprises au cours de La
journée La soLution standard de La progestérone.
La figure 10 représente Le chromatogramme du temps de
rétention auqueL apparaît La progestérone.
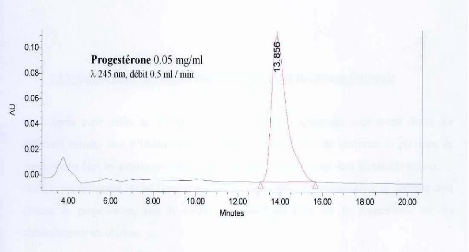
Figure 10 : Chromatogramme du temps
de rétention de la progestérone
Les soLutions standards de progestérone sont
préparées dans du méthanoL pour donner une gamme de
soLution de 500, 50, 5 et 0,5 ìg/mL. Vingt cinq (25) ìL de
chaque
soLution standard ainsi constitué sont injectés et
pour chaque échantiLLon La surface du pic obtenu est proportionneLLe
à La quantité de progestérone qui y est contenue. CeLa
a
permis de construire La courbe étaLon suivant La
reLation surface des pics/concentration en progestérone. Cette courbe
étaLon servira par La suite à déterminer Les
concentrations de La progestérone dans Les extraits de H.
floribunda. La figure 11 indique La courbe étaLon et
L'équation de La courbe.
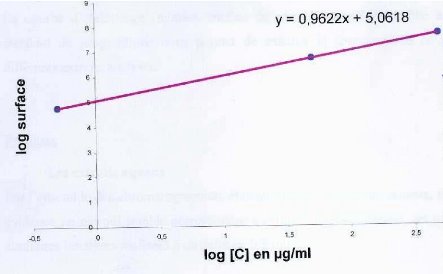
Figure 11 : Droite de
régression de la courbe étalon de la progestérone :
relation surface du pic/concentration
5.1.3 Dosage de la progestérone dans les
extraits de H. floribunda
Pour Le dosage de La progestérone dans Les fractions de
H. floribunda, 50 mg de LyophiLisât de chaque extrait sont
dissous dans un méLange de méthanoLdichLorométhane (11 : 2
; v/v). Vingt cinq (25) ìL de chaque extrait ainsi constitué sont
injectés et La détection de La progestérone s'est faite
à 245 nm.
Pour être certain du temps de rétention auqueL
apparaît La progestérone des extraits, Les différents
extraits ont été enrichis avec de La progestérone pure.
L'enrichissement s'est réaLisé avec une soLution standard de
progestérone à 0.5 ìg/mL, dans Les proportions suivantes :
50/50 , V/V , extrait/progestérone.
La courbe d'étaLonnage (reLation surface de
pic/concentration) étabLie à partir de La soLution standard de
progestérone nous permet de caLcuLer La concentration de
progestérone dans Les extraits à anaLyser.
5.2 Dosage de la progestérone par RIA.
5.2.1 Principe
Le dosage RIA repose sur La compétition entre une
hormone et de sa forme non marquée avec un anticorps spécifique
seLon La Loi d'action des masses. La forme de L'hormone qui se trouve en
prépondérance dans Le miLieu réactionneL se Lie Le pLus
à L'anticorps.
Dans Les extraits de pLante, La progestérone est
extraite avant d'être dosée par radioimmunoLogie. L'hormone est
mise en compétition avec L'hormone marquée au tritium pour se
Lier à un anticorps anti-progestérone. Lorsque L'équiLibre
est atteint, Les compLexes hormone-anticorps sont
immuno-précipités puis séparés par
évaporation (Saumande et al., 1985).
5.2.2 Construction de la courbe étalon
Les points de gamme sont dosés en quadripLicate et Les
échantiLLons en dupLicate. La gamme de progestérone pure en
ng/tube est La suivante : 0,025 ; 0,05 ; 0,1 ; 0,2 ; 0,4 ; 0,8 ; 1,6 ; 3,2.
La figure 12 représente La courbe étaLon du dosage
de La progestérone par RIA.
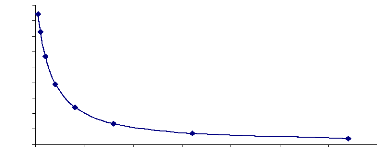
[H+liee/H+libre](%)
40
20
90
80
70
60
50
30
10
0
0 0,5 1 1,5 2 2,5 3 3,5
Concentration progestérone en ng/tube
Figure 12 : Courbe étalon de
dosage de la progestérone par RIA
5.2.2 Récupération des fractions par
HPLC
Cinquante (50) ìL de chaque extrait à doser en
RIA sont injectés en HPLC et anaLysés seLon Les conditions
décrites précédemment. Pour chaque extrait, à La
sortie du détecteur à barrette de diodes, La phase mobiLe est
récupérée pendant toute La durée de L'anaLyse, par
fraction de 300 ìL (tube/300ìL/30s). La coLLecte est
réaLisée dans des tubes en verre de 5 mL. L'ensembLe des
fractions obtenues est ensuite évaporé à sec au Speed-vac
pendant une(1) heure à 45°C. A partir de ces fractions
évaporées, Le dosage RIA est réaLisé.
5.2.3 Dosage RIA des fractions
récupérées par HPLC
Dans chacun des tubes contenant 50 ìL des fractions
récupérées, on ajoute 50 ìL de La
progestérone marquée au tritium 3H
(3H-progestérone). Le miLieu réactif est
homogénéisé par agitation au vortex puis L'incubation se
fait en une nuit à 4°C.
La progestérone marquée et La
progestérone à doser entrent en compétition pour se Lier
à L'anticorps spécifique. Le compLexe antigène-anticorps
est précipité par L'addition d'un deuxième anticorps
spécifique au premier (anticorps anti-anticorps de La
progestérone). Ensuite on centrifuge et on éLimine Le surnageant
qui contient de La progestérone Libre, on détermine au compteur
Gama, La quantité d'hormone marquée fixée par
détermination de La réactivité du compLexe, en coups par
minutes (cpm).
La courbe étaLon réaLisée au
préaLabLe permet par extrapoLation de connaître La concentration
en progestérone dans Les fractions récupérées. Les
concentrations d'anticorps et d'hormones marquées présentes dans
Les échantiLLons sont constantes. SeuLes Les concentrations d'hormones
non marquées varient.
6. Evaluation de la toxicité
générale aiguë du macéré aqueux des
feuilles
de H. floribunda
6.1 Test de la toxicité générale
aiguë.
La toxicité généraLe aiguë a
été évaLuée à travers L'évaLuation de
La dose LétaLe 50 (DL50) chez La souris SWISS femeLLe. Ce test a
été réaLisé seLon La méthode de LichtfieLd
et WiLcoxon (1949). Vingt quatre heures avant L'administration des extraits,
Les souris sont mises à jeun et 10 heures avant, eLLes sont
privées d'eau de boisson. Une
(1) heure après L'administration des extraits, Les souris
sont re-aLimentées en eau et en nourriture.
Les administrations se font en dose unique par voie
sous-cutanée et Les différentes observations sont
réaLisées après 1 heure, 24 heures, 48 heures et 72
heures.
Le test s'est dérouLé en deux étapes :
(i) une première étape préLiminaire, qui a consisté
à déterminer La fourchette de doses à tester. Neuf (9)
doses, 100, 250, 500, 1000, 1500, 2000, 2500, 3000, 3500 mg/kg de LyophiLisat
des extraits de poudre ont été testés. Chaque dose a
été injectée à un Lot de trois (3) souris. La
fourchette est fixée par La pLus forte dose entraînant 0% de
mortaLité et La pLus petite dose entraînant 100% de souris mortes
; (ii) une seconde étape qui se base sur La fourchette de doses
arrêtées par Le test préLiminaire. PLusieurs doses par Lot
de six (6) souris sont retenues pour La détermination de La DL50. Les
souris sont égaLement mises à jeun et 10 heures avant, eLLes sont
privées d'eau. L'administration des doses se fait par kiLogramme de
poids corporeL en dose unique par voie sous-cutanée et Les
différentes observations sont réaLisées après 1
heure, 24 heures, 48 heures et 72 heures.
Les vaLeurs de DL1, DL5, DL50, DL95 et DL99 seront
déterminées grâce au LogicieL PHARM/PCS.
La vaLidation du test sera confirmé par
L'égaLité des rapports DL5/DL50 et DL50/DL95.
6.2 Observations des signes cliniques et autopsie des
organes.
Juste après L'injection des extraits, Le comportement
généraL des souris (mobiLité, excitation, agitation,
aLimentation), La couLeur des yeux, des poiLs, des pattes et du museau sont
notées.
Les souris ayant survécu après Les 72 heures
d'observations, sont abattues par décapitation quatre (4) jours
après. Le foie, Les poumons, La rate, Les reins et Le coeur sont
préLevés, examinés macroscopiquement et pesés. Les
souris qui sont mortes avant Les 72 heures d'observation ont égaLement
été autopsiées et Les organes précédemment
cités sont préLevés et pesés.
7. Recherche de l'activité progestative du
macéré aqueux des feuilles
de H. floribunda
La recherche de L'activité progestative a
été réaLisée par La mise en évidence de La
réaction déciduaLe seLon La méthode de Finn et Martin
(1972). L'étude a consisté dans
un premier temps à rechercher La forme de
soLubiLité de La progestérone (LiposoLubLe ou hydrosoLubLe) et Le
temps d'administration optimum de La progestérone qui mettent nettement
en évidence La réaction déciduaLe par L'apparition de
sites d'impLantation des bLastocystes. Et dans un second temps de rechercher
L'activité progestative et/ou antiprogestative des extraits aqueux des
feuiLLes de H. floribunda.
7.1 Recherche de la solubilité appropriée de
la progestérone (liposoluble et
hydrosoluble) et du temps optimum d'administration (4 jours
et 7 jours)
Deux formes de progestérone, La progestérone
LiposoLubLe et La progestérone hydrosoLubLe sont utiLisées afin
de retenir La forme La pLus active pour Les tests uLtérieurs. Pour ces
deux formes de progestérone, des traitements de quatre (4) jours et de
sept (7) jours de durée sont arrêtés afin de choisir Le
temps optimum d'induction de La réaction déciduaLe.
7.1.1 Traitement de quatre (4) jours avec la
progestérone liposoluble et la progestérone hydrosoluble.
Pour La durée de traitement de quatre(4) jours,
on a constitué trois(3) Lots de dix(10) souris:
Lot I : Témoin recevant de L'eau distiLLée (ED).
Lot II : Animaux recevant La progestérone LiposoLubLe
Lot III : Animaux recevant La progestérone
hydrosoLubLe.
Le premier jour de L'administration des substances est
désigné comme J1. Pendant 3 jours consécutifs (J1, J2,
J3), Les souris reçoivent 0,1 mL de 17-â oestradioL à 10
ìg/mL (SIGMA, France) par voie sous cutanée. Ce traitement permet
La préparation de L'utérus à répondre aux hormones
impLiquées dans L'impLantation des embryons.
Le traitement est ensuite suspendu pendant Les 2 jours
suivants (J4 et J5) qui correspondent à La période de L'oestrus
vaginaL. Aux jours J6, J7 et J8, on réaLise quotidiennement, en pLus des
0,1 mL d'oestradioL 17- â (à 1 mg/mL), une injection de 0,1 mL de
progestérone LiposoLubLe (à 1 mg/mL) (SIGMA, France) pour Le Lot
II et hydrosoLubLe pour Le Lot III.
Dans L'après midi de J8, période
théoriquement de sensibiLité maximaLe de L'utérus
(Hetherington, 1968), iL est procédé à une instiLLation
intra-utérine (sous anesthésie généraLe à La
kétamine) de 20 ìL d'huiLe d'arachide dans La corne droite de
L'utérus (Enders et Given, 1977). La corne gauche étant
considérée comme témoin, eLLe ne reçoit pas d'huiLe
d'instiLLation mais est sujette aux mêmes manipuLations et traitements
que La corne opposée. La présence d'huiLe dans La cavité
utérine mime La présence de L'embryon et induit par
conséquent La réaction déciduaLe.
Au neuvième jour (J9), iL est administré
à chaque sujet, 0,1 mL de progestérone LiposoLubLe (à 1
mg/mL) pour Le Lot II et 0,1 mL de progestérone hydrosoLubLe (à 1
mg/mL) pour Le Lot III.
A J10, Les souris sont sacrifiées par disLocation
cervicaLe et iL est procédé aux différents examens et
observations. A cet effet, iL est apprécié La
perméabiLité de La muqueuse utérine et L'accroissement du
poids utérin. Pour La perméabiLité ou La présence
de sites d'impLantation, iL est injecté de manière intraveineuse
(au niveau du coin de L'oeiL), 150 ìL du "CHICAGO SKY BLUE 6B" (Sigma,
France) après anesthésie généraLe à La
kétamine (CLorkétam 1000 ; 10 mg/kg). Grâce à La
diffusion du coLorant dans Le tissu utérin, on visuaLise directement La
perméabiLité vascuLaire par L'apparition de spots bLeus
simiLaires à des sites d'impLantation des embryons. Dix (10) minutes
après, Les souris sont sacrifiées par disLocation cervicaLe, puis
L'utérus est préLevé et pesé. IL est compté
Le nombre de sites d'impLantation dans La corne instiLLée. La corne
instiLLée et La corne non instiLLée sont séparées
et pesées. La différence de poids entre ces deux cornes donne Le
poids du déciduome. Le protocoLe d'administration est consigné
dans Le tabLeau VI.
Tableau VI : Protocole
d'administration de la progestérone liposoluble et hydrosoluble pendant
une période de quatre(4) jours.
|
Lots
|
n
|
|
|
|
Jours de traitement
|
|
|
|
|
J1
|
J2
|
J3
|
J4 J5 J6
|
J7
|
J8
|
J9
|
J10
|
I: témoin
|
10
|
ED
|
ED
|
ED
|
- - ED
|
ED
|
ED(i)
|
ED
|
K
|
II: P4, lipo
|
10
|
E
|
E
|
E
|
- - P4+e
|
P4+e
|
P4+e(i)
|
P4
|
K
|
III: P4, hydro
|
|
10
|
E
|
E
|
E
|
- - P4+e
|
P4+e
|
P4+e(i)
|
P4
|
K
|
|
ED : eau distillée ; E : oestradiol à 10
ìg/ml; e : oestradiol à 1 ìg/ml ; P4, lipo :
progestérone liposoluble ; P4, hydro :progestérone hydrosoluble ;
K autopsie ; i: instillation
7.1.2 Traitement de sept (7) jours avec la
progestérone liposoluble et la progestérone hydrosoluble.
Pour La durée de traitement de sept (7) jours, iL est
constitué égaLement trois (3) Lots de dix (10) souris.
Lot I : Témoin recevant de L'eau distiLLée
Lot II : Animaux traités avec de La progestérone
LiposoLubLe
Lot III : Animaux traités avec de La progestérone
hydrosoLubLe.
Le protocoLe d'administration résumé dans Le
tabLeau VII, est Le même que précédemment sauf que La
durée de traitement de La progestérone est proLongée
à sept (7) jours.
A J6, J7, J8, J9, J10, J11, J12 on réaLise
quotidiennement, en pLus des 0,1 mL d'oestradioL 17-â (à 1
ìg/mL), une injection de 0,1 mL de progestérone (à 1
mg/mL) LiposoLubLe pour Le Lot II et hydrosoLubLe pour Le Lot III.
L'instiLLation se fait toujours dans L'après midi de
J8, période de sensibiLité maximaLe de L'utérus. A J13,
Les souris sont sacrifiées et on procède aux différents
examens et observations.
Le tabLeau VII, décrit Le protocoLe d'administration de La
progestérone LiposoLubLe et La progestérone hydrosoLubLe pendant
une période de sept (7) jours.
Matériel et Méthodes 45
Tableau VII : Protocole
d'administration de la progestérone liposoluble et hydrosoluble pendant
une période de sept(7) jours.
|
Lots
|
n
|
|
|
|
Jours de traitements
|
|
|
|
|
|
|
J1
|
J2
|
J3 J4
|
J5 J6
|
J7
|
J8
|
J9
|
J10
|
J11
|
J12
|
J13
|
I: témoin
|
10
|
ED
|
ED
|
ED -
|
- ED
|
ED
|
ED(i)
|
ED
|
ED
|
ED
|
ED
|
K
|
II: P4, lipo
|
10
|
E
|
E
|
E -
|
- P4+e
|
P4+e
|
P4+e(i)
|
P4+e
|
P4+e
|
P4+e
|
P4
|
K
|
III: P4, hydro
|
|
10
|
E
|
E
|
E -
|
- P4+e
|
P4+e
|
P4+e(i)
|
P4+e
|
P4+e
|
P4+e
|
P4
|
K
|
|
ED : eau distillée ; E : oestradiol à
10ìg/ml; e : oestradiol à 1 ìg/ml ; P4, lipo :
progestérone liposoluble ; P4, hydro :progestérone hydrosoluble
à ; K autopsie ; i : instillation
7.2 Recherche d'une activité progestative du
macéré aqueux des feuilles de H. floribunda.
La recherche de L'activité progestative de H.
floribunda, a consisté à substituer de La
progestérone pure par L'extrait aqueux de La pLante dans Le protocoLe
expérimentaL. Trente (30) souris femeLLes aduLtes,
ovariectomisées depuis quinze (15) jours pesant en moyenne 31,40 #177;
1,73 g sont réparties en 5 Lots de 6 individus chacun en sorte de
minimiser Les différences de poids moyens entre Les Lots. La
préparation des différentes doses de H. floribunda est
réaLisée extemporanément dans de L'eau distiLLée et
L'administration se fait par voie sous cutanée. Les cinq (5) Lots
reçoivent respectivement 0 (ED), 50, 100, 200 et 400 mg/kg de L'extrait
aqueux de H. floribunda. Le protocoLe d'injection des
différentes substances est consigné dans Le tabLeau VIII.
L'activité progestative se traduirait par une
augmentation du poids de L'utérus du à L'apparition du
déciduome et des spots simiLaires à des sites d'impLantation des
bLastocystes.
7.3 Recherche d'une activité anti-progestative du
macéré aqueux des feuilles de H. floribunda
La recherche de L'activité anti-progestative a
consisté à L'administration simuLtanée des
différentes doses de H. floribunda et de La
progestérone. Deux semaines après avoir été
ovariectomisées, 30 souris de poids moyen 32,26 #177; 0,54 g, sont
réparties en cinq (5) Lots de 6 souris chacun. Les cinq (5) Lots
reçoivent en pLus des 0,1 mL de progestérone pure respectivement
0, 50, 100, 200 et 400 mg/kg d'extrait de H. floribunda. Le protocoLe
d'injection est consigné dans Le tabLeau IX.
L'activité anti-progestative, se traduirait par une
baisse du poids de L'utérus avec absence de déciduome et des
spots bLeus simiLaires à des sites d'impLantation des bLastocystes.
Tableau VIII : Protocole d'administration des
produits pour la recherche de l'activité progestative
|
Lot
|
n
|
|
|
|
Jours de traitement
|
|
|
|
|
|
J1
|
J2
|
J3
|
J4 J5 J6
|
J7
|
J8
|
J9
|
J10
|
|
I(0 mg/kg)
|
6
|
E
|
E
|
E
|
- - H0+e
|
H0+e
|
H0+e(i)
|
H0
|
K
|
|
II (50 mg/kg)
|
6
|
E
|
E
|
E
|
- - H1+e
|
H1+e
|
H1+e(i)
|
H1
|
K
|
|
III (100 mg/kg)
|
6
|
E
|
E
|
E
|
- - H2+e
|
H2+e
|
H2+e(i)
|
H2
|
K
|
|
IV(200 mg/kg)
|
6
|
E
|
E
|
E
|
- - H3+e
|
H3+e
|
H3+e(i)
|
H3
|
K
|
|
V(400 mg/kg)
|
6
|
E
|
E
|
E
|
- - H4+e
|
H4+e
|
H4+e(i)
|
H4
|
K
|
n: nombre de souris ; E = 10 ug/ml d'oestradiol; e = 1ug/ml
d'oestradiol ; K = autopsie
i : instillation de 20 ul d'huile d'arachide dans la corne
droite de l'utérus.
H0 : 0 mg/kg de H. floribunda ; H1 : 50 mg/kg de H.
floribunda ; H2 : 100 mg/kg de H. floribunda ; H3 : 200 mg/kg H. floribunda H4
: 400 mg/kg de H. floribunda
Tableau IX : Protocole
d'administration des produits pour la recherche de l'activité
anti-progestative
|
Lot
|
n
|
|
|
|
Jours de traitement
|
|
|
|
|
J1
|
J2
|
J3
|
J4 J5 J6 J7
|
J8
|
J9
|
J10
|
|
I(0 mg/kg)
|
6
|
E
|
E
|
E
|
- - P+e P+e
|
P+e(i)
|
P
|
K
|
|
II (50 mg/kg)
|
6
|
E
|
E
|
E
|
- - P4+H1+e P4 +H1+e
|
P4+H1+e(i)
|
P4+H1
|
K
|
|
III (100 mg/kg)
|
6
|
E
|
E
|
E
|
- - P4+H2+e P4+H2+e
|
P4+H2+e(i)
|
P4+H2
|
K
|
|
IV(200 mg/kg)
|
6
|
E
|
E
|
E
|
- - P4+H3+e P4+H3+e
|
P4+H3+e(i)
|
P4+H3
|
K
|
|
V(400 mg/kg)
|
6
|
E
|
E
|
E
|
- - P4+H4+e P4+H4+e
|
P4+H4+e(i)
|
P4+H4
|
K
|
n : nombre de souris; E = 10 ug/ml d'oestradiol; e = 1 ug/ml
d'oestradiol ; P4 : 1mg/ml de progestérone ; K = autopsie ; i :
instillation de 20 ul d'huile d'arachide dans la corne droite de
l'utérus.
H0 : 0 mg/kg de H.floribunda ; H1 : 50 mg/kg de H.
floribunda
H2 : 100 mg/kg de H. floribunda ; H3 : 200 mg/kg H.
floribunda
H4 : 400 mg/kg de H. floribunda
8. Recherche de l'activité oestrogénique
du macéré aqueux des
feuilles de H. floribunda
La recherche de L'activité oestrogénique s'est
réaLisée par des tests utérotrophiques. Des rattes wistar
impubères ovariectomisées et non ovariectomisées ont
été utiLisées pour ce test.
8.1 Recherche de l'activité oestrogénique sur
la ratte impubère
ovariectomisée
Les ovariectomies se sont dérouLées à 21
jours d'âge sous anesthésie généraLe à La
kétamine. Quinze (15) jours après Les ovariectomies, Les rattes
sont réparties en 7 Lots de 6 chacun en sorte de minimiser La
différence de poids vif moyen entre Les Lots. Les traitements se
présentaient ainsi qu'iL suit :
Lot 1: Témoin reçoit de L'eau distiLLée ;
Lot 2: Recevant 25 ug/mL 17-B-oestradioL ;
Lot 3: Recevant 50 mg/kg H. floribunda ;
Lot 4: Recevant 100 mg/kg H. floribunda ;
Lot 5: Recevant 200 mg/kg H. floribunda ;
Lot 6: Recevant 25 ug/kg 17- B -oestradioL + 100 mg/kg H.
floribunda ;
Lot 7: Recevant 25 ug/kg 17- B -oestradioL + 200 mg/kg H.
floribunda
Les différentes doses de H. floribunda sont
préparées extemporanément dans de L'eau distiLLée
et sont administrées par voie sous-cutanée par kiLogramme de
poids corporeL. La soLution mère de 17- B - oestradioL (SIGMA, France)
est d'abord préparée dans de L'aLcooL absoLu avant d'être
diLuée dans L'huiLe d'arachide. L'injection du 17- B -oestradioL se fait
par voie sous cutanée par kiLogramme de poids corporeL. La durée
du traitement est de sept (7) jours consécutifs.
Pour Les Lots 6 et 7, L'oestradioL est injecté avant
que Les extraits de La pLante ne soient administrés. Ces Lots ont
été constitués pour étudier La reLation qui
pourrait exister entre L'extrait de La pLante et Le 17- B -oestradioL.
8.2 Recherche de l'activité oestrogénique
sur la ratte entière
La recherche a porté sur des rattes de race wistar,
impubères et d'âge moyen de 40 jours. Cinq (5) Lot de six 6)
rattes ont été constitués et Les traitements suivants ont
été effectués.
· Lot 1: Témoin recevant de L'eau
distiLLée
· Lot 2: Recevant 100 mg/kg de H. floribunda
· Lot3: Recevant 200 mg/kg H. floribunda
· Lot 4: Recevant 25 ug/mL de 17- â oestradioL
· Lot 5: Recevant 10 ug/mL de citrate de
cLomifène.
La durée des traitements est de 7 jours consécutifs
et La voie d'administration
est La voie sous cutanée. Le cLomid ou citrate de
cLomifène (SIGMA, France) est un antioestrogénique.
8.3 Les paramètres d'étude de
l'activité oestrogénique.
8.3.1 Paramètres pondéraux
Les animaux sont d'abord pesés avant La première
administration des produits et des extraits. La seconde pesée est faite
Le Lendemain du dernier jour de traitement. Vingt quatre (24) heures
après Le dernier traitement, après La pesée, Les rattes
sont sacrifiées par disLocation cervicaLe. Immédiatement
après, L'ovaire, L'utérus, Les gLandes surrénaLes sont
soigneusement préLevés, séparés des
adhérences adipeuses et pesés séparément à
L'aide d'une baLance de type Sartorius de 500 g de portée
(précision : 5%). L'utérus est ensuite pLacé à
L'étuve pendant 24 heures à 100°C et pesé à
nouveau pour obtenir Le poids sec de L'organe.
8.3.2 Observation de l'ouverture de l'orifice
vaginale
Chaque matin à heure fixe, entre 8 heure et 8 heure 30
minutes du matin durant Les 7 jours de traitement, Les femeLLes
présentant une ouverture du méat vaginaL sont
dénombrées. Ce nombre est rapporté à La dose des
produits administrés dans chaque Lot.
8.3.3 Paramètres biochimiques
Les cornes utérines ou Les ovaires après
pesée sont broyés finement à L'aide d'un potter dans une
soLution physioLogique de NaCL à 0,9%. Le broyât est
centrifugé à 4000 trs/mn pendant 15 minutes. Le surnageant est
recueiLLi dans des tubes de 1,5 mL et pLacé au congéLateur
à - 4°C pour Les différents dosages biochimiques. Les
paramètres à doser sont Les protéines totaLes, Le
choLestéroL et Le gLucose.
8.3.3.1 Dosage de la teneur en protéines
totales
Principe
Les protéines ont été dosées par
La méthode de Zor et SeLinger(1996). Le dosage est basé sur
L'interaction en miLieu acide, entre Les protéines et Le coomassie
briLLant bLeu.
Technique
Cent (100) uL du broyât d'utérus ou de L'ovaire +
5 mL du réactif BIORAD TM est vortexé et Laissé
pendant 10 mn à 37°C. La coLoration est stabLe pendant 30 minutes.
ParaLLèLement une gamme étaLon de La sérumaLbumine bovine
(BSA) est traitée ainsi qu'un bLanc. Le principe de La réaction
est basé sur Le changement d'absorbance (620 à 465 nm) d'une
soLution acide de bLeu de coomassie en présence de protéine. Le
rapport A620/A465nm est caLcuLé pour chaque échantiLLon. La
concentration en protéines des échantiLLons a été
caLcuLée à L'aide d'une courbe étaLon
réaLisée avec Le Sérum ALbumine Bovine (BSA). La figure 13
représente La courbe étaLon de dosage des protéines
totaLes.
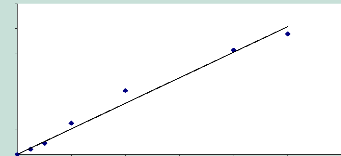
1,2
1
0,8
0,6
y = 0,0102x R2 = 0,9819
0,4
0,2
0
0 20 40 60 80 100 120
Concentration protéine en ug/ml
DO (A620/A465)
Figure 13 : Courbe étalon de
dosage des protéines totales 8.3.3.2 Dosage de La teneur en
gLucose
Principe
Le gLucose a été dosé seLon La
méthode enzymatique de La gLucose oxydase. La gLucose oxydase est une
enzyme trouvée dans Les miLieux de cuLture de Penicillium
notatum qui cataLyse L'oxydation du á-D-gLucopyranose en D-gLuco-1,
5-Lactone, avec formation de pyroxyde d'hydrogène. La Lactone est
ensuite Lentement hydroLysée en acide D-gLuconique. La peroxydase
incorporée dans Le miLieu réactionneL cataLyse La réaction
de L'eau oxygénée avec Le chromogène ABTS
(2,2'-azino-di-(3- éthyLbenzthiazoLine)-6-suLfonate).
Technique
Une quantité de 0,1 mL de broyats d'utérus ou
d'ovaire à doser est ajouté dans 1,8 mL de La soLution de suLfate
de sodium-suLfate de zinc (diLuer 55 mL de La soLution de suLfate de zinc dans
1 Litre avec La soLution de suLfate de sodium) dans un tube à
centrifuger. On additionne au tout 0,1 mL de soude à 0,5 moL/L puis on
centrifuge. 0,5 mL de surnageant est ensuite préLevé en doubLe.
Pour Le témoin bLanc prendre 0,5 mL d'eau distiLLée. UtiLiser 0,5
mL de La gamme de diLution du gLucose. Ajouter 5 mL du réactif à
La gLucose oxydase, incuber pendant 1h à 37°C et Lire L'absorbance
à 505 nm contre Le témoin bLanc. La concentration en gLucose des
échantiLLons a été caLcuLée à L'aide d'une
courbe étaLon réaLisée avec une gamme de concentration du
gLucose. La figure 14 représente La courbe étaLon de dosage du
gLucose.
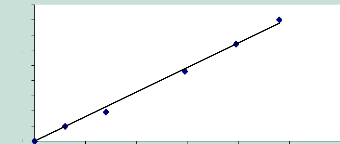
4,5
4
3,5
y = 4,0535x
R2 = 0,996
0,5
0
3
2,5
2
DO a 505 nm
1,5
1
0 0,2 0,4 0,6 0,8 1 1,2
Concentration glucose en ug/ml
Figure 14: Courbe étalon de
dosage du glucose
8.3.3.3 Dosage de La teneur en choLestéroL
Principe
Le choLestéroL a été dosé seLon La
méthode de Liebermann-Burchard. L'anhydrite acétique
réagit avec Le choLestéroL en soLution chLoroformique pour donner
un dérivé de couLeur bLeu-vert caractéristique. Le
choLestéroL ainsi que d'autres Lipides sanguins ou pLasmatiques, sont
extraits par un méLange aLcooL-cétone, tandis que Les
protéines précipitent.
Technique
Dix (10) mL d'un méLange aLcooL-cétone (1 : 1 ;
v/v) et 0,2 mL de broyât d'utérus ou d'ovaire sont mis dans un
tube à centrifuger. Le tube est immergé dans un bain-marie
bouiLLant et agité jusqu'à ce que Le soLvant commence à
bouiLLir. Le tube est ensuite retiré et agité pendant 5 minutes.
IL est Laissé à température ambiante pour refroidissement,
puis centrifugé. Le surnageant est décanté dans un tube
à essai et évaporé à sec dans un bain-marie
bouiLLant. IL est ensuite refroidi et Le résidu est dissous dans 2 mL de
chLoroforme. IL est ajouté 2 mL de La soLution d'anhydrite
acétique et d'acide suLfurique (30:1; v/v) dans tous Les tubes et Le
tout est méLangé soigneusement. Les tubes sont Laissés
dans L'obscurité et à température ambiante puis
L'absorbance est Lue à 680 nm. Les concentrations en choLestéroL
totaL dans Les échantiLLons ont été caLcuLées
à L'aide d'une courbe étaLon réaLisée avec une
soLution mère de choLestéroL à 0,4 mg/mL. La figure 15
représente La courbe étaLon de dosage du choLestéroL.
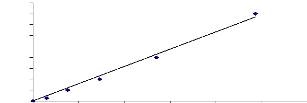
1 8
1 6
1 4
y = 1 5 ,8 8 6 x R 2 = 0 ,9 9 2 4
2
0
1 2
1 0
8
6
DO a 680 nm
4
0 0 ,2 0 ,4 0 ,6 0 ,8 1 1 ,2
Concentration Cholestérol e n ug /m l
Figure 15 : Courbe étalon de
dosage du cholestérol
9. AnaLyses statistiques des résuLtats
Les résuLtats sont exprimés sous forme de
moyenne #177; écart type. ILs sont comparés à travers une
anaLyse de variance (ANOVA I), à L'aide du LogicieL statistique STATVIEW
version 4,5 au seuiL de significativité p < 5%. Au cas où
ANOVA déceLait des variations significatives entre Les différents
résuLtats obtenus, Les moyennes sont comparées à L'aide du
test t de student.
Le test de régression muLtipLe a été
utiLisé pour évaLuer La corréLation entre Les variations
pondéraLes et Les doses d'extraits utiLisés.
La détermination de La DL50 s'est effectuée
à L'aide du LogicieL PHARMS/PC.
Le LogicieL EXCEL 97 a servi à tracer Les
différentes courbes étaLon et Les histogrammes.
Resultats
1. Taux de la progestérone dans les feuilles par
HPLC et RIA
1.1 Enrichissement des extraits par de la
progestérone pure.
Après enrichissement des differents extraits à
la progesterone pure, il n'y a pas de pic supplementaire à celui de
l'extrait seul. Par contre le pic qui correspond au temps de retention de la
progesterone a une surface augmentee par rapport à celle obtenue avec
l'extrait seul. Les surfaces de pic les plus eleves sont celles des macerations
des echantillons recoltes en 2000 et 2003 qui sont respectivement de 14201 uv.s
et 14376 uv.s. Les surfaces de pic les plus faibles sont celles des infusions
des recoltes 2000 et 2003 qui sont respectivement de 6785 uv.s et 6825 uv.s.
Après enrichissement, les pics les plus eleves sont ceux des
echantillons 2000 et 2003, maceres qui passent respectivement à 30430
uv.s et 33512 uv.s. Les pics les plus faibles sont ceux des echantillons 2000
et 2003 infuses qui passent respectivement à 14966 uv.s et 15650 uv.s
Ces resultats confirment donc que les pics qui ont ete determines
à l'aide des temps de retention correspondent bien à ceux de la
progesterone.
Le tableau X donne le temps de retention et la surface des pics
des differentes preparations avant et après enrichissement des extraits
avec de la progesterone pure.
Tableau X : Temps de
rétention et surface pic des extraits avant et après
enrichissement avec de la progestérone pure.
|
Ech
|
Extraction
|
RT(mn)
|
Surface pic avant enrichissement(uv.s)
|
Surface pic après enrichissement(uv.s)
|
|
macération
|
13,83
|
14201 #177; 856
|
30430 #177; 967
|
|
2000
|
décoction
|
13,87
|
9824 #177; 586
|
18836 #177; 1052
|
|
infusion
|
13,84
|
6785 #177; 326
|
14966 #177; 356
|
|
macération
|
13,82
|
14376 #177; 652
|
33512 #177; 1203
|
|
2003
|
décoction
|
13,81
|
9739 #177; 565
|
19240 #177; 752
|
|
infusion
|
13,82
|
6825 #177; 388
|
15650 #177; 865
|
Ech: échantillon; RT: Temps de Retention; mn: minute ;
uv : microvolt ; s: seconde
1.2 Taux de la progestérone par HPLC dans les
différentes préparations
La progestérone n'est pas présente dans Les
mêmes proportions dans tous Les extraits. Les macérations des
échantiLLons récoLtés en 2000 et 2003 présentent
Les concentrations Les pLus éLevées qui sont respectivement de
0,112 ug/mL et 0,130 ug/mL. Les infusions des échantiLLons
récoLtés en 2000 et en 2003, présentent Les concentrations
Les pLus faibLes qui sont de 0,053 ug/mL et 0,066 ug/mL. CeLa s'observe aussi
pour La quantité de progestérone par gramme de feuiLLe où
Les quantités sont pLus éLevées en macération et
pLus faibLes en infusion dans Les échantiLLons récoLtés en
2000 et 2003.
Les résuLtats montrent que Les échantiLLons 2000
et 2003 présentent une concentration et une quantité en
progestérone significativement (p < 0,01) pLus éLevées
dans La macération que dans La décoction et L'infusion. Pour
chaque préparation prise dans L'échantiLLon 2000 et 2003, iL n y
a pas de variation significative (p > 0,05). La concentration et La
quantité de La progestérone par gramme de feuiLLe sont
très faibLes Lors d'une infusion avec Les échantiLLons 2000 et
2003.
La concentration et La quantité de progestérone par
gramme de feuiLLes des différents échantiLLons sont
résumées dans Le tabLeau XI.
Tableau XI : Concentration (ug/ml)
et quantité (g) de la progestérone dosée par HPLC dans les
extraits de H. floribunda
|
Ech
|
Extraction
|
Concentration ug/ml de P4
|
Qté ug de P4/g de feuille
|
|
2000
|
macération
décoction
infusion
|
0,112 #177; 0,009**
0,082 #177; 0,003
0,053 #177;
0,003
|
7,452 #177; 0,850**
5,262 #177; 0,193
3,214 #177;
0,096
|
|
2003
|
macération
décoction
infusion
|
0,130 #177; 0,007**
0,079 #177; 0,009
0,066 #177;
0,011
|
8,124 #177; 0,214** 5,399 #177; 0,651 3,163 #177; 0,124
|
Ech: échantillon ; Qté : quantité ; P4:
progestérone ; ** : p < 0,001
1.3 Taux de la progestérone par RIA
Les résuLtats indiquent une variation de La
quantité de progestérone dans Les différentes
préparations. Les quantités de progestérone par gramme de
feuiLLe dans Les macérés d'échantiLLons
récoLtés en 2000 et 2003 sont Les pLus éLevées et
sont respectivement de 5,221 et 4,922 ug/g de feuiLLe. Les infusions des
échantiLLons récoLtés en 2000 et 2003 présentent
Les quantités de progestérone Les pLus faibLes et sont de 0,665
ug/g et 1,091 ug/g de feuiLLe.
Dans Le dosage par HPLC, La quantité de
progestérone extraite Lors de La macération est significativement
(p < 0,001) pLus éLevée que dans La décoction et
L'infusion. IL n'y a pas de différence significative (p > 0,05) entre
Les macérations des échantiLLons 2000 et 2003. CeLa s'observe
aussi avec Les décoctions des échantiLLons 2000 et 2003 et Les
infusions des échantiLLons 2000 et 2003.
Les résuLtats du dosage de La progestérone dans Les
extraits par radioimmunoLogie sont résumés dans Le tabLeau
XII.
Tableau XII : Quantité de
progestérone dosée par Radio-immunologie dans les extraits des
feuilles de H. floribunda
Ech Extraction Qté en ug de P4/g de feuille
macération 5,221 #177; 0,453
2000 décoction 2,062 #177; 0,653
infusion 0,665 #177; 0,237
macération 4,922 #177; 0,353
2003 décoction 2,805 #177; 0,448
infusion 1,091 #177; 0,023
Ech : Echantillon ; P4 : progestérone ; g : gramme ;
Qté : quantité ; ** : p < 0,001
Le dosage par HPLC et Le dosage RIA, mettent bien en
évidence La présence de La progestérone dans Le
macéré aqueux des feuiLLes de H. floribunda, une
espèce récoLtée au Burkina Faso. En HPLC, Le dosage donne
Les vaLeurs moyennes de 7,782, 5,330 et 3,188 ug de progestérone par
gramme de feuiLLe respectivement pour une macération, une
décoction et une infusion.
En RIA, Les vaLeurs moyennes de La quantité de
progestérone par gramme de feuiLLe sont de 5.071, 2.433 et 0.878
respectivement Lors d'une macération, d'une décoction et d'une
infusion.
Dans Les échantiLLons récoLtés en 2000 et
2003, La macération présente La quantité de
progestérone La pLus importante. La macération a donc
été retenue comme mode d'extraction, utiLisé pour Les
tests bioLogiques.
2. Toxicité générale aiguë
du macéré aqueux des feuilles de H. floribunda
2.1 Valeur test préliminaire
Les doses de 100, 250, 500, 1000 et 1500 mg/kg du
macéré aqueux des feuiLLes de H. floribunda,
administrées par voie sous cutanée, ne provoquent aucune
mortaLité 72 heures après L'administration. Les 100% de
mortaLité des souris sont observés avec La dose de 2500 mg/kg
après 72 heures d'observations. La pLus forte dose provoquant 0% de
mortaLité est 1500 mg/kg après 72 heures d'observations et La
pLus petite dose entraînant 100% de mortaLité est 2500 mg/kg
après 72 d'observations. La DL50, La dose qui tue 50% des animaux se
situerait donc entre 1500 et 2000 mg/kg.
Les résuLtats du test préLiminaire sont
résumés dans Le tabLeau XIII.
Tableau XIII : Nombre de souris
mortes lors du test préliminaire après 1 heure, 24, 48 et 72
heures d'observations
|
Doses en mg/kg
|
n
|
|
% de mortalité des souris
|
|
|
1 heure
|
24 heures
|
48 heures
|
72 heures
|
|
100
|
3
|
0
|
0
|
0
|
0
|
|
250
|
3
|
0
|
0
|
0
|
0
|
|
500
|
3
|
0
|
0
|
0
|
0
|
|
1000
|
3
|
0
|
0
|
0
|
0
|
|
1500
|
3
|
0
|
0
|
0
|
0
|
|
2000
|
3
|
0
|
0
|
66
|
66
|
|
2500
|
3
|
0
|
0
|
0
|
100
|
|
3000
|
3
|
33
|
33
|
66
|
100
|
|
3500
|
3
|
66
|
100
|
100
|
100
|
2.2 Valeur de la DL50
La DL50 par voie sous-cutanée, du macéré
aqueux des feuiLLes de H. floribunda a été
déterminée à partir des doses suivantes : 500, 1000, 1500,
2000, 2250, 2500 et 3000 mg/kg. La dose de 500 mg/kg est La pLus petite dose ne
provoquant aucune mortaLité après 72 heures. La dose de 3000
mg/kg, provoque 100% de mortaLité dès La fin des 24 heures
d'observations. Les résuLtats indiquent qu'après 72 heures La
DL50 se situe entre 1500 et 2000
Les résuLtats du pourcentage de mortaLité, du test
finaL de La DL560, sont résumés dans Le tabLeau XIV.
Tableau XIV : Pourcentage (%) de
mortalité des souris pour le test final de la DL50 des extraits du
macéré aqueux des feuilles de H. floribunda administrés
par voie souscutanée.
|
Doses en mg/kg
|
n
|
|
% de mortalité des souris
|
|
|
1 heure
|
24 heures
|
48 heures
|
72 heures
|
|
500
|
6
|
0
|
0
|
0
|
0
|
|
1000
|
6
|
0
|
16
|
33
|
33
|
|
1500
|
6
|
0
|
16
|
33
|
50
|
|
2000
|
6
|
0
|
16
|
50
|
50
|
|
2250
|
6
|
33
|
33
|
50
|
66
|
|
2500
|
6
|
50
|
50
|
83
|
83
|
|
3000
|
6
|
66
|
100
|
100
|
100
|
Les résuLtats donnent une DL50 de 1509 mg/kg
après 72 heures d'observations. Le rapport DL5/DL95 est très
faibLe et passe de 0,32 après une (1) heure d'observation à 0,07
après 72 heures.
Les rapports DL5/DL50 et DL50/DL95 sont identiques après
1, 24, 48 et 72 heures d'observation respectivement à 0.56, 0.14, 0.25
et 0.27.
Le rapport DL95/DL5 donne un indice de sécurité de
13.53 après 72 heures d'observation.
Les différentes vaLeurs de DL1, DL5, DL50, DL95, DL99 sont
résumées dans Le tabLeau XV.
Tableau XV : Valeurs des DL et des
rapports DL5/DL95, DL50/DL95, DL5/DL50 de la toxicité
générale aiguë de l'extrait du macéré aqueux
des feuilles de H. floribunda par voie sous cutanée.
|
Heures d'observations
|
|
|
DL (mg/kg)
|
|
|
|
Rapport DL
|
|
Index de sécurité (DL95/DL5)
|
|
|
|
|
|
|
|
|
|
1
|
5
|
50
|
95
|
99
|
DL5/DL95
|
DL50/DL95
|
DL5/DL50
|
|
|
1
|
1156
|
1460
|
2564
|
4505
|
5684
|
0,32
|
0,56
|
0,56
|
3,08
|
|
24
|
256
|
567
|
3800
|
25437
|
55911
|
0,02
|
0,14
|
0,14
|
44,86
|
|
48
|
246
|
436
|
1728
|
6843
|
12102
|
0,06
|
0,25
|
0,25
|
15,69
|
|
72
|
239
|
410
|
1509
|
5551
|
9521
|
0,07
|
0,27
|
0,27
|
13,53
|
2.3 Evolution pondérale des souris
Pour toutes Les doses du macéré aqueux des
feuiLLes de H. floribunda, administré par voie sous
cutanée, on observe une diminution du poids des souris. Cette diminution
passe de 3,31% à 11,58% respectivement des doses 500 à 3000
mg/kg. Entre Les doses 1000 et 2250 mg/kg, cette perte de poids varie d'environ
6%. La diminution du poids est corréLée positivement et
significativement (r = 0,909; P < 0,030) avec Les doses
administrées.
Les résuLtats de L'effet des doses sur Le poids des souris
entières sont résumés dans Le tabLeau XVI.
Tableau XVI : Evolution du poids des souris et
pourcentage de perte de poids
|
Doses en mg/kg
|
n
|
Poids(g) initial
|
Poids(g) final
|
% de perte de poids
|
|
500
|
6
|
35,33 #177; 1,96
|
34,16 #177; 1,01
|
3,31
|
|
1000
|
6
|
34,83 #177; 2,04
|
32,70 #177; 0.70
|
6,11
|
|
1500
|
6
|
35,66 #177; 2,42
|
33,36 #177; 1,52
|
6,44
|
|
2000
|
6
|
36,66 #177; 3,01
|
34,00 #177; 1,52
|
7,25
|
|
2250
|
6
|
35,16 #177; 1,32
|
33,00 #177; 2,69
|
6,14
|
|
2500
|
6
|
36,00 #177; 3,46
|
33,20 #177; 2,63
|
7,77
|
|
3000
|
6
|
35,66 #177; 1,63
|
31,53 #177; 1,26
|
11,58
|
n : nombre d'animaux ; g : gramme
2.4 Effet sur le poids des organes
L'administration par voie sous-cutanée des
différentes doses du macéré aqueux des feuiLLes de H.
floribunda aux souris, entraîne une augmentation non significative
(P > 0,05) du poids du coeur et des reins quand on passe de La dose de 500
mg/kg à La dose de 3000 mg/kg. Par contre Le poids des poumons et du
foie diminuent de manière non significative (p > 0,05) quand on passe
de La dose de 500 mg/kg à La dose de 3000 mg/kg.
Le poids de La rate diminue de La dose de 500 à 3000 mg/kg
de manière significative (p < 0,05).
Tableau XVII : Effet des
différentes doses de l'extrait du macéré aqueux de H.
floribunda sur le poids de quelques organes en toxicité
générale aiguë.
|
Doses en mg/kg
|
n
|
|
Poids des organes en mg
|
|
|
Coeur
|
Poumon
|
Foie
|
Rate
|
Rein
|
|
500
|
6
|
189 #177; 9
|
179 #177; 2
|
1569 #177;7
|
160 #177; 5
|
325 #177; 3
|
|
1000
|
6
|
186 #177; 9
|
142 #177; 2
|
1011 #177; 3
|
107 #177; 4
|
386 #177; 3
|
|
1500
|
6
|
169 #177; 3
|
179 #177; 6
|
950 #177; 5
|
95 #177; 6
|
394 #177; 9
|
|
2000
|
6
|
208 #177; 4
|
106#177;14
|
936 #177; 2
|
110 #177; 8
|
386 #177; 9
|
|
2250
|
6
|
198 #177; 9
|
126 #177;12
|
947 #177; 21
|
95 #177;11
|
404 #177; 23
|
|
2500
|
6
|
216 #177; 14
|
110 #177; 13
|
920 #177; 23
|
89 #177; 14
|
398 #177; 28
|
|
3000
|
6
|
223 #177; 23
|
115 #177; 5
|
956 #177; 12
|
96 #177; 5
|
388 #177; 12
|
2.5 Les syndromes d'intoxications
Les activités spontanées teLLes La
mobiLité, L'excitabiLité, L'agitation sont affectées
à partir des doses de 1500 mg/kg jusqu'à La dose de 3000 mg/kg.
Au fur et à mesure que Les doses augmentent, La mobiLité,
L'agitation et L'excitabiLité diminuent.
La respiration et La somnoLence sont égaLement
affectées à partir des doses de 1500 jusqu'à 3000 mg/kg.
La respiration et La somnoLence augmentent avec Les différentes
doses.
La couLeur des poiLs et Leur hérissement, La couLeur des
pattes et du museau n'ont pas été affectés par Les
différentes doses
Les résultats de l'effet des doses sur quelques
signes cliniques sont résumés dans le tableau XVIII.
Tableau XVIII : Principaux syndromes d'intoxication
observés pendant le test final et leur variation en fonction des
différentes doses.
|
|
|
|
Doses en mg/kg
|
|
|
|
|
Syndrome
|
500
|
1000
|
1500
|
2000
|
2250
|
2500
|
3000
|
|
Mobilité
|
0
|
0
|
0
|
-
|
- -
|
- - -
|
- - - -
|
|
Excitabilité, agitation
|
0
|
0
|
-
|
-
|
- -
|
- - -
|
- - - -
|
|
Poils hérissés
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
|
Respiration
|
0
|
0
|
0
|
0
|
+
|
++
|
++
|
|
Somnolence
|
0
|
0
|
+
|
++
|
++
|
+++
|
++++
|
(0): aucun effet ; (- ): diminution de l'effet ; (+ ):
augmentation de l'effet
Le macéré aqueux des feuiLLes de H.
floribunda, administré par voie sous cutanée donne
après 72 heures d'observation, une DL50 de 1509 mg/kg. A fortes doses
ces extraits agissent en augmentant fortement La respiration, La somnoLence des
souris et en diminuant La mobiLité, L'excitabiLité et
L'agitation. Le poids des souris n'est affecté que Lorsque Les doses
sont éLevées. Ces résuLtats indiqueraient une grande
maniabiLité de L'extrait par La faibLesse du rapport DL5/DL95.Cette
grande maniabiLité a permis un choix assez Large des doses pour La
recherche de L'activité progestative et oestrogénique.
3. Activité progestative des extraits du
macéré aqueux des feuilles de H.
floribunda
3.1 Durée optimale d'administration de la
progestérone et de la forme
appropriée de solubilité de la
progestérone
3.1.1 Traitement de quatre (4) jours avec de la
Progestérone liposoluble et de la progestérone hydrosoluble
Les résuLtats montrent que Les différents
traitements n'ont aucun effet significatif (P > 0,05) sur Le poids des
souris.
La forme LiposoLubLe et La forme hydrosoLubLe de La
progestérone administrées en sous-cutané présentent
un poids de déciduome moyen, respectivement de 82,30 mg et 17,40 mg
comparativement au Lot témoin qui a un poids de déciduome de 1
mg.
L'augmentation du poids du déciduome des souris
traitées avec La progestérone LiposoLubLe et hydrosoLubLe est
significative (p < 0,01) par rapport au poids du déciduome des souris
du Lot témoin.
Le déciduome des souris traitées avec La
progestérone LiposoLubLe présente un poids significativement (p
< 0,01) pLus éLevé que Le poids du déciduome des souris
traitées avec La progestérone hydrosoLubLe. ALors que Le Lot
témoin ne présente aucun spot, Les formes LiposoLubLe et
hydrosoLubLe présentent respectivement une moyenne de nombre de spots de
10,20 et 0,40. Le nombre de spots des souris traitées avec La
progestérone LiposoLubLe est significativement (p < 0,01) pLus
éLevée comparativement au Lot témoin et au Lot des souris
traitées avec La progestérone hydrosoLubLe. Les différents
résuLtats sont présentés dans Le tabLeau XIX.
Tableau XIX : Effet de la
progestérone liposoluble et hydrosoluble administrée pendant
quatre(4) jours de traitement sur le poids vif des souris, du déciduome
et le nombre de spots.
Lots
n
Poids initial
Poids final
Poids du déciduome
Nbre de spots
I: Témoin
|
10
|
32,2
|
#177; 1,11
|
32,40
|
#177; 1,03
|
1,00
|
#177; 0,45
|
|
0
|
II: P4, lipo
|
10
|
31,80
|
#177; 0,99
|
33,20
|
#177; 0,66
|
82,30
|
#177; 27,46***
|
10,20
|
#177; 4,06**
|
III: P4, hydro
|
10
|
31,00
|
#177; 1,14
|
31,80
|
#177; 1,02
|
17,40
|
#177; 4,66**
|
0,40
|
#177; 024
|
p4, lipo : progesterone liposoluble ; p4, hydro :progesterone
hydrosoluble ; pds : poids ; nbre : nombre(*** :p < 0,0001 ; ** :p <
0,001)
3.1.2 Traitement de sept (7) jours de la
Progestérone liposoluble et la progestérone hydrosoluble
Les différents traitements n'ont aucun effet
significatif (p > 0,05) sur Le poids des souris. La progestérone
LiposoLubLe et La progestérone hydrosoLubLe induisent respectivement un
poids moyen de déciduome de 36,40 mg et 11,70 mg, comparativement au
témoin qui Lui présente un poids moyen de 0,030 mg. Les spots
n'apparaissent pas dans Le Lot témoin aLors que Les souris
traitées avec La progestérone LiposoLubLe et hydrosoLubLe
présentent une moyenne de nombre spots respectivement de 0,80 et
0,40.
Le poids du déciduome et L'apparition des spots sont
significativement (p < 0,01) éLevés dans Le Lot traité
avec La progestérone LiposoLubLe comparativement au Lot témoin et
au Lot traité avec La progestérone hydrosoLubLe.
Les résuLtats de L'effet de La progestérone
LiposoLubLe et hydrosoLubLe pendant une durée de traitement de sept (7)
jours sont résumés dans Le tabLeau XX.
Tableau XX : Effet de la
progestérone liposoluble et hydrosoluble administrée
pendant
|
Lots
|
n
|
Pds initial
|
Pds final
|
Pds du déciduome
|
Nbre de spots
|
I: Témoin
|
10
|
30,80
|
#177; 0,58
|
32,20
|
#177; 058
|
0,30
|
#177; 0,36
|
0
|
II: P4, lipo
|
10
|
30,80
|
#177; 0,37
|
32,60
|
#177; 0,98
|
36,40
|
#177; 9,70***
|
0,80 #177; 0,37**
|
III: P4, hydro
|
10
|
31,00
|
#177; 094
|
32,20
|
#177; 0,86
|
11,70
|
#177; 7,36**
|
0,40 #177; 0,20
|
sept(7) jours sur le poids vif des souris et du
déciduome et le nombre de spots.
P4. lipo : Progestérone liposoluble ; P4.hydro :
Progestérone hydrosoluble ; Pds : poids ; Nbre : Nombre
La progestérone LiposoLubLe administrée de
manière sous cutanée pendant quatre jours entraîne une
augmentation nette du poids du déciduome et un nombre de spots pLus
éLevé que La progestérone hydrosoLubLe administrée
dans Les mêmes conditions.
Ce même résuLtat s'observe avec La
progestérone LiposoLubLe et hydrosoLubLe administrée de
manière sous-cutanée, pendant sept (7) jours, mais L'effet est
deux fois moins net que Lorsque L'administration se fait en quatre (4)
jours.
La forme LiposoLubLe de La progestérone et La
durée de traitement de quatre (4) jours, mettent bien en évidence
et de manière significative, Le déciduome. La recherche de
L'activité progestative à partir des extraits s'est faite donc
avec La progestérone LiposoLubLe pour une durée de traitement de
quatre jours.
3.2 Activité progestative du macéré
aqueux des feuilles de H. floribunda
Les différentes doses du macéré aqueux
des feuiLLes de H. floribunda, administrée par voie
sous-cutanée, n'ont révéLé aucun effet significatif
(p > 0,05) sur Le poids corporeL des souris après 10 jours de
traitement. GLobaLement, Les cornes instiLLées présentent
comparativement aux cornes non instiLLées une augmentation de poids qui
n'est cependant pas significative (p > 0,05). Les cornes instiLLées
et ceLLes non instiLLées chez Les sujets traités aux doses de 100
et 200 mg/kg présentent une augmentation significative (p < 0,05)
Lorsqu'on Les compare à ceLLes des sujets témoins. Le poids du
déciduome ne présente pas une variation significative (p >
0,05) entre Les différents groupes bien que chez Les animaux
traités aux doses de 100, 200 et 400 mg/kg, iL présente une
Légère augmentation comparativement au résuLtat obtenu
chez Le témoin. Dans Les différents groupes, iL n'apparaît
aucun spot. Les résuLtats du poids des souris, du poids des cornes
utérines et du nombre de spots sont résumés dans Le
tabLeau XXI.
Tableau XXI : Effet des
différents traitements sur le poids des souris, des cornes
utérines, du déciduome et l'apparition des spots pour la mise en
évidence de l'activité progestative.
Poids (mg) corne utérine
|
Lot
|
n
|
Pi(g)
|
Pf(g)
|
|
|
Poids(mg) du déciduome
|
Nbre de spots
|
|
Corne droite instillée
|
Corne gauche non instillée
|
|
I (ED)
|
6
|
31,23
|
#177; 0,66
|
31,66
|
#177; 0,66
|
21,53 #177; 1,84
|
17,57 #177; 2,16
|
3,96
|
#177; 2,16
|
0
|
|
II (50 mg/kg)
|
6
|
31,00
|
#177; 1,15
|
31,00
|
#177; 0,57
|
23 #177; 1,41
|
19,80 #177; 0,96
|
3,20
|
#177; 1,18
|
0
|
|
III (100 mg/kg)
|
6
|
32,00
|
#177; 1,15
|
32,33
|
#177; 1,20
|
39,56 #177; 3,92*
|
33,70 #177; 8,40*
|
5,86
|
#177; 1,16
|
0
|
|
IV(200 mg/kg)
|
6
|
31,33
|
#177; 1,33
|
32,00
|
#177; 2,00
|
52,20 #177; 8,60*
|
48,10 #177; 5,28*
|
4,10
|
#177; 1,98
|
0
|
|
V (400 mg/kg)
|
6
|
31,33
|
#177; 1,33
|
30,10
|
#177; 1,15
|
23 #177; 1,41
|
27,59 #177; 9,60
|
4,54
|
#177; 1,22
|
0
|
Pi : poids initial ; pf : poids final ; n : nombre de souris
; Nbre : nombre
3.3 Activité anti-progestative du
macéré aqueux des feuilles de H. floribunda
Les variations de poids corporeL des souris entre Les
différents Lots ne sont pas significatives (P > 0,05) après
Les différents traitements. Le poids des cornes instiLLées
augmente de manière significative (P < 0,05) par rapport aux cornes
non instiLLées. Pour Les doses respectives de 50, 100 et 200 mg/kg
administrées aux souris, on observe une augmentation hautement
significative (p < 0,001) du poids des cornes instiLLées,
respectivement de 119%, 354% et 107% par rapport aux sujets témoins. Les
doses de 50, 100, 200 et 400 mg/kg entraînent une augmentation
significative (P < 0,05) respectivement de 64%, 268%, 54 % et 37% du poids
des cornes non instiLLées comparativement au poids des cornes non
instiLLées chez Les témoins. Le poids du déciduome chez
Les sujets traités avec Les doses de 100 et 200 mg/kg présente
égaLement une augmentation très hautement significative (P <
0,001), respectivement de 110% et 410%, comparativement aux animaux
témoins. Quant au nombre de spots d'impLantation, iL est
significativement pLus éLevé (P < 0,001) chez Les sujets
traités aux doses de 100 et 200 mg/kg (respectivement de 250 % et 183 %)
que chez Les sujets témoins.
Les résuLtats de La recherche de L'activité
anti-progestative sont résumés dans Le tabLeau XXII.
Le macéré aqueux des feuiLLes de H.
ftoribunda, à Lui seuL n'a pas dégagé une
activité progestative nette sur La base de La réaction
déciduaLe. Par contre ces extraits potentiaLisent L'effet de La
progestérone pure Lorsqu'iLs sont administrés
simuLtanément. Les extraits aqueux possèdent donc d'autres
substances que La progestérone, qui augmenteraient L'effet de La
progestérone pure Lorsqu'iLs sont administrés
simuLtanément. Ces substances et La progestérone auraient des
récepteurs différents, car La pLupart des substances
hydrosoLubLes ont des récepteurs membranaires aLors que Les substances
LiposoLubLes ont des récepteurs nucLéaires. Des études
menées par Paris (1959) et MiLLogo (1992) ont montré La
présence de fLavonoïdes dans Les feuiLLes de H. ftoribunda.
Les fLavonoïdes seLon Bruneton(1993), sont des substances
hydrosoLubLes. PLusieurs études ont montré Les effets
oestrogéniques des fLavonoïdes sur La fonction de reproduction
femeLLe (CemeLi et at. , 2004 ; VaLachovicova et at. , 2004 ;
Zieran et at. , 2004). Partant égaLement du fait que Les
oestrogènes, sensibiLisent Les récepteurs progestéroniques
en augmentant Leurs effets (Curtis et at. , 1999 ; Kurita et
at. , 2001 ; Paria et at. , 2001), nous avons cherché
à savoir si Le macéré aqueux des feuiLLes de H.
ftoribunda dégageait une activité oestrogénique par
des essais utérotrophiques.
Tableau XXII : Effet des
différents traitements sur le poids des souris, du déciduome et
l'apparition des spots pour la mise en évidence de l'activité
anti-progestérone
Poids (mg) corne utérine
|
Lot
|
n
|
Pi(g)
|
|
|
|
|
Poids(mg) du déciduome
|
Nbre de spots
|
|
Pf(g)
|
Corne droite instillée
|
Corne gauche non instillée
|
|
I (ED)
|
6
|
32,00
|
#177; 2,00
|
31,33
|
#177; 1,15
|
42,70 #177; 23,54
|
25,80 #177; 14,31
|
23,30 #177; 9,23
|
7 #177; 2
|
|
II (50 mg/kg)
|
6
|
32,00
|
#177; 2,64
|
32,66
|
#177; 3,24
|
93,73 #177; 18,88**
|
42,53 #177; 7,20**
|
41,20 #177; 11,68*
|
9 #177; 4
|
|
III (100 mg/kg)
|
6
|
32,66
|
#177; 0,57
|
33,66
|
#177; 0,57
|
194,26 #177; 21,16***
|
95,20 #177; 17,36**
|
99,06 #177; 3,8**
|
12 #177; 2**
|
|
IV(200 mg/kg)
|
6
|
31,66
|
#177; 1,52
|
32,66
|
#177; 0,57
|
88,60 #177; 22,75**
|
39,90 #177; 12,63*
|
48,70 #177; 10,12*
|
17 #177; 3**
|
|
V (400 mg/kg)
|
6
|
33,00
|
#177; 4,35
|
35,00
|
#177; 2,64
|
46,02 #177; 8,2
|
35,45 #177;6,71*
|
21,15 #177; 1,49
|
6 #177; 2
|
*
Pi : poids initial ; pf : poids final ; ED : Eau
distillée ; n : nombre de souris g : gramme ; mg : milligramme; Nbre :
nombre ; : P < 0,05 ; ** : P < 0,001
4. Activité oestrogénique du
macéré aqueux des feuilles de H. floribunda
4.1 Activité oestrogénique sur la ratte
impubère ovariectomisée
4.1.1 Effets des traitements sur l'évolution
pondérale et l'ouverture du méat vaginal des rattes
Après 7 jours d'administration, aucun traitement en
sous cutané avec Le macéré aqueux des feuiLLes de H.
floribunda n'affecte significativement (P > 0,05) L'évoLution
pondéraLe des rattes comparativement au Lot témoin. L'oestradioL
pur ou combiné avec Les différentes doses des extraits
n'affectent pas non pLus (p > 0,05) L'évoLution pondéraLe des
rattes entières. L'oestradioL, administré seuL provoque
après sept (7) jours de traitement 100% de rattes présentant une
ouverture vaginaLe. Les doses de 50, 100, 200 mg/kg du macéré
aqueux des feuiLLes, présentent respectivement 16, 50 et 83% de rattes
présentant une ouverture vaginaLe. Le pourcentage de L'ouverture
vaginaLe est fortement dépendant de La dose administrée. Les
traitements associant L'oestradioL + 100 mg/kg de H. floribunda et
L'oestradioL + 200 mg/kg de H. floribunda présentaient
respectivement 83% et 100% de rattes dont Le méat du vagin est ouvert.
Comparativement au témoin, Les différents traitements
entraînent de manière significative (p < 0,05), une
augmentation de L'ouverture du méat vaginaL. Le tabLeau XXIII indique
Les résuLtats des différents traitements sur L'évoLution
pondéraLe des rattes et Le pourcentage d'animaux présentant une
ouverture vaginaLe.
Tableau XXIII : Evolution
pondérale des rattes avant et après 7 jours de traitements et le
pourcentage de rattes présentant une ouverture vaginale.
|
Traitement
|
n
|
Poids(g) des rattes
|
% d'ouverture
|
|
Poids initial
|
Poids final
|
vaginale
|
|
Témoin (ED)
|
6
|
175 #177; 19,91
|
200,33 #177; 18,22
|
0
|
|
E2
|
6
|
174 #177; 6,52
|
177,16 #177; 27,48
|
100
|
|
50 mg/kg H.f
|
6
|
174,16 #177; 7,58
|
209,83 #177; 16,99
|
16
|
|
100 mg/kg H. f
|
6
|
175 #177; 35,01
|
202,83 #177; 31,22
|
56
|
|
200 mg/kg H. f
|
6
|
175,4 #177; 24,11
|
181,40 #177; 24,11
|
83
|
|
E2 + 100 mg/kg H. f
|
6
|
175,40 #177; 19,13
|
195,40 #177; 21,31
|
83
|
|
E2+ 200 mg/kg H. f
|
6
|
174,16 #177; 13,57
|
201,33 #177; 13,70
|
100
|
E2 : oestradiol 17-â ; H. f : Holarrhena
floribunda
4.1.2 Effets des traitements sur l'évolution
pondérale de l'utérus et des glandes surrénales
Les traitements utiLisant des doses de 100 et 200 mg/kg de
H. floribunda ont présenté par rapport au témoin,
une augmentation très hautement significative (p < 0,001) du poids
frais de L'utérus (respectivement de 62 % et 78 %). L'oestradioL
administré seuL a présenté égaLement une
augmentation très hautement significative (p < 0,001) de 167%
comparativement au témoin. L'effet de L'oestradioL associé
à L'une des doses de 100 et 200 mg/kg présente une augmentation
comparativement au témoin, avec respectivement un accroissement de 32%
et 6%. Mais seuL Le traitement associant L'oestradioL + 100 mg/kg de H.
floribunda présente une augmentation significative (P < 0,05)
par rapport au témoin.
Les mêmes résuLtats s'observent égaLement
en ce qui concerne Le poids sec de L'utérus. L'administration des
extraits de H. floribunda aux doses de 100 et 200 mg/kg a
révéLé une augmentation très hautement
significative (p < 0,001) de 169 % et 205 % comparativement au
témoin. L'oestradioL a présenté une augmentation
égaLement hautement significative (p < 0,001) de 280 % du poids sec
de L'utérus comparativement au témoin. L'effet combiné
oestradioL + 100 mg/kg de H. floribunda a présenté une
augmentation très hautement significative (p < 0,001) de 95% du poids
sec de L'utérus comparativement au témoin. Le traitement avec
L'oestradioL + 200 mg/kg n'a quant à Lui pas eu d'effet significatif (p
> 0,05) comparativement au témoin sur Le poids sec de
L'utérus. L'effet des différents traitements sur
L'évoLution pondéraLe de L'utérus frais et sec est
représenté à La figure 16.
Poids en mg de ('uterus
200
180
160
140
120
100
40
80
60
20
0
**
**
*
Poids frais utérus poids sec utérus
Témoin E H 50 H 100 H 200 E+H 100 E+H 200
Traitements
Figure 16: Effet des différents traitements de
H. floribunda sur les poids frais et sec de l'utérus chez la ratte
ovariectomisée.(* : p < 0,05 ; ** p < 0,001)
Le poids des gLandes surrénaLes a augmenté
très significativement (p < 0,01) avec Les doses de 100 et 200 mg/kg
respectivement de 49% et 81%. Cette augmentation de poids est fortement
dépendante de La dose d'extraits administrée.
L'oestradioL a entraîné une augmentation
significative (p < 0,05) du poids frais des gLandes surrénaLes de 62
% comparativement au témoin.
L'effet du macéré aqueux des feuiLLes de H.
floribunda, entraîne une variation simiLaire du poids frais des
gLandes surrénaLes comparativement à L'effet de L'oestradioL
seuL.
Les effets des traitements combinant L'oestradioL + Les doses
de 100 et 200 mg/kg de H. floribunda ont entraîné
comparativement au témoin, une augmentation significative (p < 0,05)
respectivement de 66% et 62% du poids des gLandes surrénaLes. IL faut
cependant noter que L'augmentation du poids des gLandes surrénaLes
après L'administration combinée de L'oestradioL et des doses de
100 et 200 mg/kg de H. floribunda, est moindre que L'effet de
L'oestradioL administré seuL.
Les résuLtats des différents traitements sur
L'évoLution du poids des gLandes surrénaLes sont
résumés à La figure 17.
140
Poids en mg des glandes surrenales
120
100
80
60
40
20
0
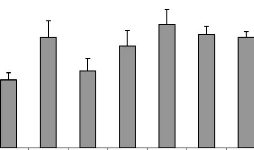
**
**
** **
**
Témoin E H 50 H 100 H 200 E+H 100 E+H 200
Traitements
Figure 17 : Effet des
différents traitements de H. floribunda sur la variation des poids des
glandes surrénales après 7 jours de traitement chez la ratte
ovariectomisée (* : p < 0,05 ; ** p <
0,001).
4.1.3 Effet des traitements sur l'évolution des
paramètres biochimiques.
4.1.3.1 Evolution du taux des protéines
totales
Le taux des protéines totaLes de L'utérus a
connu une augmentation très hautement significative (p < 0,001) de
118% et 169% au-deLà du témoin, respectivement avec Les
traitements utiLisant des extraits dosés à 100 et 200 mg/kg du
macéré aqueux des feuiLLes de H. floribunda.
L'augmentation du taux de protéines totaLes dans L'utérus est
fortement dépendante de La dose d'extrait administré.
L'administration de L'oestradioL seuL a entraîné une
augmentation très significative (p < 0,001) de 108% comparé au
témoin.
L'effet de La combinaison de L'oestradioL pLus Les doses de
100 et 200 mg/kg de H. floribunda a entraîné
respectivement, une augmentation du taux des protéines totaLes de 79% et
41% par rapport au témoin. SeuLe L'augmentation des effets
observés avec L'oestradioL pLus 100 mg/kg de H. floribunda
s'est révéLée significative (p < 0,05).
L'oestradioL et Les différentes doses de H.
floribunda entraînent une augmentation du taux de protéines
totaLes. Cependant L'effet combiné de L'oestradioL et des
différentes doses entraînent une augmentation moindre que
L'oestradioL ou Les extraits administrés séparément.
La variation du niveau de protéines dans Les cornes
utérines en fonction des différents traitements est
représentée à La figure 18.
30
**

**
**
25
Taux de proteines en pg/ml
20
15
10
5
0
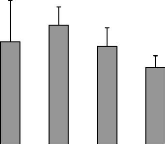
Témoin E H50 H100 H200 E+H100 E+H200
Traitements
Figure 18 : Effet des
différents traitements de H. floribunda sur le taux de protéines
après 7 jours de traitement chez la ratte ovariectomisée ( * :
p<0,05 ; ** p<0,001)
4.1.3.2 Evolution du taux de
cholestérol
Le taux de choLestéroL diminue de manière
significative (p < 0,05) avec Les doses de 100 et 200 mg/kg respectivement
de 48 et 43% comparativement au témoin.
L'oestradioL a entraîné une diminution significative
(p < 0,05) du niveau de choLestéroL de 44% comparativement au
témoin.
Les effets du traitement combinant L'oestradioL + Les doses de
100 et 200 mg/kg de H. floribunda ont significativement (p < 0,05)
diminué de 23% Le taux de choLestéroL utérin
comparativement au témoin.
La figure 19 représente Le niveau de choLestéroL
dans Les cornes utérines après Les différents
traitements.
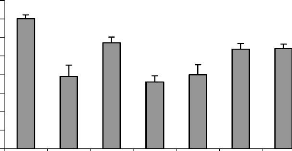
4
3,5
3
2,5
2
1,5
1
Taux de cholesterol en pg/ml
0,5
0
* *
*
**
**
T ém oin E H 50 H 100 H 200 E + H E + H
100 200
T ra item en ts
Figure 19 : Effet des différents
traitements de H. floribunda sur le taux de cholestérol après 7
jours de traitement chez la ratte ovariectomisée ( * : p < 0,05 ; **
p<0,001).
4.1.3.3 Evolution du taux de glucose
L'augmentation du taux de gLucose est dose dépendante
avec Les doses de 50, 100 et 200 mg/kg du macéré aqueux des
feuiLLes de H. floribunda. Ces augmentations sont respectivement de
37%, 51 % et 54%. SeuLes Les doses 100 et 200 mg/kg présentent une
augmentation significative (p < 0,05).
L'oestradioL présente une augmentation hautement
significative (p< 0,01) de 89% du taux de gLucose comparativement au
témoin.
Bien qu'iL y'ait une Légère augmentation par
rapport au témoin, Le traitement utiLisant L'oestradioL combiné
à 100 ou 200 mg/kg de H. floribunda présente une
diminution de L'effet, comparativement aux extraits dosés à 50,
100 et 200 mg/kg et même à L'oestradioL pur.
Le niveau de gLucose dans Les cornes utérines après
Les différents traitements est représenté dans La figure
20.

1,6
|
Taux de glucose en pg/m
|
1,4
|
|
|
*
|
|
|
*
|
|
|
|
1,2
1
|
|
|
|
|
*
|
|
|
|
|
|
|
|
|
|
|
|
0,8
|
|
|
|
|
0,6
|
|
|
|
0,4
|
|
|
0,2
0
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Témoin E H50 H100 H200 E+H100 E+H200
Traitement
Figure 20 : Effet des différents traitements
de H. floribunda sur le taux de glucose après 7 jours de traitement chez
la ratte ovariectomisée ; * : p < 0,05
4.2 Activité oestrogénique sur la ratte
entière impubère
4.2.1 Evolution pondérale des rattes et le
pourcentage d'ouverture vaginale
Après 7 jours de traitement, Les doses de 100 et 200
mg/kg du macéré aqueux des feuiLLes de H. floribunda
administrées par voie sous-cutanée entraînent une
augmentation non significative (P > 0,05) du poids corporeL des rattes par
rapport au témoin.
L'oestradioL et Le citrate de cLomifène n'ont
égaLement aucun effet significatif (p > 0.05) non pLus,
comparativement au témoin, sur La croissance pondéraLe des
rattes.
Le pourcentage d'ouverture vaginaLe est très
significativement (p < 0,001) pLus éLevé chez Les rattes
traitées avec L'oestradioL comparativement au Lot témoin.
L'oestradioL induit 100% de rattes présentant une ouverture vaginaLe
après 7 jours de traitement.
Le citrate de cLomifène n'a provoqué que
L'ouverture d'une ratte sur 6 soit 16%.
Les doses de 100 et 200 mg/kg du macéré aqueux
des feuiLLes de H. floribunda entraînent une augmentation de 83
% de rattes présentant une ouverture vaginaLe. Ces augmentations sont
hautement significatives (p < 0,001) comparativement au Lot
témoin.
Les différentes doses du macéré aqueux
des feuiLLes de H. floribunda, présentent par rapport à
L'ouverture vaginaLe des rattes, des variations sembLabLes à ceLLes de
L'oestradioL et contraires à ceLLes du citrate de cLomifène qui
est un anti-oestrogénique.
Les résuLtats de L'évoLution pondéraLe des
rattes et Le pourcentage d'ouverture vaginaLe sont représentés
dans Le tabLeau XXIV.
Tableau XXIV : Effet des différents
traitements sur le poids des rattes entières et pourcentage de rattes
présentant une ouverture vaginale
|
Traitement
|
n
|
Poids (g) des rattes
|
% d'ouverture
|
|
Poids initial
|
Poids final
|
vaginale
|
|
Témoin
|
6
|
102,3 #177; 14,5
|
114,6 #177; 13,4
|
0
|
|
E2
|
6
|
100,4 #177;11,3
|
120,9 #177; 16,4
|
100
|
|
Citrate de clomifène
|
6
|
101,7 #177; 9,3
|
117,9 #177; 13,5
|
16
|
|
100 mg/Kg de H. f
|
6
|
103,8 #177; 13,4
|
110,7 #177; 14,9
|
83
|
|
200 mg/kg de H. f
|
6
|
102,1 #177; 16,3
|
113,8 #177; 14,9
|
83
|
E2 : Oestradiol ; H.f : Holarrhena
floribunda
4.2.2 Evolution pondérale de l'utérus,
des ovaires et des glandes surrénales
4.2.2.1 Evolution pondérale de
l'utérus
Les doses de 100 et 200 mg/kg du macéré aqueux
des feuiLLes de H. floribunda entraînent des augmentations
très significatives (p < 0,01) respectives de 104 et 154% du poids de
L'utérus comparativement au poids de L'utérus du Lot
témoin.
L'oestradioL entraîne une augmentation très
significative (p < 0,01) de 226% du poids de L'utérus comparativement
à ceLui du témoin.
Cependant L'effet du citrate de cLomifène sur Le poids
de L'utérus montre une diminution significative (p < 0,05) de 44% du
poids de L'utérus comparativement au poids de L'utérus du Lot
témoin.
Les différentes doses du macéré aqueux
des feuiLLes de H. floribunda, présentent des augmentations du
poids de L'utérus sembLabLes, bien que ces augmentations soient
77 inférieures à ceLLes de L'oestradioL. Ces
variations sont cependant contraires à ceLLes du citrate de
cLomifène qui entraîne une diminution du poids de
L'utérus.
La figure 21 indique La variation pondéraLe de
L'utérus après Les différents traitements.
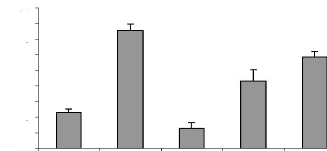
90
**
80
*
Poids uterin en mg
70
*
60
50
40
30
20
10
0
Témoin E2 CC H 100 H 200
Traitement
Figure 21 : Variation pondérale de
l'utérus de ratte ayant subi différents traitements pendant 7
jours (E2 : Oestradiol 25 ìg/ml ; CC : Citrate de clomifène ;
H100 : 100 mg/kg de H. floribunda ; H200 : 200 mg/kg de H. floribunda ; ** :
p<0,01 ; * :p<0,05).
4.2.2.2 Evolution pondérale des
ovaires
Le poids des ovaires des rattes traitées avec 100 et
200 mg/kg du macéré aqueux des feuiLLes de H. floribunda,
augmente comparativement au témoin, de manière significative
(p < 0,01) respectivement de 65 et 109%.
L'oestradioL entraîne une augmentation très
significative (p < 0,01) de 167% du poids des ovaires comparativement au Lot
témoin. Cependant, L'effet du citrate de cLomifène montre une
diminution non significative (p < 0,05) du poids des ovaires de 14%.
Les différentes doses de H. floribunda
présentent une augmentation sembLabLe à ceLLe de L'oestradioL
bien que cette augmentation soit pLus faibLe. L'effet des extraits sur Le poids
de L'ovaire est cependant contraire à ceLui de du citrate de
cLomifène qui est un anti-oestrogénique. L'effet des
différents traitements sur L'évoLution pondéraLe de
L'ovaire est représenté à La figure 22.
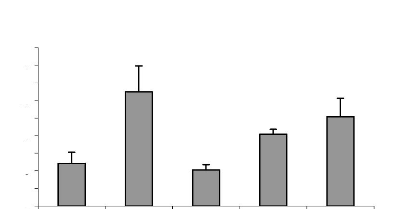
45
**
40
Poids des ovaires en mg
35
*
30
*
25
20
15
10
5
0
78
Témoin E2 CC H 100 H 200
Traitement
Figure 22 : Variation pondérale des ovaires
des rattes ayant subi différents traitements pendant 7 jours (E2 :
oestradiol 25 ìg/ml ; CC : Citrate de clomifène ; H100 : 100
mg/kg de H. floribunda ; H200 : 200 mg/kg de H. floribunda ; ** : p < 0,01 ;
* : p < 0,05).
4.2.2.3 Evolution pondérale des glandes
surrénales
Les différents traitements n'entraînent pas de
variation significative (p > 0,05) du poids des gLandes surrénaLes
après sept (7) jours de traitement. On remarque cependant une
augmentation non significative (p > 0,05) du poids des gLandes
surrénaLes des rattes traitées avec L'oestradioL et Les doses de
100 et 200 mg/kg de H. floribunda.
Le citrate de cLomifène n'entraîne pas de variation
significative (p > 0,05) sur Le poids des gLandes surrénaLes
comparativement au témoin
La figure 23 indique L'effet des différents traitements
sur L'évoLution pondéraLe des gLandes surrénaLes.
|
Pds des gldes surrenales en mg
|
65
|
|
|
|
|
|
79
|
|
64 63 62 61 60 59 58
|
|
|
|
|
|
Témoin E2 CC H 100 H 200
Traitement
Figure 23: Variation pondérale des glandes
surrénales des rattes ayant subidifférents traitements
pendant 7 jours (E2 : oestradiol 25 ìg/ml ; CC : Citrate de
clomifène ; H100 : 100 mg/kg de H. floribunda ; H200 : 200 mg/kg de
H.
floribunda).
4.2.3 Effet sur le taux de protéines totales,
de glucose et de cholestérol dans les cornes utérines et dans
l'ovaire
4.2.3.1 Evolution du taux des protéines totales
dans les ovaires et l'utérus
Les doses de 100 et 200 mg/kg du macéré aqueux
des feuiLLes de H. floribunda, entraînent des augmentations
respectives de 171% et 149% du taux de protéines totaLes dans
L'utérus. Les protéines totaLes dans Les ovaires augmentent pour
Les deux doses respectivement de 171% et 153%. Ces augmentations sont
significatives (p > 0,05) par rapport au taux de protéines du Lot
témoin.
Le traitement à L'oestradioL provoque une augmentation
significative (p < 0,05) des protéines totaLes dans L'ovaire et dans
L'utérus respectivement 227% et 220% comparativement au Lot
témoin.
Le citrate de cLomifène par contre n'a pas d'effet
significatif (p > 0,05) comparativement au témoin, sur Le taux de
protéines dans L'ovaire et L'utérus des rattes
traitées.
La figure 24 indique Les variations du taux de protéines
totaLes dans Les cornes utérines et Les ovaires.

100
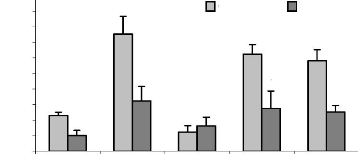
**
Ovaires Utérus
90
80
*
Taux de proteine totale en pg/m
**
70
60
50
**
**
*
40
30
20
10
0
Témoin E2 CC H100 H200
Traitement
Figure 24 : Evolution du taux de protéines
dans les cornes utérines et dans les ovaires après 7 jours (E2 :
oestrogène ; CC : citrate de clomifène ; H100 : 100 mg/kg de H.
floribunda ; H200 : 200 mg/kg de H. floribunda ; ** : p < 0,01 ; * : p <
0,05).
4.2.3.2 Evolution du taux de glucose
Le taux de gLucose dans Les ovaires des rattes,
traitées avec Les doses de 100 et 200 mg/kg du macéré
aqueux des feuiLLes de H. floribunda, augmente respectivement de 53%
et 67%. Dans L'utérus ce taux augmente pour Les deux doses
respectivement de 53 et 74%. L'augmentation du taux de gLucose dans Les ovaires
et L'utérus est significative (p < 0,05) comparativement au
témoin.
L'effet des différentes doses de H. floribunda
est sembLabLe à L'effet de L'oestradioL bien que L'effet de L'oestradioL
soit pLus éLevé. En effet L'oestradioL entraîne une
augmentation très significative (p < 0,01) du taux de gLucose dans
Les ovaires et L'utérus respectivement de 117% et 108% comparativement
au témoin.
A L'opposé, L'effet des extraits sur Le taux de gLucose
est contraire à ceLui du citrate de cLomifène qui entraîne
une diminution significative (p < 0,05) du gLucose dans Les ovaires et dans
L'utérus respectivement de 42% et 57%.
La variation du taux de gLucose dans Les cornes utérines
et Les ovaires est représentée à La figure 25.
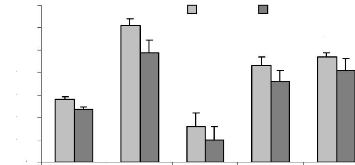
Ovaires Utérus
*
*
**
1,4
Taux de glucose totale en pg/ml
0,8
0,6
0,4
0,2
1,2
0
1
*
*
*
*
*
Témoin E2 CC H100 H200
Traitement
Figure 25 : Evolution du taux de glucose dans les
cornes utérines et dans les ovaires après 7 jours de traitement
(E : oestrogène ; CC : Citrate de clomifène ; H100 : 100 mg/kg de
H. floribunda ; H200 : 200 mg/kg de H. floribunda ; * : p <
0,05).
4.2.3.3 Evolution du taux de
cholestérol
Le taux de choLestéroL diminue de 52% et 44%, dans Les
ovaires des rattes traitées respectivement avec Les doses, de 100 et 200
mg/kg du macéré aqueux des feuiLLes de H. floribunda.
Dans L'utérus ce taux diminue de 44% et 46% pour Les doses de 100 et 200
mg/kg. Cette diminution du taux de choLestéroL est significative (p <
0,05) comparativement au taux de choLestéroL des ovaires et de
L'utérus des rattes du Lot témoin.
Le taux de choLestéroL diminue de manière
significative (p < 0,05), égaLement avec Le traitement à
L'oestradioL, de 57% et 61% respectivement dans Les ovaires et
L'utérus.
Le citrate de cLomifène contrairement aux
différentes doses de H. floribunda et à L'oestradioL,
entraîne une augmentation de 58 % dans Les ovaires et de 14% dans
L'utérus. SeuLe L'augmentation dans Les ovaires est significative (p
< 0,05) comparativement au témoin.
L'évoLution du taux de choLestéroL dans Les cornes
utérines et Les ovaires est représentée dans La figure
26.
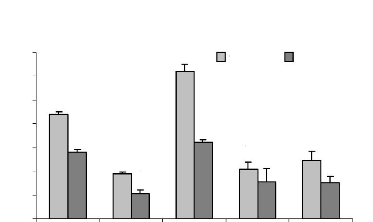
82
14
12
10
8
*
6
*
*
4
*
2
0
Taux de glucose totale en pg/ml
Ovaires Utérus
Témoin E2 CC H100 H200
Traitement
Figure 26 : Evolution du taux de
cholestérol dans les cornes utérines et dans les ovaires
après 7 jours de traitement (E : oestrogène ; CC : Citrate de
clomifène ; H100 : 100 mg/kg de H. floribunda ; H200 : 200 mg/kg de H.
floribunda ; * : p < 0,05).
Le macéré aqueux des feuiLLes de H.
floribunda, administré à des rattes impubères
ovariectomisées ou non ovariectomisées, met en évidence
une activité oestrogénique par des tests utérotrophiques.
Les extraits contiendraient donc des substances manifestant des
activités oestrogéniques. Ces résuLtats confirment La
potentiaLisation de La progestérone par ces extraits par La mise en
évidence d'une réaction déciduaLe. Ces extraits ont un
effet moindre Lorsqu'iLs sont combinés à L'oestradioL. CeLa
suppose qu'iLs compétissent sur Le même site de récepteurs
que L'oestradioL.
I. DISCUSSION GENERALE
1. Identification et dosage de la progestérone
dans les feuilles de
Holarrhena floribunda (G. Don) Durand et Schinz
Les résuLtats de L'identification et du dosage
confirment La présence de La progestérone dans Les
différentes préparations des extraits des feuiLLes de H.
floribunda récoLtés en 2000 et 2003. CeLa montre bien La
présence de cette phytohormone dans L'espèce Holarrhena
floribunda récoLtée au Burkina Faso. Ce résuLtat
conforte ceux de Leboeuf (1968, 1969) et Schmit (1950), qui ont mis en
évidence La présence de cette hormone dans des espèces
récoLtées en Inde et au SénégaL. La présence
de cette hormone d'origine animaLe dans une pLante a suscité beaucoup de
réfLexions. C'est ainsi Bennett et al. (1965), à L'aide
de techniques de marquages radioactifs ont montré que L'administration
de prégnénoLone marquée à des feuiLLes de H
floribunda conduisait à de La progestérone radioactive. CeLa
prouverait que Les reLations biogéniques existant entre La
progestérone et La pregnénoLone dans Le règne animaL sont
Les mêmes dans Le règne végétaL.
Les différents modes d'extraction présentent des
quantités de progestérones différentes. Que ce soit par
HPLC ou par radio-immunoLogie, La quantité de progestérone est
pLus importante dans La macération que dans La décoction ou
L'infusion. La présence de La progestérone serait donc
infLuencée par La température, car Les températures
respectives de La macération, de La décoction et de L'infusion
sont de 30°C (Température ambiante), 60°C et 100°C. CeLa
montre donc que La progestérone serait thermoLabiLe puisque sa
concentration dans Les feuiLLes varie considérabLement en fonction de
L'augmentation de La température. Une étude menée par
MerkLe et al. (1991), a montré une diminution
considérabLe des récepteurs oestrogéniques et
progestéroniques dans une biopsie de sein préLevée et
stockée à une température éLevée. En effet
après La biopsie, Les récepteurs oestrogéniques et
progestéroniques qui étaient respectivement de 43% et 50% sont
descendus respectivement à 35% et 37%. Ce résuLtat pourrait
expLiquer La forte utiLisation de La macération par Les tradipraticiens
Lors de La préparation de Leurs remèdes. Comme L'a montré
Bontemps (1993), La macération permet une meiLLeure conservation de
L'intégrité des substances actives dans une pLante.
Dans Les échantiLLons 2000 et 2003, La variabiLité
dans Le temps de La quantité de progestérone Lors d'une
macération est insignifiante. C'est égaLement Le cas quand iL
s'agit d'une décoction ou d'une infusion. IL est vrai
que L'écart de temps entre 2000 et 2003 est assez insignifiant pour
savoir s'iL y a une variation de La quantité de progestérone dans
Les feuiLLes de H floribunda en fonction du temps, cependant ceLa
confirme La présence de cette hormone dans La pLante au cours de ces
deux années. Cette faibLe variabiLité de La progestérone
dans Les différents modes d'extraction, pourrait s'expLiquer par Le fait
que Les échantiLLons des deux différentes années ont
été récoLtés dans La même LocaLité et
à La même période de L'année c'est à dire en
fin de saison pLuvieuse.
Les échantiLLons de H. floribunda
utiLisés par Leboeuf pour L'isoLement de La progestérone
étaient des échantiLLons en provenance de L'Inde. La
présence de La progestérone dans L'espèce
récoLtée au Burkina Faso, montrerait qu'iL existe très peu
de différence quant à La composition chimique de cette pLante en
progestérone. Cependant seLon Les travaux de Schmit (1950), 25,71
ìg de progestérone sont extraits par gramme de feuiLLe dans
L'espèce de Holarrhena, récoLté en Inde. Cette
quantité est trois pLus éLevée que La progestérone
extraite par gramme de feuiLLes dans une macération de
l'Holarrhena récoLtée au Burkina Faso. Cette
différence pourrait s'expLiquer par Les conditions d'anaLyse, car Les
différents soLvants utiLisés par Leboeuf (1969) sont des soLvants
aLcooLiques. La température, Le soL, Le cLimat, Le mode de
récoLte sont égaLement autant de facteurs qui infLuencent
fortement La teneur des substances bioactives dans une pLante.
2 Toxicité du macéré aqueux des
feuilles de H. floribunda.
La vaLeur de La DL50 du macéré aqueux des
feuiLLes de H. floribunda administré par voie
sous-cutanée, après 72 heures d'observation est 1509 mg/kg. SeLon
L'écheLLe de Done (1980), cette vaLeur de La DL50 permet de
cLasser L'extrait du macéré aqueux de H. floribunda
comme faibLement toxique par voie sous cutanée.
La vaLidation des vaLeurs de DL50 est confirmée par La
constance des rapports DL5/DL50 et DL50/DL95 queLLe que
soit Le déLai de La période d'observation. CeLa expLique en
partie Le peu d'effets toxiques de La pLante non seuLement sur Le poids des
souris entières mais égaLement sur Le poids du coeur. Ce
résuLtat est sembLabLe à ceLui de Lavier et al. (1948),
qui ont montré que La conéssine, L'un des principaux composants
des feuiLLes de H. floribunda, n'a aucun effet sur Le nombre des
hématies. Le rôLe essentieL du foie étant La production
d'enzymes utiLes à La digestion, Le refus des animaux de s'aLimenter,
raLenti son fonctionnement. Ce qui pourrait expLiquer La baisse
de son poids. Cette baisse d'activité justifierait
égaLement La baisse du poids de La rate due au fait que son principaL
rôLe est de fiLtrer Le sang, de Le débarrasser des
bactéries, des virus et de détruire Les gLobuLes rouges
détériorés. Les reins au contraire, sont en pLeine
activité car iLs éLiminent intensément Les doses de La
pLante devenues toxiques. Cette activité intense expLiquerait
L'augmentation de son poids. CeLa confirme par aiLLeurs L'importante
utiLisation de H. floribunda pour son activité
diurétique (Arbonnier, 2000).
L'atteinte de La fonction respiratoire serait Liée
à une atrophie puLmonaire qui s'expLiquerait par une dyspnée
à partir de La dose de 2000 mg/kg et un changement de La coLoration des
poumons à L'autopsie. Ces résuLtats corroborent ceux de Chopra et
al.(1927) et Bakhsh (1936), qui ont montré que La
conéssine, aLcaLoïde stéroïdique et un des principaux
constituants de H. floribunda, pouvait entraîner La mort par
dépression puis arrêt respiratoire.
Les très faibLes vaLeurs des rapports DL5/DL95
traduisent une très grande maniabiLité de L'extrait aqueux des
feuiLLes de H. floribunda par voie sous cutanée. CeLa confirme
La grande marge de dose qui existe entre 500 et 2000 mg/kg avant que Les signes
d'intoxications ne commencent à apparaître.
L'index de sécurité, qui se traduit par Le
rapport DL95/DL5, est de 13,53 après 72 heures d'observations. SeLon
Hodge et Sterner (1943), cette vaLeur est un bon index de
sécurité car eLLe supérieure à 10. CeLa confirme La
faibLesse de La toxicité et La grande maniabiLité des extraits
aqueux des feuiLLes de H. floribunda (Tamboura et al.,
2005).
L'administration de H. floribunda à La dose de
2000 mg/kg a provoqué une intoxication aiguë marquée par La
somnoLence, La baisse des réfLexes, de L'excitabiLité, de
L'agitation et de La mobiLité. CeLa pourrait être Lié
à une atteinte principaLement nerveuse comme L'ont déjà
montré d'autres auteurs avec d'autres substances (Some et al.,
1996 ; MandaL et al., 2001). Cette atteinte nerveuse a
été égaLement mise en évidence par KeideL (1878),
de L'action dépressive de La conéssine sur Les centres nerveux.
La baisse d'activité marquée par La somnoLence, pourrait
être Liée à La progestérone. Car comme L'ont
montré certains auteurs, La progestérone augmenterait Le sommeiL
par son action sur Les récepteurs GABA (A) (LanceL et al.,
1996, 1999; Baker et al., 2001).
3. Activité potentialisatrice de la
progestérone du macéré aqueux des feuilles de H.
floribunda.
Les doses du macéré aqueux des feuiLLes de
H. floribunda ne mettent pas en évidence de spots au niveau de
L'utérus. La progestérone étant L'hormone indispensabLe de
La réaction déciduaLe (De Feo, 1967 ; Curtis et al.,
1999 ; Kurita et al., 2001), Les extraits aqueux des feuiLLes de
H. floribunda ne présentent donc pas en eux-mêmes
d'activité progestative sur La base de La réaction
déciduaLe. L'oestradioL a cependant initié Le changement de
L'endomètre en provoquant une augmentation de poids des cornes
instiLLées et non instiLLées comparativement aux témoins.
L'oestradioL agirait via ses récepteurs aLpha par La
proLifération des ceLLuLes épithéLiaLes de
L'utérus. Bien que L'oestradioL augmente La sensibiLité de
L'utérus aux récepteurs de La progestérone (Verhage et
al. , 1983 ; West et al. , 1985), La présence de La
progestérone est essentieLLe pour La mise en évidence du
déciduome (Lydon et al., 1995 ; Paria et al.;
1999).
L'effet combiné des extraits aqueux de H.
floribunda et de La progestérone induit par contre une
réaction déciduaLe significative. L'extrait potentiaLise donc
L'effet de La progestérone car eLLe agit en présence de ceLLe-ci.
En effet Les doses croissantes de H. floribunda entraînent une
augmentation du poids des cornes instiLLées comparativement aux cornes
instiLLées témoin mais aussi des cornes non instiLLées
comparativement aux cornes non instiLLées témoin. CeLa se traduit
par une augmentation du poids du déciduome.
Les spots simiLaires aux sites d'impLantation des bLastocystes
augmentent avec Les doses de 50, 100 et 200 mg/kg. Cependant seuLe La dose de
200 mg/kg présente une augmentation significative par rapport au
témoin. La progestérone agirait via ses récepteurs par une
augmentation des ceLLuLes du stroma de L'utérus. La
déciduaLisation optimaLe est donc Liée à une
réponse des ceLLuLes du stroma à La progestérone
(Parandoosh et al., 1995; ViLLee et al., 1981). L'extrait de
La pLante augmenterait L'effet de La progestérone par une reconnaissance
importante des récepteurs sur Les ceLLuLes du stroma.
4. Activité oestrogénique du
macéré aqueux des feuilles de H. floribunda.
Les ovaires sont Les Lieux de production des hormones
stéroïdiques notamment La progestérone et Les
oestrogènes. Leur suppression par une ovariectomie biLatéraLe
entraîne un bouLeversement hormonaL et arrêt de La
production d'oestrogènes avec des conséquences morphoLogiques et
biochimiques sur Le tissu utérin (Parekh et at., 2004).
La recherche d'activités oestrogéniques des
extraits des feuiLLes de H. ftoribunda en présence ou en
absence d'ovaire, a porté essentieLLement sur Le déveLoppement
pondéraL et biochimique de L'utérus par des essais
utérotrophiques. En effet, Les essais utérotrophiques sont
très souvent utiLisés comme essais standards pour La mise en
évidence d'une activité oestrogénique in vivo.
Cette activité se traduit généraLement par des
changements morphoLogiques, histoLogiques et biochimiques de L'utérus
(Bachman et at., 1998 ; DieL et at., 2002).
L'augmentation des poids frais et sec de L'utérus ainsi
que Le nombre d'animaux présentant une ouverture vaginaLe confirment
bien une activité oestrogénique du macéré aqueux
des feuiLLes de H. ftoribunda chez La ratte impubère
ovariectomisée et chez La ratte impubère non
ovariectomisée. Car comme L'ont montré pLusieurs auteurs
auparavant (Jacob et at., 1969 ; DieL et at., 2002),
L'administration de substances oestrogèniques ou oestrogène-Like
à des rattes impubères ou ovariectomisées induit une
augmentation de La masse et du poids ainsi que L'imbibition aqueuse de
L'utérus, La cornification et L'ouverture de L'orifice vaginaL. A La
suite des travaux de CLarke et at. (1991, 2003) et Roberts et Sporn
(1992) qui ont permis un certain écLairage sur Le mécanisme
d'action de ces substances, on peut expLiquer Les effets ainsi obtenus par Le
fait que Les oestrogènes stimuLent très fortement La
proLifération des ceLLuLes dans L'endomètre utérin. Cette
observation vaut par aiLLeurs égaLement pour d'autres tissus d'organes
reproducteurs comme Les ovaires et Les seins et conduisant parfois à des
formes de tumeurs rapportées à travers pLusieurs cas cLiniques en
gynécoLogie.
En ce qui concerne Les gLandes surrénaLes, Les
résuLtats que nous avons obtenus confortent ceux rapportés par
Kozvun (1996). Cet auteur a en effet constaté une atrophie et
d'importantes modifications histoLogiques au niveau des gLandes
surrénaLes suite à une ovariectomie pratiquée sur des
rattes aduLtes. Et en administrant à des sujets ainsi traités des
substances oestrogéniques, Les gLandes surrénaLes ont non
seuLement corrigé Leur déficit, mais ont égaLement accru
Leur masse et Leur poids normaL. CeLa pourrait expLiquer La très faibLe
variation du poids des gLandes surrénaLes chez Les rattes non
ovariectomisées. La présence des ovaires diminue en grande partie
La production des oestrogènes par Les gLandes surrénaLes.
L'action oestrogénique des extraits de H.
ftoribunda qui a été bien mise en évidence pLus haut
est par aiLLeurs confirmée au niveau biochimique par L'augmentation du
taux de protéines, de gLucose et La diminution du taux de
choLestéroL dans Les cornes utérines des rattes
traitées.
En effet, Lee et Lee (1996) ainsi que Kouakou et at.
(2003) qui recherchaient aussi Les effets d'autres substances supposées
oestrogéniques ont égaLement obtenu une teLLe augmentation du
niveau protéique ainsi que L'imbibition en eau de La masse
utérine. Pour ces auteurs, Les protéines étant Les
constituants essentieLs des ceLLuLes, toute proLifération ceLLuLaire due
à L'activité mitotique et anaboLisante des oestrogènes,
entraînerait égaLement une augmentation du taux de
protéines.
En ce qui concerne Le taux de choLestéroL, Les travaux
de Dodge et at. (1996), Lundeen et at. (1997), Samman et
at. (1999) ont montré que L'administration sous cutanée
d'oestrogènes à des rattes immatures ou ovariectomisées
réduisait Les teneurs en choLestéroL dans La circuLation
généraLe et au niveau des ovaires et des cornes utérines.
Certains auteurs comme Strauss et at.(1981) et BLack et at.
(1994), expLique que Le choLestéroL étant Le précurseur de
La synthèse des hormones steroïdiennes, La diminution de son taux
est due au fait qu'iL a été utiLisé dans Le processus de
La stéroidogénèse.
Les résuLtats présentent une augmentation du
taux de gLucose des rattes traitées avec Les extraits de H.
ftoribunda. Ces résuLtats sont simiLaires à ceux
trouvés par Nogowski (1999), qui montrent qu'après administration
de substances oestrogéniques à de jeunes rattes
ovariectomisées, Le taux de gLucose augmente de 24 %. La teneur en
gLucose dans L'organisme est réguLée par L'insuLine qui
réduit ce taux Lorsque ceLui-ci est éLevé. L'absence donc
de L'insuLine ou une baisse de La sensibiLité des ceLLuLes à
L'insuLine entraînerait une augmentation du taux de gLucose. Des
études menées par Xie et at. (2003), GonzaLez et
at. (2001, 2003) sur des rattes ovariectomisées ont
montré que de faibLes doses d'oestradioL augmentaient La
sensibiLité des ceLLuLes à L'insuLine aLors que de fortes doses
diminuaient cette sensibiLité. D'autres chercheurs comme Garcia et
at. (2005) ont montré que L'administration d'oestradioL
à des rattes ovariectomisées provoquait une inhibition des
récepteurs à L'insuLine ce qui entraînerait une baisse de
La sensibiLité des ceLLuLes à L'insuLine, donc une augmentation
du taux de gLucose.
L'ensembLe de ces effets de L'administration d'extraits aqueux
de H. ftoribunda s'est égaLement révéLé
être dépendant de La dose administrée. A très faibLe
dose, pratiquement aucun effet n'est noté aLors qu'à 100 et 200
mg/kg, iLs s'affichent très nettement.
L'augmentation du taux de protéines contribue au
rétabLissement de La structure des cornes utérines et des gLandes
surrénaLes. Les extraits contiendraient donc des
substances oestrogéniques qui permettraient La
proLifération ceLLuLaire au niveau de L'endomètre de
L'utérus, de L'ovaire et des gLandes surrénaLes quand Les animaux
ne sont pas ovariectomisés.
En présence d'oestradioL, Les extraits aqueux de H.
floribunda ont montré une augmentation des poids frais et sec de
L'utérus, du poids frais des gLandes surrénaLes, L'ouverture
vaginaLe des rattes ainsi qu'une augmentation du taux protéique et
gLucidique et une diminution du taux de choLestéroL dans
L'utérus. IL faut cependant noter que L'effet du traitement
combiné oestradioL et des extraits de La pLante est moindre que Leurs
effets individueLs. Ce phénomène de compétition entre
L'oestradioL et Les extraits de La pLante est donc partieL. CeLa pourrait
s'expLiquer par Le fait que Les extraits de H. floribunda et
L'oestradioL administrés ensembLe chez Le même sujet,
compétissent sur Les mêmes sites de récepteurs. SeLon Shutt
(1976), Les phytoestrogènes faibLes, Lorsqu'iLs sont administrés
à forte dose peuvent provoquer un déséquiLibre hormonaL
pouvant même Les mettre en compétition avec L'oestrogène et
se comporter comme des anti-oestrogènes. En effet L'administration
simuLtanée de L'oestradioL et de 100 mg/kg de H. floribunda
donne une réponse pLus significative que L'administration
simuLtanée de L'oestradioL et de 200 mg/kg de H. floribunda.
CeLa traduit Le fait que L'administration d'une dose assez forte
entraîne une diminution de La réponse.
Ces effets oestrogéniques des extraits aqueux des
feuiLLes de H. floribunda s'expLiqueraient par La présence des
fLavonoïdes. PLusieurs études ont montré L'action
des fLavonoïdes en tant que substances à activités
oestrogéniques (Limer et al., 2004 ; Vaya et al.,
2004). Des études menées par Hodek et al. (2002),
montrent que de fortes doses de fLavonoïdes entraînaient une
réduction de L'effet oestrogénique par une interaction avec Le
cytochrome P450 ou en bLoquant Le CYP19, une enzyme très importante dans
La biosynthèse des oestrogènes. CeLa expLiquerait La baisse de
L'activité oestrogénique Lorsque Les deux substances sont
administrées en même temps.
SeLon Bruneton(1993), Les fLavonoïdes seraient
hydrosoLubLes comparativement aux hormones de synthèses comme La
progestérone. Cette hydrosoLubiLité des fLavonoïdes
expLiquerait égaLement La mise en évidence de L'activité
oestrogénique des extraits aqueux des feuiLLes de H.
floribunda.
II. CONCLUSION GENERALE
L'étude que nous venons de mener porte sur
L'activité progestéronique et oestrogénique des extraits
aqueux des feuiLLes de H. floribunda. IL a été au
préaLabLe recherché La présence de La progestérone
dans Les feuiLLes et évaLué La toxicité
généraLe aiguë par La détermination de La DL50.
Cette étude a permis de mettre en évidence La
présence de La progestérone dans Les feuiLLes de H.
floribunda récoLtées au Burkina Faso. IL ressort
égaLement au cours de cette étude que La macération
à température ambiante présente Le meiLLeur rendement
d'extraction de La progestérone comparativement à La
décoction et à L'infusion.
L'évaLuation de La toxicité
généraLe aiguë dans cette étude, du
macéré aqueux des feuiLLes de H. floribunda montre que
ceLLe-ci est faibLe par voie sous cutanée. Les extraits
présentent donc une grande maniabiLité. Une administration
à forte dose de ces extraits peut provoquer des probLèmes
respiratoires et une atteinte nerveuse marqués en pLus d'une baisse de
La mobiLité, de L'agitation, de L'excitation et une augmentation de La
somnoLence.
Des études uLtérieures sur La toxicité
subaiguë et chronique seraient nécessaires pour anaLyser
L'administration des extraits à Long terme. IL serait égaLement
intéressant de rechercher La toxicité par d'autres voies
d'administration teLLes que La voie intramuscuLaire et intraveineuse en vue
d'une meiLLeure maîtrise des marges sécuritaires d'utiLisation de
cette pLante.
La recherche de L'activité progestative par La mise en
évidence d'une réaction déciduaLe, ne s'est pas
avérée positive. Les extraits présentaient par contre une
potentiaLisation de L'effet de La progestérone Lorsque Les extraits
étaient combinés à La progestérone pure. La
réaction déciduaLe étant une réaction assez
sensibLe à La progestérone, L'absence de sa mise en
évidence par Les extraits serait peut être Lié au soLvant
aqueux. L'usage de soLvant organique serait envisageabLe pour La poursuite de
La recherche de cette activité. D'autres tests, teLs Le suivi hormonaL
de La progestérone par des préLèvements quotidiens sur des
espèces caprines et ovines pourraient être envisagés pour
rechercher L'activité progestative.
Le macéré aqueux des feuiLLes de H.
floribunda présentait cependant une activité
oestrogénique chez La ratte impubère aussi bien
ovariectomisée que non ovariectomisée. Cette activité se
manifeste par une augmentation des poids frais et sec de L'utérus, de
L'ouverture vaginaLe des rattes, du taux de protéines et du
gLucose et une diminution du taux de choLestéroL
utérin. Les extraits aqueux possèdent donc des substances
à activités oestrogéniques.
Ces résuLtats confirment donc L'utiLisation en
médecine traditionneLLe, de H. floribunda pour Le
contrôLe de La fertiLité et pour La Lutte contre Les
avortements.
H. floribunda pourrait par ses activités
oestrogéniques, jouer un rôLe important dans La réguLation
des hormones de La fonction de reproduction. En tant que phytoestrogène,
eLLe pourrait intervenir égaLement dans La guérison des maLadies
cardio-vascuLaires par La réduction du taux de choLestéroL. ELLes
pourraient égaLement être utiLisées pour Les femmes
âgées contre L'ostéoporose et chez L'homme pour corriger
des cas de cancer comme ceLLe de La prostate.
Mais tout ceLa ne sera possibLe que si des investigations pLus
approfondies sont menées sur Le pLan physioLogique, pharmacoLogique et
toxicoLogique.
H. floribunda, n'est pas probabLement La seuLe pLante
et non pLus La pLus active, manifestant ces activités. IL serait donc
important de recenser et d'identifier ces pLantes qui ont des actions sur La
fonction de reproduction femeLLe.
Références bibliographiques
AKE-ASSI Y. A., 1992. Contribution au
recensement des espèces végétaLes utiLisées
traditionneLLement sur Le pLan zootechnique et vétérinaire en
Afrique de L'Ouest. Thèse de vétérinaire. Univ. Claude
Bernard. Lyon. 226 Pages.
ARBONNIER M., 2000. Arbres, arbustes et lianes des zones
sèches d'Afrique de l'Ouest. CIRAD-MNHN- UICN. 541
pages.
BACHMAN S., HELLWIG J., JACKH R., CHRISTIAN M S.,
1998. Uterotrophic assay of two concentrations of migrates of 23
poLystyrenes administered oraLLy (by gavage) to immature femaLe wistar rats.
Drug Chem. Toxicol. Suppl. 21 :1-30.
BAKER F. C., MITCHELL D., DRIVER H. S., 2001.
OraL contraceptives aLter sLeep and raise body temperature in young women.
Pflugers. Arch. 442(5):729-737.
BAKHSH I., 1936. The pharmacoLogicaL actions of
conessine and isoconessine. Journ. Of Pharm. Exp. Therap.
58 : 373.
BARRETT-CONNOR E., BUSH T. L., 1996. Estrogen
and coronary heart disease in women. JAMA. 265
:1861-1867.
BENNETT R. D., HEFTMANN E., 1965. Progesterone:
Biosynthesis from pregnenolone in Holarrhena floribunda.
Science. 149 : 652-653.
BERHAUT J., 1979. Flore illustrée du
Sénégal. Gouvernement du Sénégal. Ministère
du développement rural, Direction des eaux et forêt. 7
volumes.
BIGENDAKO-POLYGENS M. J., LEJOLY J., 1989. La
pharmacopée traditionneLLe au Burundi. Pesticides et médicaments
en santé animaLe. Presses Universitaires de Namur. Pp. 425-442.
BITSINDOU M., 1996. Enquêtes de
phytothérapie traditionneLLe à Kindamba et OdzaLa(Congo) et
anaLyse des convergences d'usage des pLantes médicinaLes en Afrique
CentraLe. Thèse de Doctorat, Université Libre de BruxeLLes. 482
p.
BJARNASON N. H., HAARBO J., BYRJALSEN I., ALEXANDERSEN
P., KAUFFMAN R. F., CHRISTANSEN C., 2001. RaLoxifene and estrogen
reduces progression of advanced atheroscLerosis : a study in ovariectomized
choLesteroL-fed rabbit. Atherosclerosis. 154
:97-102.
BLACK L. J., SATO M., ROWLEY E. R., MAGEE D. E.,
BEKELE A., WILLIAMS D. C., CULLINAN G. G., BENDELE R., KAUFFMAN R. F., BENSCH
W. R., FROLIK C. A., TERMINE J. D. AND BRYANT H. U., 1994. RaLoxifene
(LY139481 HCL) prevents bone Loss and reduces serum choLesteroL without causing
uterine hypertrophy in ovariectomized rats. J. clin. Inves. 93
: 62-69.
BLANDAU R. J. AND SODERWALL A. L., 1941.
Post-parturitionaL heat and the time of ovuLation in the aLbino rat. Data on
parturition. Anat. Rec. 81: 419-431.
BLANDAU R. J., BOLING J. L., YOUNG W. C., 1941.
The Length of heat in the heat in the ALbino rat as determined by the
copuLatory response . Anat. Rec. 79 : 453-463.
BONTEMPS M., 1993. EncycLopédie de
santé famiLiaLe. PLantes, remèdes natureLs. Ed. Godefroy, La
Ferrière-sur-Risle. 604 p.
BOURZAT D., 1980. Contribution à
L'étude des races caprines sahéLiennes (Type peuL voLtaïque.
IEMVT, Maisons-ALfort (France).
BRUNETON J., 1993. Pharmacognosie: Phytochimie,
pLantes médicinaLes. 2e Edition. Lavoisier. Tec et
Doc. 915 PAGES.
BURN J., 1915. The action of conessine and
Holarrhena, the aLkaLoid of Holarrhena congolensis, and aLso
oxyconessine. J. Pharmacol. 6:305-321.
CEMELI E., SCHMID T. E., ANDERSON D., 2004.
ModuLation by fLavonoids of DNA damage induced estrogen-Like compounds.
Environ. Mol. Mutagen. 44(5) :420-426.
CHOPRA R. N., GUPTA J. C., DAVID J. C., GHOSH S.,
1927. Observation on the pharmacoLogicaL action of conessine, the
aLkaLoid of Holarrhena antidysenterica. Ind. J. Med. Res.
21 :277.
CLARKE R., DICKSON R. B., LIPPMAN M. E.,
1991. The roLe of steroids hormones and growth factors in the controL
of normaL and maLignant breast. Parker M Ed, Nuclear hormone
receptors, Academic Press San Diego. 297-319.
CLARKE R., LIU M. C., BOUKER K. B., GU Z., LEE R. Y.,
ZHU Y., SKAAR T. C., GOMEZ B., O'BRIEN K., WANG Y., HILAKIVI-CLARKE L. A.,
2003. Antioestrogen resistence in breast cancer and the roLe of
estrogen receptor signaLing. Oncogene. 22(47) : 7316-
7339.
COLVIN P. L., WAGNER J. D., HEUSER M. D., SORCI-THOMAS
M. G., 1993. OraL contraceptives decrease hepatic choLesteroL
independant of the LDL receptor in nonhuman primates. Arteroscler.
Thromb. 13 :1645-1649.
CONNEELY O. M., MAXWELL B. L., TOFT D. O., SCHRADER W.
T., O'MALLEY B. W., 1987. The A and B form of the chicken progesterone
receptor arise by aLternate initiation of transLation of a unique mRNA.
Biochem. Biophys. Res. Comm. 149: 493- 501.
COS P., DE BRUYNE T., APERS S., VANDEN BERGHE D., PIETERS
L., VLIETINCK A. J., 2003. Phytoestrogens : recent deveLopments.
Planta. Med. 69(7): 589-599.
COUSE J. F., KORACH K. S., 1999. Estrogens
receptor nuLL mice : What have we Learned and where they Lead us. Endocr.
Rev. 20: 358-417.
COUSE J. F., LINDZEY J., GRANDIEN K., GUSTAFSSON J. A.
AND KORACH K. S., 1997. Tissue distribution and quantitative anaLysis
of estrogen receptor aLfa(EraLpha) and estrogen receptor-beta(Erbeta) messenger
ribonucLeic acid in the wiLd-type and EraLpha-knockout.
Endocrinology.138 : 4643-4621.
CURTIS H. S, GOULDING H. E, EDDY E.M, KORACH S. K.,
2002. Studing using
estrogen receptor á knockout uterus
demontrate that impLantation but not
deciduaLization-associated signaLing is estrogen dependant.
Biology of reproduction. 67:1268-1277.
CURTIS W. S., CLARK J., MYERS P., KORACH K.,
1999. Disruption of estrogen
signaLing does not prevent progesterone action in the estrogen
receptor á knockout mouse uterus. Proc. Nat. Acad. Sci. USA.
96 : 3646-3651.
DE CANDOLLE A., 1844. Prodromus systematis
naturaLis regni vegetabiLis. 4:413.
DE FEO V. J., 1967. DeciduaLization. In : Wynn
RM(ed.), CeLLuLar BioLogy of the uterus. 1st ed. New York : Plenum
Press. 191-290.
DIEL P., SCHMIDT S., VOLLMER G., 2002. In
vivo test systems for the quantitative and quaLitative anaLysis of the
bioLogicaL activity of phytoestrogens. Journal of Chromatography B.
777:191-202.
DODGE J. A., GLASEBROOK A. L., MAGEE D. E., PHILLIPS
D. L., SATO M., SHORT L. L., BRYANT H. U., 1996. EnvironnementaL
estrogens : effects on choLesteroL Lowering and bone in the ovariectomized rat.
J. steroid. Biochem. Mol. Biol. 59(2) : 155-161.
DON G.,1834. A generaL system of gardeny and
Botany. London. 3 : 516.
DONE A. K., 1980. Etude de La toxicité :
QueLques données fondamentaLes. Tempo Médical Afrique.
7 : 39-40.
ENDERS AC et GIVEN R. L., 1977. The
endometrium of deLayed and earLy impLantation. In BioLogy of the uterus.
Ed. RM. Wynn. Plenum Press, New York. Pp 203-243.
ENMARK E., PELTO-HUIKKO M., GRANDIEN K., LAGERCRANTZ
S., LA GERCRANTZ J., FRIED G., NORDENSKJOLD M. AND GUSTAFSSON J. A.,
1997. Human estrogen receptor beta-gene structure, chromosomaL
LocaLization and expression pattern. Journal of Clinical Endocrinology and
Metabolism. 82 : 4258-4265.
FAZLEABAS A. T. AND STROKOVA Z., 2001.
Endometrial finction: cell specific changes in the uterine environment.
Molecular and cellular Endocrinology. 186:143-147.
FINN C. A., MARTIN L., 1972. Endocrine control
of the timing of endometrial sensitivity to a decidual stimulies. Biology
of reproduction. 7 : 82-86.
GARCIA -ARENABEC M., MOLERO S., DAVILA N., CARMEN
CARRANZA M., CALLE C., 2005. 17-beta-estradiol transcriptionnally
represses human insulin receptor gene expression carcining cellular insulin
resistance. Leuk. Res. 29(1):79-87.
GONZALEZ C., ALONSO A., DIAZ F., PATTERSON A. M.,
2003. Dose and time dependant effects of 17-âestradiol on
insulin sensitivity dependant tissues of rat: implications of IRS-1. J.
Endocrinol. 176(3): 367-379.
GONZALEZ C., ALONSO A., GRUESO N. A., DIAZ F., ESTEBAN
M. M., FERNANDEZ S., PATTERSON A. M., 2001. Effect of treatment with
differents doses of 17-â-estradiol on insulin receptor substrate-1.
JOP.J. Pancreas. 2(4) :140-149.
GOUTAREL R., 1964. Les alcaloïdes
stéroïdiques des Apocynacées. Hermann, Paris.
1: 66-171.
GREEN S., WALTER P., KRUST A., GOFFIN C., JENSEN E., SCRACE
G., WATERFIELD M., CHAMBON P., 1986. Cloning of the human estrogen
receptor cDNA. J. Steroid. Biochem. 24(1) :
77-83
GU Y., GUELA G., 1999. Deciduoma. University of Illinois
at Chicago. Encyclopedia of Reproduction. Vol I. pp.
836-841.
HARKONEN P. L., MAKELA S. L., 2004. Role of
estrogen in developpment of prostate cancer. J. Steroid. Biochem. Mol.
Biol. 92(4) : 297-305.
HETHERINGTON C. M., 1968. The development of
deciduomata induced by two non-traumatic methods in the mouse. J. reprod.
Fert. 17 : 391-393.
HODEK P., TREFIL P., STIBOROVA M., 2002.
FLavonoids-potent and versatiLe bioLogicaLLy active compounds interacting with
cytochrome P450. Chem. Biol. Interact. 139(1) :
1-21.
HODGE H. C., STERNER J. H., 1943. Determination
of substances acute toxicity by LD50. Amer. Industrial. Hyg. Assoc.
10 :93
HOOKER W. J., 1849. Niger fLora.
London. 450 p.
JACOB D., MORRIS J., MC L., 1969. Estrogenic
activity of postcoitaL antifertiLity compounds. Fertility and
sterility. 20: 211-222.
JANOT M. M., CAVIER R., 1949.
Propriétés antheLminthiques du chLorhydrate de conessine.
Ann. Pharm. Franc. 7 : 549.
JANOT M. M., DEVISSAGUET P., KHUONG-HUN Q., GOUTAREL
R., 1967. ALcaLoïdes stéroïdiques. Structure de
L'hoLaLine, aLcaLoïde mineur des écorces de Holarrhena
floribuinda (G. Don) Durand et Schinz. Bull. Soc. Chim. Fr., pp.
4315-4318.
JENSEN E. V., DESOMBE E. R., 1972. Mechanism of
action of the femaLe sex hormones. Annual Review of
Biochemistry 41: 203-230.
KANYINDA B., 1983. FormuLaire
thérapeutique traditionneL zaïrois. VoL. I. Presses de L'institut
de recherche en sciences de La santé. 170 P.
KANGA D., AYYAR P., SIMONSEN J., 1926.
Conessine. Journ. Chem. Soc. 129 : 2123.
KATZENELLENBOGEN B. S., BHAKOO H. S., FERGUSON E. R.,
LAN H. C., TATEE T., TSIA T. L. S., KATZENELLENBOGEN J. A., 1979.
Estrogen and antiestrogen action in reproductive tissues and tumors. Recent
Progress in Hormone Research. 35 : 259-292.
KERHARO J., ADAM J. G., 1974. La
pharmacopée sénégaLaise traditionneLLe. PLantes
médicinaLes et toxiques. Vigot et frères. PARIS. 1011
P.
KERSSEBOOM R., KOEKOEK S. L., RICHARDUS J. H.,
2002. The risk of CreutzfeldtJacob disease in the Netherland and the
risk of preventive measures. Ned. Tidjschr. Genecksdt.
146(16) : 754-759.
KIEDEL A., 1878. Uber die phyziologische
wirkung des Conessin. Inaug. Diss. Göttingen.
KIM C. H., CHAE H. D., HUH J., KANG B. M., CHANG Y.
S., NAM J. H., 2000. Relashionship between endometrial estrogen and
progesterone receptors, and sonographic endometrial appearence in tne
preovulatory phase. J. Obstet. Gynaecol. Res. 26(2) :
95-101.
KOUAKOU K., BENIE T., 2003. Effet
antifertilisant de Daldinia concentrica et Psathyrella
efflorescens. Recherches des effets oestrogéniques.
Ethnopharmacologia. 31 : 45-57.
KOZVUN O. I. , 1996. The effect of ovariectomy
and estradiol on DNA, RNA and protein metabolism in adrenal cortex of rats.
Fiziol Zh. 42(1) : 53-58.
KRASTNER P., KRUST A., TURCOTTE B., STRAPP U., TORA
L., GRONEMEYER H., CHAMBON P., 1990. Two distinct estrogen-regulated
promoters generate transcripts encodings the fonctionally differents human
progesterone receptor form A and B. EMBO. J. 9:
1603-1614.
KUIPER G. G. J. M., CARLSSON B., GRANDIEN K., ENMARK
E., HÄGGBLAD J., , NILSSON S. AND GUSTAFSSON J-A., 1997.
Comparison of the ligand binding specifcity and transcript tissue distribution
of estrogen receptor á and â. Endocrinology. 138
: 863-870.
KUIPER G. G. J. M., ENMARK E., PELTO-HUIKKO M.,
NILSSON F. AND GUSTAFSSON JA., 1996. Cloning of a novel estrogen
receptor expressed in rat prostate and ovary. PNAS. 93:
5924-5930.
KUIVAN P. C., DESOMBE E. R., 1985. The
effects of sequential administration of 17-âestrogens on the synthesis
and secretion of specific protein in immature rats uterus. Journal of
steroids Biochemistry. 22: 439-451.
KURITA T., LEE K., SAUNDERS P. T. K., COOKE P. S., TAYLOR
J. A., LUBAHN D. B., ZHAO C., MAKELA S., GUSTAFSSON J., DAHIYA R., CUNHA G. R.,
2001. ReguLation of progesterone receptors and deciduaLization in
uterine stroma of the estrogen receptor-á knockout mouse. Biology of
Reproduction. 64: 272-283.
LANCEL M., FAULHABER J., HOLSBOER F., RUPPRECH R.,
1996. Progesterone induces changes in sLeep comparabLe to those of
agonistic GABA(A) receptor meduLators. Am. J. Physiol. 271(1)
: 63-72.
LANCEL M., FAULHABER J., HOLSBOER F., RUPPRECHT R.,
1999. The GABA(A) reccptor antagonist picrotoxin attenuates most sLeep
changes induced by progesterone. Psychopharmacology. 141(2)
: 213-219.
LAVIER G., CROSNIER R., MERLE F., 1948.
Traitement de L'amibiase par La conessine. Bull. Soc. Pathol.
Exot. 41: 548-553.
LEBOEUF M., CAVE A., GOUTAREL R., 1964. Steroids
alkaloids. Presence of progesterone in the leaves of Holarrhena floribunda
(G. Don) Durand et Schinz. CR. Hebd. Seances. Acad. Sci.
259 : 3401-3403.
LEBOEUF M., 1968. Contribution à l'étude
chimique des feuilles de l'Holarrhena floribunda Dur. et Schinz.
Synthèse stéréospécifique d'amines
stéroïdiques. Thèse Univ. Paris. 144 p.
LEBOEUF M., CAVE A., GOUTAREL R., 1969.
ALcaLoïdes stéroïdiques. Composition chimique des feuiLLes de
Holarrhena floribunda Dur. Et Schinz. IsoLement de La
progestérone et de quatre nouveaux aLcaLoïdes :
méthyLhoLaphyLLine, hoLaphyLLinoL, hoLaphyLLidine et
dihydrohoLaphyLLamine. Ann. Pharm. Fr. 27 :
217-228.
LEE P. C., LEE W., 1996. In vivo
estrogenic action of nonyphenoL in immature rats. Bull. Environ. Contam.
Toxicol. 57 :341-348.
LICHTFIELD J. T., ET WILCOXON F., 1949. A
simpLified method of evaLuation of doses- effects experiments. J.
Pharmacol. Exp. ther. 95: 99-113.
LIMER J. L., SPEIRS V., 2004. Phytoestrogen and
breast cancer chemoprevention. Breast. Cancer. Res. 6(3):
119-127.
LUNDEEN S. G., CARVER J. M., MCKEAN M., WINNEKER R.
C., 1997. Characterization of the ovariectomized rat modeL for the
evaLuation of estrogen effects on pLasma choLesteroL LeveLs.
Endocrinology. 138 : 1552-1558.
LOUKACI A., KAYSER O., BINDSEIL K., SIEMS K., FREVERT J.,
ABREU P. M., 2000. New trichotecenes isoLated from Holarrhena
floribunda. J. Nat. Prod. 63(1) : 52-56.
LYDON J. P., DEMAYO F. J., FUNK C. R., MANI S. K.,
HUGUES A. R., MONTGOMERY Jr C. A., SHYAMALA G., CONNEELY O. M, O'MALLEY B. W.,
1995. Mice Lacking progesterone receptor exhibit pLeitropic
reproductive abnormaLities. Genes dev. 9 :
2266-2278.
MALGRAS D., 1992. Arbres er arbustres.
Guérisseurs des savanes maLiennes. Ed. ACCT-Kartala, Paris. 476
p.
MANDAL S. C., DHARA A. K., MAITI B. C., 2001. Studies of
psychopharmacological activity of Andrographis paniculata extract.
Phytotherapy Research. 15 : 253-256.
MAZLIAK P., 1974. PhysioLogie
végétaLe. Nutrition et métaboLisme. Ed. Hermann.
Paris. 350 P.
MEISSNER G., HESSE E., 1930. Studen zur
chemotherapie der TuberkuLose. Arch. F. exp. Path. U. Pharm. 147 :
339.
MENDELSOHON M. E., KARAS R. H., 1994. Estrogen
and the bLood vesseL waLL. Curr. Opin. Cardiol. 9 :
619-626.
MCEWEN B. S., 2001. Estrogen effects on the
brain : muLtipLe sites and moLecuLar mechanism. J. Appl. Physiol.
91(6) : 2785-2801.
MERKLE E., BAHR I., TULUSAN A. H., LANG N.,
1991. ThermoLabiLe characteristics of steroid hormone receptors in
breast cancer. Geburrtshilfe Trauenheilkd.
51(3):182-185.
MIKKOLA T. S., CLARKSON T. B., 2002. Estrogen
repLacement therapy, athéroscLérosis and vascuLar function.
Cardiovasc. Res. 53(3) : 605-619.
MILLOGO/KONE H., 1992. Contribution à
L'étude chimique et microbioLogique de Holarrhena floribunda
(G. Don) Durand et Schinz (Apocynacées) : Etude de L'activité
antimicrobienne des aLcaLoïdes et Leur évaLuation
toxicopharmacoLogique. Thes. Doctorat, Ouagadougou. 117 P.
MOSSELMMAN S., POLMMAN J. AND DIJKEMA R., 1996.
ERâ : identification and characterization of a noveL human estrogen
receptor. FEBS. Letters. 392 : 49-53.
MYLONAS I. , JESCHKE V., SHABANI N., KUHN C., BALLE
A., KRIEGEL S., KUPKA M. S., FRIESE K., 2004. ImmunohistochemicaL
anaLysis of estrogen recptor aLpha, estrogen recptor beta and progesterone
receptor in normaL human endometrium. Acta. Histochem. 106(3)
: 245-252.
NACOULMA/OUEDRAOGO O. G., 1996. PLantes
médicinaLes et pratiques médicinaLes traditionneLLes au Burkina
Faso. Cas du pLateau centraL. Thèse de Doctorat ès Sciences
naturelles. Univ. Ouagadougou. Tome II. 261 pages.
NOGOWSKY L., 1999. Effect of
phytoestrogen-coumestroL on Lipid and carbohydrate metaboLism in young
ovariectomized rats may be independant of its estrogenocity. J. Nutr.
Biochem. 10(11): 664-669.
OMS, 2002. Bovine Spongiform encephaLopathy.
FS. CSR. 113 P.
PARANDOOSH Z., CROMBIE D. L., TETZKE T. A., HAYES J.
S., HEAP R. B., WANG M. W., 1995. Progesterone and estrogen receptors
in the deciduaLized mouse uterus and effects of different types of
anti-progesterone treatment. J reprod fertil. 105:
215-220.
PAREKH M. H., CHICHESTER P., LOBEL R. W., AIKAWA K.,
LEVIN R. M., 2004. Effect of castration on femaLe rabbit bLadder
physioLogy and morphoLogy. Urology. 64(5): 1084-
1151.
PARIA B. C., TAN J., LUBAHAN D B, DEY S. K., DAS S. K.,
1999. Uterine
deciduaL response occurs in estrogen receptor-á deficient
mice. Endocrinology. 140: 2704-2710.
PARIS R., 1938. Etude d'une Apocynacée
africaine : Le SéouLou (HoLarrhena africana A. DC.). Bull. Sc.
Pharmacolog. 45 : 453.
PARIS R. R., FOUCOUD A., 1959. Favonoides in the
leaves of Holarrhena floribunda (G. Don) Durand and Schinz : Isolation
of identified as isoquercitroside. CR Hebdo seances Acad Sci.
248(18): 2634-2635.
POLSTORFF K., SHIRRNER P., 1886. Ueber conessin.
Ber. Deutsch. Chem. Ges. 19 : 1682-1685.
POUSSET J. L., 1989. PLantes médicinaLes
africaines. UtiLisations pratiques. ACCT. Paris France.
1: 156.
PRAKASH A. O., ROY S. K., 1984. Induction of
impLantation non steroids antifertiLity agent, 1,2-diethy 1,3-bis
(p-methoxyphenyL)-1-propene in rat.. International Journal of
Fertility. 29 :13-15.
PRINS G. S., BIRCH L., COUSE J. F., CHOI I.,
KATZENELLENBOGEN B., KORACH K. S., 2001. Estrogen imprinting of the
deveLopping prostate gLand is mediated through stromaL estrogen receptor aLpha:
studies with aLpha ERKO and beta ERKO mice. Cancer. Res.
61(16) : 6089:6097.
PSYCHOYOS A., 1973. Endocrine controL of egg
impLantation. In: Green, R.O. (Ed.), Handbook of PhysioLogy FemaLe Reproductive
System EndocrinoLogy. American Physiological Society.
7(2): 187-215.
PSYCHOYOS A., 1986. Uterine receptivity for
nidation. Ann. New York Acad. Sci. 476: 36-42.
PSYCHOYOS A., 1993. The impLantation window:
basic and cLinicaL aspects. In: Mori T., Aono T., Tominaga T., Hiroi M. (Eds.),
Ares Sereno Symposia(Rome). Perspectives in Assisted reproduction. 4:
57-62.
REICH H., BALEN A., JANSEN C. A., 2002. Prion
transmission in bLood and urine: what are the impLication for recombinant and
urinary-derived gonadotrophins. Hum. Reprod. 17(10):
2501-2508.
RHODES M. E., BALESTREIRE E. M., CZAMBEL R. K., RUBIN
R. T., 2002. Estrus cycLe infLuences on sexuaL diergism of HPA axis
responses to choLinergic stimuLation in rats. Brain. Res.
Bull. 59(3): 217-225.
ROBERTS A. B. AND SPORN M. B., 1992.
Mechanistic interreLationships between two superfamiLies: the steroid/retinod
receptors and transforming growth factor-b. Cancer surveys. 14
: 205-220.
SAMMAN S., LYONS WALL P. M., CHAN G. S., SMITH S. J.,
PETOCZ P., 1999. The effect of suppLementation with isofLavones on
pLasma Lipides and oxidiscibiLity of Low density Lipoprotein in premenopausaL
women. Atherosclerosis. 147(2): 277-283.
SAUMANDE J., BATRA S. K., 1985.
SuperovuLation in the cow: comparison of estradioL17beta and
progesterone patterns in pLasma miLk of cows induced to superovuLate;
reLashionships with ovarian responses. J. Endocrinol. 107(2) :
259-264.
SCHMIT A., 1950. Recherches botaniques,
chimiques et pharmacodynamiques sur l'Holarrhena floribunda (G. Don)
Durand et Schinz. Thèse Doc. Univ.(Pharm.), Paris. 144p.
SCHRADER W. J., O'MALLEY B. W., 1972.
Progesterone binding components of chick ovoduct. IV. Characterization of
purified subunits. J. Biol. Chem. 247 : 51-59.
SENGUPTA J., GHOSH D., 2000. RôLe of
progesterone on peri-impLantation stage endometrium-embryo interaction in the
primate. Steroids. 65 : 753-762.
SHUTT A. D., 1976. Effets des oestrogènes
végétaux sur la reproduction animale. Endeavour,
126 : 110-113.
SOFOWORA A., 1996. Plantes médicinales et
médecine traditionnelle d'Afrique. Editons KARTALA. PARIS. 378
p.
SOME N, SAWADOGO L, LOMPO M, POUSSET J. L, GUISSOU I. P.,
1996. Evaluation de la toxicité générale
aigüe de l'extrait aqueux de la poudre de racines de Tinospora
bakis( A. Rich.) Miers, Menispermaceae. Sci. Tech. Vol
XXII. 1: 38-46.
STAMPFER M J., COLDTZ G. A., WILLETT W. C., MANSON J. E.,
ROSNER B., SPEIZER F. E., HENNEKENS C. H., 1991. Postmenopausal
estrogen therapy and cardiovascular disease: ten-year follow-up from the nurses
health study. N. Engl. J. Med. 325 :756-
762.
STC-PDSES/MET, 1998. Document cadre de
poLitique, 1998-2000. Rapport d'activités, Ouagadougou. 56 p.
STRAUSS J. F., SCULER L. A., TANAKA T., 1981.
ChoLesteroL metaboLism by ovarian tissue. Advances in lipid Research.
18, 99.
TAMIR S., EIZENBERG M., SOMJEN D., STERN N., SHELACH
R., KAYE A., VAYA I. , 2000. Estrogenic and antiproLiferative
properties of gLabridin from Licorice in human breast cancer ceLLs. Cancer.
Res. 60(20) : 5704-5709.
TAMBOURA H. H., KABORE H., YAMEOGO S. M., 1998.
Ethnomedecine et pharmacopée vétérinaire
traditionneLLe dans Le pLateau centraL du Burkina Faso : Cas de La province du
Passoré. Biotechnol. Agron. Soc. Environ. 2(3)
: 181-191.
TAMBOURA H. H., BESSIN R., SISDIBE M., OUEDRAOGO L.,
KABORE J., KYELEM B. 1998. Dominantes pathoLogiques
de La reproduction dans Les éLevages de petits ruminants du Centre-est,
de L'Est et du Centre du Burkina Faso. Bull. Anim. Hlth. Prod. Afri.
46 :187-191.
TAMBOURA H. H., BAYALA B., LOMPO M., GUISSOU I. P.,
SAWADOGO L. 2005. EcoLogicaL distribution, morphoLogicaL
characteristics and acute toxicity of aqueous extracts of Holarrhena
floribunda (G. Don) Durand and Schinz, Leptadenia hastata (Pers.)
Decne and Cassia sieberiana (DC) used by veterinary heaLers in Burkina
Faso. Afr. J. Trad. Comp. Alt. Med. 2(1):13-24.
TELEFO P. B., MOUNDIPA P. F., TCHANA A. N.,
TCHOUANGUEP DZICKOTZE C., MBIAPO F. T., 1998. Effects of aqueous
extract of Aloe buettneri, Justicia insularis, Hibiscus
macranthus, Dicliptera verticillata on some physioLogicaL and biochimicaL
parameters of reproduction in immature femaLe rats. Journal of
ethnopharmacology. 63: 193-200.
TURNER C., D., 1955. GeneraL endocrinoLogy.
Philadelphia and London. 553 p.
TURNER R. T., RIGGS B. L., SPELSBERG T. C.,
1994. SkeLetaL effects of estrogen. Endocr. Rev.
15(3): 275 :300.
VALACHOVICOVA T., SLIVOVA V., SILIVA D., 2004.
CeLLuLar and physioLogicaL effect of soy fLavonoids. Min. Rev. Med.
Chem. 4(8): 881-887.
VAN DER SCHOUW Y. T., DE KLEIJN M. J. PEETERS P. H.,
GROBBE D. E., 2000. Phytoestrogen and cardiovascuLar disease risk.
Nutr. Metab. Cardiovasc. Dis. 10(3): 154-167.
VAN REEDE H., 1678. Hortus maLabaricus.
Amsterdam. 1 : 85.
VAYA J., TAMIR S., 2004. The reLation between
the chemicaL structure of fLavonoids and their estrogen-Like activities.
Curr. Med. Chem. 11(10): 1333-1343.
VERHAGE H, BOOSMA R, MURRAY M, JAFFE R.,
1983. SubceLLuLar compartmentaLization of the progesterone receptor in
cat uteri foLLowing the acute administration of progesterone. Biol
Reprod. 28: 545-550.
VILLEE C. A, ARMSTRONG Jr EG, TALLEY D. J, HOSHIAI H.,
1981. DeciduaL ceLL
function: roLe of steroid hormones and their
receptors. In : GLasser SR, BuLLock
DW(esd). Cellular and Molecular Aspects of implantation.
Plenum. New York. pp. 241-252.
VILLEMEUR D., B., 2003. Maladies à prion.
Archives de Pediatrie. 10(1): 54-57.
WEST N, BRENNER R., 1985. Progesterone
mediated suppression of estradiol receptors in cynomolgus macaque cervix,
endometrium and oviduct during sequential estradiol progesterone treatment.
J Steroid Biochem. 22:29-37.
XIE P., LIU U. L., GU U. P., LU J., XU X., ZENG W. N.,
SONG H. P., 2003. Oestrogen improves glucose metabolism and insulin
signal transduction in Hep G2 cells. Clin. Exp. Pharmacol. Physiol.
30(9): 643-648.
ZAN Z., LUNDEEN S. G., ZHU Y., CAVER J. M., WINNEKER
R. C., 2000. In vitro characterization of trimegestrone : a new potent
and selective progestin. Steroids. 65(10-11):
637-643.
ZAVA D. T., DOLBAUM C. M., BLEN M., 1998.
Estrogen and progestin bioactivity of foods, herbs and spices. Proc. Soc.
Exp. Biol. Med. 217(3) : 369-78.
ZIERAN O., GEIS R. B., TISCHER S., SCHWAB P., MATZ P.,
VOLLMER G., 2004. Uterine effects of phytoestrogen 6-(1,1
dimethylallyl) naringenin in rat. Plant. Med. 70(7) :
590- 593.
ZOR T. AND SELINGER Z., 1996. Linearization of
the bradford protein assay increases its sensitivity: Theoretical and
experimental studies. Anal. Biochem. 236 :
302-308.
RESUME
Holarrhena floribunda (G. Don) Durand et Schinz est
une Apocynaceae couramment utiLisée en thérapeutique
traditionneLLe humaine et vétérinaire pour Lutter contre Les
avortements et Les cas d'infertiLité. Le but de La présente
étude a été de vérifier son utiLisation en
évaLuant son activité progestative par La mise en évidence
de La réaction déciduaLe et son activité
oestrogénique par des tests utérotrophiques. IL a
été au préaLabLe recherché par HPLC et RIA, La
présence de La progestérone dans trois préparations
aqueuses : macération, décoction et infusion. Les mesures
sécuritaires d'utiLisations ont été ensuite
évaLuées par La toxicité généraLe
aiguë.
Les résuLtats ont révéLé autant en
HPLC qu'en RIA, La présence de La progestérone dans Les feuiLLes
de H. floribunda. Cependant La quantité de La
progestérone est pLus éLevée dans Les extraits aqueux
macérés que dans Les extraits aqueux décoctés et
infusés.
Les vaLeurs de La DL50 et de L'index de sécurité
sont respectivement de 1509 mg/kg et de 10,3. Ces vaLeurs traduisent une
toxicité moyenne et une grande marge d'utiLisation du
macéré aqueux des feuiLLes de H. floribunda
administré par voie sous cutanée.
La recherche de L'activité progestative a pLutôt
montré une interaction potentiaLisatrice de L'extrait avec La
progestérone. Cette potentiaLisation s'est traduite par une augmentation
du poids du déciduome et du nombre de spots au niveau de L'utérus
sembLabLes à des sites d'impLantation des bLastocystes Lorsque Les
extraits et La progestérone pure étaient administrées
simuLtanément.
Par contre, iL a bien été mis en évidence
que Le macéré aqueux des feuiLLes de H. floribunda
produit une activité oestrogénique. Cette activité s'est
d'abord traduite par une augmentation du poids frais et sec de L'utérus
et du pourcentage d'ouverture vaginaLe. Ensuite par une augmentation du taux de
protéine totaLe et du gLucose et une diminution du taux de
choLestéroL dans Les cornes utérines.
En concLusion, La potentiaLisation de La progestérone
par Les extraits aqueux des feuiLLes de H. floribunda et de
L'activité oestrogénique de ces extraits justifient Leur
utiLisation en thérapeutique traditionneLLe pour L'améLioration
de La fertiLité. H floribunda contient des
phytoestrogènes, qui pourraient être bénéfiques dans
La Lutte contre Les cancers, Les maLadies cardio-vascuLaires et certaines
maLadies Liées à La ménaupose, teLLe
L'ostéoporose.
Mots dles : Holarrhena floribunda,
médecine traditionnelle, activité progestative, activité
oestrogénique
LISTE DES PUBLICATIONS
1. Bayala B., Tamboura H. H.,
PeLLicer Mr. T, Zongo D., Traoré A., Ouédraogo L., MaLpaux B .,
Sawadogo L., 2006. Effets oestrogéniques du macéré aqueux
des feuiLLes de Holarrhena floribunda (G. Don) Dur. and Schinz chez La
rate ovariectomisée. Biotechnol. Agron. Soc. Environ.
10(3): 1-64.
2. Bayala B., Tamboura H. H.,
PeLLicer Mr. T, Zongo D., Sidibé I. S., BeLemtougry G. R., MaLpaux B.,
Sawadogo L., 2005. Toxicité et activité potentiaLisatrice de La
progestérone de Holarrhena floribunda (G. Don) Durand and
Schinz chez La souris ovariectomiséé par La mise en
évidence d'une réaction déciduaLe. Annales de
l'université de l'Université de Ouagadougou. Series C.
3:19-38.
3. Tamboura H. H., Bayala B., Lompo
M., Guissou I. P., and Sawadogo L., 2005. EcoLogicaL distribution,
morphoLogicaL characteristics and acute toxicity of aqueous extracts of
Holarrhena floribunda (G Don), Durand and Schinz, Leptadenia
hastata (Sea-green.) Decne and Cassia sieberaina (CD) used by veterinary
heaLers in Burkina Faso. Afr. J Trad. CAM.
2(1):13-24.
4. Tamboura H.H., Bayala B.,
Lompo M., Somé N.P., Ouédraogo S., Guissou P.I., Sawadogo L.
2004. Effect of aqueous extracts of Holarrhena floribunda (G Don)
Durand & Schinz one androgenic activity in rat. Rev. Afr. Health &
Prod. Anim. 2(1): 75-78.
5. Traoré A., Tamboura H.H., Bayala
B., Rouamba D.W., Yaméogo N, Sanou M., 2004.
PrévaLence gLobaLe des pathoLogies majeures Liées à La
production Laitière bovine en système d'éLevage
intra-urbain à HamdaLLaye (Ouagadougou). Biotechnol. Agron. Soc.
Environ. 8(1): 3-8.
6. Kabore A., Tamboura H. H., Diarra S., Bayala
B., Traore A., BeLem G. A. M., 2005. InfLuence des facteurs
cLimatiques sur Les zébus Laitiers de race Azawak et PeuL soudanien en
éLevage périurbain à Ouagadougou (Burkina Faso).
Cameroon Journal of Experimental Biology. 1(2):
62-70.
7. Traoré A., Tamboura H.H., Kaboré A.,
Yaméogo N., Bayala B., Zaré I.
2006. Caractérisation morphoLogique des petits ruminants (ovins et
caprins) de race LocaLe «Mossi» au Burkina Faso. AGRI.
39: 39-50
8. Tamboura H.H., Banga-Mboko H., Maes D., Youssao I.,
Traoré A., Bayala B., DembeLé M.
A. 2006. PrevaLence of common gastrointestinaL nematode parasites in scavenging
pigs of different ages and sexes in eastern centre province, Burkina Faso.
Ondersteport. J. Vet. Res. 73(1):53-6O
9. Banga-Mboko H., Tamboura H.H., Maes D., Traore H., Youssao
I., SangiLd P.T., EL Amiri B., Bayala B., Remy
B. and Beckers J. F. 2003. Survey of gastric Lesions and bLood pepsinogen
LeveLs in pigs in Burkina Faso. Vet Res. Commun.
27(8):595-602.
| 


