|
SOMMAIRE
SOMMAIRE
Erreur ! Signet non défini.
DEDICACE
iii
REMERCIEMENTS
iv
LISTE DES ABREVIATIONS
vi
LISTE DES FIGURES
viii
LISTE DES TABLEAUX
ix
RESUME
x
ABSTRACT
xi
INTRODUCTION
1
CHAPITRE I : REVUE DE LA LITTERATURE
5
I.1 Définition
6
I.2 Epidémiologie
6
I.3 Mode de transmission et facteurs de risque
7
I.4 Physiopathologie
8
I.4.1 Mécanismes cellulaires et
moléculaires
8
I.4.1.1 Physiologie cellulaire
8
I.4.1.2 Facteurs moléculaires de
virulence des agents pathogènes.
10
I.4.2 Conséquences physiopathologiques
10
I.5 Aspects cliniques
11
I.6 Investigations para cliniques
12
I.7 Les étiologies
13
I.7.1 Les virus
13
I.7.1.1 Les rotavirus
14
I.7.2.2 Les adénovirus
17
I.7.2.3 Autres virus
19
I.7.3 Les Parasites intestinaux
20
I.7.3.1 Protozooses
20
I.7.3.2 Helminthoses
23
I.7.4 Les Bactéries
26
I.8 Traitement
27
CHAPITRE II: MATERIEL ET METHODES
28
II.1 Schéma de l'étude
29
II.2 Site et période de l'étude
29
II.2.1 Ville de Bertoua
29
II.2.2 Période de l'étude
32
II.3 Population d'étude
32
II.3.1 Population source
32
II.3.2 Population cible
32
II.3.3 Taille de l'échantillon
32
II.3.4 Procédure
d'échantillonnage
33
II.4 Procédure de mise en oeuvre sur le
terrain.
33
II.5 Procédure de collecte des
données
34
II.5.1 Matériels
34
II.5.1.1 Pour la collecte des données
34
II.5.1.2 Pour le test virologique
34
II.5.1.3 Pour l'examen parasitologique
34
II.5.2 Méthodes
35
II.5.2.1 L'interrogatoire des parents ou
tuteurs
35
II.5.2.2 Le prélèvement et
l'examen biologique des selles
35
II.6 Le traitement des données.
39
II.7 Considérations éthiques
39
II.8 Activités et tâches des
membres de l'équipe de mise en oeuvre
40
II.9 Contrôle de qualité
40
II.10 Forces et limites de l'étude
40
CHAPITRE III: RESULTATS
41
III.1 Profil épidémiologique de
la diarrhée chez les enfants et données démographiques et
cliniques.
42
III.2 Examens biologiques des selles
44
III.4 Mesures d'associations
46
III.5 Devenir des enfants diarrhéiques
48
DISCUSSION
49
CONCLUSION ET RECOMMENDATIONS
54
REFERENCES BIBLIOGRAPHIQUES
57
ANNEXES
62
DEDICACE
A mes très chers parents :
feu ZANG Benoît,
MEZOU KANGA Françoise,
NDISAMETIEH Peter NJONWI
Et
MBIPEH Doris.
REMERCIEMENTS
La réalisation du présent ouvrage a connu le
soutien de plusieurs personnalités à qui nous devons une profonde
gratitude.
Premièrement nous devons tout à la
Grâce de L'Eternel Dieu et qu'à Lui seul soit la
gloire.
Nos remerciements sont ensuite adressés :
· A toutes les autorités du
département des Sciences Biomédicales de l'Université
de Dschang, plus particulièrement au chef de département
le Professeur MPOAME MBIDA et au coordonnateur le Professeur Pierre
WATCHO ;
· Au Docteur NOUBOM Michel, responsable de l'option
Biologie Clinique ;
· A tous les enseignants de Biologie Clinique à
savoir : monsieurs les Professeurs WABO PONE Josué, ZAMBOU N.
François, les Docteurs Maurice DEMANOU, MFOPOU SOULE, J. H. DONFACK,
NGANWA Grace, Florent JUTCHA,SANOU SOPZE M., ATEUDJIEU
Jérôme,TIMTCHUENG Moise,NGUEFACK TSAGUE, BOUTSING MAYAKA Georges,
NKENFOU Céline, et les autres ;
· Aux autorités de l'Hôpital Régional
de Bertoua, et particulièrement au Dr. NGUELE MEKE ;
· A tout le personnel des services d'Accueil et
Urgences, et de Pédiatrie de l'hôpital régional de
Bertoua et en particulier auxDocteurs ANAKEU T. A., MINKA OBAMA B.,
NTSASSOU J. C., NDONG ASSOKO, aux majors MATANG S., MBASSO ;
· A tout le personnel du Laboratoire l'Hôpital
Régional de Bertoua, et particulièrement au chef de service Mme
WOUATENDEM M.S., au major M. TAFILI Richard, et aux différents chefs
de paillasses ;
· à tous mes camarades de la deuxième
promotion du Département des Sciences Biomédicales, pour
leur chaleur et leur promptitude à se mettre au service les uns des
autres. Je pense à M. FOTSO Jimmy Roger, Mlle NGAKAM N. N., Mlle
NIMPA V. J., M. TENOH G. A., et la autres;
· à tous mes camarades de la deuxième
promotion de Biologie Clinique au Département des Sciences
Biomédicales ;
· à Mme MELATAGIA Odette, pour m'avoir
encadrée comme une mère durant tout mon séjour à
Dschang;
· au Pasteur Emmanuel NKENGFUA et son épouse,
pour leur soutien durant toute ma formation et dans toutes les
étapes de ma vie;
· à mes frères et soeurs :
Ignatius, Emmanuel, Enoch, Godlove, Aristide, Achille, Emile, Victor, Miracle
de Dieu, Rostand, Hilda, Emelda, Tatiana, Doris Leticia, Francine, Christiane,
Michelle, Florette, Annie, Marie-Noëlle, Mageolène, Sandrine,
Martine, Christelle, Gwendoline, Adèle et les autres ;
· A la famille NKAH qui m'a hébergée
pendant la recherche à Bertoua ;
· A PHANIE computer pour leur contribution à la
production de ce mémoire ;
· A Sébastien pour son aide dans la correction de
ce travail ;
· A tous mes amis, notamment : le Dr ANAKEU T.
Aurélien, AZING MENIA L., ABOMO Evelyne, Christelle-Harris, Dahlia,
Fleur, Corine, Fortune, Judith, Barbara, Bright, Nadia, Cédric, Blaise,
Lucien, James, Steve et les autres ;
· A mes frères et soeurs en Christ pour leurs
prières;
· A papa MPOAME MBIDA pour ses conseils et son
soutien ;
· A mes parents pour leur soutien constant dans tous les
domaines.
LISTE DES ABREVIATIONS
AdV: Adénovirus
CNPS : Caisse Nationale de Prévoyance Sociale
CPN : Consultation prénatale
D2HO : Déshydratation
ddl : degré de liberté
EDS-MICS : Enquête Démographique et de Santé
et à Indicateurs Multiples
ENIEG : Ecole Normale d'Instituteurs d'Enseignement General
ENIET : Ecole Normale d'Instituteurs d'Enseignement
Technique
Env: Enveloppe
ET : Ecart-type
G.l.: Giardia lambia
Gag: Gène de l'antigène de groupe
GAPPD : Plan d'action mondial intégré pour la
prévention et la lutte contre la pneumonie et la diarrhée
GE : Gastro-entérite
H.n.: Hymenolepis nana
IC : Intervalle de confiance
ICT : Technique d'immunochromatographie
J3 : Troisième jour
J7 : Septième jour
K.O.A.P.: Kystes, OEufs, Amibes, Parasites
ME : Microscopie électronique
MINSANTE : Ministère de la Santé Publique
NSP : Protéine non structurale
OMS : Organisation mondiale de la Santé
PEV : Programme Elargi de Vaccination
Pol: Polymérase
Rev: Regulator of viral protein expression
RV: Rotavirus
S.s.: Strongyloïdesstercoralis
SRO: Solution de Réhydration Orale
T.i.: Trichomonas intestinalis
Tat: Transactivator
TRO: Thérapie de Réhydratation par voie Orale
UNICEF : Fond des Nations Unis pour l'Enfance
Vif: Virion infectivity factor
VIP : Vaso-active intestinal peptide
VP : Protéine virale
Vpr: Viral protein R
Vpu: Viral protein U
WHO: World Health Organization
x² : Chi-carré
LISTE DES FIGURES
Figure 1: Incidence des maladies
diarrhéiques selon l'âge
3
Figure 2: Cycle de transmission des virus
responsables des gastroentérites
7
Figure 3: Répartition des Rotavirus dans le
monde.
14
Figure 4: Sérotypes du rotavirus
16
Figure 5: morphologie d'un Adenovirus
18
Figure 6: Giardia lambia : a-
trophozoïte, b - kyste
21
Figure 7: Trophozoïte de Trichomonas
intestinalis.
22
Figure 8: Hymenolepis nana: a- oeuf
observe dans les selles ; b- ver adulte
23
Figure 9: Strongyloïdes stercoralis :
a- Larves rhabditoïdes, b- OEuf; observés dans les selles.
25
Figure 10: Localisation de la ville de Bertoua
31
Figure 11: District de santé de Bertoua
31
Figure 12: Photos des échantillons de selles
et kits pour le test de rotavirus et adénovirus
38
Figure 13: Photos montrant les différents
résultats possibles avec le test après lecture.
39
Figure 14: Répartition des causes des
diarrhées en fonction des tranches d'âge.
45
LISTE DES TABLEAUX
Tableau 1: Principaux symptômes
observés en fonction du mécanisme et de l'étiologie des
diarrhées aiguës.
3
Tableau 2 : Critères
d'appréciation de l'état de déshydratation.
12
Tableau 3: Principaux motifs de consultation des
enfants de moins de 5 ans.
42
Tableau 4: Caractéristiques
démographiques et cliniques des enfants.
43
Tableau 5: Récapitulatif des
résultats des examens parasitologiques et virologiques pour les 63 cas
de diarrhée étudiés.
44
Tableau 6: Effet des caractéristiques
sociodémographiques sur la survenue de la diarrhée chez les
enfants.
44
Tableau 7: Effets du type d'alimentation sur les
causes de la diarrhée.
12
RESUME
Introduction : la diarrhée est définie par
l'émission de selles trop fréquentes, trop abondantes, de
consistances anormales (liquides ou très molles). Environ deux milliards
de cas de diarrhée sont recensés dans le monde chaque
année et 2.5 million d'enfants de moins de 5 ans meurent de
diarrhée annuellement. La plupart survenant dans les pays en voie de
développement.
Objectif : C'était celui
d'évaluer l'implication des virus et de certains parasites
entériques dans la survenue des diarrhées chez les enfants de
moins de 5 ans à l'hôpital régional de Bertoua à
l'Est du Cameroun.
Méthodologie :Il s'agit d'une
étude descriptive transversale menée pendant 03 mois à
l'Hôpital Régional de Bertoua. Des échantillons des selles
ont étés recueillis chez les enfants de moins de 5 ans en
consultation pour diarrhée et analysés au laboratoire, à
la recherche d'éventuels agents pathogènes viraux et
parasitaires. La recherche des antigènes viraux dans les selles
était faite au moyen de tests immunochromatographiques (Kit Vikia
Rota-Adéno bio Mérieux) et les parasites étaient
recherchés grâce à un examen direct de selles : Kystes,
OEufs, Amibes, Parasites (K.O.A.P.) au microscope optique.
Résultats : Au
total, 63 enfants âgés de 1 à 48 mois ont
étés recrutés et la moyenne d'âge était de
15,49#177;11,39 mois. La tranche d'âge de 0-11mois (47,7%) était
prédominante par rapport à celles de 12-24 mois (31,1%) et 25-59
mois (14,13%). Nous avons noté une étiologie infectieuse virale
et parasitaire globale de 71,43% (45/63) : soit 53,97% (34/63) virale, et
22,22% (12/63) parasitaire. Les Rotavirus (47,6%) étaient
prédominants contrairement aux Adénovirus (14,3%), et les
Protozoaires (14,3%) étaient plus fréquents que les Helminthes
(7,9%). Dans la tranche d'âge de 0 à 11 mois,
l'étiologie de la diarrhée était en faveur des Rotavirus
(66,7%) ; mais les Protozoaires et Helminthes étaient plus
présents dans la tranche d'âge de 12 à 60 mois (64,29%).
Par ailleurs, nous avons noté des coïnfections virales et
parasitaires au taux de 11,11%. Parmi les enfants enroulés dans cette
étude, 44,44% recevaient une alimentation diversifiée.
Conclusion et recommandations : Les virus
principalement Rotavirus sont donc à prendre en compte dans les
étiologies de la diarrhée dans cette région du pays. Cette
diarrhée, qu'elle soit virale ou parasitaire, augmente le risque de
mortalité chez l'enfant. Une meilleure prise en charge de ces
affections passerait par la mise en place de services dédiés au
diagnostic, à la prise en charge et à la surveillance de ces
maladies l'ensemble des centres de santé de référence du
pays.
MOTS CLES : Rotavirus,
Adénovirus, diarrhée, parasites entériques, Hôpital
Régional de Bertoua.
ABSTRACT
Introduction:Diarrhea is defined by a frequent and
abundant emission of saddles with abnormal consistency (liquid or very
soft).Approximately two billion cases of diarrhea are listed in the world each
year and 2.5 million children of less than 5 years die of diarrhea annually.The
majority occurring in developing countries.
Objective: The main objective of this study
was to evaluate the implication of viruses and some enteric parasites in
occurring of diarrhea in children of less than 5 years at the Bertoua regional
hospital, in the East of Cameroun.
Methodology: It was a descriptive cross
sectional study undertaken for 03 months. Samples of saddles were collected
from children of less than 5 years in consultation for diarrhea and analyzed at
the laboratory in search of possible viral and parasitic pathogenic agents.The
research of the viral antigens in the saddles was made by means of
immunochromatographictests (Kit Vikia Rota-Adéno bio Mérieux) and
a direct examination of saddles under an optical microscope was used for the
search of parasites (Cysts, Eggs, Amoebas, Parasites:K.O.A.P.).
Results: A total of 63 children aged from 1
to 48 months were recruited into the study, and the average age was 15,
49#177;11, 39month. The0-11 months age group was the most frequent (47, 7%)
compared to the 12-24 months (31,1%) and 25-59 months age groups. We noted a
viral and parasitic global infectious etiology of 71, 43% (45/63), 53, 97%
(34/63) of them were viruses, and 22, 22% (12/63) parasites. Rotavirus (47, 6%)
were more frequent contrary to Adenovirus (14, 3%), and the Protozoa (14, 3%)
were more frequent than the Helminths (7, 9%).In the 0 to 11 months age group,
the etiology of the diarrhea was in favour of Rotavirus (66, 7%);but Protozoa
and Helminths were more present in the 12 to 60 months age group (64,29%).In
addition, we noted a viral and parasitic coïnfections at the rate of 11,
11%.Among the children involved in this study, 44, 44% received a diversified
feeding.
Conclusion and recommendations: The viruses
mainly Rotavirus are thus to be taken into consideration in the etiologies of
diarrhea in this area of the country. This diarrhea, be it viral or parasitic,
increases the risk of mortality in the child. Abetter management of these
affections could be done through the installation of diagnosis, caring and
monitoring services of these diseases all the reference health centers of the
country.
KEY WORDS: Enteric parasites, Rotavirus,
Adenovirus, diarrhea, Bertoua Regional Hospital.
INTRODUCTION
Le diagnostic de diarrhée aiguë est retenu s'il y
a une émission de selles trop fréquentes, trop abondantes, de
consistance anormale (liquides ou très molles), et de poids
supérieur à 300g/j. En pratique clinique et selon l'OMS, on parle
de diarrhée lorsqu'il y a au moins trois selles très molles et/ou
liquides par jour. Une diarrhée est dite aiguë lorsqu'elle
évolue depuis moins de 2 semaines.
Selon le rapport de l'Organisation mondiale de la santé
(OMS) et l'UNICEF en 2013, environ deux milliards de cas de diarrhée
sont recensées dans le monde chaque année et 2.5 (18% des
décès d'enfants de moins de 5 ans) million d'enfants de moins de
5 ans meurent de diarrhée annuellement, pour la plupart dans les pays en
voie de développement. Ce qui veut dire que plus de 5000 enfants meurent
chaque jour en raison de diarrhées. Selon les données
épidémiologiques disponibles, les entérites virales sont
la cause la plus fréquente des diarrhées aigües chez
l'enfant de moins de 18 mois. Dans le monde, le rotavirus est l'agent
étiologique le plus courant des diarrhées les plus
sévères. Il ôte la vie à plus de 450 000 enfants
chaque année. Il est en outre responsable de 30 à 40 % des
hospitalisations pour gastroentérites dans le monde (OMS, 2012 ; TATE et
al, 2012). La mortalité par déshydratation reste
élevée, principalement dans les pays en voie de
développement où surviennent 82 % des quelques 440 000 à
600 000 décès annuels dus au rotavirus (MATHIE et al,
2006). A côté du rotavirus on peut aussi citer l'Adénovirus
qui est une des causes les plus fréquentes d'infections nosocomiales se
traduisant par une diarrhée aiguë apparaissant chez les enfants
hospitalisés pour une autre cause. Il est répandu dans le monde
entier et cause des affections graves chez les nourrissons et les jeunes
enfants, les infections se produisent tout au long de l'année sans
périodes de flambée précises (MATHIE et al,
2006). Dans les régions tropicales, et à un degré bien
moindre dans les pays tempérés, certains parasites peuvent
être à l'origine d'authentiques poussées de
diarrhées aiguës. Parmi les protozoaires on peut citer :
Cryptosporidium, Entamoebahistolytica, Balantidium coli, Isospora
belli. Cependant, l'infestation massive et aiguë à Giardia
lambliapeut donner des épisodes brutaux de diarrhée
aiguë mais aussi des épisodes de selles liquides plus
marqués sur un fond de diarrhée chronique. Ces troubles de
transit plus ou moins aigus ont été décrits en
présence des helminthes comme Ascaris lombricoïdes,
Trichuristrichiura, Strongyloïdesstercoralis, Necatoramericanusou de
formes adultes d'Ancylostoma duodénale.
Parmi tous les décès d'enfants pour cause de
diarrhée, 78% se produisent en Afrique et dans le Sud-est de l'Asie.
Chaque enfant de moins de 5 ans souffre en moyenne de trois épisodes de
diarrhée aigüe par année. Pour ce groupe d'âge, on
peut dire que globalement la diarrhée aigüe représente la
deuxième cause de décès après la pneumonie (UNICEF,
2012 ; OMS, 2012) et que l'incidence et le risque de mortalité dus
à la diarrhée sont les plus grands chez les enfants de ce groupe
d'âge, en particulier pendant la petite enfance et par la suite, les
taux diminuent progressivement (WGOGG, 2012).
Le Cameroun n'est pas en reste car, les maladies
diarrhéiques restent encore un problème de santé publique
en raison de leur prévalence qui est de 21% pour les enfants de 0
à 59 mois (EDS-MICS, 2011). Ellesy demeurent l'une des maladies
infantiles les plus meurtrières, car elles sont responsable d'environ
13% des décès d'enfants de moins de cinq ans (EDS-MICS, 2011). le
rotavirus tue plus de 5 800 enfants de moins de cinq ans chaque année,
et environ 33 % de toutes les hospitalisations dues aux diarrhées chez
ceux-ci sont également causées par ce virus (PATH, 2014). Une
étude menée à Yaoundé dans la région du
Centre rapporte une incidence de microbes entériques pathogènes
de 85,3% chez les enfants de moins de 5 ans, et précise que 70 à
90 % de ces étiologies étaient virales (NGUM et al,
2010). Cette étude souligne également que 32.8% de des
diarrhées étaient dues au Rotavirus. Les espoirs de diminuer le
lourd fardeau des infections à Rotavirus pour les enfants de moins de 5
ans dans le pays reposent sur l'utilisation du vaccin antirotavirus
(rotarix®), introduit depuis Mars 2014 dans le Programme Elargie de
Vaccination (PEV). Par ailleurs, lesrôlesde l'Adénovirus et de
certains parasites intestinaux dans la survenue des diarrhées
aiguës apparaissant chez les enfants dans le pays n'est pas à
négliger. Pendant qu'une étude menée à Douala dans
le Littoral incriminait l'adénovirus dans 43.1% des cas de
gastroentérites chez les enfants de moins de 5 ans (MOGTOMO et
al, 2008), une autre étude menée à Yaoundé
a notée une incidence de 6.6% des diarrhées à
Adénovirus (NGUM et al, 2010). Une étude menée à
Barombi dans le SUD-OUEST rapportait une prévalence des parasites
entériques de 42,5% chez les enfants, et une autre étude
effectuée à Douala indiquait une prévalence de 39,22% des
parasites entériques dans la population en général (LEHMAN
et al, 2012).
L'hypothèse selon laquelle les Rotavirus occupent la
première placeparmi les étiologies des maladies
diarrhéiques chez les enfants de moins 5 ans à l'hôpital
régional de Bertoua, nous a conduite à réaliser cette
étude. Car, quoique citées parmi les principales causes de
diarrhées de l'enfant, les infections à Rotavirus,
Adénovirus et Parasites entériques n'y avaient pas encore fait
l'objet d'étude permettant d'évaluer leur prévalence chez
les enfants de moins de 5 ans. Or, la mise en évidence du rôle
majeur des infections à Rotavirus, Adénovirus et parasites
entériques dans la survenue des diarrhées ces derniers,
conduirait à cibler le type d'intervention le mieux approprié
pour la prise en charge correcte des diarrhées de l'enfant à
l'Est du Cameroun en général, et à l'hôpital
régional de Bertoua en particulier.
D'une manière générale il était
question pour nous lors de cette étude d'évaluer l'implication
des virus (Rotavirus et Adénovirus) et de certains parasites
entériques (Entamoebahistolytica, Trichomonas intestinalis, Giardia
lamblia, Ascaris lombricoïdes, Trichuristrichiura,
Strongyloidesstercoralis, Tænia sp, Necatoramericanus, Ancylostoma
duodénale, Schistosomasp) dans la survenue des diarrhées
chez les enfants de moins de 5 ans à l'hôpital régional de
Bertoua, Est-Cameroun. Plus spécifiquement, il était question de
:
· Déterminer la prévalence des
diarrhées chez les enfants de moins 5 ans.
· Déterminer la prévalence des Rotavirus,
Adénovirus et des parasites intestinaux chez les enfants de moins 5 ans
présentant une diarrhée.
· Faire une analyse descriptive des données
démographiques (âge, sexe) et la recherche de corrélation
entre ces données et les pathogènes détectés
à l'aide de tests statistiques.
· Déterminer le rôle de l'alimentation dans
la survenue de ces infections diarrhéiques chez les enfants de moins 5
ans.
Dans ce mémoire donc, nous présenterons dans un
premier temps une revue bibliographique concernant les diarrhées, les
agents responsables des diarrhées infantiles dont les Rotavirus, les
Adénovirus et les parasites entériques, et dans un
deuxième temps les matériels et méthodes, ensuite, les
résultats de cette étude suivis d'une discussion et enfin une
conclusion et des recommandations.
CHAPITRE I : REVUE DE
LA LITTERATURE
I.1 Définition
Dans le langage courant, le mot diarrhée évoque
l'existence de selles liquides. Selon la définition médicale, la
diarrhée est définie par un poids quotidien de selles
supérieur à 300 grammes ; quand le volume de selles liquides ne
dépasse pas cette limite, on parle de fausse diarrhée. Elle peut
être due à des bactéries, à des parasites ou
à des virus. (DICTIONNAIRE LAROUSSE MEDICAL, 2006). Selon l'OMS, c'est
un symptôme qui consiste en l'émission de plus de 3 selles
liquides par jour précédée d'un transit normal et ne
récidive pas à court terme. C'est un symptôme très
commun à tout âge et très dangereux chez l'enfant (MS.IFMT,
2005). Elle présente par ailleurs une grande diversité
épidémiologique, étiologique et clinique regroupant entre
autres, les gastroentérites, les toxi-infections alimentaires, le
choléra et la dysenterie (GELAIS, 2008)
I.2
Épidémiologie
La diarrhée aigüe est une affection qui peut
être mortelle si elle n'est pas soignée. Elle constitue un
problème majeur de santé publique dans le monde entier, et
essentiellement dans la plupart des pays en voie de développement au
regard des conséquences meurtrières qu'elle engendre chez les
enfants de moins de cinq ans. Bien qu'étant la deuxième
(2e) cause de morbidité, et la quatrième
(4e) cause de mortalité dans le monde (PILLY, 2012), elle
représente tout de même la deuxième cause de
mortalité chez les enfants de moins de cinq ans qui représentent
la tranche d'âge la plus concernée (figure 1), avec
approximativement 2,5 millions de décès chaque année
(UNICEF, 2012). Dans les pays en voie de développement l'incidence des
diarrhées aiguës infantiles est nettement plus
élevée, le nombre d'épisodes variant de 3 à 9 par
an et par enfant. Les diarrhées sévissent en Afrique
subsaharienne de façon endémique. Elles y représentent 37%
de l'ensemble des cas de diarrhées observés dans le monde et
constituent la cause d'un quart de l'ensemble des maladies infantiles qu'on y
enregistre (NGUENDO ,et al, 2008). Le groupe de
référence d'épidémiologie de santé infantile
de l'OMS estime que 16% des décès chez les enfants africains de
moins de cinq ans sont directement attribués aux maladies
diarrhéiques (BRYCE et al, 2005 ; El MOHAMADY et al,
2006). Au Cameroun, la prévalence des maladies diarrhéiques est
encore estimée à 21% pour les enfants de 0 à 59 mois. La
région la plus affectée du pays est celle du Nord avec une
prévalence de 36% alors que la moins affectée pour la même
tranche d'âge est la région du Nord-Ouest avec une
prévalence de 9%. Elle est l'une des maladies infantiles les plus
meurtrières au Cameroun, avec environ 13% des décès
d'enfants de moins de cinq ans (EDS-MICS, 2011).
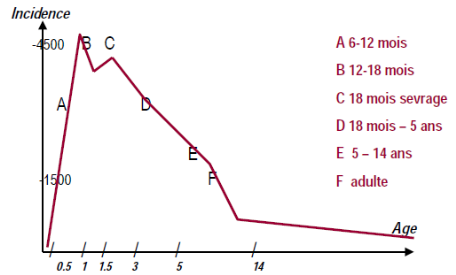
Figure 1: Incidence des maladies diarrhéiques
selon l'âge (MS.IFMT, 2005)
I.3 Mode de transmission et
facteurs de risque
La transmission de ces germes est favorisée non
seulement par les conditions du milieu physique, mais aussi et surtout par le
non-respect des mesures d'hygiène, l'insuffisance ou le
dysfonctionnement des infrastructures sanitaires et des équipements
collectifs destinés à l'évacuation et au traitement des
eaux usées, l'approvisionnement insuffisant des ménages en eau
potable, l'allaitement artificiel et même partiel pendant les 4-6
premiers mois de la vie, les mauvaises pratiques de sevrage, la
préparation et la conservation inadéquates de l'alimentation,
etc. (ATOKARE, 2008).Les agents infectieux qui provoquent les diarrhées
se propagent par l'ingestion d'aliments ou d'eau contaminée, ou par
contact de mains souillées.
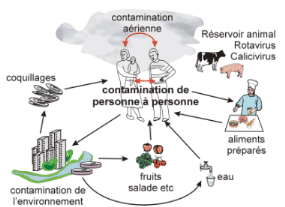
Figure 2: Cycle de transmission des virus responsables
des gastroentérites
Source : http://www.nlv.ch/epidemie-localise1/graphics/
transmission des virus.gif
Des saisons distinctes de diarrhée ont
été observées dans de nombreuses régions
géographiques. Sous les climats tempérés, les
diarrhées virales (rotavirus) s'observent pendant la saison froide. Dans
les régions tropicales, les diarrhées à rotavirus
surviennent pendant toute l'année. Mais alors que la grande saison
sèche (janvier-mars) et la grande saison des pluies (septembre-novembre)
connaissent un niveau de prévalence élevé, la petite
saison sèche (juillet-août) et la petite saison des pluies
(avril-juin) sont moins favorables aux diarrhées (NGWE et al.,
2008). Ainsi, c'est au mois de janvier que les consultations médicales
pour les diarrhées sont plus élevées ; et elles atteignent
le minimum au mois d'avril. Ce profil saisonnier ressort aussi des
données de l'enquête par sondage sur les diarrhées des
enfants menée dans la même ville conjointement par l'IFORD, l'IRD
et le Centre Pasteur de Yaoundé (BANZA-NSUNGU, 2007).
I.4 Physiopathologie
I.4.1 Mécanismes
cellulaires et moléculaires
I.4.1.1 Physiologie
cellulaire
La survenue d'une diarrhée résulte
d'interactions complexes entre l'agent pathogène et les cellules
intestinales de l'hôte.
v Barrière intestinale et zones de
passage et d'échanges.
L'épithélium intestinal a une structure
polarisée qui lui permet de fonctionner comme une barrière
séparant deux milieux mais également de transporter des
molécules ou des fluides d'un compartiment à l'autre. La
continuité de la barrière est assurée par des
rapprochements entre les cellules qui sont aussi des lieux de passage
figurés par les complexes jonctionnels, ou jonctions serrées
(encore appelées zona occludens). Cette zone est située à
la partie la plus apicale de deux entérocytes comprenant de bas en haut
: la jonction serrée proprement dite, puis une section
intermédiaire contenant un filament d'actine-myosine et enfin le
desmosome. Ces régions sont des lieux de passage parfaitement
contrôlés : l'étanchéité de la muqueuse est
en outre renforcée par un épais tapis de mucus (glyocalyx) qui
recouvre les entérocytes. Malgré tout, cette barrière
présente des points faibles où le tapis muqueux s'interrompt
représentés par les structures lymphoïdes : plaque de Peyer
et nodules solitaires. Ces zones contiennent des cellules M dont le rôle
est d'assurer l'entrée de particules pour faciliter leur
présentation aux cellules immunocompétentes. Ce sont ces «
pores » qu'utiliseront préférentiellement certains
pathogènes pour franchir la barrière épithéliale
(OLIVES, 2008).
v Fonctionnement de
l'entérocyte
Pour remplir toutes ses fonctions, il lui faut une grande
quantité d'eau qui est apporté par le bol alimentaire et les
sécrétions : salivaires, gastriques, biliaires,
pancréatiques et intestinales. L'équilibre
absorption-sécrétion se fait dans les conditions normales en
faveur de l'absorption ce qui donne un bilan d'eau positif. L'homme est un
être fait d'eau : 75% à la naissance, 60% après le
6e mois de la vie, mais cette eau n'est pas « stagnante
». La plaque tournante de ces phénomènes c'est la surface de
l'intestin. La moitié de l'eau extra-cellulaire est
libérée chaque jour dans l'intestin, soit 9 litres chez l'adulte,
dont 2 litres des aliments, 1 litre de salive, 2 litres de liquide gastrique, 1
litre de bile, 2 litres de liquide pancréatique, 1 litre de liquide
intestinal. Or l'eau excrétée chez l'adulte varie entre 100
à 200 ml, donc les liquides libérés sont presque en
totalité réabsorbés (50% dans le jéjunum, 30% dans
le l'iléon, 15% dans le colon, au Total 95%). Toute rupture du cycle
sécrétion -absorption de l'eau aboutit à une
diarrhée, ce qui en est la définition physiopathologique (OLIVES,
2008).
L'eau suit les mouvements du sodium. Le premier
mécanisme est passif c'est-à-dire qu'il se fait selon le gradient
de concentration du sodium au niveau des espaces intercellulaires des
entérocytes (« tightjunction »). Le deuxième
mécanisme regroupe à la fois une pénétration
passive par la face luminale et le rejet actif par la face sanguine
grâce à la pompe à sodium (Na + K+ ATPase). Le
troisième mécanisme est le transport couplé du sodium qui
augmente l'absorption du sodium par le couplage à certains nutriments
(surtout le glucose) et électrolytes (ex. le chlore, sodium, potassium,
bicarbonate). Il a été démontré que le transport du
sodium et le transport du glucose sont liés dans l'intestin grêle,
si bien que le glucose accélère l'absorption de soluté et
de l'eau (LANGET, 1972).
v Voies de contrôle de la
sécrétion et de la perméabilité de
l'entérocyte.
Les phénomènes de contrôle de l'absorption
et de la sécrétion d'eau et d'électrolytes sont
régulés par 4 mécanismes sous la dépendance de 4
effecteurs principaux : l'AMP cyclique, la GMP cyclique, le calcium
intra-cellulaire et les protéines du cytosquelette. Les
nucléotides cycliques (AMPc et GMPc) peuvent stimuler la
sécrétion entérocytaire par trois effets : ils activent le
canal principal à chlorure CFTR (cysticfibrosistransmembrane conductance
régulator), ils augmentent la production de calcium intra-cellulaire,
enfin ils agissent sur les jonctions serrées et sur les protéines
du cytosquelette. Le calcium intra-cellulaire par son élévation
stimule les protéines transporteuses d'ions et la
sécrétion, active le CFTR et module la perméabilité
intestinale par action sur les jonctions serrées. Les protéines
du cytosquelette assurent la rigidité du cytoplasme par des
microfilaments (kératine et actine) et l'amarrage au niveau des
jonctions serrées. C'est le maintien de la structure cylindrique des
entérocytes et leur polarité qui est le garant du fonctionnement
normal des autres mécanismes. (OLIVES, 2008).
I.4.1.2 Facteurs
moléculaires de virulence des agents pathogènes.
Les agents pathogènes disposent d'une ou plusieurs
propriétés leur permettant de « dialoguer » avec les
cellules intestinales et de troubler leur mécanisme, ou plus
radicalementd'envahir et de forcer la barrière muqueuse. Ces
capacités sont au nombre de 4 : adhésion, multiplication
(colonisation), sécrétion de toxine(s) et invasion. La
capacité d'adhésion d'un agent pathogène est liée
à des microfibrilles (frimbriae) portées comme une chevelure ou
une touffe de poils ou à la présence d'un flagelle. L'aptitude
à sécréter des toxines est très répandue
chez les agents pathogènes. Elles sont regroupées en 4 classes
principales : les entérotoxines, les toxines altérant le
cytosquelette (ZOT par exemple), les cytotoxines et les toxines à
tropisme nerveux. La capacité d'invasion est liée essentiellement
à l'utilisation de la cellule M comme porte d'entrée.
I.4.2 Conséquences
physiopathologiques
L'équilibre entre les phénomènes
d'absorption et de sécrétion électrolytique conditionne et
caractérise le cycle entéro-systémique de l'eau. Toute
diarrhée aiguë est liée à une anomalie de ce cycle
entéro-systémique, par dérèglement des processus
d'absorption ou de sécrétion des électrolytes,
essentiellement du sodium. La conséquence univoque de ces troubles de la
sécrétion ou de l'absorption hydroélectrolytique est une
perte anormale d'eau et d'électrolytes par les selles, à
l'origine d'une déplétion hydroélectrolytique. Quelle que
soit l'étiologie en cause, les concentrations moyennes fécales en
électrolytes sont : sodium, 25 à 75 mmol/l ; potassium,
30 à 75 mmol/l et chlore : 10 à 40 mmol/l. Cette
déperdition hydroélectrolytique est généralement
à l'origine d'une déshydratation de type hyponatrémique.
La perte fécale de potassium, à l'origine d'une baisse du
potassium extracellulaire entraîne un hyperaldostéronisme qui
augmente la déplétion potassique par hyperkaliurie,
l'hypokaliémie qui en résulte pouvant elle-même être
à l'origine d'un iléus paralytique qui aggrave les pertes
électrolytiques fécales. Plus rarement, la conséquence de
ces déperditions hydro-électrolytiques est une
déshydratation de type hypernatrémique qui s'observe
particulièrement dans les diarrhées aiguës très
sévères et lorsque l'enfant a une alimentation hyper-osmolaire,
trop riche en sel ou en hydrates de carbone.
Au total trois mécanismes très différents
peuvent précéder la survenue d'un épisode
diarrhéique : le premier mécanisme concerne les
diarrhées sécrétoires qui résultent de l'action des
certains agents infectieux par l'intermédiaire des toxines qui
stimulent l'adénylcyclase, ce qui aboutit à l'augmentation de
l'AMPc et à l'augmentation de la sécrétion chlore. C'est
le prototype du choléra, mais d'autres germes (certaines souches d'E.
Coli, staphylocoques) agissent par le même mécanisme. Le
deuxième mécanisme est celui de l'invasion des cellules de la
villosité intestinale par des germes qui pénètrent dans la
cellule qu'ils détruisent (selles glairo-sanglantes). On note une
atteinte côlique prédominante avec une baisse de la
capacité d'absorption du colon. C'est le prototype des Salmonelles et
Shigelles, mais aussi de certains parasites. Le troisième
mécanisme est celui des virus (les diarrhées virales), il aboutit
à l'altération (mais minime) de la bordure luminale de
l'entérocyte avec une baisse de l'absorption du sodium et d'eau.
Quelques conséquences sont à noter pour le plan
thérapeutique :
· Lors des diarrhées sécrétoires,
les capacités d'absorption de l'eau sont intactes ;
· Lors des diarrhées glairo-sanglantes,
l'absorption est basse au niveau du côlon, elle est normale pour le
grêle ;
· Lors des diarrhées virales : La capacité
d'absorption du grêle est basse, mais toujours suffisante.
I.5 Aspects cliniques
En fonction des principaux symptômes trois
entités cliniques peuvent être réalisées.
Tableau 1: Principaux
symptômes observés en fonction du mécanisme et de
l'étiologie des diarrhées aiguës.
|
Entérite virale
|
Diarrhée par production de toxine
|
Diarrhée invasive
|
|
Fièvre
|
+
|
+
|
+ + +
|
|
Déshydratation
|
+ + +
|
+ +
|
+
|
|
Choc
|
+
|
-
|
-
|
|
Vomissements
|
+ + +
|
+
|
+
|
|
Selles aqueuses
|
+ + +
|
-
|
-
|
|
Leucocytes fécaux
|
+
|
-
|
+ + +
|
Les aspects cliniques des diarrhées aiguës
infantiles peuvent également être classifiés en fonction de
l'état de déshydratation apprécié sur le
pourcentage de perte de poids ou estimé en fonction de critères
cliniques. On note ainsi :
· La diarrhée aiguë bénigne
: il n'y a pas de signes cliniques de déshydratation, la perte
de poids est nulle ou inférieure à 5 % du poids du corps,
l'enfant n'a pas de vomissements ni de météorisme abdominal.
· La diarrhée aiguë
d'intensité moyenne : les signes de déshydratation sont
nets (soif, persistance du pli cutané, perte de poids entre 5 et 8 % du
poids du corps), associés à de la fièvre, à une
anorexie, à des vomissements, à une diarrhée
importante.
· La diarrhée grave : elle est
profuse, accompagnée de l'intolérance gastrique absolue, des
signes de déshydratation marqués (soif, « faciès
toxique », état de choc, polypnée témoignant de
l'existence d'une acidose, persistance du pli cutané, sécheresse
des muqueuses, oligoanurie, parfois troubles de la conscience) ; le
météorisme abdominal est net. La perte de poids dépasse 10
% du poids du corps.
Tableau 2 :
Critères d'appréciation de l'état de
déshydratation.
|
Bilan d'hydratation
|
Non déshydraté
|
Déshydratation modérée
|
Déshydratation sévère
|
|
Etat général
|
Normal
Conscience normale
|
Agité, irritable
|
Apathique
Parfois inconscient
|
|
Hydratation intracellulaire
|
Yeux normaux
Larmes présente
Bouche, langue humides
Boit normalement
|
Yeux enfoncés
Absence de larmes
Buche, langue sèches
Assoiffé
|
Yeux enfoncés et secs
Absence de larmes
Bouche et langue très sèches
Boit avec difficulté
|
|
Hydratation extracellulaire
|
Effacement rapide du pli cutané
|
Effacement lent du pli cutané
|
Persistance prolongée du pli cutané
|
|
Vomissements
|
Absents
|
Absents ou modérés
|
Importants
|
|
Etat de cardiovasculaire
|
Pouls et TA normaux
|
Pouls rapide mais prenable
TA conservée
|
Pouls filant, hypotension artérielle
|
|
Perte de poids
|
Moins de 5%
|
5-8%
|
Plus de 8%
|
Source : Pilly Trop 2012 - Maladies infectieuses
tropicales page 250.
I.6 Investigations para
cliniques
Elles doivent être indiquées en fonction de la
nature et de la gravité du syndrome diarrhéique. La coproculture
est généralement de peu d'intérêt. La plupart des
diarrhées aiguës observées chez les enfants de moins de 5
ans sont d'origine virale (50 à 80%). Quelle que soit
l'étiologie, l'évolution se fait habituellement vers une
guérison spontanée en deux à trois jours. Un examen
bactériologique des selles ne doit donc être demandé que
lorsque les données cliniques font soupçonner une infection
bactérienne (selles glairo-sanglantes), si la diarrhée se
prolonge anormalement, particulièrement chez l'enfant vivant en
collectivité.
La mise en évidence de particules virales dans les
selles, facile à réaliser à l'heure actuelle, ne suffit
pas pour affirmer que le syndrome diarrhéique a pour origine une
infection virale qui ne peut être véritablement affirmée
que par l'étude de la séroconversion spécifique. Etant
donné l'absence d'intérêt pratique, cette recherche n'est
généralement pas réalisée. L'examen virologique des
selles a surtout un intérêt en situation épidémique,
en particulier chez des enfants vivant en collectivité. Les autres
examens paracliniques (hémogramme, culot urinaire,
prélèvements bactériologiques divers, examens
parasitologiques) sont indiqués en fonction d'une orientation
étiologique précise ou si la diarrhée se prolonge
anormalement.
La détermination du type et de la gravité de
l'état de déshydratation (protides totaux, ionogramme, pH et
réserve alcaline sanguins, dosages de Na+ et du K+ urinaires,
études répétées du pH et de l'osmolarité
urinaires) sont indispensables dès que l'enfant présente des
signes cliniques de déshydratation grave.
I.7 Les étiologies
Bien qu'étant de causes divers, 80% des maladies
diarrhéiques sont infectieuses (bactériennes, parasitaires,
virales et mycosique). Les virus sont la plus fréquente cause de
diarrhées infectieuses chez les enfants (50 à 80%). Avec les
infections respiratoires et le paludisme, elles sont une cause majeure de
mortalité infantile dans le monde.
I.7.1 Les virus
Les diarrhées virales sont très
fréquentes (80-90% des diarrhées infectieuses chez les enfants.
(OUMNIA, 2010). Elles sont dues aux Rotavirus, connus pour être la cause
la plus commune de diarrhée aiguë sévère chez les
enfants de moins de 5 ans dans le monde (OLESEN et al., 2005); aux
Adénovirus entériques et aux Calicivirus (dont le virus de
Norwalk). La symptomatologie des diarrhées virales est marquée
par des troubles digestifs aigus (nausées, vomissements, douleurs
abdominales, diarrhées hydro-électrolytiques) accompagnés
de signes généraux souvent modérés. Elles
évoluent généralement de manière bénigne en
quelques jours. Mais des formes sévères avec
déshydratation sont possibles notamment chez les nourrissons (PIGNATELLI
et al., 2000).
I.7.1.1 Les rotavirus
Le rotavirus est l'agent étiologique le plus courant
des gastroentérites de l'enfant. Il est responsable de 30 à 40 %
des hospitalisations pour gastroentérites dans le monde. C'est
également le pathogène responsable de 30 à 50 % des cas de
diarrhées les plus sévères chez les jeunes enfants. C'est
la cause majeure de morbidité et de mortalité parmi les enfants
et les jeunes enfants aussi bien dans les pays développés que
dans les pays en voie de développement, mais la mortalité par
déshydratation reste élevée, principalement dans les pays
en voie de développement où surviennent 82 % des quelque 440 000
à 600 000 décès annuels dus au rotavirus (OMS, 2012 ;
TATE et al, 2012 ; MATHIE et al, 2006). Environ 130
millions d'enfants développent des diarrhées dues aux Rotavirus
chaque année, parmi eux 18 millions passent par une
déshydratation modérée à sévère
donnant entre 418 000 à 520 000 morts avec 85% de ces
décès dans les pays à bas revenue (LUZ et al.,
2005 ; WGOGG, 2012).
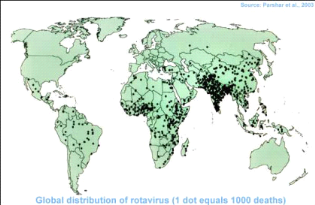
Figure 3: Répartition des Rotavirus dans le
monde.
Source :
http://www.nlv.ch/Rotavirus/graphics/rotavirusdistribution.gif
v Morphologie et Structure
En 1973, l'équipe de Bishop a observé pour la
première fois, dans des biopsies intestinales d'enfants atteints de
diarrhées, des particules virales de 70 nm de diamètre (figure
4): Ce virus a reçu le nom de Rotavirus, inspiré de sa
morphologie en forme de roue (rota en latin). (DJENEBA, 2006)
Les Rotavirus constituent un genre spécifique de la
famille des Reoviridae. Ce sont des virus non enveloppes d'un diamètre
de 70 nm a symétrie icosaédrique. Le génome viral
d'environ 18,5 kb est un ARN double brin constitué de 11 segments.
Chaque segment code pour une seule protéine virale a l'exception du
gène 11 codant pour les protéines NSP5 et NSP6 (LOISY, 2004),
soit au totale six protéines de structure (VP pour viral protein) et six
protéines fonctionnelles (NSP pour non structural protein) (TARAPOREWALA
et al., 2003). Au coeur des virions, ce génome est
stabilisé et protégé par les protéines de capside,
organisées en triple couche (BAJOLET et al., 1998) (figure
4):
· Une couche protéique externe, constituée
des protéines VP4 et VP7, qui sont des antigènes
déterminant les anticorps neutralisants et protecteurs,
spécifiques de types. VP4 est clivée en VP5 et VP8 et est
responsable de l'attachement du virion aux récepteurs membranaires
portés par les entérocytes ; elle a diverses fonctions
biologiques en rapport avec la pathogénicité:
hémagglutination, virulence, fusion, et pouvoir infectieux (BAJOLET
et al., 1998).
· Une couche intermédiaire avec une seule
protéine, VP6, fortement immunogène, qui porte les structures
antigéniques de groupe et de sous-groupe communes aux Rotavirus
infectant différentes espèces animales.
· Une couche interne formée par les
protéines internes, VP1 (polymérase), VP2 et VP3.
Différents groupes de Rotavirus humains ou animaux
peuvent être distingués en fonction de la taille de leurs segments
génomiques et des propriétés de certaines protéines
structurales.
Ainsi, en fonction de l'antigène porté par la
protéine VP6 les Rotavirus sont répertoriés en 7 groupes
désignés par des lettres (A à G). Les Rotavirus des
groupes A, B et C infectent habituellement les hommes et les animaux, les
autres sérogroupes n'ont été observés que chez les
animaux. Les Rotavirus du groupe A sont les plus nombreux et les plus
étudiés, ils sont divisés en sérotypes identifies a
partir d'antigènes induisant des anticorps neutralisants: la
protéine VP7 définit le sérotype G (glycoprotéine
ou antigène G) et la protéine VP4, le sérotype P
(protéine sensible aux protéases ou antigène P) (LOISY,
2004). Parmi les Rotavirus humains et animaux, 15 types G et 20 types P ont
été identifié de nos jours. 10 types G et 11 types P sont
associés aux infections humaines (LUZ et al.,2005). Seuls les
génotypes G ont été sérologiquement
confirmés en tant que sérotypes et parmi eux les sérotypes
G1, G2, G3, G4, sont les plus fréquents dans les infections humaines.
Pour le groupe P, P [8] est le génotype le plus commun, suivit de P [4]
et P [6] (RAHMAN et al., 2003).
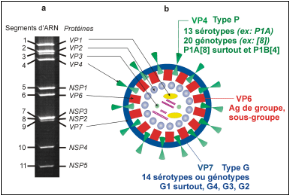
Figure 4: Sérotypes du rotavirus
v Pouvoir pathogène
La diarrhée induite par les Rotavirus est causée
par la combinaison d'un ensemble de facteurs. Ces facteurs incluent: une
réduction de surface dans la région épithéliale de
l'intestin, un remplacement d'entérocytes mûrs par des cellules
immatures, un effet osmotique résultant d'une absorption
incomplète d'hydrates de carbone de la lumière intestinale avec
une fermentation bactérienne de ces composes non absorbes, une
sécrétion de fluide intestinal et d'électrolytes à
travers l'activation du système nerveux entérique, et enfin un
effet de la protéine non structurale 4 (NSP4) du Rotavirus
qualifiée d'entérotoxine viral (BOSHUIZEN et al.,
2003).
v Diagnostic biologique
Il repose essentiellement sur la mise en évidence
directe du virus dans les échantillons de sellespar la microscopie
électronique, l'immunoélectromicroscopie et par les
méthodes immunologiques. Le diagnostic peut être
complété par la sérologie.Au cours des infections
humaines, les rotavirus sont excrétés dans les selles dès
le 2e jour. La quantité excrétée est optimale
dans les 3 à 5 jours qui suivent l'apparition des symptômes et
elle atteindrait 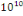 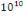 particules par millilitre de selle. Les virus ont été
retrouvés au 7e et même au 14e jour de la
maladie. Selon VESIKARI, l'excrétion diminue et elle est terminée
dans le mois. Les prélèvements des échantillons de selles
sont préférables aux écouvillonnages rectaux car donnant
plus de résultats positifs (GRENIER et al.,1981).Le diagnostic
le plus rapide se fait par recherche de l'antigène viral : la technique
d'agglutination de particules de latex sensibilisées par des anticorps
spécifiques est simple et rapide et les techniques immunoenzymatiques ou
immunochromatographiques sont adaptées à l'examen d'un grand
nombre de prélèvements. particules par millilitre de selle. Les virus ont été
retrouvés au 7e et même au 14e jour de la
maladie. Selon VESIKARI, l'excrétion diminue et elle est terminée
dans le mois. Les prélèvements des échantillons de selles
sont préférables aux écouvillonnages rectaux car donnant
plus de résultats positifs (GRENIER et al.,1981).Le diagnostic
le plus rapide se fait par recherche de l'antigène viral : la technique
d'agglutination de particules de latex sensibilisées par des anticorps
spécifiques est simple et rapide et les techniques immunoenzymatiques ou
immunochromatographiques sont adaptées à l'examen d'un grand
nombre de prélèvements.
Des moyens préventifs comme l'allaitement au sein
pourrait apporter une certaine protection contre la maladie chez le très
jeune nourrisson (OMS, 2012). Il existe de nos jours un vaccin capable
d'induire une immunité durable contre le rotavirus (PATH, 2014). Par
ailleurs, Il n'y a pas de traitement spécifique contre ce virus : le
traitement est uniquement symptomatique et vise essentiellement à
corriger les états de déshydratation qui représentent le
risque majeur de la maladie.
I.7.2.2 Les
adénovirus
Les adénovirus sont des virus de la famille des
Adenoviridae et appartiennent au genre Mastadenovirus. Isolés
indépendamment par Rowe et ses alliés (1953) et par Hilleman et
Werner (1954), les Adénovirus sont responsables de pathologies humaines
diverses: maladies respiratoires, gastro-intestinales et conjonctivales. La
famille des Adénoviridae comprend 47 sérotypes humains parmi
lesquels les sérotypes 1, 2, 5 et 6 du groupe C sont les plus
étudiés (WANG et al., 2005). En 1975 des
adénovirus ont été mis en évidence par microscopie
électronique dans les selles d'enfants présentant une
diarrhée, ils ont donc été nommés Adénovirus
entériques (UHNOO et al., 1984). Seulement deux
sérotypes d'Adénovirus, le type 40 et le type 41 sont couramment
identifies dans les selles d'enfants et de jeunes enfants présentant une
gastroentérite. Les Adénovirus entériques 40 et 41 sont
responsables de 4 à 10 % des diarrhées pédiatriques
(GIORDANO et al., 2001). Chez les enfants de moins de 2 ans,
l'infection se présente comme une diarrhée aqueuse, non
sanglante, durant 2 à 22 jours, avec plus de huit selles par jour ;
cette diarrhée s'accompagne de fièvre et de vomissements
modérés et parfois de signes respiratoires (BAJOLET et
al., 1998).
v Morphologie et structure
Les Adénovirus dont des virus de 70 à 90
nanomètres, non enveloppés à symétrie
icosaédrique. Le génome est un ADN double brin, linéaire
constitué de 30 gènes dont 12 de structure. La capside comporte
252 capsomères : 12 pentons aux sommets de l'icosaèdre et 240
hexons situés sur les arêtes et les faces. Chaque penton porte une
spicule glycoprotéique, appelée fibre, terminée par une
sphère de 4 nanomètres (nm) de diamètre qui possède
une activité hémagglutinante.
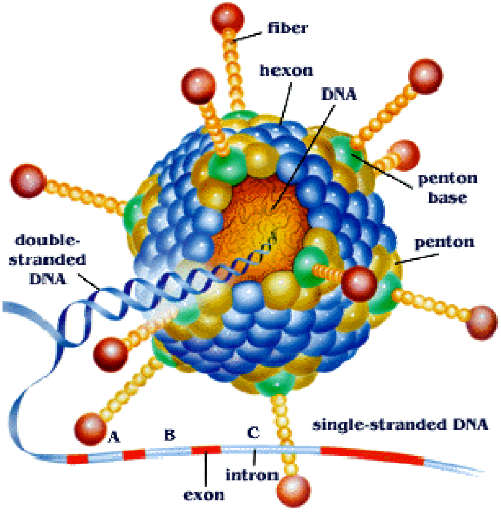
Figure 5: morphologie d'un
Adénovirus
Source:
http://nobelprize.org/nobel_prizes/medicine/laureates/1993/illpres/genes-in-pieces.html
v Multiplication et mécanisme
d'invasion
Les virus se fixent à la surface de la cellule
hôte grâce à leur hémagglutinine et
pénètrent dans le cytoplasme en traversant la membrane. Il se
fixe sur le cytosquelette et se rend vers le noyau. La capside se
désintègre libérant l'ADN qui pénètre dans
le noyau. Une première transcription d'une partie du génome
produit des ARN messagers qui sont traduits par les ribosomes en
protéines précoces qui sont utiles à la synthèse de
l'ADN viral. La réplication de l'ADN du virus peut alors commencer
grâce à l'action d'une ADN polymérase cellulaire et des
protéines précoces "E" pour "early". La réplication est
semi conservatrice, c'est à dire que chaque ADN nouveau est
constitué d'un brin parental associé à un brin
nouvellement synthétisé. Les ADN viraux ainsi produits servent de
matrice pour la transcription d'ARN messagers qui sont traduits par les
ribosomes en protéines de structure qui repassent dans le noyau
où a lieu l'assemblage pour former de nouvelles particules virales. Les
virus sont libérés par lyse de la cellule.
v Diagnostic biologique
Les indications du diagnostic virologique de l'infection
à Adénovirus se posent surtout pour identifier les formes graves
de l'infection, les pneumonies, les kératoconjectivites, les
diarrhées qui nécessite l'hospitalisation des enfants, et dans
tous les cas d'infections graves chez les sujets immunodéprimés.
Le diagnostic virologique des infections à Adénovirus est
fondé sur la détection directe du virus dans les selles en cas de
gastro-entérites. Ils existent des anticorps spécifiques de
l'ensemble des Adénovirus permettant de rechercher en quelques minutes
la présence d'Antigènes d'Adénovirus dans les selles par
test immunoenzymatique. Compte tenu de la résistance des souches, le
maintien au froid et le transport rapide ne sont pas indispensables, même
pour l'isolement en culture ou la biologie moléculaire. Les techniques
de culture virale sont plus efficaces que les techniques immunologiques pour la
recherche d'une infection à Adénovirus. Cependant, elles
nécessitent des laboratoires spécialisés en virologie, le
délai de réponse est de moins une semaine; elles peuvent aussi
déceler un virus latent, non pathogène, du pharynx ou de
l'intestin.
I.7.2.3 Autres virus
A côté de l'entité virologique,
pathogénique et épidémiologique que constituent les
infections à Rotavirus et Adénovirus, d'autres
gastro-entérites aiguës virales sont extrêmement
fréquentes, banales même, avec une distribution également
ubiquitaire et une importance significative en santé publique.
De nombreux autres virus ont été
identifiés dans les selles mais leur rôle étiologique au
cours des diarrhées aiguës infantiles n'a pas toujours
été clairement démontré.
v Les astrovirus
Les Astrovirus ont également une morphologie
caractéristique en microscopie électronique : leur
symétrie cubique, les bords arrondis, lisses, un triangle dense aux
électrons et un centre clair leur confèrent un aspect en
étoile à 5 ou 6 pointes (BAJOLET et al., 1998). Ils se
rencontrent chez l'homme mais aussi chez les moutons, les souris, le
bétail. Les Astrovirus humains sont également reconnus comme
cause commune de gastroentérites infantiles dans le monde. Le virion,
particule non enveloppée de 28 à 34 nm de diamètre, a
été décrit pour la première fois en 1975. Des
études épidémiologiques dans diverses localités
dans le monde rapportent une prévalence des astrovirus de 2 à 16
% parmi les enfants hospitalisés pour une diarrhée (MENDEZ-TOSS
et al.,2004).
Il n'existe pas à l'heure actuelle d'examens fiables,
de routine, permettant de connaître la fréquence réelle des
diarrhées aiguës à astrovirus chez l'enfant.
v Calicivirus
Les calicivirus sont des virus à ARN sans enveloppe qui
ont été décrits pour la première fois en 1972 au
cours d'une épidémie en milieu scolaire à Norwalk dans
l'Ohio. Ces virus sont transmis par l'homme, les animaux domestiques ou par
contamination de l'eau et des fruits de mer. La diarrhée est très
souvent accompagnée de signes ORL ou respiratoires.
Le Virus de Norwalk en est le mieux et le plus anciennement
connu. C'est une cause majeure de gastro-entérite surtout chez les
grands enfants et les adultes ; on le trouve associé à de petites
épidémies familiales, scolaires ou d'institutions et à de
vastes épidémies transmises par l'alimentation ou des eaux de
boissons contaminées. Sa distribution est mondiale (BAJOLET et
al., 1998).
I.7.3 Les Parasites
intestinaux
Les données disponibles montrent que les maladies dues
aux parasites intestinaux (protozooses et helminthoses) constituent un grand
problème sur le plan sanitaire, social, et économique. Il est
estimé que plus de trois millions de personnes sont infectées par
les parasites intestinaux dans le monde (NEMATIAN et al.,2004). Ces
infections sont graves et touchent surtout les communautés les plus
pauvres et désavantagées et sont très intenses et
fréquentes chez les enfants d'âge scolaire.
I.7.3.1 Protozooses
Les Protozooses regroupent un ensemble de pathologies
causées par les protozoaires qui sont des êtres unicellulaires
parasites de l'homme et des animaux. On distingue plusieurs espèces
responsables de la diarrhée chez l'enfant.
v Giardia lambia
C'est un protozoaire flagelle cosmopolite qui vit dans le
duodénum et le jéjunum de l'homme. Ce parasite qui est
strictement humain vit en milieu tempéré et chaud. Il est le plus
communément isolé du tractus gastro-intestinal. Son incidence
mondiale varie de 20 à 60% (YAKOOB et al., 2005). Il
prédomine dans les pays tropicaux et atteint avec prédilection
les enfants
- Classification
Règne: Animal
Sous-règne: Protozoaire
Embranchement: Sarcomastigophora
Sous-embranchement: Mastigophora
Classe: Zoomastigophora
Ordre: Diplomonadida
Genre: Giardia
Espèce: Giardia
lambia
- Morphologie
L'animal se présente sous deux formes:
· Le trophozoïte: corps symétrique, piriforme
(ou en «cerf -volant») avec une extrémité
antérieure large et une dépression ventrale, possède 8
flagelles (2 flagelles antérieurs, 4 ventraux et 2 postérieurs)
représente la forme végétative très mobile.
· Le Kyste: ovoïde, coque mince, claire, lisse,
réfringente, de 10 à 14 ì; 2 noyaux à
l'émission avec un amas flagellaire dans l'axe et deux corps parabasaux
en virgule; 4 noyaux après un séjour de 24 à 48 h dans la
nature. C'est la forme de résistance et de dissémination du
parasite.
a 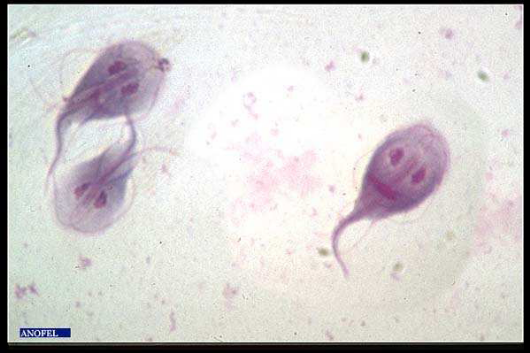 b b 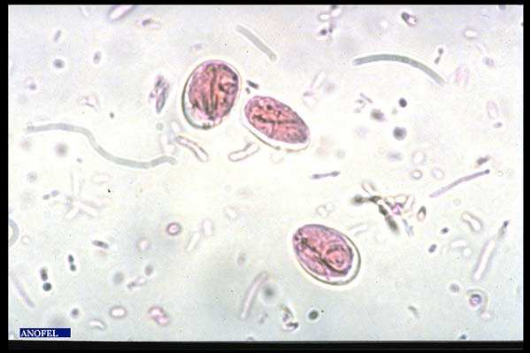
Figure 6: Giardia lambia :
a-trophozoïte, b - kyste
Source: sisbib.unmsm.edu.pe/.../images_paradigmas2.htm
- Physiopathologie
La transmission est oro-fécale le sujet s'infeste par
ingestion de kyste. Dans l'estomac ceux-ci libèrent des
trophozoïtes qui se divisent et colonisent l'intestin grêle. La
maladie se manifeste par une diarrhée, un syndrome de malabsorption en
cas d'infestation massive avec atrophie villositaire partielle plus rarement
totale (chez les enfants en milieu tropical). Le mécanisme de la maladie
est encore mal définie, des suggestions de causes vont d'une
perturbation de l'activité enzymatique intestinale et endommagement de
la muqueuse a une augmentation de la perméabilité intestinale et
perturbation de la flore bactérienne (YAKOOB etal., 2005;
ROXSTROM-LINDQUIST et al., 2005). Ainsi il a été
rapporté qu'une infection due à Giardia lambiaserait
à l'origine d'une malabsorption intestinale de graisse, de D-xylose, de
vitamine A et vitamine B12, et également du fer (OLIVARESA et
al., 2004).
Le diagnostic est effectué par la recherche des kystes
et des formes végétatives à l'examen parasitologique des
selles, ou encore par la détection des antigènes par ELISA dans
les selles.
v Trichomonas intestinalis
Trichomonas intestinalisest un protozoaire
flagellé qui se localise particulièrement dans la partie
iléo-caecale de l'intestin de l'homme et il est cosmopolite. C'est le
flagelle intestinal le plus courant de l'homme, cependant il semble qu'il cause
rarement des douleurs abdominales, des épisodes de diarrhée
muqueuse, et des anomalies dans l'intestin. Bien qu'il soit associe aux selles
diarrhéiques, certains auteurs déclarent que c'est un parasite
inoffensif et se nourrit de bactéries et de détritus qu'il
englouti grâce à des pseudopodes (ATAMBAY et al., 2002;
UKOLI, 1984).
- Classification
Règne : Animal
Sous-règne : Protozoaire
Embranchement : Sarcomastigophora
Sous-embranchement : Mastigophora
Classe : Zoomastigophora
Ordre : Trichomonadida
Famille : Trichomonadidae
Genre : Pentatrichomonas
Espèce : Trichomonas intestinalis
- Morphologie
Trichomonas intestinalisest un protozoaire
flagellé qui ne possède pas de forme kystique. Le
trophozoïte est piriforme et mesure 7 à 15 ìm de long sur 4
à 10 ìm de large. Il possède cinq (5) flagelles
antérieurs libres avec une membrane ondulante qui s'étend tout le
long du corps se terminant par un flagelle dans la partie postérieure
(flagelle récurrente) (UKOLI, 1984). Il a un mouvement
caractéristique (très rapide et de manière non
directionnelle) rendant le diagnostic facile dans les selles frais.
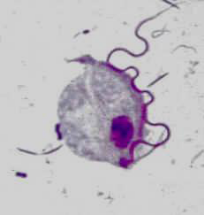
Figure 7: Trophozoïte de Trichomonas
intestinalis.
Source: sisbib.unmsm.edu.pe/.../images_paradigmas2.htm
v Autre protozoose
- Amibiase intestinale
Il s'agit d'une parasitose cosmopolite rencontrée
à l'état endémique en zones intertropicale et sous forme
sporadique en pays tempérés. Sa pré valence atteint 80%
dans les régions tropicales et subtropicales (BENHAMOU et al.,
1998). Elle est due à Entamoebahistolitica, seule amibe
pathogène pour l'homme (seul réservoir du parasite). La
contamination s'effectue par voie orofécale par l'intermédiaire
de l'eau ou des aliments souilles. Le diagnostic est établit par la mise
en évidence d'amibes hématophages d'aspect caractéristique
sur un échantillon de selles.
Dans les régions tropicales, et a un degré bien
moindre dans les pays tempérés, certains parasites peuvent
être à l'origine d'authentiques poussées de
diarrhées aiguës. Parmi les protozoaires autre que les
cryptosporidies plus marqués chez les sujets
immunodéprimés, peuvent être cités : balantidium
coli, isospora belli et cyclospora.
I.7.3.2 Helminthoses
v Hymenolepis nana
Hymenolepis nana est un parasite commun des rongeurs
et aussi de l'homme. C'est un parasite cosmopolite.
- Classification
Règne: Animal
Sous-règne: Métazoaire
Embranchement: Plathelminthe
Classe: Cestode
Ordre: Cyclophillida
Famille: Hymenolepidae
Espèce: Hymenolepis nana
- Morphologie
L'adulte: mesure environ 40mm de long sur 1mm
d'épaisseur possède un scolex a 4 ventouses, avec un rostre
rétractile arme d'une couronne de 20 a 30 crochets.
L'oeuf, ovoïde a 30 à 47 micromètres de
diamètre avec des filaments apicaux entre les 2 membranes.
a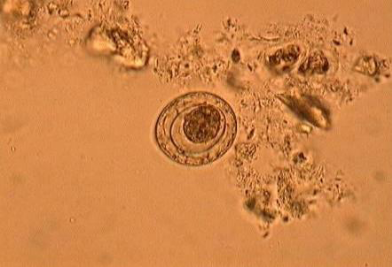 b b 
Figure 8: Hymenolepis
nana: a- oeuf observe dans les selles ; b- ver adulte
Source: sisbib.unmsm.edu.pe/.../images_paradigmas2.htm
- Cycle évolutif
Hymenolepis nana est le seul cestode capable
d'accomplir son cycle de vie chez un seul hôte : cycle direct ou
monoxene. En effet, lorsqu'il est ingère l'oeuf libère l'embryon
dans l'intestin, ce dernier pénètre dans la muqueuse où il
se développe en cysticercoïde à la base des
villosités. Après une semaine, le cysticercoïde retourne
dans la lumière intestinale, le scolex s'invagine et s'accroche à
la paroi intestinale ou il développe de nouveaux segments. Ce ver devenu
adulte va produire des oeufs a embryons hexacanthes qui vont éclore, se
développer en cysticercoïde puis en adultes comme le
précédent.
Ce ver peut également utiliser un insecte comme
hôte intermédiaire : larves de Coléoptères
(Triboliumsp.,Pulexirritans....), puces. Dans ce cas le
cysticercoide se développe dans le tissus de l'insecte et son cycle de
vie se poursuit chez l'hôte définitif lorsqu'il ingère des
céréales infestes de larves ou de puces: c'est le cycle indirecte
ou hétéroxène (UKOLI, 1984).
- Physiopathologie
La transmission est oro-fécale et le sujet s'infeste
par ingestion des oeufs éliminés avec les selles. Hymenolepis
nana cause l'hymenolepiase dont les effets sont soit moindres soit
négligeables lors d'une infection légère. Cependant
lorsque l'infection est intense, elle provoque une intoxication avec pour
symptôme: une agitation, une irritabilité, une diarrhée
particulièrement chez l'enfant.
Le diagnostic se fait par la recherche des oeufs dans les
selles.
v Strongyloïdesstercoralis
- Classification
Règne : Animal
Sous-règne : Métazoaire
Embranchement : Nemathelminthe
Classe : Nematode
Ordre : Strongyloïda
Super-famille : Rhabditoïdae
Genre : Strongyloïdès
Espèce : Strongyloïdesstercoralis
- Morphologie
La forme parasite est représentée par des
femelles parthénogénétiques se trouvant dans l'intestin
des animaux et en particulier de l'homme. Ces femelles ont une taille de 2
à 2,5mm de long et se fixent sur les cellules épithéliales
du duodénum. Les mâles, plus petit s que les femelles, avec 0,9mm
de long, ont une vie libre.
a b b 
Figure 9: Strongyloïdesstercoralis: a-
Larves rhabditoïdes, b- OEuf; observés dans les selles.
Source: sisbib.unmsm.edu.pe/.../images_paradigmas2.htm
- Cycle évolutif
Le cycle de développement présente une
possibilité d'alternance d'une génération
parthénogénétique et d'une génération libre:
La femelle pond ses oeufs dans l'intestin qui vont donner des larves de premier
stade (L1) appelés larves Rhabditoïdes rejetés avec les
selles. Elles atteignent le sol humide et évoluent dans les
matières fécales selon deux voies:
· Si la température du milieu extérieure
n'excède pas 15°C, les larves rhabditoides se transforment en
larves de stade 2 (L2) et stade 3 (L3) filaroïde infestant.
· Si la température est comprise entre 20°C
et 25°C, les larves poursuivent leur évolution dans le sol humide
pour donner des vers femelles et des vers mâles. Les individus de cette
génération libre, unisexués, s'accouplent et la femelle
pond des oeufs. Ces oeufs vont éclore et la larve qui en sort est une
larve L1.cette dernière évolue en L2 puis en L3 filaroïde
infestant.
- Physiopathologie
La principale source d'infestation est la larve
filaroïde, présente dans le sol souillé par les
matières fécales et pénètre par voie
transcutanée. Après pénétration de la larve et un
passage laryngo-pulmonaire, les femelles
parthénogénétiques s'installent dans la muqueuse
duodénale. Cette pénétration a un effet irritant et peut
provoquer une duodénite avec douleur abdominale. Chez l'enfant une
diarrhée brève et bénigne est la manifestation la plus
fréquente. En revanche chez l'enfant malnutri, la diarrhée est
prolongée et importante (NAVARO et al, 2000).
v Autres Helminthoses
- Ascaridiose
Il s'agit d'une infection cosmopolite particulièrement
fréquente en zone tropicale. Elle est due à Ascaris
lumbricoïdesnématode spécifique humain. C'est un vers
rond blanc rose, la femelle mesure 20 à 50cm de long et vie dans
l'intestin grêle, et on estime qu'un individu sur quatre dans le monde en
est porteur (NAVARO et al, 2000). Les oeufs du parasite sont
éliminés dans les selles et la contamination se fait lorsqu'ils
sont ingérés par l'enfant (eau, aliment, doigts contaminés
par la terre souillée par les matières fécales). Les
infestations massives peuvent provoquer des douleurs abdominales, des
diarrhées, des vomissements entrainant l'expulsion des vers adultes. Il
peut y avoir des complications : occlusions intestinales, perforation
intestinale avec péritonite.
- Trichocéphalose
Elle est due à Trichuristrichuria, petit ver
de 30mm à 50mm de long qui est parasite exclusivement humain. Seules les
infestations massives sont symptomatiques avec douleurs abdominales, des
diarrhées chez le jeune enfant.
- Oxyurose
L'oxyurose est très largement répandue dans le
monde et prédomine chez les enfants, 40% des enfants d'âge
scolaire en seraient porteurs (NAVARO et SCHMITZ, 2000). Elle est due à
Enterobiusvermiculariset se manifeste surtout par des prurits anaux
provoquant des lésions, et aussi des douleurs abdominales, la
diarrhée, des manifestations nerveuses, chez les enfants.
- Schistosomiase
C'est un trématode très répandue, l'OMS
estime que plus de 250 millions de personnes dans le monde sont atteintes de
bilharziose (NAVARO et SCHMITZ, 2000). La diarrhée est un symptôme
fréquent de l'infestation à Schistosomamansoniou
à Schistosomaintercalatum, moins habituelle avec
Schistosomajaponicum. L'infestation initiale chez l'enfant se traduit
bien souvent par une diarrhée transitoire accompagnée de
fièvre et d'arthralgie.
I.7.4 Les Bactéries
La plus part des bactéries responsables des
diarrhées appartiennent à une grande famille des bactéries
Gram négatif, les Enterobacteriaceae, et certaines aux Vibrionaceae. Les
Enterobacteriaceae comprennent des bactéries de la flore normale du
colon ainsi que quelques bactéries plus pathogènes (SCHAECHTER
et al., 1999). Chez toutes les bactéries entériques
étudiées jusqu'aujourd'hui, on a montré que leur
capacité à coloniser la muqueuse du tractus gastro-intestinal
dépend de leur capacité d'adhésion. Cette adhésion
bactérienne est plus particulièrement due à une
interaction spécifique entre certaines molécules de la surface
bactérienne (les adhésives) et certaines molécules de la
surface hôte (les récepteurs). Les bactéries les plus
incriminées dans les diarrhées de l'enfant sont principalement
les colibacilles (E.T.E.C., E.P.E.C., E.I.E.C., E.H.E.C.), les Salmonelles, les
Shigelles (Shigelladysenteriae), Campylobacterjejuni, et le
Vibrion cholérique (Vibriocholerae) responsable
d'épidémies spectaculaires (BENHAMOU et al., 1998).
I.8 Traitement
Les enquêtes publiées récemment montrent
que les recommandations thérapeutiques et/ou diététiques
largement diffusées par l'OMS et les sociétés
scientifiques concernant l'utilisation des solutions de réhydratation
orale (SRO) et les indications très limités des
médicaments sont peu suivies. Le futur en matière de traitement
des diarrhées aiguës de l'enfant est donc représenté
par la généralisation de protocoles visant à simplifier et
à codifier la prise en charge diététique (au moins dans
les pays défavorisés) et à limiter les prescriptions
médicamenteuses. La prévention et le développement
progressif de la vaccination anti-rotavirus constituent les actions
prioritaires pour les années à venir. Le principe du traitement
de la diarrhée tel que recommandé par l'OMS est actuellement
basé sur la rééquilibration hydro-électrolytique
par voie orale, le maintien de l'équilibre nutritionnel et la non
utilisation des anti-diarrhéiques (OMS, 2012). Le protocole
détaillé de la prise en charge des maladies diarrhéiques
est présenté dans l'annexe 6.
CHAPITRE II: MATERIEL ET
METHODES
II.1 Schéma de
l'étude
Il s'agissait d'une étude descriptive transversale
d'une durée de 03 mois concernant la recherche des parasites
entériques et des antigènes de Rotavirus et d'Adénovirus
couvrant la phase aiguë de la diarrhée chez les enfants de moins de
5 ans en consultation à l'Hôpital Régional de Bertoua.
II.2 Site et période de
l'étude
L'étude a été réalisée
à l'Hôpital Régional Bertoua; précisément
dans les services d'accueil et d'urgences, néonatalogie, de
pédiatrie et de laboratoire dudit hôpital.
II.2.1 Ville de Bertoua
Bertoua, capitale de la région de l'Est du Cameroun est
également le chef-lieu du département du
Lom-et-Djérem,
l'un des quatre départements que compte le régional. Cette ville
est située à 350 km de
Yaoundé. Sa
situation géographique fait d'elle le principal pôle de
développement de la région. Elle a une superficie estimée
à 100 km²,
avec une
population de 173 000 habitants d'après le recensement de
2001) ;
une
densité1 730 hab./km2. Elle est drainée
du nord au sud par le fleuve
Djadombe.
Son climat est de type subtropical à quatre saisons : une grande
saison sèche qui va de décembre à mi-mars ; une
petite saison de pluies de mi-mars à mi-mai, une grande saison de pluies
de mi-septembre à novembre. Les précipitations y sont
relativement abondantes (1500 à 2000mm de pluies par an). La
température y est élevée tout au long de l'année,
avec un maximum de 30°C, la moyenne oscillant entre 23°C et
25°C. Bertoua possède un
aéroport
(
code
AITA : BTA).
La croissance démographique est surtout le fait d'une
migration importante des populations des autres unités administratives
de l'Est, des autres régions du
Cameroun et des pays
voisins (
Tchad,
RCA,
Congo-Brazzaville,
Nigeria) et plus
récemment l'augmentation du nombre de réfugiés de guerre.
On y retrouve des populations autochtones, représentées
principalement par les Bayas et les Kakos, les peulhs, les
Képérés, et les populations allogènes
constituées des groupes suivants : les Makas, les Bamvelés, les
Bamilékés, les Foulbés, les Haoussas et Bororos. La ville
connait aussi affluence des Centrafricains qui y ont trouvés refuge
à cause de la guerre actuellement en cours en République
Centrafricaine. Mais la population active de Bertoua est constituée en
majeure partie de jeunes qui travaillent dans le secteur informel où le
transport occupe une place prédominante. Le niveau de revenu bas ne
favorise pas l'accès à l'éducation et à la
santé dont l'offre est par ailleurs faible ou aux coûts
élevés.
Bertoua, ville éducative, qui déploie une
impressionnante carte scolaire, comportant plus de 30 écoles primaires,
plus de 11 maternelles, plus de 10 écoles secondaires, une
université Internationale Catholique (UIC), et trois écoles de
formation (ENIET, ENIEG et CENAJES). Le taux d'alphabétisation est
maintenant de 90% et le taux de scolarisation quant à lui se situe
à 96,34%. Cependant les filles sont nettement moins scolarisées
que les garçons.
Sur le plan sanitaire, la ville de Bertoua dispose d'un
établissement ayant un rayonnement à l'échelle urbaine et
régionale. C'est l'Hôpital Régional de Bertoua. Les autres
formations sanitaires de cette localité comprennent : les Centres de
Santé Intégrés, 1 Centre de Protection Maternelle et
Infantile, 1 Dispensaire Urbain, 1 Dispensaire de la Caisse Nationale de la
Prévoyance Sociale (CNPS), 1 Infirmerie de la Garnison Militaire, 1
Dispensaire Catholique, 1 Dispensaire EPC, 1 Dispensaire privé
laïc, 3 Ecole d'infirmiers et Accoucheurs Brevetés, 1 Ecole des
Techniciens Adjoints de Laboratoire. La carte sanitaire de la ville de Bertoua
montre une relative couverture du périmètre urbain qui masque un
certain nombre de problèmes : la difficulté d'accès au
service par les couches pauvres faute de moyens nécessaires pour payer
les billets de cession donnant accès à la consultation ;
l'insuffisance du personnel sanitaire ; la pratique de la corruption dans les
centres hospitaliers publics ; la difficulté d'accès des couches
pauvres aux médicaments essentiels ; la recrudescence des MST/SIDA. Les
principales maladies qui touchent les habitants de la ville de Bertoua
comprennent : le paludisme, les broncho-pneumonies, les diarrhées graves
qui touchent particulièrement les enfants en bas âge, la rougeole,
la méningite, les bilharzioses vésicales, la dysenterie
bacillaire, le goitre endémique, la tuberculose, la kwashiorkor, la
trypanosomiase, les MST/SIDA et maintenant les hépatites virales B et C.
Selon les indicateurs sanitaires et le profil épidémiologique
donnés par le district de santé de Bertoua en 2013, les cinq
principaux motifs de consultation par ordre décroissant sont : le
paludisme, les parasitoses intestinales, les anémies, les rhinites et
les diarrhées. Le paludisme s'évit dans la tranche d'âge de
15-45 ans ; les parasitoses intestinales dans la tranche d'âge de
5-15 ans et les anémies, les rhinites et les diarrhées dans la
tranche des moins de 5 ans.La situation nutritionnelle fait état des
insuffisances nutritionnelles existantes parmi lesquelles le kwashiorkor qui
refait surface surtout chez les enfants réfugiés. Le taux global
d'approvisionnement en eau potable est de 25% et le péril fécal
reste une grande préoccupation.
Figure 10: Localisation de la ville de
Bertoua
Ville de Bertoua
HRB
 Figure 11: District de santé de Bertoua Figure 11: District de santé de Bertoua
II.2.2 Période de
l'étude
L'étude a couvert la période de Janvier 2015
à Mars 2015. Cette période a été choisie dans le
but de couvrir l'un des pics d'épisodes de diarrhée de
l'année. En effet, selon les données disponibles, il semblait y
avoir deux pics de diarrhée: le plus important survenant pendant la
saison pluvieuse (juin-septembre) et le second entre novembre et janvier (NGWE
E. et al, 2007).
II.3 Population
d'étude
II.3.1 Population source
La population source de notre étude était
constituée des enfants âgés de 0 - 59 mois en consultation
dans les services d'accueil et d'urgences, de néonatalogie, de
pédiatrie de l'Hôpital Régional Bertoua pour
diarrhée.
II.3.2 Population cible
La population cible de notre étude était
constituée des enfants âgés de 0 - 59 mois
présentant une diarrhée nécessitant (ou ne
nécessitant) pas une prise en charge.
II.3.3 Taille de
l'échantillon
La variable étudiée ici était la survenue
de la diarrhée. Le calcul de la taille d'échantillon était
donc fonction de :
· La proportion de diarrhée chez les enfants de 0
à 5 ans au Cameroun (p) ;
· Le niveau de confiance visé
(ì);
· La marge d'erreur acceptable
(e).
Soit nla taille de
l'échantillon permettant d'atteindre un niveau de confiance de 95%
(ì=1,96) avec une erreurqui est fixée à
priori à 5% (valeur type e = 0,05), soit
p = 21%la proportion
d'enfants de moins de 5 ans souffrant de diarrhée au Cameroun
(EDS-MICS,2011). Partant de ces conditions, la taille de l'échantillon
est donnée par la formule de Lorentz:
n = 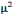 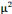 x p (1-p)/ x p (1-p)/  . .
En remplaçant, ì, pet
e par leur valeur, nous obtenons 255 enfants, et en
considérant un taux de non réponse de 10%, nous obtenons une
taille d'échantillon minimale de n = 281 enfants.
II.3.4 Procédure
d'échantillonnage
Nous avons entrepris de faire des rondes dans les services
concernés par notre étude, et chaque enfant présentant la
diarrhée faisait l'objet d'un examen clinique plus approfondi en vue de
la confirmation de la maladie. Certains enfants inclus dans notre étude
étaient référés du Centre de Santé de Mokolo
I à Bertoua après un contact établi avec celui-ci.
v Critères d'inclusion
- Enfant âgé de 0 - 59 mois présentant une
diarrhée nécessitant ou non une hospitalisation.
- Consentement de l'un des parents ou de la personne en charge
de l'enfant à participer à l'étude.
v Critères de non inclusion
- Enfant âgé de plus de 59 mois
- Enfant âgé de 0 à 59 mois ou non ne
présentant pas de diarrhée
- Refus de la personne en charge de l'enfant âgé
de 0 - 59 mois présentant une diarrhée de participer à
l'enquête.
v Critères d'exclusion
- Refus des parents ou de la personne en charge de l'enfant de
se conformer au calendrier de suivi de l'enfant quand celui-ci n'est pas
hospitalisé.
II.4 Procédure de mise
en oeuvre sur le terrain.
1ère étape :
Rédaction du protocole de recherche et acquisition des outils de
collecte des données. Le protocole de recherche a
été rédigé par l'investigateur principal sous le
contrôle de l'encadreur et du superviseur. Les outils de collecte de
données ont été commandés par l'investigateur
principal en fonction des objectifs de la recherche, notamment une commande
à l'étranger pour le KIT ayant servi à la recherche
virale.
2ème étape : Obtention des
autorisations administratives de recherche et prise de contact avec les
services compétents. La collecte des données à
l'Hôpital Régional de Bertoua a été
précédée d'une prise de contact au mois d'Octobre 2014,
avec les autorités compétentes que sont :
· Le Doyen de la Faculté des Sciences ;
· Le Directeur de l'Hôpital Régional de
Bertoua;
Au cours de cette prise de contact, ces autorités ont
pris connaissance de l'objectif de l'étude et les autorisations
académiques et administratives de recherche qui nous ont
été délivrées par ces dernières (voir
annexes 1 et 2), ont non seulement permis de faciliter notre introduction
auprès des services ciblés par cette étude, mais aussi de
constituer un dossier de demande de clairance éthique qui a
été déposé à la CameroonBioethics Initiative
(CAMBIN) (voir annexe 7).
II.5 Procédure de
collecte des données
II.5.1 Matériels
II.5.1.1 Pour la collecte des données
L'instrument de recueil des données était
conçu sous la forme d'une fiche d'enquête (questionnaire) portant
sur :
· l'interrogatoire des parents de l'enfant
· l'examen biologique des selles de l'enfant et ses
résultats
· devenir des enfants au 3ème et au
7ème sur la base des résultats et de la prise en
charge prescrite par le personnel de santé.
II.5.1.2 Pour le test
virologique
Les consommables
· Embouts de 100 et 200 uL
· Masque
· Papier absorbant
· Gants
Les équipements
· Vortex
· Micropipettes de 200 uL et de 100 à 1000 uL
Les solutions et réactifs
· Un Kit « Vikia Rota-Adéno bio
Mérieux » : qui est un test rapide, utilisant la
technologie immunochromatographique (ICT) qui permet la double détection
qualitative des Rotavirus et des Adénovirus sur un extrait unique de
selles.
II.5.1.3 Pour l'examen
parasitologique
Les consommables
· Lames et lamelles
· Pipette (pour prélever les selles)
· Gants
· Masque
· Papier absorbant
L'équipement
· Microscope optique (de marque «ZEISS»)
Les solutions et colorants
· Eau physiologique
· Lugol
II.5.2 Méthodes
II.5.2.1 L'interrogatoire des
parents ou tuteurs
Les responsables des enfants préalablement
informés et consentants étaient soumis à un questionnaire
(voir annexe 3) par l'investigateur principal et/ou les enquêteurs.
II.5.2.2 Le
prélèvement et l'examen biologique des selles
v Collecte des selles
Pour chaque enfant inclus dans l'étude, un
échantillon de selles fraiches a été prélevé
dans une boite stérile telle qu'habituellement effectué pour les
examens de routine et acheminé au laboratoire d'analyse médical
de l'hôpital. Des écouvillonnages rectaux été
réalisés chez les nouveau-nés et les enfants chez qui il
été difficile d'obtenir un échantillon de selles par
émission normale. L'acheminement des selles au laboratoire se faisait
immédiatement après la collecte par l'investigateur principal
à l'aide d'un porte vaccin contenant les pots de coproculture, sur
lesquels étaient mentionnés les éléments
d'identification des enfants (codifiés), accompagnés de la fiche
de suivi au laboratoire conçue pour la cause. Sur chaque
échantillon de selle deux types de tests ont été
effectués: la recherche des virus et la recherche des parasites
intestinaux (formes végétatives, oeufs et kystes (KOAP).
v Examens biologiques des selles
Les examens biologiques ont été
réalisés sur les paillasses de sérologie et de
parasitologie du laboratoire l'Hôpital Régional de Bertoua. Pour
le bon déroulement de l'étude il a été
établit au sein du laboratoire un protocole qui contenait les
procédures à suivre concernant les techniques.
- Recherche des parasites dans les
échantillons de selles prélevés
Cet examen a été fait dans l'heure qui suivait
l'arrivée des prélèvements au laboratoire. Il s'agissait
d'un examen simple sans concentration. Nous faisions : un examen macroscopique
qui permet de classer les selles selon leur aspect en (pâteuses,
semi-liquides avec présence ou non de glaire, liquides) et leur couleur
(jaunâtre, verdâtres, brune, blanchâtre,
décolorée) ; un examen direct entre lame et lamelle à
l'état frais dans du sérum physiologique, puis dans une solution
de Lugol.
· Principe
L'examen direct dans du sérum physiologique permet de
mettre en évidence les formes végétatives, vivantes et
mobiles des protozoaires ainsi que leurs kystes, mais également les
oeufs ou les adultes des helminthes. L'observation de toute la lame se fait
d'abord a l'objectif 10× puis a l'objectif 40×. La coloration (au
Lugol) permet d'une part de différencier les kystes
d'Entamoebahistolytica(noyaux colore en jaune) de ceux
d'Entamoeba coli, et d'autre part de bien distinguer les kystes de
Giardia (forme du kyste bien nette).
· Mode opératoire
Nous avons prélevé à plusieurs endroits
(2 à 3 endroits selon l'aspect des selles) de l'échantillon de
selle une petite quantité de selle. Ce prélèvement a
été étalé sur une lame porte objet portant une
goutte d'eau physiologique à une extrémité et une goutte
de Lugol à l'autre, puis les étalements ont été
recouvert par des lamelles 22x22, et les préparations (non
épaisses) ont été observées au microscope optique
respectivement à l'objectif 10× et 40× en commençant
par celle faite avec le sérum physiologique.
- Recherche des virus dans les
échantillons de selles prélevés
Tous les prélèvements étaient
destinés à la recherche des rotavirus. Le test utilisé
était celui le « Vikia
Rota-AdénobioMérieux » qui permet de rechercher
respectivement les rotavirus et Adénovirus dans les échantillons
de selles par l'intermédiaire d'une technique immunochromatographique
sur membrane. Ce sont des tests spécifiques qui présentent une
rapidité et une facilité d'exécution excellentes.
· Principe
Vikia Rota-Adeno est un test qualitatif basé sur
l'association d'anticorps monoclonaux spécifiques respectivement de
rotavirus et d'adénovirus. Ce test repose sur un système de
réactions immunologiques réalisées sur une bandelette par
migration (format ICT ou lateral flow) [notice du test].
Le test est composé :
Ø d'une cassette plastique contenant
:
o Une membrane de chromatographie sur laquelle sont
fixés :
§ dans la zone de test, un anticorps monoclonal
anti-rotavirus (zone «R ») et un anticorps monoclonal
anti-adénovirus (zone « A »)
§ dans la zone de contrôle, un anticorps
polyclonalanti-IgG de souris (zone « C »)
o Un support imprégné d'un conjugué
constitué du mélange d'un anticorps monoclonal anti-rotavirus
couplé à des microsphères de polystyrène de couleur
bleue et d'un anticorps monoclonal anti-adénovirus couplé
à des microsphères de polystyrène de couleur rouge.
Ø Un flacon de tampon de dilution des selles :
Tampon phosphaté (pH 7,2) + azoture de sodium 0,9 g/l
prêt à l'emploi.
L'échantillon émulsionné dans le tampon
de dilution du test est introduit au niveau du puits échantillon et
migre par capillarité le long de la membrane.
· Si l'échantillon contient des rotavirus, ceux-ci
forment un complexe antigène-anticorps avec les anticorps
spécifiques de ce virus présents sur les microsphères de
polystyrène de couleur bleue.
· Si l'échantillon contient des adénovirus,
ceux-ci forment un complexe antigène-anticorps avec les anticorps
spécifiques de ce virus présents sur les microsphères de
polystyrène de couleur rouge.
Les complexes antigène-anticorps migrent le long de la
membrane et se fixent aux anticorps anti-rotavirus et/ou aux anticorps
anti-adénovirus, formant des complexes visualisés par une ligne
bleue et/ou rouge dans la zone de test respectivement « R » et/ou
« A » de la membrane.
L'absence de cette/ces ligne(s) suggère un
résultat négatif.
A titre de contrôle, une ligne de couleur
apparaîtra toujours dans la zone de contrôle
« C » si le test a été effectué
correctement.
· Préparation des
échantillons
Ø Dévisser le bouchon du flacon de dilution et
extraire la tige nécessaire au prélèvement de la selle.
Ø Prélever une quantité d'environ 50 mg
de selle (soit l'équivalent d'un quart de petit pois) à l'aide de
la tige du flacon.
Ø Introduire cet échantillon dans le flacon
contenant le tampon de dilution.
Ø En cas de selle liquide, prélever la selle
à l'aide de la pipette et distribuer 2 gouttes de cet échantillon
(environ 50 micro litres) dans le flacon contenant le tampon de dilution.
Ø Revisser le bouchon du flacon de dilution.
Ø Agiter vigoureusement jusqu'à
homogénéisation.
· Mode opératoire
Ø Retirer la cassette du sachet scellé et
l'utiliser rapidement
Ø Placer la cassette sur une surface plane et propre
Ø Casser l'embout du flacon contenant
l'échantillon dilué
Ø Renverser le flacon et tenir verticalement.
Ø Transférer 2 gouttes d'échantillon
dilué (environ 80 micro litres) dans le puits échantillon de la
cassette et déclencher le chronomètre.
Ø Eviter la formation de bulles d'air dans le puits.
Ø Attendre l'apparition de la ligne de contrôle
« C » et éventuellement des lignes « R » et/ou
« A ».
Ø Lire le test 10 à 15 minutes après
avoir déposé l'échantillon.
a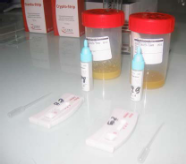 b b 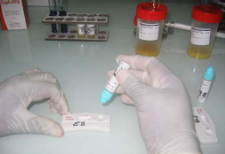
Figure 12: Photos des échantillons de selles et
kits pour le test de rotavirus et adénovirus
La photo `'a'' montre les échantillons de selles
d'enfants et 2 kits de vikia rota-adenovirus prêts à l'emploi ;
La photo `'b'' indique le transfert de 2 gouttes de
l'échantillon dilué dans le puits de la cassette.
· Interprétation des
résultats
Ø Résultats positifs : deux ou
trois lignes distinctes apparaissent : une dans la zone de contrôle (C),
et/ou deux dans la zone de test, bleue en R et/ou rouge en A.
o Si présence d'une ligne bleue en R :
l'échantillon est positif en rotavirus (photo a).
o Si présence d'une ligne rouge en A :
l'échantillon est positif en adénovirus (photo b)
o Si présence des deux lignes, bleue en R et rouge en A
: l'échantillon est positif en rotavirus et adénovirus. (photo
c)
Ø Négatifs : Une ligne
colorée apparaît dans la zone de contrôle (C). Aucune ligne
n'apparaît dans la zone de test R et A. (photo d)
Ø Non valide : la ligne de
contrôle n'apparaît pas.
a b b 
c d d 
Figure 13: Photos montrant les différents
résultats possibles avec le test après lecture.
II.6 Le traitement des
données.
Les analyses statistiques des données collectées
a été effectuées à l'aide des logiciels Epi -Info
version 3.5.3 et SPSS version 18.0.0. Le test de Chi Carré a
été utilisé pour la comparaison des fréquences. La
différence entre les valeurs moyennes a été définie
par le test-t, et la valeur de P=0,05 est considérée comme
significative. Nous avons estimées les degrés d'association entre
les variables en effectuant le croisement simple des données dans des
tableaux statistiques. Les saisies ont été faites à l'aide
des programmes office Word et Excel.
II.7 Considérations
éthiques
L'étude que nous avons mis en oeuvre prenait en compte
les considérations éthiques telles que :
v La valeur sociale : car l'étude
porte sur un problème de santé qui touche la communauté et
les résultats seront exploités dans le but d'améliorer la
santé des populations.
v La validité scientifique : car la
méthodologie adoptée nous a permis d'atteindre nos objectifs.
v Autorisation de recherche : Avant de
débuter la collecte, nous avons obtenu l'autorisation des
autorités compétentes, à savoir : l'autorisation de
recherche du directeur de l'Hôpital régional de Bertoua et des
responsables des services concernées, la soumission du protocole au
près d'un comité national d'éthique (CAMBIN), pour
l'obtention d'une clairance.
v Le consentement éclairé :
seuls les enfants des parents consentants sont inclus dans la
recherche après signature de la fiche de consentement conçue pour
la cause.
v La confidentialité : Les
données collectées sont strictement confidentielles et sous la
responsabilité de l'investigateur principal. Toutes les informations
recueillies dans le cadre de l'étude sont utilisées aux seuls
fins de la recherche. Les outils de collecte en circulation ne portent pas de
noms mais des codes donnés par l'investigateur principal pour plus de
confidentialité.
II.8 Activités et
tâches des membres de l'équipe de mise en oeuvre
Pour la mise en oeuvre de notre projet, nous avons eu recours
en plus de l'investigateur principal, d'un clinicien, de deux enquêteurs,
d'un traducteur et d'un statisticien.
II.9 Contrôle de
qualité
Les questionnaires de collecte de données et de grille
de suivi étaient standardisés ainsi que les messages à
promulguer aux parents et tuteurs d'enfants. Les analyses biologiques
étaient faites dans le respect des règles et les
Procédures Opérationnelles Standardisées (P.O.S) du
Laboratoire d'Analyses Médicales de l'Hôpital. Le contrôle
des questionnaires et des fiches de collecte de données étaient
fait après chaque séance de collecte de données par un
superviseur et les données collectées étaient directement
consignées dans un registre pour éviter les pertes de
données liées à l'égarement des fiches.
II.10 Forces et limites de
l'étude
Ce travail nous a permis d'évaluer l'impact des
Rotavirus, Adénovirus et des parasites intestinaux dans la survenue des
diarrhées chez les enfants de moins 5 ans dans la ville de Bertoua. Elle
a eue lieu au moment où le gouvernement Camerounais s'est engagé
à lutter contre la première cause des diarrhées chez les
enfants de moins de 5 ans (le Rotavirus) grâce à l'introduction du
vaccin contre ce dernier dans le programme élargie de vaccination, et de
ce fait aider à réorienter les axes stratégiques
d'intervention. Mais les éléments suivants ont faits office de
limites pour cette étude :
· Beaucoup d'enfants arrivaient à l'hôpital
seulement des jours après le début des symptômes ou lorsque
l'épisode diarrhéique persiste ;
· Les sérotypes de rotavirus n'ont pas
été déterminées et par conséquent ceux qui
circulent dans la région de l'EST ne sont pas connus;
· La période de notre étude est
relativement courte et ne permet pas d'avoir l'aperçue annuel du
problème de diarrhées dans la ville de Bertoua.
CHAPITRE III:
RESULTATS
Dans cette étude, nous avons recruté 63 enfants
âgés de 1 à 48 mois (moyenne d'âge = 15,49#177;11,39
mois) faisant la diarrhée, et analysé leurs selles pour
rechercher d'éventuels parasites intestinaux, adénovirus et
rotavirus.
III.1 Profil
épidémiologique de la diarrhée chez les enfants et
données démographiques et cliniques.
Les enfants inclus dans notre étude
représentaient 18,16% (IC : 14,3% à 22,7%) des 347 enfants
de moins de 5ans reçus en consultation pendant la période
d'étude. Le tableau 3 montre les principaux motifs de consultation des
enfants de moins de 5 ans. Nous notons que la diarrhée constitue le
3ème motif de consultation après le paludisme et les
rhinites.
Tableau 3: Principaux motifs
de consultation des enfants de moins de 5 ans.
|
Motif de consultation
|
Effectif
|
Fréquences (en %)
|
|
Paludisme
|
100
|
28,82
|
|
Rhinites
|
80
|
23,00
|
|
Diarrhées
|
63
|
18,16
|
|
Anémies
|
52
|
15,00
|
|
Parasitoses
|
38
|
11,00
|
|
Autres
|
14
|
4,02
|
|
Total
|
347
|
100,00
|
Les données du tableau 4 ci-dessous montrent
que :
Parmi les enfants inclus dans notre étude, 85,7 %
étaient âgés de 24 mois au plus. La diarrhée, dans
le cadre de notre étude, touchait beaucoup d'enfants avant leur
deuxième anniversaire. Les enfants de 0 à 11 mois étaient
les plus touchés avec une fréquence de 47,6%. Ceux
âgés de plus de 24 mois étaient les moins affectés
avec une fréquence de 14,3%. Tout ceci est statistiquement significatif
car P =<0,001.
Les garçons (56%) étaient plus
représentés que les filles (44%), mais la différence
n'était pas significative (p > 0,05).
Dans cette étude, 33,3% (soit 21/63) des enfants
faisant la diarrhée n'étaient pas déshydratés
(stade A), alors que 52,4 % (soit 33/63) avaient une déshydratation
modérée (stade B) etil y'avait une déshydratation
sévère (stade C) chez 14,3% des enfants.
La plus part de ces enfants (33,3%) recevait une alimentation
diversifiée sans produits laitiers, 22,2% recevaient l'allaitement mixte
avec une addition de lait domestique et 15,9% recevaient l'allaitement mixte
avec une addition lait industriel.
Tableau 4:
Caractéristiques démographiques et cliniques des
enfants.
|
Variables
|
Effectifs
(N=63)
|
Pourcentage
( % )
|
|
Sexe
|
|
|
|
Féminin
|
25
|
39,7%
|
|
Masculin
|
38
|
60,3%
|
|
Ages (en mois)
|
|
|
|
0-11
|
30
|
47,6%
|
|
12-24
|
24
|
38,1%
|
|
25-59
|
9
|
14,3%
|
Etat d'hydratation
|
|
|
|
Absence de déshydration (stade A)
|
21
|
33,3%
|
|
déshydratation modérée (stade B)
|
33
|
52,4%
|
|
déshydratation sévère (stade C)
|
9
|
14,3%
|
|
type d'alimentation avant l'épisode
diarrhéique
|
|
|
|
Alimentation diversifiée sans lait
|
21
|
33,3%
|
|
Allaitement artificiel exclusif
|
2
|
3,2%
|
|
Allaitement maternel + autre liquide
|
7
|
11,1%
|
|
Allaitement maternel exclusif
|
3
|
4,8%
|
|
Allaitement mixte (+ lait domestique)
|
14
|
22,2%
|
|
Allaitement mixte (+ lait industriel)
|
10
|
15,9%
|
|
Lait + Diversification
|
6
|
9,5%
|
III.2 Examens biologiques des
selles
Globalement, l'examen parasitologiquedes Kystes, OEufs,
Amibes, Parasites (K.O.A.P.) et les tests de Rotavirus et d'Adénovirus
nous ont permis de mettre en évidence 34 cas sur 63 (soit 53,97% ;
IC : 37,4% à 63,4%) d'infections par les virus, 14 cas sur 63(soit
22,22% ; IC : 10,1% à 29,3%) d'infections par les parasites,
et 3 cas de coïnfection virus-parasites. Ainsi en général
les parasites et les virus étaient responsables de 71,43% (soit 45/63)
des cas de diarrhée inclus dans cette recherche.
Parmi les virus mis en évidence, le rotavirus
était présent dans 47,6% (soit 30/63 ; IC : 34,9%
à 60,6%) des cas, et l'adénovirus dans 14,3% (soit 9/63 ;
IC : 6,7% à 25,4%) des cas (tableau 5).
Concernant les parasites, 14,3% (soit 9/63 ; IC :
6,7% à 25,4%) étaient des protozoaires
(Entamoebahistolytica, Giardia
lambia,IsosporabelietTrichomonasintestinalis),et 7,9% (soit
5/63 ; IC : 2,6% à 17,6%) étaient des helminthes
(Ascaris Lumbricoides,Strongyloïdesstercoraliset
Hymenolepisnana) (tableau 5).
Tableau 5:
Récapitulatif des résultats des examens parasitologiques et
virologiques pour les 63 cas de diarrhée
étudiés.
|
Agents infectieux
|
RV
|
AdV
|
E.h.
|
G.l.
|
I.b.
|
T.i.
|
A.l.
|
S.s.
|
H.n.
|
|
Nombre de cas
Pourcentage (%)
|
30
|
9
|
6
|
1
|
1
|
1
|
3
|
1
|
1
|
|
47,60
|
14,30
|
9,52
|
1,60
|
1,60
|
1,60
|
4,80
|
1,60
|
1,60
|
RV = Rotavirus, AdV = Adénovirus, E.h. =
Entamoebahitolytica, G.l = Giardia, lamblia,I.b. =
Isosporabeli, T.i. = Trichomonas intestinalis, A.l. =
Ascaris Lumbricoides, S.s. =
Strongyloïdesstercoralis,H.n. = Hymenolepis nana
L'étude conjointe des virus et des parasites a
montrée un taux global de coïnfections de 11,11% avec une forte
fréquence (7,94%) chez les enfants de bas âge (moins de 12 mois).
En effet, 4/63(soit 6,3%) des enfants étaient coinfectés par la
rotavirus et l'adénovirus, 2/63 (soit 3,2%) par le rotavirus et les
parasites et 1/63 (soit 1,6%) par le rotavirus, l'adénovirus et les
parasites.
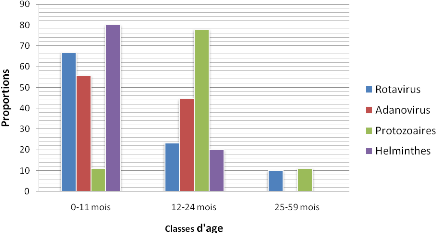
Figure 14: Répartition des causes des
diarrhées en fonction des tranches d'âge.
Cette figure nous montre que :
Les enfants de très jeune âge (0-11) sont les
plus infectés par les Rotavirus et l'Adénovirus (moyenne
d'âge: 6,84 #177; 2,89), et la fréquence des virus diminue avec
l'augmentation de l'âge.
Pour l'infection à Rotavirus, les enfants de 0 à
11 mois étaient plus atteints (66,7 %) que ceux de 12 à 24 mois
(23,3 %), et ceux de plus de 24 mois (10,0%). La différence dans
réparation du Rotavirus au sein des classes d'âge est
significative, car p = 0,01 <0,05.
Pour l'infection à Adénovirus, les enfants de 0
à 11 mois étaient plus atteints 55,6 % que ceux de 12 à 24
mois (44,4 %), et aucun cas n'a été isolé chez ceux
supérieurs à 24 mois. La différence dans réparation
de l'Adénovirus au sein des classes d'âge regroupant les enfants
de moins de 24 moins n'est pas significative, car p = 0,41 ?0,05.
Les parasitoses intestinales étaient plus
fréquentes à partir de12 mois. Pour les Protozoaires, 88,9% des
cas positifs étaient concernaient les enfants plus âgés
(âge compris entre 12 et 59 mois), tandis que la plus part (80%) des
infections par les helminthes étaient retrouvées chez les enfants
de 0 à 11 mois.
III.4 Mesures
d'associations
En effectuant le croisement des données dans des
tableauxstatistiques pour tester l'association entre lescaractéristiques
sociodémographiques et les variables dépendantes (survenue de la
diarrhée et causes de la diarrhée), nous obtenons les
données du tableau ci-dessous. Il montre queles caractéristiques
telles que l'âge et le sexe de l'enfant agissent de manière
significative sur la survenue de la diarrhée. En effet, l'association
entre la survenue de la diarrhée et la classe d'âge de 0 à
11 mois est statistiquement significative, et les valeurs p du Chi 2 sont
inférieures à 0,05. Donc on peut dire que dans cette
étude, les enfants de 0 à 11 mois ont une probabilité plus
élevée que ceux de 12 à 59 mois à faire la
diarrhée en général, et les diarrhées à
rotavirus en particulier. De même, l'association entre la survenue de la
diarrhée et le sexe est statistiquement significative, les valeurs p du
Chi 2 sont inférieures à 0,05. Donc on peut dire que dans cette
étude, les filles ont une probabilité moins élevée
que les garçons d'avoir de la diarrhée. Par contre aucune
association n'a été mise en évidence entre l'âge et
la survenue de diarrhées dues aux adénovirus et les parasites
entériques.
Tableau 6 : Effet des caractéristiques
sociodémographiques sur la survenue de la diarrhée chez les
enfants.
|
(RR)
|
IC à 95%
|
(OR)
|
IC à 95%
|
p-value
|
|
Age de l'enfant (mois)
0-11
12-24
25-59
|
2,1
0,65
0,36
|
(1,28-3,45)
(0,38-1,10)
(0,10-1,26)
|
5,75
0,4
0,18
|
(1,90-17,34)
(0,14-1,13)
(0,03-0,96)
|
0,001
0,06
0,04
|
|
Sexe de l'enfant
Masculin
Féminin
|
1,8
R
|
(1,17-2,78)
|
4,35
R
|
(1,42-13,36)
|
0,007
R
|
|
ROTAVIRUS
|
|
Age de l'enfant (mois)
0-11
12-24
25-59
|
2,2
0,59
0,42
|
(1,23-3,91)
(0,31-1,10)
(0,12-1,39)
|
4,60
0,38
0,26
|
(1,59-13,30)
(0,13-1,11)
(0,05-1,39)
|
0,004
0,06
0,09
|
|
ADENOVIRUS
|
|
Age de l'enfant (mois)
0-11
12-24
25-59
|
2,2
0,46
0,75
|
(0,60-8,03)
(0,10-2,05)
(0,10-5,30)
|
2,50
0,41
0,71
|
(0,56-11,05)
(0,079-2,19)
(0,07-6,55)
|
0,19
0,25
0,62
|
|
PARASITES DIGESTIVES
|
|
Age de l'enfant (mois)
0-11
12-24
25-59
|
0,61
2,16
0,46
|
(0,23-1,62)
(0,85-5,48)
(0,06-3,10)
|
0,53
2,75
0,39
|
(0,15-1,82)
(0,81-9,27)
(0,04-3,45)
|
0,24
0,62
0,35
|
R = valeur de référence RR = Risque Relatif OR
= Odd Ratio IC = Intervalle de Confiance à 95%
De même, en effectuant le croisement des données
dans des tableaux statistiques pour tester l'association entre les types
d'alimentations des enfants avant la survenue de la diarrhée et les
causes de celle-ci, nous obtenons les données de tableau ci-dessous. Il
montre que l'alimentation diversifiée sans lait, l'allaitement
artificiel exclusif, l'allaitement mixte (+ lait domestique) et l'allaitement
mixte (+ lait industriel) agissent de manière significative sur la
survenue des à diarrhées rotavirus. Les valeurs p du Chi 2 sont
inférieures à 0,05. Donc on peut dire que dans cette
étude, les enfants recevant soit une alimentation diversifiée
sans lait, soit un allaitement artificiel exclusif, soit un allaitement mixte
(+ lait domestique) ou alors un allaitement mixte (+ lait industriel) ont une
probabilité plus élevée que ceux qui reçoivent un
allaitement maternel + autre liquide et ceux reçoivent un allaitement
maternel exclusifà faire la diarrhée à rotavirus. Par
ailleurs, nous n'avons obtenus aucune association significative entre ces types
d'alimentations et la survenue des diarrhées causées par
l'adénovirus et les parasites digestives.
Tableau 7 : Effets du type d'alimentation sur les
causes de la diarrhée
|
(RR)
|
IC à 95%
|
(OR)
|
IC à 95%
|
p-value
|
|
Rotavirus
Alimentation diversifiée sans lait
Allaitement artificiel exclusif
Allaitement maternel + autre liquide
Allaitement maternel exclusif
Allaitement mixte (+ lait domestique)
Allaitement mixte (+ lait industriel)
Lait + Diversification
|
0,22
2,20
0,57
0,69
1,75
1,93
2,50
|
(0,08-0,64)
(1,67-8,10)
(0,17-1,89)
(0,13-3,49)
(1,09-2,80)
(1,23-3,00)
(0,40-14,07)
|
0,09
3,47
0,40
0,54
3,63
5,64
2,40
|
(0,02-0,37)
(1,47-18,32)
(0,07-2,23)
(0,04-6,24)
(1,22-13,19)
(1,09-29,14)
(0,77-2,75)
|
0,0001
0,02
0,25
0,54
0,04
0,03
0,29
|
|
Adénovirus
Alimentation diversifiée sans lait
Allaitement artificiel exclusif
Allaitement maternel + autre liquide
Allaitement maternel exclusif
Allaitement mixte (+ lait domestique)
Allaitement mixte (+ lait industriel)
Lait + Diversification
|
1,00
0,000
2,29
0,000
1,75
0,000
1,19
|
(1,28-3,45)
(0,38-1,10)
(0,10-1,26)
(1,23-3,91)
(0,31-1,10)
(0,12-1,39)
(0,10-5,30)
|
1,00
0,000
2,80
0,000
1,95
0,000
1,23
|
(1,90-17,34)
(0,14-1,13)
(0,03-0,96)
(1,59-13,30)
(0,13-1,11)
(0,05-1,39)
(0,56-11,05)
|
0,64
0,73
0,26
0,64
0,31
0,19
0,62
|
|
Parasites digestives
Alimentation diversifiée sans lait
Allaitement artificiel exclusif
Allaitement maternel + autre liquide
Allaitement maternel exclusif
Allaitement mixte (+ lait domestique)
Allaitement mixte (+ lait industriel)
Lait + Diversification
|
1,50
0,000
0,62
1,54
0,58
0,41
2,60
|
(1,17-2,78)
(0,10-5,30)
(0,23-1,62)
(0,85-5,48)
(0,06-3,10)
(0,60-8,03)
(0,10-2,05)
|
1,70
0,000
0,55
1,81
0,51
0,34
4,18
|
(1,42-13,36)
(0,15-1,82)
(0,81-9,27)
(0,04-3,45)
(0,23-1,62)
(0,85-5,48)
(0,06-3,10)
|
0,29
0,60
0,50
0,54
0,34
0,29
0,11
|
R = valeur de référence
RR = Risque Relatif OR = Odd Ratio IC = Intervalle de Confiance à
95%
III.5 Devenir des enfants diarrhéiques
A J3, l'état clinique de la plus part des enfants
(40/63) faisait preuve d'une amélioration. 7/63 des cas
évoluaient vers une aggravation et 5/63 seulement aboutissaient à
une guérison. Par ailleurs nous déplorons un cas de
décès d'un enfant (garçon) de 8 mois.
A J7, la plus part des enfants dont 38 sur les 57 restant
avaient obtenus la guérison et 14 faisaient preuve d'une
amélioration parmi lesquels : 9 étaient positifs pour le
Rotavirus, 3 pour l'Adénovirus et 2 pour les parasites. Nous
déplorons ici également un cas de décès d'un
garçon de 13 mois.
DISCUSSION
Les maladies diarrhéiques sont un syndrome qui
présente une diversité épidémiologique,
étiologique et clinique. Notre objectif général dans cette
étude était d'évaluer l'implication des virus et de
certains parasites dans la survenue des diarrhées chez les enfants de
moins de 5 ans à l'hôpital régional de Bertoua,
Est-Cameroun. Ceci nous conduit à réaliser une étude
transversale descriptive chez les enfants en consultation pour la
diarrhée à l'hôpital régional de Bertoua.
Au cours de la présente étude qui s'est
déroulée pendant la période allant de Janvier à
Mars 2015, nous avons collecté et analysé 63 échantillons
de selles provenant d'enfants présentant une diarrhée. La
moyenne d'âge de cette population est de 15,49#177;11,39 mois.
Nos principaux résultats montrent qu'en moyenne, 18,16%
des enfants en consultation soufraient de la diarrhée (tableau 3). Ce
taux est supérieur à celui trouvé par NGWE et al.
(2007) lors d'une étude réalisée à Ebolowa dans la
région du Sud au Cameroun avec une fréquence de 10,9% ; et
par NGUENDO et al. (2008) à Yaoundé dans la
région du Centre au Cameroun (14,4%). Il est par ailleurs
inférieur au taux national qui est de 21% (EDS-MICS, 2011) ; et
celui trouvé par NGWE et al. (2007) à Maroua au Nord du
Cameroun (36%). La diarrhée est l'une des maladies infantiles les plus
meurtrières au Cameroun et 13% des décès chez les enfants
de moins de 5 ans sont dus aux maladies diarrhéiques. Les variations
climatiques de la région de l'EST sont entièrement compatibles
avec les données du profil saisonnier des diarrhées décrit
par NGWE et al. (2007) lors de l'étude des déterminants
socio-environnementaux de la morbidité diarrhéique des enfants de
moins de 5 ans au Cameroun. Ils affirment qu'ils existent deux pics de
diarrhée variant en fonction des saisons. Tout ceci pourrait justifier
cette fréquence des consultations pour la diarrhée chez les
enfants de moins de 5 ans à Bertoua pendant notre période
d'étude.
Dans notre étude, nous avons constaté que les
enfants de 0 à 11 mois sont les plus touchés par la
diarrhée avec 30 cas sur 63 (47,6%) (Tableau 4). Ce fort taux avait
déjà été rapporté par NGOUM et al. (2010)
lors d'une étude réalisée dans hôpitaux de la
ville de Yaoundé au Cameroun avec une fréquence de 65,6%;
par ORLANDI et al. (2006) à Porto Velho au Brésil
(53,3%) ; par DJENEBA (2006) au Centre Médical Saint Camille de
Ouédraogo au Burkina Faso avec une fréquence de (46,97%) ;
et par KONATE (2006) au CHU Gabriel Touré de Bamoko au Mali. Pendant la
première année de vie de l'enfant la diversité du
répertoire d'anticorps contre les agents infectieux est
limitée (Olives, 2008), ce qui pourrait justifier le fait qu'il soit
particulièrement exposé à la diarrhée. De plus,
c'est à cette période que se développe
progressivement l'immunité propre à l'enfant, pendant qu'il
se produit une baisse des anticorps d'origine maternelle.Le nourrisson est
alors plus vulnérable. A cela s'ajoute également la
diversification alimentaire de l'enfant et, lorsque celle-ci est mal
conduite, la malnutrition puis la diarrhée peut survenir (WGOGG,
2012). Au moment où l'enfant commence à se
déplacer librement, il mange la terre, il touche les objets autour de
lui et il met toute chose dans sa bouche : c'est la période de haut
contact avec les microbes pathogènes. Ce temps est bien
critique pour l'enfant car il commence à manger les aliments
communs et à boire l'eau, souvent non potable, comme tout le
monde.
En ce qui concerne les causes de diarrhées chez les
enfants de moins de 60 mois :
Sur l'ensemble de notre échantillon, nous avons
identifié 47,6% d'enfants positifs au test de Rotavirus (Tableau 5). Nos
résultats sont supérieurs à ceux obtenus respectivement
par NGOUM et al. (2010) à Yaoundé (32,80%), OLESEN et al. (2005)
au Danemark (13,2%) et DJENEBA (2006) à Ouédraogo au Burkina Faso
(22,73%), ORLANDI et al. (2006) à Porto Velho au Brésil
(23,6%), KONATE (2006) au Mali (36%) et FODHA et al. (2006) en Tunisie
(20%). Ces données montrent que les Rotavirus ont une incidence qui
varie d'un pays à l'autre et à l'intérieur d'un même
pays, mais restent le principal agent étiologique dans les
gastroentérites virales des enfants partout dans le monde (MATHIE L. et
al, 2006). Une forte fréquence de Rotavirus a
été mise en évidence chez les enfants de 0-11 mois (66,7%)
par rapport à ceux de 12-24 mois (23,3%) et ceux de 24-59 mois (10,0%)
(Figure 14). En effet, le taux de détection des Rotavirus est
élevé chez les enfants de moins de 12 mois par rapport à
ceux qui ont 24 moins et décroît fortement après 2 ans
(NGOUM et al. (2010). La première infection à rotavirus suscite
chez l'enfant une réponse immunitaire spécifique du
sérotype. Cette réponse s'amplifie à l'occasion de
contacts répétés, et l'immunité acquise au cours de
ces premières infections protège l'enfant contre une maladie
grave lors des expositions ultérieures à des rotavirus de
sérotypes différents (DJENEBA 2006). Ceci expliquerait donc cette
baisse de fréquence des rotavirus chez les enfants de 12 -24 mois
obtenue dans nos résultats.
Les Adénovirus ont été mis en
évidence neuf (9) fois sur l'ensemble de l'échantillon, soit une
fréquence de 14,3% (Tableau 5). Ce taux est inférieur
aux taux rapportés par MOGTOMO et al (2008) à Douala au
Cameroun (43,1%) et par KONATE (2006) au Mali (16%). mais il est
supérieur aux taux rapportés par NGOUM et al. (2010) à
Yaoundé (6,6%), FODHA et al. (2006) en Tunisie (6%) et DJENEBA (2006)
à Ouédraogo au Burkina Faso (1,52%). En effet les
Adénovirus entériques sont principalement reconnus comme agents
étiologiques importants de gastroentérites virales infantiles
dans les pays à climat tempéré (MOGTOMO et al
(2008). Par ailleurs,ce sont les virus les plus impliqués dans la
survenue des diarrhées chez les enfants en hospitalisation, ce qui
pourrait justifier cette fréquence.
En plus des agents pathogènes viraux mis en
évidence dans notre échantillon, les parasites intestinaux
se sont également révélés comme agents
étiologiques importants dans la survenue des diarrhées
infantiles. Nous avons identifié des Protozoaires et des Helminthes dans
22,22% des cas. Deux taux similaires avaient été rapportés
par LEHMAN et al. (2012) Douala au Cameroun (26,59), DJENEBA (2006)
à Ouédraogo au Burkina Faso (18,18%), et KONATE (2006) au Mali
(20%). La fréquence des Protozoaires (Entamoebahistolytica,
Giardia lambia,IsosporabelietTrichomonasintestinalis) est
de 14,3%. Elle est le double de celle des Helminthes (Ascaris
Lumbricoides,Strongyloïdesstercoraliset Hymenolepisnana) qui
est de 7,9% (tableau 5). La fréquence des Protozoaires se rapproche de
celle observée par LEHMAN et al. (2012) Douala au Cameroun
(13,07%) et Djénéba (2006) à Ouédraogo au Burkina
Faso (12,12%). Le mode de Transmission de ces Parasites (orale, par l'eau et
les aliments souillés et transcutané, par la terre
souillée de larves) explique leur présence élevée
chez les enfants âgés de plus de 12 mois dans notre
échantillon. Dans ce même contexte Entamoebahistolytica
est le parasite le plus fréquent (9,52%). Ce même constat a
été fait par LEHMAN et al. (2012) Douala au Cameroun
avec une fréquence de (10,33%).
Parmi les enfants atteints d'une coïnfection (11,1%), les
adénovirus étaient coinfectés avec les rotavirus dans 6,3%
des cas. En Afrique en général et au Cameroun en particulier, le
rotavirus et l'adénovirus sont les cause les plus communes de la
diarrhée grave chez les enfants en bas âge. Ce qui justifierait ce
fort taux de coïnfection, en rapport avec d'autres études (FODHA et
al, 2006 ; MOGTOMO et al, 2008 ; KONATE, 2006).
Dans 3 cas, l'infection parasitaire était associée à celle
du rotavirus. Les parasites mis en cause étaient :
Trichomonas intestinalis, Ascaris Lumbricoideset
Strongyloïdesstercoralis. Dans un cas, nous avons noté une
coïnfection entre le Rotavirus, l'Adénovirus et Ascaris
Lumbricoides. Cette possibilité de coïnfection des
rotavirus avec d'autres agents pathogènes que nous avons
trouvé a été également rapporté par
Certains auteurs, notamment une coïnfection avec certains parasites
intestinaux (ORLANDI et al., 2006). Ce constat nous montre donc que virus,
et parasites entériques pourraient entretenir une relation
symbiotique dans l'intestin, et ceci constitue sans doute un facteur
d'aggravation de la diarrhée chez l'hôte.
Dans notre étude nous avons remarqué que :
33,3% des enfants recevant une alimentation diversifiée sans lait;
3,2% des enfants recevant un allaitement artificiel exclusif ; 11,1% des
enfants recevant un allaitement maternel avec d'autre liquides ;
38,1% des enfants recevant un allaitement mixte (lait maternel plus lait
industriel et/ou domestique) ; et 9,5 % des enfants recevant le lait et
divers aliments (Tableau 4). De plus, les enfants recevant soit une
alimentation diversifiée sans lait, soit un allaitement artificiel
exclusif, soit un allaitement mixte (+ lait domestique) ou alors un allaitement
mixte (+ lait industriel) avaient une probabilité plus
élevée que ceux qui reçoivent un allaitement maternel +
autre liquide et ceux reçoivent un allaitement maternel exclusif
à faire la diarrhée à rotavirus. Comme on le sait, la
durée de l'allaitement et le mode d'allaitement contribuent à la
mortalité des enfants en favorisant leur exposition aux risques
d'infection et de malnutrition. Ceux-ci incluent le risque de morbidité
diarrhéique (NGWE et al. (2007). Bref, l'allaitement
artificiel, l'alimentation inadéquate et les mauvaises pratiques de
sevrage (arrêt précoce de l'alimentation au lait maternel) en
pratique dans cette zone du pays seraient à l'origine de cette haute
fréquence des diarrhées infectieuses (ATOKARE, 2008). De plus Les
agents infectieux qui provoquent les diarrhées se propagent par
l'ingestion d'aliments ou d'eau contaminée, ou par contact de mains
souillées, d'où la nécessité du respect stricte des
mesures d'hygiène.
Parmi les biais qu'il convient de noter dans notre
étude, nous pouvons citer principalement le biais d'information qui
serait dû au fait que certaines interviews se sont
déroulées par l'intermédiaire d'un traducteur. Ceci
limitait parfois le niveau d'exploration des antécédents de
certains enfants. Ce biais a été contrôlé beaucoup
plus par les investigations cliniques des enfants.
CONCLUSION ET
RECOMMENDATIONS
Les diarrhées infantiles posent un problème de
santé publique et constituent une préoccupation quotidienne et
alarmante dans le monde en général et dans les pays en voie de
développement comme le Cameroun en particulier. Elles peuvent être
causées par un spectreélargi de virus, de parasites et
bactériesenteropathogènes. Cette étude que nous avons
réalisée montre que les diarrhées (qui
représentaient 18,16% des consultations chez les enfants de moins de
5ans à l'Hôpital Régional de Bertoua) touchent avec
prédilection l'enfant en bas âge (47,6% de cas chez les enfants de
moins de 12 mois) et, elles sont dans 71,43% des cas dus à des virus et
des parasites dans notre échantillon. Parmi ces étiologies, les
virus occupent une place importante (53,97%) particulièrement les
rotavirus à forte fréquence (47,6%) et à une
fréquence moindre les adénovirus (14,3%). Les parasites
intestinaux constituent 22,22% des étiologies infectieuses avec une plus
grande fréquence de Protozoaires (14,3%) que d'Helminthes (7,9%). Ces
parasites intestinaux ont été isolés principalement chez
les enfants de plus de 12 mois. L'étude conjointe des virus et des
parasites a montrée un taux global de coïnfections de 11,11% avec
une forte fréquence (7,94%) chez les enfants de bas âge (moins de
12 mois). Il ressort donc de notre étude que les diarrhées
virales infantiles notamment les rotaviroses occupent une place importante dans
les pathologies de l'enfant particulièrement l'enfant de moins de 12
mois, mais le rôle des parasites n'est pas à négliger. Il
ressort également de notre étude que les enfants ne recevant pas
une alimentation adéquate et ceux chez qui les règles globales
d'hygiène ne sont pas appliquées présentent toujours des
risques d'infections par les agents de la diarrhée, ainsi que ceux qui
ne suivent pas normalement le programme de vaccination.
Les différents résultats d'études
préliminaires obtenus dans ce document nous permettent d'envisager les
perspectives suivantes:
|
Responsables
|
Mécanismes de suivi
|
|
Créer des sites sentinelles de surveillance du
rotavirus dans tous les Hôpitaux de référence du pays dans
le but de mieux évaluer le poids des maladies diarrhéiques
Créer un comité national de lutte contre les
maladies diarrhéiques dont la vocation sera entre autres le suivi
épidémiologique
Assurer une éducation sanitaire des mères lors
des CPN et des séances de réhabilitation nutritionnelle
|
Ministère de la santé
|
Rapport annuel de la mise en oeuvre des activités du
Ministère de Santé
|
|
Elargir une telle étude dans toute la ville de Bertoua
et même dans toute la région de l'EST, ceci sur une plus longue
durée avoir de meilleures données statistiques, et y identifier
les différents génotypes des Rotavirus circulants à
travers des recherches moléculaires en vue de mieux cerner la biologie
du rotavirus et l'importance de sa circulation au sein de la population
|
Chercheurs
|
Rapports, Résultats des études et publications
|
|
Adopter un schéma thérapeutique adéquat
des diarrhées infantiles en fonction des germes couramment
trouvés dans leurs selles
Evaluer correctement l'état d'hydratation d'un enfant
diarrhéique
Assurer la prise charge correcte d'une déshydratation
chez un enfant diarrhéique
Eviter l'antibiothérapie en première intention
et encore moins systématique chez l'enfant diarrhéique qui
souvent peut créer une résistance
|
Personnel soignant
|
Registres de consultation et Fiches de traitement
|
|
Eduquer les mères pour la promotion de l'allaitement
maternel exclusif jusqu'à l'âge de 6 mois de vie sauf
contre-indication médicale
Sensibiliser les mères afin qu'elles ne minimisent pas
la survenue d'une diarrhée chez leurs enfants et organiser des campagnes
de sensibilisation dans le but de promulguer les directives de l'OMS concernant
le traitement des diarrhées à domicile
|
Personnel soignant, agents de santé, Responsables des
associations
|
Rapports d'activités des centres de santé
|
|
Eviter l'automédication et les traitements
traditionnels qui sont souvent inefficaces et/ou néfastes
Changer de comportement en vue d'éviter les maladies
diarrhéiques par le respect strict des règles d'hygiène et
d'assainissement
|
Parents des enfants
|
Histoire de la maladie
|
REFERENCES
BIBLIOGRAPHIQUES
AGNES BASSIGNOT, 2003 : Les gastro-entérites virales.
CHU Jean Minzoz Besançon, 20 p.
ATAMBAY M., KARAMAN U., AYCAN O. M., DALDAL N.,
2002.Cultivation of Trichomonasintestinalis in CPLM media.Derg., 9
(1): 29-31.
ATOKARE A., 2008. Facteurs explicatifs de la morbidité
diarrhéique chez les enfants de moins de cinq ans au Tchad.
Mémoire de DESS en démographie, Université de
Yaoundé II, Cameroun, 94 p. disponible sur :
http://www.memoireonline.com/01/13/6802/m_Facteursexplicatifs-de-la-morbidite-diarrheique-chez-les-enfants-de-moins-de-cinq-ans-au
Tchad0.html. Consulté le 13 Février 2015.
AUGUSTIN YOUMBI, LOUISETTE CLEMENCE BAMZOK, CHARLES TCHOUGANG,
Consultants du PNUD. Projet n°CAM/2000/008/08/56, Programmes Municipaux
Intégrés de Lutte contre la Pauvreté dans la Commune
Urbaine de Bertoua : ville a aménager pour réduire la
pauvreté, Juillet 2001, 45 p.
BAJOLET O. & CHIPPAUX-HYPPOLITE C., 1998. Les rotavirus et
autres virus de diarrhées. Faculté de Médecine de Reims,
n° PF08, 6 pp.
BENHAMOU Y., FARTOUX L. et GOULENOK C., 1998.
Gastro-entérologie. Edit. MEDLINE, ISBN: 2-84371-031-6 / ISSN:
2-908763-51-6.344 p.
BM (BANQUE MONDIALE), 2014 : Traitement de la
diarrhée (% d'enfants de moins de 5 ans recevant une
réhydratation orale et une alimentation continue) ; disponible
à :
http://donnees.banquemondiale.org/indicateur/SH.STA.ORCF.ZS.
Consulté le 19 Février 2015.
BOSHUIZEN J.A., REIMERINK J.H.J., MALE K.A.M., VAN HAM V.J.J.,
KOOPMANS M.P.G., BULLER H.A., DEKKER J., and EINERHAND A.W.C., 2003. Changes in
small intestinal homeostasis, morphology, and gene expression during rotavirus
infection of infant mice. . Journal of Virology, 77 (24):
13005-13016.
BRYCE J., BOSCHI-PINTO C., SHIBUYA K., BLACK RE. WHO estimates
of the causes of death in children.Lancet, 365(9409: 1147-1152, 2005.
DICTIONNAIRE LAROUSSE MEDICAL, 2006. Larousse, MEDECINE/SANTE,
langue Française, ISBN-10: 2035604257, 1219 p.
DJENEBA O., 2006. Prévalence des infections à
Rotavirus, Adénovirus et Parasites Entériques chez les enfants
VIH-séropositifs et VIH-séronégatifs de 0 à 5ans au
Centre Médical Saint Camille. Mémoire de DEA en Sciences
Biologiques Appliquées, Université de Ouagadougou, Burkina-Faso,
73p.
EL MOHAMADY H., ABDEL-MESSIH IA., YOUSSEF FG., SAID M., FARAG
H., SHAHEEN HI., et al., 2006. Enteric pathogens associated with
diarrhea in children in Fayoum, Egypt. DiagnMicrobiol Infect Dis 56, 1-5.
FODHA I., CHOUIKA A., PEENZE I., BEER M., DEWAR J., GEYER A.,
MESSADI F., TRABELSI A., BOUJAAF AR N., TAYLOR M.B. and STEELE D.,
2006.Identification of viral agents causing diarrhea among children in eastern
center of Tunisia.J. Med. Virol, 78: 1198-1203.
GELAIS, 2008. Les maladies diarrhéiques. Disponible
sur :
http://fr.wikipedia.org/wiki/diarrhée.
Consulté le 19 Février 2015. 5 p.
GIORDANO M.O., FERREYRA L.J., ISA M.B., MARTINEZ L.C.,
YUDOWSKY S.I. and NATES S.V., 2001. The epidemiology of acute viral
gastroenteritis in hospitalized children in Cordoba city, Argentina: an insight
of disease burden. Rev. Inst. Med.Trop. S.Paulo43 (4): 193-197.
GRENIER B. et al. 1981. Diagnoctic rapide de
l'infection digestive à rptavirus par 2 testimmunoenzymatiques ELISA :
Comparaison avec les résultats de la microscopie électronique.
Med. Mal. Infect., 11, N?14. Bis, 640-45.
INS, 2012. Enquête démographique et de
santé et à indicateurs multiples (EDS-MICS) 2011, Cameroun, 4:
576 p.
KONATE B., 2006. Surveillance épidémiologique
des diarrhées à rotavirus chez les enfants de moins de 5 ans dans
le service de pédiatrie du Centre Hospitalier Universitaire (CHU)
Gabriel Touré Bamako - Mali. Thèse de Doctorat en
Médecine, Université de Bamako au Mali, 158 p. disponible sur :
Surveillance-épidémiologique-des-diarrhées-à-rotavirus-chez-les-enfants-de-moins-de-5-ans-Bamako
- Mali.html. Consulté le 03 Février 2015.
LANGET, 2002. Traitement de la diarrhée et
l'utilisation de la thérapie par réhydratation orale. OMS/FISE,
Génève 1989.
LEHMAN L.G., KOUODJIP NONO L., BILONG BILONG C.F., 2013.
Diagnostic des parasitoses intestinales à l'aide de la microscopie
à fluorescence, Médecine d'Afrique Noire. vol.59, N°7.
LOISY F., 2004. Devenir des virus entérique humains en
milieu marin: Apport des VLPs (Virus LikeParticles) pour la purification des
coquillages. Thèse Doct. n°823 Univ Paris XI.
LUZ C.R., MASCARENHAS J.D., GABBAY Y.B., MOTTA A.R., LIMA
T.V., SOARES L.S. and LINHARES A.C., 2005. Rotavirus serotypes and
electrophoretypes identified among hospitalised children in Sao Luis, Maranhao,
Brasil. Rev. Ins. Med. Trop. SaoPaulo, 47 (5): 287-293.
MATHIE L., EMMANUEL G.L, ANTOINE B., 2006.
Épidémiologie de la diarrhée à rotavirus dans le
monde. Mt pédiatrie, vol. 9, Numéro spécial. 6 p.
MENDEZ-TOSS M., GRIFFIN D.D., CALVA J., CONTRERAS J.F., PUERTO
F.I., MOTA F., GUISCAFRE H., CEDILLO R., MUNOZ O., HERRERA I., LOPEZ S., ARIAS
C.F., 2004. Prevalence and genetic diversity of human astroviruses in Mexican
children with symptomatic and asymptomatic infections.Journal of Clinical
Microbiology, 42 (1): 151-157.
MOGTOMO M.L.K., NDOMBOH GHOGOMU H.M., TCHOUMBOU KAMDJOUM S.I.,
BAANE P.M., NGONO NGANE A., 2008. Incidence of adenovirus detected by
immunoenzymatic assay from children hospitalized with acute gastroenteritis in
Douala, Cameroon. Int. J. Biol. Chem. Sci. 2(2): 220-223. Available online at
http://www.ajol.info.Cnsulté le
13Mars 2015. 4 p.
MS.IFMT, 2005. Maladies diarrhéiques : vue
d'ensemble. Séminaire sur les Diarrhées. 41 p.
NAVARO J., SCHMITZ J., 2000. Gastroentérologie
pédiatrique. FLAMMARION, ISBN: 2-257-12481-2. 774 p.
NEMATIAN J., NEMATIAN E., GHOLAMREZANEZHAD A., ASGARIA. A.,
2004.Prevalence of intestinal parasitic infections and their relation with
socio-economic factors and hygienic habits in Tehran primary school
students.Acta Tropica, 92: 179-186.
NGUENDO Y.B., SALEM G., BRUNEAU J.C., 2008.
Épidémiologie géographique des maladies
diarrhéiques à Yaoundé (Cameroun). Rapport de recherche,
Université de Chicoutimi, Québec. 21 p.
NGUM et al., 2010. Enteric Prevalence of Rotavirus
and Adenovirus in Under Five Children Predisposed to Acute Diarrhea in
Yaoundé Cameroon. Health Sci. Dis: Vol 11 (3). 7 p.
NGWE E., BANZA-NSUNGU B., 2007. Les déterminants
socio-environnementaux de la morbidité diarrhéique des enfants de
moins de 5 ans en milieu urbain au Cameroun : les villes d'Ebolowa et Maroua.
Rapport de recherche final IFORD, Yaoundé. 61 p. disponible sur :
http://pripode.cicred.org/IMG/pdf_CM1-FinalReport.pdf.
Consulté le 13 Février 2015.
O.M.S: WORLD HEALTH ORGANIZATION, 2012. Rotavirus deaths in
children under 5 years of age, January 2012. Available at:
www.who.int/entity/immunization_monitoring/burden/ChidRota2008.xls.
OLESEN B., NEIMANN J., BOTTIGER B., ETHELBERG S., SCHIELLERUP
P., JENSEN C., HELMS M., SCHEUTZ F., OLSEN K.E.P., KROGFELT K., PETERSEN E.,
MOLBAK K., GERNER-SMIDT P., 2005. Etiology of diarrhea in young children in
Denmark: a case-control study. Journal of Clinical Microbiology , 43
(8): 3636-3641.
OLIVARESA J.L., FERNANDEZA R., FLETAA J., RUIZA M.Y., CLAVELB
A. MORENOC L. A., 2004. Iron deficiency in children with Giardia
lambliaand Enterobiusvermicularis. Nutrition Research, 24:
1-5.
OLIVES J.P., 2008 : pathologie de l'intestin grêle
du colon et proctologie, diarrhées aigues du nourrisson orientation
diagnostique, 117p.
OUMNIA N., 2010. Diagnostic et traitement d'une
diarrhée aigüe de l'adulte, JFMC Kouba, 111 p.
PATH, 2014. Infections à rotavirus et vaccins
préventifs au Cameroun. Disponible sur :
http://www.path.org/publications/files/IMM_solutions_global_killer.pdf.
PIGNATELLI S., SIMPORE J., RUGGIERI M., MUSUMECI S., 2000.
Effectiveness of forced rehydration and early re-feeding in the treatment of
acute diarrhoea in a tropical area.MinervaPediatr., 52
(7-8):357-366.
PILLY TROP, 2012. Maladies infectieuses tropicales 2012.
Édition web : www.infectiologie.com, 975p.
RAHMAN M., DE LEENER K., GOEGEBUER T., WOLLANTS E., VAN DER
DONCK I., VAN HOOVELS L., VAN RANST M., 2003. Genetic characterization of a
novel, Naturally occurring recombinant human G6P [6] rotavirus. Journal of
Clinical Microbiology, 41 (5): 2088-2095.
ROXSTROM-LINDQUIST K., RINGQVIST E., PALM D., SVARD S., 2005.
Giardia lamblia-Induced Changes in gene expression in differentiated
Caco-2 human intestinal epithelial cells.Infection and Immunity, 73
(12): 8204-8208.
SCHAECHTER, MEDOFF, EISENSTEIN, 1999. Microbiologie et
pathologies infectieuses. LUÇON, ISBN: 2-8041-1592-5. 973 p.
TARAPOREWALA Z.F., SCHUCK P., RAMIG R.F., SILVESTRI L. PATTON
J.T., 2002. Analysis of a temperature-sensitive mutant Rotavirus indicates that
NSP2 octamers are the functional form of the protein. Journal of
Virology, 76 (14): 7082-7093.
TATE J.E., BURTON A.H., BOSCHI-PINTO C., et al. 2008.
Estimate of worldwide rotavirus associated mortality in children younger than 5
years before the introduction of universal rotavirus vaccination programmes: a
systematic review and meta-analysis. The Lancet Infectious Diseases. 2012;
12(2): 136-141
UHNOO I., WADELL G., SVENSSON L. and JOHANSSON M.E.,
1984.Importance of enteric adenoviruses 40 and 41 in acute gastroenteritis in
infants and young children.Journal of Clinical Microbiology , 20 (3):
365-372.
UKOLI F.M.A., 1984.Introduction to parasitology in tropical
Africa.édit. JOH WILEY & SONS, ISBN: 0-471-10371-3. 464 p.
UNICEF, 2012. Lutter contre les maladies les plus mortelles
pour les enfants les plus pauvres du monde, Pneumonie et Diarrhée. 91
p.
WANG F., PUDDY A.C., MATHIS B.C., MONTALVO A.G., LOUIS A.A.,
McMACKIN J.L., XU J., ZHANG Y., TAN C.Y., SCHOFIELD T.L., WOLF J.J., LEWIS
J.A., 2005. Using QPCR to assign infectious potencies to adenovirus based
vaccines and vectors for gene therapy: toward a universal method for the facile
quantitation of virus and vector potency. Vaccine 23: 4500-4508.
WGOGG (World Gastroenterology Organisation Global Guidelines),
2012 : La diarrhée aigüe chez lesadultes et les enfants:une
approche globale, 28p.
YAKOOB J., JAFRI W., ABID S., JAFRI N., HAMID S., SHAH H.A.,
RIZVI L., ISLAM M., SHAIKH H., 2005. Giardiasis in patients with dyspeptic
symptoms.World Journal ofGastroenterology, 11 (42): 6667-6670.
ANNEXES

|
|



