|
Liste des abréviations
um : micromètre
°C : degré Celsius
a* : l'indice de rouge
AG : acide gras
AGPI : Acides gras poly-insaturés
ASR : Anaérobies sulfito-réducteurs
Aw : activité de l'eau
b* : l'indice de jaune
BCC : Bouillon coeur Cervelle
BP : baird parker
C* : chromaticité ou saturation
C.I.E. : commission Internationale de l'Eclairage
CIRC : Centre international de recherche sur le cancer
CT : Coliformes totaux
CUD : coefficient d'utilisation digestive
E. coui : Escherichia Coui
EPT : Eau peptonée tamponnée
FMAT : flore mésophile aérobie totale
g : gramme
GN : gélose nutritive
h : heure
H* : teinte
HK : Hektoen
HMPIT : Hôpital militaire d'instruction de Tunis
INRAT : Institut Nationale des Recherches Agronomique de
Tunis
Kg : kilogramme
KH : Kligler-Hajna
L* : luminosité
LMAA : Laboratoire militaire d'analyse alimentaire
m : limite minimale
M : limite maximale
Max : maximum
MDA : malonaldéhyde
Mg : milligramme
Min : minimum
ml : mililitre
Mm : millimètre
Mt : millions tonnes
OEP : Office de l'élevage et des pâturages
PCA :Plate Count Agar
PEC : perte à la cuisson
pH : potentiel hydrogène
RVS : Bouillon Rappaport-Vassiliadis
t : tonnes
T : Température
TBX : Tryptone bile X-glucuronide
Tc : température de cristallisation
TS : Tryptone sel
TSC : Tryptone-Sulfite-Cyclosérine
Ufc : unité formant une colonie
VRBL : Cristal violet et au rouge neutre
XLD : Xylose-Lysine-Désoxycholate
Liste des figures
|
Figure 1 : Différentes catégories
des viandes rouges
|
3
|
|
Figure 2 : Evolution de l'effectif du cheptel
bovin
|
4
|
|
Figure 3 : Evolution de l'effectif ovin (en
unité femelles) en Tunisie
|
..5
|
|
Figure 4 : Qualité de la viande
|
..9
|
|
Figure 5 : Evolution du pH musculaire
après l'abattage
|
.12
|
|
Figure 6 : Les différentes formes
chimiques de la myoglobine
|
..14
|
|
Figure 7 : classes de couleurs de viande
|
.14
|
|
Figure 8: Classification des microorganismes
selon la valeur de l'Aw
|
..21
|
|
Figure 9 : Classification des germes selon la
température de croissance
|
23
|
|
Figure 10 : Effets de la température sur
la croissance des bactéries
|
23
|
Figure 11 : Illustration de la morphologie
cristalline en fonction de la cinétique de
|
refroidissement
|
.25
|
|
Figure 12 : Les différentes phases de la
congélation d'un échantillon
|
25
|
|
Figure 13 : Diagramme d'utilisation des viandes
rouges
|
30
|
|
Figure 14 : Protocole de travail
|
31
|
|
Figure 15 : Prélèvement au niveau
du muscle gigot d'une agnelle
|
32
|
|
Figure 16 : homogénéisateur de
type « Stomacher »
|
..34
|
|
Figure 17 : Préparation de la suspension
mère et des dilutions décimales
|
.34
|
|
Figure 18 : Dénombrement des germes
totaux sur milieu PCA
|
.37
|
|
Figure 19 : Dénombrement des coliformes
totaux sur milieu VRBL
|
.37
|
|
Figure 20 : Dénombrement
d'Escherichia coui sur le milieu TBX
|
.38
|
|
Figure 21 : Etalement sur milieu baird parker
|
38
|
et des bovins .64
Figure 22 : Dénombrement des
Staphylococcus aureus sur milieu BP
|
..39
|
|
Figure 23 : Confirmation des staphylocoques
coagulase (+)
|
..40
|
|
Figure 24: Transfert de 0,1 ml d'inoculum dans
10ml de bouillon RVS
|
43
|
|
Figure 25 : Isolement de la Salmonella
en milieu XLD
|
.43
|
|
Figure 26 : Isolement de la Salmonella
en milieu HK
|
43
|
|
Figure 27 : Test d'urée indole
|
.45
|
|
Figure 28: Test Triple Sugar Iron sur milieu
Kligler-Hajna
|
46
|
|
Figure 29 : Galerie API 20E
caractéristique du Salmonella
|
47
|
|
Figure 30 : Etapes de l'utilisation de la
galerie API 20E
|
....48
|
|
Figure 31 : Mesure de Ph
|
49
|
|
Figure 32 : Détermination de la couleur
|
.50
|
|
Figure 33 : Bain marie à 75°C
|
50
|
Figure 34 : Flore mésophile
aérobie totale de la viande ovine et la viande bovine à
l'état frais
et congelé .54
Figure 35 : La charge en coliformes totaux de
la viande ovine et la viande bovine à l'état frais
et congelé .56
Figure 36 : La charge en Escherichia coli
dans les échantillons de la viande ovine à l'état
frais et congelé 57
Figure 37 : La charge en bactéries
anaérobies sulfito-réductrices chez la viande ovine à
l'état
frais et congelé .59
Figure 38 : Répartition des
résultats de satisfaction pour les Salmonelles avant et après
la
congélation 60
Figure 39 : Les valeurs moyennes de pH de la
viande fraiche et la viande congelée des ovins
Figure 40 : Les valeurs moyennes de contenu
en MDA de la viande fraiche et la viande
congelée des ovins et des bovins ..65
Figure 41 : les valeurs de l'indice de rouge
a* de la viande fraiche et la viande congelée des
ovins et des bovins 65
Figure 42 : les valeurs de l'indice de jaune
b* de la viande fraiche et la viande congelée des
ovins et des bovins 66
Figure 43 : Les valeurs de la
luminosité L* de la viande fraiche et la viande congelée des
ovins et des bovins 66
Figure 44 : Les valeurs moyennes de la teinte
(h) de la viande fraiche et la viande congelée
des ovins et des bovins .67
Figure 45 : Les valeurs de la
chromaticité C* de la viande fraiche et la viande congelée des
ovins et des bovins 68
Figure 46 : Les pourcentages moyennes de la
perte à la cuisson de la viande fraiche et la
viande congelée des ovins et des bovins ..69
Figure 47 : Les pourcentages moyennes de la
teneur en eau de la viande fraiche et la viande
congelée des les ovins et les bovins .69
Liste des tableaux
Tableau 1 : La consommation des viandes
rouges (Bovine +ovine) dans le monde 2
Tableau 2 : Evolution des effectifs bovins,
ovins et caprins en mille têtes .4
Tableau 3 : Evolution de la production des
viandes rouges en mille tonnes 6
Tableau 4 : consommation des viandes rouges
en Tunisie en mille tonnes 6
Tableau 5 : Composition biochimique moyenne
de la viande rouge 10
Tableau 6 : pH de croissance de quelques
microorganismes .22
Tableau 7 : Principales analyses
effectuées par le LMAA 33
Tableau 8 : Aspect des colonies
présumées Salmonella sur les deux milieux
ensemencés...43
Tableau 9 : Les critères biochimiques
du Salmonella spp .46
Tableau 10 : Flore mésophile
aérobie totale de la viande ovine à l'état frais et
congelé 53
Tableau 11 : Flore mésophile
aérobie totale de la viande bovine à l'état frais et
congelé 54
|
Tableau 12 : La charge en coliformes totaux dans
la viande ovine
|
55
|
|
Tableau 13 : La charge en coliformes totaux dans
la viande bovine
|
..55
|
|
Tableau 14 : La charge en Escherichia coli
dans les échantillons de la viande ovine
|
57
|
Tableau 15 : La charge en bactéries
anaérobies sulfito-réductrices chez la viande ovine......58
Tableau 16 : La charge en Staphylococcus aureus dans
les échantillons de la viande ovine.59 Tableau 17 : les
résultats des paramètres physicochimiques dans les
échantillons de la viande
ovine .62
Tableau 18 : les résultats des
paramètres physicochimiques dans les échantillons de la viande
bovine 63
Sommaire
Introduction 1
Synthèse bibliographique 2
I. Viande rouge dans le monde 2
II. Filière viande rouge en Tunisie 3
1. Effectif animal 3
1.1. Effectif bovin 4
1.2. Effectif ovin 5
2. Evolution de la production des viandes rouges 5
3. Consommation de la viande rouge en Tunisie 6
III. Généralités sur la viande 7
1. Définitions 7
1.1. La viande 7
1.2. Le muscle 7
2. Transformation de muscles en viande 8
3. Qualités de la viande 8
3.1. Qualités nutritionnelles 9
3.1.1. Protéines 10
3.1.2. Glucides 10
3.1.3. Les lipides 10
3.1.4. Les minéraux 11
3.1.5. Les vitamines 11
3.2. Qualités technologiques 11
3.2.1. pH 11
3.2.2. Le pouvoir de rétention d'eau 12
3.2.3. Oxydation des lipides de la viande 13
3.3. Qualités organoleptiques 13
3.3.1. Couleur 14
3.3.2. Tendreté 15
3.3.3. Jutosité 15
3.3.4. Flaveur 16
3.4. Qualité hygiénique 16
4. Microbiologie de la viande rouge 17
4.1. Microorganismes d'altération 17
4.1.1. Les germes saprophytes 18
4.1.2. Microorganismes indicateurs d'une contamination
fécale 18
4.1.3. Microorganismes indicateurs d'hygiène
générale : Flore mésophile aérobie
totale ..19
4.2. Microorganismes pathogène 19
4.2.1. Les salmonelles 19
4.2.2. Staphylococcus aureus 20
4.2.3. Anaérobies sulfito-réductrices (ASR) 20
4.3. Conditions de multiplication des microorganismes 20
4.3.1. Les nutriments 20
4.3.2. L'activité de l'eau 20
4.3.3. Le pH 21
4.3.4. Le potentiel d'oxydoréduction 22
4.3.5. La température 22
5. Congélation 24
5.1. Définition 24
5.2. Etapes de la congélation 25
5.3. Effet de la congélation sur la qualité de la
viande 26
5.3.1. Modifications physicochimiques 26
5.3.2. Effet sur les microorganismes 26
5.4. Décongélation 27
Matériel et méthodes 28
I. Objectif de travail 28
II. Présentation des lieux de stage 28
1. LMAA 28
2. INRAT 29
III. Echantillonnage 29
1. Diagramme d'utilisation des viandes rouges 30
2. Prélèvement 31
3. Transfert des échantillons 32
IV. Analyses microbiologiques 32
1. Réception des échantillons 33
2. Choix de diluant 34
3. Milieux de culture 34
4. Préparation de suspension mère 34
4.1. Pesée 34
4.2. Dilutions décimales 35
5. Ensemencement 36
5.1. Ensemencement en surface 36
5.2. Ensemencement en profondeur 36
6. Protocoles de recherche et de dénombrement des germes
36
6.1. Flore mésophile aérobie totale (NF ISO 4833 :
2003) 36
6.2. Coliformes totaux à 30°C (NF EN ISO 4833/2003)
37
6.3. Escherichia Coli (NF ISO 21528 - 2 :2004) 38
6.4. Les staphylocoques à coagulase positive (NFEN ISO
6888-1: 1999.2004 / NF V
08-057-1:2004) 38
|
|
6.5. Les bactéries anaérobies
sulfito-réductrices (ISO 15213:2003)
|
40
|
|
|
6.6. Expression des résultats (norme ISO 7218 : 2007)
|
41
|
|
|
6.7. Recherche des salmonelles (ISO 6579 : 2002)
|
42
|
|
|
6.7.1. Pré-enrichissement
|
42
|
|
|
6.7.2. Enrichissement
|
42
|
|
|
6.7.3. Isolement
|
43
|
|
|
6.7.4. Confirmation biochimique
|
44
|
|
V.
|
|
Analyses physico-chimiques (effectuées à l'INRAT)
|
49
|
|
1.
|
Mesure de pH
|
49
|
|
2.
|
Détermination de la couleur
|
49
|
|
3.
|
Détermination de la perte d'eau à la cuisson
|
50
|
|
4.
|
Détermination de l'oxydation des lipides : méthode
Thiobarbituric Reactive Substance
|
|
(TBARS)
|
51
|
|
5.
|
Traitement des données et analyses statistiques
|
52
|
|
|
Résultats et discussion
|
53
|
|
I.
|
|
La qualité microbiologique
|
53
|
|
1.
|
Flore anaérobie mésophile totale
|
53
|
|
2.
|
Coliformes totaux à 30°C
|
55
|
|
3.
|
Escherichia coli
56
|
|
|
4.
|
Les bactéries anaérobies sulfito-réductrices
|
58
|
|
5.
|
Staphylococcus aureus
|
59
|
|
6.
|
Salmonella spp
|
60
|
|
II.
|
|
Les paramètres physicochimiques
|
61
|
|
1.
|
pH
|
61
|
|
2.
|
Etude de l'état oxydatif des lipides
|
64
|
|
3.
|
Couleur
|
65
|
|
|
3.1. L'indice de rouge a* et l'indice de jaune b*
|
65
|
|
3.2.
|
Luminosité L*
|
66
|
|
3.3.
|
La teinte Hue
|
67
|
|
3.4.
|
Chromaticité C
|
67
|
|
4.
|
La perte de l'eau à la cuisson
|
68
|
|
5.
|
La teneur en eau
|
69
|
|
|
Conclusion et perspectives
|
70
|
|
|
Références bibliographique
|
72
|
Introduction
La viande rouge occupe une place importante dans
l'alimentation et représente une source incontournable de
protéines pour l'Homme (CIVLAIT, 2015). En effet, les viandes
possèdent une valeur nutritionnelle très élevée car
elles sont constituées de protéines digestes, riches en acides
aminés indispensables. C'est aussi une bonne source de fer et de
vitamines hydrosolubles.
La filière des viandes rouges en Tunisie couvre un
ensemble de maillons allant de la production à la consommation, elle
englobe les viandes des espèces bovines, ovines, caprines, qui sont les
plus consommées en Tunisie, et accessoirement camélines et
équines (GIVLAIT, 2015).
Les viandes sont considérées comme des
denrées très périssables ; leur production industrielle
n'est envisageable que si elle est associée à des méthodes
de conservation fiables et de durée convenable.
Plusieurs techniques peuvent être utilisées pour
conserver les viandes. La congélation est l'une des méthodes
privilégiées pour accroître la durée de conservation
des viandes et fournir une qualité microbiologique, physicochimique et
organoleptique acceptable (Chougui, 2015). Elle repose sur la transformation de
l'eau liquide en glace provoquant ainsi une diminution de l'activité de
l'eau du produit. Ceci induit à la fois une réduction de
l'activité microbiologique et un ralentissement des réactions
biochimiques, responsables de la dégradation de sa qualité
(Brice, 2004).
Ainsi, le présent projet consiste à
étudier l'effet de la congélation sur la qualité
microbiologique et physicochimique des viandes rouges consommées au sein
de l'Hôpital militaire d'instruction de Tunis.
Ce travail comporte trois parties :
? Une synthèse bibliographique rapportant des
informations à propos la viande rouge dans le monde et en particulier en
Tunisie, les facteurs de la qualité de la viande rouge et aussi les
méthodes de conservation dont principalement la congélation.
? Une partie comporte notre objectif de recherche, le
matériel et les méthodes utilisés pour l'analyse
microbiologique et physicochimique des viandes.
? Une troisième partie regroupe les résultats et la
discussion.
1
Synthèse bibliographique
I. Viande rouge dans le monde
La consommation de viande rouge dans un pays varie
principalement selon le pouvoir d'achat des habitants ; entre la période
1971-1980 et la période 2000-2007, la consommation des viandes rouges
est passée de 12,4 kg/habitant dont 10,8 kg/habitant de viande bovine et
1,6 kg/habitant de viande ovine, à 11,2 kg/habitant dont 9,4 kg/habitant
de viande bovine et 1,8 kg/habitant de viande ovine, comme l'indique le tableau
1(FAO, 2009).
Tableau 1 : La consommation des viandes rouges
(Bovine +ovine) dans le monde
(FAO, 2009)
|
En Kg/habitant
|
1971-1980
|
1981-1990
|
1990-2000
|
2001-2007
|
|
Viande bovine
|
10,8
|
10,4
|
9,7
|
9,4
|
|
Viande ovine
|
1,6
|
1,7
|
1,8
|
1,8
|
|
Viandes rouges
(bovine+ovine)
|
12,4
|
12,1
|
11,6
|
11,2
|
Le marché mondial de la viande bovine a stagné
en 2015 à cause du ralentissement économique global. La
production de viande a globalement stagné mais le marché des
bovins vivants est resté dynamique. En 2015, les principaux producteurs
mondiaux de viande bovine étaient : les États-Unis avec 10,70 Mt
de viande, le Brésil avec 8,79 Mt et l'union européenne à
28 avec 7,72 Mt (Planetoscope, 2017).
D' après l'établissement national des produits
de l'agriculture et de la terre en France, en 2014, les échanges au
niveau mondial de la viande ovine sont estimés à 1,2 Mt soit 8%
de la production mondiale. Les exportations de l'Australie et la Nouvelle
Zélande respectivement 41 % et 42 % des échanges mondiaux,
dominent le marché international de la viande ovine. Des pays comme le
Chili, l'Argentine, l'Uruguay et l'Union européenne sont venus aussi
renforcer le marché international.
2
II. Filière viande rouge en Tunisie
La filière des viandes rouges en Tunisie constitue une
branche d'activité très diversifiée occupant une place
importante dans l'économie agricole et agro-alimentaire (GIVLAIT,
2015).
Comme le lait, la viande rouge est un produit stratégique
vu son incidence sur le consommateur et sur l'équilibre des
différents systèmes de productions agricoles.
Elle provient essentiellement des élevages bovins qui
représente 44% des viandes rouges, ovins 41% et caprins 8% (Figure 1),
et sa production présente 50 % du produit brut de l'élevage et 23
% de la production agricole (OEP, 2017).
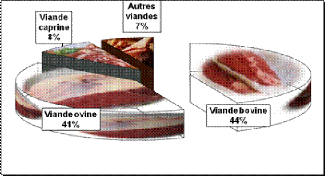
Figure 1 : Différentes
catégories des viandes rouges
(
http://www.oep.nat.tn)
1. Effectif animal
La production de viande rouge en Tunisie provient surtout de
trois types d'espèces : bovine, ovine et, à moindre degré,
caprine.
Le tableau 2 relatif à l'évolution des effectifs du
cheptel bovin, ovin et caprin couvrant la période 2007 à 2011,
montre une baisse de la production.
3
Tableau 2 : Evolution des effectifs bovins,
ovins et caprins en mille têtes
(GIVlait, 2011)
|
Espèces/ années
|
2007
|
2008
|
2009
|
2010
|
2011
|
|
Bovins
|
710
|
695
|
679
|
670
|
656
|
|
Ovins
|
7618
|
7300
|
7025
|
703
|
699
|
|
Caprins
|
1551
|
1497
|
1455
|
1295
|
1282
|
1.1. Effectif bovin
Le cheptel bovin en Tunisie est estimé, selon l'office
de l'élevage et des pâturages (OEP), à 450000 Unité
femelles, dont 191000 Unité femelles de races améliorées
soit environ 43% de la population bovine totale.
Comme l'indique la figure 2, l'effectif des femelles a
enregistré une diminution entre l'année 2005 et l'année
2013, passant de 440000 Unité femelles à 424000 Unité
femelles. Toutefois l'effectif du cheptel bovin de races
améliorées a enregistré une augmentation durant la
même période (GIVLAIT, 2013).
1000 Unités Femelles
|
500
|
444
|
450
|
454
|
449
|
440
|
440
|
|
|
|
|
400
|
|
|
|
|
|
|
430
|
427
|
424
|
|
|
|
|
|
|
|
|
|
|
300
|
239
|
|
|
|
|
|
|
|
|
|
|
235
|
231
|
229
|
220
|
217
|
208
|
202
|
196
|
|
200
100
|
205
|
215
|
223
|
220
|
220
|
223
|
222
|
225
|
228
|
|
0
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2005 2006 2007 2008 2009 2010 2011 2012 2013
Race pure race L & C Total
Figure 2 : Evolution de l'effectif du cheptel
bovin
(
http://www.avfa.agrinet.tn)
4
1.2. Effectif ovin
L'élevage des petits ruminants (ovin et caprin) occupe
une place de choix dans le pays tant par la tradition que par l'effectif. Cet
élevage, dominé par l'espèce ovine (84% de l'effectif),
est en progression et est destiné à la production de viande (Ben
Haddada, 2009).
Depuis le début des années soixante, l'effectif
ovin a enregistré une augmentation régulière. Il a atteint
7.618.000 têtes en 2008 (Figure 3) dont 3960 millions d'unités
femelles.
Près des deux tiers du cheptel national sont de race
Barbarine et 32% de race Queue Fine de l'Ouest alors que la Noire de Thibar ne
représente que 1,8% (ONAGRI, 2010). La productivité moyenne de
ces races n'a pas dépassé depuis plusieurs années 0,8
agneau/femelle/an (Khaldi, 2005).
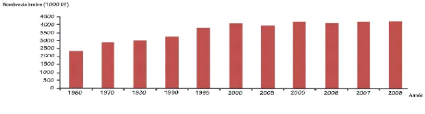
Figure 3 : Evolution de l'effectif ovin (en
unité femelles) en Tunisie
(ONAGRI, 2010)
2. Evolution de la production des viandes
rouges
La production de viandes rouges s'est élevée en
2006 à 123.000 t, dont 56.000 t viande bovine et 56.000 t viande ovine.
La production de viande bovine est souvent le fait d'élevages mixtes
(lait-viande) alors que celle de viande ovine est plutôt le fait
d'élevages spécialisés disposant de races à
vocation de viande (Belhadj, 2001).
La production de viandes rouges a augmenté pour toutes
les espèces, totalisant 125 milles tonnes en 2015 contre 120,2 milles
tonnes en 2007. Elle est constituée à hauteur de 58.3 milles
tonnes de viande bovine, 50.2 milles tonnes de viande ovine et 9.2 milles
tonnes de viande caprine. Malgré cette augmentation, les importations
des viandes rouges sont accrues et ont porté sur 2.5Mt en 2015 contre 1
Mt en 2011 (GIVLAIT, 2015).
5
Tableau 3 : Evolution de la production des
viandes rouges en mille tonnes
(GIVlait, 2015)
|
Viande/année
|
2007
|
2008
|
2009
|
2010
|
2011
|
2012
|
2013
|
2014
|
2015
|
|
Viande bovine
|
52.4
|
53.7
|
51.6
|
55.8
|
54
|
54.5
|
56
|
58
|
58.3
|
|
Viande ovine
|
49,4
|
51.5
|
49
|
50
|
50
|
48
|
48.5
|
50.1
|
50.2
|
|
Viande caprine
|
9,6
|
9.7
|
9.8
|
9.4
|
9
|
9.3
|
9.5
|
9.5
|
9.2
|
|
Autres viandes
|
8,8
|
8.6
|
6.8
|
7.5
|
8
|
7.2
|
7.2
|
7
|
7.3
|
|
Total de production
|
120.2
|
123.5
|
117.2
|
122.7
|
121
|
119
|
121.2
|
124.6
|
125
|
|
Importation
|
3.3
|
2.960
|
4.963
|
3.058
|
1
|
2.5
|
1.3
|
4
|
2.5
|
3. Consommation de la viande rouge en Tunisie
La consommation totale en viandes rouges s'est
élevée entre 2007 et 2015 pour passer de 123,5 à 127,5 Mt
(Tableau 4) (GIVlait, 2015).
Tableau 4 : consommation des viandes rouges en
Tunisie en mille tonnes
(GIVLAIT, 2015)
|
Viande/ année
|
2007
|
2008
|
2009
|
2010
|
2011
|
2012
|
2013
|
2014
|
2015
|
|
Consommation
|
123,5
|
126,46
|
122,16
|
125,75
|
122
|
121,5
|
122,5
|
128,6
|
127,5
|
La consommation moyenne des viandes rouges par habitant est de
l'ordre de 12Kg par an (OEP, 2017).
Parallèlement à l'évolution de la
production, la consommation a augmenté d'une manière sensible
particulièrement au cours de la dernière décennie du fait
des changements des habitudes alimentaires et de l'amélioration du
pouvoir d'achat de la population (Belhadj, 2001).
6
III. Généralités sur la viande
1. Définitions
1.1. La viande
On appelle « viande » la chair des animaux dont on a
coutume de se nourrir, incluant la chair des mammifères, des oiseaux et
quelque fois des poissons (Staron, 1979).
Selon le Codex Alimentarius, la viande est définie
comme étant « toutes les parties d'un animal destinées, ou
jugées saines et aptes, à la consommation humaine » et
considère le mot « animal », dans ce contexte « tout
mammifère ou oiseau». Dans ce vocabulaire sont inclues la chaire
des mammifères, Ovin, bovin, caprin, camelin ..., et des oiseaux,
poulet, dinde, pintade (Elrammouz, 2005).
Les viandes se caractérisent par une grande
hétérogénéité et sont constituées
principalement de muscles striés squelettiques. On peut les classer
selon la couleur en viandes rouges et viandes blanches et selon la richesse en
graisse, en viandes maigres et viandes plus ou moins riches en graisse (Ouali,
1990).
En ce qui concerne la viande rouge, elle est définie
selon le Centre international de recherche sur le cancer (CIRC), comme
étant toutes les viandes à l'exception des volailles issus des
tissus musculaires de mammifères comme le boeuf, le veau, le porc,
l'agneau, le mouton, le cheval et la chèvre.
1.2.Le muscle
Le muscle est l'organe responsable du mouvement et du maintien
de la posture chez les vertébrés. On distingue trois types de
muscles :
y' Les muscles lisses qui conditionnent la structure des organes
et des viscères.
y' Le muscle cardiaque qui permet d'assurer la circulation du
sang et l'apport continu d'oxygène.
y' Les muscles striés ou squelettiques qui assurent les
mouvements et permettent de transformer l'énergie des nutriments en
force motrice (Jurie et Listrat, 2010)
Dans notre projet, nous nous intéressons seulement aux
muscles squelettiques.
7
Le muscle squelettique représente 50 à 60 % de
poids vif. Il est capable de transformer l'énergie en mouvement. C'est
un muscle à contraction volontaire qui s'active grâce à une
stimulation par le système nerveux (Chougui, 2015). Il est
composé d'eau, de protéines, de lipides, de glucides, de
vitamines et des minéraux tels que le fer, le zinc et le
sélénium (Clinquart et al., 1999).
2. Transformation de muscles en viande
Après l'abattage des animaux de boucherie, des
modifications, plus ou moins importantes, se produisent dans les muscles et
contribuent à l'élaboration et à la définition des
qualités organoleptiques de la viande. La transformation du muscle en
viande fait appel à un ensemble de processus très complexes, sont
surtout d'ordre physico-chimique avec intervention des systèmes
enzymatiques (Ouali, 1990). Cette transformation, encore appelée la
maturation, est essentiellement le résultat de la variation du pH et de
la plasticité du muscle (CIV, 2004).
En fait, on peut considérer qu'au cours de sa
transformation en viande, le muscle passe successivement par trois états
(Ouali, 1990) qui sont:
? l'état pantelant qui suit directement l'abattage et
se traduit par des contractions
persistantes de la musculature, sa
durée coïncide avec la durée de survie du système
nerveux et n'excède pas 20 minutes (Joanisse, 2004).
? l'état rigide qui est l'aboutissement de la phase
d'installation de la rigidité
cadavérique. Il intervient
après l'épuisement des réserves énergétiques
et l'acidification du tissu musculaire (Boccard et Valin, 1984).
? l'état maturé est l'aboutissement de la phase
de maturation, au cours de laquelle
s'élaborent en grande partie les
divers facteurs qui conditionnent les qualités organoleptiques de la
viande et en particulier la tendreté (Balon et Yerneni, 2001).
3. Qualités de la viande
Selon la définition indiquée dans la norme ISO
8402, estimer la qualité d'une entité c'est définir
l'ensemble des caractéristiques de cette entité (activité,
produit ou organisme) qui lui confèrent l'aptitude à satisfaire
des besoins exprimés et implicites en vue de son utilisation à la
consommation et/ou à la transformation. La qualité est l'aptitude
du produit ou d'un service à satisfaire les besoins des utilisateurs.
En ce qui concerne la viande cette qualité regroupe
plusieurs critères qui sont indiqués dans la figure 4 :
8
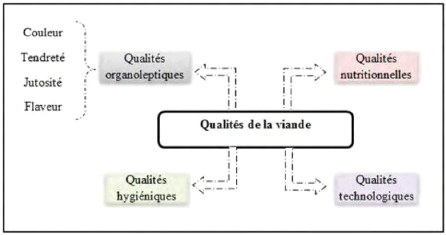
Figure 4 : Qualité de la viande
(
http://bu.umc.edu.dz)
3.1. Qualités nutritionnelles
La viande rouge est un aliment de grande valeur nutritionnelle
par sa richesse en protéines (de 20 à 30 %) et elle apporte
également des acides aminés essentiels que l'organisme humain est
incapable de synthétiser (Hébel, 2007). La viande rouge est
également une source importante de fer qui reste
l'oligo-élément le plus représenté dans l'organisme
et qui est hautement indispensable à un grand nombre de fonctions
vitales (Goulet, 1990), et de vitamines du groupe B, notamment la vitamine B12
antianémique. Elle apporte également des quantités
notables de lipides et de cholestérol (Hébel, 2007). La
digestibilité des viandes rouges est excellente, le CUD (coefficient
d'utilisation digestive) est très élevé et dépasse
95% (Williams, 2007).
9
Tableau 5 : Composition biochimique moyenne de
la viande rouge
(Rosset et al, 1984)
|
Composants Eau
|
Moyennes 75 %
|
|
Protéines
|
15,5 %
|
|
Lipides
|
3 %
|
|
Substances azotées non
protéiques
|
1,5 %
|
|
Glucides et catabolites
|
1 %
|
|
Composés minéraux
|
1 %
|
3.1.1. Protéines
Les viandes sont par excellence, la première source de
protéines grâce à leur richesse en
acides aminés indispensables qui les classe parmi les
protéines nobles.
Les protéines du muscle se repartissent de la
manière suivante :
y' Protéines extracellulaires : collagène,
réticuline, élastine
y' Protéines intracellulaires : protéines
sarcoplasmiques (albumine, globuline,
myoglobine, hémoglobine)
y' Protéines myofibrillaires : actine, myosine,
tropomyosine et actinine (Lawrie, 2006).
3.1.2. Glucides
Le glycogène du muscle se transforme en acide lactique
lors de la maturation de la viande, la teneur en glucides des viandes est
négligeable car il n'y a pratiquement plus de glycogène au stade
de sa commercialisation (Monin et Ouali, 1991).
3.1.3. Les lipides
Les lipides sont les composants essentiels des membranes
cellulaires, ils sont présents sous forme de triglycérides et de
phospholipides (lipides membranaires insaturés) et sont
constitués d'acides gras saturés dont 45 à 55% sont
indispensables (Sloan, 2009).
Les lipides sont localisés à la
périphérie des morceaux ou entre les muscles ou entre les
faisceaux de fibres. La fraction lipidique représente 3 à 5 % de
la composition totale de muscle (Coibion, 2008).
10
Les teneurs en lipides étant d'autant plus
élevées que l'animal est gras (Bauchart et al., 2002) et
l'alimentation de l'animal est le principal facteur de variation de la
composition en acides gras de la viande (Lucbert et al., 2005).
3.1.4. Les minéraux
Les viandes constituent une source principale en zinc. Elles
apportent du potassium et du phosphore, par contre elles sont très
pauvres en calcium (Henry, 1992). Les viandes sont la meilleure source de fer
heminique (3 à 6 mg) qui est beaucoup mieux assimilé par
l'organisme humain que le fer non heminique (Lucbert et al., 2005).
Les viandes sont les aliments les plus riches en
sélénium dont la teneur moyenne est d'environ 9ìg/100g de
viande. C'est un antioxydant qui protège l'organisme contre les
peroxydations lipidiques donc contre le vieillissement et les maladies
cardiovasculaires (Lucbert et al., 2005).
3.1.5. Les vitamines
Les vitamines sont indispensables à la croissance,
à la reproduction et au fonctionnement de l'organisme humain qui ne peut
les synthétiser lui-même. Les viandes contiennent les vitamines
hydrosolubles surtout de groupe B. Elles sont riches en Thiamine B1,
Riboflavine B2 et pauvre en vitamine C ; celles qui ont une teneur
élevée en gras sont riches en vitamines liposolubles (Mansour,
1996).
3.2. Qualités technologiques
Les caractéristiques technologiques représentent
l'aptitude de la viande à la conservation et à la transformation
(Monin, 1991).
3.2.1. pH
Bien qu'il s'agisse d'un paramètre chimique, le pH est
habituellement classé parmi les caractéristiques technologiques
puisqu'il influence de façon très importante l'aptitude de la
viande à la conservation et à la transformation (Hoffman, 1988).
Il traduit le degré d'acidité du muscle. La valeur du pH
intramusculaire mesurée in vivo est proche de 7. Dans les heures qui
suivent l'abattage, on observe, au sein du tissu musculaire, une chute du pH
liée à l'accumulation de l'acide lactique produit par la
dégradation du glycogène intramusculaire.
11
Lorsque les réserves de glycogène sont
épuisées, on observe une stabilisation du Ph (Figure 5). C'est le
pH ultime ou pH final dont la valeur est proche de 5,5 (Iberraken et Maouche,
2006).
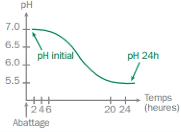
Figure 5 : Evolution du pH musculaire
après l'abattage
(
http://www.civ-viande.org)
La valeur finale de pH atteinte influence très
fortement l'aptitude de la viande à la conservation : ainsi par exemple,
un pH élevé, supérieur à 6, favorise le
développement des micro-organismes responsables d'une altération
du goût et de l'odeur de la viande, mais aussi des micro-organismes
pathogènes (Monin, 1988). Par ailleurs, il peut entraîner
également une modification de la capacité de rétention
d'eau et des qualités organoleptiques (Purchas et Aungsupakorn,
1993).
L'évolution du pH n'est pas homogène dans la
carcasse : elle varie d'un muscle à l'autre, voire même d'un
endroit à l'autre au sein du même muscle. Ces variations entre
espèces et entre muscles sont liées aux types métaboliques
des fibres musculaires (Monin, 2003).
3.2.2. Le pouvoir de rétention d'eau
Le pouvoir de rétention d'eau ou capacité de
rétention d'eau est l'aptitude de la viande à retenir fermement
l'eau qu'elle contient ou l'eau ajoutée. Il influence l'aspect de la
viande, son aptitude à la conservation et la tendreté de la
viande cuite par le biais des pertes d'eau par cuisson. Il conditionne
également le rendement de transformation de la viande (Monin, 1991 ;
Clinquart et al., 2000).
Au moment de l'abattage, le pouvoir de rétention d'eau
du muscle est très élevé. Il va diminuer très
régulièrement jusqu'à la fin de la rigidité
cadavérique. En effet, plusieurs études ont montré que sa
diminution a pour origine principale l'abaissement du pH à la suite de
la glycogénolyse anaérobie. Lorsque le pH diminue jusqu'à
une valeur basse, se rapprochant du
12
point isoélectrique des protéines (5,4 - 5,6
pour les protéines myofibrillaires), la charge nette des
protéines diminue, provoquant ainsi un resserrement du réseau
protéique myofibrillaire lié à la diminution des forces de
répulsion électrostatique entre les filaments protéiques
et il y a moins de place pour les molécules d'eau (Coibion, 2008).
Le pouvoir de rétention d'eau est mesuré lors de
la conservation, on parle alors de pertes d'eau par écoulement, mais
aussi au cours de la cuisson et on parle alors de perte à la cuisson. Il
est possible d'estimer le pouvoir de rétention d'eau par
détermination des pertes de jus lors de l'application d'une force
externe sur un échantillon de muscle, la quantité de jus produite
est appelée jus expressible (Clinquart et al., 2000).
Quelle que soit la méthode de mesure, la
capacité de rétention d'eau de la viande est influencée
principalement par la vitesse et l'amplitude de la diminution du pH
post-mortem, la taille et la forme de l'échantillon, le traitement de la
viande lors du conditionnement, la température de cuisson, de
conservation ou de congélation, l'humidité relative du local de
conservation et le délai qui s'est écoulé entre l'abattage
et la mesure (Ahounou et al., 2012).
3.2.3. Oxydation des lipides de la viande
L'oxydation des lipides constitue la cause la plus importante
de dégradation de la qualité sensorielle et nutritionnelle des
viandes rouges, cette réaction d'oxydation provoque des changements
irréversibles sur le goût, la flaveur, la couleur et la texture
des produits, aboutissant à une diminution de leur durée de vie.
Elle concerne principalement les Acides gras poly-insaturés (AGPI) parce
qu'ils sont facilement dégradables par des processus oxydants non
enzymatiques (Jeuge et al., 2012).
Plus l'acide gras (AG) est riche en doubles liaisons, plus il
est oxydable. L'oxydation des AG, lorsque son intensité est
modérée, a un effet bénéfique sur la flaveur de la
viande. Toutefois, lorsque son intensité augmente, elle devient une des
causes majeures de la détérioration de la qualité des
produits carnés crus ou cuits pendant leur stockage sous forme
réfrigérée ou congelée (Gandemer, 1999).
3.3. Qualités organoleptiques
Les qualités organoleptiques des viandes regroupent les
propriétés sensorielles à l'origine des sensations de
plaisir associées à leur consommation, elles sont
déterminées par la couleur de la viande ainsi sa flaveur, sa
jutosité et sa tendreté (Cassar-Malek et al., 2005).
13
3.3.1. Couleur
La couleur de la viande représente un facteur de
qualité important pour l'industrie de la viande ainsi que pour le
consommateur (Renerre, 2006). Ainsi, la couleur de la viande est un indice de
la fraîcheur recherchée par le consommateur (Coibion, 2008).
Le principal pigment responsable de la couleur de la viande
est la myoglobine qui est une chromoprotéine. Au contact de l'air, la
myoglobine se combine avec l'oxygène formant ainsi l'oxymyoglobine de
couleur rouge vif (figure 6).
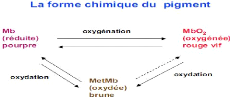
Figure 6 : Les différentes formes
chimiques de la myoglobine
(Cartier et Moëvi, 2007)
La couleur de la viande varie en fonction de l'espèce,
le sexe, la race, le type de muscle, l'alimentation, les conditions d'abattage
mais aussi en fonction du temps et des méthodes de conservation
(Fletcher, 2009).
La couleur de la viande peut être
déterminée par une méthode sensorielle ou par une
méthode instrumentale. La méthode sensorielle consiste à
juger de manière visuelle en se basant sur des grilles de classement de
couleur (figure 7) plus ou moins standardisées et officialisées
(Cartier et Moëvi, 2007).

Figure 7 : classes de couleurs de viande
(Moëvi, 2006)
14
La méthode instrumentale consiste à
déterminer par colorimétrie la couleur de la viande et à
l'exprimer d'une manière standardisée, le plus souvent dans
l'espace de couleur C.I.E. (commission Internationale de l'Eclairage ; Mancini
et Hunt, 2005). Il s'agit d'un espace colorimétrique à trois
dimensions, dans lequel chaque couleur est définie par trois
paramètres indépendants (Moëvi, 2006) :
L* : la luminance variant de 0 pour le noir à 100 pour le
blanc a* : l'indice de rouge variant de -60 pour le vert à +60 pour le
rouge b* : l'indice de jaune variant de -60 pour le bleu à +60 pour le
jaune
3.3.2. Tendreté
La tendreté est considérée comme la
caractéristique qualitative de la viande la plus appréciée
et la plus recherchée par le consommateur. Elle mesure la
facilité avec laquelle la structure de la viande peut être
désorganisée au cours de la mastication (Aubry et al.,
2006).
La tendreté est sous la dépendance de deux
composantes : le collagène et les myofibrilles. Le collagène
représente environ 80 % du poids du tissu conjonctif, celui-ci formant
l'emballage des fibres musculaires ; il fixe la dureté de base de la
viande. Les myofibrilles constituent la partie contractile du muscle, leur
tendreté évolue au cours de la maturation. L'analyse sensorielle
(utilisation d'un jury de dégustation) demeure la seule méthode
de mesure de la tendreté. (Cartier et Moëvi, 2007).
3.3.3. Jutosité
La jutosité, encore appelée succulence est la
faculté qu'a une viande d'exsuder du jus lors de la mastication
(Lameloise et al., 1984). On distingue généralement deux
types de jutosité :
La jutosité initiale qui est associée à
la quantité de jus qui s'écoule dans la bouche pendant les
premières mastications dépendante de la quantité d'eau
dans la viande, notamment, d'eau liée, celle qui demeure dans le produit
au cours de la cuisson (Lawrie, 1991).
La jutosité finale ou seconde jutosité qui est
liée à la sécrétion salivaire engendrée par
le gras du morceau après la mastication (Cartier et Moëvi,
2007).
La jutosité est influencée par les
caractéristiques musculaires telles le pH, les lipides intramusculaires
et la capacité de rétention d'eau du muscle (Cassar-Malek et
al., 2005).
15
3.3.4. Flaveur
La flaveur correspond à l'ensemble des impressions
olfactives et gustatives éprouvées au moment de la consommation
de l'aliment (Fournier, 2003), C'est un ensemble complexe de sensations
perçues par le goût et l'odorat lorsque le morceau de viande est
en bouche. Elle associe les saveurs et les arômes (Clinquart et
al., 2000).
La flaveur de la viande est déterminée par la
composition chimique et les changements apportés à cette
dernière par la cuisson. Des composés hydrosolubles aussi bien
que liposolubles sont impliqués dans le développement de la
flaveur au cours de la cuisson (Monin, 1991).
L'appréciation de la flaveur d'une viande se fait
seulement par des méthodes de laboratoire. La méthode de
référence, la plus utilisée, est l'analyse sensorielle
(dégustation par un groupe de personnes plus ou moins qualifiées
selon les objectifs recherchés). Des mesures de nature chimique et
physico-chimique (teneur et composition en matières grasses de la viande
et/ou du gras intermusculaire, stabilité oxydative des acides gras,
proportion des différents types de fibres musculaires) apportent
également des informations sur la flaveur, mais elles sont souvent
partielles (Ahounou et al., 2012).
3.4. Qualité hygiénique
La qualité hygiénique de la viande constitue
l'exigence élémentaire du consommateur. Elle peut être
altérée par la prolifération de microorganismes
néfastes, de parasites et/ou la présence de composés
toxiques. Donc la viande doit être mise dans des conditions de
sécurité quasi absolue et être protégée des
différentes contaminations (Boyer et al., 1997)..
La maîtrise de la qualité hygiénique des
viandes est une priorité de la filière. A tous les stades de la
filière (éleveurs, abatteurs, découpeurs et
transformateurs, distributeurs), les mesures susceptibles d'assurer cette
maîtrise ont été définies collectivement et sont
consignées dans des documents de référence : les Guides de
Bonnes Pratiques Hygiéniques (Cartier et Moëvi, 2007).
16
4. Microbiologie de la viande rouge
De l'animal à l'assiette de consommateur, la viande
présente un niche très favorable au développement des
micro-organismes, essentiellement les bactéries protéolytiques,
vu sa composition et sa haute valeur biologique faisant un aliment
indispensable pour une ration alimentaire équilibrée (Benaissa,
2011). La prolifération bactérienne entraîne des
modifications néfastes sur l'odeur, la couleur, la texture et produit
des substances toxiques. Donc la viande représente une matière
première fragile qui doit être strictement surveillée en
raison du danger dû à ces altérations et à la
présence éventuelle de germes pathogènes (Oumokhtar et
al., 1998).
La chair d'un animal vivant et sain est pratiquement
stérile. L'invasion des tissus animaux par les microorganismes
dépend de plusieurs facteurs qui sont à l'origine d'une
contamination microbienne de la viande. Ces facteurs sont diverses et
d'importance inégale (Cartier, 2004).
Les principaux contaminants de surface de la viande sont des
contaminants d'origine exogène, ils proviennent
généralement des conditions d'abattage (environnement de
l'abattoir, opérations d'éviscération et de
découpe...), personnels (mains sales, vêtements mal entretenus...)
et infrastructure et équipements (surface des locaux,
matériel...) (Nguyet, 2008).
Les appareils digestif et respiratoire et le cuir des animaux
sont des réservoirs pour les microorganismes d'origine endogène,
ils constituent les principales sources de contamination des carcasses
(Cartier, 2004). Ces éléments présentent un milieu
favorable pour la multiplication des bactéries anaérobies
(Clostridium,...), aéroanaérobie
(Entérobactéries: E.coli, Salmonella, Shigella,
Proteus...) microorganismes aérophiles (Entérocoques),
Levures et moisissures (Leyral et Vierling, 1997).
4.1. Microorganismes d'altération
La microflore des viandes est composée essentiellement
de germes saprophytes. La contamination par les germes pathogènes
n'apparaît que rarement (Cartier, 2007).
17
4.1.1. Les germes saprophytes
Ce sont les germes qui sont non pathogènes, vivants en
commensaux chez un hôte vivant, sans porter atteindre à
l'état de santé de celui-ci. Ces micro-organismes permettent une
acidification et une inhibition des bactéries nuisibles, et permettent
aussi un changement de la couleur qui est du à la réduction des
nitrates et l'aromatisation par lipolyse et protéolyse (Fraysse,
2005).
Les germes saprophytes les plus rencontrés sur les
viandes rouges sont les genres: Pseudomonas, Acinetobacter,
Micrococcus, Flavobacterium, les
Entérobacteriaceae, Bacillus, Lactobacillus,
Streptococcus et Clostridium (Hamad, 2009).
4.1.2. Microorganismes indicateurs d'une contamination
fécale ? coliformes totaux
Ce sont des bactéries aérobies ou
anaérobies facultatifs, à Gram négatif, non
sporulées, en forme de bâtonnets, mobiles ou non. Ces germes
possèdent l'enzyme â-galactosidase permettant l'hydrolyse du
lactose à 30°C afin de produire des colonies rouges sur un milieu
bien approprié. Ils sont oxydases négatives et réduisent
les nitrates en nitrites sous conditions anaérobies. Les coliformes
totaux incluent, entres autres, les genres suivants : Escherichia
coli, Citrobacter, Enterobacter et Klebsiella.
Le groupe des coliformes renferme plusieurs espèces de bactéries
qui fermentent le lactose (Cardinal, 2003).
? Escherichia coli
Parmi les coliformes totaux, il existe un sous-groupe de
bactéries, les coliformes fécaux ou coliformes
thermotolérants et en particulier une espèce, Escherichia
coli, qui indique une contamination fécale puisqu'elle est
présente dans le tube digestif des animaux supérieurs et de
l'homme. E. coli est le seul membre du groupe des coliformes à
être exclusivement d'origine fécale. Il fait partie de la famille
des Entérobactéries (Cardinal, 2003). Il s'agit de bacille Gram
négatif, anaérobie facultatif, non sporulé et mobile au
moyen de flagelles péritriches. Cette bactérie est capable de
fermenter plusieurs sucres, mais sa fermentation du lactose avec production de
gaz est caractéristique. La multiplication à 44°C, la
production d'indole et la présence d'une activité B-glucuronidase
sont également caractéristiques (Eslava et al.,
2003).
18
4.1.3. Microorganismes indicateurs d'hygiène
générale : Flore mésophile aérobie totale
La flore mésophile aérobie totale ne constitue
pas une famille bactérienne particulière. Il s'agit des
microorganismes formant des colonies dénombrables après leur
multiplication dans des conditions de laboratoire définies. Le milieu de
culture généralement choisi est la plate count agar (PCA) (Pearce
et Bolton, 2005).
Il est incubé dans les conditions atmosphériques
ambiantes à 30°C pendant 72 h.
Par définition, les sources de contamination des
viandes par les germes aérobies totaux sont très variées :
l'environnement, l'animal (flore présente dans l'intestin, sur la peau,
la toison, les muqueuses), la contamination croisée avec d'autres
carcasses ou aliments, la contamination par le manipulateur (Ghafir et Daube,
2007).
4.2. Microorganismes pathogène
Les germes pathogènes susceptibles de contaminer les
carcasses, les plus fréquents sont: Clostridium botulinum,
Staphylococcus aureus, Clostridium perfringens, Salmonella,
Shigella, en plus de Yersinia enterocolitica, Escherichia
coli etc... (Korsak et al., 2004).
4.2.1. Les salmonelles
Les salmonelles sont des bacilles Gram négatif
anaérobies facultatifs appartiennent à la famille des
Enterobacteriaceae, non sporulants, dont la mobilité propre est
assurée par des flagelles péritriches. Ces bacilles se trouvent
sous forme des bâtonnets de 2 à 3 ìm de long. Ce sont des
bactéries mésophiles, peu exigeantes de point de vue
nutritionnel. Leur développement est optimal à des
températures proches de la température corporelle des animaux
à sang chaud, 35 à 37°C, et à un pH de 6,5 à
7,5. Leur multiplication reste assurée dans des températures
allant de 6,7 à 41°C. Les salmonelles sont des bactéries
extrêmement résistantes aux conditions environnementales
même difficiles, elles sont capables de survivre dans un spectre large de
températures (-20 à 60°C) et de pH (4,1 à 9), ainsi
que leur capacité à résister à de aw
(activité de l'eau) de 0,94, ce qui explique leur caractère
ubiquiste (Julie, 2009). Ces bactéries peuvent se développer dans
la plupart des cultures qui ont une source de carbone et d'azote et vont
développer des colonies de 2 à 4 mm de diamètre lisses,
brillantes et homogènes (Ben Chehida, 2012).
Le genre Salmonella se divise en 2 espèces :
S.enterica et S.bangori. L'espèce S.enterica
est subdivisée en 6 sous espèces régulièrement
rencontrées cher l'Homme (Ben Chehida, 2012).
19
4.2.2. Staphylococcus aureus
Coque à Gram positif, non sporulé, immobile,
aéro-anaérobie facultatif. Les staphylocoques sont des
bactéries ubiquitaires présentes sur la peau, les muqueuses et la
sphère rhinopharyngée des animaux et en particulier chez l'Homme.
Les staphylocoques ont également été isolés de
l'environnement naturel, domestique de l'Homme, hospitalier et des ateliers de
préparation alimentaire. La présence de ce germe dans
l'environnement est vraisemblablement due à une contamination par
l'Homme ou les animaux (De Buyser et Hennekinne, 2009).
4.2.3. Anaérobies sulfito-réductrices
(ASR)
Le nom de ces bactéries est lié à la
méthode de leur détection, ce sont des bacilles Gram positif,
anaérobies strictes. En effet, elles transforment les sulfites en
sulfures noires. Elles se développent à 46°C et regroupent
certaines espèces pathogènes comme Clostridium perfringens
et Clostridium botulinum (Poumeyrol et Popoff, 2006).
4.3. Conditions de multiplication des microorganismes
Les nutriments, la température, l'activité de
l'eau (Aw), le pH et la tension d'oxygène représentent les
paramètres les plus importants en technologie de la viande qui
favorisent l'évolution des microorganismes (Fournaud, 1982).
4.3.1. Les nutriments
La viande par sa composition chimique et sa richesse en eau et
en protéines, représente un milieu favorable pour la
prolifération microbienne, (Rosset, 1988).
4.3.2. L'activité de l'eau
L'activité de l'eau est un paramètre qui
caractérise la disponibilité d'eau "libre" dans un produit
alimentaire, elle est définie par la valeur aw qui s'établit
entre 0 et 1 et influe sur la stabilité microbiologique du produit, en
favorisant la croissance de microorganismes.
En général, plus l'Aw est élevée,
plus la croissance de la microflore est intense, la plupart des
bactéries ont un optimum de croissance autour de 0,95 à 0,99
(Mescle et Zucca, 1988).
20
La viande est un produit riche en eau dont l'Aw est comprise
entre 0,98 à 0,99, elle représente un produit alimentaire assez
favorable à la multiplication de la plupart des espèces
microbiennes (Rosset, 1988)
La figure 8 représente la Classifications de certains
microorganismes selon la valeur de l'activité de l'eau.

Figure 8: Classification des microorganismes
selon la valeur de l'Aw
(
http://microbiologie.univ-tours.fr/)
4.3.3. Le pH
La majorité des bactéries et champignons ont la
capacité de se développer à un pH qui varie de 4,5
à 9 avec un optimum de 6,5 à 7,5. Les levures ont comme la
plupart des microorganismes fongiques un caractère acidotrophe, ce qui
leur permet de se développer à des pH acides indiqués dans
le tableau 6 (Mescle et Zucca, 1988).
21
Tableau 6 : pH de croissance de quelques
microorganismes
(
http://microbiologie.univ-tours.fr)
|
Minimum
|
Optimum
|
Maximum
|
|
Moisissures
|
1,5 - 3,5
|
4,5 - 6,8
|
8 - 11
|
|
Levures
|
1,5 - 3,5
|
4 - 6,5
|
8 - 8,5
|
|
Bactéries
|
E.coli
|
4,3
|
6 - 8
|
9
|
|
Salmonella
|
4 - 4,5
|
6,5 - 7,2
|
6,9 - 8
|
|
Pseudomonas
|
5,6
|
6,6 - 7
|
8
|
|
Staphylococcus
|
3 - 4
|
6 - 8
|
9
|
|
Bactéries lactiques
|
3,2
|
5,5 - 6,5
|
10,5
|
|
Bactéries acétiques
|
2
|
6,3 - 6,4
|
9,2
|
4.3.4. Le potentiel d'oxydoréduction
Après la mort de l'animal, on conserve un potentiel
redox positif à la surface de la viande favorisant la multiplication des
germes aérobies, alors que en profondeur, les réserves en O2
n'étant plus renouvelées par le sang, donc on assiste à
l'installation des conditions réductrices favorables à la
prolifération des bactéries anaérobies (Rosset et Lebert,
1982).
Selon le potentiel d'oxydoréduction, on distingue quatre
classes :
V' Aérobies stricts lorsqu'ils ne peuvent se
développer qu'en présence d'oxygène (Pseudomonas,
Microcoques, moisissures),
V' Aéro-anaérobies facultatifs : lorsque leur
développement peut se faire en présence ou en absence
d'oxygène (coliformes, staphylocoques),
V' Anaérobies stricts : lorsque leur
développement ne peut se faire qu'en absence d'oxygène
(Clostridium),
V' Microaérophiles : lorsque leur développement
ne nécessite qu'un taux faible d'oxygène (Lactobacillus,
Streptococcus).
4.3.5. La température
Le développement des microorganismes dans les carcasses
des viandes dépend d'un certain nombre de paramètres parmi les
plus importants on peut citer la température (Rosset, 1988).
22
Tous les micro-organismes ne se développent pas
à la même température (Hermier et al., 1992), mais
en règle générale, la température basse permet de
ralentir la multiplication des germes (Rosset, 1988).
En fonction de la température optimale de croissance,
on peut classer les microorganismes en trois principaux groupes
représentés dans la figure 9.

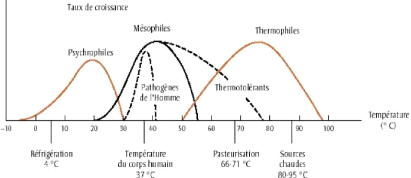
Figure 9 : Classification des germes selon la
température de croissance
(
http://microbiologie.univ-tours.fr)
V' Bactéries thermophiles. Elles ont un optimum de
développement entre 55 et 75° C.
V' Bactéries mésophiles : ont une
température optimale de 30 à 45° C. Ce groupe
contient la majorité des microorganismes et en particulier
les germes pathogènes.
V' Bactéries psychrophiles : se développent
à des températures comprises entre 0 et 25°C L'effet de la
température sur la croissance des germes sont présentés
dans la figure 10 :
23
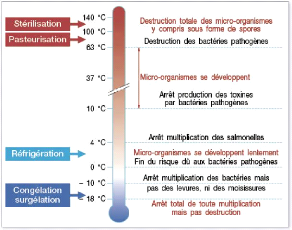
Figure 10 : Effets de la température
sur la croissance des bactéries
(
http://qcm.svt.free.fr)
5. Congélation
5.1. Définition
La congélation est un terme général
désignant un changement d'état d'eau liquide en glace et
consistant en un abaissement et un maintien de la température du produit
à une température négative de façon à
congeler l'eau, c'est un procédé qui refroidit lentement un
aliment à coeur à -18 °C. Elle empêche les
micro-organismes (bactéries, champignons microscopiques) de se
multiplier. En revanche, les enzymes, dont l'action dégrade les
aliments, restent actives à l'état de congélation, bien
que leur activité soit fortement réduite (Mafart, 1991). Les
aliments congelés présentent les mêmes
propriétés nutritionnelles et organoleptiques que les produits
frais. La congélation entraîne toutefois quelques
altérations physiques, la dilatation de l'eau (formation de cristaux de
glace) provoquant un éclatement des structures cellulaires. Si le
processus de congélation est rapide (Figure 11), les cristaux de glace
sont plus petits et provoquent moins d'altérations (Genot, 2000).
24
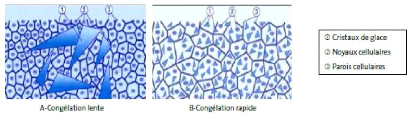
Figure 11 : Illustration de la morphologie
cristalline en fonction de la cinétique de
refroidissement.
(
http://www.airproducts.fr)
Dans un produit alimentaire, comme la viande, la
congélation se traduit par une évolution de la température
en fonction de temps en ralentissant la dégradation de ce produit, mais
elle ne permet pas d'améliorer sa qualité initiale (Bimbenet et
al., 2002).
5.2. Etapes de la congélation
Le passage d'un échantillon frais à l'état
congelé s'effectue en 3 étapes (Figure 12) (Genot, 2000) :
Pré-congélation : c'est le
refroidissement du produit jusqu'à la température de
congélation, l'eau reste encore à l'état liquide.
Congélation : c'est la phase de
changement d'état de l'eau en glace (T = Tc) avec nucléation,
puis croissance des cristaux (cristallisation).
Refroidissement : refroidissement du produit
congelé, la majeure partie de l'eau congelable est sous forme de
glace.
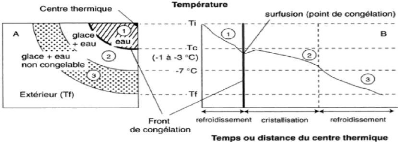
Figure 12 : Les différentes phases de
la congélation d'un échantillon
(Genot, 2000)
25
Ti : Température initiale ;
Tc : Température de congélation ;
Tf : Température finale ;
A : Etat de l'eau dans un produit de forme
géométrique simple en cours de congélation ;
B : Evolution au cours du temps de la température en un
point de l'échantillon.
5.3. Effet de la congélation sur la qualité
de la viande
5.3.1. Modifications physicochimiques
Lors de la congélation, pendant la conservation et au
moment de la décongélation, la viande perd de l'eau par
évaporation, sublimation et exsudation. Ces pertes représentent
0,5 à 1,2% de la masse de produit lors de la congélation et 1
à 5% de la masse initiale de produit lors de la
décongélation, donc elles sont considérées comme
pertes financières, elles s'accompagnent généralement
d'altération de la qualité de la viande (Genot, 2000).
La congélation provoque des modifications
organoleptiques qui sont dues au brunissement à la surface et au
ralentissement de la maturation (Benaissa, 2011), aussi des réactions
d'oxydation des lipides se poursuivent même à des basses
températures et les enzymes anti-oxydantes sont peu à peu
dénaturées par le froid (Genot, 2000).
5.3.2. Effet sur les microorganismes
Le froid ralentie ou arrête l'activité cellulaire
et les réactions enzymatiques: il fige les molécules, le
développement des microorganismes : celles-ci sont «
anesthésiés » par le froid. Cependant le froid ne
détruit pas ou du moins pas entièrement les microorganismes ou
les toxines qui pourraient être déjà contenu dans les
aliments, contrairement à la chaleur qui les assainira. Ceux-ci peuvent
reprendre leur activité, une fois le produit refroidi (Pierre, 1998). Le
domaine du froid s'étend de + 12 °C à - 45 °C environ.
Ci-dessous quelques températures clés :
V' + 10°C Arrêt de production de toxines par
staphylocoque doré et bacille botulique. V' + 6°C Arrêt de la
multiplication du staphylocoque doré.
V' + 5°C Arrêt de multiplication de salmonelle.
V' + 3°C Arrêt de toxicité des bactéries
pathogènes.
V' 0°C Réfrigération.
V' -10°C Arrêt de toute multiplication
bactérienne.
V' -18°C Arrêt de la multiplication des
moisissures.
26
5.4. Décongélation
C'est une opération très délicate qui
conditionne complètement la qualité gustative et
bactériologique du produit décongelé (Oudot, 1999), elle
est quatre fois plus lente que la congélation car la conductivité
thermique de l'eau est quatre fois plus faible que celle de la glace (Cheftel
et Cheptel, 1977). Il faut donc un contrôle rigoureux de la vitesse de
décongélation (Oudot, 1999).
D'après le règlement CE 852/2004 relatif
à l'hygiène des denrées alimentaire, la
décongélation pour tous les exploitants du secteur alimentaire
doit être effectuée de manière à réduire au
maximum le risque de développement de micro-organismes pathogènes
ou la formation de toxines dans les denrées alimentaires, donc trois
méthodes sont autorisées pour la décongélation de
vos produits, sans validation particulière (arrêté du 21
décembre 2009) :
V' Dans une enceinte réfrigérée,
V' par cuisson,
V' par remise en température sans
décongélation préalable (ex : four micro-ondes).
Selon la norme ISO 6887-2 (2003), pour la préparation
des échantillons, suspension mère et des dilutions
décimales des produits carnés, deux modes de
décongélation sont possibles :
? Décongélation à température
18°C à 27°C pendant 3 heures maximum pour les petites
pièces ;
? Décongélation à températures
2°C #177; 2 pendant 24h maximum.
27
Matériel et méthodes
I. Objectif de travail
Ce travail est réalisé à l'Institut
National des Recherches Agronomiques de Tunis (INRAT) et au Laboratoire
Militaire d'Analyses Alimentaires (LMAA) dont l'objectif principal est de
déterminer l'effet de la congélation sur la qualité
physicochimique et bactériologique des viandes rouges consommées
au sein de l'hôpital militaire d'instruction de Tunis conformément
à la note de service n°2007-8275 du 14 novembre
2007 de la direction générale de l'alimentation DGAL et le
règlement 2073/2005, en se basant sur les critères
d'hygiène des procédés,
Ce sujet suscite un véritable intérêt,
dans la mesure où son étude permettra d'exposer l'influence de la
congélation sur la qualité microbiologique et physicochimique des
viandes rouges et de savoir si la conservation par congélation pendant 7
jours a une influence sur la qualité de la viande à consommer.
II. Présentation des lieux de stage
1. LMAA
Le Laboratoire Militaire d'Analyses Alimentaires (LMAA) est un
laboratoire qui assure le contrôle des denrées, eaux et surfaces
au niveau des hôpitaux et des unités militaires et aussi le
contrôle des eaux médicales (eaux des salles blanches des
hôpitaux et eaux d'hémodialyse).
Ce laboratoire est constitué de différentes
unités:
V' L'unité de la réception
V' L'unité de la microbiologie
V' L'unité de la physicochimie
V' L'unité Maintenance - Métrologie -
Hygiène
28
Les analyses microbiologiques relatives au présent
travail, effectuées au sein de LMAA, consistent à
déterminer la qualité bactériologique des viandes rouges
consommées à l'HMPIT avant et après une congélation
en se basant sur les critères d'Hygiène des
procédés.
Les analyses concernant les germes suivants : les salmonelles,
les micro-organismes à 30°C, les coliformes à 30°C,
Escherichia coui, les Staphylocoques à coagulase+ et les
Anaérobies sulfito-réducteurs, fournissent une orientation sur
l'hygiène d'abattage, de manutention et de distribution de la viande.
2. INRAT
L'institut national des recherches agronomiques (INRAT) est un
établissement public placé sous la tutelle du Ministère de
l'Agriculture et il est rattaché à l'Institution de la Recherche
et de l'Enseignement Supérieur Agricoles (IRESA).
Il compte 6 laboratoires chacun spécialisé dans son
domaine :
V' Laboratoire de production animale et fourragère
V' Laboratoire des grandes cultures
V' Laboratoire de protection des végétaux
V' Laboratoire de protection d'horticulture
V' Laboratoire de biotechnologie appliquée à
l'agriculture
V' Laboratoire des sciences et techniques agricoles.
Les analyses physicochimiques sont effectuées au sein
de laboratoire de production animale et fourragère dont le but est
d'étudier l'influence de la congélation sur la qualité
physicochimique de la viande à savoir la mesure de pH, couleur, perte
à la cuisson, et l'oxydation des lipides.
III. Echantillonnage
Au cours de ce travail, 28 échantillons des viandes
bovine et ovine ont été analysés, provenant de la cuisine
de l'Hôpital militaire principal d'instruction de Tunis (HMPIT) dans la
période située entre le mois de février 2017 et juillet
2017.
29
Ces échantillons sont divisés en 7 lots dont chacun
contient 4 prélèvements : 3 échantillons ovins et 1
échantillon bovin, d'un poids de 300 g / échantillon, et chaque
lot est analysé à l'état frais et après sa
congélation pendant 7 jours.
1. Diagramme d'utilisation des viandes rouges
La réception des viandes rouges se fait au sein de
l'hôpital militaire principal d'instruction de Tunis en présence
d'un vétérinaire pour contrôler la salubrité des
viandes ovines et bovines et faire un bon choix en s'appuyant sur l'âge
des ovins et bovins (abattus le même jour).
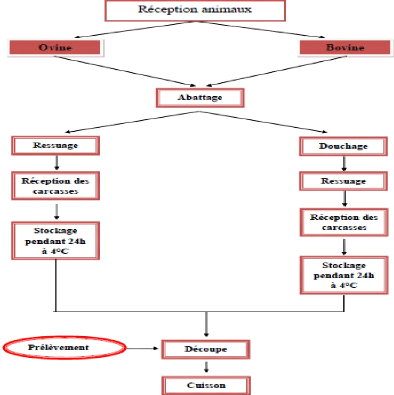

Figure 13 : Diagramme d'utilisation des
viandes rouges
30
2. Prélèvement
Le prélèvement des échantillons des
viandes rouges s'effectue au sein de l'Hôpital Militaire Principal
d'Instruction de Tunis, à partir du muscle gigot des agneaux et des
taureaux et selon un protocole présenté dans la figure 14
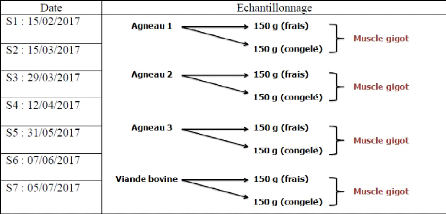
Figure 14 : Protocole de travail
Ce prélèvement a été
réalisé conformément à la norme NF EN ISO 6887-2 :
2003 pour la préparation des échantillons, suspension mère
et des dilutions décimales des produits carnés. La technique de
prélèvement consiste à :
y' Dégager l'échantillon stérilement
y' Enlever une pellicule de 2 mm d'épaisseur à
l'aide d'une pince et d'un scalpel stériles
y' A l'aide d'une autre pince et un autre scalpel
stériles, faire un prélèvement d'un échantillon
(Figure 15)
31
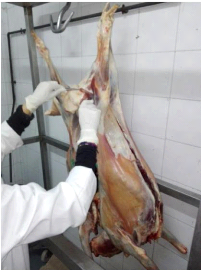
Figure 15 : Prélèvement au
niveau du muscle gigot d'une agnelle
3. Transfert des échantillons
Les prélèvements des viandes
réalisés au niveau de l'HMPIT sont acheminés au LMAA dans
les plus brefs délais. Durant le transport, les échantillons sont
conservés dans une enceinte iso-thermique
réfrigérée maintenue entre 1°C à 8°C afin
de respecter la chaine du froid, notant que la durée du transport ne
dépasse pas 20 minutes.
IV. Analyses microbiologiques
Puisque le but de mon projet est d'étudier l'effet de
la congélation sur la qualité microbiologiques des viandes rouges
consommées au sein de l'HMPIT en étudiant les critères
d'hygiène des procédés, le tableau 7 montre les principaux
germes à rechercher et/ou à dénombrer, les méthodes
utilisées ainsi que les milieux et les temps d'incubation.
32
Tableau 7 : Principales analyses
effectuées par le LMAA
|
Germes
|
Milieux
|
Incubation
|
|
Flore totale
|
PCA
|
à 30°C/72h #177; 3h
|
|
Coliformes totaux
|
VRBL
|
à 44°C/24h #177; 3h
|
|
E.Coli â-
Glucuronidase
|
TBX
|
à 44°C/18 à 24h
|
|
ASR
|
TSC
|
à 37°C/24h à 48h
|
|
Staphylocoques à
coag+
|
BP+jaune
d'oeuf tellurite +
sulfaméthazine
|
|
Salmonelle (NF EN ISO 6579
:2002)
|
Pré-
|
Enrichissement
|
Isolement
|
Identification
|
Confirmation
|
|
enrichissement
|
J2
|
J3
|
Biochimique
|
J5
|
|
J1
|
|
|
J4
|
|
|
Incubation
|
EPT à 37°C
|
RVS à 41,5°C
|
XLD à 37°C#177;1°C
|
Kligler-Hajna à 37#177; 1°C
|
Api 20 E à
|
|
18h #177; 2h
|
24h #177;3h
|
24h #177; 3h
|
24#177; 3h.
|
37°C
|
|
|
|
Hektoen à 37°C
|
Test urée indol à 37°C
|
24h
|
|
|
|
24h
|
24h
|
|
1. Réception des échantillons
A la réception, l'opérateur vérifie
l'état et les conditions du transport des échantillons : enceinte
isothermique, température...
Un code d'enregistrement est attribué à chaque
échantillon reçu pour faciliter sa traçabilité. En
plus les informations sur le produit telles que la date de réception,
son origine, et l'identification du préleveur doivent être
enregistrés dans le cahier de réception.
33
2. Choix de diluant
Le choix d'un diluant dépend du microorganisme
recherché et de la méthode d'analyse réalisée. On
distingue ainsi deux types de diluants :
? « Tryptone-Sel », c'est le diluant qui semble le
plus approprié pour la majorité des aliments, utilisé pour
la préparation des dilutions décimales.
? l'«eau peptonée tamponnée »,
utilisée pour la préparation de suspension
mère.
3. Milieux de culture
Le milieu de culture est définit selon la norme ISO
11133 : 2014 comme étant un mélange de substances, sous forme
liquide, semi-solide ou solide, qui contient des constituants naturels et/ou
synthétiques permettant la croissance des micro-organismes (avec ou sans
inhibition de certains d'entre eux), leur identification ou leur conservation
(annexe 1).
4. Préparation de suspension
mère
La préparation des échantillons est
réalisée selon le protocole de NF EN ISO6881-1 et les autres
préparations d'échantillons selon les normes spécifiques
ISO (6887-2, 3, 4) et 8261.
La prise d'essai est effectuée selon les instructions
(9-1 ISO 7218) et selon la norme spécifique.
4.1. Pesée
La manipulation des échantillons s'effectue sous une
haute à flux laminaire pour éviter toutes contaminations
extérieures.
Dans une première étape, en utilisant une pince
et un scalpel stériles, on coupe chaque échantillon en 2 portions
ayant le même poids, dont une portion va être congelée et
l'autre va être analysée à l'état frais.
Ensuite on prélève environ 26 g de
l'échantillon dans un sac stérile de polyéthylène
préalablement taré. Il est important de prélever à
4 ou 5 endroits dans l'échantillon afin d'obtenir un
échantillonnage représentatif, et on ajoute 234 ml d'eau
peptonée tamponnée, Puis, l'homogénéisation est
réalisée à l'aide d'un appareil
d'homogénéisation de type «stomacher» pendant une
minute (Figure 16).
34

Figure 16 : homogénéisateur de
type « Stomacher »
4.2. Dilutions décimales
Un volume de 1 ml de la solution mère est
inoculé à l'aide d'une micropipette dans des tubes à
essai, préalablement remplis avec 9 ml de tryptone sel
stérilisé. À l'aide d'un agitateur vortex, on fait agiter
le contenu pendant 5 à 10 secondes afin d'obtenir la dilution
10-2. Cette opération sera répétée de la
même manière pour obtenir les dilutions suivantes
10-3et 10-4 (Figure 17).
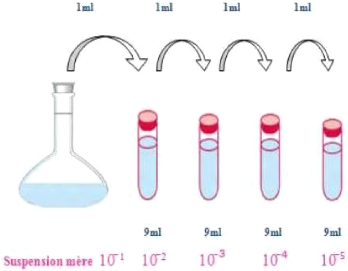
Figure 17 : Préparation de la
suspension mère et des dilutions décimales
35
5. Ensemencement
L'ensemencement est l'étape d'inoculation d'un volume
prédéterminé à partir du milieu contenant les
bactéries recherchées, dans le milieu de culture. L'ensemencement
est effectué à l'aide d'une « micropipette » dans une
zone stérile tout en désinfectant les paillasses.
5.1. Ensemencement en surface
Etalement de l'inoculum à la surface d'un milieu
gélosé à l'aide d'un étaleur. On dépose 0,1
ml de la suspension sur le milieu Baird Parker en cas de la recherche des
staphylococcus aureus par exemple, et avec un râteau, on
étale toute la suspension sur le milieu.
5.2. Ensemencement en profondeur
Souvent utilisé pour le dénombrement des
colonies, on dépose 1ml de la suspension dans une boîte de
pétri vide, et ensuite, on réalise un coulage du milieu de
culture tout en évitant de verser le milieu directement sur l'inoculum.
Mélanger immédiatement et soigneusement le milieu en surfusion et
l'inoculum, de façon à obtenir une répartition
homogène des microorganismes dans le milieu.
6. Protocoles de recherche et de dénombrement des
germes
6.1. Flore mésophile aérobie totale (NF ISO
4833 : 2003)
Suite à une dilution décimale bien
déterminée, on utilise la micropipette afin de mettre l'inoculum
(1ml) dans une boîte de pétri puis on effectue un coulage par
l'ajout de 17 ml du milieu PCA, on l'incube à une température de
30°C pendant 72h #177; 3h puis on prend les boites contenant moins de 335
colonies qui apparaissent avec une couleur blanche et une forme lenticulaire ou
ronde (Figure 18).
36
Figure 18 : Dénombrement des germes
totaux sur milieu PCA
6.2. Coliformes totaux à 30°C (NF EN ISO
4833/2003)
Il s'agit de mettre l'inoculum (1ml) dans une boîte de
pétri stérile puis il est nécessaire d'effectuer un
coulage, par l'ajout du milieu VRBL, qui se fait en deux étapes : Une
première couche en ajoutant 15ml du milieu et une deuxième couche
après 10 minutes (aprés solidification du milieu) par l'ajout
d'environ 5ml du milieu, on l'incube à une température de
30°C pendant 24h #177; 3h puis on prend toutes les boites contenant moins
de 300 colonies par boite avec au maximum 167 colonies caractéristiques
qui sont violacées, avec un diamètre = 0,5 mm (Figure 19).
Figure 19 : Dénombrement des coliformes
totaux sur milieu VRBL
37
6.3. Escherichia Coli (NF ISO 21528 - 2 :2004)
Il s'agit de mettre l'inoculum (1ml) dans une boîte de
pétri stérile et effectuer un coulage, par l'ajout de 20 ml du
TBX, puis on l'incube à une température de 44°C pendant 24h
#177; 3h. On retient les boites contenant moins de 300 colonies par boite avec
au maximum 167 colonies caractéristiques bleues (Figure 20).
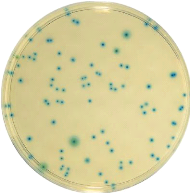
Figure 20 : Dénombrement
d'Escherichia coui sur le milieu TBX
6.4. Les staphylocoques à coagulase positive (NFEN
ISO 6888-1: 1999.2004 / NF
V 08-057-1:2004)
Il s'agit d'étaler 0,1 ml de la suspension mère
sur gélose Baird Parker avec un étaleur comme indiqué dans
la figure 21.
Figure 21 : Etalement sur milieu baird
parker
(
http://www.bio-top.net/microbio/tp/germes_peau_prep.htm)
38
L'incubation se fait à 37°C pendant 48h. On
retient les boites contenant moins de 300 colonies par boite avec au maximum
167 colonies non caractéristiques qui sont noires et des colonies
caractéristiques qui sont noires entourés par un halo clair.
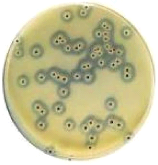
Figure 22 : Dénombrement des
Staphylococcus aureus sur milieu BP
Pour confirmer les staphylocoques à coagulase positive,
on fait choisir de chaque boite retenue 3 colonies caractéristiques(CC)
et 3 colonies non caractéristiques(CNC). La confirmation est
détaillée dans la figure 23 et selon la norme française
(NF V08.057.1 : 2004).
39
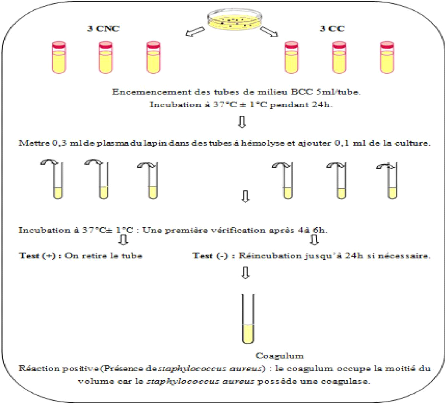
Figure 23 : Confirmation des staphylocoques
coagulase (+)
6.5. Les bactéries anaérobies
sulfito-réductrices (ISO 15213:2003)
Il s'agit de mettre l'inoculum (1ml) dans une boîte de
pétri stérile puis il est nécessaire d'effectuer un
coulage, par l'ajout du milieu TSC puis on met les boites dans des jarres en
absence total d'oxygène. L'incubation se fait à 37°C pendant
24h à 48h.
La lecture des anaérobies sulfito-réductrices est
effectuée en 3 étapes : y' Pré-lecture : Dés que
possible, après 8h à 10h d'incubation
y' 1ère lecture : Après 24h: Ne tenir compte que
des boites contenant des colonies bien séparées
c'est-à-dire éliminer les boites incomptables pour la lecture
finale.
40
? 2ème lecture après 48h : Retenir les boites
présentant des colonies de grandes tailles avec halo dont le nombre
total est inférieur à 150 colonies.
6.6. Expression des résultats (norme ISO 7218 :
2007)
Cas général
Pour q'un résultat soit valable, on estime en
général qu'il est nécessaire de compter les
colonies sur au moins une boîte contenant au moins 10
colonies, on calcule le nombre N de
microorganismes présents dans l'échantillon :
N= ÓC/ (V×1,1d)
Avec : Ó c : somme des colonies sur les
boites retenues de deux dilutions successives dont au
moins une contient au moins 10 colonies.
d : facteur de dilution correspondant à la 1ère
dilution retenue.
v : volume de l'inoculum appliqué à chaque boite,
en ml.
Estimation des petits nombres :
Si la boite contient moins de 10 colonies
caractéristiques, mais au moins 4, le résultat sera
comme suit :
Ne=C/V×d
Avec : Ne : nombre estimé.
C: nombre de colonies caractéristiques.
d : facteur de dilution correspondant à la 1ère
dilution retenue.
V: volume de l'inoculum appliqué à chaque boite, en
ml.
Nombre N'
Lorsque seule la boîte de la dernière dilution
ensemencée peut être comptée et contient plus
de 10 et moins de 300 colonies, on calcule le nombre N' de
microorganismes présents :
N' : C/V×d
C: nombre de colonies caractéristiques.
d : facteur de dilution correspondant à la 1ère
dilution retenue.
V: volume de l'inoculum appliqué à chaque boite, en
ml.
Mode de calcul après confirmation
? Pour les Staphylococcus aureus :
Après confirmation, on calcule, pour chacune des boites,
le nombre « a » des colonies
répondant aux critères de confirmation.
Résultat par dilution :
41
a=b×C/A
Avec : a: nombre de colonies à confirmer
b : nombre de colonies répondant aux critères
d'identification.
C : nombre total de colonies dénombrées
suspectes ou présumées par boite
On calcule le nombre N, Ne ou N' de microorganismes
confirmés présents dans l'échantillon
pour essai, en remplaçant ÓC par Óa.
6.7. Recherche des salmonelles (ISO 6579 : 2002)
Cette recherche nécessite 4 phases successives :
V' Pré-enrichissement
V' Enrichissement
V' Isolement
V' Confirmation
6.7.1. Pré-enrichissement
Cette étape est nécessaire à la
revivification des micro-organismes ayant subis des traitements
sublétaux et à l'augmentation non spécifique du nombre de
tous les micro-organismes présents dans la masse de produit
analysé. Après la préparation des dilutions
décimales à partir de la suspension mère pour la recherche
des germes suscités, on incube le contenu du sac stérile de
polyéthylène à 37°C #177; 1°C pendant 18 h #177;
2h.
6.7.2. Enrichissement
Cette étape se fait dans un milieu sélectif
liquide tel que le bouillon Rappaport-Vassiliadis (RVS) (Annexe 1). La forte
concentration en chlorure de magnésium ainsi que la présence de
vert malachite dans ce bouillon ralentissent la croissance des germes autres
que les salmonelles ce qui va permettre la croissance sélective des
salmonelles.
L'enrichissement se fait par le transfert de 0,1ml d'inoculum
obtenu après le pré-enrichissement, dans 10 ml de bouillon RVS
près du bec bunsen puis incubation à 41,5#177; 1°C pendant
24h#177;3h (Figure 24).
42

Figure 24: Etape d'enrichissement
6.7.3. Isolement
Deux milieux sélectifs ont été
utilisés pour l'isolement de Salmonella spp: gélose XLD
et gélose HK (annexe 1), vont être ensemencés l'aide d'une
anse stérile et à partir du milieu RVS déjà
incubé, près du bec bunsen. Ces deux boites XLD et HK
inoculées seront incubées à 37#177;1°C pendant
24#177;3h (figures 25 et 26).
L'aspect des colonies caractéristiques est cité
dans le tableau 8.
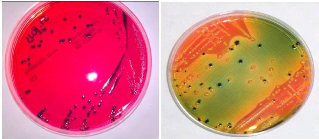
|
Figure 25 : Isolement de la Salmonella spp
en milieu XLD
|
Figure 26 : Isolement de la Salmonella spp
en milieu HK
|
Tableau 8 : Aspect des colonies
présumées Salmonella sur les deux milieux
ensemencés
|
Milieux
|
Aspect des colonies typiques
|
|
|
|
XLD
|
Centre noir, halo clair, sur fond rouge
|
Hektoen
Incolore à centre noir sur fond vert
43
6.7.4. Confirmation biochimique
Après l'incubation des géloses XLD et HK
ensemencées, une sélection de 5 colonies typiques est
effectuée suivie d'un repiquage sur gélose nutritive (annexe 1).
Une incubation à 37#177;1°C pendant 24#177;3h est ensuite
réalisée. Si la colonie suspecte est bien isolée, on
travaille sans isolement supplémentaire sur la gélose nutritive
pour pouvoir répondre plus rapidement.
Une série de tests biochimiques est
réalisée à partir d'une colonie bien isolée sur
gélose nutritive :
V' Test urée indole
V' Test Kligler-Hajna V' Test galerie API
20E
44
? Test d'urée indole

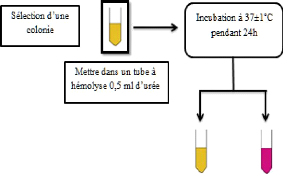

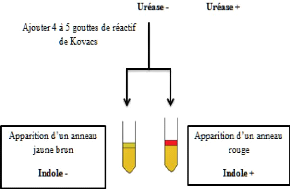
Figure 27 : Test d'urée indole
Les salmonelles sont : Uréase -
Indole -
45
+ Test Kligler-Hajna

A partir de la même colonie ensemencée dans le tube
d'urée indole, un tube Kligler-Hajna (annexe) est ensemencé par
une piqure centrale au niveau de culot puis la pente par des stries. Une
incubation à 37#177; 1°C pendant 24#177; 3h.
Le milieu Kligler-Hajna fournit 4 renseignements principaux
(Figure 28) :
V' Fermentation du glucose :
- culot rouge : glucose non fermenté - culot jaune :
glucose fermenté
|
V' Fermentation du lactose :
- Pente inclinée rouge : lactose non fermentée -
Pente inclinée jaune : lactose fermentée
|
Figure 28: Test Triple Sugar Iron sur milieu
Kligler-Hajna
|
V' Production de gaz : apparition de bulles de gaz dans
le culot
V' Formation de H2S : apparition d'une coloration
noire entre le culot et la pente ou le long de la piqure.
Les critères biochimiques de Salmonella sur le
milieu Kligler-Hajna sont indiqués dans le tableau 9 :
Tableau 9 : Les critères biochimiques du
Salmonella
|
Glucose
|
Lactose
|
Gaz
|
H2S
|
|
Salmonella
|
+
|
-
|
+
|
+
|
|
Aspect de KH
|
Culot jaune
|
Pente rouge
|
Bulles de gaz
dans le culot
|
Coloration noire
|
+ Test galerie API 20E
Ce test se fait en cas de confirmation par les tests
Kligler-Hajna et urée indole qu'il s'agit d'une Salmonella.
46
? Principe :
La galerie API 20 E comporte 20 microtubes contenant des
substrats déshydratés. Les microtubes sont inoculés avec
une suspension bactérienne. Les réactions produites pendant la
période d'incubation se traduisent par des virages colorés
spontanés ou révélés par l'addition des
réactifs.
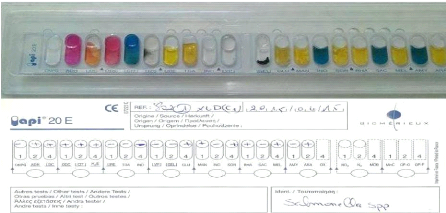
Figure 29 : Galerie API 20E
caractéristique du Salmonella
47
? Mode opératoire

Figure 30 : Etapes de l'utilisation de la
galerie API 20E Le tableau de lecture est dans l'annexe 2.
48
V. Analyses physico-chimiques (effectuées à
l'INRAT)
1. Mesure de pH
Le pH a été mesuré à l'aide d'une
sonde de pénétration reliée au pH mètre permettant
de mesurer directement la valeur du pH à l'intérieur de la
chair.
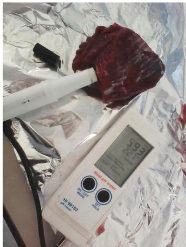
Figure 31 : Mesure de pH
2. Détermination de la couleur
Les 3 paramètres de couleur mesurés à l'aide
d'un chromamètre Minolta CR 100 sont:
L* : représente la luminosité (100
correspond au blanc pur, 0 correspond au noir pur). a* :
indice de rouge (teinte rouge positif, vert négatif) variant de - 60
à + 60.
b* : indice de jaune (intensité de teinte
jaune positif bleu négatif) variant de - 60 à + 60. Deux autres
paramètres de couleur sont calculés, il s'agit de : c* :
chrominance, lié à la quantité des pigments et
déterminée par la formule suivante :
C*= (a*2+b*2)1/2
h* : degré de teinte,
déterminée par la formule suivante :
h* = arc tg (b*/a*)
49

Figure 32 : Détermination de la
couleur
3. Détermination de la perte d'eau à la
cuisson
On pèse chaque échantillon de viande
fraîche (poids initial, Pi) puis on l'enveloppe dans un sachet en
plastique qu'on immerge dans un bain marie à 75°C durant 30 minutes
(Figure 27). On sort les échantillons cuits qu'on place sous le robinet
et on les laisse refroidir. La viande cuite sera serrée et pesée
une deuxième fois (poids final, Pf).
La perte d'eau à la cuisson (PEC) est
déterminée comme suit : PEC (%) = 100 x (Pi - Pt)
/Pi

Figure 33 : Bain marie à 75°C
50
4. Détermination de l'oxydation des lipides :
méthode Thiobarbituric Reactive Substance (TBARS)
Chaque échantillon est divisé en 2 portion dont
une potion a été placée dans une boite de pétrie,
recouvert par un film (Cryovac Lid2050), qui présente un taux de
perméabilité à l'oxygène (15 cm3 m-2 24 h-1
à 1 bar et 23 ° C) et stockées dans l'obscurité
à 4 ° C pendant 7 jours et l'autre portion a été
congelé à -18°C dans l'obscurité.
Ces échantillons ont été utilisés
pour mesurer l'oxydation des lipides (TBARS) à l'état frais et
à l'état congelé par le mode opératoire
décrit par Smeti et al (2013). L'oxydation des lipides de la
viande est déterminée par la méthode de Thiobarbituric
Reactive Substance (TBARS) qui comporte les étapes suivantes :
1.1. Préparation des solutions mères
TCA : Trichloracétique 100g de TCA/l
d'eau distillé
TBA : acide 2-thiobarbiturique 0,5884g TBA/200
ml d'eau distillé
TMP : Trimetoxipropano 16,5 ul de TMP/100ml
d'eau distillé
1.2.Préparation des standards
On prépare 7 tubes (B1, B2, 1, 2, 5, 10, 20) comme suit
:
> B1 : 5ml TBA + 5 ml H2O
> B2 : 5ml TBA + 5 ml H2O > Tube 1: 5ul TMP + 5 ml H2O >
Tube 2: 10ul TMP + 5 ml H2O > Tube 5: 25ul TMP + 5 ml H2O > Tube 10: 50ul
TMP + 5 ml H2O > Tube 20: 100ul TMP + 5 ml H2O
On procède à l'agitation de ces tubes à
l'aide d'un Rotatubos puis incubation dans un bain-marie à 100°C
pendant 35 min.
1.3.Préparation des échantillons
? Enlèvement des tissus conjonctifs de
l'échantillon puis hachage au mixeur.
? Pesée de10 g de l'échantillon + 20 ml de TCA
et hacher avec ultra-thurrax à 11000 rpm.
51
· Centrifugation à 4000 rpm pendant 30 min à
4°C
· Filtration par un papier filtre
· 2ml de filtrat + 2 ml TBA
· Préparation des tubes blancs (2 ml H2O + 2 ml
TBA)
· Incubation à 97°C pendant 20 min
· Refroidissement des tubes à température
ambiante
· Les valeurs d'absorbance (DO) des solutions
définitives et le blanc ont été enregistrés
à 532 nm dans un spectrophotomètre Shimadzu.
· Les valeurs de TBARS ont été
calculées à partir d'une courbe standard et exprimées en
mg malondialdéhyde (MDA) par kg de viande (MDA mg / kg de viande).
5. Traitement des données et analyses
statistiques
Les données relatives aux effets de l'ajout de la
congélation sur les qualités physico-chimiques et
microbiologiques des viandes ovine et bovine, ont été
traitées par le logiciel SAS®, 9.1 (2004). Ces données ont
été analysées au moyen de la procédure GLM :
programme de comparaison des moyennes. Le niveau de signification a
été fixé à 0,05 et les tendances ont
été discutées pour les valeurs de P comprises entre 0,05
et 0,10.
52
Résultats et discussion
I. La qualité microbiologique
Dans tous les échantillons analysés, les germes
suivants : Escherichia coli, les bactéries anaérobies
sulfito-réductrices ainsi que Staphylococcus aureus, n'ont pas
été détectés dans la viande bovine
ni à l'état frais ni à l'état
congelé. Ceci est probablement lié aux bonnes conditions
d'hygiène ainsi qu'à la bonne qualité de la matière
première. Aussi, on ne peut pas comparer au cours de ce projet la viande
ovine et la viande bovine car elles n'ont pas les même conditions ni
d'abattage ni de transport et aussi n'ont pas la même origine.
1. Flore anaérobie mésophile totale
Selon le Règlement (CE) n° 2073/2005 de la Commission
du 15 novembre 2005 concernant les critères microbiologiques applicables
aux denrées alimentaires et spécifiquement les carcasses des
bovins et ovins pour la flore aérobie mésophile totale on a :
m= 3,5 log ufc/g M= 5 log ufc/g
Dans le tableau 10, on présente les résultats du
dénombrement de la FMAT en log ufc/g pour les échantillons de la
viande ovine.
Tableau 10 : Flore mésophile
aérobie totale de la viande ovine à l'état frais et
congelé
|
Etat
|
Moyenne
|
Min
|
Max
|
Ecart type
|
p statistique
|
|
Frais
|
4,3206
|
<3
|
6,18
|
1,88
|
0,155
|
|
Congelé
|
4,0005
|
<3
|
4,78
|
1,31
|
? Parmi les 21 échantillons de viande ovine
analysés, 3 échantillons montrent une contamination initiale par
la FMAT de valeur supérieure aux normes requises (5 log ufc/g), selon le
DGAL 2007, et après la congélation, toutes les valeurs sont
inférieures à M donc on considère que le résultat
est acceptable et la congélation permet d'améliorer la
qualité bactériologique de la viande ovine.
53
? Les analyses statistiques ont montrés qu'il n'ya pas une
différence significative entre les échantillons à
l'état frais et à l'état congelé pour la viande
ovine (p>0,05). Ceci montre que la congélation ne détruit que
peu de microorganismes mais elle arrête leur multiplication. Le Tableau
11 présente les résultats de dénombrement de FMAT pour les
échantillons de la viande bovine à l'état frais et
à l'état congelé.
Tableau 11 : Flore mésophile
aérobie totale de la viande bovine à l'état frais et
congelé
|
Etat
|
Moyenne
|
Min
|
Max
|
Ecart type
|
p statistique
|
|
Frais
|
3,1
|
<3
|
3,3
|
1,66
|
0,03
|
|
Congelé
|
3,95
|
<3
|
4,26
|
2,03
|
? Toutes les valeurs obtenues dans le tableau ci-dessus sont
inferieures à M donc on peut dire que le produit est de qualité
satisfaisante pour les échantillons ayant une charge microbienne de FMAT
< m et acceptable pour les échantillons ayant une charge microbienne
de FMAT se situe entre m et M, pendant toute la durée de
congélation.
? La figure 34 a montré que charge de la flore
mésophile totale augmente significativement (p<0,05), elle passe de
3,1 log ufc/g à 3,95 log ufc/g après congélation durant 7
jours. Selon Hogue et al, (1993) cette augmentation peut être
due à la décongélation qui favorise la multiplication
rapide des germes après la stabilisation de la flore microbienne par la
congélation
4,5
2,5
3,5
4
2
3
ovine bovine
frais congelé
Figure 34 : Flore mésophile
aérobie totale de la viande ovine et la viande bovine à
l'état frais
et congelé
54
2. Coliformes totaux à 30°C
Selon le Règlement (CE) n° 2073/2005
de la Commission du 15 novembre 2005 concernant les critères
microbiologiques applicables aux denrées alimentaires et
spécifiquement les carcasses des bovins et ovins pour les coliformes
totaux à 30°C on a :
m= 1,5 log ufc/g M= 2,5 log ufc/g
Dans le tableau 12, on présente les résultats du
dénombrement des Coliformes totaux avant et après la
congélation dans les échantillons de la viande ovine.
Tableau 12 : La charge en coliformes totaux
dans la viande ovine
|
Etat
|
Moyenne
|
Min
|
Max
|
Ecart type
|
P statistique
|
|
Frais
|
2,35
|
<1
|
3,041
|
1,38
|
0,04
|
|
Congelé
|
1,61
|
<1
|
4,08
|
1,0007
|
? Parmi les 21 échantillons de viande
ovine analysés, 3 échantillons montrent
une charge initiale par les coliformes totaux
supérieure aux normes requises (2,5 log ufc/g) et cette charge
bactérienne est réduite après une congélation de 7
jours. Les analyses statistiques montrent que le nombre des coliformes a
diminué significativement au cours de la congélation (p<0,05).
A l'état frais, le nombre des coliformes totaux était 2,35 log
ufc/g, et après la congélation, il devient 1,61 log ufc/g (Figure
35).
Le tableau 13 présente les résultats du
dénombrement des Coliformes totaux avant et après la
congélation dans les échantillons de la viande bovine.
Tableau 13 : La charge en coliformes totaux
dans la viande bovine
|
Etat
|
Moyenne
|
Min
|
Max
|
Ecart type
|
p statistique
|
|
Frais
|
1,8
|
<1
|
2,5
|
0,624
|
0,73
|
|
Congelé
|
1,63
|
<1
|
1,78
|
0,212
|
55
? Toutes les valeurs des coliformes totaux obtenues dans le
tableau ci-dessus
sont inferieures à la limite minimale m après
subir la congélation durant 7 jours donc le résultat est
satisfaisant et montre que la viande destinée à l'armée
nationale est de bonne qualité. Les analyses statistiques montrent une
diminution significative (p<0,05) de la valeur des coliformes totaux passant
de 0,77 log ufc/g avant la congélation à 0,46 log ufc/g
après la congélation (Figure 35).
Frais Congelé
Ovine Bovine
2,5
2
1,5
1
0,5
0
Figure 35 : La charge en coliformes totaux de
la viande ovine et la viande bovine à l'état frais
et congelé
La présence des coliformes totaux est due à une
contamination fécale récente à cause des manipulations
multiples des viandes et l'application du froid intense a eu comme effets
l'inhibition du développement de ces bactéries, mais la
présence d'échantillons contaminés indique que
l'entreprise doit veiller au respect strict des règles de bonnes
pratiques d'hygiène et d'abattage.
3. Escherichia coui
Selon le Règlement (CE) n° 2073/2005 de la Commission
du 15 novembre 2005 concernant les critères microbiologiques applicables
aux denrées alimentaires et spécifiquement les carcasses des
bovins et ovins pour Escherichia coui on a :
m= 500 ufc/g M= 5000 ufc/g
56
Le tableau 14 présente les résultats de
dénombrement d'Escherichia coui dans les échantillons de
la viande ovine.
Tableau 14 : La charge en Escherichia coui
dans les échantillons de la viande ovine
|
Etat
|
Moyenne
|
Min
|
Max
|
Ecart type
|
p statistique
|
|
Frais
|
70,48
|
<10
|
510
|
118,34
|
0,212
|
|
Congelé
|
13,1
|
<10
|
80
|
30,12
|
? Tous les résultats obtenus dans le tableau ci-dessus
sont inferieurs à m avant et
après une congélation durant 7 jours, donc on
peut dire que le produit est de qualité satisfaisante pour les
différents échantillons analysés et pendant toute la
durée de congélation.
? Les analyses statistiques ont montré qu'il y a une
différence significative entre
les échantillons frais et les
échantillons congelés, ces échantillons ont
enregistré une diminution de nombre d'Escherichia coui qui
passe de 70,48 ufc/g à 13,1 ufc/g après la congélation de
7 jours (Figure 36).
Ces résultats sont trouvés aussi par Bergeron et
Gagnon (2004) qui ont fait refroidir la bactérie à
différentes températures utiles, afin de déterminer
l'effet du froid sur la bactérie Escherichia coui, et les
résultats ont permis de démontrer que la durée de
refroidissement n'influence en rien sa croissance et que le froid ne la tue
pas. Il a cependant été possible de constater qu'une vitesse
lente de congélation affaiblissait les colonies et pourrait avoir un
effet bactéricides ce qui explique nos résultats et la diminution
du nombre de ces germes pathogènes.
|
80 70 60 50 40 30 20 10
0
|
|
|
frais congelé
|
Figure 36 : La charge en Escherichia coui
dans les échantillons de la viande ovine à l'état
frais et congelé
57
4. Les bactéries anaérobies
sulfito-réductrices
Les ASR sont des indicateurs de contamination fécale,
d'origine humaine ou animale, leur présence en grande quantité
peut faire suspecter une contamination d'origine intestinale. Selon
DGAL/SDHA/N2001-8090, concernant les critères
microbiologiques applicables aux denrées alimentaires et
spécifiquement les carcasses des bovins et ovins pour les ASR on a :
Limite maximale M : 10 ufc/g.
Le tableau 15 présente les résultats trouvés
avant et après la congélation dans les échantillons de la
viande ovine en ufc/g.
Tableau 15 : La charge en bactéries
anaérobies sulfito-réductrices chez la viande ovine
|
Etat
|
Moyenne
|
Min
|
Max
|
Ecart type
|
p statistique
|
|
Frais
|
17,62
|
<10
|
110
|
33,52
|
0,02
|
|
Congelé
|
2,62
|
<10
|
20
|
4,47
|
? D'après les analyses statistiques, la valeur moyenne
des ASR a enregistré une diminution significative (p<0,05)
après avoir une congélation durant 7 jours. Le taux des ASR dans
les échantillons de la viande ovine fraiche, qui est de 17,62 ufc/g,
présente un résultat non satisfaisant pour les
échantillons de viande ovine fraiche, ce taux diminue et atteint 2,62
ufc/g après la congélation d'où on a un résultat
satisfaisant (Figure 37).
Les ASR peuvent se développer à
l'intérieur des carcasses, produisant ainsi un mauvais goût et /
ou les toxines (Tholozan et al. 1997). Ils sont en
général les clostridies. Le Clostridium perfringens est
un pathogène très répandu dans l'environnement, il est
généralement trouvé dans le tractus gastro-intestinal des
animaux sains, d'où il contamine généralement les
carcasses pendant l'abattage (Mead, 1994). Selon Aristide (2010), le fort taux
de diminution du nombre des ASR est lié à l'action de la
congélation qui se manifeste par l'inhibition de la flore
Pathogène.
58
|
20 18 16 14 12 10 8 6 4 2 0
|
|
|
frais congelé
|
Figure 37 : La charge en bactéries
anaérobies sulfito-réductrices chez la viande ovine à
l'état
frais et congelé
5. Staphylococcus aureus
Selon DGAL/SDHA/N2001-8090, concernant les
critères microbiologiques applicables aux denrées alimentaires et
spécifiquement pour les carcasses des bovins et ovins pour les
Staphylococcus aureus on a :
Limite maximale M : 102 ufc/g
Le tableau 16 présente les résultats trouvés
de dénombrement des Staphylococcus aureus, avant et
après la congélation dans les échantillons de la viande
ovine en ufc/g.
Tableau 16 : La charge en Staphylococcus
aureus dans les échantillons de la viande ovine
|
Moyenne
|
Min
|
Max
|
Ecart type
|
p statistique
|
|
Frais
|
35,5
|
<10
|
50
|
16,36
|
0,94
|
|
Congelé
|
36,25
|
<10
|
60
|
17,32
|
? La contamination des viandes rouges par les staphylocoques a
plusieurs origines tels que : la poussière et aussi la contamination
d'origine humaine à travers les manipulations et les
sécrétions (salive, la sueur) (Secke, 2007), mais touts les
valeurs obtenues dans le tableau ci-dessus sont inferieures à M, et tous
les résultats d'analyses sont satisfaisants. Donc on peut dire que le
produit est de bonne qualité.
? Les analyses statistiques ont montré qu'il n'y a pas
une différence significative entre le taux des Staphylococcus aureus
entre la viande ovine à l'état frais qui est de 35,5 ufc/g
et après la congélation de 7 jours qui est de 36,25 ufc/g. Ce
taux est inférieur à ceux de Nkolo
59
(2007) qui a trouvé 6% des échantillons des
carcasses congelées présentant des staphylocoques
présumés pathogènes.
6. Salmonella spp
Selon le Règlement (CE) n° 2073/2005
de la Commission du 15 novembre 2005 concernant les critères
microbiologiques applicables aux denrées alimentaires et
spécifiquement les carcasses des bovins et ovins pour la Salmonella
on a :
Limite : Absence/ 25g d'échantillons
n= 50 c=2
Les résultats ont montré un taux de
contamination par salmonella de l'ordre de 10% pour la viande ovine
à l'état frais, alors que cette bactérie est absente dans
tous les échantillons après la congélation de 7 jours
(Figure 38). On peut considérer que le résultat est satisfaisant
selon DGAL/SDSSA/N2007-8275.
Ce résultat est expliqué par Rosset, (1982), que
lors de la congélation, certaines propriétés des
bactéries peuvent être altérées ; cependant, bien
que les salmonelles et les autres bactéries à coloration de Gram
négatif soient considérées comme les plus sensibles
à ce processus d'altération, le taux de destruction demeure
relativement faible Cependant la congélation ne peut être
considéré comme un traitement assainissant.
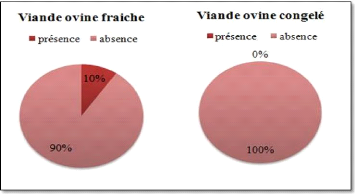
Figure 38 : Répartition des
résultats de satisfaction pour les Salmonelles dans la viande
ovine
avant et après la congélation
60
II. Les paramètres physicochimiques
Les analyses statistiques effectuées ont montré
que la congélation pendant 7 jours des viandes ovines, a
significativement affecté les paramètres physicochimiques (pH,
oxydation des lipides, perte à la cuisson et h) (p<0,05). Le tableau
17 présente les résultats des paramètres physicochimiques
de la viande ovine et le tableau 18 représente celles de la viande
bovine.
1. pH
Le potentiel d'hydrogène est classé parmi les
caractéristiques technologiques vu qu'il influence
énormément l'aptitude à la conservation des viandes
(Iberraken et Maouche, 2006). Les valeurs de pH de la viande ovine à
l'état frais sont significativement plus faibles que celles
notées pour la viande ovine congelée (p<0,05).
L'analyse statistique montre que les valeurs de pH augmentent
d'une manière significative après 7 jours de congélation
pour la viande ovine. A l'état frais, pour la viande ovine, le pH a une
valeur moyenne de 5,675. Après la congélation et la
décongélation, une augmentation de pH a été
notée, elle atteint une valeur de 5,878 (Figure 39). Mais cette analyse
statistique n'a pas montré un effet significatif de la
congélation sur le pH de la viande bovine (Tableau 18). La figure 39
suivante a révélé une valeur moyenne de pH
élevé de la viande congelée par rapport à la viande
fraiche. Ces résultats sont trouvés aussi par Biswas et
al., (2003) au cours de la conservation
réfrigérée de la viande de porc additionnée
d'antioxydant artificiel, qui a expliqué cette élévation
de la valeur de pH par le catabolisme protéique sous l'action des
microorganismes produisant ainsi des composantes azotées qui peuvent
avoir un caractère basique (accepteur de proton) grâce à
leur doublet libre sur l'azote.
61
Tableau 17 : les résultats des
paramètres physicochimiques dans les échantillons de la viande
ovine
|
Paramètres
|
Moyenne
|
Ecart-type
|
p statistique
|
|
pH
|
Frais
|
5,675
|
0,22
|
0,009
|
|
Congelé
|
5,878
|
0,39
|
|
TBARS
|
Frais
|
1,117
|
0,93
|
0.002
|
|
Congelé
|
0,402
|
0,2
|
|
PEC
|
Frais
|
22,806
|
0,04
|
0.002
|
|
Congelé
|
28,137
|
0,06
|
|
Teneur en
eau
|
Frais
|
74%
|
0,02
|
0,99
|
|
Congelé
|
74%
|
0,04
|
|
Indice de
rouge a*
|
Frais
|
16,703
|
3,78
|
0,154
|
|
Congelé
|
18,126
|
2,24
|
|
Indice de
jaune b*
|
Frais
|
7,51
|
3,12
|
0,184
|
|
Congelé
|
8,776
|
2,9
|
|
Teinte H*
|
Frais
|
22,253
|
6,47
|
0,018
|
|
Congelé
|
27,11
|
6,27
|
|
Chromaticité C*
|
Frais
|
20,024
|
2,96
|
0,361
|
|
Congelé
|
18,924
|
4,49
|
|
Luminosité
L*
|
Frais
|
37,75
|
3,9
|
0,73
|
|
Congelé
|
37,335
|
3,74
|
62
Tableau 18 : les résultats des
paramètres physicochimiques dans les échantillons de la viande
bovine
|
Paramètres
|
Moyenne
|
Ecart-type
|
p statistique
|
|
pH
|
Frais
|
5.69
|
0,31
|
0,455
|
|
Congelé
|
5,81
|
0,27
|
|
TBARS
|
Frais
|
0.89
|
0,42
|
0.027
|
|
Congelé
|
0.27
|
0,10
|
|
PEC
|
Frais
|
29.74
|
0,05
|
0.74
|
|
Congelé
|
28.93
|
0,03
|
|
Teneur en
eau
|
Frais
|
75%
|
0,02
|
0,62
|
|
Congelé
|
75%
|
0,02
|
|
Indice de
rouge a*
|
Frais
|
17,25
|
2,58
|
0,94
|
|
Congelé
|
17,15
|
1,96
|
|
Indice de
jaune b*
|
Frais
|
7,31
|
2,73
|
0,27
|
|
Congelé
|
8,75
|
1,43
|
|
Teinte H*
|
Frais
|
22,45
|
5,99
|
0,07
|
|
Congelé
|
27,27
|
2,87
|
|
Chromaticité C*
|
Frais
|
18,73
|
2,73
|
0,81
|
|
Congelé
|
19,10
|
2,57
|
|
Luminosité
L*
|
Frais
|
40,76
|
4,66
|
0,42
|
|
Congelé
|
38,71
|
4,86
|
63
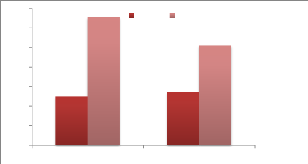
5,85
5,75
5,65
5,55
5,9
5,8
5,7
5,6
ovine Bovine
Frais congelé
Figure 39 : Valeurs moyennes du pH de la
viande fraiche et la viande congelée des ovins et
des bovins
2. Etude de l'état oxydatif des
lipides
Parmi les aldéhydes formés lors de l'oxydation
lipidique, le plus connu est le malonaldéhyde (MDA) qui est produit lors
de la coupure des acides gras polyinsaturés donc le dosage de ce
composé, à l'aide de l'acide thiobarbiturique, va nous renseigner
sur le degré d'oxydation de produit. Les résultats obtenus
après le dosage de l'indice d'oxydation des viandes ovines et bovines
ont montré que pour celles fraiches, les valeurs de TBARS des
échantillons sont significativement plus élevées
(p<0,05) que celles trouvées pour les échantillons
congelés pendant 7 jours (Tableau 17 et tableau 18).
La valeur moyenne de TBARS est de 1,117 mg MD/kg pour les
échantillons frais de la viande ovine et 0,89 mg MD/kg pour les
échantillons frais de la viandes bovine, alors que pour les
échantillons congelés est de 0,402 mg MD/kg pour la viande ovine
et 0,27 mg MD/kg pour la viande bovine (Figure 40). La diminution des valeurs
de TBARS est due à l'oxydation de la matière grasse et la
production des métabolites en présence d'oxygène pour les
échantillons analysés à l'état frais (Cava et
al., 2004). Ces résultats montrent que la méthode de
conservation utilisée a un effet efficace dans la diminution de
degré d'oxydation.
64
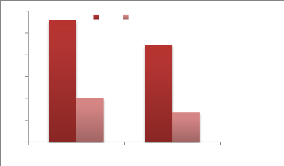
0,8
0,6
0,4
0,2
1,2
0
1
ovine bovine
frais congelé
Figure 40 : Les valeurs moyennes de contenu en
MDA de la viande fraiche et la viande
congelée des ovins et des
bovins
3. Couleur
3.1. L'indice de rouge a* et l'indice de jaune b*
Les analyses statistiques (Tableau 17 et tableau 18) ont
montré que la congélation n'a pas affecté
significativement l'indice de rouge a* et l'indice de jaune b*, de la viande
ovine et la viande bovine. Mais la figure 41 montrent qu'il y a une diminution
plus importante en indice rouge pour la viande ovine que la viande bovine
durant les 7 jours de congélation, et cette diminution est
essentiellement liée à l'oxydation de la myoglobine en
metmyoglobine (Moëvi, 2006).
frais congelé
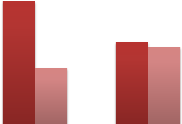
ovine bovine
18,5 18 17,5 17 16,5 16 15,5
Figure 41 : la différence de l'indice
de rouge a* entre la viande fraiche et la viande congelée
des ovins
et des bovins
65
La figure 42 montre une augmentation de l'indice de jaune b*
similaire pour la viande ovine et la viande bovine durant les 7 jours de
congélation, et cette augmentation est due à la conservation
réfrigérée qui a fait inhiber les réactions
d'oxydation et les réactions enzymatiques responsable de la
dégradation des pigments (Bhat et al., 2013).
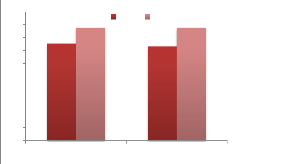
10
4
2
9
7
6
5
3
0
8
1
ovine bovine
frais congelé
Figure 42 : la différence de l'indice
de jaune b* entre la viande fraiche et la viande congelée
des ovins
et des bovins
3.2. Luminosité L*
La luminosité exprime l'impression de clarté et
de brillance de la couleur. Les valeurs de L n'ont pas significativement
varié au cours de la congélation (p>0,05), mais les
résultats ont montré que ces valeurs ont légèrement
diminué durant la période de congélation dans les deux
types de viande, de même la viande bovine était plus lumineuse que
la viande ovine (Figure 43).
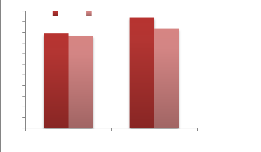
42
40
28
26
24
22
20
38
36
34
32
30
ovine bovine
frais congelé
Figure 43 : Les valeurs de la
luminosité L* de la viande fraiche et la viande congelée
des
ovins et des bovins
66
3.3. La teinte Hue
La méthode de conservation à basse
température a significativement affecté la teinte de la viande
ovine (p<0.05), la valeur moyenne de la teinte des échantillons frais
est plus faible que celle des échantillons qui ont subis une
congélation durant 7 jours, elle passe de 22,25 à 27,11.
La teinte de la viande bovine a augmenté de 22,46
à 27,27 après 7 jours de congélation. Néanmoins,
cette variation reste statistiquement non significative (p>0,05).
En effet, au cours de la conservation à basse
température, 2 composantes interviennent pour modifier la teinte du
produit :
? L'état chimique du pigment musculaire, en effet, au
cours de la conservation, la couche de metmyoglobine (MetMb) s'épaissit
et se rapproche de la surface de la viande et la couleur passe du rouge au
brun, ce qui a induit une diminution remarquable de la teinte des
échantillons qui n'ont pas subis une congélation (Coibion,
2008).
? Le développement des bactéries en surface de
la viande et ses possibles interactions
avec la forme chimique du pigment
(Coibion ,2008). La figure 44 montre la différence de la valeur moyenne
de cette composante durant la période de congélation.
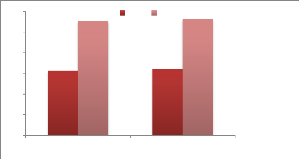
28
26
24
22
20
18
16
ovine bovine
frais congelé
Figure 44 : Les valeurs moyennes de la teinte
(H*) de la viande fraiche et la viande congelée
des ovins et des
bovins
3.4. Chromaticité C
La saturation ou la chromaticité C, est un attribut de
la sensation visuelle permettant d'estimer la proportion de couleur chromatique
pure contenue dans la sensation totale. Coibion (2008) a indiqué que ce
paramètre dépend de la quantité de pigment présent
dans le muscle. L'analyse de variance de l'effet de la congélation
montre qu'il n'y a pas eu un effet significatif.
67
Le suivi de la saturation des viandes ovine et bovine au cours
de la période de congélation est illustré par la figure
45.
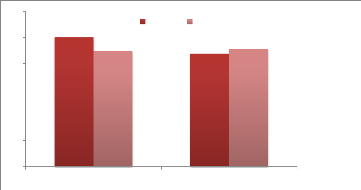
22
20
18
16
14
12
10
ovine bovine
frais congelé
Figure 45 : Les valeurs de la
chromaticité C* de la viande fraiche et la viande congelée
des
ovins et des bovins
? Les résultats montrent que les échantillons frais
de la viande ovine ont une valeur
moyenne de C élevée (20,024) contre 18,924
après la congélation. Cette diminution n'est pas observée
dans les échantillons de la viande bovine qui passe de 18,73 à
19,103 après la congélation de 7 jours (Tableau 17 et tableau
18).
4. La perte de l'eau à la cuisson
Parmi les traitements que peut subir la viande
préalablement à sa consommation, la cuisson est une étape
presque incontournable puisque les produits carnés sont consommés
dans leur quasi-totalité après une cuisson industrielle ou
ménagère (Genot, 2000).
Les analyses statistiques (Tableau 17) ont montrés que
les pourcentages moyens des pertes à la cuisson ont été
affectées par la conservation à basse température pour la
viande ovine (p<0,05), en revanche chez la viande bovine (Tableau 18),
aucune différence significative n'est mise en évidence entre
l'état frais et l'état congelé. La figure 46 montre que la
variation de la PEC est plus importante en viande ovine qu'en viande bovine.
Selon Genot, (2000), l'effet de la congélation sur la perte d'eau
à la cuisson varie avec le produit et avec le mode de
décongélation et la variation du pouvoir de rétention
d'eau dépond de la valeur de pH.
68
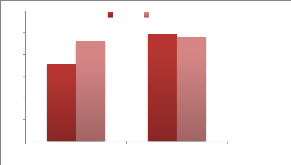
25
20
35
30
15
10
5
ovine Bovine
frais congelé
Figure 46 : Les pourcentages moyennes de la
perte à la cuisson de la viande fraiche et la
viande congelées
des ovins et des bovins
5. La teneur en eau
Les analyses statistiques et les résultats
présentés par la figure 47 ont montré que la
congélation n'a pas un effet significatif sur la teneur en eau de la
viande ovine et même pour la viande bovine.
75%
70%
65%
60%
55%
50%
80%
ovine Bovine
frais congelé
Figure 47 : Les pourcentages moyennes de la
teneur en eau de la viande fraiche et la viande
congelée des les
ovins et les bovins
69
Conclusion et perspectives
L'objectif de ce présent projet est d'étudier
l'influence de la congélation pendant 7 jours sur les qualités
microbiologique et physicochimique des viandes rouges, consommées
à l'hôpital militaire principal d'instruction de Tunis.
Deux types de viande ont été utilisés :
la viande ovine et la viande bovine. Pour chaque type de viande,
l'évolution de la flore bactérienne ainsi que les
paramètres physicochimiques pendant 7 jours de congélation, a
été suivie. La FMAT, les CT, les ASR et E. coli ainsi
que Staphylococcus aureus ont été
dénombrés et la salmonella spp a été
recherchée. Le pH, la couleur (L*, a*, b*, C* et H*), ainsi que la
teneur en MDA ont été mesurés. De même, la teneur en
eau et la perte d'eau à la cuisson ont été
déterminées.
Nous avons constaté que la congélation a
réduit la charge en germes thermo-tolérants (température
optimale supérieur à 30°C) : Escherichia coli,
coliformes totaux et bactéries anaérobies
sulfito-réductrices, elle empêche la multiplication des
microorganismes. Cependant, certains germes, plus sensibles aux basses
températures, ont été complètement détruits
par la congélation qui a probablement un pouvoir assainissant. En
conséquence, une congélation de sept jours, permet l'inhibition
de la multiplication bactérienne et une meilleure conservation des
viandes ovine et bovine.
Les germes pathogènes tels que Salmonella ont
présenté aussi une sensibilité accrue face à la
basse température (-18°C), résultats prévus
initialement, puisque les entérobactéries Gram (-) paraient plus
sensibles à la congélation selon des recherches scientifiques.
Ce résultat peut être en faveur du consommateur
final du moment où la congélation améliore le niveau de
sécurité sanitaire de la viande. Cependant, cette
réalité présente une contrainte pour le laboratoire
militaire d'analyses alimentaires lors des analyses réalisées sur
une viande congelée. Par conséquent, il sera
déconseillé de passer par une étape de congélation
avant de procéder à l'analyse microbiologique des
échantillons réceptionnés vu la sensibilité de
certains germes à la congélation. Dans le cas
échéant, la fiabilité des résultats trouvés
peut être diminuée en cas où un passage d'un niveau
d'insatisfaction à un niveau de satisfaction qui peut être
provoqué par l'effet de la congélation.
70
Concernant les paramètres physicochimiques, la teneur
en eau, la luminosité L*, la chromaticité C*, l'indice de rouge
a* et l'indice de jaune b* ne sont pas affectés par la
congélation. Par contre, le pH, la perte d'eau à la cuisson ainsi
que la teinte h ont augmenté durant la congélation ce qui
résulte en une viande plus tendre. La teneur en MDA a diminué
traduisant un meilleur statut antioxydant de la viande.
Le nombre des échantillons analysés ainsi que
l'étude de l'effet temps sont parmi les limites de cette
étude.
En perspectives, une durée de congélation plus
longue ou la surgélation de la viande peuvent-elles donner des
résultats plus révélateurs ?
71
Références bibliographique
A
Ahounou G.S., Clinquart A., Farougou S., Mensah G.A.,
Salifou C.F.A., Tougan P.U., Youssao A.K.I (2012). Critères
d'appréciation et facteurs de variation des caractéristiques de
la carcasse et de qualité de la viande bovine, Annales de
Médecine Vétérinaire pp27-42.
Aristide T.M (2010). Effets du froid sur la
qualité bactériologique de Filets de sole élaborés
dans une industrie de pêche au Sénégal, mémoire pour
l'obtention de diplôme de master 2 en qualité des denrées
Alimentaires d'origine animale, Présenté et soutenu publiquement
à l'Ecole Inter-Etats des Sciences et Médecine
Vétérinaires (EISMV) de Dakar pp 20-27.
Aubry L., Becila S., Boudjellal A., Coulis G.,
Herrera-Mendez C.H., Ouali A., Sentandreu M.A (2006). Revisiting the
conversion of muscle into meat and the underlying mechanisms. Meat Science, pp
44-58.
B
Balon T.W et Yerneni K (2001). Redox
regulation of skeletal muscle glucose transport. Medicine and Science in Sports
and Exercise pp 382 - 385.
Bauchart D., Culioli J., Geay Y., Hocquette J.F
(2002).Valeur diététique et qualités sensorielles
des viandes de ruminants. Incidence de l'alimentation des animaux. Production
Animale (INRA), pp 37-52.
Belhadj T (2001). La filière des
viandes rouge en Tunisie. Options Méditerranéennes, pp 81-87.
Ben Chehida F (2012). Apport de la
vaccination à l'aide d'un vaccin inactivé contre Salmonella
Enteriditis dans la réussite d'un plan de lutte contre les Salmonelloses
zoonotiques dans un élevage de reproducteurs ponte. Thèse pour
l'obtention du doctorat en médecine vétérinaire
présentée à l'école nationale de médecine
vétérinaire de sidi Thebet pp112.
Ben Haddada R (2009). Contribution à
l'étude du secteur des viandes rouges dans le grand Tunis. Thèse
pour l'obtention du doctorat en médecine vétérinaire
présentée et soutenue publiquement à l'école
nationale de la médecine vétérinaire de Sidi Thabet en
2009.
Benaissa A (2011). Étude de la
qualité microbiologique des viandes camelines et ovines
conservées selon différents modes. Mémoire de Master,
Biologie : Option Microbiologie Appliquée, soutenue à
l'université Kasdi Merbah Ouargla, Faculté des Sciences de la
Nature et de la Vie et des Sciences de la Terre et de l'Univers pp 61.
Bergeron A et Gagnon A.M (2004). À froid
E-coli : L'effet du froid sur la bactérie Escherichia coli,
Expo-Journal, rapport interne, programme des Sciences de la nature,
Cégep de Saint-Félicien, Saint-Félicien, pp 7.
Bhat Z.F., Kumer P., Kumer S (2013). Effect of
skin, enrobing and refrigerated storage on the quality characterics of chiken
meat balls. Association of food Scientist and Technologist, pp 890-899.
Bimbenet J., Duquenoy A., Trystman G (2002).
Génie des procédés alimentaires, Edition RIA,
DUNOD, Paris, pp.369.
Biswas A. K., Keshri R. C., Kumar S (2003).
Effect of Enrobing and Adding Antioxidants on the Quality of Pork
Patties, Journal of Animal Sciences:16(9) pp 1374-1383
Boccard R et Valin C (1984). Les viandes,
Information Techniques des services Vétérinaires .pp 93-96.
Boyer J.R., Kastner C.L., Leising J.D., Nutsch A.L.,
Phebus R.K., Riemann M. J., Schafer D. E., Wilson R.C (1997).
Evaluation of a steam pasteurization process in a commercial beef
processing facility. Journal of Food Protection, 60 pp 485 - 492.
Brice T (2004). Etude expérimentale et
numérique des phénomènes thermomécaniques lors de
la congélation de produits alimentaires. Application à des
structures multicouches. Thèse pour l'obtention du doctorat en
Génie des procédés présentée à
l'Université de Nantes.
C
Cardinal. P (2003). Lignes directrices pour
l'interprétation des résultats analytiques en microbiologie
alimentaire, Comité provincial sur l'uniformisation et
l'interprétation des critères microbiologiques des aliments,
Québec, version électronique, pp 44.
Cartier P (2004). Points de repères en
matière de qualité microbiologique viandes bovines, Institut de
l'Élevage, 24, pp 175.
Cartier P (2007). Le point sur La
qualité des carcasses et des viandes de gros bovins, Compte rendu final
n° 17 05 32 022, Service Qualité des Viandes, Département
Techniques d'Elevage et Qualité, pp 12-58.
Cartier P et Moëvi I (2007). Le point
sur la qualité des carcasses et des viandes de gros bovins. Institut de
l'Élevage : Paris, p72.
Cassar-Malek I., Hocquette J.F., Jailler R., Jurie C.,
Listrat A., Picard B (2005). Evolution des recherches sur le muscle
des bovins et la qualité sensorielle de leur viande. II : Influence des
facteurs d'élevage sur les caractéristiques musculaires. Cahiers
Agricultures, 14 (4), pp 365-372.
Cava R., Tarrega R., Ramirez M.R., Mingoarranz F.J.,
Carrasco A (2004). Effect of irradiation on color and lipid oxidation
of dry-cured hams from free-range reared and intensively reared pigs.
Innovative Food Science and Emerging Technologies. 6 (2), pp 135141.
Cheftel J.C et Cheptel H. (1977). Traitement
de préservation en introduction à la biochimie et à la
Technologie des aliments. Lavoisier Edition : Technique et Documentation, 2, pp
419.
Chougui N (2015). Technologie et
qualité des viandes. Présenté à l'Université
Abderrahmane Mira de BEJAIA, Faculté des Sciences de la Nature et de la
Vie, département des Sciences Alimentaires pp 63.
CIV (2004) : centre d'information des
viandes, Les qualités organoleptiques de la viande bovine, Bases
scientifiques pour une bonne utilisation culinaire, quatrième fascicule
de la Collection « Cahiers Sécurité des Aliments ». pp
4-14.
Fournaud J (1982). Contamination aux
différents stades Hygiène et technologie de la viande fraiche Ed
CNRS, pp 133-136.
Clinquart A., Fabry J., Casteels M (1999).
Belgian Association for Meat Science and Technology (éds), La viande,
Presses de la Faculté de Médecine vétérinaire de
l'Université de Liège, pp 75-96.
Clinquart A., Dottreppe O., Dufrasne I.L., Hornick
J.L., Istasse L., Leroy B (2000). Les facteurs de production qui
influencent la qualité de la viande des bovins Blanc Bleu belge. In :
L'élevage du Blanc Bleu Belge, Journée du Centre d'Excellence du
Secteur agricole et son Management (CESAM), Mons, pp19.
Coibion L (2008). Acquisition de la
qualité organoleptique de la viande bovine: adaptation à la
demande du consommateur. Thèse pour obtenir le grade de docteur
vétérinaire soutenue à l'Université Paul Sabatier
de Toulouse pp 7-25.
D
De Buyser L et Hennekinne A (2009). Fiche de
description de danger microbiologique transmissible par les aliments :
Staphylococcus aureus et enterotoxines staphylococciques. Afssa.
E
Elrammouz R (2005). Etude des changements
biochimiques post mortem dans le muscle des volailles .Contribution au
déterminisme de l'amplitude de la diminution du pH, p 3-4.
Eslava C., Villaseca J., Hernandez U., Cravioto A
(2003). Escherichia coli. In : Miliotis M.D., Bier J.W. (Ed.),
International handbook of foodborne pathogens. Marcel Dekker : New York pp
123-135.
F
FAO (2009) : Organisation des Nations Unies
pour l'alimentation et l'agriculture : Bilan mondiale.
Fletcher D.L (2009). Poultry meat quality.
World's Poultry Science Journal 52 (June) pp 131-145.
Fraysse A.S (2005). A systematic mutagenesis
study of Ile-282 in transmembrane segment M4 of the plasma membrane H+-ATPase
Journal of Biological Chemistry 280(23):21785-90.
G
Gandemer G (1999). Lipids and meat quality:
lipolysis, oxidation, maillard reaction and flavour. Sciences des Aliments, 19,
pp 439-458.
Genot C (2000). Aspects
généraux de la congélation in Congélation et
qualité de la viande. Editions INRA, Technique et pratique, paris,
p.92.
Ghafir Y et Daube G (2007). Le point sur les
méthodes de surveillance de la contamination microbienne des
denrées alimentaires d'origine animale, Annales de Médecine
Vétérinaire, 151, pp 79-101.
GIVlait (2011) : Groupement
interprofessionnel des viandes rouges et du lait : rapport annuel du
GIVlait.
GIVlait (2013) : Groupement
interprofessionnel des viandes rouges et du lait : rapport annuel du
GIVlait.
GIVlait (2015) : Groupement
interprofessionnel des viandes rouges et du lait : rapport annuel du
GIVlait.
Goulet O (1990). Le fer dans l'organisme
humain. Dans viande et alimentation de l'homme savoir, raison et harmonie
P49.
H
Hamad B (2009). Contribution à
l'étude de la contamination superficielle bactérienne et fongique
des carcasses camelines au niveau de l'abattoir d'EL-OUED. Mémoire de
Master en médecine vétérinaire pp 29-30.
Hébel P (2007). Enquête :
Comportements et Consommations Alimentaires en France. Henry D (1992).
Alimentation et nutrition humaines. ESF. Paris.
Hermier J., Lenoir J., Weber F (1992). Les
groupes microbiens d'intérêt laitier. Edition CEPIL, Paris.
Hoffman L.C (1988). Comparison of six
cross-breed lamb types: sensory, physical and notional meat quality
characteristics. Meat Science., 65(4): 1265-1274.
Hogue A T., Dreesen D W., Green S S., Ragland R
D.,James W O.,Bergeron E A.,Cook L V.,Pratt M D., Martin D R (1993).
Bacteria on Beef Briskets and Ground Beef: Correlation with Slaugther
volume and Antemortem Condemnation. Journal of Food Protection, 56 (2) pp
110-119.
I
Iberraken M et Maouche K (2006). Les produits
carnés. Mémoire pour l'obtention de l'ingéniorat en
contrôle de qualité et analyse, présentée à
l'université de Bejaia.
J
Jeuge S., Carlier M., Vendeuvre J.L., Nassy G (2012).
Rapport d'étude : L'oxydation des produits carnés :
méthodes de mesure et moyens de maîtrise, l'institut technique
française de Recherche et de Développement de la filière
porcine, pôle viande et charcuteries.
Joanisse D.R (2004). Skeletal Muscle
Metabolism and Plasticity, in Functional Metabolism: Regulation and Adaptation.
Edition: K. B. Storey, John Wiley & Sons, Inc., Hoboken, NJ, USA, pp 295 -
318.
Julie D (2009). Attribution des cas de
salmonelloses humaines aux différentes filières de production
animale en France Adaptabilité et robustesse du modèle
bayésien d'attribution par typage microbiologique. Thèse pour
l'obtention de doctorat en biologie et agronomie, soutenue à l'institut
supérieur des sciences agronomiques, agro-alimentaires, horticoles et du
paysage pp 15.
Jurie C et Listrat A (2010). Structure et
fonction des constituants du muscle squelettique. Dans, D.Bauchart & B.
Picard , Muscle et viande de ruminant. Editeur: Quae. pp 61-70.
Khaldi G (2005). Pratiques d'élevage
des troupeaux d'ovins en Tunisie: situation actuelle et perspectives d'avenir.
CDROM de formation, ILRI-ICARDA-IRESA.
K
Korsak N., Clinquart A., Daube G (2004).
Salmonella spp. Dans les denrées alimentaires
d'origines animale : un réel problème de santé Publique.
Annales De Medecine Veterinaire, 148(4), pp 174-193.
L
Lameloise P., Roussel-Ciquard N., Rosset R
(1984). Evolution des qualités organoleptiques : les viandes :
hygiène, technologie. Information Technology Service veterinary, pp
88-125.
Lawrie R.A (1991). The eating quality of
meat. In : Lawrie R.A (Edition.), Meat science. 5th edition. Pergamon Press :
Oxford, pp 184-224.
Lawrie R.A (2006). Lawrie's Meat Science
7th edition, Chapter 4: Chemical and Biochemical Constitution of
Muscle, pp 58-94.
Leyral G et Vierling E (1997). Microbiologie
et toxicologie des aliments. Editions Doin, pp 54-82.
Lucbert J., Moevi I., Normand J., Pottier E (2005).
Le point sur l'alimentation des bovins et des ovins et la
qualité des viandes. Institut de l'Élevage. Interverb.Paris. pp
88-101.
M
Mafart P (1991). Chapitre 7. La
congélation in Génie Industriel Alimentaire. Tome 1 Les
procédés physiques de conservation, édition. Lavoisier
Technologie et Documentation, Paris, p.295.
Mancini R.A et Hunt M.C (2005). Current
research in meat color. Meat Science, 71(1), pp 100-121.
Mansour N.K (1996). La valeur nutritionnelle
des viandes dans la santé, 1ére édition. Université
Omar El Mokhtar libye pp357.
Mead G.C (1994). Microbiological hazards from
red meat and their control. British Food. Journal. 96, pp 33-36.
Mescle J.F et Zucca. J (1988). Comportement
des microorganismes en milieu alimentaire Microbiologie alimentaire Aspect
microbiologique de la sécurité et de la qualité
alimentaire Technique et documentation, APRIA, l, pp 9-48.
Oudot C (1999). Technique de stabilisation in
la transformation des aliments, option génie alimentaire, Editions
ballery Techniplus, France, pp 79.
Moëvi I (2006). Le point sur la couleur
de la viande bovine, l'institut de l'élevage. Interbev : Paris, p
113.
Monin G (1988). Evolution post mortem du
Tissu Musculaire et Conséquence sur les Qualités de la Viande de
Porc. Journées de la Recherche Porcine en France, 20, pp 201-214.
Monin G (1991). Facteurs biologiques des
qualités de la viande bovine, INRA Productions Animales, 4(2) pp
151-160.
Monin G et Ouali A (1991). Muscle
differentiations and meat quality. Meat science, 5, pp 89-157.
Monin M (2003). Abattage des porcs et
qualités des carcasses et des viandes. INRA Productions Animales, 16(4),
pp251-262.
N
Nguyet H.T (2008). Etude de la flore lactique
du Nem chua, produit carné fermenté cru traditionnel du sud
Vietnam et maîtrise du processus de fermentation par ajout de souches
lactiques, thèse pour l'obtention de doctorat, soutenue à
l'université bordeaux, pp 12 -16.
Nkolo S.C (2007). Qualité
bactériologique de la viande de buffle congelée importée
au Sénégal, thèse présentée et soutenue
publiquement devant la Faculté de Médecine, de Pharmacie et
d'Odonto-Stomatologie de Dakar pour obtenir le Grade de docteur
vétérinaire, pp 59-64.
O
OEP (2017) : L'office de l'élevage et
des pâturages - programme de développement - élevage -
filière de la viande rouge, Ministère de l'agriculture, des
ressources hydrauliques et de la pêche.
Ouali A (1990). La maturation des viandes
facteurs biologiques et technologiques de variation. Revue scientifique :
viande et produits carnés, 11, 281-290.
Rosset R., Roussel N., Ciquard. (1984).
Composition chimique du muscle. Les viandes, Informations Techniques
des Services Vétérinaires. pp 97-102.
Oumokhtar B., Karib H., Bouchriti N., Arbada A.
(1998). Appréciation de la qualité
bactériologique de la viande et des abats de taurillons
fraîchement abattus dans les abattoirs de Rabat, Vol 18 (3). Actes
Institut Rabat, Maroc, pp 169-176.
P
Pearce R.A et Bolton D.J (2005). Excision vs
sponge swabbing: a comparison of methods for the microbiological sampling of
beef, pork and lamb carcasses. Journal of Applied Microbiology, 98(4), pp
896-900.
Pierre J (1998). Microbiologie alimentaire.
Edition Dumod. Paris. pp16.
Poumeyrol M et Popoff M (2006). Fiche de
description de danger microbiologique transmissible par les aliments :
Clostridium perfringens. Afssa.
Purchas, R.W et Aungsupakorn (1993). D'autres
recherches sur la relation entre le pH et la tendresse des échantillons
de boeuf des taureaux et des bouvillons. Meat Science pp163-178.
R
Renerre M., 2006. La mesure de la couleur de la
viande .Station QUAPA, Unité BPM, INRA Theix, 11èmes JSMTV -
Clermont Ferrand, pp 257-258.
Rosset R (1982). Chilling, freezing and
thawing. In:»Meat microbiology» applied science pub. London, pp
265-268.
Rosset R (1988). Autres viandes et produits
camés Microbiologie alimentaire Aspect microbiologique 'de la
sécurité et de la: qualité alimentaire Technologie et
Documentation, APRIA, l, pp 237-250.
Rosset R et Lebert F (1982). Les
règles d'hygiènes envisageables aux différents stades de
la filière viande : principes. Hygiène et technologie des viandes
fraiches. Edition. CNRS, pp 277- 280.
S
Sauvageot, F (1982). L'évaluation
sensorielle des denrées alimentaires (Centre de Documentation
International des Industries Utilisatrices de Produits Agricoles., Massy), pp
196.
Secke C (2007). Contribution à
l'étude de la qualité bactériologique des aliments vendus
sur la voie publique de Dakar, thèse présentée et soutenue
à l'université Cheikh Anta Diop pour l'obtention du Doctorat
d'état en médecine vétérinaire, pp 50-70.
Sloan A.E (2009). 10 top food trends. Food
Technology, April, pp 22-40.
Staron T (1979). La viande dans l'alimentation
humaine. APRIA. Paris. pp 01-05.
T
Tholozan J.L., Carlin F., Poumeyrol M., Fach P.
(1997). Bactéries anaérobies strictes et hygiène
des aliments. Bulletin de la société française de
microbiologie. pp 48-55.
W
Williams P.G (2007). Nutritional composition
of red meat. Nutrition and Dietetics, 64(4): pp113 - 119.
Webographie
ONAGRI (2010) : Observatoire National de
l'Agriculture : Evolution des prix des céréales en Tunisie.
http://www.onagri.nat.tn/ consulté le 27/04/2017
Planetoscope (2017) : Site mondial de
statistique en temps réel :
http://www.planetoscope.com
consulté le 30/04/2017
Références
réglementaires
Arrêté du 21 décembre 2009 :
relatif aux règles sanitaires applicables aux activités
de commerce de détail, d'entreposage et de transport de produits
d'origine animale et denrées alimentaires en contenant
DGAL/SDHA/N2001-8090: Direction
générale de l'alimentation Sous-direction de la
Sécurité Sanitaire des Aliments, bureau de la Surveillance des
Denrées Alimentaires et des
Alertes Sanitaires : Précisions relatives aux
modalités de mise en oeuvre des analyses microbiologiques de
denrées alimentaires et d'exploitation des résultats.
DGAL/SDSSA/N2007-8275 : Direction
générale de l'alimentation, Sous-direction de la
sécurité sanitaire des aliments, bureau des matières
premières : Critères microbiologiques applicables aux carcasses
d'animaux de boucherie et de volailles, et lignes directrices relatives aux
contrôles de surface du matériel en abattoir et en atelier de
découpe d'animaux de boucherie et de volailles.
ISO 15213 : 2003 : Microbiologie des
aliments- méthode horizontale pour le dénombrement des
bactéries sulfito-réductrices se développant en conditions
anaérobies.
ISO 6579 : 2002 : Microbiologie des aliments
-- Méthode horizontale pour la recherche des Salmonella spp.
ISO 6887-2 (2003) : Microbiologie des
aliments -- Préparation des échantillons, de la suspension
mère et des dilutions décimales en vue de l'examen
microbiologique -- Partie 2: Règles spécifiques pour la
préparation des viandes et produits à base de viande.
ISO 7218/2007 : Norme relative à la
microbiologie des aliments - Exigences générales et
recommandations
NF EN ISO 4832/2006 : Norme relative à
la microbiologie des aliments - Méthode horizontale pour le
dénombrement des coliformes - Méthode par comptage des
colonies.
NF EN ISO 4833/2003 : Norme relative à
la microbiologie des aliments - Méthode horizontale pour le
dénombrement des micro-organismes - Technique de comptage des colonies
à 30°C.
NF ISO16649-2/2001 : Norme relative à
la microbiologie des aliments - Méthode horizontale pour le
dénombrement des Escherichia coli bêta-glucuronidase positive.
NF EN ISO 6888-1/1999 : Microbiologie des
aliments - Méthode horizontale pour le dénombrement des
staphylocoques à coagulase positive.
NF ISO 21528 - 2 :2004 : Microbiologie des
aliments -- Méthodes horizontales pour la recherche et le
dénombrement des Enterobacteriaceae -- Partie 2: Méthode par
comptage des colonies.
NF V08.057.1/2004 : Norme relative à
la microbiologie des aliments - Méthode de routine pour le
dénombrement des staphylocoques à coagulase positive par comptage
des colonies à 37° C - Partie 1 : technique avec confirmation des
colonies.
Règlement CE 852/2004 : Relatif à
l'hygiène des denrées alimentaire.
| 


