|
REPUBLIQUE DEMOCRATIQUE DU CONGO
ENSEIGNEMENT SUPERIEUR, UNIVERSITAIRE
ET
RECHERCHE SCIENTIFIQUE
UNIVERSITE EVANGELIQUE EN AFRIQUE
U.E.A.

B.P : 3323
FACULTE DES SCIENCES AGRONOMIQUES ET
ENVIRONNEMENT
Effets des types de cultures (tissulaire et
sporée) et d'antibiotiques
(chloramphénicol, gentamicine et bénomyl)
sur le contrôle d'infections en
culture in vitro du champignon comestible
(PleurotusostreatusP 969).
Travail de fin de cycle pour l'obtention du diplôme de
graduat :
Par : DIEUMERCI MASUMBUKO Roosevelt
Option : Agronomie générale
Encadreur : CT.MUKENGERE BAGULA Espoir Ass. MONDO MUBALAMA
Jean
Année académique :
2014-2015.
~ I ~
Prélude.
«Aux âmes bien-nées, la valeur n'attend point
le nombre d'années » dit-on.
Pierre Corneille.
~ II ~
Dédicace.
A ma mère Régina M'NTALINDWA.
A mon cher oncle BAGULA NTALINDWA et sa femme CHIREZI
BUDUNDWA.
A mon grand et petit frère IMANI MASUMBUKO et MURHABAZI
MASUMBUKO.
A mes chers cousins et cousines Espoir BAGULA, Esperance BAGULA,
Olivier BAGULA, Willy BAGULA, Patience BAGULA, NYOTA BAGULA, Timothée
BAGULA, Joël BAGULA, Christelle BAGULA, et MUKENGE NAMUBAMBA.
Aux familles NTALINDWA et LUMESHA.
A tous mes cousins, cousines, oncles et tantes. A tous mes amis
et connaissances.
A celle qui portera la charge du coeur de ce grand homme que
l'UEA vient de former pendant trois ans.
Roosevelt MASUMBUKO.
~ III ~
Sigles et abréviations.
UEA : Université Evangélique en Afrique.
PDA : Pomme de terre Dextrose Agar.
CO2 : Dioxyde de carbone.
O2 : Oxygène.
Tcm optimale : l'intervalle des températures optimales
pour la fructification.
KV : Kanamycine - Vancomycine, dite "Kana-Vanco". MCK :
MacConkey(une gélose).
SM2 : Milieu sélectif des bactéries à Gram
négatif.
CAN2 : Candida Albicans: Acide
désoxyribonucléique.
ARN : Acide ribonucléique. pH : Potentiel en
hydrogène.
~ IV ~
Remerciements.
C'est par cet adage de Pierre Corneille, « Aux
âmes bien-nées la valeur n'attend point le nombre d'années
» que nous avions débuté ces quelques mots de
remerciement pour toutes les personnes qui ont contribué à
l'achèvement de ce travail.
Nos remerciements les plus sincères s'adressent au chef
des travaux MUKENGERE BAGULA Espoir et à l'assistant MONDO MUBALAMA Jean
qui ont accepté de diriger ce travail jusqu'à sa fin.
Notre profonde gratitude est exprimée à l'UEA,
particulièrement la Faculté des sciences agronomiques et
environnement qui, par le doyen KATCHO KARUME via le CEREA, nous a donné
l'opportunité d'effectuer notre travail dans son projet «
Champignon ».
A mon très cher oncle BAGULA NTALINDWA et sa femme
CHIREZI BUDUNDWA, nous leur disons grand merci pour tous ce qu'ils ont fait
pour nous, en nous offrant de bonnes conditions d'étude malgré le
manque des moyens financiers.
Nos remerciements s'adressent aussi à ma très
chère maman Régina M'NTALINDWA qui a supporté toutes nos
caprices durant le moment passé ensemble.
Nous ne pouvons pas oublier de remercier les membres du corps
scientifique et cadres de la Faculté des sciences agronomiques et
environnement de l'UEA, pour l'effort consenti à nous assurer une
formation de qualité. Les connaissances acquises auprès d'eux
nous ont permis d'élaborer ce travail, particulièrement au Maitre
en sciences Gaston AMZATI et le Maitre en sciences AYAGIRWE BASENGERE.
Nos remerciements les plus sincères s'adressent
également à mes amis Arsène MUKOME, Charles BAGABO, AMZATI
SAIDI, MAJALIWA MAITAPO et AGANZE MWEZE pour les conseils prodigués.
Nous tenons enfin, à remercier nos collègues et
camarades de promotion pour leur soutien pendant des bons et mauvais moments
passés ensemble.
A tous ceux qui ont contribué tant
matériellement que moralement, de près ou de loin pour la
réussite de ce travail, nous leur remercions infiniment.
Roosevelt MASUMBUKO.
~ V ~
Listes des tableaux et figures.
Tableau 1 : Quelques familles d'antibiotiques.
Tableau 2 : Taux de reprise des semences primaires.
Tableau 3 : Coloration de Gram. Tableau 4 : Identification du
genre.
Tableau 5 : Longueurs des mycéliums et des substrats et
présence d'infection pour les semences secondaires.
Figure 1 : A droite : Penicillium (bleu) et Cladosporium (vert
foncé). A gauche : Aspergillus : inhalation de spores dangereuse.
Figure 2 : Dispositif expérimental pour les semences
primaires.
Figure 3 : Analyse de la vitesse de reprise sur les
différents types de cultures.
Figure 4 : Effets du type de culture et d'antibiotiques sur le
diamètre total du mycélium.
Figure 5 : Effets de types de cultures et d'antibiotiques sur la
vitesse de croissance mycélienne.
Figure 6 : Effets du type des cultures et d'antibiotiques sur le
niveau d'infection. Figure 7 : Corrélation entre le niveau d'infection
et le diamètre total du mycélium.
~ 1 ~
Introduction
Contexte, problématique et justification du
sujet.
Notre province possède une faune et une flore sauvages
très riches et encore insuffisamment mises en valeur. C'est entre autre
le cas des champignons comestibles qui ; s'ils sont objet de cueillette
saisonnière n'ont pas encore été mis en culture (Musibono
et al., 1992).
Les champignons comestibles sont des aliments très
nutritifs ; ils contiennent des quantités importantes des sels
(minéraux, glucides et vitamines) et sont une source importante des
protéines (Hexiang et al., 2002).Tout en permettant de varier
l'alimentation, les champignons procurent un complément riche en
minéraux, en vitamines et même en protéines, rivalisant
ainsi avec les meilleurs légumes (Bart, 1994). Ils constituent des
produits forestiers non ligneux d'une importance capitale et sont très
recherchés pour leur valeur nutritive élevée, leur valeur
marchande ainsi que pour les nombreux sels minéraux et vitamines qu'ils
contiennent (Breene, 1990 ; Vetter, 1994 ; Mattila et al., 2001 ;
Ndoye et al., 2007; Ndong, 2009). Les champignons, étant
également pourvus de vertus médicinaux, sont
considérés comme idéals pour les hypertendues, les effets
rénaux et les diabétiques (Yip et al., 1987; Chandy,
1997) et sont souvent considérés comme aliments
thérapeutiques ayant des propriétés
anticholesterolémiques (Bobek et al., 1995, Galbavy et al.,
1999, Mattila et al., 2000).
Cependant, la nourriture obtenue grâce à la
cueillette et qui accompagne les produits de base est saisonnière (De
Merode et al., 2004). La saisonnalité dans l'apparition des
sporophores reste ainsi un facteur limitant pour leur disponibilité,
souvent aléatoire et concentrée sur quelques semaines par an,
principalement en saison des pluies (Dibaluku et al., 2010).
Dès lors, la mise en culture des champignons se révèle
être une activité rentable pour les paysans congolais.
Pour réaliser la culture de ces champignons ; il
conviendrait de sélectionner les espèces qui se prêtent
bien à la culture mycélienne à partir des spores ou des
tissus sporifères. Cette recherche devrait permettre de réduire
la dépendance des consommateurs kivutiens par rapport à la
cueillette saisonnière qui est insuffisante (Cohen et al.,
2002).
Bien que la culture des champignons soit une
réalité prouvée ; dans des nombreux pays en voie de
développement, la disponibilité du blanc (semences) de bonne
qualité représente un facteur de limitation de la culture des
champignons. L'importation est souvent entravée par la
--' 2 --'
bureaucratie des services des douanes, les couts de transport
élevés et la difficulté de garder le blanc à une
température basse pendant le transport (Oei, 2005).
La difficulté de produire le blanc (semences des
champignons) de manière synthétique est liée à des
problèmes d'infections dues aux bactéries ou d'autres champignons
en concurrence avec le champignon en culture. Ces bactéries ou autres
champignons peuvent avoir une croissance rapide que le champignon en culture et
occuper tout le milieu gélosé, d'où l'échec de la
culture (Khaled et al., 2007). La température excessive et
très basse du milieu de culture peut influencer les infections dans les
milieux de culture en favorisant la croissance des pathogènes et
l'inhibition de la croissance des champignons en culture (Blaizot, 2011).
La lutte contre les infections dans la culture in vitro des
champignons comestibles demeure donc une préoccupation première
des recherches sur les champignons. Ces infections peuvent être à
l'origine d'une faible production du blanc (semences des champignons) ou
presqu'inexistant lorsque les pathogènes prédominent dans les
milieux de culture et que lorsqu'il y a d'autres champignons non
cultivés qui s'y développent.
Le présent travail a tenté de faire la
combinaison de différentes combinaisons d'antibiotiques et types de
culture afin d'identifier laquelle assure le mieux le contrôle
d'infections en culture in vitro.
Questions de recherche.
Pour notre travail, nous avions conçu les questions
suivantes qui nous ont aidés à la réalisation de cette
recherche :
? Quels seraient les effets de différents antibiotiques
sur le contrôle d'infection en culture in vitro de Pleurotus
ostreatus ?
? Quels seraient les effets de différents types de
culture sur le contrôle d'infection en culture in vitro ?
? Quels seraient les différents pathogènes
susceptibles d'attaquer le milieu de culture pour les différents types
de culture utilisés
? Quels seraient les effets de ces différents facteurs
(types de culture et antibiotiques) combinés sur la vitesse de
croissance et le développement mycélien ?
~ 3 ~
Hypothèses.
Nous nous sommes fixés les hypothèses
ci-après :
· Les différents antibiotiques permettraient le
contrôle efficace des pathogènes sur milieu de culture.
· Les types de cultures auraient une influence non
négligeable dans le contrôle d'infections en culture in vitro. La
culture sporée produirait mieux que la culture tissulaire sur PDA.
· Le nombre et genres de pathogènes varieraient
d'un type de culture à l'autre en production in vitro du champignon.
· Les effets combinés des types de culture
à des antibiotiques amélioraient la vitesse de croissance et le
développement mycélien.
Objectifs.
Objectif global.
Contribuer au contrôle d'infections dues aux
pathogènes en culture in vitro de champignon comestible (Pleurotus
ostreatus).
Objectifs spécifiques.
· Evaluer l'efficacité de différents
antibiotiques dans la lutte contre les infections en culture in vitro de
Pleurotus ostreatus ;
· Evaluer l'efficacité de différents types
cultures (tissulaire ou sporée) sur le contrôle d'infections en
culture in vitro de Pleurotus ostreatus ;
· Identifier les différents pathogènes
(bactéries et champignons compétiteurs) pouvant s'attaquer aux
différents types de culture utilisés ;
· Evaluer les effets combinés des types de
culture et d'antibiotiques sur la vitesse de croissance et le
développement mycélien.
> Hyphe : filament microscopique formé des cellules
tubulaires qui constituent la partie végétative (mycélium
ou thalle) ou reproductrice (sporophore) d'un champignon.
~ 4 ~
Chapitre 1 : Revue de la littérature.
1.1. Généralités sur les
champignons : les pleurotes.
Les champignons comestibles font partis du règne de
Fungi. Il existe des champignons micro
et des champignons macroscopiques, ils sont encore
appelés des micromycètes et des macro-mycètes. Les
champignons comestibles sont des macro-mycètes (Leconte, 2006).
1.1.1. Caractéristiques des champignons.
Les champignons sont des :
> Eucaryotes ; ils peuvent être multinuclés
(homo ou hétérocaryotique) ou uninuclé. Ils sont à
l'état végétatif haploïde pour la plupart.
> Thallophytes ; ils ne possèdent pas de racines, ni
de tige, ni de feuilles.
> Hétérotrophes ; incapables d'utiliser
l'énergie solaire, ils utilisent des nombreuses molécules
carbonées fabriquées d'autres êtres vivants. Ils sont non
photosynthétiques. > Leur paroi contient de la chitine et de
polysaccharides (glucane).
> Ils se reproduisent et se multiplient par
l'intermédiaire de spores de nature diverses, issues d'une reproduction
asexuée ou sexuée (Oei, 2005).
1.1.2. Biologie, écologie.
L'organisme vivant des Fungi est un mycélium
constitué d'un fin réseau de filaments, hyphes.
Sous certaines conditions les hyphes sexuellement compatibles
fusionnent et forment les spores. Les structures les plus grandes
(supérieures à 1mm) produisant des spores sont appelées
des champignons. C'est la partie qu'on remarque le plus dans la nature, mais
elle ne constitue qu'une fructification. La partie la plus importante se trouve
sous le sol ou à l'intérieur du bois (Oyster, 2004; Oei,
2005).
Les champignons sont un groupe distinct d'organismes plus
étroitement liés aux animaux qu'aux plantes (FAO, 1998).
Un champignon est de deux grandes parties : le mycélium
qui est l'organe végétatif et le Basidiome (ou carpophore ou
encore sporophore) qui est la partie reproductrice.
Le mycélium et la baside sont formés des
structures filamenteuses appelées hyphes. Le basidiome peut être
porté par un stipe ou peut être sessile ; pour ce fait, on peut
distinguer les champignons à chapeau et en croute.
~ 5 ~
> Mycélium : masse d'hyphes continus ou
cloisonnés par des segments ou des boucles qui constituent la structure
d'un champignon.
> Hyménium : couche de cellules issues des hyphes
générateurs de la trame, qui tapissent l'intérieur des
tubes ou la surface des lames d'un sporophore.
> Baside : cellule fertile d'un champignon formé
d'un hymenophore et d'un contexte (Bordas, 1970).
Le pleurote en huitre (Pleurotus ostreatus) pousse
de l'automne à l'hiver selon les régions, en touffes sur les
feuillus vivants ou tombés. C'est un parasite de blessure mais il est
également saprophyte. La température optimale est de 24-26°C
pendant la période d'incubation ; et 1012°C pendant la
période de fructification. Un abaissement de température favorise
l'entrée en fructification. Un taux d'humidité avoisinant la
saturation (85-95°C) est meilleur pour le développement des
champignons. L'apport d'air neuf est une donnée essentielle pour
réduire la teneur en CO2 et réalimenter en O2 les processus de la
lignine (Lushiku, 2012).
1.1.3. Nutrition des champignons.
En général, les champignons assurent leur
alimentation à partir d'autres organismes, en absorbant les substances
nutritives du matériau organique dans lequel ils vivent. Les champignons
dépendent du matériel mort et vivant pour leur croissance. Ils
obtiennent leurs substances nutritives de trois façons essentielles :
> Saprophytes : champignons florissant sur de la
matière morte organique.
> Symbiotique : champignons florissant en collaboration
étroite avec d'autres organismes c.à.d. qu'il ya des
bénéfices pour chacun d'eux.
> Parasites ou Pathogènes : champignons causant du
mal à un autre organisme (Oei, 2005).
La majorité de champignons comestibles sont
symbiotiques et forment des mycorhizes avec des arbres. Les champignons
comestibles saprophytes sont aussi sauvages, mais ils sont mieux connus mais
plus estimées sous leurs formes cultivées. Les pleurotes font
partis des champignons comestibles saprophytes (Prance, 1984 ; Oei, 2005).
-' 6 -'
1.1.4. Classification.
Malgré des différences fondamentales, les
champignons sont classifiés comme des plantes. La classification des
champignons comme plantes a des conséquences pratiques faibles.
L'ethnomycologie est le terme correct qui indique que des champignons sont
impliqués .De façon similaire, la flore se réfère
seulement aux plantes. Le terme équivalent pour les champignons est
mycètes (mycota) (Ertrug, 2000).
Comme les plantes, les champignons sont des êtres
vivants. Autrefois, on répartissait les êtres vivants en deux
grands règnes : le règne animal et le règne
végétal. Aujourd'hui on les classe en 6 règnes : le
règne animal, végétal, champignon, protiste,
bactéries et le règne archéobactérie.
Le règne Champignon renferme cinq embranchements :
Chytridiomycota, Zygomycota, Ascomycota, Basidiomycota et Champignons
imparfaits. Les Pleurotes font parti de l'embranchement des Basidiomycota et la
plupart de champignons comestibles font parti de cet embranchement (Sergeeva,
2000).
1.1.4.a) Caractéristiques de l'embranchement des
Basidiomycètes (Pleurotes).
Les Basidiomycètes forment un de cinq embranchements
de champignons. Ils renferment plus de 23.000 espèces différentes
parmi lesquelles les champignons comestibles, les champignons
vénéneux, les satures, les vesses de loup, les polypores ainsi
que deux groupes importants d'agents pathogènes des plantes ; les
rouilles et les charbons. Les polypores jouent un rôle essentiel dans la
décomposition de la litière végétale : ils
constituent souvent les deux tiers de la biomasse vivante du sol (les animaux
non compris). Ils sont caractérisés par des spores formées
à l'extrémité des cellules fertiles, les basides. Le
mycélium des Basidiomycètes est toujours cloisonné, mais
les cloisons sont perforées .Chez de nombreuses espèces, le pore
de la cloison possède une marge renflée en forme d'anneau ou
tonnelet appelé dolipore. Le pleurote appartient au règne de
Fungi, à l'embranchement ou division des Basidiomycota, à la
classe des Agaricomycetes, à la sous- clase des Agaricomycetidae,
à l'ordre des Agaricales, à la famille des Pleurotaceae et au
genre Pleurotus (Hexiang, 2002 ; Mikiashvili, 2006).
Le nom Pleurote s'applique à plus de 20souches de
champignons différentes qui se distinguent par la température
exigée, la couleur et le rythme de croissance (Oei, 2005). Le genre
Pleurotus n'est pas considéré comme un champignon non
resupiné, et la plupart de souches sont monomitiques,
c'est-à-dire qu'elles ne possèdent qu'un seul type d'hyphes, ce
qui leur confère une consistance molle. Seul Pleurotus dryinus
peut parfois être dimitique, ce
~ 7 ~
qui signifie qu'il a des hyphes squelettiques
supplémentaires qui lui donnent une consistance plus ferme comme celles
des polypores. Le genre Pleurotus comprend un groupe de champignons
comestibles ligninolytiques ayant des propriétés
médicinales et d'importantes applications biotechnologiques et
environnementales (Cohen et al., 2002).
1.1.5. La culture des champignons.
1.1.5.a) Croissance mycélienne et
blanc.
Dans la culture des champignons comestibles, on n'utilise pas
les spores. Leur petite taille rend leur manipulation délicate et leurs
caractéristiques génétiques risquent d'être
différentes de celles de leurs parents. De plus, ils mettent un certain
temps à germer alors que d'autres types de champignons, les moisissures
vertes par exemple, germent et se propagent bien plus rapidement. Le champignon
sélectionné doit pouvoir coloniser le substrat avant d'autres
champignons ou bactéries. A cette fin, on mélange un
mycélium cultivé préalablement (libre de tout contaminant)
avec un substrat stérile, ce qui donne ce qu'on appelle le blanc. Cette
technique donne au champignon cultivé une longueur d'avance sur les
autres Fungi (Oei, 2005).
1.1.5.b) L'envahissement du blanc.
Comme dans la nature, le mycélium se propagera dans le
substrat en utilisant les substances nutritives qui s'y trouvent. C'est ce
qu'on appelle l'envahissement du blanc. Lorsque certaines d'entre elles sont
épuisées ou si le temps change, le mycélium atteindra une
phase différente, celle de la reproduction sexuelle. On met en culture
du tissu prélevé sur un champignon et on le dépose dans un
substrat approprié. Une fois que celui-ci est complètement
envahi, on l'utilise pour cultiver des champignons.
Pour la plupart des espèces la température
optimale pour l'envahissement du blanc est d'environ 25 °C. De plus,
l'environnement peut stimuler la croissance du mycélium : une forte
concentration de CO2 lui est favorable (mais pas à la culture).
Une fois qu'il a colonisé le substrat, le
mycélium est en état de produire des fructifications dont le
nombre et la qualité dépendront de l'environnement (Oei et
al., 2005).
-' 8 -'
1.1.5. Production de blanc de champignon.
La semence de champignon (matériau de propagation) est
généralement désignée sous le nom de blanc.
Disponibilité du blanc.
Dans de nombreux pays en développement, la
disponibilité de blanc de bonne qualité représente un
facteur de limitation de la culture des champignons. L'importation est souvent
entravée par la bureaucratie des services de douanes, les frais de
transport élevés et la difficulté à garder le blanc
à une basse température pendant le transport. C'est pourquoi le
producteur sera peut-être contraint de produire son propre blanc. Si l'on
peut obtenir du blanc de bonne qualité du champignon
désiré à un prix raisonnable, il vaut mieux se concentrer
sur les processus de croissance du champignon. Le processus complet de
production de blanc consiste à préparer le milieu de culture,
à remplir les éprouvettes ou les boîtes de Pétri et
à les stériliser, puis à inoculer des récipients
plus grands avec cette culture. La production de blanc nécessite un
laboratoire désinfecté et des connaissances
spécialisées. La production de blanc revient à mettre du
mycélium du champignon désiré dans des substrats
adéquats et stérilisés dans des conditions aseptiques.
Mais, dans la pratique, ce processus n'est pas aussi simple qu'il en a l'air.
Il faut maintenir dans des conditions strictes des souches appropriées
du champignon désiré pour éviter leur
dégénération. Lorsque c'est impossible ; la production de
blanc devrait se faire à partir de cultures de tissu d'un champignon
frais et sain. De plus, la chambre de production de blanc doit toujours
être méticuleusement propre pour éviter toute
contamination.
La culture de démarrage.
La culture de démarrage (ou culture mère) se
fait à partir d'une fructification fraîche et saine ou provient
d'un producteur de blanc ou d'un laboratoire. Elle permet de produire plusieurs
cultures d'agar qui servent à inoculer du blanc dans des
récipients plus volumineux (des flacons par exemple), puis à
inoculer le substrat final de blanc. Une unité de production de blanc
nécessite l'équipement minimum suivant :
? du matériel de stérilisation (autocuiseur,
autoclave) ;
? un environnement stérile : boîte à
inoculation ou à écoulement laminaire ;
? un équipement de laboratoire : boîtes de
Pétri, des éprouvettes, une balance, de
l'alcool, une flamme ;
? une chambre à incubation.
~ 9 ~
On trouve généralement ce genre
d'équipement dans les hôpitaux, les centres de recherche et les
universités. Les matières premières consistent en :
? des ingrédients pour la préparation du milieu
;
? du matériau du substrat (céréales,
baguettes de bois, sciure de bois ou même fibre de
noix de palme) ;
? des champignons sains de culture ou frais, d'une souche de
l'espèce désirée ;
? récipients à blanc (flacons ou sacs en
plastique).
Dans les pays peu producteurs de champignons, on se procurera
le blanc auprès d'une université ou d'un centre de recherche au
début du projet. Vous trouverez des adresses de producteurs de blanc
dans les Adresses Utiles (Oei, 2005).
La stérilisation.
Les céréales, la sciure ou le compost
contiennent un grand nombre de Contaminants. Un seul grain de
céréale peut héberger des milliers de bactéries, de
moisissures et d'actinomycètes. Un seul grain de céréale
peut héberger des milliers de bactéries, de moisissures et
d'actinomycètes. Chacun de ses éléments, appelés
contaminants, est capable d'infecter des substrats mal stérilisés
ou inoculés dans des conditions d'hygiène insuffisantes. Un
chauffage de 15 minutes à 121°C suffit généralement
à tuer tous les organismes. Il faut un certain temps pour que la vapeur
chauffe le coeur des substrats à cette température. Cela
dépend de la façon dont le récipient de
stérilisation ou de pasteurisation a été rempli et de la
capacité du brûleur. La plupart du temps, les sacs de substrat
doivent être chauffés à la vapeur pendant au moins 6 heures
pour que leur centre soit suffisamment exposé à la chaleur.
Stérilisez les sacs de 4 litres avec 2 kg de substrat de blanc pendant
au moins 2 heures a une température de 121°C (Van et al.,
2005).
De bonnes conditions de propreté sont indispensables
à la production de blanc. En particulier, l'ouverture des
récipients contenant le milieu stérilisé doit être
effectuée dans des conditions aseptiques. L'air ambiant contient de
nombreux contaminants susceptibles d'infecter facilement le milieu
stérilisé. Il faut donc pratiquer les manipulations et la
préparation des cultures (de tissu) dans des boîtes
spéciales placées dans des chambres d'inoculation (Oei, 2005).
- 10 -
1.2. Les milieux de culture.
Un milieu de culture est un support qui permet la culture de
cellules, de bactéries, de champignons, de moisissures afin de permettre
leur étude. En principe, les cellules trouvent dans ce milieu les
composants indispensables pour leur multiplication en grand nombre, rapidement,
mais aussi parfois des éléments qui permettront de
privilégier un genre bactérien ou une famille. Ainsi, selon le
but de la culture, il est possible de placer les micro-organismes dans des
conditions optimales, ou tout à fait défavorables. Il se compose
d'une base (agar-agar, eau, minéraux,...) ainsi que d'un indicateur
coloré de pH ou de réaction d'oxydoréduction pour
permettre de formuler des hypothèses sur le genre.
Il existe aussi des bouillons de culture qui possèdent
la même fonction, mais ces milieux ne contiennent pas d'agar-agar, ils
sont donc totalement liquides (Galveston et al., 1996).
1.2.1. Les différents types de
milieux.
Il existe une grande variété de milieux de
culture en rapport avec la diversité des exigences nutritives des
micro-organismes. Ainsi on distingue généralement :
? Milieu minimum.
Un milieu minimum ou milieu défini est un milieu
comportant les éléments chimiques strictement nécessaires
à la croissance bactérienne, sous une forme utilisable par des
bactéries n'ayant pas d'exigence particulière.
Composition d'un milieu minimum:
· Une source de carbone et d'énergie,
généralement le glucose.
· Une source de potassium et de phosphore: K2HPO4.
· Une source d'azote et de soufre: (NH4)2SO4.
· Une source de magnésium: MgCl2.
· Une source de calcium: CaCl2.
· Une source de fer: on emploie le citrate de fer (le
citrate a pour rôle de maintenir le fer en solution).
· Une source d'oligo-éléments: sels de Cu,
Zn, Co, Ni, B, Ti.
· Une source d'eau, indispensable à toute forme
de vie: on utilise l'eau distillée (stérile).
· Un tampon pH: il permet de maintenir un pH correct
voire optimum: KH2PO4 par exemple.
~ 11 ~
En l'absence de l'un de ces composants, les bactéries
ne se développent pas, car elles ne peuvent synthétiser ces
produits (Galveston et al., 1996).
? Milieu de culture empirique.
Un milieu de culture dit empirique est un milieu dont on ne
connaît pas exactement la composition.
Ainsi, dans le milieu type coeur-cervelle, il y a de l'eau,
de l'agar-agar, de l'hydrolysat de coeur et de cervelle sans que l'on en
connaisse les aspects qualitatifs et quantitatifs. Il sera donc utilisé
uniquement pour la croissance des bactéries. Il n'a pas d'effet
sélectif.
? Milieu de culture sélectif.
Les milieux de culture dits sélectifs permettent
uniquement la culture de certains genres de micro-organismes. Pour cela on
ajoute des éléments qui inhibent la croissance des
microorganismes indésirables comme le chlorure de sodium à forte
concentration, le thiosulfate de sodium, le cristal violet ou certains
antibiotiques, etc.
Exemples de milieux sélectifs :
? Milieu S-S : il ne permet la croissance que des Salmonelles
(Shigella s'y développe moins vite : environ 48 à 72 heures avant
d'obtenir une culture exploitable).
? Milieu de Sabouraud : il permet la pousse des
mycètes.
? Gélose Kanamycine - Vancomycine, dite "Kana-Vanco"
ou KV : elle empêche la pousse des bactéries à Gram positif
(action de la vancomycine) et de la plupart des entérobactéries
(action de la Kanamycine). Sur ce milieu, poussent
préférentiellement des bactéries anaérobies
strictes.
? Milieu de culture enrichi.
Ils contiennent, outre les composants de base, des composants
indispensables aux bactéries, que celles-ci ne peuvent pas
synthétiser. Ce sont des milieux utilisés pour l'obtention des
bactéries dites exigeantes et auxotrophes.
Par exemple : les milieux au sang frais (le sang est riche en
nutriments divers): Gélose au sang frais ou cuit. Les milieux avec du
sérum, du jaune d'oeuf : Gélose Baird Parker ou dite BP (CUQ,
2000).
CAN2 : milieu sélectif des levures qui permet la mise
en évidence de Candida albicans par la mise en évidence de
l'activité hexosaminidase (Baron's et al., 1996).
--' 12 --'
? Milieu différentiel.
Le milieu de culture dit différentiel ou indicateur
permet de distinguer deux types de microorganismes se développant dans
un même milieu. Ce type de milieu met en évidence certaines
caractéristiques biochimiques des microorganismes (principalement
l'aptitude à dégrader un substrat) en présence
d'indicateur(s) de la réaction chimique : des indicateurs colorés
de pH ou d'oxydoréduction (tel que le rouge neutre, rouge de
phénol, l'éosine ou le bleu de méthylène).
On retrouve parmi les milieux différentiels :
? La gélose MacConkey (MCK), qui différencie la
fermentation du lactose. De plus, cette gélose est sélective dans
la mesure où elle ne permet que la croissance des bacilles GRAM
négatif. La gélose Drigalski possède les mêmes
propriétés.
? La Gélose Chapman (MSA), milieu sélectif des
staphylocoques qui différencie la fermentation du mannitol permettant
une orientation entre autres vers Staphylococcus aureus.
? La gélose Hektoën, qui différencie la
fermentation de 3 glucides (lactose, saccharose et salicine) ainsi que la
production de sulfure d'hydrogène. Cette gélose est
sélective des bacilles GRAM négatif, elle est
particulièrement adaptée à la recherche
d'entérobactéries pathogènes dans les selles.
? Milieu chromogène (ou discriminant).
Ce milieu peut être sélectif ou non. Son
principe repose sur la présence d'un ou plusieurs substrat(s)
couplé(s) à une molécule chromogène. Lorsque ce
substrat est métabolisé par une enzyme bactérienne
spécifique, le chromogène associé prend une couleur
particulière (il devient un chromophore) directement lisible sur la
colonie.
Parmi ces milieux, on trouve :
SM2 : milieu sélectif des bactéries à
Gram négatif qui permet la mise en évidence de Salmonella dans
les selles grâce à la révélation d'une
activité estérase que spécifique des salmonelles.
--' 13 --'
1.3. Les infections en bactériologie.
Une infection est une maladie provoquée par des agents
pathogènes vivants ; c'est une multiplication et persistance d'un
microorganisme pathogène dans un organisme.
1.3.1 Les infections primaires.
Par infections primaires, celles qui surviennent durant la
phase stérile durant laquelle le mycélium envahit le milieu de
culture ou la surface du agar.
1.3.2. Identification de l'infection.
Nous avons l'impression que quelque chose d'autre que du
mycélium pousse dans votre boîte de Pétri ou votre bocal de
seigle, un micro-organisme est entré d'une façon ou d'une autre
dans le processus et est en train de prospérer à la place du
mycélium. On a à faire à une contamination (Nzohabonimana,
1999).
Les contaminations prennent l'aspect de taches d'un peu
toutes les couleurs (rouge, vert, noir,...) mais sauf le blanc. D'autres
ressemblent à un liquide visqueux blanchâtre et émet une
odeur de moisi (infection bactérienne).
Cette infection bactérienne est moins facile à
détecter à l'oeil nu lorsqu'elle apparaît dans un bocal de
seigle, mais si vous constater que le mycélium s'arrête de pousser
sans raison, il peut s'agir de cette infection : si aucune autre infection de
couleur louche est présente, ouvrer le pot et sentir prudemment; si
ça sent le moisi : jetez ou nettoyez ce pot. De toute façon, si
vous ouvrez le pot avant que le mycélium n'ait colonisé la
majeure partie du seigle, vous devrez le jeter, car l'infection devient
inévitable (Petignat et al., 2005).
En revanche sur les boîtes de Pétri, les
infections sont facilement repérable, y compris les infections
bactériennes. En général, les infections se
développent plus vite que le mycélium: si de minuscules
tâches apparaissent un jour, vous serez très vite fixé. Le
mycélium devrait être blanc.
L'apparition de mycélium jaune, vert ou gris à
d'autres endroits de la surface trahit la présence d'une contamination
fongique. Une croissance crémeuse et brillante révèle
souvent une contamination bactérienne (Aminetou et al.,
2008).
Les vecteurs les plus fréquents des infections sont :
--' 14 --'
? L'air ;
? Le cultivateur, ses habits, ses mains, ses expirations, etc. ?
Le milieu de culture, etc.
1.3.3. Les agents infectieux.
Il existe différents agents infectieux (microbes ou
micro-organismes) classés dans différentes catégories
(familles). Les principales catégories sont :
· les bactéries, les virus, les champignons et les
parasites.
Tous les micro-organismes (germes) n'ont pas les mêmes
capacités à provoquer les
infections, certains étant pratiquement toujours
associés à des manifestations cliniques (maladies) alors que
d'autres ne provoquent qu'exceptionnellement des maladies (Roussos, 1985).
Les prions bien que ne faisant pas partie des microbes (germes)
sont responsables de maladies infectieuses transmissibles.
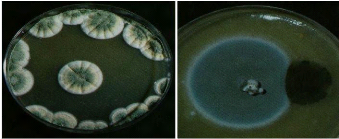
Figure 1 : A droite : Penicillium (bleu) et
Cladosporium (vert foncé). A gauche : Aspergillus.
Pour ce qui concerne les bactéries, il existe deux
grands groupes : les bactéries Gram positif et les bactéries Gram
négatif. Les bactéries se repartissent en 3 formes : les
sphères (cocci), les bâtonnets et les formes courbées. Les
bactéries peuvent se retrouver dans deux états principaux :
l'état végétatif (croissance) ou l'état de repos.
C'est à l'état de repos que la bactérie est la plus
résistante. Les bactéries du genre Bacillus et Clostridium sont
des bactéries que l'on trouve sous forme de spores. La forme de spores
est très résistante aux produits de désinfection et
nécessite des températures élevées lors de la
stérilisation pour leur destruction.
--' 15 --'
De plus la majorité des désinfectants sont
inefficaces sur les bactéries sous forme sporulée (Petignat
et al., 2006).
1.3.4. Mesures à prendre.
Il faut absolument empêcher que l'infection se repende :
Evitez autant que possible d'ouvrir le récipient contaminé
à proximité des autres récipients non contaminé.
Dans le cas où on veut garder le récipient pour observation ou
pour une tentative d'épuration, il ne faut pas les stocker avec les
récipients sains. Evidemment, il faut se laver parfaitement les mains
après avoir manipulé des récipients infectés.
Lorsque on constate la contamination d'une boîte de
Pétri, on prend les mesures qui suivent :
? Si on estime qu'elle est utilisable dans le but
d'épuration (découpe d'une partie de mycélium apparemment
non contaminée), on la stocke et on l'utilise le plus vite possible. ?
Sinon on la met dans un sac plastique et on la jette tout de suite (Aminetou
et al., 2008).
1.4. Les antibiotiques.
Un antibiotique est une substance qui permet de traiter une
infection bactérienne, soit en tuant les bactéries
(bactéricides) ou en empêchant les bactéries de se
multiplier (bactériostatiques). La découverte des antibiotiques a
constitué une véritable révolution dans le domaine des
maladies infectieuses. L'antibiothérapie a sauvé un très
grand nombre de vies et l'on a cru que les maladies infectieuses seraient un
jour toutes jugulées. Suite aux mécanismes de Resistance
développés par les bactéries, les antibiotiques perdent
leur efficacité et des maladies que l'on croyait maitrisaient
réapparaissent. Les antibiotiques n'ont aucune efficacité envers
les virus et les parasites (Bally et al., 2006).
1.4.1. Mode d'action des antibiotiques.
Les antibiotiques d'une même famille visent tous une
même cible moléculaire chez la bactérie. Ainsi, les
bêta-lactamines et les glycopeptides inhibent des enzymes responsables de
la synthèse de la paroi bactérienne, ce qui provoque la
destruction du micro-organisme. Les quinolones, quant à elles, bloquent
les enzymes qui participent à la réplication de l'ADN de la
bactérie. Cette dernière ne peut alors plus se diviser, ni
proliférer. Enfin, les tétracyclines, les aminosides et les
macrolides empêchent la synthèse des protéines en
inactivant un des
-' 16 -'
éléments de la chaîne de fabrication de
ces dernières : le ribosome. Là encore, le microorganisme est
incapable de se diviser (Courvalin et al., 2008).
1.4.2. Effets secondaires des antibiotiques.
Les biologistes ont d'ailleurs coutume de dire qu'une
molécule qui n'a pas d'effet secondaire n'a probablement pas d'action
primaire ! Même si les antibiotiques agissent peu sur
les cellules de mammifères, et donc sur celles de l'homme, ils induisent
des effets secondaires, en particulier dans les traitements prolongés ou
fortement dosés. Les plus fréquents touchent l'appareil digestif.
La prise durable d'antibiotiques peut en effet provoquer la disparition d'une
partie de la flore intestinale et déclencher des diarrhées
(Lemarchand et al., 2008).
1.4.3. Fabrication des antibiotiques.
Pour les antibiotiques naturels, il faut sélectionner
des souches de micro-organismes qui produisent le plus d'antibiotiques et
déterminer les meilleures conditions de culture température,
nature du support, etc. Par exemple, la pénicilline G est aujourd'hui
produite non pas à partir du Penicillium notatum de Fleming
mais du Penicillium chrysogenum. Concrètement, ces moisissures
sont mises dans des cuves de fermentation, où elles se multiplient leur
masse double toutes les six heures environ. Après deux jours, elles
produisent la pénicilline. La quantité d'antibiotique
fabriquée est variable d'une molécule à l'autre. Pour la
pénicilline, elle est de l'ordre de quelques grammes par litre de
culture contre seulement 0,1 gramme par litre du temps de Howard Florey et
d'Ernest Chain. L'antibiotique est ensuite extrait, purifié par voie
chimique et, enfin, conditionné. Dans le cas de la pénicilline,
10 litres de culture suffisent ainsi à produire 10 jours de traitement
pour une personne. L'enchaînement des opérations est le même
pour les antibiotiques semi-synthétiques à la différence
que le composé naturel de départ est modifié chimiquement
pour améliorer son activité, diminuer sa toxicité, etc.
(Bally et al., 2006).
1.4.4. Resistance aux antibiotiques.
Il s'agit de la capacité de certaines bactéries
à survivre malgré l'exposition à un antibiotique.
Lorsque les bactéries de la même espèce sont
insensibles à un antibiotique particulier, on parle de résistance
« naturelle ». C'est le cas, par exemple, des streptocoques,
insensibles aux aminosides. Ce type de résistance explique pourquoi les
antibiotiques sont toujours prescrits contre des infections précises,
selon un dosage et une durée déterminés. Les
résistances peuvent également être « acquises »,
lorsque, dans une population bactérienne, apparaît une
~ 17 ~
bactérie insensible à l'antibiotique. Celle-ci
peut avoir gagné cet avantage à la faveur d'une mutation
spontanée au niveau d'un de ses gènes. Elle transmettra alors la
capacité de résister à ses filles. Le cas s'est
présenté pour le bacille tuberculeux, devenu résistant
à la streptomycine et à la rifampicine à la faveur de
mutations spontanées. Mais de telles mutations sont rares : elles
concernent environ une bactérie sur dix millions, voire un milliard. En
fait, 80 % des cas de résistance bactérienne connus sont apparus
à la suite de la transmission d'un fragment d'ADN d'une bactérie
résistante à une bactérie sensible, lequel fragment
contenait un gène conférant la protection (Courvalin et
al., 2008).
1.4.5. Mécanismes permettant à une
bactérie de résister à un antibiotique.
La bactérie peut fabriquer une enzyme capable de
neutraliser l'antibiotique : la pénicillinase, par exemple, inactive les
pénicillines, l'acétylase inhibe le chloramphénicol, etc.
Le microorganisme peut posséder une membrane imperméable à
l'antibiotique ou être capable de rejeter cette substance dans le milieu
extérieur, grâce à une pompe membranaire qui refoule les
molécules hors de la cellule, les empêchant de se concentrer, et
donc d'agir sur la cible. Le micro-organisme peut enfin présenter une
modification au niveau de la cible de l'antibiotique : le site de fixation sur
la cellule est modifié, ce qui empêche l'antibiotique de se lier,
et par conséquent d'être efficace.
Les antibiotiques ne sont efficaces contre les virus
simplement parce que les virus ne possèdent pas de métabolisme
propre : pour se multiplier, ils détournent les outils de la cellule
qu'ils colonisent. Ne présentant pas les cibles sur
lesquelles les antibiotiques sont actifs, les virus leur échappent.
Seuls les antiviraux permettent éventuellement d'en venir à
bout.
L'utilisation massive des antibiotiques accentue l'apparition,
chez les malades, de bactéries résistantes. Si le personnel
soignant ne se désinfecte pas correctement les mains, il peut alors
transporter ces micro-organismes d'un patient à un autre, augmentant le
risque que les malades, déjà fragilisés, contractent une
infection supplémentaire, plus difficile à soigner (Lemarchand
et al., 2008).
-' 18 -'
1.4.6. Quelques familles d'antibiotiques.
Tableau 1 : quelques familles
d'antibiotiques.
Antibiotiques/Fa Activités Mécanismes
d'action, cibles Mécanismes de
milles résistance
|
â -lactames Gram+
Gram-
|
Inhibition de la synthèse de la paroi
bactérienne
|
-Modification de la cible
-Production de â - lactamase
Glycopeptides Gram+ Inhibition de la
synthèse de la
paroi bactérienne
Aminoglycosides Gram- Inhibition de la
synthèse des
protéines, ribosomes
-Modification de la cible
-Modification de la cible
-Production d'un
inhibiteur
Tétracyclines Gram+ Inhibition de la
synthèse des
Gram- protéines, ribosomes
-Modification de la cible
-Mécanisme de reflux
Quinolones Gram+
Gram-
Rifampin Gram+ Inhibition de la synthèse
de
l'ARN, ARN polymérase
Macrolides et
Lincosamides
Trimethoprim et Sulfonamides
Gram+ Gram-
Gram+ Gram-
Inhibition de la synthèse des protéines,
ribosomes
Inhibition de la réplication de l'ADN, ADN gyrase
Inhibition de la synthèse des acides nucléiques,
enzymes
-Modification de la cible
-Imperméabilité de la paroi Gram-Modification de la
cible
-Modification de la cible
-Modification de la cible
--' 19 --'
1.4.7. Quelques antibiotiques.
a) Chloramphénicol.
Le chloramphénicol est un antibiotique de la famille
des phénicolés, commercialisé sous la marque
Chloromycetin. Il n'est pratiquement plus utilisé que par voie locale en
médecine humaine du fait de sa toxicité potentielle. Entre
autres, il peut provoquer une aplasie médullaire due à
l'inactivation des mitochondries des cellules de la moelle osseuse. Il a
été isolé la première fois en 1947 de
Streptomyces venezuelae, une bactérie du genre
Streptomyces. Il est utilisé en association avec la gentamicine
dans des milieux de culture en mycologie pour empêcher la croissance des
bactéries et favoriser ainsi celle des champignons. Le
chloramphénicol est un antibiotique bactériostatique (Anonyme,
2009).
b) Gentamicine.
La gentamicine est un antibiotique de la famille des
aminoglycosides utilisé pour traiter divers types d'infections
bactériennes, en particulier celles provoquées par des
bactéries à Gram-négatif. La gentamicine agit en se liant
à l'ARN ribosomique au site A du ribosome bactérien, qui est le
site de décodage des codons de l'ARN messager. La fixation de la
gentamicine augmente fortement le taux d'erreur de lecture par le ribosome, ce
qui provoque la synthèse de protéines anormales, dont
l'accumulation est létale pour la cellule (Vidaver, 2002).
c) Bénomyl.
Le bénomyl quant à lui, est un produit
phytosanitaire, un fongicide qui lutte contre les maladies fongiques. Il
appartient à la famille chimique des carbamates. Le produit actif est le
Benlate (Anonyme, 2009).
--' 20 --'
Chapitre 2 : Méthodes et matériels.
2.1. Milieu d'étude.
Notre milieu d'étude était l'Université
Évangélique en Afrique (UEA) se situant en République
Démocratique du Congo dans la province du Sud-Kivu, ville de Bukavu.
Cette université se situe à 02°32'36,1» de latitude Sud
et 028°51'32,9» de longitude Est et 1661m d'altitude.
Notre étude s'est déroulée dans le
laboratoire de la biologie moléculaire à la faculté des
sciences agronomiques et Environnement, où la température
régnante est autour de 25°C. Dans ce laboratoire, la
préparation de la semence primaire et secondaire s'y était
effectuée dans des conditions aseptiques et les précautions
usuelles de manipulation étaient réunies tout au long de la
manipulation.
2 .2. Matériels utilisés.
a) Matériel biologique.
La souche P969 de l'espèce Pleurotus ostreatus
a été utilisée comme matériel biologique. Elle
a été choisie pour son adaptabilité dans la région
tropicale et son appréciation par la population consommatrice. Elle
présente les caractéristiques particulière dont : le
diamètre chapeau (carpophore) convexe, charnu, bombé puis plat
parfois un peu déprimé (en coquille). La marge est
enroulée, gris ardoisé avec des reflets bleuâtres, parfois
gris beige, gris brunâtre (colorations assez variables). Lames peu
décurrentes et peu serrées, blanches. Stipe souvent court
(parfois nul), excentrique à latéral, blanc. Chair blanche
à odeur agréable.
b) Matériel chimique.
Les matériels chimiques utilisés dans la
présente étude étaient les antibiotiques. Trois
antibiotiques ont été utilisés. Il s'agit du
chloramphénicol et de la gentamicine (bactéricides) et du
bénomyl (fongicide). Les caractéristiques relatives à ces
différents antibiotiques sont décrites dans la revue de la
littérature.
c) Matériels du laboratoire.
Ces matériels sont ceux qui étaient utilisés
pour l'exécution de nos expériences :
1°) La boite de pétri : servait à recevoir
le milieu de culture, c'est un bocal de conservation de la gélose. La
boite de pétri a un diamètre de 8,6cm et une surface de
58cm2soit 5,8.10-3m2.
Figure 2 : Dispositif
Expérimental.
--' 21 --'
2°) Balance de précision : elle nous aidait
à déterminer exactement la quantité de substances à
utiliser dans le milieu de culture.
3°) Stérilisateur : c'est un instrument qui nous
permettait de stériliser les outils pour éviter la
contamination.
4°) Les éprouvettes, l'erlenmeyer (ballon à
fond plat) : aidait pour le mélange des solutions.
5°) Autocuiseur et autoclave : pour stériliser les
récipients destinés au blanc (Wageningen, 2005).
7°) Les écouvillons : nécessaires pour
l'écouvillonnage consistant à faire rouler délicatement
les écouvillons sur les milieux sélectifs.
10°) Le bec bunsen (à flamme), pour la
stérilisation : travailler autour de 30cm à coté du bec
bunsen pour assurer l'asepsie.
11°) Incubateur : pour l'incubation à 27°C
pendant 7-10 jours.
2.3. Méthodes.
2.3.1. Dispositif expérimental.
|
V1
|
T1
|
T2
|
T3
|
T
|
|
V2
|
|
|
|
|
|
T1
|
T2
|
T3
|
T
|
Notre essai a été conçu suivant un
dispositif en split-plot. Deux facteurs étaient en étude : le
facteur principal était le type de culture avec deux modalités
(culture tissulaire et culture sporée) et le facteur secondaire,
l'antibiotique avec quatre modalités (chloramphénicol,
gentamicine et bénomyl et témoin). Les différents
traitements sont repris dans le dispositif ci-dessous.
--' 22 --'
Légende.
V1= culture tissulaire , V2= culture sporée. T =
témoin , T1=bénomyl.
T2= chloramphénicol , T3= gentamicine.
2.3.2. Conduite de l'essai.
a. Préparation du milieu de culture, PDA pour
la semence primaire.
Pour la préparation de milieu de culture, PDA (pomme de
terre, dextrose et agar) il fallait :
-Prendre 200g de pomme de terre dans un litre d'eau ;
-Ajouter 20g de dextrose ;
-18(20) g d'agar ;
-Faire la filtration sur papier -filtre ou sur tissu ;
-Ces milieux sont coulés dans des boites de
pétri à raison d'au moins 20ml par boite de pétri ; les
milieux et la verrerie doivent être stérilisés (Paulus,
1992).
b. Préparation des semences à utiliser
dans la culture. Deux types de semences à utiliser pour
évaluer l'effet de type de culture :
-Les tissus : prendre une partie de la
souche Pleurotus ostreatus ; puis repiquer les fragments dans
différentes boites de pétri sur PDA de façon aseptique.
Maintenir l'incubation à 27°C Pendant 7-9Jours.
-Les spores : après préparation
du milieu de culture ; PDA (filtration de cuisson dans un litre d'eau
déminéralisée de 200g pomme de terre+20g agar +20g
dextrose, porté à 1l).Le milieu est chauffé pendant
environ 15minutes jusqu'à dissolution des ingrédients et
obtention d'un mélange homogène qui est réparti dans des
tubes à essai. Ces derniers doivent être bouchés avec un
tampon d'ouate coiffé d'un morceau de papier aluminium avant
d'être stérilisés (120°C, 15-20minutes et une pression
de 1 atmosphère). Après stérilisation, les tubes sont
placés en position inclinée afin de maximiser la surface de
contact du milieu de culture après refroidissement. La sporulation est
obtenue en plaçant dans le goulot du tube à essai contenant le
milieu de culture, un morceau de chapeau de Pleurotus ostreatus
fixé à un ruban para film,
--' 23 --'
face hymeniale dirigée vers le milieu de culture. 12h
après, le morceau de chapeau est enlevé et le tube à essai
est rebouché en conditions aseptiques au-dessus de la flamme d'une lampe
à alcool. Le tube inoculé est placé dans un incubateur
Millipore à 32°C pendant 48h (Dibaluka, 2005).
c. Contrôle d'infections.
Après que les conditions aseptiques soient
réunies ; nous appliquerons les antibiotiques (chloramphénicol et
gentamicine) et le fongicide (bénomyl). Les antibiotiques seront
appliqués pour inhiber la colonisation bactérienne des milieux de
culture et le fongicide sera utilisé pour anéantir d'autres
colonisations fongiques autres que la souche en culture. La quantité
d'antibiotiques qui sera utilisée est de 0,5g /l.
N.B. Les antibiotiques sont soit en injection ou des
comprimés.
d. Paramètres à observer lors de la
culture in vitro.
-Le taux de reprise ;
- Jour de reprise ;
- Abondance de la colonisation mycélienne en culture ;
-Homogénéité mycélienne
c.à.d. présence ou non d'infections (bactériennes par
exemple) ;
-Longueur et vitesse de croissance mycélienne
était évaluée à l'aide d'une latte graduée.
Ainsi la vitesse de croissance sera calculée en utilisant la formule
suivante : Vn-Vn-1/Nbre de jour, ensuite la moyenne de variation sera
calculée, V1+V2+Vn.../Nbre de jour.
e. Préparation de la semence
secondaire.
Le substrat utilisé pour la préparation de la
semence secondaire était constitué des grains de sorgho. Les
grains de sorgho ont été cuits dans une casserole pendant 2
à 3h, puis essoré au soleil pour débarrasser le sorgho de
l'eau, le son de maïs a ensuite était ajouté au sorgho mais
en petite quantité en raison de 200g pour 2,5 kg de sorgho puis ont
été répartis dans les bocaux(boites à mayonnaise.
Les bocaux ont été ensuite hermétiquement fermés et
un tampon d'ouate fut placé au milieu du couvercle vissé et enfin
la stérilisation était faite à l'autoclave à une
température de 121°C pendant 30 à 45 minutes.
Après la stérilisation, les bocaux furent
refroidis pendant 45minutes. L'inoculation du mycélium (semence primaire
« stater ») sur le substrat de semis secondaire a été
réalisée à
--' 24 --'
côté d'un bec bunsen, dans des conditions de
stricte asepsie. Le matériel de prélèvement et de
transfert de l'inoculum a été stérilisé grâce
à la flamme du bec bunsen. L'incubation des grains de sorgho a
été réalisé dans les conditions de 27° pendant
21 à 30 jours dans une l'obscurité totale, dans un milieu
fermé, et le produit obtenu à l'issue de cette opération
est appelé « blanc-mère » ou « blanc de semis
».
f. Analyses des données.
L'analyse des données a été
réalisée par l'utilisation du logiciel Excel version 2007. Ici,
les données seront décrites par les moyennes de diamètre
mycélien en fonction des milieux de cultures et d'antibiotiques; et le
niveau d'infections dans chaque types de culture et d'antibiotiques. La
régression linéaire était réalisée pour voir
la corrélation existant entre le niveau d'infections et le
diamètre mycélien en fonction de types de culture et
d'antibiotiques.
--' 25 --'
Chapitre 3 : Présentation et discussion des
résultats.
3.1. Présentation et interprétation des
résultats.
Le tableau qui suit va nous montrer comment les semences de
champignons Pleurotus
osteatus (P969) se sont comportées pendant la
reprise dans la culture in vitro tissulaire et sporée en fonction
d'antibiotiques.
Tableau 2 : Taux de reprise des semences
primaires.
|
Types de
culture
|
Antibiotiques
|
Taux de
reprise(en %)
|
Jour de
reprise(en jour)
|
Degré
d'infection
|
|
Tissulaire
|
Sans
|
40
|
1.5
|
**
|
|
Chloramphénicol
|
100
|
2.8
|
*
|
|
Gentamicine
|
100
|
2
|
*
|
|
Bénomyl
|
20
|
1
|
**
|
|
Sporée
|
Sans
|
20
|
2
|
***
|
|
Chloramphénicol
|
60
|
6
|
*
|
|
Gentamicine
|
80
|
6.7
|
*
|
|
Bénomyl
|
60
|
5.3
|
**
|
Avec, *: moins sévère, **:
sévère, ***: très sévère.
Du tableau 2, la culture tissulaire présente des
meilleurs taux de reprise que la culture sporée. La culture tissulaire
plus les antibiotiques (chloramphénicol et gentamicine) donne le
meilleur taux de reprise (100%).La culture tissulaire sans antibiotique a un
taux de reprise de 40% alors que le faible taux de reprise (20%) est
enregistré pour la culture tissulaire en combinaison avec le
bénomyl (un fongicide).
Pour la culture sporée, le taux de reprise
élevé est enregistré à la gentamicine (80%) alors
que le chloramphénicol et le bénomyl ne sont pas
différents (60%) et enfin, la culture sporée sans antibiotique a
donné le taux de reprise le plus faible (20%).
En culture sporée, la reprise la rapide est
trouvée chez la culture sans antibiotique avec un temps moyen de 1,2
jour et la moins rapide est chez la gentamicine avec un temps de 5,4
--' 26 --'
Pour la précocité de reprise, la culture
tissulaire est plus précoce que celle sporée. Les
premières reprises chez la culture tissulaire interviennent un jour
après ensemencement (chez bénomyl) et les plus tardives
interviennent à 2,8 jours (chez chloramphénicol). La culture
sporée est moins précoce, le traitement le plus précoce
intervient 2 jours après ensemencement (chez la culture sporée
sans antibiotique) alors que le plus tardif intervient 6,7 jours après
ensemencement.
La synthèse des données sur le jour de reprise est
reprise sur la figure 2 ci-dessus.

7
bénomyl chloramphenicol gentamicine sans
Effets d'antibiotiques selon la culture.
6
5
4,2
Jour de reprise.
4
3,2
2,6
3
2
1,2
1
0,4
0,4
0
5,4
2
spore Tissulaire
Figure 3 : Analyse de la vitesse de reprise sur
les différents types des cultures et d'antibiotiques.
Le graphique ci-après montre comment les semences ont
repris dans différents types de cultures (tissulaire et sporée)
en fonction d'antibiotiques utilisés. Ainsi dit ; nous trouvons que dans
les deux types de cultures, la reprise est lente là où les
antibiotiques sont utilisés que là où ils ne sont pas
utilisés, sauf chez le bénomyl dans la culture tissulaire et chez
la culture tissulaire sans antibiotique où la reprise est la même
et cette reprise est de 0,4 jour.
En culture tissulaire, la reprise la plus rapide se situe chez
la culture sans antibiotique et chez le bénomyl avec une durée de
reprise de 0,4 jour et la plus lente reprise se situe chez le
chloramphénicol avec une durée moyenne de 2,6 jours.
--' 27 --'
jours. Pour les deux types de cultures, il ya un effet
inhibiteur de ces antibiotiques sur la reprise des semences.
Les données relatives aux effets d'antibiotiques et de
types de culture sur le diamètre mycélien sont
représentées à la figure 3.

46,92
80
70
63,3
Effets d'antibiotiques par culture.
60
50
Diametre(mm)
40
30,02
30
17,2
20
40,3
23,04
3,7
10
0
spore Tissulaire
33,4
Figure 4 : Effets du type de culture et
d'antibiotiques sur Diamètre total mycélien.
Le graphique explique la variation du diamètre total
des mycéliums en fonction d'antibiotiques et de types de cultures.
En effet ; la culture tissulaire présente des meilleurs
résultats tant pour les antibiotiques que pour la culture sans
antibiotique. Le diamètre est plus élevé chez le
chloramphénicol (63,3mm). Le bénomyl sur la culture sporée
a donné de bons résultats (30,02mm de diamètre) que la
culture tissulaire. Le plus petit diamètre chez la culture tissulaire se
situe chez le bénomyl avec 17,2mm.
En culture sporée ; comme chez la culture tissulaire,
le diamètre le plus élevé se situe chez le
chloramphénicol avec un diamètre de 46,92mm et le plus petit se
trouve chez la culture sans antibiotique avec 3,7mm.
-' 28 -'
Les données relatives aux effets d'antibiotiques et de
types de culture sur la vitesse de croissance mycélienne sont
représentées à la figure 4.
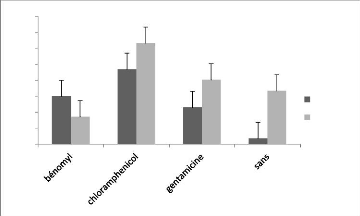
8
7
6
6,33
4,692
Vitesse (mm)
5
4,03
4
3,34
3,002
3
2,304
1,72
spore Tissulaire
2
1
0,37
0
Effets d'antibiotiques par culture.
Figure 5 : Effets du type de culture et
d'antibiotiques sur la Vitesse de croissance
mycélienne.
Dans le graphique ci-haut, la vitesse de croissance
mycélienne varie selon les types de culture (tissulaire ou
sporée) et d'antibiotiques. Mais la culture tissulaire présente
encore une fois de plus des meilleurs résultats tant pour les types de
cultures que pour les antibiotiques.
En culture tissulaire, l'antibiotique présentant une
vitesse de croissance mycélienne plus rapide est le
chloramphénicol avec une moyenne de 6,33mm par jour et la vitesse la
plus petite se situe chez le bénomyl avec 1,72mm/jour en moyenne.
En culture sporée, la croissance mycélienne la
plus rapide est chez le chloramphénicol comme chez la culture tissulaire
avec une vitesse moyenne de 4,692mm/jour et la plus petite est chez la culture
sporée sans antibiotique avec une vitesse de 0,37mm/jour.
Les données relatives aux effets d'antibiotiques et de
types de culture sur le taux d'infections sont représentées
à la figure 5.
--' 29 --'

3,5
3
2
1,6
1,6
1,4
1 1
0,8 0,8
spore Tissulaire
2,5
2
1,5
1
niveau infection
0,5
0
Effets d'antibiotiques par culture.
Figure 6 : Effets du type des cultures et
d'antibiotiques sur le niveau d'infection.
Dans le graphique ci-après le niveau d'infection en
fonction de culture et d'antibiotiques est exprimé en échelle ;
et cette dernière va de 0 jusqu'à plus de 2.
De 0 à 1 : moins sévère. De 1 à 2 :
sévère.
Supérieur à 2 : très
sévère.
Pour les deux cultures ; il ya présence d'infection
mais la culture sporée présente plus d'infections que la culture
tissulaire. En culture tissulaire, les infections sont moins
sévères chez le chloramphénicol et la gentamicine et sont
sévères chez le bénomyl et chez la culture sans
antibiotique. En culture sporée, les infections sont moins
sévères chez le chloramphénicol et la gentamicine ; elles
sont sévères chez le bénomyl et sont très
sévères chez la culture sans antibiotique.
La corrélation entre le niveau d'infection et le
diamètre total du mycélium est donnée à la figure
6.
-' 30 -'

0,5
0
0 20 40 60 80 100
N.infe
Linéaire (N.infe)
y = -0,0063x + 1,4779 R2 = 0,0671
2,5
2
1,5
1
Figure 7 : Corrélation entre le niveau
d'infection et le diamètre total du mycélium.
Le graphique montre la corrélation qui existe entre le
niveau d'infection et le diamètre total du mycélium. Cette
droite, appelé droite des moindres carrés ou droite de
régression, nous montre qu'il existe une corrélation
négative entre le niveau d'infection et le diamètre total de
mycélium et cette corrélation est expliquée à 6,7%.
Ceci explique que lorsque le niveau d'infection augmente, le diamètre
total du mycélium diminue. Le R2 veut dire le coefficient de
détermination qui sert à expliquer la quantité
d'information fournie par la droite de régression.
Le tableau ci-après ; présente les
différents pathogènes après coloration Gram.
Tableau 3 : coloration de Gram.
|
TYPE DE CULTURE
|
Pathogènes
|
|
Bactérie Gram+
|
Bactérie Gram-
|
Cocci positif
|
Levures
|
Filament mycélien
|
|
Tissulaire
|
+
|
+
|
-
|
+
|
-
|
|
Sporée
|
+
|
+
|
-
|
+
|
+
|
+ : indique la présence, - : absence.
--' 31 --'
Les résultats du tableau 4, montrent les
différents pathogènes après la détermination de la
coloration Gram ; qui se sont développés dans les
différentes boites infectées de différents types de
cultures. La culture sporée a présenté un grand nombre des
pathogènes, sur lequel s'est développé les
Bactéries Gram-, les Bactéries Gram+, les levures, Levures, et le
filament mycélien. La culture tissulaire a présenté moins
de pathogènes avec la présence de bacteries Gram+ et - et des
levures.
b) Identification du genre des
pathogènes.
Le tableau qui vient après, présente le genre
des Bactéries gram- et les Cocci trouvés sur les
différents milieux.
Tableau 4 : Identification du genre.
|
Type des cultures
|
Bactéries Gram- Cocci
|
|
|
Tissulaire E. coli Staphycoques
Sporée Entérobacter
Entérocoques
Chez la culture tissulaire, le genre identifié est
Escherichia coli avec des cocci staphycoques tandis que la culture
sporée présente des Entérobacters avec des cocci
entérocoques.
Le tableau suivant, va montrer la façon dont il ya eu
croissance mycélienne des semences secondaires en fonction
d'antibiotiques et de substrat utilisé.
Le tableau 5 suivant, va montrer la façon dont il ya eu
croissance mycélienne des semences secondaires en fonction
d'antibiotiques et de substrat utilisé en semence.
--' 32 --'
Tableau 5 : Longueurs des mycéliums, des substrats
et présence d'infection pour les semences secondaires.
|
Type
culture
|
de
|
Antibiotiques
|
Diamètre mycélium (mm)
|
Longueur substrat
|
Infections
|
|
|
|
|
(mm)
|
|
|
|
Sans
|
35.5
|
95
|
0
|
|
|
Chloramphénicol
|
53.25
|
95
|
0
|
|
Tissulaire
|
|
|
|
|
|
|
|
Gentamicine
|
58
|
95
|
0
|
|
|
Bénomyl
|
89.75
|
95
|
0
|
|
|
Sans
|
0
|
95
|
0
|
|
Sporée
|
|
Chloramphénicol
|
45.5
|
95
|
1
|
|
|
Gentamicine
|
45.75
|
95
|
0
|
|
|
Bénomyl
|
81.75
|
95
|
0
|
Pour la culture tissulaire, le meilleur résultat se
trouve (la longueur la plus admirable du mycélium est de 89,75mm) chez
le bénomyl et le résultat le moins favorable (la plus petite
longueur mycélienne est de 35,5mm) chez la culture tissulaire sans
antibiotique.
Pour la culture sporée, le mycélium s'est bien
développé aussi chez le bénomyl et la longueur du
mycélium est de 81,75mm et ce dernier s'est mal développé
chez la culture sporée sans antibiotique où la longueur
mycélienne est de 0mm c'est-à-dire qu'il n'y avait pas eu reprise
de la semence secondaire.
Pour les infections, ces derniers sont observables uniquement
chez la culture sporée, plus précisément chez la culture
sporée avec le chloramphénicol.
-' 33 -'
3.2. Discussion des résultats.
Eu égard aux différents résultats obtenus
lors de notre étude dont l'objectif était d'évaluer
l'effet de types de cultures tissulaire et sporée et d'antibiotiques sur
le contrôle d'infections en culture in vitro du champignon Pleurotus
ostreatus P969.
En effet ; selon certains auteurs, la culture sporée
pour les semences primaires présenterait des meilleurs résultats,
mais elle n'est pas souvent pratiquée à cause de sa
délicatesse et de la connaissance qu'il existe ou pas des spores
différemment à la culture tissulaire où on touche les
tissus à inoculer (Dibaluka et al., 2010) . Contrairement
à nos résultats, la culture tissulaire a présenté
des bons résultats tant pour les diamètres des mycéliums
que pour le niveau d'infections. Pour les diamètres mycéliens, la
culture tissulaire a pour tous les traitements les diamètres
supérieurs aux diamètres chez la culture sporée sauf chez
le bénomyl dans la culture sporée où le diamètre
mycélien est supérieur au diamètre mycélien chez le
bénomyl dans la culture tissulaire. Pour le niveau d'infections, la
culture sporée a présenté beaucoup d'infections que la
culture tissulaire, sauf chez le bénomyl dans la culture sporée
où le diamètre mycélien est le même. Les deux
résultats nous ont permis de dire que le milieu de culture PDA n'est pas
souvent contaminé par les champignons (utilisation du fongicide
bénomyl), ce sont souvent des bactéries qui attaquent ce
milieu.
L'effet d'antibiotiques particulièrement le
chloramphénicol et la gentamicine sur le contrôle d'infections en
culture in vitro ; selon certains auteurs (Anonyme, 2009), le
chloramphénicol est utilisé en milieu de culture pour inhiber la
croissance des bactéries (un bactériostatique) et favoriser celle
des champignons. La gentamicine quant à lui, tue les bactéries en
faveur des champignons en milieu de culture(bactéricide) ; ce qui a
confirmé nos résultats ; car les diamètres
mycéliens sont plus élevés chez le chloramphénicol
(diamètre total du mycélium est de 63,3mm pour la culture
tissulaire et de 46,92mm pour la culture sporée ) dans les deux types de
cultures (tissulaire et sporée) suivi de gentamicine dans la culture
tissulaire (40,3mm de diamètre), mais dans la culture sporée le
chloramphénicol est suivi du bénomyl (30,02mm de diamètre)
pour le diamètre mycélien.
Pour le niveau d'infections, les deux antibiotiques ont
présenté les moins d'infections dans les deux types de cultures
(tissulaire et sporée) que d'autres traitements dans notre dispositif
expérimental des semences primaires. Le niveau d'infections est tel que,
chez le chloramphénicol et la gentamicine est le même dans la
culture sporée (même niveau d'infections) et dans la culture
tissulaire, les deux antibiotiques présentent encore une fois le
-' 34 -'
même niveau d'infections, mais c'est dans la culture
sporée que le niveau d'infections est élevé que la culture
tissulaire.
Nos résultats montrent que ; plus les infections
augmentent dans les boites de pétri, les diamètres des
mycéliums diminue ; ce que la figure 6 explique qu'il existe une
corrélation négative entre le niveau d'infection et la croissance
mycélienne. Ce qui est vrai que lorsque les infections sont nombreuses
le développement mycélien doit nécessairement être
entravé.
Mais aussi, plus les mycéliums durent longtemps dans
les boites de pétrie, plus les infections augmentent.
Pour les semences secondaires, les meilleurs résultats
sont obtenus chez le bénomyl dans les deux types de cultures (tissulaire
et sporée). Le bénomyl étant un fongicide, tout champignon
qui peut se développer autre que le Pleurotus ostreatus doit
être tué (Anonyme, 2009), ceci expliquerait la croissance rapide
du mycélium tandis que le chloramphénicol a
présenté les infections ; la gentamicine n'a pas
présenté les infections, mais sa croissance mycélienne est
inferieure à celle de chloramphénicol.
-' 35 -'
Conclusion et recommandation.
Le présent travail est centré sur l'effet de
types de culture (tissulaire et sporée) et d'antibiotiques
(chloramphénicol, gentamicine et bénomyl) sur le contrôle
d'infections en culture in vitro du champignon Pleurotus ostreatus
P969.
Ce travail, fait en expérimentation, a abouti à des
résultats suivants :
? Pour les deux types de cultures, la culture tissulaire a
donné de bons résultats sur le plan de précocité de
reprise avec une reprise plus précoce chez le bénomyl (1 jour)
suivi de la culture tissulaire sans antibiotique (1,5 jours). Pour la culture
sporée la reprise la plus précoce étant chez la culture
sans antibiotique (2jours) suivi du bénomyl (5,3 jours).
? Pour le niveau d'infections, la culture sporée a
présenté plus d'infections avec plus d'infections dans la culture
sporée sans antibiotique où les infections étaient
très sévères et les moins d'infections chez le
chloramphénicol et la gentamicine où les infections
étaient moins sévères.
? Pour les diamètres mycéliens, la culture
tissulaire a beaucoup plus présenté des bons résultats
surtout chez le chloramphénicol avec 63,3mm de diamètre et la
gentamicine avec 46,92mm de diamètre et le moins de diamètre
était chez le bénomyl avec 17,2mm de diamètre.
? Pour les agents infectieux, ce sont plus les
bactéries Gram-, Gram+ et les levures qui attaquaient tous les deux
types de culture ; et les filaments mycéliens attaquaient uniquement la
culture sporée.
Ceci étant ; nos recommandations sont adressées
aux chercheurs surtout les étudiants de multiplier les efforts pour la
continuité de ce travail.
Nos efforts doivent maintenant s'orienter dans la production
de la semence des champignons, et à la mise au point des souches des
champignons disponibles localement car elles intéressent plus une bonne
partie de la population de la région du Kivu.
-' 36 -'
Références bibliographiques.
1. Aminetou Bentmohamed et Aicha mint sidi baba,
2008. Manuel de travaux pratiques de microbiologie, de
l'université de nouakchott faculté des sciences et techniques
département de biologie.
2. Anonyme, 2009. Fiche de
sécurité du Programme International sur la sécurité
des substances chimiques.
3. Bram van N et Feijter J, 2007. La
culture a petite échelle de champignons -2, 26-74p
4. Cohen R., Persky L., Hadar Y.; 2002.
Biotechnological applications and potential of wood-degrading mushrooms of the
genus Pleurotus (Applications biotechnologiques et potential des champignons
lignicole du genre Pleurotus), Applied Microbiology and Biotechnology,
Volume 58, Numéro 5 , 582-594 , - Springer.
5. Denis Blaizot, Dr.Ch.Repin, 2011. La revue
Générale des Sciences pures et appliquées.
6. Dibaluka M, Lukoki F, De Kesel A, Degreef J,
2010. Essais de culture de quelques champignons lignicoles comestibles
de la région de Kinshasa (R.D. Congo) sur divers substrats
lignocellulosiques, 1, 412-417p.
7. Petignat, DAMPH CHUV, 2005. Infections
nosocomiales Bases épidémiologiques.
8. Petignat, DAMPH CHUV, Médecin Franck BALLY,
2006. Microbiologie Pathogénèse de l'infection, Institut
central Hopitaux valaisans.5-10 p.
9. Musibono, M.H. Habari. et J.J., 1991.
Paulus Essai de la culture mycélienne de quelques champignons zairois
sur milieu semis-synthétique. 138-139 p.
10. Ertrug, F. 2000. An ethnobotanical study
in Central Anatolia (Turkey).Economic Botany, 54(2): 155-182.
11. Fabien Lemarchand, Patrique Courvalin;
2008. Les antibiotiques; back to basic, 77 p.
12. FAO, 1998b. Non-wood forest products
from conifers, by W.M. Ciesla. Non-wood Forest Products 12. Rome. 138
pp.
13. Gevry, M.-F. 2010. Études des
facteurs environnementaux déterminant la répartition de
champignons forestiers comestibles en Gaspésie, Québec. M.Sc.
thèse, Département de biologie; Gestion de la faune et de ses
habitats, Université de du Québec à Rimouski. 82 pages. 69
p.
-' 37 -'
13. Hexiang, Wanga, GaoaJiquan, Ngc T.B,
2002. A New Lectin with Highly Potent Antihepatoma and Antisarcoma
Activities from the Oyster Mushroom Pleurotus ostreatus, Biochemical and
Biophysical Research ..., - Elsevier, 2002.
14. Mikiashvili, Nona Wasser Solomon P., Nevo Eviatar
&Elisashvili Vladimir, 2006. Effects of carbon and nitrogen
sources on Pleurotusostreatusligninolytic enzyme activity: World Journal
of Microbiology & Biotechnology.
15. Ndoye O., Awono A., Preece L. &Toirambe B.,
2007. Marchés des produits forestiers non ligneux dans les
provinces de l'Équateur et de Bandundu : présentation d'une
enquête de terrain. In : Croizer C. &Trefon T., eds.
Quel avenir pour les forêts de la République
Démocratique du Congo ? Bruxelles : Coopération Technique
Belge (CTB), 68-70 p.
16. Nzohabonimana A., 1999. Influence de
l'environnement abiotique et biotique de deux modes de pasteurisation des
substrats sur la productivité de Pleurotus ostreatus hybride 336,
Mémoire de fin d'études d'Ingénieur Agronome, FAC
AGRO, UB, 35 P.
17. Oei P., 2005. La culture des
champignons à petite échelle : pleurotes, shiitakes et
auriculaires. Wageningen, Pays-Bas: Fondation Agromisa, CTA.43-48-59 p.
18. Prance, G. 1984. The use of edible fungi by
Amazonian Indians. Advances in Economic Botany, 1: 127-139.
19. Jean-Louis CUQ, 2000. Microbiologie
alimentaire, Département Sciences et Technologies des Industries
Alimentaires.
Effects of carbon and nitrogen sources on Pleurotus
ostreatus ligninolytic enzyme activity: World Journal of Microbiology
& Biotechnology.
20. Roussos S., 1985. Croissance de
Trichodermaharzianum par fermentation en milieu solide: physiologie,
sporulation, et production de cellulases. Thèse de Doctorat,
Université de Provence, Aix-Marseille I, 193 pages.
21. Sergeeva, M.2000. Fungi.250 species of
edible, poisonous and medicinal fungi. Moscow, Culture and Traditions. 263
pp.
--' 38 --'
Table des matières
0.Introduction 1
Contexte, problématique et justification du sujet
1
Chapitre 1 : Revue de la littérature 4
1.1. Généralités sur les champignons : les
pleurotes 4
1.1.1. Caractéristiques des champignons 4
1.1.2. Biologie, écologie 4
1.1.3. Nutrition des champignons 5
1.1.4. Classification 6
1.1.5. La culture des champignons 7
1.1.5. Production de blanc de champignon 8
1.2. Les milieux de culture 10
1.2.1. Les différents types de milieux 10
1.3. Les infections en bactériologie 13
1.3.1 Les infections primaires 13
1.3.2. Identification de l'infection 13
1.3.3. Les agents infectieux 14
1.3.4. Mesures à prendre 15
1.4. Les antibiotiques 15
1.4.1. Mode d'action des antibiotiques 15
1.4.2. Effets secondaires des antibiotiques 16
1.4.3. Fabrication des antibiotiques 16
1.4.4. Resistance aux antibiotiques 16
1.4.5. Mécanismes permettant à une bactérie
de résister à un antibiotique 17
1.4.6. Quelques familles d'antibiotiques 18
1.4.7. Quelques antibiotiques 19
-' 39 -'
|
Chapitre 2 : Méthodologie
|
20
|
|
2.1. Milieu d'étude
|
20
|
|
2 .2.Matériels utilisés
|
20
|
|
2.3. Méthodes
|
21
|
|
2.3.1. Dispositif expérimental
|
21
|
|
2.3.2. Conduite de l'essai
|
22
|
|
Chapitre 3 : Présentation et discussion des
résultats
|
25
|
|
3.1. Présentation et interprétation des
résultats
|
25
|
|
3.2. Discussion des résultats
|
33
|
|
Conclusion et recommandation
|
35
|
|
Références bibliographiques
|
.36
|
| 


