|
REPUBLIQUE DE COTE-D'IVOIRE
UNION - DISCIPLINE - TRAVAIL
Ministère de l'Enseignement Supérieur et de
la Recherche Scientifique
|
Institut National
Polytechnique
|
|
Félix HOUPHOUET BOIGNY
|
|
Ecole Supérieure
d'Agronomie
(ESA)
|
Département Eaux, Forêts
et
Environnement (FOREN)
|
MEMOIRE DE FIN D'ETUDES POUR L'OBTENTION
DU DIPLOME
D'AGRONOMIE APPROFONDIE (DAA)
OPTION : EAUX ET FORETS
Présenté par
KOUADIO Konan Kan
Fulbert
35eme Promotion ENSA
Thème :

|
ANALYSE DU SYSTEME
DE BIOMONITORING
DU PARC NATIONAL DE TAÏ
|
|
|

Soutenu le 12 mai 2006
Jury
:
Dr. Germain ARKUSTH (Enseignant à
l'INP-HB) Président du jury
Col Goué DANHOUE (Enseignant à
l'INP-HB) Assesseur
Cdt. Adama TONDOSSAMA (Directeur Zone Sud-Ouest
OIPR) Encadreur
(c)Mai 2006
AVANT-PROPOS ET REMERCIEMENT
Le présent rapport est le fruit de six mois de travail
marquant la fin des quatre années d'études faites à
l'Ecole Supérieure d'Agronomie (ESA).
L'ESA qui fait partie des six écoles de l'Institut
National Polytechnique Félix Houphouët Boigny de Yamoussoukro
(INP-HB) a pour vocation de former des Ingénieurs des Techniques
Agricoles et des Ingénieurs Agronomes spécialisés dans
divers domaines dont les Eaux et Forêts.
La fin de la formation des Ingénieurs des Eaux et
Forêts est sanctionnée par l'obtention du Diplôme
d'Agronomie Approfondie (DAA), option Eaux et Forêts, suite à la
présentation du mémoire de fin d'études.
C'est dans le cadre de ce mémoire que nous avons
effectué du 1er septembre 2005 au 1er mars 2006 un
stage à l'Office Ivoirien des Parcs et Réserves (OIPR), plus
précisément à la Direction du Parc National de
Taï.
Ce stage, dont le thème est « Analyse du
système de biomonitoring du Parc National de Taï » nous a
permis de mettre en pratique une fois de plus les connaissances
théoriques acquises à l'école. Nous menons ce travail
comme un exercice devant servir à la valorisation éventuelle des
méthodes de biomonitoring ou de suivi écologique pour l'OIPR.
Nous tenons à remercier tous ceux qui ont
été, un temps soit peu, attentionnés à notre
travail. Nous leur sommes reconnaissants pour leurs critiques et suggestions
qui ont contribué à améliorer le présent document.
Nous citerons :
- M. Eboua Narcisse WANDAN, notre encadreur pédagogique
pour ses pertinentes critiques et suggestions ;
- le Cdt Adama TONDOSSAMA, Directeur de la Zone Sud-Ouest OIPR
; notre maître de stage pour sa disponibilité, sa
compréhension, ses critiques et suggestions ;
- le Lt Abdoulaye DIARRASSOUBA, chef secteur de Djapadji pour
sa disponibilité et ses aides précieuses ;
- M. Kouakou Théodore KOUADIO, enseignant à
l'INP-HB de Yamoussoukro pour ses différentes corrections du document
;
Nous sommes tout particulièrement reconnaissants
à l'endroit du Cdt N'DRI, du Cdt Hubert KATCHIA, du Cdt Abroba AKE et de
notre famille pour leurs aides tant financière que matérielle.
Enfin, nous tenons surtout à dire un grand merci au Cne
Abou SANOGO, à sa femme AKA Catherine et à leurs enfants pour
l'hospitalité et la serviabilité dont ils ont
témoigné à notre égard tout le long de notre
séjour à San Pedro.
RESUME
La menace sur les ressources naturelles du Parc National de
Taï a conduit ses dirigeants à mettre en place un système de
biomonitoring. Malheureusement les données de ce biomonitoring ne sont
pas régulièrement analysées pour permettre des ajustements
probables. C'est fort de cela que la direction de l'OIPR a initié la
présente étude dont le thème est : « Analyse du
système de biomonitoring du Parc National de Taï ». Elle a
pour objectifs de présenter les résultats du système de
biomonitoring du PNT et de déceler ses faiblesses afin d'une
amélioration future. Pour y parvenir, nous avons analysé les
données du biomonitoring de 1999 à 2005. Nous avons
déterminé les densités des secteurs pour voir leur
évolution. Les espèces retenues sont Cercopithecus diana
diana, Piliocolobus badius badius, et Cep halop hus maxwelli. Le
système de biomonitoring du PNT a fourni des résultats fort
appréciables. Il ressort des analyses que le PNT est dominé par
les singes; les autres espèces y étant moins abondants. Aussi,
faut-il retenir que les secteurs situés du côté Ouest du
PNT sont plus riches et plus denses que ceux situés du côté
Est. Toutefois, le système regorge quelques insuffisances qui
méritent d'être corrigées pour une meilleure
efficacité.
ABSTRACT
The threat of natural resources of the Parc National de
Taï brought the leaders of the PNT to put up a system of biomonitoring.
However, the data of this biomonitoring are not regularly analysed to permit
likely adjustments. But for its improvement the head office of the OIPR has
initiated the present survey theme which is: « Analysis of the
biomonitoring system of the Parc National de Taï». Its main
objectives are to bring to light the PNT biomonitoring system's results and
reveal its weaknesses in order to improve in future. To obtain this results, we
had to value the data of the biomonitoring of the year 1999 with that of the
year 2005. We then determined the densities of the sectors, to see their
growth. The retained species are Cercopithecus diana diana,
Piliocolobus badius badius and Cephalophus maxwelli. The
biomonitoring system of the PNT provided very substantial results. It is
evident from the analyses that the PNT is dominated by monkeys; the other
species are less abundant. It is also notified that the sectors situated at the
western side of the PNT are more abundant than those at the Eastern side.
However, the system overflows with numerous insufficiencies that deserve to be
improved for a better efficiency.
TABLE DES MATIERES
AVANT-PROPOS ET REMERCIEMENT I
RESUME II
ABSTRACT II
SIGLES ET ABREVIATIONS V
LISTE DES TABLEAUX VI
LISTE DES PHOTOGRAPHIES IX
INTRODUCTION 1
CHAPITRE 1 : GENERALITES 3
1. PARC NATIONAL DE TAÏ 4
1.1. Historique 4
1.2. Localisation géographique 4
1.3. Climat 6
1.4. Relief 6
1.5. Hydrographie 7
1.6. Géologie et pédologie 7
1.7. Flore 7
1.8. Faune 8
1.9. Population riveraine 10
1.10. Braconnage dans le PNT 10
1.11. Gestion du PNT 10
2. SYSTEME DE BIOMONITORING 11
2.1. Définition 11
2.2. Objectif 12
2.3. Régions contrôlées 12
2.4. Collecte des données 12
2.4.1. Recensement par bloc 13
2.4.2. Recensement par quadrats 13
2.4.3. Recensement par transect 13
2.5. Traitement des données 14
2.5.1. Détermination de la densité avec Distance
14
2.5.1.1. Fonction de détection 16
2.5.1.2. Estimation de la densité 16
3. BIOMONITORING DU PARC NATIONAL DE TAÏ
17
CHAPITRE 2 : METHODOLOGIE 21
1. COLLECTE DES DONNEES 22
2. VISITE DE TERRAIN 22
3. ANALYSE DES DONNEES 22
3.1. Choix des espèces 22
3.2. Analyse qualitatives 23
3.3. Analyses quantitatives 23
4. CRITIQUES DU SYSTEME 25
CHAPITRE 3 : RESULTATS ET DISCUSSION 26
1. ANALYSES DES RESULTATS DU SYSTEME 27
1.1. Analyse qualitative 27
1.1.1. Abondance relative 27
1.1.2. Richesse spécifique 29
1.1.3. Diversité spécifique 29
1.2. Analyses quantitatives 31
1.2.1. Analyse par années 31
1.2.1.1. Fréquences annuelles de toutes les
espèces 31
1.2.1.2. Comparaison des années pour toutes les
espèces 32
1.2.1.3. Fréquences annuelles des singes et antilopes
33
1.2.1.4. Comparaison des années pour les singes et
antilopes 35
1.2.2. Analyse par secteur 38
1.2.2.1. Fréquences des secteurs pour toutes les
espèces 38
1.2.2.2. Comparaison des secteurs pour toutes les espèces
39
1.2.2.3. Fréquences des singes et des antilopes dans les
secteurs 40
1.2.2.4. Comparaison des secteurs pour les singes et antilopes
42
1.2.3. Densités 43
1.2.3.1. Densités de Cercopithecus diana diana
43
1.2.3.2. Densités de Piliocolobus badius badius
44
1.2.3.3. Densités de Cephalophus maxwelli 45
2. AVANTAGES DU SYSTEME 46
3. LIMITES DU SYSTEME 47
3.1. Au niveau du design 47
3.2. Matériel 48
3.3. Analyse des données 48
CONCLUSION 50
REFERENCES BIBLIOGRAPHIQUES 51
GLOSSAIRE 57
ANNEXES 59
SIGLES ET ABREVIATIONS
Cdt : Commandant
Cne : Capitaine
EFCPC : Ecole de Formation Continue et de
Perfectionnement des Cadres
ESA : Ecole Supérieure d'Agronomie
GLM : General Linear Model (Modèle
linéaire général)
GPS : Global Position Système
GTZ : Gesellschaft für
Technische Zusammenarbeit (Coopération
Technique Allemande) INP-HB : Institut
National Polytechnique Félix Houphouët Boigny
INS : Institut National de la Statistique
Lt : Lieutenant
OIPR : Office Ivoirien des Parcs et
Réserves
PACPNT : Projet Autonome pour la Conservation du
Parc National de Taï
PNT : Parc National de Taï
SPSS : Statistical Parckage for the Social
Science
UICN : Union Mondiale pour la Nature
UNESCO : Organisation des Nations Unies pour
l'Education, la Science et la Culture WCF: Wild Chimpanzee
Foundation
WWF: World Wildlife Fund
LISTE DES TABLEAUX
Tableau 1 : Richesse 29
Tableau 2 : Indice de diversité de Simpson 30
Tableau 3 : Ratio I 30
Tableau 4 : Comparaisons des taux d'observations des
années par paire 32
Tableau 5 : Comparaison par paires des taux d'observations de
Cercopithecus diana diana des années 36 Tableau 6 : Comparaison
par paires des taux d'observations de Piliocolobus badius badius des
années 37 Tableau 7 : Comparaison par paires des taux d'observations de
Cephalophus maxwelli des
années 38
Tableau 8 : Comparaisons par paires des taux d'observations des
secteurs 39
Tableau 9: Comparaison par paires des taux d'observations de
Cercopithecus diana diana des secteurs 42 Tableau 10 : Comparaison par
paires des taux d'observations de Piliocolobus badius badius des
secteurs 42 Tableau 11 : Comparaison par paires des taux d'observations de
Cephalophus maxwelli des
secteurs 43
Tableau 12: Taux d'échantillonnage 48
Tableau A 1: Données générales 1999-2005 par
secteur b
Tableau A 2 : Répartition des effectifs des espèces
bimonitrices par années d
Tableau A 3 : Test d'égalité des variances des
erreurs de Levene au seuil de 5% i
Tableau A 4 : Test de Kruskal-Wallis au seuil de 5% i
Tableau A 5: Distances parcourues par secteur i
Tableau A 6 : Moyenne des taux d'observations pour toutes les
espèces j
Tableau A 7 : Moyenne de Cercopithecus diana diana k
Tableau A 8 : Moyenne de Piliocolobus badius badius l
Tableau A 9 : Moyenne de Cephalophus maxwelli m
Tableau A 10 : Densités de Cephalophus maxwelli
n
Tableau A 11 : Densités de Cercopithecus diana diana
o
Tableau A 12 : Densités de Piliocolobus badius badius
p
Tableau A 13 : Récapitulatif des groupes et sous groupes
des mammifères q
Tableau A 14 : Récapitulatif des groupes et sous groupes
des oiseaux r
Tableau A 15 : Liste des espèces de mammifères
biomoniteurs v
Tableau A 16 : Liste des espèces d'oiseaux biomoniteurs
x
Tableau A 17 : Liste des espèces de gastéropodes
biomoniteurs y
Tableau A 18 : Liste des espèces de reptiles biomoniteurs
y
Tableau A 19 : Données pluviométriques de la
région Sud-Ouest de 1919 à 1998 dd
LISTE DES FIGURES
Figure 1: Carte de la situation géographique du Parc
National de Taï 5
Figure 2 : Courbe de l'évolution de la pluviométrie
de la Région de l'Ouest (19 19-1998) 6
Figure 3 : Représentation de la distance d'observation .
15
Figure 4 : Courbe de la fonction de détection g(x) 16
Figure 5 : Répartition des espèces entre les grands
groupes d'animaux du biomonitoring 18
Figure 6 : Design du biomonitoring du Parc National Taï
20
Figure 7 : Répartition des fréquences entre les
grands groupes d'animaux 27
Figure 8 : Répartition des fréquences entre les
groupes de mammifères 28
Figure 9 : Evolution des fréquences de toutes les
espèces biomonitrices 31
Figure 10 : Répartition des fréquences des singes
entre les espècesErreur ! Signet
non
défini.
Figure 11 : Répartition des fréquences des
antilopes entre les espècesErreur ! Signet non
défini.
Figure 12 : Evolution des fréquences de Cercopithecus
diana diana 34
Figure 13 : Evolution des fréquences de Piliocolobus
badius badius 35
Figure 14 : Evolution des fréquences de Cephalophus
maxwelli 35
Figure 15: Répartition des fréquences de toutes les
espèces biomonitrices par secteur 39
Figure 16 : Répartition des fréquences de
Cercopithecus diana diana par secteur Erreur !
Signet non
défini.
Figure 17 : Répartition des fréquences de
Piliocolobus badius badius par secteur Erreur !
Signet non défini.
Figure 18 : Répartition des fréquences de
Cephalophus maxwelli par secteur 41
Figure 19 : Evolution des densités de Cercopithecus
diana diana dans les secteurs III, IV et
V 44
Figure 20 : Evolution
des densités de Piliocolobus badius badius dans les secteurs
III, IV et
V 45
Figure 21 : Evolution des densités de Cephalophus
maxwelli dans les secteurs III, IV et V 46
Figure 22 : Proposition d'un design pour le biomonitoring du Parc
National de Taï 49
Figure A 1 : Répartition des pourcentages des dix
premières espèces du secteur I f
Figure A 2 : Répartition des pourcentages des dix
premières espèces du secteur II f
Figure A 3 : Répartition des pourcentages des dix
premières espèces du secteur III g
Figure A 4 : Répartition des pourcentages des dix
premières espèces du secteur IV g
Figure A 5 : Répartition des pourcentages des dix
premières espèces du secteur V h
Figure A 6 : Analyses spatiales de 1999 s
Figure A 7 Analyses spatiales de 2000 s
Figure A 8 : Analyses spatiales de 2004 s
LISTE DES PHOTOGRAPHIES
Photo 1: Céphalophus jentinki z
Photo 2 : Cephalophus maxwelli z
Photo 3 : Cephalophus niger z
Photo 4 : Cephalophus.zebra z
Photo 5 : Hyemoschus aquaticus z
Photo 6 : Syncerus caffer nanus z
Photo 7: Cercopithecus diana diana aa
Photo 8 : Cercopithecus mona lowei aa
Photo 9 : Cercopithecus petaurista aa
Photo 10 : Piliocolobus badius badius aa
Photo 11 : Colobus polykomos polykomos aa
Photo 12 : Colobus verus aa
Photo 13 : Cercocebus atys atys bb
Photo 14 : Pan troglodytes verus bb
Photo 15 : Loxodonta africana cyclotis bb
Photo 16 : Panthera pardus leopardus bb
Photo 17 : Poicephalus gulielmi bb
Photo 18 : Psittacus erithacus bb
Photo 19 : Tauraco macrorynchus cc
Photo 20 : Stephanoaetus coronatus cc
Photo 21 : Python sebae cc
Photo 22 : Bitis gabonica cc
INTRODUCTION
La terre soutient une extraordinaire variété
d'êtres vivants (végétaux, champignons, animaux, etc.) qui
représentent au total environ 10 millions d'espèces avec plus
d'un million d'espèces animales et 300 000 espèces
végétales (Dajoz, 1985). Bon nombre d'entre elles sont
menacées de disparition notamment du fait de l'expansion des populations
humaines et du développement effréné de leurs
activités (Hoppe-Dominik, 1998). Les taux d'extinction sont à
l'heure actuelle environ dix mille fois plus élevés que jamais
(Le Maître et al., 2002).
Heureusement, la valeur économique de l'héritage
naturel de la terre gagne actuellement une certaine reconnaissance. Au cours
des dernières décennies, les questions relatives à la
perte de biodiversité ont suscité de nombreuses réactions
positives. La communauté internationale a placé environ 10% de la
surface de terre sèche sous protection (Miller, 2003), adoptant un
arsenal législatif national et international destiné à
protéger les espèces menacées ou déjà en
voie de disparition. En 1992, une convention sur la biodiversité a
été signée à la conférence de la Terre
à Rio de Janeiro au Brésil. A mesure que s'est
développée la sensibilisation, de nombreuses nations ont
exprimé leur intérêt pour la protection de la
biodiversité (Carabias et al., 2003).
Cependant, l'absence de programme actif de gestion de la
protection de l'environnement dans de nombreuses zones protégées
pose souvent une menace contre la biodiversité, notamment dans les pays
en développement. Une information à la fois complète et
fiable sur la biodiversité était rarement disponible dans ces
régions. Les Etats se sont donc engagés à suivre de
manière permanente ces espaces. Le suivi de ces espaces ou biomonitoring
permet d'apprécier de façon permanente l'évolution des
écosystèmes et des menaces qui peuvent compromettre leur
dynamique.
C'est fort de cela qu'en 1994, dans le cadre du Projet
Autonome pour la Conservation du Parc National de Taï (PACPNT), le PNT fut
doté d'une cellule de suivi écologique (PNT, 2001). Elle est
chargée de faire le biomonitoring du PNT.
Notons qu'il existe beaucoup de techniques de recensements qui
ont été mis en place (Gaidet, et al., 2002 ; Thomas,
2005). Elles sont fonction des espèces ciblées, des zones
contrôlées et des périodes de collecte des données.
Ce fait pose un certain nombre de problèmes. Il est
généralement impossible de parcourir toute la superficie de la
zone étudiée (des milliers de kilomètres carrés)
(Buckland et al., 1993 ; Bouché, 2001). Faire un recensement
représentatif de toute la zone n'est pas toujours chose facile. Un autre
problème demeure le choix des espèces étudiées.
Selon quels critères les espèces sont-elles choisies (Sutherland,
1996) ? L'estimation de la densité étant dictée par
l'adaptation de la méthode de collecte des données, il n'est pas
rare de voir qu'une méthode mal exécutée entraîne
des biais dans les résultats. Le
cas du biomonitoring multi-spécifique présente
des difficultés supplémentaires. Les estimations des
densités sont faites de la même manière pour toutes les
espèces; et cela biaise énormément les résultats de
bon nombre d'entre elles (Southwood et Henderson, 2001). En ce qui concerne le
PNT, bien que connaissant un taux de déforestation faible (0,5%), il
subit une intense activité de braconnage (Hoppe-Dominik, 1998 ; PNT,
2001) qui constitue à lui seul plus de 80% des délits commis dans
celui-ci (Seka et Kissi, 2002). Malheureusement les données, du
biomonitoring mis en place depuis 1999 dans l'optique de mesurer l'impact de la
surveillance et/ou du braconnage sur l'évolution de la faune, ne font
pas l'objet d'analyses régulières.
Tous ces faits ont conduit la Direction de l'Office Ivoirien
des Parcs et Réserves (OIPR) a initié la présente
étude dont le thème est « Analyse du système de
biomonitoring du Parc National de Taï ». Cette étude a pour
objectifs de présenter les résultats du biomonitoring de la faune
du PNT et de déceler ses forces et ses faiblesses afin d'une
amélioration future.
CHAPITRE 1 :
GENERALITE S
1. PARC NATIONAL DE TAÏ
1.1. Historique
En 1926 fut créé un Parc Refuge d'une superficie
de 960 000 ha dans la région du Sud-Ouest de la Côte-d'Ivoire
(Koné, 2004). Ce Parc Refuge obtient le statut de Réserve
Spéciale de Faune en 1933, puis celui de Forêt Classée, en
1955 (PNT, 2001). C'est en 1956, par arrêté N° 56-87 du 7
août 1956, que le nom de Taï (ville située à 20 km
dans sa partie Ouest), pour la première fois, est associé
à cette aire protégée ; qui devient, alors, «
Réserve Intégrale pour la Faune et la Flore ». Elle comptait
425 000 ha de superficie (PNT, 2001). En 1972, par décret N° 72-544
du 28 août 1972, la grande partie de cette réserve (350 000 ha)
devient « Parc National de Taï » et la partie nord (72 700 ha
environ) obtient le statut de « Réserve Partielle de Faune du N'Zo
». Un an plus tard, la superficie de la Réserve de Faune du N'Zo
augmente de 20 000 ha au détriment du Parc National de Taï (PNT).
En 1978, le PNT intègre le réseau international de
Réserves de la Biosphère et est inscrit, depuis 1982 sur la liste
du Patrimoine Naturel Mondial de l'Humanité de l'UNESCO (PNT, 2001 ;
Koné, 2004).
L'actuel PNT s'étend sur une superficie de 457 000 ha,
et est prolongé, au Nord, par la Réserve de Faune du N'Zo (77 000
ha) (PNT, 2001). Cet ensemble, d'une superficie de 534 000 ha, constitue le
plus grand bloc intact de forêt ombrophile primaire d'Afrique de l'Ouest
(Koné, 2004).
1.2. Localisation géographique
Le Parc National de Taï est situé au Sud-Ouest de
la Côte d'Ivoire dans les Régions du BasSassandra et du
Bas-Cavally. Il est compris entre 5°08' et 6°24' de latitude Nord et
entre 6°47' et 7°25' de longitude Ouest dans l'interfluve entre le
Cavally et le Sassandra (PNT, 2001). Il est à cheval sur sept
sous-préfectures appartenant à quatre départements
(Guiglo, Soubré, San Pedro et Tabou) (Figure 1).
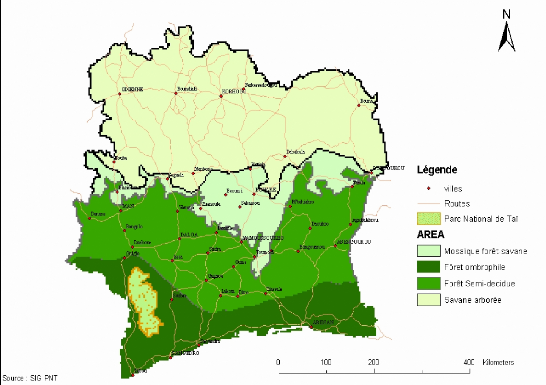
Figure 1: Carte de la situation géographique du
Parc National de Taï
1.3. Climat
Le climat du Sud-Ouest de la Côte-d'Ivoire est du type
subéquatorial, chaud et humide toute l'année (Guillaumet et
al., 1984 ; PNT, 2001).
Ce climat est caractérisé par deux saisons de
pluies, une grande (mi-mars à juillet) et une petite (septembre à
novembre). Elles alternent avec une grande saison sèche (décembre
à mars) et une petite saison sèche (juillet à août)
(Figure 2).
La moyenne des précipitations annuelles est de 1 800 mm
et la température moyenne mensuelle varie de 24° C à
28° C (Hoppe-Dominik, 1998 ; Koné, 2004). L'humidité
relative moyenne mensuelle de l'air est comprise entre 80% et 85%, et peut
atteindre souvent 100% pendant la nuit (PNT, 2001).
Les vents dominants soufflent du Sud au Sud-Ouest et la
durée d'insolation annuelle est comprise entre 1800 h et 2100 h (PNT,
2001). L'harmattan y est irrégulier et très peu ressenti ; une
à deux semaines au maximum entre décembre et janvier (Adou et
al, 2005).
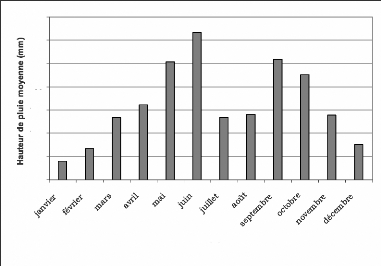
350
300
250
200
150
100
50
0
Mois
Figure 2 : Courbe de l'évolution de la
pluviométrie de la Région de l'Ouest (1919-1998)
1.4. Relief
Le relief du Parc National de Taï est une
pénéplaine qui descend graduellement d'environ 300 m
jusqu'à la mer (Avenard et al., 1971). Elle est cependant
boursouflée au sud de la Hana par de petits massifs. Il s'agit du Mont
Klon (370 m), du Mont Gilas (360 m) et du Mont Nienokoiué (396 m). Cette
topographie ondulée est caractérisée par des
dénivellements de 20 m à 40 m entre collines et bas-fonds avec
des pentes douces et longues (Bousquet, 1992).
1.5. Hydrographie
Le Parc National de Taï est drainé par de nombreux
cours d'eau permanents qui se partagent entre deux grands bassins versants et
deux bassins de petits fleuves côtiers. Près de 88% de la surface
du PNT est drainée par les affluents du Cavally, notamment
l'Audrénisrou, la Hama, le Nzé et le Memo (Hoppe-Dominik,
1995).
1.6. Géologie et pédologie
Les formations géologiques du Parc National de Taï
» appartiennent au socle primaire précambrien. Elles correspondent
aux deux grands cycles orogéniques successifs libérien et
éburnéen. Elles sont dominées par des roches
métamorphiques (Schistes). Le reste est formé de roches
plutoniques (granites) (Riezebos et al., 1994).
Sur le plan pédologique, les sols dominants sont
ferralitiques fortement désaturés. On rencontre des sols
hydromorphes à texture hétérogène assez
grossière dans les fonds de vallées des cours d'eau (Avenard et
al. 1971).
1.7. Flore
En raison de sa situation géographique et des
conditions pluviométriques, le Parc National de Taï fait partie de
la grande région floristique Guinéo-congolaise des forêts
ombrophiles denses sempervirentes (FGU-Kronberg, 1979).
C'est essentiellement un massif de forêt dense humide
sempervirente qui relève du complexe Eremospatho-Mabetum
qualifié de forêt subhygrophile (Mangenot, 1956). En bas de pente,
l'on rencontre les éléments appartenant au complexe
Diospyro-Mapanietum liés à des sols argileux ; en particulier les
nombreuses espèces du genre Mapania (Cyperaceae) et
Tarrietia utilis sprague (Sterculiaceae) (Guillaumet et
al., 1984).
Le PNT est formé en grande partie par les forêts
à Eremospatha macrocarpa et Diospyros mannii. Ce n'est
que dans le sud du parc que les forêts à Diospyros ssp et
Mapania ssp constituent la formation de climax (Guillaumet et
al., 1984).
La forêt du PNT est caractérisée par la
présence d'arbres géants de 40 à 60 m de hauteur avec chez
certaines espèces, d'énormes racines contreforts aliformes
[Piptadenistrum africanum (Hook.f.) Brenan (Mimosaceae),
Klainedoxa gabonensis Pierre ex Engl. (Irvingiaceae)] ou des racines
échasses à leur base comme chez Uapaca spp
(Euphorbiaceae). La grande densité de la végétation limite
la visibilité à environ 20 à 25 m. Elle diminue
considérablement la lumière incidente atteignant le sol
(Koné, 2004).
La richesse floristique du parc est considérée
comme étant relativement élevée, par rapport à la
flore forestière du massif guinéen, à cause de la
présence de taxa caractéristiques dits « sassandriens »
(Guillaumet et al., 1984). De récentes études
menées par Adou et al. (2005) ont porté la flore du PNT
à 1231 espèces.
1.8. Faune
Le Parc National de Taï est l'un des derniers grands
bastions forestiers ouest africain pour la faune forestière (Hamilton,
1976). Il abrite 93% des espèces de mammifères de la zone
forestière ouest-guinéenne. Il compte environ 140 espèces
de mammifères (Riezebos et al., 1992) dont 43
Chiroptères, 41 Rongeurs, 15 Ongulés, 14 Carnivores, 14
Insectivores, 12 Primates etc. Les principales familles des mammifères
rencontrées dans le PNT sont dominées par cinq ordres que sont
les Primates, les Artiodactyles, les Carnivores, les Pholidota et les
Proboscidea. L'ordre des Primates comprend trois familles (Lorisidae,
Cercopithecidae et Pongidae à laquelle appartiennent les
chimpazés (Pan troglodytes verus). Celui des Artiodactyles
comprend quatre familles (Suidae, Hippopotamidae, Bovidae, et Tragulidae) et
l'ordre des Carnivores est formé de trois familles qui sont les
Mustelidae, les Viverridae et les Felidae. L'ordre des Pholidota est
constitué de la famille des Manidae (Pangolins), alors que celui des
Proboscidea comprend la famille des Elephantidae dont la seule espèce
présente au PNT est l'éléphant des forêts
(Loxodonta africana cyclotis) (Bousquet, 1992).
Cet ensemble compte une douzaine d'espèces
d'endémiques. Les sous-espèces endémiques des Primates
sont présentes dans les forêts denses ouest-africaines
situées à l'ouest du Sassandra. On y trouve le cercocèbe
enfumé (Cercocebus atys atys), le cercopithèque
pétauriste (Cercopithecus petaurista), le cercopithèque
Mone (Cercopithecus mona lowei), le cercopithèque Diane
(Cercopithecus diana diana) et le colobe magistrat (Colobus
polykomos polykomos). Par ailleurs, Cercopithecus petaurista,
Cercopithecus diana diana et Colobus polykomos polykomos sont
endémiques d'Afrique de l'Ouest. Chez les insectivores, deux
espèces de musaraignes endémiques et rares de l'Afrique de
l'Ouest ont pu être identifiées : Crocidura nimbae et
Crocidura muricauda. (Refisch et Koné, 2001 ; Seka et Kissi, 2002).
Le micropotamogale (Micropotamogale lamottei) est lui aussi une
espèce endémique du massif forestier d'Afrique de l'Ouest de
même que l'hippopotame pygmée (Choeropsis liberiensis),
le céphalophe zébré (Cephalophus zebra) et le
céphalophe d'Ogilby (Cephalophus ogilbyi).
Le céphalophe de Jentink (Cephalophus
jentinki) est, quant à lui, endémique de Côte d'Ivoire
et du Libéria, strictement cantonné à l'Ouest du
Sassandra.
L'avifaune du PNT est très riche en espèces ; le
nombre d'espèces d'oiseaux inventoriés est de l'ordre de 235
à 240 (Allport et al., 1994 ; Koné, 2004). Les familles
les plus importantes sont les Accipitridae (Rapaces), les Alcedinidae
(Martins-pêcheurs et Martins-chasseurs) et les Bucerotidae (Calao). Vingt
quatre de ces espèces dont la pintade à poitrine blanche
(Agelastes meleagrides), de la famille des Phasianidae et le grand
calao à casque jaune (Ceratogymna elata), de la famille des
Bucerotidae sont classées endémiques pour la zone
forestière d'Afrique de l'Ouest (Koné, 2004). Neuf d'entre elles
sont considérées comme en danger et quatre menacées
d'extinction (PNT, 2001)
Le PNT compte une importante population de serpents
estimée entre 43 espèces (Rödel, 2004). Parmi eux,
Dendroaspis viridis (Elapidae) est une espèce endémique
du PNT. Trois espèces de crocodiles (Crocodylidae) se rencontrent dans
le PNT bien que le Crocodile du Nil (Crocodylus niloticus) y soit
très rare. On y retrouve également plusieurs espèces de
tortues, de varans, de caméléons et de lézards (PNT,
2001).
Les amphibiens du PNT ont été très peu
étudiés. 56 ont été dénombrées
(Rödel, 2004). Quatre de ces espèces sont endémiques du PNT.
Il s'agit de Phrynobatrachus taiensis (Ranidae), Hperolius
nienokouensis (Hyperoliidae), Bufo taiensis (Bufonidae) et
Cardioglossa leucomystax (Arthroleptidae).
Comme dans la plupart des aires protégées de
Côte d'Ivoire, la richesse spécifique en poissons, en insectes et
autres invertébrés reste encore assez mal connue (PNT, 2001). Les
populations d'insectes sont toutefois diversement connues selon les recherches
thématiques qui ont contribué à leur identification. Les
groupes les mieux recensés à ce jour sont les coprophages (93
espèces), les odonates (51 espèces), les diptères (109
espèces), les fourmis (95 espèces), les termites (44
espèces) et les nématodes (24 espèces) (PNT, 2001).
Toutefois, ce sont, vraisemblablement, des dizaines de milliers
d'espèces,voire plus, qui restent inconnues de la science dans
l'ensemble biogéographique que représente la forêt de
Taï (Koné, 2004).
1.9. Population riveraine
Lors du classement en 1972, il n'y avait pas d'installation
humaine permanente dans le Parc National de Taï. Les populations
riveraines autochtones appartenaient toutes au grand groupe Krou composé
des Bakwé à l'est et au sud-est, des Kroumen au sud-ouest, des
Oubi à l'ouest, des Wè au nord-ouest, des Bété et
des Kouzié au nord-est (Bonnéhin et al., 1997). La
situation démographique de cette région qualifiée
longtemps de désert humain a été modifiée par
divers phénomènes sociaux, économiques et politiques. Les
immigrants ne sont arrivés qu'à partir des années 1970 par
deux grandes vagues de natures différentes (Riezebos et al.,
1992).
La première vague, composée d'allochtones
Baoulés, Malinkés, Senoufo, Lobi, Yacouba et d'allogènes
Burkinabé, Maliens, Ghanéens, Guinéens et Mauritaniens,
est arrivée suite à la mise en valeur des territoires du
sud-ouest ivoirien et à la flambée du prix du café et du
cacao pendant la même période. Quant à la deuxième
vague, elle est arrivée suite à la guerre civile du Liberia en
1989 (Bonnéhin et al., 1997).
Le recensement national de 1998 a donné 781 695
habitants vivant dans la région du PNT, repartis dans 74 villages (PNT,
2001). Ces populations riveraines pratiquent l'agriculture (Seka et Kissi,
2002).
1.10. Braconnage dans le PNT
Le braconnage est la plus grande menace qui pèse
actuellement sur le parc. On estime à 20.000 personnes le nombre de
braconniers vivant à la périphérie directe du PNT (Seka et
Kissi, 2002). Parmi eux, environ 600 personnes pratiqueraient le braconnage
comme une activité professionnelle (Refisch et Koné, 2001). Le
braconnage est le délit le plus fréquemment constaté dans
le PNT. En 2001, il représentait à lui seul près de 81%
des délits du parc (PNT, 2002). Visant au début les
Eléphants pour leur ivoire, le braconnage s'est orienté vers
d'autres grands mammifères tels que les céphalophes et les singes
(Adou et al., 2005). Entre 1997 et 2002, 744 céphalophes et 686
singes ont été saisis sur des braconniers (Seka et Kissi,
2002).
1.11. Gestion du PNT
Pour assurer une bonne gestion du Parc National de Taï,
le gouvernement ivoirien a créé le Projet Autonome pour la
Conservation du Parc National de Taï (PACPNT) par arrêté
n°0198 du 02 Juillet 1993. Ce projet rattaché à la Direction
de la Protection de la Nature (DPN), fonctionne en partenariat avec la Mission
de Coopération Technique Allemande (GTZ), le
Fonds Mondial pour la Nature (WWF) et le Bureau TROPENBOS
Côte-d'Ivoire. L'autonomie du projet a permis, jusque là, de mener
des activités de protection des ressources naturelles avec une grande
flexibilité (Bonnéhin, et al., 1997). L'objectif global
du PACPNT est la conservation à long terme du PNT. L'approche globale de
ce projet consiste à impliquer les populations riveraines dans la mise
en place de stratégies de conservation du PNT. Les principaux axes
d'intervention du PACPNT sont entre autres :
· le renforcement de la surveillance et la modernisation de
moyens de surveillance ;
· la promotion du parc à travers le
développement de l'écotourisme et la sensibilisation des
populations riveraines ;
· la stimulation de l'auto-promotion des populations
riveraines à travers une assistance technique et financière
à divers projets de développement.
Depuis septembre 2004, la gestion du PNT est assurée de
l'OIPR.
Le PNT est subdivisé en cinq secteurs coordonnés
par une Direction de Zone (Zone Sud- Ouest) située à San
Pedro.
2. SYSTEME DE BIOMONITORING
2.1. Définition
Le mot biomonitoring est composé de deux termes :
« bio » qui signifie « vie » et « monitoring » ;
terme angliciste qui signifie « suivi ». Selon Spellerberg (2005), le
biomonitoring est la collecte ou la mesure et l'analyse de données et
processus écologiques de façon courante à intervalle de
temps régulier. Il permet d'apprécier les risques encourus par
(ou que peut encourir) un écosystème afin de prendre les mesures
qui s'imposent. C'est un processus à long terme (Weaver et al.,
1998, N'dri, 2005). Il existe plusieurs types ou catégories de
biomonitoring. Vaughan (2001) distingue quatre types qui sont :
· le biomonitoring simple qui consiste en l'enregistrement
des valeurs de variable unique en un endroit et à un moment donné
;
· le biomonitoring de recherche : l'absence de
données historiques pour un problème de l'environnement dans une
région particulière peut être remplacée par une
étude comparative des conditions ambiantes courantes dans la
région affectée et dans une région non affectée
;
· le biomonitoring par substitut : ici, le manque
d'informations écologiques antérieures sur la variable est
compensé par l'utilisation d'informations de remplacement pour
inférer des changements ; et
· le biomonitoring intégré qui consiste
en l'utilisation d'un ensemble détaillé d'informations
écologiques.
2.2. Objectif
L'objectif principal du biomonitoring est de suivre de
manière permanente l'évolution des écosystèmes. Il
s'agit donc de :
· observer et décrire les changements (cycliques,
occasionnels lents ou brusques) ;
· intégrer et évaluer leurs impacts
écologiques ; et
· proposer des mesures d'aménagement.
2.3. Régions contrôlées
Toutes les régions de la terre peuvent faire l'objet
de biomonitoring. Cependant, certaines régions peuvent paraître
prioritaires de par leur statut « en danger ». Tout dépend des
objectifs que l'on se donne (Sutheland, 1996). Les régions qui font
l'objet de biomonitoring sont :
· les régions où les impacts des
activités humaines sont élevés de sorte à
compromettre l'utilisation durable des terres ;
· les régions où l'impact anthropique est
moindre, mais dont les informations pourraient servir de base de comparaison
à celles de régions similaires ayant été
affectées par l'homme ; et
· les régions non affectées par les
activités de l'homme mais pour lesquelles l'on voudrait savoir si une
déchéance environnementale se produit par exemple.
2.4. Collecte des données
Les variables sur lesquelles porte le biomonitoring
concernent aussi bien les êtres vivants (animaux, végétaux,
bactéries, etc.) que les êtres abiotiques (sol, atmosphère,
eaux) (Southwood et Henderson, 2001).
Les méthodes de collecte sont aussi diverses que les
entités pour lesquelles elles sont utilisées. Elles
dépendent de plusieurs paramètres tels que la région,
l'espèce, l'objectif, les moyens (Southwood et Henderson, 2001 ;
Vaughan, 2001). Elles vont de l'utilisation de satellites aux fouilles
souterraines en passant par les relevés terrestres. Le matériel
utilisé pour la collecte des données est également
varié.
Dans le cadre du biomonitoring de la faune, deux principales
méthodes de collecte des
données sont utilisées
(Bouché, 2001). Il s'agit du recensement direct et du recensement
indirect. Le recensement direct est basé sur un
décompte direct des animaux vus (par des moyens aériens,
terrestres ou aquatiques). Quant au recensement indirect, il est basé
sur l'observation d'indices d'abondance ou de présence (crottes, trace
de pas, nids, carcasses, cris, etc.) (Bouché, 2001 ; Vaughan, 2001).
Le recensement peut être total ou partiel. Le
recensement total se fait sur toute l'étendue de la zone d'étude.
Cette méthode, trop coûteuse financièrement et
matériellement n'est pas conseillée pour de grandes surfaces
(Buckland et al., 1993 ; Bouché, 2001). Le recensement partiel
se fait sur des unités-échantillons. Si toutes les
unités-échantillons sont parcourues, on a affaire à un
recensement systématique. Par contre, si une partie seulement des
unités- échantillons est prospectée ; on parle de
recensement par échantillon.
Les unités-échantillons peuvent être des
transects, des quadrats ou des blocs.
2.4.1. Recensement par bloc
Le recensement par bloc permet de localiser des troupeaux
d'une même espèce sur des blocs de quelques centaines de
mètres de côté (Michel, 1999 ; Chardonnet, 2000 ;
Bouché, 2001). Les blocs sont fouillés en long et en large pour
compter tous les animaux considérés. Cette technique est
utilisée pour étudier la dynamique des populations (sex-ratio,
structure par âge, femelles enceintes, etc.) (Bouché, 2001).
2.4.2. Recensement par quadrats
Le recensement par quadrats consiste à quadriller la
zone d'étude par des carrés de 3 km de côté ou par
des rectangle de 3 x 5 km2. A chaque intersection de ligne et de
colonne sont dessinés des quadrats de 100 m x 100 m. Chacun de ces
petits quadrats d'un hectare est fouillé. Le recensement par quadrats a
le même principe que celui par blocs.
2.4.3. Recensement par transect
Quant au recensement par transect, il s'effectue dans les
zones où l'usage de l'avion est inefficace de par la densité des
habitats (Bouché, 2001), de par la topographie du terrain, trop
dangereux ou non valide pour les petites espèces qui se prêtent
mal aux recensements aériens (Bouché, 2001). Le transect est une
ligne le long de laquelle les animaux sont comptés. On distingue trois
types de recensement par transect qui sont le recensement par transect en
bande, le recensement par transect en ligne et le recensement par transect en
point.
· Le recensement par transect en bande
(strip transect) : ici une bande de largeur w est fixé
à l'avance de part et d'autre de la ligne de transect de sorte que la
superficie de celle-ci est : S = L. 2. w = L. l (Arvanitis et al.,
1997 ; Buckland et al., 1993 ; Bouché, 2001) avec L = longueur
du transect l = 2w = largeur du transect S = superficie de la
bande-échantillon ou bande du transect.
· Le recensement par transect en ligne (line
transect) : dans ce cas, la largeur w du transect n'est pas
fixée et peut être théoriquement égale à
l'infini. w est déterminé par les mesures des distances
perpendiculaires séparant les animaux de la ligne de transect ou par
l'angle et la distance d'observation. Cependant cette largeur peut être
fixée pour des raisons techniques (champ visuel limité) (Buckland
et al., 1993 ; Bouché, 2001 ; )
· Le recensement par transect en point (point
transect) : la technique consiste à enregistrer des indices de
présence ou d'abondance (fèces, pas, etc.), mais aussi les
animaux à partir des points. Les données sont enregistrées
dans un rayon autour de chacun de ses points (Buckland et al., 1993,
1999 ; Bouché, 2001, Young, 2005).
Quelque soit le type de recensement, il faut avoir toujours en
sa possession une carte sur laquelle seront disposés les
unités-échantillons. La disposition spatiale obtenue est
appelée le « design ».
2.5. Traitement des données
Toutes les données recueillies sur le terrain sont
enregistrées dans une bibliothèque de données. Elles sont
corrigées pour éliminer les données aberrantes puis
analysées régulièrement. Il existe une multitude de
logiciels cartographiques (Arcview, MapInfo, etc.) et statistiques (Transect,
Elephant, Ecobeaker, EstimateS, Distance, etc.) conçus pour les analyses
(Buckland et al., 1993 ; Chardonnet, 2000 ; Bouché, 2001 ;
Young, 2004).
Le plus utilisé pour le biomonitoring des animaux est
actuellement le logiciel « Distance » dans sa version 4.1 (Buckland
et al., 2003 ; Thomas, 2005).
2.5.1. Détermination de la densité avec
Distance
La méthode d'estimation de la densité des
populations animales a été développée par Buckland
et al. (1993). Elle part du principe que la densité et la
taille de la population sont corrélées de la manière
suivante :
D= N
w
D est la densité par unité de surface, N le nombre
d'individus de la population et w la superficie en question.
Le logiciel Distance nécessite que les distances aux
objets observés soient mesurées avec un angle droit à
partir de la ligne de transect. En fonction du nombre d'objets observés
dans une classe de distance déterminée au transect, les
densités sont estimées. La probabilité de
découverte forme la base du calcul. Elle diminue avec la distance de
manière caractéristique de l'espèce.
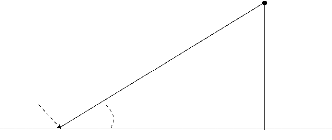
r
è
Objet
transect
observateur
x
Figure 3 : Représentation de la distance
d'observation (Buckland et al. 1993).
Pour chaque estimation, la distance aux objets sur le terrain
(r) est mesurée. On mesure aussi
l'angle (è) pour qu'ainsi la
distance avec un angle droit (x) puisse être calculée tel que suit
:
x= rsin(è).
Pour effectuer les calculs avec le logiciel Distance, six
hypothèses de bases sont posées :
1- les animaux sont distribués au hasard ;
2- les transects sont des lignes de longueur L
déterminée et repartis dans la zone inventoriée ;
3- les animaux situés sur la ligne de transect sont
toujours détectés (vus avec la probabilité g(x= 0) = 1)
;
4- les animaux sont immobiles au moment où ils sont
observés, ils n'ont pas bougés avant d'avoir été
détectés et aucun n'est compté deux fois ;
5- les distances et les angles sont mesurés avec
précision ;
6- chaque observation est un événement
indépendant.
En pratique, il n'est pas nécessaire de poser des
hypothèses (qui pourraient être erronées) quant à la
distribution spatiale des objets ; pourvu que les transects soient
disposés au hasard (Buckland et al., 1993). Dans les
méthodes couramment utilisées (estimateur robuste, non
paramétrique), seules les hypothèses de 2 à 5 sont
véritablement importantes.
2.5.1.1. Fonction de détection
Pour estimer la densité des animaux, il est
nécessaire de disposer d'un modèle conceptuel qui lie les
données aux paramètres de densité à estimer.
Le principe du modèle général est que la
probabilité de détecter un animal diminue quand on
s'éloigne de la ligne de transect. Mathématiquement cette
idée est représentée par une courbe g(x), dite fonction de
détection (Buckland, et al., 1993).
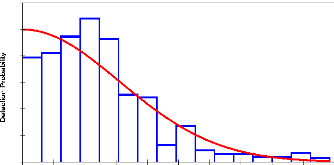
0,8
0,6
0,4
0,2
0,0
1,2
1,0
0 5 10 15 20 25 30 35 40 45 50
Perpendicular distance in meters
Figure 4 : Courbe de la fonction de détection g(x)
(Buckland, 1993) 2.5.1.2. Estimation de la densité
La fonction g(x) est la probabilité d'observer un objet
ou un animal donné situé à une distance perpendiculaire x
de la ligne de transect (Buckland, et al., 1993 ; Bouché,
2001). C'est aussi la probabilité des points comme fonction de leur
distance les séparant de la ligne de transect.
g(x)=Pr(x= w)
On en déduit que la probabilité d'observer un
animal situé sur la ligne de transect (x = 0) est égale à
1 ; c'est-à-dire g(0) = 1. g(x) peut varier pour une même aire
d'étude selon des facteurs extérieurs (expérience des
équipes, météo, période du jour, taille des
groupes, etc.) (Bouché, 2001).
Pour une espèce donnée, la densité D
s'exprime par :
D= n
S
|
S
|
2 . .
L a
|
|
Avec
|
a w g x
= ? 0 ( )
|
dx
|
D : densité en nombre d'individus par km2 ou
par ha ;
n : nombre d'individus de l'espèce ;
S : superficie en km2 ou en ha ;
a : demie largeur du transect ;
L : longueur du transect ;
w : distance perpendiculaire maximale d'observation.
On obtient donc une ligne de transect de longueur L et de largeur
2w.
Parallèlement à la fonction de détection
d'un animal g(x), il existe une fonction détection de la densité
d'un animal f(x) tel que ;
f x ( )
g x
( ) =
a
g(x) et f(x) ont exactement la même forme. Avec g(0) = 1 on
obtient f(0) = 1 / a
2.L
3. BIOMONITORING DU PARC NATIONAL DE TAÏ
Le biomonitoring du Parc National de Taï a pour objectif
principal le suivi de l'évolution des animaux dans les zones
braconnées. Il se veut capable de mesurer l'impact de la surveillance et
des mesures d'aménagements sur l'évolution de la faune.
Le matériel utilisé est composé
principalement de fiches de collecte des données et de boussoles. En
plus de cela, les écologues disposent de tentes, de bouteilles d'eau, de
machettes et de carnets pour des prises de note. Le matériel biologique
est composé de 75 espèces animales (annexes 9). Le choix de ces
espèces se justifie par leur endémisme, leur
vulnérabilité, leur rareté, leur braconnage, leur
rôle dans la dispersion des graines et la
régénération de beaucoup d'espèces de plantes,
etc.
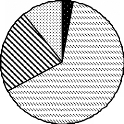
Cet ensemble se repartit entre les mammifères, les
oiseaux, les reptiles et les gastéropodes (Figure 5).
Reptiles; Gastero po des;
10,96% 2,74%
Oiseaux;
21,92%
M ammifères;
64,38%
Figure 5 : Répartition des espèces entre
les grands groupes d'animaux du biomonitoring
La méthode d'échantillonnage par distance
perpendiculaire « distance sampling » a été
utilisée pour la collecte des données.
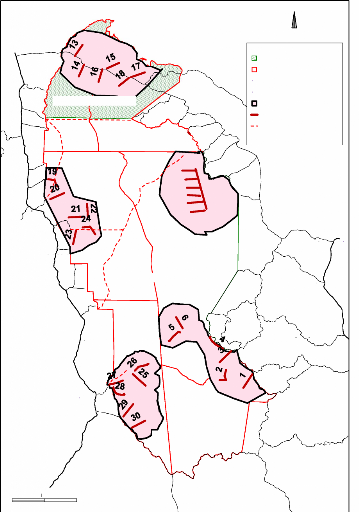
Le PNT a été subdivisé en cinq secteurs
de superficie variable (Figure 6). Dans chaque secteur sont disposés de
manière aléatoire six transects de quatre kilomètres de
long chacun. Les transects ont une largeur de trois mètres. Ces secteurs
ont été disposés à la périphérie du
parc (Figure 6). Tous les 25 m, des arbres ont été marqués
à l'aide de plastiques fluorescents pour faciliter les orientations lors
des contrôles de nuit. Ces transects sont entretenus par les collecteurs
de données pour faciliter les déplacements dans le silence.
Chaque transect est contrôlé quatre fois par
mois. Les contrôles ont lieu à 15h 00mn, à 19h 00mn et le
lendemain à 7h 30mn et à 10h 00mn. De cette manière, les
collecteurs de données peuvent observer des espèces ayant des
périodes d'activités différentes sur le même
transect. Les contrôles sont réalisés alternativement par
deux équipes de deux personnes. Pendant qu'une équipe fait le
contrôle, l'autre se repose à la base. De cette manière,
les contrôles sont faits par des personnes attentives.
Pendant les contrôles, les distances d'observation et les
angles sont estimés à l'oeil nu. Les observations notées
lors des contrôles sont entre autres :
· les distances qui séparent les observations ;
· l'espèce vue ou entendue ;
· la distance qui sépare le transect de l'animal
(distance perpendiculaire à la ligne de transect) ;
· la strate dans laquelle se trouvent les animaux ;
· l'activité des animaux ;
· le nombre d'individus par groupes ; et
· les traces et crottes.
Les données sont enregistrées dans une
bibliothèque de données mise en place par la cellule de
supervision. Seules les observations « directes » (« entendues
et vues ») ont été enregistrées dans la base de
donnée. Les traces et les crottes n'ont pas fait l'objet
d'enregistrement.
Les travaux sont réalisés sur le terrain par des
équipes de quatre collecteurs de données formés par le
parc à cet effet. Chaque équipe de collecteurs est
contrôlée par deux agents forestiers du parc, tous les quatre
à six mois.
)
V16!
V15!
Buyo!
Troya!
Ó
Ó
Zag né
!
Secteur III 42 287 Ha
ADK! Tchetaly (V1)
!
Wonsealy (V2)
!
Réserve de Faune N'Zo
Tienkoula
!
Goulegui-Beoue
!
Djidoubay
!
Mehoing
!
Vodelobly
!
Gbliglo (V3)
!
Guaboya (V4)
!
Trahaglounk
!
Légende
Parc National et Réserve de Faune Ressorts des postes de
surveillance
Ó Postes de Surveillance
Ô Postes de Surveillance en construction
Zones de biomonitoring
Transects de biomonitoring
Layons Anti-Braconnage ! Villages
Lobogba
!
Kodaya (V5)
!
Keïbly
!
Sagboya (V6)
!
Ô
Zaipobly
!
Gahably
!
SECTEUR II 41 862 Ha
SECTEUR IV 25 252 Ha
Ó
Ponan! Daobly
!
Taï
! Dikouli
!
Sarakagui
!
J ohi n
!
Amaragui
!
Tieme!
Gnamagui
!
Gouleako
!
Paule-Oula
!
Port Bouet
!
Ó
Liagui
!
Djero-Oula
!
Port-Genti
!
Takoreagui
!
Tiole-Oula
!
Pokuagui
!
Galea 2
!
Guakoreagui
!
Kangagui
!
Hana!
Parc National de Taï
Sakré!
Djigbagui
!
Walebo !
! Roviakro
Kpangban
!
SECTEUR I 35 426 Ha
SECTEUR V 30 557 Ha
Goh!
Gligbeoadgji
!
Gagny!
Nekawuinho
!
Mahino
!
KM
0
20
10
Petit Guiglo
!
Doba!
Ô
Djapadji
!
Ó
Pogreagui
! Kragui
!
Karie!
Para!
Koreagui 2
!
Seligbangan
!
Lobikro 1
!
Oupoyo
!
Nigre!
Gbletia
!
Hanagba Brouagui
!
!
Gnipi 2
!
N'Driagui
!
Robertpo rte
!
Oupagui
!
Gbehouin
!
Guiroutou
!
Poutou
!
Youkou
!
Petit Grabo
!
Figure 6 : Design du biomonitoring du Parc National
Taï (PNT, 2001)
CHAPITRE 2 :
METHODOLOGIE
1. COLLECTE DES DONNEES
Les données sur lesquelles nous avons travaillé
ont été extraites de la base de données du biomonitoring
du PNT. Il s'agit des données collectées de janvier 1999 à
juin 2005.
2. VISITE DE TERRAIN
Nous avons effectué une visite de terrain au cours de
laquelle nous avons pris part à la collecte de données. Cela nous
a permis d'appréhender les difficultés du terrain et les sources
d'erreurs.
3. ANALYSE DES DONNEES 3.1. Choix des
espèces
Les enregistrements dans la base de données ont
concerné tous les animaux entendus ou vus. Les observations de crottes
et de traces n'ont pas été enregistrées. De cette base,
nous n'avons considéré que les données sur les animaux
vus. Cela vient du fait que les estimations faites sur les animaux entendus
contiennent beaucoup de sources d'erreurs liées à la distance, au
nombre d'individus, etc.
Nos analyses ont porté d'abord sur toutes les
espèces recensées. Ensuite, nous avons retenu quelques
espèces par la méthode entonnoir. Ainsi donc, nous sommes partis
des quatre principaux groupes que sont les mammifères, les oiseaux, les
reptiles et les gastéropodes. De ces groupes, nous avons retenu celui
des mammifères vu son importance dans la mesure des impacts de la
surveillance et/ou de la chasse au PNT. Les mammifères ont
été ensuite subdivisés en plusieurs sous-groupes
représentatifs. Ce regroupement s'est fait en tenant compte soit de la
forme des espèces, soit de la famille ou la sous-famille, soit du genre,
soit du mode de vie, etc. De ces sous-groupes, nous avons
considéré celui des singes et celui des antilopes. Ces choix se
justifient par le fait que :
· les primates et les antilopes sont de bons indicateurs
du niveau de braconnage dans les forêts tropicales et aussi de bons
indicateurs de bas niveau de troubles de la forêt (Thomas, 2005) ;
· les espèces les plus braconnées du PNT sont
les singes et les antilopes (Johannes et Koné, 2001 ; Seka et Kissi,
2002).
Au sein de ces deux sous-groupes, nous avons retenu une ou deux
espèces les plus abondantes et régulières dans les
secteurs.
3.2. Analyse qualitatives
Il s'agissait de savoir si la méthode a permis de
détecter la présence des espèces biomonitrices. Pour ce
faire, nous avons utilisé l'abondance, la richesse et la
diversité. La diversité est donnée ici par l'indice de
diversité de Simpson et le Ratio I.
· L'abondance relative est la proportion
que représente une espèce au sein de la population (Galat et
Galat, 1978).
· La richesse spécifique (R) est
nombre d'espèces d'une zone. Dans notre travail, il s'agit d'une
richesse relative puisque le recensement ne concerne pas toutes les
espèces.
· La diversité spécifique
est la manière dont les animaux sont répartis entre les
différentes espèces animales. Elle est donnée par
"l'indice de diversité de Simpson (DS)" qui est la
probabilité que deux éléments tirés au hasard dans
un peuplement appartiennent à des espèces différentes
(Scherrer, 1984). Cet indice est d'autant plus faible que la diversité
est faible. Il est donné par la formule suivante :
D S 1
1) 1)
R f f
(
?= -
k k
1 (
n n
k
DS : Indice de diversité de Simpson
fk : fréquence de l'espèce k
R : Richesse n :
fréquence totale
· Le ratio I qui est l'inverse de la
concentration est très souvent utilisé pour caractériser
la diversité. Il prend la valeur maximale R lorsque toutes les
espèces sont équifréquentes dans le peuplement (Scherrer,
1984).
(1 )
- DS
Les analyses qualitatives nous ont permis de déterminer
les espèces et groupes d'espèces dominantes.
3.3. Analyses quantitatives
Les analyses quantitatives nous permettent de savoir si la
méthode donne une idée de l'évolution quantitative des
populations animales du PNT. Pour y parvenir, nous avons
considéré les fréquences, les taux d'observation et les
densités. Les analyses ont été faites sous l'angle des
années et des secteurs.
· La fréquence qui
représente le nombre d'individus d'une espèce a été
calculée au niveau des secteurs et des années. Les
fréquences des secteurs ont été calculées en
considérant uniquement les années où les collectes de
données ont eu lieu dans tous les secteurs. Celles des années ont
été déterminées en ne considérant que les
secteurs qui ont été sondés depuis 1999.
· Le taux d'observation
représente ici le nombre d'individus vus par kilomètre parcouru.
Ce taux a été retenu pour deux raisons principales. D'abord, nous
voulons considérer toute la période de collectes et tous les
secteurs pour les comparaisons bien que les collectes n'aient pas
débuté au même moment dans tous les secteurs. Ensuite pour
le fait que nous nous sommes rendu compte que tous les transects n'ont pas
été toujours entièrement parcourus. A ce niveau, nous
avons fait une analyse de variances pour déceler les secteurs et les
années qui diffèrent significativement.
Avant de faire l'analyse de variances, nous avons fait un
test de Levene pour vérifier l'homoscédasticité de la
population; c'est-à-dire la normalité de la population. Si la
distribution de la population ne suit pas une loi normale (cas le plus
fréquent chez les animaux) (Bouché, 2001), nous faisons un test
de Kruskal-Wallis. Dans le cas contraire, nous faisons un test F de Fisher
(Scherrer, 1984 ; Ouellet, 2004). Si le test de Kruskal-Wallis ou de Fisher
montre qu'il y a une différence significative, nous utiliserons un GLM
(General Linear Model) pour faire la ségrégation des moyennes.
Pour les comparaisons multiples, nous avons opté pour le test T2 de
Tamhane quand les variances sont inégales et le test de Gabriel dans le
cas contraire. Ces deux tests sont adaptés aux données de tailles
inégales (Ouellet, 2004).
· La densité représente
le nombre d'individus par unité de surface. Le calcul de la
densité tient compte du nombre d'animaux, de la longueur du transect, de
la distance d'observation et l'angle d'observation.
n
D = D : densité (individus/ha) ;
n : nombre d'individus
S
S = 2.L.a S :
Superficie ; L : longueur du transect ;
a : demie largeur du transect
Les densités ont été calculées au
sein des secteurs III, IV et V. Les données recueillies dans les
secteurs I et II sont faibles et non régulières pour permettre le
calcul de densité.
4. CRITIQUES DU SYSTEME
Nous devons entendre par critiques du système, la
présentation des avantages ou forces et des faibles ou limites du
système. Dans cette partie, le paramètre que nous avons
calculé est le taux d'échantillonnage (E). Il représente
la superficie réellement sondée par rapport à la
superficie de la zone. Il se calcule par la formule suivante :
?= 1 ×
Si
n
i
E = 100
Z (Bouché, 2001)
E : taux d'échantillonnage (%)
n : nombre de superficie échantillonnées Si :
Superficie échantillonnée (km2)
Z : Superficie totale de la zone d'étude
(km2)
CHAPITRE 3 :
RESULTATS ET
DISCUSSION
1. ANALYSES DES RESULTATS DU SYSTEME
1.1. Analyse qualitative
1.1.1. Abondance relative
Plus de 90% de l'effectif des espèces sont donnés
par seulement que 15 d'entre elles (Tableau A1).
Les espèces les plus abondantes sont le
cercopithèque Diane (Cercopithecus diana diana) (plus de 23%),
le colobe bai (Piliocolobus badius badius) (15%), le cercocèbe
enfumé (Cercocebus atys atys) (9%) et le cercopithèque
pétauriste (Cercopithecus petaurista) (8,63%). Le
cercopithèque Mone (Cercopithecus mona lowei) (4.35%) vient
après le grand calao à casque noir (Ceratogymna atrata)
(4,97%) et le touraco géant (Corythaeola cristata) (4,51%)
(Tableau A1).
Le céphalophe de Maxwell (Cephalophus
maxwelli) (1,86%) est l'antilope la plus représentée. Les
grands mammifères tels que le buffle de forêt (Syncerus caffer
nanus), l'éléphant de forêt (Loxodonta africana
cyclotis), le bongo (Tragelaphus euryceros), le léopard
(Panthera pardus leopardus), l'hippopotame nain (Choeropsis
liberiensis), le potamochère (Potamochoerus porcus porcus)
et l'hylochère (Hylochoerus meinhertzhageni) sont en nombre
très réduit. Le chimpanzé (Pan troglodytes verus)
est également en faible nombre.
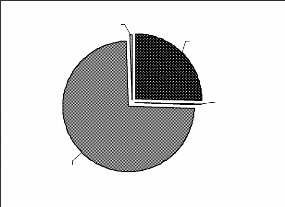
La répartition des animaux entre les quatre grands groupes
d'animaux considérés donne la figure 7.
Mammifères
73,98%
Reptiles
0,43%
Oiseaux
25,30%
Gasteropodes
0,28%
Figure 7 : Répartition des fréquences entre
les grands groupes d'animaux
Les mammifères et les oiseaux sont les plus nombreux.
Les gastéropodes et les reptiles ne représentent qu'une infime
proportion des effectifs (Figure 7). Cette disproportion est due d'une part aux
proportions initialement considérées (Figure 5) et d'autre part
à la forme de vie clandestine des gastéropodes et des reptiles
(Joseph, 2001 ; Mané et Trape, 2002).
De ces quatre groupes, nous avons retenu celui des
mammifères. En faisant une répartition des mammifères en
sous-groupes, nous obtenons la figure 8.
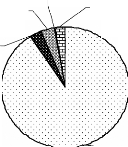
Grands
mammifères;
0,25%
Antilopes; 3,36%
Autres
mammifères;
2,54%
Autres primates;
3,11%
Singes; 90,74%
Figure 8 : Répartition des fréquences entre
les groupes de mammifères
Les mammifères sont dominés par les singes. Ils
représentent plus de neuf fois l'effectif total des autres. Les autres
mammifères ne sont que très faiblement
représentés.
La forte domination des singes s'expliquerait par le nombre
d'individus élevé par groupe (Galat et Galat, 1978 ; Refisch et
Koné, 2001). A cela, nous pouvons ajouté les conditions propices
à leur développement (stabilité, habitat favorable) par
rapport aux zones périphériques. Comme autre raison, il y a les
surestimations des effectifs de ces animaux dans certains comptages (Gerhard,
2004).
Le faible nombre des autres s'expliquerait par le nombre
d'individus peu élevé par communauté (Newing, 1979 ;
Bourgarel et al., 2000). Il y a aussi la forme de vie de bon nombre
d'entre eux qui sont plus actifs la nuit que le jour (Kingdon, 1997 ; Bourgarel
et al., 2000). Les grands mammifères tels Choeropsis
liberiensis, aiment se cacher dans les zones marécageuses (Harald
et al., 1996).
1.1.2. Richesse spécifique
Les animaux étant mobiles, il arrive que le nombre
d'espèces rencontrées dans la même zone (richesse) varie au
cours du temps. Les richesses spécifiques des différents secteurs
sont consignées dans le tableau 1.
Tableau 1 : Richesse spécifique
|
Année Secteur
|
1999
|
2000
|
2001
|
2002
|
2003
|
2004
|
2005
|
Moyenne
|
Totale espèces rencontrées
|
|
I
|
|
28
|
31
|
35
|
11
|
45
|
32
|
30,33
|
52
|
|
II
|
|
|
|
|
19
|
32
|
20
|
23,67
|
49
|
|
III
|
40
|
51
|
47
|
42
|
50
|
57
|
60
|
49,57
|
64
|
|
IV
|
37
|
53
|
43
|
43
|
31
|
37
|
31
|
39,29
|
63
|
|
V
|
43
|
45
|
52
|
46
|
33
|
40
|
36
|
42,14
|
58
|
|
Moyenne
|
40
|
44,25
|
43,25
|
41,5
|
28,8
|
42,2
|
35,8
|
37,00
|
|
|
Totale espèces rencontrées
|
55
|
67
|
65
|
59
|
56
|
67
|
66
|
|
72
|
Les secteurs les plus riches sont le secteur III (50
espèces en moyenne), le secteur IV (39 espèces) et le secteur V
(42 espèces). Les secteurs I (30 espèces) et II (24
espèces) sont les plus pauvres. Les écarts entre les richesses
totales et les moyennes montrent que ce ne sont pas toujours les mêmes
espèces qui sont rencontrées. Ce constat est plus perceptible
dans les secteurs I, II et IV. Les variations sont moindres dans le secteur
III.
Les secteurs III, IV et V sont des zones plus stables
comparativement aux secteurs I et II (Hoppe-Dominik, 1998 ; Gerhard, 2004).
L'exploitation forestière qu'a connue le secteur III il y a de cela
trois décennies aurait créé des conditions favorables
à la vie des diverses espèces. Newing en 1994 et Hoppe-Dominik en
1996 en sont arrivés à la même conclusion. Pour
apprécier la répartition des fréquences des populations au
sein des espèces, nous avons déterminé les
diversités.
1.1.3. Diversité spécifique
Les diversités sont données par les indices de
diversité de Simpson (Tableau 2).
Les diversités sont plus élevées dans les
secteurs II et III. Le secteur IV connaît les diversités les plus
faibles. Les animaux sont équitablement mieux repartis entre les
espèces dans les secteurs II et III. En revanche, le secteur IV est
dominé par quelques espèces de singes. Il en est de même du
secteur V (Annexe 3).
Tableau 2 : Indice de diversité de
Simpson
|
Année
|
Secteur
|
|
I
|
II
|
III
|
IV
|
V
|
|
1999
|
|
|
0,925
|
0,816
|
0,878
|
|
2000
|
0,769
|
|
0,914
|
0,814
|
0,857
|
|
2001
|
0,810
|
|
0,931
|
0,791
|
0,884
|
|
2002
|
0,917
|
|
0,920
|
0,834
|
0,897
|
|
2003
|
0,915
|
0,876
|
0,937
|
0,766
|
0,875
|
|
2004
|
0,874
|
0,942
|
0,925
|
0,785
|
0,888
|
|
2005
|
0,880
|
0,923
|
0,925
|
0,805
|
0,894
|
|
Moyenne
|
0,861
|
0,914
|
0,925
|
0,799
|
0,883
|
La diversité étant corrélée au ratio
I, pour mieux apprécier les variations, nous avons utilisé ce
dernier (Tableau 3).
Tableau 3 : Ratio I
|
Année
|
Secteur
|
|
I
|
II
|
III
|
IV
|
V
|
|
1999
|
|
|
8,206
|
4,336
|
11,689
|
|
2000
|
4,336
|
|
11,689
|
5,367
|
6,972
|
|
2001
|
5,267
|
|
14,590
|
4,789
|
8,652
|
|
2002
|
12,060
|
|
12,512
|
6,035
|
9,756
|
|
2003
|
11,794
|
8,080
|
15,949
|
4,280
|
7,983
|
|
2004
|
7,948
|
17,173
|
13,381
|
4,661
|
8,933
|
|
2005
|
8,312
|
12,967
|
13,249
|
5,137
|
9,466
|
|
Moyenne
|
8,286
|
12,740
|
13,562
|
5,045
|
8,627
|
Les moyennes varient de 5,045 à 13,562. Elles sont
très faibles par rapport à la valeur maximale qui est de 72. Ces
écarts signifient que les animaux sont concentrés au sein de plus
ou moins quelques espèces pour tous les secteurs.
Les variations du ratio I au niveau des secteurs sont plus
nettes dans les secteurs I et II. Les ratios I sont presque constants dans les
trois autres secteurs. Il y a donc presque une constance dans la
répartition des populations au sein des espèces dans ces trois
secteurs (III, IV et V). Par contre, les premiers comptages ont donné
des populations concentrées au sein de quelques espèces dans les
secteurs I et II.
1.2. Analyses quantitatives
1.2.1. Analyse par années
1.2.1.1. Fréquences annuelles de toutes les
espèces
Les fréquences de toutes les espèces biomonitrices
sont données par la figure 9.
25000
20000
35000
30000
15000
10000
5000
0
1999 2000 2001 2002 2003 2004 2005
Année
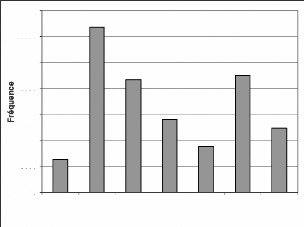
Figure 9 : Evolution des fréquences de toutes les
espèces biomonitrices
Les fréquences les plus élevées sont
celles de 2000 et de 2001. L'année 2003 a la plus faible
fréquence. L'évolution de ces fréquences montre une forte
augmentation de 1999 à 2000 puis une baisse de 2001 jusque en 2003. Il y
a une nouvelle hausse en 2004 puis une chute en 2005.
La faible fréquence de 1999 s'expliquerait par la mise
en place du système ; et donc sa non maîtrise. La fréquence
très élevée de 2000 s'expliquerait par deux raisons
essentielles. D'abord l'engouement que les collecteurs de données
avaient à bien travailler, ensuite la surestimation des effectifs des
groupes de singes (PNT, 2002) qui représentent 58% à 72% des
effectifs (Tableau A1). La moyenne des groupes de singes était de 16,25
individus en cette année.
La baisse de 2001 à 2002 serait le fait de la
réadaptation de la méthode avec une estimation des effectifs
revue à la baisse (PNT, 2002). Les groupes de singes faisant en moyenne
11,07 individus en 2001. Cette baisse se justifierait aussi par le manque
d'engouement des collecteurs de données au travail. Ces derniers ne
percevaient pas régulièrement leur salaire du fait de la fin de
la première phase du projet PACPNT. Pour ce qui est de 2003, la faible
fréquence est due en grande partie à la guerre qu'a connue la
Côte-d'Ivoire en septembre 2002. La guerre a causé l'interruption
des travaux dans tous les secteurs durant les six
premiers mois de l'année 2003. A cela, s'ajoute le taux
de braconnage qui aurait augmenté après l'arrêt des
hostilités et avant la reprise des travaux de surveillance (N'Goran,
2004). Cela a sûrement rendu les animaux tels que les singes et les
antilopes plus craintifs.
L'arrêt des hostilités en Côte-d'Ivoire et
la reprise des activités de surveillance et de collecte des
données ont permis de rehausser le niveau en 2004. La fréquence
peu élevée de 2005 s'explique par le fait que les travaux n'ont
porté que sur la moitié de l'année (janvier à
juin).
1.2.1.2. Comparaison des années pour toutes les
espèces
Le test de Levene (Tableau A3) ayant montré que la
distribution de la population ne suit pas une loi normale, nous avons fait un
test de Kruskal-Wallis (Tableau A4). La comparaison des années a
montré une différence significative entre elles (p = 0,000). Cela
nous a conduit à faire un test de ségrégation des moyennes
pour situer les différences significatives (Tableau 4).
Tableau 4 : Comparaisons des taux d'observations des
années par paire
|
(I) ANNÉE
|
(J) ANNÉE
|
Différence des
moyennes (I-J)
|
Erreur
standard
|
Signification
|
|
1999
|
2000
|
-1,651(*)
|
0,1507
|
0,000
|
|
2001
|
-,838(*)
|
0,1158
|
0,000
|
|
2002
|
-,349(*)
|
0,1142
|
0,047
|
|
2003
|
-0,284
|
0,1097
|
0,184
|
|
2004
|
-,366(*)
|
0,0967
|
0,003
|
|
2005
|
-,522(*)
|
0,1097
|
0,000
|
|
2000
|
2001
|
,813(*)
|
0,1471
|
0,000
|
|
2002
|
1,302(*)
|
0,1459
|
0,000
|
|
2003
|
1,367(*)
|
0,1423
|
0,000
|
|
2004
|
1,285(*)
|
0,1326
|
0,000
|
|
2005
|
1,129(*)
|
0,1424
|
0,000
|
|
2001
|
2002
|
,489(*)
|
0,1095
|
0,000
|
|
2003
|
,554(*)
|
0,1047
|
0,000
|
|
2004
|
,472(*)
|
0,09 10
|
0,000
|
|
2005
|
0,316
|
0,1047
|
0,052
|
|
2002
|
2003
|
0,065
|
0,1030
|
1,000
|
|
2004
|
-0,017
|
0,0890
|
1,000
|
|
2005
|
-0,173
|
0,1030
|
0,871
|
|
2003
|
2004
|
-0,081
|
0,0831
|
1,000
|
|
2005
|
-0,238
|
0,0979
|
0,274
|
|
2004
|
2005
|
-0,156
|
0,0831
|
0,726
|
* différence significative au seuil 5%
Les comparaisons appariées des moyennes des taux
d'observations montrent bien que les
années 1999, 2000 et 2001 sont
significativement différentes des autres années mais
également entre elles. En revanche, les différences
entre 2001 et 2005, entre 1999 et 2003 ne sont pas significatives. Il en est de
même pour les années 2002, 2003, 2004 et 2005.
Ceci dit, nous allons porter un regard sur les espèces les
plus braconnées que sont les singes et les antilopes.
1.2.1.3. Fréquences annuelles des singes et
antilopes
A ce niveau, nous avons considéré les
espèces les plus abondantes. Les figures 10 et 11 donnent les
espèces dominantes de chacun de ces groupes d'espèces. Les singes
sont dominés par Cercopithecus diana diana (34,93%) et
Piliocolobus badius badius (23,04%). Quant aux antilopes, elles sont
fortement dominées par Cephalophus maxwelli (82,84).
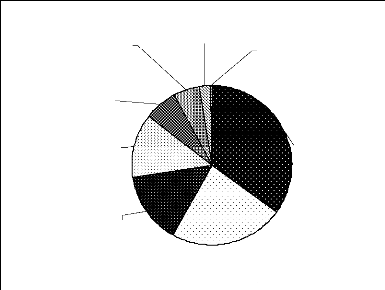
Cercopithecus
mona; 6,59%
Cercopithecus
petaurista;
13,07%
Colobus
polykomos
polykomos;
5,39%
Cercocebus
atys atys;
14,48%
Colobus verus;
2,29%
Piliocolobus
badius badius;
23,04%
Cercopithecus
nictitans;
0,20%
Cercopithecus
diana diana;
34,93%
Figure 10 : Répartition des fréquences
des singes entre les espèces

Neotra gus
pygmaeus;
2,65%
Cephalophus
olgilby;
3,14%
Cephalophus
niger; 5,60%
Cephalophus zebra; 2,61%
Hyemoschus
aquaticus;
1,82%
Tragelaphus
scriptus
scriptus;
1,02%
Cephalophus
silviculto r;
0,61%
Cephalophus
jentenki;
0,72%
Cephalophus
maxwelli;
8 1,84%
Figure 11 : Répartition des fréquences
des antilopes entre les espèces
Les fréquences de ces espèces sont
présentées par les figures 12, 13 et 14.
Les allures sont similaires à l'évolution
donnée par toutes les espèces regroupées (Figure 9). Cette
similarité s'explique par les raisons évoquées dans le cas
de toutes les espèces. A cela s'ajoute le fait que C. diana diana
et P. badius badius sont les espèces les plus
dominantes.
|
9000
8000
7000
6000
5000
4000
3000
2000
1000
0
|
|
1999 2000 2001 2002 2003 2004 2005
Année
Figure 12 : Evolution des fréquences de
Cercopithecus diana diana
4000
2000
6000
5000
3000
1000
0
1999 2000 2001 2002 2003 2004 2005
Année
Figure 13 : Evolution des fréquences de
Piliocolobus badius badius
400
600
500
300
200
100
0
1999 2000 2001 2002 2003 2004 2005
Année
Figure 14 : Evolution des fréquences de
Cephalophus maxwelli
1.2.1.4. Comparaison des années pour les singes et
antilopes
La comparaison des années s'est faite sur la base des
taux d'observation. Ces taux ont porté sur les trois espèces
sus-considérées. Ici également, le test
d'homoscédasticité (Tableau A3) a montré que les
populations ne sont pas normalement distribuées (p=4,551
E-19) . Nous avons donc fait un test de Kruskal-Wallis (Tableau A4).
Ce test a montré des différences significatives (p=0,04) entre
les années pour chacune des trois espèces. Pour mettre en
exergue les années qui sont significativement
différentes, nous avons fait des comparaisons appariées (Tableaux
5, 6 et 7).
Tableau 5 : Comparaison par paires des taux
d'observations de Cercopithecus diana
diana des
années
|
(I) ANNÉE
|
(J) ANNÉE
|
Différence
des
moyennes
(I-J)
|
Erreur
standard
|
Signification
|
|
2000
|
-4,8479(*)
|
0,8499 1
|
0,000
|
|
2001
|
-1,576
|
0,6405
|
0,267
|
|
2002
|
0,4825
|
0,5542
|
1,000
|
|
1999
|
|
|
|
|
|
2003
|
0,1275
|
0,58999
|
1,000
|
|
2004
|
-0,1468
|
0,53936
|
1,000
|
|
2005
|
-0,8211
|
0,61206
|
0,985
|
|
2001
|
3,2719(*)
|
0,78768
|
0,001
|
|
2002
|
5,3304(*)
|
0,71927
|
0,000
|
|
2000
|
2003
|
4,9754(*)
|
0,74719
|
0,000
|
|
2004
|
4,7011(*)
|
0,70789
|
0,000
|
|
2005
|
4,0269(*)
|
0,76473
|
0,000
|
|
2002
|
2,0585(*)
|
0,45303
|
0,000
|
|
2001
|
2003
|
1,7035(*)
|
0,49617
|
0,014
|
|
2004
|
1 ,4292(*)
|
0,43474
|
0,023
|
|
2005
|
0,7549
|
0,52222
|
0,966
|
|
2003
|
-0,355
|
0,37827
|
1,000
|
|
2002
|
2004
|
-0,6293
|
0,29309
|
0,498
|
|
2005
|
-1,3036(*)
|
0,41183
|
0,036
|
|
2003
|
2004
|
-0,2742
|
0,35616
|
1,000
|
|
2005
|
-0,9485
|
0,45887
|
0,574
|
|
2004
|
2005
|
-0,6743
|
0,39163
|
0,851
|
* différence significative au seuil 5%
Tableau 6 : Comparaison par paires des taux
d'observations de Piliocolobus badius
badius des
années
|
(I) ANNÉE
|
(J) ANNÉE
|
Différence
des
moyennes
(I-J)
|
Erreur
standard
|
Signification
|
|
2000
|
-4,4568(*)
|
1,8240
|
0,0287
|
|
2001
|
0,5869
|
1,3104
|
1,000
|
|
1999
|
2002
|
2,9956
|
1,2062
|
0,310
|
|
2003
|
2,3302
|
1,2472
|
0,775
|
|
2004
|
2,4502
|
1,1998
|
0,646
|
|
2005
|
2,4479
|
1,2502
|
0,706
|
|
2001
|
5,0437(*)
|
1,5416
|
0,027
|
|
2002
|
7,4524(*)
|
1,4541
|
0,000
|
|
2000
|
2003
|
6,7871(*)
|
1,4882
|
0,000
|
|
2004
|
6,9071(*)
|
1,4488
|
0,000
|
|
2005
|
6,9048(*)
|
1,4908
|
0,000
|
|
2002
|
2,4087(*)
|
0,7103
|
0,017
|
|
2001
|
2003
|
1,7434
|
0,7778
|
0,425
|
|
2004
|
1,8634
|
0,6994
|
0,160
|
|
2005
|
1,861
|
0,7827
|
0,322
|
|
2003
|
-0,6653
|
0,5855
|
0,998
|
|
2002
|
2004
|
-0,5453
|
0,4765
|
0,998
|
|
2005
|
-0,5477
|
0,5921
|
1,000
|
|
2003
|
2004
|
0,1200
|
0,5722
|
1,000
|
|
2005
|
0,1177
|
0,6715
|
1,000
|
|
2004
|
2005
|
-0,0023
|
0,5789
|
1,000
|
* différence significative au seuil 5%
Tableau 7 : Comparaison par paires des taux
d'observations de Cephalophus maxweii
des années
|
(I) ANNÉE
|
(J) ANNÉE
|
Différence
des
moyennes
(I-J)
|
Erreur
standard
|
Signification
|
|
2000
|
-,1851(*)
|
0,0496
|
0,005
|
|
2001
|
-0,1442
|
0,0482
|
0,061
|
|
1999
|
2002
|
-0,0928
|
0,0573
|
0,906
|
|
2003
|
0,0372
|
0,0425
|
1,000
|
|
2004
|
0,012
|
0,0420
|
1,000
|
|
2005
|
0,0182
|
0,0440
|
1,000
|
|
2001
|
0,0409
|
0,0558
|
1,000
|
|
2002
|
0,0923
|
0,0638
|
0,966
|
|
2000
|
2003
|
,2222(*)
|
0,0510
|
0,000
|
|
2004
|
,1971(*)
|
0,0506
|
0,002
|
|
2005
|
,2033(*)
|
0,0522
|
0,003
|
|
2002
|
0,0514
|
0,0627
|
1,000
|
|
2001
|
2003
|
,1813(*)
|
0,0496
|
0,007
|
|
2004
|
,1562(*)
|
0,0492
|
0,034
|
|
2005
|
,1624(*)
|
0,0509
|
0,034
|
|
2003
|
0,1299
|
0,0585
|
0,439
|
|
2002
|
2004
|
0,1048
|
0,0581
|
0,794
|
|
2005
|
0,111
|
0,0596
|
0,748
|
|
2003
|
2004
|
-0,0251
|
0,0436
|
1,000
|
|
2005
|
-0,0189
|
0,0455
|
1,000
|
|
2004
|
2005
|
0,0062
|
0,0451
|
1,000
|
* différence significative au seuil 5%
Ces comparaisons donnent, au niveau des deux espèces de
singes, des résultats presque identiques à ceux de toutes les
espèces regroupées. Cependant, il y a des variations importantes
avec C. maxwelli. Pour cette espèce, les différences ne
sont pas significatives entre l'année 2002 et toutes les autres
années. Il en est de même des différences entre les
années 1999, 2003, 2004 et 2005. En revanche, les années 2000 et
2001 diffèrent significativement du reste des autres années.
Cette situation serait provoquée par la guerre qui avait favorisé
le braconnage en 2003 et dont les conséquences se font ressentir sur les
autres années.
1.2.2. Analyse par secteur
1.2.2.1. Fréquences des secteurs pour toutes les
espèces
Les fréquences des secteurs sont données par la
Figure 15.
Les animaux sont plus nombreux dans les secteurs IV et III. Les
secteurs I et II ont des
fréquences très faibles. L'abondance
des animaux dans les secteurs III et IV s'expliquerait par
la
présence très marquée des singes ; mais également
par la stabilité de ces zones (braconnage
peu intense). Les très faibles fréquences des
secteurs I et II s'expliqueraient par les effets du braconnage intense. Les
animaux de ces zones sont craintifs et peu nombreux (Newing, 1994 ;
Hoppe-Dominik, 1998 ; Gerhard, 2004). Ils ont sûrement migrés vers
des zones plus stables. Le braconnage peut être à la base de la
faible fréquence du secteur V (Hoppe-Dominik, 1995)
|
25000
20000
15000
10000
5000
0
|
|
I II III IV V
Secteur
Figure 15: Répartition des fréquences de
toutes les espèces biomonitrices par secteur
1.2.2.2. Comparaison des secteurs pour toutes les
espèces
La comparaison des secteurs par le test de Kruskal-Wallis
montre qu'il y a une différence significative entre eux (Tableau A4).
Une comparaison appariée de ces secteurs (Tableau 8) montre qu'ils sont
significativement différents les uns des autres.
Tableau 8 : Comparaisons par paires des taux
d'observations des secteurs
|
(I)
SECTEUR
|
(J)
SECTEUR
|
Différence des
moyennes (I-J)
|
Erreur
standard
|
Signification
|
|
I
|
II
|
0,191(*)
|
0,0602
|
0,015
|
|
III
|
-0,798(*)
|
0,0585
|
0,000
|
|
IV
|
-2,822(*)
|
0,1039
|
0,000
|
|
V
|
-0,132(*)
|
0,0468
|
0,047
|
|
II
|
III
|
-0,988(*)
|
0,06 13
|
0,000
|
|
IV
|
-3,013(*)
|
0,1056
|
0,000
|
|
V
|
-0,323(*)
|
0,0504
|
0,000
|
|
III
|
IV
|
-2,025(*)
|
0,1046
|
0,000
|
|
V
|
0,665(*)
|
0,0483
|
0,000
|
|
IV
|
V
|
2,690(*)
|
0,0986
|
0,000
|
* différence significative au seuil de 5%
Comme dans le cas des années, nous avons ouvert une
lucarne sur les singes et les antilopes pour avoir les tendances
spécifiques.
1.2.2.3. Fréquences des singes et des antilopes
dans les secteurs
La répartition des fréquences des trois
espèces sont données par les Figures 16, 17 et 18.
Les singes ne sont presque pas rencontrés dans les
secteurs I et II. Ils sont en revanche très nombreux dans le secteur IV.
C. badius se rencontre presque exclusivement dans le secteur IV. Les
tendances sont identiques avec C. maxwelli. Cependant les
écarts sont moins marqués entre les secteurs III, IV et V.
La répartition de ces fréquences confirme
l'influence du braconnage dans les secteurs I et II. Newing (1994) a
montré que les C. maxwelli avaient une préférence
prononcée pour la forêt primaire (secteurs IV et V) que pour la
forêt secondaire (secteur III).
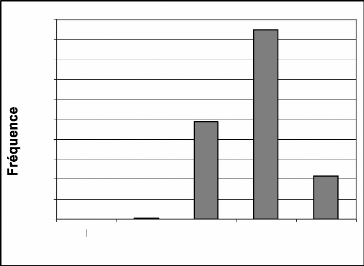
I II III IV V
Secteur
500
0
5000
4500
4000
3500
3000
2500
2000
1500
1000
Figure 16 : Répartition des fréquences de
Cercopithecus diana diana par secteur
|
6000
5000
4000
3000
2000
1000
0
|
|
I II III IV V
Secteur
Figure 17 : Répartition des fréquences de
Piiocolobus badius badius par secteur
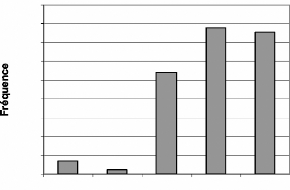
I II III IV V
900
800
700
600
500
400
300
200
100
0
Secteur
Figure 18 : Répartition des fréquences de
Cephalophus maxweii par secteur
1.2.2.4. Comparaison des secteurs pour les singes et
antilopes
La comparaison (Tableau A4) des secteurs a montré qu'il y
a des différences significatives entre eux pour chacune des trois
espèces (p = 3,980e-14).
Les comparaisons appariées (Tableaux 9, 10 et 11)
donnent des résultats presque similaires à celles de toutes les
espèces regroupées. Cependant, les différences entre les
secteurs I et II ne sont pas significatives pour les trois espèces.
Tableau 9: Comparaison par paires des taux d'observations
de Cercopithecus diana diana des secteurs
|
(I)
SECTEUR
|
(J)
SECTEUR
|
Différence
des
moyennes
(I-J)
|
Erreur
standard
|
Signification
|
|
II
|
0,7639
|
0,2789
|
0,131
|
|
III
|
-3,2389(*)
|
0,3028
|
0,000
|
|
I
|
IV
|
-7,1048(*)
|
0,4086
|
0,000
|
|
V
|
-1,7042(*)
|
0,2308
|
0,000
|
|
III
|
-4,0028(*)
|
0,2900
|
0,000
|
|
II
|
IV
|
-7,8687(*)
|
0,3992
|
0,000
|
|
V
|
-2,4681(*)
|
0,2136
|
0,000
|
|
IV
|
-3,8659(*)
|
0,4163
|
0,000
|
|
III
|
V
|
1,5347(*)
|
0,2440
|
0,000
|
|
IV
|
V
|
5,4006(*)
|
0,3672
|
0,000
|
* différence significative au seuil 5%
Tableau 10 : Comparaison par paires des taux
d'observations de Piliocolobus badius badius des secteurs
|
(I)
SECTEUR
|
(J)
SECTEUR
|
Différence
des
moyennes
(I-J)
|
Erreur
standard
|
Signification
|
|
II
|
-0,3886
|
0,1818
|
0,324
|
|
I
|
III
|
-2,3264(*)
|
0,4278
|
0,000
|
|
IV
|
-8,6064(*)
|
0,4493
|
0,000
|
|
V
|
-1,8949(*)
|
0,1669
|
0,000
|
|
III
|
-1,9378(*)
|
0,4324
|
0,000
|
|
II
|
IV
|
-8,2178(*)
|
0,4537
|
0,000
|
|
V
|
-1,5063(*)
|
0,1783
|
0,000
|
|
III
|
IV
|
-6,2800(*)
|
0,5965
|
0,000
|
|
V
|
0,4315
|
0,4263
|
0,977
|
|
IV V
|
6,7115(*)
|
0,4479
|
0,000
|
* différence significative au seuil 5%
Tableau 11 : Comparaison par paires des taux
d'observations de Cephalophus maxweii
des secteurs
|
(I)
SECTEUR
|
(J)
SECTEUR
|
Différence
des
moyennes
(I-J)
|
Erreur
standard
|
Signification
|
|
II
|
-0,0433
|
0,0484
|
0,992
|
|
I
|
III
|
-,0968(*)
|
0,0315
|
0,024
|
|
IV
|
-,2316(*)
|
0,0309
|
0,000
|
|
V
|
-,4218(*)
|
0,0448
|
0,000
|
|
III
|
-0,0535
|
0,0492
|
0,967
|
|
II
|
IV
|
-,1884(*)
|
0,0489
|
0,009
|
|
V
|
-,3786(*)
|
0,0586
|
0,000
|
|
III
|
IV
|
-,1348(*)
|
0,0321
|
0,000
|
|
V
|
-,3250(*)
|
0,0456
|
0,000
|
|
IV
|
V
|
-,1902(*)
|
0,0452
|
0,000
|
* différence significative au seuil 5%
Les secteurs I et II, situés du côté Est
du PNT, sont soumis aux mêmes pressions de braconnage. Pour ce qui est du
secteur IV, la présence de chercheurs dans la zone a joué en
faveur de celui-ci. Certaines espèces de singes y
bénéficient d'un programme d'habituation à l'homme. Cette
présence y a limité l'intensité du braconnage
(Hoppe-Dominik, 1996).
1.2.3. Densités
Rappelons que pour l'analyse des densités, nous n'avons
considéré que les secteurs III, IV et V. Nous avons tracés
les courbes évolutives des densités de ces secteurs (Figure 19,
20 et 21) pour trois espèces. Il s'agit notamment de C. diana
diana, P. badius badius et C. maxwelli.
1.2.3.1. Densités de Cercopithecus diana
diana
Du point de vue des secteurs, les densités sont plus
élevées dans le secteur IV que dans les deux autres secteurs
(Figure 19). Elles font plus du triple de celle des autres secteurs.
Dans le secteur IV, les densités de C. diana
diana varient entre 2,10 et 4,67 (Tableau A11). Elles sont comprises entre
0,72 et 1,43 dans le secteur V et entre 0,52 et 1,80 dans le secteur III.
Nous obtenons les mêmes tendances que Gerhard (2004).
Cependant il y a quelques des écarts entre les chiffres. En revanche,
nos chiffres sont proches des résultats obtenus par Refisch et
Koné en 2001 dans des zones des secteurs IV et V.
En considérant les années, nous retenons que les
densités évoluent en dents de scie au sein de
tous les
secteurs. Les densités des trois secteurs ont connu une hausse de 1999
à 2000. Par la
suite, elles ont fortement régressées jusqu'en
2003 pour connaître une nouvelle hausse à partir de 2004.
Les difficultés de 2002 auraient eu un impact sur ces
densités. Soit, le manque de surveillance a favorisé un intense
braconnage, soit le manque d'engouement au travail des collecteurs de
données a donné des résultats erronés. Le
braconnage, favorisé par la guerre, expliquerait les faibles
densités de 2003.
1999 2000 2001 2002 2003 2004 2005
Année
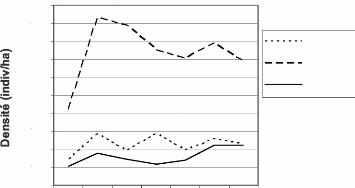
Secteur V Secteur IV Secteur III
5
4,5
4
3,5
3
2,5
2
1,5
1
0,5
0
Figure 19 : Evolution des densités de
Cercopithecus diana diana dans
les secteurs III, IV et
V
1.2.3.2. Densités de Piliocolobus badius
badius
L'évolution des densités de Piliocolobus
badius badius (Figure 20) donne presque les mêmes tendances que
C. diana diana. Le secteur IV est hautement plus dense que les deux
autres secteurs. Les densités des deux autres secteurs sont quasi
stables avec une légère tendance à la baisse depuis 2004.
L'évolution des densités des secteurs traduit l'effet de la
guerre de 2002 sur le PNT.
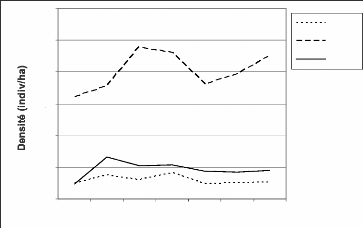
1999 2000 2001 2002 2003 2004
2005Année
Secteur V
Secteur IV
Secteur III
3
2,5
2
1,5
1
0,5
0
Figure 20 : Evolution des densités de
Piliocolobus badius badius
dans les secteurs III, IV et
V
1.2.3.3. Densités de Cephalophus
maxwelli
Les densités de Cephalophus maxwelli (Figure
21) sont plus faibles (0,27) comparativement aux singes. Du point de vu des
secteurs, le secteur V est le plus dense. Comme dans le cas des singes, le
secteur III demeure le moins dense. Les chiffres sont proches de ceux obtenus
par Gerhard en 2004. Les observations indirectes faites par Hoppe-Dominik
(1997) ont donné des résultats proches. Newing (1994) avait
trouvé des densités de 102 individus/km2 dans la
région du secteur IV.
Du point de vu des années, les densités
connaissent des variations. Dans le secteur V, La densité augmente de
1999 à 2001 puis chute. A l'inverse, elle connaît une augmentation
continuelle depuis 1999 dans le secteur IV. Le secteur III, pour sa part, a
connu une baisse graduelle de 1999 à 2002 puis une hausse de 2003
à 2005.
La baisse des densités de 2003 dans les secteurs III et
V serait à l'actif du braconnage. Quant à la hausse dans le
secteur IV, elle peut se traduire par une hausse de la population dans ce
secteur (Hoppe-Dominik, 1999). La rupture de cette croissance en 2003 peut
être l'effet du braconnage favorisé par la guerre de septembre
2002.
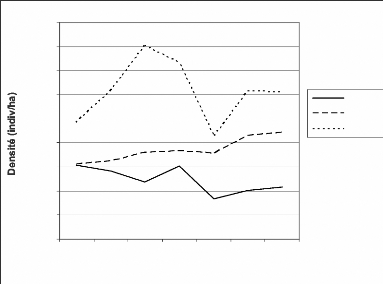
0,45
0,35
0,25
0,15
0,05
0,4
0,3
0,2
0,1
0
1999 2000 2001 2002 2003 2004 2005
Année
Secteur III Secteur IV Secteur V
Figure 21 : Evolution des densités de
Cephalophus maxweii dans les secteurs III, IV et V
2. AVANTAGES DU SYSTEME
Le système de biomonitoring du Parc National de
Taï comporte quelques points forts qui méritent d'être
signalés. Il s'agit entre autre de la méthode de collecte des
données, du personnel et des périodes de collecte des
données.
· La méthode « Distance sampling » est
la méthode la plus utilisée pour le biomonitoring des animaux
(Newing, 1994 ; Southwood, et Henderson, 2001 ; Thomas, 2005). De bons
résultats sont obtenus comme ce fut le cas au Burkina avec Michel (1999)
et Chardonnet (2000) pour le comptage des Loxodonta africana. Gaidet
(2002) a montré que le comptage des animaux à pied donnait de
meilleurs résultats surtout en zone fermée. Cependant cette
méthode demande beaucoup de précision dans la mensuration des
distances et angles (Buckland et al., 1993). ;
· L'utilisation d'anciens braconniers pour la collecte
de données contribue, un temps soit peu, à la lutte contre le
braconnage. Cela participe également à l'intégration des
populations riveraines à la gestion du PNT (Gaidet et al.,
2002) ;
· Les observations diurnes et nocturnes permettent de
prendre en compte une large gamme d'espèces animales ayant des
périodes d'activité différentes (Newing, 1994 ; Hoppe-
Dominik, 1998 ; Gaidet et al., 2002). Cependant, les
comptages de 10 heures et 15 heures peuvent provoquer des
répétitions surtout chez les singes qui ont une forte
activité dans la journée ;
· La prise en compte de 75 espèces, permet de
constituer une importante base de données pouvant servir à
diverses utilisations.
Cependant, ce système regorge de nombreuses insuffisances
qui le fragilisent en divers points.
3. LIMITES DU SYSTEME
3.1. Au niveau du design
· La disposition des secteurs ne permet pas d'extrapoler
les résultats à tout le PNT. N'Goran (2004) l'a souligné
dans ses analyses spatiales (Annexe 9). Les données recueillies dans les
secteurs périphériques ne sauraient être
généralisées à l'ensemble du PNT, du moment
où l'on ne dispose d'aucune information sur sa partie centrale. Pour
pallier cette situation, il faudra disposer un ou deux secteurs au centre du
PNT en maintenant les superficies des autres. Une augmentation des superficies
des secteurs actuels permettrait de couvrir tout le PNT (Figure 22) ;
· La disposition pêle-mêle des transects
(Figure 7) peut être source de biais dans les comptages. L'orientation de
tous les transects dans la même direction donnerait de meilleurs
résultats (Bouché, 2001). Ces transects seront
séparés d'une distance d'un kilomètre et regroupés
par quatre. La distance entre les groupes peut varier de cinq à dix
kilomètres (Figure 22). Les longueurs des transects peuvent être
maintenues (4 km). Deux groupes de quatre transects seront parcourus par mois.
Chaque transect sera l'objet de deux contrôles (7h 30min et 19h 00 min)
;
· Le taux d'échantillonnage qui représente
la superficie réellement parcourue par rapport à la superficie de
la zone est faible (0,28%). Ce taux doit être généralement
proche de 5% pour de grandes superficies (quelques milliers de km2)
(Bouché, 2001). La visibilité étant limitée (40m),
une augmentation du nombre de transects palliera cette insuffisance.
Tableau 12: Taux d'échantillonnage
|
Zone
|
Superficie
(km2)
|
Longueur
transect (km)
|
Largeur
moyenne
transect (km)
|
Nombre de
transects
|
Taux
d'échantil-
lonage (%)
|
|
Secteur I
|
354,26
|
4
|
0,04
|
6
|
0,27%
|
|
Secteur II
|
418,62
|
4
|
0,04
|
6
|
0,23%
|
|
Secteur III
|
422,87
|
4
|
0,04
|
6
|
0,23
|
|
Secteur IV
|
252,82
|
4
|
0,04
|
6
|
0,38
|
|
Secteur V
|
305,57
|
4
|
0,04
|
6
|
0,31
|
|
Total
|
1754,14
|
4
|
0,04
|
30
|
0,27
|
|
PNT
|
5340,00
|
4
|
0,04
|
30
|
0,09
|
3.2. Matériel
L'estimation des distances et angles à l'oeil nu est
une source de biais. Le logiciel « Distance » exige que les distances
et angles soient mesurés avec exactitude. Il faut utiliser des appareils
de mesure tels que le télémètre, la boussole et le GPS. Ce
dernier devant servir également à la localisation des transects
et permettre ainsi le contrôle de la bonne exécution du
travail.
3.3. Analyse des données
La prise en compte, sur la fiche, de certaines données
indirectes (crottes, pas, etc.) est déjà une bonne chose. Il
faudra que toutes ces données indirectes soient enregistrées dans
la base de données. Cela permettra de faire une double analyse et de
confronter les résultats (Lauginie, 1979 ; Newing, 1994). La
possibilité sera donnée aussi de faire des analyses pour des
espèces à observations directes difficiles tels que Panthera
pardus, Choeropsis liberiensis, etc. (Hoppe-Dominik, 1996 ;
Bourgarel, 2000 ; Chardonnet, 2002).
L'estimation du nombre d'animaux à partir des cris est
un point faible du système. Il en est de même de l'estimation des
distances et angles. Ces faits discréditent un peu le travail de
collecte des données.
Les données ne sont pas régulièrement
analysées pour servir d'orientation aux gestionnaires. Nous pensons
qu'elles doivent être analysées une fois par an pour pourvoir
suivre régulièrement l'évolution de la faune. A cet effet,
la Direction du PNT pourra former des personnes à la tâche. Car le
manque de personnel qualifié l'oblige à faire appel à des
ressources externes.
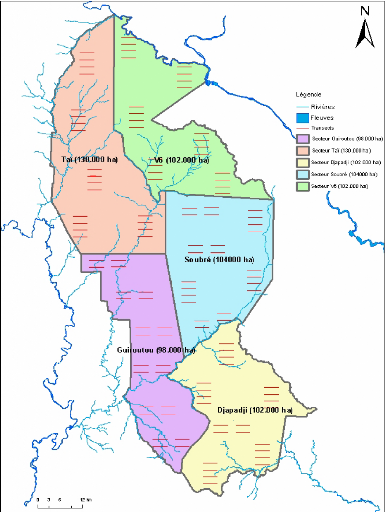
Figure 22 : Proposition d'un design pour le biomonitoring
du Parc National de Taï
CONCLUSION
Le système de biomonitoring du Parc National de
Taï a donné des résultats fort appréciables. Ainsi
donc, nous pouvons retenir que le côté Ouest du PNT est plus riche
(62 espèces) et plus dense en animaux que le côté Est.
Aussi, faut-il noter que les singes (69%) sont les espèces dominantes du
PNT. Les densités dans l'Ouest du PNT de Cercopithecus diana
diana, l'espèce la plus abondante varient entre 0,60 et 4,70
individus par hectare. Quant à Cephalophus maxwelli,
l'espèce la plus abondante des antilopes, elle a une densité qui
oscille entre 0,09 et 0,42 individus par hectare.
Il présente également quelques avantages
notables. Ainsi, Les observations diurnes et nocturnes permettent de prendre en
compte une large gamme d'animaux ayant des périodes d'activité
différentes. Aussi, l'utilisation d'anciens braconniers contribue-t-elle
énormément à la lutte contre le braconnage.
Cette étude nous a permis aussi de déceler
quelques insuffisances du système de biomonitoring du PNT. Ainsi, au
niveau du design, nous retenons que le taux d'échantillonnage est
faible. La disposition des secteurs ne permet pas de faire des extrapolations
des données recueillies sur l'ensemble du parc. L'estimation des
distances et des angles à l'oeil nu est l'une des faiblesses notables du
système.
Il est donc souhaitable d'utiliser du matériel
adéquat pour la collecte des données. Aussi, le biomonitoring,
étant un processus de suivi régulier, faudra-t-il que les
données soient régulièrement analysées. Ces
analyses pourront servir d'orientations aux gestionnaires et aux bailleurs de
fonds du PNT dans les prises de décisions.
Enfin, notre étude ayant porté sur l'analyse des
données issues d'observations directes, elle peut être approfondie
par une analyse des données des observations indirectes.
REFERENCES BIBLIOGRAPHIQUES
Acka-Douabele, C. & Goh, D.,
2004. Analyse de la perception du chimpanzé chez les
populations riveraines du PNT, Rapport d'enquête, Université
d'Abidjan, Côte-d'Ivoire. 86p.
Adou, Y.A. ; Blom, E.C. ; Dengueadhé, K.T.S. ;
Van Rompaey, R.S.A.R. ; N'Guessan, E.K. ; Wittebolle, G. & Bongers, F.,
2005. Diversité floristique et végétation dans le
Parc National de Taï, Côte-d'Ivoire, Tropenbos International,
Wageningen, Pays-Bas, pp1-21.
Allport, G. A. ; Boesch, C. ; Couturier, G.; Esser, J.;
Merz, G. & Piart, J., 1994. La faune du Parc National de Taï,
Tropenbos-CI, Wageningen, Pays-Bas, pp12-54.
Arvanitis, L.C. & Portier, K.M.,
1997. Sampling animal population, in "Natural Ressourse
Sampling", http:///
www.ifasstat.ufl.edu/nrs98/nrshome.htm.
Avenard, J.-M., 1971. Aspect de la
géomorphologie in Le milieu naturel de la Côte-d'Ivoire,
Mémoires ORSTOM n°50, Paris, France, pp70-72.
Blanc, J., Thouless, C.R.; Dublin, H.T.;
Douglas-Hamilton, I.; Craig, G.C. & Barnes, R.F.W., 2003. African
Elephant Status Report 2002, IUCN/SSC African Elephant Specialist Group, IUCN,
Gland Switzerland and Cambridge, U.K.
Boesch, C. & Boesch-Achermann, H., 2000.
The chimpanzees of the Taï forest, in "UNESCO, 2000, Biosphere reserves":
Special places for people and nature, UNESCO, Paris, p91.
Bonnéhin, L. ; Kadel, R. & Diomandé,
L., 1997. Gestion durable des ressources naturelles du PNT, plan
directeur 1997 Tome 1, Direction du PNT, San Pedro, Côte-d'Ivoire,
86p.
Bouché, P., 2001.
Méthodologies et techniques de recensement des grands mammifères
en Afrique, Institut vétérinaire Tropical, Université de
Liège, Liège, Belgique, 182 pp.
Bourgarel, M. ; Frizt, H. & Valeix, M.,
2000. Large mammal counts Hwange National Park Main Camp Area,
Departement of National Park and Wild Life Management, Harare, Zimbabwe, pp
27-39.
Bousquet, B., 1992. Guide des
Parcs nationaux d'Afrique : Afrique du Nord et Afrique de l'Ouest, Ed.
Delachaux et Niestlé, Paris, France pp 16-34, 124-179.
Buckland, S. T.; Burnham, K. P.; Anderson, D. R. &
Laake, J. L., 1993. Distance sampling: Estimating
abundance of biological populations, Chapman and Hall, London, reprinted 1999
by RUWPA, University of St Andrews, Scotland. 446pp.
Carabias, J. ; Cadena, R. & De La Maza, J.,
2003. Capacités nécessaires pour la gestion
d'Aires Protegées : l'Afrique, UICN/WCPA/Nature Conservancy, Mexico,
108p.
Casparay, H.U. ; Koné, I. ; Prouot, C. & De
Pauw, M., 2001. La chasse et la filière viande
de brousse dans l'espace Taï, Côte-d'Ivoire, Tropenbos serie2,
Wageningen. Pays-Bas, 103p.
Cawthon Lang, K.A., 2005.
Primate factsheets: Vervet (Chlorocebus) Taxonomy, Morphology and Ecology,
System Board of Regent, University of Wisconsin
Chardonnet, B.,
2000. Etude des effectifs et de la repartition
saisonnière des Eléphants des Aires Classées de l'Est du
Burkina Faso, in "Pachyderm n°28, Janvier-juin 2000, pp16-33.
Chardonnet, P., 2002. La conservation du Lion
d'Afrique : Contribution à son étude, in "Le flamboyant",
Bulletin d'information n°58, décembre 2004, pp 25-26.
Dajoz, R., 1985. Précis
d'écologie, Ed. Bordas, Paris, France pp 125-130, 321-350, 410-418.
Dallmeier, F. & Comiskey, J.A., 1998.
Forest Biodiversity research, Monitoring and modelling: Conceptual
Background and old world case studies, in «UNESCO 2002», Biosphere
reserves: Special places for people and nature, UNESCO, Paris, France,
pp46-47.
FGU-KRONBERG, 1979. Etat
actuel des parcs nationaux de la Comoé et de Taï ainsi que de la
Réserve d'Azagny et propositions visant à leur conservation et
à leur développement aux fins de promotion du tourisme, Rapport
de mission 1979, Ministère des Eaux et Forêts de
Côte-d'Ivoire, 155p.
Gaidet, N.; Fritz, H. & Nyahuma, C.,
2001. A participatory census method to monitor large mammal
populations in non-protected areas: a case study of bicycle counts in the
Zambezi valley, (Zimbabwe), Biodiversity projet, Guruve Rural District Cuncil,
Guruve, Zimbabwe, pp 15-38.
Gaidet, N.; Fritz, H.; Chardonnet, P; Bourgarel, M.;
Renaud, P.-C.; Coid, C.; Poulet, D.; Le Bel, S. & Poilecot, P.,
2002. Cost effectiveness of large mammal census technique :
comparaison of methods for a participatory approch in a communal area,
(Zimbabwe), Biodiversity projet, Guruve Rural District Cuncil, Guruve,
Zimbabwe, pp 29-49.
Galat-Luong, A. & Galat, G., 1978. Abondance
relative et associations plurispécifiques des primates diurnes du Parc
National de Taï, ORSTOM, Côte-d'Ivoire, 34p.
Gerhard, R., 2004. Le
système de surveillance et de développement des densités
des animaux braconnés du Parc National de Taï, Rapport de mission
GTZ, Direction du PNT, San Pedro, Côte-d'Ivoire, 37p.
Guillaumet J-L. ; Couturier, G. & Dosso, H.,
1984. Recherche et aménagement en milieu forestier
tropical humide ; le projet Taï de Côte-d'Ivoire, Note technique du
MAB 15, 175p.
Hamilton, A., 1976. The
significance of patterns of distribution shown by forest plants and animals in
"Tropical Africa for the reconstruction of upper plaistocens
paleoenvironnements" : a review, Paeoecology of Africa, the surrounding Islands
and Antartica 9; pp63-97
Harald, H. R. ; Hoppe-Dominik, B. ; Mühlenberg,
M. & Steinhauer-Burkart, B., 1996.
Répartition et statut des espèces des grands mammifères en
Côte-d'Ivoire ; partie IV : les Hippopotames, Zentrumfuir Naturschutz,
Universität Göttingen, Allemagne, 51p.
Hoppe-Dominik, B., 1995.
L'état actuel des effectifs des grands mammifères dans l'ensemble
du Parc National de Taï, Rapport établi par ordre et pour le compte
de GTZ, Direction du PNT, San Pedro, Côte-d'Ivoire, 66p.
Hoppe-Dominik, B., 1996.
Expertise concernant l'état actuel des effectifs des grands
mammifères dans l'ensemble du Parc National de Taï comme instrument
d'évaluation et indicateur des efforts de la surveillance, Rapport
établi par ordre et pour le compte de GTZ, Direction du PNT, San Pedro,
Côte-d'Ivoire, 75p.
Hoppe-Dominik, B., 1998.
Introduction d'un système de suivi écologique pour
l'évaluation des activités du projet dans le PNT ; Rapport
établi par ordre et pour le compte de GTZ, Direction du PNT, San Pedro,
Côte-d'Ivoire, 37p.
Hoppe-Dominik, B., 1999, Analyse du
système de Biomonitoring pour l'évaluation des activités
du projet au Parc National de Tai, Rapport établi par ordre et pour le
compte de GTZ, Direction PNT, Côte-d'Ivoire, 58p.
Joseph, D.L.D., 2001, Etude de la
distribution du peuplement reptilien du Parc National de Bouba Ndjidah (Nord
Cameroun), Mémoire pour l'obtention du Diplôme d'Etude Approfondie
(DEA) en Biologie des Organismes Animaux, Faculté des Sciences,
Universitéé de Yaoundé I, Cameroun, 72p.
Kingdon, J., 1997. The kingdon
field guide to African mammals, Ed.Academic Press, 525B Street, Suite 1900, San
Diego, California 92101-4495, USA, pp125-130, 321-324.
Koné I., 2004. Effets
du braconnage sur quelques aspects du comportement du Colobe bai -
Procolobus (Colobus baduis) baduis (Kerr) - et du Cercopithèque
diane ; Cercopithecus diana diana (L.) - dans le Parc National de
Taï - Côte-d'Ivoire, Tropenbos International, Abidjan,
Côte-d'Ivoire, 98p.
Lauginie, F., 1979. Les grands
mammifères de la Réserve de Faune d'Azagny
:
Recensement-Comportement-Actions de sauvegarde, Mémoire de fin
d'études pour
l'obtention du Diplôme d'Etudes Approfondies d'Ecologie
Tropicale, Université d'Abidjan, Côte d'Ivoire, 66p.
Le Maître, D.C. ; Van Wilgen, B.W. ; Chapman,
R.A. & McKelly, D.H., 2002. Putting social and economic values on
ecosystem services: Alien woody invaders in the cape floristic Province South
Africa, in «UNESCO 2002», Biosphere reserve: special places for
people and nature, UNESCO, Paris, France, pp43-44.
Maginis, S., 2005. Forest
Conservation and Povert Reduction : the hunt for synergies, in "Forest
Conservation Newsletter", arbovitae n°29, December 2005, pp12-16.
Mangenot, G., 1956, Etude sur la forêt des
plaines et plateaux de Côte-d'Ivoire : Etudes éburnéennes,
Tome 4, IFAN, Dakar, Sénégal pp 5-61.
Michel, J.F., 1999, Les
dénombrements d'animaux domestiques, CIRAD-EMVT, Campus International de
Baillarguet, Montpellier, France.
Miller, K., 2003.
Capacités nécessaires pour la gestion d'Aires
Protégées : l'Afrique, UICN/WCPA/Nature Conservancy, Mexico,
108p.
N'Dri, K. P., 2005.
Contribution a l'étude des effets des travaux d'aménagement
forestier (éclaircies et reboisements) sur l'évolution de la
faune en foret classée de Bossematié, Mémoire de fin
d'études pour l'obtention du Diplôme d'Ingénieur Agronome
(Option Eaux et Forêts) à l'Ecole de Formation Continue et de
Perfectionnement des Cadres (EFCPC) de Yamoussoukro, Bibliothèque de
l'ESA, Yamoussoukro, Côte-d'Ivoire, 48p.
Newing, H. S., 1994. Behavioural ecology of
Duikers (Cephalophus spp.) in forest and secondary growth, Taï,
Côte-d'Ivoire, degree of Ph.D., University of Stirling, 139p.
N'Goran, K.P., 2004, Suivi écologique de
1999 à 2004 au Parc National de Taï : quelques résultats
importants, Centre Suisse de Recherches Scientifiques, 43p.
Ouellet, F., 2004. Analyse de données
avec SPSS pour Windows, version 10.0 et 11.0, Ed. SMG, Bibliothèque
nationale du Québec, Canada, pp55-80.
PNT, 1996. Aménagement de la
Réserve partielle de la faune du N'Zo, Projet Autonome pour la
Conservation du Parc National de Taï (PACPNT), Direction de la Protection
et de la Nature, Direction du PNT, San Pedro, Côte-d'Ivoire, pp35-55.
PNT, 1999. Projet de Suivi
Ecologique dans le Parc National de Taï, Côte d'Ivoire, Direction du
PNT, San Pedro, Côte-d'Ivoire, 19p.
PNT, 2001. Plan
d'Aménagement Directeur du Parc National de Taï (2000-20 1 1), Tome
I et II, PACPNT, Direction du PNT San Pedro, Côte-d'Ivoire, pp7-24.
PNT, 2002. Rapport de
Biomonitoring (1998-2000), Direction du PNT San Pedro, Côted'Ivoire,
33p.
Refisch, J. & Koné, I.,
2001. Influence du braconnage sur les populations des singes
dans le PNT et les effets secondaires sur la végétation, projet
TÖB, Direction du PNT, San Pedro, Côte-d'Ivoire, 89p.
Riezebos, E. P. ; Vooren, A.P. & Guillaumet,
J.-L., 1992. Le Parc National de Taï, Côted'Ivoire ; I :
Synthèse des connaissances ; II : Bibliographie, Tropenbos série
8, Wageningen, Pays-Bas, 182p.
Roberts-Pichette, P. & Gillespie, L.,
2002. Protocoles de suivi de la biodiversité
végétale terrestre, Musée canadien de la nature Ottawa,
Canada, URL : http:///
www.eman-rese.ca
Rödel, M. O., 2004. Catalogue des
Amphibiens et Reptiles du Parc National de Taï, Côted'Ivoire, TOB,
Würzburg, Allemagne, pp 3-15.
Scherrer, B., 1984. Biostatistique, Ed.
Gaëtan Morin, Boucheville (Quebec), Canada, pp89-125, 45 1-467,
678-701.
Seka S. & Kissi D.,
2002. Contribution à la surveillance des parcs
nationaux et réserves: cas du Parc National de Taï, Mémoire
de fin d'études pour l'obtention du Diplôme d'Ingénieur des
Techniques Agricoles de l'Ecole Supérieure d'Agronomie, Yamoussoukro,
Côte-d'Ivoire, pp10-21, 43-55.
Southwood, R. & Henderson P., 2001.
Ecological Methods. 3e Ed. Chapman and Hall, London, England, 56p,
URL: http:///
www.blackwellpublishing.com
Spellerberg, I., 2005. Monitoring Ecological
Change, Cambridge University Press, 2nd Edition, Lincoln University, New
Zealand, 29p, URL:
http://www.cambridge.org.
Sutherland, W J., 1996. Ecological Census
Techniques, a Handbook. Cambridge, University Press, US, pp23-57.
Thomas E. L., 2005. Primate
Monitoring Protocol, in Tropical Ecology, Assessment, and Monitoring (TEAM)
Initiative, N°10, Center for Applied Biodiversity Science, Conservation
International, Washington, USA, 15-21.
Trape, J.-F. & Mané, Y.,
2002. Les Serpents du Sénégal : liste
complétée des espèces, Laboratoire de paludologie,
Institut de recherche pour le développement (IRD), Dakar,
Sénégal, pp12-18.
UICN, 2005. 2005 UICN Red List of Threatened
Animal, UICN, Gland, Switzerland, URL: http:///
www.iucn.org/espèces
ménacées/2005.
Vaughan, H., 2001. Ecological Monitoring and
Assessment Network, Lakeshore Road Burlington, Ontario, Canada, pp35-52,
URL: http:///
www.eman.rese.ca
Wassenaar, T.D., Van Aarde, R.J., Pimm, S.L. &
Ferreira, S.M., 2005. Community convergence in
disturbed Subtropical dune forests, in "Journal of Ecological", Nicholas School
of the Environment and Earth Sciences, Duke University, North Carolina, USA,
n°3, pp 655-666.
Weaver, P.L., 1998. Hurricane effects and
long term recovery in a subtropical rain forest, in "UNESCO, 2000, Biosphere
reserves": Special places for people and nature, UNESCO, Paris, pp91-92.
Young, B., Sedaghathish, G. & Roca, R.,
2004. Etude de la faune dans le cadre d'une Evaluation Ecologique
Rapide, (REA), http:///
www.google.fr/évaluation-écologique.htm.
GLOSSAIRE
Aire protégée : désigne
une portion de terre, de mer, de rivière et/ou de lagune
géographiquement délimitée qui est définie,
réglementée et gérée pour la protection et le
maintien du patrimoine naturel et culturel.
Approche paramétrique : elle pose que
f(x) fait partie des courbes de probabilité de détection de forme
connue mais dépendante d'un paramètre inconnu ?.
Approche non paramétrique : aucune
supposition n'est faite quant à la distribution spécifique
concernant les variables aléatoires à l'étude. Elles sont
plus robustes que les estimations paramétriques mais moins
précises. Les biais sont réduits au dépend de la
précision.
Diversité biologique ou biodiversité
: variabilité des organismes vivants de toute origine y
compris, entre autres, les écosystèmes terrestres, marins et
autres écosystèmes aquatiques et les complexes écologiques
dont ils font partie ; cela comprend la diversité au sein des
espèces et entre les espèces ainsi que celle des
écosystèmes.
Espèce endémique : espèces
à aire de répartition si nettement limitée qu'elle devient
caractéristique d'une région; ce sont souvent des espèces
rares à protéger.
Espèce rare : une espèce qui se
rencontre peu souvent, dont il existe peu de représentant.
Estimateur robuste ou modèle robuste :
l'estimateur de la densité D est robuste s'il ne dépend pas de
quelques hypothèses que ce soit concernant la forme de la courbe de f(x)
; ou encore lorsque l'estimateur est capable de s'ajuster aux diverses allures
prises par la fonction de détection de la densité d'un animal
f(x).
Forêt dense sempervirente : formation
végétale puissante composée de plusieurs strates d'arbres
et d'un sous bois clairsemé où l'absence de lumière au sol
ne permet pas de développer le tapis herbacé. Ne se
développe que sous climat humide.
"Parc national" désigne une aire :
- placée sous le contrôle de l'Etat et dont les
limites ne peuvent être changées, ni aucune partie
aliénée, sauf par l'autorité législative
compétente ;
- exclusivement destinée à la propagation,
à la protection, à la conservation et l'aménagement de la
végétation et les populations d'animaux sauvages, ainsi
qu'à la protection des sites, des paysages, ou des formations
géologiques d'une valeur scientifique ou esthétique
particulière, dans l'intérêt et pour la
récréation public ;
- dans laquelle l'abattage, la chasse, la capture d'animaux et
la destruction ou la collecte des plantes sont interdits, sauf pour des raisons
scientifiques ou pour les besoins de l'aménagement et à condition
que de telles opérations aient lieu sous la direction et le
contrôle de l'autorité compétente.
Patrimoine mondial : site d'importance
internationale exceptionnelle, unique sur le plan mondial,
désigné par les pays signataires de la convention du patrimoine
mondial des réserves de la biosphère.
Réserve naturelle intégrale
désigne une aire :
- placée sous le contrôle de l'Etat et dont les
limites ne peuvent être changées, ni aucune partie
aliénée, sauf par l'autorité législative
compétente ;
- sur l'étendue de laquelle toute espèces de
chasse ou de pêche, toute exploitation forestière, agricole ou
minière, tout pâturage, toute fouille ou prospection, tout sondage
ou terrassement, toute construction, tous travaux tendant à modifier
l'aspect du terrain ou la végétation, toute pollution des eaux
et, de manière générale, tout acte de nature à
apporter des perturbations à la faune ou à la flore, toute
introduction d'espèces zoologiques ou botaniques, soit indigènes
soit importées, sauvages ou domestiquées seront strictement
interdits ;
- où il sera défendu de résider, de
pénétrer, de circuler ou de camper et qu'il sera interdit de
survoler à basse altitude, sans autorisation spéciale
écrite de l'autorité compétente et dans laquelle les
recherches scientifiques (y compris les éliminations d'animaux et de
végétaux en vue de maintenir un écosystème) ne
pourront être effectuées qu'avec la permission de cette
autorité.
Système mondial de localisation - GPS (Global
Positioning System) : Le système mondial de localisation GPS
est un système de navigation basé sur l'émission par des
satellites, de signaux spécialement codés, qui une fois
reçus par récepteur GPS permettent de calculer sa
localisation. Les signaux de quatre satellites GPS sont nécessaires pour
faire le point dans les trois dimensions.
ANNEXES
Liste des annexes
Annexe 0 : Terme de référence a
Annexe 1 : Fréquences des espèces biomonitrice par
secteur b
Annexe 2 : Fréquences des espèces biomonitrices par
année d
Annexe 3 : Répartition des dix premières
espèces des secteurs f
Annexe 4 : Tests de Levene et de Kruskal-Wallis i
Annexe 5 : Distances parcourues par secteur i
Annexe 6 : Moyenne des taux d'observations des espèces
retenues j
Annexe 7 : Tableaux des densités des espèces
retenues n
Annexe 8 : Tableaux des différents groupes et sous groupes
utilisés q
Annexe 9 : Cartes d'analyses spatiales de Cephalophus
maxwelli s
Annexe 10 : Fiches de collecte des donnees de Biomonitoring t
Annexe 11 : Les espèces biomonitrices pour le Parc
National de Taï (PNT, 1999) v
Annexe 12 : Photos de quelques espèces animales
biomontrices du Parc National de Taï z
Annexe 13 : Données pluviométriques de la
région Sud-Ouest dd
Annexe 14 : Liste partielle de plantes utiles aux populations de
l'Espace Taï ee
Annexe 0 : Terme de référence
TERMES DE REFERENCE DE M. KOUADIO KONAN KAN
FULBERT,
ETUDIANT A L'INP-HB POUR SON STAGE DE
FIN D'ETUDES DU 1er
SEPTEMBRE 2005 AU 1er MARS 2006
Objet : Analyse du système de
Biomonitoring du Parc National de Taï
Pendant son stage, M. KOUADIO Konan Kan Fulbert aura à
travailler dans le Parc National de Taï.
Dans le cadre de cette étude le stagiaire après
avoir pris contact avec le Directeur de Zone Sud-Ouest, fera une brève
présentation du PNT.
Il procédera, dans un premier temps, à un
descriptif du biomonitoring Ensuite, il analysera les résultats du
système de biomonitoring du PNT
Enfin, il fera des propositions de mesures pour une meilleure
gestion du suivi écologique au Parc National de Taï
Le stagiaire tiendra le Directeur de Zone informé de
l'évolution du travail de façon périodique par un rapport
mensuel.
Le stage sera sanctionné par un rapport dont un
exemplaire sera adressé à chacune des personnes suivantes en ce
qui concerne l'Office Ivoirien des Parcs et Réserves :
- le Directeur de l'Office Ivoirien des Parcs et
Réserves
- le Directeur de Zone Sud-Ouest.
Annexe 1 : Fréquences des espèces
biomonitrice par secteur Tableau A 1: Fréquences des espèces
biomonitrices par secteur
|
Espèce
|
N° Secteur
|
Pourcentage
|
Pourcentage
cumulé
|
|
I
|
II
|
III
|
IV
|
V
|
Total
|
|
Cercopithecus diana diana
|
77
|
34
|
5333
|
16859
|
4858
|
27161
|
23,07%
|
23,07%
|
|
Piliocolobus badius badius
|
21
|
50
|
507
|
15922
|
1414
|
17914
|
15,22%
|
38,29%
|
|
Cercocebus torquatus atys
|
57
|
140
|
3964
|
5731
|
1369
|
11261
|
9,57%
|
47,86%
|
|
Cercopithecus petaurista
|
931
|
196
|
1783
|
6836
|
418
|
10164
|
8,63%
|
56,50%
|
|
Ceratogymna atrata
|
97
|
200
|
2990
|
1260
|
1300
|
5847
|
4,97%
|
61,46%
|
|
Corythaeola cristata
|
282
|
118
|
3724
|
633
|
555
|
5312
|
4,51%
|
65,98%
|
|
Cercopithecus mona lowei
|
217
|
32
|
3433
|
708
|
735
|
5125
|
4,35%
|
70,33%
|
|
Guttera eduardi
|
400
|
47
|
2761
|
1131
|
209
|
4548
|
3,86%
|
74,19%
|
|
Agelastes meleagrides
|
11
|
92
|
1407
|
1682
|
1050
|
4242
|
3,60%
|
77,80%
|
|
Colobus polykomos polykomos
|
3
|
38
|
1585
|
1717
|
852
|
4195
|
3,56%
|
81,36%
|
|
Psittacus erithacus
|
113
|
177
|
2163
|
17
|
328
|
2798
|
2,38%
|
83,74%
|
|
Cephalophus maxwelli
|
70
|
21
|
539
|
778
|
755
|
2163
|
1,84%
|
85,58%
|
|
Bycanistes fustilator
|
178
|
6
|
1013
|
601
|
364
|
2162
|
1,84%
|
87,41%
|
|
Colobus verus
|
0
|
59
|
114
|
1493
|
117
|
1783
|
1,51%
|
88,93%
|
|
Galagoides demidovii
|
147
|
33
|
826
|
140
|
211
|
1357
|
1,15%
|
90,08%
|
|
Pan troglodytes verus
|
1
|
7
|
683
|
234
|
210
|
1135
|
0,96%
|
91,04%
|
|
Ceratogymna elata
|
0
|
92
|
1031
|
1
|
0
|
1124
|
0,95%
|
92,00%
|
|
Tockus fasciatus
|
43
|
16
|
826
|
105
|
95
|
1085
|
0,92%
|
92,92%
|
|
Crossarchus obscursus
|
34
|
16
|
606
|
19
|
129
|
804
|
0,68%
|
93,60%
|
|
Francolinus lathami
|
12
|
10
|
522
|
19
|
216
|
779
|
0,66%
|
94,27%
|
|
Tropicranus albocristatus
|
101
|
33
|
207
|
20
|
229
|
590
|
0,50%
|
94,77%
|
|
Potamochoerus porcus porcus
|
52
|
14
|
87
|
200
|
205
|
558
|
0,47%
|
95,24%
|
|
Bycanistes cylindricus cylindricus
|
0
|
28
|
336
|
165
|
21
|
550
|
0,47%
|
95,71%
|
|
Dendrohyrax arboreus
|
12
|
52
|
359
|
10
|
33
|
466
|
0,40%
|
96,10%
|
|
Psittacus erithacus
|
12
|
0
|
9
|
4
|
377
|
402
|
0,34%
|
96,45%
|
|
Nandinia binotata binotata
|
4
|
31
|
180
|
12
|
119
|
346
|
0,29%
|
96,74%
|
|
Achatina achatina
|
67
|
18
|
116
|
10
|
100
|
311
|
0,26%
|
97,00%
|
|
Cephalophus dorsalis
|
16
|
1
|
136
|
100
|
34
|
287
|
0,24%
|
97,25%
|
|
Cricetomys emeni
|
46
|
43
|
100
|
50
|
31
|
270
|
0,23%
|
97,48%
|
|
Genetta pardina
|
5
|
41
|
35
|
45
|
130
|
256
|
0,22%
|
97,70%
|
|
Atilax paludinosus pluto
|
19
|
0
|
184
|
20
|
14
|
237
|
0,20%
|
97,90%
|
|
Atherurus africanus
|
13
|
5
|
132
|
30
|
34
|
214
|
0,18%
|
98,08%
|
|
Poicephalus gulielmi
|
26
|
14
|
33
|
113
|
0
|
186
|
0,16%
|
98,24%
|
|
Peridicticus potto
|
38
|
1
|
109
|
20
|
7
|
175
|
0,15%
|
98,38%
|
|
Herpestes sanguineus melanurus
|
5
|
4
|
73
|
61
|
24
|
167
|
0,14%
|
98,53%
|
|
Cercopithecus nictitans
|
0
|
49
|
90
|
18
|
0
|
157
|
0,13%
|
98,66%
|
|
Cephalophus niger
|
5
|
0
|
61
|
68
|
14
|
148
|
0,13%
|
98,79%
|
|
Crocodylus niloticus
|
5
|
0
|
18
|
90
|
25
|
138
|
0,12%
|
98,90%
|
|
Kinixys erosa
|
20
|
3
|
42
|
7
|
66
|
138
|
0,12%
|
99,02%
|
|
Crocodylus cataphractus
|
2
|
0
|
4
|
0
|
106
|
112
|
0,10%
|
99,12%
|
|
Espèce
|
N° Secteur
|
Pourcentage
|
Pourcentage
cumulé
|
|
I
|
II
|
III
|
IV
|
V
|
Total
|
|
Tockus camurus
|
0
|
0
|
64
|
33
|
0
|
97
|
0,08%
|
99,20%
|
|
Cephalophus olgibii
|
0
|
13
|
7
|
51
|
12
|
83
|
0,07%
|
99,27%
|
|
Liberiictus kuhni
|
38
|
12
|
22
|
0
|
0
|
72
|
0,06%
|
99,33%
|
|
Neotragus pygmaeus
|
3
|
0
|
51
|
7
|
9
|
70
|
0,06%
|
99,39%
|
|
Cephalophus zebra
|
6
|
0
|
19
|
21
|
23
|
69
|
0,06%
|
99,45%
|
|
Stephanoaetus coronatus
|
6
|
3
|
23
|
11
|
17
|
60
|
0,05%
|
99,50%
|
|
Syncerus caffer nanus
|
3
|
0
|
0
|
38
|
14
|
55
|
0,05%
|
99,55%
|
|
Loxodonta africana cyclotis
|
0
|
0
|
0
|
0
|
51
|
51
|
0,04%
|
99,59%
|
|
Hyemoschus aquaticus
|
4
|
0
|
9
|
9
|
26
|
48
|
0,04%
|
99,63%
|
|
Bitis nasicornis
|
1
|
1
|
14
|
24
|
0
|
40
|
0,03%
|
99,66%
|
|
Python sebae
|
0
|
0
|
37
|
1
|
0
|
38
|
0,03%
|
99,70%
|
|
Mellivora capensis cottoni
|
0
|
8
|
21
|
1
|
8
|
38
|
0,03%
|
99,73%
|
|
Manis tricuspis
|
0
|
0
|
35
|
1
|
0
|
36
|
0,03%
|
99,76%
|
|
Osteolaemus tetrapsis
|
7
|
0
|
15
|
0
|
9
|
31
|
0,03%
|
99,79%
|
|
Tragelaphus scriptus scriptus
|
0
|
1
|
2
|
24
|
0
|
27
|
0,02%
|
99,81%
|
|
Manis gigantea
|
1
|
2
|
15
|
6
|
1
|
25
|
0,02%
|
99,83%
|
|
Viverra civatta
|
0
|
2
|
20
|
1
|
1
|
24
|
0,02%
|
99,85%
|
|
Achatina ventriculosa
|
7
|
4
|
6
|
0
|
7
|
24
|
0,02%
|
99,87%
|
|
Choeropsis liberiensis
|
4
|
0
|
7
|
4
|
6
|
21
|
0,02%
|
99,89%
|
|
Hylochoerus meinherzthageni
|
0
|
2
|
9
|
8
|
2
|
21
|
0,02%
|
99,91%
|
|
Cep halop hus jentinki
|
0
|
3
|
13
|
2
|
1
|
19
|
0,02%
|
99,92%
|
|
Cephalophus silvicultor
|
2
|
0
|
11
|
3
|
0
|
16
|
0,01%
|
99,94%
|
|
Manis tetradactyla
|
1
|
0
|
12
|
1
|
1
|
15
|
0,01%
|
99,95%
|
|
Thryonomys swinderianus
|
0
|
3
|
0
|
9
|
0
|
12
|
0,01%
|
99,96%
|
|
Panthera pardus leopardus
|
0
|
0
|
0
|
9
|
2
|
11
|
0,01%
|
99,97%
|
|
Poina richardsoni
|
0
|
0
|
0
|
8
|
3
|
11
|
0,01%
|
99,98%
|
|
Tragelaphus euryceros
|
0
|
2
|
5
|
3
|
0
|
10
|
0,01%
|
99,99%
|
|
Felis aurata celidogaster
|
0
|
0
|
0
|
6
|
0
|
6
|
0,01%
|
99,99%
|
|
Bitis gabonica
|
1
|
0
|
3
|
0
|
1
|
5
|
0,00%
|
99,99%
|
|
Genetta johnstoni
|
1
|
0
|
2
|
0
|
0
|
3
|
0,00%
|
100,00%
|
|
Kinixys homana
|
1
|
1
|
0
|
0
|
0
|
2
|
0,00%
|
100,00%
|
|
Tockus camurus
|
0
|
0
|
0
|
0
|
1
|
1
|
0,00%
|
100,00%
|
|
Aonyx capensis
|
0
|
0
|
0
|
0
|
0
|
0
|
0,00%
|
100,00%
|
|
Lutra maculicollis
|
0
|
0
|
0
|
0
|
0
|
0
|
0,00%
|
100,00%
|
|
Hystrix cristata
|
0
|
0
|
0
|
0
|
0
|
0
|
0,00%
|
100,00%
|
|
Total
|
3228
|
1778
|
38543
|
57210
|
16949
|
117708
|
100,00%
|
|
Annexe 2 : Fréquences des espèces
biomonitrices par année
Tableau A 2 : Fréquences des espèces
bimonitrices par année
|
Espèce
|
Année
|
Total
|
Pource
tage (%)
|
Pourcentag
e cumulé
(%)
|
|
1999
|
2000
|
2001
|
2002
|
2003
|
2004
|
2005
|
|
Cercopithecus diana diana
|
1605
|
8211
|
5456
|
3171
|
1764
|
4364
|
2590
|
27161
|
23,075
|
23,075
|
|
Colobus badius badius
|
951
|
5366
|
3693
|
2339
|
1596
|
2571
|
1398
|
17914
|
15,219
|
38,294
|
|
Cercocebus torquatus atys
|
657
|
3817
|
1808
|
1231
|
535
|
1851
|
1362
|
11261
|
9,567
|
47,861
|
|
Cercopithecus petaurista
|
415
|
2745
|
2022
|
1369
|
787
|
1853
|
973
|
10164
|
8,635
|
56,496
|
|
Ceratogymna atrata
|
439
|
1263
|
1073
|
592
|
438
|
1525
|
517
|
5847
|
4,967
|
61,463
|
|
Corythaeola cristata
|
234
|
1115
|
793
|
569
|
329
|
1485
|
787
|
5312
|
4,513
|
65,976
|
|
Cercopithcus mona
|
222
|
1423
|
848
|
587
|
440
|
1122
|
483
|
5125
|
4,354
|
70,33
|
|
Guttera eduardi
|
60
|
913
|
983
|
648
|
507
|
787
|
650
|
4548
|
3,864
|
74,194
|
|
Agelastes meleagrides
|
153
|
1592
|
743
|
479
|
301
|
629
|
345
|
4242
|
3,604
|
77,798
|
|
Colobus polykomos polykomos
|
243
|
1026
|
825
|
616
|
188
|
902
|
395
|
4195
|
3,564
|
81,362
|
|
Psittacus erithacus
|
56
|
390
|
494
|
184
|
284
|
1012
|
378
|
2798
|
2,377
|
83,739
|
|
Cephalophus maxwelli
|
251
|
532
|
435
|
384
|
156
|
274
|
131
|
2163
|
1,838
|
85,576
|
|
Bycanistes fustilator
|
113
|
383
|
394
|
225
|
264
|
561
|
222
|
2162
|
1,837
|
87,413
|
|
Colobus verus
|
17
|
366
|
238
|
289
|
221
|
386
|
266
|
1783
|
1,515
|
88,928
|
|
Galagoides demidovii
|
221
|
279
|
152
|
189
|
114
|
258
|
144
|
1357
|
1,153
|
90,081
|
|
Pan troglodytes verus
|
13
|
338
|
270
|
102
|
86
|
190
|
136
|
1135
|
0,964
|
91,045
|
|
Ceratogymna elata
|
65
|
188
|
108
|
1
|
36
|
422
|
304
|
1124
|
0,955
|
92
|
|
Tockus fasciatus
|
54
|
127
|
116
|
123
|
104
|
358
|
203
|
1085
|
0,922
|
92,921
|
|
Crossarchus obscursus
|
31
|
186
|
138
|
32
|
76
|
156
|
185
|
804
|
0,683
|
93,605
|
|
Francolinus lathami
|
41
|
164
|
139
|
59
|
84
|
180
|
112
|
779
|
0,662
|
94,266
|
|
Tropicranus albocristatus
|
30
|
115
|
106
|
90
|
72
|
126
|
51
|
590
|
0,501
|
94,768
|
|
Potamochoerus porcus porcus
|
9
|
159
|
41
|
96
|
14
|
172
|
67
|
558
|
0,474
|
95,242
|
|
Bycanistes cylindricus cylindricus
|
47
|
110
|
88
|
33
|
21
|
190
|
61
|
550
|
0,467
|
95,709
|
|
Dendrohyrax arboreus
|
17
|
60
|
51
|
36
|
39
|
181
|
82
|
466
|
0,396
|
96,105
|
|
Psittacus erithacus
|
44
|
62
|
67
|
74
|
8
|
112
|
35
|
402
|
0,342
|
96,446
|
|
Nandinia binotata binotata
|
39
|
67
|
51
|
22
|
28
|
100
|
39
|
346
|
0,294
|
96,74
|
|
Achatina achatina
|
21
|
47
|
37
|
45
|
23
|
89
|
49
|
311
|
0,264
|
97,004
|
|
Cephalophus dorsalis
|
37
|
72
|
57
|
40
|
26
|
33
|
22
|
287
|
0,244
|
97,248
|
|
Cricetomys emeni
|
28
|
51
|
41
|
35
|
17
|
67
|
31
|
270
|
0,229
|
97,478
|
|
Genetta pardina
|
28
|
38
|
44
|
41
|
16
|
50
|
39
|
256
|
0,217
|
97,695
|
|
Atilax paludinosus pluto
|
2
|
58
|
75
|
40
|
33
|
15
|
14
|
237
|
0,201
|
97,896
|
|
Atherurus africanus
|
23
|
34
|
38
|
21
|
26
|
43
|
29
|
214
|
0,182
|
98,078
|
|
Poicephalus gulielmi
|
27
|
86
|
0
|
0
|
26
|
22
|
25
|
186
|
0,158
|
98,236
|
|
Peridicticus potto
|
11
|
28
|
22
|
15
|
40
|
40
|
19
|
175
|
0,149
|
98,385
|
|
Herpestes sanguineus melanurus
|
0
|
6
|
4
|
94
|
6
|
16
|
41
|
167
|
0,142
|
98,527
|
|
Cercopithecus nictitans
|
0
|
26
|
14
|
2
|
5
|
68
|
42
|
157
|
0,133
|
98,66
|
|
Cephalophus niger
|
8
|
28
|
18
|
34
|
7
|
31
|
22
|
148
|
0,126
|
98,786
|
|
Espèce
|
Année
|
Total
|
Pourcen
tage (%)
|
Pourcentage cumulé (%)
|
|
1999
|
2000
|
2001
|
2002
|
2003
|
2004
|
2005
|
|
Crocodylus niloticus
|
0
|
71
|
62
|
0
|
1
|
1
|
3
|
138
|
0,117
|
98,903
|
|
Kinixys erosa
|
7
|
18
|
17
|
22
|
7
|
43
|
24
|
138
|
0,117
|
99,02
|
|
Crocodylus cataphractus
|
12
|
8
|
14
|
29
|
9
|
35
|
5
|
112
|
0,095
|
99,116
|
|
Tockus camurus
|
3
|
27
|
14
|
12
|
23
|
5
|
13
|
97
|
0,082
|
99,198
|
|
Cephalophus olgibii
|
5
|
27
|
9
|
13
|
0
|
21
|
8
|
83
|
0,071
|
99,269
|
|
Liberiictus kuhni
|
0
|
13
|
25
|
0
|
0
|
26
|
8
|
72
|
0,061
|
99,33
|
|
Neotragus pygmaeus
|
6
|
17
|
10
|
7
|
8
|
12
|
10
|
70
|
0,059
|
99,389
|
|
Cephalophus zebra
|
6
|
18
|
9
|
9
|
6
|
13
|
8
|
69
|
0,059
|
99,448
|
|
Stephanoaetus coronatus
|
5
|
19
|
15
|
3
|
2
|
7
|
9
|
60
|
0,051
|
99,499
|
|
Syncerus caffer nanus
|
1
|
11
|
6
|
12
|
0
|
19
|
6
|
55
|
0,047
|
99,545
|
|
Loxodonta africana cyclotis
|
5
|
7
|
14
|
16
|
3
|
3
|
3
|
51
|
0,043
|
99,589
|
|
Hyemoschus aquaticus
|
8
|
12
|
8
|
9
|
1
|
8
|
2
|
48
|
0,041
|
99,63
|
|
Bitis nasicornis
|
0
|
5
|
19
|
6
|
2
|
3
|
5
|
40
|
0,034
|
99,664
|
|
Python sebae
|
1
|
0
|
18
|
17
|
0
|
1
|
1
|
38
|
0,032
|
99,696
|
|
Mellivora capensis cottoni
|
0
|
0
|
0
|
3
|
21
|
12
|
2
|
38
|
0,032
|
99,728
|
|
Manis tricuspis
|
1
|
8
|
3
|
0
|
3
|
14
|
7
|
36
|
0,031
|
99,759
|
|
Osteolaemus tetrapsis
|
8
|
10
|
7
|
0
|
2
|
2
|
2
|
31
|
0,026
|
99,785
|
|
Tragelaphus scriptus scriptus
|
0
|
5
|
0
|
18
|
1
|
2
|
1
|
27
|
0,023
|
99,808
|
|
Manis gigantea
|
0
|
1
|
1
|
5
|
1
|
12
|
5
|
25
|
0,021
|
99,829
|
|
Viverra civatta
|
2
|
6
|
5
|
1
|
0
|
8
|
2
|
24
|
0,02
|
99,85
|
|
Achatina ventriculosa
|
3
|
3
|
9
|
2
|
0
|
5
|
2
|
24
|
0,02
|
99,87
|
|
Choeropsis liberiensis
|
0
|
5
|
3
|
2
|
0
|
7
|
4
|
21
|
0,018
|
99,888
|
|
Hylochoerus meinherzthageni
|
0
|
2
|
3
|
4
|
6
|
2
|
4
|
21
|
0,018
|
99,906
|
|
Cephalophus jentinki
|
0
|
3
|
1
|
1
|
3
|
6
|
5
|
19
|
0,016
|
99,922
|
|
Cephalophus silvicultor
|
0
|
2
|
5
|
0
|
3
|
4
|
2
|
16
|
0,014
|
99,935
|
|
Manis tetradactyla
|
0
|
7
|
1
|
1
|
0
|
1
|
5
|
15
|
0,013
|
99,948
|
|
Thryonomys swinderianus
|
1
|
8
|
0
|
0
|
0
|
3
|
0
|
12
|
0,01
|
99,958
|
|
Panthera pardus leopardus
|
2
|
5
|
3
|
0
|
1
|
0
|
0
|
11
|
0,009
|
99,968
|
|
Poina richardsoni
|
2
|
2
|
7
|
0
|
0
|
0
|
0
|
11
|
0,009
|
99,977
|
|
Tragelaphus euryceros
|
0
|
1
|
1
|
0
|
0
|
5
|
3
|
10
|
0,008
|
99,986
|
|
Felis aurata celidogaster
|
0
|
3
|
3
|
0
|
0
|
0
|
0
|
6
|
0,005
|
99,991
|
|
Bitis gabonica
|
2
|
1
|
1
|
0
|
0
|
0
|
1
|
5
|
0,004
|
99,995
|
|
Genetta johnstoni
|
1
|
0
|
0
|
0
|
0
|
1
|
1
|
3
|
0,003
|
99,997
|
|
Kinixys homana
|
0
|
0
|
0
|
1
|
0
|
1
|
0
|
2
|
0,002
|
99,999
|
|
Tockus camurus
|
0
|
0
|
0
|
1
|
0
|
0
|
0
|
1
|
0,001
|
100
|
|
Aonyx capensis
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
100
|
|
Lutra maculicollis
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
100
|
|
Hystrix cristata
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
100
|
|
Total
|
6293
|
31796
|
21775
|
14101
|
8820
|
22523
|
12400
|
117708
|
100
|
|
Annexe 3 : Répartition des dix premières
espèces des secteurs
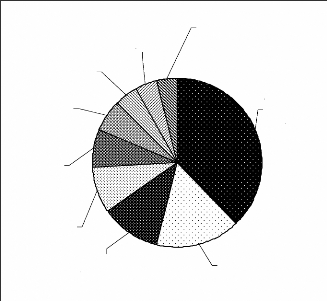
Bycanites
fistulator; 5,51%
Galagoides
demidovii; 4,55%
Cercopithecus
mona; 6,72%
Tauraco
macrorynchus;
3,50%
Corytheaola
cristata; 8,74%
Tropicranus
albocristatus;
3,13%
Ceratogymna
atrata; 3,00%
Guettera eduardi;
12,39%
Cercopithecus
petaurista;
28,84%
Figure A 1 : Répartition des pourcentages des dix
premières espèces du secteur I
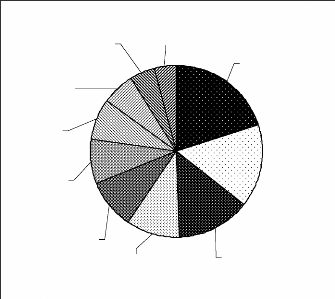
Ceratogymna
elata; 5,3 7%
Corytheaola
cristata; 5,64%
Colob us verus;
4,11%
A gela tes
meleagrides;
6,41%
Piiocolob us
b adius b adius;
3,21%
Tauraco
m acroryn chus;
6,69%
Guettera
eduardi; 2,79%
Cercoceb us
atys atys;
9,34%
Cercopithecus
petaurista;
13,59%
Ceratogymna
atrata; 10,52%
Figure A 2 : Répartition des pourcentages des dix
premières espèces du secteur II
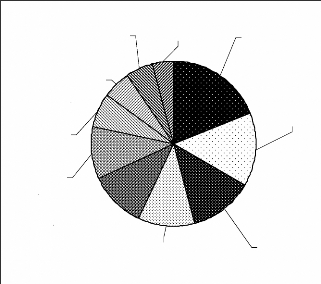
Cercopithecus
petaurista;
5,12%
Guettera
eduardi;
7,87%
Ceratogymna
atrata; 8,44%
Colobus
polykomos
polykomos;
4,32%
Guettera
elata; 4,04%
Cercopithecus
mona; 8,55%
Tauraco
macrorynchu
s; 3,23%
Cercopithecus
diana diana;
14,43%
Corytheaola
cris tata;
9,54%
Cercocebus
atys atys;
11,17%
Figure A 3 : Répartition des pourcentages des dix
premières espèces du secteur III
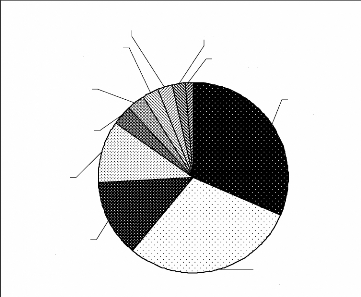
Cercocebus
atysatys; 9,95%
Cercopithecus
petaurista;
12,16%
Guettera elata;
2,99%
Colob us
polykomos
polykomos;
2,92%
Colob us verus;
2,63%
Ceratogymna
atrata; 2,22%
Guettera
eduardi; 2,01%
Cephalophus
maxwelli; 1,3 7%
Piliocolob us
b adius b adius;
2 7,93%
Cercopithecus
diana diana;
29,2 7%
Figure A 4 : Répartition des pourcentages des dix
premières espèces du secteur IV
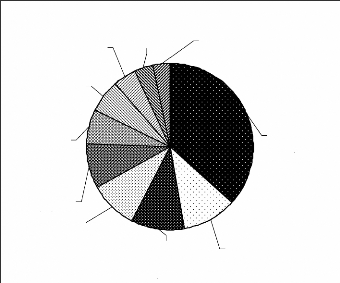
Colobus
polykomos
polykomos;
5,42%
Guettera
elata; 7,09%
Cephalophus
maxwelli;
5,08%
Cercopithecus
mona; 3,68%
Ceratogymna
atrata; 7,62%
Corytheaola
cris tata;
2,97%
Cercocebus
atys atys;
8,28%
Cercopithecus
petaurista;
2,70%
Piliocolobus
badius
badius; 8,80%
Cercopithecus
diana diana;
29,71%
Figure A 5 : Répartition des pourcentages des dix
premières espèces du secteur V
Annexe 4 : Tests de Levene et de
Kruskal-Wallis
Tableau A 3 : Test d'égalité des variances
des erreurs de Levene au seuil de 5%
|
Espèces
|
F
|
ddl1
|
ddl2
|
Signification
|
|
Cercopithecus diana diana
|
20,9799
|
26
|
1248
|
2,908E-80
|
|
Piliocolobus badius badius
|
10,711
|
29
|
706
|
0,000
|
|
Cephalophus maxweii
|
5,820
|
28
|
947
|
4,551E-19
|
|
Toutes les espèces
|
102,377
|
29
|
13307
|
0,000
|
Tableau A 4 : Test de Kruskal-Wallis au seuil de
5%
|
Espèces
|
Khi-deux
|
ddl
|
Signification asymptotique
|
|
Cercopithecus diana diana
|
Année Secteur
|
94,3 14
|
6
|
0,000
|
|
328,222
|
4
|
0,000
|
|
Piliocolobus badius badius
|
Année Secteur
|
35,153
|
6
|
0,000
|
|
355,946
|
4
|
0,000
|
|
Cephalophus maxweii
|
Année Secteur
|
18,738
|
6
|
0,004
|
|
68,844
|
4
|
3,980E-14
|
|
Toutes les espèces
|
Année Secteur
|
135,6058
|
6
|
8,470E-27
|
|
1160,1873
|
4
|
6,800E-250
|
Annexe 5 : Distances parcourues par secteur Tableau A 5:
Distances parcourues par secteur
|
Distance
parcourue
totale par an
|
Distances parcourues par Secteur
|
|
Année
|
Secteur I
|
Secteur II
|
Secteur III
|
Secteur IV
|
Secteur V
|
|
1999
|
1102,45
|
0,00
|
0,00
|
447,50
|
308,60
|
303,60
|
|
2000
|
1809,07
|
328,00
|
0,00
|
502,12
|
509,25
|
509,25
|
|
2001
|
1679,04
|
376,00
|
0,00
|
309,15
|
491,60
|
491,60
|
|
2002
|
1782,12
|
408,50
|
0,00
|
357,72
|
538,30
|
538,30
|
|
2003
|
851,70
|
148,00
|
11,40
|
325,15
|
263,15
|
263,15
|
|
2004
|
2080,20
|
300,00
|
356,20
|
500,00
|
452,00
|
452,00
|
|
2005
|
972,00
|
88,00
|
160,00
|
220,00
|
276,00
|
276,00
|
|
Total
|
10276,58
|
1648,50
|
527,60
|
2701,64
|
2838,90
|
2833,90
|
Annexe 6 : Moyenne des taux d'observations des
espèces retenues Tableau A 6 : Moyenne des taux d'observations pour
toutes les espèces
|
Année
|
Secteur
|
Moyenne
|
Ecart-type
|
Nombre d'observations
|
|
1999
|
III
|
0,921
|
1,0228
|
352
|
|
IV
|
3,055
|
4,6685
|
276
|
|
V
|
0,867
|
1,0208
|
406
|
|
moyenne 1999
|
1,47
|
2,7355
|
1034
|
|
2000
|
I
|
1,071
|
1,327
|
134
|
|
III
|
2,35
|
3,4718
|
902
|
|
IV
|
5,996
|
9,7782
|
799
|
|
V
|
1,23 1
|
1,6963
|
703
|
|
moyenne 2000
|
3,12
|
6,2666
|
2538
|
|
2001
|
I
|
1,174
|
1,2006
|
194
|
|
III
|
1,913
|
2,3329
|
609
|
|
IV
|
3,843
|
5,5924
|
785
|
|
V
|
1,251
|
1,3841
|
705
|
|
moyenne 2001
|
2,308
|
3,762
|
2293
|
|
2002
|
I
|
0,802
|
0,8435
|
226
|
|
III
|
2,151
|
5,9672
|
419
|
|
IV
|
2,52
|
3,1538
|
769
|
|
V
|
1,125
|
1,2828
|
648
|
|
moyenne 2002
|
1,818
|
3,4631
|
2062
|
|
2003
|
I
|
0,732
|
0,6839
|
83
|
|
II
|
1,089
|
0,9318
|
7
|
|
III
|
1,28
|
1,7435
|
646
|
|
IV
|
3,234
|
3,2706
|
305
|
|
V
|
1,326
|
1,7306
|
131
|
|
moyenne 2003
|
1,754
|
2,3691
|
1172
|
|
2004
|
I
|
1,194
|
1,3593
|
112
|
|
II
|
0,88
|
0,873
|
262
|
|
III
|
1,721
|
2,4583
|
1381
|
|
IV
|
3,506
|
3,1456
|
510
|
|
V
|
1,139
|
1,1982
|
534
|
|
moyenne 2004
|
1,835
|
2,4307
|
2799
|
|
2005
|
I
|
1,221
|
1,3467
|
34
|
|
II
|
0,622
|
0,7539
|
96
|
|
III
|
1,889
|
2,5442
|
731
|
|
IV
|
3,332
|
3,2909
|
352
|
|
V
|
0,933
|
0,9019
|
226
|
|
moyenne 2005
|
1,992
|
2,6262
|
1439
|
|
Moyenne
secteur
|
I
|
1,007
|
1,1325
|
783
|
|
II
|
0,816
|
0,8505
|
365
|
|
III
|
1,805
|
2,9963
|
5040
|
|
IV
|
3,829
|
5,8982
|
3796
|
|
V
|
1,139
|
1,3657
|
3353
|
|
moyenne totale
|
2,14
|
3,884
|
13337
|
Tableau A 7 : Moyenne de Cercopithecus diana
diana
|
Année
|
Secteur
|
Moyenne
|
Ecart-type
|
Nombre
d'observations
|
|
III
|
1,738
|
1,0709
|
21
|
|
1999
|
IV
|
8,017
|
7,0863
|
30
|
|
V
|
2,619
|
1,7641
|
44
|
|
Moyenne 1999
|
4,129
|
4,9322
|
95
|
|
I
|
2,125
|
2,2981
|
2
|
|
III
|
6,813
|
6,3198
|
62
|
|
2000
|
IV
|
16,202
|
13,4312
|
84
|
|
V
|
3,639
|
3,0442
|
86
|
|
Moyenne 2000
|
8,977
|
10,4455
|
234
|
|
I
|
1,125
|
0,4330
|
4
|
|
III
|
4,033
|
2,1194
|
34
|
|
2001
|
IV
|
8,824
|
7,6481
|
113
|
|
V
|
2,724
|
1,9112
|
93
|
|
Moyenne 2001
|
5,705
|
6,1333
|
244
|
|
I
|
1,056
|
0,6095
|
9
|
|
III
|
3,362
|
2,3265
|
33
|
|
2002
|
IV
|
5,004
|
4,2236
|
105
|
|
V
|
2,323
|
1,7682
|
83
|
|
Moyenne 2002
|
3,646
|
3,4272
|
230
|
|
I
|
0,250
|
0,0000
|
3
|
|
III
|
2,000
|
1,2536
|
36
|
|
2003
|
IV
|
6,100
|
3,1430
|
49
|
|
V
|
2,781
|
1,4256
|
16
|
|
Moyenne 2003
|
4,002
|
3,0935
|
104
|
|
II
|
1,000
|
.
|
1
|
|
III
|
3,997
|
2,3156
|
83
|
|
2004
|
IV
|
5,682
|
3,4003
|
95
|
|
V
|
2,602
|
1,4778
|
64
|
|
Moyenne 2004
|
4,276
|
2,9094
|
243
|
|
II
|
0,150
|
0,3354
|
5
|
|
III
|
5,436
|
3,7996
|
39
|
|
2005
|
IV
|
6,654
|
3,8163
|
52
|
|
V
|
2,069
|
1,0262
|
29
|
|
moyenne 2005
|
4,950
|
3,8494
|
125
|
|
I
|
1,056
|
0,8768
|
18
|
|
II
|
0,292
|
0,4587
|
6
|
|
Moyenne
|
III
|
4,295
|
3,8848
|
308
|
|
secteur
|
IV
|
8,160
|
8,1002
|
528
|
|
V
|
2,760
|
2,0911
|
415
|
|
moyenne Totale
|
5,331
|
6,1902
|
1275
|
Tableau A 8 : Moyenne de Piliocolobus badius
badius
|
Année
|
Secteur
|
Moyenne
|
Ecart-type
|
Nombre
d'observations
|
|
III
|
1,500
|
.
|
1
|
|
IV
|
8,950
|
6,688
|
25
|
|
1999
|
|
|
|
|
|
V
|
1,610
|
1,088
|
7
|
|
Moyenne 1999
|
7,170
|
6,634
|
33
|
|
III
|
2,880
|
2,024
|
12
|
|
2000
|
IV
|
17,860
|
17,1 12
|
73
|
|
V
|
1,880
|
1,349
|
30
|
|
Moyenne 2000
|
11,620
|
15,465
|
115
|
|
III
|
2,810
|
2,219
|
8
|
|
IV
|
8,930
|
8,24
|
94
|
|
2001
|
|
|
|
|
|
V
|
2,430
|
2,024
|
38
|
|
Moyenne 2001
|
6,580
|
7,455
|
140
|
|
III
|
3,940
|
6,151
|
10
|
|
2002
|
IV
|
5,330
|
4,418
|
98
|
|
V
|
1,800
|
1,473
|
38
|
|
Moyenne 2002
|
4,170
|
4,279
|
146
|
|
I
|
0,750
|
1,377
|
7
|
|
II
|
0,200
|
0,447
|
5
|
|
2003
|
III
|
2,390
|
2,558
|
11
|
|
IV
|
7,660
|
3,764
|
43
|
|
V
|
1,980
|
0,735
|
15
|
|
Moyenne 2003
|
4,840
|
4,237
|
81
|
|
II
|
0,780
|
0,619
|
8
|
|
III
|
1,170
|
1,125
|
12
|
|
2004
|
IV
|
6,610
|
3,492
|
84
|
|
V
|
2,270
|
0,93
|
25
|
|
Moyenne 2004
|
4,720
|
3,766
|
129
|
|
II
|
0,540
|
0,6
|
6
|
|
III
|
1,560
|
1,663
|
4
|
|
2005
|
IV
|
6,400
|
3,818
|
49
|
|
V
|
2,060
|
1,266
|
8
|
|
Moyenne 2005
|
4,720
|
4,064
|
67
|
|
I
|
0,160
|
0,683
|
32
|
|
II
|
0,550
|
0,593
|
19
|
|
Moyenne
|
III
|
2,490
|
3,126
|
58
|
|
secteurs
|
IV
|
8,770
|
9,343
|
466
|
|
V
|
2,060
|
1,463
|
161
|
|
Moyenne totale
|
6,220
|
8,241
|
736
|
Tableau A 9 : Moyenne de Cephalophus
maxwelli
|
Année
|
Secteur
|
Moyenne
|
Ecart-type
|
Nombre
d'observations
|
|
III
|
0,738
|
1,0709
|
21
|
|
IV
|
0,9017
|
7,0863
|
30
|
|
1999
|
|
|
|
|
|
V
|
1,619
|
1,7641
|
44
|
|
Moyenne 1999
|
1,129
|
4,9322
|
95
|
|
I
|
0,225
|
2,298 1
|
2
|
|
III
|
0,813
|
6,3198
|
62
|
|
2000
|
IV
|
1,202
|
13,4312
|
84
|
|
V
|
2,639
|
3,0442
|
86
|
|
Moyenne 2000
|
1,77
|
10,4455
|
234
|
|
I
|
,0125
|
0,4330
|
4
|
|
III
|
0,633
|
2,1194
|
34
|
|
2001
|
IV
|
1,824
|
7,6481
|
113
|
|
V
|
2,724
|
1,9112
|
93
|
|
Moyenne 2001
|
1,705
|
6,1333
|
244
|
|
I
|
0,56
|
0,6095
|
9
|
|
III
|
0,862
|
2,3265
|
33
|
|
2002
|
IV
|
1,004
|
4,2236
|
105
|
|
V
|
1,523
|
1,7682
|
83
|
|
Moyenne 2002
|
1,046
|
3,4272
|
230
|
|
I
|
0,250
|
0,0000
|
3
|
|
III
|
1,000
|
1,2536
|
36
|
|
2003
|
IV
|
1,100
|
3,1430
|
49
|
|
V
|
1,181
|
1,4256
|
16
|
|
Moyenne 2003
|
1,002
|
3,0935
|
104
|
|
II
|
0,200
|
.
|
1
|
|
III
|
0,997
|
2,3156
|
83
|
|
2004
|
IV
|
1,682
|
3,4003
|
95
|
|
V
|
1,602
|
1,4778
|
64
|
|
Moyenne 2004
|
1,276
|
2,9094
|
243
|
|
II
|
0,150
|
0,3354
|
5
|
|
III
|
1,036
|
3,7996
|
39
|
|
2005
|
IV
|
1,054
|
3,8163
|
52
|
|
V
|
1,069
|
1,0262
|
29
|
|
moyenne 2005
|
1,950
|
3,8494
|
125
|
|
I
|
0,256
|
0,8768
|
18
|
|
II
|
0,192
|
0,4587
|
6
|
|
Moyenne
|
III
|
0,895
|
3,8848
|
308
|
|
secteur
|
IV
|
1,160
|
8,1002
|
528
|
|
V
|
1,760
|
2,0911
|
415
|
|
moyenne Totale
|
1,331
|
6,1902
|
1275
|
Annexe 7 : Tableaux des densités des
espèces retenues Tableau A 10 : Densités de
Cephalophus maxwelli
|
Année
|
Secteur
|
Densité (Individus/ha)
|
Erreur
standard
|
CV (%)
|
Intervalle de confiance à 95%
|
|
Borne inférieure
|
Borne supérieure
|
|
V
|
0,242
|
0,0658
|
27,13
|
0,1429
|
0,411
|
|
IV
|
0,156
|
0,0538
|
34,88
|
0,07835
|
0,3033
|
|
1999
|
III
|
0,154
|
0,0271
|
17,58
|
0,1092
|
0,2172
|
|
V
|
0,308
|
0,0788
|
25,52
|
0,188
|
0,506
|
|
IV
|
0,162
|
0,0321
|
19,78
|
0,11
|
0,239
|
|
2000
|
III
|
0,142
|
0,0163
|
11,43
|
0,114
|
0,178
|
|
V
|
0,402
|
0,0920
|
21,78
|
0,275
|
0,598
|
|
IV
|
0,179
|
0,0477
|
26,53
|
0,107
|
0,301
|
|
2001
|
III
|
0,119
|
0,0164
|
13,85
|
0,09
|
0,156
|
|
V
|
0,367
|
0,1490
|
40,62
|
0,162
|
0,829
|
|
IV
|
0,183
|
0,0482
|
26,25
|
0,109
|
0,308
|
|
2002
|
III
|
0,152
|
0,0193
|
12,66
|
0,118
|
0,889
|
|
V
|
0,213
|
0,0821
|
44,64
|
0,103
|
0,409
|
|
IV
|
0,178
|
0,0441
|
24,72
|
0,11
|
0,288
|
|
2003
|
III
|
0,083
|
0,0160
|
19,27
|
0,056
|
0,121
|
|
V
|
0,308
|
0,0929
|
24,62
|
0,143
|
0,561
|
|
IV
|
0,214
|
0,0580
|
18,48
|
0,118
|
0,394
|
|
2004
|
III
|
0,101
|
0,0137
|
13,57
|
0,0773
|
0,132
|
|
V
|
0,306
|
0,0600
|
20,23
|
0,218
|
0,442
|
|
IV
|
0,221
|
0,0653
|
29,48
|
0,124
|
0,393
|
|
2005
|
III
|
0,108
|
0,0127
|
15,11
|
0,082
|
0,114
|
Tableau A 11 : Densités de Cercopithecus diana
diana
|
Année
|
Secteur
|
Densité (Individus/ha)
|
Erreur
standard
|
CV (%)
|
Intervalle de confience à
95%
|
|
Borne inférieure
|
Borne supérieure
|
|
V
|
0,721
|
0,1940
|
26,95
|
0,427
|
1,216
|
|
IV
|
2,101
|
0,3856
|
18,36
|
1,464
|
3,012
|
|
1999
|
III
|
0,524
|
0,1513
|
28,85
|
0,297
|
0,924
|
|
V
|
1,425
|
0,2709
|
19,01
|
0,983
|
2,065
|
|
IV
|
4,673
|
1,1130
|
23,82
|
2,942
|
7,422
|
|
2000
|
III
|
0,899
|
0,1590
|
17,77
|
0,634
|
1,273
|
|
V
|
0,949
|
0,1500
|
15,90
|
0,695
|
1,295
|
|
IV
|
4,436
|
0,4844
|
10,92
|
3,581
|
5,496
|
|
2001
|
III
|
0,982
|
0,1974
|
27,38
|
0,421
|
1,235
|
|
V
|
1,439
|
0,4280
|
29,76
|
0,162
|
0,829
|
|
IV
|
3,752
|
0,5340
|
14,23
|
2,834
|
4,968
|
|
2002
|
III
|
0,583
|
0,1250
|
21,50
|
0,382
|
0,889
|
|
V
|
0,782
|
0,1383
|
17,68
|
0,553
|
1,105
|
|
IV
|
3,526
|
0,5330
|
21,12
|
1,673
|
3,813
|
|
2003
|
III
|
0,683
|
0,1605
|
23,49
|
0,430
|
1,083
|
|
V
|
1,276
|
0,1780
|
12,96
|
1,066
|
1,775
|
|
IV
|
3,946
|
0,4321
|
9,30
|
2,868
|
5,579
|
|
2004
|
III
|
1,109
|
0,4860
|
26,91
|
0,907
|
2,059
|
|
V
|
1,137
|
0,1822
|
16,03
|
0,826
|
1,561
|
|
IV
|
3,452
|
0,6984
|
20,23
|
2,324
|
5,128
|
|
2005
|
III
|
1,114
|
0,2682
|
24,07
|
0,697
|
1,779
|
Tableau A 12 : Densités de Piliocolobus badius
badius
|
Année
|
Secteur
|
Densité (Individus/ha)
|
Erreur
standard
|
CV (%)
|
Intervalle de confience à 95%
|
|
Borne inférieure
|
Borne supérieure
|
|
V
|
0,721
|
0,1940
|
26,95
|
0,427
|
1,216
|
|
IV
|
1,603
|
0,3856
|
18,36
|
1,214
|
3,012
|
|
1999
|
III
|
0,524
|
0,1513
|
28,85
|
0,297
|
0,924
|
|
V
|
0,373
|
0,0986
|
26,40
|
0,222
|
0,628
|
|
IV
|
1,786
|
0,3590
|
20,10
|
1,206
|
2,645
|
|
2000
|
III
|
0,659
|
0,2050
|
31,09
|
0,359
|
1,209
|
|
V
|
0,296
|
0,0906
|
30,55
|
0,162
|
0,540
|
|
IV
|
2,395
|
0,3558
|
14,86
|
1,790
|
3,204
|
|
2001
|
III
|
0,522
|
0,1827
|
34,98
|
0,261
|
1,043
|
|
V
|
0,415
|
0,0924
|
22,28
|
0,267
|
0,644
|
|
IV
|
2,301
|
0,9260
|
40,25
|
1,060
|
4,998
|
|
2002
|
III
|
0,535
|
0,2242
|
41,86
|
0,237
|
1,208
|
|
V
|
0,233
|
0,0929
|
39,88
|
0,088
|
0,611
|
|
IV
|
1,801
|
0,7390
|
41,08
|
0,824
|
3,936
|
|
2003
|
III
|
0,438
|
0,1284
|
29,29
|
0,245
|
0,784
|
|
V
|
0,251
|
0,0545
|
21,70
|
0,163
|
0,386
|
|
IV
|
1,961
|
0,4143
|
21,12
|
1,295
|
2,970
|
|
2004
|
III
|
0,422
|
0,0823
|
19,51
|
0,288
|
0,618
|
|
V
|
0,259
|
0,0644
|
24,84
|
0,157
|
0,425
|
|
IV
|
2,259
|
0,2358
|
10,44
|
1,839
|
2,774
|
|
2005
|
III
|
0,449
|
0,1202
|
26,73
|
0,264
|
0,765
|
Annexe 8 : Tableaux des différents groupes et sous
groupes utilisés Tableau A 13 : Récapitulatif des groupes et sous
groupes des mammifères
|
Groupe Groupe niveua
niveau I II
|
Nom commun
|
Nom scientifique
|
|
|
|
Cercocèbe enfumé
|
Cercocebus atys atys
|
|
|
|
Cercopithèque diane
|
Cercopithecus diana diana
|
|
|
|
Cercopithèque hocheur
|
Cercopithecus nictitans
|
|
|
Singes
|
Cercopithèque mone
|
Cercopithecus mona
|
|
Cercopithèque pétauriste
|
Cercopithecus petaurista
|
|
|
|
|
Primates
|
|
Colobe bai
|
Piliocolobus badius badius
|
|
|
|
Colobe blanc et noir
|
Colobus polykomos polykomos
|
|
|
|
Colobe vert
|
Colobus verus
|
|
|
|
Galago de Demidoff
|
Galagoides demidovii
|
|
|
Autres
|
|
Potto de Bosman
|
Peridicticus potto
|
|
|
Primates
|
|
Chimpanzé
|
Pan troglodytes verus
|
|
|
|
|
|
|
Céphalophe à bande dorsale noire
|
Cephalophus dorsalis
|
|
|
|
Céphalophe à dos jaune
|
Cephalophus silvicultor
|
|
|
|
Céphalophe d'Ogilby
|
Cephalophus ogilbyi
|
|
|
Céphalophes
|
Céphalophe de Jentink
|
Cep halophus jentinki
|
|
Antilopes
|
|
Céphalophe de Maxwell
|
Cephalophus maxwelli
|
|
Céphalophe noir
|
Cephalophus niger
|
|
|
|
|
|
|
Céphalophe zébré
|
Cep halophus zebra
|
|
|
|
Antilope royale
|
Neotragus pygmaeus
|
|
|
Autres
|
|
Guib harnaché
|
Tragelaphus scriptus scriptus
|
|
|
Antilopes
|
|
Chevrotain aquatique
|
Hyemoschus aquaticus
|
|
|
|
|
|
|
Bongo
|
Tragelaphus euryceros
|
|
Mammifères
|
|
|
Buffle de forêt
|
Syncerus caffer nanus
|
|
Potamochère
|
Potamochoerus porcus porcus
|
|
|
|
|
|
Grands
|
|
Hippopotame nain
|
Choeropsis liberiensis
|
|
|
Mammifères
|
|
Hylochère
|
Hylochoerus meinherzthageni
|
|
|
|
|
|
|
Léopard
|
Panthera pardus leopardus
|
|
|
|
Eléphant de forêt
|
Loxodonta africana cyclotis
|
|
|
|
Athérure
|
Atherurus africanus
|
|
|
|
Aulacode
|
Thryonomys swinderianus
|
|
|
|
Pangolin à écailles
|
Manis tricuspis
|
|
|
|
Pangolin à longue queue
|
Manis tetradactyla
|
|
|
|
Pangolin géant
|
Manis gigantea
|
|
|
|
Daman d'arbres
|
Dendrohyrax arboreus
|
|
|
|
Mangouste brune
|
Crossarchus obscursus
|
|
|
|
Mangouste de Libéria
|
Liberiictus kuhni
|
|
|
Autres
|
Mangouste de marais
|
Atilax paludinosus pluto
|
|
|
Mammifères
|
Mangouste rouge
|
Herp estes sanguineus melanurus
|
|
|
|
Nandinie
|
Nandinia binotata binotata
|
|
|
|
Chat doré
|
Felis aurata celidogaster
|
|
|
|
Civette
|
Viverra civatta
|
|
|
|
Genette de Johnston
|
Genetta johnstoni
|
|
|
|
Genette pardine
|
Genetta pardina
|
|
|
|
Ratel
|
Mellivora capensis cottoni
|
|
|
|
Rat de Gambie
|
Cricetomys emeni
|
|
|
|
Poiane
|
Poina richardsoni
|
Tableau A 14 : Récapitulatif des groupes et sous
groupes des oiseaux
|
Groupe niveau I
|
Nom commun
|
Nom scientifique
|
|
Oiseaux
|
Bucerotidae
|
Calao à huppe blanche
|
Tropicranus albocristatus
|
|
Calao à joues brunes
|
Bycanistes cylindricus cylindricus
|
|
Calao Longibande
|
Tockus fasciatus
|
|
Calao Pygmé à bec noir
|
Tockus hartlaubi
|
|
Calao Pygmée
|
Tockus camurus
|
|
Calao siffleur
|
Bycanistes fustilator
|
|
Grand Calao à casque jaune
|
Ceratogymna elata
|
|
Grand Calao à casque noir
|
Ceratogymna atrata
|
|
Phasianidae
|
Pintade à poitrine blanche
|
Agelastes meleagrides
|
|
Pintade bleue
|
Guttera eduardi
|
|
Francolin de Latham
|
Francolinus lathami
|
|
Psittacidae
|
Perroquet vert
|
Poicephalus gulielmi
|
|
Jacko
|
Psittacus erithacus
|
|
Musophagidae
|
Touraco à gros bec
|
Psittacus erithacus
|
|
Touraco géant
|
Corythaeola cristata
|
|
Accipitridae
|
Aigle Blanchard
|
Stephanoaetus coronatus
|
|
Reptiles
|
Crocodiles
|
Crocodile à front large
|
Osteolaemus tetrapsis
|
|
Crocodile à nuque cuirassé
|
Crocodylus cataphractus
|
|
Crocodile du Nil
|
Crocodylus niloticus
|
|
Serpents
|
Python de séba
|
Python sebae
|
|
Vipère gabonica
|
Bitis gabonica
|
|
Vipère nasicornis
|
Bitis nasicornis
|
|
Tortues
|
Kinixys d'home
|
Kinixys homana
|
|
Kinixys rongée
|
Kinixys erosa
|
|
Gastéropodes
|
Escargots
|
Escargot géant noir
|
Achatina ventriculosa
|
|
Escargot géant rouge
|
Achatina achatina
|
Annexe 9 : Cartes d'analyses spatiales de Cephalophus
maxweii
Figure A 8 : Analyses spatiales de 1999 Figure A
7 Analyses spatiales de 2000 Figure A 6 Analyses spatiales de 2000
En 1999, l'on avait trois secteurs situés tous à
l'Ouest.
En 2000, un secteur a été ajouté du
côté Sud-Est.
En 2004, un autre secteur a été ajouté du
côté Nord-Est.
Nous remarquons qu'au fur et à mesure que l'on ajoutait
des secteurs, les analyses spatiales donnaient des résultats
différents Cela montre les limites d'extrapolation des données
des secteurs.
Annexe 10 : Fiches de collecte des donnees de
Biomonitoring
PACPNT : CELLULE SUIVI ECOLOGIQUE
PACPNT : CELLULE SUIVI ECOLOGIQUE PACPNT : CELLULE SUIVI
ECOLOGIQUE
PACPNT : CELLULE SUIVI ECOLOGIQUE
DISTANCE SAMPLING-MATIN
DISTANCE SAMPLING-SOIR
(Aller-Retour)
(15 h et 19 h)
N° Transect : .. Secteur : Date : ..../...../
Temps : sec / pluie
N° Transect : .. Secteur : Date : ..../...../
Temps : sec / pluie
Enquêteurs :
Enquêteurs :
1. / 2.
1. / 2.
Heure de départ :
Heure de départ :
Côté
Plaque
Nombre
Vu/
Entendu
Strate
Angle
Activité
Heure
Distance/
observation
Espèce
Distance
/transect
Vu/
Entendu
Angle
Strate
Activité
Nombre
Plaque
Côté
Heure
Espèce
Distance
/transect
Distance/
observation
Heure d'arrivée : Heure d'arrivée :
Interrompu : l'heure : Distance : Cause :
Remarques :
Interrompu : l'heure : Distance : Cause :
Remarques :
cr = crier, ch = chanter, vo = voler, fu = fuir, ma = manger, bo
= bouger, re = rester
cr = crier, ch = chanter, vo = voler, fu = fuir, ma = manger, bo
= bouger, re = rester cr = crier, ch = chanter, vo = voler, fu = fuir, ma =
manger, bo = bouger, re = rester
cr = crier, ch = chanter, vo = voler, fu = fuir, ma = manger, bo
= bouger, re = rester
t
|
PACPNT : CELLULE SUIVI ECOLOGIQUE
|
|
|
TRACES ET CROTTES
|
(15 h 00)
|
N° Transect : ..... Secteur : Date : ..../...../
Temps : sec/pluie
Enquêteurs :
1. / 2.
Heure de départ :
|
Eléphant
|
Buffle
|
Bongo
|
Hippopotame
|
Céph. Grand
|
Céph. Petit
|
Potamochère
|
Hylochère
|
Panthère
|
Homme (*)
|
|
Distance
|
Crottes
|
Traces
|
Crottes
|
Traces
|
Crottes
|
Traces
|
Crottes
|
Traces
|
Crottes
|
Traces
|
Crottes
|
Traces
|
Crottes
|
Traces
|
Crottes
|
Traces
|
Crottes
|
Traces
|
Traces
|
|
50
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
100
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
150
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
200
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
250
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
300
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
350
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
400
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
450
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
500
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
550
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
600
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
650
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
700
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
750
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
800
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
850
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
900
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
950
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1000
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1050
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1100
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1150
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1200
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1250
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1300
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1350
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1400
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1450
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1500
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Heure d'arrivée : Remarques :
(*) t = trace, p = pile, cp = campement, ca = cartouche, pi =
piège, fc = coup de fusil
Annexe 11 : Les espèces biomonitrices pour le Parc
National de Taï (PNT, 1999)
Soixante quinze (75) espèces animales sont actuellement
considérées comme bio indicatrices. Les critères
identifiés pour la sélection de ces espèces sont les
suivants :
- l'endémisme ;
- la vulnérabilité ;
- la menace de disparition ;
- le braconnage intensif ;
- la rareté ;
- le rôle dans la dispersion des graines et dans la
régénération de beaucoup d'espèces de plantes ;
et
- l'indication pour la qualité et le type d'habitat.
Tableau A 15 : Liste des espèces de
mammifères biomoniteurs
|
Nom scientifique
|
Nom français
|
Justification du Monitoring
|
|
Espèces
|
|
|
Raisons pour la protection et degré de
menace
(d'après l'IUCN)
|
Espèces indicatrices de la qualité
d'habitat
|
|
PRIMATES
|
|
Toutes les espèces de singes sont menacées par la
chasse et par la perte de leurs habitats.
La composition spécifique, le comportement, la taille de
groupe et les densités sont de bons indicateurs du braconnage.
|
|
Lorisidae
|
|
|
|
|
|
Perodicticus potto
|
Potto de Bosman
|
|
Endémique en Afrique de l'Ouest
|
Préférence d'habitat inconnue
|
|
Galago demidovii
|
Galago de
Demidoff
|
|
Endémique en Afrique de l'Ouest
|
Préfère la forêt secondaire; présence
probable d'une autre espèce "Galago de Thomas" dans les formations
forestières primaires
|
|
Cercopithecidae
|
|
Espèce importante pour la dispersion des grains et donc
pour la régénération de beaucoup d'espèces de
plantes
|
|
Cercopithecus mona lowei
|
Cercopithèque Mone
|
|
|
Forêt primaire et secondaire
|
|
Cercopithecus diana diana
|
Cercopithèque Diane
|
|
Sous-espèce vulnérable
|
Forêt primaire
|
|
Cercopithecus petaurista
|
Cercopithèque pétauriste
|
|
|
Forêt primaire et secondaire
|
|
Cercopithecus nictitans
|
Cercopithèque Hocheur
|
|
|
Présence dans le Parc en petit nombre
|
|
Colobus verus
|
Colobe vert
|
|
Espèce menacée
|
Forêt primaire et secondaire
|
|
Piliocolobus badius badius
|
Colobe bai
|
|
Statut vulnérable
|
Forêt primaire
|
|
Colobus polykomos polykomos
|
Colobe blanc et noir
|
|
Statut vulnérable
|
Forêt primaire et secondaire
|
|
Cercocebus torquatus atys
|
Cercocèbe enfumé
|
|
Statut vulnérable
|
Forêt primaire
|
|
Pongidae
|
|
|
|
|
|
Pan troglodytes verus
|
Chimpanzé
|
|
Espèce menacée
|
|
|
PHOLIDOTA
|
|
|
|
|
|
Manidae
|
|
|
|
|
|
Manis tricuspis
|
Pangolin à écailles
|
|
Chassé intensivement
|
|
|
Manis tetradactyla
|
Pangolin à longue queue
|
|
Chassé intensivement
|
Forêt humide
|
|
Manis gigantea
|
Pangolin géant
|
|
Chassé intensivement
|
Forêt primaire
|
|
CARNIVORA
|
|
|
|
|
|
Mustelidae
|
|
|
|
|
|
Aonyx capensis
|
Loutre à cou tacheté
|
|
|
Rivières; Statut inconnu
|
|
Lutra maculicollis
|
Loutre à joues blanches
|
|
|
Rivières; Statut inconnu
|
|
Nom scientifique
|
Nom français
|
Justification du Monitoring
|
|
Mellivora capensis cottoni
|
Ratel
|
|
|
Statut inconnu
|
|
Viverridae
|
|
Groupe riche en espèce, aussi bien terrestre
qu'arboricole; en groupe ou solitaire; aussi bien diurne que nocturne;
Le plus souvent commun et endémique; Statut dans la
forêt primaire pour la plupart inconnu.
|
|
Atilax paludinosus
|
Mangouste de marais
|
|
|
Rivières et bas fonds
|
|
Crossarchus obscurus
|
Mangouste brune
|
|
|
Forêt primaire
|
|
Liberiictus kuhni
|
Mangouste de Libéria
|
|
Endémique, Statut: espèce menacée
|
Forêt primaire
|
|
Herpestes sanguineus
|
Mangouste rouge
|
|
|
Forêt secondaire
|
|
Civetticus civetta
|
Civette
|
|
|
Forêt secondaire et primaire
|
|
Genetta pardina
|
Genette pardine
|
|
|
Statut inconnu
|
|
Genetta johnstoni
|
Genette de Johnston
|
|
Endémique; rare
|
Forêt primaire; statut inconnu
|
|
Nandinia binotata
|
Nandinie
|
|
|
Forêt primaire
|
|
Poiana richardsoni
|
Poiane
|
|
Statut vulnérable; rare
|
Forêt primaire
|
|
|
|
|
|
|
Felidae
|
|
|
|
|
|
Profelis aurata
|
Chat doré
|
|
Statut vulnérable; rare
|
Forêt primaire
|
|
Panthera pardus leopardus
|
Léopard
|
Prédateur supérieure
|
Chassé intensivement; espèce menacée
|
|
|
|
|
|
|
|
PROBOSCIDAE
|
|
|
|
|
|
|
|
|
|
|
Elephantidae
|
|
|
|
|
|
Loxodonta africana cyclotis
|
Eléphant de forêt
|
Important pour la régénération de la
forêt
|
Statut d'espèce menacée
|
Dispersion peu connue dans le PNT
|
|
HYRACOIDAE
|
|
|
|
|
|
Procaviidae
|
|
|
|
|
|
Dendrohyrax arboreus
|
Daman d'arbres
|
|
|
Arboricole
|
|
ARTYODACTYLA
|
|
|
|
|
|
Suidae
|
|
|
|
|
|
Hylochoerus meinhertzhageni
|
Hylochère
|
|
Espèce menacée
|
Mosaïque forêt- herbage
|
|
Potamochoerus porcus porcus
|
Potamochère
|
|
|
Forêt primaire
|
|
Hippopotamidae
|
|
|
|
|
|
Choeropsis liberiensis
|
Hippopotame nain
|
|
Endémique; Statut vulnérable
|
Forêt primaire
|
|
Tragulidae
|
|
|
|
|
|
Hyemoschus aquaticus
|
Chevrotain aquatique
|
|
|
Lié à l'eau
|
|
Bovidae
|
|
Toutes les espèces de céphalophes sont
chassées intensivement. La densité et les changement de
population sont des mesures importantes pour estimer le braconnage
|
|
Cephalophus maxvelli
|
Céphalophe de Maxwell
|
|
|
Forêt primaire et secondaire
|
|
Cephalophus niger
|
Céphalophe noir
|
|
|
Forêt primaire
|
|
Cephalophus dorsalis
|
Céphalophe à bande dorsale noire
|
|
|
Forêt primaire
Statut inconnu
|
|
Cephalophus zebra
|
Céphalophe zébré
|
|
Endémique. Menace de disparition
|
Forêt primaire
|
|
Cephalophus ogilbyi
|
Céphalophe d'Ogilby
|
|
|
Forêt primaire; statut inconnu
|
|
Cephalophus sylvicultor
|
Céphalophe à dos jaune
|
|
|
Présence et statut inconnu
|
|
Cephalophus jentinki
|
Céphalophe de Jentink
|
|
Endémique, espèce menacée
|
Forêt primaire
|
|
Neotragus pygmaeus
|
Antilope royale
|
|
|
Statut inconnu
|
|
Tragelaphus scriptus
|
Guib harnaché
|
|
|
Forêt secondaire
|
|
Tragelaphus euryceros
|
Bongo
|
|
|
Forêt primaire et secondaire
|
|
Syncerus caffer nanus
|
Buffle de forêt
|
|
|
Lisière de forêt
|
|
Thryonomidae
|
|
|
|
|
|
Nom scientifique
|
Nom français
|
Justification du Monitoring
|
|
Thryonomys swinderianus
|
Aulacode
|
|
Chassé intensivement
|
Forêt secondaire et plantations
|
|
Hystricidae
|
|
|
|
|
|
Atherurus africanus
|
Athérure
|
|
Espèce exploitée intensivement
|
Forêt primaire et secondaire
|
|
Hystrix cristata
|
Porc-épic
|
|
|
Présence dans la forêt primaire incertaine
|
|
Cricetidae
|
|
|
|
|
|
Cricetomys enemi
|
Rat de Gambie
|
|
Espèce exploitée intensivement
|
Forêt primaire
|
Tableau A 16 : Liste des espèces d'oiseaux
biomoniteurs
|
Nom scientifique
|
Nom français
|
Justification du Monitoring
|
|
Espèces
|
|
Espèces clés
|
Raisons pour la
protection et degré de menace
(d'après l'IUCN)
|
Espèces indicatrices de la qualité
d'habitat
|
|
Accipitridae
|
|
|
|
|
|
Stephanoaetus coronatus
|
Aigle Blanchard
|
Prédateur supérieure
|
|
Forêt primaire
|
|
Rallidae
|
|
|
|
|
|
Himantornis haematopus
|
Râle à Pattes Rouges
|
|
|
Régions marécageuses
|
|
Phasianidae
|
|
|
|
|
|
Francolinus lathami
|
Francolin de Latham
|
|
|
Forêt primaire
|
|
Guttera eduardi
|
Pintade bleu
|
|
|
Forêt primaire
|
|
Agelastes meleagrides
|
Pintade à poitrine blanche
|
|
Endémique; espèce menacée
|
Forêt primaire
|
|
Psittacidae
|
|
Comme cavernicole, l'espèce nécessite des grands
hauts arbres
|
|
Poicephalus gulielmi
|
Perroquet vert
|
|
|
Forêt primaire; Statut inconnu
|
|
Psittacus erithacus
|
Jacko
|
|
|
Forêt primaire; Statut inconnu
|
|
Musophagidae
|
|
Comme frugivore, important pour la dispersion et
régénération de beaucoup d'espèces de plantes
|
|
Corythaeola cristata
|
Touraco géant
|
|
|
Forêt primaire et secondaire
|
|
Tauraco macrorynchus
|
Touraco à gros bec
|
|
|
Forêt primaire
|
|
Bucerotidae
|
|
Comme frugivore, important pour la dispersion et
régénération de beaucoup d'espèces de plantes;
comme cavernicole l'espèce nécessite des grands hauts arbres; Les
grandes espèces sont chassées. De bons indicateurs de la
qualité d'habitat, apparaissent dans des groupes mixtes.
|
|
Bycanistes cylindricus
|
Calao à joues brunes
|
|
Espèce presque menacée
|
Forêt primaire
|
|
Ceratogymna elata
|
Grand Calao à casque jaune
|
|
Endémique dans l'Afrique de l'Ouest; espèce
presque menacée
|
Forêt primaire
|
|
Ceratogymna atrata
|
Grand Calao à casque noire
|
|
|
Forêt primaire
|
|
Tropicranus albocristatus
|
Calao à huppe blanche
|
|
|
Dans les strates moyennes de la forêt; lié aux
singes
|
|
Tockus fasciatus
|
Calao Longibande
|
|
|
Forêt secondaire et plantations
|
|
Tockus camurus
|
Calao Pygmée
|
|
|
Poursuit les fourmis
magnans et est souvent lié aux communautés
d'oiseaux
|
|
Tockus hartlaubi
|
Calao Pygmée à bec noir
|
|
|
Dans les strates moyennes de la forêt; liées aux
singes
|
Tableau A 17 : Liste des espèces de
gastéropodes biomoniteurs
|
Nom scientifique
|
Nom français
|
Justification du Monitoring
|
|
Espèces
|
|
Espèces clés
|
Raisons pour la protection et degré de
menace
(d'après l'IUCN)
|
Espèces indicatrices de la qualité
d'habitat
|
|
Gastropodae
|
|
|
|
|
|
Achatina achatina
|
Escargot géant rouge
|
|
|
Récolté intensivement
|
|
Archaratina ventricosa
|
Escargot géant noir
|
|
|
récolté intensivement
|
Tableau A 18 : Liste des espèces de reptiles
biomoniteurs
|
Nom scientifique
|
Nom français
|
Justification du Monitoring
|
|
Espèces
|
|
Espèces clés
|
Raisons pour la protection et degré de
menace
(d'après l'IUCN)
|
Espèces indicatrices de la
qualité
d'habitat
|
|
Testudines
|
Tortues
|
|
|
|
|
Kinixys erosa
|
Kinixys rongée
|
|
|
Chassé intensivement
|
|
Kinixys homana
|
Kinixys d'home
|
|
|
Chassé intensivement
|
|
Crocodylia
|
Crocodiles
|
|
|
|
|
Crocodylus niloticus
|
Crocodil du Nil
|
|
|
Chassé intensivement
|
|
Crocodylus cataphractus
|
Crocodil à nuque cuirassé
|
|
|
Chassé intensivement espèce de forêt
|
|
Ostaeolaemus tetraspis
|
Crocodil à front large
|
|
|
espèce de forêt
|
|
Serpentes
|
|
|
|
|
|
Bitis nasicornis
|
Vipère nasicornis
|
|
|
Poursuivi intensivement, forêt primaire
|
|
Bitis gabonica
|
Vipère gabonica
|
|
|
Poursuivi intensivement, forêt primaire
|
|
Phython sebae
|
Phyton de Séba
|
|
|
Poursuivi intensivement; bas fonds
|
Annexe 12 : Photos de quelques espèces animales
biomontrices du Parc National de Taï
(PNT, 2001)

Photo 1: Céphalophus jentinki
Photo 2 : Cephalophus maxwelli
Photo 3 : Cephalophus niger
Photo 4 : Cephalophus.zebra
|
|
|
Photo 5 : Hyemoschus aquaticus
|
|
Photo 6 : Syncerus caffer nanus
|

Photo 7: Cercopithecus diana diana
Photo 8 : Cercopithecus mona lowei

Photo 9 : Cercopithecus petaurista


Photo 12 : Colobus verus

Photo 10 : Piliocolobus badius badius
Photo 11 : Colobus polykomos polykomos
|
|
|
Photo 13 : Cercocebus atys atys
|
|
Photo 14 : Pan troglodytes verus
|

Photo 15 : Loxodonta africana cyclotis
Photo 16 : Panthera pardus leopardus

Photo 17 : Poicephalus gulielmi
Photo 18 : Psittacus erithacus
|
|
|
Photo 19 : Tauraco macrorynchus
|
Photo 20 : Stephanoaetus coronatus

Photo 21 : Python sebae
Photo 22 : Bitis gabonica
Annexe 13 : Données pluviométriques de la
région Sud-Ouest Tableau A 19 : Données pluviométriques de
la région Sud-Ouest de 1919 à 1998
|
Poste
météo-
rologiq
ue
|
période
de
référenc
e
|
précipitations moyennes - en mm -
|
nombre
jours
de pluie
|
minimum
absolu
(mm/an)
|
maximum
absolu
(mm/an)
|
|
janvier
|
février
|
mars
|
avril
|
mai
|
juin
|
juillet
|
août
|
septem.
|
octob.
|
novem.
|
décem.
|
moyenne
annuelle
|
|
Tabou
|
1919 - 1998
|
50,0
|
46,7
|
86,2
|
138,8
|
422,4
|
530,4
|
173,4
|
120,3
|
227,6
|
194,8
|
186,0
|
138,8
|
2 315
|
163
|
1 219
|
3 400
|
|
Grabo
|
1944 - 1996
|
87,2
|
102,4
|
169,0
|
196,8
|
286,1
|
322,7
|
99,0
|
114,7
|
245,9
|
298,8
|
227,8
|
123,5
|
2 274
|
137
|
1 661
|
3 462
|
|
Taï
|
1924 - 1996
|
17,7
|
74,2
|
162,8
|
174,3
|
218,2
|
265,3
|
147,9
|
171,0
|
307,2
|
252,2
|
114,7
|
43,5
|
1 949
|
123
|
1 384
|
3 193
|
|
Guiglo
|
1924 - 1996
|
16,8
|
54,0
|
118,3
|
152,9
|
178,3
|
252,2
|
143,6
|
184,3
|
321,0
|
212,0
|
61,2
|
28,0
|
1 723
|
105
|
886
|
3 122
|
|
Soubré
|
1940 - 1996
|
26,5
|
62,9
|
128,7
|
145,9
|
166,0
|
214,4
|
106,7
|
114,6
|
195,2
|
171,0
|
105,7
|
46,8
|
1 484
|
102
|
841
|
2 419
|
|
Moyenn
e des
régions
|
1919-1998
|
39,64
|
68,04
|
133
|
161,74
|
254,2
|
317
|
134,12
|
140,98
|
259,38
|
225,76
|
139,08
|
76,12
|
1949
|
126
|
863,5
|
3119,2
|
(Source : PNT, 2001)
Annexe 14 : Liste partielle de plantes utiles aux
populations de l'Espace Taï
(PNT, 2001)
Plantes médicinales
Alafia multiflora Alstonia boonei Carpolobia lutea Cnestis
ferruginea Corynanthe pachyceras Erythrophleum ivorense Holarrhena
floribunda
Lannea nigritana var. pubescens Leea
guineensis
Monodora myristica
Okoubaka aubrevillei Pachypodanthium staudtii
Piper guineense Pycnanthus angolensis
Plantes alimentaires de cueillette
Myrianthus arboreus Piper guineense Ricinodendron heudelotii
Salacia owabiensis Telfairia occidentalis Tieghemella heckelii Trichoscypha
arborea
Laccosperma secundiflorum
Beischmielda mannii Blighia sapida
Dacryodes klaineana Deinbollia pinnata Dioscorea
praehensilis
Irvingia gabonensis Landolphia hirsuta
Plantes servant dans la construction de l'habitat
traditionnel
Enantia polycarpa Raphia hookeri
Eremospatha macrocarpa Strombosia glaucescens
Musanga cecropioides Thaumatococcus daniellii
Pycnanthus angolensis Trema guineensis
Plantes employées dans l'artisanat
Alstonia boonei
Laccosperma secundiflorum Antiaris toxicaria var.
africana Calamus deerratus
Entada pursaetha Eremospatha hookeri Raphia hookeri
Thaumatoccus daniellii
Plantes d'usage divers
Acacia kamerunensis Aframomum exscapum
Balanites wilsoniana Celtis mildbraedii
Chrysophyllum perpulchrum Coffea canephora
Cola nitida
Cola chlamydantha Garcinia kola Iodes liberica
Momordica angustisepala Platysepalum hirsutum Strychnos
aculeata
32
|
|



