|
UNIVERSITE D'ABOMEY-CALAVI FACULTE DES SCIENCES
AGRONOMIQUES DEPARTEMENT DE PRODUCTION
VEGETALE
(DPV)
Etude de quelques paramètres biologiques de
Amblyseius swirskii Athias-
Henriot (Acari: Phytoseiidae) prédateur de
Megalurothrips sjostedti
Trybom (Thysanoptera: Thripidae) ravageur de
niébé,
Vigna unguiculata (L.) Walp.
THESE
Pour l'obtention du Diplôme d'Ingénieur
Agronome
Option : Science et Technique de Production
Végétale (STPV) Présentée et soutenue
par
Joël DA YE LOFFA
Le 17 décembre 2007
Superviseur : Prof. Dr. Ir. Pierre
ATACHI
Co-superviseur : Dr Rachid HANNA
Composition du jury :
Président : Dr. Ir. Bonaventure
AHOHUENDO
Rapporteur : Pr. Dr. Ir. Pierre ATACHI
Examinateur : Dr. Rachid HANNA
Examinateur : Dr. Elisabeth ZANNOU
UNIVERSITY OF D'ABOMEY-CALAVI FACULTY OF AGRONOMY
SCIENCES DEPARTEMENT OF PLANT
PRODUCTION
(DPV)
Some biological parameters of Amblyseius
swirskii Athias-Henriot (Acari:Phytoseiidae) predator of
Megalurothrips sjostedti Trybom (Thysanoptera: Thripidae), important
pest of cowpea, Vigna
unguiculata (L.) Walp.
THESE
Of the requierment for Agricultural Engineer degree
OPTION
Science et Technique de Production
Végétale (STPV)
Présented and submitted
on
17 december 2007
By Joël DAYE LOFFA
Supervisor : Prof. Dr. Ir. Pierre
ATACHI
Co-superviseur : Dr Rachid HANNA
Member of jury :
President : Dr. Ir. Bonaventure AHOHUENDO
Raporter : Pr. Dr. Ir. Pierre ATACHI Examiner :
Dr. Rachid HANNA
Examiner : Dr. Elisabeth ZANNOU
CERTIFICATION
Je certifie que ce travail a été conduit par DAYE
LOFFA Joël à la Faculté des Sciences Agronomiques (Option
Production Végétale; section protection des
Végétaux) de l'Université d'Abomey-Calavi.
Le Superviseur :
Pr. Dr. Ir. Pierre ATACHI, professeur d'entomologie à la
Faculté des Sciences Agronomiques (F SA) à l'Université
d'Abomey-Calavi (UAC)
DEDICACE
Je dédie ce travail :
Au Seigneur, le Père tout Puissant pour tous les bienfaits
dont il m'a comblé.
REMERCIEMENTS
Avant d'exposer les résultats de cette étude, je
voudrais exprimer ma respectueuse reconnaissance à Monsieur le
Professeur ATACHI Pierre, entomologiste à la FSA/ UAC qui a
supervisé mes travaux de recherche pour ses meilleurs conseils et pour
toutes les facilités qu'il a eues à me donner au cours de la
réalisation de ce travail.
J'exprime ma profonde gratitude au Docteur J. BRAIMA,
Directeur de l'IITACotonou pour avoir accepté ma demande de stage dans
son institut
Je présente mes sincères reconnaissances au
Docteur M. TAMO et au Docteur R. HANNA, chercheurs à l'IITA-Cotonou,
qui, prêtant une attention particulière à mes travaux,
m'ont aidé dans l'acquisition des matériels indispensables
à la réalisation de ces travaux.
Je m'en voudrais de ne pas exprimer mes sincères
reconnaissances au Dr Alexis ONZO, à M. Koffi NEGLOH, M. Cyriaque
AGBOTON, au Dr Désiré GNAVOSSOU et leurs collègues des
sections Acarologie et Niébé, pour leurs conseils divers sans
lesquels je ne pourrais rester dans le temps pour les travaux.
Mes sincères remerciements vont à l'endroit des
techniciens des sections Niébé et Acarologie de qui j'ai eu tous
les appuis techniques dans le cadre de ces travaux, je voudrais nommer en
particulier M. Richard HOUNDAFOCHE, M. Séraphin ETEKA et M. Mathias
AZOKPOTA.
Il m'est agréable de manifester toute ma reconnaissance
à tous mes parents et en particulier à mon grand-frère M.
DAYE LOFFA Anatole, directeur d'école à Aplahoué, qui
s'est investi pour ma scolarisation et envers qui je reste redevable. Qu'ils
reçoivent à travers ce document, les témoignages de ma
sincère gratitude.
C'est le moment pour moi de témoigner à ma
mère Kindémin MEDEKEGNON, à mon grand-frère
N'Gbédro DAYE LOFFA, à mon épouse Anita LOKOSSOU et mon
fils Gnonan Junior. DAYE LOFFA, toute ma reconnaissance à leurs efforts
pour moi.
Je ne saurais oublier enfin tous mes amis qui ont
été tout au long de ces recherches, des collaborateurs
dévoués et efficaces, je voudrais nommer en particulier Pamphile
LOKOSSOU, Etienne SODJI, Isidore DAGOUDO, Cyprien DATO, Clément SEWADE,
Abdel-Aziz LAWANI., Géofroid AGBON, Henriette SEWADE, Francine SEWADE,
Lydia LOKOSSOU.
TABLE DES MATIERES
TITRES PAGES
CERTIFICATION iv
DEDICACE v
REMERCIEMENTS vi
TABLE DES MATIERES .vii
LISTE DES TABLEAUX x
LISTE DES PHOTOS ..xi
LISTE DES FIGURES .. xii
LISTES DES SIGLES xiii
RÉSUMÉ xiv
ABSTRACT .xv
CHAPITRE I: INTRODUCTION ...1
CHAPITRE II: REVUE DE LITERATURE ...4
2.1 Le niébé Vigna unguiculata (Fabacae)
(L.) Walp ...5
2.1.1 Ecologie, distribution et production ...5
2.1.2 Importance et utilisation du niébé ...6
2.1.3 Complexe parasitaire du niébé ...7
2.2 Megalurpthrips sjostedti (Thysanoptera: thripidae)
Trybom ...8
2.2.1 Origine et distribution ...8
2.2.2 Taxonomie ...8
2.2.3- Morphologie, Biologie et Ecologie ...9
2.2.4- Méthodes de lutte contre les thrips .11
2.3 Les phytoséiides: Systématique, Biologie et
Ecologie .15
2.3.1 Systématique .15
2.3.2 Biologie .15
2.4-Amblyseius swirskii Athias-Henriot (Acari:
Phytoseiidae) : Systématique, Biologie et Ecologie 20
|
2.4.1- Systématique
|
.20
|
|
2.4.2- Origine, Biologie et Eologie
|
.20
|
|
2.4.3- Importance de Amblyseius swirskii
|
.21
|
|
CHAPITRE 3: MATÉRIEL ET MÉTHODES
|
.23
|
|
3.1 Cadre physique de l'étude
|
.24
|
|
3.2- Matériels
|
.24
|
|
3.2.1- Matériel végétal
|
.24
|
|
3.2.2- Matériel animal
|
.29
|
|
3.2.3- Matériel de travail
|
30
|
|
3-3 Méthodes
|
.31
|
|
3.3.1 Elevage des thrips
|
.31
|
|
3.3.2 Elevage en masse de Amblyseius swirskii (
phytoséiide)
|
.32
|
|
3.3.3 Conduite des essais
|
.33
|
|
·
· Vulnérabilité des larves d'un
jour (larves 1) et larves de deux jours (larves
2) à la prédation de A. swirskii
32
·
· Prédation de Amblyseius
swirskii à différentes densités de larves
|
|
d'un jour (larves 1)
|
33
|
|
·
· Fécondité de Amblyseius
swirskii à partir des pollens
|
.34
|
|
·
· Table de vie de Amblyseius swirskii.
|
.34
|
|
3-4- Analyses statistiques
|
.37
|
|
CHAPITRE 4: RESULTATS
|
.38
|
|
4 RÉSULTATS
|
.39
|
|
4.1 Vulnérabilité des larves d'un jour (larves 1)
et les larves de deux jours (larves 2) de M. sjostedti à la
prédation de Amblyseius swirskii
|
39
|
|
4.2 Effet de la densité de larves d'un jour sur la
capacité de prédation
|
|
|
de A. swirskii .....
|
39
|
|
4.3 Fécondité de Amblyseius swirskii sur
des pollens des plantes hôtes
|
.41
|
4.4 Effet de la combinaison de larves d'un jour et de pollen de
niébé sur la prédation
|
par A. swirskii
4.5 Effet des régimes alimentaires sur la durée des
stades juvéniles
4.6 Effet des régimes alimentaires sur la
fécondité des femelles
4.7 Effet des régimes
alimentaires sur l'éclosion
|
..42
.43
.44
|
|
des oeufs de Amblyseius swirskii
|
...47
|
|
4.8 Effet des régimes alimentaires sur le sexe ratio des
progénitures
|
.47
|
|
4.9 Influence des régimes sur la survie des
progénitures
|
.47
|
|
CHAPITRE 5: DISCUSSION
|
.49
|
|
5 DISCUSSION
|
.50
|
|
5.1 Vulnérabilité des stades larvaires de
Megalurothrips sjostedti
à la prédation de Amblyseius swirskii
|
50
|
|
5.2 Influence des densités de larve 1 sur la
capacité de prédation de
|
|
|
Amblyseius
swirskii..............................................................................
|
51
|
5.3 Fécondité de Amblyseius swirskii
suivant différents pollens .53
5.4 Table de vie de Amblyseius swirski 53
5.41 Effet de la combinaison de pollen et laves sur le taux de
prédation 53
5.4.2 Effet des aliments sur la fécondité des
femelles .55
CONCLUSION .56
RÉFÉRENCES BIBLIOGRAPHIQUES
.57
ANNEXES .67
LISTE DES TABLEAUX
TITRES PAGES
Tableau 1: Liste des prédateurs de thrips
...13
Tableau 2: Quelques variétés de
niébé 16
Tableau 3: Récapitulatif sur la
vulnérabilité des larves d'un jour et les larves de deux jours
39
Tableau 4: Nombre moyen de larves
consommées ...40
Tableau 5: Fécondité de
Amblyseius swirskii suivant les pollens ...42
Tableau 6: taux de prédation de A.
swirskii suivant la combinaison ou non
de larves avec le pollen de niébé 43
Tableau 7: Effets des aliments sur la
durée de développement des
Différents stades du Phytoséiide 43
Tableau 8: Effet des aliments sur la
fécondité des femelles de A. swirskii ..45
Tableau 9: Taux moyens d'éclosion des
oeufs suivant les régimes alimentaires....47
Tableau 10 : Sexe ratio de la progéniture
48
LISTE DES PHOTOS
TITRES PAGES
Photo 1: Mâles et femelles des thrips
floricoles .....9
Photo 2: Cycle de développement larvaire
de M. sjostedti ...10
Photo 3: Différentes plantes
utilisées 27
Photo 4: Larve de Megalurothrips sjostedti
28
Photo 5: Deux Amblyseius swirskii avec
une larve de thrips ...30
LISTE DES FIGURES
TITRES PAGES
Figure 1: Cycle de développement de
phytoséiide 18
Figure 2: Consommation moyenne de larves 1par
femelle par jour .41
Figure 3: fécondité des femelles en
fonction des aliments ...46
LISTE DES SIGLES ET ABRE VIA TIONS
FAO : Organisation des Nations Unies pour
l'Alimentation et
l'Agriculture.
FSA : Faculté des Sciences
Agronomiques.
UAC : Université d'Abomey-Calavi.
IITA : Institut International de d'agriculture
Tropicale
INRAB : Institut National de Recherche Agricole
au Bénin MAEP : Ministère de l'Agriculture, de
l'Elevage et de le Pêche MDR : Ministère du
Développement Rural
CIRAD : Centre International de Recherche
Agricole pour le Développement.
RESUME
Malgré l'existence de nombreuses méthodes de
lutte, la production du niébé Vigna unguiculata (L.)
Walpers demeure limitée par les ravageurs. La présente
étude se propose d'apprécier la possibilité de
reproduction de Amblyseius swirskii AthiasHenriot (Acari :
Phytoseiidae), prédateur de Megalurothrips sjostedti,
Trybom (Thysanoptera : Thripidae) à partir des larves et des
pollens des plantes hôtes alternatives de ces thrips floricoles, dans une
approche de lutte préventive. Pour ce faire, des essais ont
été conduits au laboratoire sur la vulnérabilité
à la prédation des larves de M. sjostedti. L'effet des
pollens de trois plantes hôtes de thrips - Lonchocarpus
sericeus, Tephrosia candida, Vigna unguiculata - et deux
plantes non- hôtes - Zea mays, Typha australis - sur la
reproduction et la survie du prédateur a été aussi
étudié. Les pollens sont extraits des fleurs des plantes
hôtes des thrips, collectées dans différentes
régions du sud et centre-Bénin. Au laboratoire, la
vulnérabilité de M. sjostedti à la
prédation par A. swirskii, a été testée
avec les larves d'un jour et les larves de deux jours de ce ravageur. Pour
chaque type, une densité de 5 larves a été
utilisée. Les résultats ont montré que le prédateur
a une influence significative sur les larves d'un jour (larves 1) de M.
sjostedti, alors qu'il n'a aucune influence sur les larves de deux jours
(larves 2). Par ailleurs, les femelles de phytoséiide, ont
été nourries séparément aux pollens des plantes
pendant une semaine. L'effet de chaque pollen sur l'oviposition des femelles du
phytoseiide a été apprécié à travers la
comparaison des moyennes d'oeufs pondus par femelle et par jour. L'essai a
montré que, le pollen de L. sericeus est le meilleur
après T. australis puis viennent respectivement les pollens de
V. unguiculata, Z. mays et T. candida.
La table de vie du prédateur a été
conduite avec les régimes alimentaires (traitements) : pollen de
V. unguiculata (V), pollen Typha australis (Ty),
larves 1 de M. sjostedti et la combinaison de pollen de V.
unguiculata + larves 1 de M. sjostedti (VL). Il
résulte de la table de vie que les traitements V, Ty, et VL, ont des
effets similaires sur la reproduction et sur la fécondité des
femelles du phytoséiide. Par contre, le niébé
entraîne une mortalité plus précoce chez les femelles
comparativement aux autres traitements. Amblyseius swirskii est un
nouvel acarien prédateur, qui possède d'intéressantes
potentialités biologiques pour une lutte biologique contre le thrips,
M. sjostedti, ravageur de niébé, Vigna
unguiculata.
Mots-clés: pollen, régime
alimentaire, table de vie, phytoseiide, Amblyseius swirskii,
prédateur, acarien, Vigna unguiculata, Tephrosia
candida, Zea mays, Lonchocarpus seriseus, Typha
australis.
ABSTRACT
Although the existence of great deal control strategies, the
cowpea, Vigna unguiculata production, still limited by pests.
In this thesis, we study the possibility of Amblyseius swisrkii
(Acari: Phytoseiidae) Athias-Henriot, to reproduce with Megalurothrips
sjostedti Trybom (Thysanoptera: thripidae) larvae instars and pollen of
this western flowering thrips host plants. So our works are conducted to
appreciate the vulnerability at the predation of M. sjostedti larvae
instars. The effect of the pollen of five thrips host plants (Lonchocarpus
sericeus, Vigna unguiculata, Tephrosia candida, Zea
mays and Typha australis) was tested too on the reproduction
function and the survival of the predator. The pollens were extracted from the
flowers of the thrips host plants, collected in different regions of south and
central-Benin. In the laboratory, the vulnerability of thrips was tested on the
first instars of M. sjostedti. (larvae 1 and larvae 2). We used five
(5) larvae for each instars with one (1) predator as densities. The results
show that the predator does not attack the larvae 2 but has a significant
effect on larvae 1 instars of the pest. In addition, phytoseiid nourish and lay
well on all the pollen sources. But the combination of cowpea pollen and larvae
1, reduces the predation rate of the phytoseiid. Nevertheless, A.
swirskii, is an interesting biological agent against M.
sjostedti.
Key words: pollens, diet, life table,
phytoseiid, Amblyseius swirskii, predator, acari, Vigna
unguiculata, Tephrosia candida, Zea mays,
Lonchocarpus sericeus, Typha australis.

INTRODUCTION
Le niébé, Vigna unguiculata (L.)
Walpers, est la légumineuse vivrière la plus importante et la
plus cultivée dans les régions d'Afrique Tropicale (Jakai &
Adalla, 1997). Il peut être cultivé en association avec d'autres
cultures principales tels que le sorgho, le maïs, l'igname ou le mil. Le
niébé se caractérise par sa richesse en protéines
et contribue énormément à la fertilisation des sols
grâce à la fixation symbiotique de l'azote atmosphérique
(Sun et Simbi, 1983). Au plan alimentaire, il occupe une place de choix du fait
qu'il constitue une importante source de protéines et d'énergie
tant pour les hommes que pour les animaux (Rachie, 1985; Anonyme, 2002). Dans
les pays en développement où l'accès aux protéines
d'origine animale est difficile voire impossible pour certaines populations, le
niébé constitue la seule source de protéine la plus
accessible et il est appelé, pour ce fait, «la viande du
pauvre». Ainsi, le niébé est susceptible de combler les
déficits protéiques des pays en développement qui
regorgent les trois quarts (3/4) de la population mondiale, mais qui ne
produisent que seulement le quart de la production mondiale de viande (Delobel
& Tran, cités par Capo-Chichi, 2005). Il constitue alors un aliment
d'appoint non négligeable pour l'amélioration de l'état
nutritionnel des populations des pays pauvres. Malgré cette
utilité du niébé, les rendements et les superficies
emblavées pour sa culture évoluent en dents de scie au
Bénin (INRAB, 1995).
Selon Coulibaly & Lowenber-Deboer (2002), l'Afrique
Occidentale est actuellement loin de couvrir ses besoins en niébé
par sa propre production. Dans cette partie du continent, les rendements moyens
oscillent autour de 230 kg/ha, sans application des pesticides, contre 800 kg/
ha avec application de pesticides (PEDUNE, 1998), alors que le rendement
potentiel du niébé est de 3000 kg/ha (Rusoke & Rubaihayo,
1994). Cette faiblesse du rendement est due au complexe parasitaire
associé à cette culture depuis la levée jusqu'au stockage
(Singh & Allen, 1980; Ahounou, 1990; Atachi, 1998; Agboton, 2004). Parmi
les insectes ravageurs, le thrips floricole Megalurothrips sjostedti
(Trybom), (Thysanoptera: Thripidae) (Syn: Taeniothrips sjostedti)
constituent la contrainte majeure à la production du niébé
dans les régions de l'Afrique au sud du Sahara (Okwakpam, 1967; Singh
& Allen, 1980; Ezueh, 1981; Jakai & Daoust, 1986; Tamo, 1991; Tamo
et al., 1993; Bottenberg et al., 1997). Ce
ravageur est capable d'occasionner des pertes de rendement
atteignant 20% à 80% des récoltes. En cas de fortes infestations,
les pertes de rendements sont totales.
Au nombre des exigences dont il faudrait tenir compte pour
augmenter la production du niébé au Bénin, on peut citer
les traitements phytosanitaires (MDR, 1992). Cette recommandation encourage
l'utilisation des pesticides de synthèse dont les effets nocifs des
résidus, ne sont plus ignorés de nos jours, quel que soit le
respect des doses recommandées. Chose plus grave, l'utilisation des
pesticides induit la résistance chez les ravageurs occasionnant leur
résurgence, et a des effets nocifs sur la santé humaine et sur
l'environnement (Programme Natura/Nectar, 1996). Il en résulte un
important risque d'intoxication difficilement chiffrable (Tissut et
al., 1979). Le faible niveau de revenu des producteurs ne leur permet pas
un accès facile à ces pesticides, du fait de leur coût
très élevé. Il s'avère alors impératif, de
rechercher d'autres méthodes de luttes contre ces ravageurs, dans le
contexte d'une agriculture écologique. On peut citer entre autres la
lutte biologique. En effet, la lutte biologique est une méthode de
protection des cultures dont le but est de réduire la population des
ravageurs en dessous du seuil économique des dégâts. Elle
se base sur l'utilisation des ennemis naturels natifs et ou exotiques pour
lutter contre les ravageurs des cultures. Cette façon de gérer
les ravageurs, permet d'éviter les effets néfastes des pesticides
chimiques sur l'environnement, les producteurs et les consommateurs (Nomikou,
2003). Dans ce contexte, certaines potentialités biologiques de
Amblyseius swirskii Athias-Henriot (Acari: Phytoseiidae), relatives
à son régime alimentaire seront évaluées, pour une
lutte biologique efficiente contre le thrips, M. sjostedti. Mais le
succès d'un programme de contrôle biologique doit provenir d'une
connaissance approfondie des paramètres bioécologiques de
l'ennemi naturel (Waag, 1989).
L'objectif global de la présente étude est de
contribuer à l'évaluation des capacités de A.
swirskii à réduire ou à supprimer les populations de
thrips en pullulation
De façon spécifique, il s'agira :
- d'évaluer la prédation de A. swirskii
sur les premier et deuxième stades larvaires de M.
sjostedti;
- de sélectionner les plantes-hôtes dont le pollen
assure au mieux la reproduction de A. swirskii; et
- d'évaluer l'effet de la combinaison du meilleur pollen
et des larves de M. sjostedti, sur le développement, la
reproduction et la survie de A. swirskii.

2.1 Le niébé, Vigna unguiculata (L.) Walp.
(Fabaceae).
Depuis des décennies, le thrips floricole, M.
sjostedti Trybom (Thysanoptera: Thripidae), l'un des principaux ravageurs
cibles du niébé, fait l'objet de nombreux travaux de recherche.
L'attachement des chercheurs à ce domaine, tient des lourdes pertes
qu'occasionnent ce thrips floricole sur la production de niébé
(Okwakpam, 1967; Singh & Allen, 1980; Ezueh, 1981; Jakai & Daoust,
1986; Tamo, 1991; Tamo et al., 1993 ; Bottenberg et al.,
1997). De nos jours, l'approche de lutte intégrée contre les
ravageurs, basée sur la manipulation de l'environnement est de plus en
plus envisagée, pour assurer une méthode de protection saine et
durable qui préserve la santé des producteurs ainsi que celle des
consommateurs (Tissut et al., 1979).
La présente revue de littérature se propose donc
de faire une synthèse des informations nécessaires à une
connaissance générale des facteurs édapho-climatiques,
sociologiques et le complexe parasitaire liés à la production de
niébé.
2.1.1- Ecologie, distribution et
production
Le niébé se développe dans les conditions
de chaleur et de luminosité intense. C'est une plante thermophile qui
requiert tout au long de sa croissance, une température oscillant entre
25 et 28°C et une pluviométrie de 750 à 1000 mm (Anochili,
1978). Il vit bien dans les sols profonds et bien drainés et est
tolérant à la sécheresse ainsi qu'à la
salinité du sol. Il peut se développer sous des conditions
environnementales variées et sur des sols pauvres, sans addition
d'engrais azotés. Il peut être semé en culture pure ou en
association avec d'autres cultures. Dans les associations de cultures, les
paramètres tels que la densité de plantation, les arrangements
spatiaux, la date de semis, le nombre de cultures associées varient
d'une région à une autre. Ces paramètres tiennent compte
de la fertilité des sols, de la disponibilité des semences et des
besoins alimentaires de la famille. Parmi les principales légumineuses
vivrières, le niébé et l'arachide occupent une place
importante en superficie et en production. Parfois les superficies du
niébé dépassent celles de l'arachide. En 2003, le
niébé a pris le dessus sur toutes les légumineuses avec
une contribution de 7 1,5% des emblavures, suivi de voandzou 10,6% (INRAB,
1995). Cela montre que le niébé est aussi une source de revenu
non
négligeable pour les producteurs. Mais l'essentiel de
la production est assuré par les petits paysans qui cultivent le
niébé avec des méthodes encore extensives.
Le niébé est cultivé au Bénin sur
toute l'étendue du territoire national. Les zones de prédilection
se rencontrent par ordre d'importance dans l'Ouémé, le Mono et le
Zou (MAEP, 2004). Les statistiques sur les douze dernières années
montrent que les superficies de production et les rendements évoluent en
dents de scie. Les rendements sont restés faibles et ne dépassent
pas 600 kg/ha (Agboton, 2004). Cette faiblesse est due au fait que le
niébé est toujours fortement parasité au champ et le
manque de traitements phytosanitaires adéquats affecte le rendement. Au
nombre des exigences dont il faudra tenir compte pour augmenter la production
du niébé, le Ministère du Développement Rural (MDR,
1992) préconise d'assurer le traitement phytosanitaire comme le font
déjà si bien les petits producteurs du coton. Ce travail doit se
faire en collaboration avec les structures d'encadrement technique
opérant sur le terrain.
2.1.2- Importance et utilisation du
niébé
Le niébé constitue la plus importante
légumineuse à graine cultivée en Afrique Tropicale. Il se
caractérise surtout par sa richesse en protéines (24-28%) et
autres constituants comme l'eau 11%, les hydrates de carbone 56,8%, les lipides
(1,3%), les fibres (3,9%), les cendres (3,6%), la vitamine A (32,42UI /100g),
la vitamine D (26- 78,02ug/100g) et la vitamine E (3,07-5,07 mg/100g). les
grains de niébé contiennent aussi du calcium (90mg/100g) du fer
(6-7mg/100g), de l'acide nicotinique (2mg/100g), de la thiamine (0,9mg/100g).
Mais il est pauvre en lysine (Platt, 1962; Oyenuga, 1968; Ogounmodedo &
Oyenuga, 1968; IITA, 1975).
Le niébé fournit une valeur
énergétique de 342 calories par 100g de graines (Oyenuga, 1968).
Sa capacité à fixer de l'azote atmosphérique lui
confère le rôle important de précédent cultural et
du maintien de la fertilité des sols (Ahounou, 1990). En dehors de ces
graines, les feuilles du niébé sont consommées comme
légume par les hommes, et comme fourrage par le bétail (INRAB,
1995). Le niébé sert aussi à la fabrication des colorants
verts (Bezpaly, 1984).
2.1.3- Complexe parasitaire du
niébé
Un vaste éventail de ravageurs s'attaque au
niébé depuis la levée jusqu'à la maturation
complète, occasionnant ainsi d'énormes dégâts
(Ahounou, 1990). Ces ravageurs ont été catégorisés
en trois groupes par Singh et al. (1979) :
+ Les insectes de pré-floraison
Il s'agit des coléoptères Chrysomelidae,
Ootheca mutabilis (Sahlb) et Paraluperodes quaternus
(Fairmare); des hémiptères Aphididae, Aphis craccivora
(Koch), des thysanoptères Thripidae du feuillage, Sericothrips
occipitalis (Hood), et les familles Jassidae, Empoasca dolichi
(Paoli).
+ Les insectes floricoles du
niébé:
Ce sont:
- les thysanoptères parasites des fleurs,
Megalurothrips sjostedti (Tryb.).
- les lépidoptères foreurs de gousses,
Maruca vitrata (Fabricius) et Cydia ptychora (Meyrick)
- les hétéroptères suceurs des gousses
Anoplocnemis curvipes (F.), Riptortus dentipes (F.),
Acanthomia tomentosicollis (Stäl), A. horrida (Germ) et
Nezara viridula (L.)
- Les coléoptères dévoreurs de fleurs
Mylabris farquharsoni
+ Les insectes de stock:
Les coléoptères Bruchidae Callosobruchus
maculatus (Fabricius), et Bruhidius atrolineatus (Pic). Nombre de
ces ravageurs sont des vecteurs des maladies virales, très
préjudiciables au niébé, en termes de qualité du
produit et du rendement. La mosaïque jaune du niébé est la
maladie virale la plus fréquemment transmise par les insectes floricoles
comme S. occipitalis, M. sjostedti, les
coléoptères P. quaternus, Nematocerus acerbus
Wilke ( Curculionidae) et Zonocerus variegatus F (Acridoidea:
Pygomophidae). (Whitney et al., cité par Sourokou, 1985).
En Afrique tropicale, en dehors des dégâts
spécifiques à chaque ravageur, le thrips M. sjostedti
peut occasionner jusqu'à 60% voire 100% de perte de rendement (Singh
& Allen, 1980; Ezueh, 1981); les larves causant plus de dégâts
que les adultes (Salifu, 1986).
2.2 Megalurothrips sjostedti (Thysanoptera: Thripidae)
Trybom
Le thrips floricole, M. sjostedti a
bénéficié de nombreuses études relatives à
son origine, sa distribution, sa taxonomie, sa morphologie et sa
bioécologie. Aussi des méthodes de lutte ont-elles
été développées pour la gestion de ce ravageur
redoutable au niébé.
2.2.1- Origine et distribution
:
L'espèce Megalurothrips sjostedti a
été rapportée pour la première fois sur le
continent africain, précisément en Afrique de l'Est, au
début du vingtième siècle (1905). Non seulement sa
répartition est restreinte au continent africain, mais il constitue la
seule espèce du genre retrouvée en Afrique (Palmer, 1987).
L'abondance en Asie de l'Est de certaines espèces de ce genre telles que
M. typicus (Bagnall), M. usitatus (Bagnall), laisse
suggérer l'Asie tropicale comme origine du genre Megalurothrips
(Palmer, 1987). Selon Salifu (1986), M. sjostedti est répandu
dans les agro-écosystèmes des pays comme l'Afrique du Sud, le
Bénin, le Cameroun, le Congo Démocratique, la Côte
d'Ivoire, le Gabon, la Gambie, le Ghana, la Guinée Equatoriale,
l'Ouganda et la Tanzanie. Autrefois appelé Taeniothrips
sjostedti, M. sjostedti est la seule espèce ayant le
statut de ravageur des cultures (Palmer, 1987). En Asie de l'Est, cette
espèce n'est pas nuisible aux cultures, puisque ses populations sont
maintenues en dessous du seuil économique des dégâts, par
des ennemis naturels. Cet argument renforce l'hypothèse selon laquelle
M. sjostedti ne soit pas d'origine africaine (Tamo et al.,
1997).
2.2.2- Taxonomie
Megalurothrips sjostedti appartient au super-ordre
des Thysanoptéroides, à l'ordre des Thysanoptères, au
sous-ordre des Terebrantia, à la famille des Thripidae, et à la
sous- famille des Thripinae (Lewis, 1997). Selon Palmer (1987), le genre
Megalurothrips regroupe des espèces facilement identifiables
par leur grande taille. Au stade adulte, ils sont de couleur noire alors que
les stades larvaires sont de couleur variable: blanchâtre, orange ou
rouge en fonction du régime alimentaire. Les mâles de M.
sjostedti sont caractérisés par un segment abdominal de
forme conique, alors que la femelle possède un petit ovipositeur
externe.
2.2.3- Morphologie, Biologie et
Ecologie
Les thrips floricoles sont de petits insectes de couleur
noirâtre de 1 à 2 mm de long, pourvus d'ailes étroites,
allongées et frangées de longs cils. On observe une segmentation
bien distincte des antennes, des pattes et de l'abdomen. De petite taille et
d'un noir pas trop foncé, les mâles sont estimés à
5% de la population, tandis que les femelles très noires, sont plus
grandes et plus abondantes (Tamo, 1991). La photo 1 montre les adultes
mâles et femelles de M. sjostedti.

1,5 mm

Photo 1: Mâle (à gauche) et femelle
(à droite) des thrips floricoles
Source: GOERGEN (communication personnelle)
IITA. Insect Museum, Cotonou Bénin
Selon Salifu (1986), le développement de l'oeuf
à l'adulte dure 19 jours dans les conditions de température de
26,8 #177; 1,4°C et de 65 #177; 10,4% d'humidité relative. Quatre
stades de développement sont identifiés: deux stades larvaires
(larve stade 1 et larve stade 2), un stade de pré nymphe et un stade de
nymphe. Les larves de stades 1 et 2 sont de très petite taille ; leurs
yeux sont rouges net brillants, avec des antennes, des pattes et l'abdomen
courts. Les nymphes se forment dans le sol. En l'absence du
niébé, les thrips se nourrissent et se reproduisent sur plusieurs
plantes hôtes. On y rencontre majoritairement des Fabaceae, quelques
Mimosaceae et Cesalpiniaceae, et une plante non légumineuse,
Cochlospermum planchoni Hook (Bisaceae) (Tamo et al., 1993a).
La photo 2 montre les différents stades de développement de
M. sjostedti.
b
a
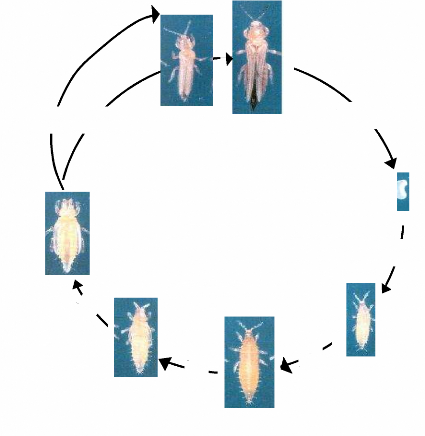
1 jour
3 - 4 jours
d
3 - 4 jours
c
g
3 - 4
jours
3 - 4
jours
f
e
2-3
jours
a) Adulte mâle b) Adulte femelle c) oeuf d) Larve
de stade 1 e) Larve de stade 2 f) Pré nymphe g) Nymphe
Photo 2 : cycle de développement M.
sjostedti, à 25°C
Source: Adapté de Tamo (1991).
2.2.4- Méthode de lutte
contre les thrips
La connaissance incomplète des caractères
biologiques de M. sjostedti restreint la gamme des mesures de lutte
contre cet insecte. Toutefois, plusieurs méthodes de lutte ont
donné des résultats appréciables (Sourokou, 1985).
+ Lutte chimique
Les pyréthrinoïdes synthétiques en
formulation simple ou combinée avec d'autres insecticides
contrôlent bien la population des thrips (IITA 1982). Le monocrotophos,
appliqué sur niébé s'est révélé plus
efficace que le fenvalérate et le DDT
(dichlodiphényltrichloroéthane) au sud du Nigéria entre
1973 et 1975. Le cymbush et le mélange cymbush (cypermétthrine) +
diméthoate sont significativement plus efficaces que atellic et
diméthoate. Un test de comparaisons d'insecticides, a conduit à
la conclusion que azodrine assure significativement un meilleur contrôle
des thrips et permet d'avoir de hauts rendements par rapport au DDT et au
sevimol. Le stade critique de menace des ravageurs est atteint à partir
du 37ème jour après semis. Singh (1980) suggéra
des interventions chimiques entre le 35ème et le
40ème jour; cependant, le début de floraison du
niébé dépend de son cycle et de sa sensibilité au
photopériodisme. Malgré leur efficacité, les effets
pervers de ces insecticides font accorder une attention particulière aux
méthodes de lutte plus écologiques (Tissut et al.,
1979).
+ Lutte culturale
Il est préférable que dans un système
d'association maïs-niébé, le maïs soit semé
avant le niébé, de façon que le maïs entre en
floraison avant celle du niébé. Cette pratique contribue au bon
développement du niébé et permet aussi de réduire
les dégâts occasionnés par les thrips. Lors de la
déhiscence des panicules, les méloïdes sont attirés
par les pollens du niébé (IITA, 1982). Par contre Rathore et
al., (1984) rapportent qu'en culture intercalaire, il n'y a pas de
différence significative entre la densité de population des
thrips sur le niébé en culture pure et celle associée au
maïs (IITA/SAFGRAD, 1984).
+ Lutte biologique
En relation avec les questions écologiques, doivent
être abordés, les problèmes des êtres vivants
auxiliaires de l'agriculture, des pollinisateurs et des prédateurs
divers
s'attaquant aux nuisibles. Dans le processus de contrôle
des thrips, des prédateurs et des parasitoïdes ont
été identifiés. Orius amnesius, O.
albidipennis (Hémiptère: Anthocoridae); Cheilomenes
sulphurea (Coléoptère: Coccinellidae), Iphyseius
sp. (Acari : Phytoseiidae) (Tamo et al., 1997) sont des
prédateurs identifiés pour une lutte biologique contre M.
sjostedti. Au nombre des parasitoïdes identifiés pour la
réduction naturelle des populations de M. sjostedti, on peut
citer: Ceranisus menes (Gahan) (Hyménoptère: Eulophidae)
(Diop, 1999), Ceranisus femoratus (Gahan) (Hyménoptère:
Eulophidae) (Agboton, 2004) et des genres de la famille Trichogrammatidae que
sont Megaphragma sp et Oligosita sp (Tamo et al.,
1997). Le tableau 1 présente la liste de quelques prédateurs de
thrips classés par ordre, famille, genre et espèce. Toutefois, la
question de l'efficacité de ces différents auxiliaires contre les
thrips se pose. Alors, des méthodes de lutte culturale et des
variétales sont aussi utilisées.
Tableau 1: Liste des prédateurs de
thrips
|
Ordre
|
Famille
|
Genre
|
Espèces
|
Proies (Thrips)
|
|
Orthoptère
|
Gryllidae
|
Oecanthus
|
Longicauda Turanicus
|
Thrips tabaci
Thrips tabaci
|
|
Névroptère
|
Chrysopidae
|
Chrysopa
|
Alobana Carnea Vulgaris Plorabula
|
Selenothrips rubrocinctus Selenothrips rubrocinctus
Odontothrips intermedius Caliothrips faciatus
|
|
Leucochrysa
|
Marquesi Submacula
|
Selenothrips rubrocinctus
Selenothrips
rubrocinctus
|
|
Hemerobiidae (brown lacewings)
|
Hemero bi us
|
Maliformicus Pacificus
|
Taeniothrips inconsequens
Taeniothrips
inconsequens
|
|
Diptère
|
Cecidomyiidae
|
Adelgimyza Artrocnodax
|
Thripiperda Occidentalis
|
Liothrips olae T. palmi
|
|
Asilidae
|
Machinu
|
Annuleps
|
Haplothrips sp.
|
|
Dolichopodidae
|
Condilostylus
|
Pacifus
|
Taeniothrips inconsequens
|
|
Syrohidae
|
Baccha Mesograpta
|
Livida Marginata
|
Gynaikothrips ficorum Thrips tabaci
|
|
Chloropididae
|
Lioscinella
|
Sabrosky
|
Teuchothrips sp.
|
|
Hyménoptère
|
Vespidae
|
Polistes
|
Hebraeus
|
Rhipiphorothrips cruentatus
|
|
Azteca Pheidole
|
Chartifox Megacephla
|
-
Liothrips urichi
|
|
Formicidae
|
Wasmannia
|
Auropunctata
|
Selenothrips rubrocinctus
|
|
Mesostigmates
|
Phytoseiidae
|
Amblyseius
|
Addoensis
Andersoni Stipulatus Swirskii
|
Heliothrips syvanus
Frankliniella occidentalis, Thrips tabaci
Scirtothrips citri
Thrips tabaci, Retrithrips syriacus
|
|
Typhlodromus
|
Pyri
Athiase
Occidentalis Waltersi
|
Drepanothrips reuteri Retrithrips syriacus Retrithrips
syriacus Frankliniella occidentalis
|
Source: Van Rijn (2002) et Agboton (2004)
·. Résistance
variétale
Des travaux d'amélioration génétique
développés par l'IITA et INRAB ont permis d'identifier du
matériel résistant aux thrips et d'autres ravageurs (IITA, 1979;
INRAB, 1995). Le tableau 2 présente quelques variétés
résistantes de niébé. IITA (op cite) a
développé des cultivars tels TVu 1509, 2870, 6507, 7133,
remarquables quant à leur degré de résistance. IITA (1982)
suggéra que cette résistance est due à une antibiose
contenue dans le niébé. Les cultivars à floraison
très précoce sont utilisés dans la lutte contre les thrips
parce qu'ils échappent en partie aux attaquent de ces thrips.
2.3- Les phytoséiides: systématique, biologie
et écologie
Les phytoséiides forment la famille des acariens, ennemis
naturels, prédateurs des ravageurs des cultures.
2.3.1- Systématique
Les phytoséiides sont des acariens appartenant à
l'Embranchement des Arthropodes, au Sous-Embranchement des
Chélicérates, à la Classe des Arachnides, à la
Sous-Classe des Acari, à l'ordre des Parasitiformes et à la
famille des Phytoseiidae.
2.3.2- Biologie
En général les espèces de la famille de
Phytoseiidae sont les plus importantes et certainement les mieux connues de
tous les acariens prédateurs. Jusqu'en 1992, seulement mille (1000)
espèces ont été décrites (Richard et al.,
1992). Leur importance s'explique par les raisons suivantes: (1) ils montrent
une forte capacité de prédation (2) ils sont capables de
maîtriser les acariens phytophages présents même à
des densités faibles (3) ils sont relativement faciles à
élever (Richard et al., 1992).
Les individus de ce groupe sont essentiellement des
prédateurs. Certaines espèces peuvent se développer sur
les acariens ériophyides, les oeufs de cochenilles, les thrips, les
aleurodes, le pollen, les exsudats végétaux et le miellat
(Richard et al., 1992 ). La plupart d'entre-eux se nourrissent de
tétranychides. Les phytoséiides sont caractérisés
par une productivité élevée et un cycle biologique court,
proche de celui de leur proie. En général, leur cycle vital
(oeuf, larve, protonymphe, deutonymphe et adulte) dure environ une (1) semaine
à 25oC. La Figure 1, présente le cycle de
développement des phytoséiides. Les femelles pondent trente (30)
à soixante-dix (70) oeufs au cours de leur vie (quatre (4) à six
(6) semaines) (Richard et al., 1992).
Tableau 2: Quelques variétés de
niébé
|
Noms
|
Synonymes
|
Port
|
Cycle (jours)
|
Caractéristiques
|
Saisons de
culture
|
Rendement s grain (T /ha)
|
Points
forts
|
Points faibles
|
|
IT 82 E
32
|
Gbenami Sévérine
|
Semi- érigé
|
60
|
Rougeâtre, moyenne et lisse
|
Grande
et petite
saison pluvieuses
|
1,5 à 2,2 avec 2 à 3 traitements
|
Insensibilité au
photopériodisme
, précocité,
bonne, aptitude
des feuilles en
sauce légume, bonne qualité de grain
|
Traitements obligatoires, sensibilité
au
Striga
|
|
IT 84 D
513
|
Glegnon
|
Erigé
|
70
|
Rouge,
moyenne, et lisse
|
Grande
et petite saison
|
1,5 à 2 avec
2 à 3 traitements
|
Bonne qualité de la
graine
|
Traitement phytosanitaire obligatoire
|
|
IT
81 D 1137
|
Evedoa
|
Erigé
|
70-80
|
Blanchâtre, grosse et
rugueuse
|
Grande
et petite saison
|
1,8 à 2,2
avec 2 traitements
|
Insensible
au photopériodisme
, assez résistant à
la bruche,
cuisson rapide,
bonne qualité
des graines
|
Sensibilité
au Striga et à la virose, traitements
phytosanitaires obligatoires.
|
|
IT 84 S 2246-4
|
Gnonmli
n
|
Erigé
|
60
-70
|
Brune, grosse et ridée
|
Grande saison et petite saison
|
1,5 avec 2 à
3 traitements
|
Résistant aux bruches, aux
aphides, et
thrips, cuisson
rapide, bonne
qualité organoleptique, bonne qualité de
|
Sensibilité
au Striga et à la
virose, traitement
phytosanitaire obligatoire
|
|
|
|
|
|
|
|
gâteau
|
|
|
TN 61
|
-
|
Erigé
|
70
|
Gris Noir,
moyenne
|
Principal
es
|
1,2 à 1, avec 2à 3 traitements
|
-
|
Traitements phytosanitaires obligatoires
|
|
TVX
185001F
|
-
|
|
65
|
Rougeâtre, moyenne à grosse
|
Principal
es
|
1,7 avec 2 à 3 traitements
|
-
|
Traitements phytosanitaires obligatoires
|
|
VITA 5
|
-
|
Semi- rampan t
|
70
|
Blanche, moyenne
|
|
1,5 avec 2 à 3 traitements
|
-
|
Traitements
obligatoires, très
sensibles aux
parasites
|
|
TVX 32-36
|
-
|
Erigé
|
70
-75
|
Crème- marron
|
|
1,6 avec 2 à 3 traitements
|
-
|
Traitements obligatoires,
graines farineuses
|
|
KPODJI
-GUEGUE
|
-
|
Semi- érigé
|
60
-70
|
Gris violet,
brun
|
Grande saison et petite saison
|
1,5 à 2,4
avec 2-3
traitements
|
Rustique, résistant
|
Susceptibilit é aux maladies
virales et
cryptogamiques
|
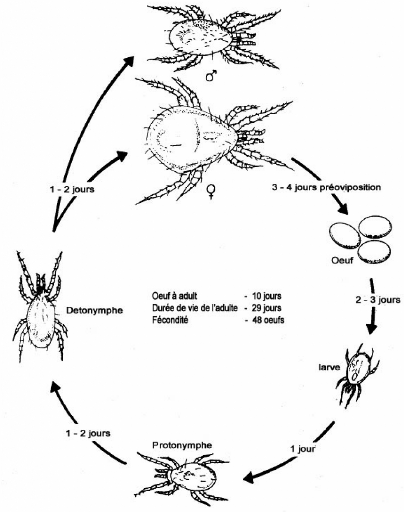
Figure 1: Cycle de développement de
Phytoséiide à 27°C et 70%
d'humidité relative.
Source: Yaninek et al., 1989.
Selon Polis et al., (1992), la forme et la source de
l'aliment sont des facteurs très importants dans l'alimentation des
prédateurs d'insectes. Selon Diehl (1993), l'âge et l'abondance
des proies sont aussi déterminants dans la consommation alimentaire
des
prédateurs. A cet effet, il faut dire que lorsque les
proies sont d'âge avancé, elles sont difficiles à capturer
par le prédateur. Les stades plus jeunes (larves ou oeufs) sont plus
vulnérables à la prédation. Aussi, la
vulnérabilité de chaque stade de la proie à la
prédation, varie-t-elle en fonction de son espèce et celle du
prédateur.
Amblyseius swirskii est un prédateur
généraliste. Il se nourrit des proies du genre Tetranychus
sur lesquelles il se reproduit très bien (McMurtry,et al.,
1991). Ce même auteur affirme que toutes les espèces du genre
Amblyseius peuvent se reproduire en l'absence de proies lorsqu'ils
sont nourris au pollen, avec une vitesse de croissance normale telle sur un
régime alimentaire constitué de proies. Des exsudats de plantes
et le miellat peuvent servir d'aliments de survie ou de réserves qui
peuvent accroître le potentiel de reproduction de A. swirskii en
présence de la proie. Il est évident que la sève brute des
feuilles soit aussi utilisée par A. swirskii (Nomikou, 2003).
Les proies potentielles de A. swirskii regroupent les thrips qui
favorisent plus ou de façon identique, sa reproduction comme dans le cas
d'un régime de pollen ou autres acariens.
L'importance de A. swirskii n'a été
révélée qu'en 2003 par le centre de recherche
néerlandais. Ce prédateur semble posséder de nombreuses
qualités: il s'attaque préférentiellement aux larves de
thrips et manifeste également une activité sur les aleurodes
(oeufs et larves mobiles essentiellement). Amblyseius swirskii n'a
montré aucune réduction de sa capacité de prédation
ni de sa vitesse de croissance en présence des pollens des
espèces du genre Typha (Nomikou, 2003). En l'absence de proie,
sa capacité à se maintenir sur les plantes à partir des
pollens permet de la placer en traitement préventif sur certaines
cultures. De plus, l'inquiétude sur la susceptibilité de A.
swirskii aux pesticides a trouvé de réponse. Ces
prédateurs ont survécu dans les champs sur des cultures ayant
subi des traitements avec des insecticides systémiques. Même
après application de ces pesticides il a gardé sa capacité
de prédation qui lui permis de réduire de façon
considérable la population des aleurodes sur les concombres et Typha
australis dont il consomme les pollens comme aliments alternatifs
(Nomikou et al., 2003). Amblyseius swirskii offre donc de
nouvelles possibilités pour lutter contre les thrips.
2.4- Amblyseius swirskii Athias-Henriot (Acari:
Phytoseiidae): Systématique, Biologie et Ecologie
Amblyseius swirskii est un nouvel acarien d'importance
écologique en matière de lutte biologique et sur lequel, des
études sont actuellement en cours (Nomikou, 2003)
2.4.1- Systématique
La systématique de Amblyseius swirskii se
présente comme suit: Règne: animal
Embranchement: Arthropodes
Sous-embranchement: Chélicérates
Classe: Arachnides
Sous-classe: Micrura
Infra-classe: Acari
Ordre: Parasitiformes
Sous-ordre: Dermanyssina
Super-famille: Ascoidea
Famille: Phytoseiidae
Genre: Amblyseius
Espèce: swirskii
Descripteur: Berlese (1904)
2.4.2- Origine, Biologie et Ecologie
·
· Origine
Encore appelé Typhlodromips swirskii,
Amblyseius swirskii est originaire des pays
méditerranéens. Son établissement en Israël a
été révélé par Nomikou (2003). Dans nombre
de régions méditerranéennes, en l'occurrence en
Israël, A. swirskii a été rencontré
naturellement sur des cultures d'importance économique dans le monde.
Aussi, a-t-il été identifié dans le delta du Nil en Egypte
et des régions adjacentes de l'Israël et du Moyen -Orient (Nomikou,
2003).
·
· Biologie et
écologie
Amblyseius swirskii est un acarien prédateur dont
l'importance écologique a été révélée
en 2003 par l'Université d'Amsterdam qui s'est immédiatement
intéressé à cet
auxiliaire très prometteur. Cet acarien polyphage
semble posséder de nombreuses qualités: il s'attaque
préférentiellement aux larves de thrips, mais manifeste
également une activité contre les aleurodes (oeufs et larves
mobiles, essentiellement) et les acariens phytophages. En l'absence de proie,
sa capacité à se maintenir sur des plantes à pollen permet
de le placer en traitement préventif sur certaines cultures. Des
résultats très positifs ont été obtenus sur
concombre et poivron. Cette espèce offre de nouvelles
possibilités pour la lutte contre les thrips en culture ornementale
(Nomikou, 2003)
Le cycle de développement de A. swirskii
comprend 5 stades à savoir: oeuf, larve, protonymphe, deutonymphe et
adulte. L'oeuf est de forme ovoïde et s'identifie aisément par son
caractère brillant. Les larves sont mobiles, de couleurs
blanchâtres et très transparentes. Les stades adultes sont de
couleurs variables, de blanchâtre à orange claire, en fonction du
régime alimentaire. La femelle est plus grosse que le mâle.
Amblyseius swirskii est actif entre 15°C et 40°C, avec un
optimum compris entre 25 et 28°C. A une température de 26°C et
une humidité relative de 70%, son cycle de développement dure 5
à 6 jours (Trottin et al., 2006). Il ne connaît pas de
diapause au cours de son développement (Nomikou, 2003, Trottin et
al., 2006). La femelle peut pondre jusqu'à 5 oeufs par jour, sur le
pollen de Typha spp. (Nomikou, 2003).
2.4.3- Importance de Amblysius swirskii
L'importance de ce prédateur réside dans le fait
qu'il s'est révélé déjà efficace contre
nombre de ravageurs de cultures d'importance. Le coton, le concombre, le
poivron, les agrumes, d'autres arbres fruitiers et la plupart des cultures
maraîchères constituent les plantes hôtes de A.
swirskii (Nomikou, 2003). Son efficacité contre les mouches
blanches du coton et des cultures maraîchères peut contribuer de
façon significative à réduire l'utilisation des pesticides
chimiques de synthèse sur le coton et les légumes. De plus, sa
faible mortalité dans les champs après emploi des pesticides
chimiques de synthèse (aldicarb), montre qu'il constitue un excellent
agent à considérer dans les programmes de lutte
intégrée contre les ravageurs des cultures dans un contexte
d'agriculture écologique. Une autre qualité du prédateur
est son aptitude à se nourrir et à se reproduire sur des pollens.
Cette qualité lui confère de potentialités à
persister et à se maintenir sur les plantes sauvages
jusqu'à la saison de cultures. Il est aussi redoutable face aux thrips
(Van Rijn et al., 2002; Nomikou, 2003). Amblyseius swirskii a
un effet significatif sur les populations de Bemisia tabaci
(Gennadius). En l'absence de ce prédateur, la population de B.
tabaci peut se multiplier par 62 en neuf semaines, alors que la
présence de ce phytoséiide réduit ce coefficient
multiplicateur à 4. Ce prédateur a un fort potentiel de
reproduction; en deux semaines la population des femelles passent de 30 par
feuille à 126. Eu égard à cette liste partielle des
avantages, A. swirskii se révèle comme un agent de lutte
biologique d'importance capitale pour une agriculture durable (Nomikou,
2003).

3.1 Cadre physique de l'étude
Les travaux se sont déroulés en deux phases dont
une phase de terrain et une phase de laboratoire. Les travaux de terrain ont
consisté à la collecte de fleurs des plantes hôtes de
M. sjostedti dans diverses régions du Bénin, à
savoir: Atlantique-Littoral, Ouémé-Plateau, Zou-Collines et
Mono-Couffo. Après la collecte, les pollens sont extraits des fleurs.
Quant aux travaux de laboratoire, ils ont été conduits à
l'Institut International d'Agriculture Tropicale sous-station de Cotonou
(IITA-Bénin) dans la section d'acarologie et la section
niébé. Cette station de recherche est située dans la
Commune d'Abomey-Calavi (Département de l'Atlantique), à environ
12 km au nord- ouest de Cotonou avec une altitude de 15 m au- dessus de la mer,
une latitude de 6°25 et une longitude de 2°20. Ces essais se sont
étendus de mai à novembre 2007.
3.2- Matériels
Les matériels utilisés dans ce travail sont de
trois ordres : (1) matériel végétal, constitués des
pollens de cinq plantes (L. sericeus, T. candida, V.
unguiculata, T. australis et Z. mays), (2)
matériel animal constitué des larves de M. sjostedti de
un et de deux jours d'âge et des adultes de A. swirskii et (3)
des équipements de laboratoire.
3.2.1- Le matériel
végétal
Le matériel végétal est constitué
du pollen de certaines plantes hôtes du thrips, M. sjostedti. Il
s'agit notamment de : Lonchocarpus sericeus (Poir.) (Fabaceae), du
niébé, Vigna unguiculata1 (L.) Walpers
(Fabaceae), Tephrosia candida Hook. F. (Fabaceae), le maïs,
Zea mays (L.) (Poaceae) et la massette, Typha australis
(Typhaceae)2.
·. Lonchocarpus sericeus:
C'est un arbre de 10 à 12 voire 20 m de haut,
élargi à la base, à cime étroite et ouverte. Ses
feuilles sont alternes, imparipennées, à pubescence fine et
ferrugineuse avec 3 à 5 paires de folioles elliptiques opposées.
L'inflorescence est un racème terminal dressé et pubescent de 10
à 20 (voire 80) cm de long avec à la base, des feuilles (Photo
3.a). Les fleurs sont groupées par deux sur l'axe principal. Elles sont
de
1 Niébé s'appelle Ayu en Adja et Ayikun
en Fon.
2 La massette s'appelle FE en Fon et FANTIN en Goun
couleur mauve. Sa floraison a lieu en abondance dans la saison
pluvieuse (mai à août). Cette plante est rencontrée dans
les régions tropicales d'Afrique dans les galeries forestières
soudano-guinéennes, au bord des rivières, sur des sols lourds
(Arodokoun, 1996 ; Arbonnier, 2002). L. sericeus est classé
parmi les plantes hôtes alternatives de M. sjostedti (Arodokoun,
1996). La photo 3a montre un aperçu des fleurs de L.
sericeus.
·
· Tephrosia
candida:
C'est un arbuste atteignant 2 à 4 mètres de haut
avec une base branchue et ramifiée. Les feuilles sont alternes,
imparipennées, de 10 à 25 cm de long avec 8 à 15 paires de
folioles oblongues et opposées. L'inflorescence est un racème
terminal. Les fleurs sont blanches, asymétriques de 3 à 3,5 cm de
long à calice densément pubescent. La floraison a surtout lieu en
saison des pluies. C'est une espèce qui s'adapte bien aux conditions
tropicales. Le pic de floraison de cette plante est atteint entre les mois
d'août et septembre (Arbonnier, 2002; Agboton, 2004). La photo 3b donne
un aperçu des feuilles et fleurs de T. candida.
·
· Vigna
unguiculata:
Il a été utilisé la variété
locale «Kpodjiguèguè». Il s'agit d'une plante à
port Semiérigé de cycle végétatif couvrant entre 60
et 70 jours. Cette variété est cultivée pendant les
grandes et petites saisons des pluies. Elle possède des feuilles
trifoliées et des fleurs de couleur gris violet (Photo 3.c).
Malgré sa rusticité et sa résistance à la
sécheresse, il est conseillé de prévoir 2 à 3
traitements chimiques pour espérer des rendements de 1,5 à 2,5 t
/ ha (I.N.R.AB, 1995).
·
· Zea mays
Le maïs est une plante herbacée annuelle, de
taille variable (de 40 cm jusqu'à 2 m, généralement, entre
1 et 3 m pour les variétés couramment cultivées). La tige
unique et de gros diamètre est pleine, lignifiée et formée
de plusieurs entrenoeuds d'une vingtaine de centimètres
séparés par autant de noeuds. Au niveau de chaque noeud est
insérée une feuille alternativement d'un côté et de
l'autre de la tige. Les feuilles, typiques des
graminées, mais de grande taille (jusqu'à 10 cm
de large et un mètre de long), ont une gaine enserrant la tige et un
limbe allongé en forme de ruban à nervures parallèles.
À la base du limbe se trouve la ligule qui a quelques millimètres
de haut. Contrairement aux autres graminées, le pied de maïs ne
talle pas, toutefois on voit parfois des tiges secondaires, de taille
limitée, à la base de la tige principale. Les fleurs mâles
sont groupées dans une panicule terminale qui apparaît
après la dernière feuille. Cette panicule est constituée
d'épillets regroupant chacun deux fleurs à trois étamines
(I.I.T.A./ SAFGRAD, 1984). La photo 3 e montre des panicules de maïs.
·
· Typha australis
:
Appelé aussi roseau à balais, cette plante est
rencontrée sur les sols frais et humides, au bord des rivières,
des lacs et des étangs. Elle aime les sols vaseux et résiste
à la stagnation de l'eau, mais est sensible au sel.
C'est une plante pérenne. Les feuilles sont basales et
sessiles. C'est une plante vivace, à tiges dressées, d'une
hauteur de 1,5 à 3 mètres, de 10 mm de diamètre, se
brisant facilement. Il porte des feuilles allongées, larges de 1
à 3 cm, d'un vert glauque. L'inflorescence est une panicule
d'épillets de couleur brun violacé. Cette plante se multiplie par
de nombreux rejets issus des tiges souterraines traçantes (
http://fr.wikipedia.org/wiki/Roseau).
La photo 3d illustre une panicule de Typha.

6 cm
8 cm
a)Lonchocarpu ssericeus b)Tephrosia candida


5 cm
4,5 cm
c) Vigna unguiculata d) Une espèce de
Typha

9 cm
e) Zea mays
Photo 3: plantes utilisées.
Source: Agboton 2004; photos personnelles,
2007
La collecte a consisté au prélèvement des
fleurs matures de chaque plante hôte et à l'extraction du pollen.
Pour les plantes légumineuses (T. candida, V.
unguiculata et L. sericeus) les fleurs ont été
cueillies au champ, dans des enveloppes en papier kraft, de marque DURO
EX-HEAVY DUTY et de format 25. Le remplissage des enveloppes était
effectué de façon à éviter l'entassement des fleurs
les mettant ainsi a l'abri d'un éventuel pourrissement. Après
leur remplissage au 3/4, les enveloppes sont agrafées par leur ouverture
puis gardées délicatement dans le véhicule durant chaque
séjour de collecte qui dure au plus 2 jours. Pour ces collectes, les
pollens de Z. mays ont été obtenus par intervalle de
trois jours jusqu'à la fin des essais, trois voyages sur le terrain ont
été organisés pour la collecte des fleurs de L.
sericeus et un voyage pour T. australis. Les fleurs de V.
unguiculata et T. candida ont été collectées
pendant 7 jours successifs. Au laboratoire, les fleurs ont été
étalées dans des plateaux plastiques. Aussitôt après
cet étalement qui a pour but de réduire l'impact des
phénomènes de transpiration des fleurs sur la qualité des
pollens, commence l'opération d'extraction de pollens. L'extraction a
été effectuée à la main et a consisté
à ouvrir les fleurs et à en enlever les étamines contenant
les grains de pollen. Ces étamines sont recueillies dans des
boîtes de Pétri et séchées pendant une (1) heure
sous une lampe à incandescence de 220 volts. Ce séchage permet de
séparer les grains de pollen des sacs polliniques. Quant aux
graminées (T. australis et Z. mays), les pollens sont
collectés directement dans les champs. Il s'agissait de prendre
l'inflorescence mâle de la plante que l'on fait battre dans un plateau
plastique. Les collectes de ces pollens sont faites en une période
où le vent souffle très peu pour éviter qu'ils soient
emportés.
Pour toutes les plantes utilisées dans les essais, les
pollens ont été purifiés après extraction.
L'opération consiste à débarrasser sous une loupe
binoculaire les grains de pollen de tous les débris (animaux ou
végétaux, grains de sable). Les pollens ainsi assainis, ont
été mis dans des tubes en plastique de 1,5 cm de diamètre
et de 5 cm de hauteur, puis conservés durant tout l'essai dans un
réfrigérateur à une température variant entre 5 et
8°C et une humidité relative oscillant entre 54% et 70%. C'est
seulement au besoin, que les pollens sont sortis du
réfrigérateur, puis y sont retournés juste après
utilisation.
3.2.2- Le matériel
animal
·
· Larves de Megalurothrips
sjostedti
Pour la production des larves de M. sjostedti, les
adultes de l'insecte ont été prélevés des fleurs de
T. candida et mis en culture au laboratoire. Les conditions ambiantes
dans la salle d'élevage sont de 25°C pour la température et
de 54% à 70% pour l'humidité relative. Les larves étaient
produites tous les jours et servies aux phytoséiides dans les
différents essais. Les photos 4 a et b montrent des larves 1 et 2.

a: Larve 1 b: larve 2
1,5 cm

Photo 4: larves de Megalurohrips
sjostedti
Source: GOERGEN (communication personnelle)
IITA. Insect Museum, Cotonou Bénin
·
· Amblyseius swirskii
Athias-Henriot(Acari: Phytoséiidae)
Les individus de A. swirskii proviennent des
unités d'élevage établies dans les laboratoires de
recherche de l'Université d'Amsterdam au Pays-Bas à partir d'une
colonie jordanienne. Ils ont été importés par
IITA-Bénin et mis en élevage au laboratoire d'Acarologie dudit
institut pour certaines études en Afrique. La photo 5 montre deux
Amblyseius swirskii avec une larve de thrips.

1 mm

Photo 5: Deux phytoséiides chassant une
larve L1 de thrips
3.2.3- Matériels de travail
Il est présenté ci-dessous la liste des
équipements et matériels de laboratoire et/ou de bureau
utilisés dans les essais. On y retrouve:
- une loupe binoculaire de marque WILD M3C (HEERBRUGG,
SWITZERLAND) utilisée pour l'installation et le suivi des
différents essais;
- de petits pinceaux qui servent à prélever les
phytoséiides, les thrips et les pollens, et à débarrasser
les pollens des corps indésirables.;
- une paire de ciseaux pour découper le coton, les
étiquettes etc ;
- des enveloppes en papier Kraft de marque DURO 25 EX-HEAVY DUTY
utilisées pour l'emballage des fleurs depuis le champ.
- Un réfrigérateur pour la conservation au froid
des pollens et de certains autres matériels;
- des boîtes de Pétri pour la préparation du
milieu de culture des phytoséiides3;
3 Le milieu de McMURTRY est un milieu de culture dont
le dispositif préserve les cultures de toute contamination par des
insectes et empêche les phytoséiides de s'évader des
substrats alimentaires.
- du coton hydrophile utilisé dans la constitution du
milieu de culture des phytoséiides.
- du parafilm pour sceller les extrémités
coupées des pédoncules et gousses de niébé;
- de grands plateaux en plastic qui ont servi pour
l'élevage des acariens prédateurs;
- de l'alcool éthylique à 70% utilisé pour
la désinfection des lieux de manipulation des organes animaux ou
végétaux;
-de l'eau tiède à 40oC utilisée
pour production synchronisée des larves de M. sjostedti
3-3 Méthodes
3.3.1- Elevage des thrips
Des thrips adultes ont été
prélevés des fleurs de T. candida, dans une parcelle de
la station de recherche de l'IITA-Cotonou. Ils ont été
élevés sur les pédoncules de gousses de
niébé dans des boîtes cylindriques en plexiglas de 11 cm de
hauteur et 4 cm de diamètre. Les pédoncules de gousses sont
collectés dans des champs de niébé (variété
«kpodjiguèguè») installés à la station
IITA-Cotonou.
Les boîtes en plexiglas sont bien lavées à
l'eau savonneuse et asséchées avec du papier hygiénique. A
l'aide de ciseaux, de petits morceaux de papier torchon de 3,5 cm de
côté sont découpés et agrafés par leur
centre. Ces papiers sont ensuite introduits dans les boîtes en plexiglas
pour réduire l'humidité interne de la boîte. Les
pédoncules des gousses de niébé sont rincés
à l'eau de robinet puis coupés en segments de 8 cm. Les
extrémités coupées de ces pédoncules sont ensuite
scellées à l'aide de parafilm pour éviter le
dessèchement précoce et les risques de pourriture. Les
pédoncules utilisés ici sont bien tendres pour faciliter
l'alimentation des femelles de thrips et leur permettre de pondre en masse.
Sept (7) pédoncules sont introduits dans chaque boîte. Ensuite, 70
thrips adultes reproducteurs ont été prélevés par
aspiration à l'aide d'aspirateur en plastique et introduits dans chaque
boîte contenant les pédoncules. Les boîtes sont ensuite
fermées à l'aide d'une toile et d'un bouchon. Les boîtes
ainsi préparées sont appelées boîte d'oviposition.
Après une période de 72 heures, les oeufs sont pondus sur
les pédoncules. Ainsi, les thrips adultes et les
pédoncules sont retirés des boîtes. Les pédoncules
sont ensuite déposés sur du papier torchon et sont
débarrassés des débris et des insectes vivants ou morts
à l'aide d'un pinceau. Les boîtes sont nettoyées et
désinfectées à l'aide de papier torchon
légèrement imbibé d'alcool éthylique à 70%,
et les pédoncules sont réintroduits dans les boîtes. Des
gousses de niébé prélevées au champ sont
nettoyées afin de les débarrasser de tous les oeufs qu'elles
portent, puis elles sont trempées dans l'eau chaude à 40°C
pendant 3 minutes. Ces gousses sont de taille variable, l'essentiel
étant qu'elles soient bien tendres. Les gousses ainsi traitées,
sont introduites dans les boîtes contenant les pédoncules.
Quelques heures plus tard, les larves émergées quittent les
pédoncules pour les gousses sur lesquelles elles vont s'alimenter. C'est
de ces gousses que les différentes larves de thrips sont
régulièrement prélevées pour les différents
tests.
Cette technique de production dite synchronisée des
larves permet de produire des larves plus ou moins de même âge. Les
larves utilisées dans les essais sont d'un (1) jour et de deux (2) jours
d'âge. Les larves d'un jour (ou larves 1) sont obtenues au plus un jour
après l'introduction des gousses dans les boites tandis que les larves
de deux jours (ou larves 2) sont obtenues le surlendemain après
l'introduction des gousses (Tamo, 1991). Les caractéristiques
fondamentales qui permettent de différencier et de bien identifier
chaque stade larvaire sont la couleur et la taille des larves. En effet, les
larves 1 sont de très petite taille de couleur blanche et transparentes
alors que les larves 2 sont de plus grande taille, de couleur blanchâtre
tendant sur du jaune et plus luisantes que les larves 1 (voir photo 4)
3.3.2- Elevage de masse des
phytoséiides A. swirskii
Ces phytoséiides sont élevés sur des
arènes plastiques de forme rectangulaire (18 cm x 15 cm), placés
sur une éponge contenue dans un plateau plastique de dimensions 35 cm x
35 cm x 6 cm presque rempli d'eau distillée. L'ensemble est maintenu
dans une chambre d'élevage à la température moyenne de
25°C et à un taux d'humidité relative fluctuant entre 54% et
70%.
Des femelles gravides de même âge ont
été utilisées pour produire des oeufs de même
âge. Les individus issus de l'éclosion de ces oeufs ont servi dans
la conduite des
essais. Au cours de l'élevage A. swirskii est
nourri au pollen de T. australis. Le pollen est servi ad
libitum de sorte que les adultes s'alimentent bien afin de stimuler la
fécondité des femelles. Ceci a permis d'avoir à tout
moment, le nombre de femelles voulues pour la conduite de chaque essai. La
pertinence de l'utilisation du pollen de T. australis réside
dans les résultats probants obtenus par Nomikou (2003), lors de ses
travaux sur la table de vie de A. swirskii, nourri aux pollens de
Typha spp.
3.3.3- Conduite des essais
Les essais ont été conduits pour
apprécier (1) la vulnérabilité des larves 1 et 2 de M.
sjostedti à la prédation de A. swirskii, (2) la
capacité de prédation du phytoséiide à
différentes densités de larves 1 de M. sjostedti et (3)
la table de survie du prédateur.
·
· Vulnérabilité des larves 1
et 2 à la prédation de A. swirskii.
Des femelles adultes de A. swirskii de 3 jours
d'âge sont d'abord affamées pendant 24 heures puis nourries aux
larves 1 ou 2 de M. sjostedti. Pour cet essai 5 larves L1 ou L2 ont
été servies à chaque femelle de A. swirskii par
disque. Les prédateurs ont été utilisés à
une densité de 3 femelles par disque foliaire. Les disques foliaires
étaient de 2 cm de diamètre, découpés dans des
feuilles de niébé. Ils ont été disposés sur
du coton imbibé d'eau dans une boîte de Pétri. Ces
boîtes de Pétri sont déposées dans des plateaux
plastiques (35 cm x 35 cm x 6 cm) et maintenues dans un incubateur (Percival)
à une temperature de 26°C et et une humidité relative de
54-
70%). Les observations pour la collecte des données ont
été effectuées quotidiennement pendant 3 jours. A chaque
observation, les larves étaient enlevées et remplacées par
d'autres de même stade correspondant.
Les données collectées ont porté sur le
nombre de larves consommées par les femelles de A. swirskii
pour chaque stade du ravageur. La vulnérabilité de chaque stade
larvaire a été évaluée à travers la
capacité des phytoséiides à attaquer et à consommer
des larves de thrips de chaque stade.
·
· Prédation de Amblyseius
swirskii à différentes densités de larves 1.
Cet essai a pour but de déterminer l'influence des
densités des larves 1 de M. sjostedti sur la
capacité de prédation de A. swirskii. Les essais ont
été réalisés sur des
disques foliaires. Quatre densités larvaires soit 3; 5;
10 et 20 larves 1 par disque foliaire constituent les traitements qui ont
été répétés 4 fois. Sur chaque disque
foliaire, sont déposées 3 femelles de A. swirskii de 3
jours d'âge. Les observations sont faites chaque jour pendant 3 jours et
ont porté sur le nombre de larves consommées par le
prédateur. Les larves consommées sont immédiatement
remplacées. Les femelles du phytoseiide et les larves sont
prélevés à l'aide d'un pinceau et déposés
sur les disques foliaires.
·
· Fécondité de Amblyseius
swirskii à partir de pollens
Ce test vise à apprécier la capacité des
femelles de A. swirskii à se nourrir et à se reproduire
sur des pollens des plantes hôtes du ravageur, M. sjostedti. Il
s'agit notamment des pollens de T. australis, V. unguiculata, T. candida,
L. sericeus et Z. mays. Le pollen de T. australis avait
constitué le traitement témoin. A cet effet, 75 jeunes femelles
de 6 jours d'âge, ont été prélevées de la
cohorte. Ces femelles sont réparties en lots de 15. Chaque lot a
été nourri avec un type spécifique de pollen (traitement).
Les lots sont maintenus sur des disques foliaires et déposés sur
du coton imbibé d'eau dans des boîtes de Pétri. Par
traitement le pollen est servi aux phytoseiides ad libitum.
L'effet des pollens sur la fécondité des
femelles a été apprécié par rapport à la
moyenne d'oeufs pondus par les femelles suivant les différents
régimes alimentaires constitués de pollens. Les observations ont
été faites chaque jour pendant 7 jours. A chaque observation, les
oeufs pondus ont été dénombrés et regroupés
par traitement.
·
· Table de vie de Amblyseius
swirskii.
Après le test de fécondité de A.
swirskii sur les différents pollens, le pollen de
niébé a été utilisé pour la table de vie de
ce phytoséiide. Cette table de vie a été
réalisée sur les quatre régimes alimentaires (traitements)
suivants:
- Pollen de niébé seul;
- larves 1 de M. sjostedti
- pollen de niébé + larves 1, M.
sjostedti;
- pollen de T. australis seul.
· Production des oeufs de
départ
Pour la table de vie, nous avons d'abord produit des oeufs de
A. swirskii. C'est à partir de ces oeufs que nous avons
démarré la table de vie du prédateur. En effet, une
cohorte de 100 femelles et de 50 mâles de phytoséiide a
été constituée et nourrie au pollen de T.
australis. Les femelles ont été accouplées avec les
mâles pendant 24 heures. Ce qui a permis d'obtenir 300 oeufs. Ces oeufs
ont été répartis par triplet sur 100 disques foliaires,
soit 25 disques foliaires par traitement. Chaque lot de phytoséiides
répartis sur 25 disques foliaires a été suivi par
intervalle de 12 heures jusqu'au moment où les larves
émergées ont atteint le stade adulte. Ce suivi a permis
d'identifier avec précision, la durée de chaque stade
juvénile du phytoséiide et certains phénomènes
physiologiques (par exemple les mues) qui se déroulent au niveau de
chaque individu. Au stade adulte, les observations se faisaient une fois par
jour. Le passage d'un stade à l'autre, est signalé par la
présence d'une mue. Déjà au stade deutonymphe, le sexage a
été fait et a permis de regrouper encore les femelles par triplet
sur des disques foliaires avec 16 répétitions par traitement. Ce
qui correspond à 48 femelles par traitement pour la suite de la table de
vie. L'accouplement de ces nouvelles femelles, a été
réalisé sur les disques foliaires à raison de 2
mâles pour 3 femelles. Les males ont été retires au bout de
24 heures. Chaque lot de 48 femelles a été soumis à un
type spécifique de régime alimentaire depuis l'émergence
des larves jusqu'à la mort des adultes. A partir du stade adulte,
quotidiennement, le total d'oeufs pondus sur chaque disque a été
dénombré et regroupé par traitement. Après
émergence des larves, celles-ci ont été suivies et
nourries jusqu'au stade deutonymphe où le sexage de la
progéniture a été fait. Ces suivis quotidiens ont permis
de collecter des données relatives à la table de vie de A.
swirskii.
paramètres étudiés
Dans cet essai, plusieurs paramètres biologiques de A.
swirskii ont été étudiés. Il s'agit notamment
de:
- la durée du stade oeuf: les oeufs ont été
suivis 2 fois par jour. Le stade oeuf est bouclé lorsqu'une larve
émerge de l'oeuf;
- taux d'éclosion: c'est le rapport entre le nombre
d'oeufs en observation et le nombre d'oeufs ayant éclos pour donner de
larve.
- la durée du stade larvaire: les larves
émergées ont été suivies 2 fois par jour (12 heures
d'intervalle). La fin de ce stade est signalée par la présence de
4 paires de pattes
chez les larves avec une première mue. La durée de
ce stade est l'intervalle de temps entre les individus de 3 paires de pattes et
la présence de la première mue;
- la durée du stade protonymphe: ce stade suit celui de
la larve. A partir de ce stade, l'acarien possède 4 paires de pattes et
mue pour la première fois. La fin du stade protonymphe est
marquée par une deuxième mue. Lorsque cette mue est
observée, elle est enlevée immédiatement, pour ne pas
corrompre le stade suivant;
- durée du stade deutonymphe: c'est le stade
observé lorsque la protonymphe a mué. C'est le stade
signalé par la deuxième mue. La fin de ce stade est
marquée par une troisième mue qui conduit au stade adulte. -
durée du stade adulte : le stade adulte est atteint lorsque la
deutonymphe a mué ou lorsque 3 mues successives ont été
obtenues chez un même individu. La durée du stade adulte part de
la dernière mue jusqu'à la mort de l'individu.
Au stade deutonymphe ou adulte, le total d'individus par sexe et
par traitement, a été dénombré afin de calculer le
sexe ratio des progénitures par traitement.
Ces données ont permis de calculer certains
paramètres biologiques de A. swirskii suivant les
différents régimes alimentaires constitués.
· Quelques paramètres de
population
Quelques paramètres de population ont été
déterminés. Il s'agit notamment de:
- la longévité de chaque individu: elle a
été déterminéeà partir de la moyenne entre
le temps d'émergence et le temps où l'adulte meurt (durée
de vie du stade oeuf à la mort);
- le sexe ratio: il a été déterminé
par le rapport du nombre d'individus femelles dans la progéniture
à l'effectif total de la progéniture;
- Le taux net de reproduction (Ro) est la vitesse de
multiplication en une génération. - G est la durée moyenne
d'une génération exprimée en jours.
- erm exprime la vitesse de multiplication de la
population par unité de temps (exprimée en jour).
- rm ou le taux de croissance ou taux d'accroissement
intrinsèque est obtenu lorsqu'on assume qu'aucun facteur ne limite la
croissance de la population.
rm, Ro, G et erm sont
déterminés en utilisant l'algorithme développé par
Hulting et al. (1990) dans lequel ces paramètres sont
calculés d'après la méthode exacte
préconisée par Birch (1948). La connaissance de ces
paramètres, en particulier le taux d'accroissement intrinsèque
(rm) permet d'estimer la croissance de la population et surtout son
efficacité prédatrice dans le cas qui nous concerne.
Le rm est très largement utilisé dans
la pratique pour la construction de modèle de population d'insectes,
pour la comparaison du potentiel de réponse numérique des
espèces, des souches ou des individus (Sickle, 1988; Hagvar &
Hofshang, 1990). Pour étudier la capacité d'accroissement des
populations d'une espèce dans des conditions déterminées
(Fereres et al., 1989; Yaninek et al., 1989).
- la fécondité ou capacité de A.
swirskii à produire des oeufs;
- la fertilité ou capacité des femelles à
produire des progénitures dans cet essai a été
évaluée par le nombre total de progénitures femelles;
et
- le temps de génération c'est-à-dire le
temps qui s'écoule de la naissance des parents jusqu'à la
naissance de la descendance (entre les premiers parents émergés
et la descendance F1).
3-4- Analyses statistiques
L'analyse statistique des données de l'étude a
été faite à l'aide des logiciels SAS ("SAS, Institute,
2002") version 8.2 et SPSS (SPSS, 2005) version 12.0. Concernant le logiciel
SAS, toutes les données relatives aux proportions ont été
soumises à une transformation 2arcsin(p)1/2 (p= proportions
transformées) avant d'être analysées. Cette transformation
a permis de normaliser les valeurs brutes recueillies et de stabiliser les
variances.
Afin de tester les effets des différents traitements,
sur les différents paramètres de développement de A.
swirskii: durée de chaque stade, la durée totale du stade
oeuf à l'adulte, la durée de préoviposition, l'intervalle
entre deux (2) pontes, le taux de fécondité des femelles et la
longévité, les tests statistiques ont été
basés sur l'analyse des variances (ANOVA) pour comparer les
différents paramètres. Ces comparaisons ont permis de soutenir
les résultats obtenus dans le présent travail.
4 RESULTATS
4-1 Vulnérabilité des larves d'un jour et
de deux jours de M. sjostedti à la prédation de
Amblyseius swirskii.
Au terme des trois jours qu'a duré l'essai, les
phytoséiides n'ont pu consommer que les larves de premier stade de
M. sjostedti. Le nombre de larves 1 consommées par jour par les
triplets de phytoséiides varient en moyenne entre 4 et 4,6
(1er cas) alors qu'aucune larve 2 n'a été
capturée par les phytoséiides (2ème cas). Donc,
il existe une différence significative entre le 1er et le
2ème . Le tableau présente les consommations moyennes
de larves 1 et 2 par le phytoséiide.
Tableau 3: Récapitulatif sur la
vulnérabilité des larves 1 et 2

de
urée essai
nsité
tions
ents
Répéti
Traitem
D Proie
totales consommées
Moyenne proies consommées/femelle/j our
|
L1
|
5
|
10
|
4
|
172
|
4,3
|
|
L2
|
5
|
10
|
4
|
0
|
0
|
4.2 Effet de la densité de larves L1 sur la
capacité de prédation de A. swirskii
L'influence des densités de larves 1 de M.
sjostedti sur la capacité de prédation de A.
swirskii, a été évaluée avec les
densités 3; 5; 10 et 20 de larves 1.
Le tableau 4 présente les taux moyens de
prédation suivant les différentes densités de larves. Il
ressort de l'analyse de ce tableau 4 que quelle que soit la densité des
larves 1, l'acarien arrive à en capturer. Aux faibles densités de
larves, les phytoséiides sont capables d'exterminer toute la population
des larves servies. A la densité de 20 larves, une femelle de
phytoséiide capture en moyenne 5,33 larves par jour. Les plus faibles
taux de prédation (0,92 #177; 0,06 et 1,16 #177; 0,14 larves1
capturées/femelle/jour) sont
obtenus avec les plus faibles densités (3 et 5 larves
1) alors que les taux les plus forts sont observés avec les plus fortes
densités de proies (10 et 20 larves 1). Les résultats de
l'analyse de comparaison multiple de Student-Newman et Keuls, indiquent qu'il
existe une différence hautement significative entre les taux de
prédation suivant les densités, au seuil de probabilité de
5% (F = 388,81; Pr > 0,0001). Toutefois, les taux moyens de prédation
sont similaires au niveau des densités de 3 et 5. Les taux sont
différents pour les densités de 10 larves (densité
intermédiaire) et de 20 larves.
Tableau 4: Nombre moyen de larves
consommées
Traitements Nombre moyen de larves
consommées/femelle/jour
D3 0,92 #177; 0,06 a
D5 1,16 #177; 0,14 a
D10 2,89 #177; 0,06 b
D20 5,33 #177; 0,10 c
Pr > F 0,0001
Les moyennes affectées de la même lettre ne sont pas
significativement différentes au seuil de 5% d'après le test de
Student- Newman et Keuls. ns : signifie test «non significatif»
La figure 2 montre la droite de régression
linéaire du nombre moyen de proies capturées par femelle par jour
sur la densité de larves, elle indique une relation positive entre les
deux paramètres. La valeur du coefficient de corrélation est de
0, 99 (r2 = 0,99). Ce coefficient permet d'affirmer que le
modèle utilisé explique presque totalement cette relation entre
la densité et la consommation de proies.
|
y = 0,2673x + 0,0374
R2 = 0,9933
|
6,00
5,00
4,00
3,00
2,00
1,00
0,00
0 5 10 15 20 25
Densité de larves 1 de thrips (en unités de larves
1)
Figure 2: Consommation moyenne de larves 1par
femelle par jour
4.3- Fécondité de Amblyseius
swirskii nourri aux pollens des plantes:
Les différents traitements, à savoir pollen de
T. australis, pollen de V. unguiculata, pollen de L.
sericeus, pollen de T. candida, pollen de Z. mays, sont
respectivement représentés par les lettres Ty, V, L, T, Z
Le tableau 5 montre les taux moyens de pontes de A.
swirskii sur les différents pollens testés. De façon
globale, les femelles du prédateur ont pondu des oeufs quel que soit le
type de pollen servi comme régime alimentaire. Ce tableau montre qu'il
existe une différence significative dans la fécondité du
prédateur entre les types de pollen servis. D'après le test de
comparaison multiple de Student-Newman et Keuls (Tableau 5), le taux moyen de
ponte est plus élevé sur Typha australis que sur les
autres pollens. La femelle peut pondre en moyenne 2,70 oeufs par jour. Par
contre, la fécondité est la plus faible sur le pollen de
T. candida. Le taux de ponte est modéré sur
pollens de Z. mays et V. unguiculata entre lesquels aucune
différence significative n'a été observée
Tableau 5: Fécondité de
Amblyseius swirskii suivant pollens
Traitement Nombre moyen d'oeufs
pondus/femelle/jour
Ty 2,70 #177; 0,15 a
L 2,19 #177; 0,09 b
Z 1,88 #177; 0,07 c
V 1,80 #177; 0,07 c
T 1,33 #177; 0,07 d
Pr > F 0,0001* * *
Les moyennes affectées de la même lettre ne sont pas
significativement différentes au seuil de 5% d'après le test de
Student- Newman et Keuls.
***: très hautement significatif
4.4- Effet de la combinaison de larve 1 et de pollen de
niébé sur la prédation par A.
swirskii
Nous rappelons que les différents régimes
alimentaires utilisés dans cet essai sont: pollen de
niébé, pollen de niébé + larves, pollen de T.
australis, larves seules, et représentés respectivement par
les symboles V, VL, Ty et L. Au cours des essais portant sur l'influence de ces
régimes alimentaires sur certains paramètres du prédateur,
nous avons recueilli comme données, le nombre de proies
consommées par le prédateur par jour, pour évaluer
l'influence de la combinaison du pollen de niébé et de larves 1
de thrips sur la capacité de prédation du phytoséiide. Il
ressort des résultats d'analyse statistique, qu'il existe une
différence significative entre les deux traitements, VL et L au seuil de
5% (Pr = 0,00 12). C'est-à-dire que la capacité de
prédation du phytoséiide diminue lorsque les larves sont
combinées avec le pollen de niébé. En effet, avec les
larves seules, les prédateurs consomment en moyenne 2,90 #177; 0,24
larves de thrips/femelle/jour alors que la capacité de prédation
est 2,04 #177; 0,19 de larves/ femelles/jour sur l'aliment à base de
niébé et larves.
Tableau 6: Taux de prédation de A.
swirskii suivant la combinaison ou non de larves avec le pollen de
niébé
Traitements Nombre moyen de
larves
consommées/femelle/jour
L 2,90 #177; 0,24 a
VL 2,04 #177; 0,19 b
0,0012 **
Pr > F
Les lettres a et b indiquent une différence significative
entre les taux de prédation selon la comparaison multiple de
Student-Newman et Keuls
* * hautement significatif.
4.5.1 Effet des régimes alimentaires sur la
durée des stades juvéniles
Le tableau 7 montre les durées moyennes des
différents stades de développement de A. swirskii en
fonction des régimes alimentaires. Ce tableau montre pour chaque stade,
qu'il n'existe aucune différence significative, au seuil de 5%, entre
les temps moyens passés par l'acarien, selon ces régimes
alimentaires. Ces derniers n'ont pas d'influence significative sur aucun stade
de développement de A. swirskii, d'après le test de
comparaison multiple de Student-Newman et Keuls.
Tableau 7: Effets des aliments sur la
durée de développement des différents stades du
Phytoséiide
|
Traiteme
nts
|
|
Larves
|
phe
|
Protonym
|
he
|
OEufDeutonymp adulte
|
|
|
Ty V
VL
|
a
a
a
|
1.49 #177; 0.10
1.33 #177; 0.09
1.18 #177; 0.08
|
a
a
a
|
2.11#177; 0.05
2.11 #177; 0.07
1.99 #177; 0.08
|
a
a
a
|
1.92 #177; 0.08
1.96 #177; 0.07
1.92 #177; 0.09
|
7.06 #177; 0.13
a
9.490 #177;
2.73 a
6.68 #177;
0.15 a
|
|
L*
Pr > F
|
|
-
0.07 ns
|
|
-
0.95 ns
|
|
-
0.94 ns
|
-
0.41 ns
|
|
Les moyennes de la même colonne affectées de la
même lettre ne sont pas significativement différentes au seuil de
5% d'après le test de Students- Newman et Keuls.
ns : Non significatif au seuil de 5%
4.6 Effet des régimes alimentaires sur la
fécondité des femelles
Les observations des mini-boîtes ont montré que les
oeufs sont, la plupart du temps, pondus le long des nervures principales et
secondaires.
L'effet des différents pollens sur la
fécondité des femelles de A. swirskii, a
été évalué avec quatre régimes alimentaires
(traitements). Ces aliments sont : larves 1 seules, pollen de
niébé + larves, pollen de niébé seul et pollen de
Typha australis (témoin), représentés
respectivement par L, VL, V et Ty. La figure 3 montre l'évolution des
nombres moyens d'oeufs pondus par femelle et par jour. Nous constatons que le
plus faible taux de ponte est obtenu avec le traitement L. Par contre, le plus
fort taux est observé sur le traitement VL. Le tableau 8 qui
présente les résultats d'analyse de variances, indique que la
différence entre les traitements est hautement significative au seuil de
5%. Mais les résultats de la classification multiple de Student-Newman
et keuls montre que les traitements VL, V et Ty ont des effets similaires sur
la fécondité des
femelles. Ces derniers assurent les plus fort taux de ponte pour
les femelles. Par contre, le traitement L se distingue nettement des trois
autres.
Tableau 8: Effet des aliments sur la
fécondité des femelles de A.
swirskii.
|
Traitements
|
Nombre moyen d'oeufs pondus/ femelle/ jour
|
|
L
|
0.42 #177; 0.079 a
|
|
VL
|
1.89 #177; 0.210 b
|
|
N
|
1.50 #177; 0.181 b
|
|
Ty
|
1.76 #177; 0.155 b
|
|
Pr > F
|
0.0001 ***
|
*** Très hautement significatif au seuil de 5%
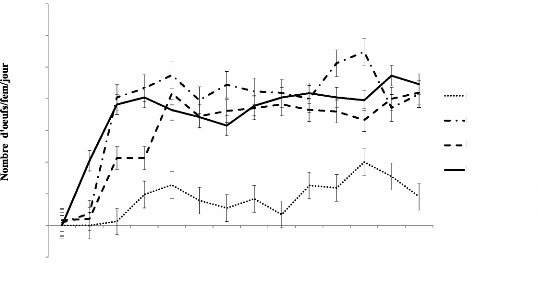
3,5
3
Larve
Larve+Pollen niebe Pollen de Niebe Pollen de typha
-0,5
1 2 3 4 5 6 7 8 9 10 11 12 13 14
Durée de la ponte (en jours)
2,5
2
1,5
1
0,5
0
Figure 3 : Fécondité de A.
swirskii suivant les différents aliments
4.7- Effet des régimes alimentaires sur
l'éclosion des oeufs de Amblyseius swirskii
Les oeufs pondus par les femelles sont collectés et
suivis par traitement. Le taux d'éclosion (ou la moyenne des ayant
éclos au nombre total d'oeufs pondus), a été
évalué pour chaque traitement. Les composantes du tableau 8
montent que les taux moyens d'éclosion varient en fonction du
traitement. D'après les résultats d'analyse, il existe une
différence significative entre les traitements, au seuil de 5%. Le taux
d'éclosion est plus élevé lorsque les femelles sont
nourries aux larves du ravageur. Ce taux est de 100% pour le traitement L. Par
contre, ils sont similaires avec les traitements VL, Ty et V. Dans ces derniers
cas, le taux varie entre 0,97 #177; 0,01 et 0,98 #177; 0,002.
Tableau 9: Taux moyens d'éclosion des
oeufs suivant les régimes alimentaires.
|
Traitements
|
Taux moyens d'éclosion
|
|
L
|
1.00
|
#177; 0,000
|
(3.14) a
|
|
VL
|
0.97
|
#177; 0.015
|
(2.93 ) b
|
|
V
|
0.97
|
#177; 0.007
|
(2.91 ) b
|
|
Ty
|
0.98
|
#177; 0.002
|
(2.98) b
|
|
Pr > F
|
0.02
|
|
|
Les moyennes de la même colonne affectées de la
même lettre ne sont pas significativement différentes au seuil de
5% d'après le test de Students- Newman et Keuls.
4.8- Effet des régimes alimentaires sur le sexe
ratio des progénitures.
Le sexe ratio de la progéniture de A. swirskii
a été calculé en faisant le rapport des individus femelles
de la progéniture sur l'effectif total de la progéniture. Le
tableau 13 montre les sexes ratios par traitement et fait observé qu'il
n'existe pas de différences significative entres les traitements, par
rapport au sexe ratio, au seuil de 5% (Pr > F=0. 185). Les
sexes ratio obtenus avec les traitements L, VL et V ne sont différents
de ceux obtenus avec le traitement témoin (Ty). Le régime
alimentaire, n'a pas d'influence
sur l'effectif des individus femelles dans la population du
phytoséiide. Ce rapport varie entre 0,71 #177; 0,008 et 0,77#177; 0,032
en faveur des femelles.
|
Tableau 10 : Sexe ratio de la
progéniture
|
|
|
Traitements
|
Sexe ratio
|
|
|
L
|
0.77 #177; 0.032
|
(2.21) a
|
|
VL
|
0.75 #177; 0.035
|
(2.18) a
|
|
V
|
0.72 #177; 0.013
|
(2.03) a
|
|
Ty
|
0.71 #177; 0.008
|
(2.01) a
|
|
Pr > F
|
0.18 ns
|
|
Les moyennes de la même colonne affectées de la
même lettre ne sont pas
significativement différentes au seuil de 5%
d'après le test de Student- Newman et Keuls. ns : signifie test
«non significatif»
NB: Les valeurs entre parenthèses sont
issues de la transformation 2 arcsin (f/p) 1/2 des proportions de
femelles dans les progénitures, pour la normalisation des proportions et
la stabilisation des variances. f= nombre femelles dans la progéniture
et p= effectif total de la population de la progéniture.
5 DISCUSSION
5.1 Vulnérabilité des stades larvaires de
Megalurothrips sjostedti à la prédation de Amblyseius
swirskii
Les larves 1 de M. sjostedti sont très
vulnérables à la prédation de A. swirskii. Par
contre, les larves de deux jours (larves 2) sont invulnérables à
la prédation de A. swirskii. La forte consommation des larves
par le phytoséiide laisse présager que le phytoséiide peut
consommer plus de 5 larves 1 par jour. Ces résultats confirment ceux
obtenus par nombre d'auteurs ayant étudié la
vulnérabilité des stades de développement des thrips
à la prédation des espèces du genre Amblyseius.
En effet, bien que des espèces comme Amblyseius scutalis et
Amblyseius tularensis attaquent et consomment les stades larvaires des
thrips floricoles de niébé (M. sjostedti) et du
citronnier (Scirtothrips citri ( Moulton), elles n'ont aucun effet sur
les autres espèces de thrips (Bounfour & McMurtry, 1987; Tanigoshi
et al., 1983; 1984, 1985; Tanigoshi, 1991; Jones & Morse, 1995).
Aussi, les prédateurs qui se sont révélés efficaces
contre une vaste gamme de thrips, sont-ils incapables de maîtriser des
larves de certaines espèces de thrips. Par exemple, Amblyseius
barkeri (Hughes), Euseius hibisci, Amblyseius
degenerans (Berlese) et Typhlodromus rickeri (Chant) sont
même incapables d'attaquer les premiers stades larvaires de
Heliothrips haemorrhoidalis sur les avocatiers (McMurtry & Badii,
1991).
Apparemment, l'incapacité des phytoseiides à
attaquer les larves réside dans un mécanisme de défense
que développent ces larves. Dans le cas de la présente
étude, l'invulnérabilité des larves 2 peut s'expliquer par
le fait qu'à ce stade, celles-ci sont très robustes et plus
fortes que les prédateurs. Ces résultats concordent avec ceux
prévus par la théorie de prédation qui stipule un rapport
de proportionnalité entre la forme et la taille du prédateur et
de sa proie (Sabelis, 1992, Diehl, 1993). En effet, le prédateur doit
avoir une taille supérieure ou égale à celle de sa proie
(Van Rijn, 2002). Ce même auteur ajoute que dans les conditions
naturelles, la plante hôte offre au ravageur, des sites de refuge dans
lesquels les ravageurs se cachent. Il est nécessaire que le
prédateur soit au moins de taille similaire à sa proie et bien
robuste, pour pouvoir pénétrer dans les sites et attaquer la
proie. Dans ces conditions, la proie devient plus exposée au
prédateur, lorsqu'elle sort de son refuge. D'autres résultats
renforçant ce mécanisme
postulent que, pour échapper à la
prédation, les larves donnent des coups aux prédateurs par leurs
segments terminaux de l'abdomen. Elles éclaboussent aussi les
prédateurs avec leurs sécrétions anales qui sont
spontanément secrétées lors du combat de la
prédation (Lewis, 1973 ; Bakker & Sabelis, 1986; 1989).
Probablement, les prédateurs ont instinctivement "peur" des larves 2 et
ne s'en approchent pas au risque de recevoir des coups ou des
secrétions. On pourrait supposer que ces secrétions anales
contiennent des substances corrosives qui pourraient provoquer des
démangeaisons chez le phytoseiide.
L'application directe qui découle de la
vulnérabilité de ce premier stade larvaire est que A.
swirskii peut efficacement contrôler la prolifération de la
population de M. sjostedti et rendre plus durable la production de
niébé. En effet, les stades larvaires de ce thrips sont les plus
redoutables au niébé. Et il suffit que six (6) larves de M.
sjostedti se nourrissent sur une inflorescence de niébé
pendant 5 jours pour provoquer la déhiscence de toutes les fleurs (Tamo,
1991). Ainsi, A. swirskii peut être employé à
titre préventif dans les champs de niébé pour la
réduction progressive de la densité des populations des larves 1.
Par ailleurs, le même auteur a établi un modèle relatif
à l'interaction trophique entre M. sjostedti et son hôte,
le niébé; lequel modèle a fait l'objet d'une
évaluation préliminaire pour déterminer l'effet d'agents
de lutte biologique potentiels sur les interactions ravageur / plante.
5.2 Influence des densités de larve 1 sur la
capacité de prédation de Amblyseius
swirskii
Il a été obtenu comme résultat que le
taux de prédation des larves L1 de M. sjostedti par les
femelles de A. swirskii, suit une corrélation positive avec la
densité de larves. Ces résultats suivent la théorie de
prédation postulée par nombre d'auteurs qui stipulent que le taux
de prédation évolue avec la densité de proie. En effet,
Van Rijn (2002) a obtenu les résultats similaires lors de ses travaux
sur la réponse fonctionnelle de certaines espèces de la famille
des Phytoseiidae. Il obtient que la courbe de prédation en fonction de
la densité, suit l'allure d'une courbe asymptotique. Il trouve que cette
relation est indépendante des espèces de prédateurs et de
leurs proies. Tout ceci confirme les résultats de Sabelis
(1992) qui expliquent cet état de chose par le fait
que le prédateur est attiré par des substances
volatiles secrétées par les proies (fèces, traces de
passage des proies) qui permettent au prédateur de repérer
facilement sa proie. Ainsi lorsque l'effectif de la proie augmente, la
concentration de ces substances volatiles augmente aussi et le prédateur
est facilement sensibilisé à la recherche de sa proie. De plus,
lorsque la densité de proies augmente, la probabilité de
rencontre du prédateur et de sa proie, est élevée (Van
Rijn, 2002), ce qui fait que le prédateur attaque plus de proies. Selon
cet auteur qui a étudié la réponse fonctionnelle des
phytoséiides Neoseiulus barkeri et N. cucumeris avec
les larves de Thrips tabaci et de Frankliniella occidentalis
comme proies, les taux de prédation augmentent lorsqu'on passe de
faibles aux fortes densités de proies. Ces différences
constatées entre les densités peuvent être
renforcées par d'autres paramètres propres aux
phytoséiides. En effet, naturellement, les prédateurs sont
supposés être limités par le temps de recherche de leurs
proies à de faibles densités. De même, ces
phytoséiides sont limités par le temps qu'ils passent sur une
proie abattue (Van Rijn, 2002). Un autre point de vue peut expliquer la
différence de prédation en fonction des densités. C'est la
vitesse de conversion de la proie par le prédateur en biomasse. En
effet, le prédateur peut bien avoir une aptitude intéressante
à capturer sa proie, mais le temps qu'il mettra à digérer
la proie peut retarder le processus de chasse (Hazzard & Ferro, 1991; Shipp
& Whitfield, 1991; Mansour & Heimbach, 1993; Fan & Petitt, 1994;
Nwilene & Nachman, 1996; Castagnoli & Simoni, 1999; Montserat et
al., 2000).
Dans le cas des larves 1 utilisées pour le
présent essai, le temps de passage de larves 1 à la larve 2 est
d'un jour. Donc le peu d'heures que perd le phytoséiide à
identifier, à chasser, à capturer, à ingérer et
à digérer une proie, donne assez de chance aux autres larves,
d'entrer progressivement dans le stade suivant, et par conséquent, les
rendre peu à peu invulnérables. C'est pourquoi, nous pouvons
soutenir que les taux de prédation obtenus avec les différentes
densités de larves sont très intéressants dans une
perspective de lutte contre les thrips floricoles de niébé,
puisque le prédateur capture les larves à de très faibles
densités. Une analyse similaire est faite par Nomikou (2003), qui a
rapporté que A. swirskii possède une aptitude de
prédation très intéressante sur les stades immatures de la
mouche blanche, Bemisia tabaci Gennadius (ravageur de
cultures maraîchères et du cotonnier), aux faibles
densités, mais n'extermine pas toute sa population.
5.3- Fécondité de Amblyseius swirskii suivant
différents pollens
Pour évaluer l'influence des pollens des plantes
hôtes sur la fécondité du prédateur, il a
été recueilli comme données, le nombre d'oeufs pondus par
les femelles du prédateur, selon qu'elles sont nourries aux pollens de
V. unguiculata, T. candida, Z. mays, L. sericeus
ou T. australis. Les résultats obtenus montrent que le
prédateur se nourrit bien des différents pollens quelle que soit
leur source. Ces résultats ont été prédits par
Nomikou (2003), qui, ayant étudié l'oviposition du
prédateur, a constaté que cette espèce d'acarien est un
polyphage. Il peut se nourrir et se reproduire à partir du régime
alimentaire autre que les proies. Ce même auteur a évoqué
que les pollens des espèces du genre Typha assurent mieux la
fécondité des femelles du prédateur, ce qui est
également le cas dans la présente étude. Les
résultats de Nomikou (2003) montrent que les femelles peuvent pondre
jusqu'à 5 oeufs par femelle et par jour à 25°C et 70%
d'humidité relative. La différence entre le taux de ponte obtenu
dans nos conditions d'essais, peut s'expliquer par les écarts entre nos
conditions thermo-hygrométriques et celles de Nomikou (2003). En effet,
nos essais ont été effectués dans une gamme de
température de 25 à 27°C avec une humidité de 54
à 70%. Cette capacité de A. swirskii à se
reproduire si aisément sur les pollens trouve son application dans
l'utilisation de ces substrats en particulier celui de T. australis
pour l'élevage au laboratoire de A. swirskii en vue des
lâchers au champ.
5.4- Table de vie de Amblyseius swirskii
La table de vie de A. swirskii a été
étudiée avec différents régimes alimentaires pour
évaluer leurs effets sur certains paramètres biologiques du
prédateur.
5.4.1- Effet de la combinaison de pollen et larves sur le
taux de prédation
Les analyses effectuées sur l'influence de la combinaison
de pollen de niébé et larves sur le prédateur montrent que
la différence entre les deux traitements est
significative au seuil de 5%. Ces résultats sont
conformes à ceux obtenus par Nomikou (2003), qui a
révélé que la capacité de prédation de
A. swirskii diminue lorsqu'il est en présence simultanée
de la proie et d'un aliment alternatif comme le pollen. Van Rijn (2002) a
découvert que lorsque le phytoséiide I. degenerans est
nourri aux larves de thrips, B. tabaci avec addition de pollen, ce
prédateur n'arrive pas à capturer les larves au moment de la
ponte (Nomikou, 2003). Il faut aussi rappeler que nos résultats ont
montré que le plus fort taux de ponte a été obtenu sur
l'aliment mixte. Donc, comme les femelles pondaient beaucoup, elles se
fatiguent plus vite et n'arrivent plus à remporter les combats de
prédation ou ne les engagent pas du tout, et se contentent facilement de
l'aliment alternatif qu'est le pollen. Cet état de chose pourrait aussi
expliquer le faible taux de prédation constaté avec l'aliment
mixte. De plus, puisqu'après la ponte, il est évident que la
femelle soit fatiguée, elle mettra sans doute plus de temps à
consommer l'aliment alternatif au détriment des larves. Car, la
prédation est un véritable combat (Van Rijn, 2002). Cependant, le
taux moyen de prédation obtenu avec le régime mixte, montre que
le prédateur peut réduire autant que possible la population de
ravageur lorsque ce dernier sera sur son hôte en train de causer des
dommages sur les pollens de niébé. De plus, cette habileté
du prédateur, montre que ce dernier peut réduire la population du
ravageur quel que soit l'aliment auquel il est soumis dans le temps.
Dans le cas précis de nos travaux, nous pouvons
expliquer cette diminution de la prédation par le fait que les larves
s'alimentent aussi du pollen de niébé, grandissent plus vite et
deviennent donc invulnérables (Tamo, 1991). Ces résultats
confirment ceux obtenus par Ragusa & Swirski (1977) qui stipulent que la
population des thrips ravageurs ne peut être exterminée par ce
prédateur. Dans la pratique, pour le succès de l'application de
A. swirskii dans la lutte biologique contre les thrips floricoles, il
s'avère nécessaire d'avoir des connaissances approfondies sur le
rapport entre le prédateur et sa proie. Pour ce faire, il faudrait
pouvoir déterminer pour le niébé, la période de son
pic de floraison et son pic de densité du ravageur. Ainsi, une
superposition de ces deux pics permettra de mieux identifier la période
critique à laquelle, l'application des phytoséiides sera
efficiente, de façon à éviter les périodes de
fortes densités du ravageur et celle du pic de floraison pour contourner
la préférence des phytoséiides aux pollens de
niébé. Ces résultats traduisent aussi une concurrence
résultant de la coexistence du
prédateur et du stade invulnérable de la proie
(Murdoch et al., 1987; Van Rijn et al., 2002).
5.4.2- Effet des aliments sur la fécondité
des femelles
Les résultats de l'effet des aliments sur la
fécondité des femelles montre que les traitements pollen de
niébé seul ou pollen de niébé + larve, sont
égaux à ceux obtenus avec le traitement témoin (pollen de
T. australis). Ceci permet de prédire une éventuelle
persistance de la population du prédateur dans les agro-
écosystèmes où il aura le pollen de niébé.
Ces résultats confirment ceux obtenus par plusieurs auteurs ayant
étudié la possibilité des phytoséiide à se
nourrir et à se reproduire à partir des sources alternatives
d'aliments, notamment le pollen, le nectar, les exsudats des fruits, ou
feuilles des plantes. Les phytoséiides possèdent en effet des
aptitudes à se nourrir et à se reproduire à partir de ces
sources alternatives d'aliments (Hagen, 1986; Alomar & Wiedenmann, 1996;
Zemek & Prenerova, 1997; Coll, 1998; Van Rijn & Tanigoshi, 1999a,
1999b). Les aliments alternatifs procurent aux prédateurs de l'eau et
des nutriments complémentaires au régime
préférentiel qui est la proie (Stoner, 1970; Salas-Aguilar &
Ehler, 1977; Limburg & Rosenheim, 2001; Coll & Guershon, 2002). La
différence significative entre la ponte sur le régime larve seule
et l'aliment mixte pourrait s'expliquer par le fait que la consommation des
larves seules, implique une rétention des oeufs dans l'oviducte des
femelles (Nomikou, 2003; observations personnelles, 2007). Nous pourrons
attribuer le faible taux de ponte obtenu au fait que la quantité de
larves offertes aux phytoséiides n'assure pas la satiété
des femelles. En effet, une moyenne de 3,33 larves est servie aux femelles par
jour alors que dans nos essais de prédation, une femelle peut consommer
plus de 5 larves. Les résultats que nous avons obtenus s'inscrivent
pleinement dans le contexte d'excellent agent biologique attribué
à A. swirskii. La disponibilité de sources d'aliments
autre que les proies, rassure sur la persistance de l'agent biologique, A.
swirskii, dans les champs, même dans les situations de rareté
de la proie.
CONCLUSION ET SUGGESTIONS
Il ressort de cette étude que A. swirskii se
nourrit et se reproduit très bien à partir des pollens des
plantes hôtes des thrips. Les larves d'un jour d'âge sont les seuls
stades vulnérables à la prédation de cet acarien. Les
différentes possibilités nutritionnelles de A. swirskii,
revêtent un intérêt particulier dans la lutte biologique
contre les thrips floricoles, M. sjostedti, ravageurs de
niébé. En effet, la nutrition à base de pollens de
maïs et de niébé permettra de faire des lâchers du
phytoséiide dans les cultures pures de niébé ou les
associations de niébé-maïs. La fécondité des
femelles de A. swirskii étant élevée sur le
pollen de Typha australis, cela facilitera les cultures de masse du
phytoséiide pour des lâchers éventuels. De plus, les
résultats intéressants obtenus avec les pollens des plantes
pérennes comme Lonchocarpus sericeus et Tephrosia
candida, rassurent sur l'établissement certain de cette
espèce dans les agro-écosystèmes naturels de ces plantes
hôtes. De plus, l'alternance des pics de floraisons chez ces plantes
hôtes, renforcera la persistance de la population du prédateur en
conditions réelles.
Considérant toutes ces intéressantes
potentialités de Amblyseius swirskii, il s'avère
nécessaire de poursuivre les études sur ce nouvel auxiliaire en
Afrique. Il s'agira notamment de:
- élargir la gamme des plantes hôtes
étudiées;
- essayer les possibilités d'établissement du
phytoséiide en milieu réel;
- étudier la bioécologie du phytoséiide dans
les grandes zones agroécologiques de l'Afrique;
- prévoir un modèle d'utilisation rationnelle de ce
prédateur pour diverses cultures de grande importance économique
et sociologique; notamment le niébé, le coton, et les cultures
maraîchères.
REFERENCES BIBLIOGRAPHIQUES
Agboton C., 2004. Potentialités
biologiques et écologiques de Ceranisus femoratus
(Gahan)(Hymenopzera: Eulophidae) un nouvel ennemi naturel
pour lutter
contre Megalurothrips sjostedti (Trybom) (Thysanoptera:
Thripidae) ravageur
du niébé au Bénin. Thèse pour
l'obtention du Diplôme d'Etudes Approfondies (DEA). UAC, 95p
Ahounou D. M., 1990. Elevage de Maruca
testulalis(Geyer) (Lépidoptère: Pyralidae). Cycle
de développement et table de vie de l'insecte en conditions de
laboratoire. Thèse d'ingénieur agronome. Université
Nationale du Bénin, Faculté des Sciences Agronomiques, 81p.
Alomar O. & Wiednmann R. N., (eds.) 1996.
Zoophytophagous Heteroptera : Implication for life history and integrated pest
management. Thomas Say
Publications, Entomological Society of America, Lanham,
Naryland, USA, 202 pp. Anochili B., 1998. Food crop
production. Word crops, 32-42
Anonyme 2002. Mémento de l'agronome.
5ème Édition CIRAD-GRET-CTA. Anhem, Pays-Bas. 635-685.
Arbonnier M., 2002. Arbres, arbustes et lianes
des zones sèches d'Afrique de l'Ouest. CIRAD-MNHN. 541p
Arodokoun D. Y., 1996. Importance des
plantes-hôtes alternatives et des ennemis naturels indigènes dans
le contrôle biologique de Maruca testulalis Geyer (Lepidoptera:
Pyralidae), ravageur de Vigna unguiculata Walp. Thèse pour
l'obtention de Philosophiae doctor (Ph. D.). Département de biologie,
Faculté des Sciences et de Génie. Université Laval/
Québec. 175 p.
Atachi P., 1998. Etude bioécologique de
Maruca testulalis (Geyer) dans les cultures de Vigna
unguiculata (L.) en République du Bénin. Perspectives de
lutte intégrée. Thèse de doctorat d'Etat
ès-Sciences Naturelles. Faculté des Sciences et Techniques de
l'Université d'Abidjan (Cocody). Côte-d'Ivoire, 351p
Bakker F.M. & Sabelis M. W., 1986. Attack
success of Amblyseius mekenziei and
the stage related defensive capacity of thrips larvae. Meded.
Fac Landbouww. Rijksuniv. Gent 51, 1041-1044.
Bakker F.M. & Sabelis M. W., 1989. How
larvae of Thrips tabaci reduce the attack success of phytoseiid
predators. Entomol. Exp. Appl. 50, 47 - 51.
Bezpaly I., 1984. Les plantes cultivées
en Afrique occidentale. Eds. Mir Moscou, 278p Bottenberg H., Tamo M.,
Arodokoun D., Jakai L. E. N., Singh B. B. & Youm O., 1997.
Population dynamics and migration of cowpea pests in northern Nigeria :
implication for integrated pest management : 27 1-284. In:
Advances in Cowpea
Research, edited by. Singh B. B., Mohan Raj D. R.,
Dashiell K. E. &. Jackai L. E.
N. Copublication of IITA, Ibadan, Nigeria.
Bounfour M. & McMurtry J. A., 1987. biology
and ecology of Euseis scutalis (Athias-Henriot) (Acarina:
Phytoseiidae). Hilgardia. 55, 1-23
Birch L. C., 1948., The intrinsic rate of
natural increase of an insect population. J. Anim. Ecol., 17,
15-26.
Capo-Chichi D. B. E., 2005. Influence des
associations de cultures Vigna-Sesbania
sur la dynamique des
populations de Maruca vitrata. Etude de l'attraction
olfactive exercée par les organes de ces plantes sur
les larves de cet insecte. Thèse d'ingénieur agronome
Université d'Abomey-Calavi, Faculté des Sciences Agronomiques
Abomey-Calavi, Bénin, 124p
Castagnoli M. & Simoni S., 1999. Effect of
long-term feeding history on functional
and numerical response of Neoseiulus Californicus (Acari:
Phytoseiidae). Exp. Appl. Acarol. 23 (3), 2 17-234.
Coll M. & Guershon M., 2002. Omnivory in
terrestrial arthropods : mixing plant and prey diets. Annu. Rev.
Entomol. 47, 267 - 297.
Coll M., 1998. Living and feeding on plants in
predatory Heteroptera. In : Coll M. and Ruberson J. R. (eds) Predatory
Heteroptera : Their ecology and use in biological
control. Thomas Say Publications, Entomological Society of
America, Lanham, Mayland, USA, pp.89-130.
Coulibaly O. & Lowenber-Deboer J., 2002. the
economics of cowpea in west Africa: 354- 366. In : Fatokun, C. A., Tarawali, S.
A, Singh, B. B, Kormawa, P. M. et Tamo, M. Challenge and Opportinuties for
enhancing sustainable cowpea production. Proceeding of the World Cowpea
Conference III held at the International Institute of Tropical Agriculture
(IITA), Ibadan, Nigeria, 4-8 September, 2000.
Diehl S., 1993. Relative consumer sizes and
strengths of direct and indirect
interactions in omnivorous feeding relationships. Oikos
68 : 151-157
Diop K., 1999. The biologigy of Ceranisus
menes (Walker) (Hym., Eulophidae), A parasitoid of the bean flower thrips
Megalurothrips sjostedti (Trybom) (Thysanoptera: Thripidae): A
comparison between African and Asian Populations. PhD thesis, University of
Ghana, Legon, Ghana, 164p
Ezueh M. I., 1981. Nature and significance of
preflowering damage by thrips to cowpea. Entomologia Experimentalis and
Applicata, 29, 305-312.
Fan Y. Q. & Petitt F. L., 1994. Biological
control of Broad Mite,
Polyphagotarsonemus latus (Banks), by Neoseiulus
barkeri Hughes on pepper. Biol. Contr. 4 (4), 390-395.
Fereres A. R. M., Araya J. E. & Foster J. E., 1989.
Development and
(Homoptera: Aphididae) on wheat
cultivars infected with barly yellow dwarf virus. Env.
Entonol. 18: 388-393.
Hagen K.S., 1986. Ecosystem analysis : Plant
cultivars (HPR), entomophagous
species and food supplements. In: D.J. Boethel and R.D.
Eikenbarry (eds) Interaction of plant resistance and parasitoids and predators
of insects. John Wiley and Sons, New York, USA, pp. 151-197.
Hagvar E. B. & Hofshang T., 1990. Fecundity
and the intrinsic rate of increase of the aphid parasitoïd Ephredus
cerasicola Stary (Homoptera: Aphididae).
J. Appl. Ent. 109, 262-267.
Hazzard R. V. & Ferro,D. V., 1991. Feeding
responses of adult Coleomegilla maculate (Coleoptera, Coccinellidae)
to eggs of Colorado potato beetle
(Coleoptera: Chrysomelidae) and green peach aphids (Homoptera:
Aphididae). Environ. Entomol. 23, 855-859
Hulting F. L., Orr D. B. & Obricky J. J., 1990.
A computer program for calculation and statistical comparison of
intrinsic rates of increase and associated life table parameters. Florida
Entomol. 73 (4), 601-612.
http://fr.wikipedia.org/wiki/Roseau
I.N.R.A.B., 1995. cultures vivrières
statistiques. Céréales et légumineuses à graines
et
tubercules: maïs, riz et sorgho, niébé,
arachide, soja, igname et manioc.fiche technique ed. 1995., 32 pp
I.I.T.A. 1975. Grain legume improvement program.
Report of the external review 1975. Int Inst Trop. Agric. Ibadan,
Nigreia. Pp 18-28
I.I.T.A. 1979. Le point de la recherche. Inst.
Int. Agric. Trop. Ibadan,
Nigeria. Pp 20-24.
I.I.T.A. 1982. Institut International
d'Agriculture Tropicale. Le niébé. Manuel de formation.
Série de manuel N°II, Ibadan, Nigeria, 234p.
I.I.T.A. /S.A.F.G.R.A.D. 984. Rapport annuel
1984. Ouagadougou, Burkina Faso. 256 p
Jakai L. E. N. & Daoust R. A., 1986. Insect
pests of cowpea. Annual review of entomology, 34 (3), 116-119.
Jakai L. E. N. & Adalla, C. B. 1997. Pest
management practies in cowpea: 240-257. In Singh B. B., Mohan Raj, D. R.,
Dashiell K. E., Jakai L. E. N. (eds). Advances in cowpea Research.
Copublication of International Institute of tropical agriculture (IITA) and
Japan International research Center for Agricultural Sciences (JIRCAS),
Publishing Devron. UK.
Jones S. A. & Morse J. G., 1995. use of
isoelectric focusing electrophoresis to evaluate citrus thrips ( Thysanoptera:
Thripidae) predation by Euseius tularensis (Acari: Phytoseiidae).
Environ. Entomol. 24, 1040-105 1
Lewis T., 1973 Thrips: Their Biology, Ecology
and Practical Importance. Academic Press, London, 297 pp.
Lewis T., 1997. Thrips as crops pest. CAB
International, Wallingford, UK, 736p Limburg D.D. & Rosenheim J.
A., 2001. Extrafloral nectar consumption and its
influence on survival and development of an omnivorous predator,
larval
Chrysoperla plorabunda (Neuroptera : Chrysopidae).
Environ. Entomol. 30 :
5 95-604.
M.A.E.P., 2004. Annuaire statistique. Campagne
agricole 2003-2004. Direction de la programmation et de la prospective. Service
Statistique. Août 2004. pp 22.
M.D.R., 1992. Filière
Niébé. Direction de l'Analyse de la Prévision et de la
Synthèse. Document provisoire. 32p
Mansour F. & Heimbach U., 1993. Evaluation
of lycosid, micryphantid and
linyphiid spiders as predators of Rhophalosiphu padi (Hom.,
Aphididae) and their functional response to prey density-Laboratory
experiments. Entomophaga 38, 79 - 87.
McMurtry J. A. & Badii M. H., 1991.
Greenhouse thrips, Heliothrips
haemorrhoidalis, in California avocado orchards :
Biological control studies.
In: Parker, B. L., M. and Lewis, T. (Eds). Towards
Understanding Thysanoptera. General Technical Report NE-147, USDA, Forest
Service, Radnor, PA, pp. 393- 398.
Montserat M., Albajes R. & Castane C., 2000.
Functional response of four
Heteropteran predators preying on
greenhouse whitefly (Homoptera :
Aleyrodidae) and western flower thrips (Thysanoptera :
Thripidae). Environ. Entomol. 29, 1075-1082.
Murdoch W.W., Nisbet R. M., Blythe S. P., Gurney W. S.
C. & Reeve J. D., 1987. An invulnerable age class and stability in
delay-differential parasitoid-host models. Am. Nat. 129, 263-282.
Nomikou M., 2003. Combating whiteflies predator
mites as a novel weapon. 156p
Nwilene F. E. & Nachman G., 1996.
Reproductive responses of Iphiseius degenerans and
Neoseiulus teke (Acari : Phytoseiidae) to changes in the density of the
cassawa green mite, Mononychellus tanajoa (Acari: Tetranychidae).
Exp. Appl. Acarol. 20 : 273 - 282.
Ogounmodedo B. K. & Oyenuga V. A., 1968
Estimation of vitamins A, D and value
of varieties of cowpea ( Vigna unguiculata(L.) Walp)
grown in Nigerian Agric. Jour. 5 (2), 65-67
Okwakpam B. A., 1967. Three species of thrips in
cowpea flowers in the dry season igeria. Nigerian entomologist magazine,
3: 45-46.
Oyenuga V. A., 1968. Nigeria's food and feeding
stuffs : the chemistry of food value. University of Ibadan Press. Pp 79-83
Palmer J. M., 1987. Megalurothrips in
the flowers of tropical legumes: a morpholmetric study : 480-495. In:Population
structure, genetics and taxonomy
of aphids and Thysanoptera. Holman J., Pelikan J., Dixon A. G. F.
& Weisman L. (eds). The Hague, SPB Academic publishing.
PEDUNE, 1998. Protection Ecologiquement Durable
du Niébé. Rapport d'activités 1997-1998 IITA
/Coopération Suisse de développement, 144 p.
Platt B.S., 1962. Tables of representative
values of food commonly used in tropical countries. Medical Research Council
Special Report Series 20. M.R.C. London.
Programme Natura / Nectar, 1996. Adaptation
du module lutte biologique. Une formation continue destinée aux
professionnels des institutions de recherche et de développement. UAC,
235 pp.
Polis G. A., 1981. The ecology and evolution of
intraguild predation: Potential competitors at each other. Ann. Rew. Ecol.
Syst. 20: 297-330.
Polis G. A. & Holt R. D., 1992. Intraguild
predation. The dynamics of complex trophic interactions. TREE. 7:
151-154
Rachie K. O. 1985. Introduction. In: Singh S. R.
& Rachie K. O. (eds) Cowpea
Research Production and Utilization. John Wiley & Sons
Chichester, London, 6p. Rathore Y. S. & Mleba. N. 1984.
Cultural control of thrips. IITA Annual Report for
1993. Ibadan Nigeria. 254 p.
Ragusa S. & Swirskii E., 1977.
feeding-habits, post-embrionic and adults survival mating, virility and
fecundity of predacious mite Amblyseius swirskii ( Acari: Phytoseiidae), on
some coccids mealybugs. Entomophaga. 20: 381-392.
Richard H., Markham A. W. & Siaka A., 1992.
Manuel de lutte biologique. PNUD/ FAO. 239p.
Rusoke D. G. & Rubaihayo P. R., 1994. The
influence of some crop protection management practices on yield stability of
cowpeas. Afr. Crop Sci.J 2, 143-148.
Sabelis M. W., 1992. Arthropod predatory. In
: Natural Enemies, the Population Biology of Predators, Parasites and Diseases
(ed. M. J. Crawley), Blackwell, Oxford, pp. 225-264.
Salifu A. B., 1986. Studies on aspects of the
biology of the thrips, Megalurothrips sjostedti Trybom with
particular reference to resistance in its hosts, cowpea
Vigna unguiculata (L.) Walp. Wye College, University of
London, PhD thesis 267
p.
Salas-Aguilar J. and Ehler L. E. 1977. Feeding
habits of Orius tristicolor. Ann Emtomol. Soc. Am 70 :
60-62.
Shipp J. L. & Whitfield G. H., 1991.
Functional response of the predatory mite, Amblyseius cucumeris (Acari
: Phytoseiidae), on western flower thrips, Frankliniella occidentalis
( Thysanoptera : Thripidae). Environ. Entomol. 20 (2),
694-699.
Sickle J. V., 1988. Unvalid estimates of rate
of populations increase from Glossina
(Diptera: Glossinidae) age
distribution. Bull. Entomol. Res. 78: 155-161.
Singh S. R. & Allen D. J., 1980. Pests,
Diseases, resistance and protection of Vigna unguiculata (L) Walp.: 4
19-443. In: Advances in legumes Science,
Summerfield R. J. & Bunting A. H., eds., London, Royal
Botanical Gardens, and Ministry of Agriculture, Fish and Food.
Sourokou B., 1985. utilisation du decis et du
systoate pour le controle de Maruca testulalis (Geyer) (Lepidoptera:
Pyralidae) et de Megalurothrips sjostedti (Trybom) (Thysanoptera:
Thripidae) du niébé ( Vigna unguiculata(L.) Walp).
Thèse d'ingénieur agronome. UNB, 123p.
Stoner A., 1970. Plant feeding by a predaceous
insect, Geocoris punitipes. J. Econ. Entomol . 63, 1911 -
1915.
Sun J. B. & Simbi O. C., 1983. Studies on
the legume pod-borer Maruca testulalis
(, flowers and pods on cowpea yield in western Kenya. Insect.
Sci Applic. 4
(1/2), 89-96.
Tamo M., 1991. Interactions between the cowpea
( Vigna unguiculata Walp.) and the
bean flower thrips
(Megalurothrips sjostedti Trybom) in Rep. of Benin. A
dissertation submitted to the Swiss Federal Institute of
Technology Zurich for the degree of Doctor of technical Sciences. 136p
Tamo M., Baumgartner J., Delucchi V. & Harren H. R.,
1993. Assessment of key factors responsible for the pest status of the
bean flower thrips Megalurothrips sjostedti(Trybom) (Thysanoptera,
Thripidae). Bulletin of Entomologia Research, 83, 25 1-258.
Tamo M., Bottenderg H., Arodokoun D. & Adeoti R.,
1997. The feasibility of classical biological control of two major
cowpea insect pests: 259-270. In:
Advances & in cowpea research, edited by Singh, B. B.,
Morhan Raj, D. R., Dashiell, K. E. & Jackai, L. E. N. Copublication of
International Institute of Tropical Agriculture ( IITA) and Japan International
Research Center for Agricultural Sciences (JIRCAS). IITA, Ibadan, Nigeria.
Tanigoshi L. K., Nishio-Wong J. Y. & Fargerlund J.
1983. Greenhouse and laboratory rearing studies of Euseis
hibisci (Chant) (Acarina : Phytoseiidae), a natural enemy of the citrus
thrips, Scirtothrips citri (Moulton) (Thysanoptera : Thripidae).
Environ. Entomol. 12 : 1298-1302.
Tanigoshi L. K., Nishio-Wong J. Y. & Fargerlund J.,
1984. Euseius hibisci : its control of citrus thrips in
southern California citrus orchards. In : Griffiths, D.
A. and Bowman, C. E. (Eds). Acarology VI, Vol. 2, Ellis
Horwood Limited,
B. Chichester, pp 717-724.
Tanigoshi L. K., Nishio-Wong J. Y., Fargerlund J. &
Griffiths H. J., 1985
Biological control of citrus Thrips, Scirtothrips citri
(Thysanoptera : Thripidae), in southern California citrus groves. Environ.
Entomol. 14 : 733 - 741.
Tanigoshi L. K., 1991. Biological control of
citrus thrips, Scirtothrips citri, by predacious phytoseiid mites. In
Parker, B. L., Skinner, M. and Lewis, T. (eds). Towards Understanding
Thysanoptera. General Technical Report NE- 147, USDA, Forest Sevice, Radnor,
PA, pp. 399-418.
Tissut M., Severin P. & Guyot J. L., 1979.
Pesticides oui ou non? Presses
universitaires de Grenoble; 235p
Trottin-Caudal Y., Chanbriere C., Fournier C., Leyre J.
M., Bordat D. & Schoen L., 2006. Etudes
expérimentales de nouveaux auxiliaires Franklinothrips
vespiformis, Encarsia hispida et
Typhlodromips swirskii en cultures légumières sous
abris: premiers résultats et perspectives. Rencontres du
végétal 16-17 janvier 2007. CtiFl, CENTREX, CIRAD, APREL. Non
paginé
Van Rijn P.C.J. & Tanigoshi L. K. 1999a.
Pollen as food for the predatory mites Iphiseius degenerans and
Neoseiulus cucumeris (Acari : Pphytoseiidae) : dietary range and life
history. Exp. Appl. Acarol. 23 , 785-802.
Warren P. H. & Lawton J. H., 1987. Invertebrate predator-
prey body size relationships: an explanation for triangular food webs and
patterns in food web structure? Oecologia. 74: 231-235.
Van Rijn P.C.J.& Tanigoshi L. K., 1999b.
The contribution of extrafloral nectar to survival and reproduction of the
predatory mite Iphiseius degenerans on Ricinus communis. Exp.
Appl. Acarol. 23 : 28 1-296.
Van Rijn P. C. J., Van Houten Y. M. & Sabelis M.
W., 2002. How plant benefit from providing food to
predators even when it is also adible to herbivores. Ecology 83: 2664-2679.
Waag J., 1989. Ecological theory and the
selection of biological control agents. In : critical Issues in biological
Control. Mackauer M., Ehler L. E. & Roland J. (eds), pp. 135-157
Yaninek J. S., de Moraes G. J. & Markham R. H.,
1989. Handbook on the
Cassava Green Mite (Mononychellus tanajoa) in Africa. A
guide to its biology and procedure for implementing classical biological
control. IITA., 139 pp.
Zemek R. & Prenerovà E., 1997.
Powdery mildew (Ascomycotina: Eysiphales) an alternative food for the
predatory mite Typhlodromus pyri Scheuten (Acari: Phytoseiidae.
Exp. Appl. Acarol. 21, 405 - 414.

ANNEXE 1: Calendrier de Floraison de quelques
plantes hôtes de M. Sjostedti.
NB: Pour ces plantes il existe des moments de
faible, moyenne et forte floraison qui ne sont pas ici
spécifiés.
Département Mois Floraison plantes
hôtes
Atacora Janvier Pterocarpus santalinoïdes ; Pterocapus
erinaceus ; Bertinia sp
& Février Pterocarpus santalinoïdes ;
Berlinia grandiflora ;
Donga Mars Pterocarpus santalinoïdes ; Berlinia
grandiflora
Avril Berlinia grandiflora ; Lonchocarpus sericeus
Mai Berlinia grandiflora ; Lonchocarpus sericeus
Juin Lonchocarpus sericeus ; vigna unguiculata
Juillet Vigna unguiculata ; Piliostigma thonningii
Août Vigna unguiculata ; Cochlospermum vitifolium ;
Berlinia
grandiflora
Septembre Vigna unguiculata ; Piliostigma thonningii ;
Tephrosia
bracteolata
Octobre Cochlospermum vitifolium ; Tephrosia bracteolata ;
Piliostigma
thonningii
Novembre Cochlospermum vitifolium ; Desmodium sp
;Pterocarpus
santalinoïdes
Décembre Pterocarpus santalinoïdes ;
Atlantique Janvier Centrosema pubescence ; Pterocarpus
santalinoïdes
Février Centrosema pubescence ; Pueraria phaseoloides
; Pterocarpus
santalinoïdes ; Milletia thonningii
Mars Pterocarpus santalinoïdes ; Milletia
thonningii
Avril Lonchocarpus sericeus ; Tephrosia bracteolata,
Milletia
thonningii
Mai Lonchcarpus cyanescence ; Lonchocarpus sericeus
Juin Lonchocarpus cyanescence
Juillet Lonchocarpus sericeus
Août Lonchocarpus sericeus
Septembre ****
Octobre ****
Novembre Centrosema pubescence ; Pueraria
phaseoloides
Décembre Centrosema pubescence ; Pueraria
phaseoloides
Borgou Janvier Pterocarpus santalinoïdes ; Pterocarpus
erinaceus ; Berlinia sp
& Février Pterocarpus santalinoïdes ;
Berlinia grandiflora ;
Alibori Mars Pterocarpus santalinoïdes ; Nerlinia
grandiflora ;
Avril Berlinia grandiflora ; Lonchocarpus sericeus
Mai Berlinia grandiflora ; Lonchocarpus sericeus
Juin Lonchocarpus sericeus ; vigna unguiculata
Juillet Vigna unguiculata ; Piliostigma thonningii ;
Lonchocarpus
cyanescens
Août Piliostigma thonningii ; Cochlospermum vitifolium
;
Lonchocarpus cyanescens
Septembre Vigna unguiculata ; Piliostigma thonningii ;
Tephrosia
bracteolate
Octobre Cochlospermum vitifolium; Tephrosia bracteolate
;
Lonchocarpus cyanescens ; Desmodium sp
Novembre Cochlospermum vitifolium ; desmodium sp ;
Pterocarpus
santalinoïdes
Décembre Pterocarpus santalinoïdes ;
Mono Janvier Pueraria phaseoloides ; Centrosema
pubescences
& Février Milletia thonningii ; Pueraria
phaseoloides
Couffo Mars Lonchocarpus sericeus
Avril Lonchocarpus sericeus ; Lonchocarpus cyanescens
Mai Lonchocarpus sericeus ; Lonchocarpus cyanescens
Juin Lonchocarpus sericeus ; Lonchocarpus cyanescens
Juillet Lonchocarpus cyanescens
Août Desmodium sp ; Piliostigma thonningii ;
Lonchocarpus
cyanescens
Septembre Tephrosia bracteolate ;
Octobre Sesbania sp ; Tephrosia ; Centrosema
pubescence
Novembre Pueraria phaseoloides ; Centrosema
pubescence
Décembre Pueraria phaseoloides ; Centrosema pubescence
;
Ouémé Janvier Pterocarpus santalinoïdes ;
Pueraria phaseoloides ; Centrosema
pubescens ; Milletia thonningii ; Berlinia sp
& Février Pterocarpus santalinoïdes ;
Milletia thonningii ; Pueraria
phaseoloides ;
Plateau Mars Pterocarpus santalinoïdes ; milletia
thonningii ; Pueraria
phaseoloides ;
Avril Lonchocarpus sericeus ; Lonchocarpus cyanescens,
Milletia
thonningii
Mai Lonchocarpus sericeus ; Lonchocarpus cyanescens
Juin Lonchocarpus sericeus ; Vigna unguiculata
Juillet Vigna unguiculata (terre ferme)
Août Tephrosia bracteolate ; Tephrosia candida ;
Sesbania sp
Septembre Tephrosia candida ;
Octobre ****
Novembre ****
Décembre Pterocarpus santalinoïdes ; Pueraria
phaseoloides ; centrosema
pubescens ; Berlinia sp
Zou Janvier Pterocarpus santalinoïdes ; Pterocarpus
erinaceus ; Berlinia sp
& Février Pterocarpus santalinoïdes ;
Pterocarpus erinaceus ; Berlinia sp
Collines Mars Pterocarpus santalinoïdes ; Lonchocarpus
sericeus ; Milletia
thonningii ;
Avril Lonchocarpus sericeus ; Lonchocarpus cyanescens ;
Pterocarpus
santalinoïdes
Mai Pterocarpus santalinoïdes ; Lonchocarpus sericeus ;
Berlinia sp
Juin Lonchocarpus sericeus ; Lonchocarpus cyanescens ;
Tephrosia
bractéolata
Juillet Lonchocarpus sericeus ; Lonchocarpus cyanescens ;
Vigna
unguiculata ; Piliostigma
Août Lonchocarpus sericeus ; lonchocarpus cyanescens ;
Vigna
unguiculata ; Tephrosia bractéolata
Septembre Vigna unguiculata ; Lonchocarpus cyanescens ;
Tephrosia
bractéolata ; Sesbania sp ;
Octobre Cochlospermum vitifolium ; Vigna unguiculata ;
Tephrosia
bractéolata ; Pterocarpus santalinoïdes
Novembre Cochlospermum vitifolium ; Pterocarpus
erinaceus
Décembre Pterocarpus santalinoïdes ; Ptercarpus
erinaceus ;
Cochlospermum vitifolium
ANNEXE 2 : Axes suivis au cours des prospections dans
le Sud et le Centre du Bénin
I/
OUEME-PLATEAU
Pobè-Kétou-Adja-Ouèrè
II/ MONO-COUFFO
Comè-Grand-Popo-Aplahoué-Klouékanmè-Couffokpa.
III/ ZOU-COLLINES
Abomey-Djidja - Bohicon - Zakpota - Covè - Zangnado
Dasso - Ouinhi - Dan - Setto - Paouignan - Dassa - Zoumè -
Savalou - Savè - Pont Ouémé- Bantè - savè
IV/ ATLANTIQUE
Abomey-Calavi Ouidah
Abomey-Calavi - Glo-Djigbé - Allada - Sékou
Annexe 3: procédure d'anova de la
fécondité des femmelles suivant les pollens
ANOVA Procedure
Dependent Variable: nboeufjfem
Sum of
Source DF Squares Mean Square F Value Pr > F
Model 4 15.45497867 3.86374467 28.19 <.0001
Error 70 9.59413333 0.13705905
Corrected Total 74 25.04911200
R-Square Coeff Var Root MSE nboeufjfem Mean
0.616987 18.67132 0.370215 1.982800
Source DF Anova SS Mean Square F Value Pr > F
Pollen 4 15.45497867 3.86374467 28.19
<.0001
The ANOVA Procedure
Student-Newman-Keuls Test for nboeufjfem
NOTE: This test controls the Type I experimentwise error rate
under the complete null
hypothesis but not under partial null hypotheses.
Alpha 0.05
Error Degrees of Freedom 70
Error Mean Square 0.137059
Number of Means 2 3 4 5
Critical Range 0.2696249 0.3237062 0.3557805 0.3785341
Means with the same letter are not significantly different.
|
SNK Grouping
|
|
Mean N Pollen
|
|
A
|
2.7053
|
15
|
Typha
|
|
B
|
2.1900
|
15
|
Lonchoca
|
|
C
|
1.8853
|
15
|
Maize
|
|
C
|
|
|
|
|
C
|
1.8007
|
15
|
Niebe
|
|
D
|
1.3327
|
15
|
Tephrosi
|
Pollen=Lonchoca
The MEANS Procedure
Analysis Variable : nboeufjfem
N Mean Std Error
ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
15 2.1900000 0.0972968
ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
Pollen=Maize
Analysis Variable : nboeufjfem
N Mean Std Error
ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
15 1.8853333 0.0685834
ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
Pollen=Niebe
Analysis Variable : nboeufjfem
N Mean Std Error
ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
15 1.8006667 0.0707475
ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
Pollen=Tephrosi
Analysis Variable : nboeufjfem
N Mean Std Error
ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
15 1.3326667 0.0702815
ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
Pollen=Typha
Analysis Variable : nboeufjfem
N Mean Std Error
ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
15 2.7053333 0.1468717
ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
Annexe 4 : Procédure d'ANOVA de la
prédation.
The ANOVA Procedure
Dependent Variable: Trconso
Sum of
Source DF Squares Mean Square F Value Pr > F
Model 3 1.11825373 0.37275124 3.56 0.0474
Error 12 1.25532633 0.10461053
Corrected Total 15 2.37358005
R-Square Coeff Var Root MSE Trconso Mean
0.471125 13.83968 0.323436 2.337016
F
Source DF Anova SS Mean Square F Value Pr >
Density 3 1.11825373 0.37275124 3.56 0.0474
The ANOVA Procedure
Dependent Variable: consjfem
Sum of
Source DF Squares Mean Square F Value Pr > F
Model 3 49.75372500 16.58457500 388.81
<.0001
Error 12 0.51185000 0.04265417
Corrected Total 15 50.26557500
R-Square Coeff Var Root MSE consjfem Mean
0.989817 8.016646 0.206529 2.576250
Source DF Anova SS Mean Square F Value Pr >
F
Density 3 49.75372500 16.58457500 388.81
<.0001
The ANOVA Procedure Student-Newman-Keuls Test for Trconso
NOTE: This test controls the Type I experimentwise error rate
under the complete null hypothesis but not under partial null
hypotheses.
Alpha 0.05
Error Degrees of Freedom 12
Error Mean Square 0.104611
Number of Means 2 3 4
Critical Range 0.4983037 0.6101252 0.6789756
Means with the same letter are not significantly different.
|
SNK Grouping Mean
A 2.7262 4
A
|
N Density
3
|
|
B
|
A
|
2.3993
|
4
|
10
|
|
B
|
A
|
|
|
|
|
B
|
A
|
2.2168
|
4
|
20
|
|
B
|
|
|
|
|
|
B
|
|
2.0058
|
4
|
5
|
The ANOVA Procedure Student-Newman-Keuls Test for consjfem
NOTE: This test controls the Type I experimentwise error rate
under the complete null hypothesis but not under partial null
hypotheses.
Alpha 0.05
Error Degrees of Freedom 12
Error Mean Square 0.042654
Number of Means 2 3 4
Critical Range 0.3181905 0.3895937 0.433558
Means with the same letter are not significantly different.
|
SNK Grouping
|
Mean
|
N Density
|
|
A
|
5.3325
|
4
|
20
|
|
B
|
2.8900
|
4
|
10
|
|
C
|
1.1650
|
4
|
5
|
|
C
|
|
|
|
|
C
|
0.9175
|
4
|
3
|
|
|
|
Density=3
|
|
|
|
|
|
|
|
|
|
|
The MEANS Procedure
Variable N Mean Std Error
ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
|
Pconso
|
4
|
0.9166667
|
0.0531904
|
|
Trconso
|
4
|
2.7262329
|
0.2476093
|
|
consjfem
|
4
|
0.9175000
|
0.0526585
|
ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
Density=5
Variable N Mean Std Error
ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
|
Pconso
|
4
|
0.7000000
|
0.0881917
|
|
Trconso
|
4
|
2.0057548
|
0.1947127
|
|
consjfem
|
4
|
1.1650000
|
0.1455163
|
ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
Density=1 0
Variable N Mean Std Error
ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
|
Pconso
|
4
|
0.8666667
|
0.0192450
|
|
Trconso
|
4
|
2.3993078
|
0.0570328
|
|
consjfem
|
4
|
2.8900000
|
0.0635085
|
ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
Density=20
Variable N Mean Std Error
ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
|
Pconso
|
4
|
0.8000000
|
0.0180021
|
|
Trconso
|
4
|
2.2167687
|
0.0461992
|
|
consjfem
|
4
|
5.3325000
|
0.1211318
|
ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
Annexe 5 : Procédure d'ANOVA de la
prédation suivant la combinaison ou non de larves et pollen de
niébé
The SAS System
The T TEST Procedure
Statistics
Lower CL Upper CL Lower CL
Upper CL
Variable Traitement N Mean Mean Mean Std Dev Std
Dev Std
Dev Std Err Minimum Maximum
|
proiefemj Larve
|
14 2.3807
|
2.9043
|
3.4279
|
0.6574
|
0.9068
|
|
1.461 0.2424 1.17 4.27
proiefemj LarveNie
|
14 1.6163
|
2.0471
|
2.478
|
0.541
|
0.7462
|
|
1.2022 0.1994 0.6 3.28
proiefemj Diff (1-2)
|
0.212 0.8571
|
1.5023
|
0.654
|
0.8304
|
1.138
|
0.3 139
|
T-Tests
|
|
|
|
|
Variable
|
Method Variances
|
DF
|
t Value
|
Pr > |t|
|
|
proiefemj
|
Pooled Equal
|
26
|
2.73
|
0.0112
|
|
proiefemj
|
Satterthwaite Unequal
|
25.1
|
2.73
|
0.0114
|
Annexe 6: Procédure d'ANOVA pour les taux
d'éclosion, les taux de ponte et les sexes ratio des progénitures
: table de vie.
The ANOVA Procedure Dependent Variable: nboeuffemj
Sum of
Source DF Squares Mean Square F Value Pr > F
Model 3 18.83966250 6.27988750 16.65 <.0001
Error 52 19.61752143 0.37726003
Corrected Total 55 38.45718393
R-Square Coeff Var Root MSE nboeuffemj Mean
0.489887 44.01284 0.614215 1.395536
Source DF Anova SS Mean Square F Value Pr > F
traitement 3 18.83966250 6.27988750 16.65 <.0001
Student-Newman-Keuls Test for nboeuffemj
null
NOTE: This test controls the Type I experimentwise error rate
under the complete
hypothesis but not under partial null
hypotheses.
Alpha 0.05
Error Degrees of Freedom 52
Error Mean Square 0.37726
Number of Means 2 3 4
Critical Range 0.4658565 0.5600883 0.6161529
Means with the same letter are not significantly different.
|
SNK Grouping
|
Mean
|
N traitement
|
|
A
|
1.8893
|
14
|
LarveNie
|
|
A
|
|
|
|
|
A
|
1.7671
|
14
|
Typha
|
|
A
|
|
|
|
|
A
|
1.5057
|
14
|
Niebe
|
|
B
|
0.4200
|
14
|
Larve
|
Dependent Variable: Treclos
Sum of
Source DF Squares Mean Square F Value Pr > F
Model 3 0.39779720 0.13259907 3.45 0.0234
Error 50 1.92328435 0.03846569
Corrected Total 53 2.32108155
R-Square Coeff Var Root MSE Treclos Mean
0.171384 6.563456 0. 196127 2.988 162
Source DF Anova SS Mean Square F Value Pr > F
traitement 3 0.39779720 0.13259907 3.45 0.0234
Dependent Variable: Trfem
Sum of
Source DF Squares Mean Square F Value Pr > F
Model 3 0.42318977 0.14106326 1.67 0.1851
Error 50 4.22056828 0.08441137
Corrected Total 53 4.64375805
R-Square Coeff Var Root MSE Trfem Mean
0.091131 13.80383 0.290536 2.104752
Source DF Anova SS Mean Square Value Pr > F
traitement 3 0.42318977 0.14106326 1.67 0.1851
The ANOVA Procedure Student-Newman-Keuls Test for Treclos
NOTE: This test controls the Type I experimentwise error rate
under the complete null hypothesis but not under partial null
hypotheses.
Alpha 0.05
Error Degrees of Freedom 50
Error Mean Square 0.03 8466
Harmonic Mean of Cell Sizes
13.44
NOTE: Cell sizes are not equal.
Number of Means 2 3 4
Critical Range 0.1519658 0.182745 0.2010664
Means with the same letter are not significantly different.
|
SNK Grouping
|
Mean
|
N traitement
|
|
A
|
3.14159
|
12
|
Larve
|
|
B
|
2.98436
|
14
|
Typha
|
|
B
|
|
|
|
|
B
|
2.93008
|
14
|
LarveNie
|
|
B
|
|
|
|
|
B
|
2.91854
|
14
|
Niebe
|
Student-Newman-Keuls Test for Trfem
NOTE: This test controls the Type I experimentwise error rate
under the complete
null
hypothesis but not under partial null
hypotheses.
Alpha 0.05
Error Degrees of Freedom 50
Error Mean Square 0.084411
Harmonic Mean of Cell Sizes
13.44
NOTE: Cell sizes are not equal. Number of Means 2 3 4
Critical Range 0.2251177 0.270713 0.2978539
Means with the same letter are not significantly different.
|
SNK Grouping
|
Mean
|
N traitement
|
|
A
|
2.2104
|
12
|
Larve
|
|
A
|
|
|
|
|
A
|
2.1827
|
14
|
LarveNie
|
|
A
|
|
|
|
|
A
|
2.0341
|
14
|
Niebe
|
|
A
|
|
|
|
|
A
|
2.0068
|
14
|
Typha
|
traitement=Larve
The MEANS Procedure
Variable N Mean Std Error
ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
|
nboeuffemj
|
14
|
0.4200000
|
0.079642 1
|
|
Peclos
|
12
|
1.0000000
|
0
|
|
Pfem
|
12
|
0.7783333
|
0.0323061
|
|
Treclos
|
12
|
3.1415927
|
0
|
|
Trfem
|
12
|
2.2104066
|
0.1031543
|
ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
Variable N Mean Std Error
ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
|
nboeuffemj
|
14
|
1.8892857
|
0.2106856
|
|
Peclos
|
14
|
0.9714286
|
0.0156141
|
|
Pfem
|
14
|
0.7557143
|
0.0358218
|
|
Treclos
|
14
|
2.9300755
|
0.0762137
|
|
Trfem
|
14
|
2.1827408
|
0.1192942
|
ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
traitement=Niebe
Variable N Mean Std Error
ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
|
nboeuffemj
|
14
|
1.5057143
|
0.1813282
|
|
Peclos
|
14
|
0.9764286
|
0.0076033
|
|
Pfem
|
14
|
0.7221429
|
0.0133498
|
|
Treclos
|
14
|
2.9185370
|
0.0597028
|
|
Trfem
|
14
|
2.0341334
|
0.0300693
|
ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
traitement=Typha
Variable N Mean Std Error
ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
|
nboeuffemj
|
14
|
1.7671429
|
0.1554908
|
|
Peclos
|
14
|
0.9900000
|
0.0025678
|
|
Pfem
|
14
|
0.7107143
|
0.0083511
|
|
Treclos
|
14
|
2.9843625
|
0.0345623
|
|
Trfem
|
14
|
2.0068214
|
0.0183621
|
ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
Annexe 7 : procédure d'ANOVA pour la
détermination des effets des aliments sur les durées des
stades
The ANOVA Procedure Dependent Variable: egg
Sum of
Source DF Squares Mean Square F Value Pr > F
Model 3 0.86320495 0.28773498 3.16 0.0276
Error 106 9.64043505 0.09094750
Corrected Total 109 10.503 64000
R-Square Coeff Var Root MSE egg Mean
0.082182 18.77802 0.301575 1.606000
Source DF Anova SS Mean Square F Value Pr > F
traitement 3 0.86320495 0.28773498 3.16 0.0276
The ANOVA Procedure
Dependent Variable: larv
Sum of
Source DF Squares Mean Square F Value Pr > F
Model 3 3.28086789 1.09362263 4.99 0.0028
Error 106 23.23738757 0.21922064
Corrected Total 109 26.5 1825545
R-Square Coeff Var Root MSE larv Mean
0.123721 37.25899 0.468210 1.256636
Source DF Anova SS Mean Square F Value Pr > F
traitement 3 3.28086789 1.09362263 4.99 0.0028
The ANOVA Procedure Student-Newman-Keuls Test for egg
NOTE: This test controls the Type I experimentwise error rate
under the complete null hypothesis but not under partial null
hypotheses.
Alpha 0.05
Error Degrees of Freedom 106
Error Mean Square 0.090948
Harmonic Mean of Cell Sizes 27.4909 1
NOTE: Cell sizes are not equal.
Number of Means 2 3 4
Critical Range 0.1612688 0.1933591 0.2123243
Means with the same letter are not significantly different.
SNK Grouping Mean N traitement
A 1.75926 27 Larve
B 1.57963 27 LarveNie
B 1.54821 28 Niebe
B 1.54143 28 Typha
The ANOVA Procedure Student-Newman-Keuls Test for larv
NOTE: This test controls the Type I experimentwise error rate
under the complete null hypothesis but not under partial null
hypotheses.
Alpha 0.05
Error Degrees of Freedom 106
Error Mean Square 0.219221
Harmonic Mean of Cell Sizes 27.4909
1
NOTE: Cell sizes are not equal.
Number of Means 2 3 4
Critical Range 0.2503777 0.3001995 0.329644
Means with the same letter are not significantly different.
SNK Grouping Mean N traitement
A 1.4882 28 Typha
B A 1.3225 28 Niebe
B C 1.1856 27 LarveNie
C 1.0193 27 Larve
Source DF Squares Mean Square F Value Pr > F
Model 2 160.258695 80.129348 1.01 0.3674
Error 80 6322.403114 79.030039
Corrected Total 82 6482.661810
R-Square Coeff Var Root MSE pnymp Mean
0.024721 292.2219 8.889884 3.042169
Source DF Anova SS Mean Square F Value Pr > F
traitement 2 160.2586954 80.1293477 1.01 0.3674
Source DF Squares Mean Square F Value Pr > F
Model 2 0.02304666 0.01152333 0.06 0.9435
Error 80 15.83402804 0.19792535
Corrected Total 82 15.85707470
R-Square Coeff Var Root MSE dnymp Mean
0.001453 22.99234 0.444888 1.934940
Source DF Anova SS Mean Square F Value Pr > F
traitement 2 0.02304666 0.01152333 0.06 0.9435
The ANOVA Procedure
Dependent Variable: eggadult
Sum of
Source DF Squares Mean Square F Value Pr > F
Model 2 128.954624 64.477312 0.91 0.4070
Error 80 5673.079431 70.913493
Corrected Total 82 5802.034055
R-Square Coeff Var Root MSE eggadult Mean
0.022226 108.5654 8.421015 7.756627
Source DF Anova SS Mean Square F Value Pr > F
traitement 2 128.9546245 64.4773 122 0.91 0.4070
NOTE: This test controls the Type I experimentwise error rate
under the complete null hypothesis but not under partial null
hypotheses.
Alpha 0.05
Error Degrees of Freedom 80
Error Mean Square 79.03004
Harmonic Mean of Cell Sizes
27.65854
NOTE: Cell sizes are not equal.
Number of Means 2 3
Critical Range 4.7573319 5.7088972
Means with the same letter are not significantly different.
SNK Grouping Mean N traitement
A 4.989 28 Niebe
A
A 2.107 28 Typha
A
A 1.993 27 LarveNie
NOTE: This test controls the Type I experimentwise error rate
under the complete null hypothesis but not under partial null
hypotheses.
Alpha 0.05
Error Degrees of Freedom 80
Error Mean Square 0.197925
Harmonic Mean of Cell Sizes 27.65854
NOTE: Cell sizes are not equal.
Number of Means 2 3
Critical Range 0.2380773 0.2856978
Means with the same letter are not significantly different.
SNK Grouping Mean N traitement
A 1.9579 28 Niebe
A
A 1.9271 28 Typha
A
A 1.9193 27 LarveNie
The ANOVA Procedure Student-Newman-Keuls Test for eggadult
NOTE: This test controls the Type I experimentwise error rate
under the complete null hypothesis but not under partial null
hypotheses.
Alpha 0.05
Error Degrees of Freedom 80
Error Mean Square 70.9 1349
Harmonic Mean of Cell Sizes
27.65854
NOTE: Cell sizes are not equal.
Number of Means 2 3
Critical Range 4.5064213 5.4077993
Means with the same letter are not significantly different.
SNK Grouping Mean N traitement
A 9.490 28 Niebe
A
A 7.064 28 Typha
A
A 6.678 27 LarveNie
.traitement=Larve
The MEANS Procedure
Variable N Mean Std Error
ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
|
egg
|
27
|
1.7592593
|
0.0542126
|
|
larv
|
27
|
1.0192593
|
0.0802630
|
|
pnymp
|
0
|
.
|
.
|
|
dnymp
|
0
|
.
|
.
|
|
eggadult
|
0
|
.
|
.
|
ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
traitement=LarveNie
Variable N Mean Std Error
ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
|
egg
|
27
|
1.5796296
|
0.0496755
|
|
larv
|
27
|
1.1855556
|
0.0846433
|
|
pnymp
|
27
|
1.9933333
|
0.0855134
|
|
dnymp
|
27
|
1.9192593
|
0.0986113
|
|
eggadult
|
27
|
6.6777778
|
0.1579068
|
ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
traitement=Niebe
Variable N Mean Std Error
ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
|
egg
|
28
|
1.5482143
|
0.0604044
|
|
larv
|
28
|
1.3225000
|
0.0887503
|
|
pnymp
|
28
|
4.9885714
|
2.8901747
|
|
dnymp
|
28
|
1.9578571
|
0.0754709
|
|
eggadult
|
28
|
9.4896429
|
2.7319309
|
ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
traitement=Typha
Variable N Mean Std Error
ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
|
egg
|
28
|
1.5414286
|
0.0638962
|
|
larv
|
28
|
1.4882143
|
0.1011234
|
|
pnymp
|
28
|
2.1071429
|
0.0553819
|
|
dnymp
|
28
|
1.9271429
|
0.0788607
|
|
eggadult
|
28
|
7.0639286
|
0.1321859
|
ÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉÉ
Egg= oeuf
Larve= larve
Pnymp= protonymphe
Dnymp= deutonymphe
Eggadult= durée oeuf à adulte
Larvnie= combinaison de larves et de pollens de
niébé
| 


