|

Université Quisqueya
Faculté des Sciences, de Génie et
d'Architecture
Projet de Fin d'Etudes
Évaluation des risques sanitaires des ookystes
de
Cryptosporidium dans l'eau destinée
à la consommation
humaine distribuée dans la zone
métropolitaine de
Port-au-Prince, Haïti.
Préparé par :
Anie BRAS
Dirigé par :
M. le professeur Evens EMMANUEL
Pour l'Obtention du Diplôme d'Ingénieur
Civil
Ce mémoire est préparé
au :
Laboratoire de Qualité de l'Eau et de
l'Environnement (LAQUE)
N° d'ordre : 05UNIQFSGA013
ANNEE-2005
Évaluation des risques sanitaires des ookystes de
Cryptosporidium dans l'eau destinée à la consommation
humaine distribuée dans la zone métropolitaine de
Port-au-Prince, Haïti.
Mémoire de fin d'études
présenté à
La Faculté des Sciences, de Génie et
d'Architecture de l'Université Quisqueya
Pour l'obtention du diplôme d'Ingénieur Civil
par
Anie BRAS
Soutenu le 30 Juin 2005 devant la commission d'examen
Président M. Christian RACCURT Professeur des
universités, praticien hospitalier,
Faculté de Médecine d'Amiens (France).
Examinateurs
M. Jacques BLAISE Professeur de la Faculté d'Agronomie
et de
Médecine Vétérinaire,
l'Université d'Etat
d'Haïti.
M. Frantz METELLUS Consultant à l'Organisation
Panaméricaine de la Santé/Organisation Mondiale de la
Santé
Mme Ruth ANGERVILLE Ingénieur de la direction de la
planification de la Centrale Autonome Métropolitaine d'Eau
Potable (CAMEP).
Responsable M. Evens EMMANUEL Professeur de
l'Université Quisqueya
Qui est sage en force est un homme robuste, et un
homme qui a de la connaissance raffermit
la vigueur.
Proverbes de SALOMON
24 : 5
À mes parents,
Marie Sylvie et Jean Lecaire,
Pour leur amour et leur soutien
incomparables.
Avant-propos
Cette étude, sur l'évaluation des risques
sanitaires des ookystes de Cryptosporidium dans l'eau destinée à
la consommation humaine dans la zone métropolitaine de
Port-au-Prince, s'inscrit dans le cadre d'un suivi des travaux
réalisés par BRASSEUR et al entre 2000 et 2002. Étude au
cours de laquelle des analyses ont été effectuées sur des
échantillons d'eau de surface et de distribution, révélant
la présence des ookystes de Cryptosporidium.
Ce travail de mémoire a été
réalisé au Laboratoire de Qualité de l'Eau et de
l'Environnement de l'Université Quisqueya.
Je tiens à remercier d'une façon toute
particulière, le Professeur Evens EMMANUEL, Directeur de ce
mémoire pour le soutien qu'il a apporté à ce travail.
Qu'il soit aussi remercié pour sa patience et sa disponibilité,
et surtout pour ses connaissances qu'il a bien voulu me prodiguer tout au long
de la phase de rédaction de ce mémoire.
Je tiens à exprimer ma profonde gratitude au
Professeur Christian RACCURT, qui a relu et soutenu ce travail avec beaucoup
d'intérêt.
Je remercie tout spécialement les Professeurs
Jacques BLAISE et Frantz METELLUS pour leur encadrement, leur aide dans
l'orientation du travail et leurs conseils qui ont contribué à
apporter des corrections profitables.
Mes remerciements vont également à l'endroit
de l'Ingénieur Ruth ANGERVILLE pour ses précieux
conseils.
Enfin, j'adresse un grand MERCI à tous mes amis et
collaborateurs pour leur aide précieuse, particulièrement :
Michel, Urbain, Antoine, Anaël, Edwine, Tundji, Carine, Martine, Medjine,
Vanessa, Ketty, Barbara, Stanley, Adias, Albert, Osnick.
Sommaire
I. INTRODUCTION
13
I.1. Objectif de l'étude
14
I.2. Structuration de l'étude
15
II. ETUDE BIBLIOGRAPHIQUE
16
II.2. Qualité microbiologique de l'eau de
boisson
16
II.3. Identification du danger
18
II.3.1. Description du pathogène :
Cryptosporidium parvum
18
II.3.2. Méthodes de détection
20
II.3.3. Méthode de mesure de la
viabilité des ookystes de Cryptosporidium parvum
21
II.3.4. Méthode de mesure de
l'infectiosité des ookystes de Cryptosporidium parvum
21
II.4. Appréciation de l'émission du
danger
22
II.4.1. Implication des animaux dans
l'émission de Cryptosporidium parvum
22
II.4.2. Implication de l'homme dans
l'émission de Cryptosporidium parvum
23
II.4.3. Durée et quantité d'ookystes
excrétés par l'Homme :
23
II.4.4. Devenir des ookystes
excrétés par l'Homme
24
II.4.5. Survie des ookystes dans
l'environnement
25
II.4.6. Survie des ookystes dans les
matières fécales
25
.4.7. Survie des ookystes dans l'eau
26
II.5. Diffusion du danger
26
II.5.1. Diffusion passive à partir des
sources de contamination fécale animale
27
II.5.2. Diffusion passive à partir des
sources de contamination fécale humaine
27
II.6. Appréciation des effets chez
l'homme
27
II.6.1. Facteurs de risques
28
II.7. Présentation de la zone
métropolitaine de Port-au-Prince
30
II.8. Facteurs influençant la diffusion du
danger dans la zone métropolitaine de Port-au-Prince
30
II.8.1. Conditions d'insalubrité
30
II.8.2. Nature et mouvement des réservoirs
d'animaux
31
II.8.3. Etat du réseau hydraulique de la
CAMEP
31
II.8.4. Inefficacité du mode de traitement
des eaux
32
II.8.5. Mobilité de la population à
travers la zone métropolitaine de Port-au-Prince face à la
problématique de l'eau
34
III. CADRE EXPERIMENTAL
34
III.I. SCHÉMA GLOBAL
35
III.2. MODULE «D'EMISSION »
36
III.3. MODULE « D'EXPOSITION »
39
III.4. MODULE DE « CONSOMMATION »
39
III.5. MODULE « D'EFFET »
40
IV. RÉSULTATS ET DISCUSSION
45
IV.1. POPULATION DE 5 ANS ET PLUS
45
IV.2. POPULATION DE MOINS DE 5ANS
49
V. CONCLUSION ET PERSPECTIVES
52
RÉFERENCES BIBLIOGRAPHIQUES
55
Liste des tableaux
Tableau 1 : Qualité microbiologique de l'eau
de boisson (OMS, 2000)
17
Tableau 2 : Efficacité des traitements
chimiques des eaux au regard des cryptosporidies (BAUDIN et al.,
2001)
33
Tableau 3 : Distribution de la concentration des
ookystes dans l'eau pour les différentes zones
38
Tableau 4 : Données d'une infection
expérimentale de volontaires sains par ingestion d'ookystes de
Cryptosporidium parvum (DUPONT et al, 1995)
42
Tableau 5 : Données d'infection de souris
immunodéprimées par ingestion d'ookystes (YANG et al.,
2000)
43
Tableau 6 : Risque d'infection pour la population 5
ans et plus immunocompétente
45
Tableau 7 : Risque d'infection et de maladies pour
la population âgée de 5ans et plus
immunodéprimée
46
Tableau 8 : Risque d'infection pour la population
immunocompétente âgée de moins de 5 ans
49
Tableau 9 : Risque d'infection et de maladies pour
la population immunodéprimée âgée de moins de 5
ans
50
Liste des figures
Figure 1 : Illustration du cycle de
développement des Cryptosridies
19
Figure 2: Illustration de la production et de la
distribution publique de l'eau d'alimentation
32
Figure 3 : Illustration de l'évaluation des
risques sanitaires propose dans le cadre de cette étude
36
Figure 4 : Variation des moyennes du risque
d'infection pour la population immunocompétente âgée de 5
ans et plus
46
Figure 5 : Variation des moyennes du risque
d'infection et de maladie pour la population immunodéprimée
âgée de 5 ans et plus
48
Figure 6 : Variation des moyennes du risque
d'infection et de maladies de la population immunodéprimée
âgée de moins de 5 ans
51
Glossaire
Coccidies : Parasites
protozoaires intracellulaires dont le stade infectieux donne
l'ookyste très résistant, excrété dans les
fèces de l'hôte définitif (UGGLA, 1996).
Cryptosporidiose : Il s'agit d'une
entérite diarrhéique d'origine parasitaire pouvant être
grave chez l'homme et entraîner la mort; elle est
déterminée par le parasitisme d'une coccidie, du genre
Cryptosporidium (EUZEBY, 1984)
Cryptosporidium spp.:
Correspond à toutes les espèces du genre Cryptosporidium
(AFSSA,2002)
Cryptosporidium sp.: Correspond
à une espèce particulière du genre mais non
déterminée (AFSSA,2002).
Cryptosporidium parvum : Correspond
à une dénomination de l'espèce déterminée,
équivaut à cryptosporidie (AFSSA, 2002).
Danger : événement de
santé indésirable tel qu'une maladie, un traumatisme, un
handicap, un décès. Par extension, le danger désigne tout
effet toxique, c'est-à-dire un dysfonctionnement cellulaire ou
organique, lié à l'interaction entre un organisme vivant et un
agent chimique, physique ou biologique (IVS, 2000).
Estimation du risque : Il
s'agit de l'estimation qualitative et/ou quantitative de la probabilité
de survenue et de la gravité des effets néfastes sur la
santé [= risque], connus ou potentiels, d'une population donnée.
Elle est basée sur l'identification des dangers, l'appréciation
des effets et l'appréciation de l'exposition (AFSSA, 2002).
Exposition : désigne, dans le domaine
sanitaire, le contact entre une situation ou un agent dangereux et un organisme
vivant. L'exposition peut aussi être considérée comme la
concentration d'un agent dangereux dans le ou les milieux pollués mis en
contact avec l'homme (IVS, 2000).
Evaluation du risque : L'évaluation
des risques se définit comme étant l'activité qui consiste
à déterminer les propriétés toxiques d'un produit
chimique et les conditions de l'exposition humaine à ce produit, en vue
de constater la réalité d'une exposition humaine et de
caractériser la nature des effets qui peuvent en résulter.
Lorsque les risques visés par l'évaluation prennent en compte la
santé humaine, on parle de risques sanitaires ou
toxicologiques. National Research Council, (NRC, 1983).
Infection : Correspond à
l'excrétion détectée d'ookystes par un individu (AFSSA,
2002)
Maladie : également appelée
cas, correspond à des manifestations cliniques de cryptosporidiose,
consécutives à l'ingestion d'ookystes (AFSSA, 2002).
Ookystes : forme de résistance ou
stade transmissible de Cryptosporidium spp (OMS,
2000) .
Risque : probabilité de survenue d'un
danger (IVS, 2000).
Résumé
La cryptosporidiose est une cause de diarrhée
fréquente en Haïti. La transmission à l'homme se fait par
l'intermédiaire de l'eau et des aliments contenant les ookystes du
parasite Cryptosporidium. Dans la population les groupes
spécifiques ayant un niveau de risque très élevé
sont les enfants, les personnes sous-alimentées et les malades
contaminés par le virus de l'immuno-déficience humaine (VIH). Les
récentes études ont démontré la présence
d'une quantité d'ookystes allant de 4 à 1274 pour 100 litres
d'eau analysés. L'exposition de la population à une telle
concentration peut générer des risques sanitaires
extrêmement élevés. L'objectif de ce travail a
été d'évaluer les risques sanitaires liés à
la présence de ce parasite dans l'eau de distribution sur la population
de la zone métropolitaine de Port-au-Prince. Pour la réalisation
de cette étude, un modèle exponentiel a été
utilisé dans le calcul de la probabilité de développer une
infection pour quatre types de populations : Populations
immunocompétente et immunodéprimée âgées de
moins de 5 ans ; immunocompétente et immunodéprimée
âgées de 5 ans et plus. Un niveau de risque d'infection allant de
1 à 5% a été retrouvé pour la population
immunocompétente, et un niveau de risque d'infection et de maladies
allant de 1% à 97% a été retrouvé pour la
population immunodéprimée. Dans ce contexte, il est important de
mettre en place une stratégie de surveillance de la qualité
microbiologique de l'eau dans la perspective de réduire les infections
liées à la consommation d'eau contaminée.
Mots clés : Cryptosporidium,
Ookystes, Cryptosporidiose, risque sanitaire.
.
Abstract
The cryptosporidiosis is one of the frequent causes of
diarrhea in Haïti. The transmission to children under five, HIV infected
persons, and people living in low level conditions, is made possible by mean of
water and food containing oocysts of Cryptosporidium. Recent studies
demonstrated that the amount of oocysts in 100 liters of drinking water used by
the population in Port-au-Prince (Haiti) rised from 4 to 1274 oocysts in the
studied water samples. Consequently the population is exposed to high sanitary
risks. The aim of this study was to evaluate the risks pointing out the
presence of the parasite in the drinking water of the metropolitan area,
Port-au-Prince. An exponential model has been used to mark on the probability
of an increasing infection. Four prototypes have been listed: immunocompetent
and immunodeficient persons under five year old; immunocompetent and
immunodeficient persons five years old and up.
It happened that a risk of 1 to 5% of infection is detected
for the immunocompetent cluster of the population and a variation between 1 to
97% for the immunodeficient cluster of the population. In this context it is
necessary to promote an appropriate strategy to improve the microbiologic
quality of drinking water in order to reduce in Haiti the risk of human
infections with pathogen microorganisms related to biological environmental
pollution.
Key words :
Cryptosporidium, Cryptosporidiosis, sanitary risk, drinking water.
I. Introduction
L'eau de boisson a, depuis toujours, été
un vecteur potentiel dans la transmission de maladies (ANDERSON et STRENSTROM,
1986; GALBRAITH et al., 1987; BENTON et al., 1989).
L'Organisation Mondiale de la Santé estime en effet que 80% des
maladies qui affectent la population mondiale lui sont directement
associées (DESJARDINS, 1990). Dans les pays en développement les
maladies hydriques sont responsables de 5 millions de morts chaque année
(OMS, 1995). Ainsi, au cours de ces dernières décennies, la
surveillance de la qualité de l'eau est devenue un facteur primordial
auquel une attention toute particulière est accordée.
Pour évaluer le danger microbiologique relatif
à l'eau de boisson, les indicateurs bactériens de contamination
fécale ont été largement utilisés. Pourtant, il
semble qu'un certain nombre d'épisodes épidémiques
liés à la consommation d'eau aujourd'hui, proviennent de germes
d'une autre nature pour lesquels le suivi des indicateurs traditionnels n'est
pas totalement satisfaisant (BONNARD, 2001). C'est le cas de
Cryptosporidium parvum, protozoaire parasite responsable d'une
infection appelée la cryptosporidiose. Les ookystes de ce dernier font
partie des pathogènes les plus résistants aux types de traitement
classique telle que la désinfection chimique; ils présentent un
haut niveau d'infectiosité et ils peuvent survivre pendant plusieurs
mois à une température de 30°C (FAYER et al.,
1998).
En effet depuis 1980, une vingtaine
d'épidémies liées aux Cryptosporidium ont
été rapportées dans le monde (RACCURT, 2002). La plus
importante est celle survenue à Milwaukee, aux Etats-Unis en 1993, qui a
contaminé 403.000 personnes dont 4.400 ont été
hospitalisées et 69 sont décédées (MAC KENZI et
al., 1994). La cause de cette tragédie était une
modification du procédé de traitement de l'eau de boisson
distribuée dans la ville.
Dans cette vaste population, les groupes
spécifiques les plus vulnérables, ayant un niveau de risque
beaucoup plus élevé sont les enfants, les personnes sous
alimentées, les personnes immunodéficientes en particulier les
malades contaminés par le virus de l'immunodéficience humaine
(VIH). Au cours de différentes enquêtes menées à
travers le monde, il a été constaté que la
prévalence de la cryptosporidiose dans les pays en développement
est de 4 à 20 % et que chez les malades atteints du SIDA elle est de
plus de 50 % dans des pays d'Afrique et en Haïti (OMS, 2000).
En Haïti, la cryptosporidiose est responsable de
17% des diarrhées aiguës, observées chez les enfants de
moins de 2 ans et de 30% des diarrhées chroniques chez les patients
contaminés par le VIH (PAPE et al., 1987). A
Port-au-Prince, la capitale haïtienne, une étude menée par
RACCURT en collaboration avec les Centres GHESKIO entre 2000 et 2001, portant
sur 1529 examens coprologiques parasitaires, indiquait que la prévalence
de Cryptosporidium sp. était de 10,3%. Chez les 57 adultes
infectés par Cryptosporidium sp., 56 (soit 98%) étaient
VIH positifs et 1 (soit 2%) était VIH négatif.
Les récentes études sur la circulation
des ookystes de Cryptosporidium sp. dans l'eau de boisson,
distribuée par adduction publique à Port-au-Prince (BRASSEUR et
al., 2002), indiquent le caractère imminent du danger. Dans ce
contexte, il est important de procéder à l'évaluation des
risques sanitaires.
I.1. Objectif de
l'étude
Evaluer les risques sanitaires liés à
la présence des ookystes de cryptosporidium dans l'eau destinée
à la consommation humaine distribuée dans la zone
métropolitaine de Port-au-Prince.
I.2. Structuration de
l'étude
L'étude s'articule autour des points suivants:
une étude bibliographique comprenant :
1) une synthèse sur la qualité microbiologique
de l'eau de boisson a) L'identification du danger : description de
Cryptosporidium parvum b) l'appréciation de l'émission
du danger, c) l'appréciation des effets chez l'Homme ;
2) une présentation du site d'étude : Zone
Métropolitaine de Port-au-Prince et les différents facteurs
influencant la diffusion du danger dans la Zone Métropolitaine de
Port-au-Prince.
le cadre expérimental comprenant : une estimation
quantitative du risque relatif à la consommation d'eau de distribution
publique dans la Zone Métropolitaine de Port-au-Prince ;
les résultats et discussion ;
la conclusion.
II. ETUDE
BIBLIOGRAPHIQUE
II.1. Eau potable :
définition
Une eau potable se
définit comme étant une eau exempte de germes de maladies
à transport hydrique, de substances toxiques, ne contenant pas de
quantités excessives de matières minérales et organiques.
Elle doit par ailleurs, être limpide incolore et ne présenter
aucun goût ou odeur désagréables. Les qualités
requises sont donc d'ordre physique, chimique et bactériologique (LANOIX
et ROY, 1976).
II.2. Qualité
microbiologique de l'eau de boisson
L'utilisation des organismes normalement
présents dans l'intestin comme indicateurs de pollution fécale
à la place des organismes pathogènes eux-mêmes est
universellement acceptée pour le contrôle et l'évaluation
de la qualité microbiologique de l'eau. L'analyse bactériologique
permet de mettre en évidence la pollution fécale de l'eau. Elle
représente également un bon moyen pour contrôler
l'efficacité des mesures de protection ou de traitement (OMS, 2000).
Pour ces différentes raisons, il est
préférable de rechercher des germes qui sont toujours
présents en grand nombre dans les matières fécales des
hommes et des animaux à sang chaud, qui se maintiennent plus facilement
dans le milieu extérieur et qui sont clairement identifiés (cf.
tableau ci-dessous).
Tableau 1 : Qualité
microbiologique de l'eau de boisson (OMS, 2000)
|
Valeurs guides OMS
|
Interprétation
|
|
Coliformes thermotolérants
|
0/100 ml
|
Indicateurs de pollution fécale
|
|
Streptocoques fécaux
|
Pas de normes
|
Indicateurs de pollution fécale
|
|
Coliformes totaux
|
0/100 ml dans 95 % des échantillons d'eaux
traitées
|
Indicateurs d'efficacité du traitement
(désinfection) ; ne signalent pas nécessairement une
pollution fécale
|
Ces germes sont dénommés germes indicateurs de
pollution fécale et leur présence témoigne de l'existence
d'une contamination fécale au moment du prélèvement. Leur
mise en évidence dans l'eau n'est pas la preuve de la présence de
pathogènes, mais elle permet de la suspecter fortement. Les coliformes
totaux ne sont pas tous d'origine fécale. Ils ne sont donc pas
indicateurs d'une pollution fécale. Leur recherche est cependant utile
pour contrôler la qualité d'une eau après traitement (OMS,
2000).
Les streptocoques fécaux sont en grande
partie d'origine humaine. Cependant, certaines bactéries classées
dans ce groupe peuvent être trouvées également dans les
fèces animales, ou se rencontrent sur les végétaux. Ils
sont néanmoins considérés comme indicateurs d'une
pollution fécale, et leur principal intérêt réside
dans le fait qu'ils sont résistants à la dessiccation (OMS,
2000). Ils apportent donc une information supplémentaire sur une
pollution. L'indicateur le plus utile pour estimer la pollution fécale
est la bactérie Escherichia coli.
Toutefois, aucun organisme ne présente
tous les caractères d'un indicateur idéal. Ainsi les
entérovirus et les kystes de certains parasites résistent mieux
à la désinfection que l'E. coli, que les
coliformes et leur absence dans l'eau de boisson qui a subi une simple
désinfection n'indique pas nécessairement l'absence de virus
entériques ou de formes quiescentes de Cryptosporidium, de
Giardia, d'amibes et d'autres parasites (OMS, 2000).
Dans les pays en développement comme
Haïti par exemple, la chloration reste le seul mode de traitement
appliqué à l'eau brute destinée à la consommation
humaine (EMMANUEL et LINDSKOG, 2002). L'apparition des pathogènes
résistants aux types de traitement classique explique le fait que dans
l'ensemble de ces pays, les maladies hydriques soient responsables de 5
millions de morts chaque année (DESJARDINS, 1990). Le contrôle de
la qualité de l'eau reste et demeure jusqu'à présent une
préoccupation cruciale à laquelle les pays en
développement doivent faire face.
Dans les pays développés par contre
le problème de la qualité microbiologique de l'eau était
censé régler jusqu'à ce qu'une nouvelle vague
épidémique liée à des parasites d'une autre nature
se soit déclarée. C'est ainsi qu'en 1993 à Milwaukee aux
Etats Unis à la suite d'une contamination de l'eau de boisson par
Cryptoporidium sp, sur un total de 840.000 consommateurs
exposés, 403.000 sont tombés malades, 4.400 ont été
hospitalisés et 69 sont décédés.
Cette épidémie a conduit à une
prise de conscience de l'importance des épidémies à
cryptosporidies, de l'inadaptation des moyens de surveillance et de la
nécessité de développer une recherche spécifique
sur ce parasite et les moyens de l'éliminer (MAC KENZIE et
al., 1994).
II.3. Identification du
danger
Environ 20 espèces de
Cryptosporidium ont été décrites chez plus de 117
espèces de mammifères dans le monde (DUMOULIN et al.,
2000). La principale d'entre elle est Cryptosporidium parvum avec,
à ce jour, 10 génotypes identifiés chez de nombreux
mammifères domestiques et sauvages (PERZ et Le BLANCQ, 2001) dont au
moins 4 sont infectants pour l'Homme (génotypes I et II principalement,
et génotypes du porc et du chien).
II.3.1. Description du
pathogène : Cryptosporidium parvum
Il s'agit d'un parasite unicellulaire
(protozoaire) appartenant à l'ordre des coccidies, phylum
Apicomplexa. Cet organisme a été observé pour la
première fois en 1907 au niveau de la muqueuse gastrique de souris
(TYZZER, 1907). Ces coccidies, cosmopolites, appartiennent à la famille
des Cryptosporiidés. Cryptosporidium occasionnent chez l'homme
des entérites diarrhéiques subfébriles. Les malades
rejettent dans leurs selles des ookystes sporulés (EUZEBY, 1984). Le
cycle de multiplication comprend des stades asexués et sexués et
se déroule dans la cellule parasitée en localisation
extra-cytoplasmique. De plus, ce cycle est caractérisé par des
phénomènes d'auto-infection et par des rétro-infections
(reproduction sexuée avec production d'ookystes se recyclant directement
dans l'intestin sans passer par le milieu extérieur) induisant une
prolificité importante du parasite (AFSSA, 2002). Les
différents stades intracellulaires présentés dans la
figure 1 se développent dans la bordure en brosse des cellules
épithéliales intestinales, dans des vacuoles parasitophores. Le
parasite peut parfois se développer aux dépens des
épithéliums des voies biliaires ou respiratoires.
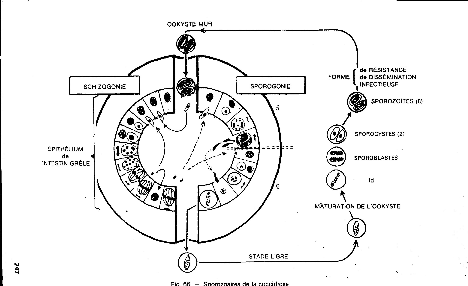
Figure 1 : Illustration du
cycle de développement des Cryptosporidies
La multiplication sexuée conduit
à la formation d'ookystes matures de petites dimensions mesurant de 4,8
à 5 micromètres, sporulés dès leur émission
et renfermant 4 sporozoïtes nus, non renfermés dans des
sporocystes. Le rejet d'ookystes sporulés, immédiatement
infectants, permet l'infection directe de l'homme au contact d'animaux
parasités (EUZEBY, 1984).
II.3.2. Méthodes de
détection
Chez l'hôte
infecté, les ookystes de Cryptosporidium sp. peuvent être
identifiés par l'examen microscopique dans des frottis fécaux,
liquide biliaire ou duodénal après coloration par le Ziehl
Nielsen modifié (ZNM), par la carbofuschine (méthode de Heim) ou
par un marquage avec un anticorps monoclonal fluorescent (AFSSA, 2002)
Appliquées à l'eau, les techniques
microscopiques sont peu performantes et une concentration préalable des
oocystes est nécessaire (AFSSA, 2002)
Pour les eaux, la méthode comporte quatre étapes
:
- Concentration sur site par filtration sur une cartouche
placée dans un dispositif de prélèvement qui enregistre la
quantité d'eau filtrée (plusieurs dizaines à plusieurs
centaines de litres d'eau) ;
- Au stade de l'analyse au laboratoire, il est
procédé à une élution du matériel retenu par
la cartouche puis à une centrifugation de l'éluat. La recherche
d'ookystes est effectuée sur le culot ;
- Pour concentrer les ookystes dans le culot, la technique par
flottation sur couche de saccharose est d'un faible rendement. Elle est
maintenant remplacée par une immunocapture sur des billes
magnétiques recouvertes d'un anticorps monoclonal
anti-Cryptosporidium sp. ;
- la révélation de la capture des ookystes
s'effectue par immunofluorescence directe utilisant un anticorps monoclonal
anti-Cryptosporidium sp. marqué à la
fluorescéine. La lecture s'effectue avec un microscope à
fluorescence.
Le couplage de l'immunocapture sur bille et la
révélation par immunofluorescence est à la base de la
technique normalisée par l'AFNOR (norme NF T 90-455, juillet 2001) pour
la recherche de Cryptosporidium sp. dans l'eau.
II.3.3. Méthodes de
mesure de la viabilité des ookystes de Cryptosporidium parvum
La mise en évidence d'ookystes de
Cryptosporidium sp. dans l'eau ne permet pas de préjuger de
leur viabilité ni de leur infectiosité. Certains de ces ookystes
peuvent être non viables, c'est-à-dire incapables de
libérer les 4 sporozoïtes qu'ils contiennent ou bien les
sporozoïtes libérés peuvent aussi être incapables de
pénétrer dans les entérocytes intestinaux et avoir perdu
leur caractère infectant.
On peut évaluer leur viabilité
à partir des méthodes permettant la mise en évidence du
dékystement des ookystes. La plus classique consiste à traiter
les ookystes séparés par un double gradient de saccharose pendant
1 h à 37° C et placés ensuite dans un bain d'eau à 4° C.
Le pourcentage d'ookystes dékystés est déterminé
par la différence du nombre d'ookystes intacts comptés avant et
après dékystement, divisé par le nombre d'ookystes
comptés avant dékystement, multiplié par 100 (BRASSEUR et
al., 2002). Ce contrôle est possible après marquage par
un anticorps monoclonal fluorescent et examen au microscope à
épifluorescence.
II.3.4. Méthode de
mesure de l'infectiosité des ookystes de Cryptosporidium parvum
L'infectiosité des ookystes peut
être déterminée avec le modèle souriceau BALB/c-NMRI
nouveau-né (LI et BRASSEUR, 2000). Les souriceaux de 4 jours exempts
d'organisme pathogène spécifique, sont inoculés par voie
orale (sonde) par des doses comprises entre 100 et 1000 ookystes. Sept jours
plus tard, les souriceaux sont sacrifiés et leur tube digestif,
prélevé en totalité du pylore à l'anus, est
homogénéisé par broyage au Potter dans 3 ml d'eau
distillée stérile. Pour chaque échantillon, 3
étalements de la suspension sont colorés par la carbofuschine et
examinés en microscopie à contraste de phase. Un souriceau est
considéré comme positif lorsque au moins un ookyste est mis en
évidence dans l'une des 3 lames examinées. Pour chaque groupe,
l'infectiosité des ookystes est exprimée en pourcentage d'animaux
trouvés infectés : (nombre d'animaux infectés)/(nombre
d'animaux inoculés) x 100. Les pourcentages d'animaux excréteurs
7 jours après l'ingestion des ookystes montrent qu'à partir d'une
dose de 1000-1500 ookystes, 100% des animaux sont infectés. Pour des
doses inférieures, on observe que le nombre d'animaux infectés
est proportionnel à la dose ingérée.
II.4. Appréciation
de l'émission du danger
II.4.1. Implication des
animaux dans l'émission de Cryptosporidium parvum
Les Cryptosporidium sont des parasites
de mammifères et de divers oiseaux, affectant surtout les individus
très jeunes, infectés très tôt après la
naissance : veaux, agneaux, chevreaux, porcelets âgés de 1
à 3 semaines, surtout lorsqu'il n'ont pas absorbé le colostrum
maternel (EUZEBY, 1984). La présence de
Cryptosporidium parvum est décrite chez les mammifères
domestiques (cheval, porc, chien, chat) et des mammifères sauvages
cervidés : buffles (Synerus caffer), zèbre
(Equus zebra), gnou (Connochaetes gnou). Un rapport
d'étude réalisée sur la faune sauvage en Tanzanie faisant
appel à l'utilisation d'anticorps monoclonaux indique la présence
d'ookystes de Cryptosporidium sur 8/36 des échantillons de
matières fécales de buffles, 7/25 de zèbre et 7/26 de
gnous (MTAMBO, 1995). La prévalence de l'infection cryptosporidienne a
été déterminée dans 38 élevages de poulets
de chair (KICHOU et al., 1996). Divers facteurs modulent les
risques de contamination environnementale par les cryptosporidies. Il s'agit de
facteurs liés aux parasites, aux hôtes, aux modes d'élevage
et à l'environnement (AFSSA, 2002).
Parmi les éléments facilitant les
modalités d'infection et/ou modifiant l'excrétion, on retient en
particulier (AFSSA, 2002) :
-la prolificité importante des cryptosporidies, due
aux particularités du cycle infectieux, l'infectiosité
immédiate des ookystes rejetés dans les excréments
responsables d'une contagion facile par ingestion ;
-la grande résistance de ces ookystes dans
l'environnement.
II.4.2. Implication de l'homme
dans l'émission de Cryptosporidium parvum
Au contraire de la plupart des autres coccidies qui
parasitent l'Homme, les ookystes de Cryptosporidium sp. sont
sporulés et infectants dès leur élimination fécale.
Par conséquent, la transmission inter-humaine, soit par contact direct
(entourage, partenaires sexuels, enfants, personnel hospitalier), soit par
contact indirect via l'alimentation ou certains supports (couches
contaminées) est une caractéristique de la cryptosporidiose
humaine. L'auto-infestation est biologiquement possible (AFSSA, 2002).
a) Rôle de l'Homme
dans le cycle parasitaire
Le rôle de l'Homme dans la contamination de
l'environnement par des ookystes de Cryptosporidium sp. est capital
pour 3 raisons (GUYOT et al., 2001) :
la transmission inter-humaine est une des
caractéristiques du cycle parasitaire;
-Cryptosporidium parvum de génotype I (humain)
semble être une variété anthroponotique (on ne la
retrouverait que chez l'Homme bien qu'elle ait été
rapportée une fois chez un singe et une fois chez un dugong) ;
Cryptosporidium parvum de génotype I est
responsable de près de la moitié des épidémies
humaines rapportées jusqu'à maintenant dans le monde, y compris
dans des pays où la variété dominante est
Cryptosporidium parvum de génotype II (bovin).
II.4.3. Durée et
quantité d'ookystes excrétés par l'Homme :
a) S'agissant des
conditions naturelles d'excrétion
Dans 70% des cas, l'excrétion d'ookystes,
après arrêt de la diarrhée, est détectable dans les
selles pendant 1-15 jours et peut se prolonger pendant 18 à 90 jours
(JOKIPII et JOKIPII, 1986).
b) S'agissant des infections
expérimentales humaines
Les principales conclusions tirées des
expérimentations humaines fondées sur l'ingestion d'inoculums
parasitaires d'origine animale et humaine (travaux du groupe de Chappell), sont
les suivantes (AFSSA, 2002) :
- il existe un délai de l'ordre d'une semaine entre
l'ingestion et l'apparition des signes cliniques ;
- l'excrétion sporadique d'ookystes se poursuit pendant
une durée pouvant aller jusqu'à un mois après l'ingestion
;
- il n'existe pas de corrélation claire entre la taille
de l'inoculum, la gravité des symptômes et/ou les quantités
d'ookystes excrétés ;
- le nombre cumulé d'ookystes excrétés
peut dépasser 108
c) S'agissant des
porteurs asymptomatiques
Ils constituent un danger potentiel de
dissémination parasitaire mais représentent une faible proportion
de la population générale. Elle est de l'ordre de 0,4 à 3
% selon l'âge des individus. (HOLTEN-ANDERSEN et al.,
1984 ; ISAACS et al., 1985 ; JOKIPII et al., 1985 ; MATA
et al., 1984 ; TZIPORI et al., 1983).
II.4.4. Devenir des ookystes
excrétés par l'Homme
Tout comme pour les ookystes
excrétés par les animaux, les temps de survie des ookystes dans
l'environnement sont longs, de l'ordre de plusieurs mois. Cette
résistance favorise la dissémination des parasites, le contact
avec de nouveaux hôtes et la possibilité de produire de nouvelles
générations d'ookystes.
II.4.5. Survie des ookystes
dans l'environnement
Les ookystes de Cryptosporidium peuvent
rester viables et infectieux dans l'eau et dans les fèces animales
pendant plusieurs mois à des températures comprises entre 0 et
30°C, ils ne peuvent pas se multiplier dans l'environnement (FAYER et
al., 1998). En effet, les ookystes de Cryptosporidium sont
très résistants et conservent pendant longtemps leur pouvoir
infectieux à la surface du sol et des plantes, surtout en milieu humide
(EUZEBY, 1984).
II.4.6. Survie des ookystes
dans les matières fécales
Des essais de viabilité ont
été réalisés sur des pools de matières
fécales de veaux à 4°C (JENKINS et al., 1997)
montrant la persistance de 10 % d'ookystes viables à 410 jours
(diminution de 88 % de l'infectiosité initiale) et 14 % de
viabilité au bout de 259 jours (diminution de 77 % de
l'infectiosité initiale).
Dans la revue de WALKER et al. (1998), trois
paramètres physico-chimiques paraissent influer la survie des ookystes
de Cryptosporidium parvum dans les matières fécales
bovines :
- la température : les températures
élevées (60°C au coeur d'un tas de fumier), ainsi que les
alternances des phases gel-dégel tendent à minorer la survie des
ookystes ;
- le temps : l'étude à l'obscurité et
à température ambiante, pendant 176 jours, montre une
réduction de la viabilité de 47 % ;
- la concentration en ammoniaque : dans un modèle de
simulation, à la concentration de 2000 mg/l et pendant 5-6 jours, ce
composé peut entraîner une inactivation des ookystes de
près de 100%.
Dans la revue de ROSE et SLIFKO (1999), la survie des
ookystes est suivie dans les matières fécales, pendant 6 mois :
pour l'Homme, une inactivation de 41 à 99 % est observée à
4°C et pour les bovins, l'inactivation atteint 60 à 72 % entre 5 et
10°C.
.4.7. Survie des ookystes
dans l'eau
Les ookystes de Cryptosporidium peuvent
rester viables et infectieux dans l'eau pendant plusieurs mois à des
températures comprises entre 0 et 30°C et jusqu'à un an dans
de l'eau de mer (FAYER et al., 1998; ROBERTSON et al., 1992 ;
TAMBURRINI & POZIO, 1999)
La viabilité et
l'infectiosité des ookystes survivants ont été
étudiées dans l'eau de distribution maintenue pendant 8 semaines
à 2 températures différentes (4°C et 10°C). Les
comptages effectués par recueil des ookystes par immunoséparation
et marquage spécifique ont montré qu'après 4 semaines de
séjour à 10°C le pourcentage d'ookystes survivants
était de 67%, 48% après 6 semaines et 27% après 8
semaines. A 4°C on obtenait dans les mêmes temps des survies de 95%,
90% et 88% respectivement. Le dékystement des ookystes survivants
à 4°C décroissait rapidement en 2 semaines et se stabilisait
à 30% jusqu'à 8 semaines alors qu'il décroissait
régulièrement à 10°C. L'infectiosité des
ookystes survivants décroissait de 40% à 10°C, en 6 semaines
et seulement de 15% par conservation à 4°C et ceci quelle que soit
la quantité d'ookystes survivants (AFSSA, 2002).
II.5. Diffusion du
danger
La diversité des hôtes potentiels
de Cryptosporidium spp. et la résistance des ookystes dans
l'environnement conduisent à considérer plusieurs facteurs
intervenant dans la diffusion du danger, en premier lieu à partir des
sources de matières fécales, animales et humaines et,
secondairement par diffusion passive (ruissellement) et infiltration dans les
sols. Certains de ces facteurs sont assez bien caractérisés,
notamment ceux qui sont liés à une activité humaine.
D'autres restent difficiles à évaluer, en particulier le
réseau hydrographique, la pédologie, le type de
végétation, la climatologie. Ils peuvent favoriser ou non la
résistance des ookystes, leur accumulation, leur accessibilité
aux espèces réceptives (ruissellement, infiltration, etc.)
(AFSSA, 2002).
II.5.1. Diffusion passive
à partir des sources de contamination fécale animale
Elle a été mise en
évidence dans plusieurs études. La recherche d'ookystes dans les
ruisseaux autour de 11 fermes bovines laitières au Nord-Est des
Etats-Unis (SISCHO et al., 2000) montre que 36% de ces ruisseaux sont
contaminés. L'épandage sur les champs apparaît comme le
facteur de risque principal.
Lors d'un suivi de 18 mois dans une exploitation
en Grande Bretagne (HOODA et al., 2000), il a été
montré que dans 70 % des cas, les eaux de surface autour de
l'exploitation sont contaminées par Cryptosporidium. Une
corrélation avec les fortes pluies, et non avec l'épandage, a
été mise en évidence. C'est ainsi que des fuites
accidentelles d'eaux de ruissellement souillées vers les fossés
de drainage plutôt que vers des fosses à lisier, peuvent
représenter une source importante d'ookystes viables.
II.5.2. Diffusion passive
à partir des sources de contamination fécale humaine
La diffusion à partir de sources de
contamination fécale humaine peut se faire principalement par les rejets
d'eaux issues des stations d'épuration et par l'épandage des
boues produites par ces installations. Par ailleurs en cas de surcharge des
installations en période de fortes pluies ou de dysfonctionnement des
installations, l'eau des réseaux d'égout est rejetée
directement dans le milieu naturel par les déversoirs d'orage d'une
partie des ouvrages (AFSSA, 2002).
II.6.
Appréciation des effets chez l'homme
La maladie due à
Cryptosporidium sp. est connue sous le nom de
cryptosporidiose. Chez l'Homme, la cryptosporidiose est de
gravité variable suivant le terrain. Chez le sujet
immunocompétent, la cryptosporidiose survient après une
incubation de 9 jours et de 12-13 jours chez les patients infectés par
le VIH (JOKIPII & JOKIPII, 1986).
Les symptômes durent 12 à 18 jours,
pouvant se prolonger jusqu'à 40 jours, même chez les patients
immunocompétents (STEHR-GREEN et al., 1987). Les signes
cliniques associant diarrhée aqueuse (en moyenne 6 à 12 selles
par jour suivant les études), douleurs abdominales, asthénie,
nausées, vomissements sont présents dans plus de 80% des cas. Une
fièvre modérée (38°- 38°5C) est observée
dans 40 à 60% des cas. On observe une perte de poids (en moyenne 4,5 kg)
dans 50 à 75% des cas. Une hospitalisation est nécessaire dans un
faible pourcentage de cas, principalement pour réhydratation. La
durée d'émission des ookystes est de 3 à 8 jours (maximum
rapporté: 90 jours) A ce jour, il n'existe aucun traitement de la
cryptosporidiose. Seules la paramomycine et la
nitazoxanide ont une efficacité partielle sur les
symptômes mais ne permettent pas d'éliminer le parasite (AFSSA,
2002).
II.6.1. Facteurs de
risques
Dans la cryptosporidiose humaine ou animale,
l'âge et le statut immunitaire de l'hôte apparaissent comme des
facteurs de risque essentiels. En revanche, le rôle des facteurs de
virulence propres au parasite reste actuellement difficile à
évaluer.
a) Facteurs de risque liés à
l'hôte
Sur la base d'observations
épidémiologiques et expérimentales, le jeune âge et
le déficit immunitaire de l'hôte sont les deux principaux facteurs
de risque identifiés, aussi bien chez l'animal que chez l'Homme. Enfin
il faut préciser qu'en zone tropicale et dans des conditions
socio-économiques défavorables, la cryptosporidiose de l'enfant
s'associe à un risque de diarrhée prolongée, de
malnutrition et éventuellement de retard de développement
psychomoteur (AGNEW et al., 1998 ; GUERRANT et al., 1999).
b) L'état immunitaire : Chez
l'Homme
Le rôle de l'immunité cellulaire dans
la pathogénie de la cryptosporidiose a été clairement
établi chez l'Homme, essentiellement par les observations cliniques et
épidémiologiques effectuées chez des malades
immunodéprimés, en particulier au cours du SIDA :
- La cryptosporidiose au cours du SIDA a plusieurs
particularités. La susceptibilité à l'infection est
croissante avec la diminution du taux de lymphocytes CD4 sanguins. Le risque
est multiplié par 2 pour un taux de 500 à 1000 lymphocytes
CD4/mm3, par 3,6 pour un taux de 100 à 200 et par 6 pour un
taux <100 (POZIO et al., 1997). L'infection par Cryptosporidium
s'associe à un risque 3 fois plus élevé de
présenter des manifestations cliniques à la suite d'une
contamination, avec une symptomatologie dont la sévérité
croit avec la diminution du taux de CD4 : diarrhée prolongée et
fréquence plus élevée de douleurs abdominales. Au cours
d'une épidémie dans une communauté de toxicomanes, un taux
d'attaque de cryptosporidiose de 16,6% a été observé chez
les malades VIH-, versus 30,7% chez les sujets VIH+ (POZIO et al.,
1997). La maladie est fréquemment chronique (plusieurs mois à
plusieurs années) avec persistance de l'émission d'ookystes et
des symptômes cliniques sans guérison parasitologique.
Cette chronicité entraîne plusieurs
type de complications : déshydratation, malabsorption, atteinte des
voies biliaires, justifiant des hospitalisations, voire des interventions
chirurgicales pour cholécystectomie (MC. GOWAN et al., 1993 ;
VAKIL et al., 1996). La cryptosporidiose s'associe à une
mortalité directement liée à ces complications (HOXIE
et al., 1997).
La description de Cryptosporidium parvum,
l'appréciation de l'émission du danger, et des effets chez
l'Homme montrent à quel point sa présence dans l'eau de boisson
peut avoir de sérieuses répercussions sur la santé des
consommateurs.
Cependant à Port-au-Prince, capitale haïtienne, la
présence des ookystes de Cryptosporidium sp. a
été décelée d'après les résultats des
récentes études effectuées par BRASSEUR et al.
(2002) sur la circulation de ces derniers dans l'eau de boisson,
distribuée par adduction publique.
II.7. Présentation
de la zone métropolitaine de Port-au-Prince
Port-au-Prince, ville côtière
située dans la baie du même nom, est au coeur d'une structure
urbaine regroupant les municipalités de Port-au-Prince, Carrefour,
Pétion-Ville et Delmas qui englobe Cité Soleil, Delmas et
Tabarre. La région accueille 2.164.207 d'habitants environ (IHSI, 2003).
Un quart de la population d'Haïti vit dans l'aire métropolitaine
qui connaît une croissance démographique explosive,
accompagnée du développement d'un prolétariat urbain et
d'une bidonvilisation incontrôlée. Aujourd'hui, avec une
disponibilité de 23,7 millions de m3 d'eau par an
(BRGM-GERSAR-LGL, 1989), Port-au-Prince ne peut fournir que 11,85
m3/an à chacun de ses 2.164.207 habitants.
II.8. Facteurs
influençant la diffusion du danger dans la zone métropolitaine
de Port-au-Prince
II.8.1. Conditions
d'insalubrité
L'accumulation des
déchets dans les ravins, sur les places et dans les marchés
publics de l'aire métropolitaine contribue à la
dégradation de l'environnement. L'agglomération produit
annuellement environ 584.000 tonnes de déchets solides (HOLLY, 1999). Or
le système de ramassage ne peut éliminer que 30 % des
déchets produits ; au moment des fortes précipitations le
reste dévale les rues, se dépose dans les parties basses de la
capitale et obstrue les égouts.
Il s'ensuit des inondations de différents quartiers de
la ville et des crues encore plus importantes à chaque averse
ultérieure. Ces inondations continuelles de la ville sont dangereuses
sur le plan sanitaire vu que les eaux contiennent en plus des ordures
ménagères, des déchets humains qui s'infiltrent dans le
réseau de distribution d'eau potable qui n'est pas continuellement en
charge et qui est soumis à une pression interne
irrégulière du fait que les canalisations vétustes dans la
plupart des cas se trouvent en surface de nombreuses rues.
II.8.2. Nature et mouvement
des réservoirs d'animaux
En pays sous-développés, où
l'hygiène et la police sanitaire sont peu respectées, les chances
pour les animaux de se contaminer puis de contaminer directement ou
indirectement l'homme sont multipliées (EUZEBY, 1984). A Port-au-Prince
l'élevage libre des animaux comme le porc, les volailles, les boeufs,
les cabris est pratiqué . Or, ces animaux sont considérés
comme étant des réservoirs ou sources de parasites tels que le
Cryptosporidium (EUZEBY, 1984). Au lieu d'être
parqués en enclos les animaux sont autorisés à circuler
dans les rues et contaminent directement l'environnement par le rejet
d'ookystes sporulés, immédiatement infectants.
L'errement des chiens n'est pas contrôlée, ils sont
exposés à la contamination du parasite qu'ils transmettront
ensuite à l'homme. De plus le réseau de drainage de
Port-au-Prince est constitué de grands collecteurs à ciel ouvert
et d'une batterie de collecteurs moyens, de conduites circulaires
majoritairement en béton et de canaux rectangulaires (LÉGER,
2002). Par conséquent, les rats qui courent le long de ces canaux
favorisent la dissémination du parasite.
II.8.3. Etat du réseau
hydraulique de la CAMEP
La Centrale Autonome Métropolitaine d'Eau
Potable (CAMEP), entreprise parapublique, chargée de l'approvisionnement
en eau potable de la Région Métropolitaine de Port-au-Prince,
d'une population de 2.164.207 habitants environ, a une production de 40
millions de m3 d'eau par an provenant de 12 forages de la Plaine du
Cul-de-Sac (totalisant 264 litres/sec.) et 17 sources du massif de la Selle
(totalisant un débit de 923 litres/sec). Cette production ne garantit
que 11,85 m3/ habitant/an, ce qui est nettement inférieur
à la dotation minimale de 36,5 m3/habitant/an (TRACTEBEL,
1998). Cette situation donne naissance à ce qu'on appelle la
problématique de l'eau. En outre, les sources captées pour
l'approvisionnement en eau potable sont contaminées par les
excréta humains du fait que les zones non
aedificandi créées autour de chaque source n'ont
pas été respectées (HOLLY, 1998). La dégradation du
réseau par la réalisation de raccordements clandestins, mal
conçus, et le fait que le réseau n'est pas toujours en charge,
causent des fuites multiples, et entraînent par conséquent la
baisse de la qualité de l'eau distribuée. Les matières
fécales déposées par les eaux de ruissellement provenant
des pluies s'infiltrent dans les canalisations d'eau potable de surface qui
courent le long des rues et contaminent le réseau de distribution.
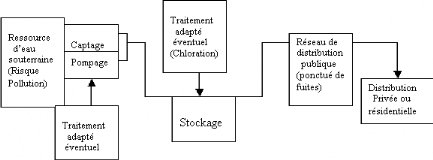
Figure 2: Illustration de
la production et de la distribution publique de l'eau
d'alimentation
II.8.4. Inefficacité du
mode de traitement des eaux
En Haïti, la chloration reste le seul mode
de traitement appliqué à l'eau brute destinée à la
consommation humaine. Théoriquement, la désinfection au chlore
est très économique et très efficace (EMMANUEL &
LINDSKOG, 2002). Toutefois d'après FAYER et al., (1998) les
ookystes de Cryptosporidium font partie des pathogènes les plus
résistants aux types de traitement classique telle que la
désinfection chimique.
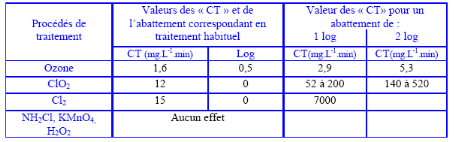
L'efficacité d'un
traitement chimique vis-à-vis de l'élimination des
microorganismes dépend principalement de la concentration [C] du
désinfectant, de la ou des substances utilisées et du temps [T]
de contact. Pour un microorganisme donné, le produit de ces deux valeurs
est voisin d'une constante, exprimée en mg.L-1.min :
[C] x [T] = constante CT
Le Tableau 2 présente d'une part, pour un traitement
effectué aux doses et temps de contact habituellement pratiqués
dans les installations, l'importance de l'abattement possible en
cryptosporidies et, d'autre part, les valeurs des « CT »
correspondant à 1 et 2 logarithmes d'abattement (BAUDIN et al.,
2001). Ce tableau montre que pour l'élimination des cryptosporidies,
dans les conditions réelles de fonctionnement des installations, les
traitements de chloration ne sont pas efficaces.
Tableau 2 : Efficacité
des traitements chimiques des eaux au regard des cryptosporidies (BAUDIN et
al., 2001)
II.8.5. Mobilité de la
population à travers la zone métropolitaine de Port-au-Prince
face à la problématique de l'eau
Les 2.164.207 habitants de
Port-au-Prince passent le plus clair de leur temps à la recherche de
l'eau potable. Plus de 60% d'entre eux n'ont accès ni à un
branchement personnel, ni à une fontaine publique. Seulement 12% des
familles bénéficient d'un branchement particulier (BONHOMME et
ROCK., 2001). Les bidonvilles qui abritent près de la
moitié de la population de la ville ne bénéficient pas
tous des services de la CAMEP. Plusieurs fois par jour, les habitants doivent
aller chercher l'eau hors de la maison; certains font même des
kilomètres pour s'approvisionner aux fontaines. Cette mobilité
des gens pour la quête de l'eau explique l'interconnection qu'il y a
entre les différentes zones. Par conséquent, une eau
contaminée dans un point bien spécifique peut avoir des
répercussions sur une population de loin supérieure à
celle de son environnement immédiat. Par hypothèse on peut dire
que ce n'est pas uniquement la zone où l'on a identifié le danger
qui représente un risque d'exposition pour la population, ce serait
plutôt toute la population de la zone métropolitaine de
Port-au-Prince qui est alimentée par ce réseau qui constitue donc
la population à risque.
Tenant compte de la surpopulation de la Région
Métropolitaine de Port-au-Prince, de la dégradation sans cesse
croissante du réseau de distribution de la CAMEP et enfin de la
mobilité de cette population pour la quête de l'eau, l'ampleur du
danger devient évident, d'où l'importance que revêt la
conduite d'une estimation quantitative des risques sanitaires.
III. CADRE EXPERIMENTAL
Une évaluation des risques se
réalise à partir de données existantes, de données
générées pour les besoins de la cause et d'outils
méthodologiques, tels que les modèles mathématiques,
l'expérimentation, l'observation et la modélisation (EMMANUEL,
2004) .
III.I. SCHÉMA
GLOBAL
Le modèle de cette évaluation quantitative des
risques s'articule autour de 4 modules :
- un module d'« Emission » (ou
contamination), donnant les résultats des analyses (nombre
d'ookystes prélevés); qui caractérise la contamination
de l'eau de distribution ;
- un module d'« Exposition
» : prise en compte de la proportion d'ookystes viables,
seuls susceptibles d'entraîner une infection ;
- un module de « Consommation »,
aboutissant à la caractérisation de l'ingestion d'eau de
consommation pour quatre types de populations donnés.
- un module d'« Effet »,
aboutissant, à l'aide d'une relation dose-réponse, à la
caractérisation du risque d'infection et, à l'aide d'une relation
infection-maladie, à celle du risque de maladie pour la population
immunodéprimée.
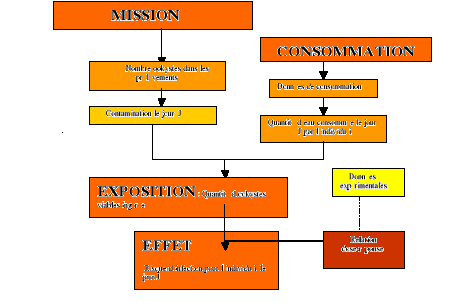
Figure 3 : Illustration de
l'évaluation des risques sanitaires propose dans le cadre de cette
étude
III.2. MODULE
«D'EMISSION »
Méthodologiquement,
l'évaluation de l'émission ou de la contamination peut se
réaliser à partir de données existantes. Ainsi, plusieurs
travaux ont été réalisés. Le choix est porté
dans le cadre de cette étude sur les travaux effectués par
BRASSEUR et al. entre 2000 et 2002. La distribution de la
concentration des ookystes dans l'eau pour les différentes zones est
présenté dans le tableau 3.
III.2.1. Matériels et méthodes
Vingt-sept prélèvements d'eau de
surface et de distribution par adduction publique dans la zone
métropolitaine de Port-au-Prince et ses environs immédiats ont
été effectués. Cette étude exclut les
prélèvements d'eau de surface. Les échantillons d'environs
100 litres sont filtrés suivant un débit de 100 litres à
l'heure, sur des capsules de polyéthersulfone. Les capsules sont
conservées à 4°C jusqu'au traitement au laboratoire
conformément à la norme AFNOR 2000. Les filtres sont
élués avec du tampon PBS, pH 7,4 additionné de tween 80.
L'éluat est centrifugé et les ookystes de
Cryptosporidium sp. sont isolés par séparation
immuno-magnétique en les recouvrant d'un anticorps monoclonal
anti-ookyste de Cryptosporidium. La collecte des billes
magnétiques a été effectuée dans un champ
magnétique. Le complexe ookystes/billes est ensuite dissocié par
HCl 0,1N. Les ookystes isolés sont marqués par un anticorps
monoclonal anti-Cryptosporidium fluorescent permettant la
détection et le comptage.
Résultats des analyses
Tableau 3 : Distribution
de la concentration des ookystes dans l'eau pour les différentes zones
|
ZONE
|
POP. TOTALE
|
n / 100L
|
Pop. moins de
5 ans
|
|
Port-au-Prince
|
704.777
|
|
65.536
|
|
Bolosse
|
|
6,9
|
|
|
Bolosse la foi
|
|
4,6
|
|
|
Rue St Martin
|
|
10
|
|
|
Christ- roi
|
|
4
|
|
|
Pacot
|
|
0
|
|
|
Blvd Harry Truman
|
|
2,8
|
|
|
Chemin des Dalles
|
|
38
|
|
|
|
|
|
|
Delmas
|
679.650
|
|
68.817
|
|
Delmas 6
|
|
1274
|
|
|
Delmas 66
|
|
8
|
|
|
Delmas 75
|
|
12
|
|
|
Delmas 33
|
|
0
|
|
|
Cité-Soleil
|
|
17,3
|
|
|
Tabarre -La Plaine
|
|
4,5
|
|
|
|
|
|
|
Pétion-Ville
|
283.052
|
|
29.415
|
|
Pétion-ville
|
48,6
|
|
|
Berthe-Péguy-ville
|
|
9,2
|
|
|
Tête de l'Eau
|
|
3,2
|
|
|
|
|
|
|
Carrefour
|
373.916
|
|
38.095
|
|
Bizoton 5
|
|
5
|
|
III.3. MODULE «
D'EXPOSITION »
Le développement de ce
module exige de prendre en compte la performance de la méthode
d'analyse. Il exige de prendre en compte la proportion d'ookystes viables. Le
nombre d'ookystes observé lors de l'analyse ne correspond en effet pas
au nombre d'ookystes réel, en raison d'un rendement (d'une
sensibilité) de la méthode inférieur à 100%. Dans
les conditions d'application de la norme AFNOR (NF T 90-455), c'est à
dire pour un volume filtré allant jusqu'à 200 litres, les
résultats d'intercalibration des laboratoires permettent d'estimer ce
rendement à 40%.
On émet les hypothèses suivantes :
Hypothèse 1
Chaque ookyste présent réellement dans un
échantillon a une probabilité constante égale à 40%
d'être observé, quel que soit l'échantillon,
indépendamment des autres ookystes.
Hypothèse 2
On considère que la probabilité pour un
ookyste d'être viable est constante, unique et indépendante des
autres ookystes (hypothèse forte).
Hypothèse 3
On considère que les ookystes viables sont tous
potentiellement infectants.
III.4. MODULE DE «
CONSOMMATION »
L'étude prend en compte la
consommation pour quatre types de populations
1 - Population immunocompétente et
immunodéprimée âgée de moins de 5 ans :
Consommation d'eau de boisson par jour : 0,75 L/j
(HOPKIN, 1980)
2 - Population adulte immunocompétente et
immunodéprimée
Consommation d'eau de boisson par jour : 2L/j
(HOPKIN, 1980)
III.5. MODULE «
D'EFFET »
III.5.1. Relation Dose-Réponse
La probabilité pour un individu
d'être infecté est clairement liée au nombre de
microorganismes pathogènes ingéré. La loi
Dose-Réponse est la fonction associant la probabilité pour un
individu d'être infecté selon la quantité d'ookystes
ingérée (la dose, notée D) :
Pr(Infection|D) = f(D)
Plusieurs fonctions Dose-Réponse ont été
proposées. Pour les dangers microbiens, les modèles les plus
fréquemment utilisés sont les modèles « exponentiel
» et « Bêta-Poisson ». Il a été
montré sur les données de DUPONT et al. (1995) que le
modèle Béta-Poisson, plus complexe que le modèle
exponentiel, ne permettait pas un meilleur ajustement aux données que le
modèle exponentiel : selon le principe statistique classique de
parcimonie, et en l'absence de données complémentaires sur le
processus entraînant ou non l'infection, le modèle
exponentiel est donc préférentiellement utilisé
dans le cadre de cette étude, plus simple. Le choix de ce modèle
nécessite toutefois l'adoption de certaines hypothèses.
La formulation suivante est retenue pour la justification
« biologique » du modèle dose-réponse de type
exponentiel :
- chaque ookyste ingéré a une probabilité
r faible de provoquer une infection. Cette probabilité n'est
pas de 1 car il faut que l'ookyste arrive sur le site d'infection, survive aux
défenses locales de l'organisme, ... ;
- cette probabilité est identique pour chaque ookyste
et chaque individu ;
- cette probabilité ne dépend pas du nombre
d'ookystes ingérés. Cette hypothèse suppose l'absence de
synergie d'action entre les ookystes ;
- enfin, ce modèle considère que l'infection est
effective dès que le nombre d'ookystes « infectants
» est supérieur à 0 (pas d'effet seuil).
On aboutit mathématiquement à la loi
dose-réponse (simple) suivante :
Pr(Infection|D) = 1 - exp(-r D)
Ce modèle ne comporte qu'un seul
paramètre r, qu'il est
nécessaire d'estimer à partir de données
expérimentales.
On notera que r correspond à la
probabilité pour un ookyste de provoquer l'infection. On peut
également, à partir de ce paramètre évalué
la dose infectieuse 50 (DI50)
, quantité d'ookystes nécessaires pour que la
probabilité d'infection soit de 50% :
DI50 = - ln(0.5) / r (AFSSA, 2002)
III.5.2. Données expérimentales pour
l'estimation du paramètre r
L'étude prend en compte deux
populations pour l'estimation du paramètre r: une population
immunocompétente, et une population immunodéprimée. La
relation dose-réponse pour ces deux populations est
différente.
Deux séries de données sont utilisées
pour traiter ce module :
- pour ce qui concerne la population immunocompétente,
les données obtenues par DUPONT et al. (1995) ;
- pour ce qui concerne, la population
immunodéprimée, les données obtenues par YANG et al
(2000).
III.5.2.a Population
immunocompétente
On retient un modèle de relation Dose-Réponse
dit « exponentiel » (HAAS et al., 1999). Pour appliquer ce
modèle exponentiel, on considère notamment les hypothèses
4 et 5 suivantes :
- Une entité infectieuse est suffisante
pour entraîner l'infection, Hypothèse 4 ;
- Les actions des particules infectieuses
ingérées sont indépendante, Hypothèse
5 ;
.
Tableau 4 : Données
d'une infection expérimentale de volontaires sains par ingestion
d'ookystes de Cryptosporidium parvum (DUPONT et al,
1995)
|
Ookystes ingérés
|
Nombre total sujets
|
Nombre sujets infectés
|
Sujets malades (Cryptosporidiose)
|
|
30
|
5
|
1
|
0
|
|
100
|
8
|
3
|
3
|
|
300
|
3
|
2
|
0
|
|
500
|
6
|
5
|
2
|
|
1000
|
2
|
2
|
0
|
|
10000
|
3
|
3
|
1
|
|
100000
|
1
|
1
|
0
|
|
1000000
|
1
|
1
|
1
|
En admettant que le nombre d'ookystes provoquant une infection
suite à l'ingestion de D ookystes suit une loi Binomiale de
paramètre D, n le nombre d'ookystes ingérés et
r la probabilité pour un ookyste d'entraîner une
infection :
n ~
Binomiale(D, r)
Comme r est faible et D est grand, on peut
utiliser la convergence de la loi Binomiale vers la loi de Poisson,
d'où :
n ~
Poisson(r D)
La probabilité d'obtenir au moins une infection est
alors égale à
Pr(Infection|D) = 1 -
exp(-r D)
D'après l'ajustement de la loi Dose-Réponse
exponentielle aux données de DUPONT et al. (1995), le
paramètre estimé est de r = 0.00419. La
dose infectieuse 50, (DI50) est de
165 ookystes.
III.5.2.b Population
immunodéprimée
Tableau 5 : Données
d'infection de souris immunodéprimées par ingestion d'ookystes
(YANG et al., 2000)
|
Ookystes ingérés
|
Nombre total de souris
|
Souris infectées
|
|
0
|
8
|
0
|
|
1
|
24
|
4
|
|
5
|
8
|
8
|
|
10
|
8
|
8
|
Dans ce contexte particulier, le
raisonnement repose sur les données observées par YANG et
al., 2000), reprises dans le Tableau 5, et obtenues sur souris
immunodéprimées avec les hypothèses suivantes :
Hypothèse 6
On retient l'hypothèse d'une transposition possible
des données obtenues sur souris immunodéprimées à
des individus immunodéprimés (hypothèse forte, mais
très sécuritaire au regard des paramètres issus de
l'étude de YANG et al. 2000) ;
Par ajustement du modèle exponentiel sur ces
données, on estime que la dose infectieuse 50 (DI50)
est égale à 1,96 ookystes, le paramètre
estimé est de r = 0.354 ce qui signifie en
d'autres termes, que moins de 2 ookystes par individu sont nécessaires
pour infecter la moitié d'une population immunodéprimée
exposée à l'ingestion d'ookystes. Pour
ce qui concerne cette population spécifique, l'hypothèse suivante
est retenue :
Hypothèse 7
La probabilité de maladie d'un individu
immunodéprimé infecté est de 1 (hypothèse forte,
sécuritaire).
En conséquence, le risque d'infection est égal au
risque de maladie dans cette sous-population et le nombre d'infections est
égal au nombre de cas cliniques de cryptosporidiose.
Le nombre de personnes contaminées par le virus du SIDA
en Haïti est estimé approximativement à
400.000 (PSI, Haïti) soit 5% de la population totale qui est de 8.304. 062
habitants (IHSI, 2003).
Hypothèse 8
Les 5% sont uniformément répartis à
travers le pays, en fonction de la population de la zone
considérée.
Connaissant le paramètre r et
acceptant le modèle exponentiel, il est alors possible d'évaluer
la probabilité d'infection quelle que soit la dose ingérée
pour les différents types de population.
IV. Résultats et
Discussion
IV.1. POPULATION DE 5 ANS
ET PLUS
Tableau 6 : Risque
d'infection pour la population 5 ans et plus
immunocompétente
|
ZONE
|
Pop. 5ans
et plus
I.C
|
n / 100 L
|
Rend. 40%
|
Nbre. ookyste. pr. 2 L / J
|
Dose ingérée
|
Risque
d'inf./ jour
|
Moy. Risque/ d'inf.
|
|
Port-au-Prince
|
607.279
|
|
|
|
|
|
1,16%
|
|
Bolosse
|
|
6,9
|
2,76
|
0,0552
|
0,0552
|
1%
|
|
|
Bolosse la foi
|
|
4,6
|
1,84
|
0,0368
|
0,0368
|
1%
|
|
|
rue st Martin
|
|
10
|
4
|
0,08
|
0,08
|
1%
|
|
|
Christ-roi
|
|
4
|
1,6
|
0,032
|
0,032
|
1%
|
|
|
chemin des
dalles
|
38
|
15,2
|
0,304
|
0,304
|
2%
|
|
|
Pacot
|
|
0
|
0
|
0
|
0
|
|
|
|
Blvd Harry Truman
|
|
2,8
|
1,12
|
0,0224
|
0,0224
|
1%
|
|
|
|
|
|
|
|
|
|
|
Delmas
|
580.292
|
|
|
|
|
|
2%
|
|
Delmas 66
|
|
8
|
3,2
|
0,064
|
0,064
|
1%
|
|
|
Delmas 6
|
|
1274
|
509,6
|
10,192
|
10,192
|
5%
|
|
|
Delmas 75
|
|
12
|
4,8
|
0,096
|
0,096
|
1%
|
|
|
Delmas 33
|
|
0
|
0
|
0
|
0
|
|
|
|
Cité Soleil
|
|
17,3
|
6,92
|
0,1384
|
0,1384
|
1%
|
|
|
Tabarre - la Plaine
|
|
4,5
|
1,8
|
0,036
|
0,036
|
1%
|
|
|
Carrefour marin
|
|
5,5
|
2,2
|
0,044
|
0,044
|
1%
|
|
|
|
|
|
|
|
|
|
|
Pétion-Ville
|
240.956
|
|
|
|
|
|
1,33%
|
|
Pétion-ville
|
|
48,6
|
19,44
|
0,3888
|
0,3888
|
2%
|
|
|
Berthe-Péguy-ville
|
|
9,2
|
3,68
|
0,0736
|
0,0736
|
1%
|
|
|
Tête de l'eau
|
|
3,2
|
1,28
|
0,0256
|
0,0256
|
1%
|
|
|
|
|
|
|
|
|
|
|
Carrefour
|
319.030
|
|
|
|
|
|
1%
|
|
Bisoton 5
|
|
5
|
2
|
0,04
|
0,04
|
1%
|
1%
|
Pop : Population ;
Rend : Rendement ; Risque d'inf./
jour : Risque d'infection pour un jour
donné ; Moy Risque.
d'inf. : moyenne
du Risque d'infection ; I.C. :
immunocompétente ; L / J : litre
par jour
Le risque d'infection
pour la population immunocompétente âgée de 5 ans et plus,
consommatrice d'eau de distribution par adduction publique, varie entre 1 et
5%. Cette probabilité de risque englobe non seulement la population de
la zone ou les prélèvements ont été
effectués mais également la population des zones avoisinantes.
Toutefois la prise en compte de l'incertitude du risque
vis-à-vis des données relatives à la présence du
parasite dans l'eau de distribution par adduction publique pour un nombre
considérable d'endroits appartenant à la même
municipalité, exige de prendre pour la population totale d'une
municipalité considérée, un niveau de risque qui serait
égal à la moyenne arithmétique des différents
résultats trouvés. La figure 2 présente la variation des
moyennes du risque à laquelle les populations respectives des
différentes municipalités de la région
métropolitaine se trouvent exposées.
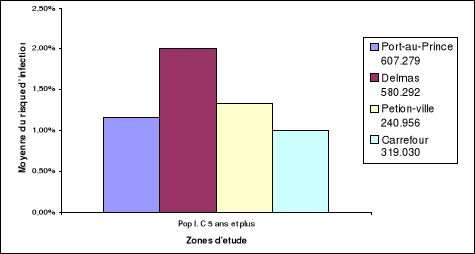
Figure 4 : Variation des
moyennes du risque d'infection pour la population immunocompétente
âgée de 5 ans et plus.
Lecture exemple : la
municipalité de Delmas qui accuse une population immunocompétente
approximative de 580.292 habitants a une moyenne de risque d'infection égale à 2%.
Tableau 7 : Risque d'infection et de maladies pour la
population âgée de 5ans et plus
immunodéprimée
|
ZONE
|
Pop.5
ans et plus I.D.
|
n / 100 L
|
rend. 40%
|
Nbre. ooKyste
pr. 2 L / J
|
Dose Ingérée
|
Risque
d'inf./ jour
|
Moy. Du
Risque/ d'inf.
|
|
|
|
|
|
|
|
|
|
Port-au-Prince
|
31.962
|
|
|
|
|
|
3,23%
|
|
Bolosse
|
|
6,9
|
2,76
|
0,0552
|
0,0552
|
2%
|
|
|
Bolosse la foi
|
|
4,6
|
1,84
|
0,0368
|
0,0368
|
1%
|
|
|
rue st Martin
|
|
10
|
4
|
0,08
|
0,08
|
3%
|
|
|
Christ-roi
|
|
4
|
1,6
|
0,032
|
0,032
|
1%
|
|
|
chemin des dalles
|
|
38
|
15,2
|
0,304
|
0,304
|
11%
|
|
|
Pacot
|
|
0
|
0
|
0
|
0
|
0%
|
|
|
Blvd Harry Truman
|
|
2,8
|
1,12
|
0,0224
|
0,0224
|
1%
|
|
|
Delmas
|
30.541
|
|
|
|
|
|
18,37%
|
|
Delmas 66
|
|
8
|
3,2
|
0,064
|
0,064
|
2%
|
|
|
Delmas 6
|
|
1274
|
509,6
|
10,192
|
10,192
|
97%
|
|
|
Delmas 75
|
|
12
|
4,8
|
0,096
|
0,096
|
3%
|
|
|
Delmas 33
|
|
0
|
0
|
0
|
0
|
0%
|
|
|
Cité Soleil
|
|
17,3
|
6,92
|
0,1384
|
0,1384
|
5%
|
|
|
Tabarre la Plaine
|
|
4,5
|
1,8
|
0,036
|
0,036
|
1%
|
|
|
Carrefour Marin
|
|
5,5
|
2,2
|
0,044
|
0,044
|
1%
|
|
|
Pétion-ville
|
12.681
|
|
|
|
|
|
5,44%
|
|
Pétion-ville
|
|
48,6
|
19,44
|
0,3888
|
0,3888
|
13%
|
|
|
Berthe-Peguy-ville
|
|
9,2
|
3,68
|
0,0736
|
0,0736
|
3%
|
|
|
Tête de l'eau
|
|
3,2
|
1,28
|
0,0256
|
0,0256
|
1%
|
|
|
Carrefour
|
16.791
|
|
|
|
|
|
|
|
Bizoton 5
|
|
5
|
2
|
0,04
|
0,04
|
1%
|
1%
|
Pop : Population ; Rend :
Rendement ; Risque d'inf./ jour : Risque
d'infection pour un jour donné ; Risque Moy. d'inf
: Risque moyen d'infection ; I.D. :
Immunodéprimée ; L / J :
litre par jour
Dans cette population le risque d'infection
est égal au risque de maladie et le nombre d'infections est égal
au nombre de cas de cryptosporidiose. Par conséquent, le risque
d'infection qui varie de 1 à 97% est aussi égal au nombre de cas
de maladie. Ces résultats expriment le caractère imminent du
danger pour la population immunodéprimée. Ces données ne
sont qu'un simple reflet de la réalité en raison du fait que la
totalité des personnes vivant avec le virus du SIDA n'est pas connu avec
exactitude. La figure 5 présente la variation approximative des moyennes
du risque auquel se trouvent exposées les populations
immunodéprimées respectives des différentes
municipalités de la région métropolitaine.
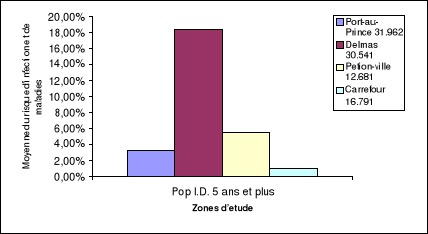
Figure 5 : Variation des
moyennes du risque d'infection et de maladie pour la population
immunodéprimée âgée de 5 ans et plus
Le nombre moyen de personnes infectées appartenant
à la population immunocompétente et le nombre moyen de personnes
infectées et malades appartenant à la population
immunodéprimée âgée de 5 ans et plus pour la
région métropolitaine de Port-au-Prince, seraient donc
égaux à la moyenne pondérée des moyennes du risque
multipliée par les populations respectives des différentes
municipalités.
Ainsi pour la Région Métropolitaine de
Port-au-Prince :
Le nombre ainsi estimé de personnes infectées
pour la population immunocompétente âgée de 5 ans et plus
est donc égal à : 23.844 personnes.
Le nombre ainsi estimé de personnes infectées et
malades pour la population immunodéprimée âgée de 5
ans et plus est donc égal à : 7.494
personnes.
IV.2. POPULATION DE MOINS
DE 5 ANS
Tableau 8 : Risque
d'infection pour la population immunocompétente âgée de
moins de 5 ans
|
ZONE
|
Pop. I.C moins
5 ans
|
n / 100 L
|
rend.
40%
|
Nbre. ookyste
pr. 0,75L / J
|
Dose
ingérée
|
Risque
d'inf./ jour
|
Moy/ Risque
d'inf.
|
|
Port-au-Prince
|
62.260
|
|
|
|
|
|
0,83%
|
|
Bolosse
|
|
6,9
|
2,76
|
0,0207
|
0,0207
|
1%
|
|
|
Bolosse la foi
|
|
4,6
|
1,84
|
0,0138
|
0,0138
|
1%
|
|
|
rue st Martin
|
|
10
|
4
|
0,03
|
0,03
|
1%
|
|
|
Christ-roi
|
|
4
|
1,6
|
0,012
|
0,012
|
1%
|
|
|
chemin des dalles
|
|
38
|
15,2
|
0,114
|
0,114
|
1%
|
|
|
Pacot
|
|
0
|
0
|
0
|
0
|
0%
|
|
|
Blvd Harry Truman
|
|
2,8
|
1,12
|
0,0084
|
0,0084
|
0%
|
|
|
Delmas
|
65.377
|
|
|
|
|
|
1,16%
|
|
Delmas 66
|
|
8
|
3,2
|
0,024
|
0,024
|
1%
|
|
|
Delmas 6
|
|
1274
|
509,6
|
3,822
|
3,822
|
2%
|
|
|
Delmas 75
|
|
12
|
4,8
|
0,036
|
0,036
|
1%
|
|
|
Delmas 33
|
|
0
|
0
|
0
|
0
|
0%
|
|
|
Carrefour marin
|
|
5,5
|
2,2
|
0,0165
|
0,0165
|
1%
|
|
|
Cité Soleil
|
|
17,3
|
6,92
|
0,0519
|
0,0519
|
1%
|
|
|
Tabarre La Plaine
|
|
4,5
|
1,8
|
0,0135
|
0,0135
|
1%
|
|
|
Pétion-ville
|
27.945
|
|
|
|
|
|
1%
|
|
Pétion-ville
|
|
48,6
|
19,44
|
0,1458
|
0,1458
|
1%
|
|
|
Berthe-Peguy-ville
|
|
9,2
|
3,68
|
0,0276
|
0,0762
|
1%
|
|
|
Tête de l'eau
|
|
3,2
|
1,28
|
0,0096
|
0,0096
|
1%
|
|
|
Carrefour
|
36.191
|
|
|
|
|
|
|
|
Bizoton 5
|
|
5
|
2
|
0,015
|
0,015
|
1%
|
1%
|
Pop : Population ;
Rend : Rendement ; Risque d'inf./
jour : Risque d'infection pour un jour donné ;
Moy / Risque d'inf :
Moyenne du Risque d'infection ; I.C. :
immunocompétente ; ; L / J : litre
par jour
Le risque d'infection pour les enfants de moins de 5 ans pour
les différentes zones est à peu près constant 1%, sauf
concernant le prélèvement effectué à Delmas 6 qui
donne un niveau de risque égal à 2%.
Tableau 9 : Risque
d'infection et de maladies pour la population immunodéprimée
âgée de moins de 5 ans
|
ZONE
|
Pop. I.D
Moins
de 5 ans
|
n / 100 L
|
rend.
40%
|
Nbre. ookystes
pr. 0,75L / J
|
Dose ingérée
|
Risque
d'inf./ jour
|
Moy/Risque. d'inf.
|
|
Port-au-Prince
|
3.276
|
|
|
|
|
|
1%
|
|
Bolosse
|
|
6,9
|
2,76
|
0,0207
|
0,0207
|
1%
|
|
|
Bolosse la foi
|
|
4,6
|
1,84
|
0,0138
|
0,0138
|
0%
|
|
|
Rue st Martin
|
|
10
|
4
|
0,03
|
0,03
|
1%
|
|
|
Christ-roi
|
|
4
|
1,6
|
0,012
|
0,012
|
0%
|
|
|
chemin des dalles
|
|
38
|
15,2
|
0,114
|
0,114
|
4%
|
|
|
Pacot
|
|
0
|
0
|
0
|
0
|
|
|
|
Blvd Harry Truman
|
|
2,8
|
1,12
|
0,0084
|
0,0084
|
0%
|
|
|
Delmas
|
3.440
|
|
|
|
|
|
13,16%
|
|
Delmas 66
|
|
8
|
3,2
|
0,024
|
0,024
|
1%
|
|
|
Delmas 6
|
|
1274
|
509,6
|
3,822
|
3,822
|
74%
|
|
|
Delmas 75
|
|
12
|
4,8
|
0,036
|
0,036
|
1%
|
|
|
Delmas 33
|
|
0
|
0
|
0
|
0
|
0%
|
|
|
Tabarre La Plaine
|
|
4,5
|
1,8
|
0,0135
|
0,0135
|
0%
|
|
|
Carrefour marin
|
|
5,5
|
2,2
|
0,0165
|
0,0165
|
1%
|
|
|
Cité Soleil
|
|
17,3
|
6,92
|
0,0519
|
0,0519
|
2%
|
|
|
Pétion-ville
|
1.470
|
|
|
|
|
|
3%
|
|
Pétion-ville
|
|
48,6
|
19,44
|
0,1458
|
0,1458
|
5%
|
|
|
Berthe-Peguy-ville
|
|
9,2
|
3,68
|
0,0276
|
0,0762
|
3%
|
|
|
Tête de l'eau
|
|
3,2
|
1,28
|
0,0096
|
0,0096
|
0%
|
|
|
Carrefour
|
1.904
|
|
|
|
|
|
|
|
Bizoton 5
|
|
5
|
2
|
0,015
|
0,015
|
1%
|
1%
|
Pop : Population ; Rend :
Rendement ; Risque d'inf./ jour :
Risque d'infection pour un jour donné ; Risque
Moy. d'inf :
Risque moyen d'infection ;
I.D. : immunodéprimée
Le risque d'infection est égal au risque
de maladie et le nombre d'infections est égal au nombre de cas de
cryptosporidiose. De ce fait le risque d'infection qui varie de 1 à 74%
est aussi égal au nombre de cas de maladies. La figure 6 présente
la variation approximative de la moyenne du risque à laquelle se
trouvent exposées les populations immunodéprimées
respectives des différentes municipalités de la région
métropolitaine, âgées de moins de 5 ans.
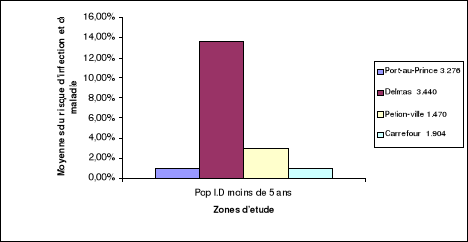
Figure 6 : Variation des
moyennes du risque d'infection et de m ladies de la population
immunodéprimée âgée de moins de 5 ans
Ainsi pour la Région Métropolitaine de
Port-au-Prince :
Le nombre de personnes infectées en moyenne pour la
population immunocompétente âgée de moins de 5 ans est
égal à 1.916 enfants.
Le nombre de personnes infectées et malades en moyenne
pour la population immunodéprimée âgée de moins de
5 ans est égale à 549 enfants.
V. CONCLUSION ET
PERSPECTIVES
Cette étude sur l'évaluation des risques
sanitaires dus aux ookystes de Cryptosporidium dans l'eau
destinée à la consommation humaine dans la Région
Métropolitaine de Port-au-Prince, s'inscrit dans le cadre d'un suivi
des travaux réalisés par BRASSEUR et al entre 2000 et
2002. Travaux au cours desquels des analyses ont été
effectuées sur des échantillons d'eau de distribution,
révélant la présence des ookystes de
Cryptosporidium. L'objectif de cette présente étude
était d'évaluer les risques sanitaires liés à la
présence de ce parasite dans l'eau destinée à la
consommation humaine et distribuée dans la zone métropolitaine de
Port-au-Prince.
A partir d'une étude bibliographique
réalisée sur Cryptosporidium parvum et les
différents facteurs influençant la diffusion du danger dans la
zone métropolitaine de Port-au-Prince un cadre expérimental a
été élaboré qui consiste en un
développement respectif des modules suivants :
- « Emission » (ou contamination) :
donnant les résultats des analyses (Nombre d'ookystes
prélevés); caractérisant la contamination de l'eau de
distribution.
- « Exposition » : prise en
compte de la proportion d'ookystes viables, seuls susceptibles
d'entraîner une infection ;
- « Consommation » :
aboutissant à l'ingestion d'eau de consommation pour quatre types de
population donnés.
- « Effet » : aboutissant,
à l'aide d'une relation dose-réponse, à la
caractérisation du risque d'infection et, à l'aide d'une relation
infection-maladie, à celle du risque de maladie pour la population
immunodéprimée.
A l'issue de ces quatre premières parties, la phase
d'interprétation des résultats est abordée où l'on
a constaté que :
Le risque d'infection pour la population
immunocompétente âgée de 5 ans et plus, consommant l'eau de
distribution par adduction publique, varie entre 1 à 5% ;
Le risque d'infection pour la population
immunodéprimée qui est égal au risque de maladie varie de
1 à 97%, situation particulièrement alarmante pour ce groupe
d'individus déjà vulnérables d'autant plus que seulement
une fraction limitée de la population infectée par le VIH a
accès au traitement anti-rétroviral ;
Le nombre estimé de personnes
immunocompétentes (âgées de 5 ans et plus) infectées
par Cryptosporidium parvum dans la zone métropolitaine de
Port-au-Prince est égal à 23.844 personnes
et le nombre estimé de personnes immunodéprimées
âgées de 5 ans et plus) infectées par Cryptosporidium
parvum et susceptibles de développer une cryptosporidiose grave est
égal à 7.494 personnes.
Le prélèvement effectué à
Delmas 6 donne un niveau de risque égal à 2% pour les enfants
âgés de moins de 5 ans et immunocompétents.
Le risque d'infection et de maladie pour les
enfants immunodéprimés âgés de moins de 5 ans varie
entre 1 et 74%.
Le nombre estimé d'enfants
infectées pour la population immunocompétente âgée
de moins de 5 ans pour la zone métropolitaine de Port-au-Prince est
égale à 1.916 enfants.
Pour la population
immunodéprimée âgée de moins de 5 ans, le nombre
estimé d'enfants infectés par Cryptosporidium parvum et
donc malades est égal à 549 enfants.
Les résultats obtenus dans ce travail sont le reflet de
la réalité donnant une idée de l'ampleur du danger que
revêt la circulation de Cryptosporidium parvum dans
l'environnement urbain et sa présence dans l'eau de distribution par
adduction publique dans la zone métropolitaine de Port-au-Prince. Par
conséquent il serait souhaitable de mettre en place une stratégie
de surveillance de la qualité microbiologique de l'eau dans la
perspective de réduire les infections liées à la
consommation d'eau contaminée.
Cependant, compte tenu de la complexité que
revêt la conduite de l'évaluation des risques sanitaires dans un
tel contexte, il serait intéressant à l'avenir d'orienter cette
recherche vers une évaluation de risque plus poussée en utilisant
la technique du type Monte Carlo qui prendrait en
compte :
1) l'incertitude du niveau de risque liée à
l'ignorance partielle ou au manque de connaissances sur le
phénomène étudié, en établissant des
intervalles de confiance.
2) la variabilité qui correspond à la
diversité et l'hétérogénéité du
risque d'un individu à l'autre, ou d'un jour à l'autre, en raison
de la variabilité de la consommation d'eau et de la variabilité
de la contamination de l'eau.
Par ailleurs, il serait souhaitable d'effectuer des analyses
sur des échantillons d'eau de consommation dite
« traitée » et vendue au détail dans des
récipients appartenant aux usagers, et de plus en plus achetée
par la population.
RÉFERENCES
BIBLIOGRAPHIQUES
AGENCE FRANÇAISE DE SECURITE SANITAIRE DES ALIMENTS
(AFSSA), (2002). Rapport sur les infections a protozoaires liées aux
aliments et à l'eau : Evaluation scientifique des risques
associés à Cryptosporidium sp.
AGNEW D.G., LIMA A. A., NEWMAN R.D., WUHIB T., MOORE R.D.,
GUERRANT R.L. & SEARS C.L. (1998). Cryptosporidiosis in Northeastern
Brazilian children : association with increased diarrhea morbidity. Journal
of infectious Diseases, 177, 754-60
ANDERSSON Y. & STRENSTROM T. A. (1986) Waterborne
outbreaks in Sweden - causes and etiology. Water Science and
Technology, 18 (10) 185-190.
BAUDIN, I., GABARD, N., BERNAZEAU, F. & LAINE, J.M. (2001)
Suivi et optimisation des procédés de clarification pour
l'élimination de Cryptosporidium. Technique Science Méthodes
96, 12, 41-47
BENTON C., FORBES G. L., PATERSON G. M., SHARP J. C. M. &
WILSON T. S. (1989) The incidence of water borne and water-associated disease
in Scotland from 1945 to 1987. Water Science and Technology,
21(3), 125-129.
BONHOMME G. & ROCK K. (1995-2001) Le
Projet d'alimentation en eau potable des quartiers défavorisés de
Port-au-Prince. .Actes du Colloque International « La gestion
intégrée de l'eau en Haïti », pp 122-128.
BONNARD R. (2001) Le risque biologique et la méthode
d'évaluation du risque. Rapport INERIS
DRC-01-25419-ERSA-RBn-383/microb6.doc
BRASSEUR P., EYMA E., VERDIER R. I., AGNAMEY P., LIAUTAUD B.,
DEI CAS E., PAPE J.W. & RACCURT C. (2002) Circulation des oocystes de
Cryptosporidium dans les eaux de surface et de distribution par
adduction publique à Port-au-Prince. Actes du Colloque
International « La gestion intégrée de l'eau
en Haïti », pp173-176.
BRGM-GERSAR-LGL SA. (1998). Etude des ressources en eau de
Port-au-Prince. Volet ABC besoins en eau de Port-au-Prince.
CRAUN G..F. (1991) Causes of waterborne outbreaks in the
United States. Water Science and Technology
, 24 (2), 17-20.
DESJARDINS R. (1990) Le traitement des eaux. Edition II revue.
Edition de l'Ecole Polytechnique de Montréal, Montréal.
DUMOULIN A., GUYOT K., LELIÈVRE E., DEI-CAS E. &
CAILLIEZ J.C. (2000) [Cryptosporidium and wildlife : a risk for
humans ?]. Parasite, 7, 167-72.
DUPONT, H.L., CHAPPELL, C.L., STERLING, C.R., OKHUYSEN, P.C.,
ROSE, J.B. & JAKUBOWSKI, W. (1995). The infectivity of Cryptosporidium
parvum in healthy volunteers. The New England journal of
Medicine, 332, 855-9.
EMMANUEL E. ( 2004 ). Caractérisation chimique,
biologique et écotoxicologique des effluents hospitaliers.
Thèse, Institut National des Sciences Appliquées de
Lyon, 257 p.
EMMANUEL E. & LINDSKOG P. (2002). Regards sur la situation
des ressources en eau de la République d'Haïti. Actes du
Colloque International « La gestion intégrée
de l'eau en Haïti », pp 30-52.
EUZEBY J. (1984). Les parasitoses humaines d'origine animale.
Caractères épidémiologiques, Paris, Médecine
Sciences 324 p.
FAYER R., MORGAN U. & UPTON S.J. (1998) Epidemiology of
Cryptosporidium : transmission detection and identification.
International Journal for Parasitology , 30,
1305-1322.
GALBRAITH N.S., BARRETT N. J. & STANWELL-SMITH R. (1987)
Water and disease after croydon ; a review of water-borne and
water-associated disease in the UK 1937-86. Journal of the Institute of
Water and Environnemental Management ,1, 7-21.D.
GUERRANT I., MOORE S.R., LIMA A.A., PATRICK P.D., SCHORLING
J.B., & GUERRANT R. L.(1999). Association of early childhood diarrhoea and
cryptosporidiosis with impaired physical fitness and cognitive function
four-seven years later in a poor urban community in Northeast Brazil. The
American Journal of Tropical Medicine and Hygiene, 61,
707-13.
GUYOT K., FOLLET-DUMOULIN A., LELIEVRE E., SARFATI C., CAMUS
D., RABODONIRINA M., NEVEZ G., CAILLIEZ J.C. & DEI-CAS E. (2001). Molecular
characterization of Cryptosporidium isolates obtained from humans in
France. Journal of clinical Microbiology,
39, 3472-80.
HAAS C.N., ROSE J.B. & GERBA C.P. (1999). Quantitative
microbial risk assessment, Wiley et Sons, New York.
HOLLY G. (1999) Les problèmes environnementaux de la
région métropolitaine de Port-au-Prince 221 p.
HOLTEN-ANDERSEN W., GERSTOFT J., HENRIKSEN S.A. &
PEDERSEN N.S. (1984). Prevalence of Cryptosporidium among patients
with acute enteric infection. The Journal of Infection,
9, 277-82.
HOODA P.S., EDWARDS A.C., ANDERSON H. A. & MILLER A.
(2000). A review of water quality concerns in livestock farming areas. The
Science of the Total Environment, 250,
143-67.
HOPKIN S..M. (1980) Drinking Water Consumption in Great
Britain: A survey of drinking habits with special reference to Tap-Based
Beverage (TR 137), Medmenham, UK, Water Research Centre.
HOXIE N.J., DAVIS J.P., VERGERONT J.M., NASHOLD R.D. &
BLAIR K.A. (1997) Cryptosporidiosis-associated mortality following a massive
waterborne outbreak in Milwaukee, Wisconsin. American Journal of Public
health, 87, 2032-5.
INSTITUT HATIEN DE STATISTIQUE ET D'INFORMATION (IHSI) (2003).
4ieme Recensement général de la population et de
l'habitat.
INSTITUT DE VEILLE SANITAIRE (IVS) (2000) Guide pour l'analyse
du volet sanitaire des études d'impact. IVS , Saint-Maurice 49 p. ISBN
2-11-09-14-82-3.
ISAACS D., HUNT, G.H., PHILLIPS A.D., PRICE E.H., RAAFAT F.
& WALKER- SMITH J.A. (1985). Cryptosporidiosis in immunocompetent
children. Journal of Clinical Pathology, 38,
76-81.
JENKINS M.B., ANGUISH L.J., BOWMAN D.D., WALKER M.J. &
GHIORSE W.C. (1997). Assessment of a dye permeability assay of determination of
inactivation rates of Cryptosporidium parvum oocysts. Applied and
Environmental Microbiology, 63, 3844-50.
JOKIPII L. & JOKIPII A.M. (1986). Timing of symptoms and
oocyst excretion in human cryptoporidiosis. The New England Journal of
Medicine, 315, 1643-7.
JOKIPII, L., POHJOLA, S., VALLE, S. L. ET JOKIPII, A. M.
(1985). Frequency, multiplicity and repertoire of intestinal protozoa in
healthy homosexual men and in patients with Gastro intestinal symptoms.
Annal Clinical Research 17, 57-9.
KICHOU F., SAGHIR F. & EL HADIMI M. (1996) Infection
naturelle à Cryptosporidium sp. chez le poulet chair au poulet.
International Foundation for Science (IFS) Parasitology Research in Africa.
Proceeding of an IFS Workshop. Bobo-Dioulasso, Burkina Faso, 424p
LANOIX J.N. & ROY M.L. (1976). Manuel du technicien
sanitaire. OMS Genève, pp. 21-22
LEGER R.J. (2002) Gestion partagée des infrastructures
de drainage et d`assainissement : cas des municipalités amont/aval
(Pétion-ville/Port-au-Prince). Actes du Colloque International
« La gestion intégrée de l'eau en
Haïti », pp.136-152.
LI X. & BRASSEUR P. (2000). An NMRI-slucking mouse model
for evaluation of infectivity Cryptosporidium parvum oocysts.
Chinese Journal of Parasitology and Parasitics Diseases,
2, 94-96.
MAC KENZIE W.R., HOXIE N.J., PROCTOR M.E., GRADUS M.S., BLAIR
K.A., PETERSON D.E., KAZÙOERCZAK J.J., ADDISS D.G. & FOX K.R.
(1994). A massive outbreak in Milwaukee of Cryptosporidium transmitted
through the public water supply. New England Journal of Medicine,
331, 161-167.
MCGOWAN I., HAWKINS A.S. & WELLER I.V. (1993). The natural
history of cryptosporidial diarrhoea in HIV-infected patients. Aids
(London, England) 7, 349-54.
.MATA L., BOLANOS H., PIZARRO D. & VIVES M. (1984).
Cryptosporidiosis in children from some highland Costa Rican rural and urban
areas. The American Journal of tropical Medicine and Hygiene,
33, 24-9.
MTAMBO M.M.A. (1995). Prevalence of Cryptosporidium
spp. oocysts in Cattle and wildlife in Tanzania : A preliminary report. .
International Foundation for Science (IFS) Parasitology Research in Africa.
Proceeding of an IFS Workshop. Bobo-Dioulasso, Burkina Faso, 424p
NATIONAL RESEARCH COUNCIL ( 1983)
Risk Assessment in the Federal Government: Managing the Process.
National Academy Press, Washington DC, 191 p.
ORGANISATION MONDIALE DE LA SANTÉ (OMS) (1995).
Directives de qualité pour l'eau de boisson, volume 1. Genève.
ORGANISATION MONDIALE DE LA SANTÉ (OMS) (2000).
Directives de qualité pour l'eau de boisson, 2ième
éd., Vol. 2 - Critères d'hygiène et document à
l'appui, OMS, Genève, 1050 p.
PAPE J.W., LEVINE E., BEAULIEU M.E., MARSHALL F., VERDIER R.
& JOHNSON W.D. (1987) Cryptosporidiosis in Haitian children. The
American Journal of Tropical Medicine and Hygiene, 36,
333-337.
PERZ J.F. & LE BLANCQ S.M. (2001). Cryptosporidium
parvum infection involving novel genotypes in wildlife from lower New York
state. Applied and Environmental Microbiology, 67,
1154-62
POZIO, E., REZZA G., BOSHINI A., PESSOTI P., TAMBURRINI A.,
ROSSI P., DI FINE M., SMACCHIA C., SHIESARI A., GATTEI E., ZUCCONI R. &
BALLARINI P. (1997). Clinical cryptosporidiosis and human immunodeficiency
virus (HIV) induced immunosupression: findings from a longitudinal study of
HIV-positive and HIV-negative former injection drug users. Journal of
Infectious Diseases, 176, 969-75.
RACCURT C. (2002) La cryptosporidiose humaine à
Port-au-Prince (Haïti) en 2000. Association Médicale
Haïtienne, sous presse.
ROBERTSON L.J., CAMPBELL A.T. & SMITH H.V. (1992).
Survival of Cryptosporidium parvum oocysts under various environmental
pressures. Applied and Environmental Microbiology,
58, 3494-500.
ROSE, J. B. ET SLIFKO, T. R. (1999). Giardia,
Cryptosporidium, and Cyclospora and their impact on foods : a
review. Journal of Food Protection 62, 1059-70.
SISCHO W.M., ATWILL E.R., LANYON L.E. & MARINAS B.J.
(2000). Cryptosporidium on dairy farms and the role these farms may
have in contaminating surface supplies in the North Eastern United States.
Preventive Veterinary Medicine, 43, 253-67
STEHR-GREEN J.K. MCCAIG L. REMSEN H.M., RAINS C.S.,
FOX M. & JURANEK D.D. (1987). Shedding of oocysts in immunocompetent
individuals infect with Cryptosporidium. The American Journal of
Tropical Medicine and Hygiene, 36, 338-42.
TAMBURRINI A. & POZIO E. (1999). Long-term survival of
Cryptosporidium parvum oocysts in seawater and in experimentally
infected mussels (Mytilus galloprovincialis). International
Journal for Parasitology, 29, 711-5.
TRACTEBEL DEVELOPPMENT (1998) Définition des
périmètres de protection pour les sources exploitées par
la CAMEP. Bruxelles.el
TZIPORI S., SMITH M., BIRCH C., BARNES G. & BISHOP R.
(1983). Cryptosporidiosis in hospital patients with gastroenteritis. The
American Journal of Tropical Medicine and Hygiene, 32,
931- 4.
TYZZER E E (1907). A sporozoan found in the peptic glands of
the common mouse. P. Soc. Exp. Biol. Med. 5: 12-13.
UGGLA A. (1996). Diagnosis of coccidial infections of domestic
animals. International Foundation for Science (IFS) Parasitology Research in
Africa. Proceeding of an IFS Workshop. Bobo-Dioulasso, Burkina Faso, 424p.
VAKIL N.B., SCHWARTZ S.M., BUGGY B.P., BRUMMITT C.F.,
KHERELLAH M., LETZER D.M., GILSON I.H. & JONES P.G. (1996). Billiary
cryptosporidiosis in HIV- infected people after the waterborne outbreak of
cryptosporidiosis in Milwaukee. The New England Journal of
Medicine, 334, 19 -23.
WALKER M.J., MONTEMAGNO C.D. & JENKINS M.B. (1998). Source
water assessment and nonpoint sources of acutely toxic contaminants : a review
of research related to survival and transport of C. parvum. Water Resources
Research, 34, 3383-92.
YANG S., BENSON S.K., DU C. & HEALEY M.C. (2000).
Infection of immunosuppressed C57BL/6N adult mice with a single oocyst of
Cryptosporidium parvum. The Journal of Parasitology,
86, 884-7.
| 


