Chapitre II
Méthodes utilisées dans cette
étude :
description
II. Introduction
Ce travail purement expérimental a été
effectué dans deux laboratoires d'analyses : le Complexe Industriel et
commercial belhassan-CIBEL et le Laboratoire Régional d'Analyses et de
Recherches Vétérinaires d'Agadir (LRARVA). Ces deux
établissements entretiennent des relations de collaborations
scientifiques avec les établissements de l'Université Ibn Zohr,
en l'occurrence la Faculté des Sciences d'Agadir.
Le LRARVA a été crée en 1980 pour couvrir
les besoins de la zone de sud du Maroc en matière d'analyse et
contrôle de qualité des produits agro-alimentaires et
halieutiques. Après une période de formation du personnel et la
mise en place des équipements, le laboratoire a démarré
ses activités techniques en 1985. Le laboratoire est organisé en
4 sections (section administrative, section qualité,
section appui et logistique et section technique). Quant au Laboratoire CIBEL,
il est fondé en 1989, c'est une unité active dans le secteur
« Produits des industries alimentaires » et dont l'activité
principale est le contrôle de la qualité des poissons et produits
de la pêche préparés.
II.1. Détermination de l'ABVT dans les produits de
mer
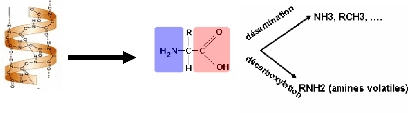
Comme signalé auparavant, l'ABVT est un des
critères utilisés pour évaluer l'altération des
produits de la mer. Il résulte principalement de la dégradation
des protéines par l'action des bactéries ou enzymes
présents dans la chair des poissons. Son dosage reste l'une des
méthodes les plus anciennement utilisées dans ce domaine. Il
permet de déterminer la teneur totale en azote des bases azotées
volatiles (NH3, DMA, TMA et R-NH2) résultant de la dégradation
des composés azotés protéiques et non protéique du
poisson. (Schéma 1)
Hydrolys
Protéine
Acides
Schéma 1 : Dégradation des
protéines
La DMA et la TMA sont produites à partir de l'oxyde de
triméthylamine (OTMA) dont la teneur varie d'une espèce à
une autre. Les transformations de TMA génèrent les mauvaises
odeurs et celles de la DMA en présence du formaldéhyde (un
polluant ubiquiste des écosystèmes naturels) conduisent au
durcissement de la chair du poisson.
II.1.1. Principe de la méthode
utilisée
Après l'extraction des protéines d'un
échantillon du poisson (100 g de chair prélevée dans trois
endroits différents du corps) à l'acide perchlorique (HClO4),
l'extrait obtenu subit une distillation suivie d'une neutralisation de l'ABVT
(essentiellement des bases volatiles) via l'acide chlorhydrique. Afin
d'alléger le manuscrit, nous avons opter de présenter le mode
opératoire sous formes des points suivants :
II. 1.2. Procédure
expérimentale
Pour garantir la fiabilité et la
répétabilité des résultats, tous les produits
chimiques que nous avons utilisé sont d'une pureté analytique
(HPLC grade): les solutions sont préparées dans de l'eau
déminéralisée ; une attention particulière a
été réservée à la préparations des
réactifs (acide perchlorique (HClO4, 0,6 mg. L-1), soude
caustique 2 g. L-1 et une solution standard d'HCl (0,05 N)) dans le
but de minimiser les sources d'incertitudes. Dans notre cas, un appareil de
distillation automatique est utilisé et par conséquent le titrage
est réalisé à l'aide d'une solution standard d'HCl (0,01
N). (Schéma 2)
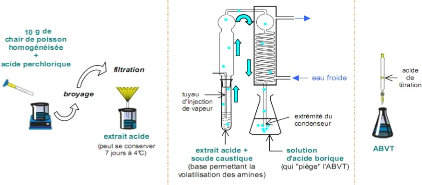
Schéma 2 : Les étapes de
détermination de l'ABVT
Mode opératoire
Après avoir hacher soigneusement l'échantillon
à analyser, on pèse 10 g qui sont broyés dans
récipient approprié puis mélangés à 90 ml de
solution d'acide perchlorique (0,6 mg. L-1). Un mélangeur
rapide assure l'homogénéisation de la solution obtenue. L'extrait
ainsi obtenu, après filtration, est parfois conservés pendant 7
jours à une température comprise entre 2 et 6 °C. Une
quantité de 50 ml de l'extrait obtenu est ensuite placée dans un
appareil de distillation à la vapeur. On vérifie l'alcalinisation
du milieu par l'ajout de quelques gouttes de phénophtaléine.
Avant de démarrer le processus de distillation, quelques gouttes d'agent
anti-moussant à base de silicone et un volume de 6,5 ml de soude
caustique (2 g. L-1) sont introduits dans le milieu
réactionnel. Après mélange, NaOH neutralise le HClO4,
selon l'équation :
NaOH + HClO4 NaClO4 + H2O
Il y a un excès de NaOH et cela libère les amines
en solution, selon la réaction:
NH4 + + OH- NH3
La distillation à la vapeur est ajustée de
façon à produire 100 ml de distillat au bout de 10 minutes. Les
bases volatiles entraînées sont recueillies dans une solution
d'acide borique (100 ml à 0,3 g. L-1) en présence
d'indicateur de Tachiro.
La réaction des amines volatiles avec l'acide borique est
:
NH3 + H3BO3 NH3-H3BO3
Les amines volatiles contenues dans la solution d'acide
borique sont ensuite titrées par une solution étalon d'HCl (0,01
N). Un essai à blanc est toujours effectué dans les mêmes
conditions que l'échantillon.
La teneur en ABVT par titrage de la solution d'acide borique
contenue dans le récepteur est déterminée à partir
de l'équation :
(V
100
- V )
ABVT(mg N/100 g chair) = 1 2 0,14 2
X X
m
V1 = volume en ml d'HCl 0,01 N versé.
V2 = volume en ml d'HCl 0,01 N pou neutraliser le blanc. m =
masse de l'échantillon en g.
II.2. Dosage de l'histamine dans les produits de
mer
L'histamine est une amine provenant de la dégradation
de l'histidine (acide aminé présent à forte dose dans
certains poissons) par décarboxylation. Sa présence, à des
teneurs supérieures à 10 mg/100g dans des poissons, est
susceptible de provoquer des phénomènes d'intoxication. La
formation d'histamine est très rapide lorsque les conditions de
température, de pH et de la salinité sont favorables.
Le principe du dosage de l'histamine consiste à
solubiliser cette amine dans de l'acide trichloracétique (TCA) suivie
d'une séparation sur une colonne chromatographique échangeuse
d'ions. L'éluant obtenu est complexé avec
l'orthophtalaldéhyde (OPA) comme agent dérivatisant pour former
un dérivé flourophore (His-OPA), facilement détectable par
fluorimétrie aux longueurs d'onde d'émission et d'excitation
respectives de 450 et 360 nm,

Histidine Histamine
Figure 1: Schéma simplifié de la
réaction de formation de l'histamine
II.2.1. Procédure expérimentale
En vue d'être dans les conditions réelles de
l'extrait d'histamine des produits halieutiques, la solution mère
d'histamine 1000 ppm est préparée dans HCl (0,1 N) : 1 g
d'histamine est placé dans une fiole jaugée (1 L). Les solutions
filles 10 Òg/ml (10 ppm) sont ensuite préparées à
partir de la solution mère.
Le dérivé fluorescent est formé
classiquement dans une série de fiole à partir des volumes
d'histamine (vHis) et d'OPA (v (OPA)).
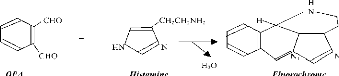
Figure 2 : Schéma de la réaction
de complexation : His-OPA
Après avoir hacher soigneusement l'échantillon
représentatif de poisson, 10 g de la masse broyée sont
placés dans un récipient auquel 90 ml de solution d'acide
trichloracétique (10%) sont ajoutés.
L'homogénéisation du mélange est réalisée
via un mixeur rapide. Une aliquote de 0,2 ml de l'extrait obtenu après
filtration, est ajoutée à 20 ml d'une solution tampon
(acétate de sodium + acide acétique) de pH = 4,6. Ce
mélange est ensuite chromatographie via une colonne remplie de
résine échangeuse d'ions selon le mode suivant : (i) l'addition
de 30 ml du tampon comme phase mobile, (ii) l'élimination des substances
non fixées est réalisée par l'ajout de 100 ml du
tampon.
Ensuite, les amines retenues par la résine, sont
élués par l'ajout de 20 ml (HCl, 0,2 N). Comme pour les autres
méthodes, un blanc traité exactement dans des conditions
similaires que l'échantillon est toujours préparé.
Une fois l'histamine élué, elle est
récupérée dans un bêcher, 2 ml de
l'éluât sont prélevés et ajoutées au
mélange dérivatisant préalablement préparé
(1 ml de NaOH (1 N) , 100 uL de l'OPA à 0,1 g. L-1).
Comme nous l'avons déjà mentionné, le
complexe fluorescent est relativement instable en milieu basique, c'est pour
cette raison, on ajoute 2 ml d'HCl (0,7 N) pour le stabiliser.
Le taux d'histamine en mg d'histamine /100g de poisson est
égal à :
|
Hist(mg N/100
|
g
|
chair)
|
(F1
|
-
|
F2
|
) 18
)
|
|
(F3
|
-
|
F2
|
F1 : fluorescence de l'échantillon.
F2 : fluorescence du blanc.
F3 : fluorescence du standard.
II.2.2 Etalonnage du fluorimètre
· Préparation des solutions
La Solution mère d'histamine à 1 g/litre. Dans une
fiole jaugée d'un litre son introduite 1,673 g d'histamine, 2 mL d'HCl
et compléter au trait de jauge avec HCl 0,1 N. Solution fille 10
Òg/ml (10 ppm). Introduire 1 ml de la solution mère dans une
fiole jaugée de 100 ml et compléter au trait de jauge par l'HCl
0,2 N.
Tableau 3 : Mode de préparation
des solutions étalons,
|
Numéro de l'étalon
|
Volume à prélever de la
solution fille (10
ppm) en
ml, *
|
Concentration de l'étalon
en (ppm)
|
|
1
|
0,22
|
0,022
|
|
2
|
0,5
|
0,05
|
|
3
|
0,8
|
0,08
|
|
4
|
1
|
0,1
|
|
5
|
1,33
|
0,133
|
|
6
|
1,8
|
0,18
|
|
7
|
2
|
0,2
|
* volume final en HCl. 0,2 N = 100 ml
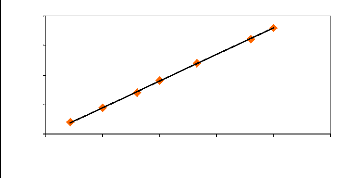
Le fluorimètre est étalonné si le
coefficient de corrélation de la régression linéaire est
supérieur à 0,75 (R2 > 0,75). Un exemple de valeurs
utilisées pour établir la droite de calibration est
consigné dans le tableau 4. La figure 3 illustre la droite
d'étalonnage obtenue.
Tableau 4 : Exemple de calibration du
fluorimètre,
|
Numéro de
l'étalon
|
Concentration de l'étalon
en (ppm)
|
Fluorescence
correspondante
|
|
1
|
0,022
|
20 #177; 9
|
|
2
|
0,05
|
45 #177; 3
|
|
3
|
0,08
|
70 #177; 13
|
|
4
|
0,1
|
90 #177; 10
|
|
5
|
0,133
|
120 #177; 2
|
|
6
|
0,18
|
160 #177; 6
|
|
7
|
0,2
|
180 #177; 12
|
R2: représente le coefficient de
corrélation
0 0,05 0,1 0,15 0,2 0,25
C (ppm)
Signal de Fluo (u ar.)
200
150
100
50
0
y = 895,65x
R2 = 0,9997
Figure 3 : Droite d'étalonnage
représentant l'intensité du fluorescence
en fonction de la
concentration (ppm), la pente est de 895,65, et R2 = 0,9997
? Fluorimetre :
Trilogy Turner est un instrument de laboratoire compact pour la
fabrication de fluorescence, les conditions de travail sont :
- Longueur d'onde d'excitation: 360 nm ; - Longueur
d'émission: 450 nm ;
- Sensibilité : moyenne ;
- Nombre de cycle: 1 ;
- Réponse : 0.02 sec;
- Courbe de calibration: linéaire ;
- Expression : Int = A + B * Conc ; - Standard blanc : 0.000 ;
II.3.Détermination du taux de dioxyde de soufre
II.3.1 Introduction
Le noircissement des crevettes est causé par une
réaction chimique d'oxydation des constituants de la carapace (tyrosine
notamment), similaire à la réaction qui prend place lors du
bronzage suite à l'exposition au soleil.
La mélanine, responsable du noircissement se forme sous
l'action de la tyrosinase contenue dans le sang qui oxyde la tyrosine libre
existant dans les tissus soit à l'état naturel, soit après
hydrolyse bactérienne.
La tyrosinase est connue pour oxyder directement
l'orthodihydroxyphénol (DOPA). Les quinones résultant de cette
oxydation se polymérisent pour donner des pigments dont la couleur varie
avec la nature du substrat (IFREMER a, 1991).
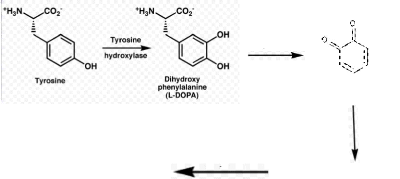
(Brun)
Mélanine
Oxydation enzymatique
(Pâle) Quinone (Jaune)
Substrats intermédiaires
Polymérisation
Schéma 3 : des réactions
chimiques impliquées lors du phénomène de
noircissement.
II.3.2 Détermination du dioxyde de soufre par la
méthode de Monier-Williams modifiée
Cette méthode décrite le dosage de SO2 total
dans les crevettes ou tout autre produit de la mer. Il se base sur
l'entraînement, par un courant d'azote, du dioxyde de soufre extrait du
produit acidifié et chauffé, sa fixation et son oxydation par
barbotage dans une solution neutre
diluée de peroxyde d'hydrogène puis le dosage de
l'H2SO4 formé par une solution titrée de NaOH. (Norme AFNOR VO3-
Mai 1975).
Pour assurer la répétabilité des
résultats, tous les réactifs que nous avons utilisés sont
d'une pureté analytique reconnue. Les solutions sont
préparées dans de l'eau déminéralisée.
La figure 4 illustre le schema du montage utilisé pour
la distillation et le dosage de SO2 dans les crevettes : (A) ballon
rodé, (B) réfrigérant, (C) ampoule d'incubation d'HCl, (D)
ampoule à barbotage.
Avec une précision de 0,01 g, on pèse entre 10 g
et 100 g de l'échantillon qui est broyés dans un récipient
approprié puis mélangés à 100 ml d'eau avant
d'introduire l'ensemble dans le ballon (A), pour favorise la réaction
ci-dessous :
Na2S2O5 + H2O 2 NaHSO3
On place dans l'ampoule (C) 50 ml de solution d'acide
chlorhydrique à 100 g.L-1, ensuite on mets dans le barboteur
(D) 3 ml de solution de peroxyde d'hydrogène à 3 % plus 0.1 ml
d'indicateur coloré (bleu de bromophénol), la solution de
peroxyde d'hydrogène est neutralisé par la solution d'hydroxyde
de sodium 0,01 N. La circulation est fait par un courant d'azote pour chasser
l'air contenu dans le ballon et dans l'ensemble du dispositif. On verse dans le
ballon (A) la solution diluée d'acide chlorhydrique contenue dans
l'ampoule (C) et on porte lentement le contenu du ballon à
ébullition qui est maintenue tout en faisant circuler
régulièrement l'azote à raison d'une à deux bulles
par seconde.
La réaction mise en joue est comme suit:
HSO3 - + HCl SO2 + H2O
En général, le dioxyde de soufre est
entraîné en 15 minutes, mais il est quelquefois nécessaire
de prolonger davantage l'opération d'entraînement par la
réaction suivant :
SO2 + H2O2 H2SO4
On peut vérifier si l'entraînement du dioxyde de
soufre a été total en remplaçant le barboteur par un autre
contenant une nouvelle charge de 3 ml de solution de peroxyde
d'hydrogène neutralisée. Le SO2 piéger dans la solution de
peroxyde d'hydrogène est ensuite titrées par une solution
étalon NaOH (0,1 N). Effectuer deux déterminations sur le
même échantillon pour essai.
La teneur en dioxyde de soufre, exprimée en milligrammes
par kg d'échantillon (ppm) est égale à :
|
SO
|
V 3,2 10
2 (ppm) = x
m
|
3
|
m = masse en grammes de la prise d'essai. V = volume en ml de
NaOH utilisé.
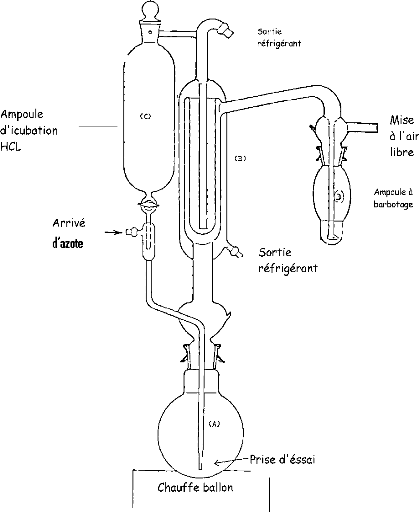
Figure 4 : Appareil utilisé pour la
distillation et le dosage de SO2, (A) ballon rodé, (B)
réfrigérant, (C) ampoule d'incubation d'HCl, (D) ampoule à
barbotage.
| 


