|

RÉ
PUBLIQUE DU CAMEROUN
REPUBLIC OF CAMEROON
UNIVERSITÉ DE YAOUNDÉ I THE
UNIVERSITY OF YAOUNDE I
FACULTÉ DES SCIENCES
FACULTY OF
SCIENCE
DEPARTEMENT DE BIOLOGIE ET PHYSIOLOGIE
ANIMALES
DEPARTMENT OF ANIMAL BIOLOGY AND
PHYSIOLOGY
LABORATOIRE DE ZOOLOGIE
LABORATORY OF ZOOLOGY
ETUDE QUALITATIVE DE LA FAUNE
CULICIDIENNE DE L'ETANG DU QUARTIER
MAIRIE
( ZOtTELE-CAMEROUN)
MEMOIRE
P
résenté et soutenu en vue de l'obtention
du
Diplôme d' Études Approfondies (DEA) de
BIOLOGIE ANIMALE
Option
: Zoologie Approfondie et Appliquée
Spécialité : Entomologie
Médicale
Par :
AMOUGOU ZIBI Serge Eugène
Maître
ès Sciences
Matricule 98Y219
Sous la direction de :
Pr. Jean MESSI
Maître de
conférences
Année académique 2010-2011
DEDICACE
Je dédie ce travail à :
> Mon feu père ZIBI OYONO
Josué,
> Ma feue mère Mme ZIBI née BEYALA
BEATRICE,
pour m'avoir donné la vie, pour toute l'affection et les
sacrifices consentis à mon égard que ce travail en soit le
couronnement.
REMERCIEMENTS
Je remercie :
- L'Eternel Dieu tout puissant pour m'avoir permis de commencer
et de terminer ce travail ;
- Le Pr. Jean Messi pour l'encadrement et la
disponibilité qu'il a consentis pour l'aboutissement de ce travail, ceci
malgré la précarité de son état de santé et
ses multiples préoccupations. Recevez ici, Mr le Professeur l'expression
de ma très profonde gratitude ;
- Le Pr. Bilong Bilong Charles Félix,
Dr. Belong Philippe, Dr. Foko
Gisèle et Dr. Atangana Jean pour leurs
conseils, suggestions et critiques.
- Tous les enseignants du laboratoire de zoologie de
l'Université de Yaoundé I ;
- Mes parents et frères : Mr et Mme Atangana
Maze, Mme Ntolo Oyono Thérèse, Me Essimi Zibi Georges, Oyono Zibi
Éric, Eyenga Françoise, Mr et Mme Nkomo Carole, Mvondo Ferdinand,
Carine Lema Zibi, Ndzié Jules, Reine Laure Ntolo, Maze Michel, Mendouga
Atangana Paulette, Massock Atangana Vanina, Atangana Raymonde Manuela, Maze
Atangana Merciel, Atangana Atangana kévin pour le soutien
spirituel, moral, matériel et financier ;
- Mme Mengue Nkili, Maire de la Commune Rurale
de Zoétélé pour avoir mis à ma disposition ses
locaux ;
- Ma fiancée Menga Beyena Hortense et
mes filles Inissom Fanie Ruth-D'or et
Amougou
Bendji Julienne Phigel pour les encouragements qu'elles m'ont
accordés ;
- Mes camarades : Azo'o Michelson, Ndo Cyril,
Abéga Réné, Avah Jean -Jaurès, Akono Patrick, Bakwo
Fils Éric, Elanga N'dillé Clément, Messop Edith,
Pando Joseph pour leur sincère collaboration
;
- Mes amis : Ondja'a Eya Serge, Nkomo Soua Petit Robert,
Beyala Frédérique, Mvondo Alvine et la
Famille Fouda pour leur aide multiforme ;
- Tous ceux qui ont contribué à la
réalisation de ce mémoire et dont les noms n'ont pas
été cités ;
- Puissent toutes ces personnes trouver dans ce mémoire,
l'expression de ma profonde gratitude.

RESUME
De janvier à décembre 2006, nous avons
mené une étude qui a contribué à la connaissance de
la faune culicidienne aux alentours de l'étang du quartier Mairie de
Zoétélé, situé en périphérie au
Nord-est de la ville de Zoétélé (Longitude-Est
11°53'40», Latitude -Nord 3°15'26»), en forêt
équatoriale du Cameroun, dans le département du Dja et Lobo,
région du Sud. Zoétélé a un climat de type
guinéen à quatre saisons : deux saisons de pluie dont la petite
en mars-juin et la grande en septembre-novembre alternant avec deux saisons
sèches dont la petite saison en juillet-août et la grande saison
en décembrefévrier .Le site de récolte est l'étang
du quartier Mairie situé 70 m de la Mairie de la dite ville.
Les larves de Culicidae 6730 dont 4274 de la
sous-famille d'Anophelinae et 2456 de la sous-famille de
Culicinae ont été récoltées dans cet
étang par la méthode « dipping ». A partir de ces
larves, nous avons obtenu 5327 nymphes de Culicidae dont 3415 de la
sousfamille d'Anophelinae et 1912 de la sous-famille de
Culicinae, et 5033 imagos de Culicidae qui ont
émergé.
Les résultats des identifications
révèlent onze espèces différentes de moustiques se
répartissant en trois genres dont quatre espèces du genre
Anopheles (Anopheles moucheti, Anopheles nili, Anopheles gambiae,
Anopheles funestus), trois espèces du genre Culex (Culex
quinquefasciatus, Culex duttoni, Culex tigripes) et quatre espèces
du genre Aedes
(Aedes albopictus, Aedes aegypti, Aedes tarsalis, Aedes
vittatus).
Il ressort ainsi que le genre Anopheles est
quantitativement le plus représenté (68,11%), suivi du genre
Culex (19,23%) et du genre Aedes (12,66%).
Dans le genre Anopheles, l'espèce
Anopheles moucheti est l'espèce la plus abondante pendant toute
l'année avec une fréquence 41,07%. Cette espèce connait sa
plus productivité pendant la petite saison des pluies. Le test d'analyse
des variances (ANOVA) nous confirme que la variation des saisons n'a pas une
influence significative sur l'abondance d'Anopheles moucheti pendant
les quatre saisons (F= 3,258 ; ddl=3 ; P=0,081). Elle est secondée par
Anopheles nili avec une fréquence de 29,72%; sa
productivité explose également pendant la petite saison des
pluies. Une différence non
significative entre les variations de l'abondance
d'Anopheles nili sur les quatre saisons est confirmée par le
test d'analyse des variances(ANOVA) (F=1,665 ; ddl= 3 ; P=0,251).
Le genre Culex est dominé par l'espèce
Culex quinquefasciatus (vecteur principal de la filariose de Bancroft
ou éléphantiasis) avec un effectif de 492 individus (50,83%). Sa
productivité est maximale lors de la petite saison sèche. Le test
d'analyse des variances (ANOVA) révèle qu'il n'existe pas une
différence significative entre les variations de l'abondance de la
population de Culex quinquefasciatus sur les quatre saisons (F=1,024 ;
ddl= 3 ; P=0,432).
Aedes albopictus vecteur potentiel de la dengue et
Aedes aegypti vecteur de la fièvre jaune sont les
espèces les plus représentées de ce genre avec
respectivement des fréquences de 47,41% et 24,65%. Ces deux
espèces connaissent leur maximum de productivité pendant la
petite saison sèche. Le test d'analyse des variances (ANOVA) nous
révèle que les quatre saisons n'influencent pas de manière
significative, l'abondance de la population d'Aedes albopictus
(F=4,031 ; ddl=3 ; P= 0,051).Une différence significative entre les
variations de l'abondance de la population d'Aedes aegypti pendant les
quatre saisons est montrée par le test d'analyse des variances (ANOVA)
(F=4,186 ; ddl= 3 ; P=0,047).
Mots clés : Faune culicidienne,
Zoétélé, Mairie, Anopheles, Culex, Aedes.

ABSTRACT
From January to December 2006, we carried out a study which
unveiled the Culicidiae fauna near the pond in the
Zoétélé council area, situated in the outskirts of the
North-East of Zoétélé town (East longitude:
11°53'40», North latitude: 3°15'26») in the Equatorial
forest of Cameroon, in the Dja and Lobo Division of South Region.
Zoétélé has a Guinean type of climate, which is
characterized by four seasons: two rainy seasons (the low peak ranging from
March to June and the high peak from September to November) alternating with
two dry seasons (the low peak ranging from July to August and the high peak
from December to February). Samples were collected from the pond in the council
neighborhood situated some 70 m from the town hall.
Culicidae larvae (6730 in number, 4274 from the
Anophelinae sub-family and 2456 from the Culicinae
sub-family) were collected from this pond using the dipping method. From these
larvae, 5327 Culicidae nymphs were obtained (3415 from the
Anophelinae sub-family and 1912 from the Culicinae
sub-family) and also 5033 Culicidae imagoes.
Eleven different types of mosquitoes emerged from the
identification process, which are classified into three types: four species of
Anopheles (Anopheles moucheti, Anopheles nili, Anopheles gambiae and
Anopheles funestus), three species of Culex (Culex quinquefasciatus,
Culex duttoni and Culex tigripes) and four species of Aedes (Aedes
albopictus, Aedes aegypti, Aedes tarsalis and Aedes vittatus).
Quantitatively, it therefore emerged that the
Anopheles species is the most widespread (68. 11 %) followed by
Culex (19. 23 %) and then Aedes (12. 66 %).
Concerning Anopheles type, Anopheles
moucheti is the leading vector of malaria throughout the year with a
frequency of 41. 07 %. Its production mostly during the low peak of the rainy
season. The analysis of variance test (ANOVA) confirmed that seasonal
variations do not significantly influence the population of Anopheles
moucheti during the four seasons (F = 3.258; ddl=3; P=0.081).
Anopheles nili comes after Anopheles moucheti, with a
frequency of 29. 72 %. Its production peak is equally during the low peak of
the rainy season. A non -significant difference in the variations of the
population of
Anopheles nili with regard to the four seasons is
confirmed by the analysis variance test (ANOVA) (F=1.665; ddl = 3; P=0.251).
The Culex type is dominated by Culex
quinquefasciatus species with a population of 492 (50. 83 %), the species
which is the leading vector of Bancroft's filariosis or elephantiasis. Its
production peak is during the low peak of the dry season. The analysis of
variance test (ANOVA) showed a non-significant difference in the variations of
the population of Culex quinquefasciatus during the four seasons
(F=1.024; ddl = 3; P=0.432).
Aedes albopictus (potential vector of the dengue) and
Aedes aegypti (vector of the yellow fever) are the most widespread
species of Aedes with a frequency of 47. 41% and 24. 65 %
respectively. Their reproduction peak is during the low peak of the dry season.
The analysis of variance test (ANOVA) revealed that the four seasons do not
significantly influence the population of Aedes albopictus (F=4.031;
ddl=3; P = 0.051). On the contrary, a significant difference in the variations
of the Aedes aegypti population during the four seasons is revealed by
the analysis of variance test (ANOVA) (F=4.186; ddl = 3; P=0.047).
Key words: Culicidae fauna,
Zoétélé, Council, Anopheles, Culex, Aedes.
SOMMAIRE
Dédicace
iRemerciements .iiRésumé iiiAbstract .v
Sommaire viiListe des figures ix
Liste des tableaux x
Liste des abréviations ..xi
INTRODUCTION .1
CHAPITRE I : REVUE DE LA LITTERATURE SUR LES
CULICIDAE 4
I.1. POSITION DANS LA SYSTEMATIQUE DES CULICIDAE ...5
I.2. BIO-ECOLOGIE ET MORPHOLOGIE SOMMAIRE DES DIFFERENTS
STADES
|
DE DEVELOPPEMENT DE CULICIDAE
|
11
|
|
I.2.1. L'oeuf
|
12
|
|
I.2.2. La larve
|
.13
|
|
I.2.3. La nymphe
|
15
|
|
I.2.4. L'adulte
|
.16
|
|
I.3. LUTTE ANTIVECTORIELLE
|
19
|
|
I.3.1. Lutte contre les oeufs et les larves
|
20
|
|
I.3.2. Lutte anti-imago .
|
.21
|
|
CHAPITRE II : MATERIEL ET METHODES
|
25
|
|
II.1. MATERIEL
|
26
|
|
II.1.1. Matériel biologique
|
..26
|
|
II.1.2. Matériel technique
|
26
|
|
II.1.3. Matériel d'élevage
|
28
|
|
II.1.3.1. Table
|
..28
|
|
II.1.3.2. Cages
|
.28
|
|
II.1.3.3. Eau d'élevage
|
28
|
|
II.1.4 Site d'étude
|
28
|
|
II.2. METHODES
|
29
|
|
II.2.1. Echantillonnage des larves de Culicidae
|
29
|
|
II.2.2. Elevage
|
.30
|
|
II.2.3.Identification morphologique des adultes de Culicidae
|
30
|
|
II.2.4. Analyse des données
|
30
|
CHAPITRE III : RESULTATS ET INTERPRETATIONS 31
III.1. ABONDANCE DES LARVES , DES NYMPHES ET LA RICHESSE
SPECIFIQUE DES ADULTES DE LA FAUNE DE CULICIDAE DE L'ETANG DU
QUARTIER
MAIRIE DE ZOETELE EN 2006 ..32
III.1.1.Abondance des larves de Culicidae du quartier
Mairie de Zoétélé en 2006 ..32
III.1.2. Abondance des nymphes de Culicidae du quartier
Mairie de Zoétélé en 2006 ....32 III.1.3.Richesse
spécifique et abondance des imagos de Culicidae du quartier
Mairie de Zoétélé en 2006 ...... .33
III.2. ABONDANCE
MENSUELLE LARVAIRE DES DIFFERENTS GENRES DE
CULICIDAE DE L'ETANG DU QUARTIER MAIRIE DE ZOETELE EN
2006 35
III.3.VARIATIONS SAISONNIERES NUMERIQUES DES LARVES, DES NYMPHES
ET DES IMAGOS DE CULICIDAE 38
III. 3.1.Variations saisonnières numériques des
larves de Culicidae . ..38
III.3.2. Variations saisonnières numériques des
nymphes de Culicidae 39
III. 3.3.Variations saisonnières numériques des
imagos de Culicidae 40
III.4. MORPHOLOGIE SOMMAIRE DES IMAGOS DES DIFFERENTES ESPECES DE
CULICIDAE IDENTIFIEES AU QUARTIER MAIRIE DE ZOETELE EN 2006 42
CHAPITRE IV : DISCUSSION 53
CONCLUSION ET PERSPECTIVES 58
RECOMMANDATIONS 61
REFERENCES BIBLIOGRAPHIQUES 63
ANNEXES 69
LISTE DES FIGURES.
|
Figure 1 : Site d'étude ...27
Figure 2 : Abondance absolue des différentes sous-familles
et genres de Culicidae de
|
|
l'étang du quartier Mairie de Zoétélé
en 2006
|
..35
|
|
Figure 3 : Morphologie d'Anopheles moucheti femelle
|
42
|
|
Figure 4 : Morphologie d'Anopheles nili femelle
|
.43
|
|
Figure 5 : Morphologie d'Anopheles gambiae femelle
|
.44
|
|
Figure 6 : Morphologie d'Anopheles funestus femelle
|
..45
|
|
Figure 7 : Morphologie de Culex quinquefasciatus femelle
|
.46
|
|
Figure 8 : Morphologie de Culex duttoni femelle
|
.47
|
|
Figure 9: Morphologie de Culex tigripes mâle
|
..48
|
|
Figure 10 : Morphologie d'Aedes albopictus femelle
|
..49
|
|
Figure 11 : Morphologie d'Aedes aegypti femelle
|
50
|
|
Figure 12 : Morphologie d'Aedes tarsalis femelle
|
51
|
|
Figure 13: Morphologie d'Aedes vittatus femelle
|
.52
|
LISTE DES TABLEAUX
Tableau I : Insecticides recommandés par l'OMS pour
imprégner les moustiquaires 23
Tableau II : Relevés des
précipitations et températures dans la ville de
Zoétélé de
janvier à décembre 2006(Station
météorologique de Sangmélima) .29
Tableau III :
Abondance par sous-familles des larves de Culicidae de l'étang
du
quartier Mairie de Zoétélé en 2006
.32
Tableau IV : Abondance par sous-familles et genre des nymphes de
Culicidae de
l'étang du quartier Mairie de Zoétélé
en 2006 .33
Tableau V : Richesse spécifiques et abondance de
Culicidae adultes de l'étang du
quartier Mairie de Zoétélé en 2006
34
Tableau VI : Abondance mensuelle larvaire par genre de Culicidae
de l'étang du
quartier Mairie de Zoétélé en 2006
36
Tableau VII : Abondance mensuelle des différents stades de
développement de
Culicidae de l'étang du quartier Mairie de
Zoétélé en 2006 37
Tableau VIII : Taux de
transformation des différents stades de développement de
Culicidae de l'étang du quartier Mairie de
Zoétélé en 2006 .37
Tableau IX: Evolution
saisonnière des différents stades de développement des
Culicidae de l'étang du quartier Mairie de
Zoétélé en 2006 38
Tableau X : Evolution
saisonnière de larves de Culicidae par genre de l'étang
du
quartier Mairie de Zoétélé en 2006
39
Tableau XI : Evolution saisonnière de nymphes de
Culicidae par genre de l'étang du
quartier Mairie de Zoétélé en 2006
40
Tableau XII : Evolution saisonnière des différentes
espèces de Culicidae de l'étang du
quartier Mairie de Zoétélé en 2006 41
LISTE DES ABREVIATIONS
A.D.N. : Acide Désoxyribonucléique
Cm. : Centimètre Cu. : Culex
Déc. : Décembre °c. : Degré celsius
fév. : Février
GSP. : Grande Saison de Pluies
GSS. : Grande Saison Sèche
I.R.D. : Institut de Recherche pour le Développement
jan. : Janvier
juil. : juillet
Km. : Kilomètre L. : Litre
L1. : Larve stade 1
L2. : Larve stade 2
L3. : Larve stade 3 L4 ..: Larve stade 4 m. : Mètre
mm. : Millimètre nov. : Novembre oct. : Octobre
OMS : Organisation Mondiale de la Santé
%. : Pourcentage
PSP. : Petite Saison de Pluies
PSS. : Petite Saison Sèche
Sept. : Septembre.
Les moustiques sont des insectes holométaboles, qui
subissent une métamorphose complète. Ils se développent
à travers les stades ovulaire, larvaire et nymphal avant d'atteindre le
stade adulte ou imago (Cléments, 2000). Ces diptères causent des
nuisances considérables et transmettent à l'Homme et aux animaux,
de nombreuses maladies parmi lesquelles le paludisme, les arboviroses (dengue,
fièvre jaune, encéphalite...), les filarioses lymphatiques
(brugioses, loase, mansonnelose, wuchereriose...).
Le paludisme est la maladie parasitaire la plus
répandue dans le monde. Cette maladie est actuellement la
première cause de mortalité et de morbidité infantile dans
les pays en voie de développement (OMS, 1999), entraîne le
décès de plus de 2 millions de personnes par an (IRD, 2004). Elle
est due au Plasmodium, agent pathogène transmis à
l'homme par la piqûre des moustiques du genre Anopheles .Le
paludisme est caractérisé par des accès de fièvres
récurrents, douleurs musculaires, d'un affaiblissement, de vomissements,
de diarrhées, de toux, de vertiges, de nausées, de tremblements
avec sueurs froides et transpiration d'asthème ...
La prolifération de ces vecteurs est favorisée
par l'insalubrité liée au progrès d'urbanisation et de
l'industrialisation des villes qui n'ont pas été suivies de ceux
de l'évacuation des ordures (Bruce-Chwatt, 1983).
Une bonne connaissance de la distribution géographique
de diverses espèces de moustiques, ainsi que la maîtrise de leur
bio-écologie et surtout une réactualisation constante de ces
données permettrait d'affiner et de choisir les moyens de lutte
antivectorielle efficace. Les méthodes de lutte antivectorielle
regroupent toutes les méthodes chimiques, physiques, biologiques ou
génétiques utilisées pour rompre la chaîne
épidémiologique au niveau d'un vecteur particulier (Foko, 2007).
Les stratégies adoptées ont pour objectif de réduire les
densités des populations vectrices à un niveau très bas,
ou de limiter le contact Homme-vecteur (Carnevale et Mouchet, 1990).C'est
à cet effet que cette étude dont le but est de
déterminer la richesse spécifique de la faune
culicidienne de l'étang du quartier Mairie de
Zoétélé, a été menée.
L'objectif général de ce travail est de contribuer
à la connaissance de la faune culicidienne de l'étang du quartier
Mairie de Zoétélé.
Nos objectifs spécifiques sont les suivants :
- Déterminer l'abondance larvaire, nymphale et la richesse
spécifique des adultes de la faune culicidienne de l'étang du
quartier Mairie de Zoétélé ;
- Evaluer l'abondance mensuelle larvaire des différents
genres de Culicidae l'étang;
- Etudier les variations saisonnières numériques
des larves, des nymphes et des imagos de Culicidae ;
- Faire la morphologie sommaire des différentes
espèces identifiées.
REVUE DE LA LITTERATURE SUR
LES CULICIDAE
I-1 POSITION DANS LA SYSTEMATIQUE DES
CULICIDAE
Selon Grassé (1961), Boué et Chanton (1962), la
position systématique des Culicidae est la suivante :
Embranchement des Arthropodes (Siebold et Stannus, 1845) :
corps à symétrie bilatérale ;
corps métamérisé et recouvert d'une cuticule
; présence d'appendices articulés.
Sous embranchement des Antennates ou Mandibulates :
présence d'une paire d'antennes à rôle
sensoriel ; présence d'une paire de mandibules.
Classe des Insectes ou Hexapodes :
respiration trachéenne ;
corps divisé en trois tagmes : tête, thorax, abdomen
; trois paires d'appendices locomoteurs.
Sous classe des Ptérygotes :
présence d'ailes au moins à un stade de leur
développement postembryonnaire;
Section des Oligonéoptères :
champ jugal avec une seule nervure longitudinale simple ; ailes
repliées en arrière au repos.
Super ordre des Mécoptéroïdes (Brauer, 1885)
:
pièces buccales de type suceur ou piqueur ; stipes des
maxilles divisés transversalement.
Ordre des Diptères (Linné, 1758) :
présence d'une seule paire d'ailes, les
antérieures, les postérieures étant transformées en
balanciers ;
pièces buccales de type piqueur-suceur ;
tarses pentamères ;
larves apodes à tête généralement peu
ou non différenciées.
Sous-ordre des Nématocères (Latreille, 1825) :
palpes grêles formés de deux à cinq articles
;
antennes longues, filiformes et multiarticulés ;
pronotum séparé du mésonotum par une suture
transverse.
Famille des Culicidae (Latreille, 1825) :
corps recouverts d'écailles filiformes ; repas sanguin
obligatoire chez la femelle ;
appareil buccal avec une trompe allongée, droite et
recourbée, toujours dirigée vers l'avant.
Sous-famille des Anophelinae (Théobald, 1905)
:
trompe dressée en avant, beaucoup plus longue que le reste
du corps ; présence des taches sur les ailes ;
OEuf muni de flotteurs latéraux ;
base de la première nervure alaire sombre ;
scutellum régulièrement courbé au bord
postérieur.
Genre Anopheles (Meigen, 1818) :
taches formées par les écailles claires et sombres
sur la costa ; présence ou non des touffes d'écailles
latérales sur l'abdomen.
Espèce Anopheles funestus (Giles, 1900) :
palpes des femelles avec trois bandes pâles très
étroites ;
costa avec quatre taches pâles, le quart basal
entièrement noir ;
fémurs et tibias entièrement noirs, parfois une
petite tache pâle à l'apex du
tibia.
Espèce Anopheles gambiae (Giles, 1902) :
palpes des femelles avec trois ou quatre bandes pâles ;
costa avec cinq taches pâles dont deux basales ;
tarse antérieur largement annelé et pâle au
niveau des articulations.
Espèce Anopheles moucheti (Evans, 1925) :
palpes lisses, avec trois bandes pâles, bande apicale
pâle impliquant tout le dernier segment ;
costa avec une tache pâle à l'apex de la nervure
anale et d'une tache pâle entre la nervure anale et la base de l'aile
;
présence d'une tache pâle à l'apex des
tarsomères I à IV quatre des pattes.
Espèce Anopheles nili (Théobald, 1904)
:
palpes des femelles étroits, une seule bande pâle
à l'apex ;
costa avec trois taches pâles, dont une basale de petite
taille ;
fémurs et tibias antérieurs, noirs avec parfois une
minuscule tache blanche à l'apex.
Sous-famille des Culicinae :
scutellum trilobé ;
palpes plus courts que la trompe chez les femelles ;
au repos, les adultes se tiennent parallèlement au
support sur lequel ils sont
posés.
Genre Culex (Linné, 1758) :
les adultes n'ont pas de poils spiraculaires ni
post-spiraculaires ;
l'extrémité abdominale des femelles est
tronquée et le premier segment flagellaire des antennes plus court que
chacun des segments suivants.
Espèce Culex duttoni (Théobald, 1901) :
proboscis noir avec un large anneau médian pâle chez
le mâle, noir et intensivement blanc ventralement chez la femelle ;
pas d'écailles sombres;
tarses I à III avec des bandes pâles basales et
apicales chez le mâle ou tibia et tarses I à V avec des bandes
pâles basales et apicales chez la femelle ;
aile sombre .
Espèce Culex quinquefasciatus (Say, 1823) :
proboscis noir parfois pâle ;
écailles présentes et sombres ;
tarse I à III avec des bandes pâles basales et
apicales ; tarse IV et V entièrement pâle ;
ailes sombres.
Espèce Culex tigripes (De grandpré et De
Charmoy1900 ) :
proboscis noir ;
écailles sombres sur le corps et jaunes à la limite
des ailes ;
fémur, tibia et tarse sombres excepté le
fémur de la patte mésothoracique ; aile entièrement sombre
avec des écailles jaunes à leur limite.
Genre Aedes (Meigen, 1818) :
la plupart des femelles portent des griffes tarsiennes
denticulées ;
l'extrémité abdominale est peu effilée et
porte des cerques beaucoup plus long que dans les autres genres.
Espèce Aedes aegypti (Linné, 1762) :
plaques blanches antérolatérales en forme de lyse
;
ligne blanche présente sur le fémur de la patte
médiane ;
tarse I à II des pattes pro et mésothoracique avec
une bande pâle apicale ; tarse I à IV de la patte
métathoracique avec une bande pâle apicale, et tarse v
entièrement pâle.
Espèce Aedes albopictus (Skuse, 1894) :
présence d'une large ligne médiane ;
pas de plaques blanches ;
tibia entièrement sombre, fémur avec une tache
blanche basale ;
tarse I à II des pattes pro et mésothoracique avec
une bande pâle apicale ; tarse I à IV de la patte
métathoracique avec une bande blanche apicale, et tarse V
entièrement pâle.
Espèce Aedes tarsalis (Newstead, 1907) :
présence d'une bande blanche cylindrique sur le proboscis
; présence des taches apicales et subapicales sur les tarses.
Espèce Aedes vittatus (Bigot, 1861) :
présence de cinq paires de plaques blanches
dorso-ventralement ; fémur moucheté avec des bandes blanches
subapicales ;
tarse I à III des pattes pro et mésothoracique avec
une bande blanche apicale ;
tarse I à IV de la patte métathoracique avec une
bande blanche apicale, et tarse V entièrement pâle.
Genre Mansonia (Blanchard ,1901) :
larves fixées à l'aide des siphons aux tiges et aux
racines des plantes aquatiques ;
Sous-famille des Toxorhynchitinae : Genre
Toxorhynchites (Théobald ,1901) :
grande taille ;
non hématophage ;
paré de couleurs brillantes ;
I-2 BIO-ECOLOGIE ET MORPHOLOGIE SOMMAIRE DE DIFFERENTS
STADES DE DEVELOPPEMENT DE CULICIDAE
Le cycle de développement complet des moustiques
comprend quatre stades : l'oeuf, la larve, la nymphe et l'adulte. Les trois
premiers stades de développement (l'oeuf, la larve et la nymphe) sont
aquatiques et le dernier stade (adulte) est aérien. La durée de
vie de chaque stade est conditionnée par des paramètres
environnementaux (Kye, 1999 ; Lyimo et al, 1991).
I-2-1 L'oeuf
Après avoir absorbé du sang, la femelle se pose
sur un endroit abrité pour digérer son repas. Quelques jours plus
tard (3 à 7 jours) selon son espèce, elle pond des oeufs dans
différents milieux aquatiques ou sur un support solide. Les oeufs
peuvent être déposés sur vase bordant un étang
temporaire (Aedes), sur l'eau d'un étang permanent
(Anopheles), sur l'eau de contenants artificiels (Culex). Le
nombre d'oeufs varie en fonction des espèces et de la quantité de
sang absorbée. Dans le genre Aedes, on a environ 100 à
300 oeufs par ponte .Les oeufs du genre Aedes sont plus
résistants à la sécheresse que ceux d'autres moustiques.
Ces oeufs peuvent résister à la dessiccation pendant environ 6
mois (Hawley, 1988 ; Hervé et al., 1998). Dans le genre
Anopheles, on a environ 150 à 400 oeufs par ponte. Les oeufs du
genre Anopheles résistent au froid ; leur résistance
à la chaleur est faible. Une exposition à 40°c pendant
quelques minutes leur est fatale. Leur résistance à la
dessiccation ne dépasse pas 48 heures. Dans le genre Culex, on
a environ 50 à 200 oeufs pondus (Cywinska et al. 2006). Le
développement embryonnaire est fonction de la température
(Rodhain et Perez, 1985).
Les oeufs de moustiques sont de petites tailles d'environ 1 mm
de long. Ces oeufs sont elliptiques, ovoïdes à coque dure et lisse
.Ils peuvent porter ou non des expansions latérales ou apicales servant
de flotteur. La forme des oeufs est variable selon les espèces. Les
oeufs du genre Anopheles sont incurvés aux
extrémités, et pourvus latéralement de deux flotteurs
rempli d'air ,leur permettant de conserver une position horizontale ; ceux du
genre Culex sont agglomérés en nacelles ou barquettes
(Annexe 1), chaque oeuf du genre Culex est muni d'un flotteur
micropylaire en socle .Ces nacelles flottent à la surface de l'eau ; les
oeufs du genre Aedes sont pondus isolément, et sont noirs,
fusiformes, dépourvus de flotteurs latéraux, munis de petites
saillies qui assurent leur stabilité sur le fond de l'eau (Lema, 2000).
Ces oeufs d'Aedes sont entourés d'une épaisse coquille
pourvue au pôle antérieur d'un micropyle (Danis et Mouchet, 1991).
Les oeufs des Culicidae
sont blanchâtres à la ponte et deviennent sombres
24 heures plus tard. L'oeuf comprend de l'intérieur vers
l'extérieur : l'embryon, la membrane vitelline pellucide, un
endo-chorion épais, un exo-chorion plus ou moins pigmenté et
ornementé. La variation de forme, de taille et de coloration sont des
critères utilisés dans la systématique pour
l'identification de certaines espèces.
L'éclosion des oeufs se produit
généralement 2 à 3 jours après la ponte en climat
tropical et 2 à 3 semaines en climat tempéré, et permet
l'obtention des larves.
I-2-2 La larve
La larve est vermiforme, cylindro-conique et apode. Elle a une
croissance discontinue et subit trois mues successives. Il existe donc 4 stades
postembryonnaires (L1,L2,L3 et L4) tous aquatiques. La larve a une
taille d'environ 2 à 12 mm. Elle est mobile et respire à la
surface de l'eau soit directement par des spiracles dorsaux et se
présente parallèlement à la surface de l'eau dans le genre
Anopheles de la sous-famille d'Anophelinae, soit par
l'intermédiaire d'un siphon respiratoire dans les genres Culex
et Aedes de la sous-famille de Culicinae (Robert, 1989), et
la larve est oblique par rapport à la surface de l'eau (Annexe 1). Les
larves peuvent être retrouvées dans toutes les collections d'eau,
les eaux courantes aux fosses, aux creux des arbres ou des rochers , tonneaux,
arrosoirs, boîtes de conserve, récipients abandonnés,
bassins, abreuvoirs, carcasses métalliques, vieux pneus, et autres . Le
choix de l'eau du gîte larvaire varie selon les espèces. Ainsi, le
genre Anopheles affectionne les eaux claires, ensoleillées et
calmes, tandis que les genres Culex et Aedes
préfèrent les eaux polluées. Les larves se nourrissent des
débris organiques et des micro-organismes (algues, bactéries
etc...) (Rodhain et Perez, 1985) grâce aux battements de
ses soies buccales quicréent un courant suffisant pour
aspirer ces aliments. Certaines espèces à l'exemple
de Culex tigripes sont carnivores et s'attaquent
à d'autres larves de Culicidae (Ngagni, 1996).
Le développement post-embryonnaire est fonction de la
température (Lyimo et al., 1991), et la compétition
intraspécifique (Reisen et Emory, 1977). Sa durée est de 4
à 30 jours dans le genre Anopheles de la sous-famille
d'Anophelinae (Mouchet et Carnevale, 1991), et de 4 à 10 jours
dans les genres Aedes et Culex de la sousfamille de
Culicinae (Cywinska et al., 2006).
Les pièces buccales sont de type piqueur-suceur. Le
corps de la larve est divisé en trois régions : la tête, le
thorax et l'abdomen.
La tête est formée de trois plaques chitineuses
unies par des sutures :
Une plaque dorso-médiane unique appelée
Fronto-clypéus avec des soies ; Deux plaques latérales
symétriques dites épicrâniennes.
Dorsalement la tête porte une paire d'antenne, deux
paires d'yeux composées (tâches ocellaires) et ventralement des
palpes maxillaires et les pièces buccales (mandibules, maxilles,
brosses). Les soies les plus intéressantes pour la diagnose se situent
pour la majorité au niveau du clypéus. La tête est capable
d'effectuer une rotation de 180° autour de son axe, qui lui permet de se
nourrir à la surface de l'eau.
Le thorax fait suite au cou, plus large que la tête et
l'abdomen. Sa forme est grossièrement quadrangulaire ; il est
formé de trois segments soudés qui sont : le prothorax, le
mésothorax, et le métathorax.
Les faces ventrale et dorsale sont ornementées de
soies.
L'abdomen est composé de neuf segments distincts dont
les sept premiers portent des soies et sont morphologiquement similaires.
Chacun de ces segments comporte :
Une plaque tergale chitinisée impaire et médiane
;
Des plaques accessoires situées en arrière de la
plaque tergale ;
Des soies palmées postéro-latérales qui
jouent un rôle dans la flottaison de la larve en surface (ces soies sont
formées de folioles dont la forme a été utilisée
comme caractère taxonomique pour certaines espèces, des soies
anté-palmées,
situées en avant et légèrement en dehors
de ces dernières qui ont également une bonne valeur
taxonomique).
Á la partie dorsale du 8e segment se
trouvent deux orifices respiratoires soit directement au niveau du
tégument chez les Anophelinae, soit à
l'extrémité apicale du siphon respiratoire chez les
Culicinae. Ils portent également un peigne constitué
d'un nombre variable d'épines et d'écailles. Sur le 9e
segment, s'insèrent les soies anales et les papilles anales translucides
(Grassé ,1979). Au stade L4, la larve parvenue à son
développement complet, cesse de se nourrir et subit une quatrième
mue donnant une nymphe.
I-2-3 La nymphe
La nymphe est une pupe mobile, apode, en forme de virgule
vivant dans l'eau, caractérisant le stade de repos qui s'intercale entre
la larve et l'adulte Elle est formée d'un céphalothorax globuleux
et d'un abdomen.
Le céphalothorax porte des ébauches des yeux et
des appendices (antennes, trompe, pattes, ailes) .On note aussi l'existence de
deux trompes siphonothoraciques respiratoires par lesquelles la nymphe respire
l'air atmosphérique ou l'air des plantes aquatiques (Grassé,
1979).
L'abdomen est composé de huit segments visibles et d'un
neuvième atrophié, tous portant des soies
caractéristiques. Le 1er segment est muni d'une soie
palmée. Les segments 2 à 7 présentent des soies simples.
Le 8e segment est muni de deux palettes natatoires ainsi qu'une soie
palmée.
Au fur et à mesure qu'approche la fin du stade nymphal,
la morphologie de l'adulte contenue dans l'exuvie devient de plus en plus
visible par transparence. L'augmentation de la pression interne entraîne
un déchirement médio-dorsal de la cuticule du
céphalothorax, permettant l'émergence de l'imago. L'exuvie
nymphale va servir de radeau jusqu'au durcissement complet de la cuticule de
l'adulte. Dès lors, l'adulte reste un instant immobile, le temps que ses
ailes se déploient, puis s'envole. L'émergence dure environ
quinze minutes et représente une phase
délicate dans la vie de l'insecte où survient
une forte mortalité par noyade allant à près de 80% dans
certains cas (Rodhain et Perez, 1985).
La durée du stade nymphal est de 2 à 3 jours.
Elle est ailleurs inversement proportionnelle à la température :
20 jours à 20°c, mais seulement 7 jours à 31°c,
permettent ainsi la compétition de cette phase dans des sites
temporaires. La variation de la pluviosité est un facteur important dans
la productivité nymphale.
Après le stade nymphal, l'insecte subit une
cinquième mue libérant ainsi l'adulte.
I-2-4 L'adulte
L'imago est un petit nématocère fin à
corps allongé de 5 à 10 mm de long. L'adulte mâle et
femelle est nectarivore, mais la femelle est en plus hématophage et la
quantité de sang prélevée fluctue de 4 à 10
mm3 en 1 à 2 minutes. La femelle est attirée par les
odeurs corporelles, le gaz carbonique ou la chaleur émise par leurs
hôtes (Rozendaal, 1999)
L'hématophagie est importante pour la maturation des
oeufs, car la plupart des espèces ont besoin d'apport
supplémentaire en protéines. Elle n'est pas indispensable
à la survie. Il existe néanmoins des espèces dites
autogènes, qui sont capables de produire leur première ponte sans
repas sanguin, et utilisent les réserves énergétiques
accumulées par la larve, à l'exemple de Culex pipiens,
Coquillettidae richiardii, Uranotaenia unguiculata (Cléments,
1963).
Les adultes présentent des préférences
trophiques diverses vis-à-vis des hôtes et l'environnement. Ainsi,
on a des espèces zoophiles (piquent les animaux), anthropophiles
(piquent l'Homme), zoo-anthropophiles (piquent les animaux et l'Homme),
exophages (piquent à l'extérieur) ou endophages (piquent à
l'intérieur des maisons), exophiles (se reposent à
l'extérieur) ou endophiles (se reposent à l'intérieur).
Les femelles sont fécondées peu de temps après
l'éclosion. L'accouplement a lieu soit en plein vol au niveau des
essaims (espèces eurygames),
soit au repos (espèces etenogames). La femelle pond
généralement après le premier repas sanguin. Le nombre de
ponte varie de trois à cinq. La femelle ne s'accouple qu'une seule fois
au cours de son existence. Les spermatozoïdes sont emmagasinés dans
un réceptacle appelé spermathèque dont ils sont extraits
progressivement pour féconder la totalité des oeufs qu'elle
produit pendant le reste de sa vie. Quand la femelle est gravide, elle cherche
un gîte aquatique adapté à la ponte. Le temps qui
s'écoule entre le repas sanguin et la ponte des oeufs s'appelle cycle
gonotrophique. La durée de ce cycle varie de deux à cinq jours
selon les espèces ; elle varie de 48 à 74 heures en zone
tropicale chez le genre Anopheles (Mouchet et Carnevale, 1991). La
longévité de l'adulte varie selon la température,
l'humidité relative de l'air et l'espèce de moustique. En
général, les femelles vivent en moyenne trente à quarante
jours, les mâles trois à quatre jours sous une température
de 25°c à 27°c et une humidité relative de 70% à
80% chez le genre Anopheles (Rodhain et Perez, 1985). Pour certaines
espèces, elle est de trois à quatre semaines (par exemple
Culex pipiens en période estivale), pour les espèces qui
hibernent à l'état adulte, elle peut atteindre et dépasser
six mois (c'est le cas d'Anopheles atroparvus) (Mouchet et Carnevale,
1991). Les moustiques adultes du genre Aedes ne survivent que dans un
climat humide, à des températures supérieures à
22°c jour et nuit, par exemple Aedes aegypti n'est actif que si
la température est supérieure à 23°c.
La distance parcourue dépend de la réserve
d'énergie fournie par le glycogène, synthétisé
à partir du nectar et stocké dans le corps gras et dans les
muscles .La distance maximale parcourue après un repas de nectar est
d'environ 30 km, mais pas forcément en une seule fois, ni une seule
direction. Le rayon d'action est variable selon le sexe et les espèces,
de 1 à 10km quand les conditions atmosphériques sont convenables.
Le mâle a un rayon d'action plus court, par conséquent la
présence d'un grand nombre de mâles indique la proximité
d'un gîte (Bakwo, 2005).
Les moustiques sont de petits nématocères fin
à corps allongé, de 5 à 10 mm de long. Le corps est
subdivisé en trois parties distinctes (la tête, le thorax, et
l'abdomen) recouvertes d'écailles qui aident à l'identification
(Holstein, 1949).
Le tégument est composé de plaques rigides
(sclérites) reliées entre elles par des membranes chitineuses
minces. Chaque métamère (segment du corps) est un anneau
formé d'un tergite (sclérite dorsal) d'un sternite
(sclérite ventral) et de deux pleurites (sclérites
latéraux). Les téguments portent des soies ou des écailles
(ornementations) qui jouent un rôle protecteur en ralentissant
l'évaporation cutanée. La disposition, la couleur des
écailles servent en taxonomie.
La tête est globuleuse et bien dégagée du
thorax. Elle est portée par un cou étroit et porte :
Une paire d'yeux très grands, réniformes et
composés d'yeux élémentaires (ommatidies)
juxtaposées en occupant la majeure partie.
Une paire d'antennes implantées dans la région
faciale formées de plusieurs segments : un bourrelet d'insertion
globuleux, le scape. Un deuxième segment allongé ; le torus qui
renferme l'organe auditif de Johnston (plus développé chez le
mâle) une troisième partie ; le flagellum composé
d'articles en nombre variable selon les sexes. Entre chaque article
s'insèrent des soies courtes chez les femelles (antennes glabres) et
très longues chez les mâles (antennes plumeuses).
La trompe est un organe impair située dans la partie
inféro-médiane. Sa structure est différente selon les
sexes : chez la femelle, hématophage, la trompe est composée :
- De trois pièces impaires qui sont de haut en bas :
l'épipharynx, l'hypopharynx et le labium.
- De quatre pièces paires et symétriques : deux
mandibules en haut, deux maxilles en bas.
Chez les mâles qui ne se nourrissent pas de sang, mais de
sucs végétaux, seuls persistent l'épipharynx et le
labium.
Les autres pièces buccales foreuses sont
atrophiées. Les deux palpes maxillaires situés de part et d'autre
de la base de la trompe, sont des organes tactiles formés de trois ou
quatre articles ; elles sont de même longueur que la trompe. Chez les
mâles, l'extrémité distale est aplatie ou raquettes.
Le thorax est renflé dorsalement et globuleux. Il est
formé de trois segments fusionnés (le prothorax, le
mésothorax, et le métathorax) portant chacun une paire de pattes
articulées composée d'un fémur, un tibia, un tarse
à cinq articles dont le premier est encore appelé
métatarse et le dernier dépourvu de deux griffes ou ongles
égales ou inégales munies (Aedes) ou non d'une ou deux
dents accompagnées (Culex) ou non (Aedes) de pulvilli.
Le prothorax est réduit par rapport au mésothorax qui porte une
paire d'ailes minces et transparentes avec une frange de soies au bord
postérieur à nervures couvertes d'écailles. Le
métathorax porte deux balanciers ou haltères qui sont les
vestiges de la deuxième paire d'ailes ; ces haltères vibrent
rapidement lorsque le moustique est en plein vol ; ils servent d'organes
d'équilibre.
L'abdomen est allongé et a une forme cylindrique. Il
est constitué de dix segments distincts dont huit seulement sont
visibles, portant des écailles chez les Culicinae,
dépourvus (sauf à de rare exception) d'écailles chez les
Anophelinae.
Chez le mâle, le neuvième segment porte
l'armature génitale ou hypygium. Chez la femelle, il porte des cerques
plus ou moins visible. Le bout de l'abdomen est effilé ou tronqué
et sert à l'identification des différents genres de
moustiques.
I-3 LUTTE ANTIVECTORIELLE
La lutte antivectorielle regroupe toutes les méthodes
chimiques, physiques biologiques ou génétiques utilisées
pour rompre la chaîne épidémiologique au niveau d'un
vecteur particulier .La connaissance de la diversité et de la
bioécologie ont permis d'élaborer des stratégies efficaces
de lutte antivectorielle.
Les stratégies adoptées ont pour objectif de
réduire la densité des populations vectrices à un niveau
très bas, ou de limiter le contact Homme-vecteur (Carnevale et Mouchet,
1990).
I-3-1 Lutte contre les oeufs et les larves
L'élimination ou la protection des gîtes potentiels
reste l'un des moyens le plus sûr et le plus efficace pour lutter contre
les moustiques chez les oeufs et les larves.
- Aménagement du territoire
Cette lutte consiste :
* Á drainer des eaux, assécher des marais et
élimination des petits gîtes larvaires ;
* Á changer l'eau des vases à fleurs au moins deux
fois par semaine en nettoyant les tiges et racines des plantes, et les parois
des vases ;
* Á protéger toutes les réserves d'eau
à l'aide de couvercles, toiles, tamis ;
* Á mettre à l'abri ou se débarrasser de
tous les objets susceptibles de contenir de l'eau (pneus, petits
récipients...)
* Á nettoyer régulièrement les caniveaux,
les canaux et gouttières, les abreuvoirs des animaux ;
* Á vérifier que la fosse sceptique fonctionne
convenablement, qu'elle soit en bon état (pas fissuré), et que le
tuyau d'aération soit en hauteur (au-dessus du toit de la maison).
- Lutte chimique
La lutte chimique constitue la base de la majorité des
programmes de lutte. Les méthodes utilisées sont très
pratiques et donnent de bons résultats ; celles-ci comportent une
multitude de composés dont le choix dépend de la cible et du mode
d'application (Guillet, 1994).
Elle consiste à répandre une mince couche de
pétrole, d'éther ou d'huile à la surface des collections
d'eau, à traiter les collections d'eau à l'aide du DDT
(Dichloro-Diphényl-Trichloroéthane),
téméphos (Robert, 1984) ou Capsicum annuum, Zingiber
officinale et Piper nigum (Foko, 2007).
- Lutte biologique
L'utilisation des prédateurs dans la lutte
anti-moustique est pratiquée depuis longtemps. Les larves de moustiques
sont des proies habituelles, d'autres larves d'insectes aquatiques tels que les
odonates, Culex tigripes .Cependant, elles sont aussi les proies de
quelques vertébrés dont les plus promoteurs sont des poissons
larvivores tels que les genres Gambusia, Lebistes, Tilapia (Fletcher
et al. 1992).
L'utilisation des agents pathogènes tels que le
champignon Metarhizium anisopliae (Robert, 1984), les bactéries
de l'espèce histopathologique sur Aedes aegypti montre que les
faits primaires de Bacillus thuringiensis israelensis correspondent
à une désintégration de l'épithélium
intestinal par gonflement, distorsion puis éclatement des cellules
(Barjac, 1978).Bacillus sphaericus dont la souche 2362 lutte contre
Culex quinquefasciatus .
I-3-2 Lutte anti-imago
- Aménagement du territoire
Elle consiste à fixer des grilles métalliques
à mailles fines aux fenêtres des habitations (Desfontaine ,1990),
à débroussailler et faucher les hautes herbes dans un rayon de
400m autour des habitations.
- Lutte chimique
La lutte chimique consiste à utiliser des moustiquaires
imprégnées d'insecticides à longue durée d'action.
L'utilisation des moustiquaires chimiquement imprégnées est de
loin la protection la plus facile, la moins chère et la plus efficace
contre les moustiques adultes. Les moustiquaires doivent être
imprégnées en tenant compte de la rémanence du produit et
le mode d'emploi du fabricant. L'utilisation de moustiquaires
imprégnées réduit de 70% le risque de transmission du
paludisme dans une région où le paludisme est endémique
(Brunetaud, 2008). Afin de la
garder en bon état, la moustiquaire doit toujours
être maintenue attachée ; pour un maximum de protection, s'assurer
qu'elle ne soit pas déchirée ou trouée, sans oublier de
rabattre les bords sous le matelas.
L'insecticide doit être correctement formulé de
manière à optimiser au mieux ses différentes
caractéristiques, de même il doit être efficace,
sélectif, peu couteux et offrir de perspective de résistance.
La lutte chimique consiste aussi à utiliser les
répulsifs biologiques (intervenant dans la protection individuelle) tels
que Curcuma spp (Pitasawat et al., 2003), Conyza newii,
Plectranthus marrubioides, Tetradenia riparia, Tarchonanthus camphoratus,
Lippia javanica et Lippia ukambensis (Omolo et al., 2004), les
répulsifs chimiques dont le plus efficace est le DEET ( N,N
-diéthyl-3- méthylbenzamide ) , les bombes aérosols tels
que Raid (molécules actives : Imiprothrine , deltaméthrine et
esbiothrine ) , Moontiger (molécules actives : Deltaméthrine et
esbiothrine), Oro ( molécules actives : Perméthrine,
téraméthrine et d-fénothrine ) , Baygon (molécules
actives : Cyfluthrine et imiprothrine) , Nofly (molécules actives :
Deltaméthrine et esbiothrine ) , les tortillons fumigènes, les
diffuseurs thermiques, les attractifs pour piéger les insectes, les
insecticides capables d'agir sur la physiologie des insectes, les synergisants
qui augmentent la toxicité des insecticides.
Pour imprégner un tissu ou un tulle moustiquaire, on
calcule tout d'abord le taux de rétention par unité de surface
(à partir d'une surface de 1 m2 si la taille de
l'échantillon le permet). Pour ce faire, on lave tout d'abord
l'échantillon pour enlever d'éventuels apprêts qui
masquerait le pourvoir de rétention réel de l'échantillon.
Après séchage, on trempe dans l'eau pendant 5 min
l'échantillon de tissu préalablement pesé à sec. La
différence de poids entre le tissu sec et le tissu égoutté
donne le volume (donc le poids) de rétention d'eau par m2
(R). Ainsi, en supposant que R soit égal à 100 ml (le volume
moyen est d'environ 64 ml/m2 pour le polyester et de 116
ml/m2 pour le coton) et que l'on veuille imprégner une
moustiquaire à 50 mg/m2, il suffit de préparer une
solution "fille" à 500 mg/l et
d'y prélever 100 ml. Les formulations commerciales
d'insecticides se présentant sous forme de formulation aqueuse, la
solution fille sera obtenue à partir de dilutions successives dans de
l'eau osmosée. L'imprégnation se fera dans une boîte de
pétri dans laquelle l'échantillon aura été
préalablement plié autant de fois que nécessaire. La
solution d'imprégnation, dont le volume correspond à la
capacité spécifique d'absorption de l'échantillon, est
ensuite versée le plus régulièrement possible à
l'aide d'une pipette puis le tissu est légèrement pressé
avec des doigts gantés, et ce à plusieurs reprises pour bien
faire pénétrer l'insecticide dans toutes les couches du tissu (on
s'assurera qu'il ne reste pas de solution non absorbée au fond de la
boîte de Pétri). L'échantillon sera ensuite
séché pendant une semaine et, après le test,
conditionné dans un papier aluminium lui-même placé dans
une pochette plastique scellée et conservée à
température ambiante. Les insecticides recommandés par l'OMS pour
imprégner les moustiquaires sont répertoriés dans le
tableau I.
Tableau I : Insecticides recommandés par
l'OMS pour imprégner les moustiquaires.
|
INSECTICIDES
|
DOSE (mg / m2)
|
|
Alpha-cyperméthrine
|
20-40
|
|
Bifenthrine
|
25
|
|
Cyfluthrine
|
30-50
|
|
Deltaméthrine
|
15-25
|
|
Etofenprox
|
200
|
|
Lambda-cyhalothrine
|
10-20
|
|
Perméthrine
|
200-500
|
- Lutte génétique
La lutte génétique consiste à modifier le
patrimoine génétique des moustiques par stérilisation des
mâles, au moyen des radiations ultraviolettes, de l'hybridation ou de
composés chimiques tels que les antibiotiques, les agents alkylants et
les antimétabolites, à les lâcher ensuite dans la nature
afin qu'ils s'accouplent avec des femelles normales. Ainsi, il en
résultera des oeufs stériles (Morlan et al. 1962 ; Fay
et al. 1963 ; Benedict et Robinson, 2003).
Dans le cadre de la lutte contre la dengue, la seule
méthode efficace reste la limitation de sa propagation en
éliminant au maximum son vecteur, le moustique du genre Aedes.
Une stratégie de lutte biologique originale faisant intervenir des
moustiques mâles de l'espèce Aedes aegypti qui seront
destinés à s'accoupler, mais pas à se reproduire. En
réalité la descendance des femelles sauvages avec lesquelles ils
s'accoupleront mourra au stade nymphal, le but étant de ramener
l'effectif de la population de moustiques autochtones au-dessous du seuil
nécessaire pour que la dengue continue à se transmettre. Cette
technique, dite de l'insecte stérile nécessite de créer
des moustiques génétiquement modifiés afin qu'ils donnent
naissance à une descendance incapable de se reproduire.
MATERIEL ET METHODES
II-1 MATERIEL
II-1-1 Matériel biologique
Le matériel biologique est constitué de larves de
moustiques récoltées dans l'étang du quartier Mairie de
Zoétélé (Cameroun), de janvier à décembre
2006.
II-1-2 Matériel technique
Le matériel technique utilisé pour ce travail est
le suivant :
Assiettes en plastiques de 3L ;
Deux bidons de 10L ;
Une paire de bottes ;
Les aiguilles à papillons ;
Les gants ;
Le saccharose à 10% ;
Une louche en aluminium ;
Les aliments pour larves (Tétra Baby Fish Food) ;
Six gobelets de 0,3L ;
L'alcool à 70° ;
Une boîte de conservation des insectes ;
Le coton hydrophile ;
Le gel de silice ;
Deux aspirateurs à bouche ;
Trois cages cubiques d'un volume de 42875 cm 3 par
cage, enveloppées de Tulle moustiquaire non imprégnée ;
Une loupe binoculaire à chambre claire munie d'un
oculaire micrométrique
WILD, M3Z.

Figure 1: Site d'étude (étang du quartier
Mairie de Zoétélé, 02 janvier 2006).
27
II-1-3 Matériel d'élevage
II-1-3-1 Table
La table est construite en bois mesurant 2m de long, 1m de
large et 1,10m de hauteur .Cette table sert de support aux assiettes en
plastique et les cages destineés à l'élevage des
moustiques. Les 4 supports de la table sont chacun trempés dans un
récipient contenant environ 0,5L d'eau savonneuse .Cette eau
empêche l'action prédatrice des fourmis vis-à-vis des
Culicidae.
II-1-3-2 Cages
Les cages sont de forme cubique et ont de 35cm d'arête.
Ces cages sont faites en bois et recouvertes de tulle moustiquaire non
imprégnée. L'une des faces de la cage possède une
ouverture pourvue d'un manchon par lequel on peut effectuer diverses
manipulations. Les différentes cages sont étiquetées.
II-1-3-3 Eau d'élevage
L'eau d'élevage est l'eau du gîte larvaire
puisé dans l'étang .Elle est transportée au laboratoire
dans des bidons de 10L.
II-1-4 Site d'étude
Le quartier Mairie de Zoétélé
(11°53'40''de longitude Est et 3°15'26''de latitude Nord) est
situé au Nord-est de la ville de Zoétélé, dans le
département du Dja et Lobo, et dans la région du Sud en
forêt équatoriale du Cameroun. La température moyenne
annuelle est de 26, 20°c, la pluviométrie annuelle est de 1814 mm.
Les périodes à forte précipitations sont septembre,
octobre, novembre et mars, avril, juin avec respectivement 820 mm et 671 mm.
Les périodes à faible précipitations sont décembre,
janvier, février et juillet, août avec respectivement 96mm et 227
mm. Ceci correspond effectivement à quatre saisons: deux saisons de
pluie dont une grande
(septembre-novembre) et une petite (mars-juin) alternant avec
deux saisons sèches dont une grande (décembre-février) et
une petite (juillet-août). Son climat est du type guinéen.
L'amplitude thermique est de 3,39°c. (Station météorologique
de Sangmélima 2006).
Notre site de récolte est l'étang situé
à 70 m de la Mairie de Zoétélé et à 500 m du
laboratoire. Cette zone marécageuse offre aux populations des
étendues cultivables où se pratiquent des cultures
maraîchères tout au long de l'année. On y trouve, des
vieilles pirogues, des vieux pneus, des vieux récipients et
approximité une porcherie. La végétation est
constituée d'arbres, arbustes et d'herbes. Ce quartier est peu
peuplé. Ce gîte larvaire est une collection d'eau claire, calme,
ensoleillée et moins riche en matières organiques. L'habitat est
situé à une distance d'environ 5 à 10 m de
l'étang.
Tableau II : Relevés des
précipitations et températures dans la ville de
Zoétélé de Janvier à Décembre 2006 (Station
météorologique de Sangmélima)
|
Mois
Paramètres
|
Jan
|
Fév
|
Mars
|
Avril
|
Mai
|
Juin
|
Juil
|
Août
|
Sept
|
Oct
|
Nov
|
Déc
|
|
Précipitations (mm)
|
15
|
25
|
73
|
154
|
283
|
161
|
96
|
131
|
262
|
328
|
230
|
56
|
|
Température moyenne
(°c)
|
25,36
|
27,95
|
27,26
|
27,82
|
27,47
|
26,07
|
25,77
|
25,39
|
24,56
|
25,04
|
25,72
|
26,02
|
II-2 METHODES
II-2-1 Echantillonnage des larves de Culicidae
De janvier à décembre 2006, nous avons
prélevé des échantillons au hasard à l'aide d'une
louche par la méthode « dipping » (Service ,1993). Les
prélèvements ont lieu de 10 heures à 12 heures à un
rythme bimensuel. Les échantillons sont transportés au
laboratoire dans des bidons non fermés.
II-2-2 Elevage
Les larves sont pipetées, dénombrées et
mises dans des assiettes en plastiques de 3 L contenant l'eau du gîte
larvaire. Cette eau d'élevage est renouvelée tous les deux jours
pour éviter d'asphyxier les larves. Les larves sont ensuite
séparées en fonction de leur position par rapport à la
surface de l'eau : les larves d'Anophelinae adoptent une position
horizontale à la surface de l'eau, tandis que celles de
Culicinae sont plutôt obliques (Annexe 1). Elles sont nourries
avec la Tétra Baby Fish Food. Les nymphes obtenues sont pipetées
tous les deux jours, dénombrées puis placées dans des
gobelets de 0,3L qui sont introduits dans des cages d'émergence. Les
imagos sont nourris à la solution de saccharose à 10%. Les
adultes sont ensuite aspirés à l'aide d'un aspirateur à
bouche et conservés : dans de l'alcool à 70°, dans du gel de
silice et dans les boîtes de conservation des insectes.
II-2-3 Identification morphologique des adultes de
Culicidae
L'identification morphologique des moustiques est faite
à l'aide des clés d'identification spécialisées de
Holstein (1949), Gillies et De Meillion(1968), Gillies et Coetzee (1987) pour
les Anophelinae et Jupp(1996) pour les Culicinae. Les
critères de diagnose sont observés sur une loupe binoculaire
à chambre claire munie d'un oculaire micrométrique WILD, M3Z.
II-2-4 Analyse des données
L'analyse des données est faite à l'aide du
logiciel Excel version 2007. Le test de Fischer(ANOVA) avec le logiciel SPSS 12
.0 est utilisé pour comparer les moyennes et les fréquences.
RESULTATS ET INTERPRETATIONS
III-1 ABONDANCE DES LARVES, DES NYMPHES ET LA RICHESSE
SPECIFIQUE DES ADULTES DE LA FAUNE DE CULICIDAE DE L'ETANG DU QUARTIER
MAIRIE DE ZOETELE EN 2006
III-1-1 Abondance des larves de Culicidae du quartier
Mairie de
Zoétélé en 2006
L'abondance des larves de Culicidae par sous-familles
est représentée dans le tableau 2. Les larves de la sous-famille
d'Anophelinae sont abondantes avec 63,51% tandis que celles de la
sous-famille de Culicinae sont moins abondantes avec 36,59%.
Tableau III : Abondance par sous-familles des
larves de Culicidae de l'étang du quartier Mairie de
Zoétélé en 2006
|
Sous-familles
|
Abondance absolue
|
Abondance relative(%)
|
|
Anophelinae
|
4274
|
63,51
|
|
Culicinae
|
2456
|
36,59
|
|
Totaux
|
6730
|
100
|
III-1-2 Abondance des nymphes de Culicidae du quartier
Mairie de
Zoétélé en 2006
Nous avons répertorié l'abondance de nymphes de
Culicidae par sous-familles et genre dans le tableau 4. Le tableau 4
nous montre que le genre Anopheles est le plus représentatif
avec 64,11%, suivi du genre Culex avec 20,22% et du genre
Aedes avec 15,67%.
D'une manière générale, la sous-famille
d'Anophelinae est la plus abondante avec 3415 individus, tandis que
celle des Culicinae compte 1912 individus.
Tableau IV : Abondance par sous-familles et
genre des nymphes de Culicidae de l'étang du quartier Mairie de
Zoétélé en 2006
|
Sous-familles
|
Genre
|
Abondance absolue
|
Abondance relative
(%)
|
|
Anophelinae
|
Anopheles
|
3415
|
64,11
|
|
Culicinae
|
Culex
|
1077
|
20,22
|
|
Aedes
|
835
|
15,67
|
|
Totaux
|
5327
|
100
|
III-1-3 Richesse spécifique et abondance des imagos
de Culicidae du
quartier Mairie de Zoétélé en
2006
Lors de notre étude entomologique, nous avons obtenu 5033
individus adultes et identifié onze espèces de moustiques :
- quatre espèces du genre Anopheles :
Anopheles moucheti, Anopheles nili, Anopheles gambiae et Anopheles
funestus ;
- trois espèces du genre Culex : Culex
quinquefasciatus, Culex duttoni et Culex tigripes ;
- quatre espèces du genre Aedes : Aedes
albopictus, Aedes aegypti, Aedes tarsalis et Aedes vittatus.
Nous avons répertorié les résultats des
abondances des imagos de Culicidae dans le tableau 4. Parmi ces
adultes de Culicidae L'espèce majoritaire est
Anopheles
moucheti avec 1408 individus (27,98%), tandis que
l'espèce minoritaire est Aedes vittatus avec 52 individus
(01,03%).
Tableau V : Richesse spécifique et
abondance des Culicidae adultes de l'étang du quartier Mairie
de Zoétélé en 2006
|
Sous -familles
|
Genres
|
Espèces
|
Abondance
absolue
|
Abondance
relative (%)
|
|
Anophelinae
(68,11%)
|
Anopheles
(68,11%)
|
Anopheles moucheti
|
1408
|
27,98
|
|
Anopheles nili
|
1019
|
20,25
|
|
Anopheles gambiae
|
655
|
13,01
|
|
Anopheles funestus
|
346
|
06,87
|
|
Culicinae
(31,89%)
|
Culex
(19,23%)
|
Culex quinquefasciatus
|
492
|
09,79
|
|
Culex duttoni
|
354
|
07,03
|
|
Culex tigripes
|
122
|
02,42
|
|
Aedes
(12,66%)
|
Aedes albopictus
|
302
|
06,00
|
|
Aedes aegypti
|
157
|
03,12
|
|
Aedes tarsalis
|
126
|
02,50
|
|
Aedes vittatus
|
52
|
01,03
|
|
Totaux
|
5033
|
100
|
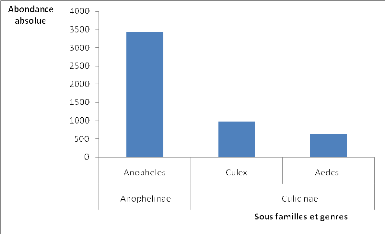
Figure 2 : Abondance absolue des
différentes sous-familles et genres de Culicidae de
l'étang du quartier Mairie de Zoétélé en
2006.
Il ressort de la figure ci-dessus que la sous-famille
d'Anophelinae est la plus représentée avec 3428
individus (68,11%), tandis que celle des Culicinae, la moins
représentée ne compte que 1605 individus (31,89%).
III-2 ABONDANCE MENSUELLE LARVAIRE DES
DIFFERENTS
GENRES DE CULICIDAE DE L'ETANG DU QUARTIER
MAIRIE
DE ZOETELE EN 2006
Au terme de 12 mois de récolte des larves de
Culicidae, nous avons obtenu les résultats illustrés par
le tableau 5 en larves des différents genres de Culicidae.
Le genre Anopheles est le genre le plus productif en
larves de Culicidae durant toute l'année, avec des maxima en
mars, juin et novembre, les minima étant observés en janvier,
février et octobre.
Le genre Culex est moins productif en larves de
Culicidae en janvier, février et mai, et plus productif aux
mois de juillet et novembre.
Les mois les plus productifs en larves de Culicidae du
genre Aedes sont mars et juillet, tandis que janvier, février
et mai sont les mois les moins productifs.
Tableau VI : Abondance mensuelle larvaire par
genre de Culicidae de l'étang du quartier Mairie de
Zoétélé en 2006
|
Mois Genre
|
Jan
|
Fév
|
Mars
|
Avril
|
Mai
|
Juin
|
Juil
|
Août
|
Sept
|
Oct
|
Nov
|
Déc
|
Total
|
%
|
|
Anopheles
|
225
|
201
|
635
|
384
|
374
|
506
|
328
|
398
|
296
|
236
|
420
|
271
|
4274
|
63,51
|
|
Culex
|
23
|
27
|
118
|
123
|
53
|
100
|
167
|
135
|
109
|
116
|
289
|
127
|
1387
|
20,61
|
|
Aedes
|
24
|
19
|
128
|
103
|
35
|
86
|
192
|
106
|
83
|
96
|
100
|
97
|
1069
|
15,88
|
|
Totaux
|
272
|
247
|
881
|
610
|
462
|
692
|
687
|
639
|
488
|
448
|
809
|
495
|
6730
|
100
|
Nous avons répertorié dans le tableau 7,
l'abondance mensuelle des différents stades de développement de
Culicidae. L'abondance du gîte en différents stades de
développement de Culicidae varie toute l'année. Les mois
les plus productifs pour tous les stades de développement sont mars,
novembre et juin, tandis que les mois dont l'abondance est basse sont janvier
et février pour les larves, janvier, février et septembre pour
les nymphes et les adultes.
Tableau VII : Abondance mensuelle des
différents stades de développement de Culicidae de
l'étang du quartier Mairie de Zoétélé en 2006
|
Mois
Stades de développement
|
Jan
|
Fév
|
Mars
|
Avril
|
Mai
|
Juin
|
Juil
|
Août
|
Sept
|
Oct
|
Nov
|
Déc
|
Total
|
|
Larves
|
272
|
247
|
881
|
610
|
462
|
692
|
687
|
639
|
488
|
448
|
809
|
495
|
6730
|
|
Nymphes
|
253
|
237
|
787
|
510
|
327
|
586
|
507
|
552
|
192
|
326
|
610
|
440
|
5327
|
|
Adultes
|
244
|
230
|
742
|
464
|
314
|
564
|
476
|
530
|
158
|
308
|
585
|
418
|
5033
|
Les taux de transformation des différents stades de
développement de Culicidae sont représentés dans
le tableau 8. Le tableau 8 révèle les taux d'émergence
annuels suivants :
- le taux de transformation de larves en nymphes est de 79,49%
;
- Le taux de transformation des nymphes en adultes est de 94,05%
;
- Le taux de transformation des larves en adultes est de
75,22%.
Tableau VIII : Taux de transformation des
différents stades de développement de Culicidae de
l'étang du quartier Mairie de Zoétélé en 2006
|
Mois
Taux de transformation
|
Jan
|
Fév
|
Mars
|
Avril
|
Mai
|
Juin
|
Juil
|
Août
|
Sept
|
Oct
|
Nov
|
Déc
|
Taux annuel
|
|
N/L X 100
|
93,01
|
95,95
|
89,33
|
83,61
|
70,78
|
84,68
|
73,80
|
86,38
|
39,34
|
72,77
|
75,40
|
88,89
|
79,49
|
|
A/N X 100
|
96,44
|
97,05
|
94,28
|
90,98
|
96,02
|
96,24
|
93,88
|
96,01
|
82,29
|
94,48
|
95,90
|
95
|
94,05
|
|
A/L X 100
|
89,70
|
93,12
|
84,22
|
76,06
|
67,96
|
81,50
|
69,29
|
82,94
|
32,38
|
68,75
|
72,31
|
84,44
|
75,22
|
III-3 VARIATIONS SAISONNIERES NUMERIQUES DES LARVES,
DES NYMPHES ET DES IMAGOS DES CULICIDAE
Les différentes variations saisonnières des
abondances de chaque stade de développement de Culicidae sont
représentées dans le tableau 8 ci-dessous. Il apparait que la
petite saison de pluies est favorable à tous les stades de
développement de Culicidae, alors que la grande saison
sèche est moins favorable.
Tableau IX : Evolution saisonnière des
différents stades de développement de Culicidae de
l'étang du quartier Mairie de Zoétélé en 2006
|
Saisons Stades
|
GSS
|
PSP
|
PSS
|
GSP
|
Totaux
|
|
Larves
|
1014
|
2645
|
1326
|
1745
|
6730
|
|
Nymphes
|
930
|
2210
|
1059
|
1128
|
5327
|
|
Adultes
|
892
|
2084
|
1006
|
1051
|
5033
|
III-3-1 Variations saisonnières numériques
des larves de Culicidae
Les variations saisonnières de l'abondance de larves de
chaque genre de Culicidae sont représentées dans le
tableau 9.
Les larves du genre Anopheles présente une
forte abondance pendant la petite saison des pluies (1899 larves).
Le test de Fischer montre qu'il existe une différence
significative (F=4,214 ; ddl=3 ; P=0,046) entre les variations de l'abondance
des larves du genre Anopheles sur les quatre saisons.
Les larves du genre Culex sont plus abondantes
pendant la grande saison des pluies (514 larves). Le test de Fischer montre
qu'il n'existe pas une différence
significative (F= 1,926 ; ddl=3 ; p=0,204) entre les variations
de l'abondance des larves du genre Culex pendant les quatre
saisons.
Le genre Aedes a un grand effectif larvaire pendant
la petite saison de pluies (352 larves). Le test de Fischer nous a permis de
montrer qu'il n'existe pas une différence significative (F=2,736 ; ddl=3
; p=0,113) entre les variations de l'abondance des larves du genre
Aedes sur les quatre saisons.
Tableau X : Evolution saisonnière de
larves de Culicidae par genre de l'étang du quartier Mairie de
Zoétélé en 2006
|
Saisons Genres
|
GSS
|
PSP
|
PSS
|
GSP
|
Totaux
|
F
|
ddl
|
p
|
|
Anopheles
|
697
|
1899
|
726
|
952
|
4274
|
4,214
|
3
|
0,046
|
|
Culex
|
177
|
394
|
302
|
514
|
1387
|
1,926
|
3
|
0,204
|
|
Aedes
|
140
|
352
|
298
|
279
|
106
|
2,736
|
3
|
0,113
|
|
Totaux
|
1014
|
2645
|
1326
|
1745
|
6730
|
|
|
|
III-3-2 Variations saisonnières numériques
des nymphes de Culicidae Les données des variations
saisonnières de l'abondance des nymphes de Culicidae par genre
sont répertoriées dans le tableau 10 ci-dessous.
Les nymphes du genre Anopheles sont plus abondantes
pendant la petite saison de pluies (1581 nymphes). Le test de Fischer montre
qu'il n'existe pas une différence significative (F=2,785, ddl=3 P=0,110)
entre les variations de l'abondance des nymphes du genre Anopheles
pendant les quatre saisons.
Le genre Culex a un grand effectif de nymphes pendant
la grande saison des pluies (345 nymphes). Le test de Fischer nous montre qu'il
n'existe pas une différence
significative (F=0,833 ; ddl=3 ; P=0,512) entre les variations de
l'abondance des nymphes du genre Culex sur les quatre saisons.
Les nymphes du genre Aedes présentent une
forte abondance pendant la petite saison des pluies (298 nymphes. Le test de
Fischer montre qu'il n'existe pas une différence significative (F=2,011
; ddl=3 ; P=0,191) entre les variations de l'abondance des nymphes du genre
Culex sur les quatre saisons.
Tableau XI : Evolution saisonnière de
nymphes de Culicidae par genre de l'étang du quartier Mairie de
Zoétélé en 2006.
|
saisons
Genres
|
GSS
|
PSP
|
PSS
|
GSP
|
Totaux
|
F
|
ddl
|
p
|
|
Anopheles
|
643
|
1581
|
586
|
605
|
3415
|
2,785
|
3
|
0,110
|
|
Culex
|
161
|
331
|
240
|
345
|
1077
|
0,833
|
3
|
0,512
|
|
Aedes
|
126
|
298
|
233
|
178
|
835
|
2,011
|
3
|
0,191
|
|
Totaux
|
930
|
2210
|
1059
|
1128
|
5327
|
|
|
|
III-3-3 Variations saisonnières numériques
des imagos de Culicidae
Les résultats de l'influence des saisons sur l'abondance
des différentes espèces de Culicidae sont
représentés dans le tableau 11.
Le tableau 11 montre que la petite saison sèche est la
plus abondante avec 2084 individus annuels. L'espèce dominante est
Anopheles moucheti avec 1408 individus (27,98%), tandis que
l'espèce la moins abondante est Aedes vittatus avec 52
espèces (01,03%).
Le test de Fischer (ANOVA) montre qu'il n'existe pas une
différence significative entre les variations de l'abondance de toutes
les espèces de Culicidae, sauf chez Aedes aegypti
où la variation est significative (F=4,186 ; ddl=3 ; p=0,047).
Tableau XII : Evolution saisonnière des
différentes espèces de Culicidae de l'étang du
quartier Mairie de Zoétélé en 2006.
|
Saisons
Espèces
|
GSS
|
PSP
|
PSS
|
GSP
|
Totaux
|
F
|
ddl
|
P
|
|
Anopheles moucheti
|
236
|
724
|
198
|
250
|
1408
|
3,258
|
3
|
0,081
|
|
Anopheles nili
|
192
|
454
|
169
|
204
|
1019
|
1,665
|
3
|
0,251
|
|
Anopheles gambiae
|
132
|
277
|
109
|
137
|
655
|
0,515
|
3
|
0,683
|
|
Culex quinquefasciatus
|
78
|
129
|
148
|
137
|
492
|
1,024
|
3
|
0,432
|
|
Culex duttoni
|
57
|
113
|
86
|
98
|
354
|
0,800
|
3
|
0,528
|
|
Anopheles funestus
|
101
|
144
|
28
|
73
|
346
|
1,119
|
3
|
0,397
|
|
Aedes albopictus
|
35
|
94
|
117
|
56
|
302
|
4,031
|
3
|
0,051
|
|
Aedes aegypti
|
19
|
54
|
57
|
27
|
157
|
4,186
|
3
|
0,047
|
|
Aedes tarsalis
|
15
|
43
|
43
|
25
|
126
|
2,967
|
3
|
0,097
|
|
Culex tigripes
|
21
|
35
|
31
|
35
|
122
|
0,593
|
3
|
0,637
|
|
Aedes vittatus
|
6
|
17
|
20
|
9
|
52
|
1,583
|
3
|
0,268
|
|
Totaux
|
892
|
2084
|
1006
|
1051
|
5033
|
|
|
|

III-4 MORPHOLOGIE SOMMAIRE DES IMAGOS DES DIFFERENTES
ESPECES DE CULICIDAE IDENTIFIEES AU QUARTIER MAIRIE DE ZOETELE EN
2006


Caractères sommaires morphologiques :
Les palpes sont lisses avec trois bandes pâles, bande
apicale pâle impliquant tout le dernier segment ; costa avec une tache
pâle à l'apex de la nervure anale et d'une tache pâle entre
la nervure anale et la base de l'aile ; présence d'une tache pale
à l'apex des tarsomères I à IV des pattes.

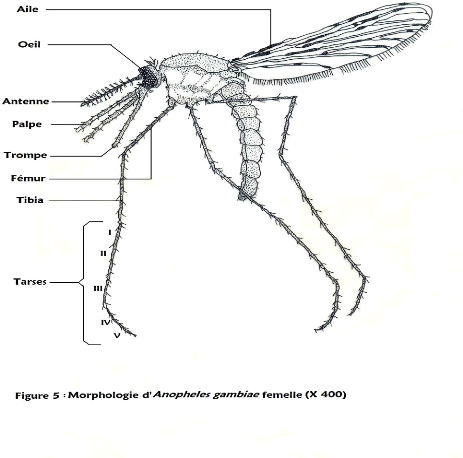
Caractères sommaires morphologiques :
Les palpes des femelles avec trois ou quatre bandes pâles ;
costa avec cinq taches pâles dont deux basales ; tarse antérieur
largement annelé et pâle au niveau des articulations.

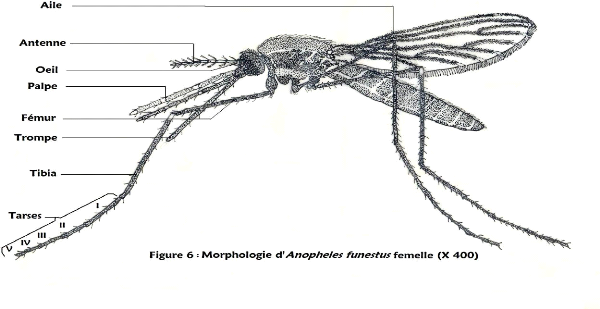
Caractères sommaires morphologiques :
Les pâles de femelles avec trois bandes pâles
très étroites ; costa avec quatre taches pâles, le quart
basal entièrement noir ; fémur, tibia entièrement noirs,
parfois une tache pâle à l'apex du tibia des pattes prothoracique
et métathoracique.
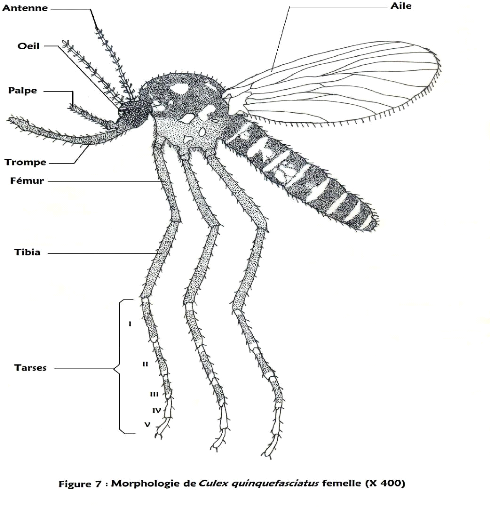
Caractères sommaires morphologiques :
Proboscis noir, parfois pâle ; écailles
présentes et sombres ; tarses I à III avec des bandes pâles
basales et apicales, tarses IV et V entièrement pâle.

Caractères sommaires morphologiques :
Proboscis noir et intensivement blanc ventralement chez la
femelle ; pas d'écailles ; tibia et tarses I à V avec des bandes
pâles basales et apicales chez la femelle.
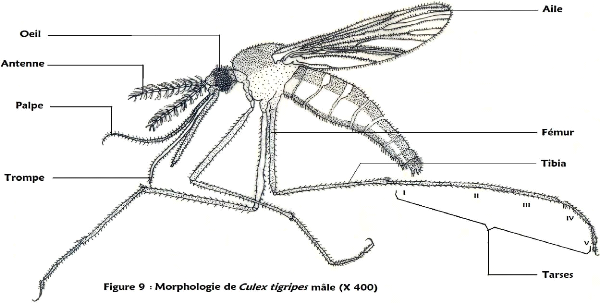
Caractères sommaires morphologiques :
Proboscis noir ; écailles sombres sur le corps et jaunes
à la limite des ailes ; fémur, tibia et tarses sombres
excepté le fémur de la patte mésothoracique ; aile
entièrement sombre avec des écailles jaunes à leur
limite.
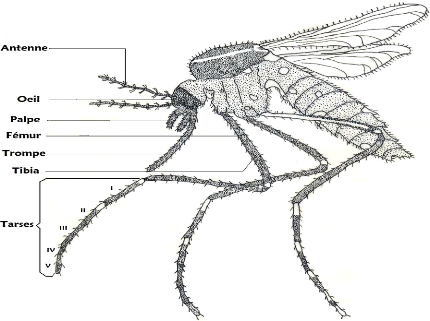

Caractères sommaires morphologiques :
Présence d'une large ligne médiane sur le thorax ;
pas de plaques blanches ; tibia entièrement sombre, fémur avec
une tache pâle basale, avec celui de la patte métathoracique
présentant une ligne blanche ; tarses I à II des pattes pro et
mésothoraciques avec une bande pâle apicale, tarses I à IV
de la patte métathoracique avec une bande pâle apicale, et tarse V
entièrement pâle.

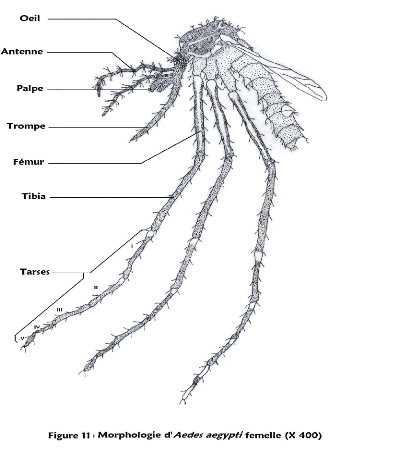
Caractères sommaires morphologiques :
Plaques blanches antérolatérales en forme de
lyse ; ligne blanche présente sur le fémur des pattes ; tarses I
à II des pattes pro et mésothoracique avec une bande pâle
apicale ; tarses I à IV de la patte métathoracique avec une bande
pâle apicale et tarse V entièrement pâle.
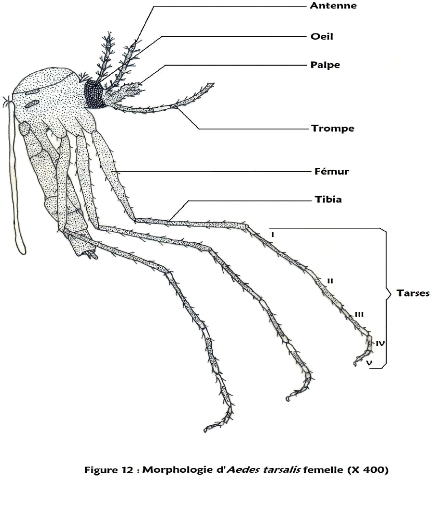
Caractères sommaires morphologiques :
Présence d'une bande blanche cylindrique sur le proboscis
; présence des taches apicales et subapicales sur les tarses.
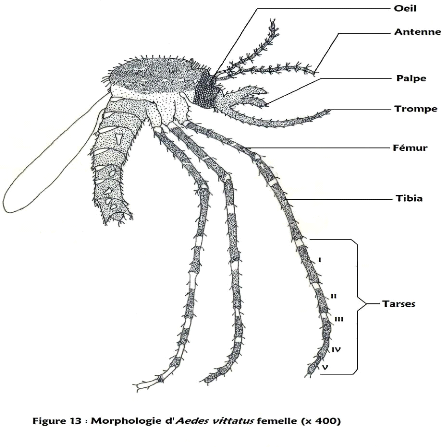
Caractères sommaires morphologiques :
Présence de cinq paires de plaques blanches
dorso-ventralement ; fémur moucheté avec des bandes blanches
subapicales ; tarses I à III des pattes pro et mésothoracique
avec une bande blanche apicale ; tarses I à IV de la patte
métathoracique avec une bande pâle apicale et tarses V
entièrement pâle.
DISCUSSION
De la présente étude, il ressort que les larves
de la sous-famille d'Anophelinae (63,51%) sont plus abondantes
(36,59%), que celles de Culicinae (36,59%). Ces résultats sont
similaires à ceux enregistrés par Akono (2005), qui a
récolté à Nkolbisson (quartier périphérique
de Yaoundé) 62,48% des larves d'Anophelinae et 37,57% de
Culicinae. La forte proportion de la sous-famille
d'Anophelinae à l'étang du quartier Mairie de
Zoétélé s'expliquerait par des conditions du milieu de vie
des larves (collection d'eau claire, calme, ensoleillée et moins riche
en matières organiques) dans cet étang. Ces observations sont par
contre différentes de celles de Ngagni(1996) qui a enregistré
07,80% de larves d'Anophelinae et 92,20% de larves de Culicinae
aux alentours du campus de l'Ecole Normale Supérieure de
Yaoundé et à ceux de Lema (2000) qui a enregistré 03,30%
de larves d'Anophelinae et 96,70% de larves de Culicinae lors
d'une étude culicidienne à Messa, Tongolo , Essos (quartiers de
la ville de Yaoundé ) , car en milieu urbain ,les collections d'eau sont
sombres, polluées et très riches en matières organiques
,et par conséquent propices au développement des
Culicinae .
En effet lorsqu'on récolte beaucoup de larves, il y a
de forte probabilité d'avoir assez de nymphes, malgré les
changements des conditions de vie des larves (milieu de vie, nutrition ...).
Nous avons enregistré 64,11% de nymphes d'Anophelinae et 35,39%
de nymphes de Culicinae. Le taux d'émergence des larves en
nymphes est de 79,49% .Ce taux de transformation est très faible au mois
de septembre car, pendant cette période, nous avons observé le
plus grand nombre de cadavres de larves de Culicidae dans les bacs
d'élevage, mortalité qui serait dû à
l'activité prédatrice de larves de l'espèce Culex
tigripes, mais aussi par la forte compétition
intra-spécifique.
L'abondance des adultes et celle des nymphes étant
synchrones, nous observons également une forte abondance d'imagos de la
sous-famille d'Anophelinae 68,11% par rapport à celle de
Culicinae 31,89%, dont 19,23% du genre Culex et 12,66% du
genre Aedes. Le taux de transformation annuel de nymphes en adultes
est de 94,05%, soit un taux de mortalité de 05,95%. Ce faible taux de
mortalité serait dû au fait que les nymphes ne se
nourrissent pas, et que ce stade de développement est
très court (1 à 2 jours). Lorsque nous comparons ces
résultats à ceux de Benleg (1999) (100% de la sous-famille de
Culicinae ) au campus de l'Université de Yaoundé I ,
Ngagni (1996) (01,78% de la sous-famille d'Anophelinae et 98,22% de la
sous-famille de Culicinae) aux alentours du campus de l'Ecole Normale
Supérieure de Yaoundé ,Wague (2002) (03,53% de la sous-famille
d'Anophelinae et 96,47 % de la sous-famille de Culicinae ) au
quartier Nkomkana , Bakwo (2005) ( 02,79% de la sous-famille d'
Anophelinae et 97,21% de la sous-famille de Culicinae )
étangs de la station aquacole du quartier Obili et Akono (2005) ( 67,85
% de la sous-famille d' Anophelinae et 32,15% de la sous-famille de
Culicinae ) à Nkolbisson, nous constatons que les
Culicinae sont plus abondants dans les quartiers du centre urbain ,
alors que les Anophelinae sont les plus représentés dans
les quartiers périphériques .Ces différences pourraient
s'expliquer par le fait que les collections d'eaux des quartiers des centres
urbains sont plus polluées que celles de la périphérie ,
d'où la distribution des larves des sous-familles de Culicidae.
Nos travaux révèlent que dans la sous-famille
d'Anophelinae, l'espèce Anopheles moucheti est
majoritaire dans l'étang du quartier Mairie de
Zoétélé avec 1408 individus (41,07 %), suivi
d'Anopheles nili avec 1019 individus (29,72 %).Nos observations
rejoignent celles de Le Goff et al. (1993), Njan Nloga et al.
(1993) et Manga et al (1995) faites dans différents
faciès écologiques du Sud-Cameroun. Ces grands effectifs
d'Anopheles moucheti s'expliqueraient par le fait que le vecteur
profite de la dégradation progressive de l'environnement forestier,
ainsi que la création des voies de pénétration en milieu
forestier pour agrandir son implantation dans ce faciès
écologique. Ces observations sont par contre différentes de
celles d'Adam (1956), Languillon et al. (1956) qui ont signalé
Anopheles gambiae comme vecteur principal dans le Sud-Cameroun. La
forte abondance de la sous-famille d'Anophelinae s'expliquerait par le
fait que notre gîte est moins riche en matières organiques, a une
eau claire, ensoleillée associée à la
végétation. Ce gîte ne convient pas à la
sous-famille Culicinae qui se reproduit abondamment dans des eaux
beaucoup plus polluées, chargées de matières organiques.
Dans la sous-famille de
Culicinae, le genre Culex est
majoritairement représenté par Culex quinquefasciatus
(09, 79%), qui est le vecteur principal de la filariose de Bancroft. Le
genre Aedes révèle qu'Aedes albopictus et
Aedes aegypti sont les plus représentées avec
respectivement 06,00% et 03,12% .Ces observations sont semblables à
celles de Nchoutpouen (2003), qui a montré qu'Aedes albopictus
et Aedes aegypti sont prépondérants dans le
Sud-Cameroun, et sont des vecteurs potentiels respectivement de la dengue et de
la fièvre jaune au Cameroun. De même, Chan et al. (1975),
ont montré également qu'Aedes albopictus et Aedes
aegypti sont des espèces majoritaires dans la zone
équatoriale de Singapour.
Nous n'avons pas obtenu les imagos du genre Mansonia
parce que leurs larves vivent au fond de l'eau fixées aux
végétaux aquatiques par leurs siphons respiratoires. Ainsi notre
méthode de récolte « dipping » ne nous a pas permis
d'obtenir ces larves du genre Mansonia.
Au terme de 12 mois, nous avons récolté 6370
larves de Culicidae. Mars, juin, juillet et novembre sont les mois les
plus productifs. Ainsi mars présente un maximum de larves avec 881
individus. Janvier, février, mai et octobre sont les mois les moins
abondants en larves de Culicidae. Les mois les plus chauds sont
février et janvier, alors que mai et octobre sont les mois les plus
pluvieux. Les mêmes observations ont été faites par Bakwo
(2005) qui a enregistré un maximum de larves de Culicidae au
mois de mars (951 larves), février, mai et octobre étant les mois
les moins productifs en larves de Culicidae. La forte abondance des
larves au mois de mars s'expliquerait par l'arrivée des premières
pluies qui reconstituent les parties du gîte préalablement
asséchés, tandis qu'en juin et en novembre le gîte est
relativement calme du fait de la diminution des pluies. La faible abondance en
larves de Culicidae aux mois de janvier et février serait due
à l'assèchement d'une bonne partie du gîte, tandis qu'en
mai et en octobre, les pluies et les vents agitent l'eau du gîte.
Les variations saisonnières numériques des
différents stades de développement de Culicidae ont
fluctué toute l'année 2006. Dans la sous-famille
d'Anophelinae, les larves du
genre Anopheles sont abondantes pendant la petite
saison de pluies (1899 larves) et peu
nombreuses pendant la grande saison sèche (697 larves).
Ceci pourrait s'expliquer par le
fait que pendant la grande saison sèche
l'activité de pêche (faucardage de l'étang) est
intense dans l'étang du quartier Mairie de
Zoétélé. Par contre pendant la petite saison de
pluies,
l'arrivée des pluies reconstitue des parties du gîte larvaire
préalablement asséché et
les activités de pêche sont moins intenses. De
même dans la sous-famille de Culicinae, le
genre Aedes est abondant pendant la petite saison de
pluies (352 larves) et peu abondant pendant la grande saison sèche (140
larves). Les larves du genre Culex sont plus abondantes pendant la
grande saison de pluies (394 larves).
Dans la sous-famille d'Anophelinae, le genre
Anopheles a connu un pic d'abondance en imagos pendant la petite
saison de pluies (1599 adultes).Par contre cette abondance en imagos est faible
pendant la petite saison sèche (504 individus ).Ces observations sont
différentes de celles d'Akono (2005) qui a plutôt
enregistré une grande quantité d'imagos du genre
Anopheles pendant la grande saison sèche , une faible abondance
en imagos lors de grande saison sèche. Dans la sous-famille de
Culicinae, chez le genre Culex, on observe une abondance en
imagos pendant la petite saison de pluies (277 individus).Cependant Culex
quinquefasciatus est abondant pendant la petite saison sèche (148
imagos) .En effet , à cause du faucardage et de l'approximité de
la porcherie , il y a pollution de l'étang à cette
période, ce qui a favorisé la prolifération de cette
espèce , car Culex quinquefasciatus affectionne les eaux
polluées ( Manga et al . 1995 ). De même dans le genre
Aedes, on a connu un pic d'abondance en imagos pendant la petite
saison sèche (237 imagos) à cause du milieu qui devient
pollué à cette période.
I- CONCLUSION
La contribution à la connaissance de la faune
culicidienne réalisée à l'étang du quartier Mairie
de Zoétélé et ses alentours, révèle deux
principales sous-familles de Culicidae : Anophelinae et
Culicinae.
Nous avons recensé 6730 larves, dont 4274 larves de la
sous-famille d'Anophelinae et 2456 larves de la sous- famille de
Culicinae, 5327 nymphes dont 3415 nymphes de la sous-famille
d'Anophelinae et 1912 nymphes de la sous-famille de Culicinae
et 5033 adultes.
La sous-famille d'Anophelinae comprend un seul genre,
le genre Anopheles représenté par Anopheles
moucheti (27,98%), Anopheles nili (20,25%), Anopheles
gambiae (13,01%) et Anopheles funestus (06,87%). La sous- famille
de Culicinae comprend 2 genres :
- Le genre Culex représenté par :
Culex quinquefasciatus (09,79%), Culex duttoni (07,03%),
Culex tigripes (02,42%) ;
- Le genre Aedes représenté par :
Aedes albopictus (06,00%), Aedes aegypti (03,12%), Aedes
tarsalis (02,50 %) et Aedes vittatus (01,03%). Il apparait que
dans cette zone forestière, les vecteurs locaux importants du paludisme
sont Anopheles moucheti, Anopheles nili, Anopheles gambiae et
Anopheles funestus, tandis qu'Aedes albopictus et Aedes
aegypti sont respectivement les vecteurs potentiels de la dengue et de la
fièvre jaune. Culex quinquefasciatus est le vecteur principal
de la filariose de Bancroft .Le développement prolifique de ces vecteurs
serait favorisé par l'écologie de la zone forestière du
Sud - Cameroun.
L'abondance en larves de Culicidae du gîte a
varié toute l'année. Les mois les plus productifs en larves de
Culicidae étant mars, juin et novembre, tandis que les mois les
moins productifs en larves de Culicidae sont janvier et février
pour les larves. Les
nymphes et imagos sont peu nombreux en janvier, février
et septembre. Les activités humaines sur l'étang (faucardage)
auraient un impact sur la productivité en larves de Culicidae.
Le taux de transformation des différents stades de
développement a varié toute l'année. Le taux annuel de
transformation des larves en nymphes est de 79,49%, tandis que celui de la
transformation annuel des nymphes en adultes est 94,05%. Le taux de
transformation annuel des larves en adultes est de 75,22%. Ce taux est
prévisible car, il dépend des transformations des larves en
nymphes d'une part, et des nymphes en adultes d'autre part.
Les quantités de larves, nymphes et adultes par genres
de Culicidae par saisons ont fluctué toute l'année 2006.
Les larves du genre Anopheles et Aedes sont plus abondantes
pendant la petite saison de pluies ; celles du genre Culex sont plus
abondantes pendant la grande saison de pluies. Les nymphes des genres
Anopheles et Aedes connaissent leur pic de
productivité pendant la petite saison de pluies, celle du genre
Culex lors de la grande saison de pluies .Chez les imagos, les genres
Anopheles et Culex sont plus abondantes pendant la petite
saison de pluies, le genre Aedes pendant la petite saison
sèche.
II- PERSPECTIVES
Nous comptons étendre ce travail dans toute la
région du Sud- Cameroun où la transmission du paludisme est
pérenne, en incluant des techniques de biologie moléculaire pour
l'identification spécifique des espèces appartenant à des
groupes ou complexes d'espèces, nous envisageons aussi de mener des
études de phylogénie et de phylogéographie en utilisant
des marqueurs appropriés tels que l'ADN mitochondrial pour mieux
comprendre l'évolution de la distribution géographique des
différentes espèces.
RECOMMANDATIONS
Nous proposons aux populations locales, l'utilisation
prolongée des moustiquaires imprégnées d'insecticides
à longue durée d'action pendant toute l'année,
d'étendre les insecticides larvicides (par exemple le
téméphos) sur l'étang par épandage tous les mois,
et l'aspersion intra-domiciliaire des insecticides sur les murs des maisons par
exemple la lambda-cyhalothrine (ICON 10CS) (Graham et al, 2008).
Adam J.P., 1956. Note faunistique et
biologique sur les Anopheles de la région de Yaoundé et
la transmission du paludisme en zone forestière du Sud -Cameroun.
Bull.Soc.Pathol.Exot.49, 210-220.
Akono N.P., 2005. Etude qualitative et
saisonnière de la faune culicidienne de Nkolbisson
(Yaoundé-Cameroun). Mémoire D.E.A, U.Y.I. 66p.
Bakwo Fils E.M., 2005. Etude qualitative de la
faune Culicidienne des étangs de la station aquacole d'Obili
(Yaoundé-Cameroun). Mémoire D.E.A, U.Y.I 48p.
Barjac D.H., 1978. Un nouveau candidat à
la lutte biologique contre les moustiques : Baccilus thuringiensis
isralensis. Institut Pasteur, Paris: 309-319.
Benedict M.Q., & Robinson A.S., 2003. The
first releases of transgenic mosquitoes: an argument for the sterile insect
technic. Trends in parasitology. Vol 19(8): 349-355.
Benleg., 1999 .Etude taxonomique de la faune
culicidienne larvaire au campus de l'Université de Yaoundé I.
Mémoire D.I.P.E.S II.ENS, U.Y.I.50 p
Boué H., & Chanton R., 1962. La
classe des insectes (Embranchement des arthropodes). Biologie : biologie
animale I : les invertébrés. Masson et Cie. Paris : 482p.
Brunetaud., 2008. Comment lutter contre les
moustiques ? Pathologies et prévention. Bull. Soc. 3,
3-12.
Bruce-Chwatt L.J., 1983. Paludisme et
urbanisation. Bull. Soc.Path. Ex. 76 : 243-249.
Carnevale P., & Mouchet J., 1990. Lutte antivectorielle et
lutte antipaludique. Médecine tropicale. 50:
392-398
Chan K.L., Chan Y.C., & Ho B.C., 1975.
Aedes aegypti (Linné) and Aedes albopictus (skuse)
in Singapour city .Observation in relation to dengue haemorrhagic fever.
Bulletin World Health Organisation.44:651-658.
Cléments A.N., 1963. The physiology of
mosquitoes. Oxford, Pergamon Press, 393 p. Cléments A.N., 2000.
The biology of mosquitoes: Development, Nutrition and Reproduction.
London School of Hygiene and Tropical Medecine CABI publishing. 511
p.
Cywinka A.,F.F Hunter & P.D.N Herbert.,
2006. Identifying canadian mosquitoes species through DNA. Barcodes,
Medical and Veterinary Entomology; 63, 413 - 424.
Danis M., & Mouchet J., 1991. Paludisme Ed.
Ellipses/UREF, Paris. 240 p.
Desfontaine M., 1990. Stratégie et moyens
actuels de lutte antipaludique. Bull. liais. Doc. OCEAC. N°
Spécial. 14 - 19.
Fay R.W., Mc Cray Jr & Kilpatrick J. W.,
1963. Mass production of sterilized male Aedes aegypti.
Mosq. News 23 (3): 210-214.
Fletcher M., Teklehaimanot A., & Yemane G.,
1992. Control of mosquito larvae in the port city of Assab by an
indigenous larvivores fish. Aphanitus dispar; Acta Tropica 52:
155- 156.
Foko D.G. A., 2007. Effet insecticide de
certaines plantes sur les différents stades de développement
d'Anopheles gambiae, Giles 1902 (Diptera Culicidae) vecteur du
paludisme. Thèse de Doctorat/Ph.D, Université de Yaoundé
I.211p.
Gillies M.T.and Coetzee M., 1987.A supplement to
the Anophelinae of Africa South of the Sahara (Afrotropical
region).The South African Institute for Medical Rechearch;55,43-62.
Gillies M.T. & De Meillon B., 1968. The
Anophelinae of African South of the Sahara (Ethiopian zoogeographical
region). The South African Institute for Medical Research, 54,
p 343.
Graham A. M.; H. Dobson.;T. Wiles & P. B. Nkot.;
2008. Integrated vector control- A pilot trial in the Sanaga Valley
Cameroon. Aspect of Applied Biology 84.
International Advances in Pesticide Application, pp.
343-347.
Grassé P.P., 1961. Zoologie I: Les
invertébrés. Masson et Cie Paris : 919 p.
Grassé P.P., 1979.
Anatomie-Systématique-Biologie des Insectes Supérieurs et
Hémiptéroïdes. Tome X. Masson. Pp 1-755.
Guillet P., 1994. Des pyréthrines aux
pyréthrinoïdes. Document dactylographié, Laboratoire des
insectes nuisibles, IRD, Montpellier, France, 8 p.
Hawley w.A., 1988. The biology of Aedes
albopictus. Journal of the American Mosquito Control Association.
4: 1-40.
Hervé J.P., Diarrassouba S. Saracino J., Kone A.
& Carnevale P ., 1998 Epidémisation de la fièvre
jaune : Comportements humains et risques entomologiques. Séminaire
International sur la fièvre jaune en Afrique -Dakar,
Sénégal, 25-27 juin 1998. 37-42. Holstein M.,
1949. Guide pratique de l'anophelisme en A.O.F. Dakar ,Direction
Générale de la Santé Publique .51p.
IRD., 2004. Découverte d'un nouveau
vecteur de paludisme en Afrique. Fiches Scientifiques. 207: 1-2.
Jupp P.G., 1996. Mosquitoes of Southern
Africa: Culicinae and Toxorhynchitinae Hartebeespoort (South
Africa): Ekogilde publischers. 155pp.
Kye O.A., 1999. Influence de quelques
paramètres ioniques (Na+, K+, Cl-, Mg++), pH sur le développement
préimaginal des Culicidae (Anophelinae, Culicinae) en
lumière continue. Mémoire DI.P.E.S II. ENS, U.Y.I. 36 p.
Languillon J., Mouchet J., Rivola E., & Rateau J.,
1956. Contribution à l'étude de
l'épidémiologie du paludisme dans la région
forestière du Cameroun. Paludométrie, espèces
plasmodiales, anophélisme, transmission .Méd. Trop.
16, 347-378.
Le Goff G., Toto J.C., Nzeyimana I., Gouagna L.C.,
& Robert., 1993. Les moustiques et la transmission du paludisme
dans un village traditionnel du bloc forestier Sud- camerounais. Bull.
Liais. Doc. OCEAC, 26 ; 133-137.
Lema E., 2000. Etude qualitative de la faune
culicidienne et son influence sur la prévalence plasmodiale en milieu
urbain et périurbain de Yaoundé. Mémoire DI.P.E.S II. ENS,
U.Y.I. 41 p.
Lyimo E. O., Takken W., & J.C., Koella.,
1991. Effect of rearing temperature and larval survival, age
at pupation and adult size of Anopheles gambiae. Entomol. Exp.
App, 63 : 265- 671.
Malengreau M., 2004. Hygiène Tropicale :
Risques et Prophylaxie. MD 2130. 96 p.
Manga L., Messi J., & Carnevale P., 1995.
Influence des étangs de pisciculture sur la faune culicidienne
du quartier Obili à Yaoundé - Cameroun.
Manga L., Toto J.C., & Carnevale P., 1995.
Malaria vectors and transmission in an area deforested for new
international airport in southern Cameroon. Ann. Soc. Belge. Med.
Trop. 75; 43-49.
Morlan., Harvey B., Mc Cray., Elmo M., Jr and
Kilpatrick J. W., 1962. Field tests with sexually sterile males for
control of Aedes aegypti. Mosq. News 22 (3):
295-300.
Mouchet J., & Carnevale P., 1991. Vectors
and transmission. In Malaria: (ed) Danis M. & Mouchet J., Ellipses/UREF,
Paris. 35-59.
Nchoutpouen E., 2003. Répartition et
biologie d'Aedes albopictus et d'Aedes aegypti, vecteurs
potentiels de la dengue et de la fièvre jaune au Cameroun.
Mémoire D.E.A U. Y.I. 70 p.
Ngagni P., 1996. Faune Culicidienne aux
alentours du campus de l'Ecole Normale Supérieure : Action
prédatrice de Culex tigripes (Lutzia) sur d'autres Culicidae.
Mémoire DI.P.E.S II ENS, U.Y.I. 48 p.
Njan Nloga A., Robert V., Toto J.C., & Carnevale
P., 1993. Anopheles moucheti, vecteur principal du paludisme
au Sud-Cameroun. Bull. Liais. Doc. OCEAC, 26 ;
63-67.
Omolo M.O., Okinyo D., Ndiege I.O., Lwande W.,&
Hassanali A., 2004. Repellency of essential oils of some kenyan plants
against Anopheles gambiae. Phytochemistry 65: 2797- 2802.
OMS., 1999. Programme d'élimination de
la filariose lymphatique. O.M.S. Genève. 01-04. Pitasawat B.,
Choochote W., Tuetun B., Tippawang kosol P., Kanjanapothi D., Jicpakdi A.,
& Riyond D., 2003. Repellency of aromatic turmeric Curcuma
aromatica under laboratory and field condiction. J. vect. Ecol. 28 :
231-240.
Reissen W.K., & R.W. Emory., 1997. The
effects of larval intraspecific competition on imaginal densities and
Anopheles stephensi (Diptera : Culicidae) : A laboratory
evaluation. Can. Ent. 109 : 1481-1484.
Robert V., 1984. Lutte contre les vecteurs du
paludisme. Polycopié. 01-28.
Robert V., 1989. Biologie des anophèles
vecteurs du paludisme en Afrique Centrale. Bull. Liais. Doc. OCEAC
N° 89-90.71-75.
Rodhain F.,& Perez C., 1985. Précis
d'Entomologie médicale et vétérinaire. Maloine. Ed. Paris.
73-153.
Rozendaal J. A., 1999. La lutte antivectorielle
: Méthodes à usage individuel et communautaire. OMS,
Genève .09-46.
Service M .W.,1993. Mosquito ecology:
Field Sampling Methods .Vector Biology and Control (2d Ed.), Liverpool
School of Tropical Medicine. Elsevier Applied Sciences Ed, UK, 988p.
Publishers, London, 583p.
Wague, T.F., 2002. Etude qualitative de la faune
culicidienne à Nkomkana (YaoundéCameroun). Mémoire
D.I.P.E.S II, ENS, U.Y.I. 48p
Annexe 1
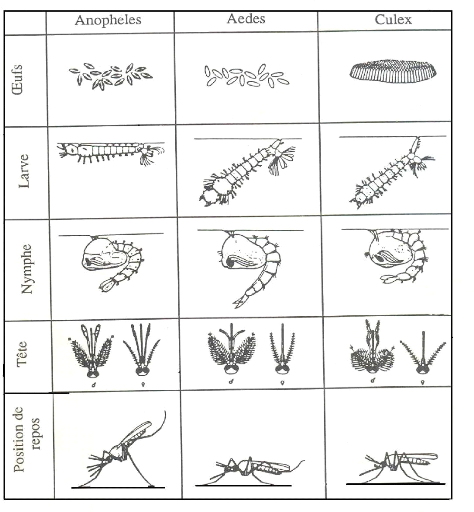
Caractères différentiels des
Anophèles, Aedes et Culex (Danis & Mouchet, 1991)

Annexe 2
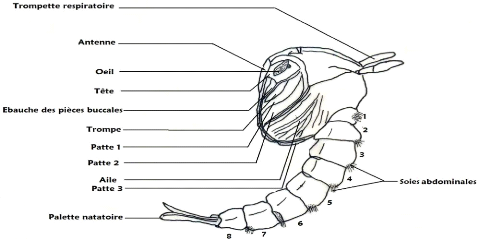
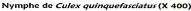
Annexe 3
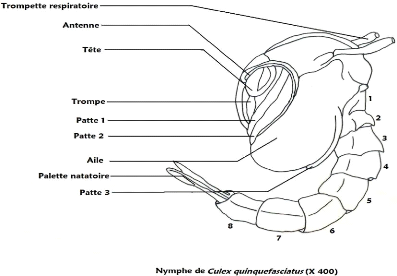
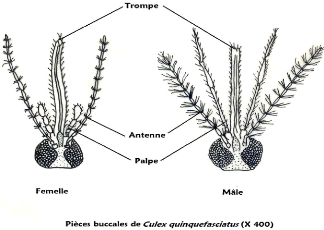
Annexe 4


| 


