|

Université Marien Ngouabi
Institut de
Développement Rural
Département des Sciences de
Développement
Rural
N° d'ordre :
Mémoire de fin d'études pour l'obtention du
Diplôme d'Ingénieur de Développement
Rural
Titre
|
|
Analyse de l'évolution avec l'âge de la
productivité de
trois générations séquentielles des pieds
mères hors sol
|
|
Présenté et soutenu publiquement par
:
LOUBOTA PANZOU Grace Jopaul
Devant le jury :
LOUMETO Jean Joël MAMPOUYA Pierre César
KOUBOUANA Félix MANKESSI François
Professeur, Faculté des sciences Maitre-assistant,
IDR Maitre-assistant, IDR
Docteur Chercheur
Président
Directeur de Mémoire Examinateur
Maître de stage
Table de matières
Liste des abréviations ix
Résumé x
INTRODUCTION 1
1. REVUE BIBLIOGRAPHIQUE 4
1.1. Définition des concepts de base 4
1.2. Multiplication végétative par bouturage 5
1.3. Facteurs limitant l'enracinement adventif 5
1.3.1. Facteurs exogènes 6
1.3.2. Facteurs endogènes 7
1.4. Intérêt et principe du rajeunissement 8
1.5. Présentation de la zone d'étude 11
2. MATERIEL ET METHODES 13
2.1. Matériel végétal 13
2.2. Méthodologie 15
2.2.1. Dispositif expérimental des pieds mères
15
2.2.2. Installation des pieds mères 15
2.2.3. Dispositif expérimental du bouturage 17
2.2.4. Variables étudiées et mesures
effectuées 18
2.3. Analyse des données 18
3. RESULTATS 20
3.1. Productivité 20
3.1.1. Mortalité des pieds mères 20
3.1.2. Analyse de la productivité 21
3.2. Taux de réussite au bouturage 23
3.3. Corrélations 25
3.3.1. Corrélation entre la productivité et la
mortalité des pieds mères 25
3.3.2. Corrélation entre la productivité des
pieds mères et le taux de réussite au
bouturage 25
4. DISCUSSION 26
4.1. Productivité 26
4.1.1. Mortalité des pieds mères 26
4.1.2. Analyse de la productivité 26
4.2. Taux de réussite au bouturage 28
4.3. Corrélations 29
CONCLUSION 30
REFERENCES BIBLIOGRAPHIQUES 32
ANNEXES 37
DEDICACE
Je dédie ce mémoire :
A mon père, Jonas LOUBOTA A ma mère, Pauline
LOUBOTA
A mes frères et soeur : Davy LOUBOTA, Aubry LOUBOTA,
Exaucé LOUBOTA, Junior LOUBOTA, Arielle LOUBOTA, Jacquelle LOUBOTA et
Dieuveille LOUBOTA.
A toute la famille de mon oncle Gaston PANZOU.
« Votre amour a été une précieuse
source de motivation pour tout mon parcours scolaire ».
REMERCIEMENTS
Ce mémoire est le résultat d'un travail qui
s'est déroulé en collaboration entre l'Institut de
Développement Rural et le Centre de Recherche sur la Durabilité
et la Productivité des Plantations Industrielles.
Cette collaboration m'a permis respectivement de mener mes
études théoriques pendant quatre ans et d'effectuer le stage de
fin d'études menant à la rédaction et la soutenance de ce
mémoire.
Je tiens donc à remercier tous ceux qui m'ont aidé
pendant toutes ces années.
Je remercie avec gratitude mes deux co-directeurs de
mémoire, Dr. Pierre César MAMPOUYA et Dr. Aubin SAYA, qui ont
accepté de diriger avec attention ce travail malgré leurs
multiples occupations.
Merci aux membres du jury qui ont accepté de juger ce
travail.
Je remercie le Directeur du CRDPI, Mr. Philippe VIGNERON,
pour m'avoir accueilli au CRDPI et avoir mis à ma disposition les moyens
financiers nécessaires à la réalisation de cette
étude.
J'ai le plaisir de remercier vivement le docteur
François MANKESSI et le doctorant Garel MAKOUANZI, pour leur
participation à l'encadrement de mon stage ; leurs conseils
scientifiques précieux m'ont été d'une grande aide, et
surtout merci pour leur rigueur scientifique qui a contribué à
améliorer la qualité de ce manuscrit.
Je remercie également toute la direction de l'IDR, le
Pr. Fulbert AKOUANGO, Directeur, le Dr. Henri BOUKOULOU secrétaire
académique et tous les chefs de départements. Que les personnels
enseignant et non enseignant de l'IDR trouvent ici toute ma gratitude.
Merci au personnel du CRDPI (permanent et contractuel) ;
chacun a d'une manière ou d'une autre apporté sa contribution
pour la réalisation de ce mémoire. Une mention spéciale
à : Mélanie TOTO, Prudence NDOKI, Bérenger LIKIBI, pour le
bon travail de bouturage et d'éducation des plants à la
pépinière de Kissoko. Mes remerciements chaleureux vont aussi
à l'endroit de François ALLAL, David OKOUO, Alphonse MATSOUMBOU,
André MABIALA, Juste AKANA, Guy KAZOTTY, Célestin KOLI,
Alphonsine MOUZONSO, Serge MAPANGUI, Maurice KENGA, Alpiche DIAMESSO,
Jean-Claude MAZOUMBOU,
Daniel OSSIBI, séraphin DZOMAMBOU, Gerda NGANGA et
Sylvain NGOYI, pour leur soutien multiforme.
Grand merci à tous mes collègues avec qui j'ai
eu à passer mon stage : Jean Urbain NGAMBAKA, Walter MANGOUMBOU, Rommel
DIHAMBANA et Daria OKO. Je ne vous oublierai pas.
Que toute ma promotion de l'IDR trouve ici l'expression de ma
profonde considération. J'ai cité : Aimé MABOUAKA, Franck
NTSOLLANI, Christian MOUANDA, Leticia OKOMBI, Franck NTOUMI, Alban MOUELE,
Aymard NKOUNKOU, Gide MBELOLO, Héritier TCHIKAYA, Flavien NOUNA, Erlich
OBEKI, Gertalie MOULOUNDA, Dolorece NTSIMBA, Hélène DEMBE,
Pascaline FILA, Dimi GATSE.
Enfin, j'exprime mon affectueuse reconnaissance au Cercle
Biblique Evangélique (CBE) et au Groupe Flûtistes
Evangélique (GFE) pour leur soutien moral.
Liste des figures
Figure 1 : principe de rajeunissement des clones d'Eucalyptus
(source : Mankessi, 2010) 9
Figure 2: courbe de pluviométrie 11
Figure 3 : localisation du site expérimental 12
Figure 4: provenance de trois générations 13
Figure 5: provenance des deux témoins 14
Figure 6: dispositif expérimental 15
Figure 7 : disposition des pieds mères dans une caisse
15
Figure 8: stérilisation de la terre humifiée 16
Figure 9: préparation du mélange 16
Figure 10: transplantation 16
Figure 11: étêtage 16
Figure 12: pied mère formé 16
Figure 13 : disposition des boutures dans les caisses 17
Figure 14: taux de mortalité des pieds mères 20
Figure 15: productivité de trois mois de bouturage 21
Figure 16: taux de réussite au bouturage 23
Liste des tableaux
Tableau 1: analyse de variance de la productivité 21
Tableau 2: test de comparaison de moyennes de
productivité selon Bonferroni 22
Tableau 3: analyse de variance du taux de réussite au
bouturage 23
Tableau 4: test de comparaison des taux moyens selon Bonferroni
24
Tableau 5: corrélation entre la productivité et la
mortalité des pieds mères 25
Tableau 6: corrélation entre la productivité et le
taux de réussite au bouturage 25
Tableau 7: calendrier des traitements fongicides et des
fertilisations appliquées aux pieds mères 37
Tableau 8:
Calendrier des traitements fongicides et des fertilisations appliqués
aux boutures
en rhizogenèse 38
Liste des abréviations
B0 Première génération de pieds
mères hors-sol
B1 Seconde génération de pieds mères
hors-sol
B2 Troisième génération de pieds
mères hors-sol
CM Carré moyen
CRDPI Centre de Recherche sur la Durabilité et la
Productivité des Plantations
Industrielles
CV Coefficient de variation
DDL Degré de liberté
EFC Eucalyptus Fibre Congo
F Valeur donnée par le tableau de Fisher
FAO Food Agricultural Organization of United Nations
IDR Institut de Développement Rural
Pr Probabilité statistique
r Coefficient de corrélation
SCE Somme des Carrées des Ecarts
Résumé
La multiplication végétative par bouturage est
fortement limitée par l'enracinement adventif imputable à l'age
physiologique du matériel à multiplier. L'aptitude au bouturage
de trois générations séquentielles des pieds mères
B0, B1 et B2 a été étudiée dans le but
d'évaluer les effets des cascades et réitérations sur le
rajeunissement physiologique des clones d'Eucalyptus urophylla x Eucalyptus
grandis. La productivité et le taux de réussite au bouturage
ont été les principaux paramètres étudiés.
Les résultats obtenus montrent que la productivité évolue
avec l'age et que les générations B1 et B2 rajeunies par cascades
ont les meilleures productivités comparativement à la
génération B0. A trois mois de bouturage, aucune
différence n'a été notée en terme de
productivité entre les générations B1 et B2.
Le taux de réussite au bouturage est élevé
avec les boutures provenant des pieds mères des
générations B1 et B2, plus rajeunis que ceux de la
génération de mobilisationB0.
Ces résultats montrent que l'age physiologique a une
influence sur l'aptitude au bouturage et que les cascades et
réitérations rajeunissent les ortets.
Mots clés : générations
séquentielles, multiplication végétative, ortet,
productivité, rajeunissement.
INTRODUCTION
Au cours de ces vingt dernières années, la
foresterie est devenue un volet important du programme d'action international
relatif aux changements climatiques (FAO, 2011). Afin de répondre
à ces changements climatiques, la génétique
forestière, qui a pour but l'étude de la diversité
génétique pour la préservation de la biodiversité
dans le cas des forêts naturelles et l'amélioration
génétique dans le cas des plantations (Zougab, 2008), occupe une
place de choix.
Des programmes de plantations forestières ont
été mis en place dans plusieurs pays à des fins de
production et/ou de protection. La superficie totale de forêts
plantées en Afrique est d'environ 15 millions d'hectares, soit 2,3% de
la superficie mondiale (FAO, 2011).
De nos jours, le reboisement avec l'Eucalyptus se pratique en
République du Congo. Grâce à la multiplication
végétative par bouturage des rejets de souches (Martin et
Quillet, 1974), 45.000 ha de plantations clonales d'eucalyptus ont
été réalisés avec les hybrides naturels et
interspécifiques dans le massif forestier autour de Pointe-Noire.
L'hybride interspécifique Eucalyptus urophylla x
Eucalyptus grandis, sélectionné avec le schéma de
sélection récurrente réciproque (Vigneron, 1991), demeure
le plus productif de tous les hybrides au champ suivant un seul critère
: la productivité. En effet, un bon nombre de ces clones pourtant
potentiellement productifs s'est révélé réfractaire
au bouturage herbacé c'est-à-dire à partir des rejets de
souches de pleine terre.
Pour mieux exploiter les potentialités des clones de
l'hybride E. urophylla x E. grandis, Saya et Bouvet (1997) avaient
recommandé plusieurs techniques de multiplication
végétative dont la culture in vitro. Après
plusieurs échecs et le fait que la culture in vitro exige de
gros moyens financiers, la multiplication des clones intéressants de
l'hybride E. urophylla x E. grandis a été
développée par la technique de bouturage à partir des
pieds mères installés dans les conteneurs ou bouturage dit «
hors sol » (Mankessi, 2003).
Les recherches sur la multiplication végétative
ont permis de mettre au point des techniques de bouturage industriel (Marien et
Mallet, 2004) qui ont été à la base de gains
génétiques importants et d'une augmentation considérable
de la production (Saya et al., 2008). Le bouturage hors sol se
pratique en utilisant les pieds mères. Cependant, la contrainte de l'age
physiologique de l'ortet soumis au bouturage exige encore une attention
particulière
(Chaperon, 1989 ; Browne et al., 1997). La
multiplication des arbres matures nécessite leur rajeunissement au
préalable (Franclet, 1980) à l'aide des pratiques et des
conditions horticoles précises.
Contexte de l'étude
De la graine à la sénescence, la plante passe
par plusieurs phases ou stades de développement, au cours desquelles
elle extériose une morphologie et une physiologie particulière
(Hackett, 1985; Poethig, 1990). Les plus étudiées de ces phases
et, qui conditionnent la multiplication végétative, demeurent les
phases juvénile et mature (Hackett, 1985). L'état juvénile
se caractérise par l'aptitude à l'enracinement adventif des
boutures, tandis que la floraison est l'indicateur principal de la
maturité physiologique (Borchert, 1976 ; Wareing et Frydman, 1976).
Avec l'age, les plantes ligneuses acquièrent certains
caractères tels que la floraison et en perdent d'autres comme l'aptitude
à l'enracinement adventif des boutures (Walker, 1985). Le processus de
maturation se défini par le passage de la phase juvénile à
la phase mature.
Chez les arbres, la maturation entraîne
généralement une modification de l'age physiologique avec perte
des potentialités juvéniles et constitue ainsi un obstacle majeur
au clonage conforme (Franclet, 1980) en entravant l'initiation et le
développement des racines adventives, étape essentielle de la
multiplication végétative.
Pour beaucoup d'espèces utilisées pour le
reboisement, les boutures issues des jeunes plantes s'enracinent facilement,
alors que celles prélevées sur les plantes matures s'enracinent
difficilement ou presque pas (Fouret et al., 1988, Monteuuis, 1984).
Le processus de maturation s'observe chez toutes les plantes
supérieures, affectant l'aptitude à la reproduction par voie
végétative (Poethig, 1990).
En République du Congo, la multiplication des clones
de l'hybride interspécifique Eucalyptus urophylla x
Eucalyptus grandis, hybride plus productif (40m3/ha/an) que
les hybrides naturels (Vigneron et al., 2006), a longtemps
été confrontée à la maturation physiologique des
ortets (Mankessi et al., 2010). Cet handicap à la production de
plants pour le reboisement, a été solutionnée par le CRDPI
grâce à la mise en place de la technique de production massive de
plants à partir de pieds mères hors sol (Mankessi, 2003 ; Saya
et al., 2008).
La compréhension de l'amélioration aussi bien
de la qualité des plants obtenus que des taux de réussite au
bouturage des pieds mères hors sol a été par la suite la
préoccupation des recherches menées entre les années 2004
et 2010 (Mankessi, 2010). Les résultats de ces recherches corroborent
ceux de nombreux travaux à travers le monde qui soutiennent que le
succès du clonage conforme est fortement dépendant de l'âge
physiologique du matériel soumis à l'enracinement adventif (Slak
et Favre, 1990 ; Browne et al., 1997 ; Hamann, 1998; Trueman et
Richardson, 2007).
Cette étude intitulée « Analyse de
l'évolution avec l'âge de la productivité de trois
générations séquentielles des pieds mères hors sol,
B0-B1-B2 » s'inscrit dans la dynamique des travaux menés au CRDPI
depuis 2001. La définition de la technique de gestion de bouturage
à partir des pieds mères hors sol a pour objectif de poursuivre
la caractérisation macroscopique de l'aptitude au clonage conforme par
l'installation d'un dispositif expérimental en pépinière
permettant de suivre la productivité des pieds mères à
trois générations successives (B0, B1, B2) par cascades et
réitérations sur au moins deux ans.
Objectif principal
L'objectif principal de notre étude est de contribuer
aux critères de sélection des clones de l'hybride Eucalyptus
urophylla x Eucalyptus grandis par la détermination de la
génération des pieds mères la mieux appropriée
à la production des boutures propices à l'enracinement
adventif.
Objectifs spécifiques
Afin de répondre à cet objectif principal, le
présent travail se propose d'étudier :
> L'évolution de la productivité avec l'age des
pieds mères de trois générations séquentielles (B0,
B1, B2) ;
> Le taux de réussite au bouturage des boutures
provenant de trois générations séquentielles (B0, B1,
B2).
Après une revue bibliographique axée sur les
facteurs limitant l'enracinement adventif et les principes de rajeunissement,
nous décrirons la méthodologie employée au cours de cette
étude, pour aborder la présentation et la discussion des
principaux résultats obtenus. Enfin la conclusion et les perspectives de
ce travail de mémoire seront abordées dans la dernière
partie.
1. REVUE BIBLIOGRAPHIQUE
1.1. Définition des concepts de base
Bouturage hors sol
C'est un système de production fondé sur la
culture d'une plante disposée sur un support autre
que le sol en
place, alimenté pour la plupart du temps par une solution nutritive
(Naasz, 2005).
Sa spécificité réside sur le fait qu'il
utilise des pieds mères hors sol ou plants donneurs des boutures
rajeunies.
L'avantage principal de cette reproduction dans le domaine
horticole et forestier est de reproduire fidèlement des
individus-parents (ortets) avec des caractéristiques désirables
pour produire des clones (Bassett, 1993).
Pied mère hors sol
Comparativement au pied mère de pleine terre, un pied
mère hors sol est un donneur de boutures, installé dans un
conteneur et exploité de façon intensive.
Le processus de formation des pieds mères, repose sur la
levée de la dominance apicale qui suscite le débourrement puis
l'émission des axes.
La conduite des pieds mères s'est focalisée sur
la poursuite des tailles réitérées de l'axe principal de
façon à rabattre celui-ci à environ 2 cm du sol, afin de
prélever les boutures proches du système racinaire, pôle le
plus juvénile de la plante selon les concepts de Krenke (1940) et de
Passecker (1947) cité par Mankessi (2005).
Productivité
C'est le nombre de boutures récoltées sur un
pied mère et chaque récolte. La productivité moyenne de
référence trouvée au CRDPI est de l'ordre de 1,5
boutures/pied mère/récolte dans les premiers mois d'installation
des pieds mères.
Rajeunissement
C'est une réacquisition partielle ou totale des
caractéristiques de formes juvéniles (Monteuuis, 1988).
1.2. Multiplication végétative par
bouturage
La multiplication végétative ou clonage est la
méthode de propagation la plus importante, utilisée pour la
production commerciale des plants industriels. Elle consiste à faire une
copie exacte du génome de la plante mère pour la perpétuer
dans de nouveaux individus (Jaenicke et Beniest, 1998). La multiplication
végétative repose donc sur l'aptitude d'un végétal
à pouvoir reconstituer un individu, identique à lui-même,
à partir d'un organe (racine, tige, feuille, ...), d'un tissu ou d'une
cellule (Cornu et Boulay, 1986).
Le bouturage, technique de multiplication
végétative, consiste à couper un fragment, appelé
bouture, d'une pousse ou d'une tige afin de reproduire à l'identique le
pied mère (Hartmann et al., 1997). L'intérêt de la
multiplication végétative par bouturage est de reproduire en un
temps relativement court, de milliers d'exemplaires d'un végétal
donné, qui seront identiques entre eux (Martin, 1977 ; Chaari-Rekhis,
1996 ; Hartmann et al., 1997 ; Ragonezi et al., 2010) et
identique à l'ortet.
La multiplication végétative par bouturage
demeure l'une des techniques les plus utilisées pour reproduire les
espèces de production de bois (Chaperon et Quillet, 1977). Car elle
permet le raccourcissement du cycle de reproductif de l'arbre (Martin,
1977).
La multiplication végétative par bouturage des
plants forestiers est l'une des technologies majeures en matière de
production forestière. La réussite de ce type de reproduction est
conditionnée par la formation des racines adventives (Hartmann et
al., 1997 ; Ragonezi et al., 2010), laquelle est fortement
limitée par plusieurs facteurs.
1.3. Facteurs limitant l'enracinement adventif
L'enracinement adventif est un processus complexe qui se
déroule en trois phases physiologiques successives mais
interdépendantes et répondant à des conditions
d'initiation différentes : l'induction, le déclenchement et
l'expression. (Li et al., 2009 cité par Ragonezi 2010).
La réussite de la multiplication
végétative, plus précisément du bouturage, est
fonction de l'initiation et du développement de l'enracinement adventif
(Thomson, 1992 ; Hudson et al., 1997 cité par Mankessi, 2005).
Le succès de l'enracinement, nécessaire à la
réussite du bouturage (Nivot, 2005) est commandé par un certain
nombre de facteurs variables.
Nous allons rapidement examiner ces facteurs qui peuvent
être exogènes (température, hormone, lumière, ...),
ou endogènes (age physiologique de l'arbre, état physiologique de
l'arbre, ...).
1.3.1. Facteurs exogènes
L'environnement dans lequel sont placées les boutures
joue un rôle important.
Température
La température favorable pour l'enracinement des
boutures varie entre 18 et 27°C (Hartmann et al., 1997 ; Ragonezi
et al., 2010). Les bases températures (inférieures
à 18°C) ne permettent pas l'enracinement des boutures (Jacquiot,
1949). Le maintien d'une température uniforme, même relativement
peu élevée (20°C), constitue la condition la plus favorable
pour l'enracinement des boutures (Cornu et Boulay, 1986).
Lumière
Bien que la photosynthèse ne soit pas
nécessaire lors de l'enracinement des boutures (Hartmann et
al., 1997), le phénomène de photopériodisme a, dans
le cas du bouturage, la même importance qu'il représente en
général dans le développement et la croissance des
végétaux (Jacquiot, 1949). Les intensités lumineuses
requises à la formation de la racine adventive varient de 60 à 80
ìmol.m-2.s-1 (Gomez and Segura 1994 cité
par Ragonezi et al., 2010). Pour les boutures d'Eucalyptus au Congo,
il est nécessaire de placer une ombrièreau dessus de l'aire de
rhizogenèse afin de réduire à moitié les
rayonnements solaires (Saya et al., 2008).
Auxines
Pour l'induction des racines, les hormones de croissance (ou
auxines) jouent un rôle principal en favorisant la croissance des racines
alors que la cytokinine a un effet inhibiteur (Imin et al., 2007). En
horticulture forestière, on utilise souvent l'acide indol-3-butyrique
(AIB) comme auxine pour l'enracinement des boutures (Tousignant et
al., 1996 ; Greenwood et al., 2001). Les résultats obtenus
par Diaz-Sala et al. (1996) et Khelifi et al. (2003) montrent
que le traitement des boutures à l'AIB est indispensable.
Depuis 1935, l'AIB est connu pour effectuer et stimuler
l'enracinement (Arteca, 1996 cité par
Ozel et al., 2006).
Plusieurs rapports indiquent que l'AIB est impliqué dans le
déclenchement
des racines adventives et que la division des racines
initiales dépend de l'auxine exogène ou
endogène (Goldfarb et al., 1998, Greenwood
et al., 2001 ; Rioux et al., 2003 ; Samagula, 2003
cité par Ozel et al., 2006). Mais, la concentration de l'AIB
doit être soigneusement choisie car en surdosage l'AIB induit une
inhibition de l'enracinement (Felipe, 1984 ; Greenwood et Weir, 1994 ; Henrique
et al., 2006).
1.3.2. Facteurs endogènes
Dans la littérature, les facteurs endogènes (en
particulier les facteurs liés à l'âge des arbres) induisent
les effets les plus significatifs sur la variation de l'aptitude à la
formation et au développement de racines adventives. Pour cette partie,
nous allons donc nous concentrer sur le facteur endogène de l'«
âge », choisi pour notre étude.
L'aptitude au bouturage décroît très
rapidement quand l'âge de l'arbre sur lequel sont prélevées
les pousses augmente (Bekkaoui et al., 1983 ; Hamann, 1988 ; Slak et
Favre, 1990). Pour beaucoup d'espèces, 1a faculté d'enracinement
des pousses disparaît au delà de 10 ou 20 ans (Jacquiot, 1949).
Les effets de la maturation peuvent éroder des gains
génétiques faits par choix clonal, et de ce fait constituent un
inconvénient très sérieux pour tout système de
multiplication végétative (Trueman et Richardson, 2007). Car la
multiplication végétative par bouturage est limitée par
l'enracinement qui devient difficile avec l'age (Lindroth et al., 2001
; Shepherd et al., 2005).
L'enracinement des boutures décroît avec
l'augmentation de l'age des pieds mères. Excellent pour les jeunes
semis, l'enracinement adventif est pratiquement nul pour des arbres adultes.
Cette décroissance s'accompagne toujours d'une diminution importante de
la qualité et du développement des boutures.
Pour la technique du bouturage horticole, l'age du pied
mère reste sans doute le paramètre le plus étudié
(Nicolini et Chanson, 1999) car il conditionne la réussite au bouturage
(Cornu et Boulay, 1986 ; Tousignant et al., 1996 ; Harmann, 1998 ;
Mankessi, 2003).
L'age a une signification particulière dans le
développement des plantes (Hartmann et al., 1997). On distingue
trois types d'ages: l'age chronologique, l'age ontogénique et l'age
physiologique (Monteuuis, 1988).
En effet, l'age chronologique, est le temps écoulé
depuis la germination de la graine (Fortanier et Jonkers, 1976), jusqu'à
la mort de la plante.
L'age ontogénique est relatif au développement
spatial de l'individu. Le vieillissement ontogénique est lié au
nombre de divisions opérées par les cellules initiales apicales
(Franclet, 1977).
Enfin, l'age physiologique d'une plante renvoi au stade de
développement dans lequel elle se situe : rhizogenèse adventive,
floraison, sénescence... (Borchert, 1976). Ce type d'age est relatif
à l'état nutritionnel et hormonal des différents
compartiments de la plante, et par conséquent varie avec la
proximité du système racinaire (Beaujard et Galopin, 1999). Donc
le succès de l'enracinement adventif, du clonage conforme des
végétaux ligneux, dépend de l'age physiologique.
Ce phénomène de maturation à une
conséquence majeure sur la multiplication végétative, il
est donc indispensable d'envisager le rajeunissement avant d'entreprendre toute
opération de propagation végétative des ortets matures.
1.4. Intérêt et principe du
rajeunissement
Comme expliqué précédemment, le
bouturage d'arbres adultes ou agés est généralement plus
difficile que le bouturage d'arbres jeunes. Rajeunir le matériel issu
d'arbres agés avant de procéder à sa multiplication
constitue donc un défi majeur pour la production forestière
(Fouret et al., 1988).
Lorsqu'une plante adulte récupère une partie de
ses caractères juvéniles, on parle du rajeunissement (Walker,
1985). Le rajeunissement est donc le retour de la phase adulte en phase
juvénile (Borchert, 1976). Le mouvement maturation qui se traduit par le
passage de l'état juvénile à l'état mature, et
rajeunissement est appelé changement de phase (Monteuuis, 1988).
Le rajeunissement est un phénomène propre au
règne végétal qui s'explique par les
propriétés spécifiques : totipotence,
différenciation, dédifférenciation, et la
rédifférenciation (Galopin et al., 1996 cité par
Mankessi, 2005).
En effet, pour rajeunir un arbre sélectionné
à l'age adulte, on utilise couramment des techniques de rajeunissement
telles que : le bouturage, marcottage, semis, greffage, ... (De champs et
al., 1986).
En 1960, la technique de rajeunissement des Eucalyptus
consistait à recéper des arbres afin de
favoriser
l'émission des rejets de souches (Martin et Quillet, 1974). Les boutures
obtenues à
partir de ce bouturage herbacé avaient un taux de
réussite faible. En vue d'améliorer ce taux de réussite,
une nouvelle technique de rajeunissement a été adoptée
(Marien et Saya, 2003 ; Mankessi, 2003). L'itinéraire technique de
bouturage à partir des pieds mères hors sol permet un
rajeunissement suivant les modes cascades et réitératifs (figure
1).
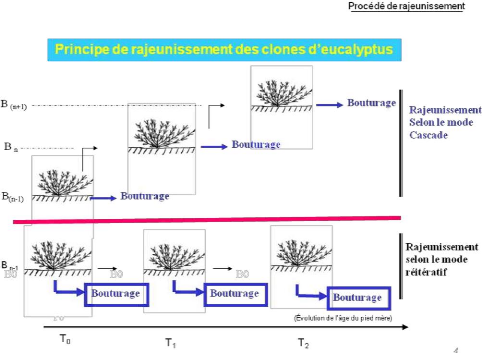
Figure 1 : principe de rajeunissement des clones
d'Eucalyptus (source : Mankessi, 2010)
La technique de rajeunissement par bouturage hors sol se fait
selon deux modes :
v' En mode cascade, basé sur une succession de cycles
de multiplication et selon lequel les dernières boutures
enracinées deviennent les pieds mères où l'on
prélève les boutures requises pour le cycle suivant (Tousignant
et al., 1996). Les cascades consistent en un changement de
générations de pieds mères dans le processus de
rajeunissement (Mankessi, 2010) ;
v' En mode réitératif, les
réitérations correspondent à des tailles
régulières répétées lors
des opérations de récolte ou d'entretien
(Mankessi, 2010). Ces réitérations ralentissent
le vieillissement (Cornu et Verger, 1992). Le bouturage en
réitération est obtenu en sectionnant le bourgeon terminal d'un
jeune plant. Cette section entraîne une ramification de l'axe orthotrope
et produit ainsi une augmentation du nombre de rejets. Cette réaction
peut être amplifiée par un étêtage des nouvelles
pousses (Verhaegen et al., 1992).
La réussite au bouturage des boutures issues de la
cime du plant est de 40 à 50%, celle des boutures
prélevées au milieu du plant est de 60 à 70% et celle des
boutures proches du système racinaire est de 80 à 100% (Hartmann
et al., 1997). L'exploitation de pieds mères hors sol est ainsi
indiquée pour rapprocher l'ensemble des pousses aériennes du
collet donc, du pôle racinaire (Mankessi, 2003) considéré
comme pôle de juvénilité (Franclet, 1977 ; Chaperon, 1989).
D'où l'importance de raccourcir le pied mère hors sol à
une hauteur de 2 à 3 cm du pôle racinaire.
1.5. Présentation de la zone d'étude
Les différents essais de cette étude ont
été menés à la pépinière industrielle
EFC de Kissoko entre octobre 2010 et septembre 2011.
La pépinière de Kissoko (11°59'21"E
4°45'51"S) est située à environ 20 km au Nord-Est de
Pointe-Noire.
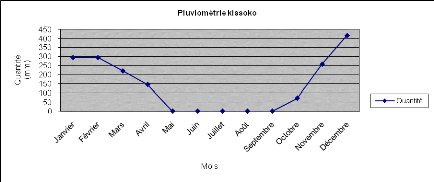
La pluviométrie moyenne au cours de la période de
notre étude a été de 1703,1 mm d'eau. Voici les
pluviométries recueillies dans notre site d'expérimentation
(Figure 2).
Figure 2: courbe de pluviométrie
La figure 3 présente la carte de localisation du site
expérimental (pépinière Kissoko) qui se trouve ci-dessous
:
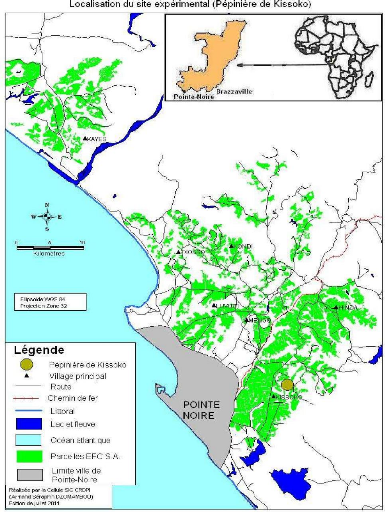
Figure 3 : localisation du site
expérimental
2. MATERIEL ET METHODES
2.1. Matériel végétal
La présente étude a porté sur le clone
18-147 de l'hybride interspécifique E. urophylla x E. grandis.
Ce clone a été sélectionné grâce
à sa productivité qui est meilleure au champ, mais
réputé difficile à la technique de bouturage des rejets de
souches de pleine terre. En plus, le clone 18-147 a fait l'objet, au cours de
ces dix dernières années de nombreuses études sur le
phénomène de maturation physiologique.
Trois générations de pieds mères du clone
18-147 (B0, B1, B2), ont été mobilisées dans le cadre de
cette étude.
La première génération, appelée
B0, provient des plants obtenus à partir de bouturage des rejets de 11
souches du parc à clones R99-02. La mobilisation en pieds mères
hors sol de cette génération a pris cinq mois, de novembre 2010
à mars 2011.
Les pieds mères des générations B1 et B2
ont été obtenues à partir des plants issus du bouturage
des pieds mères hors sol, existant en pépinière et
âgés de trois ans.
Les pieds mères B1 proviennent des pieds mères B0,
installés en juillet 2008 à partir du bouturage des rejets de
souches de la parcelle R99-02.
Les pieds mères B2 proviennent des pieds mères B1,
installés en avril 2009 à partir des pieds mères B0
installés en juillet 2008.
La mobilisation des plants, futures pieds mères, des
générations B1 et B2 a pris trois mois, de janvier à mars
2011. La figure 4 nous montre les provenances de chaque
génération.
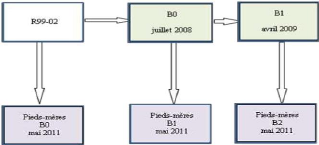
Figure 4: provenance de trois
générations
Dans notre étude, nous avons pris deux témoins
juvéniles.
Le clone 18-147 a pour géniteur, père
Eucalyptus grandis (9.21) et mère Eucalyptus urophylla
(14.74). Les semis du croisement 14.74×9.118 ont une même
mère que le clone 18- 147. Ce sont donc des demi-frères du
18-147, c'est cette raison que nous les avons pris comme témoin
juvénile.
Le premier témoin (T1), de la famille
14.74×9.118, provient des semis des graines obtenues par pollinisation
contrôlée en mai 2010. Les jeunes semis âgés de 2
mois (Figure 5) ont été transplantés en pieds mères
en mai 2011, en même période que les pieds mères du clone
18- 147.
Le second témoin (T2) provient des plants issus des
pieds mères des jeunes semis de la famille 14.63×9.66.Cette famille
a été obtenue par pollinisation contrôlée en 2009,
semée en novembre 2009 et installée en pieds mères en mars
2010. En tout 36 pieds mères ont été mobilisés pour
obtenir les plants utilisés pour ce témoin.
La figure 5 nous montre les provenances des pieds mères
des deux témoins.
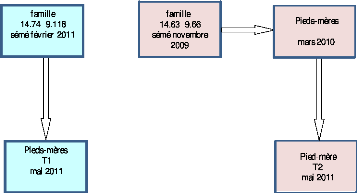
Figure 5: provenance des deux
témoins
2.2. Méthodologie
2.2.1. Dispositif expérimental des pieds
mères
Les pieds mères ont été installés
dans les caisses STUMPS double épaisseur d'une capacité de 35
litres.
Le dispositif expérimental est constitué de
trois blocs complets randomisés dont l'unité expérimentale
est une caisse renfermant 15 pieds mères. Dans chaque bloc,
l'unité expérimentale est répétée deux fois
c'est-à-dire 30 pieds mères ont été
représentées par génération du clone 18-147 ou
témoin. Quatre vingt dix (90) pieds mères par
génération ou témoin, ont été repartis de
façon randomisée dans les trois blocs (Figure 6).

Figure 6: dispositif expérimental
Les caisses ont été numérotées de 1
à 10 (c1 à c10) dans chaque bloc et les pieds mères de
chaque caisse ont été numérotées de 1 à 15
de la manière suivante :
Figure 7 : disposition des pieds mères dans une
caisse
2.2.2. Installation des pieds mères
Les pieds mères ont été installés
dans des caisses STUMPS à un écartement de 12×12 cm, soit
une densité de 625.000 pieds mères à l'hectare.
Les caisses ont été remplies d'un mélange
composé de 80 % de terre humifiée, stérilisée au
préalable par chauffage (Figure 8), et de 20 % de charbon de bois
broyé.
Le substrat a été additionné d'ammonitrate,
un engrais dosé à 21 % d'azote, à la dose de 5kg /
m3. La préparation du mélange se trouve dans la figure
9.

Figure 8: stériisation de la terre Figure 9:
préparation du mélange
humifiée
Les pieds mères ont été
transplantées (Figure 10), étêtées (Figure 11),
formées jusqu'à avoir une touffe de jeunes pousses qui vont
servir de boutures (Figure 12).

Figure 10: transplantation Figure 11:
étêtage Figure 12: pied mère formé
2.2.3. Dispositif expérimental du bouturage
Un mois après installation des pieds mères, la
campagne de bouturage a commencé. Le principe de bouturage consistait
à prélever toute bouture jugée conforme, bouture partant
du pied mère et ayant au moins deux paires de feuilles
chlorophylliennes. Toutes les boutures récoltées sont
transportées dans les récipients contenant de l'eau dans l'aire
d'enracinement.
Les boutures sont repiquées dans les caisses SAPPI,
caisses de volume 1,2 m3, par génération du clone
18-147 ou témoin et par répétition. Les caisses SAPPI,
remplies d'un substrat d'enracinement composé de vermiculite (80%) et du
charbon de bois broyé (20%), pouvaient contenir jusqu'à 49
boutures. Le repiquage des boutures dans les caisses se faisait en vrac, sans
dispositif particulier. Les boutures de chaque génération
étaient insérées dans les caisses selon leur appartenance
de la répétition. Une étiquette était mise à
la fin de chaque lot dans la caisse. La caisse pouvait contenir plusieurs lots
mais bien identifiés.

Figure 13 : disposition des boutures dans les
caisses
Le processus d'enracinement s'est déroulé suivant
deux étapes, correspondant à deux milieux distincts. Il s'agit de
l'aire d'enracinement et l'aire d'élevage.
Dans l'aire d'enracinement, les boutures subissent un
arrosage sous forme de brouillard continu le premier jour du bouturage. Un jour
après repiquage, les boutures subissent une réduction de
l'arrosage pendant vingt quatre jours. L'alimentation hydrique consiste en une
brumisation intermittente de 15 secondes toutes les 10 minutes. L'alimentation
minérale est apportée par des engrais foliaires (NPK 1-1-5,
Hakaphos rouge) à faibles doses. Le calendrier
des traitements fongicides et des fertilisations
appliquées aux boutures dans l'aire d'enracinement se trouve dans les
annexes. L'aire d'enracinement est recouverte d'une ombrière qui
réduit le rayonnement lumineux à 50%.
Après vingt cinq jours dans l'aire d'enracinement, les
caisses contenant les boutures vivantes étaient soulevées pour
vérifier les racines apparentes, et transportées dans l'aire
d'élevage qui se trouve à 100 m. Le séjour dans l'aire
d'élevage correspond à l'étape d'acclimatation des
boutures aux conditions naturelles. Cette étape est dite d'adaptation et
de croissance. Il y a une réduction d'irrigation, un seul arrosage par
jour a été effectué. Les traitements fongicides,
insecticides et des fertilisations ont été
réalisés.
2.2.4. Variables étudiées et mesures
effectuées
Deux variables ont été étudiées :
Productivité, c'est le nombre de boutures par
pied mère et par récolte.
Les récoltes ont été effectuées une
fois par semaine, le même jour, dans tous les blocs. Au total 12
récoltes ont été réalisées.
Taux de réussite au bouturage (Tr), c'est le
rapport entre le nombre de boutures vivants (NBV) à trois mois de
bouturage et le nombre de boutures entrées (NBE) dans l'aire de
rhizogenèse.
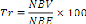
2.3. Analyse des données
Toutes les données ont été
enregistrées dans des fichiers Excel et le traitement des données
a été effectué à l'aide du logiciel SAS (SAS
Institute Inc., 2009).
Les moyennes, les coefficients de variation et les intervalles
de confiance (Dagnelie, 1992) ont été calculés par la
Procédure Univariate.
L'analyse de variance a été faite par la
procédure GLM (General Linear Models). Le modèle à effet
fixe d'analyse utilisé est le suivant :
Xij= u + Bi +Gj+ (B×G)ij+eij
Avec :
Xij= la valeur du caractère étudié
pour l'individu k de la génération j dans le bloc i. p =
moyenne de la totalité des individus ;
Bi= effet fixe du bloc i.
Gj= effet fixe des générations j,
(B×G)ij= interaction bloc i x
générations j, considéré comme fixe ;
eij= résidu, aléatoire N (0,
ó2e);
Les coefficients de corrélation de Pearson ont
été calculés par la procédure CORR.
D'abord, la corrélation entre la productivité et
la mortalité des pieds mères, pour voir si ce n'est pas la mort
des pieds mères qui fait augmenter cette productivité.
En suite, la corrélation entre la productivité des
pieds mères et le taux de réussite au bouturage.
4.
RESULTATS
3.1. Productivité
3.1.1. Mortalité des pieds mères
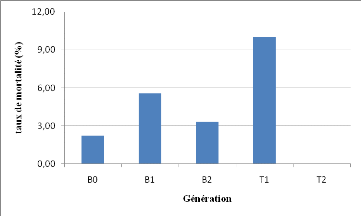
Au cours de trois mois de bouturage la mortalité des
pieds mères a été faible : 19 pieds mères morts sur
450.La figure 13 nous montre la mortalité des pieds mères pour
chaque génération.
Figure 14: taux de mortalité des pieds
mères
Cette figure nous montre que les pieds mères du T1
semblent plus affecter par la mortalité que les autres
générations. Sur 19 pieds mères morts, 9 pour le T1. Aucun
pied mère mort n'a été enregistré pour le cas du
T2.

4
0,10
0,02
3,42
0,0652
2
0,11
0,05
7,84
0,3061
Premier
mois
Générations Blocs
Total 6 0,21
4
0,16
0,04
4,48
0,0342
2
0,01
0,01
1,02
0,4043
Deuxième
mois
Générations Blocs
Total 6 0,17
4
0,67
0,16
5,74
0,0177
2
0,06
0,03
1,13
0,3697
Troisième
mois
Générations Blocs
Total 6 0,73
3.1.2. Analyse de la productivité
Trois âges ont été définis pour
analyser la productivité : au premier mois de bouturage (prod1) ; au
deuxième mois de bouturage (prod2) et au troisième mois (prod3).
Les productivités moyennes de trois mois de bouturage se trouvent dans
la figure 14.
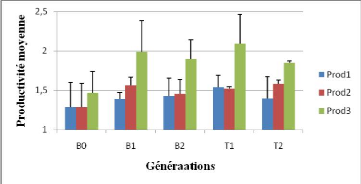
Figure 15: productivité de trois mois de
bouturage
Cette figure montre que la productivité évolue
avec l'âge du pied mère pour toutes les générations
du clone 18-147.
L'analyse de variance de la productivité des trois
premiers mois de bouturage, ne montre aucun effet bloc, mais il ya un effet
génération plus net au troisième mois (Tableau 1).
Tableau 1: analyse de variance de la
productivité
Mois Source DDL SCE CM F Pr > F
Le tableau 1 nous montre que, c'est à partir du
troisième mois de l'exploitation du pied mère, la
productivité est différente selon la génération,
car la probabilité statistique (Pr>F) est égal à
0,017.
Les coefficients de variation sont faibles, CV1=6,07% ;
CV2=6,49% et CV3=9,17% respectivement pour le premier, deuxième et
troisième mois de bouturage.
Les tests de comparaison des moyennes des productivités
de trois premiers mois de
bouturage, réalisés avec le test de
Bonferroni donne un classement de générations (Tableau 2).
Tableau 2: test de comparaison des moyennes de
productivité selon Bonferroni
Générations
|
Productivité
moyenne au
premier
mois
|
Productivité
moyenne au
deuxième
mois
|
Productivité
moyenne au
troisième
mois
|
B0
|
1,29 (a)
|
1,29 (a)
|
1,47 (b)
|
B1
|
1,39 (a)
|
1,56 (a)
|
1,99 (ab)
|
B2
|
1,43 (a)
|
1,46 (a)
|
1,90 (ab)
|
T1
|
1,54 (a)
|
1,52 (a)
|
2,09 (a)
|
T2
|
1,40 (a)
|
1,58 (a)
|
1,85 (ab)
|
|
Ce tableau nous montre l'évolution de la
productivité de toutes les générations avec l'age du pied
mère.
Les pieds mères des T1 ont une productivité
significativement différente de toutes les autres
générations. Ils sont différents des
générations obtenues à partir du bouturage hors sol (B1,
B2 et T2), et de la génération B0, obtenue à partir du
bouturage herbacé (rejets de souche de pleine terre).
A trois mois d'age, les productivités moyennes des pieds
mères des générationsB1, B2 et les témoins (T1 et
T2) sont déjà meilleurs que les B0.
3.2. Taux de réussite au bouturage
Ce paramètre va nous permettre d'apprécier
l'aptitude à l'enracinement des boutures de différentes
générations. Deux taux de réussite ont été
définis, le taux de réussite au premier mois de bouturage (Tr1)
et le taux de réussite des boutures au deuxième mois de bouturage
(Tr2). La figure 15 nous montre le taux de réussite au bouturage de
différentes générations.
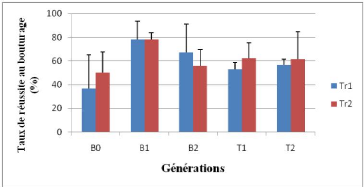
Figure 16: taux de réussite au
bouturage
Le taux de réussite au bouturage est meilleur
(strictement supérieur à 50%) pour les générations
B1 et B2 et les deux témoins pour les deux premiers mois au bouturage,
inférieur ou égal à 50% pour la génération
B0.
L'analyse de variance appliquée au taux de
réussite au bouturage ne montre aucune différence statistiquement
significative entre bloc. Des différences existent entre
génération pour le premier mois de bouturage (Tableau 3).
Tableau 3: analyse de variance du taux de
réussite au bouturage
Mois
|
Source
|
DDL
|
SCE
|
CM
|
F
|
Pr > F
|
Premier
|
Générations
|
4
|
2938,57
|
734,64
|
5,74
|
0,0177
|
mois
|
Blocs
|
2
|
142,48
|
71,24
|
0,56
|
0,5938
|
|
Total
|
6
|
3081,05
|
|
|
|
Deuxième
|
Générations
|
4
|
1306,26
|
326,56
|
3,08
|
0,0824
|
mois
|
Blocs
|
2
|
22,65
|
11,32
|
0,11
|
0,9000
|
|
Total
|
6
|
1328,91
|
|
|
|
|
Les coefficients de variation du premier (CV=19,40) et
deuxième (CV=16,72) mois de bouturage montrent qu'il y a pas une
variation.
Les tests de comparaison des taux moyens de réussite au
bouturage de deux premiers mois, réalisés avec le test de
Bonferroni donne un classement de générations (Tableau 4).
Tableau 4: test de comparaison des taux moyens selon
Bonferroni
Générations
|
Taux de réussite moyen au
premier mois
(%)
|
Taux de réussite moyen au
deuxième
mois (%)
|
B0
|
36,6 (b)
|
50,16 (a)
|
B1
|
78,16 (a)
|
78 (a)
|
B2
|
67,33 (ab)
|
55,66 (a)
|
T1
|
52,83 (ab)
|
62,33 (a)
|
T2
|
56,58 (ab)
|
61,66 (a)
|
|
Les boutures des générations B1 et B2 ont un taux
de réussite meilleur que les boutures de la génération
B0.
3.3. Corrélations
3.3.1. Corrélation entre la productivité et
la mortalité des pieds mères
Aucune corrélation n'a été
trouvée entre la mortalité et la productivité des pieds
mères au premier mois de bouturage (Pr<0,2960), au deuxième
mois de bouturage (Pr<0,8536), et au troisième mois de bouturage
(Pr<0,8494). Les coefficients de corrélation de la mortalité
et la productivité des pieds mères sont présentés
dans le tableau 5.
Tableau 5: corrélation entre la
productivité et la mortalité des pieds mères
Paramètres
|
Productivité au
|
Productivité au
|
Productivité au
|
|
premier mois de
|
deuxième mois de
|
troisième mois de
|
|
bouturage
|
bouturage
|
bouturage
|
Mortalité des pieds
|
r=0,28
|
r=0,05
|
r=0,05
|
mères
|
Pr<0,2960
|
Pr<0,8536
|
Pr<0,8494
|
|
3.3.2. Corrélation entre la productivité des
pieds mères et le taux de réussite au bouturage La
corrélation entre la productivité des pieds mères et le
taux de réussite au bouturage n'a pas été trouvée.
Le tableau 6 donne les coefficients de corrélation entre ces deux
paramètres à des âges différents.
Tableau 6: corrélation entre la
productivité et le taux de réussite au bouturage
Paramètres
|
Productivité au
|
Productivité au
|
Productivité au
|
|
premier mois de
|
deuxième mois de
|
troisième mois de
|
|
bouturage
|
bouturage
|
bouturage
|
Taux de réussite au
|
r = 0,29
|
r = 0,21
|
r = 0,66
|
premier mois
|
Pr<0,2867
|
Pr<0,4458
|
Pr<0,0068
|
Taux de réussite au
|
r = 0,11
|
r = 0,42
|
r = 0,52
|
deuxième mois
|
Pr<0,6703
|
Pr<0,1125
|
Pr<0,0447
|
|
5. DISCUSSION
4.1. Productivité
4.1.1. Mortalité des pieds mères
La faible mortalité des pieds mères des
générations B0, B1, B2 exprime une bonne aptitude
à
résister aux stress dû à des tailles
successives et au bouturage. Autrement dit, les pieds mères
T1 qui sont théoriquement les plus juvéniles et qui
présentent le taux de mortalité le plus élevé
résistent mois au stress due aux tailles successives.
4.1.2. Analyse de la productivité
La productivité évolue avec l'âge du pied
mère. Ce sont les effets des réitérations qui induisent
cette augmentation de productivité. Le pied mère a besoin du
temps pour exprimer ses potentialités. Il ya donc une influence de
l'âge sur la productivité du pied mère comme le rapportent
les travaux de Monteuuis et al. (1995) ainsi que ceux de Mankessi
(2003).
Les pieds mères T1 ont une productivité
supérieure à celles des pieds mères de toutes les autres
générations. La productivité des générations
des pieds mères (B1 et B2) issus des plants hors sol étant
voisine de celle des pieds mères issus des jeunes semis prouve que ces
trois générations ont un niveau de rajeunissement proche. Ainsi
les cascades et réitération adoptées comme moyen de
propagation, rajeunissent les clones d'eucalyptus.
L'évaluation du rajeunissement physiologique induit par
les pratiques des cascades et réitérations a été
faite en comparant la productivité des pieds mères
juvéniles (T1), des pieds mères provenant des plants hors sol et
des pieds mères issus des plants classiques. Les résultats
obtenus ont montré l'influence de l'age sur la productivité des
pieds mères.
En effet, les pieds mères des jeunes semis (T1)
présentent une physiologie très active car
leur
productivité est meilleure, et ceci confirme les
résultats de Makouanzi et Mankessi (2010).
La
supériorité des productivités moyennes au
troisième mois de bouturage des T1 par rapport aux
T2 fait penser que les pieds mères provenant des jeunes
semis (T1) sont plus rajeunis que ceux issus des jeunes semis clonés
(T2).
Les pieds mères T2 ayant une productivité
voisine de celle des générations des pieds mères B1 et B2,
nous pouvons affirmer que les B1 et B2 ont été rajeunis par
cascades et réitérations, bien plus que les B0.
Durant les trois premiers mois de taille des pieds
mères il n'est pas encore facile de distinguer les
générations B1 et B2 en terme de niveau de rajeunissement, leur
productivité étant égale, tandis qu'il est clair que ces
deux générations sont dès ces trois premiers mois plus
rajeunies que la génération B0 (productivités B1 et B2
> B0) et moins bien rajeunies que les semis dont les productivités
à trois mois sont les meilleures de toutes les générations
testées.
La faible productivité de la génération
B0 peut-être attribuée au phénomène de maturation.
En effet, les pieds mères de la génération B0 sont obtenus
à partir des rejets de souche provenant après recépage,
des arbres suffisamment âgés. Get état physiologique de
maturation est transmis aux rejets qui deviennent les pieds mères de la
génération B0. La conséquence de cette maturation est la
faible productivité.
Les résultats de cette étude sont similaires
à ceux rapportés par de nombreux travaux dont ceux de Longman
(1976), Franclet (1980), Monteuuis (1988), Slak et Favre (1990), Browne et
al., (1997), Hamann (1998), Trueman et Richardson (2007), Mankessi
(2010) selon lesquels la maturation limite le clonage conforme. Ainsi, la
procédure des cascades et réitérations mise en place au
GRDPI (Saya et al., 2008) permet de rajeunir physiologiquement les
clones d'eucalyptus.
4.2. Taux de réussite au bouturage
Les boutures issues des pieds mères B1 et B2, issus
eux-mémes d'un rajeunissement par cascade et réitération,
présentent un taux de réussite plus élevé que
celles issues des pieds mères de génération B0. Ceci
corrobore bien avec l'affirmation de Franclet (1977) selon laquelle
l'enracinement adventif est l'un des principaux indices de rajeunissement. Les
pieds mères « rajeunis » B1 et B2 pouvant être rabattue
plus bas que les B0, et plus proches du système racinaire, leurs
boutures s'enracinement facilement que les boutures des pieds mères de
la génération B0, ainsi que l'ont noté Saya et al
2008 et Mankessi et al., 2010.
Les boutures issues des pieds mères de la
génération B0 présentent un taux de réussite au
bouturage qui s'améliore avec le temps. Cela approuve que le
rajeunissement par réitération a des effets sur les pieds
mères issus des plants après maturation.
Plusieurs études ont montrées que la maturation
du matériel végétal entraine une réduction de
l'aptitude à l'enracinement (Hackett, 1985). Nos résultats
confirment bien ces travaux. Ainsi, les boutures provenant des pieds
mères de la génération B0 présentent un taux de
réussite à l'enracinement faible à cause de la maturation
physiologique des pieds mères issus des plants classiques. L'inaptitude
à l'enracinement des boutures est le résultat des plusieurs
facteurs, dont le facteur principal est l'âge physiologique du
matériel soumis à l'enracinement.
4.3. Corrélations
Les coefficients corrélation entre la
productivité et la mortalité des pieds mères sont faibles
pour le premier mois (r=0,28), le deuxième mois (r=0,05) et le
troisième mois (r=0,05). Ce résultat démontre que le fait
de récolter (bien récolter) sur les pieds mères
n'entraîne pas leur mortalité.
Aucune corrélation n'a été trouvée
entre la productivité et le taux de réussite au bouturage,
paramètre qui exprime le mieux l'aptitude à l'enracinement. Ceci
confirme les travaux de Makouanzi et Mankessi (2010) ; la productivité
n'est donc pas forcément un paramètre lié au taux de
réussite au bouturage.
CONCLUSION
L'objectif principal du présent travail était
d'apporter une contribution au processus de création variétale
des eucalyptus au Congo, notamment par la détermination de la
génération de pieds mères la plus productive en ce qui
concerne le bouturage conforme des clones de l'hybride Eucalyptus urophylla
x Eucalyptus grandis.
La multiplication végétative par bouturage des
clones de l'hybride interspécifique Eucalyptus urophylla x
Eucalyptus grandis est fortement limitée par les faibles taux de
réussite au bouturage d'un nombre important de clones performants
crées. Ces limites imputables à la maturation des ortets,
constituent un handicap majeur au clonage conforme des clones d'eucalyptus. En
effet l'utilisation de la multiplication végétative pour le
clonage des arbres forestiers se heurte au problème de la maturation ou
du maintien de la juvénilité (Chaperon, 1989).
Nos résultats approuvent ces études et montrent
l'intérêt du bouturage hors sol comme technique de rajeunissement.
Cette technique a permis de comparer trois générations obtenues
à partir des cascades et réitérations. Tous les pieds
mères des générations provenant des plants issus eux
mêmes des pieds mères hors sol ont une productivité
élevée par rapport aux pieds- mères provenant des plants
classiques. Les trois mois de bouturage n'ont cependant pas montré une
différence significative entre les pieds mères des
générations B1 et B2, différence qui devrait
apparaître à un âge plus avancé des pieds
mères. Il est visible que la productivité évolue avec
l'age.
L'aptitude à l'enracinement montre que les boutures
provenant des pieds mères des générations B1 et B2,
présentent un bon niveau de rajeunissement car elles s'enracinent mieux
que les boutures provenant des pieds mères de la
génération B0.
Cette étude confirme l'influence de l'age physiologique
sur l'aptitude à l'enracinement des boutures de différentes
générations et le rajeunissement effectué a permis
l'amélioration du taux de réussite au bouturage. Les plantations
forestières devraient être réalisées avec des plants
issus des pieds mères hors sol de deuxième (B1) et
troisième génération (B2), car leur productivité
moyenne est bonne (1,5 boutures/récolte/pied mère). Le
rajeunissement est donc un passage nécessaire pour le clonage conforme
des ortets matures (Franclet, 1980).
Les perspectives de recherche devront se focaliser sur la
poursuite de cette étude jusqu'à 12
mois de bouturage, pour
voir l'évolution avec l'age de la productivité de
différentes
générations et afin de définir la
durée d'exploitation d'un pieds mères hors sol. Cette
étude devrait aussi permettre d'avoir des résultats de la
productivité et l'aptitude à l'enracinement sur des effets de
saisons.
La comparaison des plants provenant de trois
générations séquentielles (B0 B1 B2) au champ permettra
aussi de vérifier l'importance du rajeunissement en
pépinière sur la croissance au champ.
REFERENCES BIBLIOGRAPHIQUES
1. Bassett A., 1993. Contribution aux
connaissances sur la multiplication végétative horticole des
Eucalyptus au Congo. Document interne UAIC, 55p.
2. Beaujard F., Galopin G., 1999. Nouvelles
perspectives en multiplication végétative : formation et
exploitation des micros pieds mères. Revue horticole n°400
:64-69.
3. Bekkaoui F., Arnaud Y., Larrieu C., Migniniac E.,
1983.Etude comparative de la rhizogenèse in vitro du
Sequoia sempervirens chez deux clones d'ages différents.
Afocel: 5-25.
4. Borchert R., 1976. The concept of juvenility
in woody plants. Acta Horticulturae 56: 21- 35.
5. Browne R.D., Davidson C.G., Steeves T.A., et
Dunstan D.I., 1997. Effects of ortet age on adventitious rooting of
jack pine (Pinus banksiana) long-shoot cuttings. Canadian Journal
Forest Research 27: 91-96.
6. Chaari-Rekhis A., 1996.Le bouturage
semi-ligneux de quelques variétés d'olivier cultivées en
Tunisie. Revue Ezzaitouna (1 et 2) 2 : 58-64.
7. Chaperon H., 1989. Maturation et
multiplication végétative. Impact sur les sorties
variétales. Document interne UAIC, 24p.
8. Chaperon H. et Quillet G., 1977. Bouturage
des arbres forestiers en République du Congo. Premiers résultats
obtenus par la recherche. CTFT-Congo, 84 p.
9. Cornu D. et Boulay M., 1986. La
multiplication végétative : techniques horticoles et cultures in
vitro. Revue Forestière Française, numéro
spécial (38) : 60-68.
10. Cornu D. et Verger M., 1992. La
multiplication végétative de feuillus précieux et des
clones fournissant des bois figurés. Revue Forestière
Française, numéro spécial (44) : 55- 60.
11. Dagnelie P., 1992. Statistique
théorique et appliquée. Tome 1. Les bases théoriques. Les
presses agronomiques de Gembloux, Belgique, 492p.
12. De champs E., Bekkaoui F., et Cazat T. A., 1986.
Etude de l'utilisation possible du rapport K/Ca comme marqueur de
juvénilité. Afocel: 133-157.
13. Diaz-Sala C., Hutchison K. W., Goldfarb B. et
Greenwood M. S. 1996. Maturation-related loss in rooting competence by
loblolly pine stems cuttings: The role of auxin transport, metabolism and
tissue sensitivity. Physiology Plants, 97: 481-490.
14. FAO, 2011. Situation des forêts du
monde. Rome 2011, 193p.
15. Felipe A., 1984. Enracinement de l'amandier
par bouturage ligneux. Mediterranean Agronomic Institut of Zaragoza II :
97-100.
16. Fortanier E. J., Jonkers H., 1976.
Juvenility and maturity of plants as influenced by their ontogenetical and
physiological ageing. Acta Horticulturae 56 : 37-44.
17. Fouret Y. ; Larrien C. et Arnaud Y., 1988.
Rajeunissement in vitro chez Séquoia sempervirens (Endl.). Afocel :
55-81.
18. Franclet A., 1977. Manipulation des pieds
mères et amélioration de la qualité des boutures.
Afocel : 11-40.
19. Franclet A., 1980. Rajeunissement et
propagation vegetative des ligneux. Afocel : 11-41.
20. Goldfarb B., Hackett W.P., Furnier G.R., Mohn
C.A., Plietzsch A., 1998. Adventittious root initiation in hypocotyls
and epicotyls cuttings of eastern white pine (Pinus strobes)
seedlings. Physiologia plantarum 102: 513-522.
21. Greenwood M.S., Weir R.J., 1994.Genetic
variation in rooting ability of loblolly pine cuttings: effects of auxin and
family on rooting by hypocotyl cuttings. Tree Physiology 15: 41-
45.
22. Greenwood M.S., Cuib X., Xua F., 2001.
Response to auxin changes during maturation-related loss of
adventitious rooting competence in loblolly pine (Pinus taeda) stem
cuttings. Physiology Plants 111: 373-380.
23. Hackett, W.P. (1985). Juvenility,
maturation and rejuvenation in woody plants. Hortic. Rev. 7:
109-155.
24. Harmann A., 1998. Adventitious root
formation in cuttings of loblolly pine (Pinus taeda L.): developmental sequence
and effects of maturation. Trees 12: 175-180.
25. Hartmann T. H., Kester E. D., Davies T. F. Jr.,
Geneve R. L., 1997. Plant propagation: principles and practices.
Sixth edition. Englewood cliff, prentice-hal. 770p.
26. Henrique A., Campinhos E.N., Ono E.O., Zambello
de Pinho S., 2006.Effect of plant growth regulators in the rooting of
Pinus cuttings. Brazilian Archives of Biology and Technology, 49
(2): 189-196.
27. Imin N., Nizamidin M., Wu T., Rolfe B. G.,
2007. Factors involved in root formation in Medicago
truncatula. Journal of Experimental Botany, 58 (3): 439-451.
28. Jacquiot, 1949. Aperçu sur les
problèmes du bouturage en matière forestière. Revue
Forestière Française (5) : 214-223.
29. Jaenicke H. et Beniest J., 1998. La
multiplication végétative des ligneux en agroforesterie. Ed.
sciences forestières 142p.
30. Khelifi L., Khelifi-slaoui M., Morsli A., Laradi
S., Mansouri M., Nedjahi A., 2003. Bouturage ligneux du peuplier de
l'euphrate (Populus euphratica Oliv.). Annales de l'Institut
National Agronomique El-Harrach 1 et 2 (24) : 91-105.
31. Lindroth A.M., Saarikoski P., Flygh G., Clapham
D., Grönroos R., Thelander M., Ronne H., Amold S., 2001. Two
S-adenosyl-methionine-synthetase-encoding genes differentially expressed during
adventitious root development in Pinus contorta. Plant Molecular
Biology 46: 335-346.
32. Longman K.A., 1976. Some experimental
approaches to the problem of phase change in forest trees. Acta
Horticulurae 56: 81-86.
33. Makouanzi G., Mankessi F., 2010.
Multiplication végétative par bouturage des jeunes semis
d'Eucalyptus. Note interne CRDPI, 13p.
34. Mankessi F., 2003. Bouturage horticole
des eucalyptus: gestion et optimisation de la productivité des pieds
mères hors sol. Mémoire d'ingénieur, IDR Université
Marien NGouabi, 68p + annexes.
35. Mankessi F., 2005.Analyse des
paramètres de l'enracinement : Etude comparative entre boutures issues
de différents types de pieds mères. Mémoire DEA,
Faculté des Sciences, Université Marien Ngouabi, Brazzaville
35p + Annexes.
36. Mankessi F., 2010. Etude de l'aptitude
au clonage conforme par bouturage de génotypes d'Eucalyptus urophylla x
Eucalyptus grandis. Thèse de doctorat de l'université Marien
NGouabi, 157p.
37. Mankessi F., Saya A. R., Toto M., Monteuuis O.,
2010. Propagation of Eucalyptus urophylla x Eucalyptus grandis clones
by rooted cuttings: influence of genotype and cutting type on rooting ability.
Propagation of Ornemental Plants n° 1 (10) : 42-49.
38. Marien J.N., Saya A., 2003. Transfert des
gains génétiques en plantation. Cirad info N°133 :
2-3.
39. Marien J.N., Mallet B., 2004. Nouvelles
perspectives pour les plantations forestières en Afrique centrale.
Bois et Forêts des Tropiques n°282 (4) : 67-79.
40. Martin B., 1977. Bouturage des arbres
forestiers. Progrès récents-perspectives de développement.
Revue Forestière Française, 29 (4) : 245-262.
41. Martin B. et Quillet G., 1974. Bouturage
des arbres forestiers au Congo : Résultats des essais effectués
à Pointe-Noire de 1969 à 1973. Bois et Forêts des
Tropiques n° 154 : 41- 59.
42. Monteuuis O., 1984. La multiplication
végétative du séquoia géant en vue du clonage.
Afocel : 139-169.
43. Monteuuis O., 1988. Aspect du clonage de
Séquoias géants (Sequoiadendron giganteum Buchholz)
jeunes et âgés. Culture in vitro d'extrémités
caulinaires. Comparaison des deux types de matériels. Thèse de
doctorat de l'université blaise pascal, 190p.
44. Monteuuis O., Vallauri D., Poupard C., Hazard L.,
Yusof Y., Wahaplatip A., Garcia C., Chauvière M., 1995.
Propagation clonale de tecks (Tectona grandis) matures par bouturage horticole.
Bois et Forêt des tropiques, 243 : 25-39.
45. Naasz R., 2005. Flux couples d'eau et
d'oxygène dans les supports de culture organiques : analyse et
modélisation. Thèse de doctorat, université d'Angers,
367p.
46. Nicolini E.; Chanson B., 1999. La pousse
courte, un indicateur du degré de maturation chez le hêtre
(Fagus sylvatica L.). Canadian Journal botany n°77 :
153-155.
47. Nivot N., 2005. Essais de germination et de
bouturage de six espèces indigènes sciaphytes du Canada.
Mémoire de maitrise, faculté des sciences de l'agriculture et
de
l'alimentation, université Laval, Québec canada,
129p.
48. Ozel A. C., Khawar K. M., Mirici S., Arslan O.,
Ozcan S., 2006.Induction of Ex Vitro Adventitious Roots on
Soft Wood Cuttings of Centaurea tchihatcheffii Fischet Mey using
Indole 3-Butyric Acid and á-Naphthalene Acetic Acid. International
Journal Agricultural Biology, 8 (1): 66-69.
49. Poethig, R.S., 1990. Phase change and the
regulation of shoot morphogenesis in plants. Science 250 : 923-930.
50. Ragonezi C., Klimaszewska K., Castro M. R., Lima
M., Paulo de Oliveira, et Zavattieri M. A., 2010. Adventitious rooting
of conifers: influence of physical and chemical factors.Trees
DOI10.1007/s00468-010-0488-8, 18p.
51. Rioux J.A., Richer C., Lamy M.P., Tousignant D.,
Brassard N., 2003. Propagation végétative de
l'érable à sucre : effets de divers traitements hormonaux ou
chimiques sur l'enracinement de boutures prélevées sur plusieurs
arbres. Canadian Journal of Plant Science 83 : 851-858.
52. SAS (2009) Institute Inc., SAS 9.1.2
Qualification Tools User's Guide, Cary, NC, USA.
53. Saya A., Bouvet J.M., 1997. Analyse des
données sur le bouturage de l'hybride Eucalyptus urophylla x
Eucalyptus grandis de 1980 à 1996. Document interne UR2PI,
Pointe-Noire Congo, 4p. + annexes.
54. Saya R.A., Mankessi F., Marien J.N., Monteuuis
O., Toto M., 2008. Advances in mass clonal propagation of
Eucalyptus urophylla × Eucalyptus grandis in Congo. BFT
n°297, (3): 15-25.
55. Shepherd M., Mellick R., Toon P., Dale G.,
Dieters M., 2005. Genetic control of adventitious rooting on stem
cuttings in Pinus elliottii x P. caribaeahybrid families. Annals
Forest Sciences, 62: 403-412.
56. Slak M.F. et Favre J.M., 1990.
Possibilités actuelles de la multiplication
végétative chez les chênes. RFF : 220-226.
57. Tousignant D., Périnet P., Rioux M., 1996.
Le bouturage de l'épinette noire à la
pépinière de Saint-modeste. Rapport le bouturage,
45p.
58. Trueman S. J. et RichardsonD. M.,
2007.In vitro propagation of Corymbia torelliana x C.
citriodora (Myrtaceae) via cytokinin-free node culture. Australian
Journal of Botany55: 471- 481.
59. Verhaegen D., Kadio A., Boutin B., Delaunay J.,
Legaré D., 1992. Le samba: sélection phénotypique
d'arbres << + >> et production industrielle de boutures en
Côte-d'Ivoire. Bois et Forêt des tropiques n°234 (4) :
13-28.
60. Vigneron Ph., 1991. Création et
amélioration des variétés hybrides d'Eucalyptus au Congo.
CTFT-Congo : 354-360.
61. Vigneron Ph., Saya A., Ognouabi N.,
2006. Synthèse critique sur le programme d'amélioration
génétique des eucalyptus du Congo. Document interne, UR2PI
Pointe-Noire Congo, 44p.
62. Walker N., 1985. Sequoia
sempervirens. Réjuvénilisation et culture de
méristèmes en cascade. Afocel: 25-47.
63. Wareing P. F. et Frydman V. M., 1976.
General aspects of phase change, with special reference to Hedera
helix L. acta Horticulturae 56: 57-69.
64. Zougab N., 2008. Développement
d'un modèle de génétique quantitative dynamique. Prise en
compte des compétitions interindividuelles. Mémoire de Master
recherche Bio statistiques, université de Montpellier II,
34p.
ANNEXES
Tableau 7: calendrier des traitements fongicides et des
fertilisations appliquées aux pieds mères
|
Jour
|
Produit
utilisé
|
Composition
|
Dose
|
Mode
d'application
|
|
|
N : 8% Fe : 0,05
|
|
|
|
|
P : 5,2% Zn : 0,02
|
|
|
|
Hakaphos
|
|
15g/10 litres
|
|
|
Mardi
|
rouge
|
K : 19% Cu : 0,02
|
pour 250 plants
|
Pulvérisation
|
|
|
S03: 12,5% B : 0,01
|
|
|
|
|
|
30ml/10 litres
|
|
|
Mercredi
|
Rovral
|
50% Iprodione
|
pour 250 plants
|
Pulvérisation
|
|
|
N : 14% Fe : 0,05
|
|
|
|
|
P : 4,5% Zn : 0,02
|
|
|
|
Hakaphos
|
K : 12,5% Cu : 0,02
|
15g/10 litres
|
|
|
Vendredi
|
|
|
|
Pulvérisation
|
|
bleu
|
S03: 12,2% B : 0,01
|
pour 250 plants
|
|
|
|
Mg : 1,2% Mo : 0,001
|
|
|
|
|
Mn : 0,05%
|
|
|
Tableau 8: Calendrier des traitements fongicides et des
fertilisations appliqués aux boutures en rhizogenèse
|
Jour
|
Produit utilisé
|
Composition
|
Dose
|
Mode
d'application
|
|
Mardi
|
Hakaphos rouge
|
N : 8% Fe :
0,05
P : 5,2% Zn :
0,02
K : 19% Cu :
0,02
S03: 12,5%
B : 0,01
|
15g/10l pour
833 plants
|
Pulvérisation
|
|
Mercredi
|
Rovral
|
50% Iprodione
|
15ml/10l pour
833 plants
|
Pulvérisation
|
|
Vendredi
|
NPK
|
N : 1%
P : 1%
K : 5%
|
15g/10l pour
833 plants
|
Pulvérisation
|
| 


