|
Promotion 2009
REPUBLIQUE GABONAISE
MINISTERE DE L'EDUCATION NATIONALE DE L'ENSEIGNEMENT SUPERIEUR DE
LA RECHERCHE SCIENTIFIQUE ET DE L'INNOVATION
UNIVERSITE DES SCIENCES DE LA SANTE
FACULTE DE MEDECINE

Année 2009 Mémo ire n° 259
scIE~TA ET
c
Surveillance de la résistance

aux antibiotiques de
Streptococcus pneumoniae et Haemophilus
influenzae
Mémoire pour l'obtention
Du Diplôme d'Etat de Technicien Supérieur de
Biologie Médicale
Présenté par
Monsieur ONDENOT Yann Christian
Née le 31 Décembre 1984 à Port-Gentil
Directeur : Pr Ag Angélique NDJOYI MBIGUINO
Rapporteur : Dr Modeste MABIKA MANFOUMBI
ORGANIGRAMME
PERSONNEL
ADMINISTRATIF
DOYEN Pr. Edouard NGOU
MILAMA
ASSESSEURS Pr. Jean-Baptiste MOUSSAVOU
KOMBILA
Pr. Ag. Philomène
NKOUNA
SECRETAIRE GENERAL Mr. Alphonse
RAIVIRE
SECRETAIRE GENERAL ADJOINT Mr. Apollinaire
ESSONO
PERSONNEL ENSEIGNANT
RESPONSABLE DE SECTION Pr. Maryvonne
KOMBILA
CORDINATEURS Dr. Adaku SITTI
LIAMIDI
Mr. Christophe NGUIRI
ANATOMO-PATHOLOGIE
Drs: Barthélemy MABIKA
MABIKA
Sidonie NGUIZI OGOULA Pearl NSIE
OBAME
Florence NZE NGUEMA
HEMATOLOGIE-IMMUNO HEMATOLOGIE
Pr. Alain ONDO
Drs. Vincent DITSAMBOU
Léonie Esther LETOMBO
Jean-François THARDIN Mr. André
DOUKAGA
PARASITOLOGIE-MYCOLOGIE-MEDECINE TROPICALE
Pr. Maryvonne KOMBILA
Drs Marielle Karine BOUYOU AKOTET ép.
LOUEMBET
Jean-Bernard LEKANA DOUKI
Modeste MABIKA MANFOUMBI
Denise Patricia MAWILI MBOUMBA
Jean-Romain MOUROU MBINA
Marie-Noëlle MOUSSAVOU BOUSSOUGOU
ép.
MABIKA
Edgar Brice NGOUNGOU
Joseph NZAMBA
Solange NZENZE AFENE
Anne WALKER DEEMIN
Mr. Mathieu OWONO MEDANG
BACTERIOLOGIE-VIROLOGIE
Pr. Angélique NDOYI MBIGUINO
Drs. Delphine OMWANGA ép. IGONDJO
Pélagie MOUGOLA ép. SAPHOU
DAMON
Mrs. Guy Francis NZENGUI NZENGUI
Hervé M'BOYIS KANDEM
Mme Agnès NNOH MBA
PHYSIQUE
--BIOPHISIQUE-MATHMATIQUES-INFORMATIQUE
Drs Thaddée NTOUNTOUME
Boris ONDO
Mrs. Philippe ESSONO ONDO
Emmanuel ANYUNZOGHE
TOXICOLOGIE
Drs : Colette YENOT Casimir
NZOUNGOU
CHIMIE-BIOCHIMIE-BIOLOGIE CELLULAIRE ET
MOLECULAIRE
Pr. Edouard NGOU MILAMA
Drs. Madeleine BRIDON
Guy Joseph LEMAMY
Elisabeth LENDOYE
Yvette MBA OBAME
Marie-Claude MINKOUE
Jean-Claude MOUNDOUNGA BAKITA
Bénédicte NDEBOKO
Jean-Calvin NGUELE
Marie Andrée N'NEGUE
Félix OVONO ABESSOLO
Adaku SITTI LIAMIDI
PHARMACOLOGIE
Pr. Ag. Blandine AKENDEGUE Drs.
Nadine AMBOUROUET Laurence GASSITA Pierre
GOUERANGUE Serge ISSEMBE
Marie ONDO MBA
PHYSIOLOGIE
Pr. Berkman NSHIMIUMOUREMYI
Drs. Apollinaire ESSONO
Serge BEKALE
SANTE PUBLIQUE ET MEDECINE DU TRAVAIL
Pr. Bernard OBIANG OSSOUBITA
Pr. Ag. Justine MOUECOUCOU
Drs. François EDOU
OVONO
Médard TOUNG MVE
Mr. Jérôme MBA
BITOME
Je dédie ce travail à : L'eternel
Dieu
Maître et seigneur tout puissant, c'est lui qui permet
toutes choses sur cette terre, notre créateur. OH SEIGNEUR !! Soit
bénit et glorifié.
A ma mère AZIZET Jeanne Françoise et mon
père RAKOMBA Arnaud
Pour votre soutient moral et financier, pour tous les sacrifices
consentis pour mes études et mes multiples besoins, je vous dédie
ce travail
A mon grand père ETENO Jean Bernard, mes oncles
SYLONG Jean Richard et IKOUAKOUA Jules, à mes tantes NTCHANGO
Félicité et Sylviane, NGUIZI OGOULA GERBEX Sidonie
Pour vos conseils, votre disponibilité, votre soutien sans
faille à chaque que j'ai marqué le besoin, je vous dédie
ce travail pour tous ces sacrifices consentis.
A mes frères et soeurs, cousins et amis,
particulièrement à IGALLA Judicaël
Vous qui m'avez toujours remonté le moral lorsque je
faiblissais, vous avez su m'apporter la joie, me donner du courage, je vous
dédie ce travail
A mes condisciples de classe AVA Thierry, ANGOUO
Ladislas, BATENI Julie, EMANE Alain-Georges, ETO'O Judicaël, IMOUNGA
Audrey-Sylviane, KASSA Aubin, KEMDOUM.O Descartes, KOMBA.M Olive, LUMUMBA
Clotilde, MABALA KABA Harry, MAPANGOU Nelly, MBEGA Auxence, MUSWAMI.B Laeticia,
NDONG Jean-Charles, NZAOU Denise, NZIENGUI Eric
Pour tous les moments de joies et de peines passés
ensemble et pour votre soutien qui a été sans faille,
sincères remerciements.
A ma fiancée ONKANI Shirley Priscilla
Toi qui a cru en moi des le jour ou l'on s'est rencontré,
pour ta présence, ton soutien, tes conseils et ta patience,
reçoit toutes ma gratitude et mon amour pour toi, je te dédie ce
travail
REMERCIEMENTS
A mon directeur de mémoire
Pr Angélique NDJOYI
MBIGUINO
Pour avoir dirigé ce travail avec patience et
rigueur,
Vous nous avez accordé votre précieux temps
malgré vos multiples occupations
Au responsable de la section TSBM
Pr Maryvonne
KOMBILA
Vous avez toujours été à l'écoute des
étudiants,
Vous avez de grandes qualités humaines,
Vous ne
cessez de nous soutenir et de vous montrer attentionné envers nous
telle une mère
A mon rapporteur
Dr Modeste MABIKA MAMFOUMBI
Vous avez
voulu nous accorder de votre temps,
Pour juger ce travail avec toute la
rigueur scientifique.
Sincère remerciement
Au Dr Pélagie SAPHOU DAMON
Pour votre apport, votre
disponibilité et vos conseils
tout au long de ce travail, vous avez
été telle une grande soeur.
Je vous adresse mes
sincères remerciements
A messieurs NZENGUI NZENGUI GUY-FRANCIS,
MBOYIS KANDEM Hervé,
A Mesdames NNOH MBA Agnes,
TCHOUA Diane,
Makessi Adele,
NGOUANGA Leonie,
MASSOUNGA Jeannine,
Pour votre contribution technique au cours de ces mois
passé ensemble,
Pour votre sens de la fraternité et de la famille envers
nous,
Votre souci de travailler en équipe,
Profonds remerciements.
Liste des abréviations
ORL : Oto-rhino-laryngologie
CMI : Concentration Minimale Inhibitrice
VP : Voges Proskaeur (production d'acétone)
LCR : Liquide Céphalorachidien
PSDP : Pneumocoque de Sensibilité Diminuée
à la Pénicilline.
USA: United States of America
NAD: Nicotinamide Adenine Dinucléotide
PLP : Protéine de Liaison à le
Pénicilline
ADN : Acide Désoxyrinucléique
FQ : Fluoroquinolones
ARN : Acide Ribonucléique
CO2 : Dioxyde de carbone
APH : Aminoside-phosphotransférases
ANT : Aminoside-nucléotidyl- transférase
ACC : Aminoside-acetyltransferases
D-Ala-D-Ala : D-Alanine-D-Alanine
D-Ala-D-Ser : D-alanine-D-serine
MLS : Macrolides-lincosamides- synergistines
CASFM : Comité de l'antibiogramme de la
société française de microbiologie.
Liste des tableaux pages
Tableau I: Répartition des cas dans la
population générale 42
Tableau II: Répartition des cas selon
les tranches d'âge 43
Tableau III: Antibiogramme et CMI de la
souche de S. pneumoniae ONA 45
Tableau IV: Antibiogramme et CMI de la souche
de S. pneumoniae AYO 46
Tableau V: Antibiogramme et CMI de la souche
de S. pneumoniae MAH 46
Tableau VI: Antibiogramme et CMI de la souche
de S. pneumoniae MAN 47
Tableau VII: Antibiogramme et CMI de la
souche de S. pneumoniae BOU 47
Tableau VIII: Antibiogramme et CMI de H.
influenzae 48
Liste des figures pages
Figure 1: Colonies de S. pneumoniae
sur gélose au sang 7
Figure 2: Coloration de Gram de
Streptococcus pneumoniae 8
Figure 3: Coloration de Gram de
Haemophilus influenzae 14
Figure 4: Image d'un test de CMI 34
Figure 5: Répartition des cas positifs
selon les espèces 44
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
Introduction 4
Objectifs 5
Chapitre I:Généralités 6
I.1-Généralités sur
Streptococcus pneumoniae 6
I.1.1-Historique 6
I.1.2-Définition et classification 6
I.1.3-Morphologie et caractères biochimiques
6
I.1.4-Caractère
génomique 9
I.1.5-Habitat 9
I.1.6-Pouvoir pathogène 9
I.1.7-Facteurs de pathogénicité
10
I.1.7.1-La capsule 10
I.1.7.2-Autres facteurs 10
I.1.8-Manifestations cliniques 10
I.1.9-Diagnostic bactériologique 10
I.1.9.1-Prélèvement 11
I.1.9.2-Transport 11
I.1.9.3-Diagnostic 11
I.1.10-Traitement et prévention 12
I.2-Généralités sur Haemophilus
influenzae 13
I.2.1-Historique 13
I.2.2-Définition et classification 14
I.2.3-Morphologie et caractères
biochimique 14
I.2.4-Habitat 15
I.2.5-Pouvoir pathogène 15
I.2.5.1-Infection des voies respiratoires 15
I.2.5.2-Méningites 15
I.2.5.3-Autres localisations 16
I.2.6-Facteurs de pathogénicité
16
I.2.7-Manifestations cliniques 16
I.2.8-Diagnostic
bactériologique 17
I.2.8.1-Prélèvement 17
I.2.8.2-Transport au laboratoire 17
I.2.8.3-Diagnostic 17
I.2.9-Traitement et prévention 18
I.3-Généralités sur les
antibiotiques 19
I.3.1-Historique 19
I.3.2-Définition 19
I.3.3-Classification 20
I.3.3.1-Classification selon les familles 20
I.3.3.2-Classification selon le site d'action
21
I.3.4-Mécanisme d'action des
antibiotiques 21
I.3.4.1-Action sur la paroi bactérienne
21
I.3.4.1.1-Beta-lactamines 22
I.3.4.1.2-Glycoprotéines 22
1
I.3.4.1.3-Fosfomycine 23
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
I.3.4.2-Antibiotiques actif sur la synthèse des
protéines et des acides
nucléiques 23
I.3.4.2.1-Mécanisme d'action des aminosides
24
I.3.4.2.2-Mécanisme d'action des quinolones
24
I.3.4.2.3-Mécanisme d'action du groupe
Macrolide-Lincosamide-
Synergistine-Kétolides 24
I.4-Epidémiologie de la résistance des
bactéries aux antibiotiques 2 5
I.4.1-Epidémiologie de la résistance de
Streptococcus pneumoniae aux
antibiotiques 26
I.4.2-Epidémiologie de la
résistance de Haemophilus influenzae
aux
antibiotiques 26
I. 5-La résistance des bactéries aux
antibiotiques 27
I.5.1-Mécanisme de résistance acquise
27
I.5.2-Mécanisme de résistance par grande
famille 29
I.5.2.1-Résistance aux beta-lactamines
29
I.5.2.2-Résistance aux aminosides 29
I.5.2.3-Résistance aux quinolones 29
I.5.2.4-Résistance aux glycopeptides
30
I.5.2.5-Résistance aux macrolides et
kétolides 30
I.6-La sensibilité des bactéries aux
antibiotiques 30
I.6.1-Sensibilité de Streptococcus
pneumoniae aux antibiotiques 30
I.6.2-Sensibilité de Haemophilus
influenzae aux antibiotiques 31
I.7-L'antibiogramme 31
I.7.1-Définition 31
I.7.2-Principe 31
I.8-La Concentration minimale inhibitrice 32
I.8.1-Définition 32
I.8.2-Principe 32
I.8.3-Interprétation 33
Chapitre II: Matériel et méthodes 3
5
II.1-Type d'étude 3 5
II.2-Lieu d'étude 3 5
II.3-Patients 3 5
II.3.1-Critères d'inclusions 35
II.3.2-Critères d'exclusions 35
II.4-Matériel 3 5
II. 5-Méthodes 36
II.5.1-Enregistrements 36
II.5.2-Prélèvements 36
II.5.3-Analyses bactériologiques des
prélèvements 36
Chapitre III: Résultats 41
III.1-Aspect des colonies de Streptococcus pneumoniae
et
Haemophilus influenzae 41
III.2-Résultats de la coloration de Gram
41
III.3-Lecture du test à l'optochine 41
2
III.4-Test d'agglutination 41
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
III. 5-Répartition des cas dans la population
générale 42
III.6-Répartition des cas selon les tranches
d'âge 43
III.7-Répartition des cas positifs selon les
espèces 44
III.8-Résultats de l'antibiogramme et de la CMI
des souches de
S. pneumoniae 4 5
III.9-Résultats de
l'antibiogramme et de la CMI de la souche de
Haemophilus influenzae 48
Chapitre IV: Discussion 49
IV.1-Aspect des colonies 49
IV.2-Coloration de Gram 49
IV.3-La sensibilité à l'optochine
50
IV.4-La réaction d'agglutination au latex
50
IV. 5-Antibiogramme et CMI 50
3
Conclusion 53
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
La sphère ORL (nez,
gorge, oreilles) est constituée d'une flore
polymorphe. Parmi cette flore on note la présence de
Streptococcus pneumoniae et Haemophilus influenzae
qui sont des bactéries retrouvées à
l'état commensal au niveau des muqueuses des voies
respiratoires.
Ces formes commensales n'ont
généralement pas de capsules, contrairement aux formes virulentes
dont la présence de la capsule permet la résistance à la
phagocytose.
Streptococcus pneumoniae et
Haemophilus influenzae sont responsables d'affections
graves (otites, sinusites, méningites) avec des conséquences non
négligeables.
L'isolement et l'identification du germe est
nécessaire pour une prise en charge efficace.
Devant ces pathologies, surtout les cas de
méningites, une antibiothérapie probabiliste est toujours
prescrite en attendant les résultats du laboratoire.
Face à cette démarche, et compte tenu de
l'évolution imprévisible des résistances,
particulièrement dans nos régions où
l'automédication est très importante, une surveillance
régulière de la résistance aux antibiotiques de
Streptococcus pneumoniae et Haemophilus
influenzae s'impose [1].
Aucune étude sur le profil de résistance
de Streptococcus pneumoniae et
Haemophilus influenzae n'a été faite au
Gabon, De plus, notre étude apparait comme une étude
préliminaire car la détermination de la Concentration Minimale
Inhibitrice (CMI) n'est pas pratique courante dans nos laboratoires de
bactériologie.
Le but de notre étude est :
- de déterminer le profil de résistance
des souches susmentionnées ;
- d'effectuer les CMI des souches résistantes aux
antibiotiques.
Ceci permettra au Gabon de disposer d'un profil de
résistance de S.pneumoniae et
H.influenzae aux antibiotiques, et par la même
occasion, la possibilité aux médecins de pouvoir prescrire une
antibiothérapie probabiliste (en tenant
compte des antibiotiques demeurés sensibles aux
souches).
4
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
Objectif général
> Déterminer le profil de résistance
aux antibiotiques de Streptococcus pneumoniae et
Haemophilus influenzae.
Objectifs spécifiques
> Identifier Streptococcus
pneumoniae
> Identifier Haemophilus
influenzae
> Déterminer la sensibilité
de Streptococcus pneumoniae aux
antibiotiques
> Déterminer la sensibilité de
Haemophilus influenzae aux antibiotiques
> Déterminer la Concentration Minimale
Inhibitrice (CMI) de Streptococcus pneumoniae aux
antibiotiques
> Déterminer la Concentration Minimale
Inhibitrice (CMI) de Haemophilus influenzae aux
antibiotiques
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
5
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
I.1- Généralités sur
Streptococcus pneumoniae I.1.1- Historique
En 1874, Billoroth décrit des coccies en
chaînette dans des blessures. En 1884, Rosenbach introduit le terme
de Streptococcus pour décrire des
bactéries isolées de lésions suppuratives.
Le terme de « pneumocoques » est
utilisé pour la première fois par Klein et Pasteur en 1884. La
première description de Streptococcus pneumoniae
est rapportée par Chester en 1901. Initialement
appelé Diplococcus pneumoniae en 1926, il a
été rebaptisé Streptococcus pneumoniae
en 1974, vu sa croissance en chaînes dans les milieux
liquides. Il est aussi appelé pneumocoque à cause de son
implication dans les pneumonies [2].
I.1.2- Définition et classification
Streptococcus pneumoniae est un
micro-organisme appartenant au règne Bacteria,
à l'embranchement Firmicutes, à la
classe des Bacilli, à l'ordre des
Lactobacillales, à la famille des
Streptococcaceae, et au genre
Streptococcus [3].
I.1.3-Morphologie et caractères biochimiques
Les souches de Streptococcus pneumoniae
se présentent sous forme de coques ou de coccobacilles,
à Gram positif. La coloration de Gram se perd dans les vieilles cultures
et les bactéries peuvent alors apparaître comme des coques
à Gram négatif. On les retrouve groupés par deux ou par
huit, isolés ou en courtes chaînes. Les repiquages favorisent la
formation de chaînes [2].
Il possède une capsule, il est
aéro-anaérobie, à métabolisme fermentatif, catalase
négative, Vogues Proskaeur (VP)
négatif, hydrolysant l'esculine, acidifiant l'inuline, le
fructose, le galactose, le glycogène, le glucose, le lactose, le
maltose, le saccharose, le tréhalose et le raffinose. Il acidifie
lentement l'arabinose, l'érythritol, le glycérol et le xylose. Il
n'acidifie ni le cellobiose, ni le dulcitol, ni l'inuline, ni le mannitol, ni
le ribose, ni la salicine, ni le sorbitol [2].
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
6
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae

7
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
Figure 1 : Colonies de Streptococcus pneumoniae
sur gélose au sang [18]
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
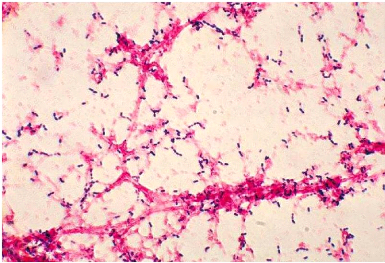
8
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
Figure 2: Coloration de Gram de Streptococcus
pneumoniae [18]
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
I.1.4-Caractères génomiques
Son génome est composé de 2160837 paires
de bases avec 2236 régions codantes et une fonction biologique a
été identifiée. Cela laisse présager des
perspectives pour la compréhension des mécanismes de virulence et
pour la mise au point de nouveaux vaccins [2].
I.1. 5- Habitat
S. pneumoniae est une bactérie
commensale des voies aériennes supérieures. La colonisation du
rhinopharynx apparaît très précocement au cours des
premiers mois de la vie : tous les enfants ont été en contact
avant l'âge de deux ans et 50% des enfants de cet âge
sont colonisés [2].
I.1.6-Pouvoir pathogène
C'est l'agent pathogène le plus fréquent
des pneumonies bactériennes communautaires. Les bronchites et
broncho-pneumopathies sont observées surtout chez les patients
insuffisants respiratoires chroniques et au décours des
viroses (grippe). La capacité de la bactérie à pouvoir
adhérer aux cellules ciliées de l'arbre bronchique est
liée à la présence de diverses protéines de surface
enchâssées dans le peptidoglycane et les polyosides capsulaires
[2].
Les abcès du poumon et les pleurésies
sont plus rares et souvent secondaires à une atteinte du parenchyme sous
jacent. En revanche, il semble le plus fréquent dans la flore
nasopharyngée des enfants présentant une otite moyenne
aiguë.
C'est aussi l'une des bactéries les plus
fréquemment rencontrées dans des mastoïdites, des
sinusites ainsi que dans des conjonctivites [2].
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
9
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
I.1.7-Facteurs de pathogénicité
I.1.7.1- La capsule
Les pneumocoques possèdent une capsule,
polysaccharidique qui exerce une action anti phagocytaire. Cette capsule est la
couche la plus externe et constitue le facteur majeur de virulence de la
bactérie. La perte de la capsule entraîne la perte de la
virulence. On connait plus de 80 variétés immunologiques
différentes de capsules, ce qui a permis de caractériser autant
de sérotypes. Certains sérotypes semblent plus pathogènes
que d'autres.
Les anticorps dirigés contre la capsule
permettent la phagocytose (ils sont opsonisant). Ces anticorps sont
protecteurs, mais leur action est spécifique de sérotype
[4].
I.1.7.2-Autres facteurs
Diverses adhésines permettent la colonisation.
L'hémolysine du pneumocoque (la pneumolysine) joue aussi un rôle
dans le pouvoir pathogène. Rappelons que la protéine
C-réactive (CRP) est une protéine de la réponse
inflammatoire qui réagit avec des constituants de la paroi du
pneumocoque (un complexe fait d'acide teichoïques et de
peptidoglycane) et qui peut activer ensuite le
complément [4].
I.1.8- Manifestations cliniques
Les manifestations cliniques pulmonaires sont
dominées par la pneumonie franche lobaire aiguë,
caractérisée par la brutalité et l'intensité des
signes généraux et fonctionnels et par la pneumopathie de
surinfection post virale [5].
Les infections de la sphère ORL à type
d'otite et de sinusite sont potentiellement graves par leurs
complications : septicémies et méningites.
La méningite à
pneumocoque est la première étiologie des
méningites purulentes de l'adulte et du nourrisson. Elle est
primitive ou secondaire à un foyer ORL ou à un traumatisme
crânien. Elle est caractérisée par un
début
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
10
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
brutal, des troubles
neurovégétatifs sévères et un syndrome
méningé franc. La gravité est
liée au risque de cloisonnement en cas de retard d'un
traitement adapté [5].
I.1.9- Diagnostic bactériologique
I.1.9.1-Prélèvements
Les prélèvements provenant de sites
normalement stériles : liquide céphalorachidien (LCR),
hémocultures, liquides de ponctions pleurales ou de péritonite,
pus de paracentèse, ne présentent pas de
particularité.
Pour le diagnostic des infections respiratoires
hautes, on peut pratiquer un prélèvement
nasopharyngé.
Pour le diagnostic des infections
respiratoires basses, plusieurs techniques sont possibles
[6].
Les méthodes invasives par fibroscopie (lavage
broncho-alvéolaire, prélèvement distal
protégé ou brossage bronchique) ou ponction transtrachéale
sont préférables ; elles sont toutefois réservées
aux malades hospitalisés présentant des signes de gravité
[2].
I.1.9.2-Transport
S. pneumoniae est une bactérie
fragile, les prélèvements doivent parvenir au laboratoire dans un
délai d'une heure. Cependant, les délais d'acheminement peuvent
être différés pour les prélèvements
effectués sur écouvillon à condition d'utiliser des
dispositifs commercialisés contenant un milieu de conservation ou des
glacières [2].
I.1.9.3-Diagnostic
Le diagnostic bactériologique repose sur
l'examen direct, la culture et l'identification du germe.
L'examen à l'état frais sur les
prélèvements liquidiens présente peu
d'intérêt en dehors de la recherche d'une capsule par le test
à l'encre de chine.
11
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
La coloration de Gram permet de mettre en
évidence l'aspect caractéristique du
pneumocoque.
La culture de S. pneumoniae
nécessite l'adjonction de facteurs de croissance. Les
milieux les plus couramment utilisés sont la gélose trypticase
soja ou gélose Columbia enrichies à 5% de sang
défibriné de mouton ou de cheval. On peut utiliser
également la gélose chocolat supplémentée en
facteurs de croissance dont la composition est proche de celle du milieu de
Mueller-Hinton.
L'ensemencement des produits se fait suivant les
techniques habituelles de bactériologie.
L'identification est faite d'abord sur l'aspect des
colonies. Elles sont opaques ou grisâtres, bombées à bord
régulier. Devant une colonie suspecte sur milieu gélosé ou
dans une culture, la confirmation rapide de cette identification se fait
grâce à des tests complémentaires [2].
I.1.10- Traitement et prévention
> Traitement
L'antibiothérapie repose essentiellement sur
l'administration d'amoxicilline par voie orale et voie intraveineuse, en
fonction de la gravité du tableau clinique.
Cependant, l'émergence de souches de pneumocoque
de sensibilité diminuée à la pénicilline (PSDP)
doit inciter à la détermination de la CMI du germe aux
béta-lactamines lorsque celui-ci est isolé en culture
[4].
Dans les traitements des infections à PSDP les
béta-lactamines restent les antibiotiques de premier choix tant que le
niveau de résistance restera compatible avec une efficacité
thérapeutique. En raison de l'échec du traitement de
méningites par le céfotaxime l'association avec la vancomycine
est recommandée [4].
Malgré une bonne activité
in vitro, la pristinamycine n'est pas toujours
efficace en thérapeutique.
Les dernières fluoroquinolones, en particulier
le levroxacine, sont une alternative thérapeutique intéressante,
néanmoins le risque d'émergence de souches résistantes est
réel si leur utilisation est mal contrôlée, cette
molécule
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
12
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
doit être réservée plutôt en
deuxième intention et lors de facteurs de risque de
complications [4].
> Prévention
L'émergence de souches résistantes aux
antibiotiques accentue l'importance de la vaccination, en particulier chez les
sujets à risque (splénectomisés, drépanocytaires,
sujets présentant une insuffisance respiratoire ou cardiaque...).
Cependant, le vaccin polysaccharidique existant est peu
immunogène chez l'enfant de moins de 2 ans [4].
Récemment est apparu un vaccin heptavalent,
capable d'induire une immunité chez l'enfant de moins de 2 ans. Son
efficacité a été démontrée dans la
prévention des infections systémiques à
pneumocoque (septicémies, méningites) et,
dans une moindre mesure, dans la prévention des pneumonies et des otites
de l'enfant.
Le calendrier vaccinal est de trois injections
à 1 mois d'intervalle chez l'enfant de moins de 6 mois, de deux
injections chez l'enfant de 6 à 12 mois et d'une injection suivie d'un
rappel si la vaccination à débuté après 1 an
[4].
I.2- Généralités sur Haemophilus
influenzae I.2.1- Historique
La bactérie a été
découverte par Pfeiffer lors de l'épidémie de
grippe des années 1890, dans les crachats de
grippés. Pfeiffer la nomme à
l'époque Bacillus influenzae sous
l'influence de la présence de l'agent de la grippe (influenza)
[7].
Quelques années auparavant la même
espèce avait été observée dans les
sécrétions purulentes de sujets atteints de conjonctivite, en
Egypte par Koch et aux USA par Weeks et nommée alors
Bacillus aegyptus ou Bacille de Koch et Weeks [7].
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
13
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
I.2.2- Définition et classification
Haemophilus influenzae est un micro-organisme
appartenant au règne Bacteria, à
l'embranchement des Proteobacteria, à la
classe des Gamma proteobacteria, à l'ordre des
Pasteurellales, à la famille de
Pasteurellaceae et au genre Haemophilus
[8].
I.2.3-Morphologie et caractères biochimiques
Haemophilus influenzae se présente
sous forme de coccobacilles ou de petits bâtonnets immobiles à
Gram négatif. Il existe aussi des formes longues,
traduisant un polymorphisme qui peut être observé dans certains
produits biologiques. La culture se caractérise par l'exigence en
facteurs de croissance intervenant dans les enzymes de la chaîne
respiratoire, le facteur X ou hémine et le facteur V ou NAD
présent dans le sang. Des milieux de cultures particuliers, dits
enrichis sont nécessaires comme la gélose « chocolat»
[7].
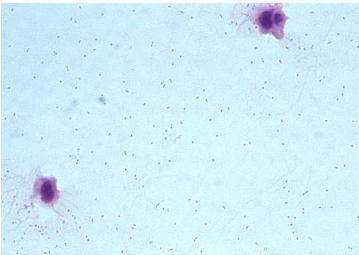
Figure 3: Coloration de Gram de Haemophilus
influenzae [7]
14
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
I.2.4- Habitat
L'habitat naturel de Haemophilus
est constitué par les muqueuses des animaux
à sang chaud avec une certaine spécificité
d'hôte. Chez l'homme, ces bactéries sont présentes dans le
rhino-pharynx, l'oropharynx, l'appareil génital, et le rectum. La
colonisation des voies respiratoires débute très tôt
après la naissance et va se poursuivre tout au long de la
vie.
La majorité des sujets sont des porteurs sains.
Lorsque la bactérie a été isolée pour la
première fois, chez des sujets décédés de grippe
(influenza), on a cru qu'elle était responsable de la
maladie, d'où le nom qui lui a été
attribué [2].
I.2.5-Pouvoir pathogène
I.2.5.1-Infections des voies respiratoires
H. influenzae est une bactérie
opportuniste, ou de surinfection. Cependant, elle peut provoquer une infection
localisée.
La bactérie est responsable d'otites, de
sinusites et rarement, chez l'enfant, d'une affection grave, de
l'épiglottite.
H. influenzae est souvent impliqué
aussi dans les surinfections survenant au cours des broncho-pneumopathies
chroniques. Il est également responsable de pneumonies chez l'enfant et
chez l'adulte (en particulier sur terrains fragiles) [4].
I.2.5.2-Méningites
Avant la vaccination, H. influenzae
était la principale cause de méningites
bactériennes chez le jeune enfant. La plupart des cas surviennent entre
3 mois et 3 ans et la mortalité est de l'ordre de 5 % [4].
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
15
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
I.2.5.3-Autres localisations
Les infections des voies respiratoires s'accompagnent
parfois des bactériémies et de localisations secondaires (en
particulier ostéo-articulaires). Des infections sévères
s'observent parfois chez le nouveau-né.
H. influenzae est aussi responsable de
conjonctivites purulentes. Un biotype particulier,
aegyptus, est habituellement responsable de
conjonctivites. Il peut aussi provoquer, dans certaines
régions, une infection systémique
sévère, la fièvre purpurique brésilienne
[4].
I.2.6-Facteurs de pathogénicité
Les infections les plus sévères
(méningites, épiglottites) sont dues au
sérotype b. Ce sérotype possède une capsule faite de la
répétition de ribose et de ribitol-phosphate. La capsule exerce
une action anti phagocytaire.
Les anticorps anti capsulaires ont un effet
opsonisant, protecteur. Ils apparaissent progressivement au cours de
l'enfance.
Ce sont les jeunes enfants, n'ayant pas encore acquis
d'immunité qui risquent d'être atteints de
méningite.
La vaccination permet maintenant de faire
apparaître l'immunité dès les premiers mois. Les infections
plus courantes sont souvent dues à des souches non-typables
[4].
I.2.7- Manifestations cliniques
Les manifestations respiratoires dominent le tableau
clinique dans la plupart des cas et conditionnent le pronostic
vital. La symptomatologie est non spécifique, dominée
par une toux chronique et la répétition de bronchites
infectieuses et/ou asthmatiformes au cours de la première enfance. La
toux est productive et l'expectoration est purulente et visqueuse. Une
dyspnée d'effort est recherchée systématiquement
[9].
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
16
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
I.2.8- Diagnostic bactériologique
I.2.8.1-Prélèvements
Pour le diagnostic des infections respiratoires, on
peut pratiquer un prélèvement nasopharyngée.
Les prélèvements
généralement non contaminés par les flores commensales
sont les liquides céphalorachidiens (LCR), les
hémocultures, les liquides d'épanchement (pleural, articulaires,
péritonéaux) et pus de ponction ou de drainage
(ostéomyélites, abcès du cerveau, liquide amniotique,
otites) [2].
I.2.8.2-Transport au laboratoire
Il est classique de dire que Haemophilus
est sensible au froid et à la dessiccation.
L'expérience montre qu'il s'agit d'une bactérie relativement
résistante qui supporte un délai de mise en culture de 2 heures
avec conservation au froid ou sur un écouvillon.
Par contre, si le transport et le délai de
culture doivent être supérieurs à 3 heures, il est
nécessaire d'utiliser des milieux de transport [2].
I.2.8.3-Diagnostic
Il repose sur l'isolement de la bactérie. La
culture nécessite des milieux adaptés, apportant les facteurs de
croissance comme le facteur V ou la nicotinamide adénine
dinucléotide (NAD) et le facteur X ou l'hémine qui
entrent dans la composition des enzymes respiratoires, contenant du fer
(cytochromes, cytochrome oxydase, catalase, peroxydase).
La gélose au sang cuit, dite gélose
chocolat, à cause de son aspect, apporte suffisamment d'hémine
mais doit être supplémentée en NAD qui peut être
partiellement détruit par la cuisson [2].
L'interprétation des résultats, est
facile lorsque le prélèvement provient d'un site normalement
stérile.
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
17
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
L'examen direct du LCR, apporte un
élément d'orientation de grande valeur
lorsqu'il montre un petit bacille à Gram
négatif polymorphe. Pour les prélèvements
d'origine respiratoire (bronchiques), on tiendra compte du contexte et de la
quantité de bactéries. La recherche d'antigènes solubles
(capsule du groupe b) peut se pratiquer sur le LCR [2].
I.2.9-Traitement et prévention
> Traitement
La bactérie est sensible à de nombreux
antibiotiques, mais un pourcentage important de souches, a acquis une
(3-lactamase qui les rend résistantes aux aminopénicillines.
C'est pourquoi, le traitement de première intention des
méningites bactériennes de l'enfant, repose sur les
céphalosporines de 3ème
génération.
En ce qui concerne les infections des voies
respiratoires, l'association d'une aminopénicilline et d'un inhibiteur
de (3-lactamases peut-être active sur les souches productrices de
(3-lactamases [4].
> Prévention
La prévention des méningites repose sur
la vaccination qui doit être précoce.
Le vaccin actuel est constitué par
l'antigène capsulaire du type b, couplé à une
protéine, dans le but de renforcer son immunogénicité. Le
vaccin est très efficace pour la prévention des
méningites et d'une façon
générale des infections invasives dues au
sérotype b. Il ne protège pas contre les autres types
d'infections, souvent dus à des souches non typables [4].
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
18
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
I.3- Généralités sur les
antibiotiques
I.3.1- Historique
Les antibiotiques existent en fait dans la nature. Ils
sont utilisés depuis des millénaires par certaines espèces
de fourmis, mais cela n'a été constaté que très
récemment.
En effet le premier antibiotique, identifié
dès la fin du XIXe siècle par Ernest Duchesne,
fut la pénicilline. Ses propriétés furent
redécouvertes par hasard en 1928 par Sir Alexander Fleming
qui s'aperçut que certaines de ses cultures
bactériennes dans des boîtes de Pétri oubliées
avaient été contaminées par les expériences de son
voisin de paillasse étudiant un champignon : le Penicillium
notatum. Mais l'importance de cette découverte, ses
implications et ses utilisations médicales ne furent comprises et
élaborées qu'après sa redécouverte, entre les deux
grandes guerres [10].
Depuis lors, d'autres antibiotiques ont
été découverts. En dehors des antibiotiques
naturels comme ceux précitées, il existe des
antibiotiques de synthèse. Le premier antibiotique (de
synthèse) a ouvert une voie nouvelle dans la lutte contre de nombreuses
maladies qui étaient considérées comme incurables
auparavant. Les antibiotiques ont augmenté l'espérance de vie
d'environ 15 ans, à ceux qui y ont accès [10].
I.3.2- Définition
On a longtemps appelé antibiotique toute
substance chimique produite par un micro-organisme (bactérie ou
champignon) et capable d'inhiber la croissance ou de détruire d'autres
micro-organismes. A l'heure actuelle, cette définition trop restrictive
doit être abandonnée, car des substances obtenues par
synthèse chimique possèdent les mêmes
propriétés.
Ainsi, on appelle antibiotique toute
substance chimique, quelle que soit son
origine, agissant spécifiquement sur une étape essentielle du
métabolisme des bactéries (antibiotique antibactériens) ou
des champignons (antibiotiques antifongiques) [11].
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
19
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
I.3.3- Classification
Les antibiotiques sont classés soit selon les
familles, ou soit selon leurs sites d'action. Une famille rassemble les
molécules ayant la même structure chimique de base. Les familles
peuvent être divisées en groupes et sous-groupes en fonction des
modifications de la structure chimique, qui apportent des
changements du spectre d'activité ou des
propriétés pharmacologiques
[12].
I.3.3.1- Classification selon les familles
Il existe 12 grandes familles
d'antibiotiques :
· Les bêta-lactamines telles que la
pénicilline,
l'amoxicilline, les céphalosporines.
· Les aminoglycosides tels que la streptomycine,
la gentamicine, la kanamycine.
· Les macrolides tels que
l'érythromycine, les kétolides, la josamycine.
· Les fluoroquinolones telles que la
ciprofloxacine, l'ofloxacine.
· Les antibiotiques
peptidiques tels que les lipoglycopeptides,
les glycopeptides.
· Les ansamycines tels que les
rifamycines.
· Les tétracyclines telles que la
tétracycline et la doxycycline.
· Les lincosamides telles la lincomycine, la
clindamycine.
· Le chloramphénicol.
· Les benzylpyrimidines telles que le
méthotrexate, le proguanil.
· Les sulfamides tels que la
sulfaméthoxydiazine.
· Les 5-nitroimidazoles [13].
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
20
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
I.3.3.2-Classification des antibiotiques selon le site
d'action
L'usage, vraisemblablement en raison de
l'intérêt bactériologique qui en découle, a
consacré une classification des antibiotiques basée sur le site
d'action dans la bactérie ou sur le processus visé
[12].
Ainsi, distingue-t-on sommairement :
· Les antibiotiques actifs sur la paroi
bactérienne : -Les béta-lactamines,
- Les glycopeptides,
- Les phosphopeptides,
· Les antibiotiques actifs sur la membrane
cytoplasmique :
- Les gramicidines,
-Les Polymyxines.
· Les antibiotiques actifs sur des processus
localisés dans le cytoplasme bactérien : synthèse
protéique, réplication de l'ADN ou les deux :
-Les aminosides, les cyclines, les macrolides, les
lincosamides, les kétolides, les streptogramines, la rifampicinine, le
chloramphénicol, l'acide fusidique, la
triméthoprime+sulfaméthoxazole,
-Les fluoroquinolones [12].
I.3.4-Mécanisme d'action des antibiotiques
I.3.4.1-Action sur la paroi bactérienne
La principale fonction de ces antibiotiques
s'exerce sur le peptidoglycane de la bactérie. Le
peptidoglycane est un polymère réticulé fait de
chaînes polysaccharidiques reliées par des peptides. Ce
constituant confère à la bactérie sa forme et sa
rigidité qui lui permet de résister à la forte pression
osmotique intra-cytoplasmique [12].
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
21
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
I.3.4.1.1- Les beta-lactamines
Les bêta-lactamines sont des acides organiques
relativement forts, et possèdent toutes un noyau (3-lactame qui est la
structure chimique indispensable à l'activité
antibactérienne. Cependant, comme elles agissent sur la partie externe
de la membrane cytoplasmique, la paroi est le seul obstacle entre
les bêta-lactamines et les cibles [12].
De ce fait, la composition de la paroi variable selon
la nature de la bactérie (Gram positif ou Gram
négatif), déterminera la sensibilité de la
bactérie aux bêta-lactamines.
Chez les bactéries à Gram positif, la
pénétration est en général aisée car le
peptidoglycane est perméable aux petites molécules comme les
(3-lactamines.
Chez les bactéries à
Gram-négatif, la pénétration des bêta-lactamines
peut se faire par voie lipophile, ou en empruntant la voie des porines pour
celles qui sont hydrophiles. Les bêta-lactamines inhibent la
dernière étape de la synthèse du
peptidoglycane, se fixent sur les protéines de liaison
à la pénicilline(PLP) par une liaison covalente. L'inhibition des
PLP conduit à l'arrêt de la croissance bactérienne
(bactériostase), ce qui correspond à un effet
bactériostatique, suivi de phénomènes complexes comme
l'activation des autolysines aboutissant à la mort des bactéries
(bactériolyse) [12].
I.3.4.1.2-Les glycoprotéines
Les glycopeptides agissent comme les (3-lactamines
à la dernière étape de la synthèse du
peptidoglycane. Ces molécules de poids moléculaire
élevé ont une structure tridimensionnelle en forme de poche. En
raison de leur volume, elles créent un encombrement qui perturbe
également les réactions de transglycolisation. Ces actions
conduisent à l'inhibition de la croissance bactérienne
[12].
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
22
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
I.3.4.1.3-Les fosfomycines
La Fosfomycine agit au début de la
synthèse du peptidoglycane, dans sa phase
intra-cytoplasmique. Elle inhibe la pyruvyl-transférase,
enzyme impliquée dans la synthèse du
précurseur, l'acide UDP-N-acétylmuramique. Pour
franchir la membrane cytoplasmique, la Fosfomycine utilise deux systèmes
de transport actif :
- le système de transport du
glycérophosphate, prépondérant, d'expression constitutive
;
- et le système de transport des hexoses
monophosphates, secondaire, d'expression inductible [12].
I.3.4.2-Antibiotiques actifs sur la synthèse des
protéines ou des acides nucléiques
I.3.4.2.1-Mécanisme d'action des aminosides
Les aminosides se comportent, sur le plan chimique,
comme les polycations. Cette particularité va leur permettre de se
concentrer dans l'environnement immédiat des bactéries par
attraction des charges négatives de celles-ci [12].
Le passage à la paroi est un
transfert passif. Il est aisé chez les bactéries à Gram
positif, par contre chez les bactéries à Gram négatif, il
utilise la voie des porines. La traversée de la membrane cytoplasmique
nécessite, un processus énergie-dépendant impliquant des
systèmes de transport qui sont les enzymes de la respiration
bactérienne. La cible principale des aminosides est la sous-unité
30S du ribosome, il va y avoir changement morphologique de l'ensemble du
ribosome et altération de toutes les étapes de la synthèse
protéique normale.
En raison de nombreuses erreurs de lecture, on
observe une synthèse de protéines anormales lesquelles vont
être incorporées dans la membrane cytoplasmique qui va ainsi
perdre son intégrité et favoriser une augmentation de la
pénétration des aminosides. La bactéricidie rapide et
profonde des aminosides résulte donc essentiellement de l'arrêt de
la synthèse protéique et de la perte de l'intégrité
membranaire [12].
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
23
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
I.3.4.2.2-Mécanisme d'action des quinolones Les
quinolones sont divisées en deux groupes :
- les anciennes molécules, appelées
parfois quinolones de 1ére
génération, actives uniquement sur les
bactéries Gram négatif responsables d'infections urinaires
;
- les fluoroquinolones (FQ), au spectre plus large et
d'utilisation systémique.
Leurs mécanismes d'action sont
identiques.
La traversée du peptidoglycane par
les quinolones, aussi bien chez les bactéries à Gram
positif que chez les bactéries à Gram
négatif se fait par diffusion passive, non saturable. Notons
que chez les bactéries à Gram négatif, les quinolones
empruntent la voie des porines.
Il existe un processus naturel d'excrétion des
systèmes d'efflux fonctionnant à bas niveau.
Les quinolones entrainent une inhibition
rapide de la synthèse de l'acide désoxyribonucléique (ADN)
aboutissant à la mort bactérienne [12].
I.3.4.2.3-Mécanismes d'action du groupe :
Macrolides-Lincosamides- Synergistines-Kétolides (MLSK)
Les macrolides, lincosamides, synergistines
et kétolides diffusent très difficilement à travers la
membrane externe des bactéries à Gram négatif, ce qui
explique la résistance naturelle de nombreux bacilles à Gram
négatif à ces antibiotiques [12].
Les macrolides, lincosamides et streptogramines se
fixent sur la sous-unité 50S du ribosome au niveau de l'ARN ribosomal
23S. Le site de liaison majeur de l'érythromycine se situe au niveau de
deux séquences contiguës de l'ARN 23S situées dans les
domaines V et II. Cette fixation a pour résultat un arrêt de la
phase d'élongation de la synthèse protéique.
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
24
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
La télithromycine possède une
affinité accrue pour le domaine II. Elle inhibe l'assemblage
des deux sous-unités 30S et 50S, bloque
l'assemblage des peptides et donc la synthèse
protéique. Les macrolides, lincosamides, sont considérés
comme bactériostatiques. Les synergistines sont formées de deux
composés (streptogramines A et B) qui possèdent des sites
d'action différents. Ils agissent en synergie et l'association est
bactéricide [12].
I.4- Epidémiologie de la résistance des
bactéries aux
antibiotiques
Depuis l'introduction des antibiotiques dans l'arsenal
thérapeutique des maladies infectieuses, les microorganismes ont
développé des moyens de défense leurs conférant une
résistance aux antibactériens [13].
Ces résistances aux antibiotiques aux doses
thérapeutiques apparaissent plus ou moins rapidement selon la
complexité chimique des antibiotiques et du patrimoine
génétique de la bactérie.
Actuellement quel que soit l'antibiotique
utilisé, il existe des souches de différentes espèces
bactériennes qui leur sont résistantes. Le mécanisme de
résistance peut avoir comme support
génétique un gène
d'origine plasmidique ou chromosomique
[13].
La réponse de la bactérie est souvent
complexe, il peut s'agir d'empêcher l'antibiotique de
pénétrer à l'intérieur de la cellule
bactérienne, d'inactiver le xénobiotique par des enzymes ou de
modifier le site d'action de l'antibiotique, voire de synthétiser des
systèmes additionnels qui permettent de contourner l'action de
l'antibiotique, voire de le refouler activement à l'extérieur
(efflux) [13].
Toutes les espèces ou genres bactériens
sont concernés par le phénomène de la résistance
aux antibactériens posant parfois de véritables problèmes
thérapeutiques. La résistance aux antibactériens est un
phénomène universel, qui semble plus aigu dans certains pays en
voie de développement du fait de la monotonie des
antibiotiques utilisables [13].
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
25
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
I.4.1-Epidémiologie de la résistance
de
Streptoccocus pneumoniae aux
antibiotiques
Streptoccocus pneumoniae est responsable
d'une importante mortalité et d'une morbidité
élevée. Il s'agit du premier agent pathogène responsable
des infections respiratoires, la deuxième étiologie
des méningites purulentes, et l'une des causes majeures des
otites de l'oreille moyenne [13].
Les sulfamides ont été introduits en
thérapeutique vers 1936, et dès 1943 les premières souches
de pneumocoques résistantes ont été rapportées. Les
premières souches résistantes aux cyclines ont été
publiées en 1962.
En 1964, les premières souches
résistantes à l'érythromycine A ont été
décrites lors d'une étude dans le traitement des surinfections
lors des poussées aigues chez les patients souffrant d'une
bronchite chronique [13].
Depuis 10 ans, le nombre de souches de S.
pneumoniae résistantes à la pénicilline G est
en augmentation constante.
On appelle souche multirésistante de
Streptoccocus pneumoniae, une souche insensible
à au moins trois antibiotiques. Le nombre de souches résistantes
à l'érythromycine A devient élevé ; ce type de
souche a été isolée dans le monde entier. Il s'agit
souvent de souches également de sensibilité diminuée ou
résistante à la pénicilline G. La première souche
multirésistante a été décrite en 1977 en Afrique du
Sud ; il s'agissait d'une souche résistante à la
pénicilline G, à l'érythromycine A, au
chloramphénicol, à la tétracycline et au cotrimoxazole
[13].
I.4.2-Epidémiologie de la résistance de
Haemophilus influenzae aux antibiotiques
Haemophilus influenzae est un agent important
des infections respiratoires basses et hautes, des conjonctivites, et des
méningites purulentes. La détermination de l'activité
in vitro des antibactériens sur
H. influenzae est complexe, car la valeur des CMI est
fonction du milieu de culture, du pH, de la composition du gaz
d'incubation du gaz d'incubation (CO2), de la taille de
l'inoculum [13].
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
26
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
De plus cette espèce bactérienne a
besoin de facteurs de croissance, ce qui complique
l'appréciation de la CMI.
Au début des années 1960, l'ampicilline
était devenu l'antibiotique de référence dans
le traitement des infections dut à
H.influenzae. Dès 1974, les premières
souches productrices de béta-lactamases furent
décrites.
La résistance à l'ampicilline
s'accompagne souvent d'une résistance au
chloramphénicol et aux cyclines. La résistance aux cyclines a
été détectée dès 1970, et celle du
chloramphénicol dès 1972.
Gould en 1994 a rapporté la première
souche de H .influenzae résistante à la
ciprofloxacine (CMI=8mg /L) et à l'ofloxacine (CMI=32mg/L)
[13].
I. 5- La résistance des bactéries aux
antibiotiques
La résistance aux antibiotiques peut-être
naturelle ou acquise.
La résistance naturelle d'une espèce ou
d'un genre est une caractéristique propre, appartenant à
l'ensemble des souches de cette espèce ou de ce genre. Elle est toujours
transmissible à la descendance (transmission verticale), car
portée par le chromosome, alors que la transmission horizontale est
très rare ou inexistante [12].
La résistance naturelle détermine les
phénotypes « sauvages » des espèces
bactériennes vis-à-vis des antibiotiques.
La résistance acquise ne concerne qu'une
proportion variable dans le temps, de souches d'une espèce ou d'un genre
; elle existe grâce à l'acquisition d'un (ou plusieurs)
mécanisme(s) de résistance qui détermine(nt) un
phénotype bien précis de résistance, différent du
phénotype sauvage caractérisant les souches n'ayant pas acquis ce
mécanisme [12].
I.5.1-Mécanisme de résistance acquise
Trois mécanismes rendent compte de la
résistance acquise des bactéries aux antibiotiques :
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
27
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
· Diminution de la quantité
d'antibiotique atteignant la cible par diminution de la
perméabilité ou par apparition de système d'efflux.
La baisse de la perméabilité concerne
surtout les bactéries à Gram négatif (membrane externe)
dont les porines s'obstruent partiellement ou totalement, ou alors
disparaissent [12].
Les systèmes d'efflux sont constitués
de protéines particulières jouant le rôle de pompe à
extrusion, utilisant une force proton-motrice et expulsant
l'antibiotique dès qu'il apparaît dans la
cellule bactérienne. Ils peuvent concerner les antibiotiques très
variés, tels que les fluoroquinolones, le chloramphénicol, les
tétracyclines, les béta-lactamines [12].
· Modification de la cible de
l'antibiotique
Ce type de résistance peut aller
jusqu'à l'absence de cible. En terme de résistance
acquise, on peut observer une modification partielle de la nature de la cible,
une modification du nombre (hyperproduction), un changement total (nouvelle
cible), parfois une association de plusieurs de ces mécanismes. Ces
modifications se font soit par mutation(s) dans les gènes codant pour la
cible de l'antibiotique, soit par acquisition de gènes étrangers
[12].
· Inactivation de
l'antibiotique
C'est le mécanisme le plus fréquent en
pathologie infectieuse. Il peut s'agir d'une destruction de l'antibiotique,
telle l'hydrolyse des béta-lactamines par les béta-lactamases, ou
d'une modification de la molécule par ajout de radicaux telles les
estérifications des aminosides par les
aminosides-phosphotransférases (APH), -nucleotidyltransférases
(ANT), -acetyltransferases (AAC) [12].
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
28
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
I.5.2-Mécanismes de résistance par grandes
familles d'antibiotiques
I.5.2.1-Résistance aux
béta-lactamines
La résistance par modification des PLP est
fréquente, qu'il s'agisse de mutation ou d'acquisition de
gènes étrangers, ou
d'hyper-acquisition des PLP normales.
Les mécanismes d'efflux sont illustrés
par Pseudomonas aeruginosa chez qui la surexpression
de trois systèmes sous l'effet de mutation touchant les gènes
régulateurs se traduit par une résistance de bas niveau aux
béta-lactamines anti-pyocyaniques.
La résistance liée à la
synthèse de béta-lactamases est très fréquente.
Plusieurs centaines d'enzymes différents existent chez les
bactéries aérobies et anaérobies à Gram positif ou
négatif [12].
I.5.2.2-Résistance aux aminosides
Les trois types de résistances qui peuvent
être élaborée à l'encontre des aminosides
sont:
- défaut d'accumulation, modification de la cible
;
- enzymes inactivatrices.
L'efficacité de ces mécanismes est
très variable ainsi que leurs fréquences respectives
[12].
I.5.2.3-Résistance aux quinolones
Deux groupes de mécanismes de
résistance ont été décrits pour les
fluoroquinolones :
- défaut ou mauvaise affinité de la cible
;
- défaut de pénétration ou
système d'efflux.
A l'heure actuelle, aucune enzyme d'hydrolyse des
quinolones n'a été décrite [12].
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
29
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
I.5.2.4-Résistance aux glycopeptides
Le site de fixation normal des glycopeptides est le
D-Ala-D-Ala terminal du précurseur du peptidoglycane. Chez les
entérocoques naturellement résistants à la vancomycine, le
D-Ala-D-Ala est remplacé par le D-Ala-D-Ser, dipeptide ayant moins
d'affinité pour la vancomycine, mais une affinité normale pour la
teicoplanine.
Deux types de résistances acquises
ont été décrits chez les entérocoques :
VanA et VanB.
I.5.2.5-Résistance aux macrolides et
kétolides
Modification de la cible :
Il s'agit d'une méthylation spécifique
de l'ARN ribosomal 23S de la sous-unité 50S du ribosome. Il s'ensuit une
diminution de l'affinité de
Macrolides-lincosamides-synergistines (MLS) pour le ribosome
[12].
Résistance enzymatique :
Elle est liée à la production
d'estérases ou de phosphotransférases à l'origine de la
résistance à haut niveau des entérobactéries aux
macrolides [12].
Efflux :
Un gène plasmidique
msrA code pour une protéine d'efflux
qui confère une résistance inductible aux macrolides
à 14 et 15 atomes [12].
I.6-La sensibilité des bactéries aux
antibiotiques
I.6.1-Sensibilité de Streptococcus pneumoniae
aux antibiotiques
Les souches Streptococcus pneumoniae
sont, jusqu'à maintenant, généralement bien
sensibles à la majorité des antibiotiques, sauf aux
aminoglycosides
Les pénicillines, les sulfamidés, les
macrolides sont actifs sur tous les pneumocoques, quel
que soit leur type [14].
30
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
I.6.2-Sensibilité de Haemophilus influenzae
aux antibiotiques
Les différentes espèces sont
habituellement résistantes au lincosamides et peu sensibles
in vitro aux macrolides.
Haemophilus influenzae est sensible aux
principales familles
d'antibiotiques telles que : la
pénicilline (ampicilline) ; les céphalosporines (Ière,
IIème et surtout IIIème génération) ; les
aminoglycosides ; le chloramphénicol ; la tétracycline ; la
triméthoprime ; les sulfamides ; la rifampicine et les quinolones
[14].
I.7-L'antibiogramme I.7.1-Définition
Un antibiogramme est une
technique de laboratoire visant à tester la
sensibilité ou la résistance d'une souche bactérienne
à croissance rapide vis-à-vis d'un panel d'antibiotiques
[15].
I.7.2-Principe
Les disques d'antibiotiques sont
déposés à la surface d'un milieu de culture
préalablement ensemencée avec une dilution calibrée de la
bactérie à tester [15].
Un gradient de concentration s'établit dans la
gélose et après 18 à 24 heures d'incubation la croissance
de la bactérie dessine des halos d'inhibition ou de non inhibition
autour du disque d'antibiotique qui seront mesurés avec une règle
spéciale (pied à coulisse) [15].
Ces diamètres, seront notés
Sensible(s), Intermédiaire(I), Résistant(R), comparativement aux
livres de référence [15].
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
31
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
I.8-La Concentration Minimale Inhibitrice(CMI)
I.8.1-Définition
La concentration minimale inhibitrice correspond
à la plus petite concentration d'antibiotique qui inhibe toute culture
visible d'une souche bactérienne après 18 heures de culture
à 37°C. Cette valeur caractérise l'effet
bactériostatique d'un antibiotique
[16].
Différentes techniques sont possibles ; en milieu
gélosé par diffusion avec des disques ou
languettes chargés d'antibiotiques ou
en milieu liquide avec différentes concentrations
d'antibiotiques dans les méthodes automatisées
[16].
I.8.2-Principe
La méthode de diffusion en gélose
consiste à déposer des disques de papier imprégnés
d'antibiotiques sur une gélose ensemencée avec la bactérie
à étudier [16].
Il s'établit dans la gélose
un gradient de concentration d'antibiotique autour de
chaque disque ou languettes. Après 18 heures d'incubation, il se produit
un halo d'inhibition autour de chaque disque ou languettes qui permet de
mesurer un diamètre [16].
Ce diamètre reflète la valeur de la
CMI. La comparaison de ce diamètre aux diamètres critiques
publiés par le CASFM (Comité de l'antibiogramme de la
Société Française de Microbiologie) permet de
répondre qualitativement si la souche étudiée est
sensible, intermédiaire ou résistante [16].
C'est la méthode de référence
pour mesurer l'activité d'un antibiotique vis-à-vis
d'une souche bactérienne donnée, elle consiste à
déterminer, dans des conditions bien standardisées (de milieu et
d'inoculum), la concentration minimale d'antibiotique capable d'inhiber la
croissance bactérienne.
Pour ce faire, on réalise une gamme de
dilutions (habituellement de raison 2) de l'antibiotique, soit en milieu
liquide, soit en milieu solide. Les différentes dilutions sont
ensemencées avec la bactérie étudiée et l'on peut
déterminer après 18h d'incubation, où se situe la CMI
[16].
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
32
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
I.8.3-Interprétation
Le diamètre de la zone d'inhibition est
corrélé à la CMI grâce à des
courbes de concordances qui ont été établies en
déterminant d'une part la CMI par dilution en gélose d'une
série de souches de sensibilités différentes et d'autre
part les zones d'inhibition obtenues avec des disques de contenu
différent et en traçant pour chaque charge de disque la courbe de
concordance entre diamètre d'inhibition et CMI .
La charge du disque qui sera choisie sera celle qui
donne le meilleur coefficient de corrélation.
En fonction de la courbe de concordance, on pourra
à partir du diamètre, déterminer la CMI et il s'agira
d'une lecture quantitative.
On peut interpréter la CMI trouvée en
fonction des critères définis plus haut et fournir les
résultats en souche sensible (S), intermédiaire (I) et
résistant (R).
Un troisième type d'interprétation est
le plus souvent utilisé : à chaque concentration
critique correspond un diamètre critique. Le
diamètre mesuré en mm peut donc être comparé
directement avec les diamètres critiques supérieurs et
inférieurs délimitant les catégories sensibles,
intermédiaires et résistantes [17].
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
33
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae

34
Figure 4 : Image d'un test de CMI [20]
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
II.1-Type d'étude
La présente étude de type transversale a
été réalisée de juin 2008 à Juin
2009.
II.2-Lieu d'étude
Les prélèvements ont été
effectués dans les différents hôpitaux et cliniques de
Libreville notamment : l'Hôpital Régional de Melen, le Centre
Hospitalier de Libreville, l'Hôpital d'Instruction des Armés Omar
Bongo Ondimba, l'Hôpital Pédiatrique d'Owendo et la clinique
EDZANG ; puis acheminés au Département de Microbiologie de la
Faculté de Médecine de l'Université des Sciences de la
Santé.
II.3-Patients
La population d'étude a été
constituée de 150 enfants et adultes, tous sexes confondus, sur lesquels
on a effectué les prélèvements du nasopharynx et de
l'oreille au cours d'une épidémie de grippe.
II.3.1-Critères d'inclusions
Les critères d'inclusions ont
été : les enfants et adultes présentant un syndrome
grippal, une rhinopharyngite, de la toux avec ou sans fièvre lors des
consultations.
II.3.2-Critères d'exclusions
Tous les patients ne présentant pas les
symptômes énoncés dans les critères
d'inclusions.
II.4-Matériel
- Gants stériles
- 4 à 5 écouvillons par
patients
- 2 jarres d'anaérobie
conditionnées
- 1 bougie
- Des allumettes
35
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
- Géloses chocolat polyvitex
- Géloses au sang préparées
à base de Trypcase soja + 5% de sang de mouton
- Pinces stériles
- Oses stériles de 1u, 10uL
- Glacière
- Etuves à 35-37°C
- Test à l'optochine
- Réaction d'agglutination : Slidex
méningites Kit ou Pastorex Kit
II. 5-Méthodes
II. 5.1-Enregistrements
Les données démographiques des patients
ont été enregistrées sur un formulaire (voir
annexe).
II. 5.2- Prélèvements
nasopharyngés et d'oreille
Ils ont été effectués par
écouvillonnages du nez ou de la gorge à l'aide d'un
écouvillon stérile. A cet effet, 4 écouvillons ont
été utilisés en effectuant des rotations.
En cas d'otite purulent, le prélèvement
a été effectué au niveau du conduit
auditif externe par le médecin ORL en utilisant 2
écouvillons.
II. 5.3-Analyses bactériologiques des
prélèvements
· Etape 1 : Ensemencement des milieux de
cultures
Premier jour
Sitôt le prélèvement
effectué, une boite de gélose a été
ensemencée par la technique des stries avec l'écouvillon
contenant les sécrétions nasales, pharyngées ou
de l'oreille.
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
36
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
La gélose à
été ensuite placée dans une jarre anaérobie. Les
prélèvements ainsi ensemencés sont transportés au
laboratoire et la jarre mise dans une étuve à 37 °C pendant
24 heures.
· Etape 2 : Examen des géloses
Deuxième jour
Après 24 heures, la jarre a été
sortie et les géloses examinées. L'examen des colonies s'est fait
devant la flamme du bec Bensen. La taille, l'aspect, la couleur et le type
d'hémolyse, ont été notés sur un
registre.
· Etape 3 : Réalisation du
frottis
Pour réaliser un frottis on a :
- émulsionné une colonie dans une
goutte d'eau distillée stérile à l'aide d'une pipette
Pasteur, sur une lame.
- séché la lame à l'air, non
loin de la flamme du bec Bensen.
- passé rapidement la lame à la flamme
trois fois pour fixer le frottis.
· Etape 4 : Coloration de Gram
C'est un examen qui a pour but de
déterminer la forme des bactéries, ainsi que leur coloration au
Gram, en vue de l'identification du germe.
Pour cela il faut :
- Recouvrir entièrement la lame d'une solution
de Violet cristal pendant 1 minute et rincer à l'eau du
robinet.
- Recouvrir ensuite d'une solution de
lugol pendant 1 minute et rincer à l'eau du
robinet.
- Décolorer la lame par de
l'alcool-acétone pendant 15 secondes, et rincer à l'eau du
robinet.
- Recouvrir la lame d'une solution de safranine
pendant 1 minute et rincer à l'eau du robinet.
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
37
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
- Sécher la lame.
- Noter la présence, la morphologie et coloration
des bactéries.
· Etape 5 : Tests
complémentaires
- Test de sensibilité à
l'optochine
La sensibilité de Streptococcus
pneumoniae à l'optochine s'est faite en touchant une
colonie suspecte alpha-hémolytique avec la boucle d'une
pipette Pasteur. Cette colonie a été ensuite ensemencée en
stries serrées sur gélose au sang.
Un disque à l'optochine de 6 mm de
diamètre est déposé sur la gélose, de
préférence aux extrémités.
La gélose a été incubée
18 à 24 heures à 37°C dans une jarre anaérobie puis
l'étuve.
- Réaction d'agglutination (trousse Slidex
méningite kit R5 de Bio Mérieux).
Ce test permet le diagnostic de certitude de
S. pneumoniae et H. influenzae.
Principe
Le principe de cette réaction est basé
sur la capacité des antigènes solubles de S
.pneumoniae ou de H. influenzae,
contenus dans l'échantillon à former des
agrégats avec les particules de latex
sensibilisées avec des anticorps spécifiques.
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
38
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
Mode opératoire
Cette technique s'effectue, suite à un
résultat positif à l'optochine, ainsi :
- une à deux colonies bactériennes ont
été placées dans un tube à essai, contenant de
l'eau distillée stérile puis émulsionnées
jusqu'à obtenir une couleur blanche laiteuse.
- la préparation centrifugée pendant 10
minutes à 2000t /min et le surnageant
récupéré.
- sur une carte aux emplacements prévus
à cet effet, on a placé 1 goutte de chacune des
suspensions homogènes de latex, puis respectivement
30uL de surnageant.
- le contenu de chaque cercle a été
mélangé, en utilisant toute la surface, à l'aide d'un
bâtonnet (utiliser une extrémité propre de bâtonnet
pour chaque cercle).
- on a imprimé à la carte un
léger mouvement de rotation, puis on a vérifié
régulièrement l'apparition d'une agglutination.
· Etape 6 : Antibiogramme Pour effectué
l'antibiogramme:
Des géloses chocolat poly Vitex
pour H. influenzae et gélose
Mueller Hinton additionnée de sang de mouton pour S.
pneumoniae on été coulées en boîte de
Pétri sur une épaisseur de 4 mm. Les géloses ont ensuite
été séchées avant l'emploi.
Dans un tube à hémolyse contenant de
l'eau distillée stérile, une à deux colonies ont
été émulsionnées pour obtenir une turbidité
comparable à celle du Mac Ferland 0.5.
Un écouvillon stérile a
été trempé dans la préparation, ensemencé
sur gélose par la technique des stries serrées. La gélose
été placée à l'étuve à 37°C
pendant 15 minutes.
Après les 15 minutes, des disques
d'antibiotiques ont été déposés à l'aide
d'une pince flambée en prenant soin de les espacer de 24 mm.
La gélose a été laissée
à température ambiante pendant 30 mm avant de la mettre à
l'étuve à 37°C pendant 24 h.
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
39
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
La lecture s'est faite à l'aide d'un pied
à coulisse en mesurant avec précision les diamètres des
zones d'inhibition sur la base de la boite de gélose
retournée et maintenue fermée.
Les résultats ont été
comparés aux valeurs critiques figurant dans les tables de lecture. Les
bactéries ont été classées dans l'une des
catégories : Sensible, Intermédiaire ou Résistant à
l'antibiotique.
· Etape 7 : Détermination de la
Concentration Minimale Inhibitrice (CMI)
La CMI est une technique de laboratoire
qui est réalisé en cas de résistance des
bactéries aux antibiotiques. Pour cela:
Dans un tube à hémolyse contenant de
l'eau distillée stérile, une à deux colonies ont
été émulsionnées pour obtenir une turbidité
comparable à celle du Mac Ferland 0.5.
Un écouvillon stérile a
été trempé dans la préparation, ensemencée
sur gélose chocolat poly Vitex pour H. influenzae
et gélose Mueller Hinton additionné de 5% sang de
mouton pour S. pneumoniae par la technique des stries
serrées.
La gélose a été placée
l'étuve à 37°C pendant 15minutes.
Après les 15 minutes, 2 languettes
d'antibiotiques ont été déposées en sens
opposé à l'aide d'une pince flambé.
Les boites ont été laissées
à température ambiante pendant 30 minutes avant de la mettre
à l'étuve à 37°C pendant 24 heures.
40
La lecture de la CMI de l'antibiotique a
été faite au point d'intersection de l'ellipse d'inhibition et de
la bandelette après 24 h.
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
III.1-Aspect des colonies de Streptococcus
pneumoniae et de Haemophilus
influenzae
Sur gélose au sang, les colonies de
S. pneumoniae sont petites, grisâtres,
muqueuses (en gouttes de rosée), entourées par une zone
verdâtre d'hémolyse alpha.
Sur gélose chocolat polyvitex, les colonies de
H. influenzae sont grandes, plates,
opaques, incolores ou grisâtres sans
hémolyse.
III.2-Résultats de la coloration de Gram
Lors de la lecture au microscope on a observé
:
S. pneumoniae qui se
présentait comme des diplocoques à Gram positif
lancéolés, parfois en chaînettes ;
H. influenzae qui
avait l'aspect de petits bacilles ou des coccobacilles à Gram
négatif polymorphes disposés au hasard.
III.3-Lecture du test à l'optochine
Après incubation, on a observé les zones
d'inhibition autour du disque d'optochine. Toutes les souches testées
ont donné un diamètre supérieur à 15 mm de
diamètre indiquant une sensibilité de la souche à
l'optochine, relative à Streptococcus pneumoniae.
III.4-Test d'agglutination
Pour toutes les souches suspectes testées, nous
avons noté qu'au niveau de celles dont le test était positif il y
avait présence d'agrégats parfois légers ou
prononcés.
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
41
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
III. 5- Répartition des cas dans la population
générale
Le tableau I montre que sur les 150
prélèvements effectués nous avons détecté 6
cas positifs soit (4%), et 144 cas négatifs soit (96%).
42
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
Tableau I : Répartition des cas dans la population
générale.
Résultats Nombre de cas Pourcentage
144 96
6 4
150 100
Négatifs Positifs Total
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
III.6-Répartition des cas selon les tranches
d'âge
Le tableau II montre que ce sont les enfants
âgés de 0 à 6 ans qui étaient infectés : 3
cas positif dans la tranche d'âge de 0-1ans, 2 cas positifs de
1-2 ans et 1 cas de 2-7 ans.
Tableau II : Répartition des cas selon les
tranches d'âge
43
Tranches d'âge
|
Résultats
|
0-1
|
1-2
|
2-7
|
7-12
|
+ de 12
|
Total
|
|
Négatifs
|
28
|
16
|
12
|
2
|
86
|
144
|
|
Positifs
|
3
|
2
|
1
|
0
|
0
|
6
|
|
Total
|
31
|
18
|
13
|
2
|
86
|
150
|
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
III.7- Répartition des cas positifs selon les
espèces
Sur les 6 cas positifs, 5 étaient des infections
dues à Streptococcus pneumoniae (83,33%) et 1
cas du à Haemophilus influenzae soit (16,67%),
(figure 5).
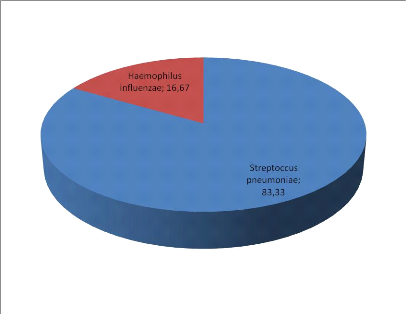
44
Figure 5 : Répartition des cas positifs selon les
espèces
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
III.8-Résultats de l'antibiogramme et de la
CMI
des souches de S. pneumoniae
Les tableaux (IIII et IV) nous montrent que les 5
souches de Streptococcus pneumoniae testées
ont été toutes résistantes à l'Erythromycine et
à la Clindamycine (100%) ; 4 souches ont été
résistantes à la tétracycline, au chloramphénicol
et à l'association sulfamide+Triméthoprime (80%) et enfin 1
souche à été sensible à la tétracycline, au
chloramphénicol et à l'association sulfamide+Triméthoprime
(20%). Les souches ont été identifiées par les 3
premières lettres du nom du patient, soit ONA, AYO, MAH, MAN et
BOU.
Tableau III : Antibiogramme et CMI de la souche S.
pneumoniae ONA
|
Antibiotiques Concentration
du disque (ug)
|
Taille de la zone d'inhibition (mm)
|
1S 2I 3R CMI (ug/ml)
|
Erythromycine 15.00 15 R 0.047
Clindamycine 2 2 R 0.5
Sulfamide+triméthoprime 23.75+1.25 25
S
Tétracycline 30 30 S
Chloramphénicol 30 30 S
Amoxicilline+acide clavulanique 20+10 20 I
0.50
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
45
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
Tableau IV : Antibiogramme et CMI de la souche
S.pneumoniae AYO
|
Antibiotiques
|
Concentration du disque (ug)
|
Taille de la 1S 2I
zone
d'inhibition
(mm)
|
3R
|
CMI (ug/ml)
|
|
Erythromycine
|
15
|
12
|
R
|
0,044
|
|
Clindamycine
|
2
|
13
|
R
|
0,75
|
|
Sulfamide+triméthoprime
|
23.75+1.25
|
12
|
R
|
|
|
Tétracycline
|
30
|
12
|
R
|
|
|
Chloramphénicol
|
30
|
13
|
R
|
|
|
Amoxicilline+acide clavulanique
|
20+10
|
14
|
R
|
6
|
Tableau V : Antibiogramme et CMI de la souche de
S.pneumoniae MAH
46
|
Antibiotiques
|
Concentration du disque (ug)
|
Taille de la 1S 2I
zone
d'inhibition
(mm)
|
3R
|
CMI (ug/ml)
|
|
Erythromycine
|
15
|
10
|
R
|
0,040
|
|
Clindamycine
|
2
|
13
|
R
|
0,75
|
|
Sulfamide+triméthoprime
|
23.75+1.25
|
12
|
R
|
|
|
Tétracycline
|
30
|
10
|
R
|
|
|
Chloramphénicol
|
30
|
13
|
R
|
|
|
Amoxicilline+acide clavulanique
|
20+10
|
19
|
R
|
0.38
|
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
Tableau VI: Antibiogramme et CMI de la souche de
S.pneumoniae MAN
|
Antibiotiques Concentration
du disque (ug)
|
Taille de la zone d'inhibition (mm)
|
1S 2I 3R CMI
(ug/ml)
|
Erythromycine 15 21 R 0,032
Clindamycine 2 21 R 0,80
Sulfamide+triméthoprime 23.75+1.25 10
R
Tétracycline 30 8 R
Chloramphénicol 30 18 R
Amoxicilline+acide clavulanique 20+10 20 I
0.50
Tableau VII : Antibiogramme et CMI de la souche de
S.pneumoniae BOU
|
Antibiotiques Concentration
du disque (ug)
|
Taille de la zone d'inhibition (mm)
|
1S 2I 3R CMI
(ug/ml)
|
Erythromycine 15 21 R
Clindamycine 2 19 R
Sulfamide+triméthoprime 23.75+1.25 8
R
Tétracycline 30 12 R
Chloramphénicol 30 15 R
Amoxicilline+acide clavulanique 16
47
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
III.9-Résultat de l'antibiogramme et de la CMI
de
Haemophilus influenzae
Le tableau VIII montre le diamètre d'inhibition
des différents antibiotiques. Il nous montre aussi que la souche de
Haemophilus influenzae testée à
été résistante à l'association Amoxicilline+acide
clavulanique, à l'association
sulfamides+Triméthoprime, et a une résistance
intermédiaire à l'Ofloxacine. La souches a été
identifiée ALE
Tableau VIII : Antibiogramme et CMI de la souche de
H.influenzae ALE
|
Antibiotiques Concentration
du disque (ug)
|
Taille de la zone d'inhibition (mm)
|
1S 2I 3R CMI
(ug/ml)
|
Amoxicilline+acide clavulanique 15 21 R
Ofloxacine 2 21 I 0 ,38
Sulfamide+triméthoprime 23.75+1.25 10 R 0
,4
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
48
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
Au terme de notre étude, nous avons recueilli 150
prélèvements, nombre qui s'avère insuffisant
lors d'une épidémie.
Généralement, les épidémies
d'affections respiratoires sont d'abord virales [4]. Ces affections sont par la
suite surinfectées par des bactéries, dont
Streptococcus pneumoniae et Haemophilus
influenzae.
Le fait de n'obtenir que 4% de cas positif tel
que mentionné dans le tableau I, peut s'expliquer par le fait
que nous avons commencé les prélèvements en retard, faute
de réactifs alors que l'épidémie tirait vers la
fin.
Bien que l'échantillonnage
soit réduit, les résultats mentionnés dans le tableau II,
similaire à ceux décrits dans la littérature [10] qui
montre que la tranche d'âge la plus touchée est celle de 0
à 2 ans (voir de 0 à Tans).
Les résultas illustrés dans la figure 4,
montrent la tendance de S. pneumoniae à
être le plus fréquemment retrouvés dans les pneumopathies,
les otites et les méningites, par rapport à H.
influenzae qui vient au second plan, suivi de
Neisseria meningitidis[19].
IV.1-Aspect des colonies
L'aspect des colonies est un élément
indispensable à l'identification d'une bactérie, car, toutes les
bactéries n'ont pas les mêmes caractéristiques
morphologiques sur gélose.
IV.2-Coloration de Gram
La coloration de Gram est une étape clé
dans l'identification des bactéries. Après l'examen de l'aspect
des colonies, il est important de déterminer le Gram de la
bactérie, afin de continuer le processus d'identification. Il nous
oriente sur le test qui va être subséquemment
effectué.
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
49
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
IV.3-La sensibilité à l'optochine
C'est à la suite des résultats de la
coloration de Gram positif, et vu que nous avions des cocci Gram positif que le
test de sensibilité à l'optochine est suggéré comme
diagnostic présomptif de S. pneumoniae. Ceci
n'était pas valable pour H. influenzae. Le
résultat positif avec S. pneumoniae
présageait qu'il pourrait s'agir de cette
bactérie. Néanmoins un test complémentaire
s'imposait.
IV.4-La réaction d'agglutination au latex
La formation d'agrégats avec les antigènes
solubles provenant des échantillons, a permis de confirmer
l'identification à savoir, qu'il s'agissait de
S. pneumoniae dans 5 cas et H.
influenzae dans 1 cas.
IV. 5-Antibiogramme et CMI
Chaque germe isolé et bien identifié a
été soumis à un antibiogramme.
Les résultats de l'antibiogramme nous ont
montré qu'il y a un spectre de sensibilité et de
résistance, d'intermédiaire, pour chacune des souches
identifiées.
Pour des exigences de recherche, la détermination
de la CMI nous a été demandée même si le les souches
étaient sensibles aux antibiotiques, tel le cas de S.
pneumoniae.
Mais en pratique courante, la CMI n'est effectuée
que si la souche est résistante à tous les antibiotiques
testée. En ce moment un seul antibiotique est choisi pour la
réalisation, en collaboration avec le médecin afin de tenir
compte des éventuels allergies aux antibiotiques,
de connaître (malade hospitalisé, malade en ambulatoire, femme
enceinte....). Le choix de l'antibiotique doit se faire en tenant
aussi compte du mode d'administration, de l'âge et du
coût.
Le résultat de la CMI est donné au
médecin sur une fiche d'antibiogramme en y inscrivant la
concentration minimale.
50
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
Le médecin fera la prescription en tenant compte
de la concentration indiquée, qui est la plus
petite quantité d'antibiotique capable d'inhiber
la croissance des bactéries.
Une étude a été menée au MALI
par MARIKO en 2005 [10], qui a montré une sensibilité
de S. pneumoniae de 97% à la
pénicilline G et une résistance de 3%, une sensibilité de
92% au Ceftriaxone et une résistance de 8% , une sensibilité de
94% au Chloramphénicol et une résistance de 6% , et enfin une
sensibilité de 87% à l'érythromycine et une
résistance 13%. Notre étude a utilisé des antibiotiques
différents (clindamycine, tétracycline, amoxicilline+acide
clavulanique, sulfamide+triméthoprime) à l'exception
de l'érythromycine et du chloramphénicol. Cinq souches
de S. pneumoniae étaient résistantes
à 100% à l'érythromycine, 4 étaient
résistantes à la tétracycline, au chloramphénicol
et à l'association sulfamide+triméthoprime soit 80%
respectivement. Pour la même bactérie et des antibiotiques
identiques, nous enregistrons un taux de résistance largement
supérieur à celui observé au MALI (résistance au
chloramphénicol 6% au MALI versus 80% au GABON, résistance
à l'érythromycine 13% au MALI versus 100% au GABON).
Si l'on regarde les tableaux III à VII, la souche
isolée chez le patient ONA (tableau III) ne devrait pas être
soumis à une CMI, puisqu'il y avait des antibiotiques pour
lesquelles la souche demeurait sensible. Par contre les souches
isolées des patients AYO, MAH, MAN et BOU étant totalement
résistantes à tous les antibiotiques testés,
nécessitaient une CMI.
Dans le cas de H. influenzae,
nous nous sommes retrouvés en présence d'une souche
qui avait un profil résistant et intermédiaire (de
sensibilité réduite). Dans ce cas aussi, une CMI
s'impose.
L'étude menée à Antananarivo
(Madagascar) par Razafindralambo en 2003 dans une
enquête sur les méningites
bactériennes lui a permis, de Juin 1998 à Juin 2000 de recueillir
27 souches de Haemophilus influenzae. Les
antibiotiques testés furent la
Triméthoprime-sulfaméthazole avec 74% de résistance, la
Kanamycine avec 59% de résistance, la Tétracycline avec 52% de
résistance, le Chloramphénicol avec 42% de résistance,
l'érythromycine avec 26% de résistance, la Minocycline avec 23%
de résistance, l'Amoxicilline avec 17% de résistance, la
Gentamycine avec 15% de résistance, l'Amoxicilline+acide
clavulanique avec 4% de résistance et 11%
51
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
d'intermédiaire, la rifampicine avec 7% de
résistance, le Céfotaxime et péfloxacine 0% de
résistance. Cette étude diffère de la nôtre sur
plusieurs antibiotiques sauf l'amoxicilline+acide clavulanique, avec un taux de
résistance inférieur au notre (4% versus 100%).
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
52
Surveillance de la résistance aux antibiotiques
de Streptococcus pneumoniae et Haemophilus
influenzae
On enregistre un taux important de
résistance aux antibiotiques des souches de
S.pneumoniae et
H.influenzae. Cependant, ceci reste à
confirmer avec un échantillonnage plus élargi.
Cette étude constitue une étape
préliminaire à la mise au point de le technique de la CMI, dont
l'importance est capitale chez un patient hébergeant une souche
multirésistante aux antibiotiques.
Il est d'autre part le point de départ de la
surveillance de la résistance de ces germes aux antibiotiques qui
à la longue sera un outil disponible chez les praticiens en cas
d'infections graves nécessitant la mise en place d'une
antibiothérapie probabiliste en attendant le résultat du
laboratoire.
MENES-USS-FM-DBV Mémoire n°2 59
présenté par ONDENOT Yann Christian
53
1-
www.santetropicale.com
2- Précis de Bactériologie clinique
2ed, J. FRENEY , François RENAUD EKSKA 2007
3-
http://fr.wikipedia.ogr/wiki/streptococcus_pneumoniae
2e d
4- Bactériologie Médicale C. NAUCIEL J-L
VILDE, 2005 MASSON
5-
www.cbm25.fr/mageslip/analyses/13-en_savoir_plus.pdf
6- Groupe Rémic de la société
française M B
7-
www.microbes-edu.org/étudiant/haemophilus.html
8-
http://fr.wikipedia.org/wiki/haemophilus_influenzae
9-
http://menbres.lycos.fr/jolan/muco/clinique.htlm
10- « Caractères bactériologiques et
place de Streptococcus pneumoniae dans les infections
bactériennes invasives chez les enfants hospitalisés dans le
service de pédiatrie de l'hôpital Gabriel TOURE »,
thèse de pharmacie soutenue par Mariko RAMATA au MALI en
2005.
11-
www.medix.free.fr/sim/evolution-dissemination-bactérienne.php
12- De l'antibiogramme à la prescription F. JEHL
M.CHOMARAT A. GERARD édition BIOMERIEUX
13- Antibiotiques, agents bactériens et
antifongiques A.BRYSKIER Ellipse
14-
www.informationhospitalière.com/dico-66-streptococcus-pneumoniae.htlm
15-
www.microbes-edu.org
16-
www.medec.com/meditline/review/bruluures/vol_1/num_3/
text%5cvol1n3p141.asp
17- L'ANTIBIOGRAMME, COURVALIN P, GOLDSTEIN F. MPC,
VIDEON e d Paris 1985
18-
www.microbelibrairy.org/etudiant/streptococcus.html
19- A.Gravet et al « Evolution de la
sensibilité de S.pneumoniae aux Antibiotiques, 2005
»
20-Manual for laboratory identification and antimicrobial
susceptibility Testing of bacterial pathogens of public health importance in
the Developing world. World Health Organization.
REPUBLIQUE GABONAISE
MINISTERE DE L'ENSEIGNEMENT SUPERIEUR
DE LA RECHERCHE ET DE L'INNOVATION
TECHNOLOGIQUE
UNIVERSITE DES SCIENCES DE LA SANTE
FACULTE DE MEDECINE

Charte Internationale
Nous technologistes biomédicaux, appartenant au corps des
biotechnologistes, chargés:
- de l'exécution des analyses de biologie
médicale, du contrôle de leur qualité et le cas
échéant de leur mise au point ;
- de la maintenance de l'appareillage ;
- du prélèvement et du recueil de
matériel et liquides organiques ;
- de la réalisation technique d'épreuves
fonctionnelles ou d'actes liés à la procréation
assistée.
Nous engageons à :
- respecter la législation en vigueur concernant le
mode d'exercice, les conditions particulières imposées pour la
direction d'un laboratoire ;
- maintenir la compétence qu'exigent les standards de
qualité d'obligation d'une formation initiale spécifique
actualisée, et d'une formation complémentaire pour toute
adaptation à une technologie nouvelle ;
- appliquer et faire appliquer les règles d'une bonne
exécution des analyses garantissant leur fiabilité ;
- mettre en commun les connaissances et l'expérience
acquise pour une amélioration des techniques ;
- aider à la formation et à la promotion du
personnel moins qualifié ;
- assurer ou faire assurer l'application des règles
minimales d'hygiène et de sécurité ;
- respecter le code de déontologie et contribuer
à la reconnaissance et à la promotion de notre profession.
REPUBLIQUE GABONAISE
MINISTERE DE L'ENSEIGNEMENT SUPERIEUR
DE LA RECHERCHE ET DE L'INNOVATION
TECHNOLOGIQUE
UNIVERSITE DES SCIENCES DE LA SANTE

FACULTE DE MEDECINE
Code de déontologie
*Bien que conscient du rôle qu'il joue dans le
diagnostic médical et de sa responsabilité dans la
réalisation technique des actes de biologie, le technologiste
biomédical doit s'abstenir de toute clinique, dans ses relations avec
les patients ou les cliniciens. A titre exceptionnel et pour des raisons
motivées par l'urgence du diagnostic et la gravité de la
pathologie, il pourra enfreindre cette règle après
délégation des autorités médicales
compétentes et une formation sanitaire complémentaire, notamment
lorsqu'une situation économique, géographique ou naturelle
particulière crée un contexte sanitaire critique.
* Le technologiste biomédical est tenu au secret
professionnel, dans les mêmes conditions que tout autre membre de la
chaîne de santé et ne peut en être relevé que dans
les conditions légales en vigueur dans son pays.
* Dans l'exercice de sa profession, le technologiste
biomédical doit tenir compte des limites de sa compétence et des
moyens mis à sa disposition avant d'accepter la charge d'une
fonction.
* Le technologiste biomédical ne doit en aucun cas
modifier ou accepter de modifier les résultats des examens qui lui sont
confiés.
* Il doit également assurer tous les contrôles
indispensables à la fiabilité des résultats.
* Le technologiste biomédicale ne contribuera pas
sciemment à des travaux dont l'objectif irait à l'encontre de la
préservation de la santé et de la qualité de la vie de
l'homme ou des recommandations des Comités d'Ethique.
* Le technologiste biomédical doit contribuer dans la
mesure de ses possibilités au perfectionnement des techniques
utilisées.
* Il doit également prendre une part active à
l'évolution de sa profession par l'intermédiaire
d'échanges avec ses collègues nationaux et internationaux et
doit, en fonction des moyens qui lui sont offerts, participer à des
actions de formations ou d'informations professionnelles.
| 


