|

Faculté des Sciences Tétouan
- äÇæØÊ
ãæáÚáÇ Éíáß
-
Master Fondamentale :
Chimie
Titre du Mémoire de PFE :
ARGILE ET MINÉRAUX ARGILEUX :
PROPRIÉTÉS
PHYSICO-CHIMIQUES ET PROPRIÉTÉS
COLLOÏDES
Présenté par :
Mr. : Abdelhadi EL HACHMI
Encadrant : Pr. Khalid DRAOUI
Date de soutenance : 08 Juillet 2013
JURY
|
Nom et Prénom
|
Etablissement
|
Qualité
|
|
Pr. Ikram BEN MAIMOUN
|
Faculté des sciences
|
Président
|
|
Pr. Khalid DRAOUI
|
Faculté des sciences
|
Encadrant
|
|
Pr. Abdesalam BARHOUN
|
Faculté des sciences
|
Examinateur
|
|
Pr. Abdelouahid BEN ALI
|
Faculté des sciences
|
Examinateur
|
Ce travail effectué au laboratoire de la
société « Céramica DERSA »

Ce travail de mémoire a été
effectué au sien de labo-technique de la société de «
Céramica DERSA » dirigée par Mr Ahmed AL KHAYAT.
Mes premiers remerciements vont à mon encadrant de
mémoire, Mr Pr Khalid DRAOUI. Je le remercie sur tous les efforts qu'il
a déployés dans la
supervision du déroulement des manipulations, de sa
contribution
substantielle dans l'analyse et l'interprétation des
résultats, des corrections du manuscrit, des encouragements et des
conseils qu'il n'a cessés de me prodiguer.
Je tiens à remercie le professeur Ikram BEN MAIMOUN de
m'avoir fait l'honneur de présider le jury de cette mémoire.
Je tiens à remercie les professeurs Abdesalam BARHOUN
et Abdelouahid BEN ALI pour avoir accepté de jurer ce travail et
d'assurer la tache d'examinateur.
Je tiens à adresser mes sincères remerciements
à Mr Abdelouahab EL SGHIAR, responsable des ressources humaines de la
société « Céramica
DERSA » de m'avoir accepté dans sa
société pour la réalisation de ce travail.
Je tiens également à adresser mes remerciements
à Mr Ahmed AL KHAYAT, responsable de laboratoire pour son aide et ses
conseils précieux.
Je remercie également toute l'équipe du
labo-technique de la société « Céramica DERSA »
et tous mes collègues qui pendant le stage m'ont aidé
professionnellement et moralement je les remercie de tout mon coeur.
Remerciement
i
I. Présentation de la société 42
Table des matières
Remerciement i
Introduction générale 6
CHAPITRE-I-:
ETUDE BIBLIOGRAPHIE
I. Les argiles 9
I.1. Origine 9
I.2. Définition 10
II. Les minéraux argileux 10
II.1. Edifices phylliteux 11
II.1.1. Structure des feuillets 11
III. Classification des minéraux argileux 15
IV. Structure des principaux minéraux argileux 16
V. Les minéraux à pseudo-feuillets et à
faciès fibrux 23
VI. Organisation texturale des matériaux argileux 24
VI.1. Organisation multi-échelle de la phase solide 24
VI.2. Empilements des feuillets 26
VI.3. Organisation des espaces poraux 28
VII. Propriétés physico-chimiques des argiles 29
VII.1. Charge des surfaces argileuses 29
VII.2. La surface spécifique 32
VII.3. Hydratation et gonflement des minéraux argileux
34
VIII. Propriétés colloïdes des argiles 36
VIII.1. Théorie de la double couche 37
VIII.2. Théorie DLVO 39
CHAPITRE-II-: DESCRIPTION GENERALE DE LA SOCIETE
« CERAMICA DERSA »
II. Description de l'usine 43
III. Processus de production 44
CHAPITRE-III-: PARTIE EXPERIMENTALE
I. Taux de l'humidité des argiles 48
II. Granulométrie des argiles 49
II.1. Définitions 49
II.2. Analyse granulométrique des argiles brute 50
III. Résistance mécanique des carreaux
céramiques 52
IV. Taux des carbonates dans les argiles 54
V. Echantillonnages 55
V.1. Echantillons à bases d'argile brute 58
V.2. Echantillons à bases d'argile
équilibrée 59
V.3. Echantillons à bases d'argile recyclée
60
Conclusion générale 61
Références bibliographiques 62
Annexes 65
1
INTRODUCTION
GENERALE
J
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 6
Introduction générale
Introduction générale
Le mot argile aurait deux origines, l'une grecque par le mot
Argos qui veut dire blanc, l'autre latine par le mot argilla
(caillère et al. 1982). L'argile est un matériau naturel
qui a été utilisé par l'homme depuis très
longtemps, notamment dans l'antiquité. Pour la poterie. Son
intérêt est considérable dans divers domaines en raison,
à la fois de son abondance et de ses propriétés en
agriculture, étant donné que tous les sols cultivés en
contiennent plus au moins mais parfois en grand quantités. On sait
depuis longtemps que les sols argileux sont fertiles mais souvent difficiles
à travailler en raison de leurs propriétés
mécaniques. Ces mêmes propriétés font des roches
argileuses des substrats difficiles pour le génie civil. Ce sont aussi
des matériaux très utilisés dans l'industrie de la
céramique, en particulière. Tous ces domaines très
différents les uns des autres font que de nombreux spécialistes
de plusieurs disciplines se sont intéressés aux argiles, chacun
avec ses connaissances et son vocabulaire. Cela se traduit par une abondante
littérature qui relate une grande quantité de travaux de diverse
nature mais aussi l'existence d'une certaine confusion dans les langages
utilisés. Aussi, est-il utile de précisé dès
maintenant le vocabulaire approprié pour le sujet qui nous
préoccupe ici.
Argiles, matériaux argileux, substrat argileux, roches
argileux ces mots et expressions sont des synonymes et désignent un
matériau naturel qui se trouve sous forme de gisements mais aussi en
quantités plus au moins grandes dans les sols et les
sédiments.
Ce matériau est soit constitué par un seul
minéral soit, le plus souvent, par un mélange de minéraux
appelés minéraux des argiles. Parmi ces minéraux, certains
sont des minéraux argileux, ou encore argiles minéralogiques,
d'autres sont des minéraux sont argileux comme des oxydes
métalliques, des carbonates, des feldspaths et le quartz par exemple.
Par ailleurs, ces minéraux des argiles se trouvent essentiellement sous
forme de très petites particules généralement
inférieures à 2 um. L'ensemble de ces petites particules est
appelé argiles granulométrique [1].
Ce travail s'inscrit alors dans le cadre général
de ce projet il présente différents études des
caractéristiques technologiques de l'argile entrante dans la fabrication
des carreaux céramiques.
Ce mémoire s'articule autour de trois chapitres.
Le chapitre -I- de ce mémoire sera
consacré à une étude bibliographique approfondie des
argiles. Les minéraux étudiés dans ce mémoire, les
minéraux argileux. Nous nous attachons à
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 7
Introduction générale
décrire leur structure, leurs propriétés
physico-chimiques et leurs propriétés colloïdes et nous
introduisons la notion d'organisation des matériaux argileux.
Le chapitre -II- est consacré à la
présentation générale de la société
« Céramica DERSA », description de l'usine et
processus de production.
Le chapitre -III- est consacré à la
présentation de la partie expérimentale, au premier temps nous
mesurons le taux d'humidité, l'analyse granulométrique et la
résistance mécanique des argiles utilisé à l'usine.
Au second temps nous préparerons des échantillons
synthétiques d'argile brute, d'argile équilibrée et
d'argile recyclée. Dans ces argiles nous muserons la perte au feu, le
retrait / dilatation, l'absorption d'eau et le taux de CaCO3.
En fin, nous clôturons par une conclusion
générale résumant les principaux résultats
significatifs acquis et nous indiquons les perspectives envisagées pour
ce travail.

CHAPITRE
-I-
ETUDE BIBLIOGRAPHIE
Chapitre-I- Etude bibliographie
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 9
I. Les argiles
I.1. Origine
L'origine des argiles peut être reliée à
différents processus, tels que l'altération physique et/ou
chimique (i.e. transformation primaire d'autres matériaux), la
déposition in situ (i.e. redéposition après le transport
de "détritus") et les processus hydrothermal et/ou
diagénèse. La figure I-1, présente les degrés
d'altération des divers silicates. On remarque que si la plupart des
minéraux sont attaqués, le quartz est particulièrement
résistant et ne sera que très peu touché par
l'altération. Il est également à signaler que les
minéraux tels que le quartz, la muscovite, le feldspath, la biotite,
l'amphibole et les plagioclases sont les principaux constituants du
granité, tandis que le basalte est constitué par le
pyroxène, l'olivine et le plagioclase calcique. Voila pourquoi le
granité résiste mieux que le basalte aux différents
processus d'altération [2].
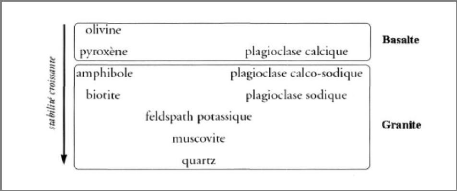
Figure I-1 : Altération
des silicates [2]
Un exemple de l'altération du granité est
montré sur la figure I-2. On peut observer que le granité se
décompose en une mélange de sable (quartz très peu
altérable) et d'argiles. En effet, les minéraux silicates autres
que le quartz sont altérés progressivement en minéraux
argileux.
Chapitre-I- Etude bibliographie
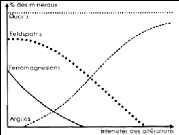
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 10
Figure I-2 : Schème
général de formation et d'évolution de roches [2]
I.2. Définition
De manière générale, le mot argile(s)
sert à désigner l'ensemble des particules dont la taille est
inférieure à 2 um. En termes de taille de grain, le mot argile a
deux sens. Il désigne d'abord les particules faites des minéraux
argileux dont les cristaux excèdent parfois 2 um. Les minéraux
argileux proviennent essentiellement de l'altération chimique de
certains minéraux composant la roche. Cette altération chimique
agit de façon que certains minéraux silicates, comme les micas ou
les feldspaths sont transformés en d'autres espèces
minérales (kaolinite, illite, Montmorillonite), souvent de
granulométrie plus fine. Les minéraux argileux sont surtout de la
famille de silicates, formés à base de silice (Si) et
d'oxygène (O), tels que le quartz et les feldspaths. Le mot
minéral argileux comprend les minéraux qui font partie du groupe
des phyllosilicates, appelés aussi silicates de structure
lamellaires.
Le terme argile désigne ensuite les débris les
plus fins de la désagrégation-altération physique des
roches appelés la farine de roche (d<2 um). Cette farine peut
contenir une proportion de minéraux argileux plus ou moins importante
[2].
II. Les minéraux argileux
Selon J. Mering (1963) le caractère argileux d'un
minéral repose sur quatre caractéristiques : -
la petite dimension des particules de minéraux,
inférieure à 2 um ;
- la dissymétrie des
particules de forme généralement lamellaire ce qui rend compte de
propriétés mécaniques comme la plasticité et de
propriétés physico-chimiques comme la rétention de
molécules d'eau ;
- la possibilité, pour ces
particules, de pouvoir donner des suspensions aqueuses plus ou moins stables
;
Chapitre-I- Etude bibliographie
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 11
- leur composition chimique ; ce
sont des silicates ;
Ces caractéristiques sont celles des phyllosilicates
qui se définissent ainsi : « Les minéraux argileux
appartiennent à la famille des phyllosilicates et sont constitués
par une couche tétraédrique bidimensionnelle de composition
T2O5, T pouvant être Si4+, Al3+ ou
Fe3+. Ces tétraèdres sont liés dans un
même plan par trois de leurs sommets, le quatrième étant
orienté dans une autre direction. Les couches
tétraédriques sont liées dans la structure à des
couches octaédriques ou à des groupes de cations
coordonnés ou indépendants » [1].
II.1. Edifices phylliteux
II.1.1. Structure des feuillets
Les minéraux argileux sont des aluminosilicates
présentant une structure en feuillets, d'où leur appellation de
phyllosilicates (terme formé d'un morphème "phullon" issu du grec
signifiant: qui a l'aspect de feuille). Ces feuillets sont bidimensionnels et
constitués de deux types de couches [3] :
? La couche tétraédrique (figure I-3)
est formée de silice tétraédrique, c'est-à-dire
d'un cation Si4+ entouré de quatre anions O2-, qui
constituent les sommets du tétraèdre. Chaque
tétraèdre partage trois atomes d'oxygène avec les
tétraèdres adjacents. Ces atomes d'oxygène partagés
sont arrangés en réseau hexagonal qui forme la base de la couche.
Le bilan des charges positives et négatives présentes dans cette
structure n'est pas neutre. En effet, chaque tétraèdre est
formé d'un cation Si4+ et de trois anions O2- qui
forment la base du feuillet et qui appartiennent aussi à un
tétraèdre adjacent, et d'un quatrième anion O2-
qui lui n'est pas partagé. Le bilan des charges est alors : 4 +
3× (-2)/2 + (-2) = -1.
L'électroneutralité de la couche est obtenue par
la liaison avec une couche chargée positivement, par la présence
d'ions compensateurs à la surface de la couche, ou par ajout d'un proton
H+ sur certains O2-. L'épaisseur de cette couche
tétraédrique est de 4,63 Å.
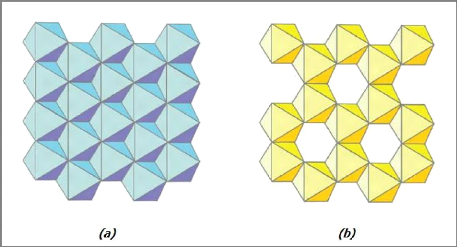
? La couche octaédrique (figure I-3) est
formée de cations Al3+ ou Mg2+ entourés de
six groupements hydroxyle OH-. Ces octaèdres sont
reliés entre eux par des anions communs, et forment une couche plane. Le
bilan des charges présentes dans le feuillet est de +3 pour le cation
Al3+ et -1 pour le groupement hydroxyle, mais chaque OH-
est partagé avec trois cations, ce qui donne : +3 + 6× (-1)/3
= +1. Pour atteindre l'électroneutralité, seulement deux sites
ocatédriques sur trois sont occupés par un cation Al3+
; on parle alors de couche di-octaédrique de gibbsite. Dans le cas
du cation Mg2+, lorsque tous les sites sont occupés, la
Chapitre-I- Etude bibliographie
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 12
couche est neutre ; c'est la structure tri-octaédrique
de brucite. La couche octaédrique a une épaisseur de 5,05
Å.
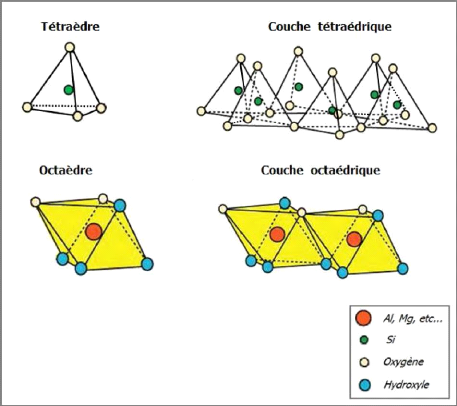
Figure I-3 :
Représentation des tétraèdres et des
octaèdres [4].
Ces couches tétraédriques ou octaédriques
sont donc formées par la superposition de plans d'oxygènes
délimitant des cavités de forme tétraédrique ou
octaédrique. La stabilité du feuillet est assurée par la
présence de cations à l'intérieur de ces cavités.
Dans la couche tétraédrique, le cation dominant est
Si4+ mais de fréquentes substitutions ont lieu avec
Al3+ et, plus rarement, avec Fe3+. Les sites
octaédriques, quant à eux, sont généralement
occupés par les cations Al3+, éventuellement
substitué par Fe2+ et surtout Mg2+, pour les
couches de type dioctaédrique et Mg2+ pour les couches
trioctaédriques [4].
Chapitre-I- Etude bibliographie
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 13
Figure I-4 :
Représentation schématique des deux types de
couches octaédriques : (a) = trioctaédrique ; (b) =
dioctaédrique [5].
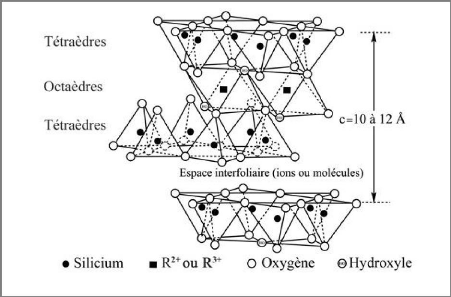
Des couches tétraédriques (T) et des couches
octaédriques (O) forment des feuillets, séparés les uns
des autres par des espaces interfoliaires pouvant contenir des molécules
d'eau et des ions (figures I-5). L'ensemble d'un feuillet et d'un espace
interfoliaire est une unité structurale. Ces unités s'agencent
alors entre elles pour former des particules argileuses. La liaison entre une
couche tétraédrique et une couche octaédrique se fait par
l'intermédiaire du quatrième oxygène de la silice
tétraédrique, qui appartient aussi à un octaèdre du
feuillet octaédrique [3].
Chapitre-I- Etude bibliographie
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 14
Figure I-5 : Assemblages de couches
tétraédriques et octaédriques : le feuillet argileux
[6]
Les espaces qui se trouvent entre les feuillets (i.e. espaces
interfoliaires) peuvent être vides ou remplis. Ils sont vides lorsque les
différents feuillets sont neutres, ou ils sont occupés par des
cations dès que l'empilement présente un déficit de charge
[2]. Les cations les plus fréquents sont le calcium
(Ca2+), le magnésium (Mg2+), le potassium
(K+), le sodium (Na+) et le lithium
(Li+).
L'ensemble, composé du feuillet
élémentaire et de l'espace interfoliaire, représente
l'unité structurale dont l'épaisseur constitue une
caractéristique fondamentale du minéral argileux et est
appelée distance interfoliaire ou distance basale et est notée
d001.
La valeur de cette distance basale peut être
déterminée à partir de la position angulaire de la
réflexion basale correspondant au plan réticulaire (001),
résolue par la diffraction des rayons X, et ce en utilisant la loi de
Bragg [7]:
X = 2 d001 sin(O)
Avec :
- O: angle entre le faisceau incident
et le réseau de plans (angle de diffraction)
- D : Espacement entre 2 plans
parallèles successifs du réseau cristallin
- X : Longueur d'onde du faisceau des
rayons X
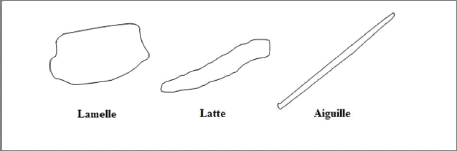
Chapitre-I- Etude bibliographie
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 15
Figure I-6 : Allures typiques des
particules de minéraux argileux [7]
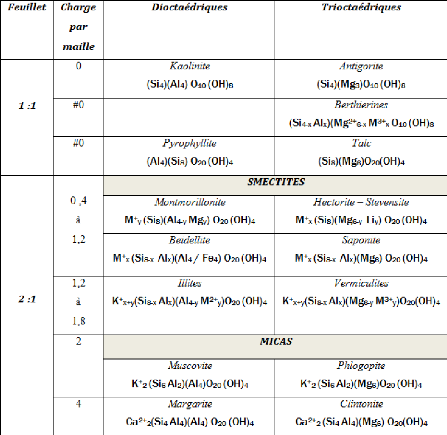
III. Classification des minéraux argileux
Les travaux de l'A.I.P.E.A. (Association Internationale
Pour l'Etude des Argiles) (19661972) et plus tard, ceux de
Pédro (1994), ont permis d'aboutir à une classification
(Tableau I1) qui repose sur l'utilisation des critères suivants [8]
:
- Type de feuillets 2/1 ou 1/1;
- Charge globale du feuillet;
- Nature des cations inferfoliaires.
Il existe différentes classifications des argiles. La
plus classique est basée sur l'épaisseur et la structure du
feuillet. On distingue ainsi 4 groupes :
- Minéraux à 7
Å : Le feuillet est constitué d'une couche
tétraédrique et d'une couche octaédrique. Il est
qualifié de T/O ou de type 1/1. Son épaisseur est d'environ 7
Å ;
- Minéraux à 10
Å : Le feuillet est constitué de deux couches
tétraédriques et d'une couche octaédrique. Il est
qualifié de T/O/T ou de type 2/1. Son épaisseur est d'environ 10
Å ;
- Minéraux à 14
Å : Le feuillet est constitué de l'alternance de feuillets
T/O/T et de couches octaédriques interfoliaires ;
- Minéraux
interstratifiés : L'épaisseur du feuillet est variable. Ces
minéraux résultent du mélange régulier ou
irrégulier d'argiles appartenant aux groupes ci-dessus.
La valeur de la charge permanente du feuillet a servi de
critère pour établir une classification des phyllosilicates 2/1
(Tableau I-1). Cette classification est déduite des travaux de
McKenzie (1975) et Brindley (1996) [8].
Chapitre-I- Etude bibliographie
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 16
Tableau I-1 : Classification des
minéraux argileux selon la charge globale du feuillet et de la
composition de sa couche octaédrique [9].
IV. Structure des principaux minéraux argileux ?
Structure de la kaolinite :
La kaolinite est constituée d'une succession de couches
alternées de feuillets en tétraèdre (Silice) et de
feuillets en octaèdre (Aluminium), qui explique donc que l'on
considère la kaolinite comme un minéral argileux 1/1. Sa formule
théorique est Si4Al4O10(OH)8. Les deux feuillets sont
liés de telle manière qu'ils forment une seule couche
d'épaisseur d'environ 7 ? (0,7 nm) qui s'étend
indéfiniment dans les deux autres directions [2].
Chapitre-I- Etude bibliographie
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 17
La liaison entre deux feuillets adjacents est assurée
par des liaisons hydrogènes. Ces liaisons s'établissent entre les
hydroxyles de la couche octaédrique et les oxygènes de la couche
tétraédrique. Elles entraînent un rapprochement des
feuillets adjacents, empêchant toute pénétration de
molécules d'eau, de molécules organiques ou d'ions
minéraux [10]. Il n'existe donc aucune possibilité de
gonflement ou de rétraction des feuillets. La faible capacité
d'échange des kaolinites est due à des sites de surface
amphotères.
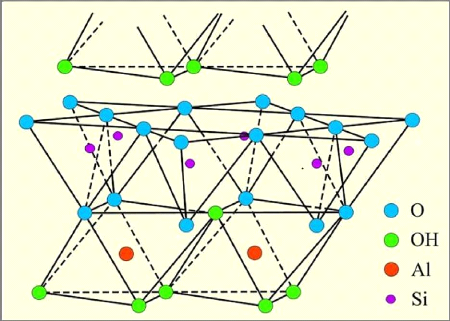
Figure I-7 : Représentation
schématique de la structure de kaolinite [11] ?
Structure de l'illite :
L'illite est constituée d'une couche octaédrique
(O) intercalée entre deux couches tétraédriques (T). Sa
formule théorique est : (Si4-xAlx) (Al2) O10 (OH)2
(K)x avec x voisin de 0,5 [1].
Les illites sont des minéraux argileux à
feuillet de type 2/1 et à équidistance basale stable à
10 Å. Elle présente des substitutions fréquentes
de Si4+ par Mg2+, Fe2+ ou Fe3+, les
défauts de charge de la maille sont compensés en
général par des ions K+ logés dans les
cavités hexagonales des couches tétraédriques
[1]. Ces gros cations assurent la liaison ionique des feuillets
adjacents et bloquent l'écart réticulaire à 10 Å
quelque soit l'état d'hydratation.
Chapitre-I- Etude bibliographie
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 18
L'argile illitique renferme de faibles quantités d'eau
zéolithique et par conséquent ne présente pas de
phénomène de gonflement [10].
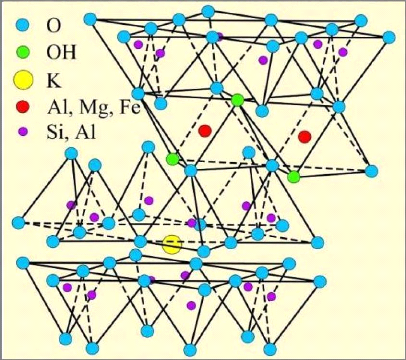
Figure I-8 : Représentation
schématique de la structure de l'illite [11] ?
Structure de chlorite :
Le chlorite est un terme qui a désigné au
début les minéraux phylliteux de couleur verte et riche en fer
ferreux [1]. Le feuillet élémentaire est de type 2/1/1,
avec en position interfoliaire une couche continue de nature hydroxylique
(couche octaédrique) déterminant une équidistance basale
très stable à 14 Å. La structure des chlorites correspond
donc à l'association d'un feuillet 2/1 de type micacé avec une
couche interfoliaire supplémentaire et indépendante,
constituée d'hydroxyde de magnésium ou de fer ferreux. Les
feuillets 2/1 sont liés entre eux par cette couche hydroxylique : les
charges négatives provenant de substitutions diverses dans le feuillet
2/1 sont en effet compensées par les charges positives
développées dans la couche octaédrique hydroxylée
au sein de laquelle se produisent des substitutions bivalent/trivalent (par
exemple : Mg2+/Al3+, Mg2+/Fe3+,
Fe2+/Fe3+) [12].
Chapitre-I- Etude bibliographie
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 19
La couche hydroxylique, appelée couche ou feuillet
brucitique, a donc une composition mixte, ferromagnésienne ; du fait de
la compensation des charges, elle assure à l'édifice cristallin
une très grande stabilité [12].
La formule structural de chlorite est : Mg5 (Al, Fe) (OH)8 (Al,
Si)4 O10
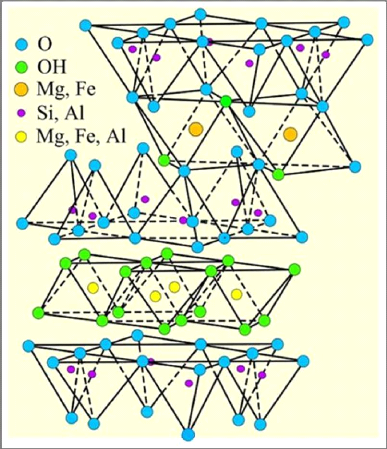
Figure I-9: Représentation
schématique de la structure de chlorite [11] ?
Structure de vermiculite :
Ce sont des minéraux à aspect de mica et sont
proches des illites et chlorites mais avec la propriété
d'être gonflants. Ils se caractérisent par la présence de
cations hydratés dans l'espace interfoliaire. Le complexe interfoliaire
comprend généralement des cations Mg ou Ca
Chapitre-I- Etude bibliographie
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 20
et 2 couches de molécules d'eau. Ainsi, si ces
minéraux sont chauffés, ils perdent leur eau interfoliaire et
leur distance inter-réticulaire rétrécit à 10
Å. Les vermiculites dioctaédriques résultent
généralement de l'altération des micas (illite ou
muscovite) et sont abondantes dans les sols des zones tempérées.
Les vermiculites trioctaédriques sont plutôt issues de
l'altération des chlorites ou néoformées [13].
La formule générale des vermiculites est :
(Mg.CaX) (Si(8-X).AlX) (Mg.Fe)6 O20 .
yH2O avec X= 1 à 1,4 et y de l'ordre de 8.
Mg2+ et Ca2+ sont les cations compensateurs très
facilement échangeables [1].
Figure I-10 : Représentation
schématique de la structure de vermiculite [30] ?
Structure de smectite :
Les smectites sont des phyllosilicates de type 2/1 (ou TOT),
constituées de deux couches tétraédriques encadrant une
couche octaédrique. Les minéraux smectites diffèrent selon
que les substitutions isomorphiques sont prédominantes dans les couches
tétraédriques et/ou octaédriques ainsi que selon la
composition chimique de leurs couches octaédriques, autrement dit
suivant que si le minéral est dioctaédrique ou
trioctaédrique [7].
Le tableau I-2 reporte la classification des différents
minéraux argileux formant la classe des smectites.
Chapitre-I- Etude bibliographie
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 21
Chapitre-I- Etude bibliographie
Tableau I-2 : Les différents
types de smectites [14].
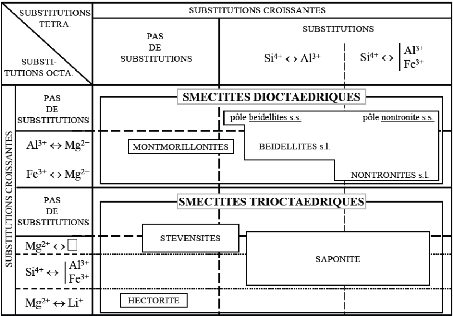
Il existe deux sous-groupes : les smectites
trioctaédriques (saponite, stevensite) et les smectites
dioctaédriques (beidellite, montmorillonite et nontronite) :
? Les smectites trioctaédriques correspondent
aux saponites ou aux stévensites dont la couche octaédrique
contient essentiellement Mg2+. Les substitutions sont alors
majoritairement tétraédriques : Si4+ remplacé
par Al3+ ou Fe3+ dans la saponite et négligeables
dans la stévensite.
? Les smectites dioctaédriques sont les
beidellites, les nontronites et les montmorillonites. Dans l'idéal, les
beidellites et les nontronites ont un déficit de charge
tétraédrique comme les saponites (Si4+
substitué par Al3+), alors que les montmorillonites ont
un déficit de charge octaédrique (Al3+
substitué par Mg2+ essentiellement). En fait, les
smectites dioctaédriques possèdent le plus souvent à la
fois des déficits de charges tétraédriques et
octaédriques et c'est cette tendance qui les classe parmi les
montmorillonites ou les beidellites. Les nontronites sont des beidellites
contenant du fer dans la couche octaédrique et éventuellement
dans la
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 22
couche tétraédrique [4]. La
montmorillonite est la smectite la plus connue et la plus
étudiée; sa structure est schématisée sur la figure
I-11.
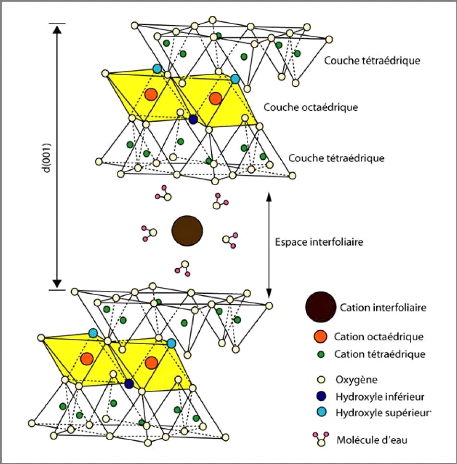
Figure I-11 :
Représentation schématique de la structure
d'une montmorillonite [4].
Les formules structurales sont très variables d'une
smectite à l'autre, même au sein d'une même espèce.
Il est donc difficile de proposer une formule structurale
générale [14]. On peut quand même donner les
formules structurales de quelques espèces parmi les plus courantes:
- Montmorillonite Rx(Al2-x
Mgx)O (Si4)T O10(OH)2,
nH2O (R=Na+ ou 1/2Ca2+, x 0,3-0,7)
- Beidellite Nax+y (Al2-x-t
Fe3+ t Mgx)O (Si4-y Aly)T
O10 (OH)2, nH2O
- Nontronite Ky (Fe3+
2-x Alx)O (Si4-y Aly)T O10(OH)2,
nH2O
Chapitre-I- Etude bibliographie
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 23
- Saponite (Mg) Nay
(Mg3)O (Si4-y Aly)T
O10 (OH)2, nH2O
Par ailleurs, la couche interfoliaire est également de
nature variable (cations mono ou divalents avec 1 ou 2 couches d'eau). Les
cations qui assurent la compensation du déficit de charge du feuillet
T/O/T. sont principalement Na+, Ca2+, Mg2+ et
K+ [7]. Ils se localisent en général
au-dessus du centre des cavités hexagonales de la couche
tétraédrique, à des cotes variables en fonction de leur
taille, de leur sphère d'hydratation et du déficit de charges du
feuillet [7].
V. Les minéraux à pseudo-feuillets et
à faciès fibreux
Les minéraux fibreux sont des espèces à
pseudo-feuillets. Leur faciès fibreux résulte d'une
discontinuité du feuillet selon l'axe b [15]. Ce
pseudo-feuillet est constitué de plans continus d'oxygène. Dans
ces plans, les oxygènes sont aux sommets d'un hexagone plus ou moins
régulier. Entre deux plans continus d'oxygène, on trouve deux
plans discontinus formés d'oxygène et d'hydroxyle. L'empilement
des deux plans discontinus forme des octaèdres enchevêtrés
créant ainsi un ruban. Cette rupture donne naissance à des
lacunes qui forment des canaux structuraux entre des rubans. La largeur de ces
rubans est caractéristique de chaque famille. Les oxygènes du
plan continu forment la base de tétraèdre dont la pointe est
constituée par un oxygène du ruban. Ces tétraèdres
sont occupés en leur centre par des ions Si4+. Les ions
Mg2+ ou Al3+ occupent les lacunes octaédriques.
Les rubans se terminent par des liaisons entre ces cations et des
molécules d'eau. On distingue deux principales familles (Figure I-12)
[15] :
? La famille des palygorskites (appelée aussi
attapulgite) où l'empilement des deux plans discontinus fait
apparaître un ruban à cinq octaèdres. Les particules ont la
forme d'aiguilles rigides.
? La famille des sépiolites où
l'empilement des deux plans discontinus fait apparaître un ruban à
huit octaèdres. Les particules ont la forme de fibres flexibles.
La palygorskite est riche en Mg et Al; sa formule
idéale se présente comme : Si8O20Al2Mg2(OH)2 (H2O)4. En revanche,
la sépiolite est purement magnésienne; sa formule idéale
est : Si6Mg4O15(OH)2 6H2O.
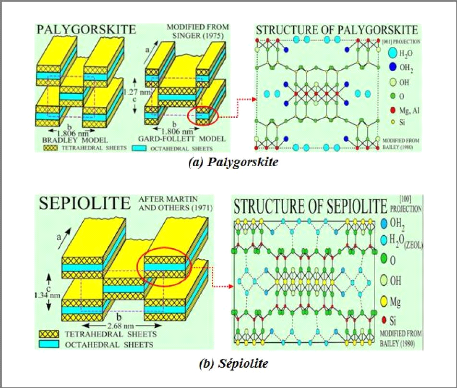
Chapitre-I- Etude bibliographie
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 24
Figure I-12 : Schéma de
la structure des minéraux argileux fibreux: (a) palygorskite et (b)
sépiolite montrant des rubans formés de pseudo-feuillets 2/1 (ou
TOT) de deux couches tétraédriques (T) prenant en sandwich une
couche octaédrique (O). Les rubans sont connectés par les
oxygènes apicaux des couches tétraédriques [11].
VI. Organisation texturale des matériaux argileux
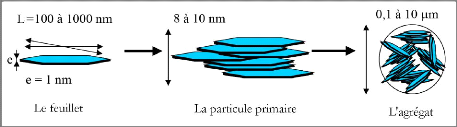
VI.1. Organisation multi-échelle de la phase solide
La phase solide du système argileux peut-être
décrite à partir de trois unités structurales et de
l'arrangement mutuel de ces unités : le feuillet, la particule et
l'agrégat (Figure I-13) [4].
Chapitre-I- Etude bibliographie
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 25
Figure I-13 : Structure
multi-échelle d'une smectite (exemple de la montmorillonite)
[7].
? Le feuillet
La première de ces unités est le feuillet. C'est
l'unité structurale de base définissant la nature
minéralogique, l'appartenance au type d'argile, les
propriétés physico-chimiques ainsi que le comportement
macroscopique. Selon la composition de ce feuillet, sa forme est très
variée. L'épaisseur est d'environ 1 nm pour une extension
latérale qui peut aller jusqu'au micron. Cette anisotropie
confère à ces feuillets une certaine souplesse [4].
? La particule primaire
La particule primaire est constituée de cinq à
dix feuillets identiques empilés et parallèles à leurs
plans de base, maintenus par les forces électrostatiques attractives
entre les ions interfoliaires et les feuillets [4]. Elle fait
généralement 8 à 10 nanomètres d'épaisseur.
La taille des particules est à peu près constante
[7].
? L'agrégat
L'agrégat est un ensemble de particules primaires
orientées dans toutes les directions. Les agrégats ont une taille
qui varie de 0.1 à 10 microns [7].
En prenant pour référence les données
d'Oberlin et Méring (1962) et Van Olphen (1964) et
portant sur les minéraux expansibles, Tessier (1975) a
proposé une nomenclature pour nommer les différents modes
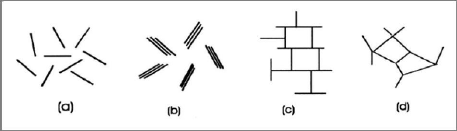
d'association des particules [4] : bord à bord et face à
face. L'agrégat constitué de plusieurs particules primaires a
été nommé « unité morphologique ». La
figure I-14 représente les différents modes d'associations
supposés formant l'agrégat.
Chapitre-I- Etude bibliographie
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 26
Figure I-14 : Modes
d'associations supposés des feuillets de montmorillonite en suspension :
(a) dispersion, (b) agrégation face-face, (c) association bord-face, (d)
association bord-bord (d'après Van Olphen, 1964) [4].
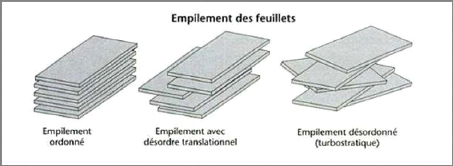
VI.2. Empilements des feuillets
? Cas des minéraux homogènes
:
Si on considère les principales espèces
minéralogiques, trois grands types d'empilements sont à
considérer (figure I-15) [9] :
i) Empilement ordonné : Dans ce cas les
feuillets sont empilés les uns sur les autres dans un ordre parfait.
C'est le cas des phyllosilicates dont l'espace interfoliaire est vide ou
anhydre (kaolinites ou illites).
ii) Empilement semi-ordonné (ou désordre
translationnel) : Les feuillets successifs présentent des
translations «semi-définies». Les feuillets sont
séparés par quelques molécules d'eau, l'épaisseur
de la particule est variable et dépend du degré d'hydratation.
Ils peuvent glisser latéralement les uns sur les autres.
iii) Empilement désordonné (ou
désordre turbostratique) : Dans ce cas d'empilement, des feuillets
successifs présentent des translations et/ou des rotations quelconques
dans tout l'édifice. Les feuillets sont séparés par un
film d'eau permettant une libre rotation autour d'un axe perpendiculaire au
plan de la particule.
Chapitre-I- Etude bibliographie
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 27
Figure I-15 : Les différents
types d'empilement dans les argiles [1]. ? Cas des
minéraux interstratifiés :
Dans le cas des minéraux interstratifiés,
l'empilement se caractérise essentiellement par le mode de succession
des feuillets de nature différente suivant la normale à leur
plan. Ainsi si on considère un minéral interstratifié qui
contient deux types de feuillets A et B, on peut envisager essentiellement
trois types d'interstratifiés (figure I-16) [8] :
i) Ségrégés : une particule
donnée présente des séquences AAABBB (Figure I-16a). Le
diagramme de diffraction X est la superposition des diagrammes produits par
chacun des constituants.
ii) Réguliers : une particule donnée
comporte alors des séquences ABABAB...AB (Figure I-16h). Une
période de surstructure perpendiculairement au plan des feuillets
égale à la somme des épaisseurs des deux feuillets
apparaît (dT=dA+dB). Le diagramme de diffraction X comporte alors des
réflexions basales de surstructure correspondant à dT.
iii) Aléatoires : c'est-à-dire tous
les cas intermédiaires entre les deux décrits
précédemment (Figure I-16c). Dans ce cas, les diagrammes de
diffraction X présentent des réflexions (001) irrationnelles, et
leur interprétation est très délicate.

Chapitre-I- Etude bibliographie
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 28
Figure I-16 : Différents
modes de succession des feuillets au sein d'une unité
interstratifiée
[8].
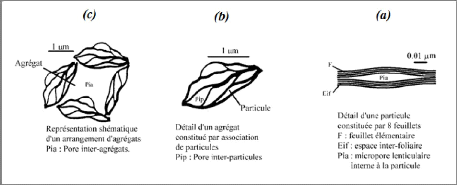
VI.3. Organisation des espaces
poraux
L'organisation des matériaux argileux (du feuillet
à l'assemblage d'agrégat) ne peut être
interprétée que si l'organisation de l'espace poral est prise en
considération. La dimension, la forme la distribution des espaces poraux
dépendent de la granulométrie du matériau argileux, de son
caractère gonflant, du fluide interstitiel et des contraintes.
Touret et Pons (1989) ont décrit l'existence de trois
types d'espace lié à l'organisation de la phase solide (Figure
I-17)
[9].
i) L'espace interfoliaire : sépare deux
feuillets dans un empilement. Il est généralement occupé
par les couches d'eau adsorbée (1 à 4) et des cations
échangeables, et son épaisseur moyenne est comprise entre 1,5 et
2,5 nm (figure I-17a).
ii) L'espace interparticulaire : séparant les
particules argileuses qui forment les agrégats. Il est susceptible de
diminuer jusqu'à atteindre la valeur de l'espace interfoliaire pour les
argiles fortement compactées; dans ce type d'espace la double couche
peut se développer. Les micropores lenticulaires sont intérieurs
aux particules, à l'échelle de quelques nm (figure I-17h).
iii) L'espace interagrégat : a une section
moyenne comprise entre 1,6 et 16 nm où l'eau circule librement (eau
libre) limitant les effets électrostatiques de la double couche (figure
I-17c).
Chapitre-I- Etude bibliographie
Figure I-17 : Les
différents types d'espaces poraux [9].
VII. Propriétés physico-chimiques des
argiles
Les propriétés donnant aux argiles des
spécificités bien définies sont nombreuses, elles peuvent
être physiques et chimiques.
VII.1. Charge des surfaces argileuses
Les minéraux argileux portent une charge
électrique nette devant être compensée par l'adsorption
d'ions de signe opposé venant de la solution. Selon son origine, cette
charge est soit « permanente », c'est-à-dire
indépendante de la physico-chimie du milieu, soit « variable »
selon la composition de la solution, particulièrement selon le pH
[5].
? Charge permanente du feuillet :
La charge permanente peut être définie comme la
charge nette résultant des substitutions isomorphes à
l'intérieur du feuillet [5].
,
4+ 3+
L'existence de substitutions isomorphiques dans les couches
tétraédriques (Si ? Al
|
3+
Fe
|
|
3+
|
2+
? Mg
|
2+
, Fe
|
2+ +
|
|
) et/ou octaédrique (Al
|
|
; ou Mg ? Li ) confère un déficit de charge au
|
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 29
feuillet [7]. Afin de rétablir
l'électroneutralité, cette charge est compensée par un
cation alcalin ou alcalino-terreux plus ou moins hydraté dit cation
compensateur et qui vient se loger dans l'espace interfoliaire entre deux
feuillets d'argile.
Chapitre-I- Etude bibliographie
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 30
Figure I-18 : Adsorption à
l'équilibre et échange ionique [16].
? Charge de bordure de feuillet :
Aux bordures d'un feuillet, les valences du silicium et de
l'oxygène en couche tétraédrique d'une part, de
l'aluminium et de l'oxygène en couche octaédrique, d'autre part,
ne sont pas saturées. Pour compenser ces valences, des molécules
d'eau s'hydrolysent et il y a apparition de groupes silanols (Si-OH) ou
aluminol (Al-OH) qui en fonction du pH peuvent capter ou libérer des
protons. Le nombre et la nature des charges de bordure de feuillet seront donc
directement liés au pH. Les réactions mises en jeu sont les
suivantes [17] :
? En couche tétraédrique :
- Libération d'un ion hydrogène : ESi-OH + OH-
ESi-O- + H2O
? En couche octaédrique :
- Capture d'un ion hydrogène : EAl-OH + H+
EAl-OH2 +
- Libération d'un ion hydrogène : EAl-OH + OH-
EAl-O- + H2O
Chapitre-I- Etude bibliographie

Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 31
Figure I-19 : Charge variable de
minéraux argileux. Influence de pH sur le silanol (Si-OH) et aluminol
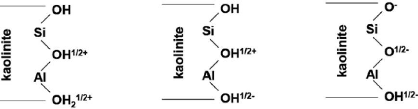
(Al-OH) en fonction des bords interrompus d'une kaolinite [5].
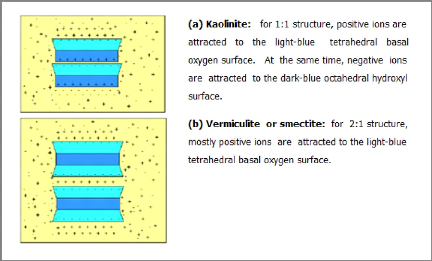
Les groupes hydroxyles, présents sur les faces
latérales des argiles 1/1 et 2/1 (Figure I-20), sont chargés
à la surface du minéral, et sont sensibles à la variation
du pH de l'eau porale (groupe amphotère). Il existe aussi des
réactions d'adsorption spécifique, situées sur les faces
latérales, de certains ions de l'eau porale (par exemple le sodium
Na+). Ces adsorptions se produisent sur les sites où les
valences des atomes du réseau ne sont pas toujours compensées
[18].
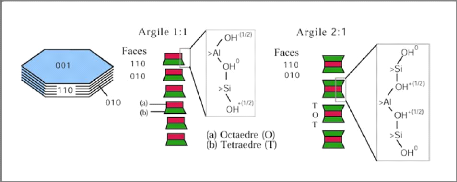
Figure I-20 : Sites de surface
aluminols, >Al-OH, et silanols, >Si-OH, en bordure de feuillet pour une
kaolinite, et sites de surface silanols pour une smectite [18].
Chapitre-I- Etude bibliographie
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 32
Chapitre-I- Etude bibliographie
Les deux types de charges des minéraux argileux
présentées ci-dessus interviennent dans la Capacité
d'Échange Cationique (CEC) [5].
La CEC se définit comme étant le nombre de
cations monovalents qu'il est possible de substituer aux cations compensateurs
pour compenser la charge électrique de 100 grammes de minéral
calciné et s'exprime en milliéquivalent/100g d'argile
calcinée [19].
L'ordre de grandeur de la CEC des minéraux argileux est
variable allant de quelques méq/100g pour la kaolinite (charge variable)
à 150 méq/100g pour les vermiculites et smectites (importance de
la charge permanente) (tableau I-3 paragraphe VII.2) [5].
VII.2. La surface spécifique
Par définition, la surface spécifique
(SS) appelée aussi « Aire massique »
représente la surface totale (AS) par unité de masse (M) et on
l'exprime généralement en m2/g [2] :
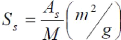
La fine taille des minéraux argileux leur
confère une surface importante par rapport au volume des particules. La
surface relative augmente avec la diminution du diamètre (Figure I21)
[20] :
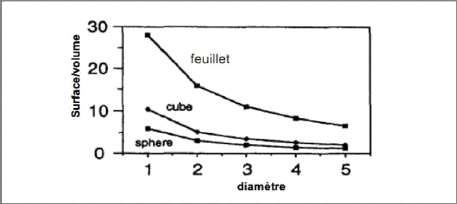
Figure I-21 : Variation du
rapport surface/volume en fonction du diamètre des particules
[20].
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 33
La surface des minéraux argileux est supérieure
à celles de minéraux de même taille mais de forme
différente [21]. La figure I-22 montre également que la
surface spécifique (SS) dépend de la forme de la particule. On
peut remarquer que celle-ci a tendance à s'aplatir quand la surface
spécifique (SS) augmente.
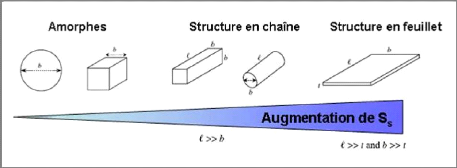
Figure I-22 : Influence de la
forme de la particule sur la surface spécifique [2].
Les propriétés des argiles sont principalement
contrôlées par leur surface interne et externe. La surface totale
comprend la surface externe, comprise entre les particules argileuses, et la
surface interne, correspondant à l'espace interfoliaire (Figure I-23)
[21].
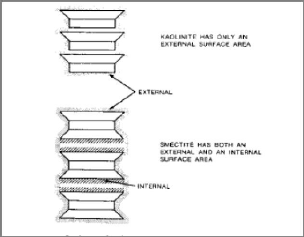
Figure I-23 : Surface des
particules argileuses: interne et externe [21].
Chapitre-I- Etude bibliographie
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 34
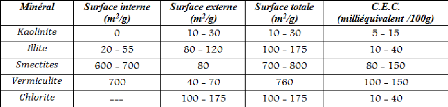
? Composition minéralogique : Le tableau I-3
présente les différentes valeurs de la surface spécifique
(SS) des minéraux les plus courants. Il est à noter que la
smectite possède les valeurs les plus importantes de surface
spécifique en comparaison avec tous les autres minéraux.
Tableau I-3 : Surface
spécifique et C.E.C. de quelques minéraux argileux [22].
VII.3. Hydratation et gonflement des minéraux
argileux ? Description de la séquence d'hydratation :
Les processus d'absorption d'eau dans la structure des argiles
sont complexes et peuvent être décrits de l'état sec vers
l'état hydraté ou de l'état hydraté vers
l'état sec. Mais ces deux séquences ne décrivent pas le
même phénomène et il résulte que les
mécanismes sont différents lorsque l'on étudie
l'hydratation ou la déshydratation. L'étude des isothermes
d'adsorption met en évidence l'existence d'hystérésis, qui
montrent que les mécanismes d'hydratation et de déshydratation ne
sont pas totalement réversibles [23].
Les minéraux argileux sont généralement
caractérisés, à des degrés différents
suivant la nature de la famille, par leur capacité d'adsorption d'eau.
Cette eau existe sous multiples formes: adsorbée sur les surfaces
externes ou associée aux cations interfolaires ou cristalline sous forme
d'hydroxyle (OH) dont l'élimination se fait par déhydroxylation
(Figure I-24) [7].
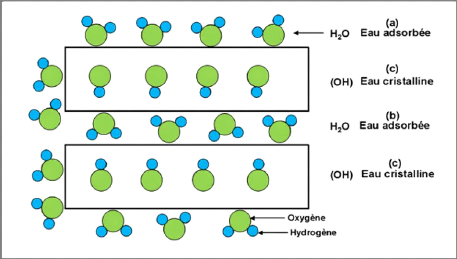
Chapitre-I- Etude bibliographie
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 35
Figure I-24 : Localisation de l'eau
dans les particules argileuses [20].
(a) Molécules d'eau adsorbées sur la surface
d'argile,
(b) Molécules d'eau associées avec les cations
dans l'espace interfoliaire,
(c) Eau cristalline sous forme d'hydroxyle qui par
deshydroxylation forme des molécules d'eau.
? Description de la séquence de gonflement
:
Dans la littérature, on trouve une nomenclature bien
spécifique à ces deux modes de gonflement qui se distinguent par
leur aptitude d'hydratation. Il s'agit des gonflements "cristallin" et
"osmotique" [8] :
i) Le gonflement cristallin :
Le gonflement cristallin correspond à la
pénétration de molécules d'eau dans l'espace interfoliaire
et à la formation d'états hydratés existant sur des
domaines précis de pression relative. A l'état sec, la
cohésion des empilements de feuillets résulte d'un
équilibre entre forces d'attraction de Van der Waals et forces
électrostatiques entre les feuillets chargés et les cations. En
présence d'eau, l'énergie d'hydratation des cations permet
à l'eau de rompre cet équilibre en provoquant l'écartement
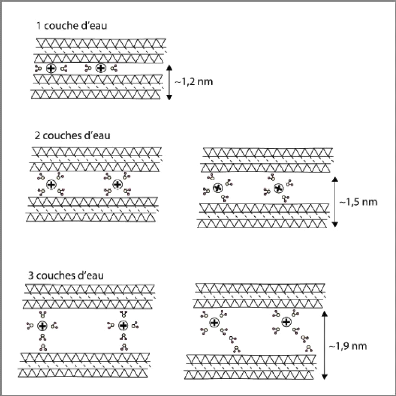
des feuillets et de pénétrer dans l'espace interlamellaire.
Chaque palier représente un état d'hydratation de l'espace
interfoliaire : état sec, état hydraté à 1, 2 ou 3
couches d'eau (figure I-25) [4].
Chapitre-I- Etude bibliographie
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 36
Figure I-25 :
Schématisation de l'hydratation des argiles au niveau
de l'espace interfoliaire de 1 à 3 couches d'eau [4].
ii) Le gonflement osmotique
:
Le gonflement osmotique, appelé également
gonflement "macroscopique" ou gonflement "libre". Il se produit lorsque
l'énergie d'hydratation est suffisante pour franchir la barrière
de potentiel due aux forces électrostatiques attractives entre
feuillets. Au-delà de la deuxième couche d'eau adsorbée
à la surface d'un feuillet, l'eau perd ses propriétés
d'eau liée et devient de l'eau libre [24].
VIII. Propriétés colloïdes des
argiles
Dans la littérature, la stabilité
colloïdale des particules chargées se résume, en grande
partie, à l'étude de la distribution des charges
électriques sur les surfaces des particules argileuses hydratées
(la double couche électrique) et à l'étude des
différentes conditions de stabilité ou
Chapitre-I- Etude bibliographie
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 37
d'agrégation à travers la combinaison entre
toutes les forces d'attraction et de répulsion dans le système
(la théorie DLVO) [25].
VIII.1. Théorie de la double couche
Les feuillets des minéraux argileux sont chargés
négativement, et les ions compensateurs hydratés sont
attirés par la surface négative des feuillets [7].
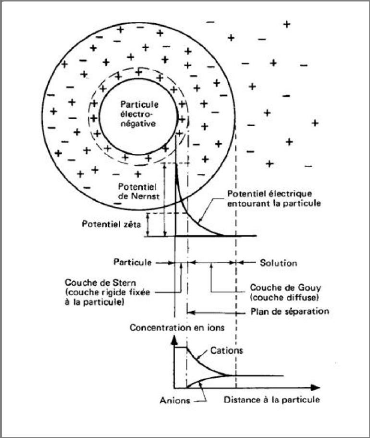
D'après Israelachvili [26], la population des
cations attirés par la surface pour rétablir
l'électroneutralité au voisinage de celle-ci peut être
séparée en deux couches. Une couche de cations immobiles
liés à la surface, appelée couche de Stern, et une couche
de cations mobiles au voisinage de la surface appelée couche diffuse. La
limite entre la couche de Stern et la couche diffuse est appelée plan
d'Helmotz ou plan de cisaillement. L'ensemble de ces deux couches constitue la
double couche électrique de la particule en suspension. La concentration
en ions positifs est donc importante au voisinage de la surface et
décroît progressivement lorsqu'on s'éloigne de la
particule. Au voisinage de la surface, il y a également un
déficit en anions, repoussés de la surface par les forces
électrostatiques. Cette différence de concentration entre anions
et cations crée un potentiel électrique. Nous avons
représenté schématiquement l'évolution de la
concentration en ions, et celle du potentiel électrique, en fonction de
la distance à la surface de la particule sur la Figure I-26. L'existence
de la couche de Stern (ions immobiles à la surface du feuillet) est
cependant controversée [24].
Chapitre-I- Etude bibliographie
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 38
Figure I-26 :
Représentation schématique de la double couche
électrique et de l'évolution du potentiel électrique en
fonction de la distance à la particule [27].
Le potentiel électrique vaut W0 à la surface de
la particule et décroit linéairement dans la couche de Stern. La
valeur du potentiel au plan d'Helmotz est le potentiel æ (potentiel
Zêta). C'est la seule valeur accessible expérimentalement selon la
théorie de Gouy Chapman à partir de l'équation [7]
:
Wx = æexp[-?(x)]
Avec :
- Wx : Valeur du potentiel
à une distance x du plan d'Helmotz
- æ : Valeur du potentiel au plan
d'Helmotz correspond au potentiel Zêta -
?-1 : Epaisseur de la double couche électrique
ou longueur de Debye
Chapitre-I- Etude bibliographie
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 39
A une distance infinie du feuillet, le potentiel s'annule puisque
l'électroneutralité est
respectée dans la solution. L'épaisseur de la
double couche électrique est régie
principalement par la
concentration en électrolyte de la solution et par la valence des ions
présents. Plus la force ionique est élevée, plus la double
couche sera comprimée. Cette double couche offre aux particules
argileuses leur stabilité en dégageant un effet répulsif
lorsque deux particules s'approchent l'une de l'autre. On comprend donc que
l'augmentation de la concentration en électrolyte aura tendance à
précipiter la floculation de la suspension en réduisant
l'épaisseur de la double couche électrique garante de la
stabilité des particules. Ce phénomène est
schématisé sur la Figure I-27.
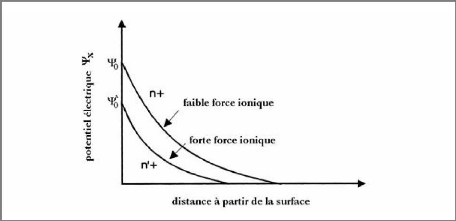
Figure I-27 :
Représentation schématique de la chute du
potentiel de surface et de la contraction de la double couche
électrique, dues à une augmentation de la force ionique
[25].
VIII.2. Théorie DLVO
Cette théorie permet d'expliquer la stabilité
des suspensions colloïdales des particules chargées; elle a
été établie à partir du modèle de la double
couche par ses précurseurs Derjaguin et Landau (1941)
d'une part et Verwey et Overbeek (1948) d'autre part
[28]. La théorie DLVO consiste à sommer l'énergie
d'interaction répulsive due aux doubles couches électriques, et
l'énergie d'interaction attractive due aux forces de Van der Waals.
Contrairement à l'énergie d'attraction de Van der Waals qui reste
constante en fonction de la charge ionique du milieu, l'énergie
répulsive de la double couche varie, en raison de la contraction de la
double couche en présence d'une force ionique élevée.
Lorsque la force
Chapitre-I- Etude bibliographie
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 40
ionique augmente, la répulsion de double couche diminue
pouvant entraîner l'agrégation ou la coagulation des
particules.
Sur la figure I-28, on distingue trois cas de stabilité
suivant l'intensité des forces ioniques : (i) Pour de faibles forces
ioniques (cas A) et pour un potentiel de surface élevé, le
potentiel répulsif est supérieur au potentiel attractif. Les
particules se repoussent mutuellement et la suspension est dans un état
de dispersion stable. Plus le maximum primaire Ømax est
élevé, plus la suspension n'est stable. (ii) Pour des forces
ioniques modérées (cas B), la courbe présente un maximum
primaire Ømax et un maximum secondaire Ømax. Lorsque les
particules sont localisées dans ce minimum secondaire, elles sont en
équilibre et sont floculées. L'état de floculation est
réversible lorsque le minimum secondaire n'est pas très profond :
(-Øsec/KBT) 1. Par contre, si (-Øsec/KBT) > 20, le minimum
secondaire est beaucoup plus profond et la suspension est fortement
floculée. (iii) Pour des forces ioniques élevées (cas C),
la courbe ne présente plus de maximum. Les particules floculent
très rapidement et de façon irréversible. La distance
entre particules correspond alors au minimum primaire Ømin. La
suspension est dans un état de coagulation.
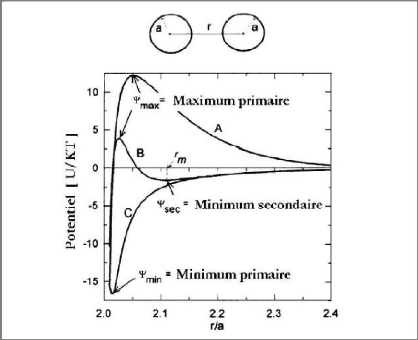
Figure I-28 :
Schématisation de l'évolution du potentiel
d'interaction en fonction de la distance interparticulaire pour des dispersions
: stable (A), floculée (B) et coagulée (C) [29].
CHAPITRE
DESCRIPTION GENERALE DE LA
SOCIETE
CERAMICA DERSA
Chapitre-II- Description générale de la
société « Céramica DERSA »
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 42
I. Présentation de la société
L'entreprise « Ceramica DERSA »,
située dans la zone industrielle de Martil à Tétouan, a
comme activité principale la production de carreaux en céramique
de différents modèles et motifs. Créée en 1988,
elle emploie 100 personnes et réalise un chiffre d'affaires moyen de 5
millions de dollars des États-Unis.
Elle a adhéré au projet MED TEST dans le but
d'identifier des opportunités d'utilisation plus efficace des ressources
(énergie thermique, eau, électricité et produits
chimiques), de réduction des coûts de production, de valorisation
de ses déchets solides et de minimisation des rejets, en particulier les
effluents liquides. L'entreprise est certifiée ISO 9001/2000.
? Organigramme de la société Céramica
DERSA :
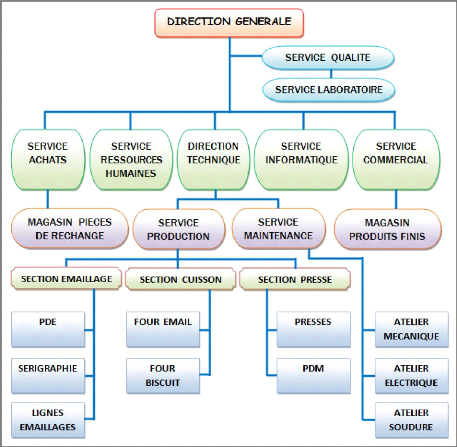
Chapitre-II- Description générale de la
société « Céramica DERSA »
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 43
II. Description de l'usine
L'usine de « Céramica DERSA» produit
des carreaux céramique pour le revêtement des murs, le
procédé de fabrication est basé sur la bicuisson (cuisson
biscuit et cuisson en deux fours séparés), la cuisson se fait
dans deux fours à rouleaux céramiques. Les carreaux
céramiques fabriqués sont de 20x20 et 25x20, sont utilisés
pour le revêtement mural. Les propriétés principales des
carreaux céramiques fabriqués sont :
? La dureté et la résistance
mécanique
? La rigidité ? La fragilité ?
L'inertie
Les matières premières utilisées pour la
production des carreaux céramiques sont en générale les
suivantes :
? Argile
? Chromate
? Cycle de fabrication :
Le procédé de fabrication des carreaux en
céramique comprend les phases suivantes :
? Dosage des matières premières
? Broyage à sec
? Stockage poudre dans des silos
? Pressage des carreaux par une station de presses
? Séchage des carreaux
? Cuisson carreaux dans un four à rouleaux
? Triage
? Emaillage
? Cuisson email
? Triage et emballage
Le cycle de production utilisé au niveau de l'usine de
« Céramica DERSA » varie entre 38 et 41 minutes. Le
flow Sheet de fabrication des carreaux céramique se présente
comme suit :
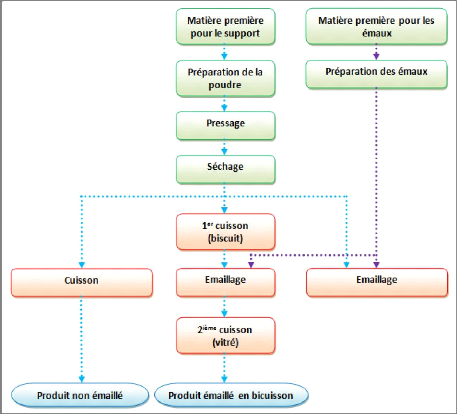
Chapitre-II- Description générale de la
société « Céramica DERSA »
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 44
III. Processus de production ?
Préparation de la poudre
Le processus de fabrication des carreaux en faïence
commence par la préparation de l'argile. En effet, Après
l'extraction de l'argile de la carrière, elle est stockée dans
des halls.
La préparation de la poudre est assurée par un
broyeur pendulaire permettant d'avoir une granulométrie relativement
fine et appropriée pour l'opération de pressage. Au terme de
cette phase de production, la poudre présente un pourcentage en eau de 2
à 6,3 %. Nous notons que ce procédé à voie
sèche est économe en énergie par rapport à la voie
humide.
Chapitre-II- Description générale de la
société « Céramica DERSA »
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 45
Trois opérations sont fondamentales dans cette phase de
production: le broyage, le mélange homogénéisation et la
régulation de la teneur en eau par la pulvérisation de l'eau.
e Pressage
Une fois obtenue la poudre, elle est stockée en deux
silos qui alimentent les deux presses par une poudre à un taux
d'humidité varié de 5,2 à 6 %, le pressage des carreaux
est assuré par des presses hydrauliques de type SACMI PH-690
à une pression de 300 KG/m2, Cette pression provoque une
réorganisation ainsi qu'une déformation partielle des grains,
permettant d'obtenir un carreau cru parfaitement compact et
résistant.
? Séchage
Les corps pressés sont séchés
principalement dans un séchoir à rouleau de marque IMAS
de capacité 3000 m2 / 24 heures. Le chauffage de ce
séchoir s'effectué par la chaleur des brûleurs à gaz
naturel (GPL). Le séchage s'effectue à une température qui
atteint environ 250°C. Le cycle de séchage est environ 10 minutes,
en fonction de la teneur en eau des produits crus. Pour éviter des
fissures et des défauts d'émail à la cuisson, il faut que
la teneur en eau résiduelle soit inférieure à 1,5%.
? Cuisson
La cuisson à l'usine est assurée par deux fours
à rouleaux céramiques d'une capacité de 3000 m2
dont un four est destiné à la cuisson des carreaux (cuisson
biscuit) et le deuxième pour la cuisson des carreaux
émaillés (cuisson émail). Grâce à la cuisson,
les carreaux acquièrent des caractéristiques mécaniques
adaptées aux nombreuses utilisations et des propriétés
d'inertie chimique. Ces caractéristiques sont le résultat des
réactions chimiques et de transformations physiques du support et de
l'émail. La cuisson se fait dans des fours continus composés
chacun de trois zones :
? Préchauffage
? Cuisson
? Refroidissement
L'usine est équipée par deux fours de cuisson
à rouleaux :
Tableau II-1 : Modes de cuisson
à la société « Céramica DERSA »

Chapitre-II- Description générale de la
société « Céramica DERSA »
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 46
O Emaillage et cuisson
Les émaux sont des mélanges broyés de
divers minéraux et se composent de : frittes, kaolin, silice, oxydes et
divers pigments colorants. Ces composants sont dosés en fonction de la
qualité de l'émail à utiliser qui sera appliqué sur
la surface du carreau. Après l'émaillage, le carreau est
porté vers le four « cuisson émail » à une
température de 1060 °C. Lors du refroidissement la couche fondue se
solidifie, formant une pellicule vitreuse qui confère à la
surface du carreau.
Les carreaux biscuit sont couvert par une couche de l'engobe
et une couche de l'émail selon le type de production
désiré : Cristalline, blanc opaque, base colorée, mate,
...
O Triage
Après la cuisson émail et avant d'être
emballés et stockés, les carreaux émaillés font
l'objet d'un triage minutieux. Le triage a pour objet trois fonctions
principales:
? Eliminer les carreaux défectueux
? Séparer les carreaux de premier choix de ceux de
choix inférieur
? Regrouper les carreaux, par classe de choix, en lots
homogènes en tenant compte des dimensions (ou plus communément en
tenant compte du calibre) et de la tonalité chromatique (appelée
communément « nuance »).
A la sortie du four « cuisson émaille », le
carreau est classé en fonction de sa qualité selon trois choix
:
IJ Choix standard IJ Choix économique IJ Choix solde
A
CHAPITRE
-III~
PARTIE EXPERIIY1EHTALE
Chapitre-III- Partie expérimentale
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 48
Le bute :
Le bute de ce travail est de présenter et de comparer
bilan des analyses chimiques et mécaniques surtout l'humidité, la
granulométrie, taux de CaCO3, résistance à la flexion,
dilatation-retrait, perte au feu et absorption d'eau. Tous ces essais sont
effectués au sien de labo-technique de société «
Ceramica DERSA».
I. Taux de l'humidité des argiles
La différence du poids de l'échantillon frais
(P11) et du poids de l'échantillon sec (PS) nous permet de
calculer le poids d'eau évaporée. Celui-ci rapporté en
pour cent du poids de l'échantillon frais donne le taux
d'humidité :
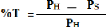
Avec :
- P11 : poids en (g) d'un
échantillon humide
- PS : poids en (g) d'un
échantillon séché
On pèse 10g de la poudre d'argile frais dans chaque
station de préparation de la poudre, après on la
séchée à une température atteindre environ 105
°C durant 15 minutes. L'humidité d'argile est
réalisée à l'aide d'une balance de type (Infrared
Moisture Determination AD - 4712).
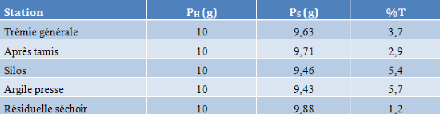
Tableau III-1 : Taux
d'humidité aux différentes stations
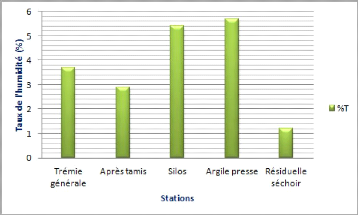
Chapitre-III- Partie expérimentale
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 49
Chapitre-III- Partie expérimentale
Figure III-1 :
Représentation graphique du taux d'humidité de
la poudre industrialisé à la société «
Céramica DERSA »
L'argile presse a un taux d'humidité
élevé de 5,7 %, ce qui signifié que l'humidité dans
ce cas a un rôle très important, elle facilite les particules
argileuses de se comprimé, et d'éviter la déformation et
la destruction des carreaux céramiques lors de ses extractions par les
moules.
Le résiduel séchoir a conservé un taux
d'humidité de 1,2%, suffisant pour éviter des fissures et des
défauts d'émail à la cuisson à haute
température.
Ces résultats sont conforme selon la norme utilisé
à la société « Céramica DERSA
».
II. Granulométrie des argiles II.1.
Définitions
Analyse granulométrique par tamisage :
ensemble des opérations aboutissant à la séparation
selon leur grosseur des éléments constituant un
échantillon, en employant des tamis à maille carrée afin
d'obtenir une représentation de la répartition de la masse des
particules à l'état sec en fonction de leur dimension.
? Dimension nominale d'ouverture d'un tamis (d) :
dimension caractéristique de la maille carrée de coté
(d).
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 50
ri Classe granulométrique : ensembles des
éléments dont les dimensions sont comprises entre deux ouvertures
(d) de tamis définissant un intervalle.
ri Dimension nominale d'ouverture à N pour cent,
(dN) : dimension interpolée sur la courbe granulométrique
pour laquelle le pourcentage massique (p) de tamisât est égal
à N pour cent.
i) Pourcentage massique d'un
tamisât
ri Pourcentage massique (p) d'un tamisât :
rapport, exprimé en pourcentage, de la masse sèche du
passant à travers un tamis d'ouverture (d), à la masse totale
initiale du matériau sec passant à travers le tamis d'ouverture
de maille (dm).
Le pourcentage massique de tamisât est
désigné par :
ii) Pourcentage massique de refus
ri Pourcentage massique de refus (r) : rapport,
exprimé en pourcentage, de la masse de matériau sec retenu par un
tamis d'ouverture (d), à la masse totale initiale de matériau sec
passant à travers le tamis de maille (dm).
iii) Courbe granulométrique
ri Courbe granulométrique :
représentation du pourcentage massique (p) des différents
tamisâtes en fonction de la dimension nominale d'ouverture des tamis.
iv) Facteur d'uniformité
ri Facteur d'uniformité : sur le passant au
tamis de 63 mm, rapport des dimensions des mailles de tamis pour lesquels il y
a respectivement 60% et 10% de passant : CU = d60/d10
II.2. Analyse granulométrique des argiles brute
Les mesures de distributions granulométriques sont
réalisées par tamisage. L'argile utilisée dans cette
analyse granulométrique est prenu directement après le grand
tamis de l'usine.
La manipulation consiste à étuvé cette
argile à 110°C pendant une heure et placées ensuite 100g
dans un vibreur SASSUOLOLAB de type SE/7 équipé de
plusieurs tamis (63, 125, 180, 250, 300, 425 et 600 um). Le temps de la
manipulation est estimé à 60 minutes. A la fin de l'essai, on
pèse les rejets afin d'en déduire le pourcentage de
rétention en masse pour chaque tamis. Les résultats des mesures
concernant l'analyse granulométrique sont affichés dans le
tableau III-2.
Chapitre-III- Partie expérimentale
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 51
Tableau III-2 : Poids de rejets et
leurs pourcentages massiques dans chaque tamis
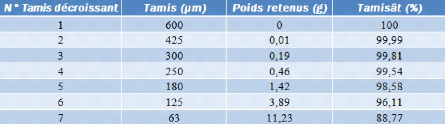
? Pourcentage massique d'un tamisât : p = 100 - r =
82,8% ? Pourcentage massique de refus : r = 12,91%
? Courbe granulométrique : p = f (dN)
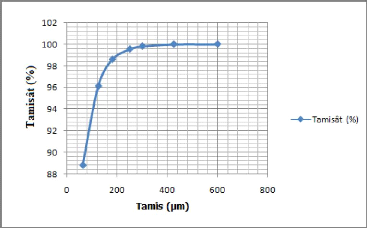
Figure III-2 :
Représentation du pourcentage massique (p) des
différents tamisâtes en fonction de la dimension nominale
d'ouverture des tamis.
Selon la courbe granulométrique nous avons :
? de 63um à 180um le pourcentage massique de retenus
égale à 15,12 %;
? de 180um à 600um le pourcentage massique de retenus
égale à 2,08 %.
Ces résultats sont conformes selon la norme de
classification des sols fines proposé par la
société « Céramica DERSA
».
Chapitre-III- Partie expérimentale
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 52
III. Résistance mécanique des carreaux
céramiques ? Flexion à trois points :
La contrainte maximale à la rupture a été
déterminée par flexion à trois points sur des barreaux de
longueur l = 300 mm et d'épaisseur (e)
découpé dans un carreau obtenu par pressage. La contrainte
maximale est réalisée à l'aide d'une machine de marque
STRUMENTO MOD. MOR/ 3-E SCLALA (0 + 400 kg) Figure III-1.
L'éprouvette repose sur deux appuis simples, distants de L = 180 mm. Une
charge Fr est appliquée en un point équidistant des
deux appuis. Si l'éprouvette est de section (l.e), la
contrainte à la rupture ?R est donnée par :
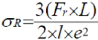
Avec :
- Résistance (contrainte
à la rupture) : óR = 3S/2 e2
- Force de rupture : S =
Fr.L/l
- Force en Newton : Fr=
m.g (la charge x 9.807)
- L : distance entre les axes,
180 mm (format 20x20) ou 280 mm (format 25x25)
- l : largeur en (mm)
- e : Epaisseur en (mm)
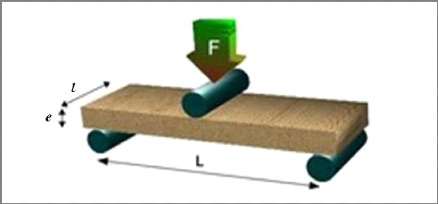
Figure III-3 : Schéma du
dispositif de la flexion à trois points.
Chapitre-III- Partie expérimentale
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 53
L'essai de flexion à trois points permet de montrer
l'évolution de la rigidité suivant l'épaisseur et largeur
des carreaux céramiques. Un carreau à tester est placée
sur deux appuis et l'on applique au centre du carreau une force croissante
jusqu'à rupture. Lors du test, la partie supérieure est en
compression et la partie inférieure en traction. Les résultats
obtenus après le test d'inflexion à trois points des sept
carreaux céramiques de dimensions (20x20) sont affichés dans le
tableau III-3.
Tableau III-3 : Résultats de
calcul de résistance à la flexion aux sept carreaux
céramiques
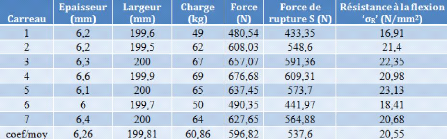
Les résultats de mesures affichés dans le
tableau III-3, sont représentés graphiquement en chaque carreau
céramique (figure III-4).
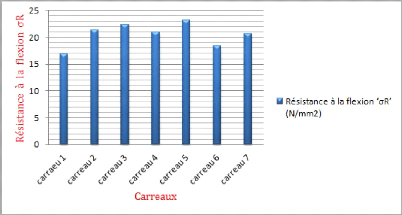
Figure III-4 :
Représentation graphique de résistance à
la flexion (oR) pour chaque carreau
Les valeurs de la résistance à la flexion
(oR) dans chaque carreau sont très fluctuantes, sans aucune
influence de l'épaisseur et de la largeur sur la dureté des
carreaux céramiques.
Chapitre-III- Partie expérimentale
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 54
Dans ce cas la cuisson à une température
élevée, donne la consolidation aux carreaux céramiques.
Cette consolidation est réalisée par la présence d'une
phase liquide à la température de cuisson et par un processus de
réaction de transformation chimique assez complexe qui abouté
à la formation de phase cristalline stable. La présence de
cristaux résistants dans la céramique, bloque la propagation, ou
du moins ralentit la progression des fissures.
IV. Taux des carbonates dans les argiles ?
Calcimètrie :
Un calcimètre permet de mesure le volume de CO2
dégagé par action de l'acide chlorhydrique (HCl) sur le carbonate
de calcium (CaCO3) d'un échantillon de sol ou de roche.
Tout matériau contenant du carbonate de calcium (CaCO3)
fait effervescence au contact d'un acide tel que HCl. celle-ci correspond au
dégagement de dioxyde de carbone (CO2), selon la réaction
chimique suivante : CaCO3 + 2HCl ? CO2 + H2O + CaCl2
La connaissance du volume de CO2 dégagé permet
de calculer le % de CaCO3 contenu dans le matériau, selon la formule
suivante :
Avec :
- AV : différence de volume
d'eau dans le tube avant et après la réaction (en ml)
- K : coefficient dépendant de
la pression et de la température pendant la manipulation -
M : masse de l'échantillon (en g).
La détermination de la teneur en CaCO3 de tous les
échantillons bruts est réalisée à l'aide du
calcimètre de Bernard. Pratiquement, une masse de (1g)
d'échantillon finement broyé est attaquée par l'acide
chlorhydrique (HCl 10%).
Le volume initial (Vi) correspond à celui de
l'équilibre des deux volumes d'eau respectifs dans le tube en verre et
l'ampoule mobile avant l'attaque acide. Le volume final (Vf) correspond
à celui de l'équilibre des deux volumes d'eau après
l'attaque acide.
Le volume de CO2 dégagé correspond à la
différence : ÄV = Vf - Vi
Les essais de calcimètrie de Bernard se sont
déroulés dans les conditions suivantes :
T = 25°C, P = 1 atm et K = 0,414.
Chapitre-III- Partie expérimentale
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 55
V. Echantillonnages
Dans le cadre de ce projet, nous sommes
intéressés à cinq échantillons que nous avons
désignés par : ARG-J (argile jaune), ARG-R (argile
rouge), ARG-B (argile bleu), ARG-T (argile référence)
et ARG-E (argile recyclé), qui sont originaires de la
carrière exploitée par l'unité industrielle «
Céramica DERSA ». Trois séries
d'échantillons ont été préparées :
? Des échantillons à partie des
argiles brutes (ARG-J, ARG-R, ARG-B et ARG-T).
e Des échantillons à partir de ces
mêmes argiles auxquelles ont été additionnés des
adjuvants (sables, feldspath, dolomite, kaolin, quartz).
? Des échantillons concernant
l'environnement (ARG-E), sont préparé à l'aide de
recyclage par équilibrages entre les matières suivants:
? ARG-T (argile employé à la
société « Céramica DERSA ») ;
? ARG-V (de couleur vert), a un taux de
CaCO3 presque nul (ce type d'argile extraite près de 2Km du barrage
« NIKHLA ») ;
? Chamottes (déchets des pertes
four biscuit, pertes four émaillé et pertes des
émaux).
Dans la présente étude, on ne s'attardera pas
sur les conditions de pressage et de cuisson, par contre on insistera sur
quelques aspects de la synthèse des céramiques où nous
avons soulevé quelques problèmes, notamment le mode de cuisson et
l'effet de l'émaillage. Aussi l'approche consiste à comparer les
caractéristiques technologiques des échantillons obtenues
à partir des cinq variétés d'argiles et
préparées sous des conditions différentes.
i) Pastille cylindrique
Des pastilles de 60 mm de diamètre et de 7 mm
d'épaisseur ont été préparées par pressage
sous une pression uniaxiale de 4000 kg. Le pressage de ces échantillons
est réalisé manuellement à l'aide d'une presse hydraulique
de type SASSUOLOLAB de 10 tonnes.
ii) Cuisson et émaillage
Ces pastilles ont été séchées
à 250°C pendant 10 minutes et cuit à 1100°C dans un
four de cuisson pendant 40 minutes, puis finalement les échantillons
sont émaillés par deux couches : -
une couche d'engobe : pâte argileuse fluide qui
permette en plus de colmatage de rendre la surface lisse ;
- une couche de cristallin :
enduit vitreux qui être transparent, compacte ou non colorée.
Afin de recuits à 1060°C dans un four d'émaillage durant 28
minutes.
iii) Chapitre-III- Partie expérimentale
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 56
Perte au feu
La perte au feu est la perte de masse qui résulte de
l'échauffement d'un matériau. Lors du
chauffage, il se produit diverses réactions qui modifient
l'échantillon :
- à 100 °C : l'eau libre
se vaporise ;
- au-dessus, l'eau liée se
libère (par exemple molécules d'eau liées dans
l'argile);
- vers 550 °C : sous air ou
atmosphère oxydante, la matière organique brûle donnant
du
dioxyde de carbone (CO2) ou du graphite (C) ;
- le carbone s'oxyde lentement pour
former du CO2 ou du CO ;
- les carbonates se
décomposent, par exemple : CaCO3 ? CaO + CO2
- sous air ou atmosphère
oxydante, les métaux s'oxydent ;
- les sels volatils se vaporisent.
Un pourcentage « Perte au feu » est
définie comme la différence de masse d'un échantillon
à l'état sec (après calcination), et d'un
échantillon à l'état humide (avant calcination).
Le pourcentage de la perte au feu est défini par la
relation :
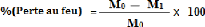
Avec :
- M0 : masse d'un
échantillon après calcination - M1 :
masse d'un échantillon avant calcination
iv) Retrait et dilatation
C'est la diminution ou allongement de longueur d'un
matériau sous l'effet de la chaleur.
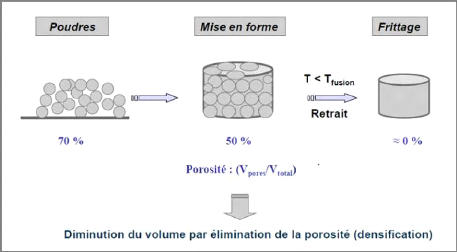
? Retrait : diminution de volume d'un matériau
due à une perte d'eau (retrait hydraulique) ou à une baisse de
température (retrait thermique).
Chapitre-III- Partie
expérimentale
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 57
Figure III-5: Retrait par
élimination de la porosité
Lors de la cuisson des matériaux céramiques sous
l'effet de la température tel que (T < Tfusion), les matériaux
diminuent ou allongent leurs volumes par élimination de la
porosité selon les types des argiles. La figure III-6, montre le
phénomène de retrait et dilatation.
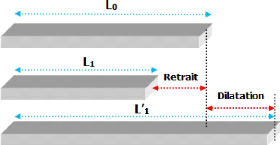
Figure III-6 : Retrait et
dilatation d'un matériau Le pourcentage de retrait / dilatation est
défini par la relation :
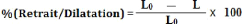
Chapitre-III- Partie expérimentale
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 58
Chapitre-III- Partie expérimentale
Avec :
- L0 : longueur initial d'un
échantillon avant la cuisson ;
- L : longueur final d'un
échantillon après la cuisson (L1= retrait, L'1= dilatation).
Les mesures du retrait et de la dilatation avant et
après la cuisson des échantillons sont effectuées à
l'aide d'un « pied à coulisse » qui permet de
déterminer les variations de longueur des échantillons.
v) Absorption d'eau
L'absorption d'eau est liée à la porosité
de la matière : une absorption d'eau élevée signifie une
porosité élevée, tandis qu'une faible absorption d'eau est
associée à une structure compacte et vitrifiée.
On détermine un pourcentage d'absorption d'eau, qui est
défini comme le rapport de l'augmentation de la masse de
l'échantillon après imbibition par l'eau, à la masse
sèche de l'échantillon. Cette imbibition est obtenue par
immersion de l'échantillon dans l'eau chaud (jusqu'à
l'ébullition de l'eau). Dans ce point on diminue la
température (< 100°C) durant deux heures.
Le pourcentage d'absorption d'eau est défini par la
relation :
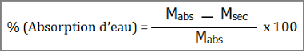
Avec :
- Msec : masse d'un échantillon
sèche, après passage à la cuisson (1060 °C) ;
- Mabs : masse d'un échantillon imbibé
par l'eau (masse absorbante).
V.1. Echantillons à bases d'argile brute
Les échantillons préparés à partir
des argiles brutes (sans additifs), suivant la chaîne de fabrication
classiquement utilisée en industrie céramique sont soumises
à des tests technologiques dont le mode opératoire est celui
recommandé par la norme du Labo-technique de la société
« Céramica DERSA ». Les résultats de mesures
des principaux tests sont présentés dans le tableau III-7.
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 59
Tableau III-7 :
Caractéristiques technologiques des échantillons issues
d'argile brute
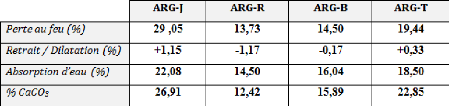
Concernant les argiles brutes, les pastilles obtenues à
partir d'une argile bleu (ARG-B), nettement plus silico-alumineux affichent un
retrait à la cuisson légèrement plus faible par rapport
d'une argile rouge (ARG-R), mais les pastilles obtenues à partir d'une
argile de référence (ARG-T) affichent une dilatation à la
cuisson plus faible par rapport à celle affiché dans l'argile
jaune (ARG-J).
Les deux argiles (ARG-R) et (ARG-B) ont la
responsabilité de convexité de la forme finale des pastilles
obtenues.
L'argile rouge (ARG-R) est moins absorbant de l'eau par
rapport aux autres types d'argiles, c'est-à-dire possède une
faible porosité et plus glus résistance à la flexion. Donc
leur structure compacte et vitrifié.
L'existence de la chaux CaO dans l'argile rouge (ARG-R) est
faible par rapport aux autres types d'argile brute.
V.2. Echantillons à bases d'argile
équilibrée
Des mélanges impliquant 70% des quatre argiles
étudiées et 30% d'adjuvants d'origine minérale
(Quartz, Sable, Feldspaths, Dolomite et Kaolin) ont été
formulés pour obtenir des argiles équilibrées
(ARG-Jéq), (ARG-Réq),
(ARG-Béq) et (ARG-Téq). Les pastilles
cylindriques obtenues en suivant les mêmes conditions de pressage et de
cuisson que pour les précédentes ont été
caractérisées. Les résultats des testes sont
présentés sur le tableau III-8.
Tableau III-8 :
Caractéristiques technologiques des
échantillons issues d'argile équilibré
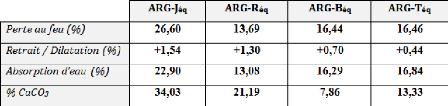
Chapitre-III- Partie expérimentale
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 60
Concernant les argiles équilibrées, les
pastilles obtenues à partir des argiles (ARG-Béq) et
(ARG-Téq), affichent une dilatation à la cuisson
légèrement plus faible par rapport aux argiles
(ARG-Réq) et (ARG-Jéq). Toutes les argiles
ont la dilatation (aucun retrait), donc on peut déduire que par
équilibrant de la composition de ces quatre argiles par l'addition
d'adjuvants bien sélectionnés, on a pu réduire
sensiblement leur retrait à la cuisson, et de réduire leur taux
de CaCO3 dans (ARG-Réq) et (ARG-Téq).
V.3. Echantillons à bases d'argile
recyclée
Les systèmes de gestion de l'environnement sont
essentiels pour réduire au minimum les incidences environnementales des
activités industrielles en général, et certaines mesures
sont plus particulièrement importantes pour l'industrie
céramique.
Les objectifs visés et les solutions envisagées
pour réduire les pertes/déchets du processus de fabrication sont
présentés, en ce qui concerne les pertes/déchets solides,
et consistent en une optimisation des procédés et en
mesures/techniques de recyclage et réutilisation. Ces mesures sont
souvent combinées afin de réduire les pertes/déchets du
processus de fabrication. Le tableau III-9 présente des mesures d'une
argile nommé (ARG-E) obtenu par recyclage des chamottes
(pertes/déchets), équilibré avec l'argile de
référence (ARG-T) et avec une argile vert nommé (ARG-V) a
une taux de CaCO3 presque nul. L'équilibrage comprend :
? ARG-T : 70 % ,
? ARG-V : 15 % ,
? Pertes four cuisson : 5 % ,
? Pertes four email : 5 % ,
? Pertes emails : 5 %.
Tableau III-9 :
Caractéristiques technologiques des
échantillons issues d'argile recyclé
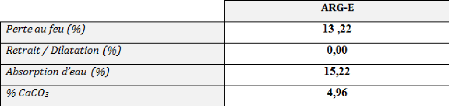
Les pastilles obtenues par recyclages des chamottes leur
retrait et leur dilatation sont nulle. On peut déduire que la
deuxième cuisson de pertes céramiques réutilisées
n'a aucun effet sur le volume de pastilles préparées.
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 61
Conclusion générale
Conclusion générale
Ce travail s'inscrit dans le cadre d'une étude
générale portant sur la caractérisation physico-chimique
des argiles de la société « Céramica
DERSA».
L'étude bibliographique réalisée nous a
permis de passer en revue les divers types des argiles susceptibles d'exister
et d'identifier leurs principaux constituants minéralogiques tout en
mettant l'accent sur leur structure. Certaines applications induites par les
propriétés caractéristiques de ces matériaux ont
été signalées.
La présente étude est portée sur la
détermination du pourcentage du taux d'humidité de l'argile en
chaque station de l'usine, l'humidité fluctué selon le chemin de
la poudre de 2% jusqu'à 6,3% selon la norme du labo-technique.
En plus l'analyse granulométrique concerne des
particules argileuses de petites dimensions, ce qui impose deux
opérations préalables. La première est le tri des
matériaux de grandes dimensions, la seconde, l'obtention de particules
solides minérales. Ces opérations sont effectuées sur un
matériau séché à l'étuve.
La résistance mécanique des carreaux
céramiques dépend la mode de cuisson. À une
température de cuisson élevée les carreaux
céramiques durent et résistent à la flexion à trois
points.
Les résultats obtenus après les essais
concernant les argiles brutes, les argiles équilibrés et l'argile
recyclée leurs compositions très fluctuantes.
Parmi les argiles brutes étudiées, l'argile
rouge (ARG-R) et l'argile bleu (ARG-B) présentent le problème de
déformation de produit final à cause de leur retrait
négative. Dans le cas des argiles équilibré toutes les
pastilles allongent leurs diamètres (aucun retrait), ce qui signifie
l'importance des additifs sur la modification des compositions des argiles.
Dans le cas des pertes recyclés aucun effet de la cuisson sur le volume
des pastilles.
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 62
Références bibliographiques
Références
bibliographiques
[1] Grim, 1968. Caillère et al, 1982. Le Sol:
Constitution, structure. Phénomènes aux interfaces. 457
pages.
[2] F. Valencia. Caractérisations des particules
fines d'un matériau granulaire de fondation par l'essai au bleu de
méthylène. Rapport GCT-2008-0, Département de
génie civil faculté des sciences et de génie,
Université LAVAL (Canada), 2008.
[3] L. Comparon. Étude expérimentale des
propriétés électriques et diélectriques des
matériaux argileux consolidés. Thèse de doctorat.
Institut de Physique du Globe de Paris (2005), 398 pages.
[4] M. Gautier. Interactions entre argile ammonie et
molécules organiques dans le contexte du stockage des déchets.
Thèse de doctorat. Université d'Orléans (2008), 276
pages.
[5] F. Hubert. Modélisation des diffractogrammes
de minéraux argileux en assemblages complexes dans deux sols de climat
tempère. Implications minéralogique et pédologique.
Thèse de doctorat, Université de Poitiers (2008), 223
pages.
[6] M. Rautureau.
Conférence "Les plantes de la racine à la
fleur, le rôle des argiles" (Grasse - Symposium International
d'aromathérapie et de plantes médicinales). Docteur d'Etat
ès Sciences Physiques, membre du GFA. 1er avril 2011.
[7] L. Bouna. Fonctionnalisation des mineraux argileux
d'origine marocaine par Tio2 en vue de l'élimination par photocatalyse
de micropolluants organiques des milieux aqueux. Thèse de doctorat.
Université de Toulouse (2012), 298 pages.
[8] A. Benchabane. Etude du comportement
rhéologique de mélanges argiles -polymères. Effets de
l'ajout de polymères. Thèse de doctorat. Université
Louis Pasteur - Strasbourg I (2006), 228 pages.
[9] N. Jozja. Étude de matériaux argileux
albanais. Caractérisation « multi-échelle » d'une
bentonite magnésienne. Impact de l'interaction avec le nitrate de plomb
sur la perméabilité. Thèse de doctorat.
Université d'Orléans(2003), 293 pages.
[10] A. Assifaoui. Étude de la stabilité de
barbotines a base d'argiles locales. Application aux formulations
céramiques industrielles. Thèse de doctorat.
Université Hassan II Ain-Chock (2002), 229 pages.
[11] L.J. Poppe, V.F. Paskevich, J.C. Hathaway, and D.S.
Blackwood. A Laboratory Manual for X-Ray Powder Diffraction. U. S.
Geological Survey Open-File Report 01-041.
http://www.usgs.gov.
[12] Bonneau M. et Souchier B., Ed. Masson, 1979.
Pédologie 2. Constituants et propriétés du sol.
Université libre de Bruxelles.
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 63
Références bibliographiques
[13] M. Ibn Ghazala. Synthèse des complexes organo
et inorgano-pyrophyllite et leur application dans le traitement des eaux
chargées en métaux lourds. Thèse de doctorat.
Université Mohammed V - Agdal (2009), 127 pages.
[14] D. Rousset. Etude de la fraction argileuse de
séquences sédimentaires de la Meuse et du Gard. Reconstitution de
l'histoire diagénétique et des caractéristiques
physico-chimiques des cibles. Aspects minéralogiques,
géochimiques et isotopiques. Thèse de doctorat,
Université Louis Pasteur de Strasbourg (2006), 281 pages.
[15] K. L. Konan. Interactions entre des matériaux
argileux et un milieu basique riche en calcium. Thèse de doctorat.
Université de limoges (2006),144 pages.
[16] Schroeder P.A., (2002). Infrared Spectroscopy in Clay
Science. In Teaching Clay Science. (ed.) Steve.
[17] E. Errais. Réactivité de surface
d'argiles naturelles. Etude de l'adsorption de colorants anioniques.
Thèse de doctorat. Université de Strasbourg (2011), 210
pages.
[18] P. Leroy, Transport ionique dans les argiles.
Influence de La microstructure et des effets d'interface. Application aux
argilites du site de bure (Meuse/haute marne). Thèse de doctorat,
université Paul Cézanne, France (2005), 216 pages
[19] N. Célini. Traitement des argiles par plasma
froid pour leur utilisation comme charges de nanocomposites
argile-polymère. Thèse de doctorat. Université du
Maine (2004), 233 pages.
[20] B. Velde. Chapter 2: Composition and Mineralogy of
Clay Minerals, in "Origin and Mineralogy of Clays, Clays and Environment"
Ed Springer, (1995), 8 - 41p.
[21] E. Eslinger, D. Peaver, Clay minerals for petroleum
geologist and engineers, SEPM Short course Notes N° 22. Soc. Economic
paleontologists and mineralogists, Tulsa, USA (1988).
[22] R. Morel (1996). Les sols cultivés.
2ème Edition : Lavoisier Tec et Doc Paris, 389 pages.
[23] F. Salles. Hydratation des argiles gonflantes :
Séquence d'hydratation multi-échelle. Détermination des
énergies macroscopiques à partir des propriétés
microscopiques. Thèse de doctorat. Université Paris VI-
Pierre et Marie Curie (2006), 327 pages.
[24] L. Le Pluart. Nanocomposites
Epoxyde/amine/montmorillonite : Rôle des interactions sur la formation,
la morphologie aux différents niveaux d'échelle et les
propriétés mécaniques des réseaux.
Thèse de doctorat de L'Institut National des Sciences
Appliquées de Lyon (2002), 254 pages.
[25] Luckham, P. F. and S. Rossi, Colloidal and
rheological properties of bentonite suspensions. Adv. Colloid Interface
Sci (1999). 82, 43-92 pages.
[26] J. Israelachvili. Intermolecular and surface
forces. London Academic Press, 1991,450 pages.
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 64
Références bibliographiques
[27] O. Cuisset. Le potentiel électrocinétique
des argiles Influence de la salinité, Thésard
Département de géotechnique Laboratoire central, 20 pages.
[28] J. P. Jolivet. De la solution à l'oxyde:
Condensation des cations en solution aqueuse, chimie de surface des
oxides, Savoirs actuels, Inter. Editions/CNRS, Edition Paris, (1994),
68111 pages.
[29] Yang M., Neubauer C.M., Jennings H.M., Interparticle
Potential and Sedimentation Behavior of Cement Suspensions; Review and Results
from Paste. Adv. Cem. Based Mater., (1997), 5, 1, 1-7 pages.
[30] E. White Robert. Principles and Practice of Soil
Science : The Soil as a Natural Resource (2004) ; 348 pages
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 65
Annexes
Annexes
Annexe 1: Body composition Ceramica DERSA versus
typical red body fast firing recipe
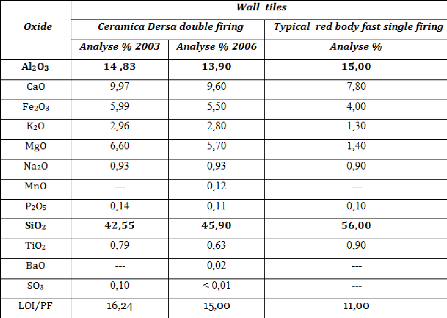
? Teneur en Al2O3 et SiO2 :
- Analyse % 2003 :
Al2O3/SiO2 = 0,348 - Analyse % 2006 :
Al2O3/SiO2 = 0,303
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 66
Annexes
Annexe 2 : Les matériels
utilisés à la société « Céramica DERSA
»

Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 67
Annexes

Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 68
Annexes

| 


