|

UNIVERSITE DE DSCHANG
********
ECOLE DOCTORALE
********
UNITE DE FORMATION
DOCTORALE
SCIENCES
FONDAMENTALES ET
TECHNOLOGIQUES
********
UNIVERSITY OF DSCHANG
******
POSTGRADUATE SCHOOL
********
DOCTORAL TRAINING UNIT FUNDAMENTAL
SCIENCES
AND
TECHNOLOGY
********
DEPARTEMENT DE CHIMIE
DEPARTMENT OF
CHEMISTRY
LABORATOIRE DE CHIMIE DES NUISANCES ET DU GENIE DE
L'ENVIRONNEMENT
(LACHINGE)
Elaboration d'un capteur électrochimique
à
l'aide du charbon actif obtenu à base
des
balles de riz: Application à la
détection
électrochimique du paraquat
Thèse présentée en accomplissement
partiel du pré- requis pour l'obtention du diplôme de «
Master of Science » (M.Sc.) en Chimie
Option : Chimie Inorganique : Chimie
Analytique
Par :
ption : Chime Analytique
TAGNE TIEGAM Rufis Fregue Matricule :
CM04-10SCI1402
Licencié en Chimie
Sous la direction de :
NCHE George NDIFOR-ANGWAFOR (Ph.D.) Chargé de
Cours
Année 2015
DEDICACE
À mes très chers parents ;
TIEGAM Jean Marie
&
KOAGNE Julienne
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 1
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 2
REMERCIEMENTS
Dieu merci pour m'avoir donné la santé, la
volonté, le courage sans lesquels ce travail n'aurait pas
été réalisé. Le présent travail a
été réalisé au sein du Laboratoire de Chimie des
Nuisances et du Génie de l'Environnement (LACHINGE) de
l'Université de Dschang. La réalisation de ce dernier à
bénéficier du support aussi bien matériel, intellectuel
que moral de plusieurs personnes à qui je témoigne ma profonde
gratitude. Je pense ainsi :
+ Au Dr. KAMGAING Théophile,
responsable du laboratoire, pour m'avoir accepté dans son équipe
de recherche. Je le remercie vivement pour l'atmosphère de
sérénité, de rigueur et de travail qu'il a su imposer dans
son équipe de recherche.
+ Au Dr. NCHE George NDIFOR-ANGWAFOR, mon
Directeur de thèse, pour toutes les qualités humaines et
l'encadrement dont j'ai bénéficié de sa personne.
L'intérêt qu'il a porté à cette oeuvre, sa rigueur
scientifique, ses suggestions ainsi que ses corrections ont
considérablement amélioré ce travail.
+ Au Pr. NGOUELA Silvère, Chef de
Département de Chimie, pour sa générosité, son
dynamisme et ses conseils. Je le remercie vivement pour la bonne organisation
du département, qui a permis que ce travail soit réalisé
et soutenu dans les délais.
+ Au Prof. TONLE KENFACK Ignas pour les
conseils et les encouragements qu'il m'a toujours donnés ; Qu'il trouve
ici toute mon estime et respectueuse gratitude.
+ Aux membres du jury qui me font l'honneur d'examiner ce
travail. Un merci à leur égard, car ils ont bien voulu prendre de
leur temps pour lire et critiquer ce dernier afin d'en améliorer la
qualité.
+ Au Pr. GHOGOMU Julius, pour ses
encouragements incessants, ses conseils judicieux et pour ses idées
fructueuses qu'il ne cesse de me prodiguer.
+ À tous les enseignants du Département
de Chimie pour leurs contributions multiformes à ma
formation.
+ Mes remerciements s'adressent à tous ceux qui de
près ou de loin ont contribué à l'élaboration de
cette thèse, en particulier :
+ TEMGOUA Ranil et TCHUIFON Donald
.Ces hommes ne saurons jamais à quel point leurs influences sur
moi fut grandes, tant au niveau scientifique qu'au niveau humain. Ils sont avec
moi depuis mes premiers pas dans la recherche et je ne sais vraiment pas
comment je vais sans eux. Ils sont mes mentors. Ils m'enseignèrent la
démarche et la rigueur scientifique, l'art de présenter des
résultats.
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 3
+ Les aînés de laboratoire
particulièrement DOUNGMO Giscard, YMELE
Ervice, TCHIENO Merlin, DJIMADOUM
Ndigangar, NGAHA Marcel, KAMDEM
Arnaud, JIOKENG Sherman et YOUMOUE Martine
pour leurs conseils et leur franche collaboration. Merci
également pour toutes les discussions enrichissantes que nous avions
partagées tout au long de ce travail.
+ A mes enseignants du primaire et du
secondaire pour toute l'attention qu'ils ont bien voulu nous
prêter.
+ Mes pensées vont aussi à l'endroit de tous mes
anciens camarades qui n'ont pas eu la chance de continuer
leurs études.
+ À tous mes camarades de promotion de CHIMIE
ORGANIQUE et CHIMIE INORGANIQUE pour les moments de
joie partagés et pour le climat amical qui m'a permis de travailler dans
la sérénité et la quiétude pendant cette
année académique.
+ Egalement à toute ma famille notamment mes
frères HOUNAN Tiegam, SOP Tiegam, TCHOUMTCHOUA
Simplice, FOKA Ernest, NKUE Antoine, SANDIE
Brice , TAMOU Rufis et mes soeurs, KOAGNE Tiegam Miriane
et KOAGNE Tiegam Josiane pour leurs soutien moral et
les encouragements.
+ A mes ami(e)s TAGNE Juile, KOAGNE
Romeol, NZEMBOUON Patrick, TIEFAN
Mario, MOUAFO Alain, MENANTE Laure,
FOUAGUE Serge pour leur sincère camaraderie et pour
leur soutien durant la réalisation de ce travail.
+ À maman KOAGNE Florence à qui
je dois une profonde reconnaissance pour son affection et ses efforts consentis
pour mon épanouissement et ma réussite.
+ J'adresse un merci très particulier à mon ami
DIBANGO Marc; ce grand-frère m'a beaucoup
assisté dans mes études.
+ A ma tante NKUIKOU Pièrette pour
tout l'amour, l'affection, le soutien et les encouragements qu'elle m'a
apportée tout au long de ma formation. Il m'est agréable de lui
exprimer ma sincère reconnaissance
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 4
TABLES DES MATIERES
|
DEDICACE
|
|
|
1
|
|
REMERCIEMENTS
|
|
|
2
|
|
TABLES DES MATIERES
|
|
|
4
|
|
RÉSUMÉ
|
|
|
7
|
|
ABSTRACT
|
|
|
8
|
|
LISTE DES ABRÉVIATIONS
|
|
|
9
|
|
LISTE DES TABLEAUX
|
|
|
10
|
|
LISTE DES SCHEMAS
|
|
|
11
|
|
LISTE DES FIGURES
|
|
|
12
|
|
INTRODUCTION GENERALE
|
|
|
14
|
|
CHAPITRE I : ETAT DE L'ART
|
|
|
16
|
|
I.1. GENERALITES SUR LES CHARBONS ACTIFS
|
ISSUS
|
DES
|
MATERIAUX
|
|
LIGNOCELLULOSIQUES
|
|
|
16
|
|
I.1.1 Généralités
|
|
|
16
|
|
I.1.2 Production du charbon et principales applications
|
|
|
17
|
|
I.1.3 Structure et texture du charbon actif
|
|
|
18
|
|
I-2 PRESENTATION GENERALE DES PESTICIDES
|
|
|
19
|
|
I.2.1 Définitions
|
|
|
19
|
|
I.2.2 Classification
|
|
|
20
|
|
I.2.3 Mode de pollution des pesticides
|
|
|
21
|
|
I.2.4 Herbicides
|
|
|
22
|
|
I.2.4.1 Le paraquat
|
|
|
22
|
|
I.2.4.2 Travaux antérieures sur le paraquat
|
|
|
25
|
I.3 ÉLECTRODES CHIMIQUEMENT MODIFIÉES ET CAPTEURS
ÉLECTROCHIMIQUES
25
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 5
I.3.1 Électrodes chimiquement modifiées (ECMs).
25
I.3.1.1 Électrodes à pâte de carbone 26
I-3.2 Capteurs électrochimiques 27
I.3.2.1 Définition et historique 27
I.3.2.2 Principe de fonctionnement des capteurs
électrochimiques 28
I-3 MÉTHODES ÉLECTROCHIMIQUES D'ANALYSES
29
I.3.1 Voltammétrie cyclique 30
I.3.2 Voltammétrie à onde carré (VOC) 31
I.3.4 La spectroscopie d'impédance électrochimique
(SIE) 32
CHAPITRE II : RÉACTIFS, MATÉRIELS ET
MÉTHODES 35
Introduction 35
II.1 RÉACTIFS 35
II-2 PREPARATION DU CHARBON ACTIF 35
II.3 TECHNIQUES DE CARACTÉRISATION DU MATÉRIAU
36
II.3.1 Analyse chimique élémentaire 36
II.3.2 Spectroscopie infrarouge à transformée de
Fourrier (SIR-TF) 36
II.3.3 Le pH de point de charge nulle (pHpzc) 37
II-4. MATERIEL ET APPAREILLAGE 38
II-5. PROCEDURE EXPERIMENTALE 39
II-5-1. Préparation de l'électrode de travail 39
II.6 CONDUITE DES MANIPULATIONS ÉLECTROCHIMIQUES
39
II.6.1 Manipulations par voltammétrie cyclique 40
II.6.2 Manipulations par voltammétrie à onde
carré 40
II.6.3 Manipulations par SIE 40
CHAPITRE III : RÉSULTATS ET DISCUSSION
42
III.1 CARACTÉRISATION PHYSICO-CHIMIQUE DU MATÉRIAU
42
III.1.1 Analyse chimique élémentaire 42
III.1.2 Le pH de point de charge nulle (pHpzc) 42
III.1.3 Analyse structurale par spectroscopie infrarouge
à transformée de Fourier 43
III-2 CARACTERISATION PAR ELECTROCHIMIQUE
45
III-2.1Spectroscopie d'impédance électrochimique
(SIE) 45
III-2.2 ÉTUDE DU COMPORTEMENT ÉLECTROCHIMIQUE DU
PARAQUAT PAR LA
VOLTAMMETRIE CYCLIQUE 46
III.3 ÉLECTROANALYSE PAR LA VOLTAMMÉTRIE A ONDE
CARREE (VOC) 48
III.3.1 Étude de l'effet du modifiant 48
III.4 Stabilité du signal du paraquat
49
III.5 Optimisation de la réponse électrochimique
de paraquat sur EPC-CHA 50
III.5.1 Etude du milieu de détection et d'accumulation
50
III.4.2 Influence de la fréquence 51
III.4.3 Influence de l'amplitude 52
III.4.4 Influence du potentiel de dépôt 54
III.4.5 Influence du temps de dépôt 55
III.4.6. Variation du temps d'accumulation 56
III.4.7 Variation du pH du milieu de détection et
d'accumulation 56
CONCLUSION GÉNÉRALE ET PERSPECTIVES
59
REFERENCES BIBLIOGRAPHIQUES 60
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 6
RÉSUMÉ
Les plus grands contribuant à la pollution toxique de
l'eau sont des herbicides, des pesticides et des composés chimiques
industriels. Vu le besoin de capteur environnemental rapide et sensible pour la
surveillance de ces polluants, l'analyse électrochimique est
étudiée dans ce travail de recherches. Ce travail porte sur la
valorisation des matériaux lignocellulosiques locaux à des fins
analytiques en particulier les balles de riz. Le charbon obtenu a
été préparé à partir des balles de riz puis
activé avec l'acide phosphorique à 450 oC. Le
matériau obtenu (charbon activé) a été par la suite
caractérisé par diverses techniques (SIR-TF, Analyse
élémentaire et le point de la charge nulle), puis exploité
pour élaborer une électrode modifiée qui a
été utilisée par la suite comme capteur
ampérométrique de paraquat (herbicide). Cette
caractérisation nous a permis d'avoir des informations sur les
groupements fonctionnels présents à la surface de
matériau, le pourcentage massique des éléments et la
charge de la surface du matériau. Deux électrodes
(électrode à pate simple et modifiée par le charbon) ont
été élaborées. Après comparaison de ces
électrodes, il ressort que l'électrode à pate de carbone
modifiée par le charbon est plus sensible et plus stable. Plusieurs
paramètres qui affectent les voltammogrammes à ondes
carrées tels que le pH du milieu d'accumulation et de détection,
le temps de préconcentration, le potentiel d'électrolyse, la
variation de l'amplitude, de la fréquence et la concentration de
paraquat ont été étudiés dans le but d'optimiser le
capteur élaboré. Il en ressort que l'EPC modifiée est 4.04
plus sensible que l'EPC simple. La suite de nos travaux a été
effectué dans les conditions optimales de détection à
savoir (CHA 10 %, potentiel d'électrolyse -0,9 V, temps d'accumulation 8
minutes, pH du milieu d'accumulation et de détection 8,).
Mots clés : matériaux
lignocellulosiques, charbon actif, paraquat, capteur
ampérométrique, balles de riz.
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 7
ABSTRACT
The greatest contributors to toxic water pollution are
herbicides, pesticides and industrial chemical compounds. Considering the need
for a rapid and sensitive environmental sensor for monitoring these pollutants,
electroanalytical methods are employed in this research work. This work
concerns the valorization of local lignocellulosic materials at analytical ends
in particular the balls of rice. Coal was prepared starting from rice husk and
activated with phosphoric acid to 450o C. The activated carbon
obtained was characterized using different techniques ((SIR-TF, elementary
Analysis and the zero point load), and exploited to work out a modified
electrode which was used thereafter as amperometric sensor of paraquat
(weedkiller). This characterization enabled us to have information on the
functional groups present at the material surface, the mass percentage of the
elements and the surface load of the material. Two electrodes (simple paste and
modified) were elaborated. After comparison of these electrodes, it arises that
the electrode with carbon paste modified by coal is more sensitive and more
stable. Several parameters which assign the voltammogrammes to wave square such
as the pH of the medium of accumulation and detection, the time of
preconcentration, the potential of electrolysis, the variation of the
amplitude, the frequency and the concentration of paraquat were studied the an
aim of optimizing and elaboratory sensor. This reveals that the modified EPC is
4.04 times more sensitive than the simple EPC. The continuation of our work
were carried out under the optimum conditions for detection to know (CHA 10 %,
potential of electrolysis -0,9 V, time of accumulation 8 minutes, pH of the
medium of accumulation and detection 8).
Keywords: Lignocellulosic materials,
activated carbon, paraquat, amperometric sensor, rice husks
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 8
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 9
LISTE DES ABRÉVIATIONS
Ag/AgCl/KCl, 3M: Electrode à l'argent
chlorure saturé au potassium chlorure CHA : Charbon
actif
DL : Dose létale
ECMs : Electrodes chimiquement
modifiées
ENH : Electrode Normale à
Hydrogène
EPC: Electrode à pâte de carbone
EPC-CHA: Electrode à pâte de
carbone modifiée par le charbon actif.
HPLC : Chromatographie liquide haute
performance
IUPAC : International Union of Pure and
Applied Chemistry (Union Internationale de Chimie Pure et Appliquée)
O.M.S : Organisation Mondiale de la
Santé
PHpzc : pH de point de charge nulle
PQ : Paraquat
SIE : Spectroscopie d'impédance
électrochimique
SIR-TF: Spectroscopie Infrarouge à
Transformée de Fourrier
VC : Voltammétrie cyclique
VDI: Voltammétrie Différentielle
Impulsionnelle
MP : Maladie de Parkinson
CEE : Circuit électrique
équivalent
ICI : Imperial Chemical Industrie
LISTE DES TABLEAUX
Tableau I.1: Principales
caractéristiques du charbon activé (Allami, 1989). 17
Tableau I.2: Quelques familles
chimiques de pesticides et leurs cibles principales (Chouteau,
2004) 20
Tableau I-3 :
Propriétés physico-chimiques du paraquat 24
Tableau I.4 : Toxicologie du
paraquat (Ngou, 2010). 25
TTableau II.1 : Formules chimiques,
noms, pureté et origine des réactifs utilisés. 35
Tableau III-1 : Analyse
élémentaire des balles de riz et du charbon actif obtenu à
partir des
balles de riz. 42
Tableau III.2 : pH et pHPZC du
matériau Erreur ! Signet non défini.
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 10
LISTE DES SCHEMAS
Schéma I-1 : Processus
impliqués dans le devenir des pesticides dans les
sols
::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::
21
Schéma I.2 : Coupe
représentative d'une électrode à pâte de carbone
simple ou Modifiée
...............
...........................................................................................................27
Thèse de" Master of Science " de TAGNE TIEGAM
RUFIS 11
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 12
LISTE DES FIGURES
Figure 1: diagramme schématique de
processus de la production du charbon actif (Demirbas,
2009) 18
Figure 2 : Structure chimique du
viologène (a) et du paraquat (b). 23
Figure 3 : Paraquat chlorure. 23
Figure 4 : principe de fonctionnement d'un
capteur 29
Figure 5 : Courbe typique de
voltampérométrie cyclique. 30
Figure 6 : Allure de la commande de potentiel
imposé en fonction du temps en voltammétrie à
ondes carrées. 32
Figure 7 : Une fonction de transfert. 33
Figure 8 : Dispositif d'analyse
voltammétrique ; A) agitateur magnétique ; B) cellule
électrochimique ; C) potentiostat ; D) ordinateur ; E)
micropipètes. 38
Figure 9 : point de charge nulle du charbon
actif étudié 43
Figure 10: Spectre JR de matériau brut
(balle de riz)
Figure 11: Spectre JR du charbon actif
44
Figure 12 : Résultat d'impédance obtenus
sur l'EPC (A) et sur EPC-CHA (B), après 120 secondes d'immersion dans
une solution de 0.2M de [Fe(CN)6]3-/4- : diagramme dans
le plan complexe de Nyquist . 45
Figure 13 : Circuits électriques
équivalents aux figures 13 A et 13 B respectivement 46
Figure 14 : Voltammogrammes cycliques d'une
solution de paraquat 5x10-4M en milieu Na2SO4
sur EPC simple ( ) et EPC-CHA ( ). 46
Figure 15 :
Voltammogrammes ondes carrées d'une solution de paraquat
(5x10-4 M) enregistrés dans Na2SO4 0,1 M à pH 6,
après 5 min de préconcentration en circuit fermé :(a)
blanc, (b) sur EPC et (c) sur EPC-CHA (10 %). Potentiel
d'électrolyse (-1 V), 48
Figure 16 : Voltammogrammes
impulsionnels d'une solution de paraquat (10-4 M) enregistrés
dans NaCl 0,1 M à pH 6 après 5 min de préconcentration en
circuit fermé sur EPC-
CHA (10 %). Potentiel d'électrolyse (-1 V), durée
(5 s). 50
Figure 17 : Voltammogrammes de paraquat à
10-5M sur EPC-CHA dans différents sels. Accumulation et
détection dans le CaSO4 0,1 M pH 6 (a), MgSO4 0,1 M pH 6 (b), Na2SO4 0
,1M pH 6 (c) et NaCl 0,1M PH6 (potentiel de dépôt : -1 V, temps
d'électrolyse : 50 s). 50
Figure 18 : Réponses
voltammétriques des pics de détection pour chaque variation de
fréquence. Conditions expérimentales : temps d'accumulation (5
min), potentiel d'électrolyse (-
1 V), milieu (NaCl pH 6). 51
Figure 19:
Variation de la fréquence sur l'intensité du paraquat à
10-5M. Conditions expérimentales : temps d'accumulation (5
min), potentiel d'électrolyse (-1V), milieu
(NaCl). 52
Figure 20 : Réponses
voltammétriques des pics de détection pour chaque variation
d'amplitude. Conditions expérimentales : temps d'accumulation (5 min),
potentiel d'électrolyse (-
1V), milieu (NaCl pH 6), fréquence (100 Hz).
53
Figure 21 : influence de l'amplitude sur le signal du
paraquat à 10-5M dans NaCl (0.1M). Conditions
expérimentales : temps d'accumulation (5 min), potentiel
d'électrolyse (-
1 V), fréquence (100 Hz). 54
Figure 22
: Variation du courant de pic du paraquat en fonction du potentiel
d'électrolyse appliqué sur EPC-CHA. Conditions
expérimentales : temps d'accumulation (5 min),
potentiel d'électrolyse (-1V), fréquence (100 Hz),
amplitude (200 mV). 54
Figure 23 : influence du temps de
dépôt sur le signal du paraquat. Conditions opératoires
identiques à celles de la figure 22, potentiel
d'électrolyse (-0.9 V) 55
Figure 24 : Variation du
courant de pic de paraquat en fonction du temps
d'accumulation.
Conditions opératoires identiques à celles de la
figure 23, durée (50 s). 56
Figure 25 : Variation
du courant de pic du paraquat en fonction du pH du milieu de d'accumulation et
de détection. Conditions opératoires identiques à celles
de la figure
24, temps d'accumulation (8 minutes). 57
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 13
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 14
INTRODUCTION GENERALE
La pollution des eaux et des sols, accidentellement ou
volontairement par certains produits chimiques d'origine industrielle
(hydrocarbures, phénols, colorants, acides organiques) ou agricole
(pesticides, engrais,) est devenue actuellement un problème crucial et
de grande inquiétude, puisque elle constitue une source de
dégradation de l'environnement et suscite à l'heure actuelle un
intérêt particulier à l'échelle international. Cette
contamination quasi-chronique des eaux naturelles en occurrence par les
pesticides ne présente pas un caractère de nouveauté, mais
reste un problème d'actualité, que ce soit pour les pouvoirs
publics, pour les traiteurs d'eau ou pour les consommateurs (Camard &
Magdelaine, 2010).
Parmi les industries susceptibles de charger les polluants dans
l'environnement au Cameroun, on trouve celle de textiles et celle
opérant dans le secteur agricole. En effet depuis la révolution
industrielle, l'exploitation des terres à des fins agricoles
s'intensifie au rythme de la croissance de la population mondiale. En plus des
progrès technologiques, l'agriculture se dote aujourd'hui de produits
chimiques performants (pesticides) pour contrer l'infestation des
espèces qui nuisent à l'évolution des plantes (Tcheumi,
2011).
Les pesticides, plus particulièrement les herbicides
dipyridiles tels que le paraquat et le diquat sont quelques-unes parmi les
matières actives utilisées par les collectivités agricoles
camerounaises pour la protection des cultures maraichères,
fruitières et cacaoyères. Leur présence dans les eaux de
surfaces et les cultures maraichères a d'ailleurs été mise
en évidence par (Sonchier et al., 2006). Bien que
consommés en faible dose dans les eaux, les légumes et dans les
fruits, les pesticides du fait de leur vitesse de dégradation
plutôt faible s'accumulent dans l'organisme ou dans l'environnement et
deviennent à long terme dangereux par le phénomène de
bioaccumulation (Lagaly, 2001). Etant donné leur toxicité
potentielle et celle de leurs sous-produits (métabolites), leur
élimination des eaux naturelles s'avère nécessaire. Leurs
principaux effets toxiques consistent en une tendance à l'anorexie,
à l'anémie, aux effets cancérigènes,
mutagènes et surtout aux perturbations potentielles du système
endocrinien (Silva et al., 2004).
L'acuité de tous ces maux amène les chercheurs
et régulateurs environnementaux à s'atteler sur le
développement de processus simples et peu onéreux de
détection et d'élimination de ces polluants de l'environnement.
Plusieurs techniques ont été utilisées pour l'analyse des
pesticides ; il s'agit entre autre de la fluorimétrie, la
spectrophotométrie, l'électrophorèse capillaire, la
spectroscopie de masse et les techniques chromatographiques (Van der Hoff
et al.,
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 15
1999). Ces techniques fournissent de bons résultats,
mais présentent un certain nombre d'inconvénients : les
procédés de séparation dans le prétraitement
d'échantillons sont souvent complexes, elles nécessitent souvent
des temps d'analyse très longs et des équipements très
couteux, les seuils de détection restent assez élevés
(Vial, 2005 ; Tonlé & Ngameni, 2011). Il est nécessaire de
réfléchir à des techniques d'efficacité
sévère et à moindre coût.
Les techniques électrochimiques ont été
couronnées de succès dans la détection et
l'électroanalyse des espèces organiques. Ainsi, les techniques
électroanalytiques qui permettent l'accumulation de l'analyte à
la surface d'une électrode modifiée conduisent au
développement des techniques sélectives et sensibles.
L'élimination des polluants organiques par le charbon actif a fait
l'objet de plusieurs publications.
L'application du charbon actif en poudre ou en grains dans le
domaine de traitement des eaux a commencé à se développer
après la seconde guerre mondiale. Utilisé initialement durant la
première moitié du siècle pour assurer la
décoloration des eaux, le charbon actif de par leurs larges surfaces
spécifiques très réactives, leurs propriétés
d'adsorption et de porosité très élevées, semblent
être de bons candidats pour la détection des molécules
neutres, même à l'état de traces. Cette étude
présente un intérêt double. Tout d'abord, il s'agit de
préparer des charbons actifs (valoriser les résidus de
l'agriculture en les utilisant comme précurseur) et d'élaborer un
capteur très sensible à l'aide d'une électrode à
pate de carbone modifiée avec ce charbon actif. Cette électrode
sera ensuite utilisée pour la détection électrochimique du
paraquat. Pour y parvenir une connaissance sur les
généralités des pesticides et des matériaux
lignocellulosiques est nécessaire. Ainsi nous présenterons dans
le chapitre I une synthèse bibliographique qui indique la structure, la
texture, la préparation et l'application du charbon actif. Les
différents clases de pesticides, leurs modes de dispersion dans le
milieu naturel, ainsi que leurs toxicité serons également
préciser. Le second chapitre expose l'ensemble des techniques et
méthodes expérimentales utilisées au cours de ce travail.
Il mentionne également les réactifs chimiques et décrit la
préparation du matériau utilisé. Quant au troisième
chapitre, il est entièrement consacré à
l'interprétation des résultats expérimentaux et comprend
dans l'ordre les résultats de la caractérisation du
matériau, l'élaboration du capteur et l'optimisation de ce
dernier à travers l'étude de divers paramètres qui
gouvernent les étapes de préconcentration du polluant, puis sa
détection électrochimique. Le travail comporte enfin une
conclusion qui résume l'essentiel des résultats obtenus dans le
cadre de ce travail.
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 16
CHAPITRE I : ETAT DE L'ART
Introduction
Dans ce chapitre, nous dressons un état de l'art des
connaissances sur les matériaux lignocellulosiques, sur les charbons
actifs et sur les électrodes modifiées pour ainsi justifier le
travail que nous avons entrepris. Un point est également fait sur les
pesticides et plus particulièrement sur le paraquat.
Vu le grand nombre de méthodes électrochimiques
qui existe, une description de celles sollicitées dans le cadre ce
travail est également faite.
I.1. GENERALITES SUR LES CHARBONS ACTIFS ISSUS DES
MATERIAUX LIGNOCELLULOSIQUES
I.1.1 Généralités
On appelle matériau lignocellulosique, l'ensemble des
matériaux produits par des végétaux au cours de leurs
croissances. Ils sont constitués essentiellement de deux sortes de
composés chimiques : les macromolécules qui représentent
plus de 90% de la biomasse et des extractibles qui représentent 2
à 8% de la matière végétale (Marvin,
2011).cependant les matériaux lignocéllulosiques peuvent
être carbonisé et activer pour prendre le nom du charbon actif.
Le charbon actif se rapporte à rapporte à
l'ensemble des substances carbonées présentant une surface
spécifique élevée (700-1500 m2 /g) et une
porosité également très élevée. C'est le
principal adsorbant utilisé en pratique. Il est obtenu à partir
de matières organiques (bois, tourbe) carbonisées, puis
activées (dégagement des cavités remplies de goudron lors
de la carbonisation). Le charbon actif peut être obtenu soit sous forme
de poudre avec des pores de quelques um de dimension, soit sous forme de grain
(Ngnié, 2009). Il peut être régénéré
selon trois procédés de désorption: à la vapeur,
thermique et chimique. L'expérience montre que les charbons actifs sont
des adsorbants à très large spectre. Sur le tableau I.1
ci-dessous sont regroupées quelques caractéristiques des charbons
activés.
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 17
Tableau I.1: Principales
caractéristiques du charbon activé (Allami, 1989).
|
Caractéristique
|
Description
|
|
Diamètre Effectif
|
Poudre : 8-9 ; granules : 0,55 -1,05mm Augmentation du taux
d'adsorption et des pertes de charge lorsque la grosseur des grains diminue.
|
|
Surface
d'adsorption
|
De 850 à 1500 m2/g. Plus cette surface est
grande plus le charbon activé est efficace.
|
|
Nombre de mélasse
|
Il est associé à la capacité du charbon
activé d'absorber les impuretés de masses moléculaires
élevées.
|
|
Densité brute
|
Evolution du volume de charbon activé utilisé.
|
I.1.2 Production du charbon et principales applications
Les applications principales du charbon activé sont
entre autres la purification, décoloration, désodorisation et en
général la désintoxication des eaux potables ainsi que la
purification de l'air et des produits chimiques, alimentaires...etc (Allami,
1989). Nous rappelons de façon très brève les
étapes de production de cet absorbant (DeLaat, 1988):
· Le séchage de la matière première :
tourbe, bois, noix de coco, charbon bitumeux etc.
· La carbonisation sous atmosphère
contrôlée (absence d'air) à une température de 400
à 600 oC. Celle-ci permet l'élimination de toutes les
matières organiques volatiles.
· L'activation assure un meilleur développement
de la surface spécifique et de la structure poreuse obtenue à
l'étape de carbonisation (Malik et al., 2007). Elle est
réalisée à l'aide d'agents oxydants physiques ou
chimiques. Le procédé d'activation qui utilise la vapeur d'eau,
le dioxyde de carbone ou l'oxygène correspond à la méthode
physique. Elle consiste en une gazéification du matériau
carbonisé au moyen du dioxyde de carbone, de la vapeur d'eau (Malik
et al., 2007).La nature de l'agent d'activation influence la
distribution poreuse du matériau par exemple, l'utilisation du dioxyde
de carbone comme agent oxydant, favorise le développement de la
microporosité alors que la vapeur d'eau favorise une porosité aux
dimensions plus larges (Tomas et al., 2001), et la formation des
groupements fonctionnels de surface généralement oxydées
qui sont à l'origine des interactions entre le solide et les
molécules adsorbées (Manole , 2007). En générale
l'activation physique a été opérée à une
température élevée et à un temps
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 18
d'activation très longue (Demirbas, 2009). Par
ailleurs, lors de l'activation chimique, la carbonisation et l'activation sont
réalisées simultanément. L'utilisation d'agents oxydants
(tels que l'acide phosphorique (H3PO4), le chlorure de Zinc (ZnCl2) ou l'acide
sulfurique (H2SO4)) influence sur la décomposition pyrolytique, en
jouant le rôle d'agent déshydratant (Malik et al., 2007).
Les conditions d'activation (température, durée, agent
d'activation) influencent fortement la structure du produit final. En effet,
les agents oxydants chimiques inhibent la formation de goudron et la production
de composés volatils (méthanol, acide acétique, etc...),
conduisant ainsi à un meilleur rendement (Molina et al., 1996).
Dans l'activation chimique la carbonisation et l'activation sont normalement
réalisées à des températures plus basses. La Figure
1 représente le processus de la production du charbon actif.
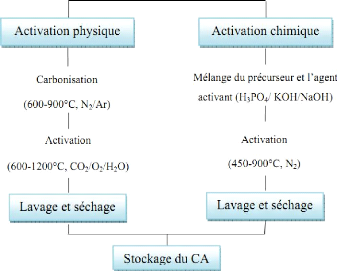
Figure 1: diagramme
schématique de processus de la production du charbon actif (Demirbas,
2009)
I.1.3 Structure et texture du charbon actif
La structure du charbon actif est semblable à celle du
graphite. En effet la structure cristalline de ce dernier consiste en un
ensemble de couches planes d'atomes de carbone, ordonnés en hexagone
réguliers, comparables aux cycles aromatiques.
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 19
L'analyse de diffraction aux rayons X, révèle
que sa structure est graphitique, mais avec quelques différences,
notamment par la disposition de ces couches planes d'atomes de carbone en un
agencement désordonné et par la formation de groupements
fonctionnels, dus à la présence d'hétéroatomes
(oxygène, métaux, hydrogène...) dans le réseau
cristallin (Ho et al., 2000). Ces modifications de structure pourront
engendrer des interactions spécifiques (groupements fonctionnels) et des
interactions non spécifiques
(hétérogénéité du réseau) pour cet
adsorbant (Ayhan et al., 2008).
La texture du charbon actif quant à elle se
caractérise essentiellement par deux paramètres qui sont l'aire
spécifique et la porosité. Ils sont essentiels pour la
détermination des capacités et des cinétiques
d'adsorption. Une classification simple permet de distinguer trois sortes de
pores (Perche, 2004).Il s'agit des :
? Macrospores : ils possèdent un rayon moyen compris
entre 500 et 1000 Å et peut atteindre jusqu'à 20000 Å.
L'ordre de grandeur de leurs aires massiques (0,5 à 2 m2/g)
montre qu'ils influencent faiblement la capacité d'adsorption.
? Mésopores : ils ont un rayon compris entre 18-20
Å et 500-1000 Å. Leurs surfaces spécifiques (25 à 75
m2. g-1) montrent qu'ils peuvent influencer moyennement
la capacité d'adsorption.
? Micropores : ils constituent pratiquement l'essentiel de la
surface spécifique totale (95%). Leur rayon qui est inférieur
à 18-20 Å (de l'ordre de la taille des molécules simples)
leur confère un très grand rôle dans le processus
d'adsorption.
I-2 PRESENTATION GENERALE DES PESTICIDES
I.2.1 Définitions
Couramment appelés produits phytosanitaires, les
pesticides (du latin « pestis » signifiant «
fléau, calamité ») ont une dénomination qui provient
du nom anglais « pests », qui désigne tout animal ou plante
(virus, bactérie, champignon, ver, mollusque, insecte, rongeur, oiseau
et mammifère) susceptible d'être nuisible à l'Homme et
à son environnement (Arfaouri, 2010). Ce terme englobe en effet toutes
les substances chimiques utilisées pour lutter contre les organismes
vivants (microbes, animaux ou végétaux) considérés
comme nuisibles aux cultures et récoltes, à la santé
humaine et vétérinaire, ainsi qu'aux bâtiments et surfaces
non agricoles (routes, voies ferrées) (Zacharia & Tano, 2011). Un
pesticide est une substance destinée à repousser ou à
combattre toute espèce indésirable végétale ou
animale, pendant la production, le stockage, le
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 20
transport, la distribution ou la transformation des
denrées destinées à l'alimentation humaine ou animale. Il
désigne aussi toute substance destinée à servir comme
régulateur de la croissance, défoliant ou dessiccateur.
(Arfaouri, 2010).
I.2.2 Classification
De manière générale, on peut admettre une
classification selon la nature chimique, le mode et le type d'action, la nature
de l'espèce à combattre, l'effet obtenu, la toxicité, le
moment d'application ou bien même le lieu d'application (El Bakouri,
2006). On classe ainsi les produits phytosanitaires d'après la nature de
l'espèce nuisible que l'on veut contrôler en herbicides,
insecticides, fongicides, molluscides (limaces), nématicides (contre les
vers), rodenticides (contre les petits rongeurs), acaricides, taupicides,
corvicides, etc. (Zacharia & Tano, 2011). En considérant seulement
les herbicides (contre les mauvaises herbes), les fongicides (contre les
champignons) et les insecticides (contre les insectes), on se trouve devant une
extraordinaire diversité de familles chimiques, et dans chaque groupe on
distingue deux sous-groupes qui sont : les produits inorganiques et les
produits organiques. Le tableau I.2 ci-dessous donne quelques familles
chimiques de pesticides et leurs cibles principales.
Tableau I.2: Quelques familles
chimiques de pesticides et leurs cibles principales (Chouteau, 2004)
|
Familles chimiques
|
Exemples de substances
actives
|
Classement selon cible
|
|
Organochlorés
|
DDT, Chlordane, Lindane,
Dieldrine, Heptachlore
|
Insecticides
|
|
Organophosphorés
|
Malathion, Parathion,
Chlorpyrifos, Diazinon
|
Insecticides
|
|
Carbamates
|
Aldicarbe, Carbaryl,
Carbofuran, Méthomyl
|
Insecticides
|
|
Dithiocarbamates
|
Mancozèbe, Manèbe,
Thirame, Zinèbe
|
Fongicides
|
|
Phtalimides
|
Folpel, Captane, Captafol
|
Fongicides
|
|
Triazines
|
Atrazine, Simazine,
Terbutylazine
|
Herbicides
|
|
Pyridines-bipyridiliums
|
Paraquat, Diquat
|
Herbicides
|
|
Aminophosphonates glycine
|
Glyphosate
|
Herbicides
|
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 21
I.2.3 Mode de pollution des pesticides
L'utilisation des pesticides facilite l'introduction d'un
certain nombre de substances chimiques dans la composition de l'air, de l'eau
et du sol. Ces substances entraînent ainsi la perturbation ou la
dégradation de ces milieux et provoquent la pollution de
l'environnement. Le traitement des plantes par les pesticides est suivi par le
phénomène de dissipation de ces derniers. Deux processus
fondamentaux contribuent à cette dissipation à savoir, la
dispersion et la dégradation (Schéma 1). La dispersion des
pesticides est assurée par de différents modes de transfert
(volatilisation, lixiviation, absorption par la plante) qui entraînent le
produit et, éventuellement ses dérivés, hors du site
d'application (Chevreuil et al., 1993 et 1996 ; Aderhold &
Nordmeyer, 1995 ; Miller et al., 1997). La dégradation des
pesticides fait intervenir des réactions chimiques (photolyse,
hydrolyse) ou biochimiques (impliquant l'intervention des micro-organismes du
sol) qui assure la transformation de la molécule initiale (Ristori &
Fusi, 1995 ; Soulas, 1999). Le schéma ci-après explique la
dissipation des pesticides dans l'environnement.
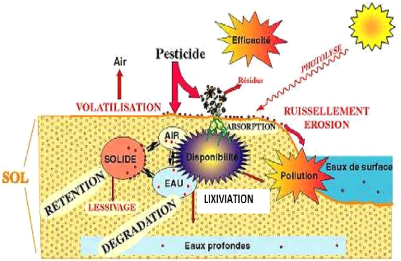
Schéma I-1 : Processus
impliqués dans le devenir des pesticides dans les sols (Barriuso et al.,
1996).
Ce schéma confirme bien que les pesticides
destinés à la protection des plantes se retrouvent dans les
différents compartiments environnementaux et représentent une
menace réelle pour l'homme et l'environnement. Quel que soit le mode
d'utilisation, ces pesticides
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 22
finissent toujours par atteindre le sol durant ou après
le traitement et leur devenir va donc dépendre des
caractéristiques du sol. De tous les polluants recensés
jusque-là, les pesticides sont l'une des classes fréquemment
rencontrées dans le milieu naturel et plus précisément
dans l'eau (Aubertot et al., 2005). La forte toxicité des
pesticides a conduit les organismes internationaux à fixer des
concentrations limites permises, très strictes. Ainsi, la norme
européenne (directive 98/83/CE) relative à la qualité de
l'eau fixe à 0,1 ug/L la teneur en chaque pesticide et à 0,5 ug/L
pour l'eau potable (Carter, 2000).
I.2.4 Herbicides
Les herbicides sont appelés parfois désherbants,
notamment en horticulture. Ils représentent 60% des ventes totales
mondiales de pesticides et 90% de ces produits sont utilisés en
agriculture (Doungmené, 2010). Ce sont des matières
actives ou des produits formulés ayant la propriété de
tuer les végétaux (Coulibaly, 2005). Ce sont des produits aux
structures chimiques complexes. Chaque herbicide possède des
caractéristiques propres selon sa composition, son mode d'absorption,
son effet sur la mauvaise herbe et son élimination progressive.
Cependant, bien que chaque produit ait ses propriétés
particulières, les herbicides d'une même famille présentent
des structures chimiques semblables et de nombreuses caractéristiques
communes (Edelahid, 2004). Ils permettent de supprimer ou de limiter le
développement de plantes non désirées et des mauvaises
herbes. Ils peuvent être sélectifs ou non sélectifs. Ils
agissent sur les mauvaises herbes soit par contact en détruisant les
parties de plante sur lesquelles ils sont déposés, soit par
pénétration et diffusion lorsqu'ils sont absorbés par les
feuilles ou les racines et exercent leurs effets toxiques sur l'ensemble du
végétal (Fdil, 2004). L'herbicide qui a retenu notre attention au
cours de ce travail est le paraquat.
I.2.4.1 Le paraquat
Le paraquat est un produit phytosanitaire ayant un effet
herbicide produit à des fins commerciales dès 1961 par ICI
(devenu Syngenta). (Fortier et al., 2005; Miquel, 2003) Il
appartient à la famille chimique des bipyridines ou viologènes
qui comprend d'autres produits phytosanitaires possédant des
propriétés similaires tels que le diquat, le cyperquat. Le nom
scientifique de ce composé d'après l'UIPAC (Union Internationale
de Chimie Pure et Appliquée) est 1,1'-diméthyl-4,4'-bipyridinium.
Le paraquat ou méthylviologène (MV2+) est l'herbicide
le plus utilisé dans le monde après le glyphosate. Sa structure
est la suivante (Mhammedi & Chtaini, 2008; Ren et al., 2009 ;
Washington, 1997):
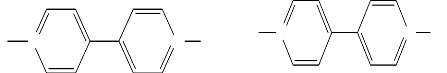
N+ N+ R
N+ N+ CH3
R
H3C
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 23
a b
Schéma I.2 : Structure
chimique du viologène (a) et du paraquat (b).
N+ N+ CH3
Cl- Cl-
Il existe dans les produits commerciaux sous le nom de
paraquat chlorure de formule C12H14Cl2N2. Le paraquat-chlorure se
présente sous la forme de cristaux blancs cassés, inodores et
hygroscopiques. Il n'est pas volatil (Kenne, 2011 ; Washington, 1997).
H3C
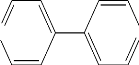
Schéma I.3 : Paraquat
chlorure.
Bien que très toxique, il sert en agriculture, en
floriculture et dans certains boisements à désherber ou
préparer le sol pour une centaine de cultures de céréales
(maïs, blé, orge, seigle, riz..), de soja, pomme de terre, fruits
(pomme, orange, banane), de plantes destinées à la fabrication de
boissons (café, thé, cacao) et des cultures traitées
(coton, huile de palme, canne à sucre et caoutchouc). Il vise à
protéger les semis contre la concurrence d'un large éventail de
plantes pluriannuelles, les adventices, qui réduisent le rendement et la
qualité de la récolte par compétition pour l'espace,
l'eau, les nutriments, et la lumière. Étant hautement toxique,
son utilisation nécessite des précautions particulières.
Quelques caractéristiques le distinguent d'autres substances actives
d'herbicides de contact :
? Non-sélectivité (il détruit un large
éventail de plantes) ;
? Action rapide ;
? La pluie survenant quelques minutes après application
ne diminue pas son efficacité ; ? Il est réputé devenir
biologiquement inactif pour les plantes au contact du sol car il y est
rapidement et très fortement adsorbé, mais on
ignore ses éventuels effets sur les
invertébrés du sol, et son devenir lorsqu'il est
emporté par l'érosion hydrique
I.2.4.1.1 Propriétés physico-chimiques
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 24
Le paraquat-chlorure se présente sous la forme de
cristaux incolores et inodores. Il n'est pas volatil. Très soluble dans
l'eau (environ 70 g/mL à 20 oc), il l'est
légèrement dans l'éthanol et l'acétone. Il est
insoluble dans les hydrocarbures.
Tableau J-3 :
Propriétés physico-chimiques du paraquat
|
Formule brute
|
C12H14Cl2N2
|
|
Masse molaire
|
257,2
|
|
Température d'ébullition
|
Supérieur à 300 °C
|
|
densité
|
Environ 1,25
|
|
Température de fusion
|
175 à 180 oC
|
Les sels de paraquat et leurs solutions aqueuses ne sont pas
inflammables. Il se décompose au-dessus de 300 °C produisant des
fumées toxiques. Il attaque les métaux, notamment le fer. Il est
stable en milieu acide ou neutre, instable en milieu basique. Avec la soude,
comme avec les agents réducteurs (Zinc,dithionite de sodium),la
réaction conduit à la formation d'un radical libre soluble dans
l'eau et de couleur bleue intense(Mckeag et al.,2002).
I.2.4.1.2 Effet du paraquat sur l'homme
Le paraquat est considéré comme l'herbicide le
plus toxique au monde. Aujourd'hui, il est utilisé essentiellement sous
forme de gramoxone et est un des composés les plus dangereux pour la
santé humaine. Des expositions répétées peuvent
causer l'irritation de la peau, des pertes de la vue, des ulcères, des
lésions des poumons et des nerfs, des graves problèmes de peau et
d'autres dommages irréversibles à la santé et au
bien-être (Washington, 1997). Il est un contaminant potentiel
des eaux grâce à sa solubilité élevée (autour
620 g/l à 25°C) (Mhammedi & Chtaini, 2008). Des
études menées sur des rongeurs suggèrent qu'il causerait
des lésions cérébrales semblables à celles de la
maladie de Parkinson (MP). Le paraquat, comme d'autres pesticides, est donc
suspecté de favoriser l'apparition de MP chez les agriculteurs (Berry
et al., 2010).
Bien que la dangerosité du paraquat soit connue et que
son utilisation en Europe soit interdite depuis quelques années, il
reste un des herbicides les plus employés au monde et cause chaque
année de nombreux décès par empoisonnement accidentel ou
volontaire (Costa et al., 2014).
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 25
Tableau I.4 : Toxicologie du
paraquat (Ngou, 2010).
|
Concentration permise dans les eaux de
consommation
|
0,1 ug.L-1
|
|
Concentration permise dans les eaux de
surface
|
1 à 3 ug.L-1
|
|
Valeur limite d'exposition professionnelle
|
0,1 mg.m-3
|
|
DL50 chez l'homme
|
35 mg.kg-1 (environ 2 gorgées de
produit
dosé à 100 g.L-1)
|
|
DL50 chez le rat
|
100 à 150 mg.kg-1 par voie orale
80 à 90 mg.kg-1 par voie intra
veineuse
(transcutanée)
|
|
DL50 chez le lapin
|
200 à 300 mg.kg-1 par voie
transcutanée
|
|
Demi-vie
|
7 ans dans les sols argileux
|
I.2.4.2 Travaux antérieures sur le paraquat
L'analyse de paraquat et des pesticides dans l'eau ou dans les
solutions aqueuses a été effectuée par différentes
techniques. Ces techniques sont entre autre la chromatographie liquide haute
performance (HPLC), la fluorescence et les techniques électrochimiques.
La HPLC a été utilisée par Zou et al. (2012) pour
la détermination de paraquat et la limite de détection atteinte
est de 200 ng/mL. La fluorescence a été utilisée par Feihu
et coauteurs (2012) et la limite de détection atteinte est de
3,35×10-9 mg/L pour la détection du paraquat. La
détermination électrochimique de paraquat a été
effectuée par plusieurs auteurs tels qu'Ulisses, Luiz, Tcheumi et Farahi
et les limites de détection sont respectivement 0,7 ug/L ;
9,3×10-8 mg/L ; 3,8×10-9 mg/L ;
6,4×10-9 mg/L (Ulisses et al., 2004; Luiz et
al., 2010 ; Tcheumi et al., 2012 ; Farahi et al., 2014).
La détection électrochimique des polluants se fait pour la
plupart en utilisant des électrodes modifiées. Le paragraphe
suivant nous présente les électrodes modifiées.
I.3 ÉLECTRODES CHIMIQUEMENT MODIFIÉES ET
CAPTEURS ÉLECTROCHIMIQUES
I.3.1 Électrodes chimiquement modifiées
(ECMs)
Le contrôle des propriétés physiques et
chimiques de l'interface électrode/électrolyte permet
d'améliorer, voire de contrôler la réactivité et la
sélectivité d'une réaction électrochimique. Le
terme électrodes chimiquement modifiées (ECMs) désigne
toute électrode à
la surface de laquelle une espèce chimique aux
propriétés spécifiques (groupe redox, catalyseur,
photosensibilisateur, complexant, colorant, etc.) a été
délibérément fixée (Navaratne & Priyantha,
2011). L'un des avantages de ces systèmes est qu'ils nécessitent
l'utilisation d'une quantité minimum de réactifs qui sont souvent
coûteux pour réaliser les analyses. Un autre avantage est la
sélectivité des ECMs (Heitzmann, 2006). Il existe plusieurs types
d'électrode chimiquement modifiée et nous pouvons citer entre
autre les électrodes à film mince, les électrodes
pressées, les électrodes dispersées et les
électrodes à pate de carbone. Le paragraphe suivant donne une
brève description des électrodes à pate de carbone car
électrodes d'intérêts de ce travail.
I.3.1.1 Électrodes à pâte de
carbone
Introduite par Adams (1958), l'électrode à
pâte de carbone (EPC) est une électrode dotée d'une
cavité remplie d'un mélange homogène de carbone
(généralement le carbone graphite) réputé
conducteur et de liant conducteur (H2SO4 par exemple) ou non conducteur (huile
tel que le nujol, silicone, paraffine) (Kurt, 1990). L'EPC présente
l'avantage d'avoir une surface facilement renouvelable par une
élimination simple de la pâte. Du fait de sa facilité de
fabrication, elle présente une bonne stabilité et les
résultats obtenus sont généralement reproductibles (Karel
et al., 2009). En plus de ces avantages, elle présente aussi un
intérêt particulier, en ce sens qu'on peut incorporer en son sein
un composé électroactif particulièrement insoluble dans
l'eau, dans le but de modifier l'électrode et ainsi de pouvoir augmenter
ses propriétés de sensibilités et de
sélectivité (Tonlé et al., 2005). De ce qui
précède, l'EPC est un instrument très sollicité
pour les analyses électrochimiques à cause de ses multiples
avantages. Elle présente cependant quelques inconvénients, ceux
d'être non réactive en milieu organique et nécessiter un
liant pour sa fabrication. Le liant représente ici un
inconvénient parce qu'il peut engendrer une chute ohmique non
négligeable. On note également une diffusion limitée du
courant lors des analyses. Cette observation permet d'expliquer l'influence de
la réponse électrochimique par une accumulation du liant à
la surface de l'électrode (Tonlé, 2004).
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 26
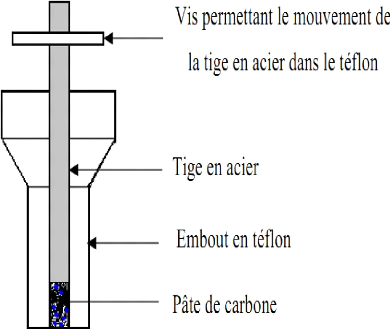
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 27
Schéma I.4 : Coupe
représentative d'une électrode à pâte de carbone
simple ou Modifiée
Compte tenu de l'objectif de notre travail et des
propriétés d'adsorption de ces matériaux (pâte de
carbone) qui les rendent utiles à l'élaboration des capteurs
électrochimiques, nous utiliserons pour la suite une EPC modifiée
par le charbon actif (à base de balles de riz).
I-3.2 Capteurs électrochimiques I.3.2.1
Définition et historique
Un capteur peut être défini comme étant un
dispositif analytique capable de transformer un phénomène
chimique en un signal électrique mesurable. Il combine un composant
chimique appelé « récepteur » et un « transducteur
» définissant le mode de détection (Vial, 2005). Un capteur
est caractérisé par plusieurs critères dont les plus
importants sont l'exactitude, la fidélité, la sensibilité,
la précision, la rapidité et un coût raisonnable
(Kétep, 2006). La fabrication de capteurs électrochimiques
nécessite la mise en oeuvre des technologies les plus importantes du
siècle (électronique, biotechnologie, nanotechnologie, etc.)
(Vial, 2005). Depuis le premier capteur (électrode de pH)
développé par Fritz Haber et Zygmunt Klemensiewicz en 1906,
des
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 28
efforts considérables ont été faits pour
mettre au point d'autres capteurs dans l'objectif de réaliser des
dosages rapides, sensibles et spécifiques de molécules
présentant un intérêt dans le domaine médical,
agroalimentaire, ou environnemental.
I.3.2.2 Principe de fonctionnement des capteurs
électrochimiques
Un capteur électrochimique est constitué d'une
électrode indicatrice (matériau conducteur) que l'on place dans
la solution à analyser. Un transfert électronique
s'établit entre un oxydant et un réducteur (espèces
neutres ou chargées), ce transfert est détecté et transmis
à la chaîne de mesure sous forme d'un signal de courant
électrique ou de tension (Vial, 2005). Les capteurs
électrochimiques se distinguent selon leur mode de transduction : mode
potentiométrique ou mode ampérométrique.
En mode potentiométrique, on mesure la
différence de potentiel (?E) qui s'établit entre
l'électrode indicatrice et une électrode de
référence. Sans imposition de courant ou "à courant nul",
lorsque l'équilibre est atteint, ?E est constante et donnée par
(E - Eréf). E est donné par l'équation de Nernst dans
laquelle intervient la concentration de l'oxydant (électrode de
1ère espèce), ou la concentration d'un contre-ion non
électroactif (électrode de 2e espèce), ou
encore les concentrations de l'oxydant et du réducteur (électrode
de 3e espèce). Avec une imposition de courant, on provoque
l'oxydation ou la réduction du substrat à doser. Dans des
conditions de diffusion pure (électrodes et solution immobiles), la
réponse potentiométrique se présente sous forme d'un
pseudo-plateau situé à un potentiel proche du potentiel standard
du couple redox impliquant le substrat. La durée de cette réponse
est proportionnelle à la concentration du substrat dosé (Vial,
2005 ; Kétep, 2006).
En mode ampérométrique, on mesure le courant qui
circule dans le circuit extérieur lorsqu'on impose une différence
de potentiel (?E) entre l'électrode indicatrice et l'électrode de
référence. Ce courant est proportionnel à la concentration
du substrat dosé, à condition que ?E soit judicieusement choisie
pour provoquer uniquement la réaction d'oxydation ou de réduction
de substrat et que les conditions de transport des espèces soient
fixées (Vial, 2005 ; Kétep, 2006). La figure 4 ci-dessous
présente le principe de fonctionnement d'un capteur
électrochimique, permettant d'obtenir des informations sur
l'espèce à détecter ou à doser dans un
échantillon.
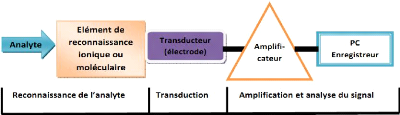
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 29
Figure 2 : principe de
fonctionnement d'un capteur
Sur la figure ci-dessus, l'élément de
reconnaissance (substance électroactive) de l'analyte peut être
une molécule chargée, une molécule portant des paires
électroniques libres ou encore une molécule hybride
fonctionnalisée. Cet élément est immobilisé
à la surface du transducteur (électrode) par physisorption,
chimisorption, par piégeage dans une membrane inerte ou par inclusion
dans une matrice solide. Il doit offrir une spécificité
(affinité physico-chimique) et une sensibilité
élevées pour l'analyte d'intérêt, avec lequel il
doit réagir soit par une réaction d'échange d'ions, soit
par une réaction de complexation, ou enfin par une réaction
redox. Le transducteur quant à lui est le composant du capteur qui
détecte les changements physiques ou chimiques se produisant dans
l'élément de reconnaissance suite à la liaison de
l'analyte, et les convertit en un signal de sortie qui peut être
amplifié, affiché et sauvegardé (Vial, 2005 ;
Kétep, 2006).
I-3 MÉTHODES ÉLECTROCHIMIQUES D'ANALYSES
Les techniques électrochimiques sont des outils
d'analyse classique très utiles en chimie analytique pour leur
facilité d'emploi (elles utilisent un seul instrument de mesure), leur
précision et la fiabilité des mesures qu'elles permettent
d'effectuer. Sensibles et sélectives, elles peuvent servir à la
détermination de plusieurs éléments dans la même
matrice, et sont adaptées à la détection des pesticides et
des métaux lourds dans l'environnement. Suivant la nature des
espèces électroactives et le type d'informations
recherchées au cours d'une analyse, on peut faire appel à une
méthode électrochimique appropriée. Ce travail
étant porté sur l'analyse des pesticides à l'état
de trace, les méthodes impulsionnelles d'analyse sont les plus
indiquées à cet effet. Il existe plusieurs méthodes
électrochimiques, mais nous ne présenterons que celles
utilisées tout au long de ce travail: la voltammétrie cyclique
(CV), la voltammétrie à onde carée (VOC) et la
spectroscopie d'impédance électrochimique (SIE).
I.3.1 Voltammétrie cyclique
Elle consiste à faire varier en aller et retour (entre
deux bornes Ei et Ef) le potentiel d'une électrode dite électrode
de travail et à enregistrer le courant correspondant. Les signaux
enregistrés (Figure 3) sont caractérisés par plusieurs
paramètres tels que :
L'écart AEp entre les potentiels de pics anodique et
cathodique donné par la relation (I1), dans laquelle Epa est le
potentiel du pic anodique et Epc le potentiel du pic cathodique.
AEp= Epa- Epc .. (I-1)
La relation entre le courant des
pics (ip) et la vitesse de défilement (V) des potentiels est
donnée par l'équation (I-2) de Randles-Sevcick. Dans cette
équation, (n) est le nombre d'électrons échangés
par la réaction chimique étudiée, (A) la surface de
l'électrode, (D) le coefficient de diffusion de l'espèce
électroactive, (V) la vitesse de balayage de potentiel, (C)
concentration de l'espèce électroactive.
Ip= (2.69 x
105)n3/2AD1/2v1/2C (I-2)
La
grandeur E1/2 est appelée potentiel de demi pic et donnée par
:
E1/2 =1/2(Epc- Epa) (I-3)
|
Ei : Potentiel initial Ef : Potentiel final ia :
Intensité anodique ic : Intensité cathodique
|
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 30
Figure 3 : Courbe typique de
voltampérométrie cyclique.
D'un point de vue théorique, la voltammétrie
cyclique est la méthode de choix pour étudier la
réversibilité d'un transfert électronique. Si au
départ l'espèce redox en solution est un réducteur, le
balayage allé se fait vers les potentiels anodiques pour favoriser son
oxydation (équation I-4). Lorsque Ef est atteint, le sens de balayage
est inversé vers les potentiels
Thèse de" Master of Science " de TAGNE TIEGAM
RUFIS 31
cathodiques afin de favoriser la réduction de
l'espèce oxydante générée au cours du balayage
allé (équation I-5) (Zoski, 2007).
Balayage allé (Epa) : Red H Ox + ne (I-4)
Balayage retour (Epc): Ox + ne H Red (I-5)
Les valeurs d'Epa et Epc (respectivement les potentiels des pics
d'oxydation et de réduction) permettent de déterminer le
potentiel de demi-pic E1/2 (équation I-6) qui est une
caractéristique du système électrochimique dans les
conditions opératoires utilisées.
E1/2 = ???? (Epc + Epa ) (I- 6)
Pour un système réversible, le rapport
??????
?????? = 1. Ce rapport est
différent de 1 pour un système
irréversible et l'écart entre les potentiels de
pics anodique (EPa) et cathodique (EPc) est donné
par:
??,??????
ÄE = Epa - Epc = ... ... ... ... ...
...(I-7)
????
Où R est la constante se gaz parfaits
(J.K-1.mol-1), T la température (K), n le nombre
d'électrons échangé et F la constante de Faraday.
Les courants de pic anodique ou cathodique sont
déterminés par l'équation I-8 appelée relation de
Randles-Sevcik :
Ip = (2069 × 10-5) n3/2
AD1/2Cv1/2 (I-8)
Où n est le nombre d'électrons
échangés par l'analyte électrochimique
étudié, A la surface de l'électrode de travail
(cm2), D le coefficient de diffusion de l'espèce
électroactive (cm2/s), C la concentration de l'espèce
électroactive (mol/L) et V la vitesse de balayage du potentiel (V/s).
I.3.2 Voltammétrie à onde carré
(VOC)
La voltammétrie à onde carrée est
basée sur la combinaison d'une modulation d'onde carrée
d'amplitude avec une rampe en escalier. Le signal mesuré est la
différence Ai entre les courants mesurés à la fin de
chaque pulse montant et descendant de l'onde carrée (Daamouche, 2009)
.La figure 6 schématise la forme de potentiel appliquée dans le
cas de la VOC.
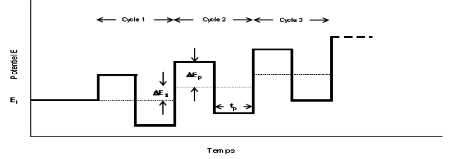
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 32
Figure 4 : Allure de la commande
de potentiel imposé en fonction du temps en voltammétrie à
ondes carrées.
Les paramètres caractéristiques de la
voltammétrie à onde carrée sont : - ÄES :
incrément de potentiel au début de chaque cycle.
- ÄEP : amplitude d'une demi-période
La voltammétrie à onde carré a l'avantage
supplémentaire d'être plus rapide que les méthodes
conventionnelles à impulsion différentielle, permettant ainsi de
réduire les durées d'analyse. En effet, alors qu'en
voltammétrie à impulsion différentielle les vitesses de
balayage varient de 1 à 10 mV/s, la voltammétrie à onde
carré autorise des vitesses de balayage de plus de 1 V/s.
I.3.4 La spectroscopie d'impédance
électrochimique (SIE)
La spectroscopie d'impédance électrochimique
« STE » est une technique non destructive adaptée à
l'étude des propriétés électriques interfaciales
(Monk et al., 2008). Elle permet de différencier les divers
phénomènes susceptibles de se produire dans la cellule
électrochimique en fonction de la fréquence : les
phénomènes rapides se produisent à hautes
fréquences, tandis que les phénomènes lents ont lieu
à basses fréquences (Ribaut, 2008).
La STE repose sur la mesure d'une fonction de transfert suite
à la perturbation volontaire du système électrochimique
étudié. Ce système peut être considéré
comme étant une « boîte noire »qui réagit en
émettant un signal y(t) quand il est soumis à une perturbation
x(t) (figure 7). Les deux signaux x(t) et y(t) sont alors reliés par une
fonction de transfert 11(w) telle que Y (w) = 11(w) X(w), X(w) et Y (w)
étant respectivement les transformées de Fourier de x(t) et y(t)
(Yang et al. ,1994).

Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 33
Figure 5 : Une fonction de
transfert.
Classiquement, la perturbation imposée est
sinusoïdale. Le signal appliqué est donc de la forme x(t) = A sin
(wt) et la réponse du système est y(t) = B sin (wt+ (p) avec une
fréquence f, une pulsation w = 2ðf et un déphasage (p.
L'impédance électrochimique se définie comme étant
le nombre complexe Z (w) résultant du rapport :
1 Zj
? ? tan?
(I-9)
Où, en mode potentiostatique, ?E(w) est la perturbation
imposée à un potentiel choisi E0, et ?I (w) la réponse en
courant du système étudié avec une composante continue I0
. Il est aussi possible d'utiliser le mode galvanostatique. Dans ce cas, c'est
une perturbation en courant de faible amplitude qui est appliquée au
système et c'est la réponse en potentiel qui est mesurée.
L'impédance Z(w) est un nombre complexe qui peut être écrit
sous deux formes équivalentes :
Z (w) = |Z (w)| ej(p(w) ou Z (w) = Zr(w) + jZj(w) avec
, (I-10)
|Z | étant le module de l'impédance, (p le
déphasage, Zr la partie réelle et Zj la partie imaginaire.
Pour passer d'une forme à l'autre, il suffit d'utiliser
les relations suivantes :
|Z |2= Z2r+ Z2j et
Zr ou Zr = |Z | cos (p et Zj = |Z | sin (p ...
(I-11)
L'impédance d'un système électrochimique,
quel qu'il soit, peut en effet être assimilée par analogie
à une impédance électrique. On peut donc associer à
ce système un circuit électrique équivalent ou (CEE)
où chaque phénomène physico-chimique se déroulant
à l'interface électrode/électrolyte peut être
modélisé par un composant électrique.
Conclusion
Ce chapitre avait pour objectif de présenter des
généralités sur le charbon actif, les pesticides, les
électrodes modifiées ainsi que les méthodes
électrochimiques d'analyses. Il ressort de cette étude
bibliographique que les charbons activés sont des composés
très attrayants du fait
de leur faible coût, leur non-toxicité, leur
préparation facile, leurs larges surfaces spécifiques, leurs
porosités et leurs capacités d'adsorption des polluants
organiques.
De plus, malgré l'apport des pesticides propice
à l'amélioration des rendements agricoles, ils contribuent
grandement à la dégradation de la qualité des eaux de
surfaces et souterraines.
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 34
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 35
CHAPITRE II : RÉACTIFS, MATÉRIELS ET
MÉTHODES
Introduction
Afin de mener à bien les expériences
présentées dans cette thèse, différents
composés et techniques ont été utilisés. Ce
chapitre donne toute d'abord une description des réactifs ainsi que la
procédure de préparation du charbon actif. Une série de
méthodes utilisées pour caractériser le matériau
d'électrode sont également décrites. Enfin nous
présentons les techniques analytiques dans cette étude et les
différents modes opératoires associés aux manipulations
effectuées au cours de la détection électrochimique du
paraquat.
II.1 RÉACTIFS
Les produits chimiques utilisés au cours de ce travail
sont regroupés dans le tableau II.1 ci-dessous.
Tableau II.1 : Formules chimiques,
noms, puretés et origines des réactifs utilisés.
|
Noms et formules
chimiques
|
Puretés(%)
|
origines
|
|
Sodium chlorure, NaCl
|
99.5
|
Fischer Scientific
International
|
|
Sodium sulphate, Na2SO4
|
99
|
BDH Chemicals Ltd.
|
|
Poudre de graphite, C
|
/
|
Johnson Matthey
|
|
Huile de silicone
|
/
|
Sigma-Aldrich
|
|
Paraquat, C12H14N2Cl2
|
99
|
Riedel-de Haen
|
|
Calcium sulphate, CaSO4
|
96
|
BDH Chemicals Ltd.
|
|
Magnésium sulphate,
MgSO4
|
99
|
BDH Chemicals Ltd.
|
|
Potassium
hexacyanidoferrate(III)
K3Fe(CN)6
|
/
|
Prolabo
|
II-2 PREPARATION DU CHARBON ACTIF
Le choix du matériau adéquat pour effectuer une
détection des polluants en milieu aqueux dépend notamment de sa
surface spécifique, de sa porosité et de sa composition chimique.
Le charbon actif préparé au cours de cette étude provient
des balles de riz, qui ont été récoltées dans la
localité de Ndop, région du Nord-Ouest Cameroun. Elles ont
été lavées plusieurs fois avec de l'eau robinet, et de
l'eau distillée, puis séchée au soleil pendant 72 heures
avant activation.
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 36
Le rapport de l'imprégnation est défini comme
rapport de la masse de l'agent d'activation à la masse du
précurseur sec de biomasse. Pour produire un charbon actif avec un
rapport d'imprégnation de 175%, 20 g de balle de riz sèches ont
été mis en contact avec 35 g d'une solution de H3PO4 de
concentration 1 M. Le mélange a été laissé pendant
30 minutes pour que l'activation ait lieu, puis séché dans un
four réglé à 105 oC pendant 24 heures.
L'échantillon a été carbonisé
pendant 1 heure à 450 oC, à une vitesse de chauffage
de 5 oC/min. Le produit obtenu à partir de la calcination a
été lavé avec de l'eau distillée jusqu'à ce
qu'il n'y ait eu aucun ion phosphate détecté. L'installation
expérimentale utilisée est un four électrique de marque
d'ISUNU avec un règlement automatique. Le charbon actif obtenu a
été séché pendant 24 heures à la
température de 105 oC, avant d'être
écrasé et tamisé pour obtenir le charbon actif ayant des
particules de taille plus basse que 100 um.
II.3 TECHNIQUES DE CARACTÉRISATION DU
MATÉRIAU
L'un des aspects les plus intéressants d'une
étude sur les matériaux est leur caractérisation. À
cet effet, une combinaison de techniques est employée à savoir
l'analyse chimique élémentaire, le point de charge nul et la
spectroscopie infrarouge à transformée de Fourrier (IRTF).
II.3.1 Analyse chimique élémentaire
L'analyse élémentaire est un type particulier
d'analyse (microanalyse élémentaire organique) qui consiste
à trouver la composition élémentaire centésimale de
la molécule étudiée, prise à l'état pur
(Rouessac et al., 2004). Le dosage d'un seul élément
voire de deux (C et H le plus souvent) permet de vérifier le
bien-fondé de la formule brute proposée pour une molécule
non encore décrite dont la structure a pu être déduite de
son étude spectrale. Par ailleurs, en comparant les pourcentages
théoriques de chaque élément à ceux trouvés
à partir d'un échantillon d'un composé dont on
connaît la formule brute, on détermine sa pureté (Rouessac
et al., 2004).Cette analyse a été sur un appareil de
marque Fissons Instruments 1108 CHNS-O.
II.3.2 Spectroscopie infrarouge à transformée
de Fourrier (SIR-TF)
La spectroscopie infrarouge (IR) est une technique rapide et
pratique pour la caractérisation des matériaux organiques et/ou
inorganiques. Son principe de base repose sur l'interaction du rayonnement
électromagnétique IR avec la matière à
différentes fréquences (Lutz & Haeuselrh, 1999). Dans le
spectre général des rayonnements
électromagnétiques, le domaine
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 37
du rayonnement JR est compris entre 12800 et 10
cm-1 qui se décompose en trois parties: l'IR proche, l'IR
moyen et l'IR lointain (Lutz & Haeuselrh, 1999 ; Demirdöven et
al., 2004). Nous nous intéressons particulièrement à
la région de l'IR moyen (IRM) qui correspond à l'intervalle de
nombres d'onde 4000 - 400 cm-1. Lors de l'irradiation d'une
molécule par le rayonnement JR, celle-ci peut absorber partiellement et
sélectivement ce rayonnement. De ce fait, elle se trouve dans un
état excité et son énergie vibrationnelle et rotationnelle
sont modifiées avec une augmentation de leurs amplitudes.
L'énergie du rayonnement JR incident se retrouve alors diminuée
après l'interaction, ce qui conduit à l'apparition d'une bande
d'absorption à cette fréquence. L'énergie absorbée
(hí0) est donc caractéristique de chacune des liaisons chimiques
du composé analysé. Le spectre JR se compose ainsi de plusieurs
bandes d'absorption. Comme tout composé possède une signature qui
lui est propre, la spectroscopie JR est très souvent utilisée
pour caractériser des échantillons formés de plusieurs
composants (Lutz & Haeuselrh, 1999 ; Demirdöven et al.,
2004). La spectroscopie JR nous permettra d'identifier les bandes correspondant
aux élongations de liaisons, aux déformations angulaires et aux
groupements fonctionnels présents dans le matériau. Dans notre
cas, les mesures d'absorption dans l'IRM ont été
réalisées à l'aide d'un spectrophotomètre Alpha-P
de la firme BROKER. L'acquisition des spectres s'est faite sur une plage de
longueur d'onde de 4000 - 400 cm-1. L'analyse des échantillons est
réalisée en déposant quelques milligrammes de poudre
d'argile sur un disque de KBr (transparent au rayonnement JR).
II.3.3 Le pH de point de charge nulle (pHpzc)
Le pHpzc ou pH du point de charge zéro ou nulle,
correspond à la valeur de pH de la solution pour laquelle, la charge
nette de la surface des adsorbants est nulle. Ce paramètre est
très important dans les phénomènes d'adsorption, surtout
quand des forces électrostatiques sont impliquées dans les
mécanismes. Une façon simple et rapide pour déterminer le
pHpzc est de placer 50 mL de solution de NaCl en flacons fermés et
ajuster le pH de chacun (valeurs comprises entre 2 et 12) par addition de
solution de NaOH ou HCl (0.1M). On ajoute ensuite à chaque flacon 0,15 g
d'échantillon de matériau à caractériser. Les
suspensions doivent être maintenues en agitation, à
température ambiante, pendant 24 h, et le pH final est alors
déterminé. On porte sur un graphe ÄpH = f(pHi) où
ÄpH = (pHf-pHi), l'intersection de la courbe avec l'axe qui passe par le
zéro donne le point
isoélectrique.il a
été réalisé avec un pH-mètre de marque
inolab (model pH 7110).
Dans la suite du travail, nous présentons
l'appareillage et le matériel utilisé, la préparation de
l'électrode à pâte de carbone et la procédure
expérimentale électrochimique.
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 38
II-4. MATERIEL ET APPAREILLAGE
Les manipulations électrochimiques ont
été effectuées au LACHINGE. Les appareils et
matériels qui ont servi à l'obtention des résultats
électrochimiques sont :
- Un dispositif d'analyse voltammétrique
constitué d'un potentiostat (Palm Sens3) relié
à la cellule électrochimique et connecté à un
ordinateur muni d'un logiciel PS Trace 4.2 pour l'enregistrement des courbes et
du logiciel ORIGIN 6.0 pour le traitement des courbes. Le potentiostat est
connecté à une cellule électrochimique dans laquelle
baignent trois électrodes :
- une électrode de travail (ET) à savoir
l'électrode à pâte de carbone simple (EPC) ou une
électrode modifiée par le charbon (EPC-CHA) ;
- L'électrode de référence (ER) qui est
ici l'électrode à l'argent chlorure Ag/AgCl/ KCl, 3M), de
potentiel égal à 0,24 V par rapport à ENH ;
- L'électrode auxiliaire (EA) ou contre
électrode (CE) qui est dans ce cas un fil de platine.
Les équipements ayant servi lors des manipulations
électrochimiques sont les suivants:
- Une verrerie nécessaire à la préparation
et la conservation des solutions ;
- Une balance de type SARTORIUS de précision 0,001 pour
les pesées ;
- Un pH-mètre de marque inolab (model pH 7110) pour
ajuster et mesurer les pH des
solutions ;
- Deux agitateurs magnétiques de marque VWR (VMS-C7) ;
- Des coupelles en plastique et des spatules pour la
préparation des pâtes de carbone simple
et modifiée.

B
E
C
D
Figure 6 : Dispositif d'analyse
voltammétrique , A) agitateur magnétique , B) cellule
électrochimique , C) potentiostat , D) ordinateur , E)
micropipètes.
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 39
II-5. PROCEDURE EXPERIMENTALE
II-5-1. Préparation de l'électrode de
travail
Dans le cadre de ce travail, nous avons élaboré
une électrode à pate de carbone simple et modifiée. En
raison de ses multiples avantages (fabrication simple, longue utilisation,
surface renouvelable), l'électrode à pâte de carbone
modifiée par le charbon a été choisie pour l'analyse du
paraquat en solution. Ainsi, les proportions suivantes ont été
adoptées pour la préparation de 100 mg de pâte : 10 mg du
charbon (10 %), 60 mg de carbone (60 %) et 30 mg d'huile de silicone (30 %).
Pour la préparation de l'électrode à
pâte de carbone simple, nous avons mélangé soigneusement de
la poudre de graphite et l'huile de silicone dans les proportions (70:30)
jusqu'à obtention d'une pâte homogène que nous avons
introduite dans l'embout en téflon. Concernant l'électrode
à pâte de carbone modifiée, nous avons utilisé les
proportions (10:60:30). Le charbon et le carbone ont été
pesés sur une microbalance et introduits dans une coupelle en plastique.
À l'aide d'une spatule, ce mélange a été finement
broyé de manière à le rendre le plus homogène
possible. Au mélange précédent a été
ajoutée la quantité requise de liant, et l'ensemble a
été remué jusqu'à obtention d'une pâte
homogène. Cette dernière a été
insérée à l'aide d'une spatule dans la cavité d'un
embout en téflon (diamètre : 3 mm, volume variable) au fond
duquel un piston en acier assure le contact électrique entre la
pâte et le reste du montage électrique. L'électrode ainsi
obtenue (EPC-CHA) a été utilisée comme électrode de
travail tout au long de la manipulation électrochimique. Avant
utilisation, la surface de l'électrode est soigneusement polie sur une
feuille de papier propre, ce qui permet en même temps d'éliminer
l'excès éventuel de liant. Le piston permet de renouveler
facilement la surface de l'électrode lorsqu'on passe d'une
expérience à une autre.
II.6 CONDUITE DES MANIPULATIONS ÉLECTROCHIMIQUES
Trois méthodes électrochimiques ont
été utilisées pour l'analyse du paraquat. Il s'agit de la
voltammétrie cyclique, la voltammétrie à onde carré
et la spectroscopie d'impédance électrochimique. La
voltammétrie cyclique nous a permis d'étudier le comportement
électrochimique du paraquat, la spectroscopie d'impédance
électrochimique (SIE) a permis d'étudier les possibilités
du transfert d'électrons sur différente électrodes et la
voltammétrie à onde carré a servis à étudier
les propriétés du capteur et à optimiser ses
paramètres. Nous présentons ici le déroulement des
manipulations électrochimiques.
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 40
II.6.1 Manipulations par voltammétrie cyclique
Une quantité infime du paraquat (solution à 5 X
10-4 M initialement dissoute dans L'eau) est introduite dans la
cellule électrochimique contenant 50 mL d'analyte support (sodium
sulfate). Le temps de préconcentration est de 5 minutes avant
l'imposition du balayage des potentiels. L'analyse est faite en milieu sodium
sulfate (0.1 M) à pH 6. Le balayage de potentiel est effectué
à la vitesse de 100 mV/s.
II.6.2 Manipulations par voltammétrie à onde
carré
Cette méthode étant plus sensible que la
voltammétrie cyclique, nous avons à réduit la
concentration du paraquat afin de mieux évaluer la sensibilité de
cette technique. L'électroanalyse du polluant consiste à
réaliser une préconcentration de l'analyte en circuit
fermé. L'accumulation de l'analyte s'est fait sur les particules du
modifiant présent à la surface de l'électrode, avant sa
détection par la VOC. C'est le principe de l'accumulation et
détection (Tonlé, 2004). Dans le cadre de ce travail,
l'électrode a été plongée pendant un temps bien
déterminé (cinq à dix minutes) dans une cellule
électrochimique contenant une solution de sodium sulfate
(10-1M à PH 6) et du paraquat. Cette solution d'accumulation
a été maintenue en agitation constante. L'agitation
régulière de la solution d'accumulation a permis un apport
permanent du paraquat au niveau de la surface de l'électrode : c'est
l'étape de préconcentration ; ensuite on a procédé
au balayage du potentiel entre -1.8 V et -0.2 V pour réduire
(détecter quantitativement) le paraquat accumulé. La hauteur du
courant de pic obtenu est proportionnelle à la quantité
accumulée lors de l'étape de préconcentration, ce qui peut
être reliée à la concentration de l'analyte dans ce
milieu.
II.6.3 Manipulations par SIE
L'électrolyte utilisé pour ces mesures est une
solution de Fe(CN)6]3-/4- (0.2 M) initialement préparer dans
le NaCl. Pour ces mesures de SIE, nous avons utilisé une
électrode à pâte de carbone simple et à pâte
de carbone modifiée. L'amplitude de perturbation est fixée
à 10 mV pour une durée de 120 secondes et une fréquence
qui varie entre 1kHz et 100 mHz.
CONCLUSION
Dans ce chapitre avons présenté les
matériaux, les réactifs, les matériels et appareillage
utilisés dans ce travail. Le protocole de préparation du
matériau a également été décrit de
façon explicite. Par ailleurs, nous avons mis un accent sur le principe
des différentes techniques spectroscopiques et électrochimiques
de caractérisation, ainsi que sur la méthode de modification
de l'EPC classique. L'électrode modifiée a
été exploitée dans le chapitre suivant pour
l'électroanalyse du paraquat en solution.
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 41
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 42
CHAPITRE III : RÉSULTATS ET DISCUSSION
Introduction
Le présent chapitre met en exergue de prime abord les
résultats de caractérisation du matériau, et en second
plan le comportement électrochimique du paraquat sur les EPC simple et
modifiée par le charbon actif. Une étude minutieuse des
différents paramètres susceptibles d'influencer les étapes
de préconcentration et de détection du paraquat constituera la
dernière partie de ce chapitre, l'objectif étant de
déterminer les conditions optimales de détection de cet
herbicide.
III.1 CARACTÉRISATION PHYSICO-CHIMIQUE DU
MATÉRIAU III.1.1 Analyse chimique élémentaire
L'analyse élémentaire fournit des moyens pour la
détermination rapide du pourcentage de carbone, d'hydrogène,
d'azote et de soufre dans les matrices organiques et d'autres types de
matériaux. Les résultats d'analyse des balles de riz et du
charbon actif étudiés, ont permis de déterminer la
composition chimique de surface, exprimée en pourcentages atomiques. Ces
sont récapitulés dans le tableau III-1 ci-dessous.
Tableau III-1 : Analyse
élémentaire des balles de riz et du charbon actif obtenu à
partir des balles de riz.
|
matériau
|
%C
|
%H
|
%N
|
%S
|
|
Balle de riz
|
38.5
|
5.0
|
0.7
|
0.1
|
|
CHA
|
38.12
|
1.57
|
0.43
|
0
|
On peut remarquer (Tableau III-1) que l'essentiel de la
matière carbonisée ou activée c'est du carbone. Le
pourcentage élevé de cet élément représente
bien une structure classique de charbon (Anundo, 1986). Ceci traduit une bonne
pyrolyse de la matière première ou balles de riz.
III.1.2 Le pH de point de charge nulle (pHpzc)
Le charbon actif peut être de nature acide, neutre ou
basique selon le pHpzc. Ce pHpzc dépend de l'origine du
précurseur et de la méthode de préparation (chimique ou
physique). Il est donc un bon indicateur des propriétés chimique
et électronique des groupes fonctionnels (Rangabhashiyam et
al., 2013).
Il faut cependant noter que si le pH de la solution est
inférieur au pHpzc, les groupes fonctionnels de surface des adsorbants
seront protonés par un excès de protons H+ de la
solution, et le support sera donc attracteur d'adsorbat chargé
négativement.
Si au contraire le pH de la solution est supérieur au
pHpzc, les groupes fonctionnels de surface seront déprotonés par
la présence des ions OH- de la solution, et donc le support
sera attracteur d'adsorbat chargé positivement. La figure 7 donne le
tracé du pH initial en fonction du pH final.
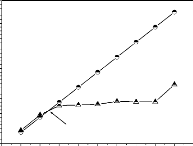
pHPCN = 3.45
10.5
10.0
9.5
9.0
8.5
8.0
7.5
7.0
6.5
6.0
5.5
5.0
4.5
4.0
3.5
3.0
2.5
2.0
1.5
1 2 3 4 5 6 7 8 9 10 11
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 43
pH intiale
Figure 7 : point de charge nulle du charbon
actif étudié
Ayant déterminé la valeur du pHpzc du
matériau, il s'avère que la charge de surface de ce
matériau est globalement négative pour des valeurs de pH de la
solution supérieur à celle du pHpzc, c'est à dire dans la
gamme (3,46-14), et positive pour des valeurs de pH de la solution
inférieur à celle du pHpzc.
III.1.3 Analyse structurale par spectroscopie infrarouge
à transformée de Fourier
La spectroscopie infra rouge est une technique importante
utilisée pour l'identification des groupements fonctionnels
caractéristiques de la surface de l'adsorbant (Altenor et al.,
2009). Ces groupements sont souvent responsables des liaisons
adsorbant-adsorbat. Les spectres d'analyse par spectroscopie infrarouge des
différents adsorbants sont représentés aux figures 10 et
11.
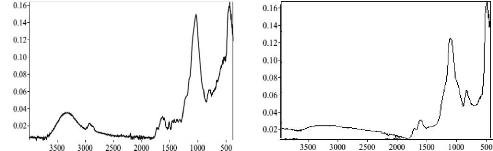
Absorbance
Absorbance
Nombre d'onde (cm-1) Nombre d'onde
(cm-1)
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 44
Figure 8: Spectre JR de
matériau brut (balle de riz) Figure 9: Spectre JR du
charbon actif
L'examen de ces spectres révèle la
présence de plusieurs bandes d'absorptions de vibrations de valences et
de déformations attribuable aux différents groupements existant
dans ces matériaux. Les différentes bandes de vibration
recensées ont été attribuées en se servant des
résultats de la littérature portant sur la caractérisation
des MLC (Tingaut, 2006, cité par Kenne, 2011).
Sur le spectre IRTF du matériau brute (figure 8), on
note une large bande d'absorption autour de 3288 cm-1, correspondant
aux vibrations d'élongation des groupements hydroxyles OH. Celles
apparaissant autour 1148 et 1074 cm-1 sont dues aux vibrations
d'élongation des groupements C-O et C-N ou aux groupements sulfoniques.
Le matériau brut montre également des bandes d'absorption
comprises entre 2852 à 2823 cm-1, résultant
principalement des vibrations d'élongation de C-H des molécules
aliphatiques. La petite bande entre 1708 et 1740 cm-1 est
attribuée aux vibrations d'élongation des groupes C=O des acides
carboxyliques, des aldéhydes, des cétones et des esters. On note
également sur le spectre une bande autour de 1650- 1600 cm-1,
due aux vibrations d'élongation des liaisons C=C du squelette
aromatique. Les bandes comprises entre 1000 et 1350 cm-1 sont
assignées aux vibrations des liaisons C-O des acides carboxyliques, des
alcools, des phénols, des éthers et des esters. Il apparait aussi
dans la zone de 900 à 600cm-1 des bandes d'absorption
caractéristiques des vibrations de déformation C-H des
systèmes polynucléaires aromatiques.
Dans le but d'apprécier l'effet de la calcination sur
le matériau, nous avons fait une étude comparative du spectre du
matériau brut à celui du charbon actif. Il en résulte de
cette étude que la bande d'adsorption des groupements O-H autour de 3288
cm-1 présent sur le spectre des balles de riz est absente sur
le spectre du charbon. En effet, cette disparition des bandes de vibration O-H
pourrait s'expliquer par la carbonisation qui est à l'origine du
départ des atomes de C, H, O, sous forme de CO2, H2O (Tchuifon et al,
2014). La bande à 2925 cm-1assignée à la
vibration
d'élongation asymétrique a disparu dans le
charbon actif. Ceci indique que l'activation enlève une partie
significative de la liaison C-H.
III-2 CARACTERISATION PAR ELECTROCHIMIQUE
III-2.1 Spectroscopie d'Impédance Electrochimique
(SIE)
Cette technique d'analyse électrochimique nous a permis
de faire une étude plus complète en régime dynamique des
processus de transfert de charges se déroulant à l'interface de
l'électrode de travail ; en mesurant la réponse de
l'électrode face à une modulation sinusoïdale de faible
amplitude du potentiel ÄE(t) en fonction de la fréquence F. Elle a
été utilisée pour caractériser les
électrodes à pate de carbone simple et modifiée. Pour les
mesures d'impédance, nous avons opté pour un balayage en
fréquence décroissant, pour une amplitude du signal d'excitation
de 10 mV dont sa fréquence varie entre 1 kHz et 100 MHz. Sur toute la
durée de la mesure, il faut s'assurer que le système reste «
quasi-stable » et que l'amplitude de la sinusoïde soit suffisamment
faible pour que la fonction I= f(E) soit linéaire dans le domaine
perturbé(Jorcin, 2007). Les figures 10 et 11 ci-dessous illustrent des
spectres d'impédance électrochimique dans le plan de Nyquist et
les circuits électriques équivalents respectivement.
A
0 Re 1 2 3 4 5 6 7
Z(k.Ohm)
0.2 0.4 0.6 0.8 1.0 1.2 1.4
Z(k.Ohm)
B
Re
+Rt
2.5
2.0
1.5
1.0
0.5
0.0
1.8
1.6
1.4
1.2
1.0
0.8
0.6
0.4
0.2
0.0
Figure 10 : Résultat
d'impédance obtenus sur l'EPC (A) et sur EPC-CHA (B), après 120
secondes d'immersion dans une solution de 0.2M de [Fe(CN)6]3-/4- :
diagramme dans le plan
complexe de Nyquist . Cd
Cd
I
Re
Rt
.
Rt

w
I
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS
45
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 46
Figure 11 : Circuits
électriques équivalents aux figures 10 A et 10 B
respectivement
De l'examen de ces figures, on observe un demi-cercle bien
défini (figure 12 A). Ceci indique une résistance
élevée de transfert d'électron (Rt = 80,52 KOhm, Re = 3.27
KOhm) sur l'électrode à pâte de carbone simple. On peut
tout conclure que la cinétique de la réaction n'est qu'un
processus de transfert d'électron. Lorsqu'on modifie de l'EPC avec le
CITA (figure 12 B), la taille du demi-cercle est considérablement
réduite (Rt = 5.36 KOhm,, Re = 0,62 KOhm), indiquant une
résistance de transfert d'électron très petite et des
possibilités électro catalytique du modifiant. Dans ce cas, on
peut dire que le processus de transfert est limité par la diffusion.
Cette technique nous a permis d'étudier des
mécanismes interfaciaux complexes, tant d'un point de vue
thermodynamique que cinétique. Malgré tout,
l'interprétation des résultats n'est pas toujours aisée.
Elle demande une bonne compréhension des phénomènes
physiques pouvant se produire et de leurs expressions en termes
d'impédance sur tout le domaine de fréquence (Jorcin, 2007).
III-2.2 Etude du comportement électrochimique du
paraquat par la voltammétrie cyclique
Dans cette partie nous examinons le comportement
électrochimique du paraquat sur deux électrodes à pate de
carbone, une simple (EPC) et l'autre modifiée par le charbon actif
(EPC-CHA). La figure 12 ci-dessous présente les voltammogrammes
cycliques d'une solution de paraquat 5×10-4 M en milieu Na2SO4
0.1 M, obtenus respectivement sur EPC simple et EPC-CAH.
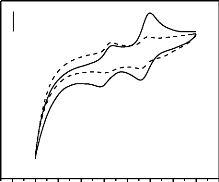
PQ2
PQ1
PQ4
PQ3
0,2uA
-1.8 -1.6 -1.4 -1.2 -1.0 -0.8 -0.6 -0.4 -0.2
0.0
Potentiel (V) vs Ag/AgCl
Figure 12 : Voltammogrammes
cycliques d'une solution de paraquat 5×10-4 M en milieu
Na2SO4
sur EPC simple ( ) et EPC-CHA ( ).
Le voltammogramme obtenu dans cet intervalle de potentiel
indique la présence (détection) du paraquat dans
l'échantillon. D'après les études antérieures, le
double pic de réduction (PQ1 et PQ2) et celui de l'oxydation (PQ3 et
PQ4) sur la figure 12 sont significatif pour la détection du paraquat.
Sur les électrodes simple et modifiée, on note dans l'intervalle
de potentiel de - 1.8 V à - 0.2 V deux systèmes
réversibles (centrés autour de - 0,65 V et - 1,15 V
respectivement) dû à la réduction du paraquat (II) en
paraquat (0) suivant un processus monoélectronique traduit par
l'équation suivante (Ulisses et al., 2004).
N N CH3
H3C N N CH3

+
+
e-
N N CH3
H3C
H3C N N CH3
+

e-
PQ+.
PQ0
H3C
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 47
Schéma III.1 : schéma
de réduction du paraquat (II) en paraquat (0) (Ulisses et
al., 2004)
Le comportement électrochimique du paraquat obtenu sur
l'EPC-CHA est différent de celui observé sur l'EPC simple. De
l'examen de la figure 12 ci-dessus, on constate que la réponse obtenue
sur l'électrode modifiée par le charbon est environ 2,04 fois
plus intense que celle obtenue sur l'électrode non modifiée. Au
regard de ces résultats, il ressort que l'électrode
modifiée par le charbon accumule de manière efficiente le
paraquat en milieu aqueux. Ce résultat pourrait s'expliquer par la
porosité du modifiant d'électrode qui accumulerait
l'espèce électroactive par gradient de concentration. On peut
également penser aux attractions électrostatiques entre les
charges négatives du matériau et les charges positives de
l'analyte en solution. Le résultat ainsi obtenu permet d'envisager
l'utilisation de ce matériau comme support d'électrode pour la
détection du paraquat.
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 48
III.3 ÉLECTROANALYSE PAR LA VOLTAMMÉTRIE A
ONDE CARREE (VOC)
III.3.1 Étude de l'effet du modifiant
Il est bien connu que la sensibilité de la
voltammétrie à onde carrée est proportionnelle au
degré de réversibilité d'un système redox (Lovric
et al, 1988). Étant donné que le système du
paraquat est réversible, nous allons utiliser cette technique pour
l'étude de l'électroanalyse sur l'électrode à
pâte de carbone modifiée par le charbon.
La figure 13 présente les voltammogrammes obtenus
après cinq minutes d'accumulation en circuit fermé dans une
solution 5 X 10-4 M de paraquat en milieu Na2SO4 0,1 M à pH
6, en utilisant une électrode à pâte de carbone simple et
modifiée par le charbon.
-1,4 -1,2 -1,0 -0,8 -0,6 -0,4 -0,2
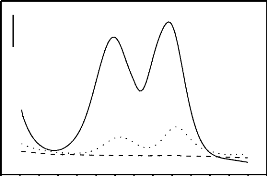
(b)
(a)
(c)
Potentiel (V) vs
Ag/AgCl
Figure 13 : Voltammogrammes
ondes carrées d'une solution de paraquat (5 X 10-4 M)
enregistrés dans Na2SO4 0,1 M à pH 6, après 5 min de
préconcentration en circuit fermé :(a) blanc, (b) sur EPC et (c)
sur EPC-CHA (10 %). Potentiel d'électrolyse (-1 V),
En accord avec les travaux précédents (El
harmoudi et al., 2013), on observe pour les deux électrodes,
deux pics de réductions entre - 1.0 et - 0.6 V, respectivement pour les
couples PQ2+/PQ+ et PQ+/PQ0. Il
ressort de l'analyse de cette figure que l'électrode modifiée par
le charbon améliore considérablement le signal de
détection du paraquat. Le courant de pic est multiplié par un
facteur de 4.04 par rapport à celui obtenu sur l'électrode non
modifiée. En effet lorsqu'on impose un potentiel d'électrolyse
convenable, le paraquat (II) accumulé sur le charbon se réduit en
paraquat (I). Par contre le paraquat accumulé à la surface de
l'électrode non modifiée

diffuse de façon plus importante de la pâte vers
la solution électrolytique, ce qui explique vraisemblablement la perte
de la sensibilité de cette électrode par rapport à celle
modifiée. Ces résultats démontrent l'effet du modifiant
(charbon actif) pour l'électroanalyse du paraquat. Il convient toutefois
d'étudier l'influence de certains paramètres de processus afin
d'optimiser la détection de l'analyte.
Dans la suite de cette étude PQ1 à -0.67 V a
été choisi pour la suite des manipulations, parce qu'à ce
potentiel on observe le pic bien définie, une sensibilité et une
sélectivité plus élevées par rapport à PQ2
obtenus à -0.98 V.
III.4 STABILITE DU SIGNAL DU PARAQUAT
L'objectif de ce travail étant d'élaborer une
électrode à pâte de carbone qui servira à la
détection électrochimique d'un composé organique
(paraquat), il convient à cet effet d'étudier la stabilité
de la réponse électrochimique de l'électrode. Pour ce
faire, l'expérience de la figure 14 précédente a
été reprise en faisant sept séries
d'accumulation-détection-accumulation dans un intervalle de cinq
minutes. Les résultats obtenus sont satisfaisants avec un écart
type de 3,18 % (N = 7), indiquant ainsi une bonne reproductibilité de la
méthode (de l'ordre de 96,82 %). Ces résultats montrent que
EPC-CHA est stable, reproductible et beaucoup plus sensible que EPC.
Thèse de" Master of Science " de TAGNE TIEGAM
RUFIS
49
1111 1 111 4 1 1111 1 1
4 1 1 1 1 1 1 i11 1 1 I1 11 1 1 1 1 1 1 1 1 4
1 1 1 1 4 1
Potentiel (V) vs Ag/AgCl
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 50
Figure 14 : Voltammogrammes
impulsionnels d'une solution de paraquat (10-4 M) enregistrés
dans NaCl 0,1 M à pH 6 après 5 min de préconcentration en
circuit fermé sur EPC-CHA (10 %). Potentiel d'électrolyse (-1 V),
durée (5 s).
La réponse électrochimique de paraquat
étant meilleure sur EPC-CHA, il convient d'optimiser un certain nombre
de paramètres afin d'accroître la sensibilité du capteur
ainsi élaboré.
III.5 OPTIMISATION DE LA REPONSE ELECTROCHIMIQUE DE
PARAQUAT SUR EPC-CHA
Nous allons étudier l'effet des paramètres tels
que le potentiel de dépôt, le temps de dépôt, la
fréquence de l'appareil, l'amplitude de l'appareil, le pH du milieu
d'accumulation et de détection et le temps d'accumulation afin
d'optimiser le capteur.
III.5.1 Etude du milieu de détection et
d'accumulation
L'objectif de cette partie est de trouver le meilleur milieu
d'accumulation et de détection de paraquat. Une étude
préliminaire a consisté à faire varier les
électrolytes supports (NaCl, Na2SO4, CaSO4 et MgSO4 de même
concentration 0.1 M) afin de déterminer le meilleur milieu
d'étude. La figure 15 présente l'influence de
l'électrolyte support sur l'intensité du courant
mesuré.
-1,0 -0,8 -0,6 -0,4 -0,2
20 uA
(a)
(c)
(b)
(d)
Potentiel (V) vs Ag/AgCl
Figure 15 : Voltammogrammes de
paraquat à 10-5 M sur EPC-CHA dans différents sels.
Accumulation et détection dans le CaSO4 0,1 M pH 6 (a), MgSO4 0,1 M pH 6
(b), Na2SO4 0 ,1 M pH 6 (c) et NaCl 0,1 M PH6 (potentiel de dépôt
: -1 V, temps d'électrolyse : 50 s).
De l'examen de cette figure, il en résulte que le
signal obtenu dans le sodium chlorure est plus intense que ceux obtenus dans
les autres milieux. Le milieu NaCl présente probablement plus
d'affinité avec les espèces en solution. Ce milieu est donc
favorable à la détection de paraquat et sera utilisé comme
électrolyte support dans ce travail.
III.4.2 Influence de la fréquence
L'effet de la fréquence sur l'intensité du pic
de paraquat en utilisant l'EPC-CHA a été évalué
dans la gamme de 10 à 100 Hz (figures 18 et 19).
-1,0 -0,8 -0,6 -0,4 -0,2
10uA
100Hz
15Hz
Potentiel (V) vs Ag/AgCl
Figure 18 : Réponses
voltammétriques des pics de détection pour chaque variation de
fréquence. Conditions expérimentales : temps d'accumulation (5
min), potentiel d'électrolyse (-1 V), milieu (NaCl pH 6).
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 51
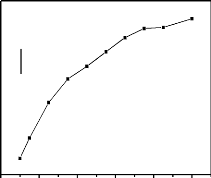
2 uA
0 20 40 60 80 100
Fréquence(Hz)
Figure 19: Variation de la
fréquence sur l'intensité du paraquat à 10-5 M.
Conditions expérimentales : temps d'accumulation (5 min), potentiel
d'électrolyse (-1 V), milieu (NaCl).
On observe que le courant de pic du paraquat est directement
proportionnel à la fréquence, ce qui indique que le processus
redox implique l'adsorption comme l'étape de détermination de la
vitesse (Lovric et al., 1988). Ce comportement est typique des
réponses obtenues à l'électrode ou les espèces
électroactives interagissent avec l'électrode de travail dans le
processus d'adsorption avant que la réaction redox ne se produise. Nous
pensons aussi que les valeurs basses de fréquences peuvent être
associées probablement à la diffusion lente du paraquat à
la surface de l'électrode. 100 Hz sera donc utilisée comme
fréquence de l'appareil dans la suite de ce travail, tout en rappelant
que cette fréquence est maximale pour l'appareil que nous disposons.
III.4.3 Influence de l'amplitude
Les figures 20 et 21 illustrent l'effet de l'amplitude sur le
signal du paraquat dans l'intervalle de 100 à 240 mV.
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 52
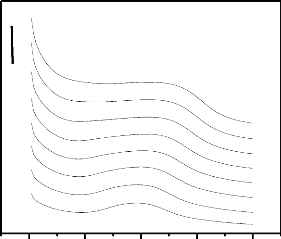
150 uA
Thèse de" Master of Science " de TAGNE TIEGAM
RUFIS
53
-1,0 -0,8 -0,6 -0,4 -0,2
Potentiel (V) vs Ag/AgCl
Figure 20 : Réponses
voltammétriques des pics de détection pour chaque variation
d'amplitude. Conditions expérimentales : temps d'accumulation (5 min),
potentiel d'électrolyse (-1 V), milieu (NaCl pH 6), fréquence
(100 Hz).
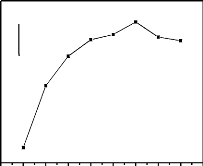
2 uA
80 100 120 140 160 180 200 220 240
260
Amplitude(mV)
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 54
Figure 21 : influence de
l'amplitude sur le signal du paraquat à 10-5 M dans NaCl (0.1
M). Conditions expérimentales : temps d'accumulation (5 min), potentiel
d'électrolyse (-1 V), fréquence (100 Hz).
Les résultats obtenus montrent que la taille de pic du
paraquat croit linéairement avec la croissance de l'amplitude
jusqu'à 200 mV. Pour des valeurs plus élevées, le signal
du paraquat a chuté, puis est resté stable en raison de
l'élargissement du pic. Pour des applications analytiques dans la suite
de ce travail, la valeur de 200 mV a été choisie comme amplitude
optimale.
III.4.4 Influence du potentiel d'électrolyse
D'après les règles classiques
d'oxydoréduction, le potentiel d'électrolyse doit être
inférieur au potentiel de pic de l'espèce dans le milieu
d'étude, afin de permettre à l'électrode de recevoir une
énergie suffisante pour faciliter la réaction
électrochimique (Tcheumi, 2011). Il convient à cet effet
d'appliquer un potentiel convenable à l'électrode afin
d'améliorer la réponse électrochimique. La figure 22
présente l'influence du potentiel d'électrolyse sur le courant de
pic obtenu sur EPC-CHA.
|
29 28
27 26 25 24
|
|
|
-1,0 -0,8 -0,6 -0,4 -0,2 0,0
|
Potentiel d'électrolyse
(V)
Figure 22 : Variation du courant
de pic du paraquat en fonction du potentiel d'électrolyse
appliqué sur EPC-CHA. Conditions expérimentales : temps
d'accumulation (5 min), potentiel d'électrolyse (-1 V), fréquence
(100 Hz), amplitude (200 mV).
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 55
Le courant de pic croît avec l'augmentation du potentiel
de préconcentration jusqu'à atteindre une valeur maximale lorsque
le potentiel appliqué est de - 0,9 V. A partir de ce potentiel, une
amplification du potentiel d'électrolyse fait plutôt chuter
l'intensité du courant. La valeur élevée du courant de pic
observée autour de - 0,9 V traduit une énergie suffisante pour
produire la réaction redox de paraquat. Pour la suite des manipulations,
nous avons fixé la valeur - 0,9 V comme potentiel de
préconcentration.
III.4.5 Influence du temps d'électrolyse
La quantité de paraquat déposée à
la surface de l'électrode doit être minutieusement
contrôlé pour éviter la saturation et de maintenir la
linéarité. Nous avions étudié l'effet de temps de
dépôt sur le pic de courant du paraquat dans la gamme de 0
à 60 s (figure 23).
0 10 20 30 40 50 60
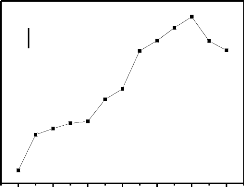
0,5 uA
Temps (s)
Figure 23 : influence du temps
de dépôt sur le signal du paraquat. Conditions opératoires
identiques à celles de la figure 22, potentiel d'électrolyse
(-0.9 V)
Comme résultat, on constate que l'intensité du
pic croit avec l'augmentation du temps de dépôt. Cependant, avec
un temps de dépôt plus grand que 50 s, le processus de nettoyage
électrochimique n'est plus efficace pour enlever la presque
totalité du paraquat déposé, causant ainsi une
détérioration dans la reproductibilité des analyses
suivantes. Tenant compte des résultats obtenus, un temps de
dépôt de 50 s a été adopté.
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 56
III.4.6. Variation du temps d'accumulation
Le temps d'accumulation est évidement un
paramètre clé en électroanalyse lorsqu'on procède
par préconcentration à une électrode modifiée. Le
tracé de l'influence de ce temps (entre 1 et 14 minutes) sur le courant
de pic de détection de paraquat est représenté à la
figure 24.
0 2 4 6 8 10 12 14 16
Temps (min)
Figure 24 : Variation du courant
de pic de paraquat en fonction du temps d'accumulation.
Conditions opératoires identiques à celles de la figure
23, durée (50 s).
La variation de l'intensité du courant en fonction du
temps d'accumulation nous a permis de déterminer le temps minimal
pendant lequel l'accumulation de paraquat à la surface de
l'électrode tend à être maximale. En effet, le courant de
pic croît avec le temps d'accumulation, jusqu'à 8 minutes. Il
apparaît ainsi que pour fixer le paraquat de façon quantitative
à la surface de l'électrode, il faudrait maintenir cette
dernière au contact de la solution pendant un temps relativement long.
Après huit minutes (8 min), l'intensité du courant
décroît très peu et cela pourrait s'expliquer par le fait
que les sites d'accumulation à la surface de l'électrode tendent
à être saturés. L'augmentation de l'intensité du
courant traduit une accumulation progressive de paraquat à la surface
EPC-CHA (10 %). Huit minutes (8 min) ont été choisies comme temps
optimal utilisé dans la suite de ce travail.
III.4.7 Variation du pH du milieu de détection et
d'accumulation
Toujours dans le souci d'optimiser les paramètres du
capteur élaboré, l'étude de l'influence du pH du milieu
d'accumulation et de détection a été effectuée.
L'expérience a
consisté à faire varier le pH de ce milieu entre
2 et 11, et à noter leur influence sur le signal de paraquat sur
EPC-CHA. Les résultats obtenus sont présentés à la
figure 25.
|
26 24
22 20 18 16 14
12 10
8
|
|
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 57
2 4 6 8 10 12
pH du milieu d'accumulation et de
détection
Figure 25 : Variation du courant
de pic du paraquat en fonction du pH du milieu de d'accumulation et de
détection. Conditions opératoires identiques à celles de
la figure 24, temps d'accumulation (8 minutes).
Nous constatons que l'intensité du courant de pic
augmente sensiblement lorsque le pH du milieu est compris entre 2 et 8 et
atteint la valeur maximale à pH 8, puis il s'en suit une
décroissance jusqu'à la valeur pH 11. La diminution de
sensibilité de la solution acide a été accompagnée
avec la diminution de pic de réduction. Ce résultat est
comparable aux travaux publiés par El Harmoudi et coauteurs (El Harmoudi
et al., 2013). Les intensités des pics ne semblent pas
être affectées par la concentration des ions H+,
suggérant l'absence d'étapes de protonations dans le
mécanisme de réduction du paraquat. La baisse des
intensités de courants de pic pourrait donc s'expliquer par une forte
affinité entre le charbon et les ions sodium dans ces milieux. Cette
forte affinité entraîne ainsi une faible accumulation de paraquat
au sein de la pâte, et par conséquent les intensités de
courants de pic diminueraient avec l'augmentation de la basicité. Dans
la suite de ce travail, le pH optimal de l'accumulation de paraquat a
été fixé à 8.
CONCLUSION
Ce chapitre avait pour objectif d'utiliser le charbon actif
pour l'élaboration d'un capteur électrochimique du paraquat
(herbicide). Pour y parvenir, le matériau a été
préparé à partir des balles de riz et
caractérisé par diverses méthodes (Analyse
élémentaire, IRTF et le pH du point
de la charge nulle). Il est apparu que l'EPC modifiée
par le charbon préparé est plus sensible et stable pour la
détection de paraquat. Un certain nombre de paramètres a
été étudié en vue d'optimiser le capteur ainsi
élaboré. Dans tous les cas, le signal électrochimique
dépend de la durée d'accumulation en circuit fermé, du pH
du milieu d'accumulation et de détection, la fréquence et
l'amplitude de l'appareil, du potentiel et du temps d'électrolyse.
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 58
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 59
CONCLUSION GÉNÉRALE ET PERSPECTIVES
Le point clé de ce travail a été la
détection électrochimique de paraquat à une
électrode à pate de carbone modifiée par un charbon
activé. Pour atteindre cet objectif, le matériau a
été préparé à partir des balles de riz puis
activé par voie chimique à l'acide phosphorique à 450
oC. Le matériau et l'analyte ont été
caractérisé par différentes techniques à savoir la
SIRTF, l'analyse élémentaire, la spectroscopie d'impédance
électrohimique, la voltammétrie cyclique et le point de la charge
nulle. Les résultats obtenus ont montré l'effectivité du
processus de préparation de ce dernier.
Le matériau caractérisé (CHA) a
été utilisé pour l'élaboration d'un capteur
ampérométrique du paraquat [EPC - CHA (10%)]. Les
résultats ont montré une nette amélioration de la fixation
de ce polluant sur cette électrode d'un facteur d'environ 4,04 par
rapport à EPC simple. Quelques paramètres physico-chimiques qui
gouvernent les étapes d'accumulation et de détection ont
été étudiés. Il ressort de cette étude que
le capteur élaboré peut se prêter à l'analyse de
paraquat dans une gamme de potentielle allant de -1,8 à 0.0 V, pour un
potentiel d'électrolyse à -0,9 V pendant 8 minutes en milieu
sodium chlorure 0,1 M à pH 8.
Globalement on peut conclure au regard de tous les
résultats obtenus que le matériau lignocellulosique
utilisé dans de ce travail et largement disponible au Cameroun, et
présente de bonnes performances analytiques et peuvent donc servir
efficacement pour la surveillance des eaux souillées par le paraquat.
Nous ne comptons pas nous arrêté à ce stade de la recherche
car beaucoup de travail reste encore à faire. A l'avenir, nous
envisageons :
- Caractériser d'avantage le matériau en faisant
des analyses complémentaires
(la diffraction aux rayons x, l'analyse thermique, l'imagerie
microscopique et mesure de la surface spécifique ) ;
- Optimiser d'autres paramètres gouvernant les
étapes de préconcentration tels que la vitesse d'agitation, la
quantité de charbon dans la pâte ;
- Examiner la sélectivité du capteur en
procédant à l'étude de l'effet d'interférence des
ions et d'autres pesticides en solution ;
- Déterminer la limite de détection du capteur ;
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 60
- Appliquer le capteur en milieu réel, c'est-à-dire
dans les eaux polluées par les pesticides.
REFERENCES BIBLIOGRAPHIQUES
Allami, A. (1989).propriétés interfaciales de
tensioactifs zwiterioniques. Thèse de doctorat,
Université de Montpelier II, Montpelier, France.
Altenor, S.; Carene, B. ; Ehrhardt, J.J.; Emmanuel, E.;
Gaspard, S. ; Lambert, J. (2009). Adsorption studies of methylene blue and
phenol onto vetver roots activated carbon
prepared by chemical activation. Jounal of Hazardous
Material, 165 ,1029-1039.
Anundo, L. (1986). Contribution à l'Etude de la
Fixation du Cyanure d'Or et de Potassium sur les Charbons Actifs.
Thèse de Doctorat, Université de Haute-Alsace,
Haute-Alsace, France, 22 - 28.
Ayhan, I.; Emrah, B. ; engil , S. ; Mahmut, O. ( 2008).
Equilibrium and kinetic data and process design for adsorption of Congo Red
onto bentonite. Journal of Hazardous Materials, 154,
613-622.
Berry, C.; La Vecchia, C.; Nicotera, P. (2010). Paraquat and
Parkinson's disease. Cell Death Differ,
17,1115-25.
Camard, J.P.; Magdelaine, C. (2010). Produits phytosanitaires
: risques pour l'environnement et la santé. Etude
réalisée, Institut d'Aménagement et d'Urbanisme
(France), PP. 7-54.
Chouteau, C. (2004). Développement d'un biocapteur
conductimétrique bienzymatique à cellule algales.
Thèse doctorat, Université Claude Bernard de Lyon, Lyon,
France.
Costa, K.M. ; Kist, L.W. ; Maciel, I.S. (2014).
Pharmacological inhibition of CXCR2 chemokine receptors modulates
paraquat-induced intoxication in rats. Journal of PLoS One,
9,105740.
Coulibaly, H. (2005). Le SCV (Semis direct sous Couverture
Végétale), un élément stratégique de gestion
durable des terres agricoles : une expérience française comme
base de réflexion pour le Mali. Mémoire (DEPA. France),
Chapitre 2 (p13-20).
Daamouche, M. (2009) `Mise au point d'une
technique d'élaboration des couches minces métalliques par voie
électrochimique. Mémoire de Magister en Physique,
Université de Batna, Batna, Algérie, 130p.
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 61
Delaat, J. (1988). Contribution à l'étude du
mode de l'élimination de molécules organiques modèles sur
le charbon actif en grain. Interaction entre les processus d'adsorption et de
biodégradation. Thèse de doctorat de 3ème cycle,
Université de Poitiers, Poitiers, France.
Demirbas, A. (2009). Agricultural based activated carbons for
the removal of dyes from aqueous solutions: a review, Journal of Hazardous
Materials, 167, 1-9.
Demirdöven, N.; Cheatum, C.M.; Chung, H.S.; Khalil, M.J.
and Tokmakoff, A. (2004). Two-dimensional infrared spectroscopy of antiparallel
beta-sheet secondary structure. Journal of the American Chemical
Society, 126, 79-81.
El Harmoudi, H.; Achak, M.; Farahi, A.; Lahrich, S.; El Gaini,
L.; Abdennouri, M.; Bouzidi, A. ; Bakasse, M.; El Mhammedi, M.A. (2013).
Sensitive determination of paraquat by square wave anodic stripping voltammetry
with chitin modified carbon paste electrode. Talanta, 115, 172-177.
Farahi, A.; Lahrich, S.; Achak, M.; El Gaini, l.; Bakasse, M.;
El Mhammedi, M.A. (2014). Parameters affecting the determination of paraquat at
silver rotating electrodes using differential pulse voltammetry. Analytical
Chemistry Research, 1, 16-21.
Fdil, F. (2004). Etude de la dégradation des herbicides
chlorophénoxyalcanoïques par des procédés
photochimique et électrochimique. Applications environnementales.
Thèse Docteur, Université de Marne La Vallée,
Marne La Vallée, France, Chapitre 1 (p 8-25).
Feihu, Y.; Hailong, L.; Guangquan, W.; Liming, D.; Xiaofen,
Y.; Yunlong, F. (2012). Determination of paraquat in water samples using a
sensitive fluorescent probe titration method. Journal of Environmental
Sciences, 24,122-130.
Heitzmann, M. (2006). Matériaux moléculaires
pour l'analyse voltammétrique de cations métalliques :
récepteurs à multiples centre redox et polymères
complexant. Thèse de doctorat/Ph.D, Université Joseph Fourier
Grenoble 1, Grenoble, France.
Ho, Y.; Mc Kay, G. (2000).The kinetics of sorption of divalent
metal ions onto sphagnum moss peat. Water Research, 34, 735.
Jorcin, J.B. (2007). Spectroscopie d'impédance
électrochimique locale : caractérisation de la
délamination des peintures et de la corrosion des alliages Al-Cu.
Thèse de Doctorat, Université de Toulouse, Toulouse,
France.
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 62
Karel, V.; Ivan, S.; Radovan, M. (2009). Carbon paste electrodes
in electroanalytical chemistry. Journal of the Serbian Chemical
Society, 74 (10), 1021-1033.
Kenne, D.G. (2011). Implication des matériaux
lignocellulosiques dans la résolution des problèmes liés
à la pollution de l'eau par le paraquat : Etude du processus de
biosorption mis en jeu et élaboration de capteurs
électrochimiques à film de sciure de bois. Thèse de
Doctorat/Ph.D, Université de Yaoundé I, Cameroun, pp.
5-97.
Kurt, K. (1990). Chemically modified carbon paste electrodes
in voltammetric analysis. Electroanalysis, 2,
419-433.
Lagaly, G. (2001). Pesticide-clay interaction and
formulations. Application. Clay science,
18,205-209.
Lovric, M.; Komorsky-Lovric, S. (1988). Square wave
voltammetry of an adsorbed reactant. Jounal Electroanalysis Chemical,
248, 239-253.
Luiz, C.S.; Figueiredo, F.; Vagner, B.; Dos, S.; Bruno ,C.J.;
Thiago, B.G.; Orlando, F.F.; Ronaldo ,C.F.; Luiz,H. M.J.(2010). Differential
Pulse Voltammetric Determination of Paraquat Using a Bismuth-Film Electrode,
Electroanalysis, 22, (11), 1260 - 1266.
Lutz, H.D.; Haeuselrh, H. (1999). Infrared and Raman
spectroscopy in inorganic solids research. Journal of molecular
structure, 511, 69-75.
Malik, R.; Ramteke, D.S.; Wate, S.R. (2007). Adsorption of
malachite green on groundnut shell waste based powdered activated carbon.
Waste Management, 27, 1129-1138.
Manole, C.C. (2007). Procédé AD-OX
d'élimination de polluants organiques non biodégradables (par
adsorption puis oxydation catalytique). Thèse de doctorat,
Polytechnique de Toulouse, Toulouse, France.
Mckeag, D.; Maini, R. (2002). The ocular surface toxicity of
paraquat. British Journal of Ophthamology, 86(3),
350-1.
Molina- Sabio, F. M.; Rodriguez-Reinoso, F.; Caturla, M.J.
(1996). Development of porosity in combined phosphoric acid-carbon dioxide
activation. Carbon journal, 34, 457-462.
Monk, P.M.S.; Mortimer, R.J.; Rosseinsky, D.R. (2008).
Electrochromism: fundamentals and applications. Corrosion science,
29, 899-917.
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 63
Moulay, A. EL.; Abdelilah, C. (2007). Electrochemical Studies of
Paraquat Adsorbed onto Crystalline Apatite. Leonardo Electronic Journal of
Practices and Technologies, 7-18.
Ngnié, T.G. (2009). « Etude cinétique de
l'adsorption des ions Cobalt(II) par le Charbon actif en poudre, la Kaolinite
et la Smectite ». Mémoire de DEA, Université de
Yaoundé I, Yaoundé, Cameroun. 56p.
Perche, F. (2004). Adsorption de poly carboxylates et de
lignosulfonates sur poudre modèle et ciment. Thèse de
Doctorat, Université de Lausanne, Lausanne, Suisse.
Rangabhashiyam, S.; Anu, N.; Selvaraj, N. (2013).
Sequestration of dye from textile industry wastewater using agricultural waste
products as adsorbents. Journal of Environmental Chemical Engineering,
1, 629-641.
Ribaut, C. (2008). Elaboration d'un biocapteur cellulaire
impédancemétrique pour la mesure des changements physiologiques
affectant la cellule parasitée, thèse de Doctorat,
Université de Toulouse, Université Toulouse III-Paul Sabatier,
France.
Rouessac, F.; Rouessac, A.; Cruché, D. (2004). Analyse
chimique : Méthodes et techniques instrumentales modernes,
(6thEd.), ISBN 2 10 048425 7, Paris, France.
Silva, D.; Cortez, C.M.; Cunha-Bastos, J.; Louro, S.R.W.
(2004). Methylparathion interaction with human and bovine serum albumine.
Toxicology letters.147, 53-61.
Sonchieu, J.; Mbofung, C.M.; Kamga, C. (2006). Kinetics of
maneb residues reduction by washing and peeling in three varieties of open
stored tomatoes. Journal of Plant pathology, 5(3),
383-387.
Syna, N.; Valix, M. (2003). Modelling of gold (I) cyanide
adsorption based on the properties of activated bagasse. Minerals
Engineering, 16, 421-427.
Tcheumi, H.L. (2011). Synthèse, caractérisation
d'une smectite modifiée par intercalation de surfactants
géminés ou gréffage d'organosilane et application à
l'électroanalyse des polluants organiques. Thèse de
Doctorat/Ph.D, Université de Yaoundé I, Yaoundé,
Cameroun.
Tcheumi, H.L.; Tonle, I.K.; Walcarius, A.; Ngameni, E. (2012).
Electrocatalytic and Sensors Properties of Natural Smectite Type Clay towards
the Detection of Paraquat Using a Film-Modified Electrode. American Journal
of Analytical Chemistry, 3, 746-754.
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 64
Tchuifon, D.R.; Anagho, S.G.; Njanja, E.; Ghogomu, J.N.;
Ndifor-Angwafor, N.G.; Kamgaing,T. (2014). Equilibrium and kinetic modelling of
methyl orange adsorption from aqueous solution using rice husk and egussi
peeling. International Journal Chemical Sciences,
12(3), 741-761.
Tingaut, P. (2006). Modification de la structure chimique du
bois par les alcoxysilanes diversement substitués, Thèse de
Doctorat, Université de bordeaux I, bordeau,France.
Tomas, K.V.; Fileman, T.W.; Readman, J.W.; Waldock, M. (2001).
Antifouling paint biocides in the UK Coastal environment and potential risks of
biological effects. Marine Pollution Bulletin, 42,
677 - 688.
Tonlé, K.I. (2004). Capteurs électrochimiques
à base d'argiles smectitiques camerounaises fonctionnalisées par
les groupements thiol et amine : Elaboration, caractérisation et
application au piégeage des métaux lourds à effet
polluant. Thèse de Doctorat/Ph.D. Université de
Yaoundé I, Yaoundé, Cameroun.
Tonlé, K.I.; Ngameni, E.; Njopwouo, D.; Carteret, C.;
Walcarius, A. (2005). Preconcentration and voltammetric analysis of mercury
(II) at a carbon paste modified with natural smectite-type clays grafted with
organic chelating groups. Sensors and Actuators B: chemical,
110, 195-203.
Ulisses, M.F.; Oliveira, D.; Jaim, L.; Jorge, C. M. (2004).
Evaluation of a Nafion Coated Glassy Carbon Electrode for Determination of
Paraquat by Differential Pulse Voltammetry. Journal of the Brazilian
Chemical Society, 15, 735-741.
Van der hoff.; Rene, R.; Van, Z. (1999). Trace analysis of
pesticide by gaz chromatography. Journal of Chromatographic science.
A 814, 301-322.
Vial, S. (2005). Immobilisation d'enzymes dans les hydroxydes
doubles lamellaires. Réalisation de biocapteurs pour la détection
de polluants organiques. Thèse de Doctorat/ph.D.
Université Blaise Pascal, Clermont-Ferrand, France.
Yang, W.; Costa, D.; Marcus, P. (1994). Resistance to Pitting
and Chemical Composition of Passive Films of a Fe-17% Cr Alloy in
Chloride-Containing Acid Solution. Journal of The Electrochemical
Society, 141, 2669-2676.
| 


