III-2.2 Etude du comportement électrochimique du
paraquat par la voltammétrie cyclique
Dans cette partie nous examinons le comportement
électrochimique du paraquat sur deux électrodes à pate de
carbone, une simple (EPC) et l'autre modifiée par le charbon actif
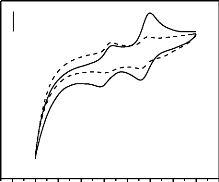
(EPC-CHA). La figure 12 ci-dessous présente les voltammogrammes
cycliques d'une solution de paraquat 5×10-4 M en milieu Na2SO4
0.1 M, obtenus respectivement sur EPC simple et EPC-CAH.
PQ2
PQ1
PQ4
PQ3
0,2uA
-1.8 -1.6 -1.4 -1.2 -1.0 -0.8 -0.6 -0.4 -0.2
0.0
Potentiel (V) vs Ag/AgCl
Figure 12 : Voltammogrammes
cycliques d'une solution de paraquat 5×10-4 M en milieu
Na2SO4
sur EPC simple ( ) et EPC-CHA ( ).
Le voltammogramme obtenu dans cet intervalle de potentiel
indique la présence (détection) du paraquat dans
l'échantillon. D'après les études antérieures, le
double pic de réduction (PQ1 et PQ2) et celui de l'oxydation (PQ3 et
PQ4) sur la figure 12 sont significatif pour la détection du paraquat.
Sur les électrodes simple et modifiée, on note dans l'intervalle
de potentiel de - 1.8 V à - 0.2 V deux systèmes
réversibles (centrés autour de - 0,65 V et - 1,15 V
respectivement) dû à la réduction du paraquat (II) en
paraquat (0) suivant un processus monoélectronique traduit par
l'équation suivante (Ulisses et al., 2004).
N N CH3
H3C N N CH3

+
+
e-
N N CH3
H3C
H3C N N CH3
+

e-
PQ+.
PQ0
H3C
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 47
Schéma III.1 : schéma
de réduction du paraquat (II) en paraquat (0) (Ulisses et
al., 2004)
Le comportement électrochimique du paraquat obtenu sur
l'EPC-CHA est différent de celui observé sur l'EPC simple. De
l'examen de la figure 12 ci-dessus, on constate que la réponse obtenue
sur l'électrode modifiée par le charbon est environ 2,04 fois
plus intense que celle obtenue sur l'électrode non modifiée. Au
regard de ces résultats, il ressort que l'électrode
modifiée par le charbon accumule de manière efficiente le
paraquat en milieu aqueux. Ce résultat pourrait s'expliquer par la
porosité du modifiant d'électrode qui accumulerait
l'espèce électroactive par gradient de concentration. On peut
également penser aux attractions électrostatiques entre les
charges négatives du matériau et les charges positives de
l'analyte en solution. Le résultat ainsi obtenu permet d'envisager
l'utilisation de ce matériau comme support d'électrode pour la
détection du paraquat.
Thèse de" Master of Science " de TAGNE TIEGAM RUFIS 48
III.3 ÉLECTROANALYSE PAR LA VOLTAMMÉTRIE A
ONDE CARREE (VOC)
III.3.1 Étude de l'effet du modifiant
Il est bien connu que la sensibilité de la
voltammétrie à onde carrée est proportionnelle au
degré de réversibilité d'un système redox (Lovric
et al, 1988). Étant donné que le système du
paraquat est réversible, nous allons utiliser cette technique pour
l'étude de l'électroanalyse sur l'électrode à
pâte de carbone modifiée par le charbon.
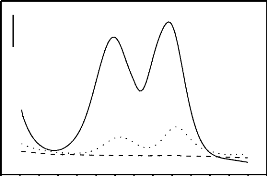
La figure 13 présente les voltammogrammes obtenus
après cinq minutes d'accumulation en circuit fermé dans une
solution 5 X 10-4 M de paraquat en milieu Na2SO4 0,1 M à pH
6, en utilisant une électrode à pâte de carbone simple et
modifiée par le charbon.
-1,4 -1,2 -1,0 -0,8 -0,6 -0,4 -0,2
(b)
(a)
(c)
Potentiel (V) vs
Ag/AgCl
Figure 13 : Voltammogrammes
ondes carrées d'une solution de paraquat (5 X 10-4 M)
enregistrés dans Na2SO4 0,1 M à pH 6, après 5 min de
préconcentration en circuit fermé :(a) blanc, (b) sur EPC et (c)
sur EPC-CHA (10 %). Potentiel d'électrolyse (-1 V),
En accord avec les travaux précédents (El
harmoudi et al., 2013), on observe pour les deux électrodes,
deux pics de réductions entre - 1.0 et - 0.6 V, respectivement pour les
couples PQ2+/PQ+ et PQ+/PQ0. Il
ressort de l'analyse de cette figure que l'électrode modifiée par
le charbon améliore considérablement le signal de
détection du paraquat. Le courant de pic est multiplié par un
facteur de 4.04 par rapport à celui obtenu sur l'électrode non
modifiée. En effet lorsqu'on impose un potentiel d'électrolyse
convenable, le paraquat (II) accumulé sur le charbon se réduit en
paraquat (I). Par contre le paraquat accumulé à la surface de
l'électrode non modifiée

diffuse de façon plus importante de la pâte vers
la solution électrolytique, ce qui explique vraisemblablement la perte
de la sensibilité de cette électrode par rapport à celle
modifiée. Ces résultats démontrent l'effet du modifiant
(charbon actif) pour l'électroanalyse du paraquat. Il convient toutefois
d'étudier l'influence de certains paramètres de processus afin
d'optimiser la détection de l'analyte.
Dans la suite de cette étude PQ1 à -0.67 V a
été choisi pour la suite des manipulations, parce qu'à ce
potentiel on observe le pic bien définie, une sensibilité et une
sélectivité plus élevées par rapport à PQ2
obtenus à -0.98 V.
| 


