|
Ministère de l'Enseignement Supérieur
et de la
Recherche Scientifique
Ecole Supérieure d'Agriculture de Mograne
Centre National des Sciences et Technologies Nucléaires

Rapport de Projet de Fin d'Etudes
(Cycle Ingénieur)
Filière : Production
Agricole
Spécialité : Production
Végétale

Optimisation de la dose d'irradiation dans le cadre
du
projet de lutte par la Technique de l'Insecte Stérile
(TIS)
contre la cératite (Cératitis
Capitata)
|
Elaboré par :
LACHIHEB Abdallah
|
Année Universitaire :
2007-2008
|
Encadré par :
Mme Meriam Guerfali M' saad
Pr. BOUBAKER
Mohsen
|
.~~~caced
Il m'est agréable de dédier ce travail aux
personnes qui me sont très chères et qui ont tout fait pour me
permettre d'être ce que je suis et tout particulièrement à
:
ü Mes chers parents en signe de mon amour et en
témoignage de ma profonde reconnaissance.
ü Mes soeurs ; Asma, Nesrine et Marwa
ü Ma grand-mère Fatma
ü Ma meilleure amie Amna
«n 2e~ ien 2~n~d
C'est avec un grand plaisir que je présente mes
sincères remerciements à tous ceux qui m'ont aidé à
réaliser ce travail ; qu'ils sachent que ces quelques lignes sont loin
de décrire toute ma reconnaissance pour l'aide, le soutien et les
remarques judiciaires qu'ils m'ont apportés.
Mes remerciements s'adressent plus particulièrement
à :
Mes encadreurs : Madame Meriam M'saad Guerfali, chef de
l'unité de production et le Professeur Mohsen Boubaker pour leurs
encadrements, leurs précieux conseils et critiques constructives qui
m'ont été bien utiles.
Par la même occasion je voudrais remercier vivement :
n Tout le personnel au sein de l'unité de production
des mâles stériles dans le Centre National des Sciences et
Technologies Nucléaires de Sidi Thabet et spécialement : Haythem
Hamden, Noureddine Ferjéni et Ramzi Yaakoubi ;
n L'ensemble des enseignants de l'Ecole Supérieure
d'Agriculture de Mograne ;
n Mais aussi à tous ceux que j'ai oublié de
nommer.
d e i
INTRODUCTION
Le contrôle des ravageurs des cultures suppose dans
l'avenir le recours à un ensemble plus ou moins complexe mais
cohérent d'actions qui dépassent largement le recours à
l'usage exclusif d'une pharmacopée coûteuse et polluante. Une
telle stratégie nécessite une parfaite connaissance du ravageur
et de son milieu. La mise en oeuvre d'une gamme diversifiée de
méthodes et de produits suffisamment sélectifs pour qu'ils
puissent être associés au contrôle du ravageur tout en
évitant l'usage excessif et inconsidéré des pesticides
chimiques.
La mouche méditerranéenne des fruits est une
espèce très polyphage s'attaquant à plus de 250 plantes
hôtes. En Tunisie, elle est plus connue pour avoir comme cible les
agrumes. Mais elle s'attaque en réalité à tous les fruits
notamment les fruits d'été qui subissent parfois des
dégâts considérables.
Il s'agit donc d'un ravageur potentiel contre lequel nous
devons mobiliser tous nos efforts d'autant plus que notre pays lui offre une
gamme très étendue d'hôtes qui se succèdent tout au
long de l'année et des conditions climatiques excessivement favorables
lui permettant de développer pas moins de sept générations
par an.
L'attention des chercheurs s'est toujours focalisée sur
la mise au point d'une stratégie de lutte par le biais d'une combinaison
de méthodes d'intervention susceptibles de contrecarrer l'amplitude des
dégâts enregistrés.
Après les méthodes de lutte chimique classique,
il y a eu recours aux méthodes biotechniques essentiellement la lutte
autocide. Mais toujours sans grand succès.
En Tunisie, on a commencé depuis les années 70
à penser à la lutte contre la Cératite. Récemment,
la technique de l'insecte stérile s'applique dans notre pays dans le
cadre du projet national de lutte contre la Cératite. Ce projet, avec la
participation de la FAO, la AIEA et le Ministère de l'Agriculture et des
Ressources Hydrauliques, tente de contrôler la cératite dans la
zone de Beni Khaled au Cap Bon, par la lâcher de
mâles stériles produit au sein de l'unité de
mouches stériles au centre national des sciences et technologies
nucléaires.
Dans le présent travail, on tient à
représenter cette technique à savoir les étapes de
production des mâles stériles et d'optimiser l'effet de la dose
d'irradiation sur la qualité et le potentiel reproducteur des
mâles destinés à la lâcher.
PRESENTATION DU CENTRE
Centre National des Sciences et Technologies
Nucléaires
Le Centre National des Sciences et Technologies
Nucléaires de Sidi Thabet a été crée en Novembre
1993 (Loi n° 93-115 du Novembre 1993), avec actuellement, un effectif
total de 54 dont 25 chercheurs, ingénieurs et techniciens.
Ses missions se présentent comme suit :
· Réalisation d'études et de recherches
nucléaires à caractères pacifiques dans les domaines de
l'agriculture, de l'industrie et de la médecine,
· Collecte et traitement des informations relatives aux
sciences, recherche et technologies nucléaires,
· Fourniture de services dans les domaines de ses
attributions, aux institutions universitaires et aux entreprises publiques et
privées, y compris la formation et les stages,
· Réalisation de toutes les activités
tendant à assurer le développement des sciences
nucléaires, la promotion de ses différentes applications et
à la maîtrise des technologies nucléaires à des fins
pacifiques.
Unité Pilote de Production des Mâles
Stériles de la Cératite
Objectif :
Création et installation d'une unité pilote de
production des mâles stériles de Cératite.
Description :
Cette unité a une capacité de production de 12
Millions de mâles adultes stériles par semaine.
Elle se compose d'un filtre permettant l'élevage de la
souche à sexage génétique (SSG) tout en
le préservant et d'un module de production.
Equipement :
La majorité des équipements utilisés dans
cette unité a été fabriquée localement avec un
design semblable avec celui des équipements de l'unité El Pino du
Guatemala.
PREMIERE PARTIE
.RCuUC 93Û6~ÛOqXaØÛJUC

- CHAPITRE 1 -
Données générales sur la biologie
de la Cératite
I- Origine et distribution géographique I.1.
Origine
Les informations concernant l'origine de la Cératite
sont assez nombreuses et différentes mais restent assez proches les unes
des autres.
Le spécimen type de Ceratitis capitata a
été collecté dans l'océan indien en 1817
probablement sur un bateau transportant une cargaison de fruits
collectés à partir d'un port africain.
L'Afrique tropicale et plus spécialement l'Afrique
occidentale où vivaient plusieurs hyménoptères parasites
indigènes de la Cératite sont probablement l'habitat d'origine de
ce diptère.
Selon Buyckx (1994), son origine est plus
précisément l'Afrique sub-saharienne à partir de laquelle
elle s'est répandue dans les deux hémisphères à une
latitude supérieure à 40° au delà de laquelle la
survie de la Cératite est limitée par le froid et les
températures hivernales.
En Afrique du Nord, la Cératite a été
signalée pour la première fois dans les îles de
l'Atlantique (Açores, Madère, Cap vert) en 1829; en
Algérie en 1859 et en Egypte en 1904.
En 1863, la Cératite a gagné l'Italie du Nord
ensuite a été signalée en 1878 en Calabre et Sicile. Ce
n'est qu'en 1885 qu'on l'a découvert en Tunisie pour la première
fois. En Afrique du Nord, elle existait sur toute la zone littorale et sub-
littorale depuis la Tunisie jusqu'au Souss au Maroc (1).
I.2. Distribution géographique
Au cours du siècle dernier, la mouche
méditerranéenne des fruits s'est dispersée dans une grande
partie du globe en arrivant à gagner des pays lointains tels que
l'Amérique du sud, l'Amérique centrale, les îles Hawaii et
l'Australie. Sa présence est signalée pour la première
fois aux Etats Unis d'Amérique (Floride) en 1929 en plein centre
citricole (Tableau 1).
Tableau 1: Répartition et date de la
première observation de Ceratitis capitata(1).
|
Afrique
|
Europe
|
Amérique centrale
|
USA
|
|
Algérie - 1858
|
Espagne - 1842
|
Brésil - 1901
|
Floride - 1929
|
|
Tunisie - 1885
|
Malte - 1845
|
Argentine - 1905
|
Texas - 1966
|
|
A.du Sud - 1889
|
Italie - 1863
|
Paraguay - 1951
|
Californie - 1975
|
|
Egypte - 1904
|
Sicile - 1878
|
Costarica -1955
|
Hawaii - 1910
|
|
Madagascar - 1915
|
France - 1900
|
Pérou - 1956
|
|
|
Turquie - 1904
|
Equateur - 1976
|
|
|
Hongrie - 1904
|
Chili - 1963
|
|
|
|
Nicaragua - 1961
|
|
|
|
Panama - 1963
|
|
|
|
Salvador - 1975
|
|
|
|
Guatemala - 1975
|
|
|
|
Mexique - 1977
|
|
Cette dispersion rapide est certainement due aux
activités diverses de l'homme telles que le transport des fruits, les
voyages touristiques et à moindre degré le vent et les migrations
naturelles.
La Cératite s'est propagée dans les
différentes contrées du globe, non seulement dans les
régions tropicales, mais aussi dans les régions
tempérées si bien qu'elle doit être
considérée aujourd'hui comme une espèce cosmopolite.
Outre son installation dans le bassin
méditerranéen avec une importante abondance répandue dans
la zone littorale et sub-littorale, la Cératite se trouve aussi dans
toutes les régions tropicales et sub-tropicales du globe.
Les adultes peuvent se disperser sur deux kilomètres et
plus, spécialement dans la direction du vent, mais ne peuvent pas migrer
ou parcourir de longues distances (2).
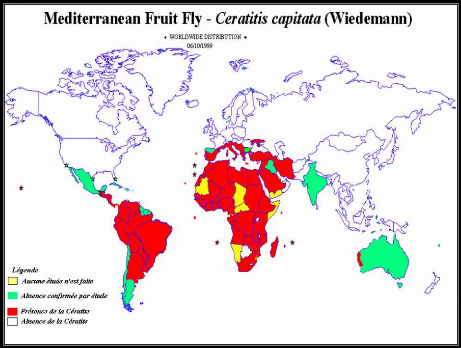
Figure 1 : Répartition géographique de
Ceratitis capitata(3).
II- Position systématique - Synonymes
Ceratitis capitata, wied; est une espèce qui a
été décrite sous plusieurs noms depuis le début du
XIXème siècle. Elle a porté le nom de Trypeta capitata
en 1824 par wiedmann, Petalophora cap itata Macepi en 1825,
Trypeta citriperda Mac leay en 1829; Trypeta hispanica de
Brème en 1842; puis Ceratitis flexuosa walk en 1856; et
Pardalaspis asparagi Bezzi en 1942 (1).
D'aprés Balachowsky et Mesnil (1935), le nom qui a
été retenu est Ceratitis capitata wiedmann 1829. Dans le
langage commun, l'espèce se nomme Cératite ou encore mouche
méditerranéenne des fruits, "med fruit fly" pour les anglo-saxons
(1).
D'après Hendel (1927), Seguy (1934), et Costantino (1950)
(1), Ceratitis capitata wiedmann est un insecte
appartenant au:
|
Projet de fin d'études
|
|
ESA Mograne
|
|
·
|
Super ordre
|
: Mecopteroides
|
|
·
|
Ordre
|
: Diptères
|
|
·
|
S / Ordre
|
: Brachycères
|
|
·
|
Division
|
: Cyclorraphes
|
|
·
|
Groupe
|
: Schizophores
|
|
·
|
S / Groupe
|
: Acalyptères
|
|
·
|
Super famille
|
: Muscoidea
|
|
·
|
Série
|
: Haplostomates
|
|
·
|
Section
|
: Trypetidiens
|
|
·
|
Famille
|
: Tephritidae ou Trypetidae
|
|
·
|
S / Famille
|
: Trypetinae
|
|
·
|
Tribu
|
: Trypetini
|
|
·
|
Genre
|
: Ceratitis
|
III- Description morphologique des différents stades
de développement
III.1. Adulte
L'adulte de la Cératite mesure environ 5 à 6 mm
et est caractérisé par un thorax noir luisant à bandes de
pruinosité argentées ou grises portant des ailes à larges
bandes jaunes serties de brun avec dessin de traits et points noirs à la
racine. Les ailes sont tenues écartées perpendiculairement au
corps, elles sont marquées d'une bande transversale jaune salie de
taches grises estompées, une autre bande de la même couleur longe
l'extrémité de la marge supérieure
(1).
L'abdomen élargi comporte des bandes transversales
alternées grises et rousses. Chez la femelle il se termine par l'organe
de ponte, l'oviscapte.
La tête porte deux yeux composés et une paire
d'antennes à une soie. Les mâles possèdent deux soies
orbitales antérieures allongées et terminées chacune par
une petite palette en forme de losange de couleur noirâtre. Les femelles
ont un ovipositeur court, large, aplati et rougeâtre à jaune
(1).

Figure 2: Aspect général du mâle et
de la femelle de Ceratitis capitata.
III.2. L'oeuf
De couleur blanche nacrée, brillant, de forme
allongée et arquée en son milieu, il a un diamètre de 0,15
mm environ sur 1mm de longueur. Le tégument est nettement visible
à la loupe binoculaire et on distingue bien ses particularités au
microscope. Il fait 0,9 à 1,1mm de long sur 0,20 à 0,25mm de
large (1). L'oeuf peut être manipulé facilement
dans l'eau où il peut éclore (4).
III.3. La larve
La larve qui est communément appelée asticot,
est acéphale, apode, lisse et de couleur blanc-crème. La larve
mesure environ 1 mm à l'éclosion, elle est de forme conique
effilée dans sa partie antérieure, elle est subcylindrique et
tronquée dans sa partie postérieure.
La larve passe par trois stades larvaires, et mesure 7 à 8
mm à la fin de son développement c'est à dire au stade L3
(1).
Les trois stades se différencient par la
présence, le nombre, la forme et la taille des stigmates. Au cours du
troisième stade, la larve est caractérisée par la
présence de stigmates fortement chitinisés et par le saut
larvaire caractérisant l'espèce, qu'elle réalise en
s'arcboutant et en se détendant brusquement pour tomber sur le sol et
s'y enfoncer pour s'y nymphoser.
III.4. La Pupe
Le troisième stade larvaire ne rejette pas son exuvie qui
va lui servir d'une enveloppe à l'intérieur de laquelle il se
nymphose formant le puparium.
La pupe a la forme d'un petit tonnelet elliptique, lisse et
résistant de 4 à 5 mm de longueur. Il change progressivement de
couleur pour devenir brun foncé.
IV- Cycle de développement de la cératite
La mouche méditerranéenne est
caractérisée par une période pré-ovipositionnelle
après laquelle la femelle s'accouple pour la formation des ovules
mûrs qui seront ensuite pondus. La survie et la durée de
développement de ce stade sont régies par plusieurs facteurs dont
notamment, la température et les caractéristiques
physico-chimiques du site de ponte.
Delrio et al. (1986) trouvent que les
éclosions peuvent se faire entre 12 et 38°C et avoir lieu
après 24-72 heures selon les conditions climatiques. L'hôte peut
exercer des effets néfastes sur les oeufs et leur développement
par l'action des pH élevés ou des acides volatils contenus dans
l'écorce (1).
IV.1. Développement larvaire
Le développement larvaire est régi par deux
principaux facteurs; les conditions climatiques et la plante hôte
(5).
Les larves peuvent manifester une compétition intra
spécifique en fonction de la densité de la population larvaire.
La qualité de l'hôte affecte aussi bien la durée de
développement que les caractéristiques biométriques de
l'adulte (poids et mensurations).
Une fois les trois stades larvaires sont achevés, le
troisième stade passe dans le sol pour se pupéfier
(6). Ce saut est stimulé par la lumière, le
phénomène commence avant l'aube, dure 3 à 4 heures et
atteint son maximum au début de la matinée. Causse (1974) et
Smith (1989) montrent une rythmicité des sauts larvaires en fonction de
la photopériode et une perturbation de ce phénomène par la
pluie (1).
IV.2. La pupaison
Une fois enfouie dans le sol, la larve entre dans un stade fixe
au cours duquel se déroule un ensemble de transformations profondes.
La durée de la pupaison est fonction de la
température et de l'humidité relative. Les pupes sont sujettes
à une mortalité causée par les facteurs biotiques et
abiotiques (1).
IV.3. La maturation
L'éclosion des pupes se fait dans le sol, d'où
émergera l'adulte après avoir durci ses ailes. Ce
phénomène est stimulé par la lumière et
s'étale sur une période de 3 à 4 heures. Elle commence
très tôt à l'aube et dure jusqu'au début de la
matinée.
A l'émergence, les adultes présentent une
période de prématurité sexuelle. En ce qui concerne le
mâle de la mouche, Bodenheimer (1951) indique qu'il exige une
période de maturation. Contrairement à Balachowsky et Mesnil
(1935) et Seguy (1951) qui le considèrent sexuellement mûr
dès l'émergence. Avec l'étude de la spermatogenèse,
Williamson (1989), opte pour la première hypothèse puisqu'il
montre que l'activité sexuelle est fonction de l'âge de l'adulte
et que cette période dure de 2 à 4 jours (1).
Chez les femelles, la prématurité sexuelle
à l'émergence est dite période de préoviposition
(7). La femelle de la Cératite exige une alimentation
protéique au cours de cette période pour pouvoir former des
oeufs. La durée de pré-oviposition dépend des conditions
climatiques, de la photopériode et de la nutrition larvaire. Dans les
conditions optimales elle dure 2 à 3 jours (1).

Figure 3. Cycle biologique de la
cératite
V- Facteurs agissant sur le développement de la
Cératite
Le développement de la mouche des fruits de l'oeuf
jusqu'à l'imago est sujet à l'influence de plusieurs facteurs
biotiques ou abiotiques, perturbant les différentes étapes
évolutives ou les arrêtant, causant parfois même la mort de
l'individu. Ces facteurs peuvent être intrinsèques relatifs
à l'insecte, ou extrinsèques dus au milieu environnant.
· Facteurs intrinsèques
Ils concernent principalement le potentiel reproductif qui
dépend des caractéristiques biophysiologiques de la population
telle que la longévité des adultes et la fécondité
des femelles.
· Facteurs extrinsèques
Ils englobent les facteurs biotiques ou abiotiques. Les
facteurs biotiques sont essentiellement l'alimentation, la compétition
intra spécifique et interspécifique, le parasitisme, le
prédatisme et la convenance de l'hôte. Il faut signaler que la
compétition intra spécifique n'entre en jeu qu'à partir
d'un seuil de densité larvaire dépendant de la qualité de
l'hôte (7).
Les facteurs abiotiques sont essentiellement les facteurs
climatiques, la température, l'humidité et la
photopériode.
- CHAPITRE 2-
Les plantes hôtes et les dégâts de
la Cératite
La Cératite est connue par sa large gamme
d'hôtes, elle est le ravageur polyphage le plus dangereux des
régions tropicales et subtropicales .A partir de son
aire d'origine, l'Afrique de l'Ouest; elle a pu s'adapter et coloniser
plusieurs régions tels que le bassin méditerranéen,
l'Amérique centrale et du sud et l'Australie de l'ouest, s'attaquant
à 353 plantes hôtes (1).
Pour la Tunisie, Cheikh et al. (1975)
(9), indiquent que la Cératite s'attaque à tous
les fruits d'hiver et d'été, particulièrement le
Bigaradier, l'Oranger, le Mandarinier, le Clémentinier, l'Abricotier, le
Néflier du Japon, le Pêcher, le Prunier, le Figuier, le Pommier,
le Poirier et la Figue de Barbarie. Sans oublier les espèces sauvages
considérées comme hôtes secondaires
(10).
I- Séquences des hôtes et époques
d'infestation
La Cératite, ravageur polyphage, est
caractérisée par la ponte dans les fruits après leur
véraison jusqu'à la maturité complète. Ceci fait
que les époques d'infestation coïncident avec la chronologie de
maturation des espèces.
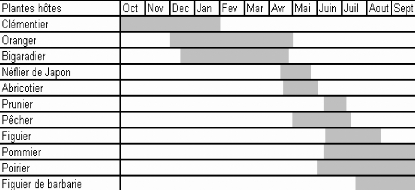
Le tableau 2 schématise la succession chronologique
des périodes d'infestation dans le nord de la Tunisie
(11). La succession des hôtes en Tunisie offre à
la Cératite une période d'infestation continue tout au long de
l'année.
Tableau 2: Succession des
périodes d'infestation sur les différentes espèces
fruitières dans le nord
de la Tunisie (17) ;(11).
II- Importance de l'hôte
L'hôte influe considérablement
l'épidémiologie de la Cératite. Cette influence à
partir de la séquence des hôtes. Elle revêt une importance
capitale car elle détermine le nombre de générations et
donc le nombre de femelles en quête de ponte dans un biotope
donné. L'absence d'hôtes pour une période donnée
conditionne le niveau des populations. Alors que l'éloignement par
rapport aux cultures pouvant être contaminées, conditionne le taux
d'infestation (10).
II.1. La Cératite et les citrus
Bondenheimer (1951) a décrit le point de piqûre
de la Cératite sur citrus. Il est facile à remarquer sur les
oranges vertes où il présente une zone de décoloration qui
le circonscrit. Ce phénomène hâte la maturité
(1).
Les points des piqûres sont légèrement
soulevés par rapport au niveau de la surface du fruit ou au contraire
légèrement affaissés. La tâche finit par
s'élargir, devient brunâtre et la chair sous-jacente pourrit
(Figure 3). La tâche des piqûres ne renfermant pas d'oeufs ou
d'individus morts, se cicatrise. La peau se dessèche sous la pourriture
(1).
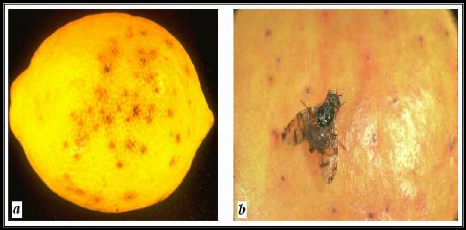
Figure 4 : Piqûres de la Cératite sur des
citrus : Citron (a) et Orange (b).
II.1.1. Susceptibilité des différentes
variétés à l'attaque
Les différentes espèces de Citrus montrent des
différences dans leurs structures physiques et chimiques,
déterminées par une variabilité de la résistance de
l'écorce, de la résistance mécanique, de la
présence des huiles d'éther et de la sécrétion de
gomme pouvant gêner d'une manière ou d'une autre le
développement adéquat des larves (12).Les
différences dans les caractéristiques font que les diverses
variétés de Citrus présentent des prédispositions
variables aux attaques de la Cératite.
Bodenheimer (1951) considère le Citronnier et le
Cedratier comme espèces immunes d'infestation, malgré la
présence de piqûres stériles. Alors que les Bigaradiers
sont sévèrement attaqués à cause du
relâchement du tissu de l'écorce (12). Les
variétés tardives telles que les Oranges Valencia Late
favorisent la pullulation de la mouche des fruits, en effet en plus des
conditions climatiques favorables, l'espèce variétale a une
épaisseur d'écorce relativement faible, facile à percer
par l'ovipositeur de la femelle.
Les Clémentines ont une peau très mince, ainsi
la ponte se fait directement dans la pulpe. Les Oranges "Navel" sont
infestées à l'approche de la maturité. Les Tangerines,
elles, sont faiblement infestées. Pour les Oranges "Thomson", le taux
maximal élevé des piqûres stériles montre une grande
réceptivité de cette variété due à la
structure de l'écorce très lisse et relativement fine. Alors que
pour les variétés "Maltaise" et "Double fine" qui mûrissent
en même temps, les piqûres stériles diminuent dans le temps
indiquant une inhibition de la ponte et un changement de l'hôte
(1).
En ce qui concerne la chute des fruits, les
variétés d'Oranges "Thomson" et "Maltaise" sont celles qui
subissent la plus forte chute due à la Cératite (Tableau 3).
Alors que les Oranges "Doubles fines" tiennent le mieux à l'arbre mais
il faut considérer que cette espèce passe durant sa maturation
par une période de froid, ce qui se traduit par un allongement de la
durée du développement larvaire (13).
Tableau 3: Epoque de réceptivité des
fruits de Citrus dans le biotope de Mraissa (13).

II.1.2. Comportement de la Cératite sur les
citrus
o Répartition de l'infestation sur les
citrus
Il a été prouvé par plusieurs auteurs
que la Cératite visite préférentiellement les endroits
dégagés plutôt que ceux diffus. Elle préfère
également le côté Sud de l'arbre, ou bien le
côté Est (1).
Quant à Gahbiche (1993), elle a montré
l'existence sur les Citrus de deux gradients décroissants d'infestation
l'un allant de l'extérieur vers l'intérieur de l'arbre, et
l'autre selon ses points cardinaux. Le côté Sud-est
présente le taux d'infestation le plus élevé, ce qui
tranche entre la préférence au côté sud et au
côté est de l'arbre (13).
o Evolution temporelle de l'infestation des
fruits
L'étude de l'évolution montre une succession de
l'infestation au rythme de la succession de la maturité des fruits.
L'augmentation du taux d'infestation est en relation directe
avec l'augmentation du taux des captures (12) ;(13). Pour ce
qui est de l'impact de l'infestation sur la chute des fruits, Soria (1961)
(14) a trouvé que lorsque la larve du 3ème stade
effectue son saut caractéristique au sol, le fruit peut ne pas
tomber.
Les Clémentines ont une structure qui permet un
développement larvaire plus important que les autres
variétés (14) trouve que la tenue des fruits sur
l'arbre est d'origine variétale, indiquant que les Oranges "Maltaise" ne
tiennent pas bien sur l'arbre.
II.2. La Cératite sur les fruits
d'été
En dehors des Citrus, l'arboriculture tunisienne offre
à la Cératite une multitude de plantes hôtes permettant le
développement du ravageur. L'ensemble des plantes hôtes
cultivées, essentiellement les arbres fruitiers, offre à la
mouche méditerranéenne le milieu favorable en plus des conditions
climatiques optimales à son développement pendant toute la
période estivale. Cette dernière commence avec le Néflier
du Japon, et se termine sur le Figuier de Barbarie, en passant par
l'Abricotier, le Pêcher, le Figuier, le Pommier, le Poirier et d'autres
espèces fruitières (Vigne,...).
II.2.1. Comportement de la Cératite sur les
principaux fruits d'été
· Les pêches : Prunus
persica :
Les pêches constituent l'hôte
préférentiel de la Cératite (Figure 4/a). En effet, elles
sont classées parmi les hôtes les plus attaqués. Dans la
région méditerranéenne, dont la Tunisie, la
Cératite est considérée comme étant le ravageur
majeur des Pêches. Fimiani (1972) trouve des taux d'infestations allant
de 80 à 100% en Italie et Selim (1967) en Egypte, mentionne un maximum
d'attaque de 97% lors des contrôles pendant la saison estivale.
Les fruits attaqués peuvent renfermer 15 à 30
larves. Quayle (1941) montre que le niveau d'infestation est de 6 à 20
larves par fruit, et peut atteindre parfois 30 à 35
larves.
Vargas et al. (1983) ont obtenu à partir de
665 fruits, 228 pupes dont 104 ont donné lieu à des adultes.
Alors que Nishida et al. (1985) ont pu avoir une moyenne de 200
adultes par kilogramme de fruits attaqués dans l'île de Hawaii. Le
maximum de larves dans un fruit est de 76 individus, alors que la moyenne est
de 24,6 larves par fruit (1).
· Les abricots: Prunus armeniaca
:
L'abricot est un hôte très recherché par la
Cératite, spécialement les variétés tardives. Les
variétés précoces échappent à
l'infestation.
En ce qui concerne la capacité du fruit, Selim (1967)
trouve une moyenne de 14,2 larves par fruit infesté, alors que la plus
grande capacité est de 29 individus. Bodenheimer (1951) montre que le
fruit d'abricot ne peut contenir plus de 3 à 5 larves. A partir
d'échantillons d'abricots collectés aux îles Hawaii,
Liquido et al. (1990) obtiennent une moyenne de 340,55 adultes par
kilogramme de fruits attaqués (1) ;(8).
· Les prunes: Prunus spp:
Les Prunes sont relativement résistantes aux attaques des
mouches des fruits: Ceratite capitata (Wied.) mais une fois
mûres elles sont rapidement infestées surtout au cours de la
période Juin-Juillet. Bien que la forte humidité
de la pulpe provoque une mortalité des jeunes larves
(1)
Nishida et al. (1985) trouvent une moyenne
d'émergence de neuf adultes par kilogramme de fruits infestés
(1).
· Les poires: Pyrus communis :
Les poires constituent un hôte favorable à la
Cératite, avec des taux d'infestation allant de 25,8 à 71,3 % et
pouvant atteindre 80 à 100 %. Plusieurs variétés
précoces ayant des fruits juteux et à petit calibre sont
sévèrement attaquées (1)
Bodenheimer (1951) trouve que les poires peuvent être
le siège de développement de 6 à 7,5 individus, alors que
Liquido et al. (1990) à Hawaii trouvent une moyenne de 1,09
adultes de Cératite par kilogramme de fruits infestés (1)
(8).
· Les Pommes: Pyrus malus :
Myburgh (1976) en Afrique du Sud, trouve en contrôlant
le niveau d'infestation dans plusieurs vergers de pommiers en fonction des
traitements insecticides, que dans les vergers traités, les taux
d'infestations varient de 0 à 2,9%, alors qu'ils atteignent le niveau de
7,9% dans les vergers n'ayant reçu aucun traitement chimique
(1)
En ce qui concerne la capacité des pommes de recevoir
et permettre le développement des larves de la mouche des fruits,
Liquido el al. (1990) obtiennent une moyenne de 79,02 adultes par
kilogramme de fruits infestés (8).
· Les Figues: Ficuscarica L:
Les figues sont susceptibles à l'attaque de la mouche
des fruits uniquement après maturité. Le liquide laiteux et acre
contenu dans la peau des figues non mûres empêche la ponte des
femelles.
En ce qui concerne la capacité des figues à
héberger la progéniture de la mouche des fruits, et à lui
procurer les éléments nécessaires à son
développement, Wong el al. (1983) trouvent à partir de
plusieurs échantillons de 122 à 471 fruits, des taux
d'infestation de 3,3 à 43,3% alors que le nombre d'individus
collectés sur le sable, varie entre 72 et 2108 pupes, avec des taux
d'émergence de 49,6 à 100%. Nishida el al. (1985) ont
obtenus à partir de 28 échantillons pris dans l'île de
Hawaii, une moyenne de 200 adultes de Cératite par kilogramme de fruits
(1). Alors que Liquido et al. (1990) obtiennent une
moyenne de 18,59 adultes par kilogramme de fruits infestés uniquement
(8).
· Les raisins : Vitis vinifera
:
Les raisins peuvent être sujets aux attaques de la
mouche des fruits: Ceratite capitata (Wied.). En effet, les raisins
sont généralement attaqués aux îles Hawaii, et
rarement voire secondairement en Afrique du Sud (1).
La présence de la Cératite est rare sur la
vigne tout en maintenant sa susceptibilité à l'attaque. Lors des
essais au laboratoire, 86% des 2251 oeufs déposés sur des grappes
de raisins ont pu se développer (1).
· Les figues de barbarie : Opuntia
ficus indica:
Elles présentent au cours de la période automnale
un hôte de privilège à la mouche des fruits
(8).
Liquido et al. (1990) obtiennent à partir des
fruits infestés une moyenne de 1,82 adultes par kilogramme de figues de
barbarie véreuses (8).
II.2.2. Autres cultures estivales hôtes de la
Cératite à importance économique en Tunisie
Plusieurs autres cultures fruitières et
maraîchères figurant sur la liste des plantes hôtes de la
mouche des fruits: Ceratite capitata (Wied.), revêtent une
importance capitale dans le système de production agricole en
Tunisie.
· Les grenades : Punica
granatum
La peau dure et résistante de la grenade saine est
inaccessible à l'ovipositeur de la mouche, ce qui est à l'origine
de la faible infestation. Ceci malgré le fait que Keck et Marshall
(1930) obtiennent des larves à l'intérieur de la grenade
mûre après son exposition à la mouche au laboratoire
(1)
· Les dattes : Phoenix
dactylifera
Back et Pemberton (1918a) signalent que les dattes sont
très peu attaquées. Elles sont classées parmi les
hôtes rarement attaqués (15)
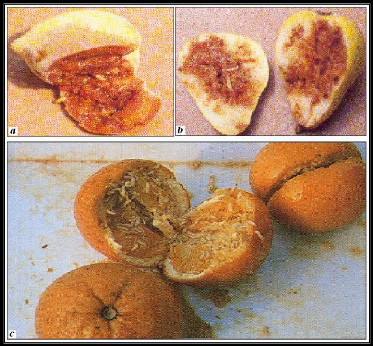
Figure 5 : Fruits infestés par la Cératite
: Pêche (a) ; Poire (b) ; Orange(c).
III- Les dégâts de la Cératite
III.1. Les dégâts de la Cératite dans
le monde
La Cératite affecte des intérêts
économiques dans plusieurs pays à travers le monde. En effet, par
son infestation de plusieurs variétés de fruits, elle cause une
réduction considérable dans la production et la qualité
des récoltes. Et si on ajoute les dépenses de montants
substantiels d'argent sur les méthodes de contrôle de la mouche
des fruits, et sur les traitements de la récolte lorsque le fruit est
destiné à l'exportation, ces pertes peuvent s'élever
à des millions de dollars américains.
En Californie, les pertes causées par la
Cératite sont estimées à 910 millions de dollars
américains, s'ajoutent les 290 millions de dollars
dépensés sur les tentatives de contrôle de l'insecte
(1).
Dans une estimation économique récente pour la
région du moyen orient (Palestine, la Jordanie, le Liban et la Syrie),
la perte annuelle causée par la Cératite a été
estimée à 132 millions de dollars américains (16)
(Tableau 4).
Dans la région du Maghreb (Algérie, Libye,
Maroc, et la Tunisie), les pertes financières imposées par la
mouche des fruits sont de 67 et 100 millions de dollars américains
chaque année (17).
|
Variétés de
fruits
|
Dommage
(%)
|
Production
(Tonne)
|
Pertes
(Tonne)
|
Prix
(US $ / Tonne)
|
Pertes
(US $ / million)
|
|
Citrus
|
39
|
205800
|
80262
|
317
|
25.44
|
|
Pomme
|
21
|
63400
|
13314
|
731
|
9.73
|
|
Poire
|
18
|
2700
|
486
|
750
|
0.36
|
|
Figue
|
55
|
6700
|
3685
|
550
|
2.03
|
|
Grenades
|
1
|
4900
|
49
|
378
|
0.02
|
|
Datte
|
2
|
1000
|
20
|
800
|
0.02
|
|
Raisin
|
7
|
53400
|
3738
|
826
|
3.09
|
|
Autres
|
7
|
300
|
21
|
350
|
0.01
|
|
Total
|
---
|
338200
|
101575
|
---
|
40,7
|
Tableau 4 : Dommages et pertes dues à la
Cératite en Jordanie en 1996 (16) .
III.2. Les dégâts de la Cératite en
Tunisie :
En Tunisie, l'évaluation économique des
dégâts dus à la Cératite (17),
indique que les pertes s'élèvent annuellement à
l'équivalent de quatre millions de Dollars américains. Et c'est
pendant la période d'été que l'on enregistre le maximum de
dégâts. Parmi les fruits hôtes, les agrumes sont les plus
touchés représentant 38% des pertes annuelles directes pour
l'économie Tunisienne.
|
Cultures
|
Superficies (ha)
|
Coût de traitement
(Milles Dinars
Tunisien)
|
|
Agrumes
|
13.500
|
377.200
|
|
Pommes
|
19.500
|
72.540
|
|
Poires
|
11.000
|
40.920
|
|
Abricots
|
12.000
|
44. 640
|
|
Pêches
|
25.000
|
93.000
|
|
Prunes
|
5.000
|
18.600
|
|
Cerisier
|
960
|
3.570
|
|
Total
|
86.960
|
650.470
|
Tableau 5: Estimation des coûts
des traitements cératicides sur les différentes cultures
(1).
Les pertes à la production, à la
commercialisation et lors de l'échange extérieur des fruits,
doivent s'ajouter à un second ensemble de pertes lié aux
coûts des traitements qui s'élèvent à 640 milles
Dinars.
Les pertes totales évaluées à 3.838.290
Dollars américains constituent les coûts directs des pertes
causées par la mouche des fruits. En Tunisie, cette estimation ne tient
pas compte des autres pertes indirectes, qui sont très importantes et
qui sont dues aux écarts de triage de la production destinée
à l'exportation et des refoulements sur le marché
intérieur (1) (Tableau 5).
Pour le secteur des agrumes ces pertes ont été
estimées à 1.403.500 dinars Tunisiens en 1990. Pour les agrumes
les écarts de triage représentent en Tunisie 30 à 35 % du
tonnage de fruits reçus dans les stations de conditionnement et
constituent des manques à gagner, car ils sont vendus sur le
marché local avec une partie destinée à la
transformation (1).
|
Fruits
|
Perte à la production
|
Perte à la commercialisation
|
Perte totale
|
|
Agrumes
|
1082.5
|
36
|
1403.5
|
|
Pêches
|
856
|
32
|
888
|
|
Poires
|
355
|
20
|
375
|
|
Pommes
|
261
|
30
|
291
|
|
Abricots
|
201
|
6
|
207
|
|
Prunes
|
156
|
6
|
162
|
|
Figues
|
104
|
1.8
|
105,8
|
|
Nèfles
|
30
|
3
|
33
|
|
Coings
|
6
|
4
|
10
|
|
Autres
|
-
|
-
|
149
|
|
Total
|
|
|
3190.3
|
Tableau 6: Estimation des pertes en milliers de Dinars
Tunisiens (17).
Bien qu'elle soit considérée comme une culture
stratégique la production d'agrumes en Tunisie connaît des
alternances importantes d'une année à l'autre, suite aux
conditions climatiques et aux techniques culturales et les attaques par les
ravageurs.
- CHAPITRE 3 -
Les méthodes de lutte et de contrôle de la
Cératite
La lutte contre la Cératite demeure un problème
très préoccupant compte tenu de la gravité et de l'ampleur
des dégâts associés à la difficulté
d'intervention. Plusieurs techniques ont été mises au point
depuis le début du siècle sans arriver à éradiquer
ce ravageur très polyphage et multivoltine.
I- La lutte chimique
La lutte chimique reste l'arme la plus déployée
contre la mouche des fruits. La gamme d'insecticide ne cesse de s'agrandir vu
le pouvoir de re-sélection, le pouvoir reproductif rapide et les
générations courtes et chevauchantes dans le temps du
ravageur.
Le seul stade cible étant l'adulte, les autres stades
exigent des produits systémiques contre-indiqués pour les fruits
en maturité susceptibles à l'attaque et pour la faune
(1).
|
Groupes d'insecticides
|
Insecticides
|
Périodes
d'utilisation
|
|
Minéraux
|
Arséniates
|
Arséniates de sodium
|
1908-1950
|
|
Organiques de
synthèse
|
Organochlorés
|
DDT
Dieldrine
HCH
Chlordane
|
1949-1963 1950-1965 1963-1974 1963-1974
|
|
Organophosphorés
|
Parathion Malathion Trichlorvios Diméthoate
Fenthion
Dichlorvos
|
1958-1973
1956- aujourd'hui
1956-aujourd'hui
1958-
aujourd'hui
1959- aujourd'hui
1963- aujourd'hui
|
|
Pyérthrinoïdes
|
Deltaméthrine
|
Récemment
|
Tableau 7 : Liste des insecticides utilisés dans
le monde contre la Cératite (1) :
L'utilisation des produits chimiques par plusieurs
méthodes vise essentiellement ces dernières années leur
épandage en quantité minimale (Tableau 7). Ces méthodes
varient de l'utilisation avec un attractif sous forme d'appâts
empoisonnés jusqu'au traitement par bandes ou par taches. En plus, les
femelles exigeant une alimentation protéique pour leur maturité
sexuelle, seront attirées dès l'émergence vers
l'appât.
Les appâts empoisonnés consistent en la
présence d'attractif alimentaire additionné à
l'insecticide attirant les mouches qui s'en alimentent et meurent.
En Tunisie, Yana et Stancic (1967) ont mis au point une
méthode de traitement aérien à très bas volume en
utilisant une part d'insecticide pour 4 parts de solution protéinique
avec une dose totale de 1,5 l /ha. Récemment, l'utilisation des
attractifs sexuels s'est avérée très prometteuse.
Le traitement par bandes alternées avec le polycore
à base de trimedlure a donné une efficacité pouvant
atteindre 76% par rapport au témoin contre 47% pour l'insecticide plus
un attractif alimentaire (Lysatex). Ce résultat est beaucoup plus
intéressant sachant qu'uniquement la moitié de la surface est
traitée ce qui permettra une meilleure gestion des ressources naturelles
: objectif primordial des politiques agricoles.
Aujourd'hui et selon les recommandations du Ministère
de l'Agriculture et des Ressources Hydrauliques, on conseille de lutter
chimiquement par voie terrestre dans les plantations d'agrumes qui est
considérée comme une culture stratégique, surtout les
espèces précoces en automne.
Toutes les autres espèces doivent être
traitées selon la chronologie de maturité des fruits, y compris
les plantations à usage familier (le Néflier de Japon, le
Pêcher, l'Abricotier...). Le traitement se fait sur les fruits
chutés et sur les arbres avec un insecticide chimique et un attractif,
sans oublier de traiter le pourtour des vergers et surtout les haies de Figuier
de Barbarie dès le mois de mai.
La lutte chimique s'est avérée insuffisante pour
contrôler ce ravageur. Les pertes, dues à la Cératite en
Tunisie, malgré les traitements effectués, sont de l'ordre de
10.500.000 $ US par an. Sans oublier l'impact de ces traitements sur
l'environnement, la santé humaine et l'entomofaune auxiliaire utile.
II- Les méthodes de lutte biotechnique :
Ce terme, de plus en plus utilisé ces dernières
années avec la montée de l'aspect écologique, a
été rapporté par Boller (1983) comme désignant des
méthodes utilisées pour la
lutte contre les insectes, comprenant des stimuli physiques et
chimiques ou agents qui agissent sur le comportement ou le développement
des insectes nuisibles. Elles englobent les attractifs, les répulsifs,
les régulateurs et les inhibiteurs de croissance en incluant la
stérilisation des insectes (1).
II.1. L'anéantissement des mâles
:
Cette méthode est basée sur l'utilisation d'un
attractif sexuel très performant mélangé à un
insecticide pour attirer les mâles et les tuer par contact. La
rareté des mâles augmente le pourcentage des femelles ne
produisant pas d'oeufs fertiles, mais cette méthode n'a pas
trouvé d'échos favorables envers la Cératite
(1).
II.2. La confusion sexuelle :
La lutte par confusion sexuelle consiste à diffuser
dans l'atmosphère du verger des quantités importantes de
phéromone sexuelle de synthèse de façon à
désorienter les mâles empêchant ainsi la rencontre des
sexes. Cette méthode ne présente aucun avantage pratique pour la
Cératite à cause de ses exigences techniques (coût
élevé de la phéromone).
II.3. La lutte biologique :
La lutte biologique consiste en l'utilisation d'ennemis
naturels d'un ravageur. La lutte biologique par épizooties est connue
principalement par les agents qui se développent au cours des
élevages de Cératite tel que les bactéries du genre
Serratia qui s'attaquent aux oeufs, larves et pupes, et les champignons
entomophorales du genre Beauvaria, ou agents viraux (1).
Mais tous les microorganismes sont sans aucune importance
pratique en dehors de leurs dégâts sur les élevages de
masse.
Les parasites sont divisés en :
- Parasites des larves généralement du genre
Diachasma (Hyménoptéra,
Braconidae).
- Endoparasite "larvo-pupaux" dont l'Opius concolor
Szepligeti (Hyménoptéra,
Braconidae) endoparasite du stade (L3) juste avant la
formation de la pupe, provoquant la mort de l'adulte et la destruction du
puparium. A l'opposé des autres parasites, il ne se disperse pas
beaucoup mais présente une grande capacité adaptative. En
Tunisie, son taux de parasitisme sur la Cératite est très bas
(13).
- Les parasites des pupes sont des espèces attaquant la
Cératite au stade pupe tel que
Trichopria capensis et galesus silvestrii
(Hyménoptéra, diapriidae).
Malgré les nombreux travaux réalisés sur
ces différents parasites, les résultats sont relativement faibles
à cause des difficultés d'élevage et de la
complexité de la relation hôte- parasite.
II.4. Piégeage de masse
Devant l'incapacité de la lutte chimique, plusieurs
auteurs se sont penchés sur la combinaison des facteurs pouvant affecter
les populations de mouches tel que le stimulus olfactif et visuel. Le
piégeage de masse consiste à l'utilisation de cet ensemble de
stimuli par le biais d'un grand nombre de pièges en vu de réduire
au maximum la population adulte de la mouche.
L'utilisation des pièges Mcphail appâtés
avec des attractifs alimentaires et des chémiostérilisants
réduit significativement l'infestation. Le contrôle par les
pièges englués à attractifs alimentaires réduit
aussi bien la densité de la population que le taux d'infestation des
fruits sous certaines conditions (1).
Les pièges appâtés à l'attractif
alimentaire et à la phéromone sexuelle capturent plus de femelles
que ceux appâtés uniquement à la phéromone. Pour
ceci les modèles mathématiques de Barclay (1988) montrent qu'en
piégeage de masse la combinaison des deux types d'attractifs sur le
même piège augmente son efficacité (1).
Haniotakis et al. (1991) concluent après un
essai de piégeage de masse, que cette technique peut être
utilisée à la place des traitements insecticides pour le
contrôle de la mouche des fruits, mais ayant l'inconvénient de
n'être dirigée que vers le stade mobile du ravageur et qu'elle
n'est efficace qu'en cas de vergers isolés où le risque de
ré invasion est minimisé (1).
En Tunisie, les captures étaient 4 à 5 fois plus
importantes dans la parcelle traitée par le piégeage de masse.
Les niveaux d'infestation étaient relativement faibles; de l'ordre de
9,6% correspondant à des réductions des piqûres de l'ordre
de 82% et 89 % par rapport aux parcelles traitées chimiquement et aux
témoins.
II.5.La technique des insectes stériles II.5.1
.Introduction
C'est une méthode de lutte biologique contre les
insectes nuisibles notamment la Cératite, qui commence à
s'imposer devant les traitements chimiques comme étant une
méthode très respectueuse de l'environnement, sans
conséquences négatives sur la santé
humaine et très efficace.
La méthode a été appliquée pour la
première fois à l'île de Curacao (Antilles) contre la
Cochliomyia hominivorax (20) ce qui a incité
les chercheurs à l'expérimenter sur plusieurs insectes notamment
ceux de la famille des Tephritidae tel que le Dacus dorsalis
Hendel et Dacus cucurbitae coquillet, Dacus tryoni Frogg,
Anastrepha ludens Loew et Anastrepha suspensa loew et plus timidement
pour Bractocera oleae Gmelin, et Rhagolettis cerasi
(21).
En ce qui concerne la Cératite, le programme qui a
permis de limiter les populations dans la région d'Amérique
centrale a commencé à Hawaii, en Californie, et en Mexique.
D'autres applications ont été engagées depuis, avec plus
ou moins de succès en Egypte et Tunisie (22) ;(11)
En Tunisie, le programme en cours est celui mené par le
ministère de l'Agriculture et le Centre National des Sciences et
Technologies Nucléaires. Ce programme qui vise le contrôle de la
cératite dans la région de Beni Khaled au Cap bon (environ 6000
hectares).
II.5.2. Principe de la méthode
C'est l'entomologiste Américain E.F.Knipling qui a
été le premier à développer l'idée de
contrôler les insectes nuisibles aux cultures végétales par
des manipulations génétiques, une méthode connue comme
« lutte autocide » ou un « contrôle
génétique des insectes nuisibles » (23).
En se basant sur les travaux du généticien
H.Mueller, qui a provoqué des mutations létales dominantes dans
les chromosomes de Drosophila melanogaster, « Knipling » et
ses collègues ont montré que des faibles doses de radiation sont
capable de stériliser les insectes. Son modèle comprend une
colonisation et un élevage en masse de l'espèce cible, sa
stérilisation et sa dispersion dans les champs. Si les mouches
stériles l'emportent largement en nombre sur les mouches
fécondes, la population des mouches sauvages est rapidement
anéantie. La proportion des mouches stériles par rapport aux
mouches sauvages fertiles doit être d'au moins 10 pour 1.
Dans les champs, les mâles trouveront et s'accoupleront
avec les femelles fertiles leur transférant ainsi leur sperme
stérile. On obtient des descendants non viables, causant de cette
façon une réduction dans la population naturelle de l'insecte
nuisible. Au début de l'année 1950, dans son essai dans les
champs contre la mouche screwworm en Floride et Curaçao, la
validité de ce modèle a été
démontrée.
II.5.3. Bases génétiques de la
stérilité
La technique des insectes stériles a comme cible les
femelles sauvages dans les champs. Les femelles déterminent la dimension
de la population de la génération suivante. Par
conséquent, la stérilité est introduite seulement dans la
population sauvage à travers les mâles stériles. Ainsi les
mâles sont l'agent actif de la technique des insectes stériles.
II.5.3.1. Processus de la
stérilisation
Le processus de stérilisation doit être
sélectif et spécifique à la population cible.
Le traitement doit affecter seulement les cellules reproductrices
tout en gardant l'insecte viable et capable de rivaliser dans les champs.
L'exposition des cellules germinales aux radiations ionisantes
cause des mutations létales dominantes dans la progéniture de la
mouche irradiée (1).
L'irradiation des jeunes pupes de la Cératite permet
d'obtenir des adultes stériles à l'émergence.
Les doses de 80 à 100 Gray provoquent un niveau
élevé de stérilité chez les mâles. Les
femelles sont sensibles à des doses d'irradiation inférieures
à celles des mâles. En effet, à des doses de 40 Gray, on
obtient des femelles stériles.
II.5.3.2. Conséquences génétiques de
l'irradiation
Bien que quelques mutations létales dominantes
causées par l'irradiation soient des mutations seulement dans les
unités génétiques (gènes), on croit que la
létalité provient du fait que des parties des chromosomes sont
perdues, se sont dupliqués ou ont subis une translocation. Ce
déséquilibre des chromosomes est engendré par la radiation
ionisante causant la fragmentation des chromosomes (25)
(Figure 5).
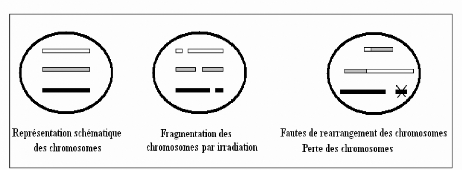
Figure 6 : Les conséquences
génétiques de l'irradiation (25)
Lors de la fécondation de la femelle par le mâle
irradié, les chromosomes fragmentés sont transmis aux cellules
causant un matériel génétique
déséquilibré. Ainsi, lors de l'embryogenèse, les
duplications et les délétions des chromosomes vont
révéler des embryons qui vont finir par mourir.
II.5.4. Base génétique des souches à
sexage génétique :
Puisque seulement les mâles irradiés transmettent
la stérilité désirée à la population cible,
et comme pour le plus part des espèces les mâles et les femelles
sont morphologiquement semblables, des souches à sexage
génétique ont été développés pour
pouvoir séparer les deux sexes lors de l'élevage et de ne
lâcher que des mâles qui sont l'agent actif de la
stérilité.
II.5. 4.1. Cytologie de la Cératite :
La mouche méditerranéenne des fruits contient 6
paires de chromosomes incluant la paire de chromosomes du sexe. Quatre
autosomes sont métacentrique ou submetacentrique et une paire est
acrocentrique. Les chromosomes du sexe sont subtelocentrique.
II.5.4.2. Les mutations génétiques
:
Pour rendre la technique de l'insecte stérile plus
efficace et plus économique, on s'est basé sur une approche
génétique pour pouvoir séparer les mâles des
femelles lors de l'élevage en masse de la Cératite.
Une mutation sur la couleur des pupes : wp (white
pupae : pupe blanche) et une deuxième mutation (temperature sensitive
lethal) : tsl (26) sont utilisés comme
marqueurs de sélection. Ces mutations sont induites sur le chromosome
5.
Philippe Kerremans et Gerald Franz (1993) (26)
ont pu déterminer la position de ces mutations sur le chromosome 5 en
construisant la carte cytogénétique de ce dernier (Figure 6).
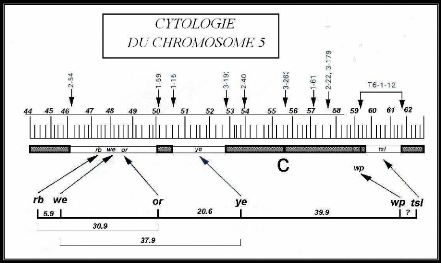
Figure 7: Carte cytogénétique du chromosome
5 de la Cératite.
D'autres marqueurs de sélection sont également
utilisés lors du sexage génétique des souches de la mouche
méditerranéenne des fruits tel que la sensibilité des
larves à la purine, la sensibilité différentielle (une
mutation Adh (Alcool deshydrogénase)) à l'alcool et la
couleur des pupes noire / brune (26).
II.5.4.3. Les souches à sexage
génétique :
Parmi les souches à sexage génétique il
y'a ceux dont on a réalisé une liaison entre l'autosome portant
le gène des marqueurs de sélection (mutation tsl et
wp) avec le chromosome du sexe mâle (chromosome Y).
L'allèle dominant du type sauvage des marqueurs de sélection est
lié au chromosome Y suite à une translocation provoquée
par irradiation.
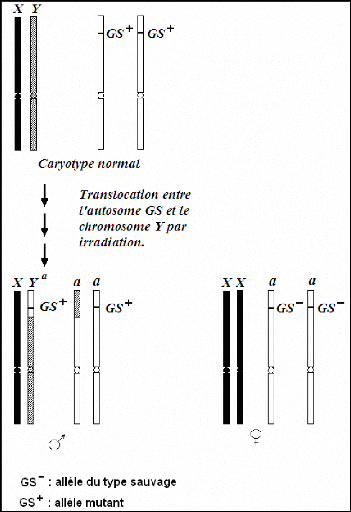
Figure 8 : Structure du chromosome des souches à
sexage génétique (26).
Dans les souches à sexage génétique, en
se basant sur ce mécanisme, les mâles sont de phénotype
sauvage (tsl/wp+ : pupe brune/résistant à la température)
et les femelles sont mutantes (tsl+/wp : pupe de couleur blanche/non
résistant à la température).
II.5.5.Milieu de développement
larvaire
II.5.5.1. Milieu d'élevage standard
Le milieu d'élevage présente la composante la
plus importante pour un élevage de masse destiné à faire
des lâchers en plein champ. Par conséquent, le souci majeur de
l'élevage de masse est d'améliorer les performances des insectes
produits tout en réduisant le coût de leur élevage. Le
milieu d'élevage adopté à l'unité est celui de
Tanaka (1969).
|
Type de milieu
|
Composition
|
|
Son de blé
|
28%
|
|
Sucre
|
12%
|
|
Levure Torula
|
7%
|
|
Benzoate de sodium
|
0.2%
|
|
HCL
|
1%
|
|
Eau
|
50%
|
Tableau 8. Milieu d'élevage de la
cératite (Tanaka 1969)
Tableau 9: Quelques milieux d'élevage
essayés dans certains programmes de lutte contre la Cératite
dans
le monde
|
Type de
milieu
|
Composition
|
Unité d'élevage
|
|
Son de blé 26 %
|
|
|
Sucre ...12%
|
|
|
Milieu Tanaka
|
Levure Torula 3,6 %
|
Unité d'élevage
|
|
(Tanaka et al,
1970).
|
Benzoate de sodium 0,1 %
Methyl-p-hydroxy benzoate 0,1%
|
Waimanalo et California
à Hawaii.
|
|
Eau .58 %
|
|
|
Methyl-p-hydroxy benzoate .0.1%
|
|
|
Sucre granulé 12%
|
|
|
Milieu à cane
|
Levure Torula (type B) 9%
|
|
|
à sucre
|
HCl concentré 1%
|
Unité d'élevage El Pino
|
|
bagasse
|
Eau 56%
|
au Guatemala.
|
|
Cane à sucre bagasse 13%
|
|
|
Farine .6%
|
|
|
Methyl-p-hydroxy benzoate ...0.6%
|
|
|
Sucre granulé .10%
|
Unité d'élevage Metapa
|
|
Levure Torula (type B) 9%
|
de Dominguez, Chiapas
|
|
Milieu à
|
HCl concentré ...0.7%
|
au Mexique.
|
|
betterave à
|
Eau .60%
|
|
|
sucre bagasse
|
Betterave à sucre bagasse .11,5%
|
|
|
Son de blé ...8%
|
|
II.5.5.2. Milieu d'élevage liquide
L'élevage de la mouche méditerranéenne
des fruits, en employant un milieu liquide a été un objectif
à réaliser pour des programmes d'élevage de masse de
mouche de fruit pendant les trois dernières décennies. A cause de
l'anatomie buccale de la cératite et de ses fonctions (la succion),
convertir le milieu de développement d'un régime solide à
base de son de blé à un régime liquide pourrait en effet
présenter une multitude d'avantages, ces avantages ont été
constatés surtout au niveau du premier et du deuxième stade de
développement de la mouche. Toutefois la mortalité
élevée et le bas rendement ont été rapportés
dans quelques études (Halanda 1976, Brunissent et La Neige 1978, Letardi
et Caffarelli 1990) (27).
Le milieu de développement larvaire de la mouche
à fruit basé sur l'utilisation du son de blé
utilisé actuellement au Département d'Agriculture des Etats Unis
(USDA) a été exécuté pendant plus de 30 ans et
excepté les changements mineurs (principalement dans les agents
nutritifs), ce milieu est employé dans le monde entier pour
l'élevage de masse de la mouche. Ce milieu contient du son de blé
qui présente pour les jeunes larves le rôle d'un substrat de
soutien aussi bien que certaines autres valeurs nutritives. Cependant, ce type
de milieu conventionnel présente quelques problèmes liés
à l'absorption de l'eau, la contamination par les champignons, le
coût de la production, la gestion (disposition, malaxage et nettoyage du
plateau), le stockage, l'espace, etc. Toutefois un milieu de
développement basé sur un liquide et fait d'un système
recyclable de substrat, pourrait diminuer plusieurs de ces problèmes
énumérés ci-dessus et réduirait le coût de
production global (27).
Le milieu est composé de levure de brasseur, de sucre,
d'agents antifongiques (benzoate de sodium et de Nipagine), d'acide citrique,
et d'eau distillée. Le tissu d'éponge placé à la
base des plateaux a été employé comme
élément de soutien pour des larves, substituant ainsi le
rôle de son de blé comme substrat dans le milieu traditionnel.
L'élevage larvaire de la Bactrocera Cucurbitae
Coquillett (la mouche du melon) sur ce type de milieu a eu comme
conséquence :
· Une production de moins de 20% de pupes
· Un poids de pupe inférieur de 10% par rapport
au milieu conventionnel, tandis que la densité, l'émergence des
adultes et les insectes adultes n'ont montré aucune anomalie
significative.
· La productivité en pupes a augmenté avec
des concentrations en levure jusqu'à 14.2%.
Les avantages d'un élevage à base d'un milieu
liquide incluent la réduction dans le coût de production, la
suppression du son de blé (qui risque d'être contaminé par
les pestes et les champignons) la réduction de l'espace de stockage et
du travail consacré (27).
Ces avantages et ces réductions du coût de
production doivent être pris en considération surtout lorsque
l'élevage passe à une grande échelle de production de
mouche stériles dans le cadre d'un programme de lutte.
- CHAPITRE 4 -
La Radiation Ionisante
I. Procédure d'irradiation des
pupes
L'effet des rayonnements gamma varie selon le stade de
développement de l'insecte. Pour les mouches des fruits, il est plus
facile d'irradier l'insecte durant le stade pupe que durant le stade adulte. Il
est important lors du choix de la période d'irradiation de
considérer les effets sur les cellules sexuelles et somatiques. Pour des
pupes jeunes, une dose plus faible peut induire une stérilité
satisfaisante, mais avec des effets somatiques néfastes, qui auront des
conséquences sur la qualité des insectes produits. Des doses plus
élevées par contre n'ont pas d'effets néfastes sur le
soma, mais donnent des taux de stérilité réduits.
Il existe notamment des différences d'effet du
rayonnement selon le sexe. Les femelles sont plus radiosensibles que les
mâles, mais cette radiosensibilité diminue à un jour de
l'émergence. La dose d'irradiation dépend donc de l'âge des
pupes. Les meilleurs résultats sont obtenus avec des pupes avant un
à deux jours de l'émergence (pupes mâles).
Les pupes de la souche à déterminisme sexuel
génétique irradiées à trois jours de
l'émergence donnent des adultes de très mauvaise qualité,
alors que celles irradiées à moins de 24 heures de
l'émergence donnent un pourcentage de stérilité
très élevé qui doit être vérifié.
II. Dose d'irradiation II.1
.Introduction
La dose absorbée qui est utilisée pour induire
la stérilité est d'importance maximale dans un programme de lutte
autocide contre la Cératite qui se base sur le lâcher des
mâles stériles, si la dose est élevée, la
stérilité atteint son maximum mais la qualité et la
compétitivité diminueront (28).
Les insectes qui reçoivent des faibles doses ne sont
pas suffisamment stériles et ceux qui reçoivent des doses
élevées seront moins compétitifs et donc l'optimisation du
processus de stérilisation est nécessaire pour équilibrer
le niveau de stérilité et la compétitivité
(29)
II.2.Facteurs modifiants la sensibilité de
l'insecte à l'irradiation La sensibilité des insectes
aux rayons ionisants dépend de plusieurs paramètres :
II.2.1.Facteurs physiques et environnementaux
a. Atmosphère ambiant
Le niveau de l'oxygène affecte la sensibilité
des insectes à l'irradiation (30). Les
dégâts causés par l'irradiation sont minimes lorsque le
radio traitement est effectué dans un milieu à faible taux
d'oxygène, donc l'atmosphère joue un rôle important dans
l'amélioration de la stérilité et la
compétitivité dans un programme TIS (29).
b. Température
L'irradiation à des températures faibles
augmente la résistance des insectes aux rayons ionisants. Une
température fraîche (20 à 25°C) avec une certaine
limite et hypoxie réduit le taux métabolique et par
conséquent le taux de développement des insectes pendant
l'irradiation (29).
II.2.2.Facteurs biologiques
Les cellules les plus sensibles à l'irradiation sont
ceux qui sont en pleine division donc les cellules qui ont un caractère
primitif. Généralement l'irradiation cause des
dégâts chromatiques qui sont à l'origine des mutations
mortelles dominantes, ces dernières qui se produisent au niveau des
cellules germinales ne causent pas le dysfonctionnement du gamète mais
la mort de l'oeuf fécondé ou l'embryon en voie de
développement.
Les premières étapes de la spermatogenèse
(spermatocyte et spermatogonie) sont généralement plus sensibles
aux rayons ã que les étapes les plus tardives (spermatides).
Poverbs (1969), Dey et Manna (1983) trouvent que les chromosomes
en métaphase et en anaphase I étaient plus sensibles aux rayons
ã que ceux dans les autres étapes (31) ;(29).
II.2.3.Fractionnement de la dose
Les effets inverses de l'irradiation paraissent en
général êtres à moindre impact, cela peut être
fait par l'utilisation d'un débit de dose inférieur et plus long
d'application pour une seule irradiation (32).
Pour conserver la qualité de l'insecte, il faut
fractionner la dose c'est-à-dire que la dose stérilisante doit
être délivrée au cours temps avec une série de
faibles expositions aux radiations ionisantes (29).
II.2.4.Age et stades de développement
L'âge et les stades du cycle de vie de l'insecte sont
deux paramètres importants qui sont pris en considération dans un
programme de lutte contre un ravageur par l'utilisation de la TIS. Les pupes
âgées ont tendance d'être plus radio résistantes que
les pupes jeunes (29) ;(33).
II.2.5. Sexe
En ce qui concerne les deux sexes, les femelles sont en
général plus sensibles au radio traitement que les mâles
(34). Mais il y a des exceptions, par exemple, chez les
Hémiptères, Pyrrhocoidae, Piesmidae et certains
Coléoptères les mâles sont plus radio sensibles que les
femelles.
Une variation de point de vu radio sensibilité entre
mâle et femelle est due aux différences au niveau de la
maturité d'oocytes. Par exemple, l'irradiation des pupes femelles de la
Cératite deux jours avant l'émergence ou plus, entraîne
l'arrêt de la production des oeufs même pour des doses
inférieures à celles stérilisant des mâles. Mais si
l'irradiation est faite un jour avant l'émergence, les femelles
contiennent plus d'oocytes croissants qui vont terminer leur maturation
même si l'irradiation est faite à des doses stérilisantes
pour les mâles (29).
II.2.6. Taille et poids
Les espèces dont les adultes sont de grandes tailles sont
plus sensibles à l'irradiation que ceux dont les adultes sont de petites
tailles.
L'expérimentation a montré que Periplaneta
americana est stérilisée à certaines doses alors que
les insectes de petite taille tel que Drozophila, Habrobracon et Triboluim sont
résistants. Il y a une corrélation entre la taille, le poids et
la radiosensibilité (29).
II.2.7. Stade nutritionnel
Le stade nutritionnel peut être influencé par la
radiosensibilité chez certains insectes. Exemple, pour avoir 100% de
stérilité d'Amblyomma americanum (mâle et femelle) on
utilise une dose de 10 Gy avant engorgement et 24 Gy après engorgement
(29).
II.2.8.Facteurs supplémentaires
- L'état d'hydratation de l'insecte ou son degré
d'humidité peut influencer potentiellement les effets de
l'irradiation.
- Les différences génétiques reliées
à la diversité géographique de l'espèce peuvent
affecter potentiellement la radiosensibilité de l'insecte (29)
;(35).
III. Radiosensibilité de la
Cératite
Ceratitis capitata ou mouche
méditerranéenne des fruits appartient à l'ordre
Diptère et la famille de Tephritidae. La dose de stérilisation de
cet ordre varie entre 20 et 160 Gy (29).
Les familles de Drosophilidae et Agromyzidae sont parmi les
familles les plus résistantes à l'irradiation alors que la
famille de Tachnidae est la plus sensible. Le stade
préféré de l'irradiation est le stade pupe.
La famille de Tephritidae est la majeure famille dans cet
ordre à laquelle on a appliqué la TIS. Cette famille est
relativement homogène en ce qui concerne la sensibilité à
l'irradiation, c'est pour cela au moins 100 Gy est exigé pour accomplir
la stérilité complète pour les cinq genres les plus
majeurs (Bactrocera, Cératitis, Amastrepha, Dacus, Rhagoletis)
(36). Beaucoup de programmes appliquant la TIS contre la
famille de Tephritidae utilisent des doses variant entre 100 et 150 Gy pour la
stérilisation, c'est une précaution pour augmenter la marge de
stérilité. Mais ces doses ont souvent baissé la
compétitivité et la capacité totale d'aptitude au vol des
mouches irradiées et donc la transmission de la stérilité
à la population sauvage (37). Dans les programmes les
plus récents, ces hautes doses sont habituellement associées avec
l'usage d'hypoxie pour rehausser la compétitivité des mâles
stériles.
IV. Effet de l'irradiation sur la
qualité
Pour plusieurs groupes d'insectes, l'irradiation provoque une
réduction de la compétitivité. Récemment, plusieurs
travaux ont visés à éliminer cet effet négatif. En
plus, cet effet est influencé par plusieurs facteurs tels que
l'étape de développement de l'insecte, l'atmosphère
utilisée pendant l'irradiation et la dose de l'irradiation. Normalement,
le minimum des dégâts causés par l'irradiation sur les
mâles adultes est obtenu quand l'irradiation est portée peu
après émergence mais le problème est que l'irradiation
d'un grand nombre d'insectes adultes est souvent impraticable et difficile
à réaliser, par conséquent on irradie en stade pupe peu
avant l'émergence. Pour la mouche méditerranéenne des
fruits, le
développement des pupes est déterminé par la
couleur des yeux ainsi on peut déterminer le stade optimal pour
l'irradiation (38).
L'irradiation crée des radicaux libres qui affectent la
qualité des insectes. Si on exclu l'oxygène en traitant les
récipients des pupes par de l'azote liquide, l'impact de ce
problème est réduit. Plus tard, Robinson (1975) a
découvert que quand les récipients sont scellés, les pupes
épuisent l'oxygène rapidement et produisent l'anhydride
carbonique, ainsi l'hypoxie résultante a fourni une protection
semblable.
Pour plusieurs insectes, les femelles seront 100%
stériles à des doses inférieures à celles des
mâles. Mais pour atteindre 100% de stérilité chez les
mâles on doit augmenter la dose par conséquent la qualité
sera diminuée donc il est obligatoire de réduire la dose pour
obtenir sur le terrain un mâle plus compétitif et une meilleure
énumération des femelles stériles
(37).
Pour les Lépidoptères et
Hétéroptères, les très hautes doses d'irradiation
sont exigées pour induire des mutations mortelles dominantes à
cause de la structure des chromosomes. Mais pour d'autres groupes, des doses
inférieures peuvent être utilisées et les mâles
traités ont un haut degré de stérilité.
- CHAPITRE 5 -
Etude de la compétitivité sexuelle
I. Définition
Elle détermine l'aptitude des mâles
stériles à entrer en compétition avec les mâles
sauvages et à s'accoupler avec des femelles sous des conditions semi
contrôlées. Ceci est réalisé par l'analyse du nombre
d'accouplements des mâles sauvages et stériles avec les femelles
sauvages (39).
L'aptitude à l'accouplement a été
définie comme étant la proportion des femelles qui s'accouplent
et qui représentent un indicatif de la tendance des mouches à
l'accouplement.
II. Durée d'accouplement
La durée de la copulation peut être une
indication sur l'adaptation de la souche dans le Laboratoire et peut avoir un
rapport avec la qualité de sperme et les glandes accessoires fluides
transférés aux femelles. Cependant une courte durée
d'accouplement des mâles stériles, relativement à celle des
mâles sauvages en copulation avec le même type de femelle, doit
être contrôlée et peut corréler avec d'autres
données.
Les mâles d'élevage de masse ont tendance à
réduire le temps de copulation en comparaison avec les mâles
sauvages (39).
III. Durée de la parade nuptiale chez le
mâle (Male calling time)
Le comportement sexuel avant accouplement (parade nuptiale) ou
la libération de phéromones pour attirer les femelles, est une
étape critique pour le mâle afin d'assurer la copulation. Dans la
cage, le nombre de mâles stériles observés en copulation
doit être typiquement plus élevé que le nombre de
mâles sauvages.
L'incidence d'accouplement est une composante de l'aptitude
d'accouplement, et une faible incidence d'accouplement entre les mâles
stériles peut traduire une faible qualité et viabilité des
mouches.
Les mâles stériles peuvent aussi mal participer
à l'accouplement malgré l'incidence relative élevée
d'accouplement qu'ils possèdent.
La durée d'accouplement peut être
évaluée par le calcul du temps au cours duquel les mâles
sauvages et stériles sont observés en copulation.
L'aptitude des mâles à attirer les femelles peut
être estimée par l'utilisation d'un auxiliaire "le test de
compatibilité de phéromones".
IV. Compétitivité sexuelle chez la
Cératite
Chez la Cératite, les mâles commencent par
choisir un micro habitat convenable pour la parade nuptiale, notamment
l'émission de la phéromone qui attire les femelles.
Généralement, ils choisissent la partie inférieure de la
feuille.
Les mâles effectuent parfois cette parade en formant ce
qu'on appelle le "leks" comparable à celui de certains
vertébrés (40). Quand la femelle s'approche, le
mâle initie un rituel qui consiste à secouer la tête et
à balancer les ailes (41). Si la femelle est
réceptive la copulation aura lieu.
Les femelles peuvent quitter le lieu où se
déroule ce rituel à n'importe quel moment. Même
après avoir accepté le mâle, les femelles peuvent
abandonner le substrat et rejettent le mâle avant que la copulation n'ait
lieu.
Avec ce système d'accouplement ou de comportement
sexuel des divergences minimes dans le comportement sexuel des mâles
stériles peuvent réduire la compétitivité.
Certaines recherches ont montré que les femelles sauvages de la
Cératite s'apprêtent plus à s'accoupler avec les
mâles sauvages qu'avec les mâles stériles .Par contre,
d'autres essais qui ont été fait sur terrain ont montré
que la stérilité induite chez la Cératite donne une
compétitivité de 10 % supérieur à celle des
sauvages (41).
Les interactions des mâles et des femelles entre 3
souches sauvages d'élevage de la mouche méditerranéenne
des fruits C. capitata (wiedemann) ont été étudiées
et observées par Lance et al. (2000) (42), à
Hawaii et Guatemala dans des cages contenant des plants hôtes.
Pour cette série d'expériences, il a
été démontré que les interactions entre mâles
et femelles stériles sont de l'ordre de 36 % de l'ensemble des
interactions observées, alors que seulement 18 % des interactions ont
été marquées entre mâles et femelles sauvages.
Les
interactions des mâles sauvages avec des femelles stériles
et des mâles stériles avec des femelles sauvages étaient
chacune de l'ordre de 23 % du total.
Suite aux observations faites sur les appels (calling) des
mâles stériles qui étaient actifs et leur participation aux
agrégations d'accouplement, Shelly et al. (1994) (43)
ont suggéré que la faible compétitivité de
ces derniers a été due à la réduction de leur
aptitude à attirer les femelles sauvages au cours de la parade
nuptiale.
Dans les cages, le nombre de mâles observés
entrain d'appeler les femelles (calling) était similaire ou
légèrement supérieur à celui des mâles
sauvages. L'aptitude des mâles
stériles à attirer les femelles à leurs
alentours, apparaît comparable (ou s'approche) de celle des mâles
sauvages (41).
En plus, la distribution randomisée des interactions
observées entre les mouches sauvages et stériles suggère
que les mâles stériles comme les sauvages étaient capables
d'attirer les femelles sauvages ainsi que les femelles stériles.
Durant les observations faites, les comportements de la parade
nuptiale (courtship behavior) des mâles sauvages et stériles
apparaissent qualitativement similaires.
Aussi, on a détecté des différences
qualitatives pour le comportement des femelles pendant la parade ; en effet,
les analyses de la parade, ont détecté des différences
entre les mâles stériles et sauvages en relation avec la
fréquence et la durée de certains composants de la
séquence de la parade .
De la même manière, Heath et al. (1994)
(41) ont détecté des différences
quantitatives de la libération des quatre composants majeurs de
phéromones de C. capitata entre les mâles sauvages à
déterminisme sexuel génétique et irradiés.
Il est possible que la phéromone produite par les
mâles stériles soit adéquate pour attirer les femelles
sauvages à leurs alentours, mais moins que l'optimal durant la
parade.
Quelque soit la cause, les taux faibles d'acceptabilité
(acceptation) des mâles stériles pour les femelles sauvages,
réduisent le rendement de l'efficacité du coût du programme
TIS (44).
DEUXIEME PARTIE
JkatU~ie(ô et JkUt~wdeô

- CHAPITRE 6 -
Matériels et méthodes
I. Matériel biologique
Dans nos essais nous avons utilisé :
- une souche de Cératite à sexage
génétique VIENNA 8 (tsl+, wp+).
I.1. Les étapes de l'élevage massif de la
souche à sexage génétique de la
Cératite:
I.1.1. Système d'élevage au
filtre
Le système d'élevage au filtre adopté par
l'unité pilote de Sidi Thabet représente la solution pour
éviter l'accumulation des individus recombinants et assurer leur
élimination. L'élevage au niveau du filtre se fait dans un seul
sens, aucun insecte ne revient au filtre et la colonie au niveau du filtre est
appelée "colonie mère".
La 1ère étape de l'amplification est
appelée colonie d'initiation, elle aura pour rôle d'amplifier la
colonie mère et donc d'initier le filtre. La 2ème étape de
l'amplification est appelée colonie d'injection qui va alimenter les
colonies de production. La dernière étape est la colonie de
lâcher dont les oeufs seront traités par la chaleur. Cette colonie
va donner seulement des mâles pour le lâcher.
Dans le filtre, le recyclage de la colonie a lieu seulement au
niveau de la colonie mère. Cette dernière doit donc être
maintenue sous des conditions minimales de stress pour éviter au maximum
l'accumulation des recombinants.
Le système d'élevage du filtre comprend les
différentes étapes de l'élevage en masse mais sur un
modèle plus réduit ; ces dernières sont effectuées
dans des salles où les conditions sont bien respectées.
La 1ère tâche débute par la séparation
des pupes mâles brunes des pupes femelles blanches et choisir celles de
bonne qualité et de bon calibre (Figure 8).

Figure 9:Séparation des pupes
Ces pupes sont mises dans des alvéoles avec un volume
bien déterminé (150 ml pupes femelles et 50 ml pupes mâles)
jusqu'à émergence, sous une température de 24 °C et
une humidité relative de 75%.

Figure 10:Mise des pupes dans les bouteilles pour
émergence.
Après émergence, les recombinants qui sont soit
des femelles issues des pupes brunes, soit des mâles issus des pupes
blanches sont éliminés. L'élimination concerne aussi les
pupes non émergées, demi émergées et les adultes
déformées.
Les adultes restants sont vidés dans une cage avec un
rapport de 1:1 (un mâle pour une femelle), tout en évitant le
stress au cours de l'élevage. Chaque cage présente une source de
nourriture avec les proportions suivantes : 2/3 sucre et 1/3 levure
hydrolysée. La cage est ensuite mise dans la chambre d'élevage
à une température de 24 °C et une HR de 75 %. Dans ces
conditions, les femelles sont excitées et la ponte est favorisée.
Pour récupérer les oeufs, deux bacs en inox, remplis d'eau, sont
placés de part et d'autre de la cage (Figure 10).

Figure 11: Récupération des
oeufs
.
Les oeufs collectés sont ensemencés sur un
milieu d'élevage bien déterminé. Après
éclosion et arrivant au stade L3, les larves effectuent leur saut
larvaire caractéristique, dans la sciure de bois où se fait la
pupaison à une température de 20-22 °C et HR 70%.

Figure 12: Saut larvaire caractéristique des L3
dans la sciure de bois
.
II. Elevage de masse de la
cératite
L'unité pilote d'élevage de la cératite
présente un travail cyclique qui se déroule dans plusieurs
salles, chaque salle est caractérisée par des conditions
spécifiques de température et d'humidité relative. Ces
conditions sont citées dans le tableau qui suit :
|
Salle
|
Température (°C)
|
Humidité relative (%)
|
|
Contrôle de qualité
|
24
|
70
|
|
Initiation
- Lâcher + injection -
Mâle
|
22 à 25
28 à 30
|
70
|
|
Larves
|
17
|
75
|
|
Pupes
|
20 à 22
|
70
|
Tableau 10: Conditions de température et
d'humidité dans la salle d'élevage [15]
Filtre

Sélection individuelle entre les males et
les
femelles

OEufs
collecte journaliére

Oxygénation
Injection & Lâcher

Éclosion des oeufs et libération
des
mouches

OEufs
collecte journaliére

Oxygénation

Éclosion des oeufs et libération
des
mouches

OEufs
collecte journaliére

Oxygénation
24h à 34°c


Irradiation
Chargement des
cages




Pupaison
Ensemencement
Maturation des larves
Collecte des larves



Chargement des
cages

Ensemencement

Maturation des larves

Collecte des larves

Pupaison

Séparation des pupes

Maturation des pupes

Maturation des pupes

Ensemencement


Maturation des larves Collecte des
larves


Pupaison
Maturation des pupes


Figure 13: Le système d'élevage
adopté à l'UPMS
II.1 Les étapes de l'élevage
massive
II.1.1 Préparation de milieu d'élevage a.
Milieu d'élevage standard
|
Type de milieu
|
Composition
|
|
Son de blé
|
28%
|
|
Sucre
|
12%
|
|
Levure Torula
|
7%
|
|
Benzoate de sodium
|
0.2%
|
|
HCL
|
1%
|
|
Eau
|
50%
|
Tableau 11: Milieu d'élevage de la
cératite (Tanaka 1969)
La quantité du milieu à préparer pour chaque
colonie est déterminée selon la formule suivante :
Nombre de plateaux Mâles = Nombre de ml d'oeufs
mâles produits / 8
Nombre de plateaux Injection = Nombre de ml d'oeufs
Injection produits / 4
Nombre de plateaux Lâcher = Nombre de ml d'oeufs
Lâcher produits / 4
Les ingrédients du milieu sont pesés en
respectant les pourcentages indiqués dans le tableau et
mélangés dans le malaxeur. Après malaxage,
vérification de la texture du milieu ; la valeur admise du pH varie
entre 3.2 et 3.8.
Une vis sans fin assure l'entraînement du milieu vers la
salle d'ensemencement, où il sera réparti à raison de 5 kg
/ plateau.
b. Essai d'un milieu d'élevage liquide
+ Protocole expérimental
Ce type de milieu est utilisé pour la première fois
en Tunisie, et pour tester son efficacité, une comparaison avec le
milieu standard s'avère nécessaire :
|
Type de milieu
|
Composition
|
|
Levure de brasseur
|
15.06%
|
|
Sucre
|
8.99%
|
|
Benzoate de sodium
|
0.15%
|
|
Nipagine
|
0.15%
|
|
Acide Citrique
|
1.70%
|
|
Huile de germe de blé
|
0.15%
|
|
Eau
|
73.81%
|
Tableau 12: Milieu d'élevage liquide de la
cératite
En effet le prototype expérimental envoyé du
Département de l'agriculture des Etats Unies l'USDA-ARS était
composé de : un récipient plastique, une bouteille de germe de
blé, une sachet de sucre, une sachet d'acide citrique, un mélange
de levure et de produit chimique et de deux éponges.

a
d
b
c
f
e
h
g
a.Récipient plastique b.Filet en plastique c.Germe
de blé d.Sucre e.A.citrique f.Levure et Nipagine g et h. Deux
éponges
Figure 14: Les composants du kit
expérimental
Après avoir mélangé tous les composants
ensemble et avant de verser le milieu dans le récipient, un ajustement
de l'acidité avec quelques goûtes d'acide chlorhydrique doit
être fait pour atteindre un pH de 3,5 (Figure 14) optimal pour le
développement des larves.

Figure 15: Mélange des composants et ajustement du
pH
Par la suite, le mélange est versé dans le
récipient et une quantité de 1 ml d'oeufs sera ensemencée
sur la petite éponge supérieure où les oeufs se
développeront après éclosion (Figure 15).

Figure 16:Préparation du milieu et ensemencement
des oeufs
Parallèlement, et pour pouvoir juger
l'efficacité de ce milieu liquide, un milieu témoin avec les
composants standards est préparé et ensemencé par la
même quantité des oeufs (Figure 16).

Figure 17: Préparation du milieu
standard
Trois répétitions de chaque type de milieu ont
été réalisées ; ces essais seront par la suite
incubés dans une étuve à 23°C pendant 6 jours pour le
développement des trois stades larvaires. Vers le septième jour
ces milieux sont déplacés vers la salle de collecte des larves
où ces derniers effectueront le saut larvaire dans la sciure de bois.
· . Collecte des données
· Contrôle de la qualité
Les pupes issues de ces deux milieux vont subir certains tests de
contrôle de qualité afin de pouvoir affirmer le plus performant
des deux, les tests subis sont :
- Test de sexe ratio
C'est un test qui permet de déterminer le rapport entre
le nombre des mâles et celui des femelles. Un volume de 2 ml de pupes est
pris afin de compter le nombre de pupes de chaque sexe et déterminer la
sexe ratio selon la formule suivante :
% de pupes femelles = Nbr de pupes femelles/Nbr total des
pupes * 100
% de pupes mâles = 100 - % de pupes
femelles
- Test d'aptitude au vol
L'aptitude au vol est un paramètre très important
dans l'étude de l'activité de la souche. Ce test consiste
à contrôler la capacité des adultes de voler.
On effectue trois répétitions, chaque
répétition consiste à mettre 100 pupes (T) de chaque sexe
dans un cylindre noir qui contient du papier filtre noir avec du papier en
accordéon afin d'accorder aux mouches de l'espace pour
se déployer les ailes. On met du talque sur le contour du cylindre. Les
cylindres sont mis dans une cage d'aptitude au vol (T°= 25°C et HR=
60%) et les mouches émergées étant
régulièrement aspirées.
La lecture des résultats se fait après 72
heures. On compte le nombre des adultes non émergés (A), demi
émergés (B), déformés (C) et émergés
non effectuant le vol (D) puis on fait la moyenne des trois
répétitions.
% du vol = [T- (A+B+C+D)]/100
- Test d'émergence
Ce test consiste à calculer le pourcentage
d'émergence des adultes pour contrôler leur capacité
d'émergence lors du lâcher dans la nature.
La procédure de ce test est la même que celle
utilisée pour le test d'aptitude au vol sauf qu'on compte seulement le
nombre des adultes non émergés (A) et demi émergés
(B).
% d'émergence = T- (A+B) / 100
- Test de poids des pupes
Ce test est utilisé pour la détermination de la
qualité des mouches destinées au lâcher. Il consiste
à faire trois prélèvements de 2 ml chacun, on compte le
nombre des pupes et on les pèse à l'aide de la balance de
précision. On calcule le poids d'une pupe et le poids moyen des trois
prélèvements. On dégage ainsi le nombre moyen des pupes
par millilitre.
II.1.2. Collecte et préparation des oeufs
:
Les adultes de la mouche des fruits sont logés dans des
cages rectangulaires de cadre métallique avec quatre faces
revêtues de moustiquaires.
Les cages sont gardées durant une quinzaine de jours
à une température de 23°C #177;1 et à une
humidité relative de 70%. La lumière est fournie par un tube
fluorescent fixé au plafond ou à proximité des cages.
L'eau est introduite par l'intermédiaire des éponges
imbibées d'eau par capillarité. Pour l'alimentation des adultes,
un mélange de sucre et de levure hydrolysée « yeast
hydrolysat enzymatic » à raison de 3/1 est placé à
l'intérieur de la cage.

Figure 18. Les cages d'émergence, de maturation
et de copulation des mouches
Une fois matures, les femelles s'accouplent avec les mâles
et pondent leurs oeufs à travers les mailles des cages.
Les oeufs pondus tombent sous l'effet de la pesanteur dans des
bacs remplis d'eau placés sur les côtés de chaque cage et
sont collectés et comptés d'une façon volumétrique
quotidiennement.

Figure 19. Les bacs d'eau placés des
cotés des cages
Les suspensions d'oeufs sont incubées sous agitation
permanente, dans le "bubbling", à température ambiante (environ
25 °C) pendant 48 heures pour les colonies Injection et Lâcher.

Figure 20. Le bubbling
Une partie des oeufs collectés est destinée au
lâcher. Ces oeufs subissent un traitement thermique par la mise dans un
bain marie réglé à une température de 34 °C
sous une agitation permanente pendant 24 heures, c'est la colonie Mâle.
La température de la solution est réglée à
34°C pour assurer l'élimination des embryons femelles et par
conséquent, il ne reste que les mâles.
II.1.3 Ensemencements des oeufs :
L'ensemencement des oeufs sur le milieu d'élevage est une
opération journalière qui se fait pour toutes les colonies dans
la salle d'ensemencement.
Les solutions d'oeufs sont récupérées dans
une solution d'arrosage contenant du Benzoate de sodium, de l'acide HCL 32 % et
de l'eau.
Le volume de la suspension des oeufs de chaque colonie est
déterminé selon la formule
suivante : Vs = Nombre de plateaux X 50 ml
Pour chaque colonie, on indique la date d'ensemencement, le
volume total et le nombre des plateaux ensemencés sur le haut des
plateaux.

Figure 21. L'ensemencement d'une colonie
Mâle
II.1.4 Mouvements des transferts :
Juste après ensemencement, les transferts Injection et
Lâcher sont placés dans la salle d'initiation femelle à une
température de 23 #177; 1°C et une HR de 70 #177; 10%.
Les transferts mâles sont placés dans la salle
d'initiation mâle, réglée à une température
de 28 #177; 1°C et d'une humidité relative de 70 #177; 10%. Cette
température permet la dégénérescence des embryons
femelles qui peuvent résister au traitement thermique. La durée
de séjour des plateaux (transfert) dans la salle d'initiation est de
trois jours.
Les transferts seront par la suite déplacés vers
la salle de maturation où les larves auront accompli leur 1er
et 2ème stade larvaire. La température est de 21 #177;
2°C et l'humidité relative est de 70 #177;10 % pendant trois jours
jusqu'au stade larvaire L3.
II.1.5. Collecte des larves :
Une fois le 3ème stade larvaire est
accompli, les plateaux seront déplacés vers la salle de collecte.
Les larves L3 quittent le milieu en accomplissant leur saut
caractéristique dans des bacs remplis de sciure de bois.

Figure 22. Salle de collecte
II.1.6. Collecte des pupes :
La collecte des pupes se fait par simple séparation de
la sciure de bois soit par un tamis électrique soit manuellement. Les
pupes ainsi collectées sont mises dans des plateaux dont le fonds est
constitué de filet de très fines mailles afin de favoriser
l'aération des pupes.

Figure 23. Collecte des pupes dans la sciure de bois et
leur tamisage par la suite
II.1.7. Préparation des cages adultes
:
La préparation des cages d'élevage est une
opération journalière. Tous les jours,
l'opérateur doit préparer au minimum quatre cages
: une pour l'injection, une pour le lâcher et
62
Centre National des Sciences et Technologies
Nucléaires
deux pour la colonie des mâles. Ces cages vont remplacer
celles qui ont achevé leur période de ponte (environ 10
jours).
Les pupes des différentes collectes des transferts
matures sont identifiées en prenant 100 pupes de chaque collecte et en
notant la couleur des yeux de chaque pupe. Le pourcentage de couleur des yeux
doit être noté : les pupes sont considérées matures
lorsqu'on trouve 75 % de couleur marron foncé.
On établit le ratio Mâles/femelles pour chaque
collecte choisie et on calcule le volume nécessaire de chaque transfert
pour le chargement d'une cage (1.5 l de pupes mâles et 1.5 l de pupes
femelles),
Injection : Ratio Mâles / femelles 1:1
Lâcher : Ratio Mâles / femelles 1:2
Mâles : Ratio Mâles / femelles 1:3
La nourriture est préparée à raison de 2/3
sucre et 1/3 levures hydrolysées et sera répartie entre les
cages.
On met de « chamex » dans les endroits
réservés dans les abreuvoirs et remplit les tubes avec de l'eau.
Chaque plateau contenant les pupes, les abreuvoirs d'eau et la nourriture doit
être identifié par un numéro, la date de chargement et la
colonie.
III. Contrôle de la qualité :
La qualité des mouches produites dans l'unité
d'élevage doit être contrôlée conformément aux
indications données dans un manuel de contrôle de la
qualité. Ce dernier décrit les types d'essais afin de s'assurer
que les mouches stériles produites sont de bonne qualité. En
effet, le contrôle de la qualité est un outil de gestion qui
consiste à :
- Mettre en place des normes de la qualité,
- Une conformité à ces normes,
- Agir lorsque ces normes sont transgressées,
- Planifier pour l'amélioration de ces normes.
Les facteurs qui influent la qualité du produit sont de
deux types. Des facteurs d'ordre technique et des facteurs d'ordre humain. Les
facteurs humains incluent les opérateurs, les superviseurs et le reste
du personnel et ils sont de loin les facteurs les plus importants. Le but du
programme de contrôle de la qualité est de surveiller et
d'identifier ces facteurs qui généreraient une faible
qualité durant le processus de production au lieu d'essayer de corriger
cette qualité après que les insectes aient été
élevé en masse.
Le programme de contrôle de la qualité aura pour but
d'améliorer la qualité du produit ainsi que la conscience
professionnelle et de réduire les coûts de la production.

Les procédures de contrôle de la qualité
concernent les paramètres suivants : Eclosion des oeufs
Sexe ratio
Recombinants
Aptitude au vol
Emergence
Poids des pupes
IV. Radiation et Dosimétrie
L'unité de radio traitement utilisé est une
source scellée radioactive de rayon gamma contenant du cobalt 60. La
source est télescopique, constituée de deux cylindres
encastrables chacun contient 4 crayons de cobalt 60 de 45.2 cm et sont
disposés et encapsulés suivant une symétrie axiale. Le
stockage de cette source se fait à sec dans un container cylindrique
dans lequel elle a été transportée. Il est
constitué d'acier et de plomb. L'activité initiale de la source
est de 98.000 Ci.
L'unité d'irradiation est constituée d'une
cellule d'irradiation abritant la source, d'un labyrinthe, d'une salle de
commande, d'un laboratoire de dosimétrie, d'un hall de stockage des
produits ionisés et non ionisés et de chambres froides.
Les sachets sont fermés et exposés à une
dose de 110 Gy. Après irradiation des pupes colorées, les cartons
sont transportés au laboratoire de la Direction Générale
de la Protection et du Contrôle de la Qualité des Produits
Agricoles (DGPCQPA) pour la mise des pupes à l'émergence.
Les pupes sont mises de nouveau dans des sachets en Kraft dont
chacun contient 130 ml de pupes avec 8 g de sucre. On introduit du papier pour
accorder aux mouches de l'espace pour se déployer les ailes. On ferme
ainsi les paquets avec de l'agrafe. Ces paquets sont mis à une
température de 24°C. Après 48 heures, les mouches
émergent et sont prêtes à être
lâchées.
IV .1. Dose d'irradiation
L'effet des rayonnements gamma varie selon le stade de
développement de l'insecte. Pour des pupes jeunes, une dose plus faible
peut induire une stérilité satisfaisante, mais avec des effets
somatiques néfastes, qui auront des conséquences sur la
qualité des insectes
produits. Des doses plus élevées par contre n'ont
pas d'effets néfastes sur le soma, mais donnent des taux de
stérilité réduits.
IV.1.1. Protocole expérimental
Ainsi, et pour pouvoir déterminer une approximation de
la dose nécessaire d'irradiation, un test de détermination de la
stérilité chez la cératite a été
effectué où les pupes ont été exposées
à différentes doses d'irradiation 50 Gy, 60 Gy, 70 Gy, 80 Gy, 90
Gy, 100 Gy, 110 Gy, 120 Gy, 145 Gy.
Les pupes soumises à différentes doses
d'irradiation sont par la suite placées dans des bouteilles contenant
une ration alimentaire (levure +sucre) et de l'eau, deux autres bouteilles une
contenant que des pupes femelles et l'autre avec des pupes mâles non
irradiées seront placées en émergence avec ceux
irradiées dans la salle d'élevage , 3 jours après
émergence les mouches seront déplacées dans des boites
rectangulaires coupées à la base et enveloppées par une
moustiquaire avec de l'aliment et de l'eau (Figure 23).
Dans chaque boite 25 mouches mâles de chaque dose y
compris le témoin et 25 autres femelles y seront placés et cette
procédure est répétée 5 fois pour en avoir à
la fin 5 boites de chaque dose (Figure 24).

Figure 24. Les bouteilles où les mouches
émergent et mûrissent et les boites où elles seront
transférées par
la suite
Figure 25. Le transfert des mouches dans les
boites
Ces boites seront placées dans la salle
d'élevage à une température de 23°C et une
humidité relative de 75%, les mouches vont s'accoupler, et sur un petit
morceau d'éponge imbibé d'eau, recouvert d'un papier filtre noir,
les oeufs seront récoltés (Figure 25).

Figure 26. Disposition des boites et collecte des
oeufs
IV.1.2. Collecte des données
Le taux de stérilité des mâles
irradiés est déterminer par l'intermédiaire du taux
d'éclosion de leur progéniture ; ainsi les oeufs collectés
sur le papier filtre vont subir le test d'éclosion des oeufs, un test
d'observation qui consiste à vérifier l'état normal de
l'oeuf tout en déterminant le taux d'éclosion.
Les oeufs sont étalés sur le papier filtre et la
lecture de ce test se fait, sous loupe binoculaire, quatre jours après
la collecte.
B
A
D
C
A. oeuf intact B. larve C. oeuf déshydraté
D. membrane d'un oeuf éclos
Figure 27. Vu des oeufs 4 jours après ponte sous
la loupe binoculaire
Une fois les oeufs étalés, le comptage du nombre
des oeufs déshydratés, transparents, les oeufs éclos et
non éclos est effectué.
Le pourcentage d'éclosion est calculé comme suit
:
Nbr d'oeufs éclos = Nbr Tot des oeufs - Nbr
d'oeufs non éclos - Nbr d'oeufs déshydratés - Nbr d'oeufs
Transparents
% d'éclosion = (Nbr d'oeufs éclos/Nbr Tot
des oeufs)*100
V. Effet de l'irradiation sur la génération
F1 issue des mâles
traités
Généralement l'irradiation cause des
dégâts chromatiques qui sont à l'origine des mutations
mortelles dominantes, ces dernières qui se produisent au niveau des
cellules germinales ne causent pas le dysfonctionnement du gamète mais
la mort de l'oeuf fécondé ou l'embryon en voie de
développement. Malgré les dégâts causés,
certains oeufs peuvent échapper à cette létalité,
écloser et se développer même en pupe, ainsi un suivi de la
progéniture F1 de ses mouches irradiées à
différentes doses s'avère nécessaire.
V.1. Protocole expérimental
De même que le test précédent, des pupes
mâles sont soumises à différentes doses d'irradiation mises
dans des bouteilles pour émergence et les mouches mâles sont
transférées par la suite avec des femelles dans des boites pour
accouplement.
Ces boites seront placées dans la salle
d'élevage à une température de 23°C et une
humidité relative de 75%, les mouches vont s'accoupler, et une fois la
ponte est réalisée, les oeufs vont être
récupérés dans des boites de pétri remplies d'eau
sans papier filtre. Cette procédure est répétée 3
fois pour avoir à la fin 3 boites de chaque dose (Figure 27).

Figure 28. Disposition des boites et collecte des oeufs
pour ensemencement
Par la suite, un milieu mélangé à base de
son de blé est réparti dans des boites de pétri où
les oeufs collectés quotidiennement seront ensemencés (Figure
28).

Figure 29. Préparation du milieu et ensemencement
des oeufs
Les répétitions ensemencées de chaque dose
vont être mises par la suite dans une étuve à 23°C
pendant 4 jours pour assurer une éclosion, s'il y aura lieu, parfaite
(Figure 29).

Figure 30. Disposition des boites
ensemencées
Après 4 jours, ces boites sont mises
séparément sur de la sciure de bois où les larves se
transformeront en pupe.
V.2. Collecte des données
Dans chaque étape de ce test, tous les stades de
développement de la génération F 1 de ces mouches
irradiées sont suivis soigneusement.
Les oeufs, les larves ainsi que les pupes issues de chaque
répétition de chaque dose sont comptés et installés
séparément dans les salles d'élevages appropriées
(salle de collecte, salle d'élevage...), une évolution du
développement de la progéniture des mouches par rapport aux
différentes doses d'irradiation sera réalisée.
VI. Etude de la compétitivité sexuelle
de la cératite VI.1. Protocole
expérimental
Deux jours avant le test, les mouches sont marquées
individuellement selon leur type (irradiées ou non) par l'application
d'une petite quantité de peinture (gouache) sur la face dorsale du
thorax à l'aide d'un pinceau fin. L'immobilisation des mouches peut
être effectuée de deux manières, soit par leur placement
à une basse température (5°C) pendant quelques minutes, soit
sous une pochette en moustiquaire à mailles moyennes.
Figure 31. Marquage des mouches par la
gouache
Bien que le marquage des mouches par la peinture paraisse sans
effet sur la performance d'accouplement, cette application pourra endommager en
partie les ailes de la mouche et induire à une incapacité de
voler. Ainsi, on a opté pour la coloration en stade pupe par un colorant
synthétique, technique déjà utilisée pour le
marquage des mouches irradiées avant leur lâcher au champs.

Figure 32. Coloration de la cératite en stade
pupe
Immédiatement après marquage, les mouches sont
transférées dans des bouteilles contenant une source de
protéine et de sucre 1: 3, de l'eau et une aération
suffisante.
Le jour du test, soit le 5ème jour après
émergence où les mouches atteignent leur pique de maturation, 15
mâles fertiles et 15 mâles stériles sont lâchés
ensemble dans une bouteille, il faut attendre 15 à 30 minutes avant le
lâcher des femelles, le temps nécessaire pour qu'ils se dispersent
et prennent leur bonne position. Le temps de lâcher doit
précéder le temps du pic d'accouplement de ces espèces.
Les mouches doivent effectuer leurs vols toutes seuls et non forcés. Par
la suite les 15 femelles fertiles sont lâchées.

Figure 33. Déclenchement du test par la
présence des fertiles, des stériles et des femelles
Le nombre et le type de paires qui se sont accouplés
sont continuellement contrôlés. En effet, cinq minutes
après l'initiation d'accouplement, les couples sont collectés
dans des boites (50 ml de volume) pour suivre la durée d'accouplement de
près.
VI.2. Collecte des données
Toutes les informations sont enregistrées y compris le
temps du début d'accouplement lorsqu'un couple est collecté dans
la boite, le type du mâle traité ou non collecté dans
chaque boite. Une étiquette est placée sur chaque boite indiquant
le nombre d'accouplements qui ont eu lieu, le jour du test et le nombre des
paires en copulation. Les couples doivent être numérotés
dans l'ordre de leur collecte dans la cage.
Pour chaque couple, on note le début et la fin de
l'accouplement. On calcule par la suite la durée de l'accouplement ainsi
que le temps de latence (le temps mis dès l'heure de début du
test jusqu'à l'obtention d'un couple).
TROISIÈME PARTIE
. 1 ? , /J uitat/J et di/Jeu/J/J~ca

- CHAPITRE 7 -
Résultats et Discussion
I. Le milieu liquide
I.1. La production
|
Qté de pupes en
ml
|
60 50 40 30 20 10 0
|
|
|
Milieu Standard Milieu Liquide
|
collecte collecte collecte collecte collecte collecte
N°1
N°2 N°3 N°4 N°5 N°6
N°de collecte
Figure 34. Quantité de pupes produite par les deux
milieux dans 6 jours (Moyenne/ Voir Annexe)
D'après la précédente figure en remarque
une production en larve du milieu témoin (standard) assez importante par
rapport au milieu liquide , une production qui connaît une chute
dés la troisième collecte, probablement due à une charge
microbienne assez importante qui consomme une grande quantité du milieu
pour son développement et ainsi les larves ne trouvent pas la
quantité entière d'ingrédients ce qui inhibe leur
développement alors que le milieu liquide continue de produire avec une
baisse moins importante jusqu'au sixième jour.

38

Qté de pupes
37
36
35
Qté totale de 34 pupes (ml)
33
32 31 30 29 28

Milieu standard Milieu Liquide
Nature du milieu
Figure 35. Quantité totale de pupes produite
(Moyenne/ Voir Annexe)
D'après ces résultats, le milieu à base
de son de blé se montre plus productif de 5 ,55% que le milieu liquide
à base de levure de brasserie, probablement due à la baisse du
taux éclosion enregistrée à l'unité ce qui a
causé une densité moins importante des larves dans la boite de
développement les empêchant ainsi de monter le bord de la boite et
d'effectuer le saut larvaire.

Figure 36. Représentation de la disposition des
larves dans la boite de développement du milieu liquide
I.2. Contrôle de qualité
I.2.3. Test du poids des pupes
Ce test consiste à déterminer le poids des pupes
de chaque collecte afin d'évaluer la qualité des pupes obtenus.
En effet, le poids des pupes renseigne sur la nutrition des larves et le
degré de croissance de l'adulte de la Cératite avant son
émergence.
|
9 8 7 6 5 4 3 2 1 0
|
|
|
|
|
|
|
|
|
|
|
|
Poids en (mg)
|
|
|
Poids moyen d'une pupe femelle
|
|
|
Poids moyen d'une pupe male
|
Pupes Pupes
issues d'un issues d'un
milieu std milieu
liquide
Nature du milieu
Figure 37. Variation du poids moyen d'une pupe dans les
deux milieux (Moyenne/ Voir Annexe)
D'après la IAEA (2003) (39), les limites
des paramètres de contrôle qualité des pupes sont les
suivants :
|
Paramètres
|
Limites
|
|
Poids des pupes
Emergence
Aptitude au vol
|
6.5 mg
75 % pré irradiation,
70 % post
irradiation
65 % pré irradiation,
60 % post
irradiation
|
Tableau 13. Normes de quelques paramètres de
contrôle qualité des pupes
D'après la figure 37 on remarque que le poids moyen
d'une pupe mâle et d'une pupe femelle produite à partir d'un
milieu liquide est supérieur à ceux produites à partir d'u
milieu standard et assez supérieur aux normes fixés par la
AIEA.
Ceci est probablement dû à l'association de la
Nipagine, un agent antifongique, et le benzoate de sodium qui inhibent la
croissance des microorganismes et offre aux larves une disponibilité
plus favorable des ingrédients, cette association présente dans
le milieu liquide mais qui ne fait pas partie des composants du milieu
standard.
I.2.2. Test d'émergence et d'aptitude au
vol
L'aptitude au vol c'est l'aptitude des adultes de la
Cératite à voler après émergence. Le test de
l'aptitude au vol calcul le pourcentage des adultes produits ayant volés
parmi les pupes non émergées, les adultes déformés
et ceux qui sont demi émergés.
Les résultats du test de l'aptitude au vol sont
représentés comme suit :
Emergence et Emergence et Emergence et Emergence et
aptitude
au vol aptitude au vol aptitude au vol aptitude au vol
pour les males pour
les femelles pour les males pour les femelles
MS MS ML ML
Pourcentage
99,00
98,00
97,00
96,00
95,00
94,00
93,00
92,00
91,00
90,00
% d'émergence Aptitude au vol
Emergence et Aptitude au vol
Figure 38. Variation du pourcentage d'émergence
et d'aptitude au vol pour les deux types de milieux
(Moyenne/Voir
Annexe)
D'après les valeurs des histogrammes, on remarque que
les pupes mâles et femelles qui sont issues du milieu liquide
présentent un pourcentage d'émergence et d'aptitude au vol
compris entre 99% et 96%, donc assez supérieur à celui
enregistré pour les pupes issues du milieu standard compris entre 95% et
92%, ce qui confirme la bonne qualité des pupes et des mouches produites
à partir d'un milieu liquide par rapport au milieu à base de son
de blé.
I.3. Conclusion
Bien que le milieu standard qui est à base de son de
blé présente une production totale des pupes plus importante que
le milieu liquide, ce dernier, et d'après les paramètres de
contrôle de qualité se montre plus efficace et d'une production de
plus bonne qualité.
II. Détermination de la dose d'irradiation
Le choix de la dose d'irradiation est un équilibre
entre la stérilité et la qualité des mâles qui
doivent être compétitifs capables de voler et capables de produire
chez la femelle, après la copulation, le réflexe de non
réceptivité d'autres accouplements.
II.1. Test d'éclosion des oeufs
Pour pouvoir déterminer la dose nécessaire
d'irradiation, un test de détermination de la stérilité
chez la cératite a été effectué où les pupes
ont été exposées à différentes dose
d'irradiation : 50 Gy, 60 Gy, 70 Gy, 80 Gy, 90 Gy, 100 Gy, 110 Gy, 120 Gy, 145
Gy, les femelles et les mâles utilisés sont ceux du
laboratoire.
Le but de cet essai est d'enregistrer l'effet de l'irradiation
par rapport à l'éclosion des oeufs issus de l'accouplement des
femelles fertiles avec les mâles stériles.
Pour les oeufs obtenus de chacune des doses, on compte aussi le
nombre total de ces oeufs, le nombre des déshydratés,
transparents, éclos et non éclos.
|
Nbre d'oeuf
|
OEufs déshydratés
|
OEufs transparents
|
OEufs Non éclos
|
OEufs éclos
|
% d'éclosion
|
|
Témoin
|
302,65
|
4,17
|
1,96
|
149,22
|
147,30
|
52,29
|
|
50 Gy
|
438,00
|
8,57
|
2,87
|
407,17
|
19,40
|
4,70
|
|
60 Gy
|
350,20
|
6,78
|
3,13
|
334,57
|
5,73
|
1,63
|
|
70 Gy
|
474,33
|
7,33
|
3,37
|
457,37
|
6,27
|
1,36
|
|
80 Gy
|
323,53
|
3,07
|
2,38
|
316,63
|
1,45
|
0,70
|
|
90 Gy
|
284,35
|
3,55
|
0,78
|
278,27
|
1,55
|
0,64
|
|
100 Gy
|
404,4
|
22
|
1,6
|
321,13
|
2,73
|
0,52
|
|
110 Gy
|
403,80
|
13,67
|
1,57
|
381,67
|
0,40
|
0,15
|
|
120 Gy
|
574,27
|
19,00
|
2,60
|
459,87
|
2,07
|
0,39
|
|
145 GY
|
382,40
|
6,28
|
1,38
|
372,38
|
0,47
|
0,17
|
Tableau 14 : Profils des oeufs enregistrés pour
chaque dose d'irradiation (Moyenne/Voir Annexe)
D'après le tableau 12, on remarque que la moyenne des
oeufs non éclos ne cessent d'augmenter en fonction de l'augmentation de
la dose d'irradiation appliquées sur les pupes mâles , un
résultat évident vue l'effet de l'irradiation sur les cellules
germinales des testicules et le par la suite transfert du sperme.
Ainsi par les formules :
Nbr d'oeufs éclos = Nbr Tot des oeufs - Nbr
d'oeufs non éclos - Nbr d'oeufs déshydratés - Nbr d'oeufs
Transparents % d'éclosion = (Nbr d'oeufs
éclos/Nbr Tot des oeufs)*100
On a pu calculer le pourcentage d'éclosion des oeufs qui
se présente comme un indice de détermination de la
stérilité induite chez les mouches
|
Répétition 1
|
Répétition 2
|
Répétition 3
|
Répétition 4
|
Répétition 5
|
Moyenne
|
|
Témoin
|
57,13
|
60,56
|
51,16
|
40,16
|
52,43
|
52,288
|
|
50 Gy
|
7,62
|
4,53
|
3,46
|
5,01
|
2,87
|
4,698
|
|
60 Gy
|
1,29
|
1,05
|
1,4
|
1,95
|
2,48
|
1,634
|
|
70 Gy
|
1,35
|
0,99
|
0,71
|
1,58
|
2,17
|
1,36
|
|
80 Gy
|
0,6
|
0,46
|
0,48
|
0,74
|
1,24
|
0,704
|
|
90 Gy
|
1,35
|
0,36
|
0,24
|
0,3
|
0,98
|
0,646
|
|
100 Gy
|
0,81
|
0,42
|
0,84
|
0,03
|
0,51
|
0,522
|
|
110 Gy
|
0
|
0
|
0,11
|
0,46
|
0,16
|
0,146
|
|
120 Gy
|
0,21
|
0,83
|
0
|
0,53
|
0,38
|
0,39
|
|
145 Gy
|
0
|
0
|
0
|
0
|
0,1
|
0,02
|
Tableau 15:Calcul du taux de stérilité
des mouches irradiés par rapport au pourcentage
d'éclosion
(Moyenne/Voir Annexe)

Taux d'éclosion
50
40
30
% d'éclosion
20
10
0
Témoin 60 80 100 120
Dose d'irradiation (Gy)
Figure 39. Variation du taux d'éclosion d'oeufs
issus des mouches irradiées par rapport au
Témoin
(Moyenne/Voir Annexe)
D'après les résultats illustrés dans le
dernier tableau et ceux indiqués sur les histogrammes, on remarque que
le pourcentage d'éclosion des oeufs issus des femelles accouplées
avec les males irradiés est d'une part, négligeable par rapport
à l'éclosion des mouches non traitées (ces derniers qui
ont subi une baisse de 25% du taux d'éclosion à cause d'une
rupture de production) et ne cesse, d'autre part, de diminuer en fonction de
l'augmentation de la dose d'irradiation.
La dose d'irradiation recommandée pour un programme TIS
doit avoir une stérilité strictement supérieur à 5
% ce qui nous permet d'éliminer la dose 50 Gy qui présente un
taux de fertilité proche de 95%.
A ce niveau, la dose d'irradiation placée comme
idéale pour un programme de contrôle ne peut être que 145
Gy, mais ceci est une hypothèse qui reste à vérifier car
il ne faut pas négliger l'effet de l'irradiation sur les mouches
traitées, leurs performances sexuelles, leurs
compétitivités, leurs aptitudes d'émerger et de voler.
Pour déterminer le niveau de la stérilité
induite, les différents résultats sont transformés pour
une analyse du Probit, c'est-à-dire, les différentes doses
d'irradiation sont transformées en une fonction logarithmique, ainsi que
le taux d'éclosion des oeufs qui est ajusté et analysé par
la loi normal inverse NED pour donner à la fin les valeurs du Probit qui
est égale à :
Probit (fertility) = NED + 5
|
Témoin
|
57,13
|
60,56
|
51,16
|
40,16
|
52,43
|
52,288
|
100%
|
Log (dose)
|
NED
|
Probit (fertility)
|
|
50 Gy
|
7,62
|
4,53
|
3,46
|
5,01
|
2,87
|
4,698
|
8,98%
|
1,69897
|
-1,34198765
|
3,65801235
|
|
60 Gy
|
1,29
|
1,05
|
1,4
|
1,95
|
2,48
|
1,634
|
3,13%
|
1,7781513
|
-1,862021924
|
3,137978076
|
|
70 Gy
|
1,35
|
0,99
|
0,71
|
1,58
|
2,17
|
1,36
|
2,60%
|
1,845098
|
-1,943133751
|
3,056866249
|
|
80 Gy
|
0,6
|
0,46
|
0,48
|
0,74
|
1,24
|
0,704
|
1,35%
|
1,90309
|
-2,211517809
|
2,788482191
|
|
90 Gy
|
1,35
|
0,36
|
0,24
|
0,3
|
0,98
|
0,646
|
1,24%
|
1,9542425
|
-2,244503873
|
2,755496127
|
|
100 Gy
|
0,81
|
0,42
|
0,84
|
0,03
|
0,51
|
0,522
|
1,00%
|
2
|
-2,326347874
|
2,673652126
|
|
110 Gy
|
0
|
0
|
0,11
|
0,46
|
0,16
|
0,146
|
0,28%
|
2,0413927
|
-2,770327233
|
2,229672767
|
|
120 Gy
|
0,21
|
0,83
|
0
|
0,53
|
0,38
|
0,39
|
0,75%
|
2,0791812
|
-2,432379059
|
2,567620941
|
|
145 Gy
|
0
|
0
|
0
|
0
|
0,1
|
0,02
|
0,04%
|
2,161368
|
-3,352794781
|
1,647205219
|
Répétition 1
Répétition 2
Tableau 16: Ajustement des résultats pour
l'obtention du Probit (fertility) (Moyenne/Voir Annexe)
Répétition 3
Répétition 4
Répétition 5
Moyenne
Ajustement
y = -3,6073x + 9,7227
R2 = 0,8897
4
3,5
3
2,5
probit(fertility)
2
1,5
1
0,5
0
1,6 1,7 1,8 1,9 2 2,1 2,2
Log(dose)
Figure 40 . La relation entre la dose d'irradiation et la
stérilité
1700
1600
Nbre d'oeuf
II.2.1. Quantité d'oeuf F1
1500
Qté des oeufs
D'après l'allure de la courbe de tendance tracée
sur la figure 35, on peut remarquer la baisse significative du taux
d'éclosion donc l'augmentation du taux de stérilité des
mouches traitées par rapport à l'augmentation des doses
d'irradiations.
II.2. Suivi de la F1
Pour s'assurer de l'effet de l'ionisation et des
dégâts chromatiques causés par les différentes doses
d'irradiation, un suivi de la progéniture d'une génération
irradiée s'impose :
50 Gy70 Gy80 Gy90 Gy 100 110 120 145
Gy Gy Gy Gy
Dose d'irradiation (Gy)
Figure 41. Quantité totale d'oeufs produites par
les différentes mouches irradiées (Moyenne/ Voir
Annexe)
D'après ces résultats on remarque une production
presque équilibrée par toutes les femelles copulées avec
des mouches irradiées à différentes doses ce qui permet de
conclure qu'à ce stade, l'irradiation ne présente aucun effet ni
sur la ponte des oeufs ni sur la quantité des oeufs pondus.
II.2.1. Quantité de larves F1
Ces oeufs, après comptage, ont été
semés dans un milieu de développement larvaire et ces
résultats ont été enregistrés :
Nbre de larves
2,5
3,5
0,5
1,5
2
3
0
1
y = -0,2714x + 2,5214
R2 = 0,5688
Qté de larves
Linéaire (Qté de larves )
50 Gy 70 Gy 80 Gy 90 Gy 100 110 120 145
Gy Gy Gy Gy Dose d'irradiation (Gy)
Figure 42. Moyenne des larves issues des oeufs par dose
(Moyenne/ Voir Annexe)
On remarque que le nombre des larves issues des femelles
accouplées avec les mâles irradiés ne cesse de diminuer
pour atteindre la moyenne de deux larves issues de trois
répétitions dans la dose 145 Gy.
II.2.2 Quantité de pupes produites à la fin
du cycle
Ces mêmes larves sont collectées et mises dans des
boites à pétri contenant de la sciure de bois pour
vérifier si ces larves arrivent a effectué la métamorphose
en pupe :
0,4
0
0,2
0,6
0,8
1
1,2
1,4
Nbre de
pupes
y = -0,1x + 0,75
R2 = 0,375
50 Gy70 Gy80 Gy90 Gy 100 110 120 145
Gy Gy Gy Gy Dose d'irradiation (Gy)
Figure 43. Moyenne des pupes produites par dose
(Moyenne /Voir Annexe)
0,4
0,35
0,25
% d'éfficacité
0,2
0,3
% d'éfficacité
Linéaire (% d'éfficacité)
0,15
0,1
0,05
0
40 50 60 70 80 90 100 110 120 130 140 150
y = -0,0027x + 0,3554
R2 = 0,4392
Le nombre de la descendance de ces mouches irradiées ne
cessent de diminuer tout au long du cycle de développement pour
atteindre 0 pour quelques doses telles que 80 Gy, 100 Gy et 145 Gy.
% de transformation = (Nombre de pupes formées
/Nombre totale des oeufs)*100
Dose d'irradiation
Figure 44. Pourcentage de transformation des oeufs en
pupes - Efficacité
D'après les résultats de ce test, on se trouve
dans la mesure d'affirmer les conclusions du test d'éclosion qui
présentent la dose 145 Gy comme une dose efficace avec un faible taux
d'éclosion et sans aucun développement des oeufs éclos,
autrement dit, aucun effet sur le fruit en cas de piqûre par une
cératite traitée par cette dose.
II.3. Contrôle de qualité
Afin de s'assurer de la qualité des mouches
stériles produites différents tests tels que le test
d'émergence et d'aptitude au vol doivent être
réalisés.
II.3.1. Test d'émergence et d'aptitude au
vol
Cinq répétitions pour chacune des neufs doses
sont réalisées, chaque répétition consiste à
mettre 100 pupes dans un cylindre noir qui contient du papier filtre noir avec
du papier en accordéon afin d'accorder aux mouches de l'espace pour se
déployer les ailes. On met du
talque sur le contour du cylindre. Les cylindres sont mis dans
une cage d'aptitude au vol (T°= 25°C et HR= 60%) et les mouches
émergées étant régulièrement
aspirées.
|
N émergé
|
1/2 émérgé
|
Déformé
|
N. V
|
% émerg
|
% A.V
|
|
50 Gy
|
4,8
|
1,4
|
0,8
|
1,8
|
93,8
|
91,2
|
|
60 Gy
|
4,6
|
2
|
0,6
|
1,8
|
93,4
|
91
|
|
70 Gy
|
6,6
|
2,4
|
0,2
|
1,6
|
91
|
89,2
|
|
80 Gy
|
6,6
|
2,2
|
0,6
|
1,4
|
91,2
|
89,2
|
|
90 Gy
|
7,6
|
3,2
|
0,8
|
2,2
|
89,2
|
86,4
|
|
100 Gy
|
5
|
7,6
|
2,2
|
0,8
|
87,4
|
84,4
|
|
110 Gy
|
8,4
|
4,6
|
2,2
|
0,4
|
87
|
84,4
|
|
120 Gy
|
7,6
|
8,8
|
1
|
0,8
|
83,6
|
81,8
|
|
145 Gy
|
10,4
|
7,8
|
1,6
|
0,8
|
81,8
|
79,2
|
Tableau 17. Calcul de pourcentage d'émergence et
d'aptitude au vol (Moyenne/Voir Annexe)
D'après les valeurs illustrées sur ce dernier
tableau, on remarque une augmentation significative du nombre des mouches non
et demie émergées, ce qui a provoqué une baisse dans les
pourcentages d'émergence et d'aptitude au vol proportionnellement avec
l'augmentation de la dose d'irradiation.
Pourcentage
( % )
50 60 70 80 90 100 110 120 145
95
90
85
80
75
70
% d'émergence
% d'Aptitude au Vol
Dose d'irradiation
Figure 45. Variation du % d'émergence et de vol
par rapport aux différentes doses d'irradiations
(Moyenne/Voir
Annexe)
En fonction des allures des histogrammes qui présentent
les différents pourcentages d'émergence et d'aptitude au vol, on
remarque une baisse de ces deux taux en fonction de l'augmentation de la dose
de traitement.
On a dit auparavant, suite aux résultats du test
d'éclosion, que la dose 145 Gy semblait la meilleure de toutes les
autres pour assurer une stérilité proche de 100%, mais suite aux
résultats de cette dernière expérimentation on remarque
que cette même dose présente les taux les plus bas des mouches
émergées et présentant une bonne aptitude au vol, ce qui
permet de dire que plus la dose de traitement des mouches est
élevée, moins elles ont la capacité d'émerger des
pupes et de voler convenablement et vice-versa.
% compétitivité = Nombre de couple obtenu/
Nombre de couple possible
Donc par une élimination des extremums des doses de
traitement, une approximation entre 70 Gy et 110 Gy de traitement semble assez
recommandée pour l'irradiation de la cératite. Reste à
vérifier la capacité de ces derniers vis-à-vis de la
compétitivité sexuelle avec les mouches non traitées
fertiles.
II.4. Etude de l'effet de l'irradiation sur le potentiel
de reproduction des mouches : la compétitivité
sexuelle
Pour étudier l'effet d'irradiation sur l'accouplement,
on a travaillé avec des mâles stériles qui ont
déjà été irradiés au stade pupe.
Différentes doses ont été choisies: 50 Gy, 60 Gy, 70 Gy,
80 Gy, 90 Gy, 100 Gy ,1 10 Gy, 120 Gy et 145 Gy. Les femelles utilisées
sont celles du laboratoire.
Le but de cet essai est de voir s'il y a un effet de
l'irradiation sur le nombre des couples formés, la durée
d'accouplement et la compétitivité des mâles traités
par rapport aux mâles non traités.
|
70 60 50 40 30 20 10 0
|
|
|
|
% de compétitivité
|
Irradiée
N. Irradiée
|
|
|
50 60 70 80 90 100 110 120 145
Dose
d'irradiation
Figure 46. Compétitivité des couples des
différentes doses (Moyenne/Voir Annexe)
D'après les valeurs enregistrées sur les
histogrammes de cette figure, on remarque que le nombre des couples
formés à partir des mâles irradiés est largement
supérieur de 30,22% au nombre des couples formés à partir
des mâles non traités, ce qui permet d'affirmer une
compétitivité importante des mouches stériles par rapport
aux mouches fertiles.
Vue aussi la distribution des couples par rapport aux doses
d'irradiations, on remarque une performance exceptionnelle pour les couples
issus des doses 80 Gy et 90 Gy par rapport aux mouches traitées par les
autres doses. Probablement les deux les plus adéquats pour l'obtention
des mouches présentant un faible taux d'éclosion de
transformation en larve et de pupaison, une émergence et une aptitude au
vol tolérables et une compétitivité acceptable.
180
Durée d'Accouplement
(mn)
160
140
120
100
80
60
40
20
0
y = -4,085x + 148,1
R2 = 0,4388
50 60 70 80 90 100 110 120 145
D. d'irradiation (Gy)
Figure 47. Variation de la durée d'accouplement
en fonction des doses d'irradiation (Moyenne/Voir
Annexe)
D'après cette figure, on remarque que la durée
moyenne d'accouplement varie avec la dose. Elle est décroissante avec
l'élévation de la dose. En effet, elle passe de 162 minutes
à la dose 50Gy pour atteindre les 98,5 minutes à la dose 145
Gy.
Plus on augmente la dose d'irradiation plus la durée
d'accouplement est raccourcie : un phénomène qui peut être
à l'origine d'une diminution dans le transfert du sperme à la
femelle.
|
250
200
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
y = 3,7402x + 144,84
R2 = 0,1362
|
|
|
150
|
|
|
|
|
|
|
|
|
|
|
Temps de
latence (mn)
|
|
|
|
|
|
|
|
|
|
|
100 50 0
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
50 60 70 80 90 100 110 120 145
D. d'irradiation (Gy)
Figure 48. Variation du temps de latence en fonction
des doses d'irradiation (Moyenne/Voir Annexe)
D'après la l'allure de la courbe de tendance
représenté dans la figure de la variation du temps de latence en
fonction de la dose d'irradiation, on remarque un effet négatif
perceptible sur l'initiation de l'accouplement.
En effet la moyenne du temps de latence à 145 Gy arrive
à 230,6 minutes. Des doses élevées d'irradiation
retarderaient probablement l'accouplement.
Ce qui confirme le choix des doses 80 Gy et 90 Gy, ces derniers
présentant un temps de latence et d'accouplement assez proches
tolérables et proches de la moyenne.
Conclusion et Perspectives
La Cératite n'a cessé de susciter
l'intérêt de la recherche dans notre pays. Les dégâts
qu'elle commet sur les fruits d'une façon générale et sur
les oranges d'une façon particulière sont très importants.
De plus, la dépréciation de la valeur marchande des fruits
piqués, même intacts, et leur refus à l'exportation touche
une proportion importante de notre production.
Depuis, on a pensé à lutter contre ce ravageur
par la technique de l'insecte stérile (TIS). La principale composante de
réussite de la technique de l'insecte stérile est
l'élevage massif de la Cératite tout en utilisant un milieu
d'élevage convenable, en appliquant tous les tests de contrôle de
qualité des mouches produites et destinées aux lâchers et
surtout en maîtrisant la technique et la dose d'irradiation. Cependant,
après lâcher, des différences de comportement sexuel des
mâles stériles par rapport aux mâles sauvages peuvent
apparaître.
L'objectif de ce présent travail a été de
déterminer une dose d'irradiation efficace qui assure une
stérilité acceptable et qui permet en même temps le
maintien de la bonne qualité de l'insecte.
D'après les résultats du premier test
effectué sur le taux d'éclosion des oeufs issus des femelles
accouplées avec les mâles irradiés à
différents degrés d'ionisation, on a pu constater que la dose 145
Gy a assuré une stérilité parfaite par rapport aux autres
doses avec un taux de 0,02% d'éclosion des oeufs.
L'analyse de la progéniture F1 de ces mêmes
mouches irradiées a révélé le développement
de quelques pupes issues des mouches irradiées à
différentes doses telles que la dose 50 Gy qui présente un total
de 6 pupes produites par trois répétitions alors que la dose 145
Gy présente une production 0 de pupes, ce qui a confirmé les
résultats du dernier test.
Mais suite au contrôle de qualité de ces mouches
irradiées en question, les résultats ont
révélé la mauvaise qualité de cette dose
supposée être la meilleure vue les bas valeurs enregistrées
par rapport au taux d'émergence des mouches et leurs aptitude au vol par
la suite.
Donc par une élimination des extremums des doses de
traitement, une approximation entre 70 Gy et 110 Gy d'irradiation semble assez
recommandée pour l'irradiation de la cératite, une conclusion qui
a été affirmée par la suite à l'aide d'une analyse
de la compétitivité des différentes doses d'irradiation,
un test qui a révélé la capacité des mouches
irradiées à 80 Gy et à 90 Gy à former le plus grand
nombre de couples que le témoin non irradié et les autres mouches
irradiées ensembles avec des temps de latence et d'accouplement assez
tolérables et proches de la moyenne.
Au sein de l'unité d'irradiation les pupes de la
cératite se trouvent exposées à une dose d'irradiation de
110 Gy mais au terme de ce travail on pourra conseiller une marge entre 80 Gy
et 90 Gy. Une marge qui assure un développement, une émergence et
une aptitude au vol parfaits, ainsi qu'une compétitivité, un
temps de latence et un temps d'accouplement tolérables et enfin un taux
d'éclosion et une génération F1 assez basse pour pouvoir
causer des dégâts aux différents types de fruits.
Ce travail pourrait ainsi connaître un développement
ultérieur
- Par la répétition d'autres essais pour pouvoir
appuyer d'avantages les résultats des
tests;
- Par le suivie complet de la génération F1,
c'est-à-dire suivie de l'émergence, de l'aptitude au vol et de la
compétitivité ;
- Par l'application du test de la compatibilité et la
compétitivité sexuelle entre les mouches irradiées et les
mouches de la souche sauvage.
ANNEXE

|
Nature du milieu
|
Témoin 1
|
|
|
|
date de collecte
|
09/05/2008
|
|
qté de pupes totale (ml)
|
17
|
|
Nbre
|
Poids
|
PM
|
|
?
|
94
|
0,5434
|
0,005781
|
|
?
|
20
|
0,1333
|
0,006665
|
|
N émer
|
1/2 emer
|
Déformé
|
No Fly
|
|
?
|
2
|
0
|
0
|
0
|
|
?
|
1
|
0
|
0
|
0
|
|
Nature du milieu
|
Témoin 2
|
|
|
|
date de collecte
|
09/05/2008
|
|
qté de pupes totale (ml)
|
17
|
|
Nbre
|
Poids
|
PM
|
|
?
|
66
|
0,4614
|
0,006991
|
|
?
|
20
|
0,1537
|
0,007685
|
|
N émer
|
1/2 emer
|
Déformé
|
No Fly
|
|
?
|
7
|
0
|
0
|
0
|
|
?
|
2
|
1
|
0
|
0
|
|
|
|
|
|
Nature du milieu
|
Témoin 3
|
|
date de collecte
|
09/05/2008
|
|
qté de pupes totale (ml)
|
18
|
|
Nbre
|
Poids
|
PM
|
|
?
|
73
|
0,4921
|
0,006741
|
|
?
|
21
|
0,1421
|
0,006767
|
|
N émer
|
1/2 emer
|
Déformé
|
No Fly
|
|
?
|
4
|
1
|
0
|
0
|
|
?
|
3
|
0
|
0
|
0
|
|
Nature du milieu
|
Témoin 1
|
|
|
|
date de collecte
|
10/05/2008
|
|
qté de pupes totale (ml)
|
14
|
|
Nbre
|
Poids
|
PM
|
|
?
|
100
|
0,874
|
0,008740
|
|
?
|
9
|
0,0557
|
0,006189
|
|
N émer
|
1/2 emer
|
Déformé
|
No Fly
|
|
?
|
3
|
0
|
1
|
0
|
|
?
|
0
|
1
|
0
|
0
|
|
Nature du milieu
|
|
|
|
|
date de collecte
|
10/05/2008
|
|
qté de pupes totale (ml)
|
15
|
|
Nbre
|
Poids
|
PM
|
|
?
|
97
|
0,8699
|
0,008968
|
|
?
|
7
|
0,052
|
0,007429
|
|
N émer
|
1/2 emer
|
Déformé
|
No Fly
|
|
?
|
2
|
1
|
0
|
0
|
|
?
|
|
1
|
0
|
1
|
|
Nature du milieu
|
Témoin 3
|
|
|
|
date de collecte
|
10/05/2008
|
|
qté de pupes totale (ml)
|
13
|
|
Nbre
|
Poids
|
PM
|
|
?
|
90
|
0,8451
|
0,00939
|
|
?
|
10
|
0,0511
|
0,00511
|
|
N émer
|
1/2 emer
|
Déformé
|
No Fly
|
|
?
|
1
|
1
|
0
|
0
|
|
?
|
2
|
0
|
1
|
0
|
Témoin 2
1
Milieu Liquide
|
Nature du milieu
|
Témoin 1
|
|
|
|
date de collecte
|
11/05/2008
|
|
qté de pupes totale (ml)
|
4
|
|
Nbre
|
Poids
|
PM
|
|
?
|
41
|
0,246
|
0,0060
|
|
?
|
43
|
0,258
|
0,0060
|
|
N émer
|
1/2 emer
|
Déformé
|
No Fly
|
|
?
|
2
|
0
|
1
|
0
|
|
?
|
0
|
1
|
0
|
0
|
|
Nature du milieu
|
Témoin 2
|
|
|
|
date de collecte
|
11/05/2008
|
|
qté de pupes totale (ml)
|
4,2
|
|
Nbre
|
Poids
|
PM
|
|
?
|
39
|
0,221
|
0,005667
|
|
?
|
57
|
0,3945
|
0,006921
|
|
N émer
|
1/2 emer
|
Déformé
|
No Fly
|
|
?
|
2
|
1
|
0
|
0
|
|
?
|
0
|
1
|
0
|
0
|
|
Nature du milieu
|
Témoin 3
|
|
|
|
date de collecte
|
11/05/2008
|
|
qté de pupes totale (ml)
|
5
|
|
Nbre
|
Poids
|
PM
|
|
?
|
40
|
0,233
|
0,005825
|
|
?
|
45
|
0,2674
|
0,005942
|
|
N émer
|
1/2 emer
|
Déformé
|
No Fly
|
|
?
|
2
|
0
|
0
|
0
|
|
?
|
2
|
1
|
0
|
0
|
|
Nature du milieu
|
Témoin 1
|
|
|
|
date de collecte
|
12/05/2008
|
|
qté de pupes totale (ml)
|
2
|
|
Nbre
|
Poids
|
PM
|
|
?
|
39
|
0,2561
|
0,006567
|
|
?
|
51
|
0,4201
|
0,008237
|
|
N émer
|
1/2 emer
|
Déformé
|
No Fly
|
|
?
|
1
|
0
|
0
|
0
|
|
?
|
2
|
1
|
0
|
1
|
|
Nature du milieu
|
|
|
|
|
date de collecte
|
12/05/2008
|
|
qté de pupes totale (ml)
|
2,1
|
|
Nbre
|
Poids
|
PM
|
|
?
|
37
|
0,2491
|
0,006732
|
|
?
|
50
|
0,4173
|
0,008346
|
|
N émer
|
1/2 emer
|
Déformé
|
No Fly
|
|
?
|
3
|
0
|
1
|
0
|
|
?
|
|
0
|
0
|
1
|
|
Nature du milieu
|
Témoin 3
|
|
|
|
date de collecte
|
12/05/2008
|
|
qté de pupes totale (ml)
|
2
|
|
Nbre
|
Poids
|
PM
|
|
?
|
35
|
0,2401
|
0,00686
|
|
?
|
55
|
0,4401
|
0,00800
|
|
N émer
|
1/2 emer
|
Déformé
|
No Fly
|
|
?
|
2
|
1
|
0
|
0
|
|
?
|
1
|
1
|
0
|
1
|
Témoin 2
3
|
Nature du milieu
|
Milieu liquide 1
|
|
|
|
date de collecte
|
09/05/2008
|
|
qté de pupes totale (ml)
|
8,5
|
|
Nbre
|
Poids
|
PM
|
|
?
|
75
|
0,6774
|
0,00903
|
|
?
|
20
|
0,2012
|
0,01 006
|
|
N émer
|
1/2 emer
|
Déformé
|
No Fly
|
|
?
|
0
|
0
|
1
|
1
|
|
?
|
0
|
2
|
0
|
0
|
|
Nature du milieu
|
Milieu liquide 2
|
|
|
|
date de collecte
|
09/05/2008
|
|
qté de pupes totale (ml)
|
10
|
|
Nbre
|
Poids
|
PM
|
|
?
|
66
|
0,5889
|
0,00892
|
|
?
|
21
|
0,21
|
0,01 000
|
|
N émer
|
1/2 emer
|
Déformé
|
No Fly
|
|
?
|
1
|
1
|
0
|
0
|
|
?
|
1
|
0
|
0
|
0
|
|
Nature du milieu
|
Milieu liquide 3
|
|
|
|
date de collecte
|
09/05/2008
|
|
qté de pupes totale (ml)
|
9,1
|
|
Nbre
|
Poids
|
PM
|
|
?
|
71
|
0,6426
|
0,009051
|
|
?
|
25
|
0,2194
|
0,008776
|
|
N émer
|
1/2 emer
|
Déformé
|
No Fly
|
|
?
|
0
|
0
|
0
|
0
|
|
?
|
0
|
0
|
0
|
0
|
|
Nature du milieu
|
Milieu liquide 1
|
|
|
|
date de collecte
|
10/05/2008
|
|
qté de pupes totale (ml)
|
7,5
|
|
Nbre
|
Poids
|
PM
|
|
?
|
62
|
0,554
|
0,00894
|
|
?
|
8
|
0,056
|
0,00700
|
|
N émer
|
1/2 emer
|
Déformé
|
No Fly
|
|
?
|
0
|
0
|
0
|
0
|
|
?
|
1
|
2
|
0
|
0
|
|
Nature du milieu
|
Milieu liquide 2
|
|
|
|
date de collecte
|
10/05/2008
|
|
qté de pupes totale (ml)
|
8
|
|
Nbre
|
Poids
|
PM
|
|
?
|
101
|
0,8714
|
0,00863
|
|
?
|
11
|
0,1012
|
0,00920
|
|
N émer
|
1/2 emer
|
Déformé
|
No Fly
|
|
?
|
0
|
1
|
0
|
0
|
|
?
|
1
|
0
|
0
|
0
|
|
Nature du milieu
|
Milieu liquide 3
|
|
|
|
date de collecte
|
10/05/2008
|
|
qté de pupes totale (ml)
|
8
|
|
Nbre
|
Poids
|
PM
|
|
?
|
101
|
0,8817
|
0,008730
|
|
?
|
11
|
0,0989
|
0,008991
|
|
N émer
|
1/2 emer
|
Déformé
|
No Fly
|
|
?
|
0
|
0
|
0
|
1
|
|
?
|
0
|
1
|
0
|
0
|
|
Nature du milieu
|
Milieu liquide 1
|
|
|
|
date de collecte
|
11/05/2008
|
|
qté de pupes totale (ml)
|
5,9
|
|
Nbre
|
Poids
|
PM
|
|
?
|
45
|
0,3669
|
0,0081 53
|
|
?
|
46
|
0,3988
|
0,008670
|
|
N émer
|
1/2 emer
|
Déformé
|
No Fly
|
|
?
|
0
|
1
|
0
|
0
|
|
?
|
0
|
0
|
0
|
1
|
|
Nature du milieu
|
Milieu liquide 2
|
|
|
|
date de collecte
|
11/05/2008
|
|
qté de pupes totale (ml)
|
7
|
|
Nbre
|
Poids
|
PM
|
|
?
|
55
|
0,5325
|
0,009682
|
|
?
|
40
|
0,3661
|
0,0091 53
|
|
N émer
|
1/2 emer
|
Déformé
|
No Fly
|
|
?
|
0
|
0
|
0
|
2
|
|
?
|
1
|
0
|
0
|
0
|
|
Nature du milieu
|
Milieu liquide 3
|
|
|
|
date de collecte
|
11/05/2008
|
|
qté de pupes totale (ml)
|
6,5
|
|
Nbre
|
Poids
|
PM
|
|
?
|
47
|
0,3501
|
0,007449
|
|
?
|
43
|
0,38
|
0,008837
|
|
N émer
|
1/2 emer
|
Déformé
|
No Fly
|
|
?
|
0
|
0
|
0
|
1
|
|
?
|
1
|
0
|
0
|
0
|
|
Nature du milieu
|
Milieu liquide 1
|
|
|
|
date de collecte
|
12/05/2008
|
|
qté de pupes totale (ml)
|
4
|
|
Nbre
|
Poids
|
PM
|
|
?
|
41
|
0,3861
0,413
|
0,009417
|
|
?
|
49
|
0,008429
|
|
N émer
|
1/2 emer
|
Déformé
|
No Fly
|
|
?
|
1
|
1
|
0
|
0
|
|
?
|
2
|
0
|
1
|
0
|
|
Nature du milieu
|
Milieu liquide 2
|
|
|
|
date de collecte
|
12/05/2008
|
|
qté de pupes totale (ml)
|
5,3
|
|
Nbre
|
Poids
|
PM
|
|
?
|
42
|
0,39
|
0,00929
|
|
?
|
50
|
0,421
|
0,00842
|
|
N émer
|
1/2 emer
|
Déformé
|
No Fly
|
|
?
|
1
|
1
|
1
|
0
|
|
?
|
2
|
0
|
0
|
0
|
|
Nature du milieu
|
Milieu liquide 3
|
|
|
|
date de collecte
|
12/05/2008
|
|
qté de pupes totale (ml)
|
5,1
|
|
Nbre
|
Poids
|
PM
|
|
?
|
44
|
0,3995
|
0,009080
|
|
?
|
48
|
0,4031
|
0,008398
|
|
N émer
|
1/2 emer
|
Déformé
|
No Fly
|
|
?
|
0
|
0
|
0
|
0
|
|
?
|
1
|
0
|
0
|
0
|
|
Nature du milieu
|
Milieu liquide 1
|
|
|
|
date de collecte
|
13/05/2008
|
|
qté de pupes totale (ml)
|
3,8
|
|
Nbre
|
Poids
|
PM
|
|
?
|
42
|
0,28
|
0,006667
|
|
?
|
55
|
0,4413
|
0,008024
|
|
N émer
|
1/2 emer
|
Déformé
|
No Fly
|
|
?
|
1
|
1
|
0
|
0
|
|
?
|
2
|
0
|
0
|
0
|
|
Nature du milieu
|
Milieu liquide 2
|
|
|
|
date de collecte
|
13/05/2008
|
|
qté de pupes totale (ml)
|
4
|
|
Nbre
|
Poids
|
PM
|
|
?
|
41
|
0,2884
|
0,007034
|
|
?
|
56
|
0,4502
|
0,008039
|
|
N émer
|
1/2 emer
|
Déformé
|
No Fly
|
|
?
|
1
|
0
|
0
|
0
|
|
?
|
1
|
0
|
0
|
0
|
|
Nature du milieu
|
Milieu liquide 3
|
|
|
|
date de collecte
|
13/05/2008
|
|
qté de pupes totale (ml)
|
3,5
|
|
Nbre
|
Poids
|
PM
|
|
?
|
40
|
0,2931
|
0,00733
|
|
?
|
53
|
0,4493
|
0,00848
|
|
N émer
|
1/2 emer
|
Déformé
|
No Fly
|
|
?
|
1
|
0
|
0
|
0
|
|
?
|
0
|
0
|
1
|
0
|
|
Nature du milieu
|
Milieu liquide 1
|
|
|
|
date de collecte
|
14/05/2008
|
|
qté de pupes totale (ml)
|
2
|
|
Nbre
|
Poids
|
PM
|
|
?
|
38
|
0,3121
|
0,008213
|
|
?
|
52
|
0,4793
|
0,009217
|
|
N émer
|
1/2 emer
|
Déformé
|
No Fly
|
|
?
|
1
|
0
|
0
|
0
|
|
?
|
0
|
1
|
0
|
0
|
|
Nature du milieu
|
Milieu liquide 2
|
|
|
|
date de collecte
|
14/05/2008
|
|
qté de pupes totale (ml)
|
2,3
|
|
Nbre
|
Poids
|
PM
|
|
?
|
34
|
0,2901
|
0,008532
|
|
?
|
56
|
0,4901
|
0,008752
|
|
N émer
|
1/2 emer
|
Déformé
|
No Fly
|
|
?
|
0
|
0
|
1
|
0
|
|
?
|
0
|
1
|
1
|
0
|
|
Nature du milieu
|
Milieu liquide 3
|
|
|
|
date de collecte
|
14/05/2008
|
|
qté de pupes totale (ml)
|
3
|
|
Nbre
|
Poids
|
PM
|
|
?
|
37
|
0,301
|
0,008135
|
|
?
|
55
|
0,4801
|
0,008729
|
|
N émer
|
1/2 emer
|
Déformé
|
No Fly
|
|
?
|
2
|
1
|
0
|
0
|
|
?
|
0
|
2
|
0
|
1
|
|
Témoin 1
|
Témoin 2
|
Témoin 3
|
Moyenne
|
ML1
|
ML2
|
ML3
|
Moyenne
|
|
Qté tot de pupes (ml)
|
37
|
38,3
|
38
|
37,767
|
31,7
|
36,6
|
35,2
|
34,5
|
|
Nbr des pupes ?/ 2ml
|
274
|
239
|
238
|
250,33
|
303
|
339
|
340
|
327,33
|
|
Nbr des pupes ?/ 2ml
|
123
|
134
|
131
|
129,33
|
230
|
234
|
235
|
233,00
|
|
Poids d'une pupe ? (g)
|
0,006772
|
0,007090
|
0,007204
|
0,00702
|
0,008403
|
0,008681
|
0,008295
|
0,00846
|
|
Poids d'une pupe ? (g)
|
0,006773
|
0,007595
|
0,006455
|
0,00694
|
0,008567
|
0,008927
|
0,008701
|
0,00873
|
|
|
Nbre de pupe / 2ml
|
N émer
|
1/2 emer
|
Déformé
|
No Fly
|
% Emergence
|
% Fly
|
|
?
|
Témoin 1
|
274
|
8
|
0
|
2
|
0
|
97,08
|
96,35
|
|
Témoin 2
|
202
|
14
|
2
|
1
|
0
|
92,08
|
91,58
|
|
Témoin 3
|
238
|
9
|
3
|
0
|
0
|
94,96
|
94,96
|
|
Moyenne
|
238
|
10,33
|
1,67
|
1
|
0
|
94,96
|
94,54
|
|
?
|
Témoin 1
|
123
|
3
|
2
|
0
|
1
|
95,93
|
95,12
|
|
Témoin 2
|
134
|
5
|
2
|
0
|
2
|
94,78
|
93,28
|
|
Témoin 3
|
131
|
8
|
2
|
1
|
1
|
92,37
|
90,84
|
|
Moyenne
|
129,33
|
5,33
|
2,00
|
0,33
|
1,33
|
94,33
|
93,04
|
|
?
|
M L 1
|
303
|
3
|
3
|
1
|
0
|
98,02
|
97,69
|
|
M L 2
|
339
|
3
|
3
|
2
|
0
|
98,23
|
97,64
|
|
M L 3
|
340
|
3
|
1
|
0
|
2
|
98,82
|
98,24
|
|
Moyenne
|
327,33
|
3,00
|
2,33
|
1,00
|
0,67
|
98,37
|
97,86
|
|
?
|
M L 1
|
230
|
6
|
5
|
1
|
1
|
95,22
|
94,35
|
|
M L 2
|
234
|
6
|
1
|
1
|
0
|
97,01
|
96,58
|
|
M L 3
|
235
|
2
|
3
|
1
|
1
|
97,87
|
97,02
|
|
Moyenne
|
233
|
4,67
|
3
|
1
|
0,67
|
96,71
|
95,99
|
Test d'éclosion des oeufs
50 Gy
Répétition 1
OEufs Néclo
% d'éclo
OEufs eclos
date
oeufs desyh
N° collecte
OEufs trsp
Nb d'oeuf
44
13,73
7
02/04/2008
0
1
0
51
437
5,59
27
03/04/2008
15
2
4
483
539
3,54
20
04/04/2008
4
2
3
565
1020
22,86
19
Somme
54
6
1099
340
7,62
18
6,33
Moyenne
2
366,33
Répétition 2
OEufs Néclo
% d'éclo
OEufs eclos
date
oeufs desyh
OEufs trsp
N° collecte
Nb d'oeuf
329
2,82
10
02/04/2008
2
14
1
355
700
6,25
35
49
03/04/2008
2
0
784
1029
9,07
59
Somme
37
14
1139
514,5
4,53
29,5
Moyenne
18,5
7
569,5
Répétition 3
OEufs Néclo
% d'éclo
oeufs desyh
OEufs eclos
date
N° collecte
OEufs trsp
Nb d'oeuf
171
1,72
3
02/04/2008
0
0
1
174
701
3,78
28
03/04/2008
10
2
2
741
142
4,88
8
04/04/2008
10
4
3
164
1014
10,38
39
Somme
20
6
1079
338
3,46
6,67
Moyenne
13
2
359,67
Répétition 4
OEufs Néclo
% d'éclo
OEufs eclos
date
oeufs desyh
OEufs trsp
N° collecte
Nb d'oeuf
345
4,61
17
02/04/2008
3
4
1
369
649
5,41
38
03/04/2008
15
0
2
702
994
10,02
Somme
18
55
4
1071
497
5,01
27,5
Moyenne
9
2
535,5
Répétition 5
OEufs Néclo
% d'éclo
OEufs eclos
date
oeufs desyh
OEufs trsp
N° collecte
Nb d'oeuf
322
4,15
14
02/04/2008
0
1
1
337
616
1,57
7
03/04/2008
10
2
3
636
101
2,88
3
0
04/04/2008
0
3
104
1039
8,61
27
Somme
7
4
1077
346,33
2,87
9
Moyenne
2,33
1,33
359
60 Gy
Répétition 1
OEufs Néclo
% d'éclo
oeufs desyh
date
OEufs trsp
N° collecte
Nb d'oeuf
OEufs eclos
70
1,41
0
02/04/2008
1
0
71
1
583
1,15
03/04/2008
15
3
2
608
7
431
1,30
04/04/2008
16
3
7
6
460
1084
3,86
Somme
31
10
1139
14
361,33
1,29
10,33
Moyenne
3,33
379,67
4,67
Répétition 2
OEufs Néclo
% d'éclo
date
oeufs desyh
N° collecte
OEufs trsp
OEufs eclos
Nb d'oeuf
273
0,68
02/04/2008
2
1
15
2
292
606
1,58
03/04/2008
12
2
3
10
631
228
0,87
0
04/04/2008
0
3
230
2
1107
3,14
Somme
14
18
1153
14
369
1,05
Moyenne
4,67
6
384,33
4,67
Répétition 3
OEufs Néclo
% d'éclo
date
oeufs desyh
OEufs trsp
N° collecte
Nb d'oeuf
OEufs eclos
177
0,55
0
02/04/2008
1
4
182
1
360
0,52
15
03/04/2008
2
4
381
2
402
0,74
04/04/2008
0
3
0
405
3
95
3,77
05/04/2008
7
4
0
106
4
1034
5,59
22
Somme
8
1074
10
258,5
1,40
Moyenne
5,5
2
268,5
2,5
Répétition 4
OEufs Néclo
% d'éclo
date
oeufs desyh
OEufs trsp
N° collecte
OEufs eclos
Nb d'oeuf
68
6,41
02/04/2008
1
4
1
5
78
88
-
0
03/04/2008
0
2
88
0
95
1,02
04/04/2008
2
0
3
1
98
197
1,49
05/04/2008
1
4
0
201
3
587
0,81
06/04/2008
28
5
0
620
5
1035
9,73
Somme
32
4
1085
14
207
1,95
6,4
Moyenne
0,8
217
2,8
Répétition 5
OEufs Néclo
% d'éclo
oeufs desyh
date
N° collecte
OEufs trsp
OEufs eclos
Nb d'oeuf
273
1,77
1
02/04/2008
1
3
5
282
681
3,19
13
03/04/2008
2
4
23
721
954
4,96
14
Somme
7
1003
28
477
2,48
7
Moyenne
3,5
14
501,5
70 Gy
Répétition 1
OEufs Néclo
% d'éclo
oeufs desyh
date
OEufs trsp
N° collecte
Nb d'oeuf
OEufs eclos
42
-
1
02/04/2008
1
0
43
0
308
1,27
03/04/2008
4
0
2
316
4
601
2,79
04/04/2008
25
1
3
18
645
951
4,06
Somme
30
1
22
1004
317
1,35
Moyenne
10
0,33
7,33
334,67
Répétition 2
OEufs Néclo
% d'éclo
date
oeufs desyh
OEufs trsp
N° collecte
Nb d'oeuf
OEufs eclos
145
1,32
02/04/2008
2
1
2
151
2
507
0,57
03/04/2008
7
2
5
522
3
909
1,06
04/04/2008
11
13
3
943
10
1561
2,96
20
Somme
20
1616
15
520,33
0,99
Moyenne
6,67
6,67
538,67
5
Répétition 3
OEufs Néclo
% d'éclo
date
oeufs desyh
N° collecte
OEufs trsp
Nb d'oeuf
OEufs eclos
303
1,29
02/04/2008
1
1
2
310
4
771
0,13
11
03/04/2008
4
2
787
1
1074
1,42
Somme
12
6
1097
5
537
0,71
Moyenne
6
3
548,5
2,5
Répétition 4
OEufs Néclo
% d'éclo
date
oeufs desyh
N° collecte
OEufs trsp
OEufs eclos
Nb d'oeuf
150
1,30
1
02/04/2008
1
1
154
2
621
1,56
2
03/04/2008
2
7
640
10
303
1,89
6
04/04/2008
3
2
317
6
1074
4,75
9
Somme
10
1111
18
358
1,58
3
Moyenne
3,33
370,33
6
Répétition 5
OEufs Néclo
% d'éclo
oeufs desyh
date
OEufs trsp
N° collecte
Nb d'oeuf
OEufs eclos
235
2,8
02/04/2008
4
1
4
7
250
874
1,54
18
03/04/2008
2
3
909
14
1109
4,34
Somme
22
7
1159
21
554,5
2,17
11
Moyenne
3,5
10,5
579,5
80 Gy
Répétition 1
|
date
|
N° collecte
|
Nb d'oeuf
|
oeufs desyh
|
OEufs trsp
|
OEufs Néclo
|
OEufs eclos
|
% d'éclo
|
|
02/04/2008
|
1
|
61
|
0
|
0
|
60
|
1
|
1,64
|
|
03/04/2008
|
2
|
396
|
7
|
2
|
385
|
2
|
0,51
|
|
04/04/2008
|
3
|
411
|
7
|
3
|
400
|
1
|
0,24
|
|
05/04/2008
|
4
|
180
|
5
|
0
|
175
|
0
|
-
|
|
Somme
|
|
1048
|
19
|
5
|
1020
|
4
|
2,39
|
|
Moyenne
|
|
262
|
4,75
|
1,25
|
255
|
1
|
0,60
|
Répétition 2
|
date
|
N° collecte
|
Nb d'oeuf
|
oeufs desyh
|
OEufs trsp
|
OEufs Néclo
|
OEufs eclos
|
% d'éclo
|
|
02/04/2008
|
1
|
170
|
5
|
5
|
159
|
1
|
0,59
|
|
03/04/2008
|
2
|
513
|
0
|
0
|
511
|
2
|
0,39
|
|
04/04/2008
|
3
|
503
|
5
|
1
|
495
|
2
|
0,40
|
|
Somme
|
|
1186
|
10
|
6
|
1165
|
5
|
1,38
|
|
Moyenne
|
|
395,33
|
3,33
|
2
|
388,33
|
1,67
|
0,46
|
Répétition 3
|
date
|
N° collecte
|
Nb d'oeuf
|
oeufs desyh
|
OEufs trsp
|
OEufs Néclo
|
OEufs eclos
|
% d'éclo
|
|
02/04/2008
|
1
|
129
|
0
|
6
|
122
|
1
|
0,78
|
|
03/04/2008
|
2
|
389
|
3
|
0
|
384
|
2
|
0,51
|
|
04/04/2008
|
3
|
713
|
0
|
2
|
710
|
1
|
0,14
|
|
Somme
|
|
1231
|
3
|
8
|
1216
|
4
|
1,43
|
|
Moyenne
|
|
410,33
|
1
|
2,67
|
405,33
|
1,33
|
0,48
|
|
Répétition 4
|
|
date
|
N° collecte
|
Nb d'oeuf
|
oeufs desyh
|
OEufs trsp
|
OEufs Néclo
|
OEufs eclos
|
% d'éclo
|
|
02/04/2008
|
1
|
113
|
0
|
3
|
108
|
2
|
1,77
|
|
03/04/2008
|
2
|
200
|
2
|
1
|
197
|
0
|
-
|
|
04/04/2008
|
3
|
629
|
9
|
6
|
612
|
2
|
0,32
|
|
05/04/2008
|
4
|
117
|
0
|
0
|
116
|
1
|
0,85
|
|
Somme
|
|
1059
|
11
|
10
|
1033
|
5
|
2,94
|
|
Moyenne
|
|
264,75
|
2,75
|
2,5
|
258,25
|
1,25
|
0,74
|
|
Répétition 5
|
|
date
|
N° collecte
|
Nb d'oeuf
|
oeufs desyh
|
OEufs trsp
|
OEufs Néclo
|
OEufs eclos
|
% d'éclo
|
|
02/04/2008
|
1
|
80
|
0
|
5
|
75
|
0
|
-
|
|
03/04/2008
|
2
|
115
|
3
|
2
|
106
|
4
|
3,48
|
|
04/04/2008
|
3
|
720
|
1
|
7
|
711
|
1
|
0,14
|
|
05/04/2008
|
4
|
226
|
10
|
0
|
213
|
3
|
1,33
|
|
Somme
|
|
1141
|
14
|
14
|
1105
|
8
|
4,94
|
|
Moyenne
|
|
285,25
|
3,5
|
3,5
|
276,25
|
2
|
1,24
|
90 Gy
Répétition 1
OEufs trsp
date
OEufs Néclo
% d'éclo
OEufs eclos
N° collecte
Nb d'oeuf
oeufs desyh
0
02/04/2008
53
1,85
1
1
54
0
0
03/04/2008
621
0,79
5
2
632
6
2
04/04/2008
416
1,42
6
3
424
0
2
Somme
1090
4,06
Somme
12
1110
6
0,67
Moyenne
363,33
1,35
4,00
370,00
2,00
Répétition 2
OEufs trsp
date
OEufs Néclo
% d'éclo
OEufs eclos
N° collecte
Nb d'oeuf
oeufs desyh
0
02/04/2008
94
-
0
1
94
0
2
03/04/2008
338
1,43
2
5
350
5
3
04/04/2008
447
-
0
3
465
15
0
05/04/2008
186
-
0
4
190
4
5
Somme
1065
1,43
5
somme
1099
24
1,25
Moyenne
266,25
0,36
1,25
274,75
6
Répétition 3
OEufs trsp
date
OEufs Néclo
% d'éclo
OEufs eclos
N° collecte
Nb d'oeuf
oeufs desyh
0
02/04/2008
60
-
0
1
60
0
0
03/04/2008
307
0,32
1
2
311
3
2
467
04/04/2008
0,62
3
3
482
10
0
05/04/2008
194
-
0
4
194
0
2
Somme
1028
0,94
2
Somme
1047
13
0,5
Moyenne
257
0,24
0,5
261,75
3,25
Répétition 4
OEufs trsp
date
OEufs Néclo
% d'éclo
N° collecte
OEufs eclos
Nb d'oeuf
oeufs desyh
0
02/04/2008
7
-
0
1
7
0
3
03/04/2008
532
0,55
3
2
546
8
0
04/04/2008
310
0,64
2
3
312
0
0
147
05/04/2008
-
0
4
149
2
3
996
Somme
1,19
5
Somme
1014
10
0,75
Moyenne
249
0,30
1,25
253,5
2,5
Répétition 5
OEufs trsp
date
OEufs Néclo
% d'éclo
OEufs eclos
N° collecte
Nb d'oeuf
oeufs desyh
0
02/04/2008
33
2,94
1
1
34
0
3
474
03/04/2008
0,40
2
2
494
15
0
04/04/2008
358
0,55
2
3
361
1
0
05/04/2008
158
-
0
4
158
0
3
1023
Somme
3,90
5
Somme
1047
16
0,75
255,75
Moyenne
1,25
0,98
261,75
4
100 Gy
|
Répétition 1
|
|
date
|
N° collecte
|
Nb d'oeuf
|
oeufs desyh
|
OEufs trsp
|
OEufs Néclo
|
OEufs eclos
|
% d'éclo
|
|
02/04/2008
|
1
|
219
|
0
|
0
|
216
|
3
|
1,36
|
|
03/04/2008
|
2
|
594
|
39
|
4
|
551
|
0
|
0
|
|
04/04/2008
|
3
|
205
|
20
|
0
|
183
|
2
|
1,08
|
|
somme
|
|
1018
|
59
|
4
|
950
|
5
|
2,44
|
|
Moyenne
|
|
339,33
|
19,67
|
1,33
|
316,67
|
1,67
|
0,81
|
|
Répétition 2
|
|
date
|
N° collecte
|
Nb d'oeuf
|
oeufs desyh
|
OEufs trsp
|
OEufs Néclo
|
OEufs eclos
|
% d'éclo
|
|
02/04/2008
|
1
|
61
|
0
|
0
|
55
|
1
|
0,4
|
|
03/04/2008
|
2
|
332
|
0
|
2
|
328
|
2
|
0,6
|
|
04/04/2008
|
3
|
853
|
57
|
3
|
791
|
2
|
0,25
|
|
SOMME
|
|
1246
|
57
|
5
|
1174
|
5
|
1,25
|
|
Moyenne
|
|
415,33
|
19,00
|
1,67
|
391,33
|
1,67
|
0,42
|
|
Répétition 3
|
|
date
|
N° collecte
|
Nb d'oeuf
|
oeufs desyh
|
OEufs trsp
|
OEufs Néclo
|
OEufs eclos
|
% d'éclo
|
|
02/04/2008
|
1
|
109
|
3
|
0
|
102
|
4
|
0,77
|
|
03/04/2008
|
2
|
466
|
0
|
0
|
459
|
7
|
1,5
|
|
04/04/2008
|
3
|
793
|
56
|
2
|
733
|
2
|
0,27
|
|
somme
|
|
1368
|
59
|
2
|
1294
|
13
|
2,54
|
|
Moyenne
|
|
456,00
|
19,67
|
0,67
|
431,33
|
4,33
|
0,85
|
|
Répétition 4
|
|
date
|
N° collecte
|
Nb d'oeuf
|
oeufs desyh
|
OEufs trsp
|
OEufs Néclo
|
OEufs eclos
|
% d'éclo
|
|
02/04/2008
|
1
|
11
|
0
|
0
|
11
|
0
|
0
|
|
03/04/2008
|
2
|
320
|
11
|
3
|
306
|
0
|
0
|
|
04/04/2008
|
3
|
1033
|
79
|
2
|
95
|
1
|
0,1
|
|
SOMME
|
|
1364
|
90
|
5
|
412
|
1
|
0,1
|
|
Moyenne
|
|
454,67
|
30,00
|
1,67
|
137,33
|
0,33
|
0,03
|
|
Répétition 5
|
|
date
|
N° collecte
|
Nb d'oeuf
|
oeufs desyh
|
OEufs trsp
|
OEufs Néclo
|
OEufs eclos
|
% d'éclo
|
|
02/04/2008
|
1
|
58
|
8
|
1
|
46
|
3
|
0
|
|
03/04/2008
|
2
|
338
|
4
|
3
|
328
|
3
|
0,9
|
|
04/04/2008
|
3
|
674
|
53
|
4
|
613
|
11
|
0,64
|
|
somme
|
|
1070
|
65
|
8
|
987
|
17
|
1,54
|
|
Moyenne
|
|
356,67
|
21,67
|
2,67
|
329,00
|
5,67
|
0,51
|
110 Gy
|
Répétition 1
|
|
date
|
N° collecte
|
Nb d'oeuf
|
oeufs desyh
|
OEufs trsp
|
OEufs Néclo
|
OEufs eclos
|
% d'éclo
|
|
02/04/2008
|
1
|
145
|
0
|
1
|
136
|
0
|
0
|
|
03/04/2008
|
2
|
680
|
6
|
1
|
673
|
0
|
0
|
|
04/04/2008
|
3
|
262
|
2
|
0
|
260
|
0
|
0
|
|
Somme
|
|
1087
|
8
|
2
|
1069
|
0
|
0
|
|
Moyenne
|
|
362,33
|
2,67
|
0,67
|
356,33
|
0
|
0
|
|
Répétition 2
|
|
date
|
N° collecte
|
Nb d'oeuf
|
oeufs desyh
|
OEufs trsp
|
OEufs Néclo
|
OEufs eclos
|
% d'éclo
|
|
02/04/2008
|
1
|
296
|
7
|
2
|
282
|
0
|
0
|
|
03/04/2008
|
2
|
848
|
69
|
3
|
776
|
0
|
0
|
|
Somme
|
|
1144
|
76
|
5
|
1058
|
0
|
0
|
|
Moyenne
|
|
572
|
38
|
2,5
|
529
|
0
|
0
|
|
Répétition 3
|
|
date
|
N° collecte
|
Nb d'oeuf
|
oeufs desyh
|
OEufs trsp
|
OEufs Néclo
|
OEufs eclos
|
% d'éclo
|
|
02/04/2008
|
1
|
37
|
0
|
0
|
36
|
0
|
0
|
|
03/04/2008
|
2
|
522
|
2
|
2
|
518
|
0
|
0
|
|
04/04/2008
|
3
|
569
|
11
|
0
|
556
|
2
|
0,35
|
|
Somme
|
|
1128
|
13
|
2
|
1110
|
2
|
0,35
|
|
Moyenne
|
|
376,00
|
4,33
|
0,67
|
370,00
|
0,67
|
0,12
|
|
Répétition 4
|
|
date
|
N° collecte
|
Nb d'oeuf
|
oeufs desyh
|
OEufs trsp
|
OEufs Néclo
|
OEufs eclos
|
% d'éclo
|
|
02/04/2008
|
1
|
138
|
1
|
0
|
131
|
0
|
0
|
|
03/04/2008
|
2
|
666
|
35
|
7
|
624
|
0
|
0
|
|
04/04/2008
|
3
|
229
|
9
|
0
|
217
|
3
|
1,36
|
|
Somme
|
|
1033
|
45
|
7
|
972
|
3
|
1,36
|
|
Moyenne
|
|
344,33
|
15,00
|
2,33
|
324,00
|
1,00
|
0,45
|
|
Répétition 5
|
|
date
|
N° collecte
|
Nb d'oeuf
|
oeufs desyh
|
OEufs trsp
|
OEufs Néclo
|
OEufs eclos
|
% d'éclo
|
|
02/04/2008
|
1
|
197
|
0
|
0
|
196
|
1
|
0,5
|
|
03/04/2008
|
2
|
739
|
19
|
4
|
641
|
0
|
0
|
|
04/04/2008
|
3
|
157
|
6
|
1
|
150
|
0
|
0
|
|
Somme
|
|
1093
|
25
|
5
|
987
|
1
|
0,5
|
|
Moyenne
|
|
364,33
|
8,33
|
1,67
|
329,00
|
0,33
|
0,17
|
120 Gy
|
Répétition 1
|
|
date
|
N° collecte
|
Nb d'oeuf
|
oeufs desyh
|
OEufs trsp
|
OEufs Néclo
|
OEufs eclos
|
% d'éclo
|
|
02/04/2008
|
1
|
99
|
0
|
3
|
90
|
0
|
0
|
|
03/04/2008
|
2
|
624
|
9
|
2
|
609
|
4
|
0,65
|
|
04/04/2008
|
3
|
1126
|
89
|
3
|
1034
|
0
|
0
|
|
Somme
|
|
1849
|
98
|
8
|
1733
|
4
|
0,65
|
|
Moyenne
|
|
616,33
|
32,67
|
2,67
|
577,67
|
1,33
|
0,22
|
|
Répétition 2
|
|
date
|
N° collecte
|
Nb d'oeuf
|
oeufs desyh
|
OEufs trsp
|
OEufs Néclo
|
OEufs eclos
|
% d'éclo
|
|
02/04/2008
|
1
|
463
|
5
|
0
|
453
|
5
|
1,21
|
|
03/04/2008
|
2
|
861
|
15
|
2
|
442
|
2
|
0,45
|
|
Somme
|
|
1324
|
20
|
2
|
895
|
7
|
1,66
|
|
Moyenne
|
|
662
|
10
|
1
|
447,5
|
3,5
|
0,83
|
|
Répétition 3
|
|
date
|
N° collecte
|
Nb d'oeuf
|
oeufs desyh
|
OEufs trsp
|
OEufs Néclo
|
OEufs eclos
|
% d'éclo
|
|
02/04/2008
|
1
|
23
|
1
|
2
|
20
|
0
|
0
|
|
03/04/2008
|
2
|
355
|
1
|
1
|
3
|
0
|
0
|
|
04/04/2008
|
3
|
793
|
12
|
0
|
381
|
0
|
0
|
|
Somme
|
|
1171
|
14
|
3
|
404
|
0
|
0
|
|
Moyenne
|
|
390,33
|
4,67
|
1,00
|
134,67
|
0,00
|
0,00
|
|
Répétition 4
|
|
date
|
N° collecte
|
Nb d'oeuf
|
oeufs desyh
|
OEufs trsp
|
OEufs Néclo
|
OEufs eclos
|
% d'éclo
|
|
02/04/2008
|
1
|
396
|
8
|
2
|
383
|
3
|
0,77
|
|
03/04/2008
|
2
|
706
|
26
|
4
|
674
|
2
|
0,29
|
|
Somme
|
|
1102
|
34
|
6
|
1057
|
5
|
1,06
|
|
Moyenne
|
|
551
|
17
|
3
|
528,5
|
2,5
|
0,53
|
|
Répétition 5
|
|
date
|
N° collecte
|
Nb d'oeuf
|
oeufs desyh
|
OEufs trsp
|
OEufs Néclo
|
OEufs eclos
|
% d'éclo
|
|
02/04/2008
|
1
|
27
|
0
|
0
|
22
|
0
|
0
|
|
03/04/2008
|
2
|
836
|
16
|
12
|
799
|
9
|
1,14
|
|
04/04/2008
|
3
|
1092
|
76
|
4
|
1012
|
0
|
0
|
|
Somme
|
|
1955
|
92
|
16
|
1833
|
9
|
1,14
|
|
Moyenne
|
|
651,67
|
30,67
|
5,33
|
611,00
|
3,00
|
0,38
|
145 Gy
|
Répétition 1
|
|
date
|
N° collecte
|
Nb d'oeuf
|
oeufs desyh
|
OEufs trsp
|
OEufs Néclo
|
OEufs eclos
|
% d'éclo
|
|
02/04/2008
|
1
|
265
|
0
|
0
|
257
|
0
|
0
|
|
03/04/2008
|
2
|
707
|
15
|
2
|
690
|
0
|
0
|
|
04/04/2008
|
3
|
63
|
0
|
0
|
63
|
0
|
0
|
|
somme
|
|
1035
|
15
|
2
|
1010
|
0
|
0
|
|
Moyenne
|
|
345
|
5
|
0,66666667
|
336,666667
|
0
|
0
|
|
Répétition 2
|
|
date
|
N° collecte
|
Nb d'oeuf
|
oeufs desyh
|
OEufs trsp
|
OEufs Néclo
|
OEufs eclos
|
% d'éclo
|
|
02/04/2008
|
1
|
270
|
0
|
2
|
264
|
4
|
0
|
|
03/04/2008
|
2
|
769
|
19
|
4
|
746
|
0
|
0
|
|
SOMME
|
|
1039
|
19
|
6
|
1010
|
4
|
1,49
|
|
Moyenne
|
|
519,50
|
9,50
|
3,00
|
505,00
|
2,00
|
0,75
|
|
Répétition 3
|
|
date
|
N° collecte
|
Nb d'oeuf
|
oeufs desyh
|
OEufs trsp
|
OEufs Néclo
|
OEufs eclos
|
% d'éclo
|
|
02/04/2008
|
1
|
24
|
0
|
0
|
20
|
0
|
0
|
|
03/04/2008
|
2
|
383
|
1
|
2
|
370
|
10
|
2,63
|
|
04/04/2008
|
3
|
845
|
12
|
3
|
830
|
0
|
0
|
|
SOMME
|
|
1252
|
13
|
5
|
1220
|
10
|
2,63
|
|
Moyenne
|
|
417,33
|
4,33
|
1,67
|
406,67
|
3,33
|
0,88
|
|
Répétition 4
|
|
date
|
N° collecte
|
Nb d'oeuf
|
oeufs desyh
|
OEufs trsp
|
OEufs Néclo
|
OEufs eclos
|
% d'éclo
|
|
02/04/2008
|
1
|
10
|
0
|
0
|
10
|
0
|
0
|
|
03/04/2008
|
2
|
293
|
3
|
1
|
286
|
0
|
0
|
|
04/04/2008
|
3
|
517
|
6
|
0
|
511
|
0
|
0
|
|
05/04/2008
|
4
|
194
|
0
|
0
|
194
|
0
|
0
|
|
Somme
|
|
1014
|
9
|
1
|
1001
|
0
|
0
|
|
Moyenne
|
|
253,50
|
2,25
|
0,25
|
250,25
|
0
|
0
|
|
Répétition 5
|
|
date
|
N° collecte
|
Nb d'oeuf
|
oeufs desyh
|
OEufs trsp
|
OEufs Néclo
|
OEufs eclos
|
% d'éclo
|
|
02/04/2008
|
1
|
57
|
2
|
2
|
49
|
0
|
0
|
|
03/04/2008
|
2
|
320
|
0
|
0
|
319
|
1
|
0,31
|
|
04/04/2008
|
3
|
753
|
29
|
2
|
722
|
0
|
0
|
|
Somme
|
|
1130
|
31
|
4
|
1090
|
1
|
0,31
|
|
Moyenne
|
|
376,67
|
10,33
|
1,33
|
363,33
|
0,33
|
0,10
|
Témoin
|
Répétition 1
|
|
date
|
N° collecte
|
Nb d'oeuf
|
oeufs desyh
|
OEufs trsp
|
OEufs Néclo
|
OEufs eclos
|
% d'éclo
|
|
02/04/2008
|
1
|
17
|
1
|
0
|
3
|
13
|
76,47
|
|
03/04/2008
|
2
|
336
|
4
|
0
|
149
|
183
|
54,46
|
|
04/04/2008
|
3
|
532
|
6
|
0
|
301
|
225
|
42,29
|
|
05/04/2008
|
4
|
161
|
0
|
0
|
72
|
89
|
55,28
|
|
Somme
|
|
1046
|
11
|
0
|
525
|
510,00
|
228,51
|
|
Moyenne
|
|
261,5
|
2,75
|
0
|
131,25
|
127,5
|
57,13
|
|
Répétition 2
|
|
date
|
N° collecte
|
Nb d'oeuf
|
oeufs desyh
|
OEufs trsp
|
OEufs Néclo
|
OEufs eclos
|
% d'éclo
|
|
02/04/2008
|
1
|
134
|
2
|
4
|
35
|
93
|
69,40
|
|
03/04/2008
|
2
|
380
|
6
|
1
|
170
|
203
|
53,42
|
|
04/04/2008
|
3
|
695
|
5
|
1
|
280
|
409
|
58,85
|
|
Somme
|
|
1209
|
13
|
6
|
485
|
705
|
181,67
|
|
Moyenne
|
|
403,00
|
4,33
|
2
|
161,67
|
235
|
60,56
|
|
Répétition 3
|
|
date
|
N° collecte
|
Nb d'oeuf
|
oeufs desyh
|
OEufs trsp
|
OEufs Néclo
|
OEufs eclos
|
% d'éclo
|
|
02/04/2008
|
1
|
74
|
0
|
0
|
23
|
51
|
68,92
|
|
03/04/2008
|
2
|
239
|
1
|
1
|
107
|
130
|
54,39
|
|
04/04/2008
|
3
|
247
|
19
|
4
|
104
|
120
|
48,58
|
|
05/04/2008
|
4
|
394
|
10
|
2
|
181
|
201
|
51,02
|
|
06/04/2008
|
5
|
79
|
3
|
0
|
50
|
26
|
32,91
|
|
Somme
|
|
1033
|
33
|
7
|
465
|
528
|
255,82
|
|
Moyenne
|
|
206,6
|
6,6
|
1,4
|
93
|
105,6
|
51,16
|
|
Répétition 4
|
|
date
|
N° collecte
|
Nb d'oeuf
|
oeufs desyh
|
OEufs trsp
|
OEufs Néclo
|
OEufs eclos
|
% d'éclo
|
|
02/04/2008
|
1
|
128
|
1
|
6
|
77
|
44
|
34,38
|
|
03/04/2008
|
2
|
435
|
14
|
5
|
199
|
217
|
49,89
|
|
04/04/2008
|
3
|
552
|
2
|
6
|
344
|
200
|
36,23
|
|
Somme
|
|
1115
|
17
|
17
|
620
|
461
|
120,49
|
|
Moyenne
|
|
371,67
|
5,67
|
5,67
|
206,67
|
153,67
|
40,16
|
|
Répétition 5
|
|
date
|
N° collecte
|
Nb d'oeuf
|
oeufs desyh
|
OEufs trsp
|
OEufs Néclo
|
OEufs eclos
|
|
|
02/04/2008
|
1
|
59
|
0
|
0
|
23
|
36
|
61,02
|
|
03/04/2008
|
2
|
306
|
4
|
1
|
139
|
162
|
52,94
|
|
04/04/2008
|
3
|
621
|
2
|
2
|
417
|
200
|
32,21
|
|
05/04/2008
|
4
|
96
|
0
|
0
|
35
|
61
|
63,54
|
|
Somme
|
|
1082
|
6
|
3
|
614
|
459
|
209,71
|
|
Moyenne
|
|
270,5
|
1,5
|
0,75
|
153,5
|
114,75
|
52,43
|
Test d'émergence et d'Aptitude au vol
50 Gy
|
N émergé
|
1/2 émérgé
|
Déformé
|
No fly
|
% émerg
|
% fly
|
|
Répétition 1
|
6
|
0
|
1
|
4
|
94
|
89
|
|
Répétition 2
|
6
|
1
|
0
|
2
|
93
|
91
|
|
Répétition 3
|
7
|
0
|
0
|
1
|
93
|
92
|
|
Répétition 4
|
1
|
3
|
2
|
1
|
96
|
93
|
|
Répétition 5
|
4
|
3
|
1
|
1
|
93
|
91
|
|
Moyenne
|
4,8
|
1,4
|
0,8
|
1,8
|
93,8
|
91,2
|
60 Gy
|
N émergé
|
1/2 émérgé
|
Déformé
|
No fly
|
% émerg
|
% fly
|
|
Répétition 1
|
6
|
2
|
0
|
3
|
92
|
89
|
|
Répétition 2
|
3
|
3
|
1
|
2
|
94
|
91
|
|
Répétition 3
|
5
|
2
|
2
|
1
|
93
|
90
|
|
Répétition 4
|
5
|
2
|
0
|
1
|
93
|
92
|
|
Répétition 5
|
4
|
1
|
0
|
2
|
95
|
93
|
|
Moyenne
|
4,6
|
2
|
0,6
|
1,8
|
93,4
|
91
|
70 Gy
|
N émergé
|
1/2 émérgé
|
Déformé
|
No fly
|
% émerg
|
% fly
|
|
Répétition 1
|
6
|
2
|
0
|
1
|
92
|
91
|
|
Répétition 2
|
8
|
2
|
0
|
1
|
90
|
89
|
|
Répétition 3
|
8
|
2
|
0
|
0
|
90
|
90
|
|
Répétition 4
|
7
|
3
|
0
|
3
|
90
|
87
|
|
Répétition 5
|
4
|
3
|
1
|
3
|
93
|
89
|
|
Moyenne
|
6,6
|
2,4
|
0,2
|
1,6
|
91
|
89,2
|
80 Gy
|
N émergé
|
1/2 émérgé
|
Déformé
|
No fly
|
% émerg
|
% fly
|
|
Répétition 1
|
5
|
1
|
0
|
2
|
94
|
92
|
|
Répétition 2
|
3
|
4
|
0
|
3
|
93
|
90
|
|
Répétition 3
|
8
|
2
|
2
|
1
|
90
|
87
|
|
Répétition 4
|
8
|
4
|
1
|
1
|
88
|
86
|
|
Répétition 5
|
9
|
0
|
0
|
0
|
91
|
91
|
|
Moyenne
|
6,6
|
2,2
|
0,6
|
1,4
|
91,2
|
89,2
|
90 Gy
|
N émergé
|
1/2 émérgé
|
Déformé
|
No fly
|
% émerg
|
% fly
|
|
Répétition 1
|
6
|
2
|
1
|
3
|
92
|
89
|
|
Répétition 2
|
7
|
4
|
0
|
2
|
89
|
87
|
|
Répétition 3
|
12
|
4
|
0
|
1
|
84
|
83
|
|
Répétition 4
|
5
|
1
|
2
|
1
|
94
|
91
|
|
Répétition 5
|
8
|
5
|
1
|
4
|
87
|
82
|
|
Moyenne
|
7,6
|
3,2
|
0,8
|
2,2
|
89,2
|
86,4
|
100 Gy
|
N émergé
|
1/2 émergé
|
Déformé
|
No Fly
|
% émergence
|
% Fly
|
|
Répétition 1
|
5
|
7
|
3
|
0
|
88
|
85
|
|
Répétition 2
|
6
|
8
|
0
|
3
|
86
|
83
|
|
Répétition 3
|
3
|
8
|
2
|
1
|
89
|
86
|
|
Répétition 4
|
4
|
8
|
3
|
0
|
88
|
85
|
|
Répétition 5
|
7
|
7
|
3
|
0
|
86
|
83
|
|
Moyenne
|
5
|
7,6
|
2,2
|
0,8
|
87,4
|
84,4
|
110 Gy
|
N émergé
|
1/2 émergé
|
Déformé
|
No Fly
|
% émergence
|
% Fly
|
|
Répétition 1
|
5
|
9
|
2
|
0
|
86
|
84
|
|
Répétition 2
|
8
|
3
|
4
|
0
|
89
|
85
|
|
Répétition 3
|
11
|
5
|
0
|
2
|
84
|
82
|
|
Répétition 4
|
8
|
5
|
2
|
0
|
87
|
85
|
|
Répétition 5
|
10
|
1
|
3
|
0
|
89
|
86
|
|
Moyenne
|
8,4
|
4,6
|
2,2
|
0,4
|
87
|
84,4
|
120 Gy
|
N émergé
|
1/2 émergé
|
Déformé
|
No Fly
|
% émergence
|
% Fly
|
|
Répétition 1
|
5
|
12
|
0
|
0
|
83
|
83
|
|
Répétition 2
|
10
|
9
|
0
|
0
|
81
|
81
|
|
Répétition 3
|
7
|
9
|
0
|
3
|
84
|
81
|
|
Répétition 4
|
8
|
6
|
2
|
1
|
86
|
83
|
|
Répétition 5
|
8
|
8
|
3
|
0
|
84
|
81
|
|
Moyenne
|
7,6
|
8,8
|
1
|
0,8
|
83,6
|
81,8
|
145 Gy
|
N émergé
|
1/2 émergé
|
Déformé
|
No Fly
|
% émergence
|
% Fly
|
|
Répétition 1
|
13
|
5
|
2
|
0
|
82
|
80
|
|
Répétition 2
|
7
|
11
|
3
|
0
|
82
|
79
|
|
Répétition 3
|
9
|
6
|
0
|
4
|
85
|
80
|
|
Répétition 4
|
13
|
8
|
3
|
0
|
79
|
76
|
|
Répétition 5
|
10
|
9
|
0
|
0
|
81
|
81
|
|
Moyenne
|
10,4
|
7,8
|
1,6
|
0,8
|
81,8
|
79,2
|
Témoin
|
N émergé
|
1/2 émergé
|
Déformé
|
No Fly
|
% émergence
|
% Fly
|
|
Répétition 1
|
3
|
2
|
0
|
0
|
95
|
95
|
|
Répétition 2
|
2
|
3
|
0
|
0
|
95
|
95
|
|
Répétition 3
|
2
|
1
|
2
|
1
|
97
|
94
|
|
Répétition 4
|
1
|
4
|
1
|
0
|
95
|
94
|
|
Répétition 5
|
2
|
2
|
0
|
2
|
96
|
94
|
|
Moyenne
|
2
|
2,4
|
0,6
|
0,6
|
95,6
|
94,4
|
Compétitivité sexuelle
50 G
|
Répétition
|
Irradié/témoin
|
Début
accouplement
|
Fin
accouplement
|
Durée
accouplement
(min)
|
Tps de
latence (min)
|
Tps de mise
des mouches
|
|
3
|
T
|
10 : 01
|
15 : 08
|
307
|
19
|
R1 9 : 40
|
|
3
|
I
|
10 : 08
|
15 : 10
|
302
|
26
|
R2 9 : 45
|
|
1
|
I
|
10 : 10
|
12 : 50
|
160
|
30
|
R3 9 ; 42
|
|
2
|
I
|
10 :48
|
14 : 18
|
210
|
63
|
R4 9 : 41
|
|
2
|
I
|
11 : 13
|
13 : 07
|
114
|
76
|
R5 9 :44
|
|
2
|
I
|
13 : 34
|
15 : 21
|
107
|
229
|
|
|
4
|
T
|
14 : 30
|
15 : 56
|
86
|
289
|
|
|
5
|
I
|
14 : 44
|
16 : 45
|
121
|
300
|
|
|
2
|
I
|
14 : 38
|
16 : 38
|
120
|
293
|
|
|
4
|
T
|
15 : 27
|
17 : 04
|
97
|
346
|
|
|
3
|
T
|
15 : 43
|
18 : 30
|
167
|
361
|
|
60 G
|
Répétition
|
Irradié/témoin
|
Début
accouplement
|
Fin
accouplement
|
Durée
accouplement
(min)
|
Tps de
latence (min)
|
Tps de mise
des mouches
|
|
2
|
I
|
10: 33
|
12:08
|
125
|
18
|
R1 10 :13
|
|
2
|
I
|
11 :55
|
14 : 24
|
149
|
100
|
R2 10:15
|
|
2
|
T
|
12 : 19
|
14 : 18
|
119
|
124
|
R3 10 :10
|
|
2
|
T
|
12 : 10
|
13: 57
|
47
|
115
|
R4 10:16
|
|
3
|
I
|
12:25
|
15: 32
|
187
|
135
|
R5 10:11
|
|
2
|
I
|
15 : 01
|
16 : 45
|
104
|
286
|
|
|
2
|
T
|
15 : 35
|
17: 10
|
95
|
320
|
|
|
2
|
I
|
14:38
|
16: 21
|
103
|
263
|
|
2
|
T
|
15 : 35
|
17: 10
|
95
|
320
|
|
|
70 G
|
Répétition
|
Irradié/témoin
|
Début
accouplement
|
Fin
accouplement
|
Durée
accouplement
(min)
|
Tps de
latence (min)
|
Tps de mise
des mouches
|
|
5
|
T
|
12:02
|
15:05
|
183
|
114
|
R110 :04
|
|
3
|
I
|
12:43
|
14:54
|
131
|
161
|
R210:05
|
|
1
|
I
|
12:46
|
14:56
|
130
|
162
|
R310:02
|
|
1
|
T
|
12:49
|
15:27
|
158
|
165
|
R410:07
|
|
1
|
I
|
13:16
|
14:42
|
86
|
192
|
R510:08
|
|
1
|
I
|
13:06
|
15:00
|
114
|
182
|
|
80 G
|
Répétition
|
Irradié/témoin
|
Début
accouplement
|
Fin
accouplement
|
Durée
accouplement
(min)
|
Tps de
latence (min)
|
Tps de mise
des mouches
|
|
1
|
T
|
10:23
|
13:10
|
167
|
55
|
R1 9:28
|
|
4
|
I
|
10:54
|
12:56
|
122
|
82
|
R2 9:30
|
|
2
|
I
|
10:34
|
11:40
|
66
|
64
|
R3 9:29
|
|
4
|
I
|
12:38
|
14:30
|
112
|
186
|
R4 9:32
|
|
2
|
I
|
12:24
|
12:59
|
35
|
174
|
R5 9:33
|
|
1
|
I
|
10:24
|
13:50
|
206
|
56
|
|
|
1
|
I
|
12:36
|
15:35
|
179
|
188
|
|
|
4
|
I
|
12:00
|
15:38
|
218
|
148
|
|
|
4
|
I
|
13:08
|
14:49
|
101
|
216
|
|
|
3
|
T
|
13:22
|
14:48
|
86
|
233
|
|
|
4
|
I
|
13:23
|
14:48
|
85
|
231
|
|
|
3
|
T
|
15:22
|
16:49
|
87
|
353
|
|
|
3
|
I
|
14:05
|
16:31
|
146
|
276
|
|
90 G
|
Répétition
|
Irradié/témoin
|
Début
accouplement
|
Fin
accouplement
|
Durée
accouplement
(min)
|
Tps de
latence (min)
|
Tps de mise
des mouches
|
|
3
|
I
|
10:03
|
15:09
|
147
|
27
|
R1 9:37
|
|
3
|
I
|
10:03
|
10:59
|
51
|
27
|
R2 9:34
|
|
3
|
I
|
10:06
|
11:16
|
70
|
30
|
R3 9:36
|
|
4
|
T
|
10:38
|
11:53
|
75
|
59
|
R4 9:39
|
|
5
|
T
|
10:01
|
12:09
|
128
|
23
|
R5 9:38
|
|
5
|
I
|
10:17
|
12:30
|
133
|
39
|
|
|
5
|
I
|
12:14
|
14:30
|
136
|
156
|
|
|
3
|
T
|
14:18
|
16:06
|
108
|
282
|
|
|
3
|
T
|
12:47
|
16:07
|
80
|
191
|
|
|
3
|
I
|
14:13
|
16:12
|
119
|
274
|
|
|
1
|
T
|
13:20
|
16:12
|
172
|
223
|
|
|
2
|
I
|
13:14
|
16:40
|
206
|
220
|
|
|
1
|
I
|
15:14
|
17:33
|
139
|
337
|
|
|
1
|
I
|
15:14
|
17:42
|
148
|
337
|
|
100 G
|
Répétition
|
Irradié/témoin
|
Début
accouplement
|
Fin
accouplement
|
Durée
accouplement
(min)
|
Tps de
latence (min)
|
Tps de mise
des mouches
|
|
5
|
T
|
12:42
|
15:09
|
147
|
167
|
R1 9:50
|
|
5
|
I
|
11:45
|
13:09
|
84
|
110
|
R2 9:58
|
|
5
|
I
|
10:12
|
11:16
|
64
|
17
|
R310:00
|
|
2
|
I
|
11:45
|
14:15
|
150
|
107
|
R4 10 : 01
|
|
5
|
I
|
12:18
|
15:20
|
182
|
143
|
R5 9:55
|
|
3
|
I
|
12:40
|
15:39
|
179
|
160
|
|
|
5
|
I
|
14:48
|
16:06
|
78
|
293
|
|
|
2
|
I
|
12:27
|
14:57
|
150
|
149
|
|
|
5
|
T
|
15:05
|
17:48
|
163
|
310
|
|
110 G
|
Répétition
|
Irradié/témoin
|
Début
accouplement
|
Fin
accouplement
|
Durée
accouplement
(min)
|
Tps de
latence (min)
|
Tps de mise
des mouches
|
|
2
|
I
|
11:15
|
13:30
|
135
|
84
|
R1 9:52
|
|
1
|
T
|
10:22
|
12:03
|
101
|
30
|
R2 9:51
|
|
2
|
T
|
10:29
|
13:06
|
157
|
38
|
R3 9:53
|
|
3
|
I
|
10:56
|
13:50
|
174
|
63
|
R4 9:48
|
|
5
|
I
|
13:36
|
14:55
|
79
|
227
|
R5 9:49
|
|
2
|
T
|
13:29
|
15:57
|
148
|
218
|
|
|
1
|
I
|
14:10
|
16:40
|
150
|
268
|
|
120 G
|
Répétition
|
Irradié/témoin
|
Début
accouplement
|
Fin
accouplement
|
Durée
accouplement
(min)
|
Tps de
latence (min)
|
Tps de mise
des mouches
|
|
3
|
I
|
11 :
|
00
|
12 :
|
40
|
100
|
42
|
R1 10 :
|
23
|
|
3
|
I
|
10 :
|
26
|
13 :
|
50
|
204
|
8
|
R2 10 :
|
21
|
|
3
|
I
|
11 :42
|
|
14 :
|
07
|
145
|
84
|
R3 10 :
|
18
|
|
5
|
I
|
13 :
|
37
|
15 :
|
20
|
103
|
198
|
R4 10 :
|
24
|
|
3
|
I
|
13 :
|
19
|
15 :
|
21
|
122
|
181
|
R5 10 :
|
19
|
|
5
|
T
|
13 :
|
39
|
15 :
|
31
|
112
|
200
|
|
|
|
3
|
T
|
13 :
|
16
|
15 :
|
42
|
146
|
178
|
|
|
|
1
|
T
|
13 :
|
07
|
15 :
|
54
|
167
|
164
|
|
|
|
3
|
T
|
15 :
|
29
|
17 :
|
10
|
101
|
311
|
|
|
|
1
|
I
|
15 :
|
39
|
16 :
|
48
|
69
|
316
|
|
|
|
2
|
T
|
15 :
|
34
|
17 :
|
36
|
122
|
313
|
|
|
|
3
|
T
|
14 :
|
41
|
17 :
|
47
|
186
|
263
|
|
|
145 G
|
Répétition
|
Irradié/témoin
|
Début
accouplement
|
Fin
accouplement
|
Durée
accouplement
(min)
|
Tps de
latence (min)
|
Tps de mise
des mouches
|
|
3
|
I
|
11
|
: 47
|
12 :
|
20
|
33
|
54
|
R1 10 :
|
50
|
|
3
|
I
|
11
|
:57
|
14 :
|
51
|
174
|
64
|
R2 10 :
|
53
|
|
5
|
T
|
14
|
: 45
|
17 :
|
51
|
186
|
247
|
R3 10 :
|
53
|
|
2
|
I
|
17
|
: 21
|
18 :
|
59
|
98
|
388
|
R4 10 :
|
37
|
|
4
|
I
|
17:33
|
19 :
|
02
|
89
|
416
|
R5 10 :
|
38
|
Génération F1
|
Collecte N°1
|
Collecte N°2
|
Collecte N°3
|
Collect e N°4
|
Collecte N°5
|
|
oeuf
|
larve
|
pupe
|
oeuf
|
larve
|
pupe
|
oeuf
|
larve
|
pupe
|
oeuf
|
larve
|
pupe
|
oeuf
|
larve
|
pupe
|
|
50 Gy
|
57
|
2
|
0
|
269
|
3
|
2
|
344
|
5
|
4
|
377
|
4
|
0
|
567
|
3
|
0
|
|
70 Gy
|
56
|
2
|
0
|
240
|
2
|
0
|
354
|
1
|
1
|
367
|
2
|
1
|
589
|
0
|
0
|
|
80 Gy
|
78
|
2
|
0
|
283
|
1
|
0
|
328
|
1
|
0
|
345
|
1
|
0
|
578
|
1
|
0
|
|
90 Gy
|
70
|
2
|
1
|
245
|
3
|
0
|
345
|
0
|
0
|
389
|
0
|
0
|
556
|
0
|
0
|
|
100 Gy
|
26
|
1
|
0
|
284
|
3
|
0
|
356
|
1
|
0
|
380
|
0
|
0
|
572
|
0
|
0
|
|
110 Gy
|
19
|
1
|
0
|
274
|
2
|
2
|
345
|
0
|
0
|
390
|
0
|
0
|
586
|
1
|
0
|
|
120 Gy
|
73
|
0
|
0
|
286
|
2
|
1
|
354
|
0
|
0
|
366
|
1
|
0
|
532
|
2
|
0
|
|
145 Gy
|
69
|
1
|
0
|
233
|
0
|
0
|
310
|
1
|
0
|
358
|
0
|
0
|
630
|
1
|
0
|
|
Somme des larves
|
Moyenne
|
Somme des pupes
|
Moyenne
|
Somme des oeufs
|
Moyenne
|
|
50 Gy
|
17
|
3,4
|
6
|
1,2
|
1614
|
322,8
|
|
70 Gy
|
7
|
1,4
|
2
|
0,4
|
1606
|
321,2
|
|
80 Gy
|
6
|
1,2
|
0
|
0
|
1612
|
322,4
|
|
90 Gy
|
5
|
1
|
1
|
0,2
|
1605
|
321
|
|
100 Gy
|
5
|
1
|
0
|
0
|
1618
|
323,6
|
|
110 Gy
|
4
|
0,8
|
2
|
0,4
|
1614
|
322,8
|
|
120 Gy
|
5
|
1
|
1
|
0,2
|
1611
|
322,2
|
|
145 Gy
|
3
|
0,6
|
0
|
0
|
1600
|
320
|
Références Bibliographiques
(1) Fellah, H., 1996. Contribution à
l'étude de la bioécologique de la mouche
méditerranéenne des fruits ceratitis capitata Weidemann (Diptera
:Trphritidae) sur fruits d'été. Mémoire de fin du cycle de
spécialisation de L'INAT.
(2) Buyckx, E.J., 1994. Unfecundated dates,
host of the Mediterranean Fruit Fly (Diptera:Tephritidae) in the oases of
Tozeur. Proceeding of IOBC/WPRS Int. Open Meet. Working group «Fruit flies
of economic importance», Lisbon, Portugal. 14-16 Oct. 1993. IOBC/WPRS
Bull. 17 (6), 25-37.
(3) Maddison P.A., and Bartlett B.Y., 1989 - A
contribution towards the zoogeograph of the Tephritidae. In. A.S. Robinson
& G. G.Hooper (ed). Fruit flies, their biology, natural ennemies and
control. Elsevier, Amsterdam, vol.3A : 27-35pp.
(4) Sacantanis K., 1951-Influence de
l'humidité sur l'incubation des oeufs de la mouche des fruits,
Ceratitis capitata Wied. 9éme Congrès Int.
Entomol-Amesterdam. 1: 460-464pp.
[5] Back E.A., and Pemberton C.E., 1918b The
Mediterranean fruit fly. USDA Bulletin 640.
[6] Zaïdi H., 1974 - Méthode
d'éclosion en milieu liquide et ses conséquences sur
l'amélioration de l'élevage massif de Ceratitis capitata
Wied (Diptère, Trypetidae). Mémoire de fin d'études
du cycle de spécialisation de l'INAT, pp39.
(7) Whittier T.S., Kaneshiro K.h., and Prescott LD.,
1992 - Mating behavior of Mediterranean fruit fly (Diptera:
Tephritidae) in a natural environment. Soc. America vol 85: W2;
214-218.
(8) Liquido N.J., Cunningham R.T., et Nakagawa S.,
1990 Host plants of the mediterranean fruit fly on the island of
Hawaii (1949-1985 survey). ]. Econ. Entomol. 83: 1863-1878.
(9) J. Cheikh M., Howell J.F., Harris E.J., Ben Salah
H., et Soria F., 1975 Suppression of the Mediterranean fruit fly in
Tunisia with released sterile insects. J.Econ . Entomol., 68 : 237-243.
(10) Soria F., 1962b - Plantes hôtes
secondaires de Ceratitis capitata wied en Tunisie Ann.de l'INRAT, vol
35: 5 1-72.
(11) Cheikh M., et Ben Salah, H., 1976
Degrés et époques des infestations des principaux hôtes de
la mouche méditerranéenne des fruits Ceratitis capitata
wied (Diptère, Trypetidae). Communication présentée
au colloque du CLAM (Comité de liaison de l'Agrumiculture
Méditerranéenne).
(12) Delanoué P., et Soria F., 1962 - Au
sujet de l'avortement de l'évolution de Ceratitis capitata wied
dans certains agrumes de Tunisie Ann de l'INRAT vol 35 : 73-96.
(13) Gahbiche H., 1993 - Contribution
à l'Etude de la Bioécologie de la mouche
méditerranéenne des fruits Ceratitis capitata Wiedemannc
1829 (Diptera: Tephritidae) dans deux biotopes du Nord de la Tunisie.
Mémoire de fin d'études du cycle de spécialisation de
l'INAT.
(14) Soria F., 1961 - Evolution des chutes de
fruits dans un verger d'agrumes en Tunisie au cours de la saison agrumicole
160/61. Ann. de l'INRAT, vol 32: 95-108.
(15) Mitchell W.C., Andrew C.O., Hagen K.S., Hamilton
R.A., Harris E.J., Maehler K.L., et Rhode R.H., 1977 - The
Mediterranean fruit fly and its economie impact on Central American countries
and Panama. University of California, Berkeley.
(16) Enkerlin, W.R and J.D.Mumford. 1998.
Economic evaluation of three alternative methods for control of the
Mediterranean fruit fly (Diptera: Tephritidae) in Palestine, Jordan, Labanon
and Syria. Final report to IAEA. Technical contact 8441/RB/TC, LEB/5/013 and
SYR/S/016 IAEA Vienna.
(17) Driouchi A., 1990. Evaluation
économique des pertes causées par la mouche
méditerranéenne des fruits: Cas de l'économie agricole
Tunisienne Rapport de mission d'un expert consultant AlEA/FAO. Division de
l'assistance technique et de la coopération, 22p.
(18) IAEA, 1995. Economic evaluation of damage
caused by, and methods of control of, the Mediterranean Fruit Fly in the
Maghreb. An analysis covering three control options, including the sterile
insect technique. IAEA-TECDOC-830, pp 64. Vienna
(19) GIAF, 1997. Rapport d'activité,
campagne 96/97.
(20) Baumhover A.H., Graham A.J., Hopkin D.E., Dudley
F.H., New W.D., and Bushland R.C., Control of screwworms through
release of sterilized flies.J.Econ.Entomol., vol.48:pp462-466.
(21) Lopez D.F., 1970 - Sterile-male
technique for eradication of the Mexican and Caribbean fruit flies: review of
Cuitent status, 111-117. ln: F AO/IAEA Div. Atomic. Energy in Food Agric.
Sterile-male technique for control of fruit flies. Proc. of panel on the
application of the sterile male technique for control of insects with special
reference to fruit flies. Vienna, 1-5 Sept. IAEA, Vienna : p175.
(22) Awadallah A., Fouda A.F., G.H.S, 1974: A
trial for testing the sterile male technique as a means of controlling the
medfly, ceratitis capitata (wied). In Egypt Agric. Rech. Rev., 52:41-49.
(23) Knipling E. F., 1955 - Possibilities of
insect control or eradication through the use of sexually steriles males. J.
Econ. Ent., 48:459-462.
(24) DeMurtas I.D., Cirio U, Guerrieri G, and Enkerlin
S.D., 1970 - An experiment to control the mediterranean fruit fIy on
the island of Procida by the sterile insect technique IAFA STI, PUB/276,
Vienna, 175p.
(25) Gerald Franz, 1999: The genetic Basis of
SIT and All- Male strains. Proceedings of the seminar- Madeira MED: Portugal;
63-71.
(26) Franz G, Kerremans Ph (1993) Radiation
induced chromosome aberration for genetic analysis and manipulation of the
Mediterrranean fuit fly, Ceratitis capitata. In : IAEA (ed) Proceedings of the
International Symposium on Management of Insect Pest. Nuclear and related
molecular and genetic techniques. Internationl Atomic Energy Agency, Vienna,
19-23 October 1992, pp 187-194.
(27) Chiou Ling Chang, Carlos Caceres, and Eric B. Jang
A Novel Liquid Larval Diet and Its Rearing System for Melon Fly,
Bactrocera cucurbitae (Diptera: Tephritidae) 2003
(28) CALKINS C. O., 1989. Quality control. In
A. S. Robinson and G. Hooper [eds.] Fruit flies, their biology, natural enemies
and control. Amsterdam.
(29) DYCK V.A., HENDRICHS J. AND ROBINSON A .S.,
2005. Sterilizing insects with ionizing radiation. Stérile
Insect Technique, principales and practice in Area-wide integrated pest
management. pp: 250...253, 431.
(30) FISHER K., 1997. Irradiation effects in
air and in nitrogen on Mediterranean fruit fly (Diptera: Tephritidae)
pupae in Western Australia. J. Econ. Entomol. 90: 1609-1614.
(31) LACHANCE L. E. AND LEVERICH A. P., 1962.
Radiosensitivity of developing reproductive cells in female Cochliomyia
hominovorax. Genetics 47: 721-735
(32) Yanders 1959
(33) ISMAIL I. I., EL-NAHAL A. K. M., KAME A. H. AND
MOSTAFA T. M., 1987. Effect of gamma radiation on the different stages
of the Angoumois grain moth, Sitotroga cerealella (Olivier)
(Lepidoptera: Gelechiidae). Insect Science and its Application 8:
327-329.
(34) COBURN, R. R., E. W. TLTON, AND J. H. BROWER.
1973. Almond moth: gamma radiation effects on the life stages. Journal
of Entomology 66: 745-751.
(35) FISHER K., 1997. Irradiation effects in
air and in nitrogen on Mediterranean fruit fly (Diptera: Tephritidae)
pupae in Western Australia. J. Econ. Entomol. 90: 1609-1614.
(36) HALLMAN, G. J. 2000. Expanding radiation
quarantine treatments beyond fruit flies. Agricultural and Forestry Entomology
2: 85-95.
(37) TOLEDO, J., J. RULL, A. OROPEZA, E. HERNANDEZ, AND
P. LIEDO. 2004. Irradiation of Anastrepha obliqua (Dptera:
Tephritidae) revisited: optimizing sterility induction. Journal of
Economic Entomology 97: 383-3 89.
(38) RUHM, M. E. AND CALKINS C. O., 1981.
Eye-color changes in Ceratitis capitata pupea, a technique to
determine pupal development. Enntomologia Experimentalis et Applicata 29:
237-240.
(39) IAEA, FAO, USDA ; May 2003 ; Required
Periodic Quality Control Tests
(40) Prokopy R. J. and Hendrichs J., 1979.
Mating behavior of Ceratitis capitata on a field-caged host coffee
tree. Ann. Entomol. Soc. Am. 72: 642-648.
(41) Heath R. R., Epsky N. D., Dueben B. D., Gusman A.
and Andrade L. E., 1994. Gamma radiation effect on production of four
pheromonal components of male Mediterranean fruit flies (Diptera: Tephritidae).
J. Econ. Entomol. 87: 904-909.
(42) Lance D. R., Odell T. M., Mastro V. C. and Schwalbe
C. P., 1988. Temperature-mediated programming of activity rythms in
male gypsy moths (Lepidoptera: Lymantriidae): implications for the sterile male
technique. Environ. Entomol. 17: 649-653.
(43) Shelly T. E., Whittier S. T. And Kaneshiro K. Y.,
1994. Sterile insect release and the natural mating system of the
Mediterranean fruit fly, Ceratitis capitata (Diptera: Tephritidae).
Ann. Entomol. Soc. Am. 89: 754-758.
(44) Barclay H. J., 1982. The sterile release
method with unequal male competitive ability. Ecol. Model. 15: 25 1-263.
Liste des Figures
Figure 1 : Répartition géographique de
Ceratitis capitata(3). 10
Figure 2: Aspect général du mâle et de la
femelle de Ceratitis capitata. 12
Figure 3. Cycle biologique de la cératite 15
Figure 4 : Piqûres de la Cératite sur des citrus :
Citron (a) et Orange (b) 19
Figure 5 : Fruits infestés par la Cératite :
Pêche (a) ; Poire (b) ; Orange(c). 24
Figure 6 : Les conséquences génétiques de
l'irradiation (25) 33
Figure 7: Carte cytogénétique du chromosome 5 de la
Cératite. 35
Figure 8 : Structure du chromosome des souches à sexage
génétique (26). 36
Figure 9:Séparation des pupes 51
Figure 10:Mise des pupes dans les bouteilles pour
émergence. 51
Figure 11: Récupération des oeufs 52
Figure 12: Saut larvaire caractéristique des L3 dans la
sciure de bois 52
Figure 13: Le système d'élevage adopté
à l'UPMS 53
Figure 14: Les composants du kit expérimental 55
Figure 15: Mélange des composants et ajustement du pH
56
Figure 16:Préparation du milieu et ensemencement des oeufs
56
Figure 17: Préparation du milieu standard 57
Figure 18. Les cages d'émergence, de maturation et de
copulation des mouches 59
Figure 19. Les bacs d'eau placés des cotés des
cages 59
Figure 20. Le bubbling 60
Figure 21. L'ensemencement d'une colonie Mâle 61
Figure 22. Salle de collecte 62
Figure 23. Collecte des pupes dans la sciure de bois et leur
tamisage par la suite 62
Figure 24. Les bouteilles où les mouches émergent
et mûrissent et les boites où elles seront
transférées par la suite 65
Figure 25. Le transfert des mouches dans les boites 66
Figure 26. Disposition des boites et collecte des oeufs 66
Figure 27. Vu des oeufs 4 jours après ponte sous la loupe
binoculaire 67
Figure 28. Disposition des boites et collecte des oeufs pour
ensemencement 68
Figure 29. Préparation du milieu et ensemencement des
oeufs 69
Figure 30. Disposition des boites ensemencées 69
Figure 31. Marquage des mouches par la gouache 70
Figure 32. Coloration de la cératite en stade pupe 71
Figure 33. Déclenchement du test par la présence
des fertiles, des stériles et des femelles 71
Figure 34. Quantité de pupes produite par les deux milieux
dans 6 jours (Moyenne/ Voir Annexe) 74
Figure 35. Quantité totale de pupes produite (Moyenne/
Voir Annexe) 75
Figure 36. Représentation de la disposition des larves
dans la boite de développement du milieu liquide 75
Figure 37. Variation du poids moyen d'une pupe dans les deux
milieux (Moyenne/ Voir Annexe) 76
Figure 38. Variation du pourcentage d'émergence et
d'aptitude au vol pour les deux types de milieux (Moyenne/Voir Annexe)
Figure 39. Variation du taux d'éclosion d'oeufs issus des
mouches irradiées par rapport au Témoin (Moyenne/Voir Annexe)
80
Figure 40 . La relation entre la dose d'irradiation et la
stérilité 81
Figure 41. Quantité totale d'oeufs produites par les
différentes mouches irradiées (Moyenne/ Voir Annexe) 82
Figure 42. Moyenne des larves issues des oeufs par dose (Moyenne/
Voir Annexe) 83
Figure 43. Moyenne des pupes produites par dose (Moyenne /Voir
Annexe) 83
Figure 44. Pourcentage de transformation des oeufs en pupes -
Efficacité 84
Figure 45. Variation du % d'émergence et de vol par
rapport aux différentes doses d'irradiations (Moyenne/Voir Annexe)
85
Figure 46. Compétitivité des couples des
différentes doses (Moyenne/Voir Annexe) 87
Figure 47. Variation de la durée d'accouplement en
fonction des doses d'irradiation (Moyenne/Voir Annexe) 87
Figure 48. Variation du temps de latence en fonction des doses
d'irradiation (Moyenne/Voir Annexe) 88
Liste des Tableaux
Tableau 1: Répartition et date de la première
observation de Ceratitis capitata(1) 9
Tableau 2: Succession des périodes d'infestation sur les
différentes espèces fruitières dans le nord de la Tunisie
(17) ;(1 1). .. 18
Tableau 3: Epoque de réceptivité des fruits de
Citrus dans le biotope de Mraissa (13) 20
Tableau 4 : Dommages et pertes dues à la Cératite
en Jordanie en 1996 (16) . 25
Tableau 5: Estimation des coûts des traitements
cératicides sur les différentes cultures (1). 26
Tableau 6: Estimation des pertes en milliers de Dinars Tunisiens
(17) 27
Tableau 7 : Liste des insecticides utilisés dans le monde
contre la Cératite (1) : 28
Tableau 8. Milieu d'élevage de la cératite (Tanaka
1969) 37
Tableau 9: Quelques milieux d'élevage essayés dans
certains programmes de lutte contre la Cératite dans le monde 38
Tableau 10: Conditions de température et d'humidité
dans la salle d'élevage [15] 52
Tableau 11: Milieu d'élevage de la cératite (Tanaka
1969) 54
Tableau 12: Milieu d'élevage liquide de la cératite
55
Tableau 13. Normes de quelques paramètres de
contrôle qualité des pupes 76
Tableau 14 : Profils des oeufs enregistrés pour chaque
dose d'irradiation (Moyenne/Voir Annexe) 79
Tableau 15:Calcul du taux de stérilité des mouches
irradiés par rapport au pourcentage d'éclosion (Moyenne/Voir
Annexe) 79
Tableau 16: Ajustement des résultats pour l'obtention du
Probit (fertility) (Moyenne/Voir Annexe) 81
Tableau 17. Calcul de pourcentage d'émergence et
d'aptitude au vol (Moyenne/Voir Annexe) 85
Sommaire
INTRODUCTION 3
PRESENTATION DU CENTRE 5
CENTRE NATIONAL DES SCIENCES ET TECHNOLOGIES NUCLEAIRES
5
PREMIÈRE PARTIE 7
- CHAPITRE 1 - 8
DONNÉES GÉNÉRALES SUR LA
BIOLOGIE DE LA CÉRA TITE 8
I- ORIGINE ET DISTRIBUTION GEOGRAPHIQUE
8
I.1. Origine 8
I.2. Distribution géographique 8
II- POSITION SYSTEMA TIQUE - SYNONYMES
10
III- DESCRIPTION MORPHOLOGIQUE DES DIFFERENTS STADES
DE DEVELOPPEMENT 11
III.1. Adulte 11
III.2. L'oeuf 12
III.3. La larve 12
III.4. La Pupe 13
IV- CYCLE DE DE VELOPPEMENT DE LA CERATITE
13
IV. 1. Développement larvaire 13
IV.2. La pupaison 13
IV.3. La maturation 14
V- FACTEURS AGISSANT SUR LE DE VELOPPEMENT DE LA
CERATITE 16
- CHAPITRE 2- 17
LES PLANTES HÔTES ET LES DÉGÂTS DE
LA CÉRA TITE 17
I- SEQUENCES DES HOTES ET EPOQUES D'INFESTATION
17
II- IMPORTANCE DE L'HOTE 18
II.1. La Cératite et les citrus 18
II.1.1. Susceptibilité des différentes
variétés à l'attaque 19
II.1.2. Comportement de la Cératite sur les citrus
20
II.2. La Cératite sur les fruits d'été
21
II.2.1. Comportement de la Cératite sur les principaux
fruits d'été 21
II.2.2. Autres cultures estivales hôtes de la
Cératite à importance économique en Tunisie 23
III- LES DEGATS DE LA CERATITE 24
III.1. Les dégâts de la Cératite dans le
monde 24
III.2. Les dégâts de la Cératite en
Tunisie : 25
- CHAPITRE 3 - 28
LES MÉTHODES DE LUTTE ET DE CONTRÔLE DE
LA CÉRA TITE 28
I- LA LUTTE CHIMIQUE 28
II- LES METHODES DE LUTTE BIOTECHNIQUE :
29
II.1. L'anéantissement des mâles : 30
II.2. La confusion sexuelle : 30
II.3. La lutte biologique : 30
II.4. Piégeage de masse 31
II.5.La technique des insectes stériles 31
II.5. 1.Introduction 31
II.5.2. Principe de la méthode 32
II.5.3. Bases génétiques de la
stérilité 33
II.5.4. Base génétique des souches à
sexage génétique : 34
II.5.5.Milieu de développement larvaire 37
- CHAPITRE 4 - 41
LA RADIATION IONISANTE 41
I. PROCEDURE D'IRRADIATION DES PUPES
41
II. DOSE D'IRRADIATION 41
II. 1.Introduction 41
II.2.Facteurs modifiants la sensibilité de l'insecte
à l'irradiation 42
II.2. 1.Facteurs physiques et environnementaux 42
II.2.2.Facteurs biologiques 42
II.2.3.Fractionnement de la dose 42
II.2.4.Age et stades de développement 43
II.2.5. Sexe 43
II.2.6. Taille et poids 43
II.2.7. Stade nutritionnel 43
II.2. 8.Facteurs supplémentaires 44
III. RADIOSENSIBILITE DE LA CERATITE
44
IV. EFFET DE L'IRRADIATION SUR LA QUALITE
44
- CHAPITRE 5 - 46
ETUDE DE LA COMPÉTITIVITÉ SEXUELLE
46
I. DEFINITION 46
II. DUREE D'ACCOUPLEMENT 46
III. DUREE DE LA PARADE NUPTIALE CHEZ LE MALE (MALE
CALLING TIME) 46
IV. COMPETITIVITE SEXUELLE CHEZ LA CERATITE
47
DEUXIÈME PARTIE 49
- CHAPITRE 6 - 50
MATÉRIELS ET MÉTHODES
50
I. MATERIEL BIOLOGIQUE 50
I.1. Les étapes de l'élevage massif de la
souche à sexage génétique de la Cératite:
50
I.1.1. Système d'élevage au filtre 50
II. ELE VA GE DE MASSE DE LA CERATITE
52
II.1 Les étapes de l'élevage massive 54
II.1.1 Préparation de milieu d'élevage
54
II.1.2. Collecte et préparation des oeufs : 58
II.1.3 Ensemencements des oeufs : 60
II.1.4 Mouvements des transferts : 61
II.1.5. Collecte des larves : 61
II.1.6. Collecte des pupes : 62
II.1.7. Préparation des cages adultes : 62
III. CONTROLE DE LA QUALITE : 63
IV. RADIATION ET DOSIMETRIE 64
IV .1. Dose d'irradiation 64
IV.1.1. Protocole expérimental 65
IV.1.2. Collecte des données 67
V. EFFET DE L'IRRADIATION SUR LA GENERATION F1 ISSUE
DES MALES TRAITES 68
V.1. Protocole expérimental 68
V.2. Collecte des données 70
VI. ETUDE DE LA COMPETITIVITE SEXUELLE DE LA CERATITE
70
VI.1. Protocole expérimental 70
VI.2. Collecte des données 72
TROISIÈME PARTIE 73
- CHAPITRE 7 - 74
RÉSULTATS ET DISCUSSION 74
I. LE MILIEU LIQUIDE 74
I.1. La production 74
I.2. Contrôle de qualité 76
I.2.3. Test du poids des pupes 76
I.2.2. Test d'émergence et d'aptitude au vol
77
I.3. Conclusion 78
II. DETERMINA TION DE LA DOSE D'IRRADIATION
78
II.1. Test d'éclosion des oeufs 78
II.2. Suivi de la F1 82
II.2.1. Quantité d'oeuf F1 82
II.2.1. Quantité de larves F1 82
II.2.2 Quantité de pupes produites à la fin du
cycle 83
II.3. Contrôle de qualité 84
II.3.1. Test d'émergence et d'aptitude au vol
84
II.4. Etude de l'effet de l'irradiation sur le potentiel de
reproduction des mouches : la compétitivité sexuelle 86
CONCLUSION ET PERSPECTIVES 89
ANNEXE 91
REFERENCES BIBLIOGRAPHIQUES 116
LISTE DES FIGURES 119
LISTE DES TABLEAUX 121
SOMMAIRE 122
|
|



